Результат интеллектуальной деятельности: Трет-бутилзамещённые трифенодиоксазины, обладающие люминесцентными свойствами, и способ их получения
Вид РИД
Изобретение
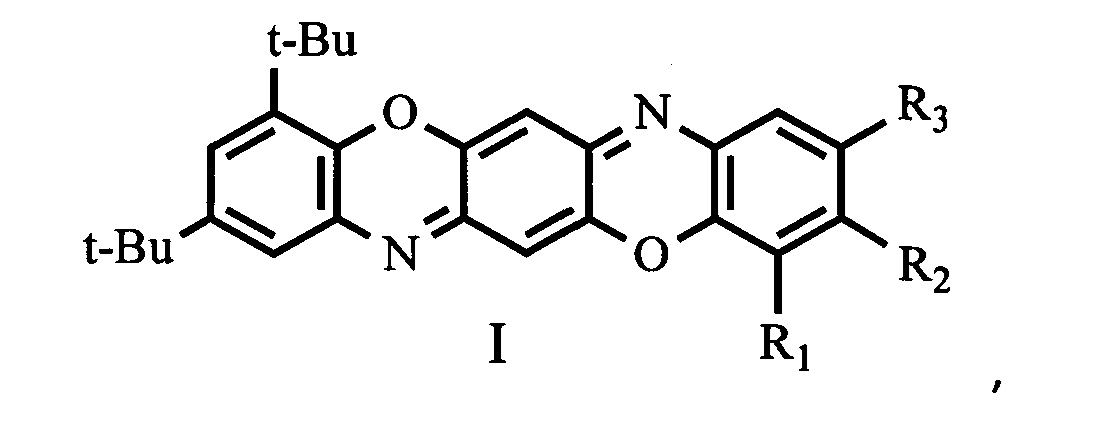
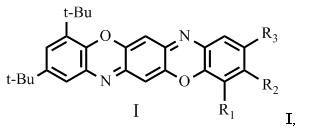
Изобретение относится к новым соединениям в ряду трифенодиоксазинов, а именно к замещенным 2,4-ди-трет-бутилбензо[5,6][1,4]оксазино[2,3-b]феноксазинам общей формулой I,
где R1 = водород, галоген, трет-бутил;
R2 = водород, галоген, нитро-группа;
R3 = водород, галоген, алкил С1-С4, трет-бутил, нитро-группа,
при условии:
Ia R1 = трет-бутил, R2 = водород, R3 = трет-бутил;
Iб R1 = водород, R2 = водород, R3 = водород;
Iв R1 = галоген, R2 = водород, R3 = нитро-группа;
Iг R1 = водород, R2 = водород, R3 = хлор;
Iд R1 = водород, R2 = водород, R3 = алкил С1-С4;
Iе R1 = водород, R2 = водород, R3 = трет-бутил;
Iж R1 = водород, R2 = галоген, R3 = водород;
Iз R1 = водород, R2 = водород, R3 = бром;
Iи R1 = водород, R2 = водород, R3 = нитро-группа;
Iк R1 = водород, R2 = нитро-группа, R3 = водород,
обладающие люминесцентной активностью, которые могут быть использованы в качестве пигментов для окрашивания широкого круга различных материалов [1], полупроводников (в основном для n-типа транзисторов) [2-5], флуоресцентных красителей [6-7], как элементы для LED-мониторов [8-10], в фотовольтаике и как сенсибилизированные красители для солнечных батарей [11], лазерные красители [12], и антимикробные препараты [13].
В ряду трифенодиоксазинов известен 3,10-ди(N-фенилфениламидо)-6,13-дихлордибензо[5,6][1,4]оксазино[2,3-b]феноксазин формулы II:
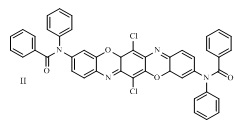
Соединение обладает флуоресценцией в желто-оранжевой области спектра (λmax 578 нм - толуол, 609 нм - этанол) [6].
В ряду трифенодиоксазинов известен также 3,10-ди(N-фенил-4-метилфенилсульфамидо)-6,13-дихлордибензо[5,6][1,4]оксазино[2,3-b]феноксазин формулы III:
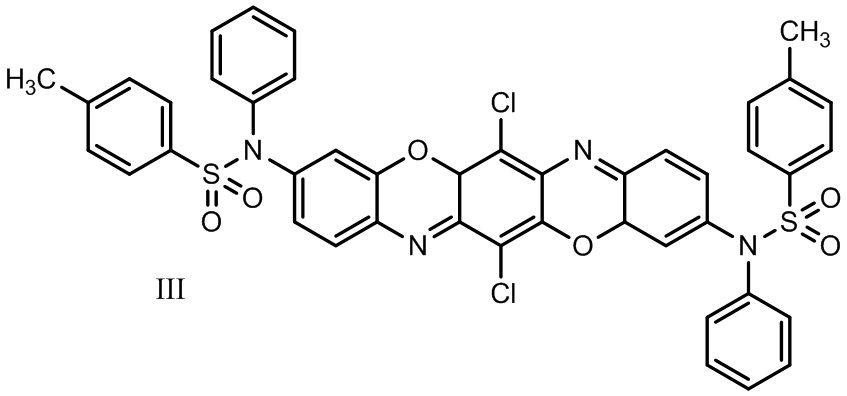
Соединение обладает флуоресценцией в красной области спектра (λmax 632 нм - толуол, 661 нм - ацетон) [6].
Наиболее близким по выполнению является 3-амино-10-нитро-6,13-дихлордибензо[5,6][1,4]оксазино[2,3-b]феноксазин формулы IV:
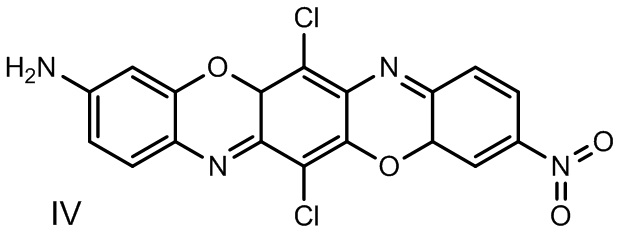
Соединение обладает флуоресценцией в оранжево- красной области спектра [7].
Известен способ получения соединений II-IV, заключающийся в конденсации о-аминофенола с п-хлоранилом в присутствии оснований, для удаления, выделяющегося в результате реакции хлористого водорода. На первой стадии происходит конденсация с образованием C-N связи и выделение хлористого водорода, на второй стадии окислительная циклизация, приводящая к образованию оксазиновых циклов [14].
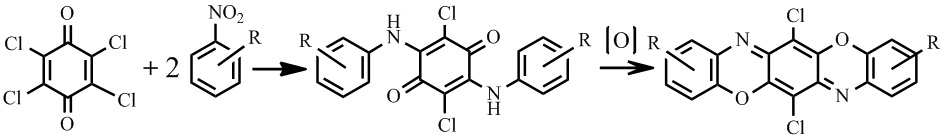
Известен также способ получения соединений II-IV, который протекает по схеме:
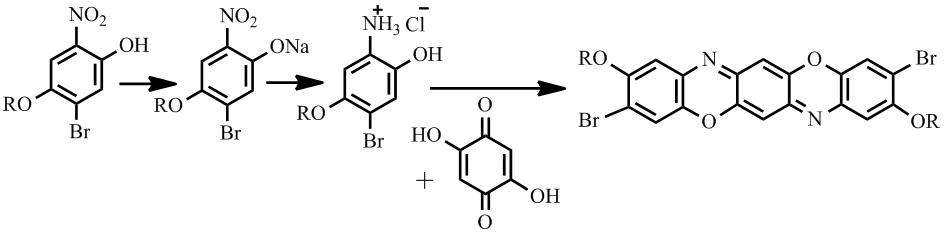
Первая стадия заключается в получении натриевой соли в щелочной среде, затем нитро-группу восстанавливают боргидридом натрия в среде этиловый спирт/диэтиловый эфир в присутствии хлорида никеля (II) при комнатной температуре. Последняя стадия получения представляет собой конденсацию с 2,5-дигидрокси-1,4-бензохиноном в уксусной кислоте [9].
Соединения I не могут быть получены этим способом.
Техническим результатом являются соединения в ряду трифенодиоксазинов, обладающие люминесценцией в желто-зеленой области спектра.
Техническим результатом являются также соединения в ряду трифенодиоксазинов, обладающие люминесценцией в оранжевой и красной областях спектра и достаточной растворимостью в полярных и неполярных растворителях.
Техническим результатом являются также способ получения соединений I.
Технический результат достигается соединениями I и способом их получения.
Способ получения соединений Iа-ж заключается во взаимодействии 3,5-ди-трет-бутил-о-хинона с п-аминофенолом, которое приводит к получению 6,8-ди-трет-бутил-3Н-феноксазин-3-она с его последующей конденсацией с замещенными о-аминофенолами.
Ранее было показано [15], что реакция 3,5-ди-трет-бутил-о-бензохинона с ароматическими аминами на ряду о-хинониминами образует 6,8-ди-трет-бутил-10H-феноксазин. В предлагаемом случае реакция пространственно-экранированного о-хинона с п-аминофенолом, в среде апротонных растворителей (бензол, толуол) вместо ожидаемого 6,8-ди-трет-бутил-10H-феноксазин-3-ол, приводит к продукту его окисления 6,8-ди-трет-бутил-3Н-феноксазин-3-ону. В отличие от большинства феноксазинов, окисление которых протекает в жестких условиях [16], такой результат, можно связать с наличием в молекуле 6,8-ди-трет-бутил-10H-феноксазин-3-ола двух трет-бутильных групп в положении 6 и 8, обеспечивающих способность к легкому окислению гидроксильной группы.
Конденсация 6,8-ди-трет-бутил-3Н-феноксазин-3-она с замещенными о-аминофенолами ранее в литературе описывалась.
Способ получения соединений Iз-к заключается во взаимодействии 3,5-ди-трет-бутил-о-хинона с замещенными о-аминофенолами.
Описываемая реакция, вместо ожидаемых пространственно-экранированных феноксазинов [17,18] приводит к трифенодиоксазинам. Возможность о-аминофенолов образовывать димерные структуры известна для некоторых случаев в жестких условиях [19].
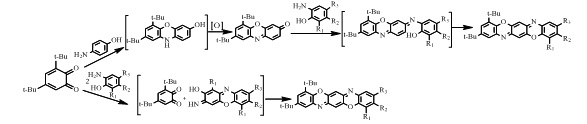
Соединения Iг и Iз могут быть получены обоими способами. Однако, выход соединения Iг, полученного по первому способу при взаимодействии 5-ди-трет-бутил-о-хинона с п-аминофенолом, составляет 33%, в то время как по второму способу при взаимодействии 3,5-ди-трет-бутил-о-хинона с замещенными о-аминофенолами составляет 8%. Выход соединения Iз по первому способу составляет 10%, а по второму способу 45%.
Ниже приведены примеры получения соединений.
Пример 1. 2,4,9,11-тетра-трет-бутилбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Ia).
Стадия 1. Получение 6,8-ди-трет-бутил-3H-феноксазин-3-она
2.20 г (10 ммоль) 3,5-ди-трет-бутил-1,2-бензохинона, 2.20 г (20 ммоль) п-аминофенола и 10 мг п-толуолсульфокислоты растворили в 20 мл толуола. Раствор перемешивали при кипячении с обратным холодильником в течение 7-9 часов. Продукт очищали колоночной хроматографией на Al2O3 (толуол) собирая оранжевую фракцию с Rf ~ 0.51 (вещество наносили в виде твердой смеси с сорбентом). Растворитель упарили и соединение кристаллизовали из ацетонитрила с получением 0.680 г (26%) оранжевых кристаллов. Т.пл.: 155-157 °C.
ИК (см−1): 3057.9, 2955.68, 2907.46, 2868.41, 1638.88, 1617.67, 1568.97, 1505.32, 1469.64, 1393.46, 1356.82, 1225.67, 1197.22, 1100.3, 994.71, 881.88, 859.22, 816.79, 813.9, 748.8, 672.14, 596.92, 502.9, 465.29, 459.5, 410.81;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.36 (с, 9H, t-Bu), 1.48 (с, 9H, t-Bu), 6.35 (д, 1H, J = 2.1 Гц, 4-H), 6.85-6.89 (дд, 1H, J = 2.1 Гц, J = 9.9 Гц, 2-H), 7.43 (д, 1H, J = 9.9 Гц, 1-H), 7.58 (д, 1H, J = 2.4 Гц, 7-H), 7.66 (д, 1H, J = 2.1 Гц, 9-H).
Найдено, (%): C, 77.33; H, 7.61; N, 4.72. C20H23NO2. Вычислено, (%): C, 77.64; H, 7.49; N, 4.53.
Стадия 2. 0.31 г (1 ммоль) 6,8-ди-трет-бутил-3H-феноксазин-3-она, и 0.44 г (2 ммоль) 2-амино-4,6-ди-трет-бутилфенола растворили в 20 мл ДМФА. Раствор перемешивали при кипячении с обратным холодильником в течение 8-10 часов. Продукт очищали колоночной хроматографией на Al2O3 (толуол) собирая фракцию с желтой флуоресценцией (нм) с Rf ~ 0.82. Растворитель упарили и соединение повторно доочистили колоночной хроматографией на SiO2 (толуол) для полного отделения от исходных веществ. Продукт получили в виде оранжевых кристаллов с выходом 0.145 г (28%).
ИК (см−1): 3001.49, 2988.47, 2958.09, 2920.48, 2853.46, 2048.73, 2007.26, 1977.85, 1597.9, 1568.49, 1559.81, 1461.93, 1358.26, 1290.76, 1238.2, 1163.95, 1112.36, 991.82, 892.97, 873.2, 847.65, 800.88, 757.0, 723.25, 620.07, 610.12, 602.71, 540.99, 525.08;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.31 (с, 9H, t-Bu), 1.44 (с, 9H, t-Bu), 6.46 (с, 2H, 6,13-H), 7.24 (с, 2H, 3,10-H), 7.30 (д, 2H, J = 2.4 Гц, 1,8-H).
Найдено, (%):C, 79.67; H, 8.41; N, 5.65. C34H42N2O2. Вычислено, (%):C, 79.96; H, 8.29; N, 5.49.
Пример 2. 2,4-ди-трет-бутилбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iб).
0.31 г (1 ммоль) 6,8-ди-трет-бутил-3H-феноксазин-3-он, и 0.23 г (2 ммоль) o-аминофенола растворили в 20 мл ДМФА. Раствор перемешивали при кипячении с обратным холодильником в течение 8-10 часов. Продукт очищали колоночной хроматографией на Al2O3 (толуол) собирая фракцию с оранжевой флуоресценцией (нм) с Rf ~ 0.71. Растворитель упарили и соединение повторно доочистили колоночной хроматографией на SiO2 (толуол) для полного отделения от исходных веществ. Продукт получили в виде оранжевых кристаллов с выходом 0.123 г (31%). Т.пл.: 227-229 °C.
ИК (см−1): 3627.82, 3389.63, 3073.33, 3003.41, 2952.31, 2924.82, 2903.61, 2866.96, 1571.38, 1478.32, 1461.93, 1377.55, 1312.46, 1260.87, 1169.74, 1111.39, 1093.55, 1017.37, 873.2, 852.47, 763.27, 737.23, 617.17, 585.83;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.31 (с, 9H, t-Bu), 1.44 (с, 9H, t-Bu), 6.46 (с, 1H, 6-H), 6.50 (с, 1H, 13-H), 7.02-7.04 (дд, 1H, J = 1.5 Гц, J = 7.8 Гц, 10-H), 7.12-7.15 (дд, 1H, J = 1.8 Гц, J = 7.5 Гц, 9-H), 7.16-7.19 (дд, 1H, J = 1.8 Гц, J = 7.8 Гц, 11-H), 7.26 (д, 1H, J = 2.4 Гц, 3-H), 7.34 (д, 1H, J = 2.1 Гц, 1-H), 7.38-7.41 (дд, 1H, J = 1.5 Гц, J = 7.7 Гц, 8-H).
Найдено, (%):C, 78.23; H, 6.75; N, 6.99. C26H26N2O2. Вычислено, (%):C, 78.36; H, 6.58; N, 7.03.
Пример 3. 2,4-ди-трет-бутил-11-хлор-9-нитробензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iв).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль о-аминофенола использовали 1.5 ммоль 2-амино-6-хлор-4-нитрофенола), как описано для Iб. Iв получили в виде темно-красных кристаллов 0.143 г (30%) (Rf ~ 0.72). Т.пл. > 260 °C.
ИК (см−1): 3095.99, 2991.84, 2955.68, 2925.79, 2869.37, 1773.89, 1743.03, 1591.63, 1565.11, 1557.88, 1526.54, 1455.66, 1392.98, 1339.94, 1258.94, 1183.72, 1090.66, 1074.27, 1015.92, 988.92, 891.53, 855.85, 797.5, 795.57, 775.81, 734.82, 689.02, 614.76, 537.62;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.33 (с, 9H, t-Bu), 1.45 (с, 9H, t-Bu), 6.53 (с, 1H, 6-H), 6.68 (с, 1H, 13-H), 7.18 (д, 1H, J = 2.7 Гц, 3-H), 7.37 (д, 1H, J = 2.1 Гц, 8-H), 7.43 (д, 1H, J = 2.4 Гц, 10-H), 8.01-8.11 (дд, 1H, J = 2.7 Гц, J = 8.4 Гц, 1-H).
Найдено, (%): C, 65.27; H, 5.30; Cl, 7.54; N, 8.50. C26H24ClN3O4. Вычислено, (%): C, 65.34; H, 5.06; Cl, 7.42; N, 8.79.
Пример 4. 2,4-ди-трет-бутил-9-хлорбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iг).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль о-аминофенола использовали 1.5 ммоль 2-амино-4-хлорфенола), как описано для Iб. Iг получили в виде красных кристаллов с выходом 0.214 г (33%) (Rf ~ 0.83). Т.пл.: 229-231 °C.
ИК (см−1): 3066.1, 2957.13, 2925.3, 2904.57, 2868.41, 1599.35, 1565.59, 1559.81, 1391.53, 1375.62, 1361.64, 1247.85, 1236.76, 1172.63, 1158.65, 1075.71, 991.33, 916.12, 871.76, 857.77, 813.9, 810.04, 803.29, 799.43, 782.56, 662.01, 652.37, 594.99;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.34 (с, 9H, t-Bu), 1.46 (с, 9H, t-Bu), 6.50 (д, 2H, J = 6.9 Гц, 6-H,13-H), 6.97 (д, 1H, J = 8.7 Гц, 3-H), 7.12-7.15 (дд, 1H, J = 2.7 Гц, J = 8.6 Гц, 11-H), 7.31-7.39 (м, 3H, 1-H, 8-H, 10-H).
Найдено, (%): C, 72.38; H, 5.60; Cl, 8.01; N, 6.62. C26H25ClN2O2. Вычислено, (%): C, 72.13; H, 5.82; Cl, 8.19; N, 6.47.
Пример 5. 2,4-ди-трет-бутил-9-метилбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iд).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль о-аминофенола использовали 1.5 ммоль 2-амино-4-метилфенола), как описано для Iб. Iд получили в виде красных кристаллов с выходом 0.099 г (24%) (Rf ~ 0.71). Т.пл.: 233-235°C.
ИК (см−1): 2996.18, 2956.16, 2923.38, 2867.93, 1741.59, 1608.51, 1587.77, 1569.45, 1564.15, 1479.29, 1375.14, 1362.12, 1235.79, 1162.99, 1126.82, 992.78, 896.35, 850.06, 800.88, 760.86, 607.05, 598.85, 580.05, 540.99;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.31 (с, 9H, t-Bu), 1.43 (с, 9H, t-Bu), 2.32 (с, 1H, CH3), 6.44 (с, 1H, 6-H), 6.49 (с, 1H, 13-H), 6.92 (д, 1H, J = 8.1 Гц, 3-H), 6.98-7.01 (дд, 1H, J = 1.8 Гц, J = 8.4 Гц, 10-H), 7.20 (с, 1H, 8-H), 7.25 (д, 1H, J = 2.4 Гц, 11-H), 7.33 (д, 1H, J = 2.1 Hz, 1-H).
Найдено, (%): C, 78.53; H, 6.65; N, 7.06. C27H28N2O2. Вычислено, (%): C, 78.61; H, 6.84; N, 6.79.
Пример 6. 2,4,9-три-трет-бутилбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iе).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль о-аминофенола использовали 1.5 ммоль 2-амино-4-трет-бутилфенола), как описано для Iб. Iе получили в виде темно-коричневых кристаллов с выходом 0.159 г (35%) (Rf ~ 0.85). Т.пл.: 215-217°C.
ИК (см−1): 3063.69, 2953.27, 2924.82, 2904.09, 2871.78, 1754.6, 1567.04, 1559.33, 1527.5, 1364.53, 1360.67, 1265.69, 1171.18, 1162.99, 1135.5, 995.19, 872.24, 858.26, 822.58, 640.32, 606.08, 591.14, 597.89;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.31 (с, 9H, t-Bu), 1.44 (с, 9H, t-Bu), 1.54 (с, 9H, t-Bu), 6.45 (с, 1H, 6-H), 6.48 (с, 1H, 13-H), 6.96-7.00 (дд, 1H, J = 3.3 Гц, J = 8.7 Гц, 10-H), 7.22 (д, 1H, J = 2.4 Гц, 3-H), 7.25 (д, 1H, J = 2.4 Гц, 11-H), 7.33 (д, 1H, J = 2.4 Гц, 8-H), 7.42-7.45 (дд, 1H, J = 2.4 Гц, J = 7.8 Гц, 1-H).
Найдено, (%): C, 79.33; H, 7.66; N, 5.97. C30H34N2O2. Вычислено, (%): C, 79.26; H, 7.54; N, 6.16.
Пример 7. 2,4-ди-трет-бутил-10-хлорбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iж).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль о-аминофенола использовали 1.5 ммоль 2-амино-5-хлорфенола), как описано для Iб. Iж получили в виде красных кристаллов с выходом 0.173 г (40%) (Rf ~ 0.77). Т.пл. > 260°C.
ИК (см−1): 2987.99, 2960.98, 2906.5, 2866.96, 1729.53, 1639.85, 1575.72, 1566.08, 1527.99, 1461.45, 1378.03, 1365.01, 1259.9, 1156.72, 1079.57, 1017.85, 911.29, 877.54, 859.7, 816.31, 798.47, 649.0, 588.73, 573.3, 564.13;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.31 (с, 9H, t-Bu), 1.43 (с, 9H, t-Bu), 6.47 (д, 2H, J = 1.5 Гц, 6, 13-H), 7.03-7.07 (дд, 1H, J = 2.1 Гц, J = 8.4 Гц, 9-H), 7.09 (д, 1H, J = 2.1 Гц, 3-H), 7.28 (д, 1H, J = 2.4 Гц, 8-H), 7.32 (с, 1H, 1-H), 7.35 (д, 1H, J = 2.4 Гц, 11-H).
Найдено, (%): C, 72.04; H, 5.98; Cl, 8.25; N, 6.34. C26H25ClN2O2. Вычислено, (%): C, 72.13; H, 5.82; Cl, 8.19; N, 6.47.
Пример 8. 9-бром-2,4-ди-трет-бутилбензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iз).
0.22 г (1 ммоль) 3,5-ди-трет-бутил-1,2-бензохинона, 0.38 г (2 ммоль) 2-амино-4-бромфенола и 0.5 мл трифторацетилуксусной ксилоты растворили в 20 мл ацетонитрила. Раствор перемешивали при кипячении с обратным холодильником в течение 6-8 часов. Продукт очищали колоночной хроматографией на Al2O3 (толуол) собирая фракцию с оранжевой флуоресценцией (нм) с Rf ~ 0.88. Растворитель упарили и соединение повторно доочистили колоночной хроматографией на SiO2 (толуол) для полного отделения от исходных веществ. Продукт получили в виде красных кристаллов с выходом 0.215 г (45%). Т.пл.: 249-251°C.
ИК (см−1): 2960.5, 2867.4, 1560.2, 1527.9, 1439.7, 1361.6, 1287.3, 1236.2, 1175.5, 991.8, 858.73, 812.9, 646.5;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.34 (с, 9H, t-Bu), 1.46 (с, 9H, t-Bu), 6.50 (д, 2H, J = 6.3 Гц, 6, 13-H), 6.92 (д, 1H, J = 8.7 Гц, 3-H), 7.31-7.38 (м, 3H), 7.16-7.19 (дд, 1H, J = 1.8 Гц, J = 7.8 Гц, 11-H), 7.54 (д, 1H, J = 2.4 Гц, 8-H).
Найдено, (%): C, 65.62; H, 5.32; Br, 16.89; N, 5.47. C26H25BrN2O2. Вычислено, (%):C, 65.41; H, 5.28; Br, 16.74; N, 5.87.
Пример 9. 2,4-ди-трет-бутил-9-нитробензол[5,6][1,4]оксазино[2,3-b]феноксазин, (Iи).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль 2-амино-4-бромфенола использовали 2 ммоль 2-амино-4-нитрофенола), как описано для Iз. Iи получили в виде красных кристаллов с выходом 0.178 г (40%) (Rf ~ 0.75). Т.пл. > 260°C.
ИК (см−1): 2956.16, 2906.5, 1564.15, 1523.65, 1445.05, 1392.98, 1343.8, 1262.31, 1156.72, 1075.71, 896.35, 851.02, 822.58, 738.2, 654.78;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.34 (с, 9H, t-Bu), 1.41 (с, 9H, t-Bu), 6.56 (д, 2H, J = 9.0 Гц, 6, 13-H), 7.11 (д, 1H, J = 9.0 Гц, 3-H), 7.36-7.42 (дд, 2H, J = 2.4 Гц, J = 13.5 Гц, 1, 11-H), 8.03-8.07 (дд, 1H, J = 2.7 Гц, J = 9.0 Гц, 10-H), 8.25 (д, 1H, J = 2.4 Гц, 8-H).
Найдено, (%): C, 70.23; H, 5.62; N, 9.72. C26H25N3O4. Вычислено, (%): C, 70.41; H, 5.68; N, 9.47.
Пример 10. 2,4-ди-трет-бутил-10-нитробензо[5,6][1,4]оксазино[2,3-b]феноксазин, (Iк).
Соединение получили в тех же условиях и при использовании тех же реагентов (вместо 2 ммоль 2-амино-4-бромфенола использовали 2 ммоль 2-амино-5-нитрофенола), как описано для Iз. Iк получили в виде темных кристаллов с выходом 0.199 г (45%) (Rf ~ 0.78). Т.пл. > 260°C.
ИК (см−1): 2957.1, 2906.5, 1561.2, 1520.2, 1480.2, 1388.1, 1334.3, 1243, 1157.2, 1067.5, 878, 851.9, 735.3;
Спектр ЯМР 1H, (600 МГц), δ, м.д. (CDCl3): 1.35 (с, 9H, t-Bu), 1.48 (с, 9H, t-Bu), 6.60 (д, 2H, J = 9.3 Гц, 6, 13-H), 7.39-7.47 (м, 3H), 7.89 (д, 1H, J = 2.4 Гц, 1-H), 7.97-8.01 (дд, 1H, J = 2.7 Гц, J = 8.9 Гц, 11-H).
Найдено, (%): C, 70.30; H, 5.72; N, 9.55. C26H25N3O4. Вычислено, (%): C, 70.41; H, 5.68; N, 9.47; O, 14.43.
Электронные спектры поглощения и излучения регистрировали на спектрофотометрах Cary Scan 100 (Varian) и Cary Eclipse 100 (Varian). Квантовые выходы флуоресценции определяли по методу Паркера-Риса (27,28 в дайсе). Результаты представлены в таблице 1.
Результаты растворимости приведены в таблице 2. Там же приведены результаты растворимости аналогов, а именно, соединений II, III и IV. Соединения II и III синтезированы по методике из статьи [6], соединение IV синтезировано по методике из статьи [7].
Таблица 1
|
Таблица 2
|
Как видно из таблиц 1 и 2, соединения I, за исключением Iв и Iк, флюоресцируют в зеленой и желто-зеленой областях спектра, и обладают достаточной растворимостью в полярных и неполярных растворителях, в отличие от соединения прототипа (IV), которое флюоресцирует в оранжево-красной области спектра и обладает плохой растворимостью в этих растворителях.
Соединения Iв и Iк, флюоресцируют соответственно в оранжевой и красной областях спектра, близкой к области флюоресценции прототипа, и обладают достаточной растворимостью в полярных и неполярных растворителях, в отличие от соединений прототипа, а также других аналогов (II-III), которые обладает плохой растворимостью в этих растворителях.
Хорошая растворимость в полярных и неполярных растворителях особенно важна при создании элементов для солнечных батарей.
Список литературы
1. Kraska J., Boruszczak Z., Landwijt B. Synthesis and properties of reactive dyes, derivatives of 3,10-bis(30-aminopropylamino)-6,13-dichlorotriphenodioxazin-4,11-disulphonic acid. Dyes and Pigments, 1999, 43, 1-6;
2. Wannebroucq A., Gruntz G., Suisse J.-M., Nicolas Y., Meunier-Prest R., Mateos M., Toupance T., Bouvet M. New n-type molecular semiconductor-doped insulator (MSDI) heterojunctions combining a triphenodioxazine (TPDO) and the lutetium bisphthalocyanine (LuPc2) for ammonia sensing. Sensors and Actuators B, 2018, 255, 1694-1700;
3. Nicolas Y., Castet F., Devynck M., Tardy P., Hirsch L.,  C., Allouchi H., Toupance T. TIPS-triphenodioxazine versus TIPS-pentacene: Enhanced electron mobility for n-type organic fleld-effect transistors. Organic Electronics, 2012, 13, 1392-1400;
C., Allouchi H., Toupance T. TIPS-triphenodioxazine versus TIPS-pentacene: Enhanced electron mobility for n-type organic fleld-effect transistors. Organic Electronics, 2012, 13, 1392-1400;
4. Qiao F., Liu A., Xiao Y., Ou Y. P., Zhang quan J., Sang chang Y. Enhanced photovoltaic characteristics of solar cells based on n-type triphenodioxazine derivative. Microelectronics Journal, 2008, 39, 1568 - 1571;
5. Gruntz G., Lee H., Hirsch L. l, Castet F., Toupance T., Briseno A. L., Nicolas Y. Nitrile Substitution Effect on Triphenodioxazine-Based Materials for Liquid-Processed Air-Stable n-Type Organic Field Effect Transistors. Adv. Electron. Mater., 2015, 1-6;
6. Shao Y., Yang J. A new fluorescent triphenodioxazine dye derived from 4-aminodiphenylamine. Dyes and Pigments, 1994, 24(2), 143-150;
7.  D., Neubauer S. Preparation of an unsymmetrically substituted push-pull triphenodioxazine. Archive for organic chemistry, 2001, 1, 62-66;
D., Neubauer S. Preparation of an unsymmetrically substituted push-pull triphenodioxazine. Archive for organic chemistry, 2001, 1, 62-66;
8. Tanaka T., Sekine Ch., Ashida T., Ishitobi M., Konya N., Minai M., Fujisawa K. Highly Anisotropic Molecular Materials for LCD. Molecular Crystals and Liquid Crystals Science and Technology. Section A., 2000, 346(1), 209-216;
9. Tanaka T., Ashida T. Highly Dichroic Triphenodioxazine Dyes for Guest Host Liquid Crystalline Mixtures. Molecular Crystals and Liquid Crystals Science and Technology. Section A., 2001, 364(1), 779-786;
10. Tanaka T., Ashida T., Matsumoto S. Highly Dichroic and Luminescent Triphenodioxazine Dyes. Chem. Lett., 2011, 40, 573-575;
11. Gong X., Han P., Wen H., Sun Y., Zhang X., Yang H., Baoping. Synthesis and Properties of Triphenodioxazine-Based Conjugated Polymers for Polymer Solar Cells. Eur. J. Org. Chem., 2017, 3689-3698;
12. Chen S.-L., Zhu Z.-H., Chen K.-C. A class of novel laser dyes: triphenodioxazines. Optics communications, 1989, 74(1,2), 84-86;
13. Heda L., Pareek C., Pareek D., Mosalpuri S.. Synthesis and biological screening of octasubstituted-triphenodioxazines and its sulphur analogues with some novel intermediates. Cent. Eur. J. Chem., 2010, 8(1), 51-57;
14. Nicolas Y., Allama F., Lepeltier M., Massin J., Castet F., Ducasse L., Hirsch L., Boubegtiten Z., Jonusauskas G., Olivier C., Toupance T. New Synthetic Routes towards Soluble and Dissymmetric Triphenodioxazine Dyes Designed for Dye-Sensitized Solar Cells. Chem. Eur. J., 2014, 20, 3678-3688;
15. Ivakhnenko E. P., Romanenko G. V., Kovalenko A. A., Revinskii Yu. V., Knyazev P. A., Kuzmin V. A., Minkin V. I. Reaction of 3,5-di-(tert-butyl)-o-benzoquinone with arylamines developing to the formation of a pentaheterocyclic 12Н-quinoxaline[2,3-b]phenoxazine system. A deeper insight into the reaction mechanism. Dyes and Pigments, 2018, 150, 97-104;
16. Barret R., Daudon M. Synthesis of Quinone-Imines with Iodoxybenzene. Synthetic Communications, 1990, 20(10), 1543-1549;
17. Ivakhnenko E.P., Knyazev P.A., Romanenko G.V., Kovalenko A.А., Ivakhnenko T.E., Revinskii Yu. V., Minkin V. I. The carboxyl derivatives of 6,8-di-(tert.-butyl)phenoxazine: Synthesis, oxidation reactions and fluorescence. Tetrahedron, 2019, 75(4), 538-544;
18. Abakumov G.A., Cherkasov V.K., Piskunov A.V., Trofimova O.Yu., Shavyrin A.S. Cyclization-Decyclization of Sterically Hindered oIminobenzoquinone. Doklady Chemistry, 2011, 440(6), 765-769;
19. Bruyneel F., Diveb G., Marchand-Brynaert J. Non-symmetrically substituted phenoxazinones from laccase-mediated oxidative cross-coupling of aminophenols: an experimental and theoretical insight. Org. Biomol. Chem., 2012, 10, 1834-1846.