Результат интеллектуальной деятельности: НАЦЕЛЕННОЕ НА GPC3 ЛЕКАРСТВЕННОЕ СРЕДСТВО, КОТОРОЕ ВВОДЯТ ПАЦИЕНТУ, ЧУВСТВИТЕЛЬНОМУ К НАЦЕЛЕННОЙ НА GPC3 ЛЕКАРСТВЕННОЙ ТЕРАПИИ
Вид РИД
Изобретение
[Область техники, к которой относится изобретение]
[0001]
Настоящее изобретение предоставляет способ определения эффективности действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента или определения продолжения нацеленной на GPC3 лекарственной терапии для пациента. Настоящее изобретение также предоставляет нацеленные на GPC3 лекарственное средство или препарат, которые будут в дальнейшем вводиться пациенту, для определения эффективности действия нацеленной на GPC3 лекарственной терапии или продолжения нацеленной на GPC3 лекарственной терапии.
[Предшествующий уровень техники]
[0002]
Гепатоцеллюлярный рак по имеющимся сведениям является пятой ведущей причиной смертей от злокачественных новообразований в мировом масштабе, учитывая приблизительно 600000 смертных случаев каждый год (непатентная литература 1). Большинство пациентов с гепатоцеллюлярным раком умирают в интервале 1 года после диагностирования заболевания. К сожалению, случаи гепатоцеллюлярного рака часто диагностируют на поздней стадии, которая редко реагирует на методы радикальной терапии. Пока еще медицинские воздействия, включающие химиотерапию, химиоэмболизацию, абляцию и терапию протонным пучком, являются недостаточно эффективными для таких пациентов. Многие пациенты проявляют рецидив заболевания с сосудистой инвазией и множественными внутрипеченочными метастазами, которые быстро прогрессируют в распространенную стадию. Их 5-летние коэффициенты выживаемости составляют только 7% (непатентная литература 2). Пациенты с гепатоцеллюлярным раком, подлежащие резекции местных очагов, имеют относительно хороший прогноз, хотя их 5-летние коэффициенты выживаемости все еще остаются на уровне 15% и 39% (непатентная литература 3). Таким образом, в данной области существует востребованность в новой терапии такого злокачественного заболевания гепатоцеллюлярным раком.
[0003]
Гепатоцеллюлярный рак по имеющимся сведениям является ответственным за более чем 90% случаев первичного рака печени в Японии. Медицинские методы лечения такого гепатоцеллюлярного рака включают, например, терапию на основе химиотерапевтической транскатетерной артериальной эмболизации (TAE), которая включает в себя индуцирование селективного некроза гепатоцеллюлярного рака посредством инъекции смеси контрастной среды на масляной основе (Lipiodol), противоопухолевого средства и стенозирующего вещества (Gelfoam) в печеночную артерию (которая служит в качестве пути доставки питательных компонентов к опухоли), приводя к закупорке питательной артерии. В дополнение, применяют инвазивные подходы, такие как чрескожная инъекция этанола, чрескожная микроволновая коагуляционная терапия и радиочастотная абляция. Также были проведены клинические испытания по системной химиотерапии с использованием химиотерапевтических средств, таких как фторурацил (5-FU), урацил-тегафур (UFT), митомицин C (MMC), митоксантрон (DHAD), адриамицин (ADR), эпирубицин (EPI) и цисплатин (CDDP), либо по отдельности, либо в комбинации с интерфероном (IFN) (непатентная литература 4).
[0004]
В то же время, была разрешена к применению перорально активная форма сорафениба (Nexavar, BAY43-9006), которая является более преимущественно эффективной, чем химиотерапевтические средства, описанные выше, таким образом, что это средство блокирует рост раковых клеток посредством ингибирования Raf-киназы при Raf/MEK/ERK сигнальной трансдукции, в то время как средство проявляет антиангиогенные эффекты посредством направленного действия на тирозинкиназы VEGFR-2, VEGFR-3 и PDGFR-β. Эффективность действия сорафениба была исследована в двух с фазой-III многоцентровых плацебо-контролируемых испытаниях (испытание Сорафениба по рандомизированному протоколу оценки ГЦР (SHARP) и Азиатское-Тихоокеанское испытание), нацеленные на распространенный гепатоцеллюлярный рак. Было подтверждено, что Сорафениб продлевает продолжительности выживания, с HR, равным 0,68, в обоих этих испытаниях. При испытании SHARP сорафениб продлевал продолжительность выживания до 10,7 месяцев по сравнению с 7,9 месяцами для плацебо. При Азиатском испытании это средство продлевало продолжительность выживания до 6,5 месяца по сравнению с 4,2 месяцами для плацебо. Средство, однако, имело низкую частоту объективных ответов и не показывало продление времени до симптоматического прогресстрования, хотя средство продлевало время до прогрессирования опухоли (5,5 месяцев по сравнению с 2,8 месяцами при Европейском и Американском испытании и 2,8 месяца по сравнению с 1,4 месяцами при Азиатском испытании) на изображениях. Азиатские когорты проявляли короткую продолжительность продления жизни, которая вероятно обусловлена тем, что лечение начинали на немного более поздней стадии во время протекания болезни в Азиатском регионе в сравнении с Европой и Соединенными Штатами (непатентные литературы 5 и 6).
[0005]
По мере того, как рак печени прогрессирует, обычно наблюдают его специфические симптомы, ассоциированные с дисфункцией печени, такие как анорексия, потеря массы тела, общее недомогание, пальпируемая масса на уровне правого подреберья, боль в правом подреберье, ощущение переполнения желудка, лихорадка и желтуха. Химиотерапевтические средства (например, сорафениб), однако, имеют осложнения, которые нужно преодолеть, включающие их характерные нежелательные реакции, такие как диарея или запор, анемия, подавление иммунной системы с вызыванием инфекции или сепсиса (с летальным отягощением), кровоизлияние, кардиотоксичность, печеночную токсичность, почечную токсичность, анорексию и потерю массы тела.
[0006]
Несмотря на то, что при раке печени конкретных симптомов ранних стадий первоначально не наблюдают, его специфические симптомы, ассоциированные с дисфункцией печени, такие как анорексия, потеря массы тела, общее недомогание, пальпируемая масса в правом подреберье, боль в правом подреберье, ощущение переполнения желудка, лихорадка и желтуха, как правило, наблюдают при прогрессировании рака печени. В соответствии с клиническим наблюдением, такие симптомы усиливаются при применении химиотерапевтических средств. Например, анорексия у пациента с обнаруживаемыми клетками рака печени и симптомами, такими как потеря массы тела, ассоциированная с анорексией или независимая от анорексии, могут быть более усилены посредством введения химиотерапевтических средств пациенту, чем без применения химиотерапевтических средств. В некоторых случаях применение химиотерапевтических средств должно быть отменено для пациента, имеющего такие симптомы. Эти усиленные симптомы являются препятствиями для терапий с использованием химиотерапевтических средств. Таким образом, имеется потребность в установлении превосходящей терапии с точки зрения, например, улучшения терапевтических эффектов или улучшения QOL пациентов, подлежащих лечению.
[0007]
Глипикан 3 (GPC3) часто экспрессируется на высоком уровне при раке печени, и как таковой, по-видимому, является применимым при идентификации его функций при раке печени или в качестве терапевтической или диагностической мишени рака печени.
[0008]
При данных обстоятельствах, описанных выше, на стадии разработки находятся лекарственные средства с GPC3 в качестве терапевтической мишени рака печени. Было разработано лекарственное средство против рака печени, содержащее антитело против GPC3 в качестве активного ингредиента, антитело, имеющее активность антителозависимой клеточноопосредованной цитотоксичности (далее в настоящем документе именуемой как "ADCC") и/или активность комплементзависимой цитотоксичности (далее в настоящем документе именуемой "CDC") против клеток, экспрессирующих GPC3 (патентная литература 1). Также было разработано нацеленное на GPC3 лекарственное средство, содержащее гуманизированное антитело против GPC3, имеющее активность ADCC и активность CDC, в качестве активного ингредиента (патентная литература 2). В дальнейшем были разработаны нацеленные на GPC3 лекарственные средства, которые содержат гуманизированное антитело против GPC3 с усиленной активностью ADCC (патентная литература 3 и 4), или антитело против GPC3, имеющее активность ADCC и активность CDC, а также улучшенную динамику в плазме (патентная литература 5). Было обнаружено, что эти антитела против GPC3 при комбинированной терапии с использованием химиотерапевтических средств, таких как сорафениб, ослабляют нежелательные реакции, например, вызываемые монотерапией химиотерапевтическими средствами (например, сорафенибом), а также проявляют синергические воздействия, основанные на этих средствах (патентная литература 6). Соответственно, превосходящие способы лечения рака печени находятся в процессе установления, с использованием нацеленных на GPC3 лекарственных средств в качестве ядра с точки зрения, например, улучшения терапевтических эффектов или улучшения QOL пациентов, подлежащих лечению.
[0009]
В то же время, разрабатываются также нацеленные на GPC3 способы для диагностирования рака печени. Известно, что GPC3 экспрессируется на клеточной поверхности и процессируется на конкретном участке конвертазой, фосфолипазой D, Нотум или по неустановленному механизму (непатентная литература 7 и 8) во время или после экспрессии на клеточной поверхности. Посредством использования такого явления, были разработаны диагностическое средство или диагностический способ для рака печени, которые включают в себя антитело, способное к связыванию с эпитопом в растворимой форме GPC3, секретируемой в плазму пациента после процессинга (патентная литература 7). Также были разработаны диагностическое средство или диагностический способ для рака печени, которые включают антитело, способное к связыванию с эпитопом в фиксированной форме GPC3, еще существующей на клеточной поверхности после процессинга в тканевом препарате или т.п., выделенном из пациента (патентная литература 8). Эти диагностические средства или диагностические способы, однако, являются средствами для обнаружения наличия рака печени у пациента, подлежащего тестированию. Ни способ для определения эффективности действия нацеленной на GPC3 лекарственной терапии для пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, ни способ определения продолжения нацеленной на GPC3 лекарственной терапии для пациента, еще не известны.
[0010]
Ссылки, приведенные в настоящем описании, являются такими, как приведено ниже. Содержание, описанное в этих литературных источниках, полностью включено в настоящее описание посредством ссылки. Следует отметить, что ни один из этих литературных источников не может рассматриваться как предшествующий уровень техники для настоящего изобретения.
[Список цитируемых источников]
[Патентная литература]
[0011]
[Патентная литература 1] WO2003/000883
[Патентная литература 2] WO2006/006693
[Патентная литература 3] WO2006/046751
[Патентная литература 4] WO2007/047291
[Патентная литература 5] WO2009/041062
[Патентная литература 6] WO2009/122667
[Патентная литература 7] WO2004/038420
[Патентная литература 8] WO2009/116659
[Непатентная литература]
[0012]
[Непатентная литература 1] Llovet JM, Burroughs A, Bruix J; Lancet (2003), 362, 1907-17
[Непатентная литература 2] Bosch FX, Ribes J, Cleries R; Gastroenterology (2004), 127, S5-16
[Непатентная литература 3] Takenaka K, Kawahara N, Yamamoto K, Kajiyama K, Maeda T, Itasaka H, Shirabe K, Nishizaki T, Yanaga K, Sugimachi K; Arch Surg (1996), 131, 71-6
[Непатентная литература 4] Yeo W, Mok TS, Zee B, Leung TW, Lai PB, Lau WY, Koh J, Mo FK, Yu SC, Chan AT, Hui P, Ma B, Lam KC, Ho WM, Wong HT, Tang A, Johnson PJ; J Natl Cancer Inst (2005), 97, 1532-8
[Непатентная литература 5] Llovet J, Ricci S, Mazzaferro V, Hilgard P, Gane E, et al. Sorafenib in advanced hepatocellular carcinoma. New Eng. J. Med. (2008) 359, 378-90
[Непатентная литература 6] Cheng AL, Chen Z, Tsao CJ, Qin S, Kim JS, et al. Efficacy and safety of sorefanib in patients in Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomized, double-blind, placebo-controlled trial. Lancet Oncol. (2009) 10, 25-34
[Непатентная литература 7] De Cat B, Muyldermans S-Y, Coomans C, Degeest G, Vanderschueren B, et al. Processing by proprotein convertases is required for glypican-3 modulation of cell survival, Wnt signaling, and gastrulation movements. J. Cell. Biol. (2003) 163, 625-635
[Непатентная литература 8] Traister A, Shi W and Filmus J. Mammalian Notum induces release of glypicans and other GPI-anchored proteins from cell surface. Biochem. J. (2008) 410, 503-511
[Краткое содержание сущности изобретения]
[Техническая проблема]
[0013]
Настоящее изобретение было создано с учетом ситуаций, как описано выше, и целью настоящего изобретения является предоставить способ для определения эффективности действия нацеленной на GPC3 лекарственной терапии для пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, или определения продолжения нацеленной на GPC3 лекарственной терапии для пациента. Еще одной целью настоящего изобретения является предоставить нацеленные на GPC3 лекарственное средство или препарат, которые будут далее вводиться пациенту, для которого была определена эффективность действия нацеленной на GPC3 лекарственной терапии или было определено продолжение нацеленной на GPC3 лекарственной терапии.
[Решение проблемы]
[0014]
Авторы настоящего изобретения провели тщательные исследования в условиях ситуаций, описанных выше, и последовательно создали способ, включающий мониторинг концентрации свободного GPC3 в биологическом образце, выделенном из пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, в котором, когда концентрация свободного GPC3 имеет заранее определенное значение, или, когда концентрация свободного GPC3 увеличилась в результате получения нацеленной на GPC3 лекарственной терапии, определяют эффективность действия нацеленной на GPC3 лекарственной терапии или определяют продолжение нацеленной на GPC3 лекарственной терапии. Авторы настоящего изобретения также создали нацеленное на GPC3 лекарственное средство или препарат, которые будут в дальнейшем вводиться пациенту, для которого была определена эффективность действия нацеленной на GPC3 лекарственной терапии или было определено продолжение нацеленной на GPC3 лекарственной терапии. Исходя из ранее полученных результатов, ожидалось, что концентрация свободного GPC3, обнаруженная в плазме, уменьшается в динамике при продолжении лечения, если нацеленная на GPC3 лекарственная терапия имеет эффективность действия. Неожиданно, авторы настоящего изобретения обнаружили, что концентрация свободного GPC3 стабилизируется или увеличивается, в большей степени, чем уменьшается, в плазме, выделенной из пациента со стабильным заболеванием, который может реагировать на нацеленную на GPC3 лекарственную терапию.
[0015]
Более конкретно, настоящее изобретение предоставляет следующие аспекты:
[1] способ определения эффективности действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента или определения продолжения нацеленной на GPC3 лекарственной терапии для пациента, включающий мониторинг концентрации свободного GPC3 в биологическом образце, выделенном из пациента перед началом нацеленной на GPC3 лекарственной терапии, и/или пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, в котором, когда концентрация свободного GPC3 имеет заранее определенное значение, определяют эффективность действия нацеленной на GPC3 лекарственной терапии или определяют продолжение нацеленной на GPC3 лекарственной терапии,
[2] способ в соответствии с [1], в котором концентрация свободного GPC3 представляет собой концентрацию в образце цельной крови, образце плазмы или образце сыворотки, выделенном из пациента,
[3] способ в соответствии с [2], в котором концентрация свободного GPC3 в биологическом образце, выделенном из пациента, представляет собой концентрацию в образце плазмы или образце сыворотки,
[4] способ в соответствии с любым из [1]-[3], в котором заранее определенное значение свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл,
[5] способ в соответствии с любым из [1]-[4], в котором концентрацию свободного GPC3 измеряют с использованием иммунологического метода,
[6] способ в соответствии с любым из [1]-[5], в котором концентрация свободного GPC3 является больше, чем та же концентрация в биологическом образце, выделенном из пациента перед началом нацеленной на GPC3 лекарственной терапии,
[7] способ в соответствии с любым из [1]-[6], в котором пациент показывает высокую экспрессию GPC3 по балльной оценке иммуногистохимического окрашивания,
[8] способ в соответствии с любым из [1]-[7], в котором злокачественное новообразование является раком печени,
[9] способ в соответствии с любым из [1]-[8], в котором нацеленное на GPC3 лекарственное средство вводят, чтобы достичь остаточного уровня в крови, равного 200 мкг/мл или выше, у пациента со злокачественным новообразованием,
[10] способ в соответствии с любым из [1]-[9], в котором нацеленное на GPC3 лекарственное средство содержит антитело против GPC3 в качестве активного ингредиента,
[11] способ в соответствии с [10], в котором антитело против GPC3 имеет активность антителозависимой клеточноопосредованной цитотоксичности (ADCC) и/или активность комплементзависимой цитотоксичности (CDC),
[12] способ в соответствии с [10] или [11], в котором антитело против GPC3 представляет собой химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее любую из следующих (1)-(5):
(1) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 4, 5 и 6, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 7, 8 и 9, соответственно;
(2) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 12, 13 и 14, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 15, 16 и 17, соответственно;
(3) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 20, 21 и 22, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 23, 24 и 25, соответственно;
(4) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 28, 29 и 30, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 31, 32 и 33, соответственно; и
(5) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 36, 37 и 38, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 39, 40 и 41, соответственно,
[13] Способ в соответствии с любым из [10]-[12], в котором антитело против GPC3 содержит любую из следующих (1)-(6):
(1) вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, представленную SEQ ID NO: 51;
(2) вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, выбранную из группы вариабельных областей легкой цепи, представленных SEQ ID NO: 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 и 66;
(3) вариабельную область тяжелой цепи, представленную SEQ ID NO: 67, и вариабельную область легкой цепи, представленную SEQ ID NO: 68;
(4) вариабельную область тяжелой цепи, представленную SEQ ID NO: 69, и вариабельную область легкой цепи, представленную SEQ ID NO: 70;
(5) вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 72; и
(6) вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 73,
[14] способ в соответствии с [10], в котором нацеленное на GPC3 лекарственное средство содержит антитело против GPC3, конъюгированное с цитотоксическим веществом,
[15] нацеленное на GPC3 лекарственное средство, которое будет вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием перед началом нацеленной на GPC3 лекарственной терапии,
[16] нацеленное на GPC3 лекарственное средство, которые будет в дальнейшем вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии,
[17] лекарственное средство в соответствии с [15] или [16], в котором концентрация свободного GPC3 представляет собой концентрацию в образце цельной крови, образце плазмы или образце сыворотки, выделенном из пациента со злокачественным новообразованием,
[18] лекарственное средство в соответствии с [17], в котором концентрация свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием, представляет собой концентрацию в образце плазмы или образце сыворотки,
[19] лекарственное средство в соответствии с любым из [15]-[18], в котором заранее определенное значение свободного GPC3 находится в интервале от 0,1 нг/мл до 60 нг/мл,
[20] лекарственное средство в соответствии с любым из [15]-[19], в котором концентрацию свободного GPC3 измеряют с использованием иммунологического метода,
[21] лекарственное средство в соответствии с любым из [15]-[20], в котором концентрация свободного GPC3 увеличилась в результате получения нацеленной на GPC3 лекарственной терапии,
[22] лекарственное средство в соответствии с любым из [15]-[21], в котором пациент показывает высокую экспрессию GPC3 по балльной оценке иммуногистохимического окрашивания,
[23] лекарственное средство в соответствии с любым из [15]-[22], в котором пациент со злокачественным новообразованием представляет собой пациента с раком печени,
[24] лекарственное средство в соответствии с любым из [15]-[23], в котором нацеленное на GPC3 лекарственное средство вводят, чтобы достичь остаточного уровня в крови, равного 200 мкг/мл или выше, у пациента со злокачественным новообразованием,
[25] лекарственное средство в соответствии с любым из [15]-[24], в котором нацеленное на GPC3 лекарственное средство содержит антитело против GPC3 в качестве активного ингредиента,
[26] лекарственное средство в соответствии с [25], в котором антитело против GPC3 имеет активность антителозависимой клеточноопосредованной цитотоксичности (ADCC) и/или активность комплементзависимой цитотоксичности (CDC),
[27] лекарственное средство в соответствии с [25] или [26], в котором антитело против GPC3 представляет собой химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее любую из следующих (1)-(5):
(1) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 4, 5 и 6, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 7, 8 и 9, соответственно;
(2) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 12, 13 и 14, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 15, 16 и 17, соответственно;
(3) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 20, 21 и 22, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 23, 24 и 25, соответственно;
(4) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 28, 29 и 30, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 31, 32 и 33, соответственно; и
(5) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 36, 37 и 38, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 39, 40 и 41, соответственно,
[28] лекарственное средство в соответствии с любым из [25]-[27], в котором антитело против GPC3 содержит любую из следующих (1)-(6):
(1) вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, представленную SEQ ID NO: 51;
(2) вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, выбранную из группы вариабельных областей легкой цепи, представленных SEQ ID NO: 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 и 66;
(3) вариабельную область тяжелой цепи, представленную SEQ ID NO: 67, и вариабельную область легкой цепи, представленную SEQ ID NO: 68;
(4) вариабельную область тяжелой цепи, представленную SEQ ID NO: 69, и вариабельную область легкой цепи, представленную SEQ ID NO: 70;
(5) вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 72; и
(6) вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 73,
[29] лекарственное средство в соответствии с [25], в котором нацеленное на GPC3 лекарственное средство содержит антитело против GPC3, конъюгированное с цитотоксическим веществом,
[30] препарат для нацеленного на GPC3 лечения, содержащий инструкцию, утверждающую, что препарат будет в дальнейшем вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием перед началом нацеленной на GPC3 лекарственной терапии,
[31] препарат для нацеленного на GPC3 лечения, содержащий инструкцию, устанавливающую, что препарат будет в дальнейшем вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии,
[32] препарат в соответствии с [30] или [31], где концентрация свободного GPC3 представляет собой концентрацию в образце цельной крови, образце плазмы, или образце сыворотки, выделенном из пациента со злокачественным новообразованием,
[33] препарат в соответствии с [32], где концентрация свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием, представляет собой концентрацию в образце плазмы или образце сыворотки,
[34] препарат в соответствии с любым из [30]-[33], где заранее определенное значение свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл,
[35] препарат в соответствии с любым из [30]-[34], где концентрацию свободного GPC3 измеряют с использованием иммунологического метода,
[36] препарат в соответствии с любым из [30]-[35], где концентрация свободного GPC3 увеличилась в результате получения нацеленной на GPC3 лекарственной терапии,
[37] препарат в соответствии с любым из [30]-[36], где пациент показывает высокую экспрессию GPC3 по балльной оценке иммуногистохимического окрашивания,
[38] препарат в соответствии с любым из [30]-[37], где пациент со злокачественным новообразованием является пациентом с раком печени,
[39] препарат в соответствии с любым из [30]-[38], где нацеленное на GPC3 лекарственное средство вводят, чтобы достичь остаточного уровня в крови, равного 200 мкг/мл или выше у пациента со злокачественным новообразованием,
[40] препарат в соответствии с любым из [30]-[39], в котором нацеленное на GPC3 лекарственное средство содержит антитело против GPC3 в качестве активного ингредиента,
[41] препарат в соответствии с [40], в котором антитело против GPC3 имеет активность антителозависимой клеточноопосредованной цитотоксичности (ADCC) и/или активность комплементзависимой цитотоксичности (CDC),
[42] препарат в соответствии с [40] или [41], в котором антитело против GPC3 представляет собой химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее любую из следующих (1)-(5):
(1) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 4, 5 и 6, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 7, 8 и 9, соответственно;
(2) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 12, 13 и 14, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 15, 16 и 17, соответственно;
(3) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 20, 21 и 22, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 23, 24 и 25, соответственно;
(4) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 28, 29 и 30, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 31, 32 и 33, соответственно; и
(5) CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 36, 37 и 38, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 39, 40 и 41, соответственно,
[43] препарат в соответствии с любым из [40]-[42], в котором антитело против GPC3 содержит любую из следующих (1)-(6):
(1) вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, представленную SEQ ID NO: 51;
(2) вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, выбранную из группы вариабельных областей легкой цепи, представленных SEQ ID NO: 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 и 66;
(3) вариабельную область тяжелой цепи, представленную SEQ ID NO: 67, и вариабельную область легкой цепи представленную SEQ ID NO: 68;
(4) вариабельную область тяжелой цепи, представленную SEQ ID NO: 69, и вариабельную область легкой цепи, представленную SEQ ID NO: 70;
(5) вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 72; и
(6) вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 73,
[44] препарат в соответствии с [40], в котором нацеленное на GPC3 лекарственное средство содержит антитело против GPC3, конъюгированное с цитотоксическим веществом,
[45] способ лечения злокачественного новообразования, включающий введение нацеленного на GPC3 лекарственного средства пациенту, определенного посредством способа в соответствии с любым из [1]-[14].
[Эффект изобретения]
[0016]
В соответствии с настоящим изобретением, может быть удобным образом и точно определено, имеет ли нацеленная на GPC3 лекарственная терапия эффективность действия или должна ли продолжаться нацеленная на GPC3 лекарственная терапия. Это может улучшить эффекты нацеленной на GPC3 лекарственной терапии и улучшить QOL пациента, подлежащего лечению. В результате достигают лучшего лечения злокачественного новообразования.
[Краткое описание чертежей]
[0017]
[ФИГ. 1A] ФИГ. 1A представляет собой чертеж, показывающий изображения гистохимического окрашивания тканей, оцениваемых, как имеющие высокую экспрессию по балльной оценке окрашивания GPC3-IHC (метод окрашивания 1). Число, показанное в верхней части каждого изображения окрашивания, представляет номер пациента.
[ФИГ. 1B] ФИГ. 1B представляет собой чертеж, показывающий изображения гистохимического окрашивания тканей, оцениваемых, как являющиеся негативными или имеющие низкую экспрессию по балльной оценке окрашивания GPC3-IHC (метод окрашивания 1). Число, показанное в верхней части каждого изображения окрашивания, представляет номер пациента.
[ФИГ. 2] ФИГ. 2 представляет собой диаграмму, показывающую продолжительность введения GC33 в 20 случаях. Каждый цикл включает в себя четыре дозы GC33 (вводимых один раз в неделю).
[ФИГ. 3] ФИГ. 3 представляет собой диаграмму, показывающую различие по продолжительности выживаемости без прогрессирования заболевания среди группы пациентов, из которых выделяли образцы, разделенные на две группы (с общей балльной оценкой, равной 7 или выше, и с общей балльной оценкой ниже 7), в соответствии с методом окрашивания, основанным на демаскировке антигена с использованием автоклавирования. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы с общей балльной оценкой, равной 7 или выше (9 случаев). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания группы с общей балльной оценкой ниже 7 (7 случаев). Отношение рисков группы с общей балльной оценкой, равной 7 или выше, к группе с общей балльной оценкой ниже 7 составляло 0,376 (95% доверительный интервал: 0,116-1,227, p=0,0852).
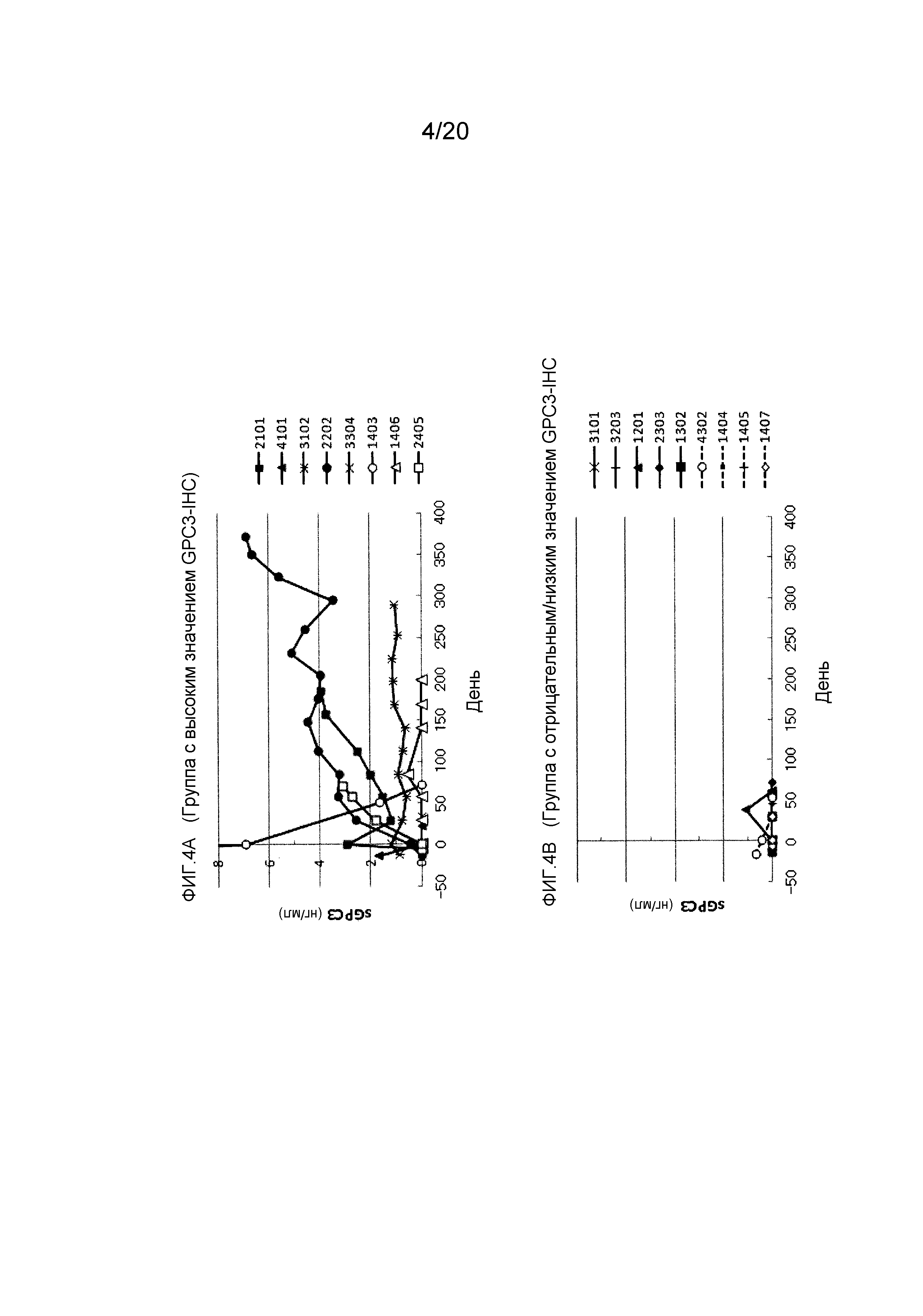
[ФИГ. 4A] ФИГ. 4A представляет собой диаграмму, показывающую корреляцию между концентрацией свободного GPC3, обнаруженного в сыворотке, и балльной оценкой GPC3-IHC опухолевых тканей, в группе, оцениваемой, как имеющую высокую экспрессию GPC3. Ордината показывает сывороточную концентрацию (нг/мл) свободного GPC3. Абсцисса показывает число прошедших дней (день) после начала нацеленной на GPC3 лекарственной терапии.
[ФИГ. 4B] ФИГ. 4B представляет собой диаграмму, показывающую корреляцию между концентрацией свободного GPC3, обнаруженного в сыворотке, и балльной оценкой GPC3-IHC опухолевых тканей, в группе, оцениваемой, как имеющую низкую экспрессию GPC3 или являющейся отрицательной. Ордината показывает сывороточную концентрацию (нг/мл) свободного GPC3. Абсцисса показывает число прошедших дней (день) после начала нацеленной на GPC3 лекарственной терапии.
[ФИГ. 5A] ФИГ. 5A представляет собой диаграмму, показывающую корреляцию между концентрацией свободного GPC3 в сыворотке, выделенной из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов. Ордината показывает коэффициент выживаемости. Абсцисса показывает продолжительность выживаемости без прогрессирования заболевания (день) после начала нацеленной на GPC3 лекарственной терапии. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей измеряемый уровень свободного GPC3 (6 случаев). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей уровень GPC3 ниже предела измерения (0,4 нг/мл) (14 случаев).
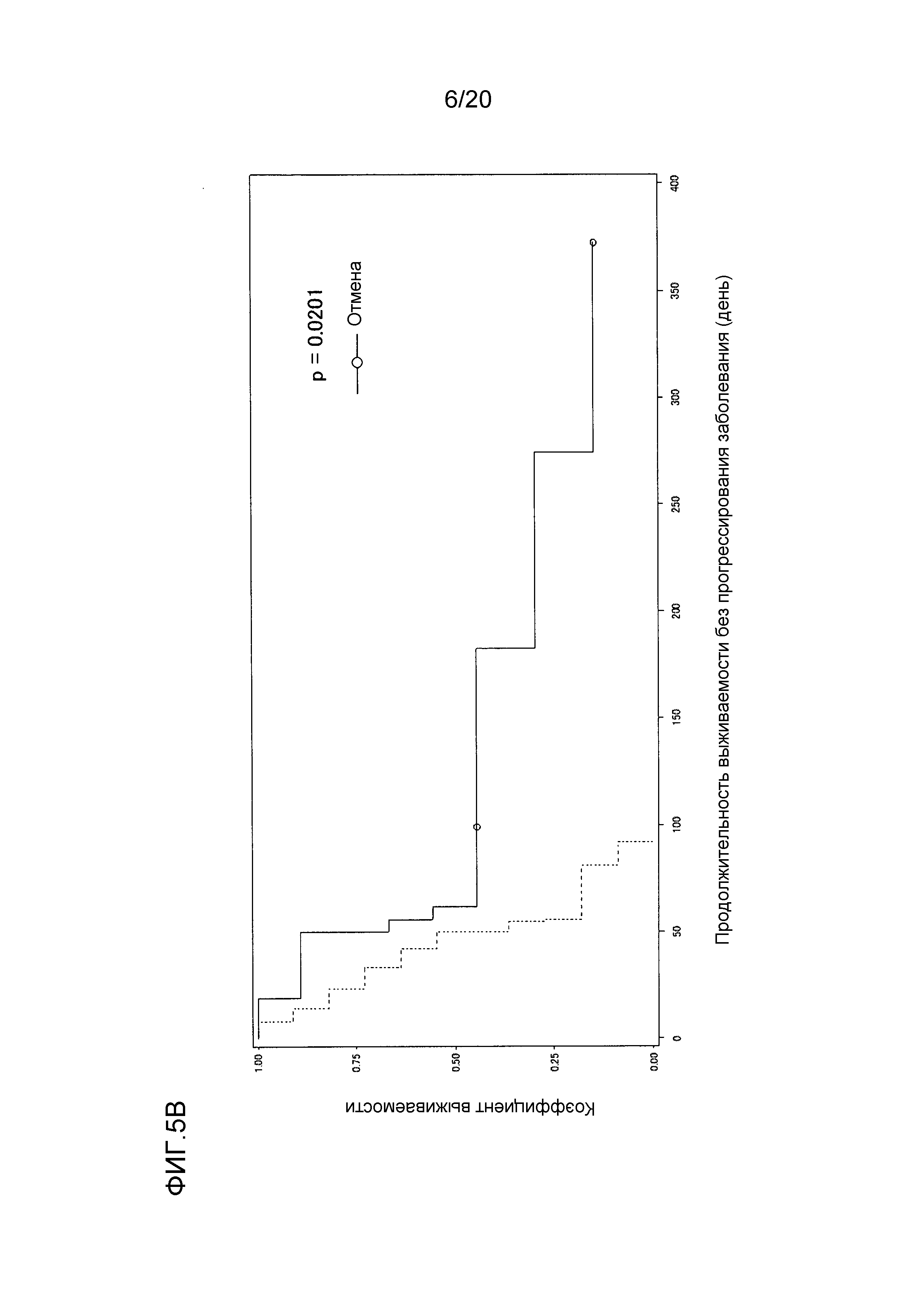
[ФИГ. 5B] ФИГ. 5B представляет собой диаграмму, показывающую корреляцию между концентрацией свободного GPC3 в сыворотке, выделенной из сыворотки, собранной от пациентов во время периода тестирования (включающего до и после начала нацеленной на GPC3 лекарственной терапии), и продолжительностью выживаемости без прогрессирования заболевания пациентов. Ордината показывает коэффициент выживаемости. Абсцисса показывает продолжительность выживаемости без прогрессирования заболевания (день) после начала нацеленной на GPC3 лекарственной терапии. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей измеряемый уровень свободного GPC3 (9 случаев) в сыворотке, выделенной из сыворотки, собранной от пациентов до или во время нацеленной на GPC3 лекарственной терапии. Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей уровень GPC3 ниже предела измерения (0,4 нг/мл) (как до, так и после начала нацеленной на GPC3 лекарственной терапии) (11 случаев), в сыворотке, выделенной из сыворотки, собранной от пациентов, проходящих лечение терапией.
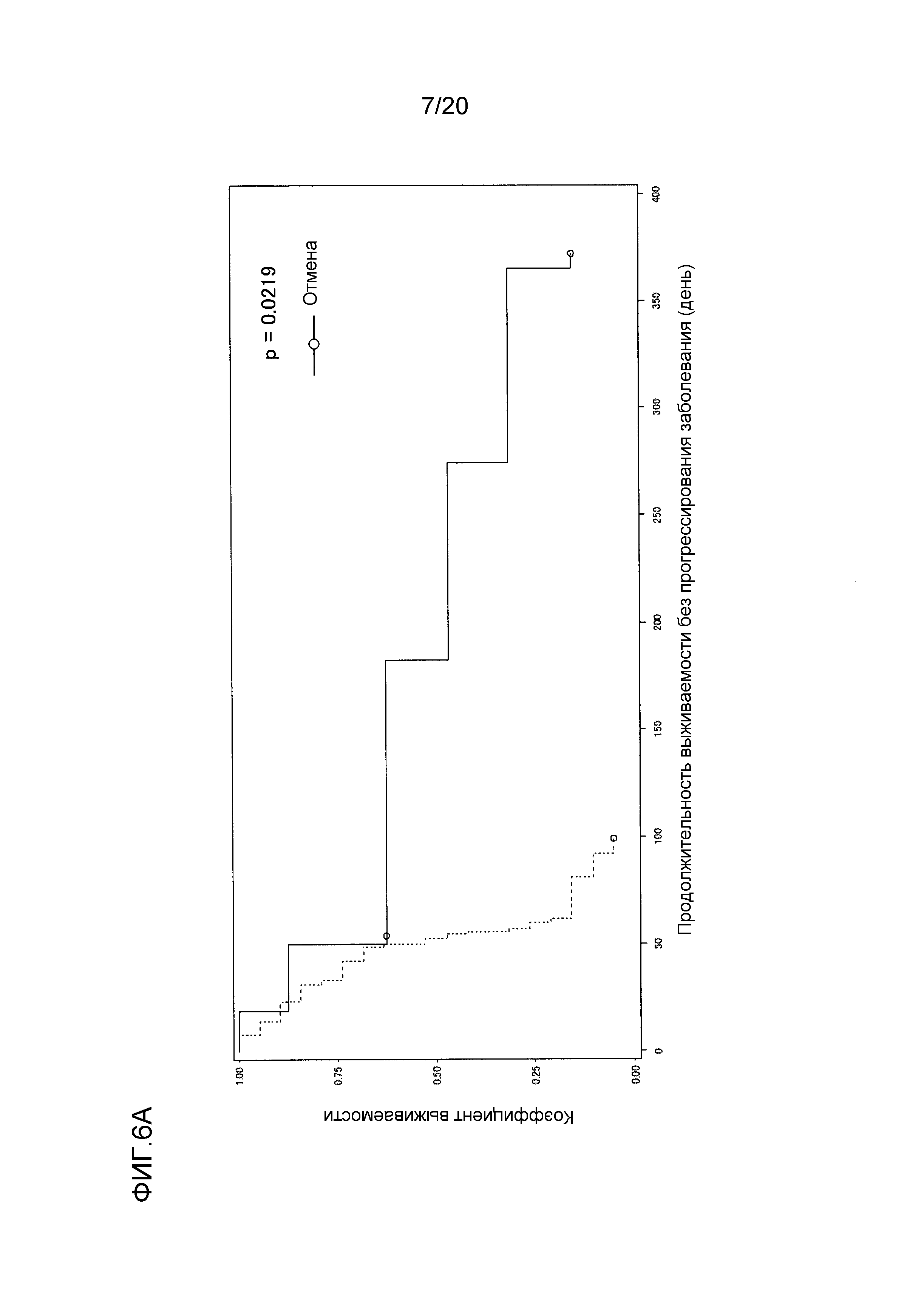
[ФИГ. 6A] ФИГ. 6A представляет собой диаграмму, показывающую корреляцию между концентрацией свободного GPC3 в сыворотке, выделенной из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов. Ордината показывает коэффициент выживаемости. Абсцисса показывает продолжительность выживаемости без прогрессирования заболевания (день) после начала нацеленной на GPC3 лекарственной терапии. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей измеряемый уровень свободного GPC3 (8 случаев). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей уровень GPC3 ниже предела измерения (0,4 нг/мл) (19 случаев). Отношение рисков группы с обнаруживаемым уровнем GPC3 к группе с уровнем GPC3 ниже предела обнаружения, составляло 0,265 (95% доверительный интервал: 0,077-0,914, p=0,0219).
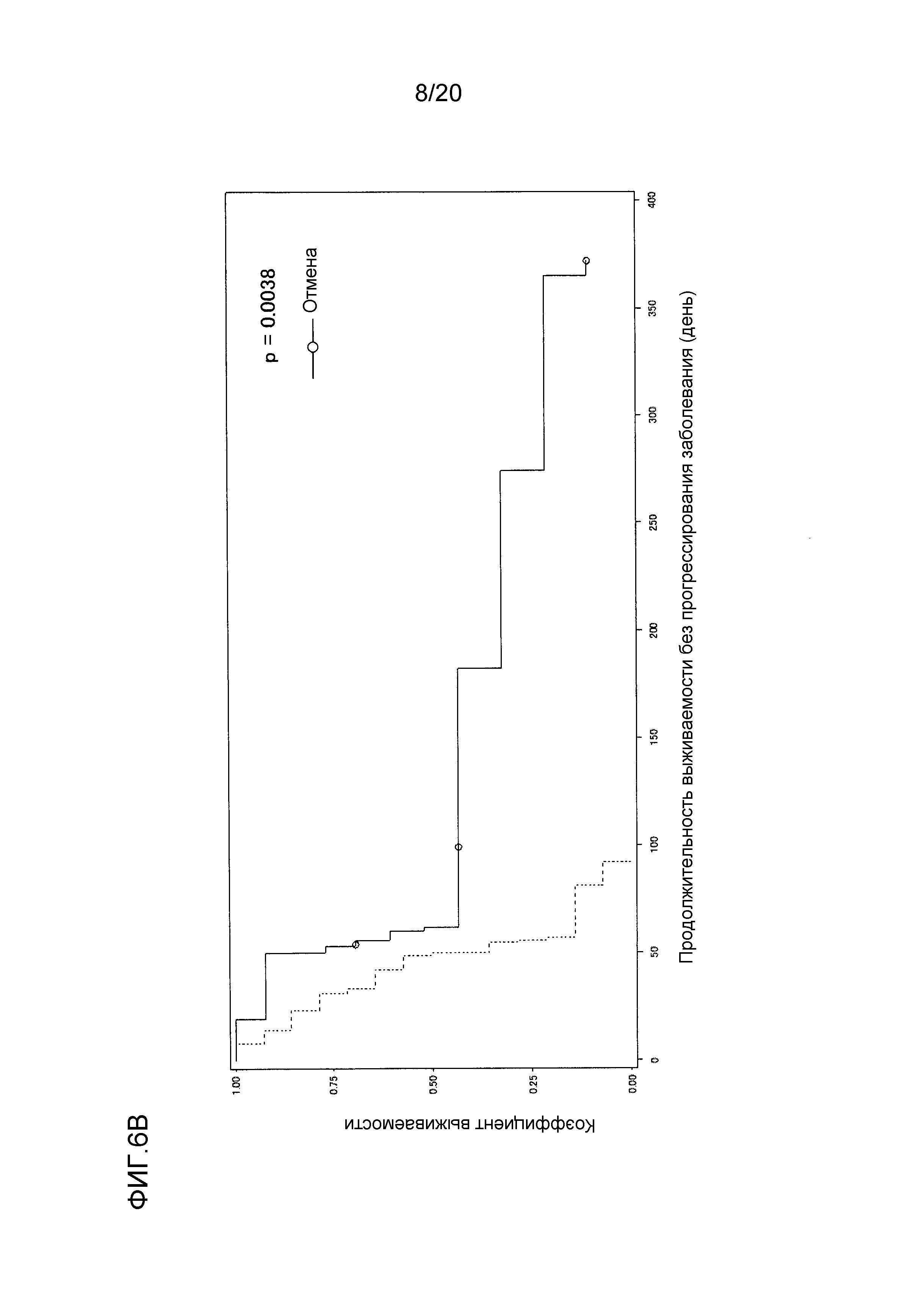
[ФИГ. 6B] ФИГ. 6B представляет собой диаграмму, показывающую корреляцию между концентрацией свободного GPC3 в сыворотке, выделенной из сыворотки, собранной от пациентов во время периода тестирования (включающего до и после начала нацеленной на GPC3 лекарственной терапии), и продолжительностью выживаемости без прогрессирования заболевания пациентов. Ордината показывает коэффициент выживаемости. Абсцисса показывает продолжительность выживаемости без прогрессирования заболевания (день) после начала нацеленной на GPC3 лекарственной терапии. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей измеряемый уровень свободного GPC3 (13 случаев), в сыворотке, выделенной из сыворотки, собранной от пациентов до или во время нацеленной на GPC3 лекарственной терапии. Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, имеющей уровень GPC3 ниже предела измерения (0,4 нг/мл) (как до, так и после начала нацеленной на GPC3 лекарственной терапии) (14 случаев), в сыворотке, выделенной из сыворотки, собранной от пациентов, проходящих лечение терапией. Отношение рисков группы с обнаруживаемым уровнем GPC3 к группе с уровнем GPC3 ниже предела обнаружения составляло 0,283 (95% доверительный интервал: 0,112-0,715, p=0,0038).
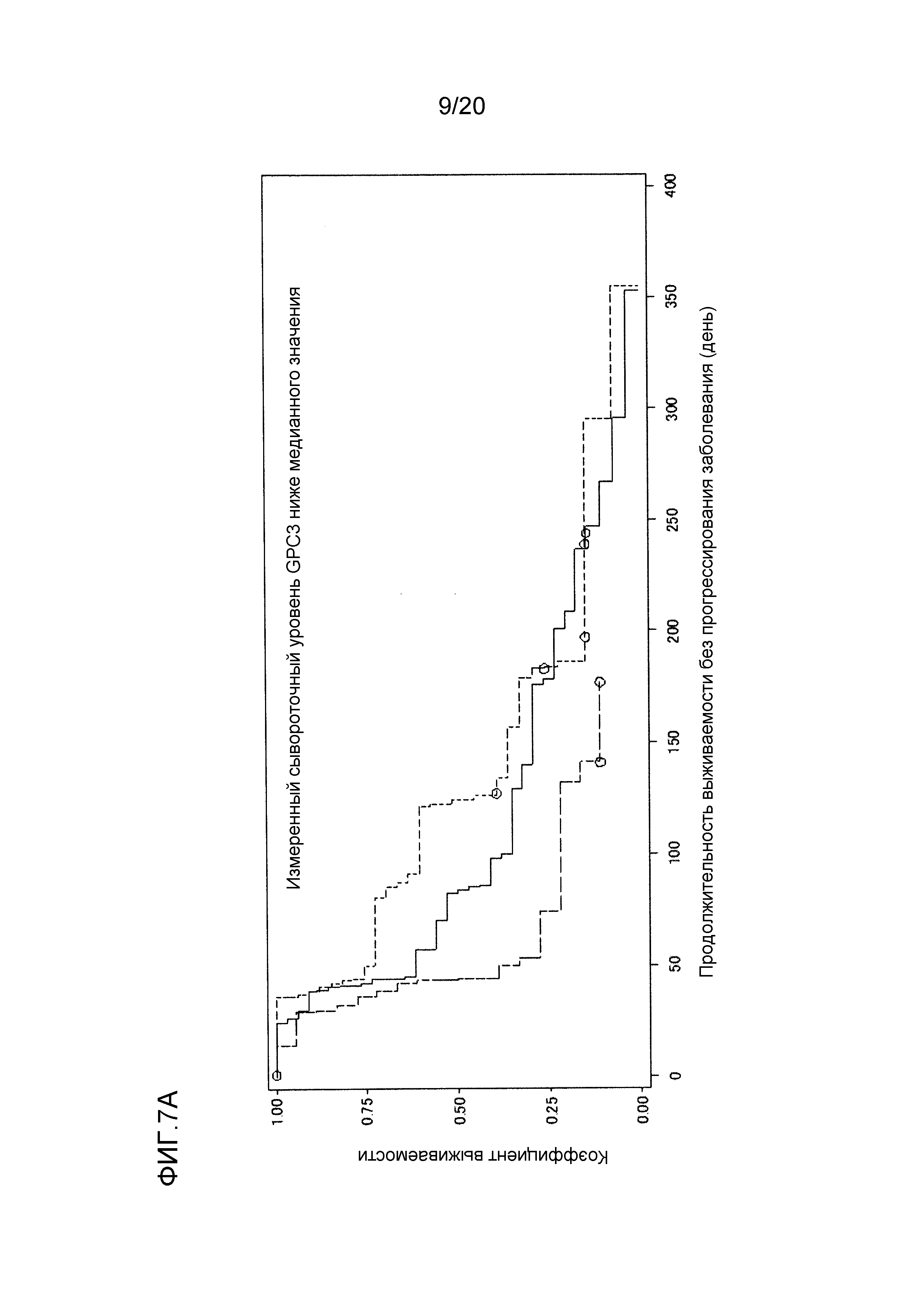
[ФИГ. 7A] ФИГ. 7A представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов в группе с сывороточной концентрацией свободного GPC3 более низкой, чем медианное значение (1129,7 пг/мл). Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы плацебо (34 случая). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания группы с предполагаемым минимальным уровнем GC33 ниже, чем медианное значение (группа, подвергнутая воздействию низкой концентрации GC33: 19 случаев). Пунктирная точечная линия представляет продолжительность выживаемости без прогрессирования заболевания группы с предполагаемым минимальным уровнем GC33, равным или выше чем медианное значение (группа, подвергнутая воздействию высокой концентрации GC33: 34 случая). Медианное значение продолжительности выживаемости без прогрессирования заболевания составляло 83 дня для группы плацебо, 43,5 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 124 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,803 (p=0,397), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,425 (p=0,010).
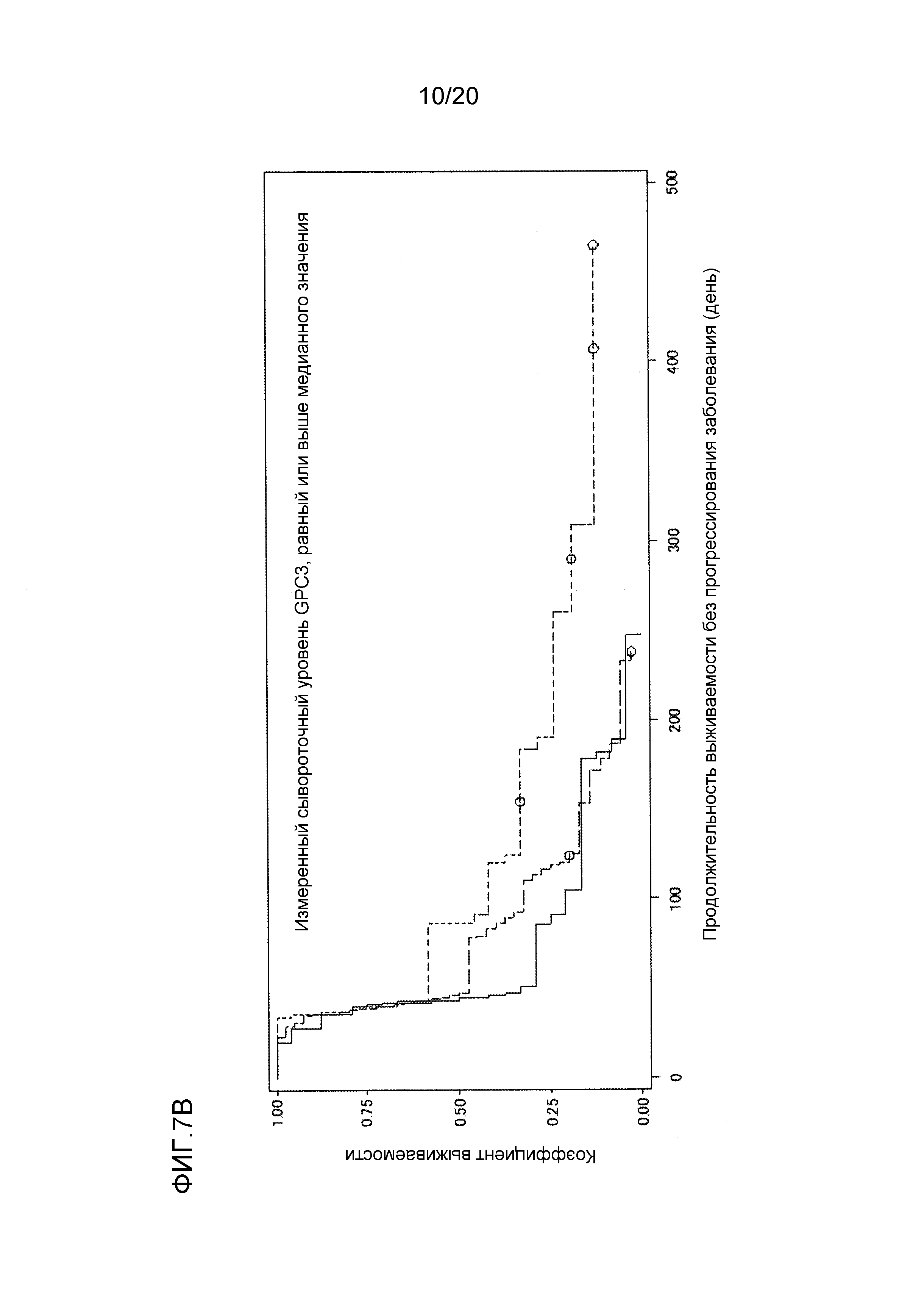
[ФИГ. 7B] ФИГ. 7B представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов в группе с сывороточной концентрацией свободного GPC3, равной или выше, чем медианное значение (1129,7 пг/мл). Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы плацебо (24 случая). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию низкой концентрации GC33 (40 случаев). Пунктирная точечная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию высокой концентрации GC33 (24 случая). Медианное значение продолжительности выживаемости без прогрессирования заболевания составляло 44 дня для группы плацебо, 46,5 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 87 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,510 (p=0,036), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33 к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,572 (p=0,056).
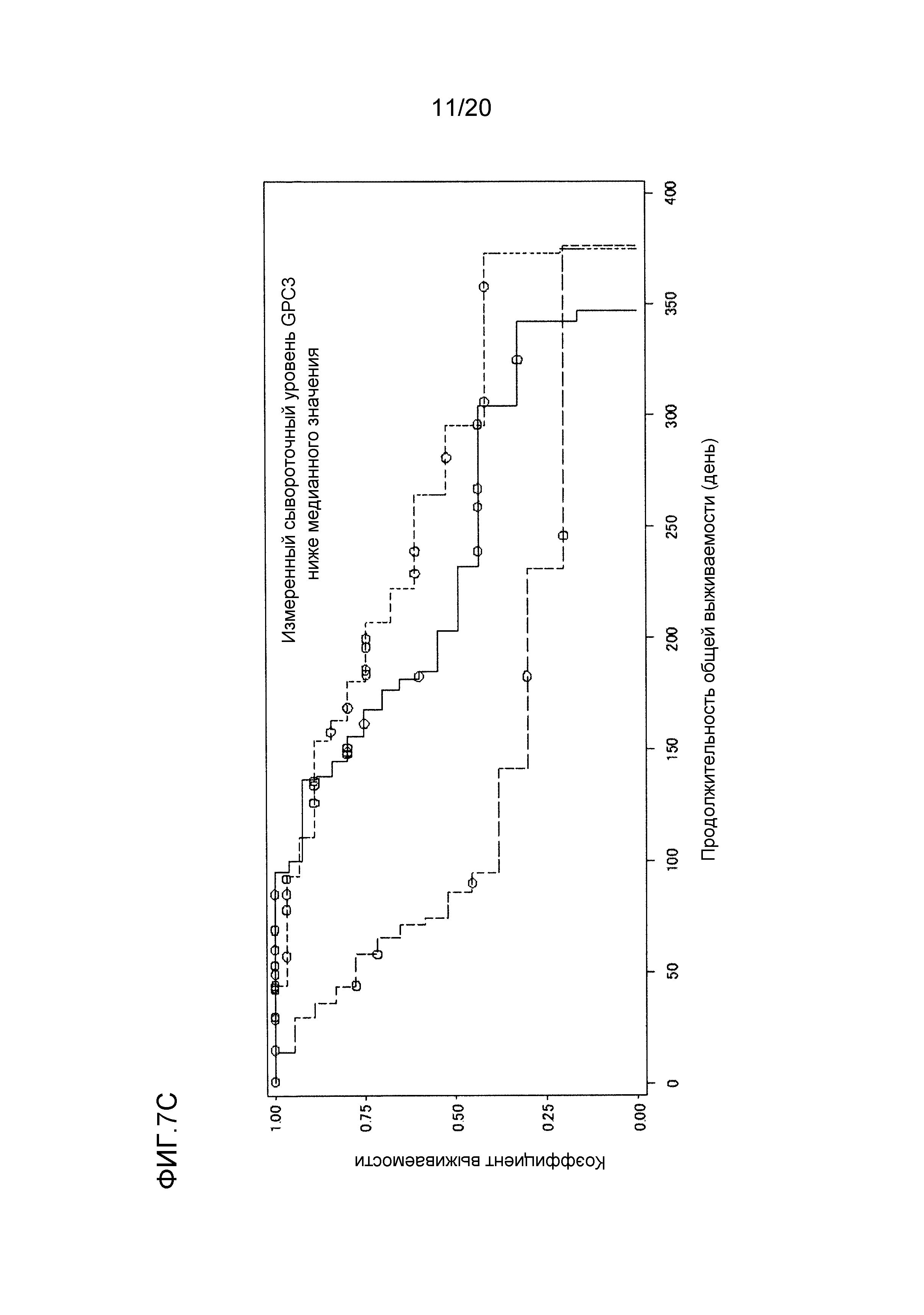
[ФИГ. 7C] ФИГ. 7C представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью общей выживаемости пациентов в группе с сывороточной концентрацией свободного GPC3 более низкой, чем медианное значение (1129,7 пг/мл). Сплошная линия представляет продолжительность общей выживаемости группы плацебо (34 случая). Пунктирная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию низкой концентрации GC33 (19 случаев). Пунктирная точечная линия представляет продолжительность общей выживаемости группы, подвергнутой воздействию высокой концентрации GC33 (34 случая). Медианное значение продолжительности общей выживаемости составляло 203 дня для группы плацебо, 86 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 295 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,590 (p=0,200), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,329 (p=0,008).
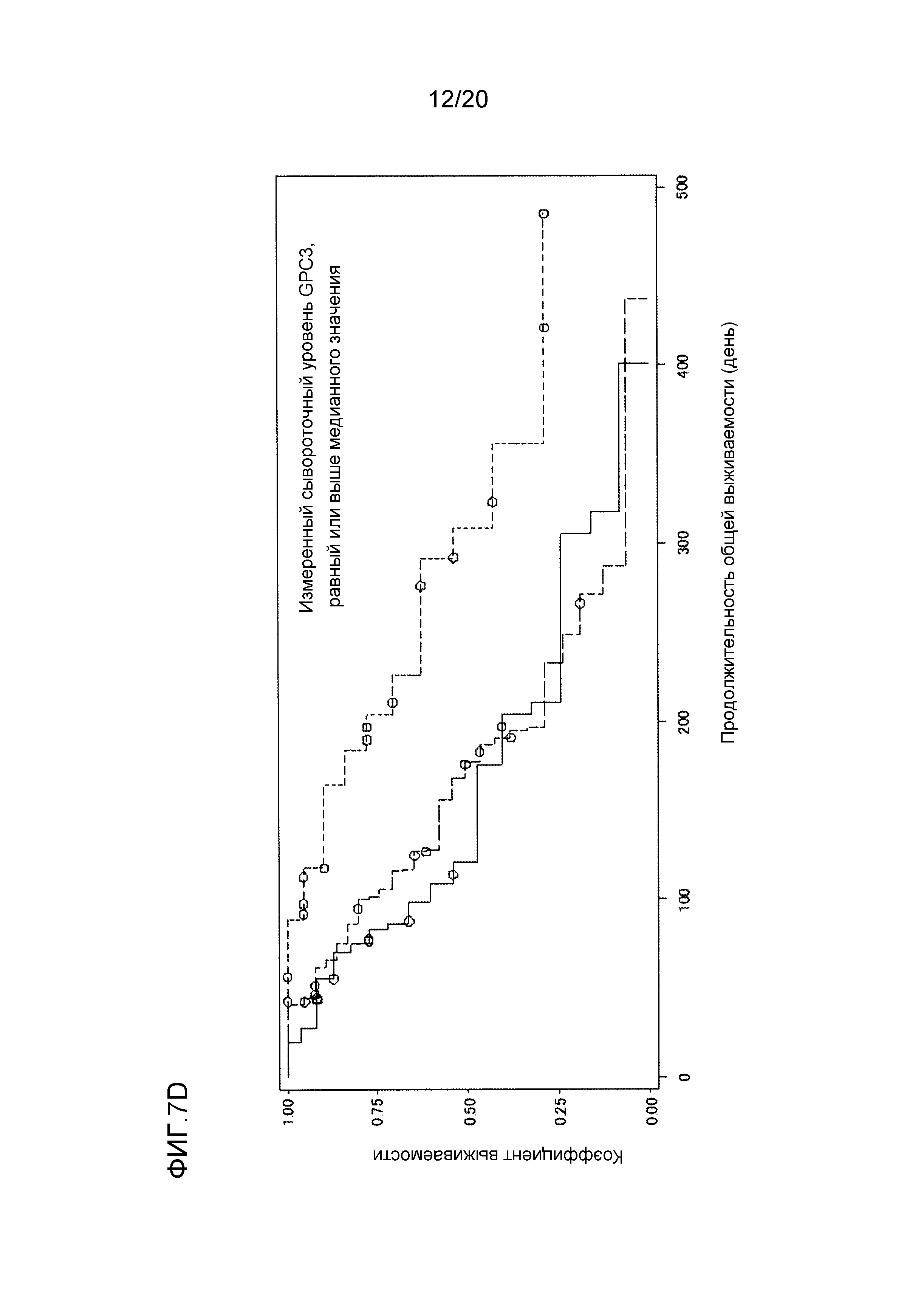
[ФИГ. 7D] ФИГ. 7D представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью общей выживаемости пациентов в группе с сывороточной концентрацией свободного GPC3, равной или выше чем медианное значение (1129,7 пг/мл). Сплошная линия представляет продолжительность общей выживаемости для группы плацебо (24 случая). Пунктирная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию низкой концентрации GC33 (40 случаев). Пунктирная точечная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию высокой концентрации GC33 (24 случая). Медианное значение продолжительности общей выживаемости составляло 121 день для группы плацебо, 177 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 308 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,303 (p=0,005), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,280 (p=0,002).
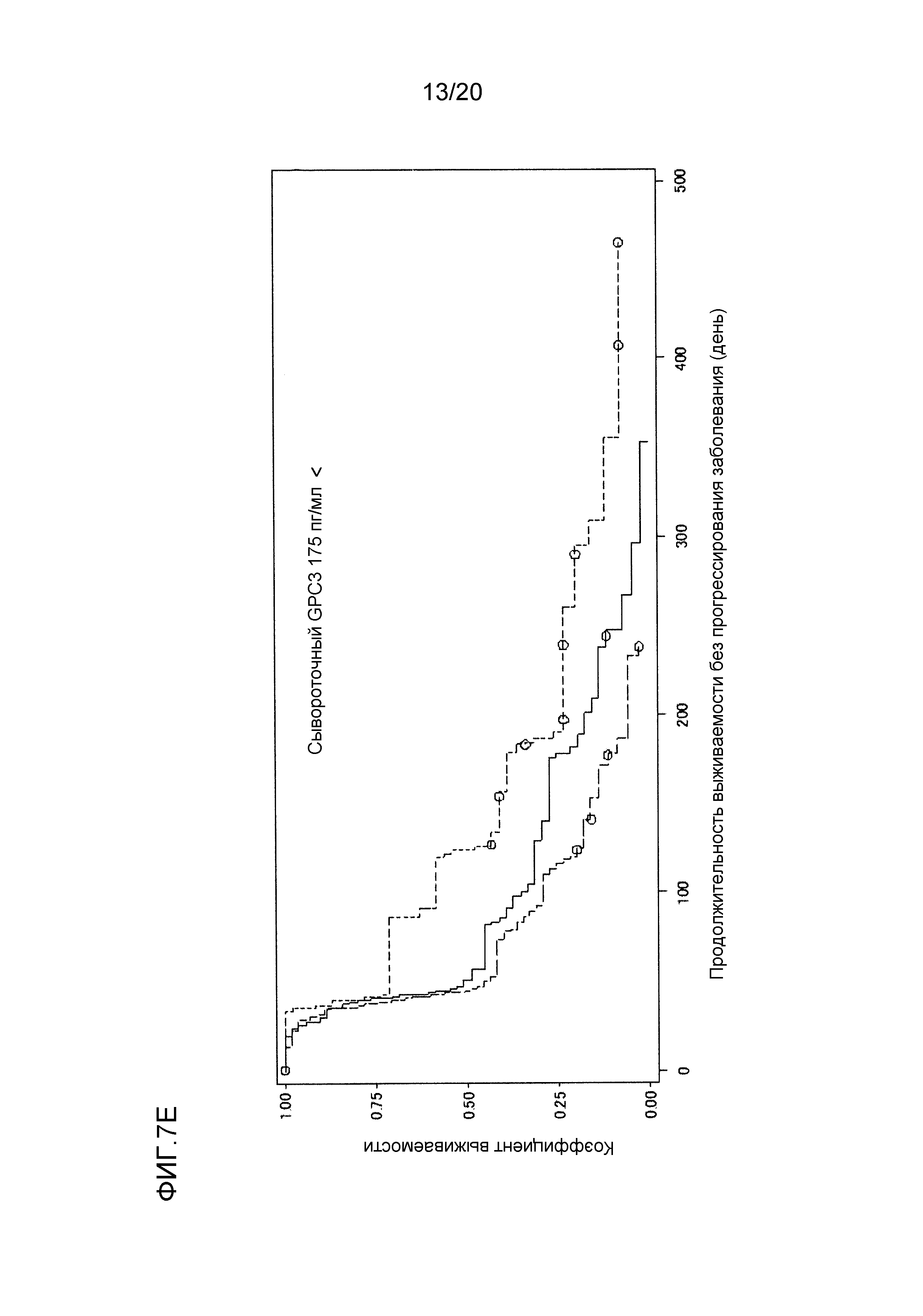
[ФИГ. 7E] ФИГ. 7E представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов в группе с сывороточной концентрацией свободного GPC3, более высокой, чем 175 пг/мл. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы плацебо (51 случай). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию низкой концентрации GC33 (56 случаев). Пунктирная точечная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию высокой концентрации GC33 (47 случаев). Медианное значение продолжительности выживаемости без прогрессирования заболевания составляло 51 день для группы плацебо, 45 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 124 дня для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,597 (p=0,0184), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,439 (p=0,0003).
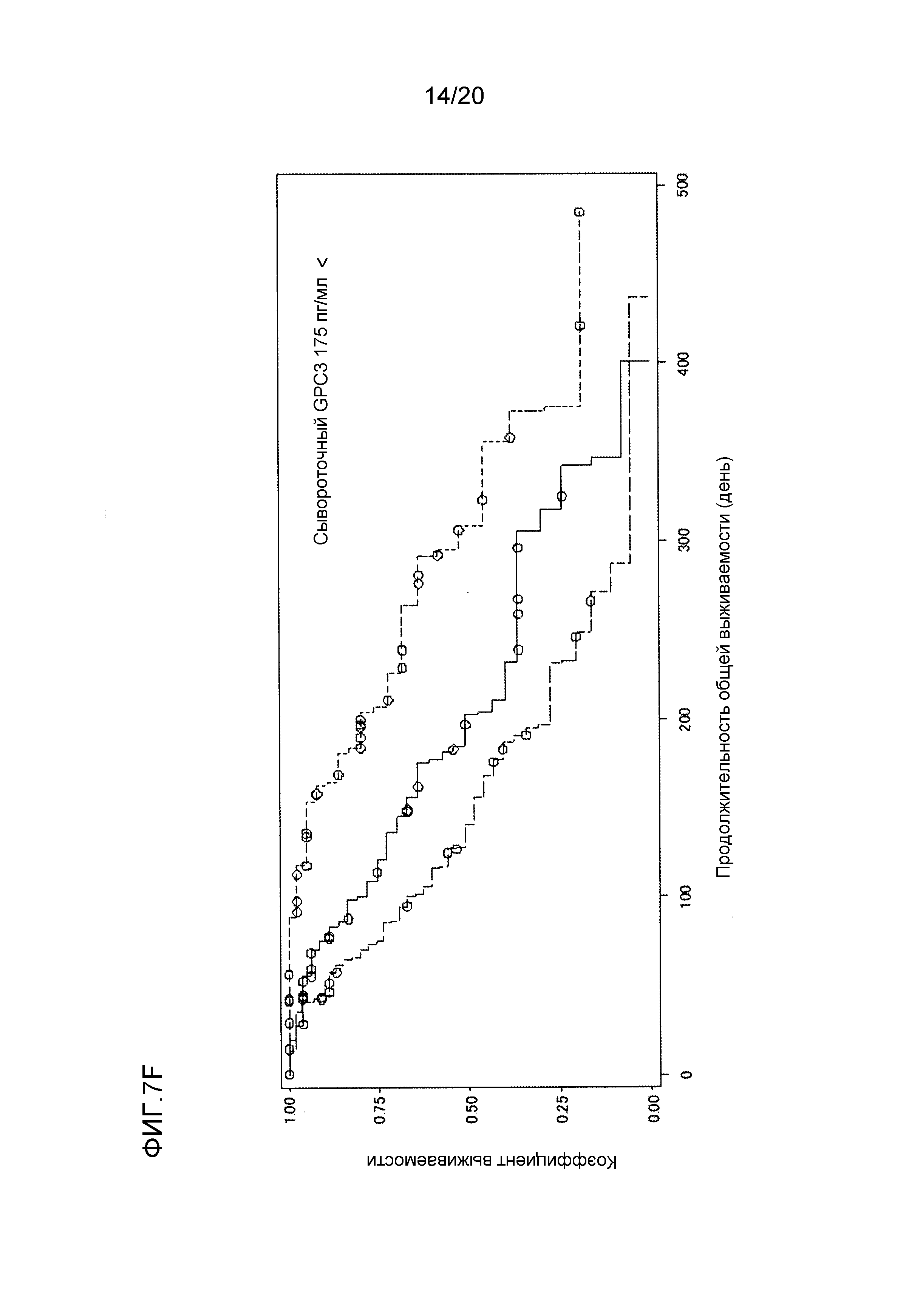
[ФИГ. 7F] ФИГ. 7F представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью общей выживаемости пациентов в группе с сывороточной концентрацией свободного GPC3, более высокой, чем 175 пг/мл. Сплошная линия представляет продолжительность общей выживаемости группы плацебо (51 случай). Пунктирная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию низкой концентрации GC33 (56 случаев). Пунктирная точечная линия представляет продолжительность общей выживаемости группы, подвергнутой воздействию высокой концентрации GC33 (47 случаев). Медианное значение продолжительности общей выживаемости составляло 203 дня для группы плацебо, 141 день для группы, подвергнутой воздействию низкой концентрации GC33, и 308 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,402 (p=0,0037), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,238 (p=<0,0001).
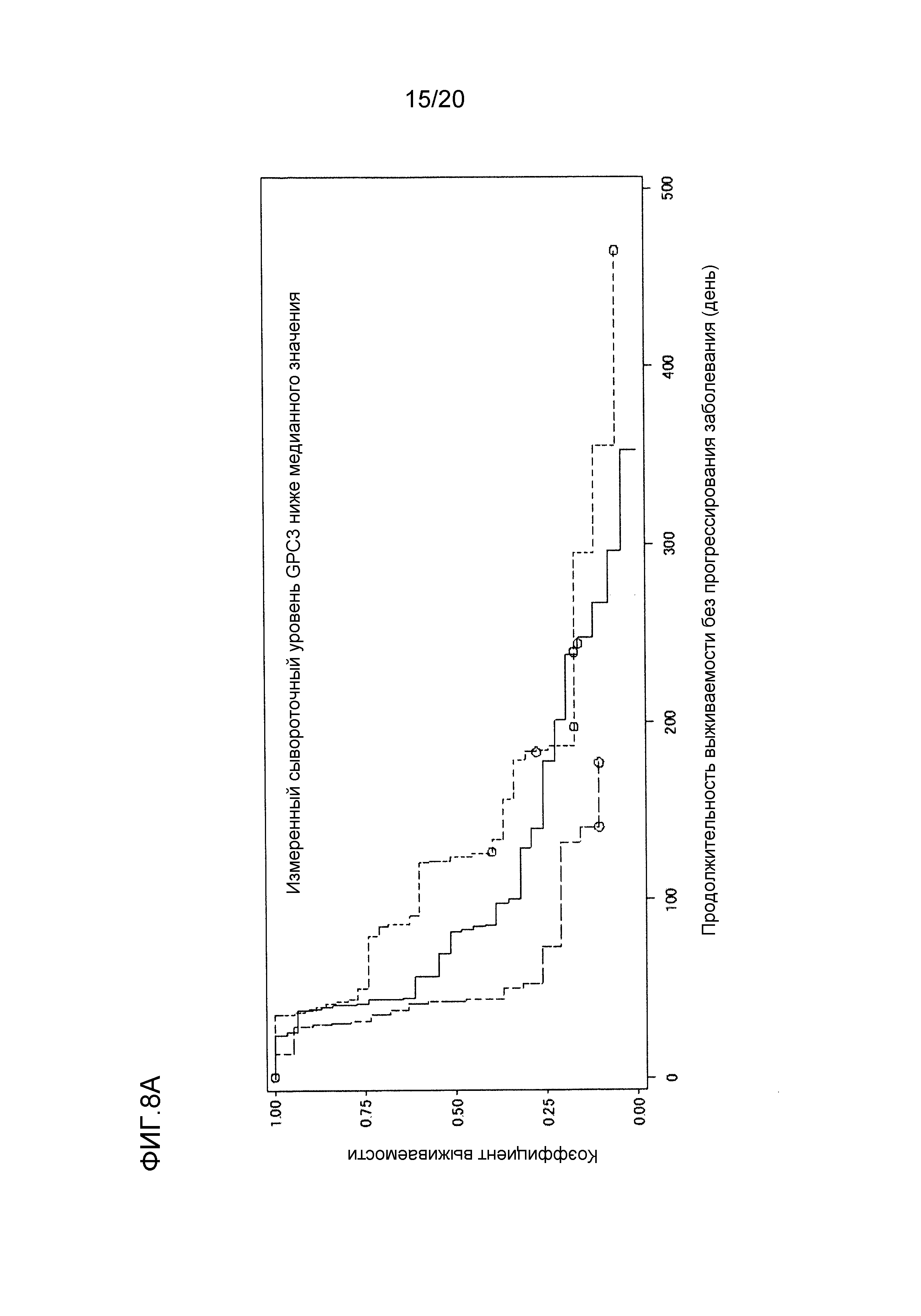
[ФИГ. 8A] ФИГ. 8A представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов в группе с сывороточной концентрацией свободного GPC3, более низкой, чем медианное значение (1161,5 пг/мл). Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы плацебо (31 случай). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию низкой концентрации GC33 (20 случаев). Пунктирная точечная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию высокой концентрации GC33 (36 случаев). Медианное значение продолжительности выживаемости без прогрессирования заболевания составляло 82 дня для группы плацебо, 43 дня для группы, подвергнутой воздействию низкой концентрации GC33, и 124 дня для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,713 (p=0,197), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,392 (p=0,004).
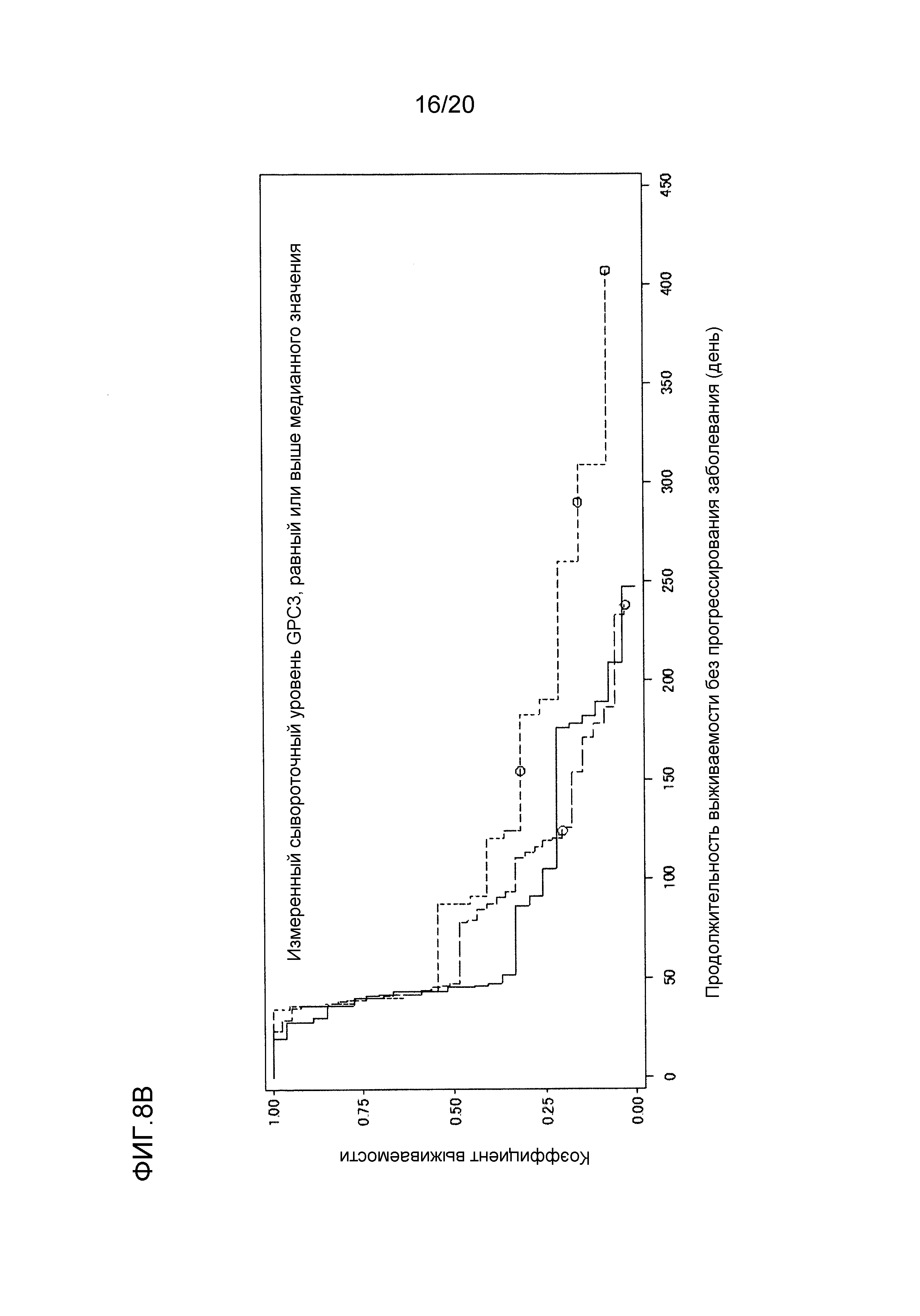
[ФИГ. 8B] ФИГ. 8B представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов в группе с сывороточной концентрацией свободного GPC3, равной или выше, чем медианное значение (1161,5 пг/мл). Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы плацебо (27 случаев). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию низкой концентрации GC33 (39 случаев). Пунктирная точечная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию высокой концентрации GC33 (22 случая). Медианное значение продолжительности выживаемости без прогрессирования заболевания составляло 45 дней для группы плацебо, 47 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 87 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,588 (p=0,092), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,626 (p=0,116).
[ФИГ. 8C] ФИГ. 8C представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью общей выживаемости пациентов в группе с сывороточной концентрацией свободного GPC3, более низкой, чем медианное значение (1161,5 пг/мл). Сплошная линия представляет продолжительность общей выживаемости группы плацебо (31 случай). Пунктирная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию низкой концентрации GC33 (20 случаев). Пунктирная точечная линия представляет продолжительность общей выживаемости группы, подвергнутой воздействию высокой концентрации GC33 (36 случаев). Медианное значение продолжительности общей выживаемости составляло 203 дня для группы плацебо, 86 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 295 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,508 (p=0,100), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,287 (p=0,002).
[ФИГ. 8D] ФИГ. 8D представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью общей выживаемости пациентов в группе с сывороточной концентрацией свободного GPC3, равной или выше, чем медианное значение (1161,5 пг/мл). Сплошная линия представляет продолжительность общей выживаемости группы плацебо (27 случаев). Пунктирная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию низкой концентрации GC33 (39 случаев). Пунктирная точечная линия представляет продолжительность общей выживаемости группы, подвергнутой воздействию высокой концентрации GC33 (22 случая). Медианное значение продолжительности общей выживаемости составляло 176 дней для группы плацебо, 177 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 291 день для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,300 (p=0,022), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,324 (p=0,005).
[ФИГ. 8E] ФИГ. 8E представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью выживаемости без прогрессирования заболевания пациентов в группе с сывороточной концентрацией свободного GPC3, более высокой, чем 259,7 пг/мл. Сплошная линия представляет продолжительность выживаемости без прогрессирования заболевания группы плацебо (50 случаев). Пунктирная линия представляет продолжительность выживаемости без прогрессирования заболевания для группы, подвергнутой воздействию низкой концентрации GC33 (55 случаев). Пунктирная точечная линия представляет продолжительность выживаемости без прогрессирования заболевания группы, подвергнутой воздействию высокой концентрации GC33 (47 случаев). Медианное значение продолжительности выживаемости без прогрессирования заболевания составляло 46,5 дней для группы плацебо, 45,5 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 124 дня для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,567 (p=0,010), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,467 (p=0,0009).
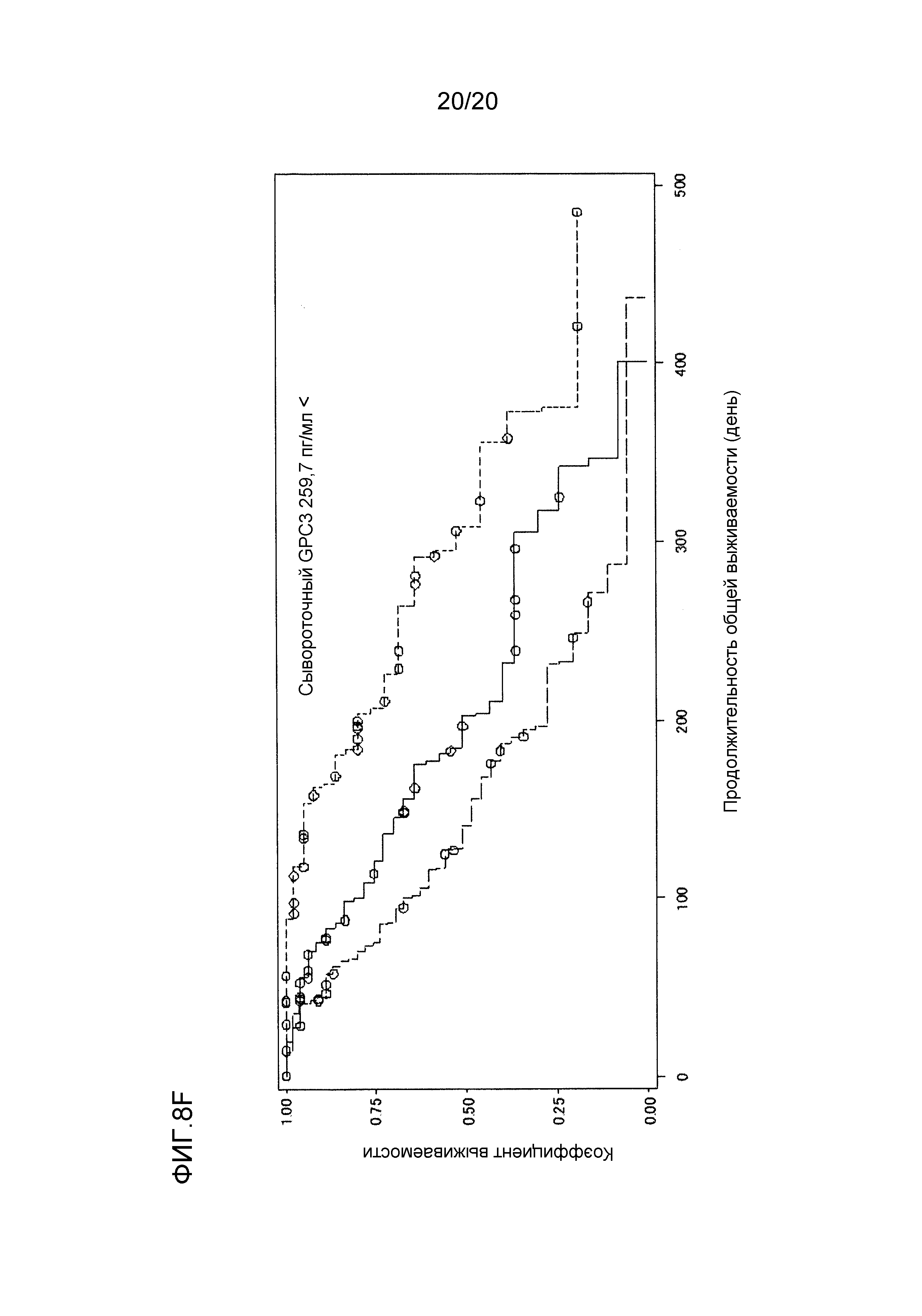
[ФИГ. 8F] ФИГ. 8F представляет собой диаграмму, показывающую корреляцию между сывороточной концентрацией свободного GPC3, выделенного из сыворотки, собранной от пациентов перед началом нацеленной на GPC3 лекарственной терапии, и продолжительностью общей выживаемости пациентов в группе с сывороточной концентрацией свободного GPC3, более высокой, чем 259,7 пг/мл. Сплошная линия представляет продолжительность общей выживаемости группы плацебо (50 случаев). Пунктирная линия представляет продолжительность общей выживаемости для группы, подвергнутой воздействию низкой концентрации GC33 (55 случаев). Пунктирная точечная линия представляет продолжительность общей выживаемости группы, подвергнутой воздействию высокой концентрации GC33 (47 случаев). Медианное значение продолжительности общей выживаемости составляло 185 дней для группы плацебо, 156 дней для группы, подвергнутой воздействию низкой концентрации GC33, и 308 дней для группы, подвергнутой воздействию высокой концентрации GC33. Отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе плацебо составляло 0,414 (p=0,0043), в то время как отношение рисков группы, подвергнутой воздействию высокой концентрации GC33, к группе, подвергнутой воздействию низкой концентрации GC33, составляло 0,304 (p=<0,0001).
[0018]
Настоящее описание охватывает содержание, описанное в описании патентной заявки Японии № 2012-280304, по которой установлен приоритет настоящей заявки.
[Описание вариантов осуществления]
[0019]
Определение
Химические термины и технические термины, используемые в отношении к настоящему изобретению, имеют значения, в целом, понятные квалифицированным специалистам в данной области, если иным образом не определено в настоящем описании.
[0020]
Неопределенный артикль
В настоящем изобретении, неопределенные артикли "a" и "an" относится к одному или двум или нескольким (т.е. по меньшей мере одному) объекту(объектам), грамматически представленными неопределенными артиклями. Например, "фактор" означает один фактор или два или несколько факторов.
[0021]
Аминокислота
Каждая аминокислота указана в настоящем описании посредством однобуквенного кода или трехбуквенного кода, или их обоих, как представлено посредством, например, Ala/A, Leu/L, Arg/R, Lys/K, Asn/N, Met/M, Asp/D, Phe/F, Cys/C, Pro/P, Gln/Q, Ser/S, Glu/E, Thr/T, Gly/G, Trp/W, His/H, Tyr/Y, Ile/I и Val/V.
[0022]
Модификация аминокислоты
Аминокислота в аминокислотной последовательности антигенсвязывающей молекулы может быть модифицирована посредством соответственно принятого метода, известного в данной области, такого как сайт-направленный мутагенез (Kunkel et al., Proc. Natl. Acad. Sci. USA (1985) 82, 488-492) или ПЦР с перекрывающимися праймерами. Также, множество методов, известных в данной области, могут быть приняты в качестве методов для модификации аминокислоты, чтобы заменить аминокислоту аминокислотой, отличной от природной аминокислоты (Annu. Rev. Biophys. Biomol. Struct. (2006) 35, 225-249; и Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (11), 6353-6357). Например, тРНК-содержащая бесклеточная система трансляции (Clover Direct (Protein Express, компания, специализированная по научным исследованиям и разработкам)), содержащая неприродную аминокислоту, связанную с амбер-супрессорной тРНК, комплементарной с кодоном UAG (амбер-кодоном), который представляет собой стоп-кодон, также предпочтительно применяется.
[0023]
Термин "и/или", используемый в настоящем описании для представления участков модификации аминокислот, подразумевает включение каждой комбинации, соответственно представленной посредством "и" и "или". Конкретно, например, фраза "аминокислоты 43, 52 и/или 105 являются замещенными" включает следующие вариации модификации аминокислот:
(a) положение 43, (b) положение 52, (c) положение 105, (d) положения 43 и 52, (e) положения 43 и 105, (f) положения 52 и 105 и (g) положения 43, 52 и 105.
[0024]
Нумерация ЕU и нумерация Кабат
В соответствии с методом, используемым в настоящем изобретении, положения аминокислот, отнесенные к CDR и FR антитела, определяют по методу Кабат (Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, Md., 1987 and 1991). Когда антигенсвязывающая молекула, описанная в настоящем описании, представляет собой антитело или антигенсвязывающий фрагмент, аминокислоты в вариабельных и константных областях указаны в соответствии с нумерацией Кабат и нумерацией ЕU, соответствующей положениям аминокислот по Кабат, соответственно.
[0025]
Биологический образец
В настоящем изобретении термин "биологический образец" относится к образцу ткани или текучей среды, выделенному из субъекта. В неограничивающем аспекте, примеры таких образцов включают плазму, сыворотку, спинномозговую жидкость, лимфу, внешние срезы кожи, дыхательные пути, кишечник, и урогенитальный тракт, слезы, слюну, мокроту, молоко, цельную кровь или любую фракцию крови, производные крови, кровяные клетки, опухоль, нервные ткани, органы или любой тип ткани, любой образец, полученный посредством смыва (например, образцы, полученные из бронхов), и образцы компонентов, сотавляющих клеточные культуры in vitro.
[0026]
Концентрация свободного GPC3 может быть измерена в биологическом образце, выделенном из пациента. Концентрация свободного GPC3 может быть измерена в, например, образце цельной крови или образце фракции крови (например, сыворотки или плазмы) (также называемом как образец цельной крови, образец сыворотки или образец плазмы, соответственно, в настоящем описании). В неограничивающем аспекте, концентрация свободного GPC3 в образце цельной крови, образце сыворотки или образце плазмы из пациента может быть измерена с использованием, например, доступного для приобретения набора ELISA для человеческого Глипикана-3 (BioMosaics Inc.) или набора для фермент-связанного иммуносорбентного аналитического теста для Глипикана 3 (GPC3) (USCN Life Science Inc.) и образца цельной крови, образца сыворотки или образца плазмы, обработанных ЭДТА.
[0027]
Термин "изолированный" относится к вызыванию "искусственного" изменения от природного состояния, т.е. перемещению и/или удаление природного вещества из его исходного окружения. В настоящем изобретении, термин "изолированный" означает, что, например, полинуклеотид или полипептид, присутствующий в организме, является неизолированным, в то время как тот же самый полинуклеотид или полипептид становится изолированным, когда его отделяют от материала, присутствующего с полинуклеотидом или полипептидом в природном состоянии. Полинуклеотид или полипептид, вводимый в организм посредством трансформации, генетической манипуляции или любого другого метода рекомбинации, находится в изолированном состоянии, даже когда присутствует в организме (независимо от того, является ли он живым или мертвым).
[0028]
Свободный GPC3
В настоящем изобретении термин "свободный GPC3" относится к GPC3, не зафиксированному на GPC3-экспрессирующих клетках, и включает фрагменты секреторного GPC3, которые могут легко диссоциировать из GPC3, зафиксированного на GPC3-экспрессирующих клетках в конкретных условиях in vivo или in vitro. В неограничивающем аспекте, примеры "свободного GPC3" могут включать полипептид от аминоконца до положения 358 в GPC3, состоящего из полипептида, определяемого SEQ ID NO: 1, полипептид от аминоконца до положения 374 в GPC3, состоящего из полипептида, определяемого SEQ ID NO: 1, GPC3 полипептид, высвобождаемый при деградации GPI-фиксатора, присутствующего на карбоксиконце, и их фрагментов (патентная литература 7). Специалисты в данной области могут соответственно выбрать подход, известный в данной области, для определения структуры свободного GPC3. В неограничивающем аспекте, такой метод, который может применяться соответствующим образом, включает в себя, например, непосредственное обнаружение свободного GPC3, присутствующего в сыворотке или плазме пациента, или модельном животном по методу, описанному в патентной литературе 7, и анализ его структуры, или включает в себя, например, обеспечение возможности ферменту, диссоциирующему свободный GPC3, такому как конвертаза, фосфолипаза D или Нотум, воздействовать на GPC3, экспрессируемый в клетках, культивируемых in vitro, обнаружение полученного в результате свободного GPC3, и анализ его структуры (например, J. Cell. Biol. (2003) 163 (3), 625-635).
[0029]
Метод измерения концентрации свободного GPC3
Концентрация свободного GPC3 может быть измерена посредством одного или нескольких методов, выбранных из группы, состоящей из следующих: спектроскопические методы, такие как ядерный магнитный резонанс (ЯМР) и масс-спектрометрия (МС); и SELDI(-TOF), MALDI(-TOF), 1D анализ на геле, 2D анализ на геле, жидкостная хроматография (например, высокоэффективная жидкостная хроматография (ВЭЖХ) или жидкостная хроматография низкого давления (НДЖХ)), тонкослойная хроматография, и методы на основе ЖХ-МС. Примеры соответствующих методов ЖХМС могут включать ICAT(R) (Applied Biosystems, Inc.) и iTRAQ(R) (Applied Biosystems, Inc.). Также, соответственно, может быть принят метод, который включает в себя обнаружение дополнительного фрагмента свободного GPC3, дополнительно обрабатываемый соответствующим ферментом.
[0030]
Аналитический тест свободного GPC3 может выполняться посредством прямого или косвенного метода обнаружения. Свободный GPC3 может быть обнаружен непосредственно или косвенно через взаимодействие лиганда или группы лиганда с, например, ферментом, связью, рецептором или транспортным белком, антителом, пептидом, аптамером или олигонуклеотидом, или условным синтетическим химическим рецептором или соединением, способным к специфическому связыванию со свободным GPC3. Лиганд может быть модифицирован обнаруживаемой меткой, такой как люминесцентная метка, флуоресцентная метка или радиоактивная метка и/или аффинная метка.
[0031]
Иммунологический метод
Примеры предпочтительных методов для аналитического тестирования свободного GPC3 могут включать иммунологические методы с использованием антитела, способного к связыванию эпитопа, присутствующего в GPC3. Примеры иммунологических методов включают иммуноферментный анализ (ELISA или EIA), иммунофлуоресцентный анализ (FIA), радиоиммунологический анализ (RIA), иммунолюминесцентный анализ (LIA), иммуноферментный метод, метод флуоресцентных антител, иммунохроматография, иммунотурбидиметрия, латексная иммунотурбидиметрия и анализ латекс-агглютинации. В иммунологическом методе настоящего изобретения свободный GPC3 может быть проанализирован методиками в ручном режиме или с использованием устройства, такого как анализатор.
[0032]
Иммунологический метод настоящего изобретения может выполняться в соответствии с, например, методом, известным в данной области, таком как сэндвич-метод. Например, первичное антитело, иммобилизованное на носителе, биологический образец, и вторичное антитело, модифицированное веществом для мечения, взаимодействуют одновременно или по порядку. Эта реакция образует комплекс первичного антитела, иммобилизованного на носителе, свободного GPC3, и вторичного антитела, модифицированного веществом для мечения. Вещество для мечения, конъюгированное с вторичным антителом, содержащимся в данном комплексе, может быть количественно определено, чтобы, таким образом, измерить количество (концентрацию) свободного GPC3, содержащегося в биологическом образце.
[0033]
В случае, например, иммуноферментного анализа, предпочтительно используют микропланшет с иммобилизованным первичным антителом, серийно разбавленные биологические образцы, вторичное антитело, модифицированное ферментом, таким как HRP, промывочный буфер, и раствор, содержащий субстрат, реагирующий с ферментом, таким как HRP. В неограничивающем аспекте аналитического теста, модифицирующее фермент вторичное антитело взаимодействует при оптимальных для него условиях с субстратом. Количество полученного в результате продукта ферментативной реакции может быть измерено посредством оптического метода или т.п. В случае иммунофлуоресцентного анализа могут предпочтительно использоваться иммобилизованный на первичном антителе оптический волновод, серийно разбавленные биологические образцы, вторичное антитело, модифицированное флуоресцентным веществом, и промывочный буфер. В неограничивающем аспекте аналитического теста, флуоресцентное вещество, модифицирующее вторичное антитело, может быть облучено возбуждающим светом, чтобы, таким образом, эмитировать флуоресценцию, интенсивность которой затем измеряют.
[0034]
Радиоиммунологический анализ включает в себя измерение количества излучения от радиоактивного вещества. Иммунолюминесцентный анализ включает в себя измерение интенсивности люминесценции, полученной от люминесцентной системы реакции. Например, иммунотурбидиметрия, латексная иммунотурбидиметрия или метод латекс-агглютинации включают в себя измерение пропущенного света или рассеянного света посредством метода конечных точек или метода сравнительной оценки. Иммунохроматография, например, которая основана на визуальном наблюдении, включает в себя визуальное измерение цвета вещества для мечения, появляющегося на линии тестирования. Альтернативно, прибор, такой как анализатор, может соответственно применяться вместо этого визуального измерения.
[0035]
В иммунологическом методе настоящего изобретения первичное антитело для иммобилизации на носителе может быть адсорбировано или связано с носителем посредством метода, такого как физическая адсорбция, химическое связывание или их комбинация. Метод, известный в данной области, может соответственно применяться для иммобилизации антитела посредством физической адсорбции. Примеры метода включают метод, который включает в себя контактирование антитела с носителем посредством смешивания в растворе, таком как буферный раствор, и метод, который включает в себя контактирование антитела, растворенного в буфере или т.п., с носителем. Альтернативно, антитело может быть иммобилизовано на носителе посредством химического связывания. Примеры метода включают метод, который включает в себя контактирование антитела и носителя посредством смешивания с дивалентным сшивающим реагентом, таким как глутаральдегид, карбодиимид, сложный эфир имида или малеимид, для взаимодействия реагента с аминогруппами, карбоксильными группами, тиольными группами, альдегидными группами или гидроксигруппами как в антителе, так и носителе. Такая иммобилизация может требовать обработки для подавления неспецифической реакции или природной агрегации или т.п. носителя с иммобилизованным антителом. В таком случае последующая обработка иммобилизации может проводиться посредством метода, известного в данной области. Примеры метода включают метод, который включает в себя покрытие поверхности или внутренней стенки носителя с иммобилизованным антителом посредством контактирования с, например, белком (например, альбумином бычьей сыворотки (BSA), казеином, желатином, яичным альбумином или их солью), поверхностно-активным веществом или сепарированным молоком.
[0036]
В иммунологическом методе настоящего изобретения, вторичное антитело для модификации веществом для мечения может быть адсорбировано или связано с веществом для мечения посредством метода, такого как физическая адсорбция, химическое связывание или их комбинации. Метод, известный в данной области, может соответственно применяться для связывания антитела с веществом для мечения посредством физической адсорбции. Примеры метода включают метод, который включает в себя контактирование антитела с веществом для мечения посредством смешивания в растворе, таком как буферный раствор, и метод, который включает в себя контактирование антитела, растворенного в буфере или т.п., с веществом для мечения. Когда вещество для мечения представляет собой, например, колоидное золото или латекс, метод физической адсорбции является эффективным. Антитело может быть смешано и приведено в контакт с колоидным золотом в буфере, чтобы получить антитело, меченное колоидным золотом. Альтернативно, антитело может быть модифицировано веществом для мечения посредством химического связывания. Примеры метода включают метод, который включает в себя контактирование антитела и вещества для мечения посредством смешивания с дивалентным сшивающим реагентом, таким как глутаральдегид, карбодиимид, сложный эфир имида или малеимид для взаимодействия реагента с аминогруппами, карбоксильными группами, тиольными группами, альдегидными группами или гидроксигруппами как в антителе, так и в веществе для мечения. Когда веществом для мечения является, например, флуоресцентное вещество, фермент или хемилюминесцентное вещество, метод химического связывания является эффективным. Такая модификация может требовать обработки для подавления неспецифической реакции или природной агрегации или т.п. антитела, модифицированного веществом для мечения. В таком случае последующая обработка мечения может проводиться посредством метода, известного в данной области. Примеры метода включают метод, который включает в себя покрытие антитела, связанного с веществом для мечения посредством контактирования с, например, белком (например, альбумином бычьей сыворотки (BSA), казеином, желатином, яичным альбумином или их солью), поверхностно-активным веществом или сепарированным молоком.
[0037]
Например, пероксидаза (POD), щелочная фосфатаза (ALP), β-галактозидаза, уреаза, каталаза, глюкозооксидаза, лактатдегидрогеназа или амилаза могут применяться в качестве вещества для мечения для иммуноферментного анализа. Например, изотиоцианат флуоресцеина, изотиоцианат тетраметилродамина, изотиоцианат замещенного родамина, изотиоцианат дихлортриазина, цианин или мероцианин могут применяться для иммунофлуоресцентного анализа. Например, тритий, йод-125 или йод-131 могут применяться для радиоиммунологического анализа. Например, люминольная система, люциферазная система, система сложного эфира акридиния или система соединения диоксетана могут применяться для иммунолюминесцентного анализа. Альтернативно, мелкодисперсные частицы, изготовленные из материала, такого как полистирол, сополимер стирола-стиролсульфоната, сополимер акрилонитрила-бутадиена-стирола, сополимер винилхлорида-сложного эфира акриловой кислоты, сополимер винилацетата-акриловой кислоты, полиакролеин, сополимер стирола-метакриловой кислоты, сополимер стирола-глицидил(мет)акрилата, сополимер стирола-бутадиена, полимер метакриловой кислоты, полимер акриловой кислоты, латекс, желатин, липосома, микрокапсула, оксид кремния, оксид алюминия, углеродная сажа, соединение металла, металл, металлический коллоид, керамическое или магнитное вещество, могут применяться для иммунохроматографии, иммунотурбидиметрии, латексной иммунотурбидиметрии или метода латекс-агглютинации.
[0038]
Твердофазный носитель в форме, например, гранул(шариков), микропланшета, пробирки, палочки, мембраны или образцов для тестирования, изготовленных из материала, такого как полистирол, поликарбонат, поливинилтолуол, полипропилен, полиэтилен, поливинилхлорид, найлон, полиметакрилат, полиакриламид, латекс, липосома, желатин, агароза, целлюлоза, Сефароза, стекло, металл, керамика или магнитное вещество, может соответственно применяться в качестве носителя в иммунологическом методе настоящего изобретения.
[0039]
Настоящее изобретение также предоставляет набор реактивов для анализа, содержащий компоненты для применения в иммунологическом методе настоящего изобретения. Набор реактивов для анализа содержит по меньшей мере один тип антитела, способного к связыванию эпитопа, присутствующего в GPC3. Антитело может быть предоставлено в иммобилизованном состоянии на носителе, указанном выше, или может быть предоставлено независимо от носителя. Набор может дополнительно содержать стандартные растворы серийно разбавленного свободного GPC3. Набор реактивов для анализа может дополнительно содержать по меньшей мере один тип антитела, способного к связыванию эпитопа, отличающегося от эпитопа, присутствующего в GPC3. Принципы анализа и т.д., для применения в наборе реактивов для иммунологического анализа настоящего изобретения являются такими же, как в иммунологическом методе, указанном выше. В наборе реактивов для иммунологического анализа настоящего изобретения могут применяться различные водные растворители. Примеры водных растворителей включают очищенную воду, физраствор и различные буферы, такие как трис-буферы, фосфатные буферы и забуференный фосфатом физраствор. pH этого буфера может быть соответственно выбрано из подходящих pH. Используемое значение pH не ограничивается, и его обычно выбирают в пределах интервала pH от 3 до 12.
[0040]
Набор реактивов для иммунологического анализа настоящего изобретения может дополнительно соответственно содержать, в дополнение к компонентам, указанным выше, один или два или несколько компонентов, выбранных из белков (например, альбумин бычьей сыворотки (BSA), человеческий сывороточный альбумин (HSA), казеин и их соли), различные соли, различные сахара, сепарированное молоко, различные животные сыворотки (например, нормальную кроличью сыворотку), различные антисептики (например, азид натрия и антибиотики), активирующие вещества, вещества, инициирующие реакцию, вещества, увеличивающие чувствительность (например, полиэтиленгликоль), вещества, ингибирующие неспецифическую реакцию, и различные поверхностно-активные вещества, такие как неионные поверхностно-активные вещества, амфотерные поверхностно-активные вещества и анионные поверхностно-активные вещества. Концентрации этих компонентов, содержащихся в реагенте для анализа, не являются ограниченными и составляют предпочтительно от 0,001 до 10% (масс./об.). Конкретно предпочтительные концентрации соответственно выбирают в пределах интервала от 0,01 до 5% (масс./об.).
[0041]
Набор реактивов для иммунологического анализа настоящего изобретения может дополнительно комбинироваться с другими реагентами, в дополнение к компонентам, указанным выше. Примеры этих других реагентов включают буферы, растворы для разбавления биологических образцов, растворы для разбавления реагента, реагенты, содержащие вещества для мечения, реагенты, содержащие вещества, которые генерируют сигналы, такие как цвет, реагенты, содержащие вещества, вовлеченные в генерацию сигналов, таких как цвет, реагенты, содержащие вещества для калибровки, и реагенты, содержащие вещества для контроля точности.
[0042]
Набор реактивов для иммунологического анализа настоящего изобретения может иметь любую форму без ограничений, и может быть предоставлен как диагностический набор интегрального типа, содержащий все компоненты, составляющие набор реактивов для иммунологического анализа настоящего изобретения, чтобы выполнить анализ удобным образом в короткое время. Примеры диагностического набора интегрального типа включают наборы ELISA, наборы для иммунофлуоресцентного анализа и наборы для иммунохроматографии. Форма набора ELISA содержит, например, микропланшет с иммобилизованным первичным антителом, стандартные растворы серийно разбавленного свободного GPC3, вторичное антитело, модифицированное ферментом, таким как HRP, промывочный буфер, и раствор субстрата для ферментативной реакции. Набор для иммунофлуоресцентного анализа содержит, например, оптический волновод с иммобилизованным первичным антителом, стандартные растворы серийно разбавленного свободного GPC3, вторичное антитело, модифицированное флуоресцентным материалом, и промывочный буфер. Набор для иммунохроматографии содержит мембрану, помещаемую в кассету для реакции. В одном примерном аспекте, первичное антитело иммобилизуют по одному концу (вниз по потоку) мембраны; проявляющий раствор помещают по другому концу (вверх по потоку) мембраны; подложку, дополненную субстратом средства мечения, располагают поблизости (вниз по потоку) для проявления раствора; и подложку, дополненную вторичным антителом, меченым, как описано выше, располагают в центральной части мембраны.
[0043]
В настоящем изобретении предпочтительные примеры биологических образцов, используемых для обнаружения уровня экспрессии GPC3 в тканях, включают тестируемые полученные от субъекта препараты. Тестируемый полученный от субъекта препарат является предпочтительно тканью, полученной от тестируемого субъекта, более предпочтительно тканью рака печени или гепатоцеллюлярного рака тестируемого субъекта. Ткань рака печени или ткань гепатоцеллюлярного рака собирают предпочтительно с использованием метода биопсии, известного в данной области. Биопсия печени относится к методу прямого введения тонкой длинной иглы в печень от поверхности кожи и сбора тканей печени. Участок для прокалывания иглой обычно представляет собой межреберное пространство правой нижней части грудной клетки. Безопасность участка для прокалывания иглой подтверждают перед операцией с использованием устройства для ультразвукового исследования. Затем участок для прокалывания иглой дезинфицируют. Область от кожи до поверхности печени подвергают анестезии. После небольшого надреза кожи на участке для прокалывания иглой, иглу для пункции вводят в него.
[0044]
Для микроскопического наблюдения пропущенных пучков, получают срезы препарата ткани до той степени, которая позволяет лучам света для применения в микроскопе в достаточной степени проникать через срез ткани. На стадии, предшествующей получению срезов, препарат ткани фиксируют. В частности, белки или клетки в тканях коагулируют посредством дегидратации или денатурации, чтобы, таким образом, быстро уничтожить клетки, составляющие ткани. Полученная в результате структура стабилизируется и инсолюбилизируется. Сначала препарат ткани, подлежащий фиксации, нарезают на фрагмент с размером и формой, подходящими для препарата залитых парафином срезов, посредством применения ножа, такого как хирургический нож. Впоследствии фрагмент погружают в фиксатор, который является реагентом, используемым для выполнения фиксации. Формалин, более предпочтительно нейтральный забуференный формалин, предпочтительно применяют в качестве фиксатора. Концентрацию нейтрального забуференного формалина соответственно выбирают в соответствии с характеристиками или физическими свойствами препарата ткани. Используемая концентрация может соответственно изменяться между 1 и 50%, предпочтительно 5 и 25%, более предпочтительно 10 и 15%. Фиксатор с препаратом ткани, погруженным в него, соответственно дегазируют с использованием вакуумного насоса. Для фиксации препарат ткани оставляют в течение нескольких часов в фиксаторе в условиях обычного давления и комнатной температуры. Время, выбранное для фиксации, может быть соответственно выбрано в пределах интервала от 1 часа до 7 дней, предпочтительно от 2 часов до 3 дней, более предпочтительно от 3 часов до 24 часов, дополнительно предпочтительно от 4 часов до 16 часов. Препарат ткани, таким образом, фиксируемый, соответственно погружают в раствор фосфатного буфера или т.п. в течение дополнительных нескольких часов (которые могут быть соответственно выбраны в пределах интервала от 2 часов до 48 часов, предпочтительно от 3 часов до 24 часов, более предпочтительно от 4 часов до 16 часов).
[0045]
Далее, срезы могут быть предпочтительно получены посредством нарезания с замораживанием или нарезания в парафине из препарата ткани, таким образом, зафиксированного. Предпочтительные примеры нарезания с замораживанием включают метод, который включает в себя добавление тканей в Соединение O.C.T. (Miles Inc.), замораживание смеси, и нарезания замороженной смеси с использованием криостата (устройства для получения замороженных срезов препарата). При нарезании с парафином, фиксированный препарат ткани погружают в заливочное средство, которое затем отверждают, чтобы, таким образом, придать ему однородную и соответствующую твердость. Парафин может предпочтительно применяться в качестве заливочного средства. Фиксированный препарат ткани дегидратируют с использованием этанола. В частности, препарат ткани погружают в 70% этанол, 80% этанол и 100% этанол в таком порядке и посредством этого дегидратируют. Время, требуемое для погружения, и число циклов могут быть соответственно выбраны в пределах интервалов от 1 часа до нескольких дней и от 1 до 3 раз, соответственно. Препарат ткани может быть погружен туда при комнатной температуре или 4°C. В случае погружения при 4°C, более длительное время погружения (например, в течение ночи) является более предпочтительным. После замены жидкой фазы на ксилол, препарат ткани заливают в парафин. Время, требуемое для замены жидкой фазы на ксилол, может быть соответственно выбрано в пределах интервала от 1 часа до нескольких часов. Эта замена может выполняться при комнатной температуре или 4°C. В случае замены при 4°C, более длительное время замены (например, в течение ночи), является более предпочтительным. Время, требуемое для заливки в парафин, и число циклов могут быть соответственно выбраны в пределах интервалов от 1 часа до нескольких часов и от 1 до 4 раз, соответственно. Эта заливка может выполняться при комнатной температуре или 4°C. В случае заливки при 4°C, более длительное время заливки (например, в течение ночи), является более предпочтительным. Альтернативно, препарат ткани может быть предпочтительно залит в парафин с использованием устройства для заливки в парафин (EG1160, Leica, и т.д.), которое автоматически выполняет реакцию заливки в парафин.
[0046]
Препарат ткани, таким образом, залитый в парафин, связывают с блокирующей основой, чтобы получить "блок". Этот блок нарезают с желательной толщиной, выбранной из толщин от 1 до 20 мкм используя микротом. Тонко нарезанный тканевый срез оставляют отстаиваться на стеклянном слайде в качестве проницаемой подложки и, таким образом, фиксируют на нем. В этом случае стеклянный слайд, покрытый 0,01% поли-L-лизином (Sigma-Aldrich Corp.) и затем высушенный, может предпочтительно использоваться, чтобы препятствовать рассыпанию тканевого среза. Фиксированный тканевый срез сушат на воздухе в течение подходящего времени, выбранного из интервала между несколькими минутами и 1 часом.
[0047]
Демаскировка эпитопа
В предпочтительном аспекте, эпитоп в антигене, реактивность которого с антителом была ослаблена вследствие фиксации в формалине, демаскируют. В настоящем изобретении индуцированная протеазой демаскировка эпитопа (PIER) или индуцированная нагревом демаскировка эпитопа (HIER) могут применяться для демаскировки. В неограничивающем аспекте, PIER может применяться к одному из "двух идентифицируемых препаратов ткани", полученных, как показано ниже, в то время как HIER может применяться к другому препарату. В этом случае различие по степени окрашивания между этими препаратами, взаимодействующими с антителами, может быть оцифровано.
[0048]
В неограничивающем аспекте, получают набор из двух препаратов ткани, которые получают, как показано в параграфе "Биологический образец", и прикрепляют на проницаемые подложки. Препараты ткани желательно представляют собой два гистологически идентифицируемых препарата ткани. Термин "идентифицируемый" означает, что два препарата ткани, подлежащие взаимному сравнению, составлены из по существу одинаковых клеток или тканей в тестируемых, полученных от субъекта препаратах, служащих в качестве исходных препаратов ткани. Например, два препарата ткани, полученные как соседние срезы, соответствуют двум идентифицируемым препаратам ткани. В настоящем изобретении также "два идентифицируемых препарата ткани" относятся к двум препаратам ткани, полученным в качестве соседних срезов, если не установлено иначе. В дополнение, два препарата ткани, составленные из клеток или тканей, структурно идентифицируемых между препаратами, соответствуют "двум идентифицируемым препаратам ткани", даже, если препараты ткани не получают в виде соседних срезов. Предпочтительные примеры таких двух препаратов ткани, составленные из клеток или тканей, структурно идентифицируемых между ними, включают (1) тканевые срезы, содержащие клетки, полученные из одинаковых клеток в одинаковых положениях в плоскостных координатах в срезах, и (2) тканевые срезы, в которых по меньшей мере 50% или более, предпочтительно 60% или более, более предпочтительно 70% или более, дополнительно предпочтительно 80% или более, еще дополнительно предпочтительно 90% или более, конкретно предпочтительно 95% или более клеток присутствуют в одинаковых положениях в плоскостных координатах.
[0049]
При индуцируемой нагревом демаскировке эпитопа соответственно используют, например, метод нагрева с использованием микроволн, метод нагрева с использованием автоклава или метод нагрева с использованием обработки кипячением. В случае обработки кипячением при выходной мощности 780 Вт, так, чтобы поддерживать температуру жидкости при приблизительно 98°C, время, требуемое для демаскировки, включая обработку, соответственно выбирают из интервала между 5 минутами и 60 минутами, и составляет, например, 10 минут. Обработка для демаскировки эпитопа может проводиться в 10 мМ буферном растворе цитрата натрия, а также, например, доступном для приобретения Растворе для Целевой Демаскировки (DakoCytomation). Раствор для Целевой Демаскировки применяют в Примерах, описанных ниже. Предпочтительно используют любой буферный раствор или водный раствор, поскольку эпитоп в антигене, который распознается антителом против GPC3, приобретает способность связываться с антителом в результате обработки для демаскировки, таким образом, что может быть обнаружен комплекс антиген-антитело, указанный позже.
[0050]
Протеаза для применения при индуцированной протеазой демаскировке эпитопа не ограничивается его типом или происхождением. Общедоступная протеаза может быть соответственно выбрана для применения. Предпочтительные используемые примеры протеазы включают пепсин с 0,05% концентрацией в 0,01н хлористоводородной кислоте, трипсин с 0,1% концентрацией, дополнительно содержащий CaCl2 с 0,01% концентрацией в растворе трис-буфера (pH 7,6), и протеазу K с концентрацией от 1 до 50 мкг/мл в 10 мМ буферном растворе трис-HCl (pH 7,8), содержащем 10 мМ EDTA и 0,5% SDS. В случае использования протеазы K, pH реакционного раствора соответственно выбирают из интервала между 6,5 и 9,5, и SH реагент, ингибитор трипсина или ингибитор химотрипсина может соответственно применяться. Конкретные примеры такой предпочтительной протеазы также включают протеазу, прикрепленную к набору Histofine HER2 (MONO) (Nichirei Biosciences Inc.). Индуцированную протеазой демаскировку эпитопа обычно проводят при 37°C. Температура реакции может соответственно изменяться в пределах интервала от 25°C до 50°C. Время реакции индуцированной протеазой демаскировки эпитопа, проводимой при 37°C, соответственно выбирают из интервала между, например, 1 минутой и 5 часами и составляет, например, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 3 часа или 4 часа. После завершения обработки для демаскировки, препарат ткани, обработанный, таким образом, промывают раствором промывочного буфера. Забуференный фосфатом физраствор (PBS) предпочтительно используют в качестве промывочного буферного раствора. Альтернативно, может предпочтительно использоваться буферный раствор трис-HCl. Условия промывки, принятые в этом методе, обычно включают три цикла промывки при комнатной температуре в течение 5 минут. Время и температура промывки могут соответственно изменяться.
[0051]
Реакция между препаратом ткани и антителом против GPC3
Препарат ткани, таким образом, обработанный посредством индуцированной нагревом демаскировки эпитопа и/или препарат ткани, таким образом, обработанный посредством индуцированной протеазой демаскировки эпитопа, взаимодействуют с антителом против GPC3, указанным позже, в качестве первичного антитела. Реакцию выполняют при условиях, соответствующих распознаванию эпитопа в антигене антителом против GPC3 и последующему образованию комплекса антиген-антитело. Реакцию обычно проводят в течение ночи при 4°C или при 37°C в течение 1 часа. Условия реакции могут быть соответственно изменены в пределах интервала, подходящего для распознавания эпитопа в антигене антителом и последующего образования комплекса антиген-антитело. Например, температура реакции может изменяться в пределах интервала от 4°C до 50°C, в то время как время реакции может изменяться между 1 минутой и 7 днями. Более длительное время реакции является более предпочтительным для реакции, проводимой при низкой температуре. После завершения реакции первичного антитела, каждый препарат ткани промывают промывочным буферным раствором. Забуференный фосфатом физраствор (PBS) предпочтительно используют в качестве промывочного буферного раствора. Альтернативно, может предпочтительно использоваться буферный раствор трис-HCl. Условия промывки, принятые в этом методе, обычно включают три цикла промывки при комнатной температуре в течение 5 минут. Время и температура промывки могут соответственно изменяться.
[0052]
Впоследствии, каждый препарат ткани, таким образом, взаимодействующий с первичным антителом, взаимодействует с вторичным антителом, которое распознает первичное антитело. Обычно используют вторичное антитело, меченное заранее веществом для мечения, для визуализации вторичного антитела. Предпочтительные примеры вещества для мечения включают: флуоресцентные красители, такие как флуоресцеина изотиоцианат (FITC), Cy2 (Amersham Biosciences Corp.) и Alexa 488 (Molecular Probes Inc.); ферменты, такие как пероксидаза и щелочная фосфатаза; и коллоидное золото.
[0053]
Реакцию с вторичным антителом выполняют при условиях, подходящих для образования комплекса антиген-антитело между антителом против GPC3 и вторичным антителом, которое распознает антитело против GPC3. Реакцию обычно проводят при комнатной температуре или 37°C в течение от 30 минут до 1 часа. Условия реакции могут соответственно изменяться в пределах интервала, подходящего для образования комплекса антиген-антитело между антителом против GPC3 и вторичным антителом. Например, температура реакции может изменяться в пределах интервала от 4°C до 50°C, в то время как время реакции может изменяться между 1 минутой и 7 днями. Более длительное время реакции является более предпочтительным для реакции, проводимой при низкой температуре. После завершения реакции вторичного антитела, каждый препарат ткани промывают раствором промывочного буфера. Забуференный фосфатом физраствор (PBS) предпочтительно используют в качестве раствора промывочного буфера. Альтернативно, может предпочтительно использоваться раствор трис-HCl буфера. Условия промывки, принятые в этом методе, обычно включают в себя три цикла промывки при комнатной температуре в течение 5 минут. Время и температура промывки могут соответственно изменяться.
[0054]
Затем каждый препарат ткани, таким образом, взаимодействующий с вторичным антителом, взаимодействует с веществом, способным к визуализации вещества для мечения. Когда пероксидазу применяют в качестве вещества для мечения во вторичном антителе, 0,02% раствор водного пероксида водорода и раствор диаминобензидина (DAB) с концентрацией, приведенной до 0,1% с помощью 0,1 M трис-HCl буферного раствора (pH 7,2), смешивают в равных количествах непосредственно перед инкубацией и препарат ткани инкубируют в полученном в результате растворе реакции. Хромогенный субстрат, такой как DAB-Ni или AEC+ (оба от Dako Japan Inc.) могут быть соответственно выбраны вместо DAB. Во время протекания инкубации реакция визуализации может быть остановлена погружением препарата ткани в PBS на стадии, где соответствующее проявление цвета подтверждают эпизодическим микроскопическим наблюдением степени проявления цвета.
[0055]
Когда щелочную фосфатазу применяют в качестве вещества для мечения во вторичном антителе, каждый препарат ткани инкубируют в растворе субстрата 5-бром-4-хлор-3-индолилфосфорная кислота (BCIP)/нитросиний тетразолий (NBT) (Zymed Laboratories, Inc.) (раствор NBT и BCIP, растворенных при концентрациях 0,4 мМ и 0,38 мМ, соответственно, в 50 мМ буферном растворе карбоната натрия (pH 9,8), содержащем 10 мМ MgCl2 и 28 мМ NaCl). Альтернативно, например, Перманентный Красный, Быстрый Красный, или Фуксин+ (все от Dako Japan Inc.) соответственно будет применяться вместо BCIP и NBT. Перед инкубацией, препарат ткани может быть предварительно инкубирован при комнатной температуре в течение от 1 минуты до нескольких часов в буферном растворе 0,1 M трис-HCl (pH 9,5), содержащим хлорид левамизола (Nacalai Tesque, Inc.), ингибитор эндогенной щелочной фосфатазы, с концентрацией 1 мМ, 0,1 M хлорида натрия, и 50 мМ хлорида магния. Во время протекания инкубации, препарат ткани промывают водой или TBST (TBS, содержащим 0,1% Твин 20) после остановки реакции посредством добавления TBS, содержащего 2% поливиниловый спирт, на стадии, где осаждение конечного продукта реакции пурпурного формазана подтверждают эпизодическим микроскопическим наблюдением. Когда коллоидное золото используют в качестве метки во вторичном антителе, металлическое серебро присоединяют к частицам золота посредством интенсификации серебром, чтобы, таким образом, визуализировать коллоидное золото. Метод интенсификации серебром обычно известен специалистам в данной области.
[0056]
Когда флуоресцентный краситель, такой как флуоресцеина изотиоцианат (FITC), Cy2 (Amersham Biosciences Corp.) или Alexa 488 (Molecular Probes Inc.) применяют в качестве вещества для мечения во вторичном антителе, стадия реакции с визуализирующим веществом не является необходимой. Каждый препарат ткани облучают светом при длине волны возбуждения для флуоресцентого вещества. Испускаемый свет может быть соответственно обнаружен с использованием флуоресцентного микроскопа.
[0057]
Балльная оценка иммуногистохимического окрашивания
В неограничивающем аспекте, настоящее изобретение также предоставляет способ определения эффективности действия нацеленной на GPC3 лекарственной терапии или определения продолжения нацеленной на GPC3 лекарственной терапии, исходя из концентрации свободного GPC3, а также уровня экспрессии GPC3, обнаруженного в тканях методом, описанным выше. В неограничивающем аспекте, экспрессию GPC3, обнаруженнную в тканях методом, описанным выше, оцифровывают посредством, например, неограничивающего метода представленного примером ниже. В настоящем изобретении такой оцифрованный уровень экспрессии GPC3 в тканях называют "балльной оценкой иммуногистохимического окрашивания GPC3".
[0058]
Относительные баллы положительного показателя клеток (PR), интенсивности окрашивания цитоплазмы (SI-cp) или интенсивности окрашивания клеточной мембраны (SI-cm), и схему окрашивания клеточной мембраны (Sp-cm) рассчитывают в соответствии с критериями, показанными в таблице 1, по методу, описанному в WO2009116659, и дополненными на основании расчетных выражений 1 и 2. Полученная в результате балльная оценка представлена как неограничивающая балльная оценка иммуногистохимического окрашивания GPC3 (называемая "композитной балльной оценкой 1" ради удобства) настоящего изобретения.
[0059]
|
[0060]
[Выражение 1]
Общая IHC = PR + SI-Cp + SI-Cm + Sp-Cm
[0061]
[Выражение 2]
IHC cm = PR + SI-Cm + Sp-Cm
[0062]
|
[0063]
В дополнение, H-балльная оценка является известной (литература: KS. McCarty Jr. et al., Use of monoclonal anti-Estrogen receptor antibody in the immunohistochemical evaluation of human tumors. Cancer Res. Suppl. (1986) 46, 4244s-4248s), которую рассчитывают на основании доли клеток, каждая из которых проявляет интенсивность окрашивания (интенсивность окрашивания клеточной мембраны или цитоплазмы), классифицированную от 0 до 3.
[0064]
Еще один пример балльной оценки иммуногистохимического окрашивания включает следующий алгоритм присвоения баллов для классификации от 0 до 3+ на основании интенсивности окрашивания мембраны, интенсивности окрашивания цитоплазмы и степени окрашивания, и оценки в баллах на основании алгоритма (композитная балльная оценка 2).
[0065]
|
[0066]
В настоящем изобретении, например, композитная балльная оценка 1, H-балльная оценка и композитная балльная оценка 2 могут применяться по отдельности или в комбинации в качестве "балльной оценки иммуногистохимического окрашивания GPC3". В неограничивающем аспекте, композитная балльная оценка 1 может применяться в качестве "балльной оценки иммуногистохимического окрашивания GPC3". В еще одном другом неограничивающем аспекте, композитная балльная оценка 2 может применяться в качестве "балльной оценки иммуногистохимического окрашивания GPC3".
[0067]
Нацеленное на GPC3 лекарственное средство
В настоящем изобретении термин "нацеленное на GPC3 лекарственное средство" относится к каждой молекуле, которая блокирует, подавляет, ингибирует или снижает биологическую активность GPC3, включая сигнальный путь, опосредованный GPC3, или является цитотоксической по отношению к клеткам, экспрессирующим GPC3. Термин "направленное (нацеленное) лечение" не предполагает определенного механизма, имеющего биологические воздействия, и в принципе включает каждый возможный эффект фармакологических, физиологических и биохимических взаимодействий GPC3. Примеры нацеленного на GPC3 лекарственного средства включают: (1) антагонистические или неантагонистические ингибиторы связывания GPC3 с GPC3-связывающим лигандом, т.е. активные вещества, которые препятствуют связыванию GPC3 с его лигандом; (2) активные вещества, которые не препятствуют связыванию GPC3 с его лигандом, но вместо этого ингибируют или уменьшают активность, возникающую при связывании GPC3 с его лигандом; (3) активные вещества, которые уменьшают экспрессию GPC3; и (4) активные вещества, способные к вызыванию цитотоксической активности против клеток, экспрессирующих GPC3. В неограничивающем аспекте, примеры лиганда могут включать wnt (Cancer Res. (2005) 65, 6245-6254), IGF-II (Carcinogenesis (2008) 29 (7), 1319-1326), и фактор роста фибробластов 2 (Int. J. Cancer (2003) 103 (4), 455-465). В неограничивающем аспекте, такие активные вещества могут включать, например, антитела (включая их антигенсвязывающие домены), молекулы нуклеиновой кислоты (антисмысловые молекулы или молекулы РНКи и т.д.), пептиды, непептидные низкомолекулярные органические вещества.
[0068]
В неограничивающем аспекте, примеры непептидного низкомолекулярного органического вещества, которое может применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения, включают непептидные низкомолекулярные производные хинолина (WO2008/046085), которые воздействуют на активацию супрессорных генов. Дополнительные их примеры могут включать HLA-A2-рестриктированный пептид GPC3 144-152 (SEQ ID NO: 2) и HLA-A24-рестриктированный пептид GPC3 298-306 (SEQ ID NO: 3) (Clin. Cancer Res. (2006) 12 (9), 2689-2697), которые вызывают цитотоксическую активность цитотоксических T-клеток.
[0069]
Антитело против GPC3
В неограничивающем аспекте, примеры антитела против GPC3, которое может применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения, могут включать конъюгат антитело-лекарственное средство (ADC) (WO2007/137170), содержащий антитело 1G12 (WO2003/100429) (поставляемое под каталожным № B0134R BioMosaics Inc.), конъюгированное с цитотоксическим веществом.
[0070]
В альтернативном неограничивающем аспекте, примеры антитела против GPC3 включают гуманизированное антитело против GPC3, описанное в WO2006/006693 или WO2009/041062. В частности, гуманизированное антитело против GPC3, содержащее CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 4, 5 и 6, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 7, 8 и 9, соответственно, могут применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения. Гуманизированное антитело против GPC3 может быть получено с использованием, в качестве матрицы для гуманизации, соответственно выбранных человеческих каркасных последовательностей, имеющих высокую идентичность последовательности с каркасной последовательностью тяжелой цепи, представленной SEQ ID NO: 10, или каркасной последовательностью легкой цепи, представленной SEQ ID NO: 11.
[0071]
В дополнительном альтернативном неограничивающем аспекте, химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 12, 13 и 14, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 15, 16 и 17, соответственно, могут применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения. Гуманизированное антитело против GPC3 может быть получено с использованием, в качестве матриц для гуманизации, соответственно выбранных человеческих каркасных последовательностей, имеющих высокую идентичность последовательности с каркасной последовательностью тяжелой цепи, представленной SEQ ID NO: 18, или каркасной последовательностью легкой цепи, представленной SEQ ID NO: 19.
[0072]
В альтернативном неограничивающем аспекте, химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 20, 21 и 22, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 23, 24 и 25, соответственно, могут применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения. Гуманизированное антитело против GPC3 может быть получено с использованием, в качестве матриц для гуманизации, соответственно выбранных человеческих каркасных последовательностей, имеющих высокую идентичность последовательности с каркасной последовательностью тяжелой цепи, представленной SEQ ID NO: 26, или каркасной последовательностью легкой цепи, представленной SEQ ID NO: 27.
[0073]
В дополнительном альтернативном неограничивающем аспекте, химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 28, 29 и 30, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 31, 32 и 33, соответственно, может применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения. Гуманизированное антитело против GPC3 может быть получено с использованием, в качестве матриц для гуманизации, соответственно выбранных человеческих каркасных последовательностей, имеющих высокую идентичность последовательности с каркасной последовательностью тяжелой цепи, представленной SEQ ID NO: 34, или каркасной последовательностью легкой цепи, представленной SEQ ID NO: 35.
[0074]
В альтернативном неограничивающем аспекте, химерное антитело против GPC3 или гуманизированное антитело против GPC3, содержащее CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленные SEQ ID NO: 36, 37 и 38, соответственно, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленные SEQ ID NO: 39, 40 и 41, соответственно, может применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения. Гуманизированное антитело против GPC3 может быть получено с использованием, в качестве матриц для гуманизации, соответственно выбранных человеческих каркасных последовательностей, имеющих высокую идентичность последовательности с каркасной последовательностью тяжелой цепи, представленной SEQ ID NO: 42, или каркасной последовательностью легкой цепи, представленной SEQ ID NO: 43.
[0075]
В дополнительном альтернативном неограничивающем аспекте, гуманизированное антитело против GPC3, содержащее вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, представленную SEQ ID NO: 51, может применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения. В дополнительном альтернативном неограничивающем аспекте, гуманизированное антитело против GPC3, содержащее вариабельную область тяжелой цепи, выбранную из группы вариабельных областей тяжелой цепи, представленных SEQ ID NO: 44, 45, 46, 47, 48, 49 и 50, и вариабельную область легкой цепи, выбранную из группы вариабельных областей легкой цепи, представленных SEQ ID NO: 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65 и 66, может применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения.
[0076]
В дополнительном альтернативном неограничивающем аспекте, гуманизированное антитело против GPC3, содержащее вариабельную область тяжелой цепи, представленную SEQ ID NO: 67, и вариабельную область легкой цепи, представленную SEQ ID NO: 68, гуманизированное антитело против GPC3, содержащее вариабельную область тяжелой цепи, представленную SEQ ID NO: 69, и вариабельную область легкой цепи, представленную SEQ ID NO: 70, гуманизированное антитело против GPC3, содержащее вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 72, или гуманизированное антитело против GPC3, содержащее вариабельную область тяжелой цепи, представленную SEQ ID NO: 71, и вариабельную область легкой цепи, представленную SEQ ID NO: 73, могут также применяться в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения.
[0077]
Цитотоксическая активность
Альтернативные примеры антитела против GPC3 настоящего изобретения включают антитело против GPC3, имеющее цитотоксическую активность. В настоящем изобретении неограничивающие примеры цитотоксической активности включают активность антителозависимой клеточноопосредованной цитотоксичности или антителозависимой клеточной цитотоксичности (ADCC), активность комплементзависимой цитотоксичности (CDC) и цитотоксическую активность, основанную на T клетках. В настоящем изобретении, активность CDC означает цитотоксическую активность, придаваемую системой комплемента. С другой стороны, активность ADCC означает активность повреждения клеток-мишеней посредством, например, иммуноцитов, через связывание иммуноцитов посредством Fcγ-рецепторов, экспрессируемых на иммуноцитах к Fc-областям антигенсвязывающих молекул, содержащих антигенсвязывающие домены, способные к связыванию мембранных молекул, экспрессируемых на клеточных мембранах клеток-мишеней. Имеет или нет антигенсвязывающая молекула, представляющая интерес, активность ADCC или активность CDC, может быть определено посредством метода, известного в данной области (например, Current protocols in Immunology, Chapter 7. Immunologic studies in humans, Coligan et al., ed. (1993)).
[0078]
В частности, сначала получают эффекторные клетки, раствор комплемента и клетки-мишени.
(1) Препарат эффекторных клеток
Иссекают селезенки мышей CBA/N или т.п., и клетки селезенки отделяют от них в среде RPMI1640 (Invitrogen Corp.). Клетки селезенки могут быть промыты этой средой, содержащей 10% зародышевой бычьей сыворотки (FBS, HyClone Laboratories, Inc.) и затем концентрацию доводят до 5×106 клеток/мл, чтобы получить эффекторные клетки.
[0079]
(2) Препарат раствора комплемента
Комплемент детеныша кролика (CEDARLANE Laboratories Ltd.) может быть разбавлен 10-кратно средой (Invitrogen Corp.), содержащей 10% FBS, чтобы получить раствор комплемента.
[0080]
(3) Препарат клеток-мишеней
Антиген-экспрессирующие клетки могут культивироваться при 37°C в течение 1 часа, вместе с 0,2 мКи 51Cr-хроматом натрия (GE Healthcare Bio-Sciences Corp.), в среде DMEM, содержащей 10% FBS, чтобы, таким образом, пометить радиоактивным изотопом клетки-мишени. Клетки, таким образом, меченные радиоактивным изотопом, могут быть промыты три раза средой RPMI1640, содержащей 10% FBS, и затем доводят концентрацию до 2×105 клеток/мл для получения клеток-мишеней.
[0081]
Активность ADCC или CDC может быть проанализирована методом, описанным ниже. Для анализа на активность ADCC клетки-мишени и антигенсвязывающую молекулу (каждые 50 мкл/лунку) добавляют в 96-луночный планшет с U-образным дном (Becton, Dickinson and Company) и дают им взаимодействовать в течение 15 минут на льду. Затем 100 мкл эффекторных клеток добавляют в каждую лунку, и планшет оставляют отстаиваться в течение 4 часов в инкубаторе с СО2. Конечная концентрация антитела (антигенсвязывающей молекулы) может быть установлена равной, например, 0 или 10 мкг/мл. Радиоактивность 100 мкл супернатанта, извлеченного из каждой лунки планшета, таким образом, оставленного отстаиваться, измеряют с использованием гамма-счетчика (COBRA II AUTO-GAMMA, MODEL D5005, Packard Instrument Company). Цитотоксическая активность (%) может быть рассчитана на основании уравнения для расчета (A-C)/(B-C)×100 с использованием значения измерения, в котором А представляет радиоактивность (число импульсов в минуту) от каждого образца; B представляет радиоактивность (число импульсов в минуту) от образца, дополненного 1% NP-40 (Nacalai Tesque, Inc.); и C представляет радиоактивность (число импульсов в минуту) от образца, содержащего только клетки-мишени.
[0082]
Для анализа на активность CDC, клетки-мишени и антигенсвязывающую молекулу (каждые по 50 мкл/лунку) добавляют в плоскодонный 96-луночный планшет (Becton, Dickinson and Company) и они взаимодействуют в течение 15 минут на льду. Затем 100 мкл раствора комплемента добавляют в каждую лунку, и планшет оставляют отстаиваться в течение 4 часов в инкубаторе с СО2. Конечная концентрация антитела (антигенсвязывающей молекулы) может быть установлена при, например, 0 или 3 мкг/мл. Радиоактивность 100 мкл супернатанта, извлеченного из каждой лунки планшета, оставленного отстаиваться, таким образом, измеряют с использованием гамма-счетчика. Цитотоксическая активность на основании активности CDC может быть рассчитана таким же методом, что и в анализе на активность ADCC.
[0083]
Цитотоксическое вещество
В неограничивающем аспекте, альтернативные примеры антитела против GPC3 настоящего изобретения включают антитело против GPC3, конъюгированное с цитотоксическим веществом. Такой конъюгат антитело против GPC3-лекарственное средство (ADC), в частности, раскрыт в, например, WO2007/137170, хотя конъюгат настоящего изобретения не ограничивается конъюгатами, описанными в указанном документе. В частности, цитотоксическое вещество может представлять собой любое из химиотерапевтических средств, перечисленных ниже или может являться соединением, раскрытым в Alley et al. (Curr. Opin. Chem. Biol. (2010) 14, 529-537) или WO2009/140242. Антигенсвязывающие молекулы являются конъюгированными с этими соединениями через соответствующие линкеры или т.п.
[0084]
Примеры химиотерапевтических средств, которые могут быть конъюгированы с антителом против GPC3 настоящего изобретения могут включать следующие: азарибин, анастрозол, азацитидин, блеомицин, бортезомид, бриостатин-1, бусульфан, камптотецин, 10-гидроксикамптотецин, кармустин, Целебрекс, хлорамбуцил, цисплатин, иринотекан, карбоплатин, кладрибин, циклофосфамид, цитарабин, дакарбазин, доцетаксел, дактиномицин, дауномицина глюкуронид, даунорубицин, дексаметазон, диэтилстильбэстрол, доксорубицин, доксорубицина глюкуронид, эпирубицин, этинилэстрадиол, эстрамустин, этопозид, этопозида глюкуронид, флоксуридин, флударабин, флутамид, фторурацил, флуоксиместерон, гемцитабин, гидроксипрогестерона капроат, гидроксимочевина, идарубицин, ифосфамид, лейковорин, ломустин, майтанзиноид, мехлорэтамин, медроксипрогестерона ацетат, мегэстрола ацетат, мелфалан, меркаптопурин, метотрексат, митоксантрон, митрамицин, митомицин, митотан, фенилбутират, преднизон, прокарбазин, паклитаксел, пентостатин, семустин, стрептозоцин, тамоксифен, таксаны, Таксол, тестстерона пропионат, талидомид, тиогуанин, тиотепа, тенипозид, топотекан, урациловый иприт, винбластин, винорелбин и винкристин.
[0085]
В настоящем изобретении предпочтительное химиотерапевтическое средство представляет собой низкомолекулярное химиотерапевтическое средство. Маловероятно, что низкомолекулярное химиотерапевтическое средство препятствует функциям антитела против GPC3 даже после образования конъюгата настоящего изобретения антитело против GPC3-лекарственное средство. В настоящем изобретении, низкомолекулярное химиотерапевтическое средство имеет молекулярную массу, равную обычно от 100 до 2000, предпочтительно от 200 до 1000. Все химиотерапевтические средства, перечисленные в настоящем описании, представляют собой низкомолекулярные химиотерапевтические средства. Эти химиотерапевтические средства в соответствии с настоящим изобретением включают пролекарственные средства, которые преобразуются в активные химиотерапевтические средства in vivo. Пролекарственные средства могут активироваться посредством ферментативного превращения или неферментативного превращения.
[0086]
Альтернативные примеры конъюгированного цитотоксического вещества в конъюгате настоящего изобретения антитело против GPC3-лекарственное средство могут включать токсические пептиды (токсины), такие как экзотоксин A из Pseudomonas, сапорин-s6, дифтерийный токсин и токсин книдарий, радиоактивный йод и фотосенсибилизаторы. Примеры токсических пептидов предпочтительно включают следующие:
А-цепь дифтерийного токсина (Langone et al., Methods in Enzymology (1983) 93, 307-308);
экзотоксин из Pseudomonas (Nature Medicine (1996) 2, 350-353);
А-цепь рицина (Fulton et al., J. Biol. Chem. (1986) 261, 5314-5319; Sivam et al., Cancer Res. (1987) 47, 3169-3173; Cumber et al., J. Immunol. Methods (1990) 135, 15-24; Wawrzynczak et al., Cancer Res. (1990) 50, 7519-7562; и Gheeite et al., J. Immunol. Methods (1991) 142, 223-230);
дегликозилированная А-цепь рицина (Thorpe et al., Cancer Res. (1987) 47, 5924-5931);
цепь А абрина (Wawrzynczak et al., Br. J. Cancer (1992) 66, 361-366; Wawrzynczak et al., Cancer Res. (1990) 50, 7519-7562; Sivam et al., Cancer Res. (1987) 47, 3169-3173; and Thorpe et al., Cancer Res. (1987) 47, 5924-5931);
гелонин (Sivam et al., Cancer Res. (1987) 47, 3169-3173; Cumber et al., J. Immunol. Methods (1990) 135, 15-24; Wawrzynczak et al., Cancer Res., (1990) 50, 7519-7562; and Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
противовирусный белок лаконоса из семян (PAP-s) (Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
бриодин (Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
сапорин (Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
момордин (Cumber et al., J. Immunol. Methods (1990) 135, 15-24; Wawrzynczak et al., Cancer Res. (1990) 50, 7519-7562; and Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
моморкочин (Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
диантин 32 (Bolognesi et al., Clin. exp. Immunol. (1992) 89, 341-346);
диантин 30 (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8);
модессин (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8);
вискумин (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8);
волкенсин (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8);
додекандрин (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8);
тритин (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8);
люффин (Stirpe F., Barbieri L., FEBS letter (1986) 195, 1-8); и
трихокирин (Casellas et al., Eur. J. Biochem. (1988) 176, 581-588; and Bolognesi et al., Clin. exp. Immunol., (1992) 89, 341-346).
[0087]
В случае анализа на цитотоксическую активность конъюгата антитело против GPC3-лекарственное средство настоящего изобретения, клетки-мишени и конъюгат антитело против GPC3-лекарственное средство (каждого 50 мкл/лунку) добавляют в плоскодонный 96-луночный планшет (Becton, Dickinson and Company), и они взаимодействуют в течение 15 минут на льду. Планшет инкубируют в течение от 1 до 4 часов в инкубаторе с СО2. Конъюгат антитело против GPC3-лекарственное средство может соответственно применяться при конечной концентрации в интервале от 0 до 3 мкг/мл. После культивирования 100 мкл супернатанта извлекают из каждой лунки, и радиоактивность супернатанта измеряют с использованием гамма-счетчика. Цитотоксическая активность может быть рассчитана таким же образом, как и при анализе на активность ADCC.
[0088]
Fc-область
Fc-область, содержащаяся в константной области, содержащейся в антителе против GPC3 настоящего изобретения, может быть получена из человеческих IgG, хотя Fc-область настоящего изобретения не ограничивается конкретным подклассом IgG. Fc-область относится к константной области тяжелой цепи антитела, содержащей шарнирную область и CH2 и CH3 домены из N-конца шарнирной области, которая является сайтом расщепления для папаина (приблизительно аминокислота 216 на основе EU-нумерации). Предпочтительные примеры Fc-области включают Fc-области, имеющие связывающую активность против Fcγ-рецепторов, как указано позже. В неограничивающем аспекте, примеры таких Fc-областей включают Fc-области, содержащиеся в константных областях, представленных SEQ ID NO: 74 для человеческого IgG1, SEQ ID NO: 75 для IgG2, SEQ ID NO: 76 для IgG3, и SEQ ID NO: 77 для IgG4.
[0089]
Fcγ-рецептор (FcγR)
Fcγ-рецептор (также именуемый FcγR) относится к рецептору, способному к связыванию с Fc-областью моноклонального антитела IgG1, IgG2, IgG3 или IgG4, и по существу означает даже любого члена семейства белков, кодируемого генами Fcγ-рецептора. У людей это семейство включает, но не ограничивается ими: FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc; FcγRII (CD32), включая изоформы FcγRIIa (включая аллотипы H131 и R131; т.е. FcγRIIa (H) и FcγRIIa (R)), FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2), и FcγRIIc; FcγRIII (CD16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158; т.е. FcγRIIIa (V) и FcγRIIIa (F)) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2); и даже любые необнаруженные человеческие FcγR или изоформу или аллотип FcγR. FcγR включает человеческие, мышиные, крысиные, кроличьи и обезьяньи Fcγ рецепторы. FcγR настоящего изобретения не ограничивается этими рецепторами и может быть получен из любого организма. Мышиный FcγR включает, но не ограничивается ими, FcγRI (CD64), FcγRII (CD32), FcγRIII (CD16) и FcγRIII-2 (FcγRIV, CD16-2), и даже любые необнаруженные мышиные FcγR или изоформу или аллотип FcγR. Предпочтительные примеры таких Fcγ-рецепторов включают человеческие FcγRI (CD64), FcγRIIa (CD32), FcγRIIb (CD32), FcγRIIIa (CD16) и/или FcγRIIIb (CD16). Полипептидная последовательность человеческого FcγRI описана в SEQ ID NO: 78 (NP_000557.1); полипептидная последовательность человеческого FcγRIIa (аллотип H131) описана в SEQ ID NO: 79 (AAH20823.1) (аллотип R131 имеет последовательность с заменой на Arg по аминокислоте 166 в SEQ ID NO: 79); полипептидная последовательность FcγRIIb описана в SEQ ID NO: 80 (AAI46679.1); полипептидная последовательность FcγRIIIa описана в SEQ ID NO: 81 (AAH33678.1); и полипептидная последовательность FcγRIIIb описана в SEQ ID NO: 82 (AAI28563.1) (регистрационные номера базы данных, такой как RefSeq показаны внутри скобок). Имеет или нет Fcγ-рецептор связывающую активность против Fc-области моноклонального антитела IgG1, IgG2, IgG3 или IgG4, можно подтвердить посредством метода, известного в данной области, такого как форматы FACS или ELISA, а также метод BIACORE с использованием скрининга на основе гомогенного анализа усиленной за счет эффекта близости люминесценции (ALPHA) или явления поверхностного плазмонного резонанса (SPR) (Proc. Natl. Acad. Sci. U.S.A. (2006) 103 (11), 4005-4010).
[0090]
В FcγRI (CD64), включая изоформы FcγRIa, FcγRIb и FcγRIc, и в FcγRIII (CD16), включая изоформы FcγRIIIa (включая аллотипы V158 и F158), и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2), α-цепь, способная к связыванию Fc-области IgG ассоциируется с общей γ-цепью, имеющей ITAM, который передает активирующие сигналы в клетки. С другой стороны, FcγRII (CD32), включая изоформы FcγRIIa (включая аллотипы H131 и R131) и FcγRIIc, содержит ITAM в его цитоплазматическом домене. Эти рецепторы экспрессируются в многих иммуноцитах, таких как макрофаги, тучные клетки и антиген-проявляющие клетки. Эти рецепторы связываются с Fc-областями IgG и посредством этого передают активирующие сигналы, которые, в свою очередь, инициируют фагоцитарную способность макрофагов, выработку воспалительных цитокинов, дегрануляцию тучных клеток, и увеличенную функцию антиген-проявляющих клеток. Fcγ-рецепторы, которые способны передавать активирующие сигналы, как описано выше, именуют активными Fcγ-рецепторами в настоящем описании.
[0091]
С другой стороны, FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2) содержит ITIM, который передает ингибиторные сигналы, в его внутрицитоплазматическом домене. В B-клетках активирующие сигналы от рецепторов B-клеток (BCR) ингибируются посредством сшивки BCR с FcγRIIb, приводящей в результате к подавленной выработке антител BCR. Фагоцитарная способность макрофагов или их способность вырабатывать воспалительные цитокины подавляется посредством сшивки FcγRIII и FcγRIIb. Fcγ-рецепторы, которые способны передавать ингибиторные сигналы, как описано выше, в настоящем описании именуют ингибиторными Fcγ-рецепторами.
[0092]
Связывающая активность Fc-области против FcγR
Как указано выше, примеры Fc-области, содержащейся в антителе против GPC3 настоящего изобретения, включают Fc-области, имеющие связывающую активность против Fcγ-рецепторов. В неограничивающем аспекте, примеры таких Fc-областей включают Fc-области, содержащиеся в константных областях, представленных SEQ ID NO: 74 для человеческих IgG1, SEQ ID NO: 75 для IgG2, SEQ ID NO: 76 для IgG3 и SEQ ID NO: 77 для IgG4. Имеет или нет Fcγ-рецептор связывающую активность против Fc-области моноклонального антитела IgG1, IgG2, IgG3 или IgG4, можно подтвердить посредством метода, известного в данной области, такого как форматы FACS или ELISA, а также метод BIACORE с использованием скрининга на основе гомогенного анализа усиленной за счет эффекта близости люминесценции (ALPHA) или явления поверхностного плазмонного резонанса (SPR) (Proc. Natl. Acad. Sci. U.S.A. (2006) 103 (11), 4005-4010).
[0093]
Скрининг ALPHA выполняют на основании следующих принципов в соответствии с технологией ALPHA с использованием двух шариков, донорного и акцепторного. Сигналы люминесценции обнаруживают только тогда, когда эти два шарика располагаются вблизи через биологическое взаимодействие между молекулой, связанной с донорным шариком, и молекулой, связанной с акцепторным шариком. Возбуждаемый лазером фотосенсибилизатор в донорном шарике преобразует окружающий кислород в синглетный кислород в возбужденном состоянии. Синглетный кислород диффундирует вокруг донорного шарика и достигает акцепторного шарика, расположенного вблизи от него, чтобы, таким образом, вызвать хемилюминесцентную реакцию в шарике, который в конечном счете испускает свет. В отсутствие взаимодействия между молекулой, связанной с донорным шариком, и молекулой, связанной с акцепторным шариком, синглетный кислород, продуцируемый донорным шариком, не достигает акцепторного шарика. Таким образом, никакой хемилюминесцентной реакции не происходит.
[0094]
Например, меченное биотином антитело против GPC3, содержащее Fc-область, связывается с донорным шариком, в то время как Fcγ-рецептор, с меткой из глутатион S-трансферазы (GST) связывается с акцепторным шариком. В отсутствие конкурирующего антитела против GPC3, содержащего модифицированную Fc-область, антитело против GPC3, имеющее нативную Fc-область, взаимодействует с Fcγ-рецептором, чтобы генерировать сигналы от 520 до 620 нм. Антитело против GPC3, содержащее немеченую модифицированную Fc-область, конкурирует с антителом против GPC3, имеющим нативную Fc-область, за взаимодействие с Fcγ-рецептором. Уменьшение флуоресценции, вызываемое в результате конкуренции, может быть количественно определено, чтобы, таким образом, определить относительную аффинность связывания. Биотинилирование антитела с использованием сульфо-NHS-биотина или т.п. является известным в данной области. Fcγ-рецептор может быть помечен GST посредством соответственно принятого метода, который включает в себя, например: слияние полинуклеотида, кодирующего Fcγ-рецептор, в рамке с полинуклеотидом, кодирующим GST; функциональное лигирование полученного в результате гибридного гена с вектором; и обеспечение для клеток или т.п., несущих вектор, возможность экспрессировать GST-меченный Fcγ-рецептор, который затем очищают с использованием колонки с глутатионом. Полученные сигналы предпочтительно анализируют с использованием, например, программного обеспечения GRAPHPAD PRISM (GraphPad Software, Inc., San Diego), адаптированного к модели односайтной конкуренции на основании нелинейного регрессионного анализа.
[0095]
Одно (лиганд) из веществ, между которыми будет наблюдаться взаимодействие, иммобилизуют на тонкой золотой пленке сенсорного чипа. Сенсорный чип облучают светом с обратной стороны, таким образом, что происходит полное отражение на границе раздела между тонкой золотой пленкой и стеклом. В результате участок, имеющий падение интенсивности отражения (сигнал SPR), образуется в части отраженного света. Другое (аналит) из веществ, между которыми будет наблюдаться взаимодействие, растекается по поверхности сенсорного чипа и связывается с лигандом так, что масса иммобилизованной молекулы лиганда увеличивается, чтобы изменить показатель преломления растворителя на поверхности сенсорного чипа. Это изменение показателя преломления сдвигает положение сигнала SPR (напротив, диссоциация связанных молекул возвращает сигнал назад в исходное положение). Система Biacore размещает на ординате количество сдвига, т.е. изменение массы на поверхности сенсорного чипа, и отображает зависимое от времени изменение массы как данные анализа (сенсограмма). Кинетика: константа скорости ассоциации (ka) и константа скорости диссоциации (kd) могут быть определены по кривой сенсограммы, и аффинность (KD) может быть определена по отношению между этими константами. Анализ ингибирования также предпочтительно применяется в методе BIACORE. Примеры анализа ингибирования описаны в Lazor et al. (Proc. Natl. Acad. Sci. U.S.A. (2006) 103 (11), 4005-4010).
[0096]
Связывающая Fcγ-рецептор (FcγR) модифицированная Fc-область
В дополнение к Fc-областям, содержащимся в константных областях, представленных SEQ ID NO: 74 для человеческого IgG1, SEQ ID NO: 75 для IgG2, SEQ ID NO: 76 для IgG3 и SEQ ID NO: 77 для IgG4, FcγR-связывающая модифицированная Fc-область, имеющая более высокую связывающую активность против Fcγ-рецепторов, чем связывающая активность Fc-области нативного человеческого IgG против Fcγ-рецепторов, может соответственно использоваться в качестве Fc-области, содержащейся в антителе против GPC3 настоящего изобретения. "Fc-область нативного человеческого IgG", описанная в настоящем описании, означает Fc-область, имеющую фукозосодержащую сахарную цепь в качестве сахарной цепи, связанной с положением 297 (ЕU-нумерация) Fc-области, содержащейся в константной области человеческих IgG1, IgG2, IgG3 или IgG4, представленной SEQ ID NO: 74, 75, 76 или 77. Такая FcγR-связывающая модифицированная Fc-область может быть получена посредством аминокислотной модификации Fc-области нативного человеческого IgG. Имеет или нет FcγR-связывающая модифицированная Fc-область более высокую связывающую активность против FcγR, чем связывающая активность Fc-области нативного человеческого IgG против FcγR, может быть соответственно подтверждено посредством метода, известного в данной области, такого как форматы FACS или ELISA, а также метод BIACORE с использованием скрининга на основе гомогенного анализа усиленной за счет эффекта близости люминесценции (ALPHA) или явления поверхностного плазмонного резонанса (SPR), как описано выше.
[0097]
В настоящем изобретении "модификация аминокислот(ы)" или "аминокислотная модификация" Fc-области включает модификацию до аминокислотной последовательности, отличающейся от аминокислотной последовательности исходной Fc-области. Любая Fc-область может применяться как исходная Fc-область, поскольку модифицированная форма исходной Fc-области может связываться с человеческим Fcγ-рецептором в нейтральной области pH. Альтернативно, Fc-область, дополнительно модифицированная из уже модифицированной Fc-области, как исходной Fc-области, может предпочтительно использоваться как Fc-область настоящего изобретения. Исходная Fc-область может означать полипептид сам по себе, композицию, содержащую исходную Fc-область, или аминокислотную последовательность, кодирующую исходную Fc-область. Исходная Fc-область может включать Fc-области, известные в данной области, продуцируемые посредством рекомбинации, обзор которых приведен в параграфе об антителе. Исходная Fc-область не ограничивается ее происхождением и может быть получена из условного организма животного, не являющегося человеком, или человека. Предпочтительные примеры условного организма включают организм, выбранный из мышей, крыс, морских свинок, хомяков, песчанок, кошек, кроликов, собак, коз, овец, крупного рогатого скота, лошадей, верблюдов и приматов, не являющихся человеком. В еще одном другом аспекте, исходная Fc-область может быть получена из яванской макаки, мартышки, макаки-резус, шимпанзе или человека. Предпочтительно, исходная Fc-область может быть получена из человеческого IgG1, хотя исходная Fc-область настоящего изобретения не ограничивается конкретным классом IgG. Данное означает, что Fc-область человеческих IgG1, IgG2, IgG3 или IgG4 может соответственно применяться как исходная Fc-область. Аналогично, это в настоящем описании означает, что Fc-область условного IgG-класса или подкласса из условного организма может предпочтительно использоваться как исходная Fc-область. Примеры вариантов природных IgG или их манипулируемых форм описаны в литературных источниках, известных в данной области (Curr. Opin. Biotechnol. (2009) 20 (6), 685-91; Curr. Opin. Immunol. (2008) 20 (4), 460-470; Protein Eng. Des. Sel. (2010) 23 (4), 195-202; и Международной Публикации № WO2009/086320, WO2008/092117, WO2007/041635 и WO2006/105338), хотя варианты или манипулируемые формы настоящего изобретения не ограничиваются теми, что описаны в них.
[0098]
Примеры модификации включают одну или несколько вариаций, например, вариацию, которая заменяет аминокислоту(аминокислоты) в исходной Fc-области на аминокислотные остаток(остатки), отличные от них, введение одного или нескольких аминокислотных остатков в аминокислотную последовательность исходной Fc-области и/или делеция одной или нескольких аминокислот из аминокислотной последовательности исходной Fc-области. Предпочтительно, аминокислотная последовательность Fc-области, модифицированная таким образом, содержит аминокислотную последовательность, содержащую по меньшей мере неприродную часть Fc-области. Такой вариант неизбежно имеет менее чем 100% идентичности или сходства последовательности с исходной Fc-областью. В предпочтительном варианте осуществления, вариант имеет аминокислотную последовательность с приблизительно от 75% до менее чем 100% идентичности или сходства последовательности, более предпочтительно приблизительно от 80% до менее чем 100%, дополнительно предпочтительно приблизительно от 85% до менее чем 100%, еще дополнительно предпочтительно приблизительно от 90% до менее чем 100%, наиболее предпочтительно приблизительно от 95% до менее чем 100% идентичности или сходства последовательности с аминокислотной последовательностью исходной Fc-области. В неограничивающем аспекте настоящего изобретения, исходная Fc-область и FcγR-связывающая модифицированная Fc-область настоящего изобретения отличаются по меньшей мере одной аминокислотой. Различие по аминокислоте между исходной Fc-областью и FcγR-связывающей модифицированной Fc-областью настоящего изобретения может быть предпочтительно определено по различию в аминокислоте с идентифицированным положением ее аминокислотного остатка, определяемым, конкретно, посредством EU-нумерации.
[0099]
Аминокислота(аминокислоты) в Fc-области могут быть модифицированы посредством соответственно принятого метода, известного в данной области, такого как сайт-направленный мутагенез (Kunkel et al., Proc. Natl. Acad. Sci. USA (1985) 82, 488-492) или ПЦР с перекрывающимися праймерами. Также, множество методов, известных в данной области, могут быть приняты в качестве методов для модификации аминокислоты, чтобы заменить аминокислоту на аминокислоту, отличающуюся от природной аминокислоты (Annu. Rev. Biophys. Biomol. Struct. (2006) 35, 225-249; и Proc. Natl. Acad. Sci. U.S.A. (2003) 100 (11), 6353-6357). Например, тРНК-содержащая бесклеточная система трансляции (Clover Direct (Protein Express, Компания, ориентированная на исследования и разработки)), содержащая неприродную аминокислоту, связанную с амбер-супрессором тРНК, комплементарным с UAG-кодоном (амбер-кодоном), который является стоп-кодоном, также предпочтительно используется.
[0100]
FcγR-связывающая модифицированная Fc-область (содержащаяся в антигенсвязывающей молекуле настоящего изобретения), имеющая более высокую связывающую активность против Fcγ-рецепторов, чем активность нативной человеческой Fc-области IgG против Fcγ-рецепторов, может быть получена посредством любого метода. В особенности, FcγR-связывающая модифицированная Fc-область может быть получена посредством аминокислотной модификации Fc-области человеческого иммуноглобулина IgG, используемой в качестве исходной Fc-области. Примеры Fc-области иммуноглобулинов IgG, предпочтительной для модификации, включают Fc-области, содержащиеся в константных областях человеческих IgG (IgG1, IgG2, IgG3 и IgG4, и их модифицированные формы), представленных SEQ ID NO: 74, 75, 76 и 77.
[0101]
Модификация до других аминокислот может включать аминокислотную модификацию по любому положению, поскольку получаемая в результате Fc-область имеет более высокую связывающую активность против Fcγ рецепторов, чем активность Fc-области нативного человеческого IgG против Fcγ-рецепторов. Когда антигенсвязывающая молекула содержит Fc-область человеческого IgG1 в качестве человеческой Fc-области, модификация предпочтительно позволяет Fc-области содержать фукозосодержащую сахарную цепь в качестве сахарной цепи, связанной с положением 297 (ЕU-нумерация), и она является эффективной для получения более высокой, связывающей активности против Fcγ-рецепторов, чем активность нативной Fc-области человеческих IgG против Fcγ рецепторов. Такая аминокислотная модификация изложена, например, в международных публикациях № WO2007/024249, WO2007/021841, WO2006/031370, WO2000/042072, WO2004/029207, WO2004/099249, WO2006/105338, WO2007/041635, WO2008/092117, WO2005/070963, WO2006/020114, WO2006/116260 и WO2006/023403.
[0102]
Примеры аминокислот, которые могут претерпевать такую модификацию, включают по меньшей мере одну или несколько аминокислот, выбранных из группы, включающей
положение 221, положение 222, положение 223, положение 224, положение 225, положение 227, положение 228, положение 230, положение 231, положение 232, положение 233, положение 234, положение 235, положение 236, положение 237, положение 238, положение 239, положение 240, положение 241, положение 243, положение 244, положение 245, положение 246, положение 247, положение 249, положение 250, положение 251, положение 254, положение 255, положение 256, положение 258, положение 260, положение 262, положение 263, положение 264, положение 265, положение 266, положение 267, положение 268, положение 269, положение 270, положение 271, положение 272, положение 273, положение 274, положение 275, положение 276, положение 278, положение 279, положение 280, положение 281, положение 282, положение 283, положение 284, положение 285, положение 286, положение 288, положение 290, положение 291, положение 292, положение 293, положение 294, положение 295, положение 296, положение 297, положение 298, положение 299, положение 300, положение 301, положение 302, положение 303, положение 304, положение 305, положение 311, положение 313, положение 315, положение 317, положение 318, положение 320, положение 322, положение 323, положение 324, положение 325, положение 326, положение 327, положение 328, положение 329, положение 330, положение 331, положение 332, положение 333, положение 334, положение 335, положение 336, положение 337, положение 339, положение 376, положение 377, положение 378, положение 379, положение 380, положение 382, положение 385, положение 392, положение 396, положение 421, положение 427, положение 428, положение 429, положение 434, положение 436 и положение 440, на основе EU-нумерации. Модификация этих аминокислот может давать на выходе Fc-область (FcγR-связывающую модифицированную Fc-область), имеющую более высокую связывающую активность против Fcγ-рецепторов, чем активность нативной Fc-области человеческих IgG против Fcγ рецепторов.
[0103]
Примеры особенно предпочтительной модификации для применения в настоящем изобретении включают по меньшей мере одну или несколько аминокислотных модификаций, выбранных из группы, состоящей из модификаций
аминокислоты 221 до Lys или Tyr,
аминокислоты 222 до Phe, Trp, Glu или Tyr,
аминокислоты 223 до Phe, Trp, Glu или Lys,
аминокислоты 224 до Phe, Trp, Glu или Tyr,
аминокислоты 225 до Glu, Lys или Trp,
аминокислоты 227 до Glu, Gly, Lys или Tyr,
аминокислоты 228 до Glu, Gly, Lys или Tyr,
аминокислоты 230 до Ala, Glu, Gly или Tyr,
аминокислоты 231 до Glu, Gly, Lys, Pro или Tyr,
аминокислоты 232 до Glu, Gly, Lys или Tyr,
аминокислоты 233 до Ala, Asp, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 234 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 235 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 236 до Ala, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 237 до Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 238 до Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 239 до Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr,
аминокислоты 240 до Ala, Ile, Met или Thr,
аминокислоты 241 до Asp, Glu, Leu, Arg, Trp или Tyr,
аминокислоты 243 до Leu, Glu, Leu, Gln, Arg, Trp или Tyr,
аминокислоты 244 до His,
аминокислоты 245 до Ala,
аминокислоты 246 до Asp, Glu, His или Tyr,
аминокислоты 247 до Ala, Phe, Gly, His, Ile, Leu, Met, Thr, Val или Tyr,
аминокислоты 249 до Glu, His, Gln или Tyr,
аминокислоты 250 до Glu или Gln,
аминокислоты 251 до Phe,
аминокислоты 254 до Phe, Met или Tyr,
аминокислоты 255 до Glu, Leu или Tyr,
аминокислоты 256 до Ala, Met или Pro,
аминокислоты 258 до Asp, Glu, His, Ser или Tyr,
аминокислоты 260 до Asp, Glu, His или Tyr,
аминокислоты 262 до Ala, Glu, Phe, Ile или Thr,
аминокислоты 263 до Ala, Ile, Met или Thr,
аминокислоты 264 до Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Trp или Tyr,
аминокислоты 265 до Ala, Leu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 266 до Ala, Ile, Met или Thr,
аминокислоты 267 до Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr,
аминокислоты 268 до Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Pro, Gln, Arg, Thr, Val или Trp,
аминокислоты 269 до Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 270 до Glu, Phe, Gly, His, Ile, Leu, Met, Pro, Gln, Arg, Ser, Thr, Trp или Tyr,
аминокислоты 271 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 272 до Asp, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 273 до Phe или Ile,
аминокислоты 274 до Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 275 до Leu или Trp,
аминокислоты 276 до Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 278 до Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp,
аминокислоты 279 до Ala,
аминокислоты 280 до Ala, Gly, His, Lys, Leu, Pro, Gln, Trp или Tyr,
аминокислоты 281 до Asp, Lys, Pro или Tyr,
аминокислоты 282 до Glu, Gly, Lys, Pro или Tyr,
аминокислоты 283 до Ala, Gly, His, Ile, Lys, Leu, Met, Pro, Arg или Tyr,
аминокислоты 284 до Asp, Glu, Leu, Asn, Thr или Tyr,
аминокислоты 285 до Asp, Glu, Lys, Gln, Trp или Tyr,
аминокислоты 286 до Glu, Gly, Pro или Tyr,
аминокислоты 288 до Asn, Asp, Glu или Tyr,
аминокислоты 290 до Asp, Gly, His, Leu, Asn, Ser, Thr, Trp или Tyr,
аминокислоты 291 до Asp, Glu, Gly, His, Ile, Gln или Thr,
аминокислоты 292 до Ala, Asp, Glu, Pro, Thr или Tyr,
аминокислоты 293 до Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 294 до Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 295 до Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 296 до Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr или Val,
аминокислоты 297 до Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 298 до Ala, Asp, Glu, Phe, His, Ile, Lys, Met, Asn, Gln, Arg, Thr, Val, Trp или Tyr,
аминокислоты 299 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr,
аминокислоты 300 до Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp,
аминокислоты 301 до Asp, Glu, His или Tyr,
аминокислоты 302 до Ile,
аминокислоты 303 до Asp, Gly или Tyr,
аминокислоты 304 до Asp, His, Leu, Asn или Thr,
аминокислоты 305 до Glu, Ile, Thr или Tyr,
аминокислоты 311 до Ala, Asp, Asn, Thr, Val или Tyr,
аминокислоты 313 до Phe,
аминокислоты 315 до Leu,
аминокислоты 317 до Glu или Gln,
аминокислоты 318 до His, Leu, Asn, Pro, Gln, Arg, Thr, Val или Tyr,
аминокислоты 320 до Asp, Phe, Gly, His, Ile, Leu, Asn, Pro, Ser, Thr, Val, Trp или Tyr,
аминокислоты 322 до Ala, Asp, Phe, Gly, His, Ile, Pro, Ser, Thr, Val, Trp или Tyr,
аминокислоты 323 до Ile,
аминокислоты 324 до Asp, Phe, Gly, His, Ile, Leu, Met, Pro, Arg, Thr, Val, Trp или Tyr,
аминокислоты 325 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 326 до Ala, Asp, Glu, Gly, Ile, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr,
аминокислоты 327 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Thr, Val, Trp или Tyr,
аминокислоты 328 до Ala, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 329 до Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 330 до Cys, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 331 до Asp, Phe, His, Ile, Leu, Met, Gln, Arg, Thr, Val, Trp или Tyr,
аминокислоты 332 до Ala, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr,
аминокислоты 333 до Ala, Asp, Glu, Phe, Gly, His, Ile, Leu, Met, Pro, Ser, Thr, Val или Tyr,
аминокислоты 334 до Ala, Glu, Phe, Ile, Leu, Pro или Thr,
аминокислоты 335 до Asp, Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Arg, Ser, Val, Trp или Tyr,
аминокислоты 336 до Glu, Lys или Tyr,
аминокислоты 337 до Glu, His или Asn,
аминокислоты 339 до Asp, Phe, Gly, Ile, Lys, Met, Asn, Gln, Arg, Ser или Thr,
аминокислоты 376 до Ala или Val,
аминокислоты 377 до Gly или Lys,
аминокислоты 378 до Asp,
аминокислоты 379 до Asn,
аминокислоты 380 до Ala, Asn или Ser,
аминокислоты 382 до Ala или Ile,
аминокислоты 385 до Glu,
аминокислоты 392 до Thr,
аминокислоты 396 до Leu,
аминокислоты 421 до Lys,
аминокислоты 427 до Asn,
аминокислоты 428 до Phe или Leu,
аминокислоты 429 до Met,
аминокислоты 434 до Trp,
аминокислоты 436 до Ile или
аминокислоты 440 до Gly, His, Ile, Leu или Tyr
на основании EU-нумерации в Fc-области. Число аминокислот, подлежащих модификации, не ограничивается. Только одна аминокислота может быть модифицирована или две или несколько аминокислот могут быть модифицированы. Примеры комбинаций аминокислотных модификаций по двум или более положениям включают комбинации, как описано в таблице 3 (таблицы 3-1 - 3-3). Также, WO2007/047291 раскрывает конкретные примеры антитела против GPC3, содержащего FcγR-связывающую модифицированную Fc-область, имеющую более высокую связывающую активность против Fcγ-рецепторов, чем активность Fc-области нативного человеческого IgG против Fcγ-рецепторов.
[0104]
[0105]

[0106]
[0107]
Fcγ-рецептор-связывающий домен, содержащийся в антителе против GPC3 настоящего изобретения, может быть подвергнут анализу на предмет его связывающей активности против Fcγ-рецептора соответствующим образом с использованием условий pH, выбранных из кислых до нейтральных областей pH. Области рН от кислых до нейтральных, как условия, при которых Fcγ-рецептор-связывающий домен, содержащийся в антигенсвязывающей молекуле настоящего изобретения, анализируют на предмет его связывающей активности против Fcγ-рецептора, обычно означают от pH 5,8 до pH 8,0. Интервал pH предпочтительно указывают посредством условных значений pH от pH 6,0 до pH 7,4 и предпочтительно выбирают из pH 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3 и 7,4. Конкретно, интервал pH от 6,15 до 7,4, который близок к pH тканей злокачественных новообразований, является предпочтительным (Vaupel et al., Cancer Res. (1989) 49, 6449-6665). Аффинность связывания Fc-области для человеческого Fcγ-рецептора можно оценить при условиях анализа, включающих в себя условную температуру от 10°C до 50°C. Предпочтительно, температуру от 15°C до 40°C применяют для определения аффинности связывания Fc-области для человеческого Fcγ-рецептора. Более предпочтительно, условную температуру от 20°C до 35°C, например, любую температуру из 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 и 35°C, также применяют для определения аффинности связывания Fc-области для Fcγ-рецептора. Температура 25°C представляет собой один неограничивающий пример в аспекте настоящего изобретения.
[0108]
Фраза "FcγR-связывающая модифицированная Fc-область, имеющая более высокую связывающую активность против Fcγ-рецепторов, чем активность нативной Fc-области против Fcγ-рецепторов", описанная в настоящем документе, означает, что FcγR-связывающая модифицированная Fc-область имеет более высокую связывающую активность против любого из человеческих Fcγ-рецепторов FcγRI, FcγRIIa, FcγRIIb, FcγRIIIa и/или FcγRIIIb, чем такая активность нативной Fc-области против человеческого Fcγ-рецептора. Фраза означает, что, например, на основании метода анализа, описанного выше, антитело против GPC3, содержащее FcγR-связывающую модифицированную Fc-область, проявляет 105% или более, предпочтительно 110% или более, 115% или более, 120% или более, или 125% или более, конкретно предпочтительно 130% или более, 135% или более, 140% или более, 145% или более, 150% или более, 155% или более, 160% или более, 165% или более, 170% или более, 175% или более, 180% или более, 185% или более, 190% или более, 195% или более, в 2 раза или более, 2,5 раза или более, 3 раза или более, 3,5 раза или более, 4 раза или более, 4,5 раза или более, 5 раз или более, 7,5 раза или более, 10 раз или более, 20 раз или более, 30 раз или более, 40 раз или более, 50 раз или более, 60 раз или более, 70 раз или более, 80 раз или более, 90 раз или более, 100 раз или более связывающую активность в сравнении со связывающей активностью антитела против GPC3, содержащего нативную Fc-область человеческого IgG, служащего в качестве контроля. Применяемая нативная Fc-область может являться исходной Fc-областью или может являться нативной Fc-областью антитела того же самого подкласса, как рассматриваемое антитело против GPC.
[0109]
В настоящем изобретении нативную Fc-область человеческого IgG, имеющую фукозосодержащую сахарную цепь в качестве сахарной цепи, связанной с аминокислотой 297 (ЕU-нумерация), предпочтительно применяют как нативную Fc-область человеческого IgG, служащую в качестве контроля. Является или нет сахарная цепь, связанная с аминокислотой 297 (ЕU-нумерация), фукозосодержащей сахарной цепью, можно подтвердить с использованием подхода, известного в данной области. Является или нет, сахарная цепь, связанная с нативной Fc-областью человеческого IgG, фукозосодержащей сахарной цепью можно определить посредством, например, метода, как показано ниже. Нативный человеческий IgG, подлежащий тестированию, высвобождает сахарную цепь через реакцию с N-Гликозидазой F (Roche Diagnostics K.K.) (Weitzhandler et al., J. Pharma. Sciences (1994) 83, 12, 1670-1675). Далее, белки удаляют через реакцию с этанолом, и полученный в результате раствор реакции (Schenk et al., J. Clin. Investigation (2001) 108 (11) 1687-1695) упаривают досуха, и затем флуоресцентно метят 2-аминобензамидом (Bigge et al., Anal. Biochem. (1995) 230 (2) 229-238). После удаления реагента твердофазной экстракцией с использованием целлюлозного картриджа, 2-AB-флуоресцентно меченную сахарную цепь анализируют посредством хроматографии на нормальной фазе. Обнаруженный пик на хроматограмме можно наблюдать, чтобы таким образом определить, является или нет сахарная цепь, связанная с нативной Fc-областью человеческого IgG, фукозосодержащей сахарной цепью.
[0110]
Антитело против GPC3, имеющее Fc-область IgG моноклонального антитела, может соответственно применяться как антитело против GPC3, содержащее нативную Fc-область антитела такого же подкласса, служащую в качестве контроля. Структурные примеры Fc-области включают Fc-области, содержащиеся в константных областях, представленных SEQ ID NO: 74 (имеющей А, добавленную к N-концу последовательности, имеющей регистрационный № AAC82527.1 в базе данных), 75 (имеющей А, добавленную к N-концу последовательности, имеющей регистрационный № AAB59393.1 в базе данных), 76 (регистрационный № CAA27268.1 в базе данных) и 77 (имеющей А, добавленную к N-концу последовательности, имеющей регистрационный № AAB59394.1 в базе данных). В случае с использованием определенного изотипа антитела против GPC3 в качестве тестируемого вещества, антитело против GPC3, содержащее Fc-область, подлежащее тестированию, исследуют на предмет его эффекта связывающей активности против Fcγ-рецепторов посредством применения антитела против GPC3 определенного изотипа в качестве контроля. Соответственно выбирают антитело против GPC3, содержащее Fc-область, для которого, таким образом, подтверждается, что оно имеет более высокую связывающую активность против Fcγ-рецепторов.
[0111]
Fc-область, имеющая более высокую связывающую активность против активного Fcγ-рецептора, чем его связывающая активность против ингибиторного Fcγ-рецептора
Как описано выше, предпочтительные примеры активных Fcγ-рецепторов включают FcγRI (CD64), включая FcγRIa, FcγRIb и FcγRIc, FcγRIIa и FcγRIII (CD16) включая изоформы FcγRIIIa (включая аллотипы V158 и F158) и FcγRIIIb (включая аллотипы FcγRIIIb-NA1 и FcγRIIIb-NA2). Предпочтительные примеры ингибиторных Fcγ-рецепторов включают FcγRIIb (включая FcγRIIb-1 и FcγRIIb-2).
[0112]
В неограничивающем аспекте, альтернативные примеры антитела против GPC3 настоящего изобретения включают антитело против GPC3, содержащее Fc-область, имеющую более высокую связывающую активность против активных Fcγ-рецепторов, чем его связывающая активность против ингибиторных Fcγ-рецепторов. В этом случае фраза "имеющее более высокую связывающую активность против активных Fcγ-рецепторов, чем его связывающая активность против ингибиторных Fcγ-рецепторов" означает, что Fc-область имеет более высокую связывающую активность против любого из человеческих Fcγ-рецепторов FcγRIa, FcγRIIa, FcγRIIIa и/или FcγRIIIb, чем его связывающая активность против FcγRIIb. Фраза означает, что, например, на основании метода анализа, описанного выше, антигенсвязывающая молекула, содержащая Fc-область, проявляет 105% или более, предпочтительно 110% или более, 120% или более, 130% или более, или 140% или более, конкретно предпочтительно 150% или более, 160% или более, 170% или более, 180% или более, 190% или более, 200% или более, 250% или более, 300% или более, 350% или более, 400% или более, 450% или более, 500% или более, 750% или более, в 10 раз или более, 20 раз или более, 30 раз или более, 40 раз или более, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз или более высокую связывающую активность против любого из человеческих Fcγ-рецепторов FcγRIa, FcγRIIa, FcγRIIIa и/или FcγRIIIb в сравнении с его связывающей активностью против FcγRIIb. Известно, что IgG антитело, содержащее такую Fc-область, обладает усилением активности ADCC. Таким образом, антитело против GPC3, содержащее Fc-область, является применимым в качестве нацеленного на GPC3 лекарственного средства настоящего изобретения.
[0113]
В неограничивающем аспекте настоящего изобретения, примеры Fc-области, имеющей более высокую связывающую активность против активных Fcγ-рецепторов, чем его связывающая активность против ингибиторных Fcγ-рецепторов (имеющей селективную связывающую активность против активных Fcγ-рецепторов), предпочтительно включают Fc-области, в которых по меньшей мере одна или несколько аминокислот, выбранных из группы, состоящей из положения 221, положения 222, положения 223, положения 224, положения 225, положения 227, положения 228, положения 230, положения 231, положения 232, положения 233, положения 234, положения 235, положения 236, положения 237, положения 238, положения 239, положения 240, положения 241, положения 243, положения 244, положения 245, положения 246, положения 247, положения 249, положения 250, положения 251, положения 254, положения 255, положения 256, положения 258, положения 260, положения 262, положения 263, положения 264, положения 265, положения 266, положения 267, положения 268, положения 269, положения 270, положения 271, положения 272, положения 273, положения 274, положения 275, положения 276, положения 278, положения 279, положения 280, положения 281, положения 282, положения 283, положения 284, положения 285, положения 286, положения 288, положения 290, положения 291, положения 292, положения 293, положения 294, положения 295, положения 296, положения 297, положения 298, положения 299, положения 300, положения 301, положения 302, положения 303, положения 304, положения 305, положения 311, положения 313, положения 315, положения 317, положения 318, положения 320, положения 322, положения 323, положения 324, положения 325, положения 326, положения 327, положения 328, положения 329, положения 330, положения 331, положения 332, положения 333, положения 334, положения 335, положения 336, положения 337, положения 339, положения 376, положения 377, положения 378, положения 379, положения 380, положения 382, положения 385, положения 392, положения 396, положения 421, положения 427, положения 428, положения 429, положения 434, положения 436 и положения 440 (ЕU-нумерация) являются модифицированными до аминокислот, отличающихся от аминокислот в нативной Fc-области.
[0114]
В неограничивающем аспекте настоящего изобретения, дополнительные примеры Fc-области, имеющей более высокую связывающую активность против активных Fcγ-рецепторов, чем его связывающая активность против ингибиторных Fcγ-рецепторов (имеющей селективную связывающую активность против активных Fcγ-рецепторов), предпочтительно включают Fc-области, в которых множество аминокислот, описанных в таблицах 3-1 - 3-3 являются модифицированными до аминокислот, отличающихся от аминокислот в нативной Fc-области.
[0115]
Fc-область, имеющая модифицированную сахарную цепь
Fc-область, содержащаяся в антителе против GPC3, предоставленная настоящим изобретением, может также включать Fc-область, модифицированную так, что более высокая доля фукозо-дефицитных сахарных цепей связана с Fc-областью, или более высокая доля N-ацетилглюкозамина в точках ветвления является добавленной к Fc-области в композиции сахарных цепей, связанных с Fc-областью. Известно, что удаление остатка фукозы из N-ацетилглюкозамина по восстанавливающему концу N-гликозид-связанной комплексной сахарной цепи, связанной с Fc-областью антитела, усиливает ее аффинность для FcγRIIIa (Sato et al., Expert Opin. Biol. Ther. (2006) 6 (11), 1161-1173). Известно, что IgG1 антитело, содержащее такую Fc-область, обладает усилением активности ADCC. Таким образом, антигенсвязывающая молекула, содержащая Fc-область, является также применимой в качестве антигенсвязывающей молекулы, содержащейся в фармацевтической композици настоящего изобретения. Примеры антитела, в котором отсутствует остаток фукозы в N-ацетилглюкозамине по восстанавливающему концу N-гликозид-связанной комплексной сахарной цепи, связанной с Fc-областью антитела, включают следующие антитела:
гликозилированные антитела (например, международная публикация № WO1999/054342); и
антитела, лишенные фукозы, добавленной к сахарной цепи (например, международная публикация № WO2000/061739, WO2002/031140 и WO2006/067913).
Также WO2006/046751 и WO2009/041062 раскрывают конкретные примеры антитела против GPC3, содержащего Fc-область, модифицированную так, что более высокая доля фукозо-дефицитных сахарных цепей, связанных с Fc-областью, или более высокую долю N-ацетилглюкозамина в точках ветвления добавляют к Fc-области в композиции сахарных цепей, связанных с Fc-областью.
[0116]
Более конкретно, в альтернативном неограничивающем аспекте антитела, в котором отсутствует остаток фукозы в N-ацетилглюкозамине по восстанавливающему концу N-гликозид-связанной комплексной сахарной цепи, связанной с Fc-областью антитела, может быть получено антитело, лишенное фукозы, добавленной к сахарной цепи (например, международная публикация № WO2000/061739, WO2002/031140, и WO2006/067913). С этой целью, получают клетки-хозяева, в меньшей степени способные добавлять фукозу к сахарным цепям, как результат изменения активности образующих сахарную цепь структур полипептидов, которые подвергаются модификации сахарной цепи. Клеткам-хозяевам обеспечивают условия для экспрессии гена желательного антитела, и антитело, лишенное фукозы в его сахарной цепи может быть извлечено из культурального раствора клеток-хозяев. Неограничивающие предпочтительные примеры активности образующих сахарную цепь структур полипептидов могут включать активность фермента или транспортера, выбранного из группы, состоящей из фукозилтрансферазы (EC 2.4.1.152), транспортера фукозы (SLC35C1), ГТФ-маннозо-4,6-дегидратазы (ГМД) (EC 4.2.1.47), ГТФ-кето-6-дезоксиманнозо-3,5-эпимеразы/4-редуктазы (Fx) (EC 1.1.1.271), и ГДФ-β-L-фукозопирофосфорилазы (GFPP) (EC 2.7.7.30). Эти ферменты или транспортеры необязательно ограничены их структурами постольку, поскольку ферменты или транспортеры могут проявлять их активность. Эти белки, способные к проявлению такой активности, именуются функциональными белками в настоящем описании. В неограничивающем аспекте, примеры методов для изменения активности включают делецию активности. Клетки-хозяева, у которых отсутствует активность, могут быть получены посредством соответственно принятого метода, известного в данной области, такого как метод, который включает в себя разрушение генов этих функциональных белков, чтобы сделать гены нефункциональными (например, международная публикация № WO2000/061739, WO2002/031140 и WO2006/067913). Такие клетки-хозяева с отсутствием активности могут быть получены посредством, например, метода, который включает в себя разрушение эндогенных генов этих функциональных белков в клетках, таких как клетки CHO, клетки BHK, клетки NS0, SP2/0 клетки, клетки YO миеломы, клетки P3X63 мышиной миеломы, клетки PER, клетки PER.C6, клетки HEK293 или клетки гибридомы, чтобы сделать гены нефункциональными.
[0117]
Антитела, содержащие сахарные цепи, имеющие в точках ветвления GlcNAc (например, международная публикация № WO2002/079255), известны в данной области. В неограничивающем аспекте, клетки-хозяева, экспрессирующие гены, кодирующие функциональные белки, имеющие активность β-1,4-маннозил-гликопротеин-4-β-N-ацетилглюкозаминилтрансферазы (GnTIII) (EC 2.4.1.144) или активность β-1,4-галактозилтрансферазы (GalT) (EC 2.4.1.38) получают, чтобы получить такое антитело, содержащее сахарные цепи, имеющие в точках ветвления GlcNAc. В еще одном другом неограничивающем предпочтительном аспекте, получают клетки-хозяева, соэкспрессирующие ген, кодирующий функциональный белок, имеющий активность человеческой маннозидазы II (ManII) (3.2.1.114), ген, кодирующий функциональный белок, имеющий активность β-1,2-ацетилглюкозаминилтрансферазы I (GnTI) (EC 2.4.1.94), ген, кодирующий функциональный белок, имеющий активность β-1,2-ацетилглюкозаминилтрансферазы II (GnTII) (EC 2.4.1.143), ген, кодирующий функциональный белок, имеющий активность маннозидазы I (ManI) (EC 3.2.1.113), и ген α-1,6-фукозилтрансферазы (EC 2.4.1.68), в дополнение к функциональным белкам, описанным выше (Международная Публикация № WO2004/065540).
[0118]
Клетки-хозяева, в меньшей степени способные добавлять фукозу к сахарной цепи, и клетки-хозяева, имеющие активность образования сахарных цепей, имеющих в точках ветвления GlcNAc структуры, как описано выше, могут быть трансформированы с помощью векторов экспрессии, содержащих ген антитела, чтобы соответственно получить антитело, с отсутствием остатка фукозы в N-ацетилглюкозамине по восстанавливающему концу N-гликозид-связанной комплексной сахарной цепи, связанной с Fc-областью антитела, и антитело, содержащее сахарные цепи, имеющие в точках ветвления GlcNAc. Методы получения этих антител являются также применимыми к способу получения антигенсвязывающей молекулы, содержащей Fc-область, модифицированную так, что более высокая доля фукозо-дефицитных сахарных цепей является связанной с Fc-областью, или более высокую долю N-ацетилглюкозамина в точках ветвления добавляют к Fc-области в композиции сахарных цепей, связанных с Fc-областью настоящего изобретения. Композицию сахарных цепей, связанных с Fc-областью, содержащейся в антигенсвязывающей молекуле настоящего изобретения, полученной таким способом получения, можно подтвердить методом, описанном в параграфе "Fcγ-рецептор (FcγR)-связывающая модифицированная Fc-область".
[0119]
Антитело против GPC3, имеющее измененную изоэлектрическую точку
В неограничивающем аспекте, дополнительные примеры антитела против GPC3, которое может применяться в настоящем изобретении, включают антитело против GPC3, имеющее аминокислотный остаток, модифицированный, чтобы изменить его изоэлектрическую точку (pI). Предпочтительные примеры "изменения электрического заряда аминокислотного остатка" в антителе против GPC3, предоставленным настоящим изобретением, являются следующими: изменение, чтобы увеличить значение pI, может проводиться посредством, например, по меньшей мере одной замены, выбранной из замены Q на K по положению 43, замены D на N по положению 52 и замены Q на R по положению 105, на основании нумерации Кабат в вариабельной области тяжелой цепи антитела против GPC3, представленной SEQ ID NO: 50, которую последовательно модифицируют до, например, аминокислотной последовательности, представленной SEQ ID NO: 67. Также, это изменение может проводиться посредством, например, по меньшей мере одной замены, выбранной из замены E на Q по положению 17, замены Q на R по положению 27, и замены Q на R по положению 105 на основании нумерации Кабат в вариабельной области легкой цепи антитела против GPC3, представленной SEQ ID NO: 51 или 66, которую последовательно модифицируют до, например, аминокислотной последовательности, представленной SEQ ID NO: 68. С другой стороны, изменение, чтобы уменьшить значение pI, может проводиться посредством по меньшей мере одной замены, выбранной из замены K на T по положению 19, замены Q на E по положению 43, замены G на E по положению 61, замены K на S по положению 62, замены K на Q по положению 64 и замены G на D по положению 65 на основании нумерации Кабат в вариабельной области тяжелой цепи антитела против GPC3, представленной SEQ ID NO: 50, которую последовательно модифицируют до, например, аминокислотной последовательности, представленной SEQ ID NO: 69 или 71. Также, это изменение может проводиться посредством, например, по меньшей мере одной замены, выбранной из замены R на Q по положению 24, замены Q на E по положению 27, замены K на T по положению 74, замены R на S по положению 77 и замены K на E по положению 107 на основании нумерации Кабат в вариабельной области легкой цепи антитела против GPC3, представленной SEQ ID NO: 51 или 66, которые последовательно модифицируют до, например, аминокислотной последовательности, представленной SEQ ID NO: 70, 72 или 73. Дополнительные примеры изменения, чтобы уменьшить значение pI, включают замену по меньшей мере одной аминокислоты, выбранной из аминокислот 268, 274, 355, 356, 358 и 419 на основании EU-нумерации в константной области тяжелой цепи, представленной SEQ ID NO: 74. Предпочтительные примеры этих замен могут включать по меньшей мере одну замену, выбранную из замены H на Q по положению 268, замены K на Q по положению 274, замены R на Q по положению 355, замены D на E по положению 356, замены L на M по положению 358 и замены Q на E по положению 419, на основании EU-нумерации в константной области тяжелой цепи, представленной SEQ ID NO: 31. В результате этих замен, строится химера, имеющая константные области человеческого антитела IgG1 и IgG4. В особенности, эти замены могут давать на выходе антитело, имеющее желательный pI без оказания влияния на иммуногенность модифицированного антитела.
[0120]
Модификация, чтобы снизить гетерогенность
Константная область IgG, с отсутствием Gly по положению 446 и Lys по положению 447 на основании EU-нумерации в константной области IgG, представленной SEQ ID NO: 74, 75, 76 или 77, может также применяться как константная область, содержащаяся в антителе против GPC3 настоящего изобретения. Отсутствие обеих этих аминокислот может снизить гетерогенность, являющуюся производной конца константной области тяжелой цепи антитела.
[0121]
Модификация антитела
Посттрансляционная модификация полипептида относится к химической модификации, придаваемой полипептиду, транслируемому во время полипептидного биосинтеза. Поскольку первичная структура антитела составлена из полипептида, антитело против GPC3 настоящего изобретения также включает модифицированную форму, которая имеет полученную посттрансляционную модификацию полипептида, составляющего первичную структуру антитела против GPC3. Посттрансляционная модификация полипептида может широко классифицироваться на присоединение функциональной группы, присоединение полипептида или пептида (ISGилирование, SUMOилирование или убиквитинирование), конверсию химических свойств аминокислоты (силилирование, деаминирование или деамидирование), и структурную конверсию (дисульфидирование или деградацию протеазой). В неограничивающем аспекте, примеры посттрансляционной модификации в соответствии с настоящим изобретением включают присоединение пептида или функциональной группы к аминокислотному остатку в качестве блока, составляющего полипептид. Примеры такой модификации могут, в частности, включать фосфорилирование (серин, треонин, тирозин, аспарагиновая кислота и т.д.), глюкозилирование (серин, треонин, аспарагиновая кислота, и т.д.), ацилирование (лизин), ацетилирование (лизин), гидроксилирование (лизин и пролин), пренилирование (цистеин), пальмитоилирование (цистеин), алкилирование (лизин и аргинин), полиглутамилирование (глутаминовая кислота), карбоксилирование (глутаминовая кислота), полиглицилирование (глутаминовая кислота), цитруллинирование (аргинин), и образование сукцинимида (аспарагиновая кислота). Например, антитело против GPC3, которое имеет полученную модификацию N-концевого глутамина до пироглутаминовой кислоты посредством пироглутамилирования, также включают в антитело против GPC3 настоящего изобретения, как само собой разумеющееся. Также, например, посттрансляционно модифицированное антитело против GPC3, содержащее тяжелые и легкие цепи, или тяжелые цепи, связанные через "дисульфидную связь", которая означает ковалентную связь, образованную между двумя атомами серы, включают в антитело против GPC3 настоящего изобретения. Тиольная группа, содержащаяся в аминокислоте цистеине, может образовывать дисульфидную связь или сшивку со второй тиольной группой. В целых молекулах IgG области CH1 и CL связаны через дисульфидную связь, и два полипептида, составляющие тяжелые цепи, связаны через дисульфидную связь между остатками цистеина по положениям 226 и 229 на основании EU-нумерации. Посттрансляционно модифицированное антитело против GPC3, имеющее такое связывание через дисульфидную связь, также включают в антитело против GPC3 настоящего изобретения.
[0122]
Нацеленная на GPC3 лекарственная терапия
Термин "нацеленная на GPC3 лекарственная терапия" относится к введению нацеленного на GPC3 лекарственного средства пациенту.
[0123]
Фраза "эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования" или "нацеленная на GPC3 лекарственная терапия имеет эффективность действия для злокачественного новообразования" означает, что нацеленная на GPC3 лекарственная терапия производит желательные или благоприятные воздействия на пациента, которому диагностировано злокачественное новообразование. Желательные или благоприятные воздействия могут включать: (1) ингибирование дополнительных роста или диффузии опухолевых клеток; (2) уничтожение опухолевых клеток; (3) ингибирование рецидива злокачественного новообразования; (4) снятие, снижение, смягчение или ингибирование относящихся к раку симптомов (боли и т.д.) или снижение частоты проявления симптомов; и (5) улучшение коэффициента выживаемости пациента. Ингибирование рецидива злокачественного новообразования включает ингибирование роста злокачественного новообразования, уже подвергавшегося лечению посредством облучения, химиотерапии, хирургической операции или других методов, на первичном участке злокачественного новообразования и соседних с ним тканях, и отсутствие роста злокачественного новообразования на новом дистальном участке. Желательные или благоприятные эффекты могут субъективно восприниматься пациентом или могут быть объективно обнаружены. В случае, например, пациента-человека, человек способен распознать улучшение по энергии или жизненной активности или снижение боли как улучшение или чувствительный к терапии признак, воспринимаемый пациентом. Альтернативно, клиницист способен заметить уменьшение размера опухоли или количества опухолевых тканей на основании данных, полученных посредством медицинского осмотра, экспериментальных параметров, опухолевых маркеров или рентгенографии. Некоторые экспериментальные признаки, которые могут наблюдаться клиницистом в ответ на лечение, включают нормализованные результаты теста, например, лейкоцитарные формулы, количества эритроцитов, количества тромбоцитов, скорости оседания эритроцитов и уровни различных ферментов. Клиницист дополнительно способен наблюдать уменьшение обнаруживаемого уровня опухолевого маркера. Альтернативно, другие тесты, такие как ультразвуковое исследование, тест ядерного магнитного резонанса и позитронно-эмиссионный тест могут применяться для оценки объективного улучшения.
[0124]
Любое злокачественное новообразование, имеющее высокую экспрессию целевого GPC3, соответствует злокачественному новообразованию, подлежащему лечению посредством нацеленной на GPC3 лекарственной терапии настоящего изобретения. Один пример такого злокачественного новообразования включает рак, выбранный из рака молочной железы, рака шейки матки, рака толстой кишки, рака тела матки, рака шеи и головы, рака печени, рака легкого, злокачественного карциноида, злокачественной глиомы, злокачественной лимфомы, злокачественной меланомы, рака яичника, рака поджелудочной железы, рака простаты, рака почки, рака кожи, рака желудка, рака яичка, рака щитовидной железы, рака уротелия и т.п.
[0125]
Способ определения эффективности действия нацеленной на GPC3 лекарственной терапии или способ определения продолжения нацеленной на GPC3 лекарственной терапии
В неограничивающем аспекте, настоящее изобретение предоставляет способ, включающий мониторинг концентрации свободного GPC3 в биологическом образце, выделенном из пациента перед началом нацеленной на GPC3 лекарственной терапии и/или пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, в котором, когда концентрация свободного GPC3 имеет заранее определенное значение, определяют эффективность действия нацеленной на GPC3 лекарственной терапии или определяют продолжение терапии. "Пациент перед началом нацеленной на GPC3 лекарственной терапии" относится к пациенту, у которого диагностировано злокачественное новообразование, не имеющее истории введения нацеленного на GPC3 лекарственного средства. Пациент может являться пациентом, для которого эффективность действия нацеленной на GPC3 лекарственной терапии была определена, исходя из уровня экспрессии GPC3 в тканях. Дополнительно, "пациент, подвергаемый лечению с использованием нацеленной на GPC3 лекарственной терапии" относится к пациенту, имеющему историю введения нацеленного на GPC3 лекарственного средства. Путь введения нацеленного на GPC3 лекарственного средства может быть соответственно выбран из путей введения, подходящих для свойств и т.д., нацеленного на GPC3 лекарственного средства, подлежащего введению. Примеры пути введения включают парентеральное введение. Дополнительные примеры парентерального введения включают инъекцию, трансназальное введение, транспульмональное введение и чрескожное введение. Дополнительные примеры инъекции включают системное или местное введение на основе внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции и подкожной инъекции.
[0126]
Известные результаты, полученные посредством общепринятых методов перед завершением создания настоящего изобретения, показывают, что свободный GPC3, секретируемый в плазму посредством процессинга на конкретном участке в полипептидной последовательности GPC3 ферментом, таким как конвертаза, фосфолипаза D или Нотум, обнаруживается в плазме, выделенной из пациентов с раком печени, в то время как свободный GPC3 не обнаруживается в плазме, выделенной из здоровых индивидуумов (патентная литература 7 и т.д.). Исходя из таких результатов, ожидалось, что концентрация свободного GPC3, обнаруженная в сыворотке или плазме, снижается с течением времени вместе с продолжением лечения, если нацеленная на GPC3 лекарственная терапия имеет эффективность действия. В результате проведения тщательных исследований при таких обстоятельствах, неожиданно, авторы настоящего изобретения обнаружили, что концентрация свободного GPC3 стабилизируется или увеличивается, в большей степени, чем уменьшается, в сыворотке или плазме, выделенной из пациента со стабильным заболеванием, который может реагировать на нацеленную на GPC3 лекарственную терапию. Авторы настоящего изобретения также обнаружили, что, когда концентрация свободного GPC3, обнаруженная в сыворотке или плазме, перед введением нацеленной на GPC3 лекарственной терапии является равной или более высокой, чем заранее определенная концентрация, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0127]
В неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в биологическом образце, выделенном из пациента, в котором, когда концентрация имеет заранее определенное значение, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии. Заранее определенное значение может быть определено из конкретных значений, таких как 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл, 1,0 нг/мл, 2,0 нг/мл, 3,0 нг/мл, 4,0 нг/мл, 5,0 нг/мл, 6,0 нг/мл, 7,0 нг/мл, 8,0 нг/мл, 9,0 нг/мл, 10,0 нг/мл, 15,0 нг/мл, 20,0 нг/мл, 25,0 нг/мл, 30,0 нг/мл, 35,0 нг/мл, 40,0 нг/мл, 45,0 нг/мл, 50,0 нг/мл, 55,0 нг/мл, 60,0 нг/мл, 65,0 нг/мл, 70,0 нг/мл, 75,0 нг/мл, 80,0 нг/мл, 85,0 нг/мл, 90,0 нг/мл, 100,0 нг/мл, или может быть определено как числовой интервал, содержащий конкретные значения, условно выбранные в качестве верхнего и нижнего пределов из приведенной выше группы конкретных значений. Как пример, такой числовой интервал может быть соответственно выбран из числовых интервалов от 0,1 нг/мл до 100 нг/мл. Примеры числового интервала включают от 0,1 до 100 нг/мл, от 0,5 до 80 нг/мл, от 1,0 до 60 нг/мл, от 2,0 до 55 нг/мл, от 3,0 до 50 нг/мл, от 4,0 до 45 нг/мл, от 5,0 до 40 нг/мл, от 6,0 до 35 нг/мл, от 7,0 до 30 нг/мл, от 8,0 до 25 нг/мл, от 9,0 до 20 нг/мл и от 10 до 20 нг/мл. Числовой интервал составляет, например, предпочтительно от 0,1 до 0,35 нг/мл, более предпочтительно от 0,15 до 0,3 нг/мл, хотя числовой интервал настоящего изобретения не ограничивается этими интервалами. Заранее определенное значение концентрации свободного GPC3 может немного варьировать в зависимости от многих факторов, например, используемого метода анализа, типа образца для анализа на свободный GPC3, условий хранения (например, температуры и продолжительности) образца, и этнической принадлежности пациента. В способе предсказания, ожидания или определения эффективности действия или определения продолжения терапии, концентрацию в образце крови, плазме или сыворотки, выделенном из пациента, измеряют как концентрацию свободного GPC3.
[0128]
Концентрация свободного GPC3 может быть измерена в образце, выделенном до и/или после начала нацеленной на GPC3 лекарственной терапии, и может быть измерена в множестве образцов, собранных в заранее определенных временных интервалах. Когда концентрация свободного GPC3 в любом одном из множества образцов, собранных в заранее определенных временных интервалах, является заранее определенной концентрацией, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии. Заранее определенные интервалы времени устанавливают соответственно. В неограничивающем аспекте интервалов, образцы могут быть собраны при интервалах 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней (т.е. 1 неделя), 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней (т.е. 2 недели), 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 21 день (т.е. 3 недели), 22 дня, 23 дня, 24 дня, 25 дней, 26 дней, 27 дней, 28 дней (т.е. 4 недели), 29 дней, 30 дней, 1 месяц, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после первоначального введения нацеленного на GPC3 лекарственного средства, или в условных временных точках между стартом и завершением терапии, например, после 1, 2, 3, 4 или более циклов лечения. Интервалы дозирования, т.е. циклы лечения, могут быть установлены соответственно. Один их неограничивающих примеров включает 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней (т.е. 1 неделя), 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней (т.е. 2 недели), 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 21 день (т.е. 3 недели), 22 дня, 23 дня, 24 дня, 25 дней, 26 дней, 27 дней, 28 дней (т.е. 4 недели), 29 дней, 30 дней, 1 месяц, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев.
[0129]
В неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0130]
В неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют продолжение нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют продолжение нацеленной на GPC3 лекарственной терапии.
[0131]
В еще одном другом неограничивающем аспекте настоящего изобретения, концентрация свободного GPC3 может сравниваться с концентрацией свободного GPC3 ("исходной концентрацией"), измеренной в образце крови, плазмы или сыворотки, выделенным перед началом нацеленной на GPC3 лекарственной терапии из пациента. В этом аспекте "заранее определенное значение" концентрации свободного GPC3 означает, что концентрация свободного GPC3 в биологическом образце, выделенном из пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, является равной или более высокой, чем исходная концентрация. В особенности, когда концентрация свободного GPC3 после начала нацеленной на GPC3 лекарственной терапии равна или больше такой концентрации перед началом терапии у одного пациента, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии. Показатель, при котором концентрация свободного GPC3 после начала нацеленной на GPC3 лекарственной терапии равна или больше такой концентрации перед началом терапии, может быть соответственно выбрана специалистами в данной области и не ограничивается конкретным значением. Такой показатель может быть соответственно выбран из числового интервала от 1 раза до 106 раз. Когда показатель составляет, например, 1 раз или более, 1,05 раза или более, 1,1 раза или более, 1,2 раза или более, 1,3 раза или более, 1,4 раза или более, 1,5 раза или более, 1,6 раза или более, 1,7 раза или более, 1,8 раза или более, 1,9 раза или более, 2 раза или более, 2,1 раза или более, 2,2 раза или более, 2,3 раза или более, 2,4 раза или более, 2,5 раза или более, 2,6 раза или более, 2,7 раза или более, 2,8 раза или более, 2,9 раза или более, 3 раза или более, 3,1 раза или более, 3,2 раза или более, 3,3 раза или более, 3,4 раза или более, 3,5 раза или более, 3,6 раза или более, 3,7 раза или более, 3,8 раза или более, 3,9 раза или более, 4 раза или более, 4,1 раза или более, 4,2 раза или более, 4,3 раза или более, 4,4 раза или более, 4,5 раза или более, 4,6 раза или более, 4,7 раза или более, 4,8 раза или более, 4,9 раза или более, 5 раз или более, 5,1 раза или более, 5,2 раза или более, 5,3 раза или более, 5,4 раза или более, 5,5 раза или более, 5,6 раза или более, 5,7 раза или более, 5,8 раза или более, 5,9 раза или более, 6 раз или более, 6,1 раза или более, 6,2 раза или более, 6,3 раза или более, 6,4 раза или более, 6,5 раза или более, 6,6 раза или более, 6,7 раза или более, 6,8 раза или более, 6,9 раза или более, 7 раз или более, 7,1 раза или более, 7,2 раза или более, 7,3 раза или более, 7,4 раза или более, 7,5 раза или более, 7,6 раза или более, 7,7 раза или более, 7,8 раза или более, 7,9 раза или более, 8 раз или более, 8,1 раза или более, 8,2 раза или более, 8,3 раза или более, 8,4 раза или более, 8,5 раза или более, 8,6 раза или более, 8,7 раза или более, 8,8 раза или более, 8,9 раза или более, 9 раз или более, 9,1 раза или более, 9,2 раза или более, 9,3 раза или более, 9,4 раза или более, 9,5 раза или более, 9,6 раза или более, 9,7 раза или более, 9,8 раза или более, 9,9 раза или более, 10 раз или более, 11 раз или более, 12 раз или более, 13 раз или более, 14 раз или более, 15 раз или более, 16 раз или более, 17 раз или более, 18 раз или более, 19 раз или более, 20 раз или более, 21 раз или более, 22 раза или более, 23 раза или более, 24 раза или более, 25 раз или более, 26 раз или более, 27 раз или более, 28 раз или более, 29 раз или более, 30 раз или более, 31 раз или более, 32 раза или более, 33 раза или более, 34 раза или более, 35 раз или более, 36 раз или более, 37 раз или более, 38 раз или более, 39 раз или более, 40 раз или более, 41 раз или более, 42 раза или более, 43 раза или более, 44 раза или более, 45 раз или более, 46 раз или более, 47 раз или более, 48 раз или более, 49 раз или более, 50 раз или более, 55 раз или более, 60 раз или более, 65 раз или более, 70 раз или более, 75 раз или более, 80 раз или более, 85 раз или более, 90 раз или более, 95 раз или более, 100 раз или более, 105 раз или более, 110 раз или более, 120 раз или более, 130 раз или более, 140 раз или более, 150 раз или более, 160 раз или более, 170 раз или более, 180 раз или более, 190 раз или более, 200 раз или более, 220 раз или более, 240 раз или более, 260 раз или более, 280 раз или более, 300 раз или более, 320 раз или более, 340 раз или более, 360 раз или более, 380 раз или более, 400 раз или более, 420 раз или более, 440 раз или более, 460 раз или более, 480 раз или более, 500 раз или более, 550 раз или более, 600 раз или более, 650 раз или более, 700 раз или более, 750 раз или более, 800 раз или более, 850 раз или более, 900 раз или более, 950 раз или более, 1000 раз или более, 2000 раз или более, 3000 раз или более, 4000 раз или более, 5000 раз или более, 6000 раз или более, 7000 раз или более, 8000 раз или более, 9000 раз или более, 104 раз или более, 2×104 раз или более, 4×104 раз или более, 6×104 раз или более, 8×104 раз или более, 105 раз или более, 2×105 раз или более, 4×105 раз или более, 6×105 раз или более, 8×105 раз или более, или 106 раз или более, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии.
[0132]
В неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 превышает в от 1 раза или более до 106 раз или более исходную концентрацию, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0133]
Как описано выше, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В данной методике можно учитывать уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента. В особенности, когда концентрация свободного GPC3 у пациента равна или больше исходной концентрации, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, равен или больше конкретной балльной оценки, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 в от 1 раза или более до 106 раз или более превышает исходную концентрацию, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, равен или больше заранее определенной балльной оценки иммуногистохимического окрашивания, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0134]
В неограничивающем аспекте, примеры случая, где уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, равен или больше заранее определенной балльной оценки иммуногистохимического окрашивания, могут включать высокую экспрессию и низкую или умеренную экспрессию (общая балльная оценка IHC: 7 или выше и ниже чем 7, соответственно) в композитной балльной оценке, рассчитанной как результат окрашивания в соответствии с методом окрашивания 1. В неограничивающем аспекте, альтернативные примеры случая, где уровень экспрессии GPC3 равен или больше заранее определенной балльной оценки иммуногистохимического окрашивания, могут включать балльные оценки GPC3-IHC, равные 1+, 2+, и 3+, рассчитанные как результат окрашивания в соответствии с методом окрашивания 2.
[0135]
В неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют продолжение нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 в от 1 раза или более до 106 раз или более превышает исходную концентрацию, определяют продолжение нацеленной на GPC3 лекарственной терапии.
[0136]
Как описано выше, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют продолжение нацеленной на GPC3 лекарственной терапии. В данной методике можно учитывать уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента. В частности, когда концентрация свободного GPC3 у пациента равна или больше исходной концентрации, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, равен или больше конкретной балльной оценки, определяют продолжение нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, способ настоящего изобретения включает мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 в от 1 раза или более до 106 раз или более превышает исходную концентрацию, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, равен или больше заранее определенной балльной оценки иммуногистохимического окрашивания, определяют продолжение нацеленной на GPC3 лекарственной терапии.
[0137]
В неограничивающем аспекте, примеры случая, где уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, равен или больше заранее определенной балльной оценки иммуногистохимического окрашивания, могут включать высокую экспрессию и низкую или умеренную экспрессию (Общая балльная оценка IHC: 7 или выше и ниже чем 7, соответственно) в композитной балльной оценке, рассчитанной как результат окрашивания, в соответствии с методом окрашивания 1. В неограничивающем аспекте, альтернативные примеры случая, где уровень экспрессии GPC3 равен или больше заранее определенной балльной оценки иммуногистохимического окрашивания, могут включать балльные оценки GPC3-IHC, равные 1+, 2+ и 3+, рассчитанные как результат окрашивания в соответствии с методом окрашивания 2.
[0138]
Лекарственное средство и препарат
В настоящем изобретении лекарственное средство обычно относится к средству для лечения или предотвращения заболевания или для исследования или диагностики. В настоящем изобретении, фраза "нацеленное на GPC3 лекарственное средство, которое будет вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием перед началом нацеленной на GPC3 лекарственной терапии" может быть переведена в "способ лечения злокачественного новообразования, включающий введение нацеленного на GPC3 лекарственного средства пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием перед началом нацеленной на GPC3 лекарственной терапии" или может быть переведена в "применение нацеленного на GPC3 лекарственного средства, которое будет вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием перед началом нацеленной на GPC3 лекарственной терапии, для получения средства для лечения злокачественного новообразования". В настоящем изобретении фраза "нацеленное на GPC3 лекарственное средство, которое будет в дальнейшем вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии" может быть переведена в "способ лечения злокачественного новообразования, включающий дополнительное введение нацеленного на GPC3 лекарственного средства пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии" или может быть переведена в "применение нацеленного на GPC3 лекарственного средства, которое будет в дальнейшем вводиться пациенту со злокачественным новообразованием, имеющему заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии, для получения средства для лечения злокачественного новообразования". Фраза "имеющий заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии" может быть переведена во фразу "концентрация свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии, увеличилась в результате получения нацеленной на GPC3 лекарственной терапии".
[0139]
Лекарственное средство настоящего изобретения может быть составлено с использованием метода, общеизвестного специалистам в данной области. Например, лекарственное средство настоящего изобретения может парентерально применяться в форме инъекции в стерильном растворе или суспензии с водой или в любом другом фармацевтически приемлемом растворе. Например, активный ингредиент может быть соответственно комбинирован с фармакологически приемлемыми носителями или средой, в частности, стерильной водой или физиологическим раствором, растительным маслом, эмульгатором, суспендирующим средством, поверхностно-активным веществом, стабилизатором, ароматизатором, эксципиентом, носителем, антисептиком, связующим и т.п. и смешан с ними в единичную дозированную форму, требуемую для общепринятой фармацевтической практики, чтобы получить препараты. Количество активного ингредиента в этих препаратах устанавливают, чтобы обеспечить соответствующий объем в пределах предписанного интервала.
[0140]
Стерильные композиции для инъекции могут быть составлены в соответствии с обычной фармацевтической практикой с использованием носителя, такого как дистиллированная вода для инъекций. Примеры водных растворов для инъекций включают физиологический раствор и изотонические растворы, содержащие глюкозу или другие адъюванты (например, D-сорбит, D-маннозу, D-маннит и хлорид натрия). Соответствующий солюбилизатор, например, спирт (этанол и т.д.), полиспирт (пропиленгликоль, полиэтиленгликоль и т.д.), или неионное поверхностно-активное вещество (Полисорбат 80(TM), HCO-50, и т.д.) может применяться в комбинации с ними.
[0141]
Примеры масляных растворов включают кунжутное масло и соевое масло. Бензилбензоат и/или бензиловый спирт могут применяться в качестве солюбилизатора в комбинации с ними. Эти инъекционные растворы могут быть смешаны с буфером (например, раствором фосфатного буфера и раствором буфера ацетата натрия), успокоительным средством (например, прокаина гидрохлоридом), стабилизатором (например, бензиловым спиртом и фенолом) и антиоксидантом. Полученные инъекции обычно заправляют в соответствующие ампулы.
[0142]
Лекарственное средство настоящего изобретения предпочтительно вводят посредством парентерального введения. Например, лекарственное средство вводят в дозированной форме инъекции, трансназального средства, транспульмонального средства или чрескожного средства. Лекарственное средство может вводиться системно или местно посредством, например, внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции или подкожной инъекции.
[0143]
Способ введения может быть соответственно выбран в соответствии с возрастом и симптомами пациента. Однократная доза фармацевтического препарата, содержащего лекарственное средство, может быть установлена в пределах интервала, например, от 0,0001 мг до 1000 мг на кг массы тела. Альтернативно, доза может быть установлена до, например, от 0,001 до 100000 мг на пациента, хотя доза настоящего изобретения необязательно ограничивается этими числовыми значениями. Доза и способ введения варьируют в зависимости от массы тела, возраста, симптомов и т.д. пациента. Специалисты в данной области могут установить соответствующие дозу и способ введения с учетом этих условий. Как предпочтительный пример дозы и способа введения настоящего изобретения, лекарственное средство настоящего изобретения может вводиться, чтобы достичь остаточного уровня в крови, равного или более высокого, чем заранее определенный уровень у пациента. Предпочтительные примеры остаточного уровня в крови могут включать 150 мкг/мл или выше, 160 мкг/мл или выше, 170 мкг/мл или выше, 180 мкг/мл или выше, 190 мкг/мл или выше, 200 мкг/мл или выше, 210 мкг/мл или выше, 220 мкг/мл или выше, 230 мкг/мл или выше, 240 мкг/мл или выше, 250 мкг/мл или выше, 260 мкг/мл или выше, 270 мкг/мл или выше, 280 мкг/мл или выше, 290 мкг/мл или выше, 300 мкг/мл или выше и 400 мкг/мл или выше. Его более предпочтительные примеры могут включать 200 мкг/мл или выше.
[0144]
Препарат настоящего изобретения содержит инструкцию, утверждающую, что препарат будет в дальнейшем вводиться пациенту со злокачественным новообразованием, имеющим заранее определенное значение концентрации свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, препарат настоящего изобретения содержит инструкцию, утверждающую, что препарат будет в дальнейшем вводиться пациенту со злокачественным новообразованием, у которого концентрация свободного GPC3 в биологическом образце, выделенном из пациента со злокачественным новообразованием после начала нацеленной на GPC3 лекарственной терапии, увеличилась в результате получения нацеленной на GPC3 лекарственной терапии.
[0145]
В неограничивающем аспекте настоящее изобретение предоставляет препарат, содержащий инструкцию, утверждающую, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в биологическом образце, выделенном из пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, в котором, когда концентрация свободного GPC3 имеет заранее определенное значение, определяют эффективность действия нацеленной на GPC3 лекарственной терапии или определяют продолжение терапии.
[0146]
В неограничивающем аспекте настоящее изобретение предоставляет препарат, содержащий инструкцию, утверждающую, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в биологическом образце, выделенном из пациента, в котором, когда концентрация имеет заранее определенное значение, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии. Заранее определенное значение может быть определено из конкретных значений, таких как 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл, 1,0 нг/мл, 2,0 нг/мл, 3,0 нг/мл, 4,0 нг/мл, 5,0 нг/мл, 6,0 нг/мл, 7,0 нг/мл, 8,0 нг/мл, 9,0 нг/мл, 10,0 нг/мл, 15,0 нг/мл, 20,0 нг/мл, 25,0 нг/мл, 30,0 нг/мл, 35,0 нг/мл, 40,0 нг/мл, 45,0 нг/мл, 50,0 нг/мл, 55,0 нг/мл, 60,0 нг/мл, 65,0 нг/мл, 70,0 нг/мл, 75,0 нг/мл, 80,0 нг/мл, 85,0 нг/мл, 90,0 нг/мл, 100,0 нг/мл, или может быть определено как числовой интервал, содержащий конкретные значения, условно выбранные в качестве верхнего и нижнего пределов из приведенной выше группы конкретных значений. Как пример, такой числовой интервал может быть соответственно выбран из числовых интервалов от 0,1 нг/мл до 100 нг/мл. Примеры числового интервала включают 0,1-100 нг/мл, 0,5-80 нг/мл, 1,0-60 нг/мл, 2,0-55 нг/мл, 3,0-50 нг/мл, 4,0-45 нг/мл, 5,0-40 нг/мл, 6,0-35 нг/мл, 7,0-30 нг/мл, 8,0-25 нг/мл, 9,0-20 нг/мл, и 10-20 нг/мл. Числовой интервал составляет, например, предпочтительно 0,1-0,35 нг/мл, более предпочтительно 0,15-0,3 нг/мл, несмотря на то, что числовой интервал настоящего изобретения не ограничивается этими интервалами. Заранее определенное значение концентрации свободного GPC3 может немного варьировать в зависимости от многих факторов, например, используемого метода анализа, типа образца для анализа свободного GPC3, условий хранения (например, температуры и продолжительности) образца, и этнической принадлежности пациента. В способе предсказания, ожидания или определения эффективности действия или определения продолжения терапии, концентрацию в крови, плазме или образце сыворотки, выделенных из пациента, измеряют как концентрацию свободного GPC3.
[0147]
Концентрация свободного GPC3 может быть измерена в образце, выделенном до и/или после начала нацеленной на GPC3 лекарственной терапии, и может быть измерена во множестве образцов, собранных в заранее определенных интервалах времени. Когда концентрация свободного GPC3 в любом из множества образцов, собранных в заранее определенных интервалах времени, представляет собой заранее определенную концентрацию, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии. Заранее определенные интервалы времени, в которые образец собирают после начала нацеленной на GPC3 лекарственной терапии, устанавливают соответственно. В неограничивающем аспекте интервалов, образцы могут быть собраны, при интервалах, составляющих 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней (т.е. 1 неделю), 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней (т.е. 2 недели), 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 21 день (т.е. 3 недели), 22 дня, 23 дня, 24 дня, 25 дней, 26 дней, 27 дней, 28 дней (т.е. 4 недели), 29 дней, 30 дней, 1 месяц, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после первоначального введения нацеленного на GPC3 лекарственного средства, или в условных временных точках между началом и завершением терапии, например, после 1, 2, 3, 4 или нескольких циклов лечения. Интервалы дозирования, т.е. циклы лечения, могут быть соответственно установлены. Один неограничивающий его пример включает 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней (т.е. 1 неделю), 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней (т.е. 2 недели), 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 21 день (т.е. 3 недели), 22 дня, 23 дня, 24 дня, 25 дней, 26 дней, 27 дней, 28 дней (т.е. 4 недели), 29 дней, 30 дней, 1 месяц, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев.
[0148]
В неограничивающем аспекте, инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии от пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0149]
В неограничивающем аспекте инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют продолжение нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии, из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 находится в интервале от 0,1 нг/мл до 100 нг/мл, определяют продолжение нацеленной на GPC3 лекарственной терапии.
[0150]
В еще одном другом неограничивающем аспекте настоящего изобретения концентрацию свободного GPC3 можно сравнивать с концентрацией свободного GPC3 ("исходной концентрацией"), измеренной в крови, плазме или образце сыворотки, выделенных перед началом нацеленной на GPC3 лекарственной терапии из пациента. В этом аспекте "заранее определенное значение" концентрации свободного GPC3 означает, что концентрация свободного GPC3 в биологическом образце, выделенном из пациента, подвергаемого лечению с использованием нацеленной на GPC3 лекарственной терапии, равна или выше, чем исходная концентрация. Конкретно, когда концентрация свободного GPC3 после начала нацеленной на GPC3 лекарственной терапии является равной или большей, чем концентрация перед началом терапии у одного пациента, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжение терапии. Степень, при которой концентрация свободного GPC3 после начала нацеленной на GPC3 лекарственной терапии является равной или большей, чем концентрация перед началом терапии, может соответственно быть выбрана специалистами в данной области и не ограничена конкретным значением. Такая степень может быть соответственно выбрана из числового интервала от 1 раза до 106 раз. Когда степень составляет, например, 1 раз или более, 1,05 раза или более, 1,1 раза или более, 1,2 раза или более, 1,3 раза или более, 1,4 раза или более, 1,5 раза или более, 1,6 раза или более, 1,7 раза или более, 1,8 раза или более, 1,9 раза или более, 2 раза или более, 2,1 раза или более, 2,2 раза или более, 2,3 раза или более, 2,4 раза или более, 2,5 раза или более, 2,6 раза или более, 2,7 раза или более, 2,8 раза или более, 2,9 раза или более, 3 раза или более, 3,1 раза или более, 3,2 раза или более, 3,3 раза или более, 3,4 раза или более, 3,5 раза или более, 3,6 раза или более, 3,7 раза или более, 3,8 раза или более, 3,9 раза или более, 4 раза или более, 4,1 раза или более, 4,2 раза или более, 4,3 раза или более, 4,4 раза или более, 4,5 раза или более, 4,6 раза или более, 4,7 раза или более, 4,8 раза или более, 4,9 раза или более, 5 раз или более, 5,1 раза или более, 5,2 раза или более, 5,3 раза или более, 5,4 раза или более, 5,5 раза или более, 5,6 раза или более, 5,7 раза или более, 5,8 раза или более, 5,9 раза или более, 6 раз или более, 6,1 раза или более, 6,2 раза или более, 6,3 раза или более, 6,4 раза или более, 6,5 раза или более, 6,6 раза или более, 6,7 раза или более, 6,8 раза или более, 6,9 раза или более, 7 раз или более, 7,1 раза или более, 7,2 раза или более, 7,3 раза или более, 7,4 раза или более, 7,5 раза или более, 7,6 раза или более, 7,7 раза или более, 7,8 раза или более, 7,9 раза или более, 8 раз или более, 8,1 раза или более, 8,2 раза или более, 8,3 раза или более, 8,4 раза или более, 8,5 раза или более, 8,6 раза или более, 8,7 раза или более, 8,8 раза или более, 8,9 раза или более, 9 раз или более, 9,1 раза или более, 9,2 раза или более, 9,3 раза или более, 9,4 раза или более, 9,5 раза или более, 9,6 раза или более, 9,7 раза или более, 9,8 раза или более, 9,9 раза или более, 10 раз или более, 11 раз или более, 12 раз или более, 13 раз или более, 14 раз или более, 15 раз или более, 16 раз или более, 17 раз или более, 18 раз или более, 19 раз или более, 20 раз или более, 21 раз или более, 22 раза или более, 23 раза или более, 24 раза или более, 25 раз или более, 26 раз или более, 27 раз или более, 28 раз или более, 29 раз или более, 30 раз или более, 31 раз или более, 32 раза или более, 33 раза или более, 34 раза или более, 35 раз или более, 36 раз или более, 37 раз или более, 38 раз или более, 39 раз или более, 40 раз или более, 41 раз или более, 42 раза или более, 43 раза или более, 44 раза или более, 45 раз или более, 46 раз или более, 47 раз или более, 48 раз или более, 49 раза или более, 50 раз или более, 55 раз или более, 60 раз или более, 65 раз или более, 70 раз или более, 75 раз или более, 80 раз или более, 85 раз или более, 90 раз или более, 95 раз или более, 100 раз или более, 105 раз или более, 110 раз или более, 120 раз или более, 130 раз или более, 140 раз или более, 150 раз или более, 160 раз или более, 170 раз или более, 180 раз или более, 190 раз или более, 200 раз или более, 220 раз или более, 240 раз или более, 260 раз или более, 280 раз или более, 300 раз или более, 320 раз или более, 340 раз или более, 360 раз или более, 380 раз или более, 400 раз или более, 420 раз или более, 440 раз или более, 460 раз или более, 480 раз или более, 500 раз или более, 550 раз или более, 600 раз или более, 650 раз или более, 700 раз или более, 750 раз или более, 800 раз или более, 850 раз или более, 900 раз или более, 950 раз или более, 1000 раз или более, 2000 раз или более, 3000 раз или более, 4000 раз или более, 5000 раз или более, 6000 раз или более, 7000 раз или более, 8000 раз или более, 9000 раз или более, 104 раз или более, 2×104 раз или более, 4×104 раз или более, 6×104 раз или более, 8×104 раз или более, 105 раз или более, 2×105 раз или более, 4×105 раз или более, 6×105 раз или более, 8×105 раз или более, или 106 раз или более, эффективность действия нацеленной на GPC3 лекарственной терапии злокачественного новообразования у пациента предсказывают, ожидают или определяют, или определяют продолжительности терапии.
[0151]
В неограничивающем аспекте инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии от пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 является в 1 раз или более до 106 раз или более исходной концентрации, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0152]
Как описано выше, инструкция утверждает, что, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В этом случае инструкция может утверждать, что уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента также учитывают. Конкретно, инструкция может утверждать, что, когда концентрация свободного GPC3 у пациента равна или больше исходной концентрации, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента является равным или большим, чем конкретная оценка в баллах, определяют эффективность действия нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, инструкция может утверждать, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 является от 1 раза или более до 106 раз или более больше исходной концентрации и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, является равным или больше, чем заранее определенная балльная оценка иммуногистохимического окрашивания, определяют эффективность действия нацеленной на GPC3 лекарственной терапии.
[0153]
В неограничивающем аспекте примеры случая, где уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, является равным или большим, чем заранее определенная балльная оценка иммуногистохимического окрашивания, могут включать высокую экспрессию и низкую или умеренную экспрессию (общая балльная оценка IHC: 7 или выше и ниже чем 7, соответственно) в композитной балльной оценке, рассчитанной как результат окрашивания в соответствии с методом окрашивания 1. В неограничивающем аспекте, альтернативные примеры случая, где уровень экспрессии GPC3 является равным или большим, чем заранее определенная балльная оценка иммуногистохимического окрашивания могут включать балльные оценки GPC3-IHC, равные 1+, 2+ и 3+, рассчитанные как результат окрашивания в соответствии с методом окрашивания 2.
[0154]
В неограничивающем аспекте, инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 30 дней или 1 месяц после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют продолжение нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, инструкция утверждает, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 в 1 раз или более до 106 раз или более больше, чем исходная концентрация, определяют продолжение нацеленной на GPC3 лекарственной терапии.
[0155]
Как описано выше, инструкция утверждает, что, когда концентрация свободного GPC3 равна или больше исходной концентрации, определяют продолжение нацеленной на GPC3 лекарственной терапии. В этом случае в инструкции может утверждаться, что уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, также учитывается. В особенности, в инструкции может утверждаться, что, когда концентрация свободного GPC3 у пациента равна или больше исходной концентрации, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, является равной или большей, чем конкретная балльная оценка, определяют продолжение нацеленной на GPC3 лекарственной терапии. В еще одном другом неограничивающем аспекте, в инструкции может утверждаться, что пациента выбирают на основании метода, включающего мониторинг концентрации свободного GPC3 в крови, плазме или сыворотке, выделенных через 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев после начала нацеленной на GPC3 лекарственной терапии из пациента, проходящего лечение терапией, в котором, когда концентрация свободного GPC3 в 1 раз или более до 106 раз или более, чем исходная концентрация, и уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, является равной или большей, чем заранее определенная балльная оценка иммуногистохимического окрашивания, определяют продолжение нацеленной на GPC3 лекарственной терапии.
[0156]
В неограничивающем аспекте примеры случая, где уровень экспрессии GPC3 в ткани, конкретно ткани злокачественного новообразования (включая ткань рака печени), выделенной из пациента, является равной или большей, чем заранее определенная балльная оценка иммуногистохимического окрашивания, могут включать высокую экспрессию и низкую или умеренную экспрессию (общая балльная оценка IHC: 7 или выше и ниже чем 7, соответственно) в композитной балльной оценке, рассчитанной как результат окрашивания в соответствии с методом окрашивания 1. В неограничивающем аспекте, альтернативные примеры случая, где уровень экспрессии GPC3 является равным или большим, чем заранее определенная балльная оценка иммуногистохимического окрашивания, могут включать балльные оценки GPC3-IHC, равные 1+, 2+ и 3+, рассчитанные как результат окрашивания в соответствии с методом окрашивания 2.
[0157]
Далее в настоящем документе настоящее изобретение будет описано в особенности со ссылкой на примеры. Однако настоящее изобретение не ограничивается этими примерами.
[Пример 1]
[0158]
GC33 представляет собой рекомбинантное гуманизированное IgG1 моноклональное антитело, способное к связыванию человеческого GPC3 с высокой аффинностью (WO2006/006693). Чтобы подтвердить дозолимитирующую токсичность (DLT) GC33 у пациентов с распространенным и/или рецидивирующим гепатоцеллюлярным раком (ГЦР), проводили фазу-I многоцентрового клинического испытания (тест GC-001US). В этом тесте, направленном на подтверждение безопасности и/или переносимость у пациентов с распространенным и/или рецидивирующим HCC, фармакокинетические профили GC33, и его противоопухолевые эффекты, и поиск биомаркеров, GC33 (от 2,5 мг/кг до 20 мг/кг) вводили посредством инъекции через внутривенное вливание каждому пациенту с ГЦР один раз в неделю.
[0159]
Пациенты с ГЦР, подвергаемые введению, имели гистологически или цитологически подтвержденный распространенный или метастатический ГЦР, не подлежащий хирургической операции и/или радикальному лечению. Подходящие пациенты имели по меньшей мере 18-летний возраст и проявляли показатель общего состояния, равный 0 или 1, по классификации Восточной объединенной онкологической группы, и класс А или B по шкале Чайлд-Пью. Пациенты также имели по меньшей мере одно повреждение, которое было оцениваемым в соответствии с критериями оценки ответа при солидных опухолях (RECIST). Предоставление опухолевых тканей ГЦР (препараты пункционной биопсии) для применения при иммуногистохимическом окрашивании GPC3 (GPC3-IHC), соответствующие гематопоэтические функции (абсолютное число нейтрофилов ≥1500/мкл, тромбоциты ≥50000/мкл), функции печени (общий билирубин ≤3 раза нормального уровня, аспартатаминотрансфераза и аланинаминотрансфераза ≤5 раз нормального уровня, PT-INR ≤2,0), и функции почек (сывороточный креатинин ≤ двойного нормального уровня), оценивали как другие критерии. Регистрируемые субъекты исключали беременных, кормящих грудью или имеющих положительный тест на беременность (женщины, перенесшие менструацию в интервале 12 месяцев от даты регистрации были подвергнуты тесту на беременность) пациентов, пациентов, которые не планировали применять соответствующее регулирование рождаемости, пациентов с положительной реакцией на антитела к ВИЧ, пациентов, имеющих активную инфекцию, требующую лечение за исключением HBV или HCV, пациентов имеющих другие активные злокачественные опухоли с интервалом без заболевания короче, чем 5 лет, пациентов, имеющих прошлую историю трансплантации, пациентов с подтвержденными симптомами метастазов в мозге, пациентов, имеющих расстройство центральной нервной системы или другие психические заболевания, которые препятствуют согласию или пониманию протокола, пациентов, которые представляли симптомы центральной нервной системы, относимые к печеночной энцефалопатии, и пациентов, которые проявляли известную гиперчувствительность к другим лекарственным средствам на основе антител или фармацевтическим средствам, полученным с использованием клеток CHO. Альтернативно, пациенты, которые получали лечение, включая основную хирургическую операцию, лучевую терапию и другие химиотерапии в пределах 4 недель перед введением нацеленного на GPC3 лекарственного средства, пациенты, которые получали лечение сорафенибом в пределах 2 недель перед введением, или пациенты, которые получали пункционную биопсию в пределах 1 недели перед введением, были исключены из субъектов, зарегистрированных для прохождения нацеленной на GPC3 лекарственной терапии, но были подвергнуты GPC3-нацеленному лечению после заранее определенного периода отмывки. Протокол проводился в соответствии с руководством по Надлежащей клинической практике (GCP) и был одобрен каждым участником комиссии по этике при проведении клинических испытаний. Все пациенты подписали письменное информированное согласие перед регистрацией. Пациенты получали непрерывное введение GC33 (каждый цикл включал в себя четыре дозы GC33), за исключением тех случаев, когда болезнь прогрессировала или появлялась неприемлемая токсичность. Опухоль оценивали на основании исходного уровня и повторно оценивали каждые два цикла, пока болезнь прогрессировала. Течение заболевания подвергалось оценке руководителями клинических испытаний.
[0160]
Экспрессию белков GPC3 в опухолевых тканях ГЦР оценивали посредством иммуногистохимического окрашивания GPC3 (GPC3-IHC). Медианное измерение GPC3-IHC выполняли в Charles River Laboratory (USA). Неокрашенные слайды опухолевых тканей ГСР, полученных из опухолевых блоков, фиксированных в формалине и погруженных в парафин после иссечения при пункционной биопсии, в каждой больнице были подвергнуты иммуногистохимическому окрашиванию. Подход с гистохимическим окрашиванием, такой как демаскировка эпитопа для измерения в Charles River Laboratory (USA), осуществляли в соответствии с методом, описанном в WO2009/116659. Применяемые антитела представляли собой мышиное антитело GC33 и мышиное антитело IgG2a в качестве антитела для отрицательного контроля (WO2006/006693).
[0161]
Что касается GPC3-IHC (метода окрашивания 1), выполняемого в Charles River Laboratory, относительные балльные оценки положительного клеточного показателя (PR), интенсивности окрашивания цитоплазмы (SI-cp) или интенсивности окрашивания клеточной мембраны (SI-cm), и схему окрашивания клеточной мембраны (Sp-cm) рассчитывали в соответствии с критериями, показанными в таблице 4, и дополняли на основании расчетных выражений 1 и 2, чтобы оценить каждый окрашенный препарат. Оценку каждого окрашенного препарата завершали на совещании по независимому рассмотрению с участием трех патоморфологов.
[0162]
|
[0163]
[Выражение 3]
IHC полная = PR + SI-Cp + SI-Cm + Sp-Cm
[0164]
В одном из 20 случаев, которые были зарегистрированы для участия в данном тесте и получили введение, не удалось получить препарат, и 3 случая не содержали опухолевых клеток, достаточных для оценки. В конечном счете, 16 случаев можно было оценивать. Эти случаи были разделены на две группы на основании общей балльной оценки IHC около 7, которая составляла половину максимального значения (14) при окрашивании на основании демаскировки эпитопа с использованием автоклавирования. Результаты оценки каждого случая показаны в таблице 5 и на фиг. 1.
[0165]
|
[Пример 2]
[0166]
Противоопухолевые эффекты оценивали посредством введения GC33 при GPC3-направленном лечении. Продолжительности введения GC33 в 20 случаях, как описано выше, показаны на фиг. 2. Как результат оценки состояния заболевания, 5-месячная или более длительная стабилизация заболевания (SD) была подтверждена в 4 случаях.
[0167]
Экспрессию GPC3 в опухолевых тканях исследовали по ее отношению к противоопухолевым эффектам GC33. Как результат, показывающий отношение общих балльных оценок IHC для 16 случаев, оцениваемых GPC3-IHC, к продолжительности введения, все случаи, подтвержденные как имеющие SD через 5-месячный или более длительный период, были включены в группу с высоким значением, когда 16 случаев были разделены на две группы (с общей балльной оценкой IHC, равной 7 или выше, и с общей балльной оценкой IHC ниже, чем 7). В дополнение, полученные результаты показали, что процентная доля случаев с длительным периодом SD в группе с высоким значением была также высокой (таблица 6).
[0168]
|
[0169]
Далее, продолжительность выживаемости без прогрессирования заболевания или выживаемость без прогрессирования заболевания (PFS) сравнивали между группой с общей балльной оценкой IHC, равной 7 или выше, и группой с общей балльной оценкой IHC ниже 7. Результаты показали, что группа с общей балльной оценкой IHC, равной 7 или выше, имела существенно более длительную PFS (фиг. 3).
[0170]
Некоторые из опухолевых образцов, оцениваемых таким образом, использовали при дополнительной оценке GPC3-IHC. Медианное измерение окрашивания препаратов, полученных от 14 случаев, выполнялось Ventana Medical Systems, Inc. (USA) в соответствии с инструкцией, приложенной к мышиному GC33 моноклональному первичному антителу против глипикана 3 (Ventana Medical Systems, Inc.) с использованием устройства для автоматизированного окрашивания BenchMark (производимого Ventana Medical Systems, Inc.). При GPC3-IHC (методе окрашивания 2), проводимом Ventana Medical Systems, Inc., препараты окрашивали в соответствии с приложенной инструкцией и затем оценивали в баллах по 4 шкалам от 0 до 3+ с точки зрения степени, интенсивности и т.д. окрашивания в опухолевых клетках. Как результат, было получено распределение, показанное в таблице 7.
[0171]
|
[0172]
При методе окрашивания 2, случаи, проявляющие SD с длительным периодом, были включены при высоком проценте и без какого-либо пропуска в 2+/3+-группу, когда случаи были разделены на две группы (с балльной оценкой, равной 0 и 1+ и с балльной оценкой, равной 2+ и 3+) (таблица 8).
[0173]
|
[Пример 3]
[0174]
Концентрацию свободного GPC3 измеряли в сыворотке пациентов, которые получали введение GC33 при GPC3-нацеленном лечении. Каждое из мышиных моноклональных антител против GPC3, M3C11 и L9G11 (WO2004/022739), разбавляли до 7,5 мкг/мл иммобилизующим буфером (0,05 моль/л бикарбоната натрия, pH 9,6), и затем распределяли в планшет при концентрации, равной 100 мкл/лунку. Затем планшет оставляли отстаиваться при комнатной температуре в течение 1 часа. Каждую лунку промывали три раза промывочным буфером (0,05 моль/л трис-забуференный физраствор, pH 8,0, 0,05% Твин-20). Затем блокирующий буфер (25 ммоль/л трис-HCl буфер, pH 8,1, 0,5 ммоль/л хлорида магния, 72 ммоль/л хлорида натрия, 0,05% ProClin 150, 5 мг/мл альбумина бычьей сыворотки, 0,025% Твин-20, 1% Block Ace) распределяли в планшет при концентрации, равной 200 мкл/лунку. Планшет оставляли отстаиваться при комнатной температуре в течение 2 часов для получения планшета с иммобилизованным антителом. Если планшет не использовали немедленно, планшет хранили при 4°C и затем использовали при измерении.
[0175]
Сыворотку каждого пациента, собранную при клиническом испытании, разбавляли 4х-кратно разбавляющим буфером (25 ммоль/л трис-HCl буфер, pH 8,1, 0,5 ммоль/л хлорида магния, 72 ммоль/л хлорида натрия, 0,05% ProClin 150, 5 мг/мл альбумина бычьей сыворотки, 0,025% Твин-20, 0,4% Block Ace) и добавляли в планшет при концентрации, равной 100 мкл/лунку. Планшет оставляли отстаиваться в течение ночи при 4°C. Используемое стандартное GPC3 представляло собой рекомбинантное GPC3 с остатками серина по положениям 495 и 509, замененными на остатки аланина, таким образом, чтобы не позволить осуществиться связыванию сахарных цепей гепарансульфата (Hippo et al., Cancer Res. (2004) 64, 2418-2423).
[0176]
Последовательно каждую лунку планшета промывали три раза промывочным буфером, и биотин-меченное поликлональное антитело против глипикана-3 (производимое R&D Systems, Inc.), разбавленное до 0,3 мкг/мл разбавляющим буфером, добавляли в планшет при концентрации, равной 100 мкл/лунку. Планшет дополнительно оставляли отстаиваться при 25°C в течение 1 часа, и каждую лунку промывали три раза промывочным буфером. Затем HRP-меченый стрептавидин (Streptavidin-Poly HRP80; производимый Stereospecific Detection Technologies (SDT)), разбавленный разбавляющим буфером в соответствии с инструкцией, добавляли в планшет при концентрации, равной 100 мкл/лунку. Планшет оставляли отстаиваться при 25°C в течение 1 часа. Затем каждую лунку планшета промывали три раза промывочным буфером. Затем проявляли цвет с использованием TMB Микролуночной Субстратной Системы Пероксидазы (производимой Kirkegaard & Perry Laboratories Inc.) в соответствии с инструкцией, приложенной к набору. Поглощение раствора реакции в каждой лунке измеряли при 450 нм и 650 нм. Калибровочную кривую, полученную на основании стандартного образца, содержащего рекомбинантное GPC3, применяли для расчета уровня антигена GPC3 в сыворотке каждого пациента по полученному поглощению каждой лунки.
[Пример 4]
[0177]
Изменение сывороточной концентрации обнаруженного свободного GPC3, рассчитанное в примере 3, показано на фиг. 4 для двух групп, т.е. группы с высоким значением и группы с низким значением балльных оценок GPC3-IHC опухолевой ткани, определенных в примере 2. Большое число случаев с измеряемым уровнем свободного GPC3 было включено в группу, оцениваемую, как имеющую высокую экспрессию GPC3 на основании балльной оценки GPC3-IHC (фиг. 4A). Повышение концентрации свободного GPC3 или ее стабилизацию наблюдали в случаях, проявляющих длительную SD. Напротив, малое число случаев с измеряемым уровнем свободного GPC3 включали в группу, оцениваемую, как имеющую низкую экспрессию GPC3 или являющуюся отрицательной на основании балльной оценки GPC3-IHC (фиг. 4B).
[0178]
Продолжительность выживаемости без прогрессирования заболевания или выживаемость без прогрессирования заболевания (PFS) сравнивали между группой, имеющей измеряемый уровень GPC3 в сыворотке, собранной во время скрининга или до первоначального введения (GPC3-положительная группа), и группой с уровнем GPC3 ниже предела обнаружения. Было подтверждено, что PFS сывороточной GPC3-положительной группы до практического применения GPC3-нацеленного лечения была более длительной, чем для отрицательной группы (фиг. 5A). Тест с логранговым критерием дополнительно проводили, если группа с GPC3-положительной сывороткой включала сыворотку, в которой сывороточный GPC3 измеряли после начала введения нацеленного на GPC3 лекарственного средства. Результаты теста показали, что PFS этой группы была значительно более длительной, чем у отрицательной группы (случаи с уровнем GPC3 ниже предела измерения, независимо от того, до или после введения нацеленного на GPC3 лекарственного средства) и положительной группы (фиг. 5B).
[Пример 5]
[0179]
Как показано в таблицах 9 и 10, сывороточные GPC3-положительные группы с высоким значением балльных оценок GPC3-IHC, оцененные с использованием метода окрашивания 1 и метода окрашивания 2 имеют более высокий процент длительной SD, чем группы с высокими значениями балльных оценок GPC3-IHC (таблицы 6 и 8-10).
[0180]
|
[0181]
|
[Пример 6]
[0182]
При клиническом испытании, дополнительные 7 случаев (один из которых оценивали как имеющий общую балльную оценку IHC, равную 6 в результате конечной оценки) были дополнительно зарегистрированы как случаи, имеющие общую балльную оценку IHC, равную 7 или выше, в GPC3-IHC на основании результатов метода окрашивания 1 и балльной оценки A по Чайлд-Пью. Их сывороточные уровни GPC3 измеряли в соответствии с методом примера 3. Всего 27 случаев, которые получали введение нацеленного на GPC3 лекарственного средства, оценивали на предмет их PFS таким же образом, как в примере 4. Отношение сывороточных уровней GPC3 к PFS в этих случаях исследовали с использованием логрангового критерия. Результаты теста показали, что как PFS группы, имеющей измеряемый уровень сывороточного GPC3 перед введением (фиг. 6A), так и PFS группы, имеющий измеряемый уровень сывороточный GPC3 либо до, либо после введения (фиг. 6B), были значительно более длительными, чем у группы, с сывороточным уровнем GPC3 ниже предела измерения.
[Пример 7]
[0183]
Чтобы подтвердить эффективность действия и безопасность GC33 у пациентов с распространенным и/или рецидивирующим гепатоцеллюлярным раком (ГЦР), проводили фазу-II многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического испытания, которая включала в себя введение 1600 мг GC33 каждые две недели (NP27884 study), нацеленную на взрослых пациентов с неоперабельным распространенным или метастатическим гепатоцеллюлярным раком, имеющих прошлую историю лечения. Этих пациентов рандомизировали в GC33-группу (фиксированную дозу 1600 мг вводили каждые две недели после введения двух доз с 1-недельным интервалом; n=121 случай) или плацебо-группу (n=60 случаев) при отношении, равном 2:1, и стратифицировали в 3 когорты на основе уровней экспрессии (0, 1+, и 2+/3+) посредством IHC окрашивания с использованием GPC3-IHC-набора (производимого Ventana Medical Sistems, Inc.). Первичный анализ проводили во время регистрации событий выживаемости без прогрессирования заболевания (PFS) в 128 случаях, запланированных в протоколе.
[0184]
Пациенты с ГЦР, подвергнутые введению, имели гистологически подтвержденный распространенный или метастатический ГЦР (за исключением фиброламеллярного типа), неподходящей для радикального лечения (хирургической резекции, трансплантации печени и т.д.) и/или местного лечения, или истощенные после лечения и имевшие прошлую историю лечения на основе системной терапии с использованием по меньшей мере одного средства. Подходящие для участия в исследовании пациенты имели по меньшей мере 18-летний возраст со способностью предоставления образца опухоли для анализа на GPC3 и проявляли показатель общего состояния, равный 0 или 1, по классификации Восточной объединенной онкологической группы и класс А или B по шкале Чайлд-Пью. Пациенты также имели по меньшей мере одно повреждение, которое было оцениваемым в соответствии с критериями оценки ответа при солидных опухолях (RECIST). Соответствующие гематопоэтические функции (абсолютное число нейтрофилов ≥1500/мкл, тромбоциты ≥50000/мкл, гемоглобин ≥8,0 г/дл), функции печени (общий билирубин ≤2 мг/дл, аспартатаминотрансфераза и аланинаминотрансфераза ≤5 раз верхнего предела нормального уровня), и функции почек (сывороточный креатинин ≤ двойного верхнего предела нормального уровня) оценивали как другие критерии. Регистрируемые субъекты женского пола представляли собой женщин-пациентов предклимактерического возраста с подтвержденным отрицательным результатом теста сыворотки на беременность, проведенного в пределах 10 дней перед началом введения исследуемого лекарственного средства, женщин без возможности для беременности в результате хирургической контрацепции или после отклонения в 1 год или более после менопаузы, и женщины-пациенты, отличающиеся от женщин постклимактерического возраста (12 месяцев или более или с отсутствием менструации) или женщины после хирургической контрацепции (резекция яичника и/или матки), которые дали согласие на применение двух типов, подходящих для методов регулирования рождаемости во время лечения при клиническом испытании и в течение по меньшей мере 3 месяцев или более после завершения введения исследуемого лекарственного средства. Регистрируемые субъекты мужского пола представляли собой пациентов, которые дали согласие на применение регулирования рождаемости на основании барьерного метода во время лечения при клиническом испытании и в течение по меньшей мере 40 дней после завершения введения исследуемого лекарственного средства. С другой стороны, регистрируемые субъекты исключали пациентов, которые получали основную хирургическую операцию в пределах 2 недель перед введением нацеленного на GPC3 лекарственного средства или не пришли в себя после тяжелого расстройства, пациентов с подтвержденными метастазами в мозге или лептоменингеальными метастазами, пациентов, имеющих прошлую историю злокачественной опухоли в интервале последних 5 лет, пациентов, имеющих активную инфекцию, требующую лечения за исключением гепатита B или гепатита C, пациентов, имеющих прошлую историю кровоизлияния NCI-CTCAE v4.0 Степень 3 или выше в интервале 4 недель перед началом введения исследуемого лекарственного средства, пациентов, имеющих прошлую историю трансплантации органов, включая трансплантацию печени, пациентов, которые включены в план приема или получали введение противоопухолевого средства, отличающегося от средства, подлежащего введению в данном тесте, пациентов, которые получали введение противоопухолевого средства в интервале 2 недель перед регистрацией для участия в испытании, пациентов которые окончательно не оправились от нежелательных реакций, ассоциированных с предшествующей местно-регионарной или системной терапией гепатоцеллюлярного рака, пациентов, проходящих терапию интерфероном, пациентов, которые имели исходный QTc, превышающий 470 мс, или проявляли исходную брадикардию покоя (менее чем 45 ударов/мин), пациентов, которые получали введение антикоагулянта или тромболитического средства для терапевтических целей в интервале 2 недель перед началом введения исследуемого лекарственного средства (за исключением введения средства при низкой дозе с целью удаления закупорок в катетере или в профилактических целях), беременных или кормящих грудью пациентов, ВИЧ-положительных пациентов или пациентов, имеющих заболевание, относящееся к СПИД, пациентов, имеющих прошлую историю гиперчувствительности к аналогичным средствам (моноклональным антителам, белоксодержащим препаратам и препаратам, полученным из яичника китайских хомяков), и пациентов, имеющих серьезное сопутствующее заболевание по заключению руководителя испытания или соисследователя, как имеющих возможность ухудшения состояния вследствие исследуемого лекарственного средства.
[0185]
Протокол выполнялся в соответствии с руководством по Надлежащей клинической практике (GCP) и был одобрен каждым участником комиссии по этике при проведении клинических испытаний. Все пациенты подписали письменное информированное согласие перед регистрацией. Пациенты получали непрерывное введение GC33, если заболевание не прогрессировало или не появлялась неприемлемая токсичность. Опухоль оценивали на основании исходного уровня и оценку проводили после 4 циклов, 7 циклов и 10 циклов от начала введения и затем повторно каждые четыре цикла, если заболевание не прогрессировало. Каждый цикл включал в себя две недели. Состояние заболевания оценивали руководители клинических испытаний.
[0186]
Экспрессию белков GPC3 в опухолевых тканях ГСР оценивали посредством иммуногистохимического окрашивания GPC3 (GPC3-IHC). Центральное измерение GPC3-IHC проводилось Ventana Medical Systems, Inc. (USA). Неокрашенные слайды опухолевых тканей ГСР, полученные из опухолевых блоков, фиксированных в формалине и залитых парафином, после надреза посредством пункционной биопсией в каждой больнице подвергали иммуногистохимическому окрашиванию. Используемое антитело представляло собой мышиное антитело GC33.
[Пример 8]
[0187]
В случаях, в которых субъекты получали GC33 или плацебо при GPC3-нацеленном лечении, сывороточную концентрацию свободного GPC3 измеряли до первоначального введения с использованием комбинации двух типов различных антител, способных к связыванию свободного GPC3 (комбинации антитела GT30 и антитела GT607 или комбинации GT114 и GT165). GT30, GT607, GT114 и GT165 получали в соответствии с методом, описанным в WO2004/022739, и выбирали в качестве антител, способных к связыванию свободного GPC3. H и L цепи GT30 показаны в SEQ ID NO: 83 и 84, соответственно. H и L цепи GT607 показаны в SEQ ID NO: 85 и 86, соответственно. H и L цепи GT114 показаны в SEQ ID NO: 87 и 88, соответственно. H и L цепи GT165 показаны в SEQ ID NO: 89 и 90, соответственно.
[0188]
Раствор связанных с антителом частиц, содержащий GT30 или GT114, связанные с магнитными частицами-гранулами (производимыми JSR Corp.), добавляли при концентрации, равной 25 мкл/лунку в 96-луночный микропланшет. Далее применяли раствор стандартного образца для калибровочной кривой (стандарта GPC3, описанного в примере 3) или соответственно разбавленный образец сыворотки добавляли в планшет при концентрации, равной 25 мкл/лунку, и дополнительно, в планшет добавляли GT607 или GT165, меченные щелочной фосфатазой, при концентрации, равной 25 мкл/лунку. После встряхивания при 25°C в течение 20 минут, каждую лунку промывали 5 раз промывочным раствором, причем магнитные гранулы собирали с использованием Dyna-Mag-96 с боковым обтекателем (производимого VERITAS Corp.). Раствор люминесцентного субстрата, предварительно нагретый до 37°C, добавляли в планшет при концентрации, равной 50 мкл/лунку. Планшет встряхивали при комнатной температуре в течение 1 минуты и затем оставляли отстаиваться в течение 4 минут для испускания света. Интенсивность хемилюминесценции измеряли с использованием люминометра (производимого VERITAS Corp.).
Калибровочную кривую (стандартную кривую), полученную на основании стандартного образца, содержащего рекомбинантное GPC3, применяли для расчета уровня антигена GPC3 в сыворотке каждого пациента, исходя из полученной интенсивности хемилюминесценции каждой лунки.
[Пример 9]
[0189]
Как только события PFS от 128 случаев получали от 125 случаев с введением GC33 и 60 случаев с введением плацебо, как описано выше, эффекты введения GC33 при GPC3-нацеленном лечении оценивали на основании PFS. В дополнение, общую выживаемость (OS) оценивали в качестве вторичного конечного результата при достижении 78 событий.
[0190]
Группу с вводимым GC33 дополнительно разделяли на две группы (группу, подвергнутую воздействию GC33 при уровне, более низком, чем предельное значение: группу, подвергнутую воздействию низкой концентрации GC33, и группу, подвергнутую воздействию GC33 при уровне, более высоком, чем предельное значение: группу, подвергнутую воздействию высокой концентрации GC33), с использованием, в качестве предельного значения медианного значения 230 мкг/мл планируемых остаточных уровней GC33 в крови перед введением в день 1 в 3-ем цикле (на 4-ой неделе от начала первоначального введения), на основании популяционных ФК-моделей, полученных с использованием значений сывороточной концентрации GC33 этой фазы-II клинического испытания. Продолжительность выживаемости без прогрессирования заболевания или выживаемость без прогрессирования заболевания (PFS) или продолжительность общей выживаемости или общую выживаемость (OS) сравнивали в качестве показателя клинических эффектов при сравнении между этими группами или между этими группами и группой плацебо по методу Каплана-Мейера.
[Пример 10]
[0191]
Сывороточные концентрации обнаруженного свободного GPC3, рассчитанные в примере 8, были разделены на две группы, т.е. группу с низким значением и группу с высоким значением, на основании медианного значения концентраций, измеренных в системе, имеющей GT30 и GT607 в комбинации. Кривые PFS или OS групп с воздействием низкого GC33, групп с воздействием высокого GC33 и плацебо группы, как показано в примере 9, показаны на фиг. 7A-7D. Аналогично, сывороточные концентрации свободного GPC3 были разделены на две группы на основании медианного значения концентраций, измеренных в системе, имеющей GT114 и GT165 в комбинации. Кривые PFS или OS этих групп показаны на фиг. 8A-8D.
[0192]
Во всех случаях, группа с низкой концентрацией свободного GPC3 проявляла низкий эффект пролонгирования продолжительностей PFS и OS, в то время как группа, подвергнутая воздействию высокой концентрации GC33, с высокой концентрацией свободного GPC3 в сыворотке проявляла существенно более низкое отношение рисков продолжительностей PFS и OS к группе, подвергнутой воздействию низкой концентрации GC33 или группе с плацебо.
[0193]
В результате оценки предельного значения свободного GPC3, которое достигало наименьшего значимого различия, предельное значение составляло 175 пг/мл для системы GT30-GT607 и 259,7 пг/мл для системы GT114-GT165. Кривые PFS и OS для группы пациентов, которая проявляла уровень свободного GPC3, более высокий, чем предельное значение в каждой системе, показаны на фиг. 7E и 7F и фиг. 8E и 8F, соответственно. В этом случае также, в значительной степени низкое отношение рисков, т.е. удлинение каждой продолжительности выживания, проявлялось в группе, подвергнутой воздействию высокой концентрации GC33.
[0194]
Все публикации, патенты и патентные заявки, цитируемые в настоящем описании, полностью включены в настоящий документ, посредством ссылки.
[Промышленная применимость]
[0195]
Настоящее изобретение способствует улучшению эффективности действия нацеленной на GPC3 лекарственной терапии и улучшению QOL пациента, подлежащего лечению, и является применимым при лечении злокачественного новообразования, включая рак печени.