Результат интеллектуальной деятельности: КОМБИНАЦИЯ ИНГИБИТОРА PIK3 И ИНГИБИТОРА С-МЕТ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической комбинации, содержащей (a) ингибитор фосфатидилинозитол 3-киназы или его фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль для одномоментного, раздельного или последовательного введения для лечения пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания; фармацевтической композиции, содержащей такую комбинацию; способу лечения индивидуума с пролиферативным заболеванием, содержащему введение указанной комбинации нуждающемуся в этом индивидууму; применению такой комбинации для лечения пролиферативного заболевания; и серийной упаковке, содержащей такую комбинацию.
Уровень техники
Протеинкиназы (ПК) представляют собой группу ферментов, регулирующую различные важные биологические процессы, включая рост, жизнестойкость и дифференцировку клеток, формирование органов и морфогенез, неоваскуляризацию, восстановление и регенерацию тканей, наряду с некоторыми другими. Протеинкиназы проявляют свои физиологические функции посредством катализирования фосфорилирования белков (или субстратов) и, таким образом, модулирования клеточной активности субстратов в различных биологических контекстах.
Протеинкиназы можно подразделить на категории рецепторного типа и нерецепторного типа. Рецепторные тирозинкиназы (РТК) имеют внеклеточную часть, трансмембранный домен и внутриклеточную часть, в то время на нерецепторные тирозинкиназы являются полностью внутриклеточными. РТК-опосредованная передача сигнала, как правило, начинается от внеклеточного взаимодействия с конкретным фактором роста (лигандом), как правило, с последующей димеризацией рецептора, стимуляцией внутренней активности протеин-тирозинкиназы и трансфосфорилированием рецептора. Таким образом, создаются участки связывания для молекул внутриклеточной передачи сигнала, и происходит образование комплексов с разнообразными цитоплазматическими сигнальными молекулами, способствующими возникновению соответствующей клеточной реакции, такой как клеточное деление, дифференцировка, метаболическое воздействие, и изменений во внеклеточном микроокружении. Нерецепторный тип тирозинкиназы также состоит из множества подсемейств, включая Src, Btk, Abl, Fak и Jak.
c-Met, протоонкоген, является членом отдельного подсемейства гетеродимерных рецепторных тирозинкиназ, которые включают Met, Ron и Sea (Birchmeier, C. et al., Nat. Rev. Mol. Cell Biol. 2003, 4(12):915-925; Christensen, J. G. et al., Cancer Lett. 2005, 225(1):1-26). Единственным высокоаффинным лигандом для c-Met является фактор роста гепатоцитов (HGF), также известный как рассеивающий фактор (SF). Связывание HGF с c-Met вызывает активацию рецептора посредством автофосфорилирования, приводящего к повышению рецептор-зависимой передачи сигнала. Как c-Met, так и HGF в значительной степени экспрессируются в различных органах, но, как правило, их экспрессия ограничивается клетками эпителиального и мезенхимального происхождения, соответственно. Точно подтверждены документальными доказательствами биологические функции c-Met (или сигнального пути c-Met) в здоровых тканях и злокачественных новообразованиях человека, таких как рак (Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26; Corso, S. et al., Trends in Mol. Med. 2005, 11(6):284-292).
Каждый из HGF и c-Met необходим для нормального развития млекопитающего, и нарушения, отмеченные как у HGF-, так и c-Met-нулевых мышей, соответствуют вероятности экспрессии в эмбрионе и нарушению эпителиально-мезенхимального перехода во время морфогенеза органов (Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26). В соответствии с этими открытиями, было доказано важное значение трансдукции сигнала и последующего биологического действия пути HGF/c-Met для эпителиально-мезенхимального взаимодействия и регуляции клеточной миграции, инвазии, клеточной пролиферации и жизнеспособности, ангиогенеза, морфогенеза и организации трехмерных тубулярных структур (например, тубулярных клеток почек, формирования желез) во время развития. Конкретные следствия активации пути c-Met в указанных клетках/тканях в значительной степени зависят от контекста.
Факты свидетельствуют о том, что неуправляемый путь c-Met играет важную роль и иногда является причиной (в случае генетических изменений) образования, роста, сохранения и прогрессирования опухоли (Birchmeier, C. et al., Nat. Rev. Mol. Cell. Biol. 2003, 4(12):915-925; Boccaccio, C. et al., Nat. Rev. Cancer 2006, 6(8):637-645; Christensen, J.G. et al., Cancer Lett. 2005, 225(1):1-26). HGF и/или c-Met сверхэкспрессированы в значительной доле большинства видов рака человека и часто связаны с неблагоприятным клиническим исходом, таким как более агрессивная форма заболевания, прогрессирование заболевания, метастаз опухоли и сокращение продолжительности жизни пациента. Кроме того, пациенты с высоким уровнем белков HGF/c-Met более резистентны к химиотерапии и лучевой терапии. В дополнение к аномальной экспрессии HGF/c-Met, c-Met рецептор также можно активировать у пациентов с раком посредством генетических мутаций (как зародышевых, так и соматических) и амплификации гена. Несмотря на то, что амплификация гена и мутации являются наиболее типичными генетическими изменениями, отмеченными у пациентов, рецептор также можно активировать посредством делеции, укорочения, перестановки генов, а также аномального процессинга рецептора и механизмов нарушенной негативной регуляции.
Кроме того, при активации cMET активирует различные пути внутриклеточной передачи сигнала, включая в качестве неограничивающих примеров путь фосфатидилинозитол 3-киназы (PI3K)/Akt, ERK 1/2, с.38 и STAT3. PI3K содержат семейство липид и серин/треонин киназ, катализирующих перевод фосфата в положение D-3 инозитольных липидов для получения фосфоинозитол-3-фосфата (PIP), фосфоинозитол-3,4-дифосфата (PIP2) и фосфоинозитол-3,4,5-трифосфата (PIP3), которые, в свою очередь, выступают в качестве вторичного мессенджера в сигнальных каскадах посредством взаимодействия белков, содержащих гомологичные плекстрину, FYVE, Phox и другие фосфолипид-связывающие домены, с различными сигнальными комплексами, часто расположенными на плазматической мембране (Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001); Katso et al., Annu. Rev. Cell Dev. Biol. 17:615 (2001)). Из двух PI3K класса 1, PI3K класса 1A является гетеродимерами, состоящими из каталитической субъединицы p110 (α, β, δ изоформы), конститутивно связанной с регуляторной субъединицей, которой может быть p85α, p55α, p50α, p85β или p55γ. Подкласс 1B имеет одного представителя семейства, гетеродимера, состоящего из каталитической субъединицы p110γ, связанной с одной из двух регуляторных субъединиц, p101 или p84 (Fruman et al., Annu Rev. Biochem. 67:481 (1998); Suire et al., Curr. Biol. 15:566 (2005)). Модуляторные домены субъединиц p85/55/50 включают домены (SH2) Src-гомологии, связывающие остатки фосфотирозина в контексте определенной последовательности на активированных рецепторных и цитоплазматических тирозинкиназах, полученных в результате активации и локализации PI3K класса 1A. PI3K класса 1B активируют непосредственно с помощью рецепторов, сопряженных с G-белками, связывающими различный репертуар пептидных и непептидных лигандов (Stephens et al., Cell 89:105 (1997)); Katso et al., Annu. Rev. Cell Dev. Biol. 17:615-675 (2001)). Путь PI3K является решающим регулятором основных клеточных процессов, включая пролиферацию, жизнеспособность, хемотаксис, клеточную миграцию, подвижность, метаболизм, воспалительные и аллергические реакции, транскрипцию и трансляцию (Cantley et al., Cell 64:281 (1991); Escobedo и Williams, Nature 335: 85 (1988); Fantl et al., Cell., 69: 413 (1992).)
Несмотря на значительный прогресс в медицине и многочисленные варианты лечения для пациентов с раком, сохраняется необходимость в эффективных и безопасных терапевтических средствах и необходимость в новых способах комбинированного лечения, которое можно вводить для эффективного длительного лечения рака. В настоящее время обнаружено, что комбинация, содержащая (a) ингибитор фосфатидилинозитол 3-киназы, выбранный из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III) или его фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met, в частности 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемую соль, является особенно эффективной для лечения пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания. Предполагается, что антипролиферативный эффект этой комбинации превосходит максимальный эффект, который можно достичь с любым из других ингредиентов, взятым в отдельности.
Сущность изобретения
Настоящее изобретение относится к фармацевтической комбинации, содержащей (a) фосфатидилинозитол 3-киназу, выбранную из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль для одномоментного, раздельного или последовательного введения для лечения пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания. Комбинация по изобретению особенно пригодна для лечения рака легких (например, немелкоклеточного рака легких) или глиобластомы.
В предпочтительном варианте осуществления соединение формулы (I) представляет собой 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидро-имидазо[4,5-c]хинолин-1-ил)-фенил]-пропионитрил («СОЕДИНЕНИЕ A») или его монотозилатную соль и 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-он («СОЕДИНЕНИЕ B»).
В предпочтительном варианте осуществления соединение формулы (II) представляет собой 5-(2,6-ди-морфолин-4-ил-пиримидин-4-ил)-4-трифторметил-пиридин-2-иламин («СОЕДИНЕНИЕ C») или его гидрохлоридную соль.
В предпочтительном варианте осуществления соединение формулы (III) представляет собой (S)-пирролидин-1,2-дикарбоновая кислота 2-амид 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)-пиридин-4-ил]-тиазол-2-ил}-амид) («СОЕДИНЕНИЕ D») или его фармацевтически приемлемую соль.
В предпочтительном варианте осуществления ингибитор рецепторной тирозинкиназы c-Met представляет собой 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемую соль.
В одном из аспектов настоящее изобретение относится к способу лечения пролиферативного заболевания, содержащему введение нуждающемуся в этом индивидууму комбинации (a) фосфатидилинозитол 3-киназы, выбранной из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемой соли, и (b), по меньшей мере, одного ингибитора рецепторной тирозинкиназы c-Met или его фармацевтически приемлемой соли в количестве, которое является терапевтически эффективным по отношению к указанному пролиферативному заболеванию. Предпочтительно, пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание.
В дополнительном варианте осуществления настоящее изобретение относится к способу ингибирования образования метастазов у индивидуума с раком, содержащему введение нуждающемуся в этом индивидууму комбинации (a) фосфатидилинозитол 3-киназы, выбранной из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемой соли, и (b), по меньшей мере, одного ингибитора рецепторной тирозинкиназы c-Met или его фармацевтически приемлемой соли в количестве, которое является терапевтически эффективным по отношению к указанному раку. Предпочтительно, раком является c-Met-зависимый рак.
В одном из аспектов настоящее изобретение относится к применению КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ для лечения пролиферативного заболевания и/или для получения лекарственного средства для лечения пролиферативного заболевания. В предпочтительном варианте осуществления пролиферативным заболеванием является рак. В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание.
В одном из аспектов настоящее изобретение относится к применению КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ для ингибирования образования метастазов у индивидуума с раком и/или для получения лекарственного средства для ингибирования образования метастазов у индивидуума с раком. В предпочтительном варианте осуществления раком является c-Met-зависимый рак.
В одном из аспектов изобретение относится к фармацевтической композиции, содержащей количество, которое является в совокупности терапевтически эффективным по отношению к пролиферативному заболеванию, в частности c-Met-зависимому пролиферативному заболеванию, КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ и одного или нескольких фармацевтически приемлемых носителей. Эта фармацевтическая композиция может состоять из терапевтических средств (a) и, (b), вводимых индивидууму в виде фиксированной комбинации в единичном составе или стандартной лекарственной форме любым подходящим способом. Альтернативно, терапевтические средства, например, как ингибитор фосфатидилинозитол 3-киназы, так и ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль вводят индивидууму в виде нефиксированной комбинации в раздельных фармацевтических композициях или составах или стандартных лекарственных формах, и введение осуществляют одномоментно, одновременно или последовательно с отсутствием конкретных временных сроков.
В одном из аспектов настоящее изобретение относится к серийной упаковке, содержащей в качестве терапевтических средств КОМБИНАЦИЮ ПО ИЗОБРЕТЕНИЮ вместе с инструкциями для ее одномоментного, раздельного или последовательного введения при лечении пролиферативного заболевания, в частности рака легких (например, немелкоклеточного рака легких) или глиобластомы.
Подробное описание фигур
На фигуре 1 представлено воздействие доз СОЕДИНЕНИЯ C в комбинации с 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамидом на пролиферацию моделей глиобластомы человека H4.
На фигуре 2 представлено воздействие доз СОЕДИНЕНИЯ C в комбинации с 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамидом на пролиферацию моделей глиобластомы человека U87-MG.
На фигуре 3 представлено воздействие доз СОЕДИНЕНИЯ C в комбинации с 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамидом на пролиферацию моделей глиобластомы человека A172.
На фигуре 4 представлено воздействие доз СОЕДИНЕНИЯ C в комбинации с 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамидом на пролиферацию моделей глиобластомы человека LN229.
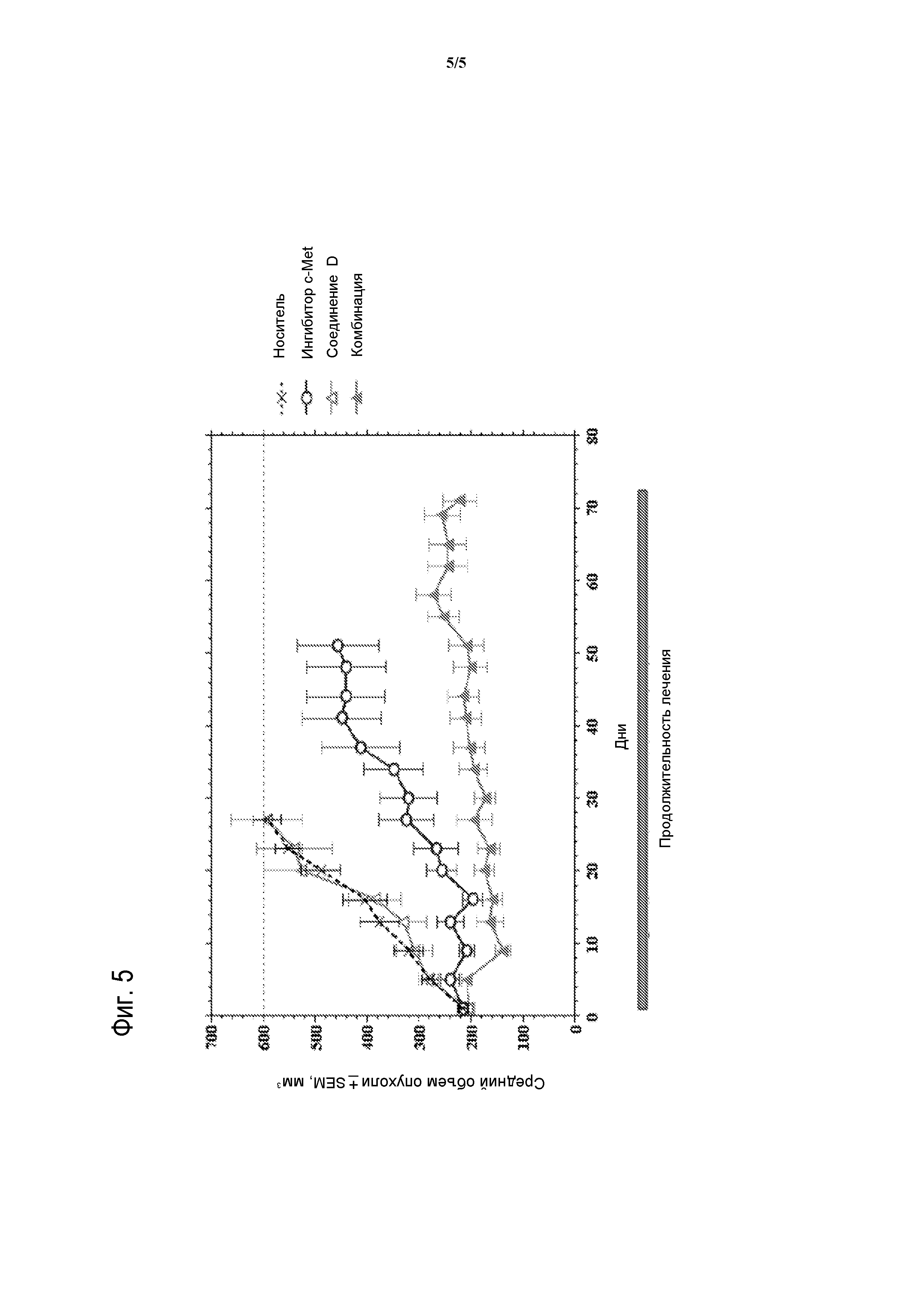
На фигуре 5 представлено сопоставление среднего воздействия на подавление роста опухоли комбинации 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида и СОЕДИНЕНИЯ D на ксенотрансплантатные модели немелкоклеточного рака легких человека NCI-H1993 в сравнении с контролем-носителем и обеими монотерапиями.
Подробное описание
Настоящее изобретение относится к фармацевтической комбинации, содержащей (a) фосфатидилинозитол 3-киназу, выбранную из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль для одномоментного, раздельного или последовательного введения для применения в лечении пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания. Комбинация по изобретению особенно пригодна для лечения рака легких (например, немелкоклеточного рака легких) или глиобластомы.
Определения общих терминов, используемых в настоящем документе, имеют следующие значения, если четко не обозначено иное:
Термины «содержащая» и «включая» используют в настоящем документе в неограничивающем смысле, если не указано иное.
Термины, употребленные в единственном числе в отношении описания изобретения (в особенности в отношении формулы изобретения), также подразумевают включение форм как единственного, так и множественного числа, если не указано иное в настоящем документе или отсутствует прямое противоречие по контексту. При использовании формы множественного числа для соединений, солей и т.п. также подразумевается значение соединения, соли в единственном числе и т.п.
Под термином «комбинация» или «фармацевтическая комбинация» в настоящем документе подразумевается или фиксированная комбинация в одной стандартной лекарственной форме, нефиксированная комбинация или набор частей комбинированного введения, при котором ингибитор фосфатидилинозитол 3-киназы и ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль можно вводить независимо одновременно или раздельно в пределах временных интервалов, обеспечивающих проявление совместного, например, синергетического действия терапевтических средств.
Термин «фиксированная комбинация» означает то, что терапевтические средства, например, ингибитор фосфатидилинозитол 3-киназы и ингибитор рецепторной тирозинкиназы c-Met вводят индивидууму одномоментно в форме единого целого или в лекарственной форме.
Термин «нефиксированная комбинация» означает то, что терапевтические средства, например, ингибитор фосфатидилинозитол 3-киназы и ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль вводят пациенту как в виде самостоятельных единиц, так и в лекарственных формах или одномоментно, одновременно или последовательно с отсутствием конкретных временных сроков, где такое введение обеспечивает терапевтически эффективный уровень трех соединений в организме индивидуума, например, млекопитающего или человека, нуждающегося в них.
Термин «набор частей» относится к терапевтическим средствам (a) и (b), как определено выше, определенные дозы которых вводят независимо или посредством применения различных фиксированных комбинаций с отмеченным количеством терапевтических средств (a) и (b), т.е., одномоментно или в различные моменты времени. Затем части набора частей можно, например, вводить одномоментно или с отсрочкой по времени, то есть в различные моменты времени и с равными или различными временными интервалами для любой части набора частей. Соотношение общего количества терапевтического средства (a) к терапевтическому средству (b) для введения в комбинированном препарате может варьироваться, например, с целью удовлетворения потребностей подгруппы пациентов, подлежащих лечению, или потребностей одного пациента.
Под термином «ингибитор фосфатидилинозитол 3-киназы» или «ингибитор PI3K» в настоящем документе подразумевается соединение, которое направлено на, снижает или ингибирует фосфатидилинозитол 3-киназу. Доказано, что активность фосфатидилинозитол 3-киназы повышается в ответ на ряд стимулов гормонами и фактором роста, включая инсулин, фактор роста тромбоцитов, инсулиноподобный фактор роста, эпидермальный фактор роста, колониестимулирующий фактор и фактор роста гепатоцитов, и она причастна к процессам, относящимся к росту и трансформации клеток.
Под термином «ингибитор рецепторной тирозинкиназы c-Met» в настоящем документе подразумевается соединение, которое направлено на, снижает или ингибирует активность рецепторной тирозинкиназы c-Met.
Термин «c-Met-зависимое пролиферативное заболевание» или «c-Met-зависимый рак» относится к тем пролиферативным заболеваниям с нарушением пути передачи сигнала c-Met и/или HGF/c-Met, в частности сверхэкспрессией и амплификацией гена HGF/c-Met, HGF-зависимой аутокринной и паракринной активацией и/или генетическими мутациями (как зародышевыми, так и соматическими) рецептора c-Met. В предпочтительном варианте осуществления пролиферативным заболеванием является рак с нарушением пути передачи сигнала c-Met и/или HGF/c-MET. Определение термина «нарушение пути передачи сигнала c-Met и/или HGF/c-Met» включает активацию класса рецепторных тирозинкиназ c-Met с помощью различных механизмов, включая в качестве неограничивающих примеров HGF-зависимую аутокринную и паракринную активацию, сверхэкспрессию и/или амплификацию гена HGF/c-met, точечные мутации, делеции, укорочения, перестройку, а также аномальный процессинг рецептора и механизмы нарушенной негативной регуляции. В предпочтительном варианте осуществления термин «c-Met-зависимое пролиферативное заболевание» или «c-Met-зависимый рак» включает сверхэкспрессию и амплификацию гена HGF/c-met.
Термин «фармацевтическая композиция» в настоящем документе относится к смеси или раствору, содержащему, по меньшей мере, одно терапевтическое средство для введения индивидууму, например, млекопитающему или человеку, с целью лечения конкретного заболевания или состояния, поразившего индивидуума.
Термин «фармацевтически приемлемый» в настоящем документе относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые с медицинской точки зрения, подходят для контакта с тканями индивидуума, например, млекопитающего или человека, без излишней токсичности, аллергической реакции в виде раздражения и других осложнений в соответствии с разумным соотношением пользы/риска.
Термин «лечения» или «лечение» в рамках изобретения содержит лечение, облегчающее, ослабляющее или смягчающее, по меньшей мере, один симптом у индивидуума или оказывающего сдерживание прогрессирования заболевания. Например, лечением может быть уменьшение одного или нескольких симптомов расстройства или полное устранение расстройства, такого как рак. В рамках значения по настоящему изобретению термин «лечение» также означает приостановку, сдерживание начала (т.е., периода перед клиническим проявлением заболевания) и/или снижение риска развития или ухудшения течения заболевания.
Термин «в совокупности терапевтически активный» или «совокупный терапевтический эффект» в рамках изобретения означает то, что терапевтические средства, которые можно давать раздельно (с отсрочкой по времени, в особенности специфично к последовательности) с предпочтительными для них временными интервалами теплокровному животному, в особенности человеку, которому необходимо лечение, тем не менее, демонстрируют (предпочтительно синергетическое) взаимодействие (совокупный терапевтический эффект). В этом случае, помимо прочего, его можно определить по показателям крови, показывающим то, что оба терапевтических средства присутствуют в крови человека, которому необходимо лечение, по меньшей мере, во время определенных временных интервалов.
Термин «фармацевтически эффективное количество» или «клинически эффективное количество» фармацевтической комбинации терапевтических средств представляет собой количество, достаточное для обеспечения наблюдаемого улучшения исходных клинически наблюдаемых признаков и симптомов пролиферативного заболевания, которое лечат с помощью этой комбинации.
Термин «синергетическое действие» в рамках изобретения относится к действию двух терапевтических средств, таких как, например, (a) соединение формулы (I), например, СОЕДИНЕНИЕ A или СОЕДИНЕНИЕ B, или его фармацевтически приемлемая соль, и, по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемая соль, или (b) соединение формулы (II), например, СОЕДИНЕНИЕ C, или его фармацевтически приемлемая соль и ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемая соль, или (c) соединение формулы (III), СОЕДИНЕНИЕ D, или его фармацевтически приемлемая соль и ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемая соль, оказывающих эффект, например, замедления прогрессирования симптомов пролиферативного заболевания, в частности рака или его симптомов, который превышает эффект простого добавления каждого терапевтического средства, вводимого по отдельности. Расчет синергетического действия можно произвести, например, с использованием подходящих способов, таких как сигмоидальное уравнение для вычисления максимальной эффективности (Holford, N. H. G. и Scheiner, L. B., Clin. Pharmacokinet. 6: 429-453 (1981)), уравнение аддитивности по Лоэву (Loewe, S. и Muischnek, H., Arch. Exp. Pathol Pharmacol. 114: 313-326 (1926)) и уравнение медианного эффекта (Chou, T. C. и Talalay, P., Adv. Фермент Regul. 22: 27-55 (1984)). Каждое из вышеуказанных уравнений можно применить к экспериментальным данным для составления соответствующего графика, помогающего оценить воздействие лекарственной комбинации. Соответствующие графики, связанные с вышеуказанными уравнениями, представляют собой кривую зависимости воздействия от концентрации, изоболограмму и кривую показателя аддитивности, соответственно.
Термин «индивидуум» или «пациент» в рамках изобретения включает животных, страдающих от или способных быть пораженными пролиферативным заболеванием или любым расстройством, включающим, в прямой или скрытой форме, опухоль. Примеры индивидуумов включают млекопитающих, например, людей, собак, коров, лошадей, свиней, овец, коз, кошек, мышей, кроликов, крыс и трансгенных животных, не являющихся человеком. В предпочтительном варианте осуществления индивидуумом является человек, например, человек, пораженный, с риском поражения или потенциально способный быть пораженным пролиферативным заболеванием.
Термин «около» или «приблизительно» обозначает в пределах 10%, более предпочтительно в пределах 5% указанного значения или диапазона.
Комбинации по настоящему изобретению включают ингибитор PI3K, выбранный из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или его фармацевтически приемлемые соли.
В WO2006/122806 и WO2008/103636 описаны производные имидазохинолина, которые, как обнаружено, ингибируют активность PI3K и мишень рапамицина в клетках млекопитающих (mTOR). Конкретные производные имидазохинолина, являющиеся подходящими для настоящего изобретения, их получение и подходящие фармацевтические составы, содержащие их, описаны в WO2006/122806 и WO2008/103636 и включают соединения формулы (I)
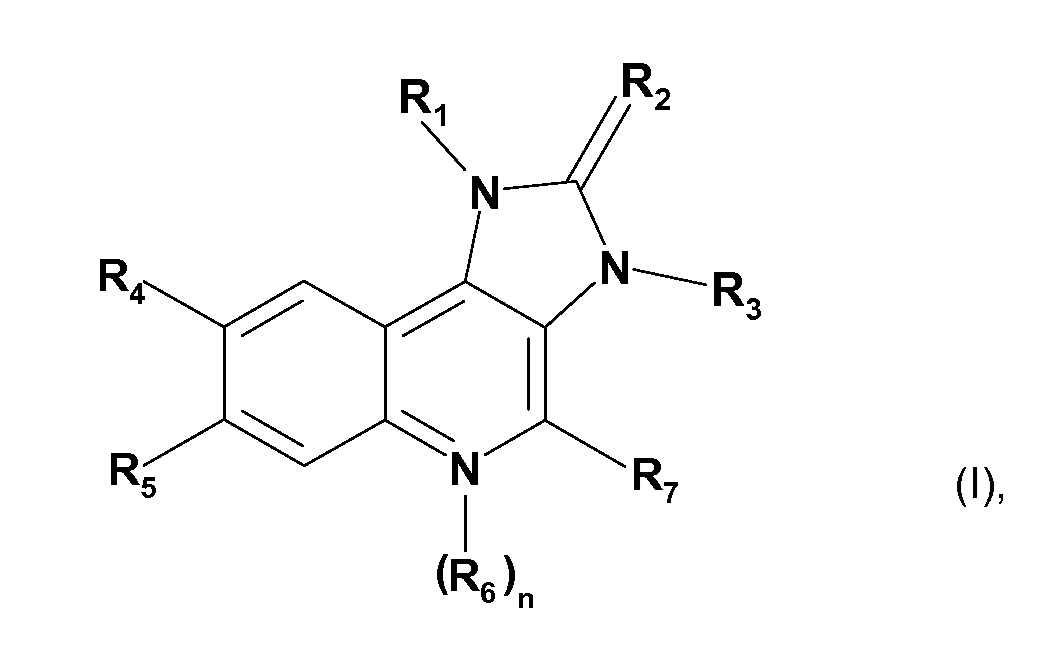
где
R1 является нафтилом или фенилом, где указанный фенил замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена; низшего алкила, незамещенного или замещенного галогеном, циано, имидазолилом или триазолилом; циклоалкила; амино, замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из низшего алкила, низшего алкилсульфонила, низшего алкокси и низшего алкокси-низшего алкиламино; пиперазинила, незамещенного или замещенного одним или двумя заместителями, независимо выбранными из группы, состоящей из низшего алкила и низшего алкилсульфонила; 2-оксо-пирролидинила; низшего алкокси-низшего алкила; имидазолила; пиразолила; и триазолила;
R2 является O или S;
R3 является низшим алкилом;
R4 является пиридилом, незамещенным или замещенным галогеном, циано, низшим алкилом, низшим алкокси или пиперазинилом, незамещенным или замещенным низшим алкилом; пиримидинилом, незамещенным или замещенным низшим алкокси; хинолинилом, незамещенным или замещенным галогеном галогеном; хиноксалинилом; или фенилом, замещенным алкокси;
R5 является водородом или галогеном;
n равно 0 или 1;
R6 является оксидо;
при условии, что если n=1, то N-атом, несущий радикал R6, имеет положительный заряд;
R7 является водородом или амино.
Радикалы и символы, использованные при определении соединения формулы (I), имеют значения, как описано в WO2006/122806, содержание публикации которого, таким образом, полностью включено в настоящую заявку посредством ссылки.
Соединение формулы (I) ингибитора PI3K может присутствовать в комбинации в форме свободного основания или его фармацевтически приемлемой соли. Подходящие соли соединений формулы (I) включают те, которые образованы, например, в качестве солей присоединения кислот, предпочтительно с органическими или неорганическими кислотами. Подходящими неорганическими кислотами являются, например, галогенные кислоты, такие как соляная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновая, фосфоновая, сульфоновая или сульфаминовые кислоты, например, уксусная кислота, пропионовая кислота, октановая кислота, декановая кислота, додекановая кислота, гликолевая кислота, молочная кислота, фумаровая кислота, янтарная кислота, малоновая кислота, адипиновая кислота, пимелиновая кислота, субериновая кислота, азелаиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, салициловая кислота, 4-аминосалициловая кислота, фталевая кислота, фенилуксусная кислота, миндальная кислота, коричная кислота, метан- или этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 4-толуолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталин-дисульфоновая кислота, 2- или 3-метилбензолсульфоновая кислота, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота или другие органические протонные кислоты, такие как аскорбиновая кислота.
Предпочтительными соединениями формулы (I) для применения в комбинации по настоящему изобретению являются 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидро-имидазо[4,5-c]хинолин-1-ил)-фенил]-пропионитрил («СОЕДИНЕНИЕ A») или его монотозилатная соль и 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-он («СОЕДИНЕНИЕ B»). Синтез СОЕДИНЕНИЯ A и его монотозилатной соли, например, описан в WO2006/122806 в качестве примеров 7 и 152-3, соответственно. Синтез СОЕДИНЕНИЯ B, например, описан в WO2006/122806 в качестве примера 86. В одном предпочтительном варианте осуществления соединением формулы (I) является СОЕДИНЕНИЕ A или его монотозилатная соль.
В WO07/084786 описаны производные пиримидина, которые, как обнаружено, ингибируют активность PI3K. Эти конкретные ингибиторы PI3K, подходящие для комбинации по настоящему изобретению, ее получения и подходящих фармацевтических составов, содержащих ее, описаны в WO07/084786 и включают соединения формулы (II):
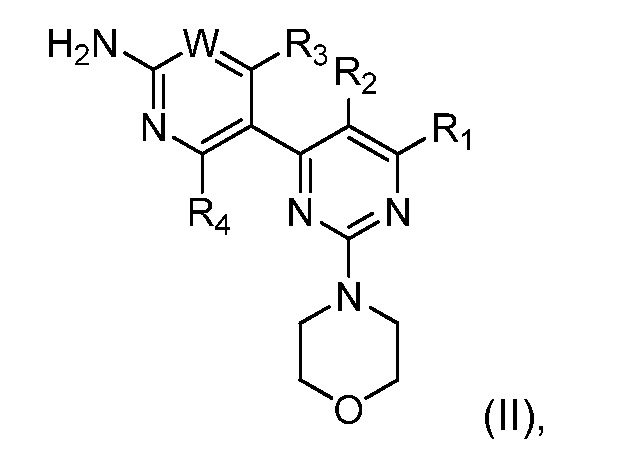
где W является CRw или N, где
Rw выбран из группы, состоящей из:
(1) водорода,
(2) циано,
(3) галогена,
(4) метила,
(5) трифторметила,
(6) сульфонамида;
R1 выбран из группы, состоящей из:
(1) водорода,
(2) циано,
(3) нитро,
(4) галогена,
(5) замещенного и незамещенного алкила,
(6) замещенного и незамещенного алкенила,
(7) замещенного и незамещенного алкинила,
(8) замещенного и незамещенного арила,
(9) замещенного и незамещенного гетероарила,
(10) замещенного и незамещенного гетероциклила,
(11) замещенного и незамещенного циклоалкила,
(12) -COR1a,
(13) -CO2R1a,
(14) -CONR1aR1b,
(15) -NR1aR1b,
(16) -NR1aCOR1b,
(17) -NR1aSO2R1b,
(18) -OCOR1a,
(19) -OR1a,
(20) -SR1a,
(21) -SOR1a,
(23) -SO2NRlaR1b, где
R1a, и R1b независимо выбраны из группы, состоящей из:
(a) водорода,
(b) замещенного и незамещенного алкила,
(c) замещенного и незамещенного арила,
(d) замещенного и незамещенного гетероарила,
(e) замещенного и незамещенного гетероциклила и
(f) замещенного и незамещенного циклоалкила;
R2 выбран из группы, состоящей из:
(1) водорода,
(2) циано,
(3) нитро,
(4) галогена,
(5) гидрокси,
(6) амино,
(7) замещенного и незамещенного алкила,
(8) -COR2a, и
(9) -NR2aCOR2b, где
R2a, и R2b независимо выбраны из группы, состоящей из:
(a) водорода, и
(b) замещенного и незамещенного алкила;
R3 выбран из группы, состоящей из:
(1) водорода,
(2) циано,
(3) нитро,
(4) галогена,
(5) замещенного и незамещенного алкила,
(6) замещенного и незамещенного алкенила,
(7) замещенного и незамещенного алкинила,
(8) замещенного и незамещенного арила,
(9) замещенного и незамещенного гетероарила,
(10) замещенного и незамещенного гетероциклила,
(11) замещенного и незамещенного циклоалкила,
(12) -COR3a,
(14) -NR3aR3b
(13) -NR3aCOR3b,
(15) -NR3aSO2R3b,
(16) -OR3a,
(17) -SR3a,
(18) -SOR3a,
(19) -SO2R3a, где
R3a, и R3b независимо выбраны из группы, состоящей из:
(a) водорода,
(b) замещенного и незамещенного алкила,
(c) замещенного и незамещенного арила,
(d) замещенного и незамещенного гетероарила,
(e) замещенного и незамещенного гетероциклила, и
(f) замещенного и незамещенного циклоалкила; и
R4 выбран из группы, состоящей из
(1) водорода, и
(2) галогена.
Радикалы и символы, использованные в определении соединений формулы (II), имеют значения, как описано в WO07/084786, содержание публикации которого, таким образом, полностью включено в настоящую заявку посредством ссылки.
Соединение формулы (II) ингибитора PI3K может присутствовать в комбинации в форме свободного основания или его фармацевтически приемлемой соли. Подходящие соли соединения формулы (II) в качестве неограничивающих примеров включают следующие: ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, йодогидрат, 2 гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2 нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы могут быть кватернизированы такими средствами, как алкилгалогениды, такие как метил, этил, пропил и бутилхлорид, бромиды, и йодиды; диалкилсульфаты, такие как диметил, диэтил, дибутил и диамилсульфаты, длинноцепные галогениды, такие как децил, лаурил, миристил, и стеарилхлориды, бромиды и йодиды, аралкил галогениды, такие как бензил и фенэтилбромиды и другие.
Подходящие соли соединения формулы (II) также в качестве неограничивающих примеров включают катионы на основе щелочных и щелочноземельных металлов, такие как соли натрия, лития, калия, кальция, магния, алюминия и т.п., а также катионы нетоксичного аммония, четвертичного аммония и аминные катионы, включая в качестве неограничивающих примеров аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. Другие представители органических аминов, пригодных для образования солей присоединения оснований, включают диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин, пиридин, пиколин, триэтаноламин и т.п., и основные аминокислоты, такие как аргинин, лизин и орнитин.
Предпочтительным соединением формулы (II) для применения в комбинации по настоящему изобретению является ингибитор 5-(2,6-ди-морфолин-4-ил-пиримидин-4-ил)-4-трифторметил-пиридин-2-иламина PI3K (далее в настоящем документе «СОЕДИНЕНИЕ C») или его гидрохлоридная соль. Синтез СОЕДИНЕНИЯ C описан в WO2007/084786 в качестве примера 10, содержание которого включено в настоящий документ посредством ссылки.
В WO2010/029082 описаны конкретные производные 2-карбоксамид-циклоаминомочевины, которые, как обнаружено, обладают ингибирующей активностью в отношении α-изоформы PI3K. Конкретные производные 2-карбоксамид-циклоаминомочевины, подходящие для комбинации по настоящему изобретению, ее получения и подходящих составов, содержащих ее, описаны в WO2010/029082 и включают соединения формулы (III)
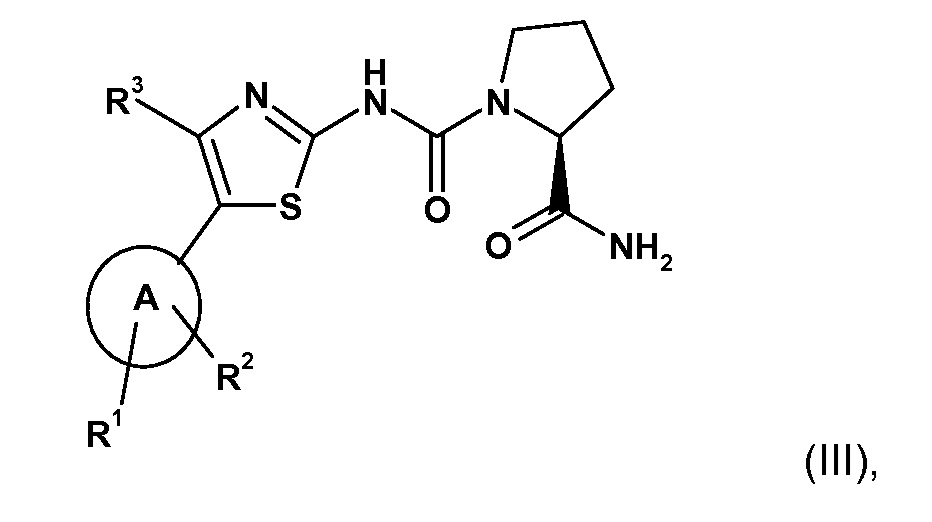
где
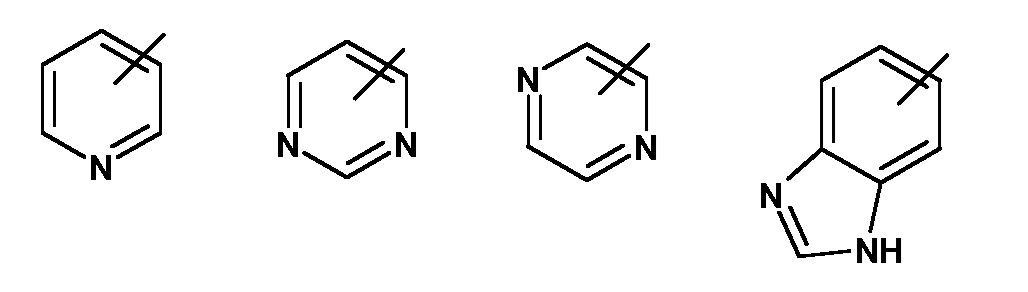
A представляет собой гетероарил, выбранный из группы, состоящей из:
R1 представляет собой один из следующих заместителей: (1) незамещенный или замещенный, предпочтительно замещенный C1-C7-алкил, где указанные заместители независимо выбраны из одного или нескольких, предпочтительно от одного до девяти из следующих фрагментов: дейтерия, фтора или от одного до двух из следующих фрагментов C3-C5-циклоалкила; (2) необязательно замещенный C3-C5-циклоалкил, где указанные заместители независимо выбраны из одного или нескольких, предпочтительно от одного до четырех из следующих фрагментов: дейтерия, C1-C4-алкила (предпочтительно метила), фтора, циано, аминокарбонила; (3) необязательно замещенный фенил, где указанные заместители независимо выбраны из одного или нескольких, предпочтительно от одного до двух из следующих фрагментов: дейтерия, гало, циано, C1-C7-алкила, C1-C7-алкиламино, ди(C1-C7-алкил)амино, C1-C7-алкиламинокарбонила, ди(C1-C7-алкил)аминокарбонила, C1-C7-алкокси; (4) необязательно моно- или ди-замещенный амин; где указанные заместители независимо выбраны из следующих фрагментов: дейтерия, C1-C7-алкила (который не замещен или замещен одним или несколькими заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, гидрокси), фенилсульфонила (который не замещен или замещен одним или несколькими, предпочтительно одним C1-C7-алкилом, C1-C7-алкокси, ди(C1-C7-алкил)амино-C1-C7-алкокси); (5) замещенный сульфонил; где указанный заместитель выбран из следующих фрагментов: C1-C7-алкила (который не замещен или замещен одним или несколькими заместителями, выбранными из группы, состоящей из дейтерия, фтора), пирролидинo, (который не замещен или замещен одним или несколькими заместителями, выбранными из группы, состоящей из дейтерия, гидрокси, оксо; в частности одним оксо); (6) фтор, хлор;
R2 представляет собой водород;
R3 представляет собой (1) водород, (2) фтор, хлор, (3) необязательно замещенный метил, где указанные заместители независимо выбраны из одного или нескольких, предпочтительно от одного до трех из следующих фрагментов: дейтерия, фтора, хлора, диметиламино.
Радикалы и символы, использованные в определении соединений формулы (III), имеют значения, как описано в WO2010/029082, содержание публикации которого, таким образом, полностью включено в настоящую заявку посредством ссылки.
Предпочтительным соединением по настоящему изобретению является соединение, которое конкретно описано в WO2010/029082. Особенно предпочтительным соединением по настоящему изобретению является (S)-пирролидин-1,2-дикарбоновая кислота 2-амид 1-({4-метил-5-[2-(2,2,2-трифтор-1,1-диметил-этил)-пиридин-4-ил]-тиазол-2-ил}-амид) (в настоящем документе, обозначаемый как «СОЕДИНЕНИЕ D») или его фармацевтически приемлемая соль. Синтез СОЕДИНЕНИЯ описан в WO2010/029082 в качестве примера 15.
Соединения формулы (III) можно использовать в форме свободного основания или его фармацевтически приемлемой соли. Подходящие соли включают те, которые образованы, например, в качестве солей присоединения кислот, предпочтительно с органическими или неорганическими кислотами из соединений формулы (III) с основным атомом азота. Подходящими неорганическими кислотами являются, например, галогенные кислоты, такие как соляная кислота, серная кислота или фосфорная кислота. Подходящими органическими кислотами являются, например, карбоновые кислоты или сульфоновые кислоты, такие как фумаровая кислота или метансульфоновая кислота.
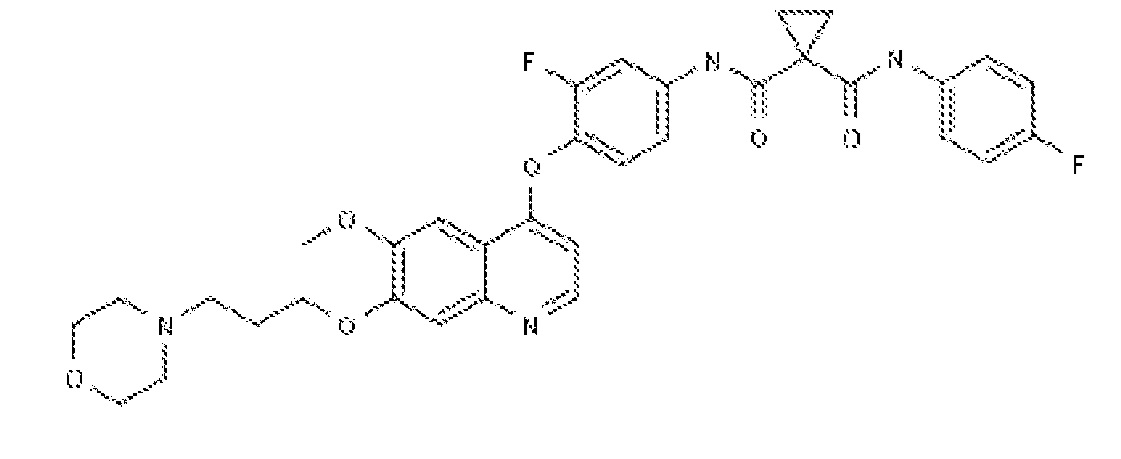
Комбинации по настоящему изобретению также включают, по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль. Примеры подходящего ингибитора рецепторной тирозинкиназы c-Met в качестве неограничивающих примеров включают 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид, ARQ197 (tavantinib), AMG458, GSK1363089 (XL880 или foretinib), PF2341066 (crizotinib) или их фармацевтически приемлемую соль.
Предпочтительно, ингибитором рецепторной тирозинкиназы c-Met для применения в комбинации по настоящему изобретению является соединение формулы (IV)
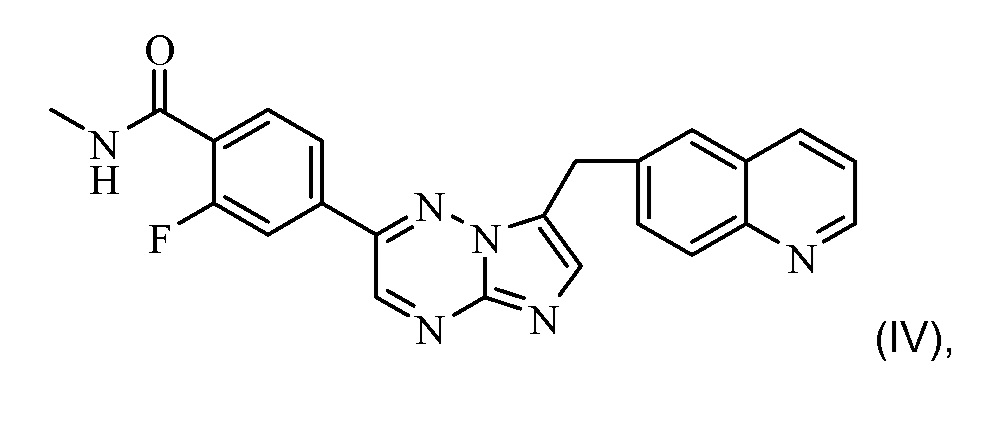
или его фармацевтически приемлемая соль. Соединение формулы (IV) имеет химическое название: 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид. Это соединение и способ синтеза этого соединения описан в примере 7 международной патентной заявки PCT WO2008/064157, содержание которой полностью включено в настоящий документ посредством ссылки.
Соединение формулы (IV) можно использовать в форме свободного основания или его фармацевтически приемлемой соли. Подходящие соли 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида включают минеральные или органические кислые соли основных остатков, такие как амины; щелочные или органические соли кислотных остатков, такие как карбонов кислоты; и т.п. Фармацевтически приемлемые соли по настоящему изобретению включают общепринятые нетоксические соли исходного соединения, образованные, например, от нетоксических неорганических или органических кислот. Предпочтительно, соединением формулы (IV) является солевая форма, описанная в патентной заявке PCT WO2009/143211, содержание которой полностью включено в настоящий документ посредством ссылки. Предпочтительные формы соли соединения формулы (IV) включают солевую форму дигидрохлорной кислоты и солевую форму дибензолсульфоновой кислоты 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида.
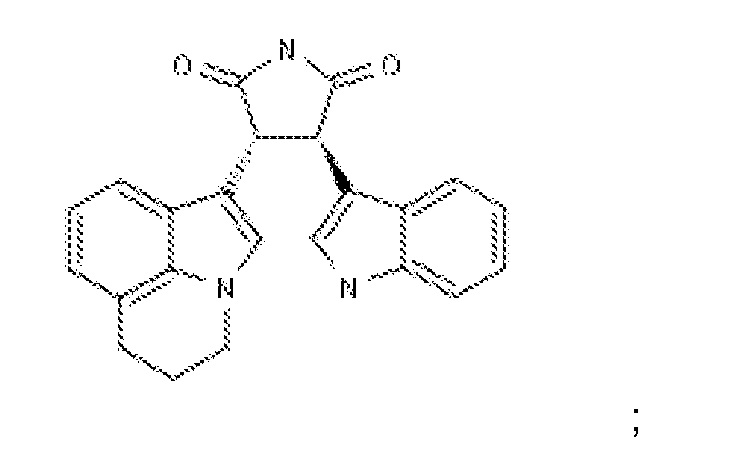
Подходящие ингибиторы рецепторной тирозинкиназы c-Met также включают:
(i.) ARQ197 (tavantinib)(разработанный Daiichi Sankyo и ArQule) с химической структурой:
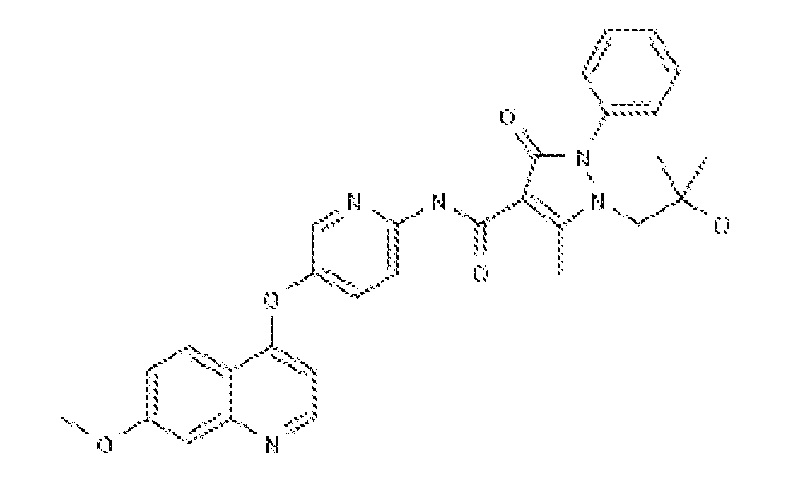
(ii.) AMG458 (разработанный Amgen) с химической структурой:
(iii.) GSK1363089 (также известный как XL880 или foretinib) (разработанный GlaxoSmithKline) с химической структурой:
 ; и
; и
(iv.) PF2341066 (также известный как crizotinib) (разработанный Pfizer) с химической структурой:
Структуру терапевтических средств, идентифицированных кодовыми номерами, непатентованные или торговые наименования можно найти в текущем издании стандартного справочника «The Merck Index» или в базах данных, например, Patents International (например, публикациях IMS World). Их соответствующее содержание включено, таким образом, посредством ссылки.
Фармацевтическая комбинация, содержащая (a) фосфатидилинозитол 3-киназу, выбранную из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III) или ее фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль, рассматривается далее в настоящем документе как КОМБИНАЦИЯ ПО ИЗОБРЕТЕНИЮ.
Если не указано иначе, или если четко не указано в тексте, или неприменимо, ссылка на терапевтические средства, пригодные для КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ, включает как свободное основание соединений, так и все фармацевтически приемлемые соли соединений.
В одном предпочтительном варианте осуществления настоящего изобретения комбинация содержит (a) ингибитор фосфатидилинозитол 3-киназы, СОЕДИНЕНИЕ A, СОЕДИНЕНИЕ B, СОЕДИНЕНИЕ C или СОЕДИНЕНИЕ D, или его фармацевтически приемлемую соль, и (b) 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемую соль.
В другом предпочтительном варианте осуществления настоящего изобретения комбинация содержит (a) ингибитор фосфатидилинозитол 3-киназы, СОЕДИНЕНИЕ C, или его фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор c-Met, выбранный из группы, содержащей 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемую соль.
В другом предпочтительном варианте осуществления настоящего изобретения комбинация содержит (a) ингибитор фосфатидилинозитол 3-киназы, СОЕДИНЕНИЕ D, или его фармацевтически приемлемую соль, и (b) 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемую соль.
В соответствии с настоящим изобретением, КОМБИНАЦИЯ ПО ИЗОБРЕТЕНИЮ пригодна для лечения пролиферативного заболевания у нуждающегося в этом индивидуума. КОМБИНАЦИЮ ПО ИЗОБРЕТЕНИЮ можно использовать для лечения пролиферативного заболевания у нуждающегося в этом индивидуума посредством введения индивидууму фармацевтической комбинации содержащей (a) эффективное количество фосфатидилинозитол 3-киназы, выбранной из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемой соли, и (b) эффективное количество, по меньшей мере, одного ингибитора рецепторной тирозинкиназы c-Met, такого как 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид, или его фармацевтически приемлемой соли. Предпочтительно, эти терапевтические средства вводят в терапевтически эффективных дозах, которые в сочетании обеспечивают совокупное положительное воздействие. Введение может быть раздельным, одномоментным или последовательным.
В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание.
Природа пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания, является многофакторной. При определенных обстоятельствах лекарственные средства с различным механизмом действия можно комбинировать. Однако просто рассмотрение возможности какой-либо комбинации лекарственных средств с различным механизмом действия не обязательно приводит в результате к комбинациям с полезным эффектом.
Выявлено, что введение КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ можно использовать для лечения индивидуума с пролиферативным заболеванием, в частности раком легких (например, немелкоклеточным раком легких) или глиобластомой. В настоящем изобретении введение КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ приводит в результате к более эффективному лечению, например, синергетическому или повышенному антипролиферативному эффекту, например, в отношении сдерживания прогрессирования пролиферативного заболевания или в отношении изменения объема опухоли, по сравнению с какой-либо монотерапией.
В предпочтительном варианте осуществления КОМБИНАЦИЯ ПО ИЗОБРЕТЕНИЮ пригодна для лечения пролиферативных заболеваний с нарушением пути передачи сигнала c-Met и/или HGF/c-Met. В одном из вариантов осуществления этим пролиферативным заболеванием является рак с нарушением пути передачи сигнала c-Met и/или HGF/c-Met. В дополнительном варианте осуществления этим пролиферативным заболеванием является рак с сверхэкспрессией и/или амплификацией гена HGF/c-met.
Пролиферативные заболевания, в частности c-Met-зависимые пролиферативные заболевания, подходящие для лечения с помощью КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ, в качестве неограничивающих примеров включают рак, атеросклероз, фиброз легких, фиброз и регенерацию почек, заболевания печени, аллергические расстройства, воспалительные и аутоиммунные нарушения, цереброваскулярные болезни, сердечно-сосудистые заболевания и состояния, связанные с трансплантацией органа.
В одном из вариантов осуществления пролиферативным заболеванием является рак. Термин «рак» используют в настоящем документе для обозначения широкого спектра опухолей, включая все плотные опухоли и гемобластозы. Примеры таких опухолей в качестве неограничивающих примеров включают доброкачественные и злокачественные опухоли молочной железы, мочевого пузыря, шейки матки, холангиокарциномы, ободочной и прямой кишки, пищевода, желудка, головы и шеи, почек (например, паппилярную почечноклеточную карциному), печени (например, печеночноклеточную карциному), легких (например, мелкоклеточный рак легких и немелкоклеточный рак легких), носоглотки, яичника, поджелудочной железы, предстательной железы, щитовидной железы, эндометрия, саркому костно-мышечной системы (например, остеосаркому, синовиальную саркому, рабдомиосаркому), саркому мягких тканей (например, MFH/фибросаркому, лейомиосаркому, саркому Капоши), множественную миелому, лимфомы, T-клеточный лейкоз-лимформу взрослого, острый миелоидный лейкоз, хронический миелолейкоз, глиобластомы, астроцитомы, меланомы, мезотелиомы и опухоль Вильма и т.п.
В дополнительном варианте осуществления настоящего изобретения пролиферативным заболеванием является плотная опухоль. Термин «плотная опухоль» в частности обозначает рак молочной железы, рак мочевого пузыря, рак яичника, колоректальный рак, меланому, рак желудка, рак шейки матки, рак легких (например, мелкоклеточный рак легких и немелкоклеточный рак легких), рак головы и шеи, рак предстательной железы или саркому Капоши. Настоящая комбинация ингибирует рост плотных опухолей, а также жидких опухолей.
В дополнительном варианте осуществления настоящего изобретения пролиферативным заболеванием является рак легких (например, немелкоклеточный рак легких) или глиобластома.
Следует понимать, что настоящее изобретение относится к дополнительным вариантам осуществления, в которых любое из вышеописанных пролиферативных заболеваний или рак является c-Met-зависимым пролиферативным заболеванием или раком.
В дополнительном варианте осуществления настоящее изобретение относится к КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ, пригодной для лечения пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания, резистентного к лечению с помощью ингибитора рецепторной тирозинкиназы c-MET, в частности 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида или его фармацевтически приемлемой соли. В рамках изобретения термин «резистентный» означает опухоли, которые были ранее чувствительными и которые при постоянном присутствии ингибитора рецепторной тирозинкиназы c-MET или вновь разрослись после уменьшения в связи с лечением, или появились вновь после временной ликвидации в связи с лечением. Успешное лечение резистентных опухолей может стать причиной, например, повышенной чувствительности опухолевых клеток к новой или ранее несостоявшейся терапии против рака и/или химиотерапевтическим средствам, и может привести, например, к последующей гибели опухолевых клеток и предотвращению метастазов.
В дополнительном варианте осуществления настоящее изобретение относится к КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ, пригодной для ингибирования роста и/или распространения метастазов рака, в частности c-Met-зависимых опухолей. КОМБИНАЦИЯ ПО ИЗОБРЕТЕНИЮ подходит для лечения пациентов с неблагоприятным прогнозом, в особенности пациентов с неблагоприятным прогнозом, страдающих метастатическим раком легких (например, немелкоклеточным раком легких) или глиобластомой.
В дополнительном варианте осуществления настоящее изобретение относится к фармацевтической комбинации, содержащей (a) ингибитор фосфатидилинозитол 3-киназы, СОЕДИНЕНИЕ C или СОЕДИНЕНИЕ D, или его фармацевтически приемлемую соль, и (b) ингибитор рецепторной тирозинкиназы c-Met, 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид, или его фармацевтически приемлемую соль для применения в лечении пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания. Предпочтительно, пролиферативным заболеванием является рак, наиболее предпочтительно рак легких (например, немелкоклеточный рак легких) или глиобластома.
В дополнительном варианте осуществления настоящее изобретение относится к фармацевтической комбинации, содержащей (a) ингибитор фосфатидилинозитол 3-киназы, СОЕДИНЕНИЕ C, или его фармацевтически приемлемую соль, и (b) ингибитор рецепторной тирозинкиназы c-Met, PF2341066 (также известный как crizotinib), или его фармацевтически приемлемую соль для применения в лечении пролиферативного заболевания, в частности c-Met-зависимого пролиферативного заболевания. Предпочтительно, пролиферативным заболеванием является рак, наиболее предпочтительно глиобластома.
В одном из аспектов настоящее изобретение относится к способу лечения пролиферативного заболевания, содержащему введение нуждающемуся в этом индивидууму комбинации (a) фосфатидилинозитол 3-киназы, выбранной из группы, состоящей из соединения формулы (I), соединения формулы (II), соединения формулы (III), или ее фармацевтически приемлемой соли, и (b), по меньшей мере, одного ингибитора рецепторной тирозинкиназы c-Met или его фармацевтически приемлемой соли в количестве, которое является терапевтически эффективным по отношению к пролиферативному заболеванию.
Пациенту с пролиферативным заболеванием, в особенности с раком легких (например, немелкоклеточным раком легких) или глиобластомой, можно вводить раздельно, одномоментно или последовательно комбинацию, содержащую (a) фосфатидилинозитол 3-киназу, выбранную из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемую соль, и (b), по меньшей мере, один ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль для лечения указанного пролиферативного заболевания в соответствии с настоящим изобретением.
В дополнительном варианте осуществления настоящее изобретение относится к способу лечения пролиферативного заболевания, содержащему введение нуждающемуся в этом индивидууму комбинации (a) ингибитора фосфатидилинозитол 3-киназы, СОЕДИНЕНИЯ C или СОЕДИНЕНИЯ D, или его фармацевтически приемлемой соли, и (b) ингибитора рецепторной тирозинкиназы c-Met 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-илl]бензамида, или его фармацевтически приемлемой соли в количестве, которое является в совокупности терапевтически эффективным по отношению к указанному пролиферативному заболеванию. Предпочтительно, пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. Предпочтительно, пролиферативным заболеванием является рак, наиболее предпочтительно рак легких (например, немелкоклеточный рак легких) или глиобластома.
В дополнительном варианте осуществления настоящее изобретение относится к способу лечения пролиферативного заболевания, содержащему введение нуждающемуся в этом индивидууму комбинации (a) ингибитора фосфатидилинозитол 3-киназы, СОЕДИНЕНИЯ C, или его фармацевтически приемлемой соли, и (b) ингибитора рецепторной тирозинкиназы c-Met, PF2341066 (также известного как crizotinib), или его фармацевтически приемлемой соли в количестве, которое является в совокупности терапевтически эффективным по отношению к указанному пролиферативному заболеванию. Предпочтительно, пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. Предпочтительно, пролиферативным заболеванием является рак, наиболее предпочтительно глиобластома.
В дополнительном варианте осуществления настоящее изобретение относится к способу ингибирования образования метастазов у индивидуума с раком, содержащему введение нуждающемуся в этом индивидууму комбинации (a) фосфатидилинозитол 3-киназы, выбранной из группы, состоящей из соединения формулы (I), соединения формулы (II) и соединения формулы (III), или ее фармацевтически приемлемой соли, и (b), по меньшей мере, одного ингибитора рецепторной тирозинкиназы c-Met или его фармацевтически приемлемой соли в количестве, в совокупности терапевтически эффективным по отношению к указанному раку. Предпочтительно, раком является c-Met-зависимый рак. Подходящими видами рака являются те, которые указаны выше в вариантах осуществления и включены в настоящий документ посредством ссылки.
В предпочтительном варианте осуществления способы и комбинации по настоящему изобретению можно использовать для лечения рака легких (например, немелкоклеточного рака легких) или глиобластомы.
В одном из аспектов настоящее изобретение относится к применению КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ для лечения пролиферативного заболевания и/или для получения лекарственного средства для лечения пролиферативного заболевания. В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. В предпочтительном варианте осуществления пролиферативным заболеванием является рак. Подходящими пролиферативными заболеваниями и/или раком являются те, которые указаны выше в вариантах осуществления и включены в настоящий документ посредством ссылки.
В одном из вариантов осуществления настоящее изобретение относится к применению ингибитора фосфатидилинозитол 3-киназы, выбранного из группы, состоящей из соединения формулы (I) (например, СОЕДИНЕНИЯ A или B), соединения формулы (II) (например, СОЕДИНЕНИЯ C) и соединения формулы (III) (например, СОЕДИНЕНИЯ D), или его фармацевтически приемлемой соли в комбинации с, по меньшей мере, одним ингибитором рецепторной тирозинкиназы c-MET или его фармацевтически приемлемой солью для получения лекарственного средства для лечения пролиферативного заболевания. В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. В предпочтительном варианте осуществления пролиферативным заболеванием является рак, в особенности рак легких (например, немелкоклеточный рак легких) или глиобластома.
В дополнительном варианте осуществления настоящее изобретение относится к применению ингибитора фосфатидилинозитол 3-киназы, СОЕДИНЕНИЯ C или СОЕДИНЕНИЯ D, или его фармацевтически приемлемой соли в комбинации с ингибитором рецепторной тирозинкиназы c-MET 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамидом, или его фармацевтически приемлемой солью для получения лекарственного средства для лечения пролиферативного заболевания. В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. В предпочтительном варианте осуществления пролиферативным заболеванием является рак, в особенности рак легких (например, немелкоклеточный рак легких) или глиобластома.
В дополнительном варианте осуществления настоящее изобретение относится к применению ингибитора фосфатидилинозитол 3-киназы, СОЕДИНЕНИЯ C, или его фармацевтически приемлемой соли в комбинации ингибитором рецепторной тирозинкиназы c-MET, PF2341066 (также известным как crizotinib), или его фармацевтически приемлемой солью для получения лекарственного средства для лечения пролиферативного заболевания. В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. В предпочтительном варианте осуществления c-Met-зависимым пролиферативным заболеванием является рак, в особенности глиобластома.
В одном из аспектов, настоящее изобретение относится к применению КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ для ингибирования образования метастазов у индивидуума с раком и/или для получения лекарственного средства для ингибирования образования метастазов у индивидуума с раком. В предпочтительном варианте осуществления раком является c-Met-зависимый рак.
Введение КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ может приводить не только к положительному воздействию, например, терапевтическому эффекту по сравнению с монотерапией с помощью отдельных терапевтических средств комбинации, например, синергетическому терапевтическому эффекту, например, в отношении смягчения, сдерживания прогрессирования или ингибирования симптомов, но также к неожиданному положительному воздействию, например, уменьшению побочных эффектов, улучшенному качеству жизни или снижению заболеваемости, по сравнению с монотерапией с применением только одного из фармацевтически терапевтических средств, используемых в комбинации по изобретению.
Дополнительным преимуществом является то, что терапевтические средства КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ можно использовать в пониженных дозах, например, то, что зачастую требуются не только более низкие дозы, но также снижается частота их введения, или их можно использовать с целью устранения возникновения побочных эффектов, наблюдаемых при введении одного из терапевтических средств по отдельности. Это осуществляется в соответствии с пожеланиями и требованиями пациентов, которым необходимо лечение.
С помощью определенных моделей для испытания можно показать то, что КОМБИНАЦИЯ ПО ИЗОБРЕТЕНИЮ приводит к положительному воздействию, описанному выше в настоящем документе. Специалист в данной области имеет все возможности для выбора соответствующей модели для испытания с целью доказательства положительного воздействия. Фармакологическую активность КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ можно продемонстрировать, например, в клиническом исследовании или при методике испытаний in-vitro, как по существу описано ниже в настоящем документе.
Подходящими клиническими исследованиями являются, в частности, например, открытые исследования с увеличением дозы у пациентов с пролиферативным заболеванием, в особенности с c-Met-зависимым пролиферативным заболеванием, в частности раком легких (например, немелкоклеточным раком легких) или глиобластомой. Такие исследования подтверждают, в частности, синергизм терапевтических средств комбинации по изобретению. Положительное воздействие на c-Met-зависимые пролиферативные заболевания можно определять непосредственно с помощью результатов этих исследований, известных, в сущности, специалисту в данной области. Такие исследования, в частности, могут подходить для сравнения воздействия монотерапии с использованием или терапевтического средства, или фармацевтической комбинации по изобретению. В одном из вариантов осуществления дозу ингибитора фосфатидилинозитол 3-киназы, выбранного из группы, состоящей из соединения формулы (I) (например, СОЕДИНЕНИЯ A или B), соединения формулы (II) (например, СОЕДИНЕНИЯ C) и соединения формулы (III) (например, СОЕДИНЕНИЯ D) увеличивают до достижения максимально переносимой дозировки, и вводят фиксированную дозу ингибитора рецепторной тирозинкиназы c-Met, например, 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида. Альтернативно, можно вводить фиксированную дозу ингибитора фосфатидилинозитол 3-киназы, выбранного из группы, состоящей из соединения формулы (I) (например, СОЕДИНЕНИЯ A или B), соединения формулы (II) (например, СОЕДИНЕНИЯ C) или соединения формулы (III)(например, СОЕДИНЕНИЯ D), и можно увеличивать дозу ингибитора рецепторной тирозинкиназы c-MET, например, 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида. Каждый пациент может получать дозы ингибитора фосфатидилинозитол 3-киназы или ежедневно, или с перерывами. Эффективность лечения по таким исследованиям можно определять, например, спустя 12, 18 или 24 недели посредством оценки выраженности симптомов каждые 6 недель.
Измерение синергетического взаимодействия между одним или несколькими компонентами, оптимальный диапазон для воздействия и диапазоны абсолютной дозы каждого компонента для воздействия можно однозначно осуществить посредством введения компонентов при различных диапазонах соотношения масс./масс. и доз для пациентов, нуждающихся в лечении. Ввиду сложности и стоимости проведения клинических исследований на пациентах применение этой формы испытания в виде первичной модели для синергичности может показаться людям практически нецелесообразным. Однако посредством наблюдения за синергичностью у одного вида можно прогнозировать воздействие на другие виды, и существуют модели на животных, как описано в настоящем документе, для измерения синергетического действия, и результаты таких исследований также можно использовать для потенциального определения диапазонов соотношений эффективных доз и абсолютных доз и концентрации плазмы, необходимых для других видов, посредством применения фармакокинетических/фармакодинамических способов. Определенная корреляция между моделями опухоли и воздействием, наблюдаемая у человека, позволяет предположить, что синергичность у животных можно продемонстрировать, например, с помощью ксенотрансплантатных моделей или в соответствующих линиях клеток.
В способах по настоящему изобретению можно использовать комбинации ингибиторов фосфатидилинозитол 3-киназы, составленных в фармацевтическую композицию, содержащую один или несколько фармацевтически приемлемых носителей.
В одном из аспектов изобретение относится к фармацевтической композиции, содержащей количество, в совокупности являющееся терапевтически эффективным по отношению к пролиферативному заболеванию, в частности c-Met-зависимому пролиферативному заболеванию КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ и одного или нескольких фармацевтически приемлемых носителей. Эта фармацевтическая композиция может состоять из терапевтических средств (a) и (b), вводимых пациенту в качестве фиксированной комбинации в единичном составе или стандартной лекарственной форме любым подходящим способом. Альтернативно, терапевтические средства, например, как ингибитор фосфатидилинозитол 3-киназы, так и ингибитор рецепторной тирозинкиназы c-Met или его фармацевтически приемлемую соль, вводят пациенту в качестве нефиксированной комбинации в отдельных фармацевтических композициях или составах или стандартных лекарственных формах и вводят или одномоментно, одновременно, или последовательно с отсутствием конкретных временных сроков.
В предпочтительном варианте осуществления изобретение относится к фармацевтическим композициям, раздельно содержащим количество, в совокупности являющееся терапевтически эффективным по отношению к пролиферативному заболеванию, в частности c-Met-зависимому пролиферативному заболеванию, терапевтическое средство (a) и терапевтическое средство (b), которые вводят одновременно, но раздельно, или вводят последовательно нуждающемуся в этом индивидууму.
Фармацевтические композиции для раздельного введения терапевтических средств или для введения терапевтических средств в фиксированной комбинации, т.е. единичной галеновой композиции, содержащей КОМБИНАЦИЮ ПО ИЗОБРЕТЕНИЮ, можно получать способом, известным по существу и, ими является те, которые подходят для энтерального введения, такого как пероральное или ректальное, и парентерального введения индивидуумам (теплокровным животным), включая людей, и которые содержат терапевтически эффективное количество, по меньшей мере, одного фармакологически активного терапевтического средства в отдельности, например, как указано выше, или в комбинации с одним или несколькими фармацевтически приемлемыми носителями, в особенности подходящими для энтерального или парентерального применения.
Новая фармацевтическая композиция может содержать, от приблизительно 0,1% до приблизительно 99,9%, предпочтительно от приблизительно 1% до приблизительно 60%, терапевтических(ого) средств(а).
Фармацевтические композиции для комбинированного лечения, включая фиксированные комбинации или нефиксированные комбинации, для энтерального или парентерального введения являются, например, те, которые представлены в стандартных лекарственных формах, таких как таблетки, покрытые сахарной оболочкой, таблетки, капсулы или суппозитории, или ампулы. Если не указано иное, их получают способом, известным по существу, например, посредством различных общепринятых процессов смешивания, измельчения, гранулирования, покрытия сахарной оболочкой, растворения, лиофилизации или технологией производства, очевидных специалистам в данной области. Следует понимать, что содержание единичной дозы терапевтического средства, содержащегося в индивидуальной дозе каждой лекарственной формы, не обязательно само по себе представляет собой эффективное количество ввиду того, что необходимого эффективного количества можно достичь посредством введения множества дозированных единиц.
Единичная лекарственная форма, содержащая комбинацию средств и отдельные средства комбинации, может быть представлена в форме микротаблеток внутри капсулы, например, желатиновой капсулы. Для этого можно использовать желатиновую капсулу, как при использовании в фармацевтических составах, такую как твердая желатиновая капсула, известная как CAPSUGEL, доступная от Pfizer.
Стандартные лекарственные формы по настоящему изобретению могут необязательно дополнительно содержать дополнительные общепринятые носители или эксципиенты, используемые для фармацевтических препаратов. Примеры таких носителей в качестве неограничивающих примеров включают дезинтегранты, связывающие средства, смазочные средства, способствующие скольжению средства, стабилизаторы и наполнители, разбавители, красители, ароматизаторы и консерванты. Специалист в данной области может выбрать один или несколько из вышеуказанных носителей в отношении конкретных необходимых свойств лекарственной формы посредством общепринятого экспериментирования и без каких-либо неоправданных затрат. Количество каждого используемого носителя может варьироваться в пределах диапазонов, общепринятых в данной области. В следующих ссылках, содержание всех из которых, таким образом, включено посредством ссылки, описаны методы и эксципиенты, используемые для составления пероральных лекарственных форм. См. The Handbook of Pharmaceutical Excipients, 4 издание, Rowe et al., Eds., American Pharmaceuticals Association (2003); и Remington: the Science и Practice of Pharmacy, 20 издание, Gennaro, Ed., Lippincott Williams & Wilkins (2003).
Эти необязательные дополнительные общепринятые носители могут быть включены в пероральную лекарственную форму или посредством включения одного или нескольких общепринятых носителей в исходную смесь до, или во время гранулирования из расплава, или посредством комбинирования одного или нескольких общепринятых носителей с гранулами в пероральной лекарственной форме. В последнем варианте осуществления комбинированную смесь можно дополнительно смешивать, например, с помощью V-образного смесителя, и затем компрессовать или прессовать в таблетку, например монолитную таблетку, заключать в капсулу или наполнять в саше-пакет.
Примеры фармацевтически приемлемых дезинтегрантов в качестве неограничивающих примеров включают крахмалы; глину; целлюлозы; альгинаты; камеди; сшитые полимеры, например, сшитый поливинилпирролидон или кросповидон, например, POLYPLASDONE XL от International Specialty Products (г. Уэйн, штат Нью-Джурси); сшитую карбоксиметилцеллюлозу натрия или кроскармеллозу натрия, например, AC-DI-SOL от FMC; и сшитую карбоксиметилцеллюлозу кальция; соевые полисахариды; и гуаровую камедь. Дезинтегрант может присутствовать в количестве от приблизительно 0% до приблизительно 10% по массе композиции. В одном из вариантов осуществления дезинтегрант присутствует в количестве от приблизительно 0,1% до приблизительно 5% по массе композиции.
Примеры фармацевтически приемлемых связывающих средств в качестве неограничивающих примеров включают крахмалы; целлюлозы и их производные, например, микрокристаллическую целлюлозу, например, AVICEL PH от FMC (г. Филадельфия, штат Пенсильвания), гидроксипропилцеллюлозу, гидроксилэтилцеллюлозу и гидроксилпропилметилцеллюлозу МЕТОЦЕЛ от Dow Chemical Corp. (г.Мидленд, штат Мичиган); сахарозу; декстрозу; кукурузный сироп; полисахариды; и желатин. Связывающее средство может присутствовать в количестве от приблизительно 0% до приблизительно 50%, например, 2-20% по массе композиции.
Примеры фармацевтически приемлемых смазочных средств и фармацевтически приемлемых способствующих скольжению средств в качестве неограничивающих примеров включают коллоидный диоксид кремния, трисиликат магния, крахмалы, тальк, трикальцийфосфат, стеарат магния, стеарат алюминия, стеарат кальция, карбонат магния, оксид магния, полиэтиленгликоль, порошковую целлюлозу и микрокристаллическую целлюлозу. Смазочное средство может присутствовать в количестве от приблизительно 0% до приблизительно 10% по массе композиции. В одном из вариантов осуществления смазочное средство может присутствовать в количестве от приблизительно 0,1% до приблизительно 1,5% по массе композиции. Способствующее скольжению средство может присутствовать в количестве от приблизительно 0,1% до приблизительно 10% по массе.
Примеры фармацевтически приемлемых наполнителей и фармацевтически приемлемых разбавителей в качестве неограничивающих примеров включают кондитерский сахар, прессуемый сахар, декстраты, декстрин, декстрозу, лактозу, маннит, микрокристаллическую целлюлозу, порошковую целлюлозу, сорбит, сахарозу и тальк. Наполнитель и/или разбавитель, например, может присутствовать в количестве от приблизительно 0% до приблизительно 80% по массе композиции.
В одном из вариантов осуществления фармацевтическая композиция содержит количество, являющееся в совокупности терапевтически эффективным по отношению к пролиферативному заболеванию, в особенности-Met-зависимому пролиферативному заболеванию, КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ и одного или нескольких фармацевтически приемлемых носителей, где ингибитор фосфатидилинозитол 3-киназы выбран из группы, состоящей из СОЕДИНЕНИЯ A, СОЕДИНЕНИЯ B, СОЕДИНЕНИЯ C и СОЕДИНЕНИЯ D или их фармацевтически приемлемой соли.
В дополнительном варианте осуществления фармацевтическая композиция содержит количество, являющееся в совокупности терапевтически эффективным по отношению к пролиферативному заболеванию, КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ и одного или нескольких фармацевтически приемлемых носителей, где ингибитором c-Met является 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемая соль.
В дополнительном варианте осуществления фармацевтическая композиция содержит количество, являющееся в совокупности терапевтически эффективным по отношению к пролиферативному заболеванию, КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ и одного или нескольких фармацевтически приемлемых носителей, где ингибитором фосфатидилинозитол 3-киназы является СОЕДИНЕНИЕ C, СОЕДИНЕНИЕ D или их фармацевтически приемлемая соль, и ингибитором c-Met является 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид или его фармацевтически приемлемая соль.
В дополнительном варианте осуществления фармацевтическая композиция содержит количество, являющееся в совокупности терапевтически эффективным по отношению к пролиферативному заболеванию, КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ и одного или нескольких фармацевтически приемлемых носителей, где ингибитором фосфатидилинозитол 3-киназы является СОЕДИНЕНИЕ C, СОЕДИНЕНИЕ D или их фармацевтически приемлемая соль, и ингибитором c-Met является PF2341066 (также известный как crizotinib) или его фармацевтически приемлемая соль.
В соответствии с настоящим изобретением, терапевтически эффективное количество каждого из терапевтических средств комбинации по изобретению можно вводить одномоментно или последовательно и в любом порядке, и компоненты можно вводить раздельно или в качестве фиксированной комбинации. Например, способ лечения пролиферативного заболевания по изобретению может содержать (i) введение первого терапевтического средства (a) в свободной или фармацевтически приемлемой солевой форме, и (ii) введение терапевтического средства (b) в свободной или фармацевтически приемлемой солевой форме, одномоментно или последовательно в любом порядке, в совокупном терапевтически эффективном количестве, предпочтительно в синергетически эффективном количестве, например, в дозировках, вводимых ежесуточно или с перерывами, соответствующих количеству, описываемому в настоящем документе. Отдельные терапевтические средства КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ можно вводить раздельно в различное время в период проведения терапии или одновременно в разделенных или единичных формах комбинации. Кроме того, термин «введение» также включает использование пролекарственного средства терапевтического средства, по существу преобразующегося in vivo в терапевтическое средство. Таким образом, подразумевается, что настоящее изобретение охватывает все такие схемы одномоментного или чередующегося лечения, и термин «введение» следует толковать таким образом.
Эффективная дозировка каждого из терапевтических средств, используемых в КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ, может варьироваться в зависимости от конкретного используемого соединения или фармацевтической композиции, способа введения, состояния, подлежащего лечению, и степени тяжести состояния, подлежащего лечению. Таким образом, режим дозирования комбинации по изобретению выбран в соответствии со многими различными факторами, включая способ введения и функцию почек и печени пациента. Клиницист или врач в данной области легко может определить и установить эффективное количество одиночных терапевтических средств, необходимых для смягчения, противодействия или приостановления прогрессирования состояния.
Для эффективной дозы каждого из терапевтических средств может потребоваться более частое введение одного из соединения(й) по сравнению с другим(и) соединением(ями) в комбинации. Таким образом, для обеспечения соответствующей дозы упакованные фармацевтические препараты могут содержать одну или несколько лекарственных форм, содержащих комбинацию соединений, и одну или несколько лекарственных форм, содержащих одну из комбинаций соединений, но не другое(ие) соединение(я) комбинации.
При применении терапевтических средств, используемых в КОМБИНАЦИИ ПО ИЗОБРЕТЕНИЮ, в форме, зарегистрированной для продажи в виде единичных препаратов, их дозировка и способ введения может соответствовать информации, представленной на вкладыше в упаковке соответствующего зарегистрированного для продажи препарата, если иное не указано в настоящем документе.
Доза соединения формулы I, в особенности СОЕДИНЕНИЯ A, или его фармацевтически приемлемой соли для введения нуждающемуся в этом индивидууму, например, людям с массой тела приблизительно 70 кг составляет предпочтительно от приблизительно 3 мг до приблизительно 5 г, более предпочтительно от приблизительно 10 мг до приблизительно 1,5 г, более предпочтительно от приблизительно 100 мг до приблизительно 1200 мг, наиболее предпочтительно от приблизительно 100 мг до приблизительно 1000 мг на человека в сутки, разделенных предпочтительно на 1-3 однократные дозы, которые могут быть, например, соразмерными.
Соединение формулы II, в особенности СОЕДИНЕНИЕ C, предпочтительно вводить ежесуточно в дозе, находящейся в диапазоне от приблизительно 0,001 до 1000 мг/кг массы тела и более предпочтительно от 1,0 до 30 мг/кг массы тела. В одном предпочтительном варианте осуществления дозировка соединения формулы I, в особенности СОЕДИНЕНИЯ C, находится в диапазоне от приблизительно 10 мг до приблизительно 2000 мг на человека в сутки.
Дозу соединения формулы III, в особенности СОЕДИНЕНИЯ D, предпочтительно вводить ежесуточно в диапазоне от приблизительно 0,05 до приблизительно 50 мг на килограмм массы тела реципиента в сутки; предпочтительно приблизительно 0,1-25 мг/кг/сутки, более предпочтительно от приблизительно 0,5 до 10 мг/кг/сутки. Таким образом, для введения человеку массой тела 70 кг наиболее предпочтительный диапазон доз составляет приблизительно 35-700 мг в сутки.
Ингибитор рецепторной тирозинкиназы c-Met, в частности 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид, предпочтительно вводить ежесуточно в дозе, находящейся в диапазоне от приблизительно 0,01 мг/кг до приблизительно 100 мг/кг массы тела в сутки. Таким образом, для введения человеку массой тела 70 кг наиболее предпочтительный диапазон доз составляет от приблизительно 0,7 мг до 7 г в сутки, более предпочтительно от 50 мг до 300 мг в сутки.
Оптимальную дозу каждого терапевтического средства для лечения пролиферативного заболевания можно определять эмпирически для каждого индивидуума с применением известных способов, и она будет зависеть от многих различных факторов, включая, но не ограничиваясь ими, степень прогрессирования заболевания; возраст, массу тела, общее состояние здоровья, пол и питание индивидуума; время и способ введения; и другие лекарственные средства, принимаемые индивидуумом. Оптимальную дозировку можно установить с использованием стандартного тестирования и методик, хорошо известных в данной области.
Количество каждого терапевтического средства, которое можно комбинировать с материалом-носителем для получения единичной лекарственной формы, варьируется в зависимости от индивидуума, получающего лечение, и конкретного способа введения. В некоторых вариантах осуществления в стандартных лекарственных формах, содержащих комбинацию средств, как описано в настоящем документе, каждое средство комбинации представлено в таком количестве, в котором средства, как правило, вводят по отдельности.
Частота введения дозы может варьироваться в зависимости от используемого соединения и конкретного состояния, подлежащего лечению. В основном, предпочтительным является использование минимальной дозировки, достаточной для обеспечения эффективной терапии. Как правило, можно проводить мониторинг терапевтической эффективности у пациентов с использованием анализов, подходящих для состояния, подлежащего лечению, и известных специалистам в данной области.
В одном из вариантов осуществления настоящее изобретение относится к фармацевтической комбинации терапевтических средств, СОЕДИНЕНИЯ A или B или его фармацевтически приемлемой соли и ингибитора рецепторной тирозинкиназы c-Met, предпочтительно 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида), или его фармацевтически приемлемой соли, которые могут присутствовать в комбинациях, фармацевтических композициях и лекарственных формах, описываемых в настоящем документе в соотношении в диапазоне 20:1 до 2:1, более предпочтительно 20:1 до 5:1, соответственно, ежесуточно.
В предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической комбинации терапевтических средств, СОЕДИНЕНИЯ C или его фармацевтически приемлемой соли и ингибитора рецепторной тирозинкиназы c-Met, предпочтительно 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида или его фармацевтически приемлемой соли, присутствующих в дозированном соотношении в диапазоне 1:1 до 1:4 ежедневно, более предпочтительно 1:1 или 1:2 ежесуточно.
В предпочтительном варианте осуществления настоящее изобретение относится к фармацевтической комбинации терапевтических средств, СОЕДИНЕНИЯ D или его фармацевтически приемлемой соли и ингибитора рецепторной тирозинкиназы c-Met, предпочтительно 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида или его фармацевтически приемлемой соли, присутствующих в дозированном соотношении в диапазоне 8:1 до 1:1, более предпочтительно 4:1 до 2:1 до 1:1, соответственно, ежесуточно.
Оптимальные соотношения, индивидуальные и комбинированные дозы и концентрации лекарственных соединений, являющихся эффективными при отсутствии токсичности, основаны на кинетике возможности доступа терапевтических средств к целевым сайтам, и их определяют с использованием способов, известных специалистам в данной области.
Кроме того, настоящее изобретение относится к серийной упаковке, содержащей в качестве терапевтических средств КОМБИНАЦИЮ ПО ИЗОБРЕТЕНИЮ, вместе с инструкциями для ее одномоментного, раздельного или последовательного введения при лечении пролиферативного заболевания. В предпочтительном варианте осуществления пролиферативным заболеванием является c-Met-зависимое пролиферативное заболевание. В предпочтительном варианте осуществления пролиферативным заболеванием является рак легких (например, немелкоклеточный рак легких) или глиобластома.
Описанное выше изобретение пояснено в следующих примерах; однако, предполагается, что они ни коим образом не ограничивают объем изобретения. Положительное воздействие фармацевтической комбинации по настоящему изобретению можно также определить с помощью других моделей для испытания, известных квалифицированному специалисту в области техники.
Полезность КОМБИНАЦИИ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ, как описано в настоящем документе, можно продемонстрировать in vitro, в способах испытания на животных, а также в клинических исследованиях. Например, полезность соединений формулы (I) в соответствии с настоящим изобретением можно продемонстрировать в соответствии со способами, описываемыми далее в настоящем документе:
Пример 1: Комбинации с СОЕДИНЕНИЕМ A при немелкоклеточном раке легких
Материалы и методы
Комбинацию ингибитора PI3K (СОЕДИНЕНИЯ A) и ингибитора рецепторной тирозинкиназы c-MET 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида, оценивают на моделях немелкоклеточного рака легких. Смесь обоих соединений получают отдельно в ДМСО. Соединения серийно разбавляют с использованием дозатора Tecan для обеспечения диапазона концентрации 1000x. Самой высокой концентрацией, использованной для эксперимента, является следующая: СОЕДИНЕНИЕ A=2,7 мкМ и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид=0,27 мкМ. Как одиночный компонент, так и комбинации тестируют при множестве различных концентраций, вместе с контролями и одной перекрестной.
Культура клеток и измерения жизнеспособности
Линии клеток, используемые в исследовании, приобретают из Американской коллекции типовых клеток, включая линии клеток немелкоклеточного рака легких человека EBC-1 (несущим амплификацию c-Met), NCI-H1993 (несущим амплифицированный c-MET), NCI-H1648 (несущим амплификацию c-Met), NCI-H1573 (несущим амплификацию c-Met и мутацию KRAS) и HCC2935 (мутация EGFR). Все линии клеток хранят в соответствующей среде для культивирования, как поставщиком.
Для оценки воздействия комбинации клетки высевают в 384-луночные планшеты при 500 клеткок/лунку и инкубируют в течение ночи. Содержимое основных планшетов с содинением предварительно разбавляют 1:200 (1 мкл раствора соединения к 200 мкл среды для культивирования клеток RPMI-160, содержащей 10% эмбриональной телячьей сыворотки) перед переносом 5 мкл этого предварительного раствора в клеточные пластины, содержащие 20 мкл среды для культивирования клеток, для достижения целевой конечной концентрации соединения, а также 0,09% концентрации носителя (ДМСО).
Воздействие одиночных компонентов, а также их комбинации на жизнеспособность клеток оценивают через 72 часа инкубации при 37°C/5% CO2 посредством количественного измерения клеточного уровня АТФ (CellTiterGlo, Promega) с использованием 25 мкл реагента/лунку и n=2 повторных планшетов на состояние. Количество/жизнеспособность клеток во время добавления соединения оценивают аналогично и используют для оценки времени удвоения популяции линии клеток.
Для необработанных и обработанных, U и T, уровни ингибирования рассчитывают с использованием формулы I=1-T/U, диапазон которого составляет от 0% до 100% для полного ингибирования. «Ингибирование роста» GI=1-(T-U0)/V0 при T<U0 и 1-(T-U0)/(U-U0) в остальных случаях, где U0 является уровнем без обработки при нулевом времени. Уровни GI, составляющие 0, 100% и 200% соответствуют неактивным, цитостатическим и цитотоксическим соединениям.
Активность соединения, синергичность и расчет селективности
Активность одиничного компонента для каждого соединения характеризуют посредством применения сигмоидальной функции Хилла формы I=ImaxCα/[Cα+EC50α], где C является концентрацией, EC50 является точкой перегиба и α является сигмоидальностью. Расчет точки пересечения IC50 производят при достижении кривой, построенной по экспериментальным точкам, 50% ингибирования.
Для комбинаций расчет синергичности обозначают как аддитивную модель Лоэва (ожидание «взаимодействия лекарственного средства с самим собой», получаемое в результате добавления эффективных доз). Расчет ожидания Лоэва [Loewe S., Ergebn Physiol 27: 47-187 (1928)) производят при каждой совместной дозе CX,Y, определяя ингибирование ILoewe таким, что (CX/ICX)+(CY/ICY)=1 и ICX,Y являются эффективной концентрацией при ILoewe для кривых одиночного компонента, построенных по экспериментальным точкам, с использованием численной оптимизации [Berenbaum MC, J Theor Biol 114: 413-431 (1985)]. Расчет «показателя синергичности» S производят посредством усреднения разницы между Idata и ILoewe на всех точках с координатами доз тестируемой комбинации, исключая точку самой высокой концентрации в матрице доз, в которой наиболее вероятно преобладает нецелевое воздейсвтвие лекарственного средства. GImax является максимальным ингибированием роста в матрице (исключая самую высокую совместную дозу), в качестве измерения общей эффективности комбинации.
Оценку избирательной синергичности осуществляют посредством сравнения показателей синергичности оценивают для комбинации на всех тестируемых линиях клеток. Расчет «показателя избирательности» для этой комбинации в единичной линии клеток производят как SS=abs(S)*GImax*(S-μ)/σ, где μ является срединным значением, и σ является срединным абсолютным отклонением S на всех линиях клеток. Этот взвешенный Z-показатель выделяет комбинации, являющиеся исключительно синергичными в линии клеток и являющиеся сами по себе как эффективными, так и синергичными.
Все расчеты проводят с использованием программного обеспечения Chalice (CombinatoRx, Cambridge MA). В этом эксперименте толкование данных GImax осуществляют по следующей шкале: (a) GImax=«0» указывает на отсутствие ингибирования, (b) GImax=приблизительно «1» указывает на 100% ингибирование и остановку роста, и (c) GImax=2 указывает на 200% ингибирование и полную ликвидацию или гибель клеток рака. С использованием этой методики эффективность комбинации (GImax), исключая самую высокую концентрацию, представлена следующим образом:
|
В этом эксперименте толкование синергетического показателя (СП) осуществляют следующим образом: (a) SS=«0» указывает на синергичность, (b) SS=«0,1» указывает на высокую степень синергичности, и (c) SS=отрицательное значение от «-0,01 до -0,07» указывает на аддитивность. Показатель избирательной синергичности, полученный для комбинации, исключая самую высокую концентрацию, представлен следующим образом:
|
Пример 2: Комбинации с СОЕДИНЕНИЕМ C при немелкоклеточном раке легких
После экспериментальной методики, описанной выше в примере 1, эффективность и синергичность комбинации ингибитора PI3K, СОЕДИНЕНИЯ C, и ингибитора рецепторной тирозинкиназы c-MET 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида, оценивают на моделях немелкоклеточного рака легких. Соединения серийно разбавляют с использованием дозатора Tecan для обеспечения диапазона концентрации 1000x. Самой высокой концентрацией, использованной для эксперимента, является следующая: СОЕДИНЕНИЕ C=11 мкМ и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид=0,27 мкМ. Как одиночный компонент, так и комбинации тестируют при многих различных концентрациях, вместе с контролями и одной перекрестной.
Все расчеты проводят с использованием программного обеспечения Chalice (CombinatoRx, Cambridge MA). С использованием этой методики эффективность комбинации (GImax), исключая самую высокую концентрацию, представлена следующим образом:
|
Кроме того, показатель избирательной синергичности для комбинации, исключая самую высокую концентрацию, представлен следующим образом:
|
Пример 3: Комбинации с СОЕДИНЕНИЕМ D при немелкоклеточном раке легких
После экспериментальной методики, описанной выше в примере 1, эффективность и синергичность комбинации ингибитора PI3K, СОЕДИНЕНИЯ D, и ингибитора рецепторной тирозинкиназы c-MET 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида, оценивают на моделях немелкоклеточного рака легких. Соединения серийно разбавляют с использованием дозатора Tecan для обеспечения диапазона концентрации 1000x. Самой высокой концентрацией, использованной для эксперимента, является следующая: СОЕДИНЕНИЕ D=11 мкМ и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид=0,27 мкМ. Самой низкой концентрацией, использованной для эксперимента, является следующая: СОЕДИНЕНИЕ D=0,15 мкМ и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид=0,0003 мкМ. Как одиночный компонент, так и комбинации тестируют при многих различных концентрациях, вместе с контрольными, и одной перекрестной.
Все расчеты проводят с использованием программного обеспечения Chalice (CombinatoRx, Cambridge MA). С использованием этой методики эффективность комбинации (GImax), исключая самую высокую концентрацию, представлена следующим образом:
|
Кроме того, показатель избирательной синергичности для комбинации, исключая самую высокую концентрацию, представлен следующим образом:
|
Пример 4: Комбинации с СОЕДИНЕНИЕМ C при глиобластоме
Способы
Комбинацию ингибитора PI3K, СОЕДИНЕНИЯ C, и ингибитора рецепторной тирозинкиназы c-MET 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида, оценивают на опухолевых моделях глиобластомы. СОЕДИНЕНИЕ C (10 мМ) и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид (10 мМ) растворяют в ДМСО и хранят в аликвотах при -20°C.
Культура клеток и анализ жизнеспособности клеток
Линии клеток глиобластомы человека, U-87 MG (мутантный PTEN и экспрессирующая линия HGF), H4 (мутантный PTEN и экспрессирующая линия HGF), A172 (мутантная линия PTEN с низким уровнем экспрессии HGF) и LN-229 (PTEN дикого типа и низкий HGF) приобретают из Американской коллекции типовых клеток и хранят в увлажненном инкубаторе при 37°C в 5% CO2 в рекомендованной среде. Все четыре линии клеток экспрессируют детектированный MET при уровне мРНК.
Клетки перевивают два раза в неделю, и среду меняют каждые 2-3 суток. Для проведения анализа жизнеспособности клеток клетки трипсинизируют с использованием TryPLE Express и высевают (4000 клеток/лунку) в 96-луночные черные планшеты с прозрачным дном (Costar, #3904) в трех параллельных опытах, и оставляют для прикрепления в течение ночи спустя 72 часа инкубации при различных концентрациях компонентов ингибитора или комбинаций компонентов.
Жизнеспособность клеток определяют посредством измерения клеточного содержания АТФ с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (CTG) (Promega). Каждую обработку клеток с помощью одного средства и с помощью комбинации сравнивают с контролями или клетками, обработанными эквивалентным объемом среды. Равный объем реагентов CTG добавляют в каждую лунку в конце обработки соединения и люминесценцию записывают на планшетном спектрофотометре Envision (Perkin Elmer). Расчет уменьшенных и повышенных значений сигнала люминесценции (ответной реакции) производят относительно необработанных (контрольных) клеток.
Способ расчета воздействия комбинаций
Для объективной оценки антипролиферативной активности этого ингибитора PI3K с этим ингибитором cMET, а также для определения синергетического действия при всех возможных концентрациях, проводят исследования с помощью «матрицы доз». При этом используются все возможные перестановки серийно разбавленного одиночного компонента и «матрицы доз», состоящей из следующего:
● СОЕДИНЕНИЯ C, которое подвергают серийному разведению из расчета 5 доз 2X с высокой дозой, составляющей 2,4 мкМ, и низкой дозой, составляющей приблизительно 150 нМ.
● Этого ингибитора c-MET, который подвергают серийному разведению из расчета 5 доз 2X, с высокой дозой, составляющей 1 мкМ, и низкой дозой, составляющей приблизительно 12 нМ.
Расчет синергетического взаимодействия (анализируемого с использованием программного обеспечения Chalice [CombinatoRx, Cambridge MA]) производят посредством сравнения ответной реакции от комбинации и ответной реакции компонента, выступающего в отдельности, по отношению к эталонной модели добавочных доз для случая взаимодействия лекарственного средства с самим собой. Отклонения от добавочной дозы можно оценивать количественно с помощью показателя аддитивности (CI), который является количественным измерением общей силы воздействия комбинации. Этот расчет (по существу показатель объема) представлен следующим образом:
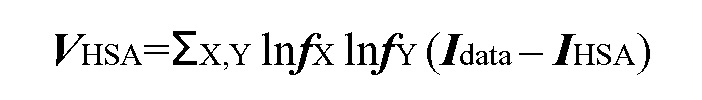
Дополнительно, осуществляют расчет CI между данными и самым высоким значением поверхности одиночного компонента, нормализованным для факторов разведения одиночного компонента (Lehar J et al (2009), «Synergistic drug combinations tend to improve therapeuticaly relevant selectivity», Nature Biotechnology 27: 659-66 (2009).)
Анализ данных
Оценку данных и составление графика проводят с использованием программного обеспечения Microsoft Excel и программного обеспечения Chalice.
Результаты
Воздействие СОЕДИНЕНИЯ C и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида оценивают методом «матрицы доз», как указано выше. Все четыре клетки обрабатывают в 96-луночном формате в течение 2 суток СОЕДИНЕНИЕМ C и 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамидом. Жизнеспособность клеток измеряют с использованием анализа CellTiter-Glo, и данные % ингибирования количественно отображаются в виде шкалы доз 6 X6. На фигурах с 1 до 4 в настоящем документе представлен краткий обзор результатов вышеуказанной методики. Каждая эксперименталная точка представляет собой усредненные данные из 3 лунок, и цветовой спектр также представляет собой уровень ингибирования. Выделенные полужирным шрифтом прямоугольники обозначают область, где комбинация является более эффективной, чем одиночные компоненты в такой же дозе.
Процент ингибирования по всей школе доз показан на фигурах 1-4 в настоящем документе. СОЕДИНЕНИЕ C показывает антипролиферативную активность, зависимую от концентрации, во всех четырех линиях клеток, меньшую активность в одной линии клеток, а именно PTEN дикого типа (LN229). 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид показывает только умеренную активность в двух высоких уровнях линий клеток HGF (U87 MG и H4), полное отсутствие активности в двух других (A172 и LN229). При совместном использовании синергичность наблюдают как у H4, так и U87-МГ, но в A172 и LN229, в которых подтвердились более высокие показатели ингибирования роста, чем у каждого из одиночных компонентов в выделенных областях, а также изоболограммах, показанных на фигурах 1-4 в настоящем документе.
Данные позволяют предположить, что эта комбинация синергетически ингибирует рост субпопуляции линий клеток глиобластомы, мутантной PTEN, а также высоких уровней линий клеток HGF, и, как поедставляется, комбинация более чувствительна к каждому из одиночных компонентов, и приводит к более выраженному ингибированию роста.
Пример 5: Комбинации с СОЕДИНЕНИЕМ C на ксенотрансплантатных моделях глиобластомы
В этом эксперименте ксенотрансплантатную модель глиобластомы человека U-87 MG используют оценки противоопухолевой эффективности ингибитора PI3K, СОЕДИНЕНИЯ C, и ингибитора c-Met 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида, в качестве одиночных компонентов или в комбинации. Отмечается, что опухолевые клетки U-87 MG, полученные из Национального института рака, являются гомозиготными для вероятных онкогенных вариантов CDKN2A, CDKN2C, CDKN2a и PTEN; детектировано отсутствие мутации в MET, PIK3CA или 58 других генах, часто видоизменяющихся в опухолевых клетках; и экспрессия HGF.
Мыши получали лечение ежесуточно в течение 21 суток с помощью монотерапии 17,7 и 35,3 мг/кг ингибитором c-Met и 32,7 мг/кг СОЕДИНЕНИЕМ C, и с помощью двухкомпонентной терапии ингибитором c-Met/СОЕДИНЕНИЕМ C при 17,7:32,7. Комбинацию ингибитора c-Met/СОЕДИНЕНИЯ C при соотношении доз 58,8:5,4 мг/кг включали в это исследование. Контрольная группа мышей получала обоих носителей, и показатели опухолевой модели контролировали с помощью стандартной доклинической схемы приема темозоломида. Пероральное лечение начали на 1 сутки на мышах «nude» с установленными подкожными опухолями. Каждое животное подвергали эвтаназии, когда опухоль достигала предопределенного предельного объема, составляющего 2000 мм3, или на 60 сутки, в зависимости от того, что произошло раньше. Исследование завершили на 51 сутки. Кратковременную эффективность определяли, исходя из средних и срединных изменений объема опухоли на 13 сутки, последние сутки до исключения из исследования более 50% мышей из любой группы. Общую эффективность определяли, исходя из времени, необходимого для прогрессирования опухоли до достижения предельного объема и исходя из выживаемости на 51 сутки и уровня регрессии. В этом отчете описаны способы и результаты эксперимента по сдерживанию роста опухоли U87MG-e326.
Мыши
Самки мышей «nude» (nu/nu, Charles River) с диапазоном массы тела (МТ) 15,5-27,3 г находятся на 1 сутки исследования в возрасте 10 недель. Животным дают неограниченно воду (обратный осмос, 1 ч./млн. Cl) и NIH 31 Modified и Irradiated Lab Diet®, состоящее из 18,0% сырого белка, 5,0% сырого жира и 5,0% сырой клетчатки. Мышей содержат на irradiated Enrich-o’cobs™ Laboratory Animal Bedding в статических микроизоляторах при 12-часовом цикле при 20-22°C (68-72°F) и влажности 40-60%.
Имплантация опухоли и измерение
Опухолевую линию клеток U-87 MG получали из Американской коллекции типовых клеток и поддерживали серийными трансплантациями у мышей «nude». Фрагмент опухоли (1 мм3) имплантировали подкожно в правый бок испытуемой мыши. Опухоли измеряют кронциркулем в двух измерениях для контроля роста при приближении значения среднего объема к необходимому диапазону 100-150 мм3. Размер опухоли в мм3, рассчитывали, исходя из: объема опухоли=(ширина2 × длина)/2, где ширина и длина (в мм) являются измерениями опухоли. Массу опухоли можно установить, если считать, что 1 мг эквивалентен 1 мм3 объема опухоли. Спустя четырнадцать суток после имплантации опухолевых клеток на 1 сутки исследования, мышей с индивидуальным объемом опухоли, составляющим 63-196 мм3, сортируют на семь групп со средним групповым объемом опухоли, составляющим 122-127 мм3.
Тестируемые препараты
Ингибитор c-Met 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид (ди-HCl соль, 84,98% свободного основания), хранят при 4°C и добавляют к деонизированной воде при конечной концентрации 2X и подвергают действию ультразвука до растворения. Равный объем 0,5% метилцеллюлозы и 0,1% Tween® 80 деонизированной воде добавляют для получения 5,884 мг/мл дозированного раствора в 0,25% метилцеллюлозе и 0,05% Tween® 80 в деонизированной воде (носитель 1). Этот раствор по частям разбавляют с помощью носителя 1 для получения 3,53 и 1,765 мг/мл дозированных растворов.
СОЕДИНЕНИЕ C (HCl соль, 91,85% свободного основания) хранят при -20°C и добавляют к 1% Tween® 80 в деонизированной воде и подвергают действию ультразвука для получения однородной суспензии при конечной концентрации 2X. Добавляют равный объем 1% метилцеллюлозы в деонизированной воде, и смесь перемешивают и подвергают действию ультразвука для получения 3,266 мг/мл непрозрачной бесцветной дозированной суспензии в 0,5% метилцеллюлозы и 0,5% Tween® 80 в деонизированной воде (носитель 2). 0,544 мг/мл дозированной суспензии получают посредством разбавления части первой суспензии с помощью носителя 2.
Темозоломид (Temodar®, Schering Corporation, капсула 100 мг, партия # IRSA001) получают единожды с помощью суспензии в деонизированной воде, и хранят при 4°C.
План лечения
Как тестируемые средства, так и носители вводят посредством перорального принудительного кормления один раз в сутки в течение двадцати-одних последующих суток (каждый день × 21). При способах комбинированного лечения дозу СОЕДИНЕНИЯ A дают через 60 минут после ингибитора c-Met. Темозоломид вводят перорально один раз в сутки в течение пяти последующих суток (каждый день x 5). Во всех группах дозированный объем 10 мл/кг (0,2 мл/20 г массы тела мыши) соизмеряют с массой каждого животного, определенной в сутки получения дозы, за исключением выходных, когда осуществляют перенос данных предыдущей МТ.
Семь групп мышей «nude» (n=10/группу) получают следующее лечение. Мыши группы 1 мыши получают носители 1 и 2, и служат в качестве контроля для всех анализов. На 7 сутки этой группе случайно дают дозу с отрицательным результатом на антитело IgG; было сделано заключение о том, что эта ошибка не оказала воздействия на контрольный рост опухоли. Группы 2 и 3 получают монотерапию c-Met при 17,7 и 35,3 мг/кг (эквивалентно 15 и 30 мг/кг свободного основания), соответственно. Группа 4 получает монотерапию СОЕДИНЕНИЕМ C при 32,7 мг/кг (30 мг/кг свободного основания). Группа 5 получает 17,7 мг/кг ингибитора c-Met в комбинации с 32,7 мг/кг СОЕДИНЕНИЯ C. Группа 6 получает 58,8 мг/кг ингибитора c-Met в комбинации с 5,4 мг/кг СОЕДИНЕНИЯ C (эквивалентно 50 и 5 мг/кг свободного основания, соответственно). Группа 7, эталонная группа, получает монотерапию темозоломидом при 100 мг/кг.
Ингибирование роста опухоли
Кратковременную эффективность определяют на 13 сутки. До 13 суток одно животное группы 1 с повторной опухолью исключают, когда суммарный объем опухоли достигает предельного значения. Последний отмеченный объем опухоли для этого животного включают в данные 13 суток. ΔTV, разницу объема опухоли с 1 суток (начала введения дозы) до суток достижения предельного значения определяли для каждого животного. Для каждой экспериментальной группы ответную реакцию на сутки достижения предельного значения рассчитывали посредством одного из следующих соотношений:
T/C (%)=100×ΔT/ΔC, для ΔT>0
T/T0 (%)=100×ΔT/T0, для ΔT<0,
где
ΔT=(средний объем опухоли экспериментальной группы на сутки достижения предельного значения) - (средний объем опухоли экспериментальной группы на 1 сутки),
ΔC=(средний объем опухоли контрольной группы на сутки достижения предельного значения) - (средний объем опухоли контрольной группы на 1 сутки) и
T0=средний объем опухоли контрольной группы на 1 сутки.
Отрицательное значение T/T0 представляет собой чистое уменьшение размеров опухоли для группы. Значение T/C, составляющее 40% или менее, предположительно указывает на потенциальную терапевтическую активность.
Сдерживание роста опухоли
Каждое животное подвергают эвтаназии при достижении предельного объема неоплазии (2000 мм3) или на последние сутки исследования (51 сутки). Для каждого животного, размер опухоли которого достигал предельного объема, время достижения предельного значения (TTE) рассчитывали посредством следующего уравнения:
TTE=(log10 (предельный объем) - b)/m
где TTE выражено в сутках, предельный объем представлен в мм3, b является пересечением и m представляет собой угловой коэффициент линии, получаемой посредством линейной регрессии совокупности данных лог-трансформированного роста опухоли. Данные содержат первое наблюдение, превышающее конечный объем исследования, и трех последовательных наблюдений, непосредственно предшествующих достижению конечного объема. У любого животного с опухолью, не достигающей предельного значения, значение TTE приравнивают к последним суткам исследования. У любого животного, классифицированного как погибшего по причинам, связанным с лечением, приравнивают значение TTE к суткам наступления смерти. Любого животного, классифицированного как погибшего по причинам, не связанным с лечением (за исключением метастаза), исключают из расчетов TTE.
Эффективность лечения определяют, исходя из сдерживания роста опухоли (TGD), которое определяют как увеличение среднего TTE для каждой экспериментальной группы по сравнению с контрольной группой:
TGD=T-C,
выраженное в сутках или процентах срединного TTE контрольной группы:
% TGD=[(T-C) C]×100
где:
T=срединное TTE для экспериментальной группы,
C=срединное TTE для обозначенной контрольной группы.
MTV и критерии для ответных регрессивных реакций
Эффективность лечения можно также определять, исходя из объема опухолей животных, оставшихся в исследовании на последние сутки, и исходя из количества ответных регрессивных реакций. MTV определяют как срединный объем опухоли на 51 сутки у числа оставшихся животных, n, опухоли которых не достигли предельного объема. Лечение может привести к частичной регрессии (ЧР) или полной регрессии (ПР) опухоли у животного. ЧР указывает на то, что объем опухоли составляет 50% или менее своего объема на 1 сутки в трех последовательных измерениях в ходе проведения исследования, и равен или составляет более чем 13,5 мм3 в одном или нескольких из этих трех измерений. ПР указывает на то, что объем опухоли составляет менее чем 13,5 мм3 в трех последовательных измерениях в ходе проведения исследования. Любое животное, у которого присутствует ответная реакция ПР на последние сутки исследования, дополнительно классифицируют как выжившего с отсутствием опухоли.
Токсичность
Животных взвешивают на 1-5 сутки, на каждые сутки лечения (за исключением выходных) и после этого два раза в неделю до окончания исследования. Определение самой низкой средней групповой МТ исключает измерения, произведенные после исключения из исследования более чем 50% подлежащих оценке мышей, и также исключает любое животное, классифицированное с летальным исходом, не связанным с лечением во время исследования. Приемлемую токсичность для максимально переносимой дозы (МПД) определяют как среднюю групповую потерю МТ, составляющую менее чем 15% во время проведения испытания, с не более чем одним случаем летального исхода, связанного с лечением, из числа десяти животных. Любое животное с потерей МТ, превышающей 15% в трех последовательных измерениях, или с потерей МТ, превышающей 20% в одном измерении, подвергают эвтаназии, и классифицируют как летальный исход, связанный с лечением, если это не первый случай летального исхода в группе. Летальный исход классифицируют как не связанный с лечением, если не подтверждено доказательствами то, что летальный исход связан с побочными эффектами лечения, и летальный исход случился не более чем через 14 суток после введения последней дозы. Летальные исходы, не связанные с лечением, подразделяют на следующие категории: летальный исход, являющийся результатом случайности или ошибки, летальный исход по неизвестным причинам или летальный исход по подтвержденной вскрытием причине распространения опухоли посредством инвазии и/или метастаза). Для сохранения животных при обеспечении максимальной информации первый летальный исход в группе классифицировали как летальный исход по неизвестным причинам; такой летальный исход, не связанный с лечением, переклассифицировали на связанный с лечением, если были зарегистрированы два последующих летальных исхода в этой же группе.
Статистический и графический анализ
Все статистические и графические анализы проводят с помощью Prism 3,03 (GraphPad) для Windows. Сначала изменения среднего объема опухоли для 1-7 групп сравнивают посредством дисперсионного анализа (ANOVA) с помощью теста Бартлетта. При наличии значимых отличий между дисперсиями (P<0,0001), отмеченных с помощью теста Бартлетта, группы сравнивают с помощью анализа Крускала-Уоллиса, показывающего значимые отличия в изменениях срединного объема опухоли (P<0,0001). Апостериорный тест множественных сравнений Данна сравнивает группы, получавшие лечение с помощью лекарственного средства, с контрольной группой 1. Эти непараметрические тесты повторяют один раз для сравнения одной из групп, получающей комбинированное лечение, с группами, получающими соответствующую монотерапию.
Выживаемость анализируют посредством способа Каплана-Мейера на основе значений TTE. Логранговый критерий (Кокса-Мантеля) применяют для определения значения разницы между критериями общей выживаемости (кривые выживаемости) двух групп. С помощью логрангового критерия анализируют индивидуальное TTE для всех животных в группе, кроме тех, которых исключили ввиду летального исхода, не связанного с лечением. Двусторонние статистические анализы проводят при P=0,05. С помощью Prism приводят результаты, являющиеся незначительными (ns) при P>0,05, значительными (обозначенными символом «*») при 0,01<P≤0,05, в высокой степени значительными («**») при 0,001P≤0,01 и в наивысшей степени значительными («***») при P≤0,001. Ввиду того, что тесты статистической значимости не обеспечивают оценку величины разницы между группами, все уровни значимости описаны как или значительные, или незначительные в рамках текста данного отчета.
Результаты
После проведения вышеуказанной методики получены следующие результаты исследования:
|
|
Монотерапия ингибитором c-Met при 15 мг/кг и 30 мг/кг приводит к 5% и 1% T/C, соответственно. СОЕДИНЕНИЕ C при 30 мг/кг приводит к 31% T/C. При комбинации 15 мг/кг ингибитора c-Met и 30 мг/кг СОЕДИНЕНИЯ C достигается регрессия опухоли с T/T0: -83%, что является более значительным результатом, чем при использовании одного средства в отдельности.
По окончании лечения процент сдерживания роста опухоли (%TGD) оценивают посредством контроля роста опухоли и записи времени достижения предельного значения (TTE). Группа, получавшая лечением носителем, достигла предельного значения на 11,7 сутки. Ингибитор c-Met при 15 мг/кг и 30 мг/кг увеличивает срединное TTE на 21,4 суток (183% TGD) и 23,4 суток (200%TGD), соответственно. СОЕДИНЕНИЕ C при 30 мг/кг увеличивает срединное TTE на 9,3 суток (79% TGD). Комбинация ингибитора c-Met при 15 мг/кг и СОЕДИНЕНИЯ C при 30 мг/кг демонстрирует увеличение срединного TTE на 28,7 суток, что составляет 245% TGD.
Пример 6: Комбинации с СОЕДИНЕНИЕМ D на ксенотрансплантатных моделях немелкоклеточного рака легких
В этом эксперименте ксенотрансплантатную модель немелкоклеточной карциномы легких человека NCI-H1993 используют для оценки противоопухолевой эффективности ингибитора PI3K, СОЕДИНЕНИЯ D, и ингибитора c-Met 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамида, в качестве одиночных компонентов или в комбинации. Опухолевые клетки NCI-H1993, приобретенные из Американской коллекции типовых клеток (ATCC), получены из метастазов в лимфоузлах пациента, находящегося на стадии 3A аденокарциномы легких и имеющего курение в анамнезе.
Мыши
Самки мышей «nude» (кнтр:NU (Ncr)-Foxn1nu, Charles River) с диапазоном массы тела (МТ) 16,1-26,2 г на 1 сутки исследования находятся в возрасте 8 недель. Животным дают неограниченно воду (обратный осмос, 1 ч./млн. Cl) и NIH 31 Modified и Irradiated Lab Diet®, состоящее из 18,0% сырого белка, 5,0% сырого жира и 5,0% сырой клетчатки. Мышей содержат на облученном Enrich-o’cobs™ Laboratory Animal Bedding Laboratory Animal Bedding при 12-часовом световом цикле при 20-22°C (68-72°F) и влажности 40-60%.
Имплантация опухоли и измерение
Опухолевую линию клеток NCI-H1993 получали из Американской коллекции типовых клеток и хранили в среде DRS_NC в RPMI-1640, содержащей 100 единиц/пенициллина-G-натрия, 100 мкг/мл сульфата стрептомицина, 25 мкг/мл гентамицина, 10% эмбриональной телячьей сыворотки и 2 мМ глутамина. Опухолевые клетки культивировали во флаконах для тканевых культур в увлажненном инкубаторе при 37°C в атмосфере, содержащей 5% CO2 и 95% воздуха.
Опухолевые клетки, использованные для имплантации, собирают во время лог-фазы роста и ресуспендируют в холодном ФСБ, содержащем 50% Matrigel™ (BD Biosciences). Каждой мыши подкожно вводят в правый бок 1×107 клеток (0,2 мл клеточной суспензии). Опухоли измеряют кронциркулем в двух измерениях для контроля роста при приближении значения среднего объема к необходимому диапазону 200-250 мм3. Размер опухоли, в мм3, рассчитывали, исходя из: объема опухоли=(ширина2 × длина)/2, где ширина и длина (в мм) являются измерениями опухоли. Массу опухоли можно установить, если считать, что 1 мг эквивалентен 1 мм3 объема опухоли. Спустя четырнадцать суток после имплантации опухолевых клеток на 1 сутки исследования, мышей с индивидуальным объемом опухоли, составляющим 172-256 мм3, сортируют на десять групп со средним групповым объемом опухоли, составляющим 206-215 мм3.
Тестируемые препараты
Ингибитор c-Met 2-фтор-N-метил-4-[7-хинолин-6-ил-метил)-имидазо[1,2-b][1,2,4]триазин-2-ил]бензамид, (соль HCl, 84,98% свободного основания) хранят при 4°C и добавляют к объему деонизированной воды. равному 1/2 конечного объема и подвергают действию ультразвука до растворения для получения однородной суспензии 2X. Равный объем 0,5% метилцеллюлозы: 0,1% Tween® 80 добавляют для получения 1,77 мг/мл раствора с конечной концентрацией носителя, составляющей 0,25% метилцеллюлозы и 0,05% Tween® 80 в деонизированной воде (носитель 1). Свежие растворы получают один раз в сутки для дозы в послеполуденные часы и хранят при комнатной температуре для дозы в дополуденное время.
СОЕДИНЕНИЕ D суспендируют при 3,0 мг/мл в 0,5% метилцеллюлозы в деонизированной воде. Носитель добавляют в частях, равных 1/3 конечного объема. Суспензию перемешивают на центрифуге-вортекс» после каждого добавления, а затем, наконец, пробу подвергают ультразвуку на льду для получения гомогенной белой суспензии. Свежую суспензию получают еженедельно, хранят при 4°C, и ресуспендируют перед введением дозы.
Носитель 2 получают при конечной концентрации носителя, составляющей 35% D5W (5% декстрозы в воде): 5% от 10% Tween® 80 (0,05% конечной концентрации): 60% 100 мМ ацетатного буфера при pH 4,5.
План лечения
Каждый из ингибитора c-MET и носителя вводят посредством перорального принудительного кормления два раза в сутки в течение проведения исследования (два раза в сутки до его окончания). СОЕДИНЕНИЕ D вводят посредством перорального принудительного кормления один раз в сутки в течение проведения исследования (один раз в сутки до его окончания). При способах комбинированного лечения, дозу СОЕДИНЕНИЯ D вводят через 30 минут после введения ингибитора c-Met. Во всех группах объем дозы 10 мл/кг (0,2 мл/20 г мыши) соизмеряют с массой каждого животного, определяемой в сутки получения дозы, за исключением выходных, когда осуществляют перенос данных предыдущей МТ.
Группы мышей «nude» (n=10/группу) получают следующее лечение. Группа 1 получает носитель 1 и носитель 2 и выступает в качестве контрольной группы для исследования. Группа 2 получает 17,7 мг/кг монотерапии ингибитором c-MET два раза в сутки в течение проведения исследования (два раза в сутки до его окончания). Группа 3 получает 30 мг/кг монотерапии СОЕДИНЕНИЕМ D один раз в сутки в течение проведения исследования (один раз в сутки до его окончания). Группа 4 получает 17,7 мг/кг ингибитора c-MET два раза в сутки до окончания в комбинации с 30 мг/кг СОЕДИНЕНИЯ D, получаемого один раз в сутки.
Ингибирование роста опухоли
Кратковременную эффективность определяют на 20 сутки. До наступления 20 суток одно животное в группе 1 и одно животное в группе 3 исключили в связи с прогрессией опухоли; конечный объем опухоли каждого переносят и включают в средний групповой объем.
ΔTV, разницу в объеме опухоли с 1 суток (начала введения дозы) до суток достижения предельного значения определяли для каждого животного. Для каждой экспериментальной группы ответную реакцию на сутки достижения предельного значения рассчитывали посредством одного из следующих соотношений:
T/C (%)=100×ΔT/ΔC, для ΔT>0
T/T0 (%)=100×ΔT/T0, для ΔT<0,
где
ΔT=(средний объем опухоли экспериментальной группы на сутки достижения предельного значения) - (средний объем опухоли экспериментальной группы на 1 сутки),
ΔC=(средний объем опухоли контрольной группы на сутки достижения предельного значения) - (средний объем опухоли контрольной группы на 1 сутки), и
T0=средний объем опухоли контрольной группы на 1 сутки.
Отрицательное значение T/T0 представляет собой чистое уменьшение размеров опухоли для группы. Значение T/C, составляющее 40% или менее, предположительно указывает на потенциальную терапевтическую активность.
Сдерживание роста опухоли
Опухоли измеряют кронциркулем два раза в неделю, и каждое животное подвергают эвтаназии при достижении предельного объема неоплазии (600 мм3), или на последние сутки исследования (71 сутки), в зависимости от того, что произошло раньше. Время достижения предельного значения (TTE) для каждой мыши рассчитывают с помощью следующего уравнения:
TTE=(log10 (предельный объем) - b)/m
где TTE выражено в сутках, предельный объем выражен в мм3, b является пересечением и m представляет собой угловой коэффициент линии, получаемой посредством линейной регрессии совокупности данных лог-трансформированного роста опухоли. Данные содержат первое наблюдение, превышающее конечный объем исследования, и трех последовательных наблюдений, непосредственно предшествующих достижению конечного объема. У любого животного с опухолью, не достигающей предельного значения, значение TTE, приравнивают к последним суткам исследования. У любого животного, классифицированного как погибшего по причинам, связанным с лечением, значение TTE приравнивают к суткам наступления смерти. Любого животного, классифицированного как погибшего по причинам, не связанным с лечением (за исключением метастаза), исключают из расчетов TTE.
Эффективность лечения определяют с учетом сдерживания роста опухоли (TGD), который определяют как увеличение срединного TTE для экспериментальной группы по сравнению с контрольной группой:
TGD=T-C,
Выраженное в сутках или процентах срединного TTE контрольной группы:
% TGD=[(T-C) C]×100
где:
T=срединное TTE для экспериментальной группы,
C=срединное TTE для обозначенной контрольной группы.
MTV и критерии для ответных регрессивных реакций
Эффективность лечения можно также определять, исходя из объема опухолей животных, оставшихся в исследовании на последние сутки, и исходя из количества ответных регрессивных реакций. MTV определяют как средний объем опухоли на 71 сутки у числа оставшихся животных, n, опухоли которых не достигли предельного объема.
Лечение может привести к частичной регрессии (ЧР) или полной регрессии (ПР) опухоли у животного. ЧР указывает на то, что объем опухоли составляет 50% или менее своего объема на 1 сутки в трех последовательных измерениях в ходе проведения исследования, и равен или составляет более чем 13,5 мм3 в одном или нескольких из этих трех измерений. ПР указывает на то, что объем опухоли составляет менее чем 13,5 мм3 в трех последовательных измерениях в ходе проведения исследования.
Токсичность
Животных взвешивают на 1-5 сутки, на каждые сутки проводимого лечения (за исключением выходных) и после этого дважды в неделю до окончания исследования. Максимальную среднюю групповую потерю массы тела (МТ) определяют для временного интервала с 1 по 20 сутки, а также за все время проведения исследования. Определение самой низкой средней групповой МТ исключает измерения, произведенные после исключения из исследования более чем 50% подлежащих оценке мышей, и также исключает любое животное, классифицированное с летальным исходом, не связанным с лечением во время исследования. Приемлемую токсичность для максимально переносимой дозы (МПД) определяют как среднюю групповую потерю МТ, составляющую менее чем 15% в ходе проведения испытания и с не более чем одним случаем летального исхода, связанного с лечением, из числа десяти животных. Любое животное с потерей МТ, превышающей 15% в трех последовательных измерениях, или с потерей МТ, превышающей 20% для одного измерения, подвергают эвтаназии, и классифицируют как летальный исход, связанный с лечением, если это не первый случай летального исхода в группе. Летальный исход классифицируют как не связанный с лечением, если не подтверждено доказательствами то, что летальный исход связан с побочными эффектами лечения, и летальный исход случился не более чем через 14 суток после введения последней дозы. Летальные исходы, не связанные с лечением, подразделяют на следующие категории: летальный исход, являющийся результатом случайности или ошибки, летальный исход по неизвестным причинам или летальный исход по подтвержденной вскрытием причине распространения опухоли посредством инвазии и/или метастаза). Для сохранения животных при обеспечении максимальной информации первый летальный исход в группе классифицировали как летальный исход по неизвестным причинам; такой летальный исход, не связанный с лечением, переклассифицировали на связанный с лечением, если были зарегистрированы два последующих летальных исхода в этой же группе.
Статистический и графический анализ
Статистический и графический анализы проводят с помощью Prism 3,03 (GraphPad) для Windows. Изменения среднего объема опухоли для всех групп сравнивают с однофакторным дисперсионным анализом (ANOVA), с помощью теста Бартлетта для равных дисперсий. Ввиду значительных различий между дисперсиями (P< 0,01), группы сравнивают с помощью анализа Крускала-Уоллиса и апостериорного теста множественных сравнений Данна. Последние повторяют для сравнения комбинации с монотерапиями, проводимыми с помощью ее компонентов.
Выживаемость анализируют посредством способа Каплана-Мейера на основе значений TTE. Логранговый критерий применяют для определения значения разницы между испытаниями общей выживаемости (кривые выживаемости) двух групп. Двусторонние статистические анализы проводят при P=0,05. С помощью Prism приведены результаты, являющиеся незначительными (ns) при P>0,05, значительными (обозначенными символом «*») при 0,01<P≤0,05, в высокой степени значительными («**») при 0,001<P≤0,01 и в наивысшей степени значительными («***») при P≤0,001. Ввиду того, что тесты статистической значимости не обеспечивают оценку величины разницы между группами, все уровни значимости описаны как или значительные, или незначительные в рамках текста данного отчета.
Результаты
После осуществления вышеуказанной методики получают следующие результаты в конце исследования, как определено выше:
|
|
При монотерапии ингибитором c-Met при 17,7 мг/кг перорально два раза в сутки до ее окончания не достигается значительного ингибирования относительно контроля (группы 1) ввиду переменной ответной реакции и совпадающих изменений диапазонов объема опухоли. Монотерапия СОЕДИНЕНИЕМ D при 30 мг/кг перорально два раза в сутки до ее окончания приводит к незначительному срединному ускорению роста опухоли. Комбинация ингибитора c-Met и СОЕДИНЕНИЯ D приводит к -17% T/T0 и значительной срединной активности (P<0,01, критерий Даннета), но при монотерапии ингибитором c-Met на 20 сутки не происходит значительного повышения эффекта.
В целом, монотерапия ингибитором c-Met увеличивает срединное TTE на 97% и значительно повышает выживаемость (P<0,001, логранговый критерий), обеспечивая четырех выживших на 71 сутки и один случай ЧР. Хорошо переносимая монотерапия СОЕДИНЕНИЕМ D приводит к незначительной, более кратковременной общей выживаемости, чем у контроля (группы 1).
Комбинация ингибитора c-Met и СОЕДИНЕНИЯ D увеличивает срединное TTE на максимально возможные 184%. В группе, получавшей комбинацию, 8 выживших и 1 случай частичной регрессии. Эффект комбинации значительно повышается при обеих монотерапиях. На фигуре 5 в настоящем документе представлен краткий обзор результатов.
В итоге монотерапия ингибитором c-Met при 17,7 мг/кг два раза в сутки до ее окончания приводит к 15% T/C и незначительному ингибированию роста опухоли на 20 сутки, но достигается 97% увеличение срединного TTE и значительное повышение выживаемости. Монотерапия СОЕДИНЕНИЕМ D при 30 мг/кг каждый день до ее окончания не является в значительной степени активной (неактивной). Комбинация демонстрирует благоприятное лекарственное взаимодействие, приводя к уменьшению размера опухоли на 20 сутки и получению максимально возможного увеличения срединного TTE на 184%. Значительные улучшения в ходе проведения монотерапии ингибитором c-Met не наблюдаются на 20 сутки; однако комбинация в значительной степени повышает выживаемость в отношении обеих соответствующих монотерапий. Один летальный исход в течение монотерапии ингибитором c-Met и 2 летальных исхода во время комбинированного лечения были обусловлены индивидуальной потерей массы тела. Так как средняя групповая потеря массы тела составляет ноль или ничтожно мала, нельзя однозначно утверждать, что монотерапия ингибитором осуществляется при максимальной терминальной дозе и что комбинация превышает максимальную терминальную дозу для модели.