Результат интеллектуальной деятельности: Способ диагностики энзоотической пневмонии свиней методом полимеразной цепной реакции
Вид РИД
Изобретение
Предлагаемое изобретение относится к области биотехнологии, молекулярно-генетической диагностики инфекционных болезней животных, микро-биологии, научных исследований в ветеринарии и молекулярной биотехнологии и может быть использовано в диагностических исследованиях в научно-исследовательских институтах и ветеринарных лабораториях.
Энзоотическая (микоплазменная) пневмония свиней (лат.- Pneumonia бронхопневмония, вирусная пневмония, микоплазменная пневмония, респираторный микоплазмоз свиней) - инфекционная хроническая энзоотическая болезнь свиней всех возрастов, проявляющаяся ремиттирующей лихорадкой, катаральной бронхопневмонией, сухим кашлем. Болезнь вызывает значительные экономические потери вследствие замедления роста и развития поросят из-за плохой усвояемости корма (зараженные животные расходуют на единицу прироста живой массы на 18-20% кормов больше, чем здоровые). Показатели смертности составляют от 2 до 15%, заболеваемость 38-100% [Thacker E.L, Minion F.C. Mycoplasmosis. Diseases of swine, 10-th edition. - Wiley-Blacwell, 2012. P. 779-797]. Возбудителем энзоотической пневмонии свиней является Mycoplasma hyopneumoniae (М. hyo). По морфологическим и ферментативным свойствам возбудитель имеет сходство с некоторыми другими видами микоплазм, однако отличается от них высокой требовательностью к питательным средам и медленной репликацией (до 30 дней). Возбудитель распространен повсеместно, особенно в регионах интенсивного свиноводства, и играет важную роль в развитии респираторного симптомокомлекса свиней (РСКС) - многокомпонентного заболевания, одной из актуальных проблем современного свиноводства. Кроме того, возбудитель открывает «ворота инфекции» для условно-патогенной микрофлоры, а также увеличивает тяжесть и продолжительность респираторных заболеваний вирусной и бактериальной этиологии (прежде всего таких, как цирковирусные болезни и репродуктивно-респираторный синдром свиней, а также стрептококкоз, гемофилез и пастереллез). [Maes D., Segales J., Meyns Т. et al. Control of Mycoplasma hyopneumoniae infections in pigs // Vet. Microbiol. 2008. №126(4). P. 297-309].
Источником инфекции являются больные и переболевшие животные, в организме которых М. hyo может сохраняться до 15 месяцев. Возбудитель выделяется с частицами слизи при кашле и чихании, а также с молоком и влагалищным секретом, заражение происходит преимущественно воздушно-капельным путем и при прямом контакте. Содержание зараженных и незараженных животных в одном стаде приводит к раннему и часто повторному заражению. К болезни восприимчивы свиньи всех возрастов, но особенно чувствителен молодняк. Инфицирование поросят происходит свиноматками-носителями во время опороса и при прямом контакте, при этом клинические признаки у поросят-сосунов могут отсутствовать, проявляясь только к 2-3-м месяцам. В этом возрасте происходит отъем поросят и объединение их для доращивания, что в свою очередь может вызывать энзоотические вспышки заболевания. Зараженность стада может сохраняться годами, вызывая значительный экономический ущерб.
Проникнув в легкие аэрогенным путем, микоплазмы в течение первых 2 недель после заражения активно размножаются на слизистой оболочке трахеи, бронхов и бронхиол, вызывая образование очажков серозно-катаральной бронхопневмонии. Затем они постепенно проникают в более глубокие части дыхательных путей и в альвеолы, вызывая воспалительные процессы, препятствующие нормальному дыханию. В это время начинают появляться первые клинические признаки болезни - одышка, чихание, кашель. Воспаление чаще развивается в вентилируемых участках - по краям верхушечных долей легких в виде лобулярной пневмонии, чаще с правой стороны, что обусловлено топографией регионарных лимфатических узлов.
Уровень техники
В настоящее время диагностику заболевания проводят с учетом эпизоотологических, клинических, патологоанатомических данных [Thacker E.L. Di-Anim. Health Res. Rev. 2004. №(2). P. 317-320].
В лаборатории направляют фрагменты пораженных легких, средостенные и бронхиальные лимфатические узлы, сыворотку крови больных поросят. Для установления диагноза используют микроскопическое обнаружение возбудителя в легких (методами прямой и непрямой РИФ, окраски по Гимзе); выделение чистых культур на средах Фриза, Гудвина и других с последующей идентификацией по культурально-морфологическим и биохимическим тестам [Thacker E.L. Diagnosis of Mycoplasma hyopneumoniae // Anim. Health Res. Rev. 2004. №(2). P. 317-320]; определение антигенных свойств (PA); выявление специфических антител (микроагглютинация, РСК, латексагглю-тинация, ИФА) [Erlandson K., Thacker В., Wegner М. et al. Evaluation of three serum antibody ELISA tests for Mycoplasma hyopneumoniae // J. Swine Health and Production. 2005. №13(4). P. 198-203], постановку биопробы на поросятах 2-2,5-месячного возраста из хозяйств, благополучных по энзоотической пневмонии свиней. Гибридизация in situ позволяет выявлять и определять конкретное расположение ДНК M. hyo в фиксированных препаратах легких инфицированных свиней. Возможность только посмертной диагностики и длительность выполнения методики существенно ограничили ее применение.
Широко применяемый метод оценки распространенности и тяжести пневмонии - измерение коэффициента поражения легких при обследовании приблизительно 30 животных. Системы измерения поражений легких имеют несколько модификаций и разные единицы измерения, но для любой из них характерен один и тот же недостаток: высокая субъективность визуальной оценки, в связи с этим необходимы дополнительные методы диагностики [Sibila M., Nofrarias M., Lopez-Soria S. et al.. Chronological study of Mycoplasma hyopneumoniae infection, seroconversion and associated lung lesions in vaccinated and non-vaccinated pigs // Vet. Microbiol. 2007. №122. P. 97-107].
Для выявления непосредственно возбудителя энзоотической пневмонии свиней во всем мире широко используется метод полимеразной цепной реакции (ПЦР). Принцип ПЦР заключается в многократном цикличном повторении (амплификации) трех процессов: тепловой денатурации ДНК исследуемой пробы, гибридизации («отжига») исследуемой ДНК со специфическими олигонуклеотидами (праймерами), ограничивающими определенный участок ДНК и синтез комплементарных цепей ДНК с помощью фермента термостабильной ДНК-полимеразы. После проведения n циклов амплификации концентрация синтезированного специфического фрагмента в исследуемой пробе увеличивается в 2n раз (например, в миллион раз после 20 циклов), что позволяет визуально учитывать результаты пцр с помощью электрофореза в агарозном геле. Для эффективного прохождения пцр, ее высокой чувствительности и специфичности, необходимо правильно выбрать область генома исследуемого возбудителя, подобрать специфические олигонуклеотиды (прямой и обратный) и выбрать оптимальный температурно-временной режим проведения амплификации.
За прототип взят способ выявления фрагмента генома Mycoplasma hyopneumoniae методом nested-PCR («гнездовой» ПЦР) с использованием двух пар праймеров к гену 16SRNA [Yamaguti М., Muller Е.Е., Piffer A.I., Kich J.D., Klein C.S., Kuchiishi S.S. // Detection of Mycoplasma hyopneumoniae by polymerase chain reaction in swine presenting respiratory problems. - Brazilian Journal of Microbiology (2008), 39: 471-476].
В nested-PCR используют две пары праймеров и проводят две последовательные реакции ПЦР (две амплификации). Вторая пара праймеров ампли-фицирует участок ДНК внутри продукта полученного после проведения первой реакции. В прототипе используются две пары прямых и обратных праймеров к фрагменту гена 16SRNA Mycoplasma hyopneumoniae. Первая пара («внешние праймеры») фланкирует фрагмент размером 649 п.н. (позиция на гене для прямого праймера - 212-233 п.н.; для обратного - 839-860 п.н.); вторая пара соответственно фланкирует фрагмент размером 352 п.н. (позиция на гене для прямого праймера - 463-484 п.н., для обратного - 797-815 п.н.). Состав реакционной смеси для проведения 1-й амплификации, на одну реакцию: 11,85 мкл деионизованной воды; 2,5 мкл реакционного буфера; 2,0 мкл MgCl2 в конечной концентрации 4 mM; по 2,5 мкл прямого и обратного праймера в конечной концентрации 1,0 mM; 1,0 мкл dNTPS (по 0,2 M/dNTP); 0,15 мкл Taq-полимеразы; 2,5 мкл исследуемой ДНК (общий объем смеси - 25,0 мкл на одну реакцию ПЦР). Состав реакционной смеси для проведения 2-й амплификации, на одну реакцию: 13,85 мкл деионизованной воды; 2,5 мкл реакционного буфера; 2,0 мкл MgCl2 в конечной концентрации 4 mM; по 2,5 мкл прямого и обратного праймера в конечной концентрации 1,0 mM; 1,0 мкл dNTPS (по 0,2 M/dNTP); 0,15 мкл Taq-полимеразы; 0,5 мкл продукта, полученного после проведения 1-й амплификации (общий объем смеси - 25,0 мкл на одну реакцию ПЦР). Реакцию проводят с помощью прибора - амплификатора (термоциклера), обеспечивающего периодическое нагревание и охлаждение пробирок, в соответствии с заданными параметрами проведения пцр (Mastercycler gradient 5331, «Эппендорф», Германия).
Температурно-временные параметры проведения пцр для обеих амплификаций:
94°C - 5 мин - 1 цикл (первичная денатурация ДНК);
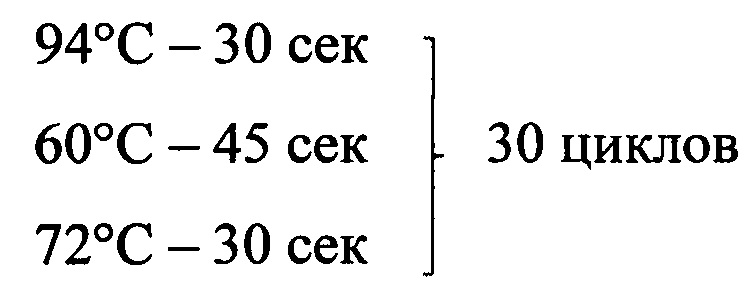
(денатурация ДНК при 94°С, «отжиг» праймеров при 60°С и элонгация комплементарных цепей при 72°С);
72°С - 7 мин - 1 цикл (конечная элонгация).
Результаты исследования определяют с помощью электрофореза в 2%-ном агарозном геле продуктов, полученных после проведения 2-й амплификации. После проведения амплификации результат анализируют с помощью электрофореза в 2%-ном агарозном геле, с использованием 50-кратного ТАЕ-буфера, содержащего бромистый этидий в конечной концентрации 1,2 мг/мл. Результаты электрофореза просматривают в ультрафиолетовом свете с длиной волны 254 нм. Амплифицированные фрагменты выявляются в виде светящихся красноватых полос. В положительных пробах должен выявляться фрагмент размером 649 п.н.
Технической проблемой является необходимость создания эффективного способа обнаружения фрагментов генома Mycoplasma hyopneumoniae методом ПЦР за один раунд, с использованием специфических олигонуклеотидных праймеров, написанных к фрагменту специфического гена белка р102.
Раскрытие сущности изобретения
Техническим результатом является выявление фрагмента генома Mycoplasma hyopneumoniae (возбудителя энзоотической пневмонии свиней), в один раунд с низким шансом ложноположительных результатов.
Авторами изобретения было выявлено, что для обнаружения Mycoplasma hyopneumoniae целесообразно использовать олигонуклеотиды к консервативной области специфичного гена поверхностного белка р102 (таблица 1). При конструировании праймеров и оценке их специфичности использовали первичные структуры геномов различных штаммов Mycoplasma hyopneumoniae, представленные в Интернете в базе данных GenBank (NCBI). Прай-меры разрабатывали с использованием компьютерных программ BioEdit 7.0.1 (Ibis Therapeutics, Inc., США), Primer premier 5.0 (Premier Biosoft International, США) и Primer-BLAST (NCBI). С помощью перечисленных выше программ и интернет-ресурса NCBI выбраны наиболее подходящие нуклеотидные последовательность. Праймеры проверены на отсутствие гомологии с последовательностями генома человека, других микроорганизмов и других видов бактерий рода Mycoplasma с помощью программы BLAST, предоставленной в свободном доступе на веб-ресурсе NCBI (http://www.ncbi.nih.gov/). В результате была подобрана пара олигонуклеотидных праймеров, обеспечивающих проведение полимеразной цепной реакции, ее чувствительность и специфичность.
Праймеры были проверены на комплементарность выбранному фрагменту гена, отсутствие самокомплементарности («шпилек»), отсутствие комплементарности между прямым и обратным праймерами («дуплексов»). Праймеры ограничивают консервативную последовательность фрагмента гена поверхностного белка р102. Синтез разработанных праймеров осуществлялся в коммерческой организации.
Проведение амплификации специфических фрагментов ДНК Mycoplasma hyopneumoniae с помощью разработанных олигонуклеотидов для диагностики энзоотической пневмонии свиней.
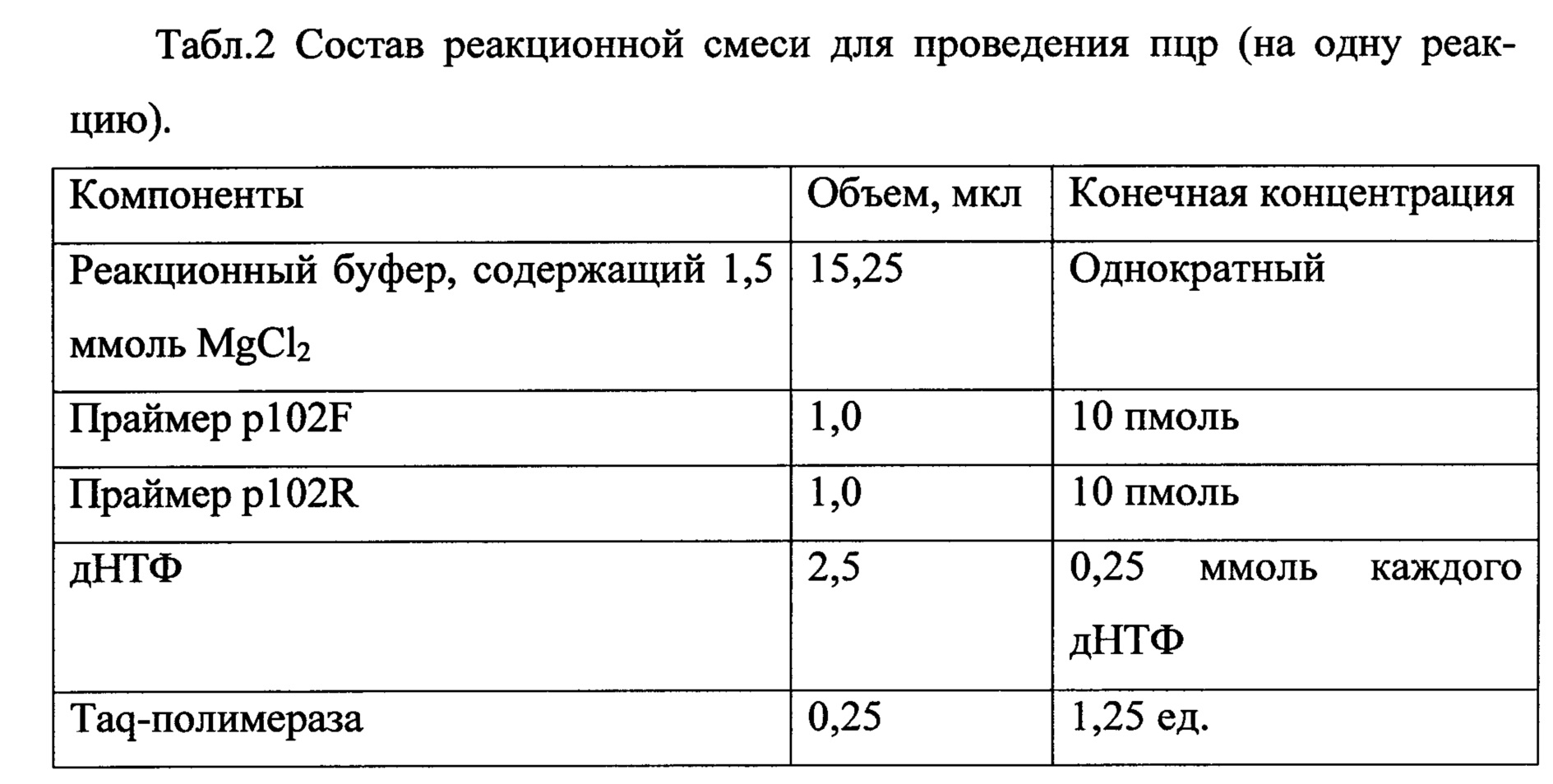
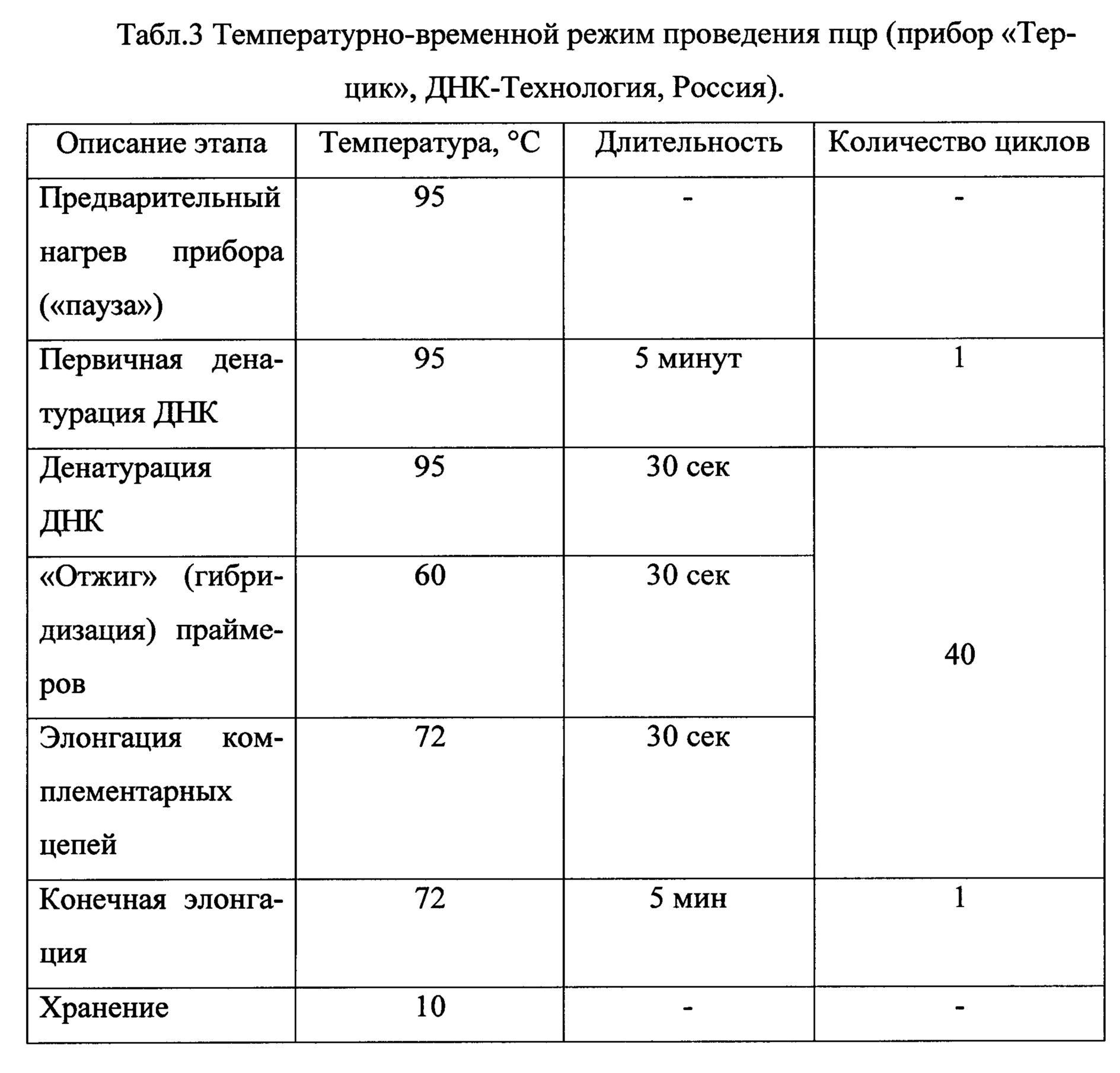
В процессе экспериментальной работы подобраны оптимальные условия проведения пцр с разработанными праймерами. Состав реакционной смеси указан в таблице 2, температурно-временной режим проведения пцр для прибора «Терцик» (четырехканальный ДНК-амплификатор), предназначенный для проведения ПЦР, производства «ДНК-технология», Россия) указан в таблице 3. Полимеразную цепную реакцию проводят в объеме 25 мкл на 1 реакцию ПЦР. В качестве положительного контроля используют референтный штамм Mycoplasma hyopneumoniae J. В качестве отрицательного контроля используют дистиллированную воду или физиологический раствор.
После проведения амплификации результат анализируют с помощью электрофореза в 2%-ном агарозном геле, содержащем бромистый этидий. Результаты электрофореза просматривают в ультрафиолетовом свете с длиной волны 254 нм. Амплифицированные фрагменты выявляются в виде светящихся красноватых полос. При учете результатов проведения пцр в первую очередь оценивают контрольные образцы. Фрагмент, полученный после проведения пцр с положительным контролем (К+), имеет размер 201 п.н. В отрицательном контроле не выявляется никаких полос. При исследовании опытных образцов положительными (содержащими ДНК М. hyo) считаются те образцы, в которых обнаруживаются амплифицированные фрагменты соответствующие по размеру фрагменту в положительном контроле. Если фрагмент не выявляется или не соответствует по размеру фрагменту положительного контроля (т.е. располагается на другом расстоянии от старта), такие образцы считают отрицательными. Специфичность праймеров проверяли на образцах культур клеток, зараженных микоплазмами. Специфическая полоса выявлялась только в случаях наличия в образце ДНК Mycoplasma hyopneumoniae.
Предложенный способ диагностики апробирован с положительным результатом и регулярной воспроизводимостью в 2016-2017 годах на более чем 200 образцах крови, сывороток крови и органов свиней, полученных из разных регионов. Предлагаемое изобретение найдет применение в диагностических исследованиях в научно-исследовательских институтах и ветеринарных лабораториях.
Источники информации
1. Жбанова Т.В., Дрыгин В.В., Дудникова Н.С. Микоплазмозы свиней. 2005. ФГУ ФЦОЗЖ, 2005 (Полигр. база ФГУ Федерал, центр охраны здоровья животных). 75 стр.
2. Орлянкин Б.Г., Алипер Т.Н., Мишин A.M. Инфекционные респираторные болезни свиней: этиология, диагностика и профилактика // Свиноводство. 2010. №3. С. 67-69.
3. Artushin S., Stipkovits L., Minion F.C. Development of polymerase chain reaction primes to detect Mycoplasma hyopneumoniae // Mollecular and Cellular Probes. 1993. №7. P. 381-385.
4. Erlandson K., Thacker В., Wegner M. et al. Evaluation of three serum antibody ELISA tests for Mycoplasma hyopneumoniae // J. Swine Health and Production. 2005. №13(4). P. 198-203.
5. Friis N.F. Some recommendations concerning primary isolation of Mycoplasma suipneumoniae and Mycoplasma flocculare a survey // Nord. Vet. Med. 1975. №27. P. 337-339.
6. Maes D., Segales J., Meyns T. et al. Control of Mycoplasma hyopneumoniae infections in pigs // Vet. Microbiol. 2008. №126(4). P. 297-309.
7. Sibila M., Nofrarias M., Lopez-Soria S. et al.. Chronological study of Mycoplasma hyopneumoniae infection, seroconversion and associated lung lesions in vaccinated and non-vaccinated pigs // Vet. Microbiol. 2007. №122. P. 97-107.
8. Simionatto S.,. Marchioro S.B, Maes D. et al. Mycoplasma hyopneumoniae: From disease to vaccine development // Vet. Microbiology. 2013. №16. P. 234-242.
9. Thacker E.L. Diagnosis of Mycoplasma hyopneumoniae // Anim. Health Res. Rev. 2004. №(2). P. 317-320.
10. Thacker E.L, Minion F.C. Mycoplasmosis. Diseases of swine, 10-th edition. - Wiley-Blacwell, 2012. P. 779-797.
11. Thacker E.L. Diagnosis of Mycoplasma hyopneumoniae / E.L. Thacker // Anim. Health Res. Rev. - 2004. - N5(2) - P. 317-320.
12. Villarreal I, Maes D, Meyns T, Gebruers F, Calus D, Pasmans F, Haesebrouck F. // Vaccine. 2009 Mar 13; 27(12): 1875-1879
13. Yamaguti M., Muller E.E., Piffer A.I., Kich J.D., Klein C.S., Kuchiishi S.S. // Detection of Mycoplasma hyopneumoniae by polymerase chain reaction in swine presenting respiratory problems. - Brazilian Journal of Microbiology (2008), 39: 471-476.
14. https://www.ncbi.nlm.nih.gov/
Осуществление изобретения иллюстрируется следующими примерами:
1. В 2016 году было исследовано 26 образцов цельной крови 3-месячных поросят, полученных из свиноводческого хозяйства, находящегося в Московской области. Из них 14 образцов были получены от животных с симптомами, присущими энзоотической пневмонии свиней (кашель, чихание, отставание в приросте массы) и 12 образцов от животных без респираторной симптоматики.
Выделение ДНК из полученных образцов крови проводили с использованием неорганического сорбента. К 200 мкл каждого образца добавляли 600 мкл лидирующего раствора, содержащего 6М гуанидина тиоционата и инкубировали их при комнатной температуре в течение 10 минут, периодически перемешивая на лабораторном смесителе типа Vortex. После этого пробы центрифугировали 1 минуту при 16 тыс.об/мин на настольной центрифуге («Эппендорф», Германия), осадок отбрасывали, а надосадок переносили в заранее подготовленные пробирки, содержащие 40 мкл суспензии неорганического сорбента (silica). Пробы тщательно перемешивали на лабораторном смесителе типа Vortex до полного ресуспендирования сорбента и инкубировали в течение 10 минут при комнатной температуре, периодически перемешивая на смесителе. Инкубированные пробы центрифугировали 1 минуту при 16 тыс.об/мин, надосадок отбирали с помощью медицинского вакуумного отсасывателя ОМ-01 («Еламед», Россия), а к осадку добавляли 100 мкл промывочного раствора, содержащего 2М гуанидина тиоционата. Пробы перемешивали на смесителе до полного ресуспендирования сорбента, центрифугировали 1 минуту при 16 тыс.об/мин, надосадок удаляли, к осадку повторно добавляли 100 мкл 2М раствора гуанидина тиоционата, вновь перемешивали на смесителе, центрифугировали и отбирали надосадок. Полученный осадок дважды промывали таким же образом, используя 70%-ный раствор этилового спирта. Полученный после последней промывки осадок сушили 10 минут в пробирках с открытой крышкой в твердотельном термостате «Гном» («ДНК-Технология», Россия) при температуре 56°С, затем к нему добавляли 30 мкл деионизованной воды для элюции ДНК с сорбента и снова инкубировали в твердотельном термостате в течение 10 минут при температуре 56°С, с закрытыми крышками, периодически перемешивая на смесителе для лучшей элюции ДНК. Полученные пробы ДНК использовали для постановки в ПЦР.
ПЦР проводили в один раунд, с использованием олигонуклеотидов, написанных к фрагменту специфического гена белка р102 М. hyopneumoniae (прямой праймер - AGACTCGCTTTTGATGCAACC, обратный праймер - AGGCTTTGGAAATACAGAACAAGC).
Состав реакционной смеси для проведения ПЦР изложен в таблице 2. Температурно-временные параметры проведения ПЦР изложены в таблице 3. Полимеразную цепную реакцию проводили в автоматическом термоциклере «Терцик» (ДНК-Технология, Россия). Полученные амплификаты после проведения ПЦР анализировали с помощью электрофореза в 2%-ном агарозном геле с использованием 50-кратного ТАЕ-буфера, содержащего бромистый этидий в конечной концентрации 1,2 мг/мл. Гель просматривали с помощью прибора «Трансиллюминатор» в ультрафиолетовом свете с длиной волны 254 нм. В 14 образцах были выявлены светящиеся полосы на уровне 201 п.н., что соответствует размеру специфического фрагмента ДНК М. hyopneumoniae. В 12 образцах, полученных от поросят, не имевших симптомов респираторных заболеваний, никаких полос обнаружено не было.
2. В 2017 году было исследовано 120 образцов сывороток крови взрослых свиноматок, полученных из разных свиноводческих хозяйств Краснодарского края. Выделение ДНК из полученных образцов сывороток крови проводили с использованием неорганического сорбента, по методике, описанной в примере №1. Полученные пробы ДНК использовали для постановки в ПЦР в один раунд с использованием олигонуклеотидов, написанных к фрагменту специфического гена белка р102 М. hyopneumoniae (прямой праймер - AGACTCGCTTTTGATGCAACC, обратный праймер - AGGCTTTGGAAATACAGAACAAGC).
Состав реакционной смеси для проведения ПЦР изложен в таблице 2. Температурно-временные параметры проведения ПЦР изложены в таблице 3. Полимеразную цепную реакцию проводили в автоматическом термоциклере «Терцик» (ДНК-Технология, Россия). Полученные амплификаты после проведения ПЦР анализировали с помощью электрофореза по методике, описанной в примере №1. В 78 образцах, полученных от животных с респираторным симптомокомплексом, характерным для энзоотической пневмонии свиней, были выявлены светящиеся полосы на уровне 201 п.н., что соответствует размеру специфического фрагмента ДНК М. hyopneumoniae. В 42 образцах, полученных от поросят, не имевших симптомов респираторных заболеваний, никаких полос обнаружено не было.
3. В 2017 году было исследовано 10 образцов фрагментов легких поросят, полученных из свиноводческого хозяйства Тюменской области».
Выделение ДНК из полученных образцов легких проводили с использованием неорганического сорбента. Предварительно каждый образец измельчали с помощью ножниц и растирали в лизирующем растворе, содержащем 6М гуанидина тиоционата, получая примерно 10%-ную суспензию. К 200 мкл полученной суспензии добавляли 600 мкл лизирующего раствора (6М гуанидин тиоционат), и далее выделение ДНК проводили аналогично методике, описанной в примерах №1 и №2. Полученные пробы ДНК использовали для постановки в ПЦР.
ПЦР проводили в один раунд, с использованием олигонуклеотидов, написанных к фрагменту специфического гена белка р102 М. hyopneumoniae (прямой праймер - AGACTCGCTTTTGATGCAACC, обратный праймер - AGGCTTTGGAAATACAGAACAAGC).
Состав реакционной смеси для проведения ПЦР изложен в таблице 2. Температурно-временные параметры проведения ПЦР изложены в таблице 3. Полимеразную цепную реакцию проводили в автоматическом термоциклере «Терцик» (ДНК-Технология, Россия). Полученные амплификаты после проведения ПЦР анализировали по методике, описанной в примерах №1 и №2. В шести образцах были выявлены светящиеся полосы на уровне 201 п.н., что соответствует размеру специфического фрагмента ДНК М. hyopneumoniae. Данные образцы были получены от животных, проявлявших симптомы, характерные для энзоотической пневмонии свиней. В образцах, полученных от поросят, не имевших симптомов респираторных заболеваний, никаких полос обнаружено не было.