Результат интеллектуальной деятельности: Способ выявления дефицитов факторов свертывания крови методом тромбоэластометрии
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к диагностике нарушений гемостаза, вызванных дефицитом факторов свертывания крови.
В настоящее время известны различные методы диагностики нарушений гемостаза, вызванных дефицитом факторов свертывания крови (наследственные коагулопатии). Материалом для коагулогических исследований является плазма, содержащая факторы свертывания. Выявление изменений в основных клоттинговых тестах, таких как активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ) и других, позволяет заподозрить дефицит различных факторов свертывания крови:
1. Изолированное удлинение ПВ при нормальных значениях АЧТВ свойственно дефициту фактора VII (FVII).
2. Удлинение АЧТВ при нормальных значениях ПВ наблюдается только при дефиците фактора свертывания VIII (FVIII), FIX, FXI, FXII;
3. Удлинение АЧТВ и ПВ при плазменной концентрации фибриногена более 1 г/л наблюдается при дефиците FV (очень редко FII и FX).
При обнаружении патологических значений АЧТВ и/или ПВ должна проводиться дальнейшая дифференциальная диагностика нарушений гемостаза. Установить точно, активность какого из факторов свертывания снижена в крови больного, позволяет лишь дополнительное обследование. Для этого используются тесты количественного определения факторов свертывания в плазме (З.С. Баркаган, А.П. Момот. Диагностика и контролируемая терапия нарушений гемостаза. Москва: НЬЮДИАМЕД, 3е изд, 2008). Возможен дефицит различных факторов свертывания.
Дефицит FVII проявляется геморрагическим синдромом. FVII или проконвертин - прокоагулянт, участвующий в свертывании крови по внешнему пути и активирующий FIX и FXI, входящие во внутренний путь свертывания. Заболевание, возникающее вследствие дефекта синтеза или молекулярных аномалий FVII, называется гипопроконвертинемией, распространенность составляет 1 случай на 500000 населения (Н.И. Зозуля, П.В. Свирин. Диагностика и лечение гемофилии. Национальные клинические рекомендации. Москва: Национальное гематологическое общество, 2014). Спонтанные кровотечения у больных гипопроконвертинемией встречаются редко. Заболевание у мужчин часто протекает бессимптомно, у женщин проявляется обильными менометроррагями. Геморрагический синдром может проявиться при травме или хирургических вмешательствах (А.Н. Мамаев. Коагулопатии. Москва: ГЭОТАР-Медиа, 2012). Диагностика гипопроконвертинемии основана на результатах определения плазменной активности FVII. Диапазон нормальных значений плазменной активности FVII составляет 70-120%. При гипопроконвертинемиии выраженность клинических проявлений слабо коррелирует с выраженностью дефицита FVII (F.H Herrmann et al. Molecular Biology and Clinical Manifestation of Hereditary Factor VII Deficiency. Seminars in Thrombosis and Hemostasis 2000, 393-400).
Дефицит FV. Неферментный фактор свертывания FV увеличивает скорость образования тромбина из протромбина. Дефицит FV (болезнь Оврена) проявляется геморрагическим синдромом. Распространенность заболевания 1:1000000. Мужчины и женщины болеют с одинаковой частотой, тип наследования - аутосомно-рецессивный. При выраженном дефиците FV у больных обнаруживают удлинение ПВ и АЧТВ. Удлинение времени в обоих тестах связано с тем, что FV входит в состав протромбиназного комплекса общего пути свертывания, который катализирует превращение тромбина из протромбина. Диапазон нормальных значений плазменной активности FVII составляет 70-120%. Диагноз устанавливается при обнаружении уменьшения плазменной активности FV (А.Н. Мамаев. Коагулопатии. Москва: ГЭОТАР-Медиа, 2012), (З.С. Баркаган, А.П. Момот. Диагностика и контролируемая терапия нарушений гемостаза. Москва: НЬЮДИАМЕД, 3е изд, 2008).
Дефицит FVIII называется гемофилиепй А. Гемофилия А относится к группе наследственных коагулопатий. Встречается, как правило, у лиц мужского пола, поскольку наследование заболевания сцеплено с Х-хромосомой. В Российской Федерации заболеваемость гемофилией составляет 9,1 случай на 100000 населения, всего зарегистрировано 6525 больных гемофилией А Основное проявление гемофилии - кровотечения и кровоизлияния. При гемофилии отмечается увеличение АЧТВ при сохранении других показателей в пределах нормальных значений, снижение активности FVIII в крови. Для тяжелой формы гемофилии А характерно снижение активности FVIII менее 1%, для средней степени тяжести > 1 - ≤5%, для легкой степени тяжести >5% (Н.И. Зозуля, П.В. Свирин. Диагностика и лечение гемофилии. Национальные клинические рекомендации. Москва: Национальное гематологическое общество, 2014).
Дефицит FIX называется гемофилиепй В. Гемофилия В (наследственный дефицит FIX) является сцепленные с полом заболеванием, встречается с частотой 1 на 30000 населения. Доля их от общего числа больных гемофилией составляет 20-25% (Soucie, Evatt, and Jackson. Occurrence of hemophilia in the United States. The Hemophilia Surveillance System Project Investigators. Am J Hematol 1998, 59(4):288-94). Клинические проявления заболевания: гемартрозы, гематомы, посттравматические и постоперационные кровотечения. Лабораторная диагностика гемофилии В основана на выявлении удлинения АЧТВ, снижения активности FIX в плазме. Диапазон нормальных значений плазменной активности FVII составляет 50-120%. Для тяжелой формы гемофилии В характерно снижение активности FIX менее 1%, для средней степени тяжести > 1 - ≤5%, для легкой степени тяжести >5% (Н.И. Зозуля, П.В. Свирин. Диагностика и лечение гемофилии. Национальные клинические рекомендации. Москва: Национальное гематологическое общество, 2014).
Дефицит FIX называется гемофилиепй С. FXI (фактор Розенталя) учувствует в активации основного профермента внутреннего теназного комплекса. Заболеваемость гемофилией С составляет 1 на 1000000. Наследуется аутосомно, встречается как у мужчин, так и у женщин. Геморрагический синдром редко возникает спонтанно, как правило, - после хирургических манипуляций, травм. Диапазон нормальных значений плазменной активности FXI составляет 70-120%. Диагноз устанавливается на основании удлинения АЧТВ и сниженной плазменной активности FXI (А.Н. Мамаев. Коагулопатии. Москва: ГЭОТАР-Медиа, 2012).
Дефицит FXII или болезнь Хагемана относится к группе редких коагулопатий, частота составляет 1 на 1000000 населения. Болезнь Хагемана рассматривается как протромботическое состояние, ввиду того, что FXII учувствует в процессах фибринолиза. Геморрагические проявления при дефиците FXII случаются редко, обычно при инвазивных вмешательствах или операциях. Нарушения гемостаза обнаруживают случайно при предоперационном скрининге. Диапазон нормальных значений плазменной активности FXI составляет 70-120%. В коагулограмме выявляют удлинение АЧТВ, сниженную активность FXII (А.Н. Мамаев. Коагулопатии. Москва: ГЭОТАР-Медиа, 2012).
В основу методов определения активности факторов свертывания крови положено проведение теста ПВ (FII, FV, FVII, FX) и/или АЧТВ (FVIII, FIX, FXI, FXII) в разбавленном исследуемом образце. При этом снижение активности факторов свертывания компенсируют внесением в инкубационную среду субстратной плазмы, не содержащей соответствующего фактора, но имеющей полноценную активность других факторов свертывания. Таким образом, активность анализируемых факторов в исследуемом образце оказывается единственной неизвестной величиной, определяющей скорость процесса свертывания. Количественное определение активности факторов проводят по калибровочному графику разведений плазмы-калибратора с аттестованной активностью соответствующего фактора.
Наиболее распространенным способом определения дефицита факторов свертывания является одностадийный клоттинговый метод исследования с использованием субстратных (дефицитных) образцов плазмы, лишенных одного из факторов свертывания крови (R.D Langdell, R.H Wagner, K.М Brinkhous. Effect of antihemophilic factor on one-stage clotting tests; a presumptive test for hemophilia and a simple one-stage antihemophilic factor assy procedure. The Journal of Laboratory and Clinical Medicine 1953, 637-47). Принцип метода заключается в определении промежутка времени после добавления стартового реактива, запускающего каскад свертывания плазмы по внутреннему или внешнему пути, в смесь субстратной (дефицитной) плазмы, в которой отсутствует исследуемый фактор, и исследуемой плазмы больного (под ред. Меньшикова В.В. Методики клинических лабораторных исследований. Справочное пособие. Москва: Лабора, Том 1, 2008). Степень коррекции зависит от активности исследуемого фактора свертывания, поскольку активность других факторов свертывания в этой системе в норме. Активность дефицитного фактора в исследуемой плазме определяют по кривой разведения. При проведении этого анализа необходимо соблюдать требования по приготовлению реагентов: разведение, прогревание, построение калибровочного графика. Правильность построения калибровочного графика для определения активности отдельных факторов оценивают с помощью международных стандартов. Качественным критерием наборов с субстратной плазмой являются очень низкая или неопределяемая активность одного из факторов свертывания крови (менее 1%), нормальная активность других факторов, наличие в наборе калибраторов с дробным содержанием фактора, чтобы можно было построить калибровочную кривую как в зоне с нормальным, так и патологическим содержанием фактора свертывания. Метод применяется для диагностики врожденных и приобретенных дефицитов различных факторов свертывания. Основными ограничениями метода определения активности факторов свертывания одностадийным методом является его чувствительность к присутствию в образце крови гепарина или непрямых антикоагулянтов, волчаночного антикоагулянта. Для его выполнения необходимы специальные реактивы: АЧТВ-реагент (суспензия каолина или эллаговой кислоты, кефалин, фосфолипиды), имидазоловый буфер, раствор хлорида кальция, лиофилизированная контрольная плазма с аттестованной активностью исследуемого фактора и лиофилизированная субстратная плазма, не содержащая исследуемый фактор (дефицитная плазма). Дефицитная плазма может быть получена путем иммуносорбции отдельных факторов с добавлением других факторов, а также от доноров, больных с недостаточностью одного из факторов свертывания. Кроме того, не любая комбинация дефицитной плазмы и тест-наборов на ПВ или АЧТВ дают схожие результаты, поэтому следует пользоваться рекомендациями фирм-производителей дефицитных плазм и тест-наборов. Качество дефицитной плазмы и чувствительность реагентов имеют значение при определении дефицита факторов свертывания крови.
Известен также двухстадийный клоттинговый метод определения активности факторов свертывания крови. Этот коагулогический метод является модификацией теста образования тромбопластина по Biggs (Rosemary Biggs, J. Eveling, G. Richards. The Assay of Antihaemophilic-Globulin Activity. British Journal of Haematology 1955, 1:20-34). На первой стадии формируется реакционная смесь, содержащая избыток компонентов, требуемых для образования протромбиназного комплекса (FXa, FVa, фосфолипидов, ионов кальция). На второй стадии регистрируют скорость реакции, которая зависит от количества образовавшегося активированного фактора свертывания. По результатам измерения времени образования сгустка определяют коагулогическую активность фактора свертывания в анализируемой плазме. Двухстадийный клоттинговый метод не требует использования субстратной дефицитной плазмы и не зависит от наличия активированного фактора свертывания в исследуемом образце (А.Л. Берковский и др. Внутренний путь свертывания крови. Методы исследования. Методическое руководство. Москва, 2013). Основным недостатком метода является ограничение его широкого применения ввиду использования сложной стандартизации применяемых реагентов, что возможно только в специализированных лабораториях.
Известен также хромогенный метод определения активности факторов свертывания крови (M.J Seghatchian and М. Miller-Andersson. A colorimetric evaluation of factor VIII:C potency. Medical Laboratory Sciences 1978, 347-54). Возможно проведение хромогенного метода 2 способами: по кинетике образования хромогена под действием активированного фактора или по конечной точке накопления хромогена за определенное время инкубации. Синтетический субстрат представляет собой молекулу, которая распознается и разрезается сериновой протеиназой. Этот разрез ведет к отщеплению от субстрата сигнальной молекулы, метки. Метка либо изменяет оптическую плотность раствора (хромогенный, т.е. окрашивающий субстрат), либо способна флуоресцировать при освещении (флуорогенный субстрат). Субстрат можно добавлять в исследуемую плазму и записывать сигнал, получающийся при свертывании. К преимуществам хромогенного метода по сравнению с одностадийным методом является его резистентность к волчаночному антикоагулянту, гепарину или другим антикоагулянтам (например, ингибиторам тромбина) (под ред. Меньшикова В.В. Методики клинических лабораторных исследований. Справочное пособие. Москва, Набора, Том 1, 2008). Ограничением метода является использование специального оборудования (центрифуга, фотометры). В настоящее время проводятся попытки стандартизации как коагуляционных, так и хромогенных методов определения активности факторов свертывания. До введения стандартизации рекомендуется метод с хромогенными субстратами использовать только как ориентировочный и предпочтительно для оценки концентратов факторов свертывания, а не с диагностическими целями (В.В. Долгов, П.В. Свирин. Лабораторная диагностика нарушений гемостаза. ООО издательство «Триада», Тверь, 2005).
Во всех методах расчет активности факторов свертывания производят, сравнивая активность тестируемого образца с активностью Международного стандарта NIBSC или вторичного стандартного образца фактора свертывания, откалиброванного относительно международного стандарта в международных единицах активности (ME). Эквивалентность международного стандарта в ME устанавливается ВОЗ. За 1 ME (100%) принимают активность фактора свертывания в 1,0 мл свежей нормальной пулированной плазме крови от 300 доноров. Активность фактора выражается в МЕ/мл, МЕ/флакон, МЕ/мг белка и в %.
Таким образом, все имеющиеся в настоящее время методы определения дефицита факторов свертывания являются трудоемкими, требующими специального оборудования, выполняются врачами-лаборантами, специалистами в области гемостаза и применяется только в узкоспециализированных стационарах. Во многих стационарах нет условий, оборудования и специалистов для проведения подобных исследований. В результате при выявлении нарушений в системе гемостаза отменяются либо откладываются инвазивные вмешательства, а лечение проводится без установленного диагноза и может оказаться неэффективным. В то же время, согласно приказу Министерства здравоохранения РФ от 15 ноября 2012 г. №919н "Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю «анестезиология и реаниматология" в стандарт оснащения отделения анестезиологии-реанимации с палатами реанимации и интенсивной терапии входит тромбоэластограф или тромбоэластометр.
Белорусские исследователи (А.Ф. Минов, A.M. Дзядзько, О.О. Руммо. Тромбоэластометрические критерии коррекции нарушений гемостаза при трансплантации печени. Анестезиология И Реаниматология 2006, 35-41) изучили параметры тромбоэластометрии во время операции трансплантации печени, при которых отмечались изменения в крови содержания факторов свертывания (фибриногена, FII, FV, FVII, FVIII, FIX, FX, FXI, FXII). Авторы отметили, что наибольшей диагностической эффективностью обладали следующие параметры: время начало образования сгустка (СТ) в тесте внешнего пути > 80 (ЕХТЕМст > 80 с) и время начало образования сгустка (СТ) в тесте внутреннего пути > 240 с (INTEMct > 240 с). Чувствительность изменения ЕХТЕМст составила всего 19%, т.е. по данным тромбоэластометрии восполнение дефицита факторов будет проводиться лишь в 19% случаев, когда имеются показания согласно общепринятым рекомендациям (Международное нормализованное отношение (MHO) > 2,0). Чувствительность изменения INTEMCT > составила 51%. Однако в данном исследовании авторы не пытались по изменениям тромбоэластометрических параметров дифференцировать дефицит отдельных факторов крови, а лишь оценивали их изменения в совокупности. Авторы не представили алгоритм, позволивший бы выявить дефицит какого фактора вызывал изменения тромбоэластометрии. Кроме того, в этом исследовании дефицит факторов был невыраженный, минимально факторы снижались через 15 минут после реперфузии (медианы FII 44%, FV 17%, FVII 29%, FIX 59%, FX 39%, FXI 56%, FXII 66%), что значительно больше, чем у больных с врожденным дефицитом, чем можно объяснить низкую чувствительность тестов.
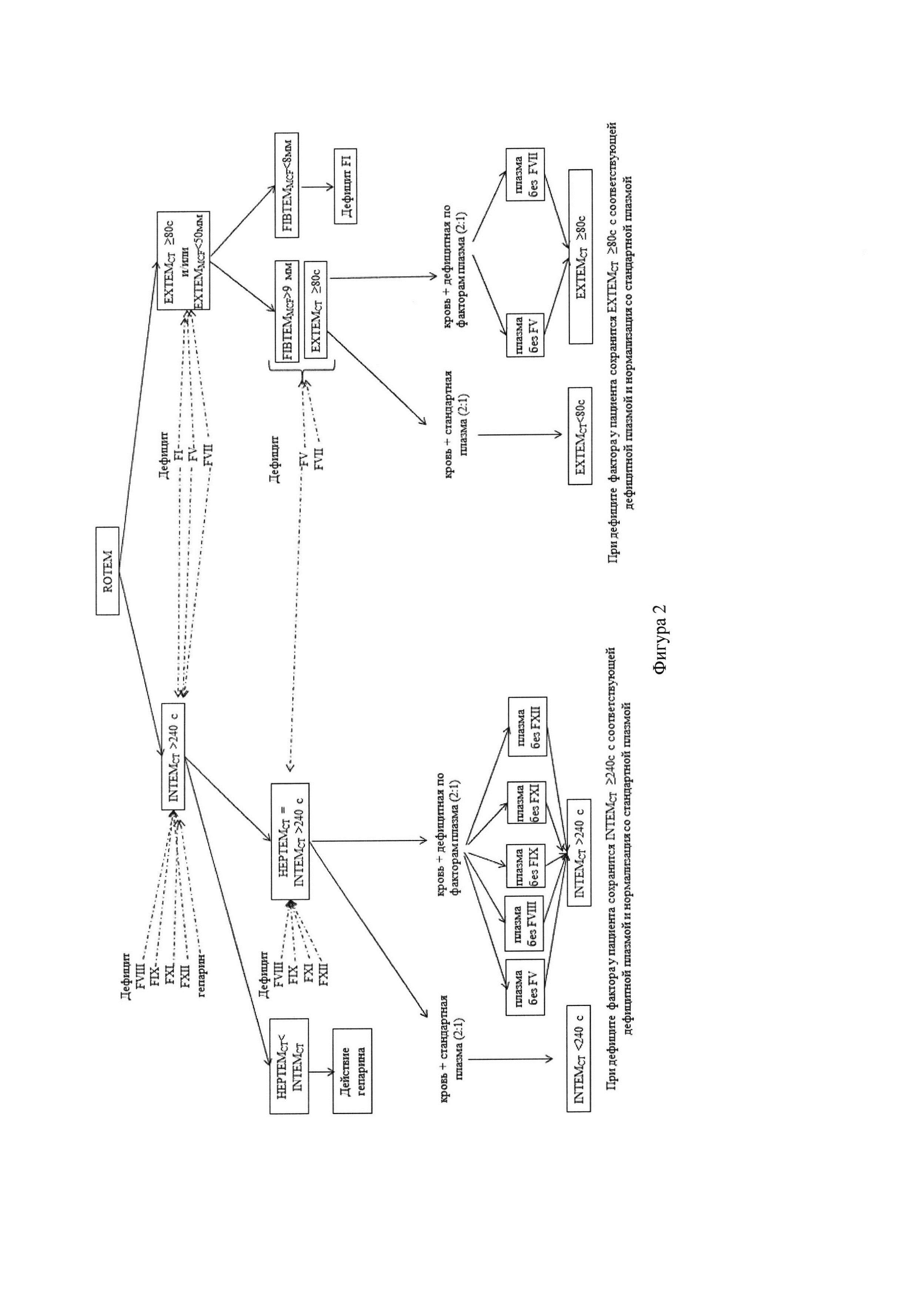
Технический результат заявленного изобретения достигается тем, что дефицит того или иного фактора свертывания диагностируется посредством исследования цельной крови с помощью ротационной тромбоэластометрии (РОТЭМ). На первом этапе выполняют два стандартных теста, позволяющих выявить гипокоагуляцию по внешнему (тест ЕХТЕМ) или внутреннему (тест INTEM) пути свертывания, в которых оценивается параметр СТ, характеризующий начало образования сгустка и позволяющий оценить суммарную активность факторов свертывания. Тесты выполняются согласно рекомендациям производителя на приборе РОТЭМ (ROTEM delta, "Pentapharm GmbH", Германия). Кривые реакции и параметры каждого образца сравнивают с эталонными результатами здоровых людей, описанные для тестов РОТЭМ (Thomas Lang et al. Multi-centre investigation on reference ranges for ROTEM thromboelastometry. Blood Coagulation & Fibrinolysis: An International Journal in Haemostasis and Thrombosis 2005, 301-10). При проведении анализа используется автоматическое пипетирование цельной цитратной крови в комбинации с различными специфическими реагентами: реагент ех-ТЕМ содержит тканевой фактор и используется для постановки теста ЕХТЕМ; реагент in-TEM содержит эллаговую кислоту и используется для постановки теста INTEM; реагент fib-TEM содержит блокатор рецепторов тромбоцитов цитохалазин D, в комбинации с реагентом ех-ТЕМ используется для постановки теста FIBTEM; hep-TEM содержит гепариназу, в комбинации с реагентом in-TEM используется для постановки теста INTEM.
Объемы используемых реагентов и исследуемых образцов крови:
- в тесте ЕХТЕМ: 20 мкл СаCl2 0,2М + 20 мкл реагента ех-ТЕМ+ 300 мкл цитратной крови;
- в тесте INTEM: 20 мкл СаCl2 0,2М + 20 мкл реагента in-TEM + 300 мкл цитратной крови;
- в тесте FIBTEM: 20 мкл реагента ех-ТЕМ + 20 мкл реагента fib-TEM + 300 мкл цитратной крови;
- в тесте НЕРТЕМ: 20 мкл реагента in-TEM + 20 мкл реагента hep-TEM + 300 мкл цитратной крови.
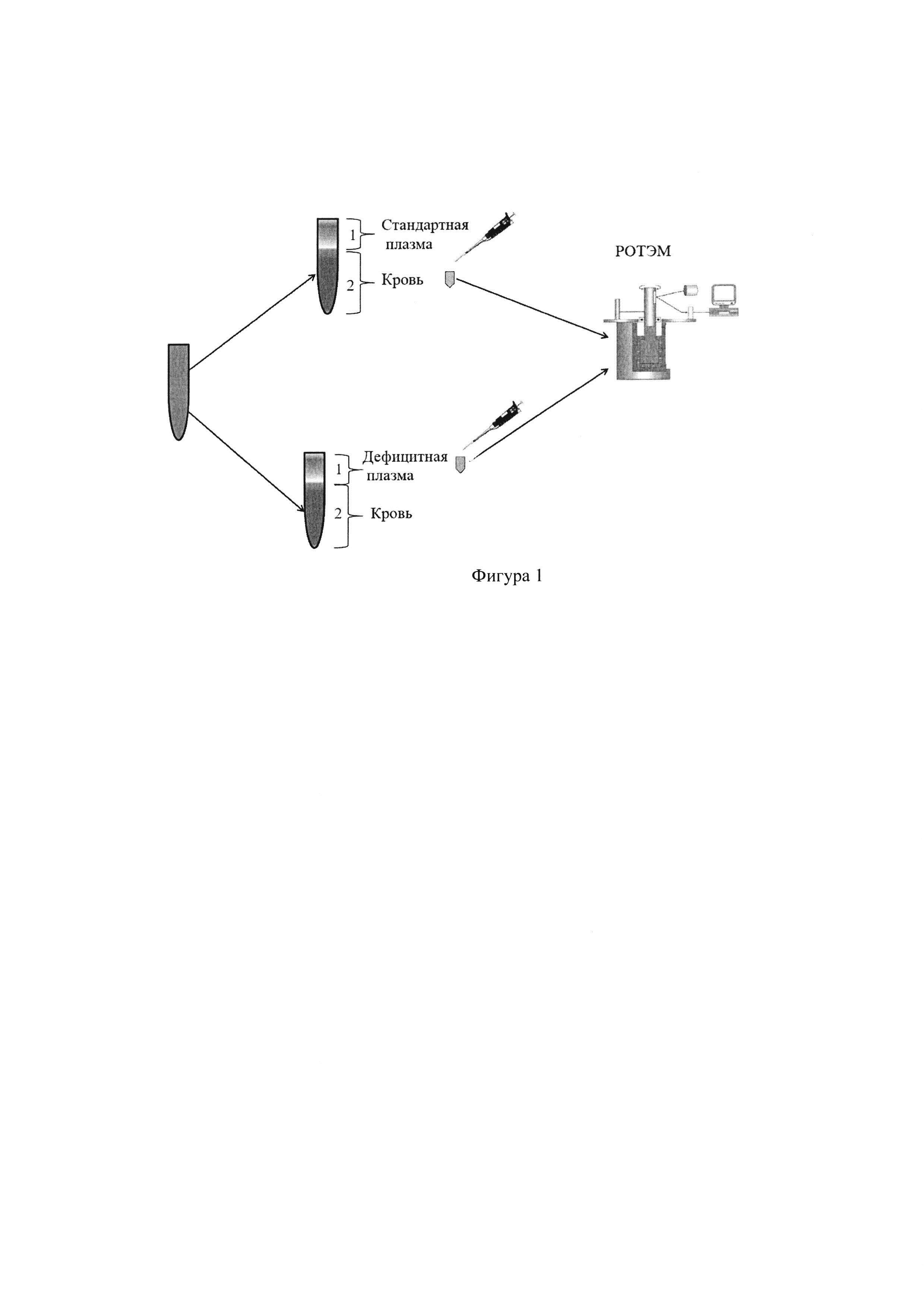
Для исключения гипокоагуляции в тесте ЕХТЕМ, вызванной гипофибриногенемией, выполняется тест FIBTEM. Значения показателя FIBTEMMCF ≥ 8 мм позволяют исключить дефицит фибриногена (фактора свертывания FI) как причину гипокоагуляции. Для исключения гипокоагуляции в тесте INTEM, вызванной гепарином, выполняется тест НЕРТЕМ. Отсутствие укорочения интервала СТ в тесте НЕРТЕМ по сравнению с тестом INTEM свидетельствует, что гипокоагуляция вызвана дефицитом факторов свертывания крови, а не действием гепарина. Дальнейшие исследования направлены на выявление дефицита факторов свертывания крови. Принцип выявления дефицита отдельных факторов свертывания одинаков: в две пробирки вносят по 2 части цельной цитратной исследуемой крови, затем в одну из них вносят 1 часть стандартной плазмы (((Standard human plasma», SIEMENS Healthcare, Германия), в другую - 1 часть дефицитной плазмы (((Coagulation Factor Deficient Plasma», SIEMENS Healthcare, Германия), в которой отсутствует тот или иной исследуемый фактор свертывания крови. На фигуре 1 представлена схема выполнения исследования.
Использование тестов ЕХТЕМ или INTEM, или обоих вместе зависит от участия фактора свертывания крови в коагуляционном каскаде, что видно из алгоритма диагностики на фигуре 2.
Поскольку в цельной крови примерно половину составляет плазма, добавление такого же количества стандартной плазмы, содержащий все факторы свертывания крови, компенсирует дефицит факторов и приводит к нормализации измененного показателя СТ, в пробе же с дефицитной плазмой показатель СТ останется удлиненным.
Сущность изобретения. Задачей настоящего изобретения является определение сниженной активности факторов свертывания в цельной крови с помощью ротационной тромбоэластометрии по удлинению времени начала образования сгустка крови (интервал СТ) в тестах ЕХТЕМ и/или INTEM. Особенностью метода является использование в тестах ротационной тромбоэластометрии стандартной плазмы и плазмы, дефицитной по одному из факторов свертывания, по предложенному алгоритму, для выявления компенсации гипокоагуляции при добавлении стандартной плазмы и сохранении гипокоагуляции при добавлении дефицитной по изучаемому фактору плазмы.
Предлагаемый способ осуществляется следующим образом: кровь больного для исследования набирают в пробирку, содержащую 3,2% раствор трехзамещенного двухводного цитрата натрия в соотношении 1:9 (1 часть раствора цитрата, 9 частей крови). Исследование выполняется на приборе РОТЭМ (ROTEM, «Pentapharm GmbH», Германия). Используют четыре канала тромбоэластометра. На первом канале тромбоэластометра в кювету вносят 20 мкл СаCl2 0,2М и 20 мкл реагента ех-ТЕМ, содержащего тканевой фактор и гепариназу, и 300 мкл исследуемой цитратной крови. На втором канале тромбоэластометра в кювету вносят 20 мкл СаCl2 0,2М и 20 мкл реагента in-TEM, содержащего эллаговую кислоту, и 300 мкл цитратной крови. На третьем канале в кювету для тромбоэластометрии вносят 20 мкл реагента in-TEM, 20 мкл реагента hep-TEM, содержащего гепариназу, и 300 мкл исследуемой цитратной крови. На четвертом канале в кювету для тромбоэластометрии вносят 20 мкл реагента ех-ТЕМ + 20 мкл реагента fib-TEM + 300 мкл цитратной крови. Нормальные значения тесте FIBTEMMCF (> 9 мм) и отсутствие укорочения НЕРТЕМCT по сравнению INTEMCT позволяют исключить гипофибриногенемию и действие гепарина как причины гипокоагуляции. Дальнейшие исследования направлены на выявление дефицита отдельных факторов свертывания крови.
Удлинение только ЕХТЕМCT выявляется при дефиците FVII
Для подтверждения дефицита FVII на одном канале тромбоэластометра выполняется тест ЕХТЕМ из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части стандартной плазмы, а на другом канале выполняется тест ЕХТЕМ из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части плазмы, дефицитной по FVII. При дефиците FVII в тесте, выполненном со смесью крови с дефицитной плазмой, сохранится удлинение ЕХТЕМCT, а в тесте со смесью крови со стандартной плазмой произойдет нормализация ЕХТЕМCT.
Одновременное удлинение ЕХТЕМCT и INTEMCT выявляется при дефиците FV
Для доказательства дефицита FV выполняются тесты ЕХТЕМ и INTEM с дефицитной по FV и стандартной плазмой. Для этого на двух каналах тромбоэластометра выполняются тесты ЕХТЕМ и INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части стандартной плазмы, а на других двух каналах выполняются тесты ЕХТЕМ и INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части плазмы, дефицитной по FV. При дефиците FV в тестах ЕХТЕМ и INTEM, выполненных со смесью крови с дефицитной плазмой, сохранится удлинение ЕХТЕМCT, и INTEMCT, а в тестах ЕХТЕМ и INTEM, выполненных со смесью исследуемой крови со стандартной плазмой, произойдет нормализация ЕХТЕМCT и INTEMCT.
Удлинение только INTEMCT возникает при дефиците FVIII, FIX, FXI и FXII.
Для доказательства дефицита FVIII выполняется тест INTEM с дефицитной по FVIII и стандартной плазмой. Для подтверждения дефицита FVIII на одном канале тромбоэластометра выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части стандартной плазмы, а на другом канале выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части плазмы, дефицитной по FVIII. При дефиците FVIII в тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранится удлинение INTEMCT, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, произойдет нормализация INTEMCT.
Для доказательства дефицита FIX выполняется тест INTEM с дефицитной по FIX и стандартной плазмой. Для подтверждения дефицита FIX на одном канале тромбоэластометра выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части стандартной плазмы, а на другом канале выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части плазмы, дефицитной по FIX. При дефиците FIX в тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранится удлинение INTEMCT, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, произойдет нормализация INTEMCT.
Для доказательства дефицита FXI выполняется тест INTEM с дефицитной по FXI и стандартной плазмой. Для подтверждения дефицита FXI на одном канале тромбоэластометра выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части стандартной плазмы, а на другом канале выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части плазмы, дефицитной по FXI. При дефиците FXI в тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранится удлинение INTEMCT, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, произойдет нормализация INTEMCT
Для доказательства дефицита FXII выполняется тест INTEM с дефицитной по FXII и стандартной плазмой. Для подтверждения дефицита FXII на одном канале тромбоэластометра выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части стандартной плазмы, а на другом канале выполняется тест INTEM из пробирки, содержащей смесь 2 частей цельной цитратной исследуемой крови и 1 части плазмы, дефицитной по FXII. В тесте INTEM, выполненном со смесью крови с дефицитной плазмой, сохранится удлинение INTEMCT, а в тесте INTEM, выполненном со смесью исследуемой крови со стандартной плазмой, произойдет нормализация INTEMCT.
Преимущества метода заключается в том, что дефицит факторов свертывания крови диагностируется с помощью РОТЭМ без изменения технологии выполнения метода, вся пробоподготовка (внесение субстратной и дефицитных плазм) проводится на преаналитическом этапе. Метод РОТЭМ позволяет заподозрить и быстро диагностировать наследственную коагулопатию, вызванную дефицитом факторов свертывания крови. Выявление дефицита факторов свертывания с помощью метода РОТЭМ, позволяет, зная какие изменения параметра РОТЭМ обуславливает этот дефицит факторов крови, проводить оценку эффективности гемостатической терапии у больных с врожденным дефицитом факторов свертывания крови, не измеряя при этом их активность в плазме крови. При этом ставится цель, поддерживать соответствующие параметры РОТЭМ на нормальных или близких к нормальным значениям, что облегчает и делает доступным контроль за гемостатической терапией у данной категории больных.
Примеры осуществления способа. Пример 1. Диагностика дефицита FVII
Больной О., 28 лет, страдает гипопроконвертинемией. Заболевание протекает с геморрагическим синдромом в виде желудочно-кишечных и носовых кровотечений. Основные показатели системы гемостаза: АЧТВ 31 с, протромбин по Квику 14,5 %, MHO 4,6, фибриноген 2,3 г/л, плазменная активность FVII 1,7%. В тесте INTEM не выявлено отклонений от нормы, в тесте ЕХТЕМ выявлено удлинение ЕХТЕМCT до 809 с (норма до 79 с). На фигуре 3 представлены показатели тромбоэластометрии у больной гипопроконвертинемией: удлинение ЕХТЕМCT, нормальные INTEMCT FIBTEMMCF. В тесте FIBTEM показатель MCF был в пределах нормы (12 мм), что исключило гипофибриногенемию как причину гипокоагуляции. В тесте ЕХТЕМ, выполненном со смесью цельной цитратной крови со стандартной плазмой, ЕХТЕМCT стал 75 с, а в тесте ЕХТЕМ, выполненном со смесью цельной цитратной крови с плазмой, дефицитной по FVII, ЕХТЕМCT остался удлиненным до 490 с (норма до 240 с)., что свидетельствует об изолированном дефиците FVII. На фигуре 4 представлен тест ЕХТЕМ при постановке со смесью цельной крови больного с дефицитом FVII со стандартной плазмой и смесью цельной крови больного с дефицитом FVII и плазмой, дефицитной по FVII. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой (фигура 4).
Пример 2. Оценка эффективности гемостатической терапии у больной гипопроконвертинемией
У больных гипопроконвертинемией СТ в ЕХТЕМ отражает активность FVII. Тромбоэластометрию использовали для контроля за гемостатической терапией рекомбинантным активированным FVII (rFVIIa) во время оперативных вмешательств. Лабораторные тесты (АЧТВ, ПВ, плазменная активность FVII) у больных гипопроконвертинемией не коррелируют с гемостатическим эффектом rFVIIa (U. Martinowitz, М. Michaelson. Guidelines for the Use of Recombinant Activated Factor VII (rFVIIa) in Uncontrolled Bleeding: A Report by the Israeli Multidisciplinary rFVIIa Task Force. Journal of Thrombosis and Haemostasis 2005, 640-48).
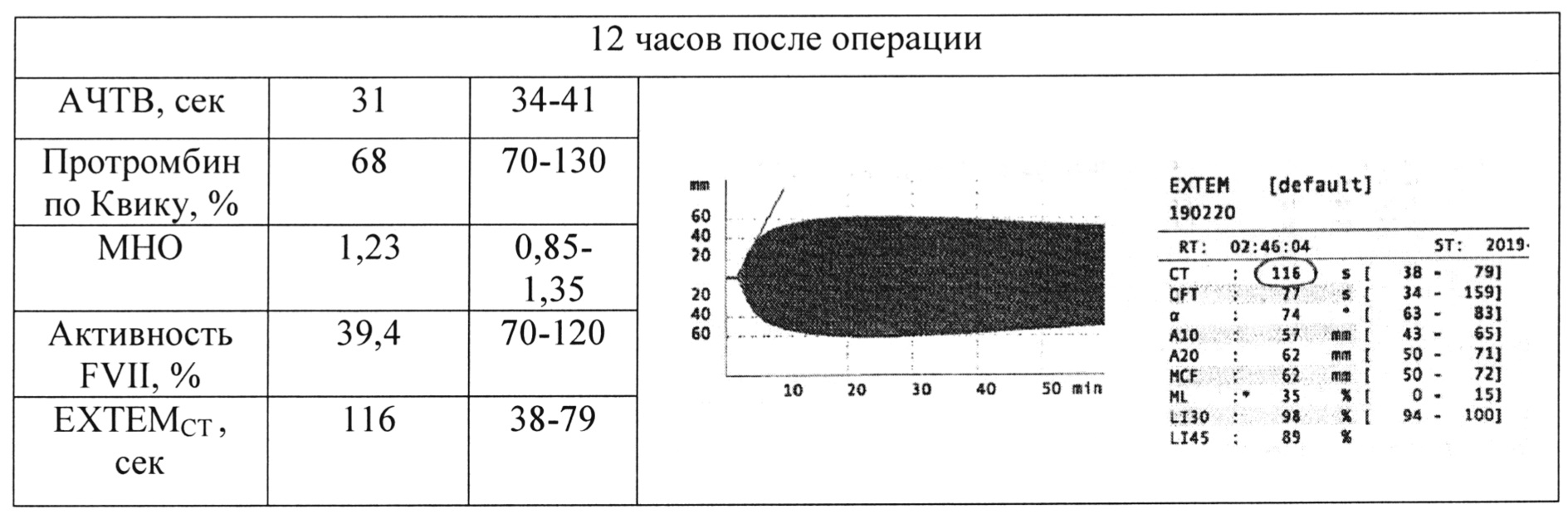
Больной О, 28 лет, страдающей гипопроконвертинемией, было выполнено лапароскопическое удаление кисты яичника. До и после оперативного вмешательства выполнялись коагулогические исследования, измерялась плазменная активность FVII, выполнялась тромбоэластометрия. Результаты исследований в динамике представлены в таблице 1. Как видно из табл. 1., до введения rFVIIa отмечалось выраженное удлинение ЕХТЕМCT, до 405 с (норма до 79 с). После введения rFVIIa у больной уменьшился ЕХТЕМCT с 405 с до 71 с, т.е. до нормы и лишь через 12 ч возникли показания к повторному введению rFVIIa (удлинение ЕХТЕМCT, до 116 с), хотя активность FVII в плазме была при этом 39%, а MHO 1,23.
Таким образом, использование РОТЭМ позволило контролировать у больной гемостаз во время операции и в послеоперационном периоде и принять решение о повторном введении rFVIIa.
Пример 3. Диагностика дефицита FV
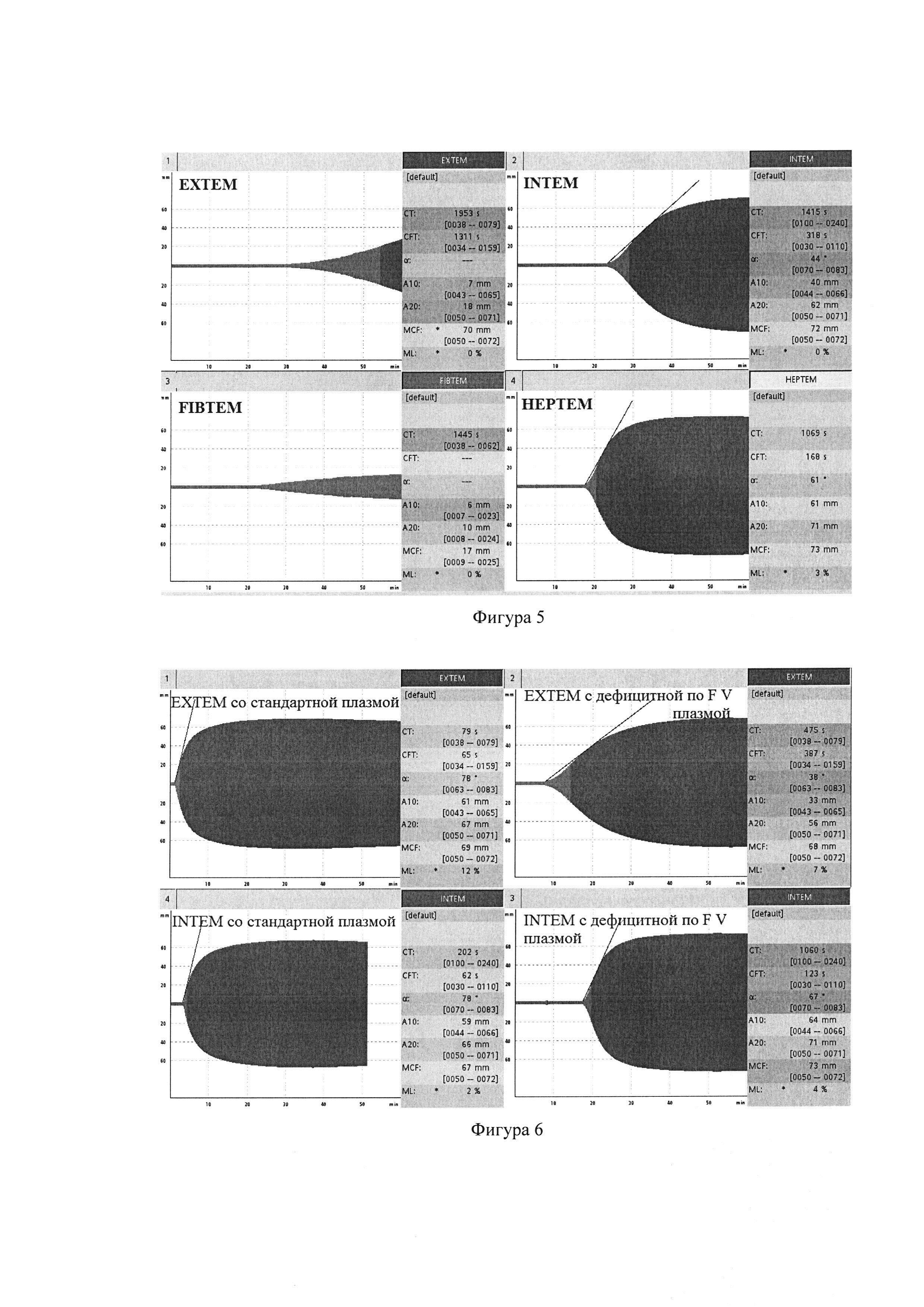
Больная Д., 18 лет, врожденный дефицит FV у нее был выявлен в возрасте 7 лет. Геморрагический синдром проявлялся маточными кровотечениями (плазменная активность FV 0,5%, АЧТВ 200 с, протромбин по Квику 10,7%). В тесте ЕХТЕМ выявлено удлинение СТ до 1953 с (норма до 79 с), в тесте INTEM - удлинение СТ до 1415 с (норма до 240 с). Показатель FIBTEMMCF = 17 мм позволил исключить дефицит фибриногена. Сохраняющееся удлинение СТ до 1069 с в тесте НЕРТЕМ позволило исключить действие гепарина как причины гипокоагуляции. На фигуре 5 представлены показатели тромбоэластометрии у больной с дефицитом FV: удлинение ЕХТЕМCT и INTEMCT, нормальный FIBTEMMCF, отсутствует нормализация СТ в тесте НЕРТЕМ.
При выполнении тестов со смесью цельной цитратной крови со стандартной плазмой, ЕХТЕМCT стал 79 с, INTEMCT - 202 с, т.е. нормализовались. При выполнении тестов со смесью цельной цитратной крови с плазмой, дефицитной по FV, сохранилось патологическое удлинение ЕХТЕМCT до 475 с и INTEMCT до 1060 с, что подтвердило дефицит FV. На фигуре 6 видно, что ЕХТЕМ и INTEM при постановке тестов смеси цельной крови больной с врожденным дефицитом FV со стандартной плазмой и смеси цельной крови больной с врожденным дефицитом FV и плазмой, дефицитной по FV. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой.
Пример 4. Оценка эффективности гемостатической терапии у больной с дефицитом FV
Больной И-вой, 21 года, с врожденным дефицитом FV (плазменная активность FV 0,5%) была выполнена имплантация венозной порт-системы. Коррекция гипокоагуляции проводилась трансфузией свежезамороженной плазмы и концентратом тромбоцитов, поскольку FV содержится в плазме и альфа-гранулах тромбоцитов (Gavva Chakri et al. Transfusion Management of Factor V Deficiency: Three Case Reports and Review of the Literature. Transfusion 2016, 1745-49). В таблице 2 представлены основные коагулогические показатели и результаты тромбоэластометрии до и после заместительных трансфузий. Особенностью данного клинического примера являлось то, что у больной в анамнезе были эпизоды венозных тромбозов после лечения свежезамороженной плазмой. Поэтому основной задачей лечения было компенсировать гипокоагуляцию таким образом, чтобы избежать гиперкоагуляции, сохраняя умеренную гипокоагуляцию, которая позволила бы выполнить оперативное вмешательство (табл. 2).
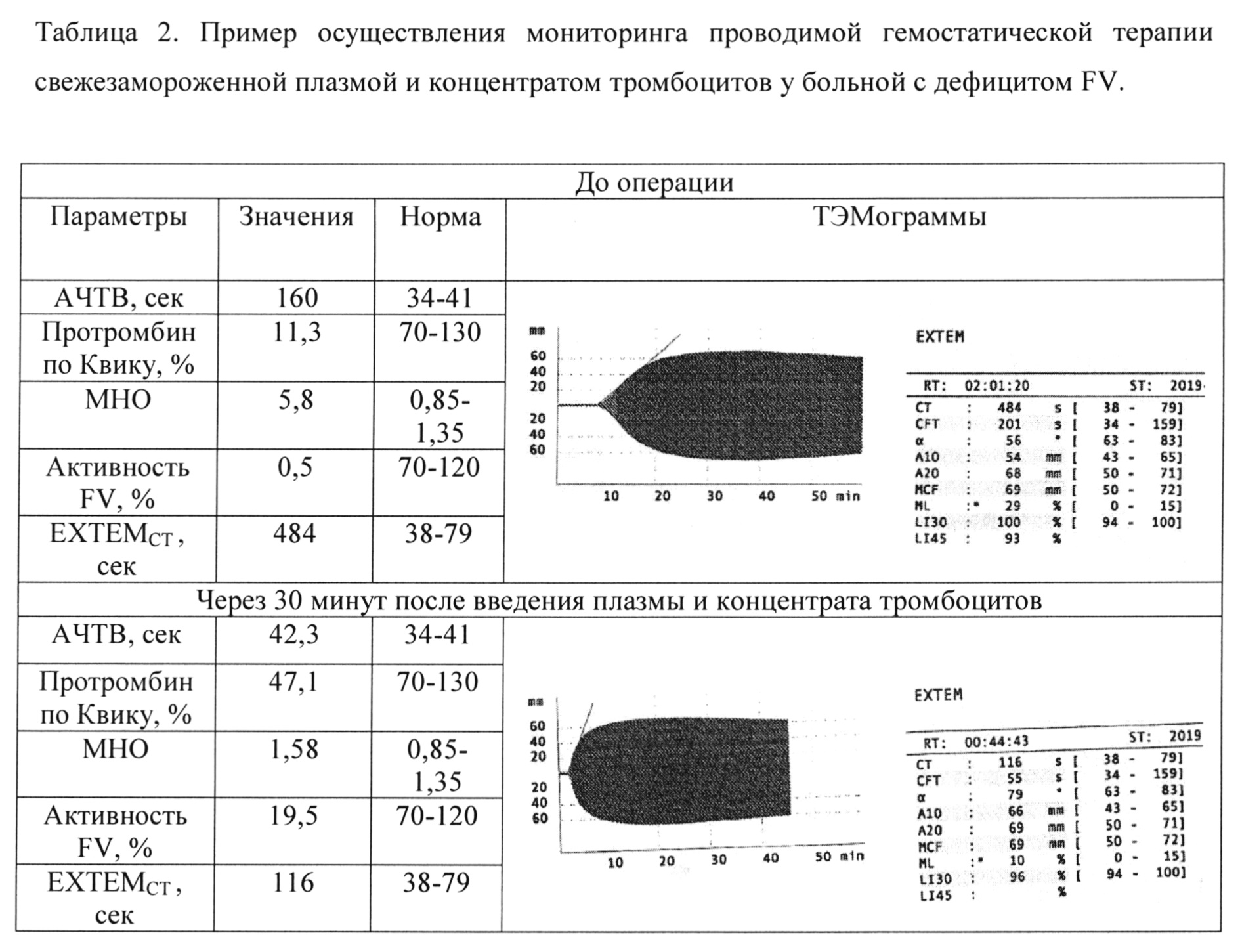
Как видно из таблицы 2, до операции отмечалось выраженное удлинение ЕХТЕМCT, до 484 с (норма до 79 с). После трансфузии плазмы и концентрата тромбоцитов у больной уменьшился ЕХТЕМCT 116 с, активность FV в плазме была при этом 19,5%, MHO 1,58. Использование РОТЭМ позволило контролировать у больной гемостаз во время операции, избежав тромботических осложнений.
Пример 5. Диагностика дефицита FVIII
Больному А, 32 лет, диагноз гемофилия А был установлен в детском возрасте. В анамнезе отмечались рецидивирующие гемартрозы, кровотечения после экстракции зубов. Плазменная активность FVIII составляла 0,7-1,5%. При настоящем обследовании на фоне профилактической гемостатической терапии в коагулограмме: АЧТВ 57 с, протромбин по Квику 110%, фибриноген 2,4 г/л, активность FVIII 11%. При обследовании в соответствии с алгоритмом диагностики дефицита факторов свертывания с помощью РОТЭМ (фиг. 2), в тесте ЕХТЕМ не выявлено отклонений от нормы, в тесте INTEM выявлено удлинение СТ до 872 с (норма 240 с) (фиг 7). На фигуре 7 представлены показатели тромбоэластометрии больного гемофилией А (дефицит FVIII): удлинение INTEMCT, нормальный ЕХТЕМCT, отсутствует нормализация СТ в тесте НЕРТЕМ. Сохранение гипокоагуляции в тесте НЕРТЕМ исключило влияние гепарина (фигура 7). При выполнении теста INTEM со стандартной плазмой и плазмой, дефицитной по FVIII, выявлено укорочение INTEMCT до 232 сек в пробе со стандартной плазмой и сохранение удлинения INTEMCT до 1929 с в пробе с плазмой, дефицитной по FVIII (фигура 8), что подтверждает дефицит FVIII. Дальнейшее увеличение INTEMCT в пробе с дефицитной плазмой можно объяснить дилюцией и уменьшением концентрации FVIII. На фигуре 8 представлен тест INTEM при постановке тестов смеси цельной крови больного гемофилией А со стандартной плазмой и смеси цельной крови больного гемофилией А и плазмой, дефицитной по FVIII. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой.
Пример 6. Диагностика дефицита FIX
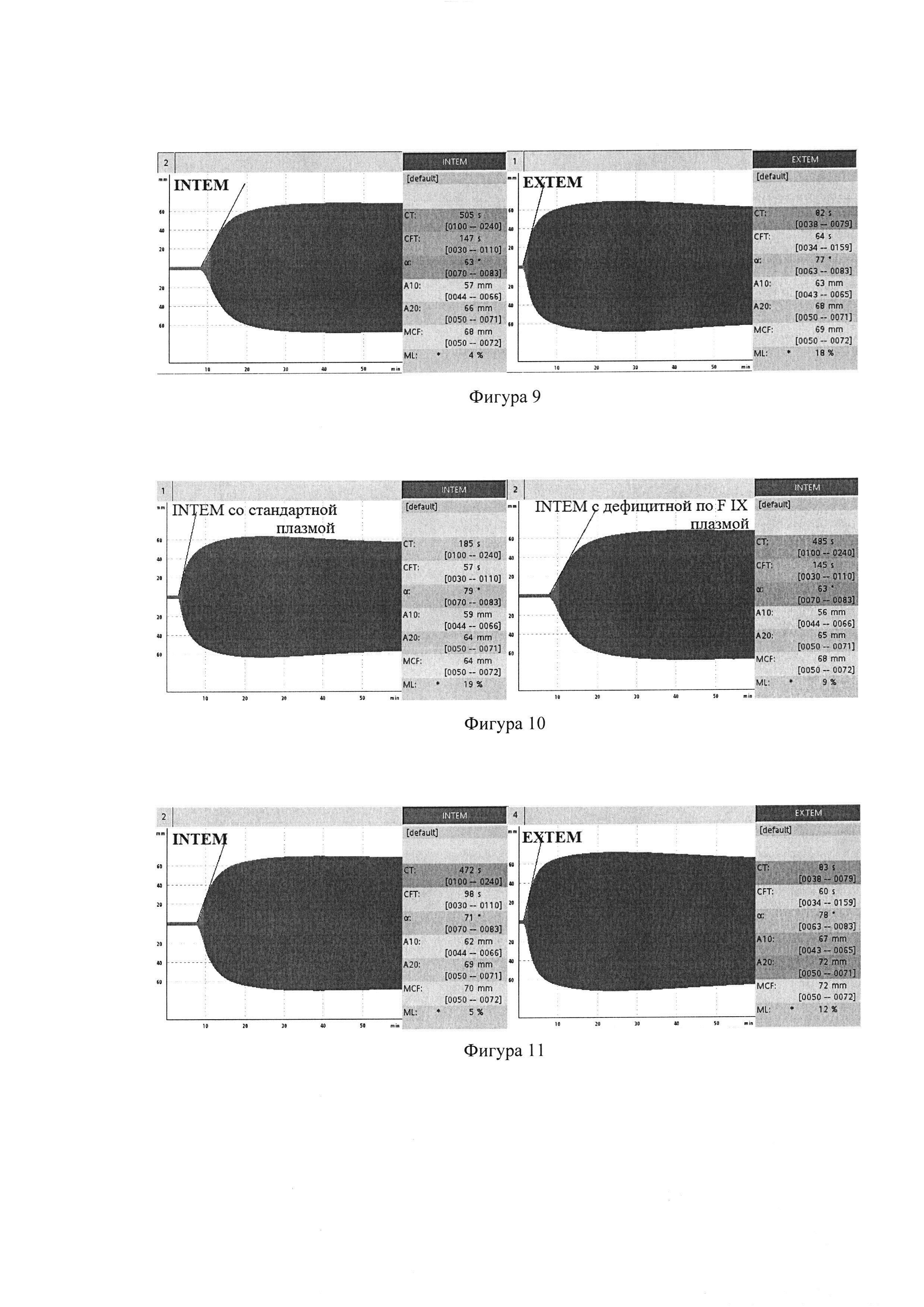
У больного И., 15 лет, с рождения возникали спонтанные внутримышечные гематомы, носовые кровотечения, гемартрозы обоих коленных суставов. Диагностирована гемофилия В, тяжелая форма (FIX < 1%). При настоящем обследовании АЧТВ 151с, протромбин по Квику 71%, фибриноген 2,9 г/л, плазменная активность FIX 0,5%. При обследовании, в соответствии с алгоритмом диагностики дефицита факторов свертывания (фигура 2), в тесте ЕХТЕМ не выявлено отклонений от нормы, выявлено удлинение INTEMCT до 505 с (норма до 240 с). На фигуре 9 представлены показатели тромбоэластометрии у больного гемофилией В (дефицит FIX): удлинение INTEMCT, нормальный ЕХТЕМCT. С помощью теста НЕРТЕМ было исключено действие гепарина. При исследовании цельной крови со стандартной плазмой INTEMCT - 185 с, в тесте с дефицитной плазмой INTEMCT - 485 сек (фигура 10), что подтверждает диагноз гемофилии В. На фигуре 10 показан INTEM при постановке тестов смеси цельной крови больного гемофилией В со стандартной плазмой и смеси цельной крови больного гемофилией В и плазмой, дефицитной по FIX. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой.
Пример 7. Диагностика дефицита фактора свертывания XI
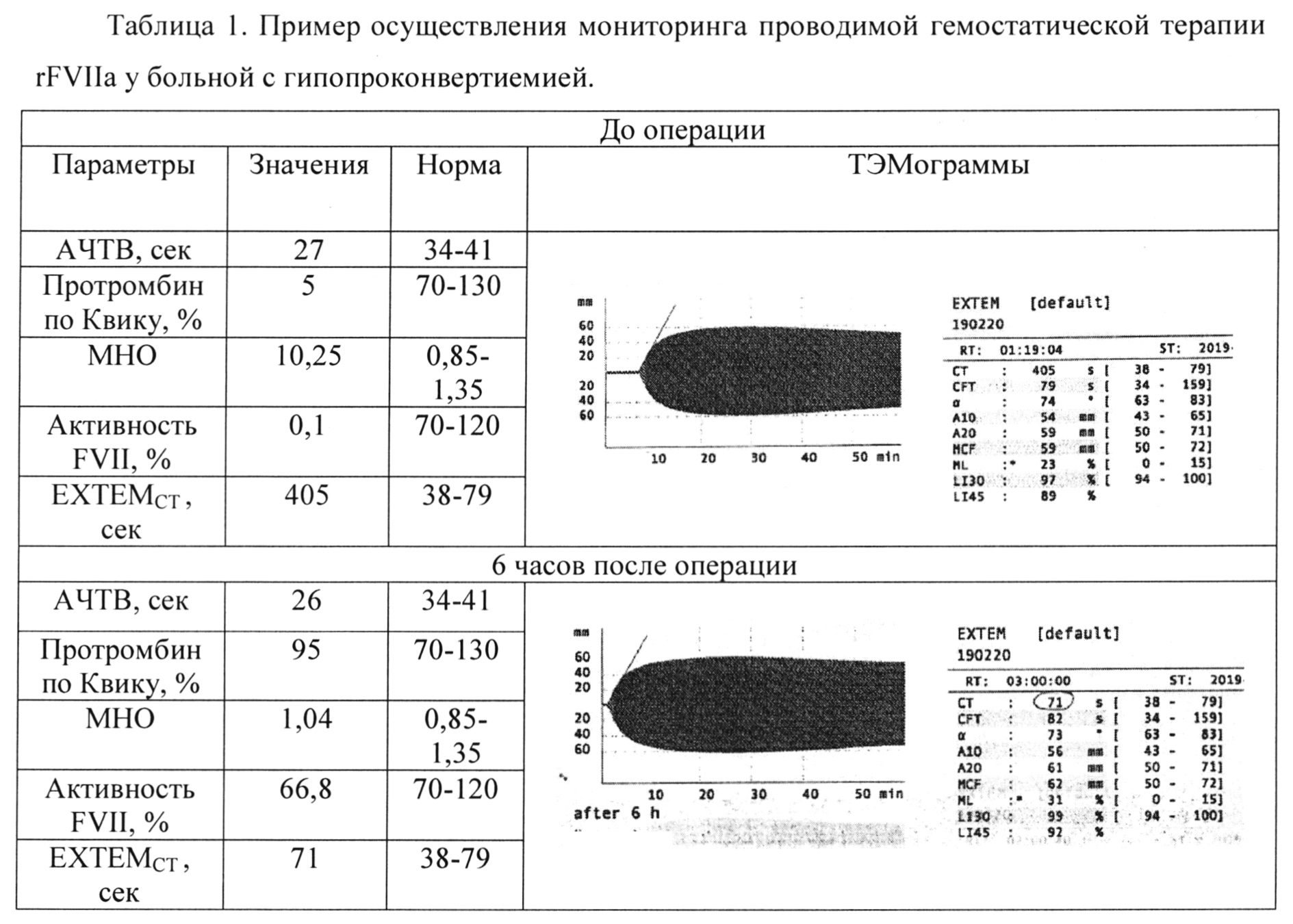
Больная К., 44 лет, страдает гемофилией С. Жалоб на спонтанную кровоточивость не предъявляла, считала себя здоровой. Диагноз был установлен при обследовании перед хирургическим вмешательством: АЧТВ удлинено до 90 сек, протромбин по Квику 92%, фибриноген 3,3 г/л, активность FXI составила 0,7%. При обследовании в соответствии с алгоритмом диагностики дефицита факторов свертывания (фигура 2) в тесте ЕХТЕМ не выявлено отклонений от нормы, выявлено удлинение INTEMCT до 472 сек (норма до 240 сек). На фигуре 11 представлены показатели тромбоэластометрии у больной гемофилией С (дефицит FXI): удлинение INTEMCT, нормальный ЕХТЕМCT. С помощью теста НЕРТЕМ было исключено действие гепарина. При исследовании цельной крови больной со стандартной плазмой ЕМТЕМCT составил 203 с, в то время как в тесте с дефицитной плазмой INTEMCT - 637 с (фигура 12), что подтвердило наличие дефицита FXI как причины гипокоагуляции. На фигуре 12 INTEM при постановке тестов смеси цельной крови больной гемофилией С со стандартной плазмой и смеси цельной крови больной гемофилией С и плазмой, дефицитной по FXI. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой.
Пример 8. Диагностика дефицита FXII
Больная Д, 47 лет, страдает болезнью Хагемана. Заболевание впервые диагностировано в возрасте 37 лет, когда накануне оперативного вмешательства было выявлено удлинение АЧТВ до 86 с, активность FXII составляла менее 1%. В соответствии с алгоритмом диагностики дефицита факторов свертывания (фигура 2) в тесте ЕХТЕМ не выявлено отклонений от нормы, выявлено удлинение INTEMCT до 1681 с (норма до 240 с). На фигуре 13 представлены показатели тромбоэластометрии у больной болезнью Хагемана (дефицит FXII) с: удлинение INTEMCT, нормальный ЕХТЕМCT. С помощью теста НЕРТЕМ было исключено действие гепарина. При исследовании цельной крови больной со стандартной плазмой INTEMCT нормализовался - 243 с, в то время как в тесте с плазмой, дефицитной по FXII, INTEMCT остался удлиненным - 694 с (фигура 14), что подтверждает дефицит FXII. На фигуре 14 INTEM при постановке тестов смеси цельной крови больной с дефицитом FXII со стандартной плазмой и смеси цельной крови больной с дефицитом FXII и плазмой, дефицитной по FXII. Происходит нормализация СТ в смеси со стандартной плазмой и сохраняется гипокоагуляция в смеси с дефицитной плазмой.
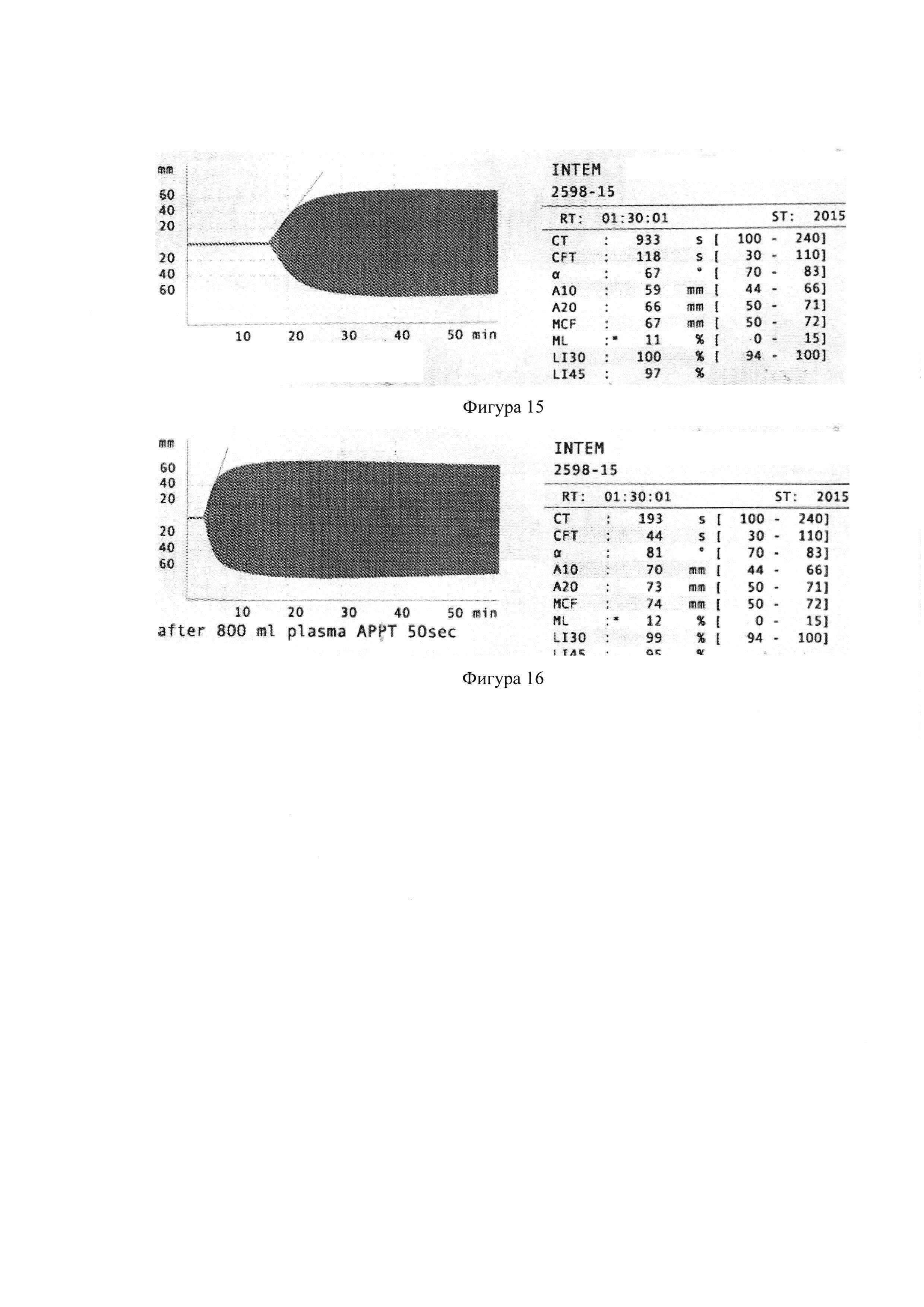
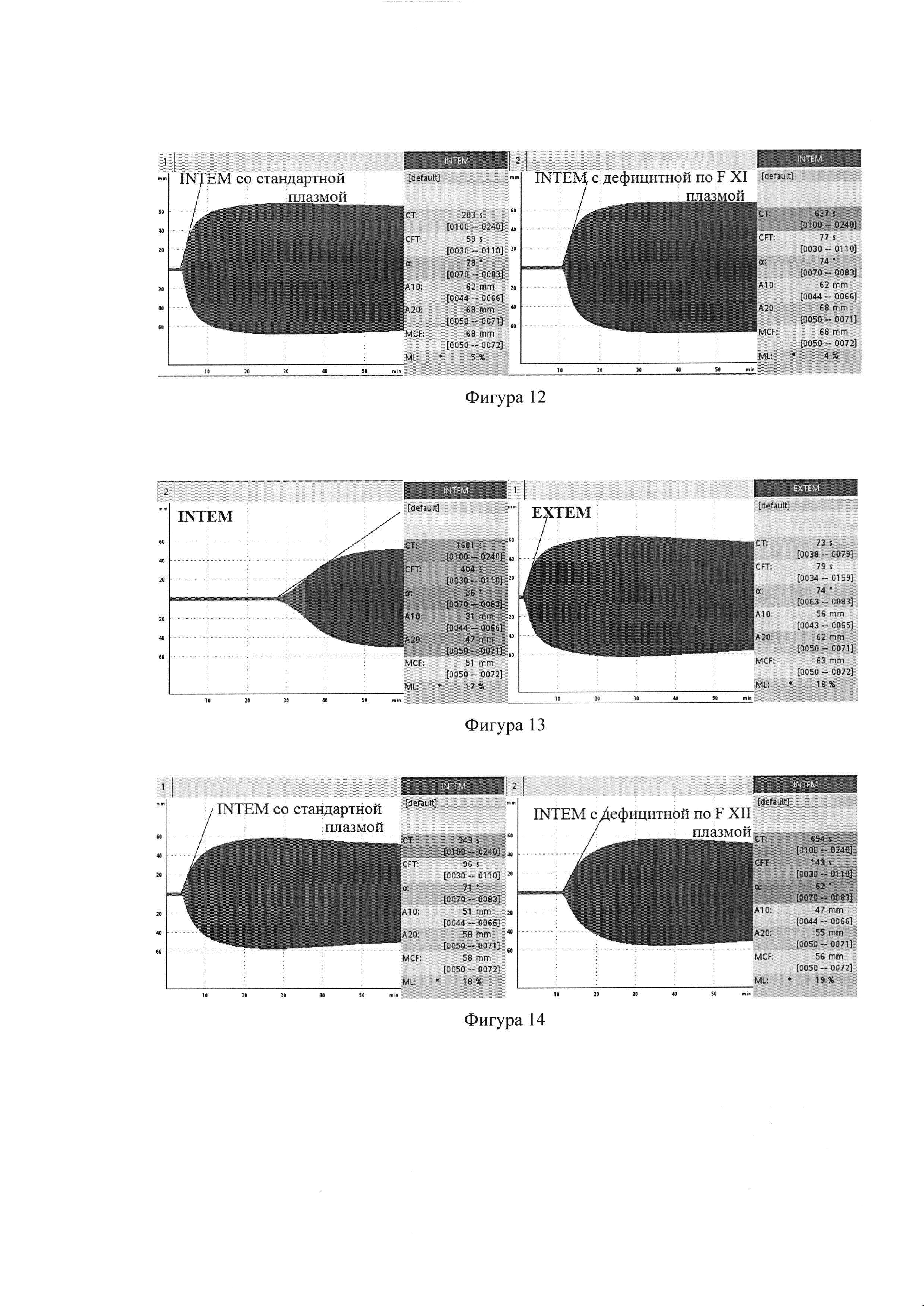
Пример 9. Оценка эффективности гемостатической терапии у больного с врожденным дефицит FXII
Больному В, 54 лет, с диагнозом болезнь Хагемана, выполнено эндопротезирование коленного сустава. До операции в коагулограмме: АЧТВ 164 сек, концентрация фибриногена 3,8 г/л; протромбин по Квику 90 %, MHO 1.06; плазменная активность FXII 1%. При исследовании методом РОТЭМ цельной крови удлинение INTEMCT 933 сек (фиг. 15). После гемостатической терапии СЗП в коагулограмме АЧТВ сократилось до 45 сек. При исследовании методом РОТЭМ после терапии СЗП уменьшился до нормальных значений INTEMCT 193 сек (фиг. 16). В послеоперационном периоде каких-либо геморрагических и тромботических осложнений не наблюдалось.
Таким образом, тромбоэластометрия, выполненная со стандартной плазмой и плазмой, дефицитной по различным факторам свертывания крови, отразила дефицит отдельных исследуемых факторов свертывания крови, что говорит о высокой точности заявленного метода.
Способ выявления дефицита отдельных факторов свертывания крови, заключающийся в том, что при постановке теста ротационной тромбоэластометрии (РОТЭМ) и выявлении удлинения параметра, характеризующего время начала образования сгустка (СТ) в тестах внутреннего и внешнего пути свертывания крови (ЕХТЕМ и/или INTEM) с цельной цитратной кровью, выполняются дополнительно две пробы с добавлением к цельной цитратной крови в соотношении 2:1 либо стандартной плазмы, либо плазмы, дефицитной по исследуемому фактору свертывания, в случае нормализации параметра СТ в тестах ЕХТЕМ и/или INTEM в пробах со стандартной плазмой и сохранении удлиненного параметра СТ в пробах с плазмой, дефицитной по исследуемому фактору свертывания, диагностируется дефицит того или иного фактора свертывания крови.