Результат интеллектуальной деятельности: ФЛУОРЕСЦИРУЮЩАЯ КЛЕТОЧНАЯ ЛИНИЯ ГЛИОМЫ И СПОСОБ ЕЁ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Группа изобретений относится к биотехнологии, в частности к генетической инженерии и может быть использована для получения генетически трансформированных клеток млекопитающих в культурах, продуцирующих флуоресцентные белки, используемых в научных исследованиях для визуализации клеток в тканях и для разработки новых ненвазивных методов ранней диагностики опухоли мозга, а также эффективных методов лечения глиомы путём адресной доставки противоопухолевых препаратов через гематоэнцефалический барьер.
Известны флуоресцирующие клеточные линии, полученные путём трансфекции линии через лентивирусы.
В частности, известна флуоресцирующая клеточная линия лейкоцитов человека MDS (myelodysplasticsyndrome) и способ её получения, заключающийся в трансфекции линии лейкоцитов человека MDS трансляции SKM-1 через лентивирусы, несущие GFP-гены (greenfluorescentprotein) (см. заявку на изобретение CN105670999, МПК А01К67/027, опуб. 15.06.2016).
Известны также флуоресцирующие клеточные линии глиобластомы (GBM), экспрессирующие красные флуоресцентные белки mKate2 и mCherry и способ ее получения, заключающийся в трансфекции линии U251MG глиобластомы человека через лентивирусы, несущие mKate2 и mCherry – гены. Линии оценивались как инструмент неинвазивной визуализации ортотопических опухолей.(Verreault M, Strutt D, Masin D, Fink D, Gill R, Bally MB. Development of glioblastoma cell lines expressing red fluorescence for non-invasive live imaging of intracranial tumors. Anticancer Res. 2011 Jun; 31(6): 2161-71.)
Известна также флуоресцирующая клеточная линия глиомы человека SU3- RFP, экспрессирующая красный флуоресцентный белок (RFP) и способ ее получения, заключающийся в трансфекции линии глиомы человека SU3 лентивирусами, несущими ген RFP, линия оценивалась как инструмент неинвазивной визуализации ортотопических опухолей (Yuntian S, Quanbin Z, Ginshi Z, Zhaohui L, Aidong Wang, Xifeng Fei, Xingliang Dai, Jinding Wu, Zhimin Wang, Yaodong Z, Ye T, Jun D, Qing L and qiang H. Advantages of a dual-color fluorescence-tracing glioma orthotopic implantation model: detecting tumor location, angiogenesis, cellular fusion and the tumor microenvironment. Eexperimental and therapeutic medicine 10: 2047-2054, 2015).
Однако, использование лентивирусов увеличивает риск инсерционного мутагенеза. Кроме этого, к недостаткам данных методов можно отнести ограниченный объем вставки кодируемых последовательностей (до 8 тыс. пар оснований), способный переносится лентивирусом. Так же к недостаткам процесса трансфекции можно отнести его трудоемкость, поскольку необходимо определять чувствительность клеточной линии к лентивирусной трансдукции; осуществлять выбор оптимального промотора для экспрессии флуоресцентного белка; конструировать лентивирусные векторы, кодирующие флуоресцентные белки и проводить трансдукцию.
Наиболее близкой к заявляемой группе изобретений является флуоресцирующая клеточная линия melKor-TurboRFP и способ её использования для исследований in vitro в экспериментальной онкологии (см. патент РФ №2458123, МПК С12N5/09, опуб. 10.08.2012). Способ получения клеточной линии заключается в выращивании клеточной линии, добавлении смеси плазмидной ДНК pTurboRFP-C ("Евроген", Россия), кодирующей флуоресцентные белки, с липосомами Lipofectamine 2000 (Invitrogen, США), инкубировании, добавлении антибиотика - генетицина (антибиотик G418, аналог неомицина), культивировании и отборе флуоресцирующих колоний.
Однако, для получения данной клеточной линии речь идет о введении только одного вектора флуоресцентного белка, что может обуславливать недостаточный уровень экспрессии флуоресцентного белка. Кроме этого, способ является дорогостоящим из-за высокой стоимости коммерческого реактива Lipofectamine 2000.
Технической проблемой группы изобретений является разработка клеточной линии глиомы для экспериментальной медицины, обеспечивающей развитие новых подходов к ранней диагностики опухоли мозга, а также эффективных методов лечения глиомы путём адресной доставки противоопухолевых препаратов через гематоэнцефалический барьер.
Технический результат заключается в повышении выживаемости опухолевых клеток в процессе трансфекции и обеспечении высокой приживаемости клеток в мозге животных после их имплантации при расширении технологических возможностей изучения динамики развития опухоли мозга.
Указанная проблема и технический результат решается тем, что получена новая флуоресцирующая клеточная линия С6-TagRFP-TurboFP635 путём введения генов, кодирующих экспрессию красных флуоресцирующих белков TagRFP и TurboFP635 и используемая для исследования глиомы мозга in vitro и in vivo.
В способе получения флуоресцирующей клеточной линии, заключающемся в выращивании клеточной линии в ростовой среде до монослоя, удалении среды и добавлении к монослою смеси плазмидной ДНК, кодирующей флуоресцентные белки, с липосомами и неполной питательной средой, инкубировании, добавлении антибиотика, культивировании и отборе флуоресцирующих колоний, согласно изобретению, в качестве плазмидной ДНК используют, по крайне мере, два вектора pTagRFP-С и pTurboFP635-С, а в качестве липосом используют липосомы, синтезированные с использованием фосфатидилхолина и ганглиозида.
Соотношение векторов к липосомам выбирают 1:10.
В преимущественном варианте осуществления способа фосфатидилхолин используют из яичного желтка, а ганглиозид- из мозга быка. В качестве антибиотика используют генетицин.
Способ поясняется иллюстрациями, где представлены:
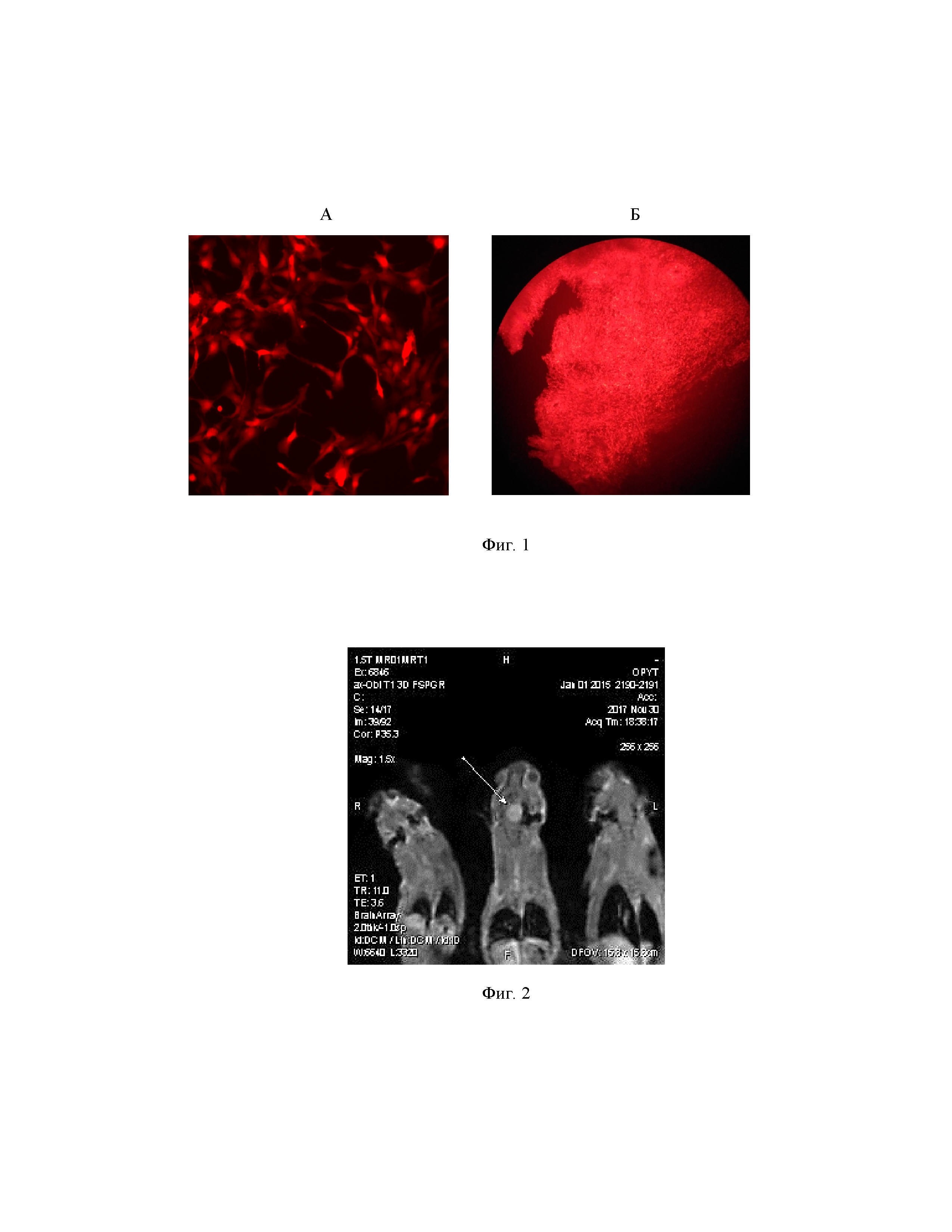
на фиг. 1 – микрофотографии опухолевых клеток флуоресцирующей глиомы С6-TagRFP-TurboFP635 после культивирования in vitro (А) и срезов мозга крысы после инфекции опухолевых клеток флуоресцирующей глиомы (Б);
на фиг. 2 – результат магнитно-резонансной томографии развития глиомы у крыс; стрелками показано накопление контрастного вещества – гадолиний в тканях опухоли, свидетельствующего о ее развитии; рядом –контрольные животные (без опухоли);
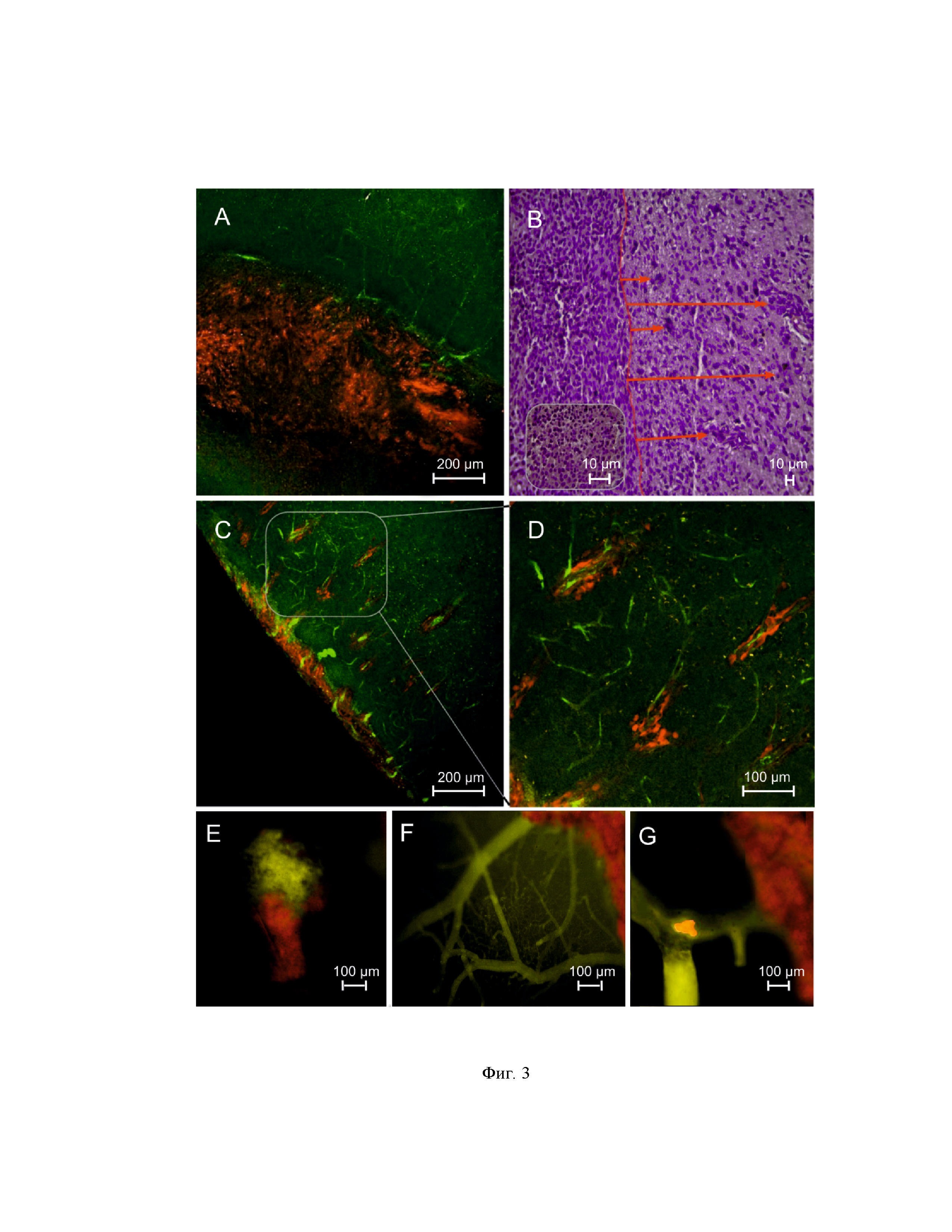
на фиг. 3 – данные конфокальной и флуоресцентной микроскопии, а также гистологического анализа развития флуоресцентной глиомы у крыс:
А – флуоресцентная глима (красная) с кровеносными сосудами (зеленые);
В – гистологический препарат глимы крысы; стрелками показана миграция опухолевых клеток из дочерних тканей в здоровые участки мозга; на большом увеличении показан плиморфизм глиомы, как морфологический признак ее развития;
С – конфокальная микроскопия роста глиомы по сосудам мозга;
D – то же на большом увеличении;
Е – данные флуоресцентной микроскопии о развитии глиомы (красный цвет) и открытия гематоэнцефалического барьера (зеленый цвет означает пропускание через сосуды мозга в области глиомы зеленого красителя) как функционального признака тяжелой степени развития опухоли;
F – сосуды мозга (зеленые) рядом с опухолью (красные); показана граница опухоли возле здоровых тканей, где сосуды еще не повреждены;
G – флуоресцентная микроскопия миграции опухоли (желтая за счет сливания двух цветов зеленого и красного) по сосудам мозга (зеленый цвет).
Способ осуществляется следующим образом.
Трансфицированная клеточная линия была получена из клеточной линии глиомы крысы С6(РККК (П)) следующим образом: клетки трансфицировали плазмидной ДНК pTagRFP-C и pTurboFP635-C с использованием метода липосомальной трансфекции с последующей селекцией при помощи генетицина (антибиотик G418, аналог неомицина).
Полученная клеточная линия С6-TagRFP-TurboFP635 обладает стабильными культуральными и морфологическими характеристиками.
Морфологические признаки клеточной линии.
Полученная клеточная линия характеризуется наличием множественных плотных центров роста опухолевых клеток веретенообразной формы, образовывающих контакты с другими клетками в культуре. Имеются гигантские многоядерные клетки, фигуры митоза.
Культуральные свойства клеточной линии.
Культивируется в питательной среде DMEM, содержащей 10% фетальной телячьей сыворотки и антибиотики (пенициллин и стрептомицин в концентрации 100 ед./мл и 100 мкг/мл соответственно). В культуральные флаконы объемом 25 см2 в 5 мл среды засевают 1х106 клеток. Температура культивирования 37°С. Монослой клеток формируется через 2-5 дня.
Клетки снимаются с использованием стандартного раствора Трипсин-ЭДТА ("Панэко", Россия).
Условия криоконсервации.
Для длительного хранения клетки консервируют путем замораживания в жидком азоте. Клетки ресуспендируют в ростовой среде для замораживания (BioRad, Россия). Режим замораживания: жидкий азот, снижение температуры на 1°С в минуту до минус 25°С, затем быстрое замораживание до минус 70°С. Хранение в жидком азоте при температуре минус 196°С.
Размораживание быстрое при 37°С. Клетки разводят в 10 мл бессывороточной среды и осаждают центрифугированием, ресуспендируют в 5 мл той же среды, содержащей 10% фетальной телячьей сыворотки, и переносят в культуральный флакон объемом 25 см2. Жизнеспособность клеток оценивают по включению трипанового синего. Жизнеспособность клеток после размораживания составляет 85-90%.
Контаминация.
При длительном наблюдении бактерии и грибы в культуре не обнаружены.
Стабильность экспрессии флуоресцирующего белка в отсутствии селектирующей среды наблюдается в течение более чем 10 циклов культивирования.
Клетки полученной клеточной линии экспрессируют флуоресцирующие белки, что позволяет эффективно исследовать действие противоопухолевых агентов на монослои этих клеток in vitro, не применяя трудоемкий подсчет клеток при помощи камеры Горяева или функциональные тесты жизнеспособности клеток, требующие дополнительных манипуляций с соответствующими реагентами.
Способ иллюстрируется примерами.
Пример 1. Получение комплекса липосом с векторами pTagRFP-C и pTurboFP635-C.
Были сконструированы липосомы на базе матрицы из фосфатидилхолина яичного желтка (ePC) и ганглиозида GM1 из мозга быка (GM1-липосомы).
Липосомы получали стандартным методом экструзии после гидратации липидной пленки по методу Kuznetsova N., Kandyba A., Vostrov I., Kadykov V., Gaenko G., Molotkovsky J., Vodovozova E.,. Liposomes loaded with lipophilic prodrugs of methotrexate and melphalan as convenient drug delivery vehicles. J. Drug Delivery Science Technol. 19 (2009) 51–59. Образец в бислое содержал 1 мольн % фосфатидилхолина.
В равной пропорции векторы pTagRFP-C и pTurboFP635-C добавлялись в момент синтеза липосом в массовой доле 1:10, в концентрации 400 нг/мкл.
После экструзии через мембранные фильтры с диаметром пор 100 нм на установке Lipex (NorthernLipids, Канада) получали липосомальные дисперсии в физиологическом растворе (фосфатный буфер, рН 7.1, концентрация по суммарным липидам 25 мМ). По данным динамического светорассеяния (установка Malvern Zetasizer Nano ZS, “Malvern”, Великобритания), средние диаметры и индексы полидисперсности для липосом составили — 104 нм и 0.076.
Пример 2. Культивирование клеточной линии C6.
За 2 суток до трансфекции клетки рассаживали в лунки 24-луночного планшета в 0,5 мл ростовой среды (DMEM), содержащей 10% фетальной телячьей сыворотки, не содержащей антибиотиков, таким образом, чтобы во время трансфекции клетки составляли бы 70-90%-ный монослой.
100 мкл комплекса ДНК-липосом ресуспендировали в 1мл бессывороточной среды DMEM, инкубировали 5 минут при комнатной температуре. Затем добавляли по 200 мкл ДНК-липосомного комплекса в каждую лунку планшета, содержащую клетки и по 0,5 мл бессывороточной среды DMEM без антибиотиков. Осторожным покачиванием планшета распределяли добавленный комплекс по всей площади лунок. Клетки инкубировали при 37°С в СO2-инкубаторе в течение 6 часов, затем старую питательную среду удаляли и вносили 0,5 мл среды DMEM, содержащей 10% фетальной телячьей сыворотки без антибиотиков.
После трансфекции смесь трансфицированных и нетрансфицированных клеток подвергали селекции при помощи генетицина в концентрации в ростовой среде 800 мкг/мл. Смену селектирующей среды с антибиотиком производили каждый 4-й день, селекцию производили в течение 2-х недель.
Количество жизнеспособных клеток определяли по стандартной методике в камере Горяева, используя 0,5% раствор трипанового синего в PBS. В культуральные флаконы объемом 25 см2 в 5 мл среды засевали 1×106 клеток. Температура культивирования 37°С. Клетки культивировали в среде DMEM, содержащей 10% телячьей фетальной сыворотки, пенициллин (100 ед./мл), стрептомицин (100 мкг/мл) в культуральных флаконах (Costar).
Пример 3. Флуоресценция клеточной линии С6-TagRFP-TurboFP635 in vitro подтверждена при помощи флуоресцентной микроскопии (фиг.1А).
На фиг.1 Б приведены микрофотографии срезов мозга крысы после приживания опухолевых клеток флуоресцирующей глиомы С6-TagRFP-TurboFP635.
Пример 4. Исследования были проведены на 170 половозрелых беспородных крысах. Эксперименты выполняли на половозрелых самках крыс в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства высшего и среднего образования СССР от 13.11.1984г. №742). Моделирование глиомы in vivo выполняли с помощью внутримозговой стереотаксической имплантации флуоресцентных клеток С6. Крысе предварительно проводили премедикацию седуксеном (50 мкг/мл), затем глубоко наркотизировали внутрибрюшинным введением золетила (100 мкг/кг). Иммобилизовали на стереотаксическом столике фиксацией головы по методике, удаляли шерсть в месте планируемой операции, производили разрез в области планируемого введения по выбранным координатам размером длиной 2 мм. Подготовленные клетки глиомы (5х105 клеток на крысу) имплантировали в область каудопутамена с помощью стереотаксического аппарата Narishige (США) по следующим координатам Ар -1; L 3,0; V 4,5, TBS -2,4 мм. Клетки вводили с помощью гамильтоновского микрошприца, соединенного с инфузоматом, со скоростью 3 мкл/мин в объёме 1015 кл/мл. После введения клеток рану послойно ушивали, обрабатывали 2% раствором бриллиантового зеленого. Животное помещали в чистую клетку. Длительность имплантации не превышала 10-15 минут. Животное самостоятельно просыпалось через 30 минут после наркотизации. Болевых или иных неприятных проявлений при этом не отмечалось. Результаты стереотаксической имплантации оценивали по данным МРТ сканирования мозга на томографе Brivo MR 355 1.5 Т в Т2 режиме (GE Healthcare, Великобритания).
На фиг. 2 приведены фотографии МРТ сканирования развития глиомы у крыс. На фиг. 3 представлены данные конфокальной микроскопии, подтверждающие наличие и развитие глиомы (А, C, D, F и G) и открытие гематоэнцефалического барьера на тяжелых стадиях развития опухоли (E), а также результат гистологического анализа развития флуоресцентной глиомы у крыс (B).
Таким образом, разработана новая клеточная линия глиомы для экспериментальной медицины, обеспечивающая развитие новых подходов к ранней диагностики опухоли мозга, а также эффективных методов лечения глиомы путём адресной доставки противоопухолевых препаратов через гематоэнцефалический барьер.