Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОТИТОВ У МЕЛКИХ ЖИВОТНЫХ
Вид РИД
Изобретение
Изобретение относится к ветеринарной медицине и может быть использовано при лечении острых и хронических отитов бактериального происхождения у собак.
В настоящее время болезни органов слуха различной этиологии занимают существенный удельный вес в общей патологии животных. Одними из причин, вызывающих отиты у животных являются паразитарные, бактериальные и грибковые агенты. Но не всегда эти агенты участвуют одновременно, и в большинстве случаях распространенной причиной отитов и дерматитов наружного слухового прохода у животных является внедрение бактериальной микрофлоры.
На рынке ветеринарных препаратов капли ушные (растворы для аурикулярного применения) для лечения отитов у животных нередко содержат сразу несколько действующих веществ, обладающих противогрибковым, противомикробным, противопаразитарным действиями.
В связи с отсутствием в некоторых случаях показаний к применению животным средств с противогрибковым и противопаразитарным действием и наличием только бактериального агента имеется необходимость в расширении ассортимента средств для лечения бактериальных отитов.
Для лечения наружного отита бактериальной и грибковой этиологии, поверхностного дерматита у собак и кошек используют Отибиовин (Bioveta, а.s., Чехия). Раствор Отибиовина содержит триамцинолона ацетонид, кислоту салициловую, гентамицина сульфат и обладает противомикробным спектром действия. Недостатком капель является их высокая стоимость.
Лекарственный препарат для ветеринарного применения «Аурикан» («Ceva Sante Animale», Франция) в качестве действующих веществ содержит диазинон, преднизолона натрия сульфобензоат, гексамидина диисетионат и тетрациклина гидрохлорид. Данный препарат в первую очередь применяют собакам и кошкам с лечебной целью при отодектозе.
Капли глазные и ушные Софрадекс® (AVENTIS PHARMA Ltd., Индия) содержат фрамицетина сульфат, грамицидин, дексаметазон и обладают широким спектром антибактериального действия. Недостатком являются отсутствие дозировок для животных, высокая стоимость.
Лекарственное средство «Капли ушные Барс форте» (ООО «НВЦ Агроветзащита», Москва) содержит миконазола нитрат и энрофлоксацин, данный препарат в первую очередь назначают при лечении грибковых инфекций.
Для успешного лечения заболеваний в терапии необходим комплексный подход. Готовые лекарственные формы должны содержать по возможности компоненты, которые обеспечивают комплексное воздействие на патологический очаг при минимизации числа введений различных препаратов и затрат рабочего времени ветеринарных специалистов на дополнительные обработки (см. Елфачева, Ю.Д. Фармакологические свойства «Отина»: дис… канд. вет. наук: 16.00.04 / Елфачева Юлия Дмитриева. - СПб., 2004. - 129 с; Ивченко, О.В. Диагностика малассезиозов животных: автореф. канд. вет. наук: 06.02.02 / Ивченко Олеся Валерьевна. - М., 2010. - 22 с.).
Задачей изобретения является разработка высокоэффективного комплексного средства для лечения острых и хронических отитов бактериального происхождения у собак; расширение ассортимента средств для лечения отитов, включающих ингредиенты отечественного производства, в том числе, из местного сырья.
Задача решается тем, что в средстве для лечения отитов у мелких животных, которое предназначено для лечения острых и хронических отитов бактериального происхождения, используется комбинация веществ: йодоформ - 8%, гентамицина сульфат - 1%, димексид-50%, масло зародышей пшеницы - до 100%, при курсе применения 2-3 раза в сутки в течение 7-10 дней.
В данном комплексном препарате содержится йодоформ -антисептическое йодсодержащее лекарственное средство широкого спектра действия. Основным действующим веществом является трийодметан, который оказывает антисептическое и дезинфицирующее действие. При наружном применении данный препарат способствует грануляции и очищению раневой поверхности. Активное вещество (трийодметан) под воздействием тканевых выделений, света и воздуха медленно разлагается, при этом выделяя йод. Используется в качестве антисептического средства.
Гентамицина сульфат - бактерицидный антибиотик широкого спектра действия из группы аминогликозидов, эффективен в отношении многих грамположительных и грамотрицательных бактерий.
Димексид - обладает выраженным местноанестезирующим действием, а также противовоспалительным и антимикробным, изменяет чувствительность микрофлоры, резистентной к антибиотикам.
Масло - возможно использование различных масел, растительного, облепихового, в том числе, из зародышей пшеницы местного производства и др. На терапевтическую эффективность лекарственных веществ значительное влияние оказывает природа и свойства основы. Растительные масла, использующиеся в качестве основы (масло зародышей пшеницы, подсолнечное, оливковое, соевое, кукурузное, кокосовое и др.), обеспечивают хорошую всасываемость лекарственных веществ и способствуют качественному удалению скопившейся серы и воспалительного экссудата из слухового прохода.
Хранение комплексного препарата осуществляют при температуре +8+15 градусов, в защищенном от воздействия солнечных лучей месте.
Сопоставимый анализ заявляемого технического решения с известными средствами показывает, что заявляемое средство отличается составом и купирует бактериальные агенты, вызывающие отиты у животных.
Изобретение иллюстрируется примерами исследований предложенного средства на токсичность, а также практическими исследованиями.
Для исследований на токсичность использовали морских свинок, кроликов, белых крыс, белых мышей, которых в экспериментах ранее не использовали. Контроль за состоянием здоровья опытных животных проводили ежедневно.
Содержание животных осуществляли согласно санитарным правилам и на стандартном рационе в соответствии с Приказом МЗ СССР №1045-73 от 06.04.1973 г., Правилам лабораторной практики и Приказом МЗ СССР №1179 от 10.10.1983 г. Кормление животных осуществляли в соответствии с Приказом МЗ СССР №163 от 10.03.1966 г. о рационе лабораторных животных, а также в соответствии с «Временными суточными нормами гранулированных комбикормов для лабораторных животных», утвержденными МЗ СССР 04.12.1978 г. и методическими указаниями «Стандартизация экологической среды лабораторных животных по фактору питания» (Академия медицинских наук, 1980).
Для кормления опытных животных использовали комбикорм (полнорационный гранулированный для лабораторных животных), изготовленный на комбикормовом заводе (ГОСТ Р 50258-92). Поение животных осуществляли из стандартных поилок водой, соответствующей ГОСТ «Вода питьевая».
Животных содержали в помещениях с естественно-искусственным освещением и контролируемым микроклиматом. Ежедневно осуществляли контроль за температурой в помещении и влажностью с использованием гигрометров психрометрических ВИТ-2. Показатели температуры помещения находились в пределах нормы 20-22 С; относительной влажности - 60-70%.
Подготовку животных к опыту проводили в соответствии с указаниями ОФС «Испытание на токсичность» ГФ XI (2). Перед опытом у животных забирали корм и воду. Через два часа животных взвешивали и распределяли по группам.
У животных в опытных и контрольных группах определяли показатели:
- гематологические (содержание гемоглобина, лейкоцитов, эритроцитов на автоматическом ветеринарном анализаторе Abacus Junior Vet (Diatron, Австрия), лейкоцитарную формулу подсчитывали в мазках крови, окрашенных по общепринятой методике;
- биохимические (общий белок, креатинин, мочевина, щелочная фосфатаза, аланинаминотрансфераза, аспартатаминотрансфераза, глюкоза) на автоматическом биохимическом и ИФА-анализаторе ChemWell 2910 (Combi) (производство США) с использованием наборов реагентов DIALAB (производство Австрия) согласно методикам, рекомендованным Международной федерацией клинической химии (IFCC).
Химический состав органов животных определяли по показателям: содержание жира по ГОСТ 23042-2015 с использованием фильтрующей делительной воронки (ускоренный метод); белок по ГОСТ 25011-81 (метод определения массовой доли белка по Кьельдалю), массовую долю общей золы по ГОСТ 31727-2012 гравиметрическим методом.
Определяли аминокислотный состав в печени путем измерения массовой доли аминокислот методом высокоэффективной жидкостной хроматографии на хроматографе жидкостном LC - 20 Prominence производство фирмы Shimadzu (производство Японии) со спектрометрическим детектором (SPD - 20А). Разделение фенилтиокарбамидных производных аминокислот проводили на колонке с обращенной фазой С18 в режиме градиентного элюирования и их спектрометрическим детектировании на длине волны 254 нм.
Подбор животных в группы проводили произвольно, методом «случайных чисел», используя в качестве критерия массу тела. Индивидуальные значения массы тела не отклонялись от среднего значения в группе более чем на 10%. Животных взвешивали на весах BP-05МС-3/0.5-БР (Россия).
Токсикологические исследования проводятся для определения степени опасности препаратов при применении однократно и многократно.
Оценку острой токсичности проводили на кроликах и мышах, находящихся в одинаковых условиях содержания и кормления.
Для проведения исследований острой токсичности были подобраны крольчихи по принципу парных аналогов -3 группы по 10 голов в каждой с массой 2,3-2,4 кг (№1 контрольная, №№2, 3 - опытные группы).
Животные во всех группах были клинически здоровы.
Кроликам контрольной группы (№1) вводили 50 мл питьевой воды на голову. Кроликам опытных групп до кормления непосредственно в желудок вводили водный раствор в таком же объеме: для опытной группы №2 к 12,5 мл средства добавляли воду и доводили до 50 мл на голову; для опытной группы №3 к 25 мл средства добавляли воду и доводили до 50 мл на голову.
Длительность наблюдения за животными составила 10 суток.
При проведении исследовательских работ учитывали клиническое состояние всех исследуемых животных (таблица 1), а также динамику массы тела (таблица 2), выживаемость животных.
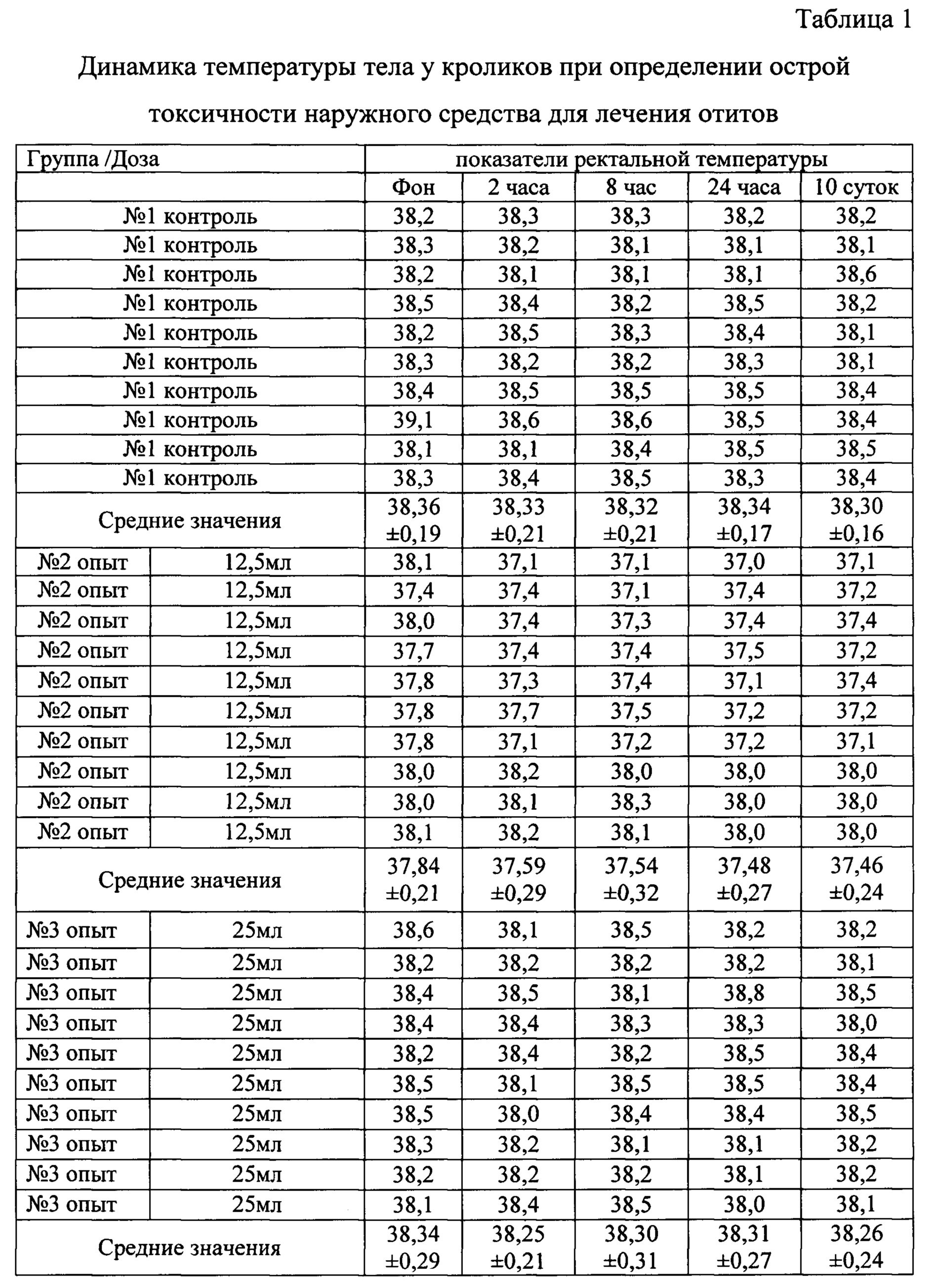
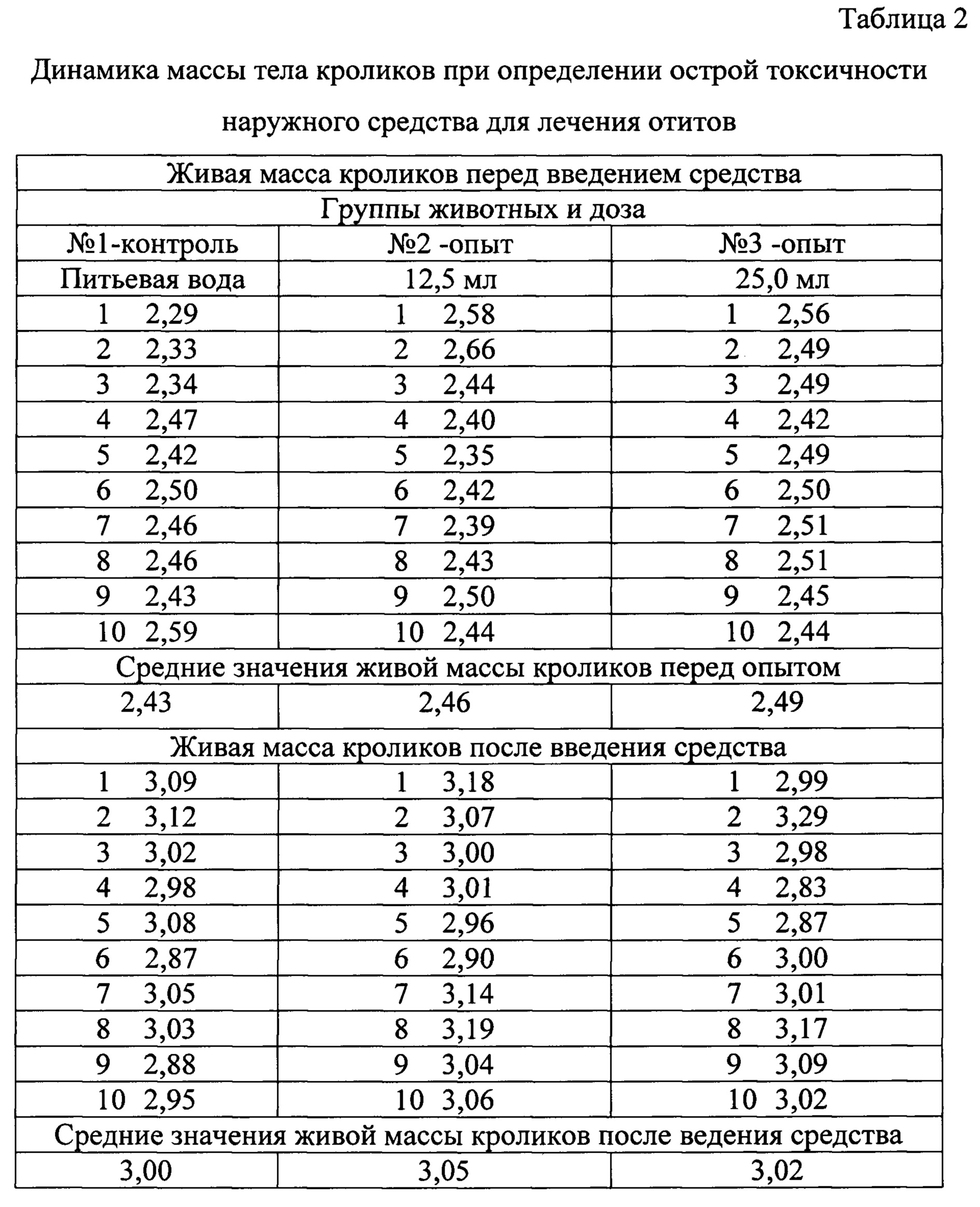
В результате проведения опыта показатели у кроликов в контрольной и опытных группах достоверных различий не имели (таблицы 1-2). Признаки интоксикации у животных не обнаружены.
На основании результатов проведенных исследований, установили, что средство относится к 4-му классу опасности, что соответствует ЛД50/более 5000 мг/кг. Введенные дозы средства в 50 и 100 раз превышающие рекомендуемые, не вызвали гибель животных.
Для дальнейших исследований были подобраны группы мышей с живой массой 50 г: 4 группы по 10 голов в каждой (№1-2-контрольная, №3-4-опытные группы) (таблица 3).
Животные во всех группах были клинически здоровы.
Животным вводили готовое средство из расчета 5 г/кг, что для животных массой 50 г г составило 0,25 мл.
Средство опытным мышам вводили через зонд внутрижелудочно в количестве 0,25 мл однократно.
Мыши в контрольной группе аналогичным образом получали только воду в том же количестве.
Длительность наблюдения за животными составила 10 суток.
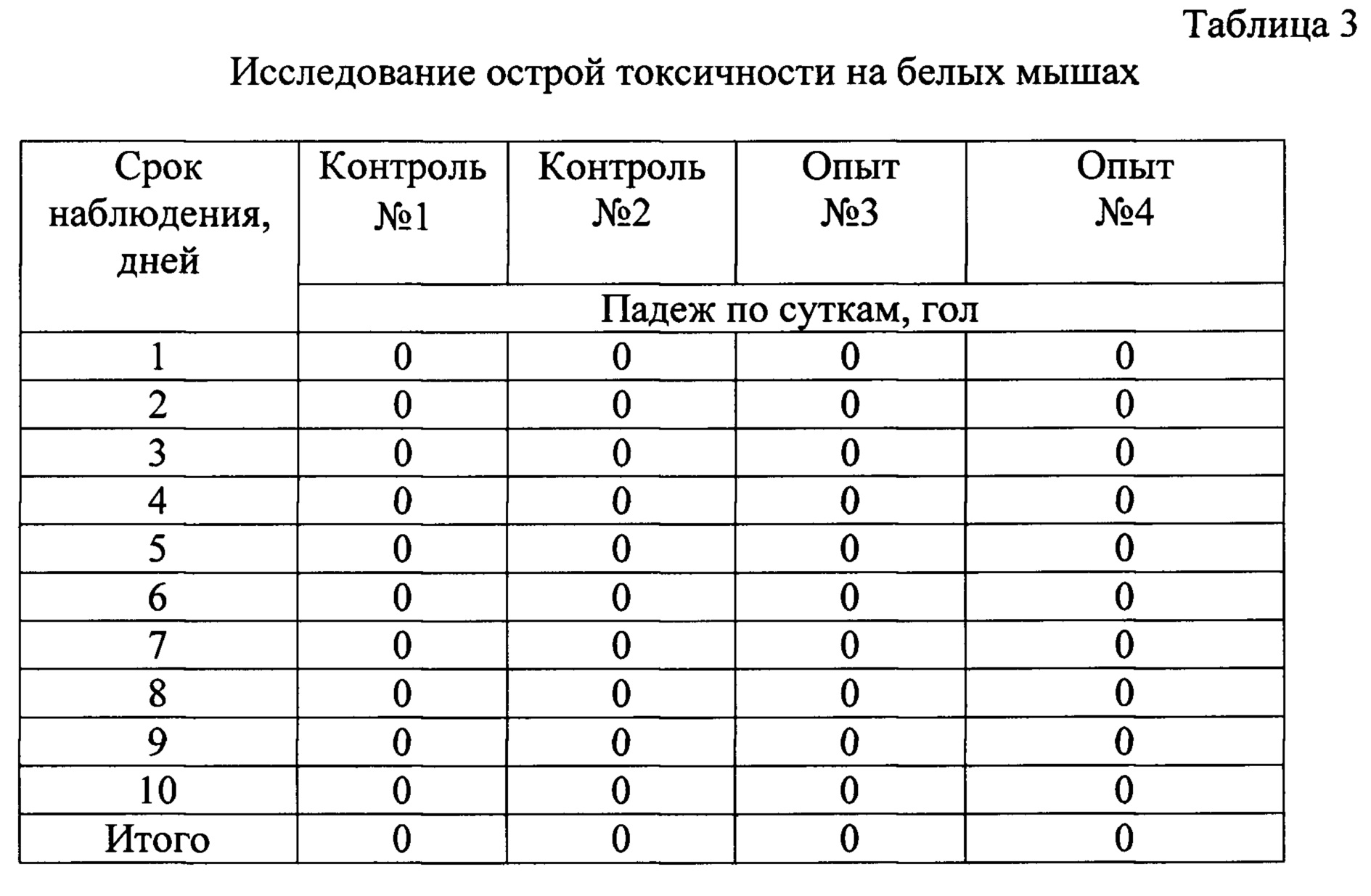
В результате проведения опыта мыши из контрольных и опытных групп остались живы. Признаки токсикоза у мышей в опытных группах не наблюдались.
На основании проведенных исследований на кроликах и мышах было установлено, что внутрижелудочное однократное введение средства не влияло на рост животных, что видно из данных о приросте живой массы в контрольных и опытных группах. Клинических признаков интоксикации (температура, внешний вид, поведенческие реакции) не выявлено.
Для моделирования кожно-резорбтивного поступления средства животным применялись низкие дозы перорально. Лабораторным животным ежедневно на 100 мл питьевой воды включали средство в разных дозах:
- исследование на аутбредных белых мышах (группы: №1 - контрольная-20 голов, №2 - опытная-20 голов) - 2,5 мл;
- исследование на морских свинках (группы: №1 - контрольная-10 голов, №2- опытная-10 голов)- 25 мл;
- исследование на кроликах (группы: №1 - контрольная-10 голов, №2- опытная-10 голов)- 50 мл;
- исследование на белых крысах (группы: №1 - контрольная-10 голов, №2-опытная-10 голов)- 25 мл.
Длительность наблюдения за животными составила 20 суток.
При проведении экспериментальных исследований проводили контроль показателей приростов массы тела, показателей гематологических, иммунологических и биохимических исследований крови; учитывали результаты химических исследований органов и патологоанатомических исследований, вес внутренних органов.
Гомеостаз организма в значительной степени зависит от функционального состояния печени. При проведении патологоанатомических исследований были отобраны пробы печени, так как печень участвует в процессах детоксикации организма.
Провели химические исследования печени белых мышей после применения средства (Таблица 4).
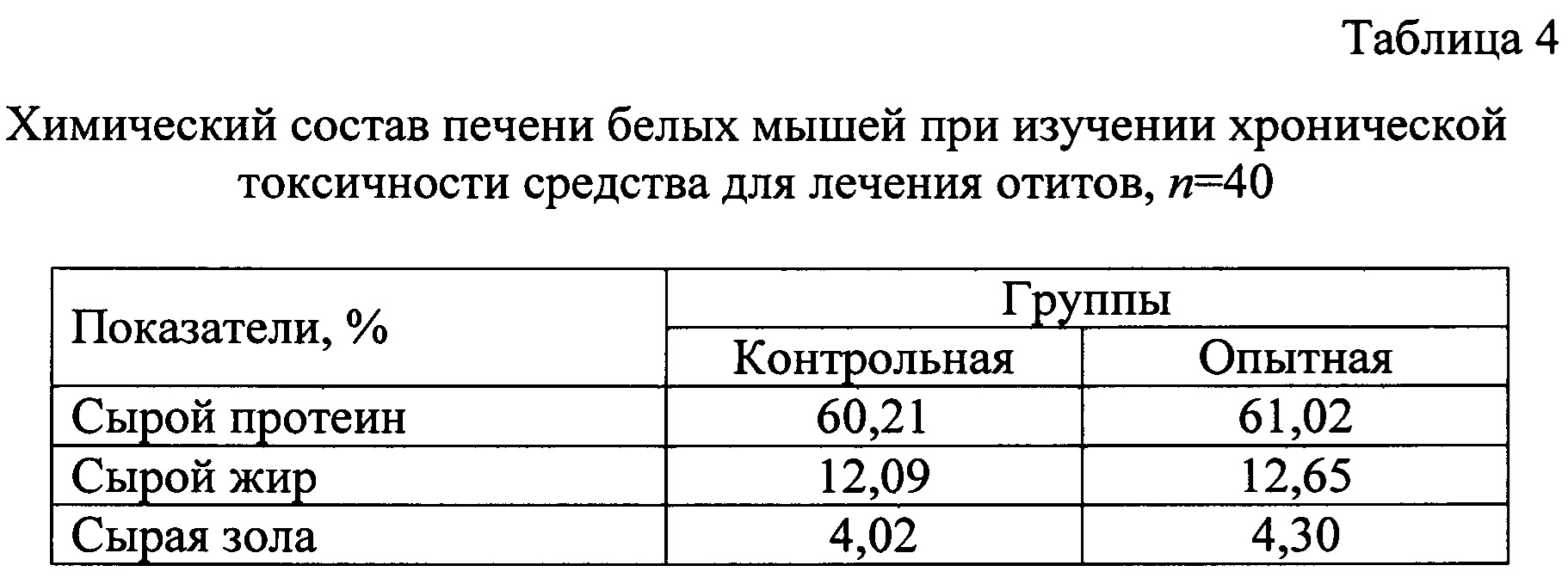
Анализируя показатели химического состава печени, достоверные различия не выявили, что может свидетельствовать о нейтральном воздействии на гепатобилиарную систему.
Аминокислоты принимают участие во всех важных процессах организма, в том числе, детоксикационных. Количественное содержание аминокислот, их соотношения являются одними из показателей уровня интенсивности детоксикационных возможностей организма. В связи с этим провели исследования проб печени на содержание аргинина, цистеина, метионина, треонина, лизина (Таблица 5).
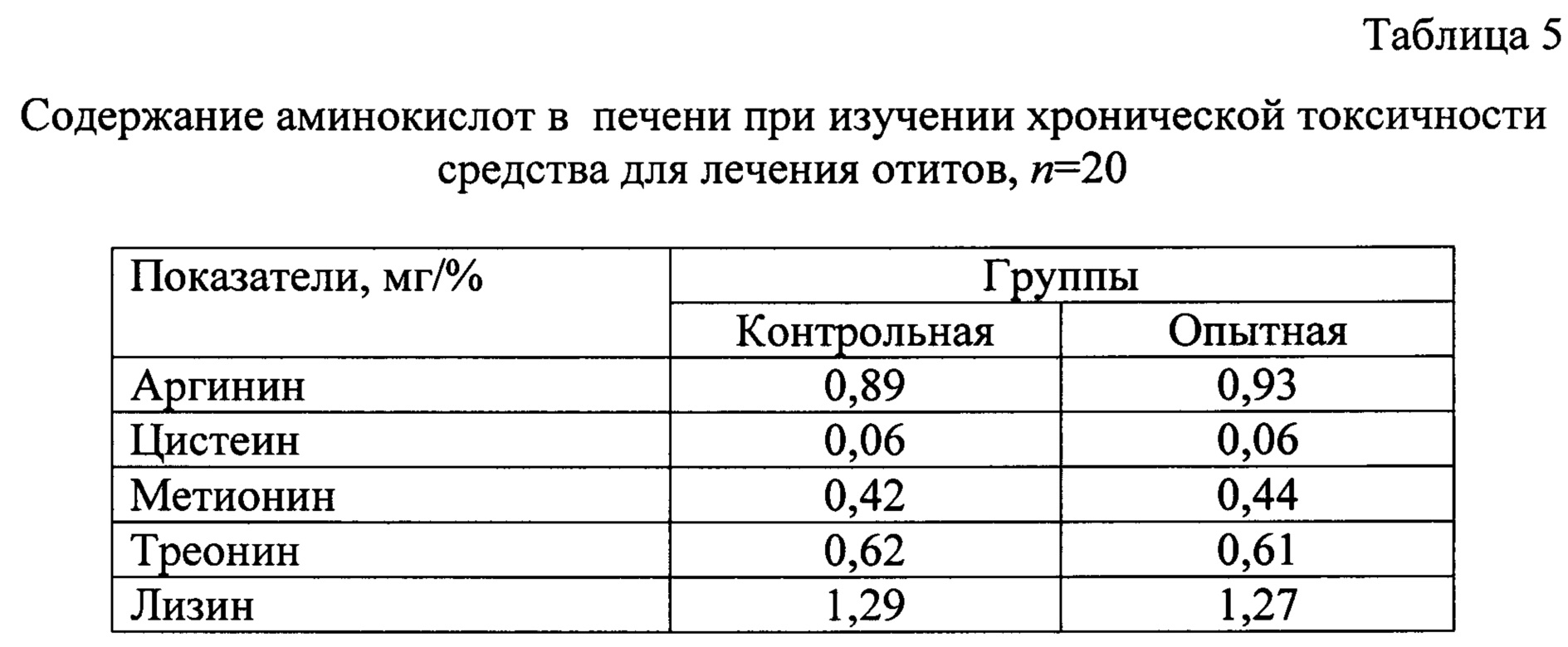
На основании результатов исследований аминокислотного состава печени животных достоверные различия результатов не обнаружены. В связи с этим можно констатировать, что использование средства для лечения отитов, не вызывает нарушений в белково-синтетической функции печени.
Для оценки уровня воздействия различных факторов на организм животных применяют исследования состояния гомеостаза, так как сложные нейроэндокринные, иммунные и метаболические нарушения, характеризующие ответные реакции организма, находят определенное отражение в морфологическом, иммунологическом, биохимическом составах крови (Таблицы 6, 7).
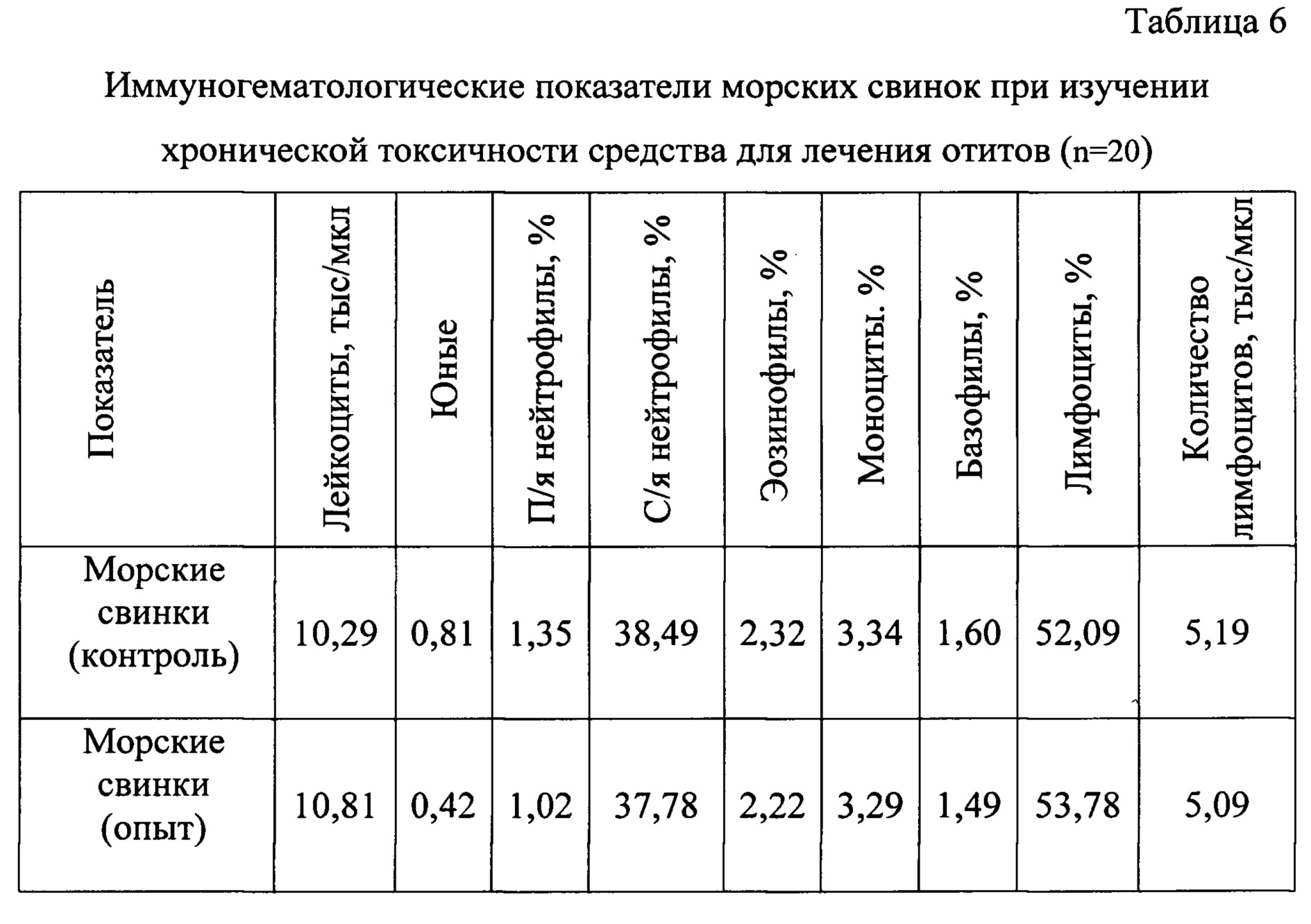
На основании результатов иммуногематологических исследований установили, что применение предложенного средства в течение 20 дней не оказывало негативного влияния на популяцию лейкоцитов у животных.
Для оценки метаболического профиля опытных животных были проведены биохимические исследования сыворотки крови (Таблица 7).
Одним из общепринятых методов диагностики патологических состояний, включающих интоксикацию организма, являются исследования показателей белкового обмена. При анализе содержания общего белка было установлено, что у животных в опытной и контрольной группах данные показатели были на одинаковом уровне.
Креатинин является важным показателем в лабораторном исследовании, который отвечает за отклонения в работе почек, является итоговым продуктом белкового обмена в организме, в связи с этим его определение необходимо для установления патологий в мочевыделительной системе. У животных в опытной и контрольной группах данные показатели были на одинаковом уровне.
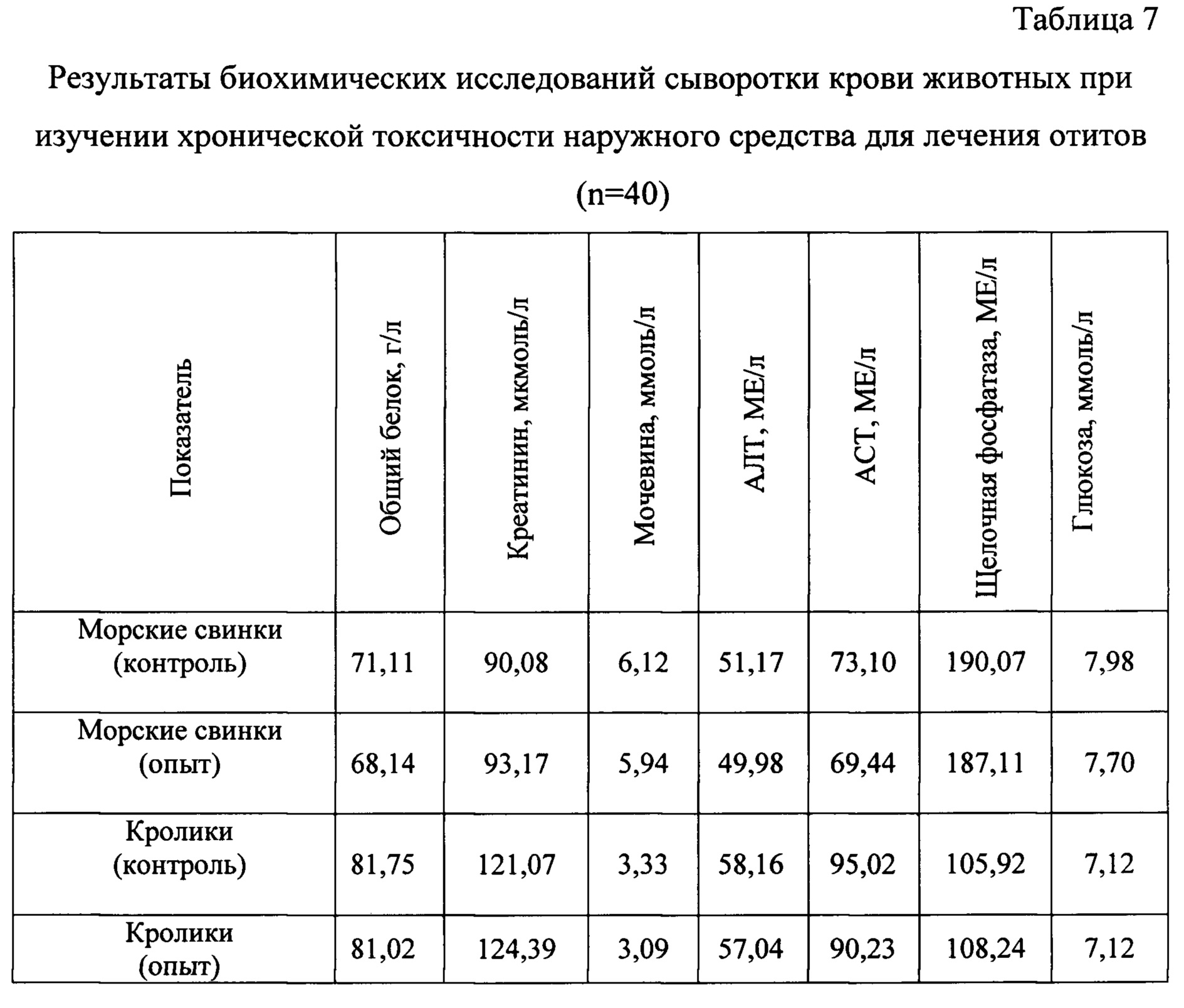
Мочевина, являясь продуктом обезвреживания эндогенного и экзогенного аммиака, может свидетельствовать об интенсивности обменных процессов, а также являться показателем состояния детоксикационной функции печени. У животных уровень мочевины находился на одном уровне.
Как уже отмечали выше, гомеостаз организма в значительной степени зависит от функционального состояния печени. Показатели аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT) являются одними из тестов ее функциональной активности, а также одними из тестов токсической нагрузки организма. Увеличение данных показателей может указывать на выраженное повреждение эпителия желчных протоков при элиминации с желчью различных токсичных веществ. У опытных животных эти показатели во всех группах достоверно не отличались.
Определение уровня активности щелочной фосфатазы в сыворотке крови используют в клинической диагностике для выявления патологий гепатобилиарной системы и костной ткани. Активность щелочной фосфатазы повышается при повреждении гепатоцитов. Повышение активности щелочной фосфатазы происходит не только в условиях активного роста костной ткани, но и при ее разрушении - остеопорозе и последующей остеомаляции. У опытных животных эти показатели во всех группах достоверно не отличались.
Известно, что количественные значения глюкозы в крови в течение суток непостоянны, зависят от мышечной активности, интервалов между кормлениями, гормональной регуляции. При ряде патологических состояний нарушается регуляция уровня глюкозы в крови, что приводит к гипо - или гипергликемии. Измерение содержания глюкозы в крови является основным лабораторным тестом для диагностики нарушений углеводного обмена. Изменение количества глюкозы может быть физиологическим (физиологическая гипергликемия) под влиянием умеренной физической нагрузки, стресса. Нормальное функционирование индивидуальных клеток, органов и организма в целом поддерживается гомеостатическими механизмами, которые обеспечивают потребности тканей в глюкозе. У животных данный показатель находился в пределах нормы.
Анализируя показатели биохимических исследований сыворотки крови, у животных было установлено, что использование данного средства не оказывало действий, которые бы приводили к дестабилизации метаболической функции организма животных.
С целью оценки влияния средства для лечения отитов провели исследования по изучению хронической токсичности на крысах.
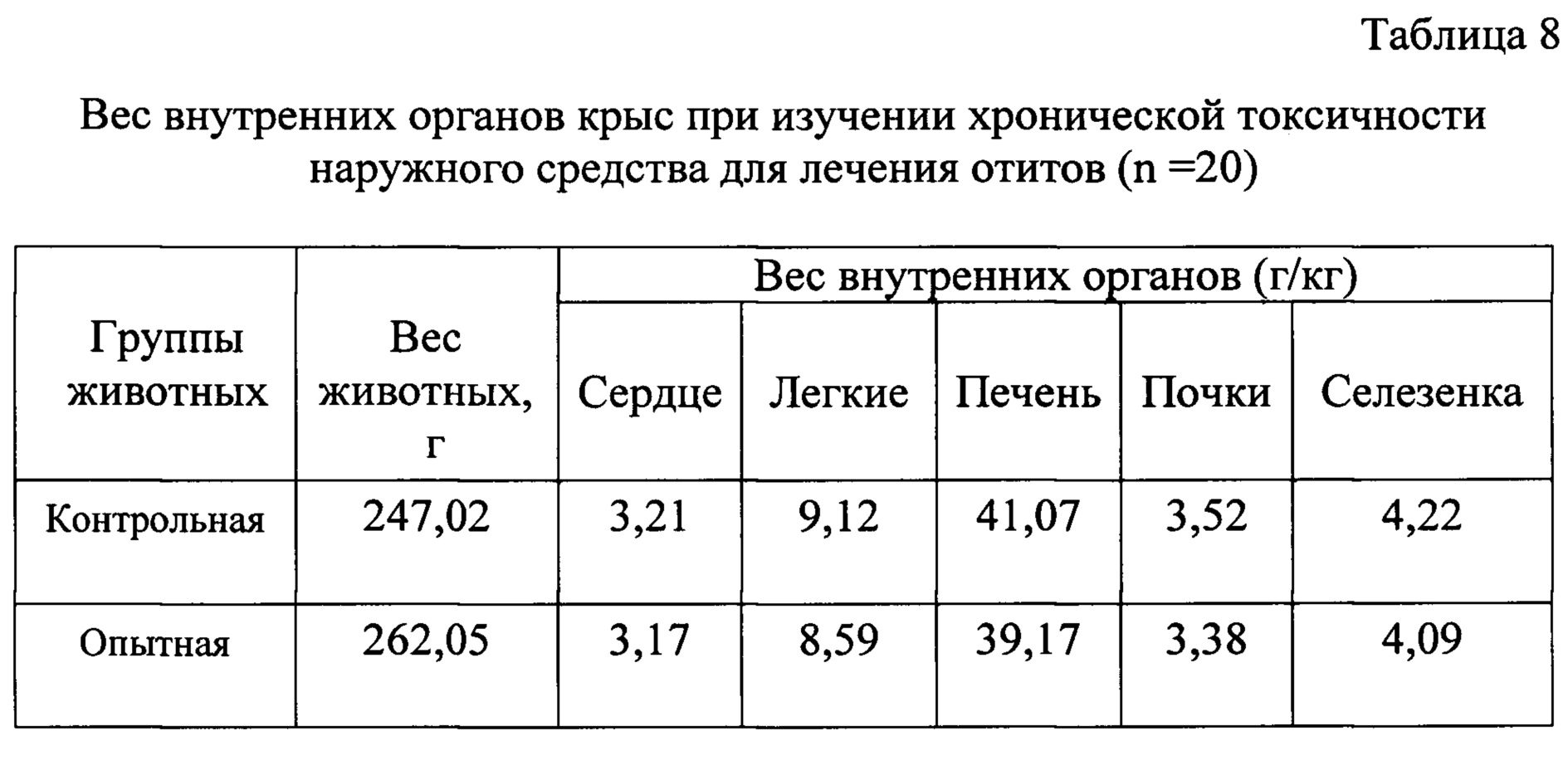
Анализируя результаты патологоанатомических исследований опытных и контрольных животных, достоверные различия не выявлены.
Изучение раздражающего действия препарата проводили на 20 белых кроликах-самцах массой 2,4-2,6 кг, у которых выбривали наиболее чувствительные участки кожи в области живота и затем втирали препарат в течение 3 суток. Реакцию учитывали по наличию покраснения, появления кожной складки.
Установили, что признаков воспалительного и раздражающего действия кожного покрова при нанесении средства для лечения отитов не отмечено.
Проведение практических исследований. С целью определения терапевтической эффективности разработанного средства для лечения отитов были проведены производственные исследования на 10 собаках (граждан-владельцев) с признаками отита, а также 18 собаках центра реабилитации животных.
Через 10 дней после начала применения средства у животных отмечали, что экссудация, зуд и воспаление прекратились. Процесс заживления кожного покрова в наружном слуховом проходе протекал эффективно.
Для оценки наличия микробной флоры были проведены микробиологические исследования. У всех животных был выделен золотистый стафилококк (Staphylococcus aureus). При проведении повторного посева содержимого из наружного слухового прохода установлено, что на 10 сутки после использования препарата бактерии из группы стафилококков не выявлялись. Таким образом, применение средства в предложенном составе приводит к клиническому выздоровлению при бактериальном отите животных.
Новизна средства от аналогов состоит в расширении ассортимента средств для лечения отитов при низкой стоимости и использовании отечественных компонентов, в том числе, местного производства. Область применения - ветеринарная медицина. Курс применения 2-3 раза в сутки в течение 7-10 дней. Средство хорошо зарекомендовало себя при лечении отитов у собак. Предложенное средство способно конкурировать с отечественными и импортными аналогами при лечении отитов у мелких животных, показывая неочевидный эффект комплексного лечения у мелких животных.
Средство для лечения отитов у мелких животных путем применения капель ушных (раствора для аурикулярного применения), которое в качестве действующих веществ содержит в масс. %: йодоформ - 8%, гентамицина сульфат - 1%, димексид - 50%, масло зародышей пшеницы - до 100%, при курсе применения 2-3 раза в сутки в течение 7-10 дней.
