Результат интеллектуальной деятельности: Тест-система для выявления РНК возбудителя вируса артериита у лошадей
Вид РИД
Изобретение
Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики вирусных и инфекционных заболеваний у животных, в частности к методам выявления ДНК возбудителя вируса артериита у лошадей.
Вирусный артериит лошадей (Arteriitis viralis equorum, Equine viral arteritis) - контагиозное заболевание, характеризующееся некрозами стенки кровеносных сосудов, катаральным воспалением органов дыхания и пищеварения у жеребят, абортами у кобыл и нарушением воспроизводительной функции у жеребцов.
Известно, что диагноз на вирусный артериит устанавливают на основании эпизоотологических, клинических данных и, в случае гибели животных, патоморфологических исследований. Лабораторные методы диагностики включают выделение вируса в культуре клеток, ретроспективные серологические исследования. Для выделения вируса используют культуры клеток лошади, перевиваемых линии ВНК-21, Веро и др. Идентификацию вируса проводят в реакции нейтрализации со специфической сывороткой. Альтернативными (вспомогательными) методами лабораторных исследований являются РСК, ИФА. Полимеразная цепная реакция для диагностики вирусного артериита лошадей, находится на стадии изучения. http://www.liveanimal.ru/loshadi/veterinariya/zaraznye-zabolevaniya/infektsionnye-zabolevaniya/virusnyj-arteriit-loshadej
Известна тест-система для обнаружения РНК вируса инфекционной болезни, путем проведения полимеразной цепной реакции в реальном времени с использованием специфичных для участка генома возбудителя инфекции олигонуклеотидных праймеров, флуоресцентно-меченного зонда и контрольных образцов (патент РФ №2515916, кл. C12N 15/11, 2014).
Также известна тест-система для обнаружения генома возбудителя инфекции с помощью мультиплексной полимеразной цепной реакции с детекцией в режиме реального времени, включающий буфер для проведения полимеразной цепной реакции, смесь для ее проведения состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов специфичные для коронавируса, смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE и обратной транскриптазы MMLV REVERSE TRANSCRIPTASE; буфер для разведения РНК в виде деионизованной воды, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец, (патент РФ №2506317, C12Q 1/68, 2014 г. - прототип).
Общим недостатком известных технических решений является отсутствие возможности диагностики ДНК возбудителя вируса артериита у лошадей.
Техническим результатом является расширение функциональных возможностей и получение достоверной диагностики с помощью ОТ - ПЦР в реальном времени.
Технический результат достигается тем, что в тест-системе для выявления РНК возбудителя вируса артериита у лошадей, включающем буфер для проведения полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени, смесь для ее проведения состоящая из дезоксинуклеозидтрифосфатов, праймеров и флуоресцентных зондов специфичные для возбудителя вируса инфекции и для внутреннего контрольного образца; смесь ферментов из ДНК полимеразы с антителами, ингибирующих активность фермента, TAQ POLYMERASE; буфер для разведения РНК, внутренний контрольный образец, отрицательный контрольный образец, положительный контрольный образец, согласно изобретению для выделения РНК используют биологический материал, взятый от инфицированных возбудителем вируса артериита (Equine viral arteritis- EAV) лошадей, при этом для внутреннего контрольного образца используют суспензию бактериофага MS2 с концентрацией 5×103 копиий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца - смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома вируса артериита (Equine viral arteritis-EAV) у лошадей и фрагмент генома бактериофага MS2, взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики вируса артериита лошадей используют тест-систему для проведения двух последовательных реакций: обратной транскрипции вирусной РНК для получения кДНК и полимеразной цепной реакции для амплификации фрагмента полученной кДНК матрицы. Обе реакции проводятся последовательно в одной ПЦР-пробирке (one-tube) с использованием специфичных для участка генома артериита олигонуклеотидных праймеров, флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага MS2: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ОТ-ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации и возможность ошибки при переносе кДНК в другую пробирку для ПНР. Кроме того, детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый тест-система рекомендован использовать в ветеринарной вирусологии, а именно к средствам диагностики возбудителя вируса артериита лошадей, что соответствует критерию «промышленная применимость».
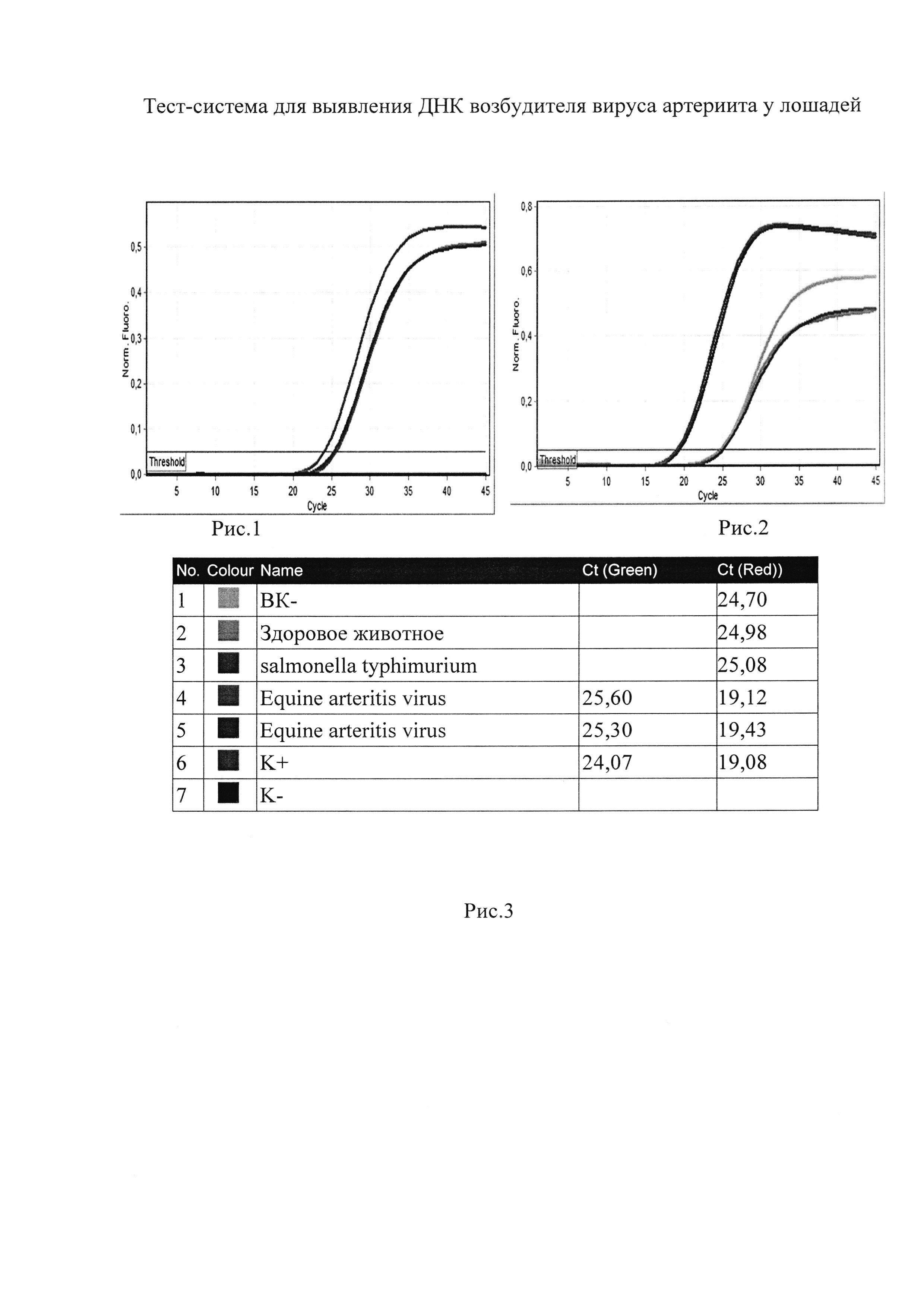
Сущность изобретения поясняется чертежом, где представлены скриншоты графиков и таблицы, на рис. 1 - представлен канал FAM /Green - для тестирования наличия ДНК возбудителя вируса артериита у лошадей; на рис. 2 представлен канал Cy5/Red - для тестирования сигнала внутреннего контрольного образца (ВКО), на рис. 3 - таблица количественных данных для Cycling A.Green (Equine arteritis virus) и A.Red (ВКО).
Пример конкретного использования тест-системы для выявления РНК возбудителя вируса артериита у лошадей
Для исследования с целью выделения РНК используют биологический материал животных по выбору: в виде выделений из носа, глаз, фекалий, крови, спермы и фрагментов внутренних органов и тканей взятые от лошадей инфицированных возбудителем вируса артериита (Equine arteritis virus). Для внутреннего контрольного образца используют суспензию бактериофага MS2 с концентрацией 5×103 копий нуклеотилных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя вируса артериита лошадей (Equine arteritis virus) и фрагмент генома бактериофага MS2 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
Затем измеряют накопление флуоресцентного сигнала по каналам: FAM/Green для специфического сигнала; Cy5/Red для сигнала внутреннего контроля и интерпретируют результаты на основании наличия/отсутствия пересечения кривой флуоресценции с пороговой линией (Threshold). Если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Использование для разных видов контроля различные формы материала бактериофага MS2: суспензии и фрагмента генома со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения РНК из образцов.
Выбор последовательности и расчет первичной структуры олигонуклеотидных праймеров и зондов.
Вирус артериита входит в семейство Arteriviridae, род Arierivirus. Вирионы размером около 60 нм, сферической формы. Тип симметрии кубический, некоторые из них имеют хвостоподобные выступы. Состоят из нуклеокапсида и липидсодержащей суперкапсидной оболочки клеточного происхождения, на поверхности которой имеются выступы длиной 12-15 нм. Геном представлен 10 фрагментами 2-нитевой РНК, Белковый капсид его состоит из 7 структурных белков (36-120 кД).
Праймеры высокоспецифичны к коротким консервативным участкам гена ORF5 (Equine arteritis virus strain SER-1 large envelope protein (ORF5) gene, partial cds, код доступа KX645659.1, участок между 70 и 390) и не комплементарны каким-либо участкам геномов других вирусов. Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации был подобран олигонуклеотидный флуоресцентно-меченный зонд EAVP (комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров EAVF и EAVR). Зонд был помечен красителем FAM. Для гашения самопроизвольной флуоресценции на 3'-конце олигонуклеотидного зонда прикреплен гаситель BHQ-1 Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
С помощью программы «Oligo 6.0» проанализирована нуклеотидная последовательность бактериофага MS2 (Enterobacteria phage MS2 isolate ST4, complete genome. ACCESSION EF204940). Бактериофаг MS2 содержит однонитевую позитивно ориентрованную РНК размером 3569 оснований. В результате анализа внутри гена белка ‘созревания’ (maturation protein) выбран участок между 200 и 350 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд MS2P, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров MS2F и MS2R. Используя программу «Oligo 6.0» описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
Для исследования используют следующий материал:
- Соскобы со слизистых конъюнктивы глаз и ротоглотки берут сухими ватными зондами;
- Фекалии весом 5 г отбирают в стерильный пластиковый контейнер;
- Сперму, отбирают в пластиковую микропробирку объемом 1,5 мл
- Для получения сыворотки забирают кровь в пробирку без антикоагулянта;
- Фрагменты внутренних органов и ткани (трахея, легкие, селезенка, мозг, воздухоносные мешки, кишечник, лимфоузлы) помещают в стерильный контейнер.
Соскобы со слизистых конъюнктивы и ротоглотки в физиологическом растворе исследуют без предварительной подготовки.
Сперму разводят физиологическим раствором 1:3, тщательно перемешивают на вортексе. Для экстракции РНК используют аликвоту 0,1 мл суспензии.
Для получения сыворотки пробирки с кровью (без антикоагулянта) отстаивают при комнатной температуре в течение 30 минут до полного образования сгустка. Затем центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 10 минут при комнатной температуре. Сыворотку переносят отдельными наконечниками с фильтром в стерильные пробирки объемом 1,5 мл.
Из тканей и органов вырезают небольшие кусочки до 1 г весом. Растирают пробы в отдельных фарфоровых ступках или гомогенизируют на автоматических гомогенизаторах. Затем готовят 10% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 9000 об./мин на центрифуге «MiniSpin», Eppendorf, в течение 1 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции РНК.
Из фекалий (1-5 г) готовят 10% суспензию на стерильном физиологическом растворе. Взвесь фекалий декантируют в течении 5-10 минут. Отбирают 1 мл надосадочной жидкости и переносят в чистую пробирку 1,5 мл, центрифугируют при 5000 об./мин на центрифуге «MiniSpin», Eppendorf, в течение 5 мин. Экстракцию РНК из осветленного экстракта фекалий проводят по возможности, сразу. При необходимости хранения замораживают.
Анализ проводят с помощью набора реагентов «ПЦР-АРТЕРИИТ-ФАКТОР» методом ОТ-ПЦР РВ:
Набор состоит из комплекта реагентов для проведения мультиплексной ОТ-ПЦР РВ (Комплект №1) и контрольных образцов (Комплект №2).
Набор выпускается в двух вариантах:
1) Для анализа 55 образцов (включая контрольные образцы)
2) Для анализа 110 образцов (включая контрольные образцы).
Состав набора приведен в Таблицах 1 и 2.
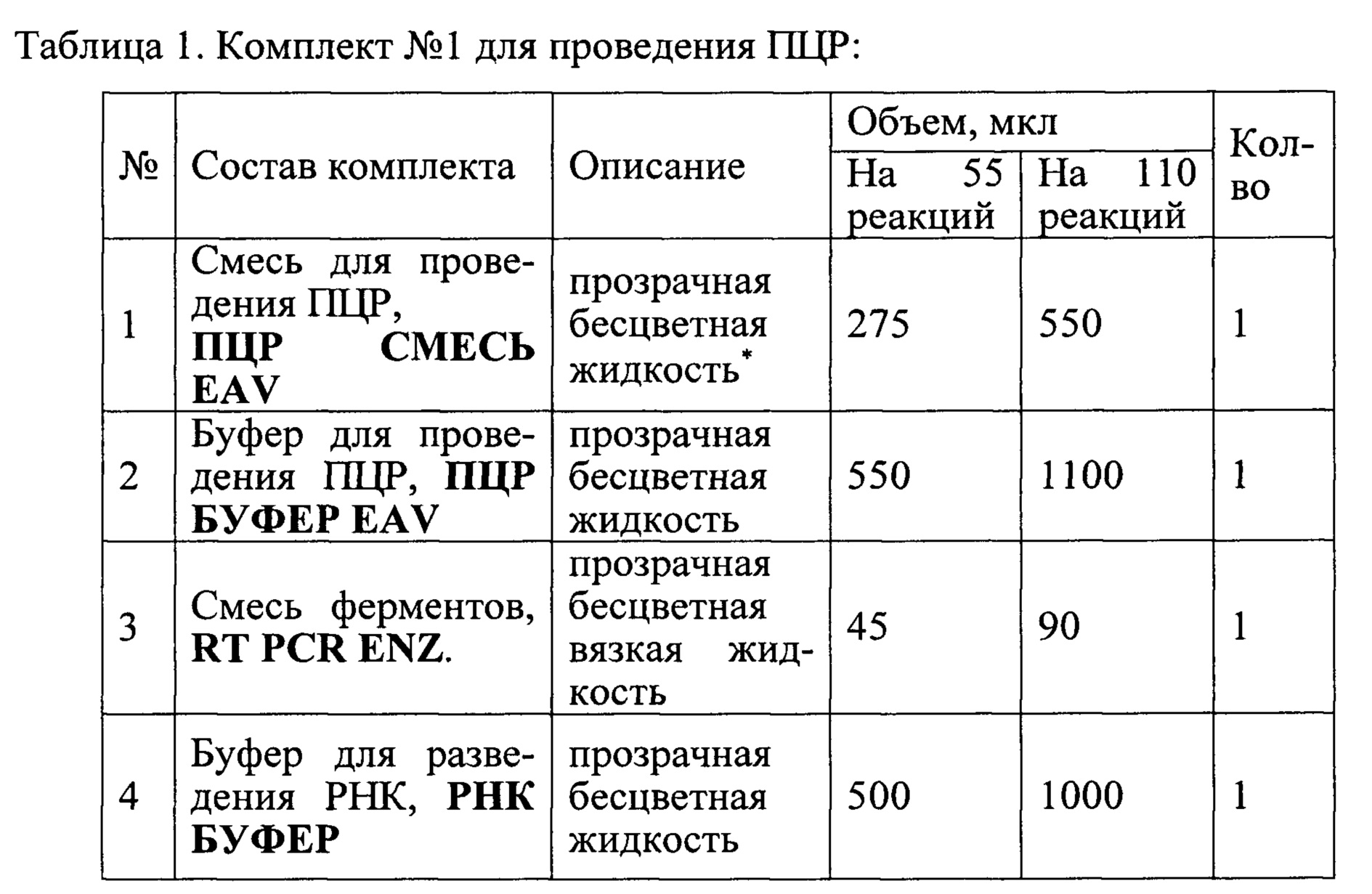
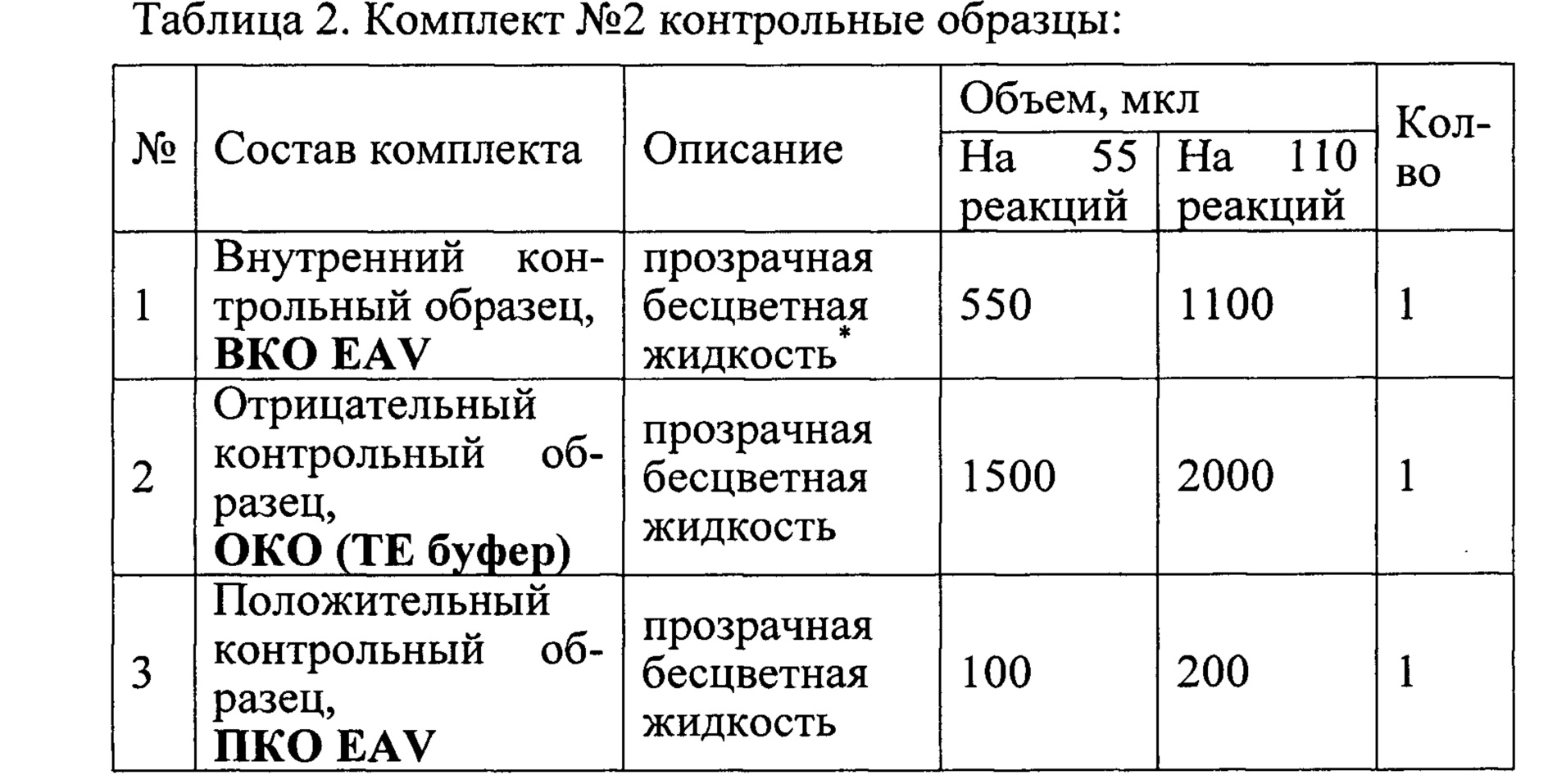
Наборы используют в соответствии с инструкцией по применению набора реагентов «ПЦР-АРТЕРИИТ-ФАКТОР» для выявления РНК вируса артериита лошадей (Equine arteritis virus) в биологическом материале от животных методом совмещенной реакции обратной транскрипции и полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени (ОТ ПЦР РВ), ТУ 21.10.60-126-51062356-2017 (для диагностики in vitro)
*Возможна легкая опалесценция
http://www.vetfaktor.ru/.
В набор не входят реактивы для экстракции НК. Выделение РНК может проводиться, например, с помощью наборов на основе сорбционного метода, в состав которых входит силика или микроцентрифужные колонки, наборов на основе фенол-хлороформной экстракции и т.п. Рекомендуется использовать набор «ДНК/РНК-С-ФАКТОР» либо аналогичный.
Анализ состоит из трех этапов:
- экстракция НК (на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»);
- проведение реакции ОТ-ПЦР РВ;
- учет результатов анализа.
Экстракцию (выделение) нуклеиновых кислот (НК) из исследуемых проб проводят следующим образом.
Отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки, включая пробирку для отрицательного контрольного образца (ОКО), по 10 мкл внутреннего контрольного образца (ВКО EAV) в качестве которого используют суспензию бактериофага MS2 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, если концентрация копий нуклеотидных последовательностей отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов. Для положительного контрольного образца (ПКО EAV) используют смесь рекомбинантных плазмидных ДНК, содержащих фрагмент генома возбудителя вируса артериита лошадей (Equine arteritis virus) и фрагмент генома бактериофага MS2 взятых в соотношении 1:1, со следующими нуклеотидными последовательностями: 

Выделяют НК из анализируемых и контрольных образцов согласно инструкции производителя набора для выделения НК.
Для подготовка образцов к проведению ПЦР Общий объем реакционной смеси - 25 мкл, объем РНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием компонентов из комплектов 1 и 2 набора ПКО EAV, ВКО EAV и РНК Буфер.
В отдельной пробирке смешать компоненты набора из расчета на каждую реакцию: 10 мкл ПЦР БУФЕР EAV 5 мкл ПЦР СМЕСЬ EAV 0,75 мкл RT PCR ENZ
Перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием. Отбирают необходимое количество пробирок для амплификации НК исследуемых и контрольных проб и вносят в них по 15 мкл приготовленной реакционной смеси.
Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл РНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл НК соответствующей пробы;
в) в пробирку с положительным контролем ПЦР (К+) вносят 10 мкл ПКО EAV.
Помещают подготовленные для проведения ПЦР пробирки в ячейки амплификатора, программируют прибор согласно инструкции производителя и осуществляют интерпретацию результатов анализа
Далее проводят ПЦР РВ с флуоресцентной детекцией с помощью прибора - амплификатора типа «Rotor-Gene Q» при следующих режимах представленных в таблице 3.

Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в соответствии с инструкцией производителя к прибору. Учет результатов ОТ-ПЦР РВ проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции НК в соответствии с таблицей 4.

Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции ВК- на канале Fam/Green и для отрицательного контроля этапа ПЦР К- на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Образцы, для которых по каналу Cy5/Red значение Ct отсутствует или превышает 35 цикл (при этом по каналу Fam/Green отсутствует значение Ct) требуют повторного проведения исследования (рис. 2, 3). Задержка в значениях пороговых циклов для исследуемых образцов на канале Cy5/Red указывает на присутствие ингибиторов в пробе(ах) или на ошибки при постановке реакции ОТ-ПЦР РВ. Требуется провести исследование, начиная с этапа экстракции НК.
Образец считается положительным, РНК вируса артериита лошадей присутствует, если наблюдается экспоненциальный рост сигнала на канале Fam/Green, при этом значения Ct контрольных образцов находятся в пределах нормы (см. Табл. 3, рис. 1, 3). Если для исследуемого образца по каналу Fam/Green значение Ct определяется позднее 37 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (Ct на канале Fam/Green более 37), требуется повторное взятие материала от того же животного для проведения ПЦР-исследования и (или) использование альтернативных методов диагностики.