Результат интеллектуальной деятельности: Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида
Вид РИД
Изобретение
Изобретение относится к химии органических гетероциклических соединений, а именно - к способу получения четвертичной аммониевой соли 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида формулы (I), проявляющей антибактериальные, противогрибковые, противовирусные и антипротозойные свойства. Соединение может найти применение в медицине и ветеринарии.
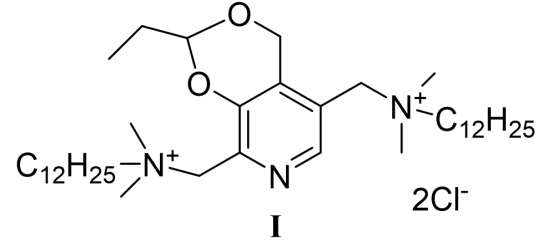
Четвертичные аммониевые соединения являются одним из важнейших классов антисептических средств и уже более 100 лет применяются в лечебной практике. Современные четвертичные аммониевые соединения характеризуются широким спектром противомикробной активности по отношению к грамположительным и грамотрицательным микроорганизмам, грибам, вирусам и простейшим [McDonnell G., Russell A.D. Antiseptics and Disinfectants: Activity, Action, and Resistance. Clinical Microbiology Reviews. - 1999 – V. 12(1). - P. 147-179].
Четвертичное аммониевое соединение на основе природного соединения витамина В6 - 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорид, впервые описано в изобретении по патенту [Антисептическое лекарственное средство. Патент РФ №2641309 от 17.01.2018, дата приоритета от 24.07.2017 / Ю.Г. Штырлин, Н.В. Штырлин, С.В. Сапожников, А.Г. Иксанова, Р.Р. Казакова, М.Н. Агафонова, А.Д. Стрельник]. Представленный в данном изобретении 7-стадийный способ получения (схема 1) включает первоначальное взаимодействие пиридоксина гидрохлорида 1 с пропионовым альдегидом с образованием шестичленного ацеталя 2. Далее осуществляется ацилирование гидроксиметильной группы в соединении 2 под действием хлористого ацетила. Полученный ацетат 3 под действием м-хлорпербензойной кислоты переводится в N-оксид 4, который далее перегруппировывается в среде уксусного ангидрида в диацетоксипроизводное 5. Последующее снятие ацетатных групп в щелочной среде приводит к получению диола 6, хлорированием которого под действием хлористого тионила получают дихлорпроизводное 7. На последней стадии взаимодействием дихлорида 7 с двукратным мольным избытком N,N-диметилдодециламина получают целевой продукт I.
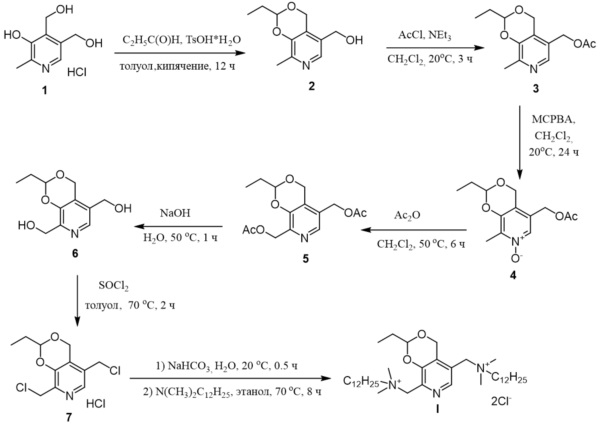
Схема 1
Задача, на решение которой направлено заявленное техническое решение, заключается в разработке нового, более простого и малоотходного способа синтеза I без использования уксусного ангидрида, который входит в список прекурсоров, в отношении которых в РФ вводятся особые меры контроля, обеспечивающего высокие выходы целевого продукта при сохранении его чистоты не менее 99 %.
Существенными недостатками известного способа получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида I по сравнению с заявленным техническим решением являются:
- высокая трудоемкость, вызванная большим количеством стадий необходимых для получения целевого продукта, а именно 7 стадий против 4 в заявленном техническом решении;
- низкий общий выход продукта (13 %) в сравнении с 22 % в заявленном техническом решении;
- необходимость использования уксусного ангидрида, который входит в список прекурсоров, в отношении которых в РФ вводятся особые меры контроля;
- значительное количество отходов. Так, при получении соединения I описанным способом, на 1 кг получаемого продукта образуется около 600 кг отходов в сравнении с 120 кг в заявленном техническом решении, что не маловажно для решения экологических проблем.
Техническим результатом заявленного технического решения является способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино [4,5-c]пиридиний дихлорида I с выходом не менее 22 % при сохранении чистоты не менее 99 %, при одновременном снижении трудоемкости и количества отходов, что не является очевидным для специалиста в данной области техники.
Технический результат достигается заявляемым способом получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида I, включающем следующие действия над материальными объектами с использованием материальных средств (схема 2):
- пиридоксин гидрохлорид, п-толуолсульфокислоту и пропионовый альдегид с молярным соотношением реагентов 1 : 1.07 : 1.42 кипятят в толуоле 6 часов с выделением 5-(гидроксиметил)-2-этил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина формулы 2;
- соединение 2 хлорируют хлористым тионилом с молярным соотношением реагентов 1 : 1.9 в толуоле при 50°C в течение 4 часов с выделением 5-(хлорметил)-2-этил-8-метил-4H-[1,3]диоксино[4,5-c]пиридиний хлорида 8;
- раствор соединения 8 в хлористом метилене нейтрализуют водным раствором гидрокарбоната натрия с молярным соотношением реагентов 1 : 1, с дальнейшим отделением органической части и ее взаимодействием при кипячении в хлороформе с трихлоризоциануровой кислотой с молярным соотношением реагентов 1 : 1.05, с последующим фильтрованием осадка и обработкой фильтрата хлороводородом с выделением 5,8-бис(хлорметил)-2-этил-4H-[1,3]диоксино[4,5-c]пиридин гидрохлорида 7;
- соединение 7 нейтрализуют водным раствором гидрокарбоната натрия с молярным соотношением реагентов 1 : 1.1, выделенный осадок нагревают в ацетоне при 55°C с N,N–диметилдодециламином с молярным соотношением реагентов 1 : 2, отфильтровывают и перекристаллизовывают из смеси этилацетат : этанол.
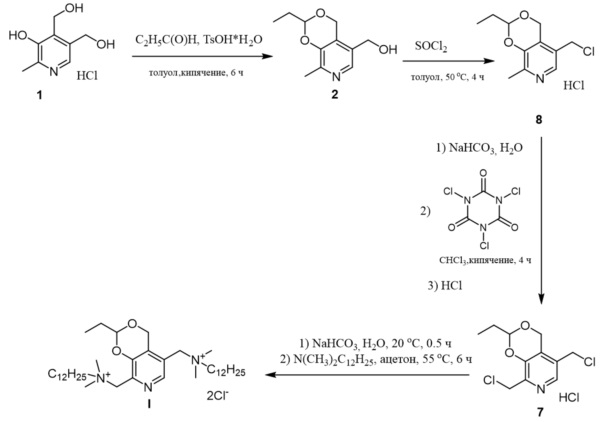
Схема 2
Заявленное техническое решение иллюстрируется Фиг.1, Фиг.2.
На Фиг.1 приведена хроматограмма соединения I;
На Фиг.2 приведено содержание основного вещества и примесей соединения I.
Заявленное техническое решение иллюстрируется примером конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1Н и 13С ЯМР-спектроскопии. Спектры ЯМР регистрировали на приборе AVANCE-400 (Bruker, Германия). Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13С). Температуры плавления определялись с помощью прибора Stanford Research Systems MPA-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates. HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, AB Sciex (Германия) из раствора в метаноле методом ионизации – турбоионный спрей (TIS) – при энергии столкновения с молекулами азота 10 еВ.
Пример реализации способа получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида (I)
Стадия 1: Получение 5-(гидроксиметил)-2-этил-8-метил--4H-[1,3]диоксино[4,5-c]пиридина (2)
Через загрузочный люк в 15 л стеклянный реактор загружают 0.805 кг (4.18 моль) моногидрата п-толуолсульфокислоты и 10 л толуола. Реакционную смесь нагревают до кипения и выдерживают в течение 4 часов до прекращения накопления воды в насадке Дина-Старка.
Далее в реактор добавляют 0.805 кг (3.92 моль) пиридоксин гидрохлорида 1, нагревают реакционную смесь до кипения и выдерживают в течение 2 часов до прекращения выделения хлористого водорода.
Реакционную смесь охлаждают до комнатной температуры и добавляют 0.400 л (5.57 моль) пропионового альдегида. Реакционную смесь нагревают до кипения и выдерживают в течение 6 часов для завершения реакции образования шестичленного ацеталя.
Далее растворитель упаривают досуха на роторном испарителе при пониженном давлении в 50-100 мбар и температуре 40±1°С в течение 2 ч. Полученный остаток растворяют в 4 л дихлорметана и добавляют раствор 0.210 кг (5.25 моль) гидроксида натрия в 4 л воды. Включают интенсивное перемешивание и выдерживают 1 час при 25±1°C. После этого перемешивание отключают и оставляют раствор до четкого разделения на две фазы. Органический слой сливают через нижний клапан в круглодонную колбу и упаривают досуха на роторном испарителе при пониженном давлении в 1-3 мбар и температуре 60±1°С в течение 1.5 ч.
К осадку добавляют 2 л толуола и нагревают при 90±2°C до полного растворения осадка. После растворения остатка колбу снимают с роторного испарителя и оставляют на 1 день при температуре 5±1°С для выпадения осадка.
Массу из колбы переносят на нутч-фильтр, где отфильтровывают от маточного раствора. После фильтрации осадок промывают 0.25 л толуола и высушивают на роторном испарителе при пониженном давлении в 1-3 мбар и температуре 80±1°С в течение 1.5 ч.
Выход 0.449 кг (55%), светло-желтое кристаллическое вещество, т.пл. 110-111°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.00 т (3H, 3JH-H = 7.5 Гц, СH3CH2), 1.77-1.83 кв д (2H, 3JH-H = 7.5 Гц, 3JH-H = 5.0 Гц, СH3CH2), 2.30 c (3H, CH3), 4.38 д (2H, 3JH-H = 4.3 Гц, CH2OH), 4.95 c (2H, CH2O), 5.06 т (1H, 3JH-H = 5.0 Гц, CHC2H5), 5.18 т (1H, 3JH-H = 4.3 Гц, CH2OH), 7.93 с (1H, CHпир).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 7.78 c (СH3CH2), 18.16 с (CH3), 27.06 c (СH3CH2), 58.21 с (CH2O), 63.43 с (CH2O), 100.02 с (CHC2H5), 126.88 c (Cпир), 130.94 c (Cпир), 138.95 c (CHпир), 145.09 c (Cпир), 146.91 c (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 210.1125, C11H16NO3. Вычислено [М+H]+ 210.1130.
Стадия 2: Получение 5-(хлорметил)-2-этил-8-метил-4H-[1,3]диоксино[4,5-c]пиридиний хлорида (8)
Через загрузочный люк в 15 л стеклянный реактор загружают 0.449 кг (2.14 моль) соединения 2 и 4 л толуола, после чего в реактор из мерника самотеком подается 0.300 л (4.13 моль) хлористого тионила в течение 20 минут. Реакционную смесь перемешивают при 50±2°C в течение 4 часов.
Суспензию из реактора с помощью вакуума переносят на нутч-фильтр. После фильтрации осадок промывают 0.5 л толуола, переносят в колбу и высушивают на роторном испарителе при пониженном давлении в 1-3 мбар и температуре 80±1°С в течение 1.5 ч. Выход 0.536 кг (95%), белое кристаллическое вещество, т.пл. 144-149°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.09 т (3H, 3JHH = 7.5 Гц, СH3CH2), 1.94 кв д (2H, 3JHH = 7.5 Гц, 3JHH = 4.8 Hz, СH3CH2), 2.79 с (3H, CH3), 4.59 с (2Н, СН2), 5.15 с (1H, 3JHH = 4.8 Hz, СHC2H5), 5.17 с (2Н, СН2), 8.29 с (1H, CHPyr), 17.97 уш с (1H, NH).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 7.58 c (СH3CH2), 14.14 с (CH3), 27.25 с (СH3CH2), 38.57 с (CH2Cl), 63.92 с (СH2O), 102.61 с (СHC2H5), 130.98 с (CPyr), 131.49 с (CPyr), 136.38 с (CPyr), 144.14 с (CPyr), 150.63 с (CPyr).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 228.0768, C11H15NO2. Вычислено [М-Cl]+ 228.0768.
Стадия 3: Получение 5-(хлорметил)-2-этил-8-метил-4H-[1,3]диоксино[4,5-c]пиридина (7).
Через загрузочный люк в 15 л стеклянный реактор загружают 0.536 кг (2.03 моль) соединения 8 и 4 л хлористого метилена. После из емкости добавляют раствор 0.171 кг (2.03 моль) гидрокарбоната натрия в 4 л воды. Включают интенсивное перемешивание и выдерживают 1 час при 25±1°C.
Суспензию из реактора с помощью вакуума переносят на нутч-фильтр. После фильтрации осадок промывают 0.5 л хлористого метилена, переносят в колбу и высушивают на роторном испарителе при пониженном давлении в 50-100 мбар и температуре 40±1°С в течение 2 ч.
Полученный осадок переносят через загрузочный люк в 15 л стеклянный реактор, добавляют 0.487 кг (2.10 моль) трихлоризоциануровой кислоты и 3 л хлороформа, после чего реакционную смесь выдерживают в течение 4 часов при кипячении. Суспензию из реактора с помощью вакуума переносят на нутч-фильтр. После фильтрации осадок промывают 1 л хлороформа.
К фильтрату добавляют 8 л петролейного эфира и при перемешивании добавляют 0.365 кг (10 моль) хлороводорода в течение 20 минут. Выпавший осадок переносят на нутч-фильтр, промывают 1 л смеси петролейного эфира с хлороформом (2/1 по объему), переносят в колбу и высушивают на роторном испарителе при пониженном давлении в 1-3 мбар и температуре 80±1°С в течение 1.5 ч. Выход 0.382 кг (64%), белое кристаллическое вещество, т.пл. 100-110°С (разл).
Спектр ЯМР 1H (400 МГц, ДМСО-d6) Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 1.01 т (3H, 3JH-H = 7.5 Гц, СH3CH2), 1.80-1.88 м (2H, СH3CH2), 4.77 c (2H, CH2), 4.77, 4.87 AB-система (2H, 2JH-H = 11.6 Гц, CH2), 5.12, 5.20 AB-система (2H, 2JH-H = 16.4 Гц, CH2), 5.27 т (1H, 3JH-H = 4.8 Гц, CHC2H5), 8.32 с (1H, CHпир), 8.69 c (1H, N+H).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 7.23 c (СH3CH2), 26.86 c (СH3CH2), 39.77 с (CH2Cl) 63.36 с (CH2O), 101.07 с (CHC2H5), 131.14 c (Cпир), 132.32 c (CHпир), 138.87 c (Cпир), 142.64 c (Cпир), 148.33 c (Cпир).
Стадия 4: Получение 5,8-(Бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида (I).
Через загрузочный люк в 15 л стеклянный реактор вносят раствор 0.110 кг (1.31 моль) гидрокарбоната натрия в 4 л воды и при перемешивании добавляют 0.382 кг (1.28 моль) соединения 7. Включают интенсивное перемешивание и выдерживают 1 час при 25±1°C. Суспензию из реактора с помощью вакуума переносят на нутч-фильтр. После фильтрации осадок промывают 0.5 л воды, переносят в колбу и высушивают на роторном испарителе при пониженном давлении в 1-3 мбар и температуре 80±1°С в течение 1.5 ч.
Полученный осадок через загрузочный люк помещают в 15 л стеклянный реактор, добавляют 4 л ацетона и 0.69 л (2.56 моль) N,N–диметилдодециламина 9. Реакционную смесь перемешивают при 55±1°C в течение 6 часов, после чего охлаждают до 5±1°С и оставляют на 24 часа для выпадения осадка.
Суспензию из реактора с помощью вакуума переносят на нутч-фильтр. После фильтрации осадок промывают 0.5 л ацетона, переносят в колбу и высушивают на роторном испарителе при пониженном давлении. Сухой осадок переносят в емкость для перекристаллизации, куда самотеком подается 1.65 л этилацетата и 0.15 л этанола.
Реакционную смесь кипятят до растворения осадка, после чего охлаждают до 5±1°С и оставляют на 24 часа для выпадения осадка. Полученный осадок отфильтровывают от маточного раствора на нутч-фильтре и промывают 0.4 л смеси этилацетата с этанолом 10/1 по объему. Осадок переносят в колбу и высушивают на роторном испарителе при пониженном давлении в 1-3 мбар и температуре 80±1°С в течение 1.5 ч. Выход 0.572 кг (65%) соединения I, белое кристаллическое вещество, т.пл. 180-190°С (разл). Чистота не менее 99 % (ВЭЖХ).
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (6H, 3JHH = 6.7 Гц, 2CH3C11H22), 1.00 т (3H, 3JH-H = 7.5 Гц, СH3CH2), 1.22-1.33 м (32H, 16CH2), 1.70-1.84 м (6H, 3CH2), 2.96 м (2H, CH2), 3.29-3.32 м (12H, 4CH3N+), 3.50-3.83 м (4H, 2CH2N+), 4.69, 4.74 (AB-система, 2H, 2JHH = - 13.6 Гц, CH2), 5.10, 5.55 (AB-система, 2H, 2JHH = - 16.7 Гц, CH2), 5.11, 5.21 (AB-система, 2H, 2JHH = - 13.6 Гц, CH2), 8.60 с (1H, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 8.01 с (СH3), 14.21 с (СH3), 22.77 c (CH3), 23.18 c (CH2), 26.46 c (CH2), 27.57 c (CH2), 29.43 c (CH3), 29.46 c (CH2), 29.53 c (CH2), 29.62 c (CH2), 29.70 (c, CH2), 31.99 c (CH2), 49.60 c (CH3N+), 49.76 c (CH3N+), 51.11 c (CH3N+), 51.34 c (CH3N+), 61.94 c (CH2), c 62.26 (CH2), 65.60 c (CH2), 65.66 c (CH2N+), 66.34 c (CH2N+), 102.04 c (C(CH3)2), 122.92 c (Cпир), 134.60 c (Cпир), 136.87 c (Cпир), 146.54 c (Cпир), 150.88 c (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 308.7924. C39H75Cl2N3O2Сl2. Вычислено [М-2Cl]2+ 308.7924. Чистота 99.57 % (ВЭЖХ).
Определение чистоты соединения I проводили методом обращенно-фазовой ВЭЖХ, с использованием высокоэффективного жидкостного хроматографа Agilent 1220 (США), с УФ-детектром на колонке Zorbax RX-SIL (размер 250×4,6 мм, 5 мкм). Температура термостата колонки – 40°С, скорость потока 1.6 мл/мин, объем вводимой пробы 2.5 мкл. УФ-детектирование осуществляли при аналитической длине волны 295 нм. Подвижная фаза: смесь ацетонитрил - буферный раствор 0.1 М аммоний ацетат (84:16, об. %). Буферный раствор состоит из 7.7 г аммония ацетата в 1000 мл воды после фильтрования через фильтр 0.22 мкм (0.1 М раствор аммония ацетата).
Хроматограмма образца соединения I приведена на Фиг. 1, содержание основного вещества и примесей соединения I приведено на Фиг. 2.
Таким образом, заявителем достигнут заявленный технический результат - разработан способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино [4,5-c]пиридиний дихлорида I, проявляющего антибактериальные, антимикотические, противовирусные и антипротозойные свойства, с выходом не менее 22% при сохранении чистоты не менее 99 %, при одновременном снижении трудоемкости и количества отходов, что не является очевидным для специалиста в данной области техники.
Заявляемый способ получения по сравнению с прототипом позволяет:
- получить 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорид в четыре стадии вместо семи;
- увеличить выход целевого продукта до 22 % при сохранении его чистоты не менее 99%;
- избежать использования уксусного ангидрида, который входит в список прекурсоров, в отношении которых в РФ вводятся особые меры контроля;
- в пять раз уменьшить количество отходов (при производстве 1 кг получаемого продукта образуется 120 кг отходов вместо 600 кг), что делает его более экологически безопасным.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», т.к. может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/3cbbd95ed19bfb00273bc73732359ac5.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/ea42424c09b2e3d36ff7c48157040148.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/dd53e5de379b2a70f3e1a1a903b739f4.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/08134fa4d4cef1d4219924613b767121.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/0195c31e3f8ac90a3ef228ef290afb79.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/a310f05062c2edd965032b84270a04da.png)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/b6588b0710adde1be411b8fb768a0271.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/d3be89e86a607ede03fac86cdac782f4.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/9c0d302b37b53adcb8c58d7bb760cc2a.jpg)
![Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида](https://fips.edrid.ru/images/rid/93/c6/ee/babd3c654a15ddf6d51302aa8fbd7cdb.jpg)

