Результат интеллектуальной деятельности: Вариабельные домены лёгкой и тяжёлой цепи мышиного моноклонального антитела против интерферона альфа (IFN-α) человека, антигенсвязывающий фрагмент (Fab) против IFN-α человека, содержащий указанные домены
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к антителам, в частности к вариабельным доменам легкой и тяжелой цепи мышиного моноклонального антитела, связывающегося с интерфероном альфа (IFN-α) человека и нейтрализующего его, и антигенсвязывающему фрагменту (Fab) против интерферона альфа (IFN-α) человека, содержащему указанные домены.
Предшествующий уровень техники
Интерфероны I типа (IFN) (IFN-α, IFN-β, IFN-ω, IFN-τ) представляют собой семейство структурно связанных цитокинов, обладающих противовирусными, противоопухолевыми и иммуномодулирующими эффектами (Hardy и др., Blood, 2001, 97:473; Cutrone и Langer, J. Biol Chem., 2001, 276:17140). Локус IFNα человека включает в себя два подсемейства. Первое подсемейство состоит по меньшей мере из 14 неаллельных генов и 4 псевдогенов, имеющих гомологию не менее 75%. Второе подсемейство, все омега (ω), содержит 5 псевдогенов и 1 функциональный ген, который имеет гомологию 70% с генами IFNα. Подтипы IFNα имеют разную специфическую активность, но они обладают одним и тем же биологическим спектром (Streuli и др., Proc. Natl. Acad. Sci. USA, 1981, 78:2848), и имеют тот же клеточный рецептор (Agnet M. и др., в «Интерферон», т. 5, Ред. И. Грессер, 1983, стр. 1-22, Academic Press, Лондон).
Все интерфероны человеческого типа I связываются с рецептором на поверхности клеток (IFN-альфа-рецептор, IFNAR), состоящим из двух трансмембранных белков, IFNAR-1 и IFNAR-2 (Uze и др., Cell, 1990, 60: 225; Novick и др. Cell, 1994, 77: 391; Pestka и др. Annu Rev. Biochem., 1987, 56: 727; Mogensen и др. J. Interzeron Cytokine Res., 1999, 19: 1069). IFNAR-1 имеет важное значение для высокоаффинного связывания и дифференциальной специфичности комплекса IFNAR (Cutrone, 2001, см. выше). Хотя функциональные различия для каждого из подтипов IFN типа I не были идентифицированы, считается, что каждый из них может вступать в различные взаимодействия с компонентами рецептора IFNAR, что приводит к потенциально разнообразным сигнальным результатам (Cook и др., J. Biol. Chem., 1996, 271: 13448). В частности, исследования с использованием мутантных форм IFNAR1 и IFNAR2 позволили предполжить, что альфа- и бета-интерфероны по-разному передают сигналы через рецептор, взаимодействуя по-разному с соответствующими цепями (Lewerenz и др., J. Mol. Biol., 1998, 282: 585).
Ранние функциональные исследования IFN типа I были сосредоточены на врожденной защите от вирусных инфекций (Haller и др., J. Exp. Med., 1981, 154:199; Lindenmann и др. Methods Enzymol., 1981, 78:181). Однако в более поздних исследованиях выяснилось, что IFN типа I являются мощными иммунорегуляторными цитокинами в адаптивном иммунном ответе. В частности, было показано, что IFN типа I облегчают дифференциацию наивных Т-клеток по пути Thl (Brinkmann и др., J. Exp. Med., 1993, 178:1655), усиливают продукцию антител (Finkelman и др., J. Exp., Med., 1991, 174:1179) и поддерживают функциональную активность и выживание Т-клеток памяти (Santini и др., J. Exp. Med., 2000, 191:1777; Tough и др., Science, 1996, 272: 194-1).
Результаты недавних работ ряда групп позволяют предположить, что IFN-α может усиливать созревание или активацию дендритных клеток (DCs) (Santini и др, 2000, см. выше; Luft и др. J. Immunol., 1998, 161:1947; Luft и др., Int. Immunol., 2002, 14:367; Radvanyi и др., Scand. J. Immunol., 1999, 50:499; Paquette и др., J. Leukoc. Biol., 1998, 64:358). Кроме того, повышенная экспрессия интерферонов типа I была описана в многочисленных аутоиммунных заболеваниях (Foulis и др., Lancet, 1987, 2:1423, Hooks и др., Arthritis Rheum, 1982, 25:396; Hertzog и др., Clin. Immunol. Immunopathol., 1988, 48:192; Hopkins и Meager, Exp. Immunol., 1988, 73:88; Arvin и Miller, Arthritis Rheum., 1984, 27:582). Наиболее изученными примерами этих заболеваний являются инсулин-зависимый сахарный диабет (IDDM) (Foulis, 1987, см. выше), системная красная волчанка (SLE) (Hooks, 1982, см. выше; Blanco и др. Science, 2001, 294:1540; Ytterberg и Schnitzer, Arthritis Rheum, 1982, 25:401, Batteux и др., Eur. Cytokine Netw., 1999, 10(4): 509) и аутоиммунный тиреоидит (Prummel и Laurberg, Thyroid, 2003, 13:547; Mazziotti и др., J. Endocrinol, 2002, 25:624; You и др., Chin. Med. J., 1999, 112:61; Koh и др., Thyroid, 1997, 7:891), при этом все из них связаны с повышенными уровнями IFN α, а также ревматоидный артрит (RA) (Hertzog, 1988; Hopkins и Meager, 1988, Arvin и Miller, 1984, см. выше), в котором IFN-β может играть более значительную роль.
Кроме того, сообщалось, что введение интерферона α усугубляет основное заболевание у пациентов с псориазом, аутоиммунным тиреоидитом и рассеянным склерозом и вызывает синдром системной красной волчанки у пациентов без предшествующей истории аутоиммунного заболевания. Было показано, что интерферон α также индуцирует гломерулонефрит у нормальных мышей и ускоряет начало спонтанного аутоиммунного заболевания мышей NZB/W. Кроме того, в некоторых случаях терапия с использованием IFN-α приводила к нежелательным побочным эффектам, включая лихорадку и неврологические расстройства. Следовательно, существуют патологические ситуации, в которых ингибирование активности IFN-α может быть полезным для пациента, и существует потребность в агентах, эффективных для ингибирования активности IFN-α.
Известны моноклональные антитела против IFN-α человека, описанные в патенте США № US 4423147, в заявках РСТ, опубликованных как WO 8403105, WO 02066649, WO 2006086586. Однако существует насущная необходимость в получении новых антител против IFN-α человека с улучшенными характеристиками.
Краткое описание изобретения
Целью настоящего изобретения является получение мышиных антител, связывающихся с интерфероном альфа (IFN-α) человека и нейтрализующих его, определение последовательностей вариабельных доменов тяжелых (VH) и легких (VL) цепей указанных антител и получение антигенсвязывающих фрагментов (Fab) мышиного антитела, связывающихся с IFN-α человека и нейтрализующих его.
Указанная цель была достигнута путем выделения двух мышиных антител, Ifna С4 и Ifna С6, обладающих способностью к ингибированию активности IFN-α человека, и определения последовательности их вариабельных участков.
Настоящее изобретение представляет собой вариабельный участок тяжелой цепи (VH) антитела Ifna С4, содержащий последовательность аминокислот SEQ ID NO: 1, вариабельный участок легкой цепи (VL) указанного антитела, содержащий последовательность аминокислот SEQ ID NO: 2, а также антигенсвязывающий фрагмент (Fab), содержащий указанные вариабельные участки.
Также настоящее изобретение представляет собой вариабельный участок тяжелой цепи (VH) антитела Ifna С6, содержащий последовательность аминокислот SEQ ID NO: 3, вариабельный участок легкой цепи (VL) указанного антитела, содержащий последовательность аминокислот SEQ ID NO: 4, а также антигенсвязывающий фрагмент (Fab), содержащий указанные вариабельные участки.
Также настоящее изобретение представляет собой антигенсвязывающий фрагмент (Fab), содержащий указанные вариабельные участки антитела Ifna С4 или указанные вариабельные участки антитела Ifna С6.
Краткое описание рисунков
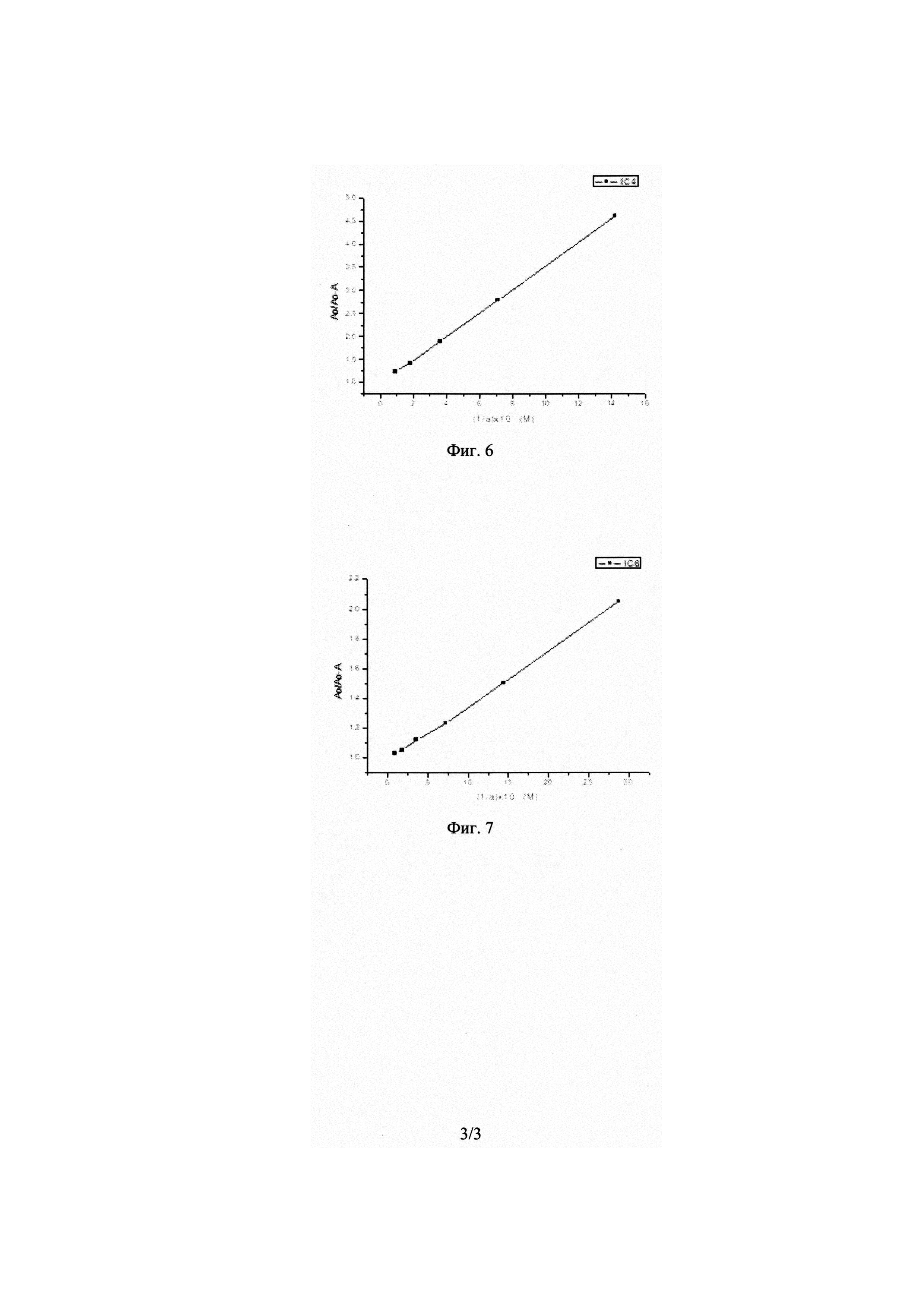
На Фиг. 1 показаны результаты иммуноферментного анализа блота, полученного после электрофореза IFN-α 2b в невосстанавливающих условиях. Дорожка 1 - МоАт αB3, дорожка 2 - МоАт αB5, дорожка 3 - МоАт αD3, дорожка 4 - МоАт αE3, дорожка 5 - МоАт αE5, дорожка 6 - МоАт αG1, дорожка 7 - МоАт IfnaC4, дорожка 8 - МоАт IfnaC6, дорожка 9 - МоАт IfnaE8, дорожка 10 - МоАт IfnaG1, дорожка 11 - МоАт IfnaH9, дорожка 12 - неспецифическое антитело (отрицательный контроль), дорожка 13 - контроль без антител, дорожка 14 - маркеры, кДа.
На Фиг. 2 показаны результаты иммуноферментного анализа блота, полученного после электрофореза IFN-α 2b в восстанавливающих условиях. Дорожка 1 - МоАт αB3, дорожка 2 - МоАт αB5, дорожка 3 - МоАт αD3, дорожка 4 - МоАт αE3, дорожка 5 - МоАт αE5, дорожка 6 - МоАт αG1, дорожка 7 - МоАт IfnaC4, дорожка 8 - МоАт IfnaC6, дорожка 9 - МоАт IfnaE8, дорожка 10 - МоАт IfnaG1, дорожка 11 - МоАт IfnaH9, дорожка 12 - неспецифическое антитело (отрицательный контроль), дорожка 13 - контроль без антител, дорожка 14 - маркеры, кДа.
На Фиг. 3 показан калибровочный график для определения концентрации IFN-α 2b.
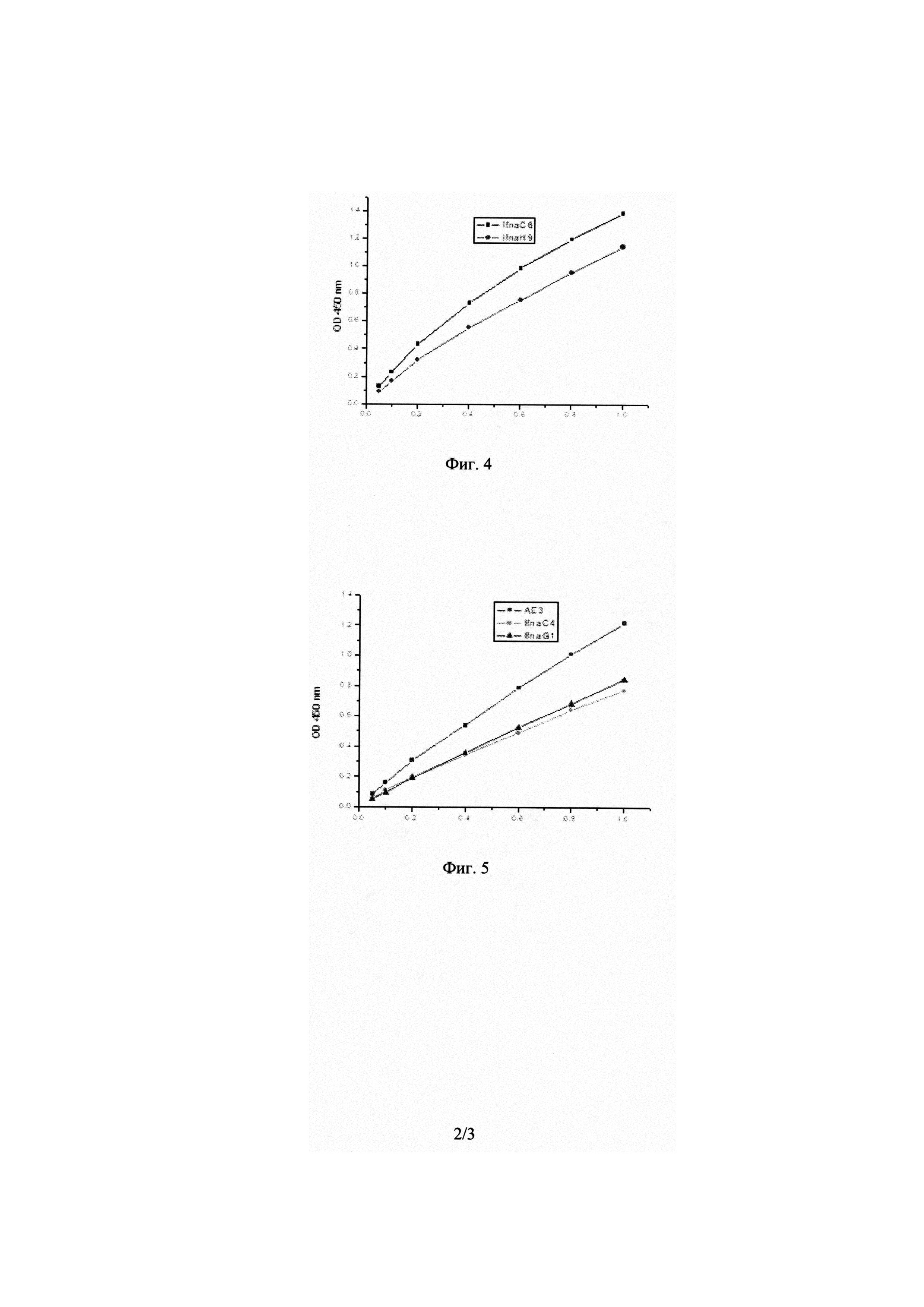
На Фиг. 4 показаны калибровочные кривые связывания моноклональных антител IfnaC6, IfnaH9 с сорбированным IFN-α 2b в непрямом ИФА. На оси Х приведен коэффициент разведения антител.
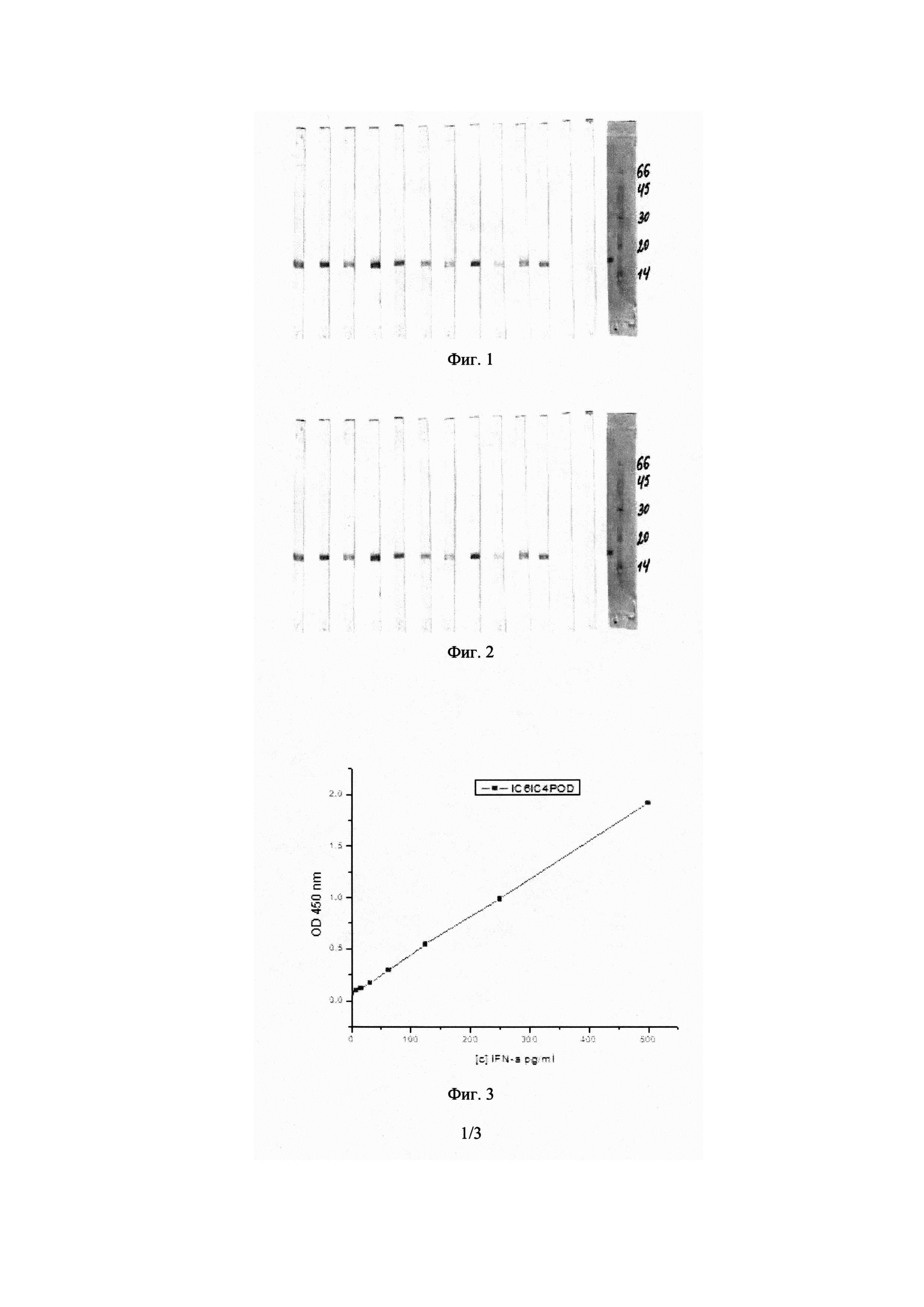
На Фиг. 5 показаны калибровочные кривые связывания моноклональных антител αE3, IfnaC4, IfnaG1 с сорбированным IFN-α 2b в непрямом ИФА. На оси Х приведен коэффициент разведения антител.
На Фиг. 6 показана кривая Клотца связывания IFN-α 2b и антитела IfnaC4.
На Фиг. 7 показана кривая Клотца связывания IFN-α 2b и антитела IfnaC5.
Подробное описание настоящего изобретения
Антитела обычно состоят из двух тяжелых цепей, связанных между собой дисульфидными связями, и легких цепей, ассоциированных с N-концом каждой из тяжелых цепей. Каждая тяжелая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Каждая легкая цепь также содержит на N-конце вариабельный домен с константным доменом. Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий фрагмент (Fab). Вариабельные домены легкой и тяжелой цепей обладают похожей общей структурой, и каждый домен включает каркас из четырех участков, последовательности которых являются относительно консервативными, связанных посредством трех участков, определяющих комплементарность (complementarity determining regions, CDRs). Четыре каркасных участка формируют конформацию типа бета-складчатого слоя, а CDRs образуют петли, связывающие конструкцию из бета-складчатого слоя. Участки CDRs расположены в непосредственной близости друг от друга благодаря каркасным участкам и вносят вклад в образование антигенсвязывающего участка. Участки CDRs и каркасные участки антител могут быть определены путем ссылки на нумерационную систему Кабата (Kabat numbering system, Kabat et al., (1987) "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office) в сочетании in conjunction with x-ray crystallography, as set forth in WO 91/09967.
Для получения антитела, которое может связываться с каким-либо специфическим антигеном, обычно используют методику Kohler и Milstein (Kohler et al., (1976) Nature 256:495-497), получившую название  технологии. Суть метода сводится к получению культуры «бессмертных» гибридов
технологии. Суть метода сводится к получению культуры «бессмертных» гибридов  путем слияния плазматической клетки (В-лимфоцита, продуцирующего антитела) и опухолевой клетки (миеломы или плазмоцитомы). Полученная
путем слияния плазматической клетки (В-лимфоцита, продуцирующего антитела) и опухолевой клетки (миеломы или плазмоцитомы). Полученная  способна продуцировать моноклональные антитела (как В-клетка) и при этом бесконечно делится (как опухолевая клетка), что позволяет достаточно долгое время секретировать in vitro или in vivo антитело, специфическое для целевого антигена.
способна продуцировать моноклональные антитела (как В-клетка) и при этом бесконечно делится (как опухолевая клетка), что позволяет достаточно долгое время секретировать in vitro или in vivo антитело, специфическое для целевого антигена.
Слияние клеток происходит под действием полиэтиленгликоля, изолецитина или вируса Сендай. На следующем этапе необходимо отобрать неслившиеся с лимфоцитами миеломные клетки (неслившиеся лимфоциты убирать не нужно: через недолгое время они погибнут сами). В процессе такой селекции  клетки высаживают на среды, содержащие вещества, блокирующие синтез нуклеотидов миеломными клетками. Для этого выведены специальные мутантные миеломные клеточные линии, дефектные по некоторым ферментам, участвующим в синтезе нуклеотидов.
клетки высаживают на среды, содержащие вещества, блокирующие синтез нуклеотидов миеломными клетками. Для этого выведены специальные мутантные миеломные клеточные линии, дефектные по некоторым ферментам, участвующим в синтезе нуклеотидов.
Отбор  секретирующих нужные антитела, проводится путем проверки среды, в которой росли клетки, на предмет наличия в ней антител нужной специфичности.
секретирующих нужные антитела, проводится путем проверки среды, в которой росли клетки, на предмет наличия в ней антител нужной специфичности.
Таким образом отбирают клетки, секретирующие антитела стабильно и в достаточном количестве. Большой объем антител нарабатывают или in vitro, или путем введения гибридом в перитонеальную полость мышей для получения асцита (Свешников, П.Г. Введение в молекулярную иммунологию и гибридомную технологию / П.Г. Свешников, В.В. Малайцев, И.М. Богданова, О.Н. Солопова, изд. МГУ, М., 2006).
Получение материала, использующегося в качестве антигена, для инъекций животных включают в себя методики, хорошо известные из уровня техники, например, использование полноразмерного белка, использование пептида, выбранного из иммуногенных участков белка, модифицирование антигена такими способами как, например, связывание с динитрофенолом, связывание с арсаниловой кислотой, денатурация антигена, связывание антигена с белком-переносчиком, таким как, например, гемоцианин улитки, с пептидами, содержащими участки связывания с рецепторами Т-клеток класса II, с бусинами, а также любыми другими методами, известными из уровня техники. Смотри, например, Harlow и др. Antibodies, a Laboratory Manual, Cold Spring Harbor Labs Press, 1988.
В частности, антителами, обладающими способностью к связыванию с интерфероном альфа (IFN-α) человека и нейтрализации его, являются антитела, содержащие вариабельные домены тяжелой и легкой цепи согласно настоящему изобретению. Указанные вариабельные домены тяжелой цепи мышиного моноклонального антитела содержат аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 3, а вариабельные домены легкой цепи антитела (VL) содержат аминокислотную последовательность SEQ ID NO: 2 или SEQ ID NO: 4, необходимые для функционирования указанного антитела. Изолированный антигенсвязывающий фрагмент (Fab) согласно настоящему изобретению, селективно связывающийся с IFN-α человека и нейтрализующий его, включает в себя вариабельный домен тяжелой цепи (VH) с последовательностью аминокислот SEQ ID NO: 1 и вариабельный домен легкой цепи (VL) с последовательностью аминокислот SEQ ID NO: 2; или вариабельный домен тяжелой цепи (VH) с последовательностью аминокислот SEQ ID NO: 3 и вариабельный домен легкой цепи (VL) с последовательностью аминокислот SEQ ID NO: 4
В настоящем изобретении фраза "антитело или Fab, обладающие способностью к связыванию с интерфероном альфа (IFN-α) человека и нейтрализации его" означает молекулу, которая связывается с IFN-α человека, образует стабильный комплекс и ингибирует активность IFN-α человека. Стабильным комплексом является комплекс, в котором связывание между партнерами происходит на период времени, достаточный для того, чтобы произвести детектирование указанного комплекса с использованием описанных здесь методов. Термин “селективно связывается с IFN-α человека” означает способность указанной молекулы предпочтительно связываться с IFN-α человека в отличие от связывания с белками, не имеющими отношения к IFN-α человека, или связывания с небелковыми компонентами, присутствующими в образце. Антитело или Fab, которые предпочтительно связываются с IFN-α человека, являются антитело или Fab, которые связываются с IFN-α человека, но не связываются в существенной степени с другими молекулами или компонентами, которые могут присутствовать в образце. Такое существенное связывание предполагает, например, связывание антитела или Fab, связывающихся с IFN-α человека, с молекулой, не являющейся IFN-α человека, с аффинностью или силой достаточной для того, чтобы помешать способности антитела, связывающегося с IFN-α человека, определить уровень IFN-α человека в образце. Примерами таких молекул и компонентов, которые могут присутствовать в образце, являются, но не ограничиваются ими, белки, не являющиеся IFN-α, липиды и углеводы.
Способность антитела или Fab к связыванию с антигеном может быть определена специалистом в данной области с использованием методов, включающих, но не ограничивающихся методом ELISA и равновесным диализом. Методы определения аффинности и силы связывания хорошо известны специалисту в данной области техники, подробно описаны Janeway и др. (Immunobiology: The Immune System in Health and Disease (Garland Publishing Company, 1996)).
Fab, пригодный для осуществления настоящего изобретения, - это Fab, обладающий способностью к связыванию с IFN-α человека и нейтрализации его, когда концентрация IFN-α человека составляет от около 10 нг/мл и до около 10 пг/мл. В частности, пригодные в рамках настоящего изобретения Fab связывают IFN-α человека и нейтрализуют его, когда концентрация IFN-α человека составляет 10 нг/мл, около 1 нг/лм или менее, предпочтительно 100 пг/мл. Такие антитела и Fab описаны в сопутствующих Примерах.
Fab моноклональных мышиных антител в соответствии с настоящим изобретением, которые селективно связываются с IFN-α человека и нейтрализуют его, также могут быть получены с использованием подходящей 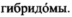
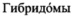 могут быть выращены в питательной среде, и накопленные антитела могут быть выделены. Здесь и далее термин "выращиваемые клетки" относится к
могут быть выращены в питательной среде, и накопленные антитела могут быть выделены. Здесь и далее термин "выращиваемые клетки" относится к 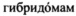 или другим линиям клеток, которые производят антитела. Способы получения и проверки таких выращиваемых клеток описаны Harlow и др. (см. выше). Методы получения антигенного материала для инъекций в животное включают в себя методы, известные из уровня техники, например, использование полноразмерного белка, пептидов, выбранных из иммуногенного участка этого белка, модифицирование антигена такими способами как, например, связывание с динитрофенолом, связывание с арсаниловой кислотой, денатурация антигена, связывание антигена с белком-переносчиком, таким как, например, гемоцианин улитки, с пептидами, содержащими участки связывания с рецепторами Т-клеток класса II, с бусинами, а также любыми другими методами, известными из уровня техники. Смотри Harlow и др. (см. выше).
или другим линиям клеток, которые производят антитела. Способы получения и проверки таких выращиваемых клеток описаны Harlow и др. (см. выше). Методы получения антигенного материала для инъекций в животное включают в себя методы, известные из уровня техники, например, использование полноразмерного белка, пептидов, выбранных из иммуногенного участка этого белка, модифицирование антигена такими способами как, например, связывание с динитрофенолом, связывание с арсаниловой кислотой, денатурация антигена, связывание антигена с белком-переносчиком, таким как, например, гемоцианин улитки, с пептидами, содержащими участки связывания с рецепторами Т-клеток класса II, с бусинами, а также любыми другими методами, известными из уровня техники. Смотри Harlow и др. (см. выше).
Fab, связывающиеся с IFN-α человека и нейтрализующие его, согласно настоящему изобретению, могут включать в себя многофункциональные молекулы, например, бифункциональные молекулы, содержащие, по крайней мере, одну функциональную часть, которая специфически связывается с IFN-α человека и нейтрализует его. Такие многофункциональные молекулы могут включать в себя, например, химерные молекулы, включающие в себя молекулу, которая связывается с IFN-α человека и нейтрализует его, и вторую часть, которая дает возможность данной химерной молекуле связываться с субстратом или позволяет детектировать ее способом, при котором связывание с IFN-α человека и его нейтрализация не ухудшаются. Примерами таких вторых частей являются, но не ограничиваются ими, фрагменты молекулы иммуноглобулина, флуоресцентный белок или фермент. Также Fab, связывающиеся с IFN-α человека и нейтрализующие его, согласно настоящему изобретению, могут быть модифицированы полиэтиленгликолем, т.е. пегилированы.
Термин "взаимодействие", использованный здесь, означает введение, добавление образца, предположительно содержащего IFN-α человека, к Fab, связывающему IFN-α человека, например, путем объединения или смешения образца с Fab. В случае, если IFN-α человека присутствует в образце, образуется комплекс Fab с IFN-α человека; образование такого комплекса означает способность Fab селективно связываться с IFN-α человека с образованием стабильного комплекса, который может быть детектирован. Детектирование может быть качественным, количественным или полуколичественным. Связывание IFN-α человека из образца с Fab происходит в условиях, подходящих для формирования комплекса. Такие условия (например, подходящие концентрации, буферы, температура, время реакции), а также методы оптимизации таких условий хорошо известны специалисту в данной области техники. Связывание может быть обнаружено и измерено с использованием множества методов, являющихся стандартными в данной области техники, включая, но не ограничиваясь ими, ферментативные методы иммунохимии (например, ELISA), иммунопреципитации, методы иммуноблотинга и другие методы иммунохимии, описанные, например, Sambrook и др. (("Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press, 1989) и Harlow и др. (см. выше). Эти ссылки также описывают примеры условий, в которых образуется комплекс.
Фразы «нейтрализует IFN-α человека», «ингибирует активность IFN-α человека» означают, что указанное антитело или Fab связывается с IFN-α человека таким образом, что нейтрализует его, то есть ингибирует активность IFN-α и блокирует его. Способность антитела или Fab к нейтрализации (ингибированию) IFN-α человека может быть определена, например, методом, описанным в Примере 4.
Методы получения плазмидной ДНК, расщепления и лигирования ДНК, трансформации, подбора олигонуклеотидов в качестве праймеров, и подобные методы могут быть стандартными методами, хорошо известными специалисту в данной области техники. Эти методы описаны, например в Sambrook, J., Fritsch, E.F., and Maniatis, T., ("Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)).
Последующие примеры приведены для целей объяснения и не ограничивают каким-либо образом рамки настоящего изобретения.
Пример 1. Получение мышиных антител против IFN-α человека.
Для получения антител мышей линии BALB/c иммунизировали дважды с интервалом в 2 недели в подушечки задних лап раствором иммуногена в полном (для первой иммунизации) или неполном (для второй иммунизации) адъюванте Фрейнда. В качестве иммуногена использовали рекомбинантный интерферон альфа 2b человека производства ООО «Фармапарк». Для каждого раунда иммунизации использовали 25 мкг интерферона альфа 2b. Гибридизацию клеток подколенных лимфоузлов иммунных мышей с клетками миеломы линии sp2/0 проводили по стандартной методике с использованием полиэтиленгликоля с молекулярной массой 4000 (Monoclonal Antibody Production. National Research Council (US) Committee on Methods of Producing Monoclonal Antibodies. Washington (DC): National Academies Press (US); 1999.)
Скрининг супернатантов гибридных клеток на наличие антител против IFN-α проводили через три дня после второго раунда иммунизации методом непрямого иммуноферментного анализа (Engvall E, Perlmann P. Enzyme-linked immunosorbent assay (ELISA). Quantitative assay of immunoglobulin G., Immunochemistry. 1971, 8(9): P.871-4).
Титр специфических антител против IFN-α составил порядка 125 тыс.
В результате было получено 11 клонов против ИФНа, в том числе клоны Ifna С4 и Ifna С6.
Субизотипы тяжелой и легкой цепей определяли при помощи коммерческого набора для определения (Kat# ISO2 - Mouse Monoclonal Antibody Isotyping Reagents, Sigma).
Субизотип антител Ifna С4 и Ifna С6 был определен как IgG1- каппа.
Антитела нарабатывали в асцитных жидкостях мышей, для этого мышам, предварительно праймированных пристаном, вводили внутрибрюшинно по 106 клеток каждого клона. Очистку антител из асцитных жидкостей проводили аффинной хроматографией на колонке с белок-G сефарозой по стандартной методике (Jungbauer, A. и др. Comparison of protein A, protein G and copolymerized hydroxyapatite for the purification of human monoclonal antibodies, J. Chromatogr. 1989, 476: 257-268). Чистоту выделенных антител контролировали при помощи SDS-ПААГ электрофореза в 12% полиакриламидном геле в присутствии SDS и DTT в ступенчатой буферной системе Лэмлли, используя Mini PROTEAN 3 Electrophoresis System BIO-RAD, Catalog N 165-3301 (Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4, Nature, 1970, 227: 680-685). Чистота всех полученных антител составила не менее 95%.
Пример 2. Характеристика мышиных моноклональных антител против IFN-α в иммуноферментном анализе
Иммуноферментный анализ.
Специфичность антител Ifna С4 и Ifna С6 определяли методом твердофазного иммуноферментного анализа (ИФА). ИФА проводили по следующим схемам:
а) ИФНа сорбировали в лунки планшета в фосфатно-солевом буфере (ФСБ) в концентрации 1 мкг/мл в течение ночи при 4°С. После отмывки планшет инкубировали с серийными разведениями антител Ifna С4 и Ifna С6 в ФСБ с добавлением 0,2% бычьего альбумина и 0,05% Tween20 (ФСБ-АТ) в концентрациях от 1 до 1000 нг/мл в течение 1 часа при 37°С. после отмывки планшет инкубировали с поликлональной козьей сывороткой против иммуноглобулинов мыши, конъюгированной с пероксидазой, в течение 1 часа при 37°С. После отмывки планшет инкубировали с раствором ТМБ и перекиси водорода до развития окраски. реакцию останавливали добавлением 0,1 М H2SO4, в лунках измеряли оптическую плотность при 450 нм.
б) антитела козы против иммуноглобулинов мыши сорбировали в лунки планшета в фосфатно-солевом буфере (ФСБ) в концентрации 1 мкг/мл в течение ночи при 4°С. После отмывки планшет инкубировали с серийными разведениями антител Ifna С4 и Ifna С6 в ФСБ-АТ в концентрациях от 1 до 1000 нг/мл в течение 1 часа при 37°С. После отмывки планшет инкубировали с ИФНа, конъюгированным с биотином, в ФСБ-АТ, в течение 1 часа при 37°С. После отмывки планшет инкубировали со стрептавидином, конъюгированным с пероксидазой, в ФСБ-АТ, в течение 1 часа при 37°С. После отмывки планшет инкубировали с раствором ТМБ и перекиси водорода до развития окраски. реакцию останавливали добавлением 0,1 М H2SO4, в лунках измеряли оптическую плотность при 450 нм.
Результаты представлены в Таблице 1.
Вывод: антитело Ifna C4 способно связывать интерферон-альфа 2b, находящийся в растворе, а антитело Ifna C6 связывает преимущественно сорбированный на твердой фазе интерферон-альфа 2b.
Вестерн блот.
Осуществляли электрофоретический перенос в сочетании с иммуноферментным анализом.
На первом этапе проводили электрофоретическое разделение рекомбинантных белков с помощью электрофореза в 15% полиакриламидном геле (ПААГ). Затем осуществляли электрофоретический перенос (электроблоттинг) разделенных белков из геля на твердую подложку. В качестве твердой подложки использовали MEMBRANE FILTERS CELLULOSE NITRATE; размер пор 0,45 мкм. Перенесенные белки выявляли на полученном блоте с помощью непрямого иммуноферментного анализа.
Для этого осуществляли блокировку нитроцеллюлозы 1% БСА. Инкубировали 1 час на шейкере при комнатной температуре. Промывали нитроцеллюлозу раствором ФСБ-твин 0,1% 3 раза. Нитроцеллюлозу разрезали на полоски и помещали в раствор МоАт. Для разведения антител использовали буфер ФСБ-АТ (БСА 0,2%). Антитела разводили до концентрации 2 мкг/мл. Инкубировали ночь при 4°С или 1 час при 37°С. Промывали нитроцеллюлозу раствором ФСБ-твин 0,1% 3 раза. Инкубировали 1 час на шейкере в растворе ФСБ-АТ, содержащим конъюгат анти-IgG мыши. Промывали нитроцеллюлозу раствором ФСБ-твин 0,1% 3 раза и один раз в ФСБ. После промывки блот помещали на 5-10 минут в раствор субстрата. В ФСБ добавляли 3,3-диаминобензидин, 4-хлор-1-нафтол и перекись водорода. Реакцию останавливали, промывая мембрану водой.
Результаты исследования приведены на Фиг. 1 и 2.
Вывод: Антитела Ifna C4 и Ifna C6 связывают мономер интерферона-альфа 2b человека в иммуноблоте.
Сэндвич ИФА. Стандартные калибровочные кривые для определения IFN-α 2b.
При разработке сэндвича была проведена его оптимизация по нескольким параметрам: подбор буфера для сорбции Мкат, концентрация Мкат для сорбции, разведение коньюгата, были выбраны оптимальная температура и время проведения анализа. В результате проведенных экспериментов была выбрана оптимальная пара для сэндвича IfnaC6-IfnaC4-ПХ, где ПХ-пероксидаза хрена.
Протокол ИФА для пары IfnaC6- IfnaC4-ПХ приведен ниже:
а. Антитела IfnaC6 сорбировали на планшет в концентрации 5 и 10 мкг/мл в ФСБ в течение ночи при 4°C.
б. Антиген титровали от 1 нг/мл с шагом 2 в ФСБ-АТ, 1 час при комнатной температуре.
в. Коньюгат IfnaC4-ПХ брали в разведении 1/100000 в ФСБ-АТ, 1 час при комнатной температуре.
г. Субстрат ТМБ (3,3',5,5'-тетраметилбензидина гидрохлорида) с перекисью водорода, 30 минут при комнатной температуре.
д. Стоп-раствор, 0,5М серная кислота.
е. Измерение оптической плотности при 450 нм.
Калибровочный график для определения IFN-α 2b в сэндвич - ИФА, построенный на основании данных, приведенных в Таблице 2, приведен на Фиг. 3.
Вывод: Антитела Ifna C4 и Ifna C6 направлены к разным эпитопам интерферона-альфа человека. В сэндвич-ИФА с антителами Ifna C4 и Ifna C6 интерферон альфа может быть определен с пределом чувствительности порядка 15 пг/мл.
Пример 3. Определение константы диссоциации моноклональных антител Ifna C4 и Ifna C6.
Константу диссоциации (Kd) определяли по методике, описанной в работе Friguet B. и др., Measurements of the True Affinity Constant in Solution of Antigen-Antiojdy Complex by Enzyme-Linked Immunosorbent Assay, Journal of Immunological Methods, 1985, 77: 305-319.
Для этого на планшет, блокированный 0,25% желатином, наносили МоАт в различной концентрации, которые в последствии использовали для построения калибровочного графика. На этом же планшете антиген в разной концентрации инкубировали с антителами в постоянной концентрации до достижения равновесия антиген-антитело в буферном растворе ФСБ-АТ. Время инкубации - 2 часа при комнатной температуре.
После достижения равновесия на планшет с сорбированным IFN-α 2b антигеном переносили свободные антитела для построения калибровочной кривой и смесь антиген-антитело. Далее проводили иммуноферментный анализ с разделением компонентов (непрямой ИФА) для определения концентрации свободных антител. По значениям оптических плотностей строили график калибровочной кривой (Фиг. 4 и 5).
Как следует из приведенных данных, для всех МоАт удалось выбрать диапазон концентраций, при котором зависимость оптической плотности OD 450 нм от разведения МоАт (на всех калибровочных графиках по оси Х отложен коэффициент разведения антител) имеет практически линейный вид, что позволяет использовать упрощенный метод для расчета Kd.
Константу диссоциации (Kd) рассчитывали по уравнению Клотца:
Ао/Ао-А=1+1/а Kd, где
Ао - оптическая плотность, измеренная для антител в отсутствии антигена, А - оптическая плотность, измеренная для свободных антител в смеси антиген-антитело, а - концентрация антигена.
Значения этих параметров для МоАт приведены в Таблице 3, а также на Фиг. 6 и 7. Концентрацию МоАт для измерения Kd выбирали на линейном участке калибровочной кривой.
Полученные значения Кd МоАт IfnaC4 и IfnaC6 приведены в Таблице 4.
Пример 4. Нейтрализация активности интерферона-а антителами Ifna C4 и Ifna C6.
Нейтрализующую способность антител Ifna C4 и Ifna C6 определяли, используя методику, описанную в ОФС.1.7.2.0002.15 «Биологические методы испытания препаратов интерферона с использованием культур клеток». В методике использовали клетки бычьих почек Madin-Darby MDBK и вирус везикулярного стоматита (VSV). Антитела Ifna C4 и Ifna C6 брали в серийных разведениях от 5 мг/мл с шагом 10. Нейтрализующую активность антител измеряли в процентах.
Результаты исследования приведены в Таблице 5.
Вывод:. антитела Ifna C4 и Ifna C6 обладают способностью к эффективной нейтрализации противовирусной активности интерферона альфа человека в концентрации вплоть до 50 нг/мл.
Пример 5. Клонирование генов, кодирующих Fab фрагменты мышиных моноклональных антител против IFN-α, используя мРНК из подходящих линий клеток в качестве матриц.
Тотальную РНК выделяли из 1×107 клеток подходящих 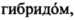 содержащих антитела согласно настоящему изобретению против IFN-α. Клетки (107 клеток) два раза промывали однократным буфером PBS. В пробирку со 100 мкл клеток добавляли 400 мкл раствора GTB (4 M гуанидинтиоцинат, 30 мМ цитрат натрия, 1% N-лаурилсаркозил натрия, 120 мМ β-меркаптоэтанол). Клетки суспендировали пипетированием в течение 2-3 минут и помещали на лед. Затем добавляли 50 мкл 3M ацетата натрия (pH 5.2) и 500 мкл фенола, насыщенного водой, и полученную суспензию тщательно перемешивали на мешалке Vortex. Затем добавляли 100 мкл смеси хлороформ - изоамиловый спирт, и суспензию тщательно перемешивали на мешалке Vortex в течение 1 мин с перерывами в 1 минуту. Суспензию откручивали в течение 10 мин и супернатант переносили в новую пробирку. Процедуру повторяли. Добавляли равный объем изопропанола (500 мкл) и хранили при -20°С. Образец откручивали в течение 10 минут, осадок промывали этанолом (70%) и растворяли в воде (50 мкл). Выделили в целом 30 мкг РНК (0,60 мкг/мкл), которые использовали для дальнейшего синтеза кДНК.
содержащих антитела согласно настоящему изобретению против IFN-α. Клетки (107 клеток) два раза промывали однократным буфером PBS. В пробирку со 100 мкл клеток добавляли 400 мкл раствора GTB (4 M гуанидинтиоцинат, 30 мМ цитрат натрия, 1% N-лаурилсаркозил натрия, 120 мМ β-меркаптоэтанол). Клетки суспендировали пипетированием в течение 2-3 минут и помещали на лед. Затем добавляли 50 мкл 3M ацетата натрия (pH 5.2) и 500 мкл фенола, насыщенного водой, и полученную суспензию тщательно перемешивали на мешалке Vortex. Затем добавляли 100 мкл смеси хлороформ - изоамиловый спирт, и суспензию тщательно перемешивали на мешалке Vortex в течение 1 мин с перерывами в 1 минуту. Суспензию откручивали в течение 10 мин и супернатант переносили в новую пробирку. Процедуру повторяли. Добавляли равный объем изопропанола (500 мкл) и хранили при -20°С. Образец откручивали в течение 10 минут, осадок промывали этанолом (70%) и растворяли в воде (50 мкл). Выделили в целом 30 мкг РНК (0,60 мкг/мкл), которые использовали для дальнейшего синтеза кДНК.
кДНК синтезировали с использованием набора RevertAid™ H Minus First Strand cDNA Synthesis (Fermentas) в соответствии с "протоколом синтеза кДНК, подходящего для ПЦР", рекомендованного производителем.
Дизайн праймеров для клонирования гена, кодирующего тяжелую цепь.
Для того, чтобы идентифицировать пару праймеров, пригодных для клонирования гена, кодирующего тяжелую цепь, проводили ПЦР для клонирования с использованием ДНК полимеразы Tag (реакционная смесь содержала 10X буфер для ДНК полимеразы Tag (67 мМ Tris-HCl (pH 8,8 при 25°C), 166 мМ (NH4)2SO4, 100 мМ 2-меркаптоэтанола) + 20 мМ MgCl2, 1,25 мМ dNTP, 5'-концевой праймер (25 пмоль), 3’-концевой праймер (25 пмоль), ДНК полимераза Taq (2,5 U), кДНК 1 мл, бидистиллированная вода до 50 мкл). Тотальную кДНК использовали в качестве матрицы. Программа ПЦР была следующей: 95°C в течение 3 минут; 35 циклов 94°C в течение 1 минуты, 45°C в течение 1 минуты и 72°C в течение 1 минуты; в конце 72°C в течение 10 минут.
5'-Концевой праймер соответствовал набору из 16 дегенеративных праймеров А3-А11, В6-В12 (SEQ ID NO: 5-20, соответственно), узнающих 95% последовательностей сигнальных пептидов в генах, кодирующих тяжелую цепь, выложенных в базе данных Кабат (Kabat, E., Wu, T., Perry, H. 1991. Sequences of proteins of Immunological Interest, 5th edn. US Departament of Health and Human Services, Public Health Service, NIH).
В качестве 3'-концевого праймера в ПЦР использовали праймер A26, комплементарный 3'-концу гена, кодирующего CH1 домен антитела подкласса IgG1, с введенным сайтом XhoI (SEQ ID NO: 21):
Агарозный электрофорез продуктов ПЦР показал, что существуют пары праймеров, приводящие к образованию ПЦР фрагментов ожидаемого размера (Таблица 6).
Размеры полученных ПЦР фрагментов хорошо согласуются с ожидаемыми последовательностями кДНК генов тяжелой цепи IgG Mus musculus, представленной в Gene-Bank и IMGT-GENE-DB.
Дизайн праймеров для клонирования гена, кодирующего легкую цепь.
Ранее было показано, что изучаемое антитело содержит легкую цепь типа каппа. На основании этих данных в качестве 5'-концевого праймера использовали набор из 23 дегенеративных праймеров А15-А23, В1-В5, С1-С10 (SEQ ID NO: 22-45, соответственно). Этот набор узнает 95% последовательностей, соответствующих сигнальным пептидам в генах, кодирующих каппа цепь, опубликованных в базе данных Кабат (Kabat, E., Wu, T., Perry, H. 1991. Sequences of proteins of Immunological Interest, 5th edn. US Departament of Health and Human Services, Public Health Service, NIH).
В качестве 3'-концевого праймера в ПЦР, соответствовавшего 3`-концу легкой цепи фрагмента Fab (каппа-тип), с введенным на 5'-конец сайтом XhoI использовали праймер L-m-r (SEQ ID NO: 46).
Агарозный электрофорез продуктов ПЦР показал, что существуют пары праймеров, приводящие к образованию ПЦР фрагментов ожидаемого размера (Таблица 7).
Размеры полученных ПЦР фрагментов хорошо согласуются с ожидаемыми последовательностями кДНК генов легкой цепи IgG Mus musculus, представленной в Gene-Bank и IMGT-GENE-DB.
Клонирование генов, кодирующих Fab фрагменты антител против IFN-α
Pfu ДНК полимеразу (Fermentas) использовали для клонирования генов, кодирующих цепи антитела. Условия ПЦР оптимизировали подбором температуры отжига и концентрации Mg2+ (реакционная смесь содержала 10X буфер для Pfu ДНК полимеразы (200 мМ Tris-HCl (pH 8,8 при 25°C), 100 мМ (NH4)2SO4, 100 мМ KCl, 1% Тритон X-100, 1 мг/мл БСА) + 20мМ MgCl2, 1,25 мМ dNTP, 5'-концевой праймер (25 пмоль), 3'-концевой праймер (25 пмоль), Pfu ДНК полимераза (1,25 U), кДНК 1 мкл, бидистиллированная вода до 50 мкл). Программа для ПЦР была следующая: 95°C в течение 3 минут; 35 циклов 94°C в течение 1 минуты, 45°C в течение 1 минуты и 72°C в течение 2 минут; в конце 72°C в течение 10 минут.
Пример 6. Секвенирование фрагментов генов, кодирующих вариабельные части Fab-фрагмента мышиного моноклонального антитела против IFN-α человека.
ПЦР-фрагменты, содержащие гены цепей Fab-фрагмента антител против IFN-α человека, элюировали из агарозного геля и секвенировали с помощью набора реактивов ABI PRISM® BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3730 Applied Biosystems. В качестве праймеров для определения последовательностей фрагментов генов использовали праймеры, с помощью которых клонировали гены антител против IFN-α человека.
Аминокислотная последовательность вариабельного домена тяжелой цепи мышиного антитела Ifna С4 против IFNα человека приведена в Перечне последовательностей под номером SEQ ID NO: 1.
Аминокислотная последовательность вариабельного домена легкой цепи мышиного антитела Ifna С4 против IFNα человек приведена в Перечне последовательностей под номером SEQ ID NO: 2.
Аминокислотная последовательность вариабельного домена тяжелой цепи мышиного антитела Ifna С6 против IFNα человек приведена в Перечне последовательностей под номером SEQ ID NO: 3.
Аминокислотная последовательность вариабельного домена легкой цепи мышиного антитела Ifna С6 против IFNα человек приведена в Перечне последовательностей под номером SEQ ID NO: 4.
Хотя настоящее изобретение было подробно описано со ссылкой на предпочтительные варианты его осуществления, для специалиста в данной области техники ясно, что могут быть сделаны различные замены и применены эквиваленты, которые не выходят за рамки настоящего изобретения. Все процитированные здесь документы являются частью настоящей заявки, включенные путем ссылки.
Таблица 1. ИФА. Тестирование антител против интерферона-альфа человека.
|
Таблица 2. Данные для построения калибровочного графика для определения IFN-α 2b в сэндвич - ИФА
|
Таблица 3. Определение Kd для антител IfnaC4 и IfnaC6
|
Таблица 4. Значения Kd для антител IfnaC4 и IfnaC6
|
Таблица 5. Нейтрализация интерферона-α антителами Ifna C4 и Ifna C6
|
Таблица 6. Электрофорез ПЦР фрагментов генов тяжелой цепи в агарозном геле.
|
Таблица 7. Электрофорез ПЦР фрагментов генов легкой цепи в агарозном геле.
|