Результат интеллектуальной деятельности: ГУМАНИЗИРОВАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ (Fab), СВЯЗЫВАЮЩИЕСЯ С ИНТЕРФЕРОНОМ- γ ЧЕЛОВЕКА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ, КЛЕТКА, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО АНТИТЕЛА И АНТИГЕНСВЯЗЫВАЮЩЕГО ФРАГМЕНТА
Вид РИД
Изобретение
Область техники
Изобретение относится к антителам, в частности к гуманизированным антителам, связывающимся с интерфероном-γ человека.
Уровень техники
Развитие иммунного ответа млекопитающих обеспечивается несколькими типами клеток, которые специфично взаимодействуют с чужеродным материалом, то есть антигенами. Один из типов клеток, B-клетки, отвечает за продукцию антител. Другой тип клеток, T-клетки, включающий в себя ряд клеточных субпопуляций, который обеспечивает разрушение клеток, инфицированных вирусом, или контроль за функциями B-клеток и гемопоэтических клеток in vivo, а также самих T-клеток. Третий тип клеток, макрофаги, обрабатывают и представляют антигены в комплексе молекулами главного комплекса гистосовместимости (MHC) T-клеткам. Взаимодействия между этими типами клеток обеспечиваются совместным действием цитокинов, таких как интерлейкины-1-6 и интерферон-γ (ИФН-γ) (см. в основном Paul, W.E., Fundamental Immunology, 3rd ed., Raven Press, New York (1993).
Одним из важнейших цитокинов является ИФН-γ, секретируемый некоторыми T-клетками. ИФН-γ обладает противовирусной активностью, а также стимулирует NK-клетки и T-хелперные клетки 1 типа (T×1), активирует макрофаги и стимулирует экспрессию молекул главного комплекса гистосовместимости на поверхности клеток (Paul, стр.764-766). Таким образом, в случае аутоиммунных заболеваний, при которых наблюдается повышенная активность иммунной системы, использование антагонистов ИФН-γ может способствовать нейтрализации стимулирующих эффектов данного цитокина и, соответственно, быть полезно для терапии таких заболеваний. Результаты клинических исследований показали, что использование поликлональных антител к ИФН-γ способствует терапии Th1-опосредованных аутоиммунных заболеваний (Skurkovich В. & S. Skurkovich. Anti-interferon-γ antibodies in the treatment of autoimmune diseases. Curr. Opin. in Mol. Therapeutics (2003) 5(1): 52-57).
Компанией Protein Design Labs был получен препарат на основе моноклонального антитела против ИФН-γ - Fontolizumab (US Patent Application Publication: Humanized antibodies to gamma-interferon. Pub. No.: US 2002/0091240 A1, Jul. 11, 2002). Были проведены клинические испытания эффективности данного препарата для терапии болезни Крона (Reinisch W, de Villiers W, Bene L, Simon L et al., Inflamm Bowel Dis. 2010 Feb; 16(2): 233-42).
Использование моноклональных антител животного происхождения имеет ряд недостатков при терапии заболеваний человека, особенно выраженных при повторных введениях препарата. Например, мышиные моноклональные антитела имеют короткое время циркуляции в организме человека, а также вследствие неспособности их Fc-фрагмента связываться с человеческими рецепторами на поверхности эффекторных клеток не обладают важными функциональными характеристиками.
Возможно, более важной особенностью мышиных моноклональных антител является то, что они содержат аминокислотные последовательности, которые являются иммуногенными для человека. Ряд исследований показывает (R. Fagnani, Immunol. Ser. 61 (1994) 3-22; M.B. Khazaeli, R.M. Conry, A.F. LoBuglio, J Immunother. 15 (1994) 42-52; K. Kuus-Reichel, L.S. Grauer, L.M. Karavodin, C. Knott, M. Krusemeier, N.E. Kay, Clin. Diagn. Lab. Immunol. 1 (1994) 365-372), что введение чужеродного антитела может вызывать сильный иммунный ответ у пациента и в конечном итоге приводит к неэффективности терапии уже на ранней стадии лечения. Более того, при использовании мышиных или других чужеродных (для человека) антител для лечения различных заболеваний последующее лечение другими мышиными антителами может быть неэффективно или даже опасно из-за кросс-реактивности используемых антител.
Для снижения неблагоприятных реакций пациентов при использовании антител в терапии указанные антитела или их части должны быть гуманизированы для того, чтобы быть менее иммуногенными, чем их мышиные прототипы. Так, авторы настоящего изобретения на основе мышиных моноклональных антител, обладающих способностью с высокой специфичностью и высоким аффинитетом связываться с человеческим ИФН-γ, и каркасных участков антител человека сконструировали гуманизированные антигенсвязывающие фрагменты (Fab) против ИФН-γ.
Раскрытие изобретения
Задачей, решаемой авторами настоящего изобретения, было получение гуманизированного антитела и, в частности, антигенсвязывающего участка антитела (Fragment antigen binding, Fab), способного к связыванию с человеческим ИФН-γ.
Техническим результатом является получение нового гуманизированного антитела, способного к связыванию с человеческим ИФН-γ, характеризующегося Кд 4,6 нМ и параметром IC50 в тесте на клетках U937 не менее 1,5 нМ.
Поставленная задача решается путем конструирования гуманизированного антигенсвязывающего фрагмента (Fab) против человеческого ИФН-γ на основе ранее изолированного авторами настоящего изобретения моноклонального мышиного антитела против человеческого ИФН-γ и демонстрации высокой специфичности указанного антитела в связывании с человеческим ИФН-γ.
Таким образом, настоящее изобретение предоставляет новое гуманизированное антитело, селективно связывающее человеческий ИФН-γ, отличающееся тем, что вариабельный участок тяжелой цепи (VH) указанного антитела содержит последовательность аминокислот SEQ ID NO: 1, а вариабельный участок легкой цепи (VL) указанного антитела содержит последовательность аминокислот SEQ ID NO: 2.
Также настоящее изобретение предоставляет изолированный фрагмент ДНК, кодирующий гуманизированное антитело, описанное выше, или его фрагмент, представляющий собой вариабельный участок тяжелой цепи, характеризующийся последовательностью аминокислот SEQ ID NO: 1, или вариабельный участок легкой цепи, характеризующийся последовательностью аминокислот SEQ ID NO: 2.
Также настоящее изобретение предоставляет гуманизированный антигенсвязывающий фрагмент (Fab), селективно связывающий человеческий ИФН-γ, который содержит вариабельный участок тяжелой цепи (VH) с последовательностью аминокислот SEQ ID NO: 1, соединенной с доменом CH1 человеческого иммуноглобулина, и вариабельный участок легкой цепи (VL) с последовательностью аминокислот SEQ ID NO: 2, соединенной с CL человеческого иммуноглобулина.
Также настоящее изобретение предоставляет гуманизированный антигенсвязывающий фрагмент (Fab), описанный выше, отличающийся тем, что доменом CH1 является домен CH1 человеческого иммуноглобулина IgG1, а доменом CL является домен CL человеческого иммуноглобулина каппа.
Также настоящее изобретение предоставляет изолированный фрагмент ДНК, кодирующий антигенсвязывающий фрагмент (Fab) против человеческого ИФН-γ, описанный выше.
Также настоящее изобретение предоставляет плазмидную ДНК, содержащую изолированный фрагмент ДНК, кодирующий антигенсвязывающий фрагмент (Fab) против человеческого ИФН-γ, описанный выше.
Также настоящее изобретение предоставляет бактериальную клетку, содержащую упомянутую выше плазмидную ДНК, обладающую способностью к продукции Fab.
Также настоящее изобретение предоставляет упомянутую выше бактериальную клетку, которая представляет собой клетку Escherichia coli.
Также настоящее изобретение предоставляет плазмидную ДНК, содержащую изолированный фрагмент ДНК, кодирующий гуманизированное антитело против человеческого ИФН-γ, описанное выше.
Также настоящее изобретение предоставляет клетку эукариот, содержащую упомянутую выше плазмидную ДНК, обладающую способностью к продукции гуманизированного антитела.
Также настоящее изобретение предоставляет упомянутую выше клетку эукариот, которая представляет собой клетку яичников Cricetulus griseus (CHO).
Также настоящее изобретение предоставляет способ получения гуманизированного антитела, включающий в себя культивирование клеток в питательной среде и выделение указанного антитела из культуральной жидкости.
Также настоящее изобретение предоставляет способ получения антигенсвязывающего фрагмента (Fab), включающий в себя культивирование клеток в питательной среде и выделение указанного антиген-связывающего фрагмента из культуральной жидкости.
Краткое описание фигур
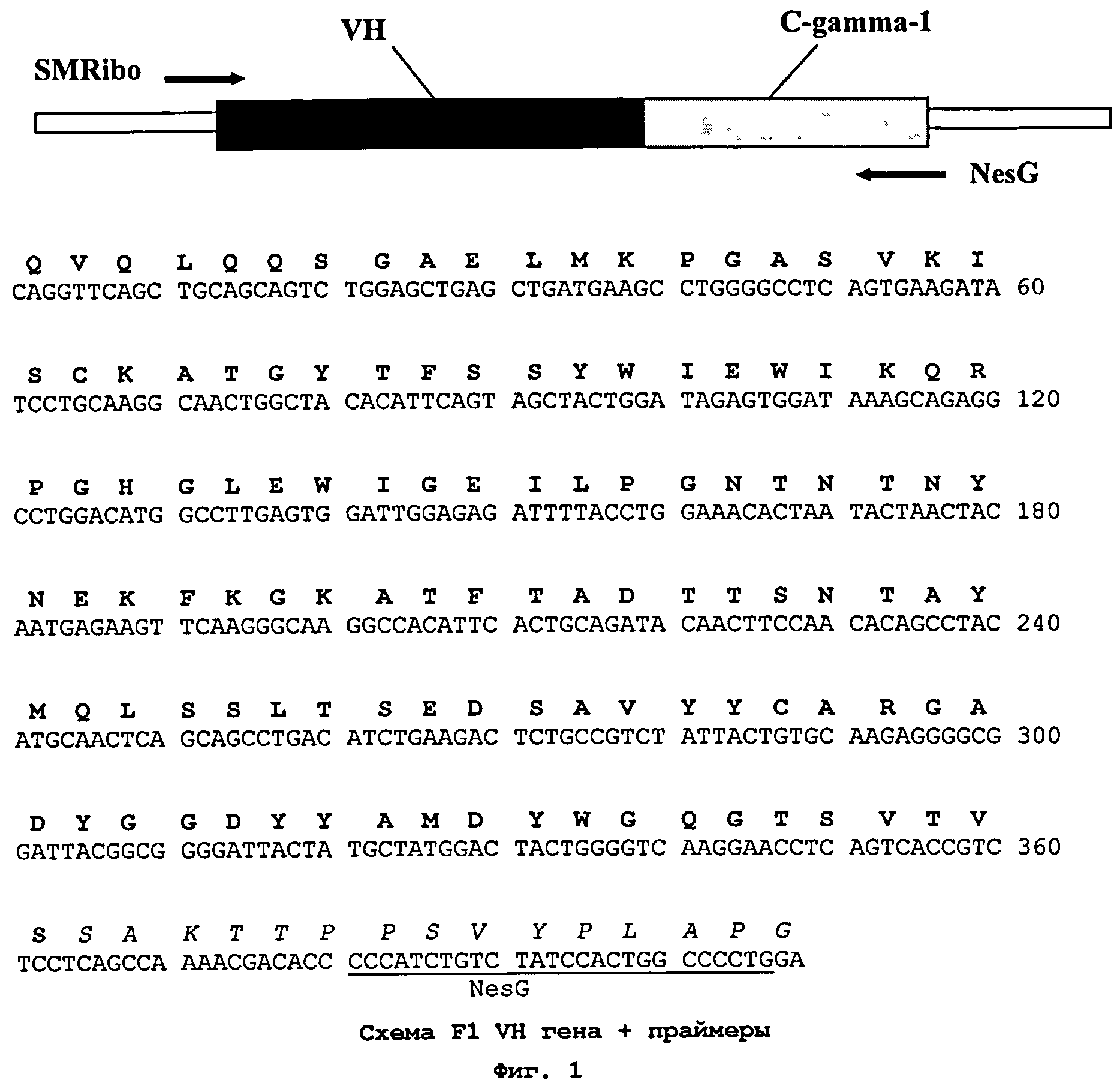
На Фиг.1 показана схема секвенирования, нуклеотидная последовательность клонированного гена, кодирующего вариабельный домен тяжелой цепи и часть первого константного домена IgG1 мышиного антитела против ИФН-γ, и соответствующая аминокислотная последовательность. Нуклеотидные последовательности ген-специфических праймеров, использованных для секвенирования гена тяжелой цепи антитела против ИФН-γ, подчеркнуты, аминокислотная последовательность вариабельного домена тяжелой цепи антитела выделена жирным шрифтом, аминокислотная последовательность, относящаяся к первому константному домену IgG1 антитела мыши, выделена курсивом.
На Фиг.2 показана схема секвенирования, нуклеотидная последовательность клонированного гена, кодирующего вариабельный домен легкой цепи и часть константного домена легкой каппа-цепи мышиного антитела против ИФН-γ, и соответствующая аминокислотная последовательность. Нуклеотидные последовательности ген-специфических праймеров, использованных для секвенирования гена тяжелой цепи антитела против ИФН-γ, подчеркнуты, аминокислотная последовательность вариабельного домена легкой цепи антитела выделена жирным шрифтом, аминокислотная последовательность, относящаяся к константному домену легкой каппа-цепи антитела мыши, выделена курсивом.
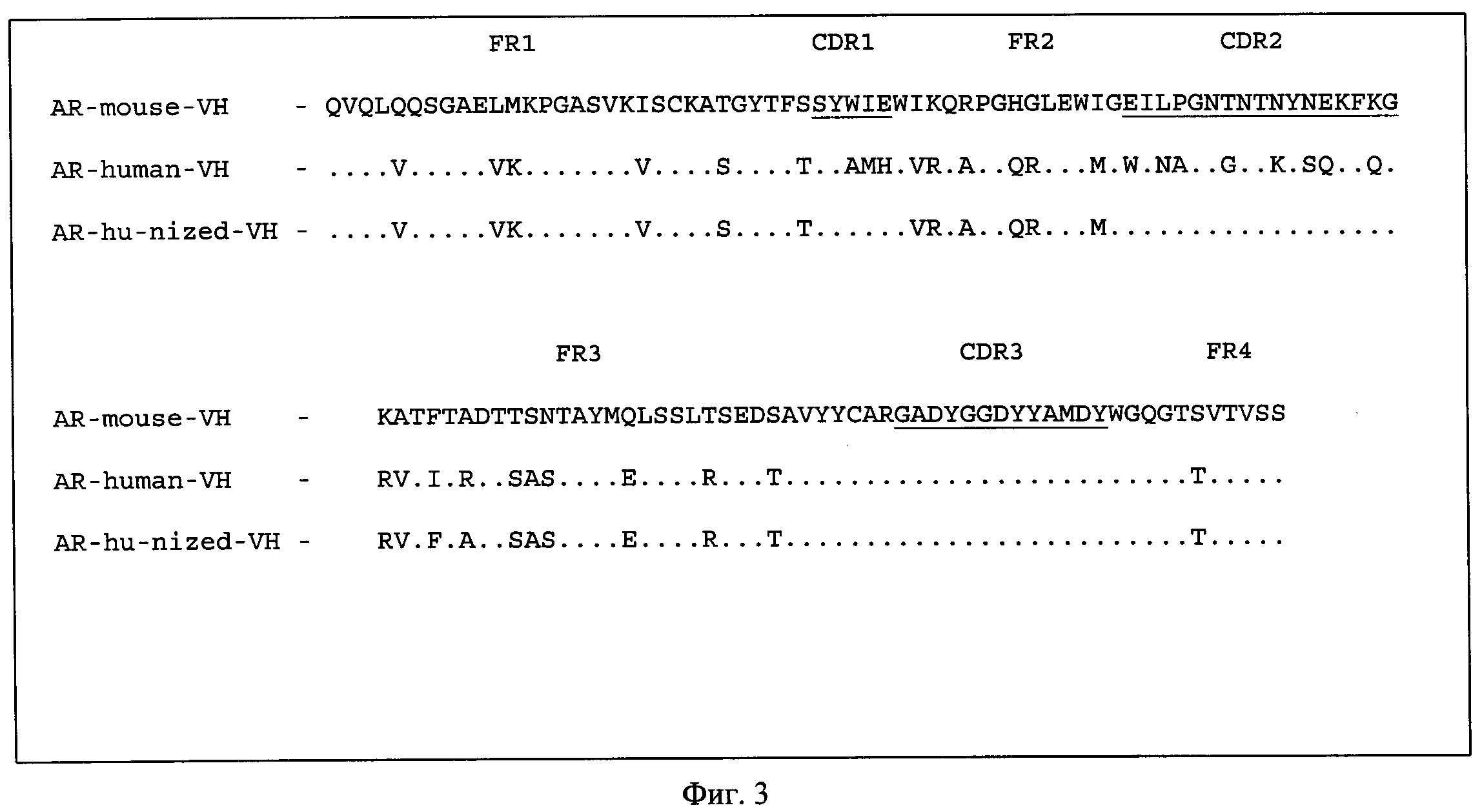
На Фиг.3 показано сравнение мышиной, человеческой и гуманизированной аминокислотных последовательностей вариабельного домена тяжелой цепи антитела против ИФН-γ.
На Фиг.4 показано сравнение мышиной, человеческой и гуманизированной аминокислотных последовательностей вариабельного домена легкой цепи антитела против ИФН-γ.
Подробное описание настоящего изобретения
Антитела обычно состоят из двух тяжелых цепей, связанных между собой дисульфидными связями, и легких цепей, ассоциированных с N-концом каждой из тяжелых цепей. Каждая тяжелая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Каждая легкая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязывающий участок. Вариабельные домены легкой и тяжелой цепей обладают похожей общей структурой, и каждый домен включает каркас из четырех участков, последовательности которых являются относительно консервативными, связанных посредством трех участков, определяющих комплементарность (complementarity determining regions, CDRs). Четыре каркасных участка формируют конформацию типа бета-складчатого слоя. Участки CDRs расположены в близком соседстве друг с другом благодаря каркасным участкам и вносят вклад в образование антигенсвязывающего участка. Участки CDRs и каркасные участки антител могут быть определены путем ссылки на нумерационную систему Кабата (Kabat numbering system, Kabat et al., 1987 "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office) в сочетании с данными рентгеноструктурного анализа, как указано в заявке WO 91/09967.
Для получения антитела, которое может связываться с каким-либо специфическим антигеном, обычно используют методику Kohler и Milstein (Kohler et al. (1976) Nature 256: 495-497). Моноклональные антитела получают путем слияния клеток селезенки из иммунизированного животного и клеток миеломы с получением гибридомы. Гибридомы могут быть проверены на способность к продукции нужного антитела, затем гибридомы могут быть выращены, из них могут быть выделены указанные антитела. Термин «выращенные клетки», использованный здесь, означает гибридомы или другие линии клеток, которые производят антитела. Методы получения и проверки таких выращенных клеток описаны Harlow и др. (Antibodies, a Laboratory Manual, Cold Spring Harbor Labs Press, 1988). Получение материала, использующегося в качестве антигена, для инъекции животных включают в себя методики, хорошо известные из уровня техники, например использование полноразмерного белка, использование пептида, выбранного из иммуногенных участков белка, а также любыми другими методами, известными из уровня техники. См. Harlow и др. (см. выше).
Подходящий способ для выделения антител, эффективных для использования в рамках настоящего изобретения, включает (a) назначение животному эффективного количества белка или пептида с целью получения антител, (b) выделение указанных антител, (c) определение последовательности антител и конструирование гуманизировнных антител.
Ранее авторы настоящего изобретения получили панель мышиных моноклональных антител против человеческого ИФН-γ. В результате детального изучения свойств антител было отобрано антитело F1. Указанное антитело F1 обладает следующими характеристиками: 1) взаимодействует с человеческим ИФН-γ (константа диссоциации комплекса составляет 1,7×10-9 М; 2) обладает нейтрализующей активностью по отношению к человеческому ИФН-γ, IC50 в тесте на клетках U937 составила менее 1,5 нМ. Мышиное антитело имеет IgG1 изотип и содержит легкую каппа-цепь.
Затем авторы настоящего изобретения клонировали гены, кодирующие вариабельные домены тяжелой и легкой цепей мышиного антитела против человеческого ИФН-γ, и определили их последовательности (SEQ ID NO: 3 и 4 соответственно). Такое антитело содержит последовательность аминокислот SEQ ID NO: 5 в качестве вариабельного участка тяжелой цепи (VH) антитела, последовательность аминокислот SEQ ID NO: 6 в качестве вариабельного участка легкой цепи (VL) антитела и консервативные участки обеих цепей, необходимые для функционирования антитела.
Затем были осуществлены дизайн и гуманизация мышиного антитела против человеческого ИФН-γ. Сначала были определены границы каркасных участков согласно Kabat, E.A., Wu, T.T., Reid-Miller, М., Perry, Н.М. and Gottesman, K.S. (Sequences of Proteins of Immunological Interest, (1987) U.S. Department of Health and Human Services, NIH, Bethesda, MD). Для вариабельного домена каждой цепи были найдены ближайшие гомологи в базе данных человеческих последовательностей вариабельных доменов антител зародышевой линии - IGHV1-3*01-IGHJ6*01 и IGKV4-1*01-IGKJ2*01 для VH и VL соответственно. Окончательные последовательности гуманизированных вариабельных доменов антитела против ИФН-γ человека были составлены преимущественно из последовательностей каркасных участков выбранных генов вариабельных доменов антител человека и последовательностей мышиных CDR (Фиг.1 и 2). Термин "CDR" или "участок, определяющий комплементарность" относится к тем частям тяжелой и легкой цепи антитела, которые расположены в непосредственной близости друг от друга в трехмерном пространстве и формируют антигенсвязывающую поверхность антитела.
Так было выполнено настоящее изобретение.
В частности, антителом согласно настоящему изобретению является гуманизированное антитело, обладающее способностью к связыванию человеческого ИФН-γ.
Таким антителом является антитело, содержащее последовательность аминокислот SEQ ID NO: 1 в качестве вариабельного участка тяжелой цепи (VH) указанного антитела, последовательность аминокислот SEQ ID NO: 2 в качестве вариабельного участка легкой цепи (VL) указанного антитела и консервативные участки обеих цепей, необходимых для функционирования указанного антитела. Такое новое гуманизированное антитело селективно ввязывается с человеческим ИФН-γ. Консервативные участки тяжелой цепи человеческого иммуноглобулина IgG, IgM, IgA, IgD или IgE могут быть использованы в качестве консервативных участков для тяжелой цепи согласно настоящему изобретению. Консервативные участки легкой цепи человеческого иммуноглобулина каппа или лямбда могут быть использованы в качестве консервативных участков для легкой цепи антитела согласно настоящему изобретению.
Также антигенсвязывающим фрагментом (Fab) согласно настоящему изобретению является изолированный Fab, который селективно связывается с человеческим ИФН-γ и который включает в себя вариабельный участок тяжелой цепи (VH) с последовательностью аминокислот SEQ ID NO: 1, соединенный с доменом CH1 иммуноглобулина человека, и вариабельный участок легкой цепи (VL) с последовательностью аминокислот SEQ ID NO: 2, соединенный с доменом CL иммуноглобулина человека. Домен CH1 тяжелой цепи человеческого иммуноглобулина IgG, IgM, IgA, IgD или IgE может быть использован в качестве домена CH1 тяжелой цепи Fab согласно настоящему изобретению. Домен CL легкой цепи человеческого иммуноглобулина каппа или лямбда может быть использован в качестве домена CL легкой цепи Fab согласно настоящему изобретению. Такой Fab согласно настоящему изобретению представлен, но не ограничивается Fab, содержащим последовательности аминокислот SEQ ID NO: 7 (тяжелая цепь) и SEQ ID NO: 8 (легкая цепь) (Фиг.3 и 4).
В настоящем изобретении термин "антитело" использован для описания иммуноглобулинов или их фрагментов, мономеров или димеров легкой цепи или тяжелой цепи, одноцепочечных антител, таких как одноцепочечные антитела Fv's, в которых вариабельные домены тяжелой и легкой цепей соединены пептидным линкером, а также как природных, так и полученных методами рекомбинантных ДНК или другим образом, при условии, что антитело содержит, по крайней мере, один антигенсвязывающий участок. Остальная часть антитела не должна обязательно включать только последовательность, производную от иммуноглобулина. Например, может быть сконструирован ген, в котором часть цепи, последовательность ДНК, кодирующая часть цепи человеческого иммуноглобулина, соединена с последовательностью ДНК, кодирующей последовательность аминокислот полипептида эффектора или молекулы-репортера. Используемый в настоящем документе термин «антитело» предназначен для обозначения молекул иммуноглобулина, составленных из четырех полипептидных цепей, при этом две тяжелые (H) цепи и две легкие (L) цепи связываются друг с другом дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в настоящем документе VH) и константную область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно называемую в настоящем документе VL) и константную область легкой цепи. Константная область легкой цепи состоит из одного домена: CL. Области VH и VL могут далее подразделяться на области гипервариабельности, которые называются определяющими комплементарность областями (CDR), перемежаемые областями с более высоким уровнем консервативности, называемыми каркасными областями (FR). Каждая область VH и VL образована тремя CDR и четырьмя FR, расположенными от амино-терминального конца к карбокси-терминальному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Используемый в настоящем документе термин «антиген-связывающая область» антитела обозначает один или несколько фрагментов антитела, которые сохраняют способность к специфическому связыванию с антигеном. К примерам связывающих фрагментов, включенных в термин «антиген-связывающая область» антитела, относятся (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, состоящий из двух фрагментов Fab, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH отдельной области антитела; (v) фрагмент dAb (Ward et al. (1989) Nature 241: 544-546), состоящий из домена VH; и (vi) отдельная определяющая комплементарность область (CDR). Более того, несмотря на то что два домена в фрагменте Fv, VL и VH кодируются различными генами, их можно объединить, используя рекомбинантные технологии, посредством синтетического линкера, который позволяет построить из них единую белковую цепочку, в которой области VL и VH связываются с образованием моновалентных молекул (известных как одиночная цепь Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также включаются в сферу охвата термина «антигенсвязывающая область» антитела.
Термин "гуманизированное антитело" используется для описания антитела, содержащего по крайней мере один, а предпочтительно два или три участка CDR в одном или обоих вариабельных участках, полученных из антитела первого вида животного, это понимается как то, что он может содержать определенный выбранный каркасный участок из аминокислот, соединенный с определенной гипервариабельной последовательностью аминокислот. Оставшиеся части антитела, полученные из иммуноглобулина Ig, получают из одного или нескольких различных антител. Вариабельные домены могут быть получены с использованием техники рекомбинантных ДНК или пептидным синтезом.
Гуманизированные антитела или их связывающие белки согласно настоящему изобретению содержат последовательности аминокислот, включающие в себя все или части CDR, полученные главным образом из моноклонального антитела, обладающего специфичностью к человеческому ИФН-γ. В наиболее предпочтительном варианте осуществления изобретения таким моноклональным антителом является мышиное по происхождению антитело. Аминокислотные последовательности каркасных участков вариабельных доменов антитела или их части являются главным образом человеческими по происхождению в наиболее предпочтительном варианте осуществления изобретения и, следовательно, "гуманизированными антителами". Эта "гуманизация" считается полезной в снижении иммуногенности указанного антитела при терапевтическом назначении пациентам. Определенные выбранные аминокислотные остатки в каркасных участках остаются мышиными, а не человеческими. Считается, что это необходимо для достижения нужной трехмерной структуры молекулы и таким образом для повышения связывающей специфичности и аффинности к человеческому ИФН-γ.
В настоящем изобретении фраза "антитело или Fab, обладающий способностью к связыванию с человеческим ИФН-γ" означает молекулу, которая связывается с человеческим ИФН-γ и образует стабильный комплекс. Способность антитела или Fab к связыванию с антигеном может быть определена специалистом в данной области с использованием методов, включающих, но не ограничивающихся методом иммуноферментного анализа (ИФА), равновесным диализом, с использованием плазмон-поверхностного резонанса. Методы определения аффинности хорошо известны специалисту в данной области техники, подробно описаны Janeway и др. (Immunobiology: The Immune System in Health and Disease (Garland Publishing Company, 1996)). Изолированным фрагментом ДНК, кодирующим антитело, согласно настоящему изобретению является экспрессирующийся фрагмент ДНК, содержащий промотор, сигнальную последовательность, последовательность нуклеотидов, кодирующую структурные части тяжелой и легкой цепи антитела, участок терминации транскрипции.
Изолированным фрагментом ДНК, кодирующим антитело, согласно настоящему изобретению является экспрессирующийся фрагмент ДНК, содержащий промотор, сигнальную последовательность, нуклеотидную последовательность, кодирующую структурные части тяжелой и легкой цепей антитела, участок терминации транскрипции.
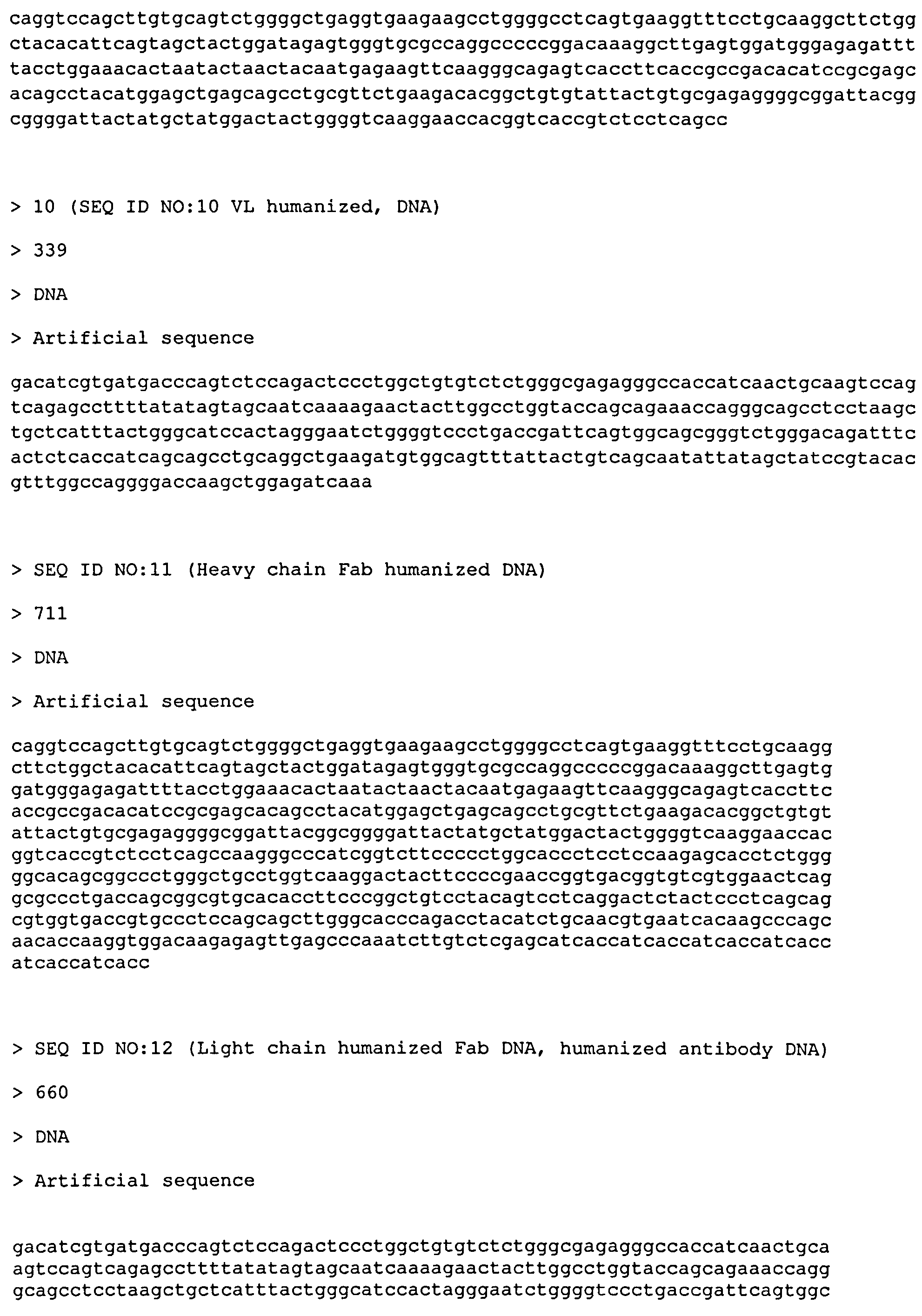
В частности, нуклеотидные последовательности, кодирующие структурные части тяжелой и легкой цепи антитела согласно настоящему изобретению, содержат фрагмент ДНК, кодирующий вариабельный участок тяжелой цепи (VH) (SEQ ID NO: 9) и вариабельный участок легкой цепи (VL) (SEQ ID NO: 10), связанный с фрагментом ДНК, кодирующим консервативные участки обеих цепей, необходимые для функционирования указанного антитела. Нуклеотидные последовательности, кодирующие Fab согласно настоящему изобретению, представлены, но не ограничиваются нуклеотидными последовательностями с 1 по 711 нуклеотид в SEQ ID NO: 11 (тяжелая цепь) и с 1 по 660 нуклеотид в SEQ ID NO: 12 (легкая цепь) (Фиг.3 и 4). Фрагмент ДНК, кодирующий Fab согласно настоящему изобретению, может быть получен любым методом, известным специалисту в данной области техники, включая ПЦР с использованием набора перекрывающихся праймеров, химическим способом и т.д.
Ввиду вырожденности трансляционного кода могут быть различия в последовательности ДНК. Фрагменты ДНК согласно настоящему изобретению не ограничены фрагментами, показанными в SEQ ID NO: 9 или 10, при условии, что они кодируют участки цепей антитела с аминокислотной последовательностью, показанной в SEQ ID NO: 1 или 2.
Фрагменты ДНК, кодирующие гуманизированное антитело и гуманизированный антигенсвязывающий фрагмент (Fab), селективно связывающий человеческий ИФН-γ, может быть встроен в вектор (плазмиду). Под вектором подразумевается плазмида, содержащая набор генетических элементов для экспрессии клонированного фрагмента в бактериальных и эукариотических клетках. В частности, к векторам, способным обеспечивать экспрессию указанных антител в клетках бактерий Escherichia coli, относятся, но не ограничиваются этим перечнем вектора серии pET (Novagen), pQE (Qiagen), pTrc (GE Healthcare). К векторам, способным обеспечивать экспрессию указанных антител в эукариотических клетках, относятся, но не ограничиваются этим перечнем вектора серии pcDNA и pOptiVEC (Invitrogen). Для получения гуманизированного антитела и гуманизированного антигенсвязывающего фрагмента (Fab), селективно связывающего человеческий ИФН-γ, может быть использован любой метод получения рекомбинантных антител, известный специалисту в данной области. включающий в себя
Продукция антитела может быть осуществлена, в частности, в бактериальных и эукариотических клетках. Примером клетки бактерий, пригодных для продукции Fab, согласно настоящему изобретению являются, но не ограничиваются ими, клетки бактерии Escherichia coli. Фраза "бактерии Escherichia coli" означает, что указанные бактерии классифицируют как Escherichia coli (E.coli) в соответствии с классификацией, известной специалисту в данной области микробиологии. Примерами бактерий E.coli, применимых в рамках настоящего изобретения, являются, но не ограничиваются ими, бактерии E.coli BL-21 (DE3) (Novagen).
Примером эукариотической клетки, пригодной для продукции полноразмерного антитела, согласно настоящему изобретению являются, но не ограничиваются ими, клетки яичников Cricetulus griseus (CHO). Фраза "клетки яичников Cricetulus griseus" означает, что указанные эукариотические клетки классифицируют как клетки яичников С.griseus (CHO) в соответствии с классификацией, известной специалисту в данной области биотехнологии. Примерами клеток яичников Cricetulus griseus (CHO), применимых в рамках настоящего изобретения, являются, но не ограничиваются ими, клетки яичников Cricetulus griseus (CHO) клетки CHO DG44 (Invitrogen).
Способом согласно настоящему изобретению является способ получения полноразмерного гуманизированного антитела или его антигенсвязывающего фрагмента, включающий выращивание трансформированных клеток (Escherichia coli, клетки эукариот) в питательной среде и выделение полученных антител из культуральной жидкости. В настоящем изобретении выращивание, накопление и очистка антител из культуральной жидкости может быть осуществлена методом, сходным с традиционными методами ферментации, когда некий белок производится с использованием трансформированных клеток.
Выращивание клеток Escherichia coli осуществляют в аэробных условиях, таких как культивирование с перемешиванием, взбалтывание с аэрации при температуре от 20 до 37°C, предпочтительно от 28 до 30°C. Выращивание обычно продолжают в течение 18-24 часов.
Выращивание клеток эукариот осуществляют в атмосфере 5% CO2 в режиме культивирования с перемешиванием в синтетических средах, таких как среда OptiCHO, в течение нескольких 3-6 суток.
После выращивания твердые компоненты, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрации с использованием мембраны, а затем антитела или Fab могут быть выделены и очищены методом осаждения с солями с использованием сульфата натрия или сульфата аммония, аффинной хроматографии, ионообменной хроматографии, ионообменной хроматографии и т.п.
Осуществление изобретения
Последующие примеры приведены для целей объяснения и не ограничивают каким-либо образом рамки настоящего изобретения.
Пример 1. Получение клеток гибридом, продуцирующих мышиные моноклональные антитела против ИФН-γ
Мыши линии Balb/c в возрасте 8 недель были иммунизированы введением внутрибрюшинно 50 мкг рекомбинантного человеческого ИФН-γ трижды с двухнедельными интервалами. Для первой иммунизации раствор антигена был смешан с равным объемом полного адъюванта Фрейнда до образования гомогенной эмульсии. Подобным образом, но с использованием неполного адъюванта Фрейнда был приготовлен антиген для второй иммунизации. Для третьей, и последней, иммунизации использовался раствор 50 мкг ИФН-γ в буфере PBS.
На 4-й день после третьей иммунизации у мышей была взята кровь для получения сыворотки, которая использовалась в качестве положительного контроля. Селезенка была гомогенизирована, половина полученных лимфоцитов была заморожена в жидком азоте с добавлением диметилсульфоксида до 10%, остаток лимфоцитов был слит с клетками миеломы штамма SP2/0 с использованием 50% PEG4000 в соответствии со стандартным протоколом.
Клетки были высеяны на 96-луночные планшеты в среде DMEM с добавлением L-глютамина, пирувата натрия, гентамицина, НАТ (гипоксантин, аминоптерин, тимидин) и 8% фетальной сыворотки. Предварительно в лунки была внесена суспензия клеток-помощников - перитонеальных макрофагов, полученных промыванием перитонеальной полости здоровых мышей. Первичный рост культур оценивали визуально с помощью микроскопа. На 10-12 день после гибридизации супернатанты из лунок были проверены на содержание специфических антител методом ИФА.
Первичные культуры из лунок, содержащих моноклональные антитела (МоАТ), были дважды клонированы методом лимитирующих разведений в среде DMEM с теми же добавками, что и при первичном посеве, за исключением НАТ, на слое клеток-помощников. Положительные клоны, при необходимости, были реклонированы еще 1-3 раза, после чего были определены изотипы МоАт с использованием метода ИФА.
Пример 2. Выделение моноклональных антител против человеческого ИФН-γ и определение константы их взаимодействия с ИФН-γ
Выбранные клоны гибридом были инокулированы в мышей, предварительно праймированных пристанем. Асциты собирали на 7-10 день после инокуляции клеток. Все МоАТ были выделены из асцитных жидкостей аффинной хроматографией на Protein G-сефарозе и диализованы против буфера PBS. Концентрация была измерена спектрофотометрически при длине волны 280 нм. Коэффициент экстинкции (E) иммуноглобулинов с концентрацией 1 мг/мл равен 1,4.
Асциты были взяты в объеме 6 мл, разведены в MES-буфере 1:4 и очищены методом хроматографии на колонке с Protein G-сефарозой.
Константы диссоциации МоАТ определяли в соответствии с методикой, предложенной Klotz I.M. (The Proteins. Ed. H. Neurath and K. Bailey Academic Press, New York. 1953. V.1. P.727), с модификациями из В. Friguet и др. (В. Friguet et. al. Measurements of the True Affinity Constant in Solution of Antigen-Antibody Complex by Enzyme-Linked Immunosorbent Assay. Journal of Immunological Methods, 77 (1985) 305-319).
Для установления равновесия в системе антиген-антитело в лунки планшета для ИФА, предварительно блокированные 0,25% желатином, вносили 50 мкл рекомбинантного человеческого ИФН-γ в концентрации 10-10 М в PBS-AT (PBS, 2 мг/мл BSA, 0.1% Tween 20) по три дорожки каждого и титровали серией двукратных разведении антител в объеме 50 мкл нужной концентрации. Проводили инкубацию при комнатной температуре на шейкере в течение двух часов. После инкубации содержимое всех лунок переносили в другой планшет, лунки которого предварительно покрывали рекомбинантным человеческим ИФН-γ в концентрации 5 мкг/мл в PBS, инкубировали 1 час, отмывали буфером PBS-T (PBS, 0.05% Tween 20) и добавляли 100 мкл конъюгата пероксидазы хрена с анти-мышиными IgG. После инкубации в течение 1 часа и отмывки добавляли раствор субстрата ТМВ. Через 20 мин реакцию останавливали добавлением равного объема 10% H2SO4 и проводили измерение оптической плотности при длине волны 450 нм на приборе Multiscan (Thermo Scientific).
Константы диссоциации рассчитывали в соответствии с уравнением Клотца:
Ao/Ao-A=1+1/a Kd, где
Ao - оптическая плотность, измеренная в лунках в отсутствие антигена,
A - оптическая плотность, измеренная для свободных антител в смеси антиген-антитело,
a - концентрация антигена.
Значения этих параметров для антитела F1 против человеческого ИФН-γ приведены в таблице. Концентрация антител для определения Kd выбрана в линейной части калибровочной кривой и составляла 30 нг/мл для антитела F1.
|
Как видно из приведенных данных, моноклональное антитело связывается с антигеном с высокой аффинностью, так как конечная точка титрования соответствует концентрации моноклонального антитела 3 нг/мл.
В результате проведенных вычислений было получено следующее значение константы диссоциации моноклонального антитела:
Kd(F1)=1,7×10-9 M
Пример 3. Клонирование и секвенирование последовательностей кДНК, кодирующих вариабельные домены мышиного антитела F1 против человеческого ИФН-γ
На первом этапе были выделены гены вариабельных доменов легкой и тяжелой цепей МоАТ F1. Из 1-2×106 клеток гибридомы F1 выделяли тотальную РНК с помощью реагента Trizol (Invitrogen) согласно рекомендуемому производителем протоколу. С помощью реакции обратной транскрипции была синтезирована кДНК, кодирующая вариабельные фрагменты легкой и тяжелой цепей МоАТ. Для амплификации данных последовательностей были использованы следующие праймеры:
SMRibo (SEQ ID NO: 13) 5'-AAGCAGTGGTATCAACGCAGAGTACGCrGrGrG
RT-KAP (SEQ ID NO: 14) 5'-GAGTCAGCACACGAAGAACTTG
NesG (SEQ ID NO: 15) 5'-CAGGGGCCAGTGGATAGAC
Полученные ПЦР-фрагменты длиной около 450 п.о. клонировали во вспомогательный вектор pAL-TA (Евроген), после чего с помощью секвенирования были определены нуклеотидные последовательности. Полученные последовательности оценивали с помощью сравнения с гомологичными последовательностями, находящимися в базе данных GeneBank (IgBlast), что подтвердило их принадлежность к генам вариабельных доменов тяжелой и легкой цепи антител Mus musculus. Таким образом, были получены нуклеотидные последовательности SEQ ID NO: 3 и SEQ ID NO: 4.
Пример 4. Дизайн вариабельных областей фрагмента Fab гуманизированного антитела F1 и конструирование генов, кодирующих фрагмент Fab гуманизированного антитела F1 против человеческого ИФН-γ
Для сохранения аффинности мышиного антитела F1 в гуманизированном варианте в основном был использован метод Queen и др. (Queen et al. Proc. Natl. Acad. Sci. USA 86: 10029 (1989) and U.S. Pat. Nos. 5,585,089 and 5,693,762). Выбор источника последовательностей каркасных областей для гуманизированного антитела может быть критичным для сохранения аффинности антитела. В принципе, последовательности каркасных областей любого человеческого антитела могут служить в качестве матрицы для пересадки CDR-областей; однако было показано, что простая замена CDR-областей в таком человеческом антителе может приводить к значительному снижению аффинности по отношению к антигену (Tempest et al., Biotechnology 9: 266 (1992)). Чем выше гомология между последовательностями человеческого и мышиного антитела, тем меньше вероятность внесения человеческими каркасными областями искажений в структуру CDR-последовательностей, приводящих к снижению аффинности.
С использованием базы данных IgBlast из последовательностей функциональных вариабельных областей антител зародышевой линии человека были выбраны последовательности с наибольшей степенью гомологии по отношению к аминокислотным последовательностям вариабельных доменов мышиного антитела F1 - IGHV1-3*01-IGHJ6*01 и IGKV4-1*01-IGKJ2*01 для тяжелой и легкой цепи соответственно. На основании литературных данных и анализа пространственной модели вариабельных фрагментов легкой и тяжелой цепей мышиного антитела F1 против ИФН-γ, полученных с помощью сервера Rosetta (Rosetta antibody modeling server), были выбраны аминокислотные остатки в последовательностях человеческих каркасных областей тяжелой цепи, обратная замена которых на соответствующие остатки в мышином антителе F1, вероятно, приведет к восстановлению аффинности гуманизированного антитела F1. В результате проверки нескольких вариантов обратных замен были получены последовательности вариабельных доменов гуманизированного антитела F1, содержащие две обратные замены в тяжелой цепи: I69F и R71A (SEQ ID NO: 1 и SEQ ID NO: 2). Гены вариабельных доменов легких и тяжелых цепей гуманизированного Fab против ИФН-γ синтезировали из набора перекрывающихся олигонуклеотидов с помощью ПЦР. Фрагменты ДНК, кодирующие гены вариабельных доменов легких и тяжелых цепей гуманизированного Fab против ИФН-γ, с помощью метода ПЦР с перекрывающимися областями были объединены с генами константного домена легкой цепи человека каппа Cκ и константного домена тяжелой цепи IgG1 человека CH1 соответственно (SEQ ID NO: 11 и SEQ ID NO: 12).
Пример 5. Получение антигенсвязывающих фрагментов (Fab) против человеческого ИФН-γ в клетках E.coli
Гены, кодирующие фрагмент Fab гуманизированного антитела против человеческого ИФН-γ, были клонированы в экспрессионный вектор, описанный в статье (Калиниченко А.А. и др. Биоорганическая химия 36(1): 122-132, 2010), который был использован для синтеза фрагмента Fab гуманизированного антитела F1 в клетках E.coli. Для биосинтеза рекомбинантного Fab-фрагмента гуманизированного антитела F1 использовали метод автоиндукции, для чего клетки выращивали в питательной среде 2ZY, содержащей 2 мМ MgSO4, 25 мМ Na2HPO4, 25 мМ KH2PO4, 50 мМ NH4Cl, 5 мМ Na2SO4, 0.5% глицерина, 0.05% глюкозы, 0.2% моногидрата α-лактозы и ампициллин, в течение 20 ч при температуре 30°C. Оптическая плотность культуры к моменту завершения инкубации достигала 7 OE600. После завершения инкубации клетки осаждали, культуральную жидкость, содержащую целевой белок, концентрировали с помощью тангенциальной фильтрации через мембрану с нижней границей удержания 30 кДа (Millipore) и диализовали против буфера, содержащего 47 мМ K2HPO4, 3 мМ KH2PO4, 500 мМ KCl, 0,001% PMSF, pH 8.0. Полученный раствор наносили на Co2+-ИДА-сефарозу (GE Healthcare, США), уравновешенную калиево-фосфатным буфером, используемым для диализа. Белок элюировали фосфатно-солевым буфером (ФСБ) pH 7.4, содержащим 300 мМ имидазола. Наличие и чистоту целевого белка во фракциях анализировали с помощью электрофореза в восстанавливающих условиях в 12,5% ПААГ по методу Лэммли. Фракции, содержащие целевой белок соответствующего размера, объединяли и концентрировали с помощью концентратора Amicon Ultra (Millipore) с нижней границей удержания 30 кДа, после чего разбавляли буфером и наносили на колонку Superdex 75-10/300-GL (GE Healthcare). Фракция, выходящая на 22 минуте, была собрана, сконцентрирована и диализована против ФСБ, pH 7.4.
В результате был получен Fab-фрагмент гуманизированного антитела против человеческого ИФН-γ, отличающееся тем, что вариабельный участок тяжелой цепи (VH) указанного антитела содержит последовательность аминокислот SEQ ID NO: 1, a вариабельный участок легкой цепи (VL) указанного антитела содержит последовательность аминокислот SEQ ID NO: 2.
Пример 6. Получение полноразмерного гуманизированного антитела против человеческого ИФН-γ в клетках линии CHO
Конструирование фрагмента ДНК, кодирующего нуклеотидную последовательность тяжелой цепи полноразмерного гуманизированного антитела против человеческого ИФН-γ проводили последовательным присоединением к нуклеотидной последовательности SEQ ID NO: 9 фрагмента ДНК, кодирующего 5'-нетранслируемую область; последовательности лидерного пептида, обеспечивающего секрецию иммуноглоболинов; константных доменов CH1-CH3 тяжелой цепи человека IgG1-подкласса; фрагмента ДНК, кодирующего 3'-нетранслируемую область и содержащего сайт полиаденилирования.
Конструирование фрагмента ДНК, кодирующего нуклеотидную последовательность легкой цепи полноразмерного гуманизированного антитела против человеческого ИФН-γ, проводили последовательным присоединением к нуклеотидной последовательности SEQ ID NO: 10 следующих нуклеотидных последовательностей: фрагмента ДНК, кодирующего 5'-нетранслируемую область; последовательности лидерного пептида, обеспечивающего секрецию иммуноглоболинов; константного домена легкой цепи человека каппа-подкласса; фрагмента ДНК, кодирующего 3'-нетранслируемую область и содержащего сайт полиаденилирования.
Объединение указанных фрагментов в случае легкой цепи антитела осуществляли посредством метода ПЦР с перекрыванием амплифицируемых фрагментов (SOE-PCR). В случае тяжелых цепей присоединение 5'-нетранслируемой области и последовательности лидерного пептида также осуществляли методом SOE-PCR, в то время как присоединение константных доменов CH1-CH3 тяжелой цепи человека IgG1-подкласса и 3'-нетранслируемой области, содержащей сайт полиаденилирования, производили рестрикцией-лигированием по Apa I-сайту, присутствующему на 5'-конце нуклеотидной последовательности человеческого CH1 домена.
На 5'-конце полученных таким образом нуклеотидных последовательностей был размещен сайт рестрикции Nhe I, а на 3'-конце - сайт рестрикции Xho I. В результате был получен фрагмент ДНК, включающий в себя нуклеотидную последовательность зрелой тяжелой цепи полноразмерного гуманизированного антитела против человеческого ИФН-γ (SEQ ID NO: 13) и фрагмент ДНК, включающий в себя нуклеотидную последовательность зрелой легкой цепи полноразмерного гуманизированного антитела против человеческого ИФН-γ. Последовательность легкой цепи полноразмерного гуманизированного антитела против человеческого ИФН-γ полностью соответствует SEQ ID NO: 12.
Полученные нуклеотидные последовательности тяжелой и легкой цепей гуманизированного антитела были по отдельности встроены по NheI-XhoI сайтам в вектор pcDNA 3.1 (Invitrogen). Таким образом, были получены плазмиды pcDNA-L и pcDNA-H, содержащие легкую и тяжелую цепь гуманизированного антитела, соответственно.
Полученные экспрессионные плазмиды использовали для трансфекции клеток CHO. До трансфекции клетки CHO культивировали при 37°C в атмосфере 5% CO2 в среде DMEM, содержащей 10% телячью сыворотку с пониженным содержанием иммуноглобулинов. Клетки высевали на 60 мм чашки и культивировали до плотности 90-95% до трансфекции. После проведения трансфекции клетки продолжали инкубировать 72 ч без замены среды. После инкубирования собирали культуральную среду, центрифугировали 1,500 rpm 5 мин и сохраняли супернатант.
Выделение антител проводили с использованием метода аффинной хроматографии. Для выделения белкового препарата из фильтрованной среды использовали подготовленную колонку необходимого размера, содержащую Protein A - сефарозу (GE Healthcare). Объем носителя составлял не менее 5 мл.
Для уравновешивания колонки с Protein A - сефарозой колонку промывали 5-10 объемами отмывочного буфера, 50 мМ Трис-HCl, pH 7.0. Затем в колонку вносили диализованную против отмывочного буфера культуральную жидкость. После протекания концентрата через колонку и связывания белка колонку промывали 3-10 объемами отмывочного буфера.
Элюирование связанных антител проводили с помощью элюирующего буфера, 100 мМ Глицин, pH 3.0. Непосредственно после прохождения элюирующего буфера через колонку он смешивается в соотношении 20:1 с нейтрализующим буфером, 1 M Трис-HCl, pH 9.0 для восстановления нормального значения pH и сохранения связывающей способности антител. Осуществляли фракционную элюцию белка с колонки, для этого на колонку последовательно наносили 5-6 порций буфера для элюции, каждая из которых равна объему колонки. Каждая фракция после элюции смешивалась в соотношении 20:1 с нейтрализующим буфером, собиралась отдельно и затем исследовалась на наличие требуемого белка. Для этих целей использовали электрофоретический и хроматографический анализы. Фракции, содержащие искомые антитела, объединяли. В окончательном виде полученный образец гуманизированных антител к ИФН-γ был сконцентрирован и диализован относительно фосфатного буфера (pH 7,4).
В результате было получено полноразмерное антитело IgG против человеческого ИФН-γ, содержащего аминокислотные последовательности SEQ ID NO: 12 и SEQ ID NO: 13.
Пример 7. Характеристика аффинности фрагмента Fab гуманизированного антитела F1 против человеческого ИФН-γ, произведенного в клетках E.coli
Определение константы диссоциации (Kd) фрагмента Fab гуманизированного антитела F1 определяли в ходе двухступенчатого метода ИФА, как описано в Примере 2. Было установлено, что Kd для фрагмента Fab гуманизированного антитела F1 против человеческого ИФН-γ составляет 4,6×10-9 М.
Пример 8. Определение нейтрализующей активности фрагмента Fab гуманизированного антитела против человеческого ИФН-γ
Экспрессия антигена HLA-DR была индуцирована на клетках U937, как было описано ранее (Gao J, Folghera S, Fiorentini S et al. The influence of fetal calf serum on interferon-γ induced HLA-DR expression on U937 cells. J Biol Regul Homeost Agents 1993; 7: 115-20). Кратко, 2×105 клеток инкубировались в течение 24 часов при 37°C в среде, содержащей 10 U/мл рИФН-γ (Prospec, Israel). МоАТ и Fab-фрагменты МоАТ добавлялись к клеткам в диапазоне концентраций от 200 нМ до 1,5 нМ (в двукратных разведениях). В качестве отрицательного контроля использовались клетки U937, которые культивировались в среде без добавок. В качестве положительного контроля использовались клетки U937, которые культивировались в среде с добавлением рИФН-γ. FITC-меченные анти-HLA-DR МоАТ были использованы для обнаружения молекул HLA-DR на поверхности клеток U937. Анализ проводился с использованием FACScan цитофлуориметра (Becton-Dickinson, San Jose, СА). Параметр IC50 рассчитывался как концентрация антитела, при которой доля HLA-DR-положительных клеток составляет половину от разницы значений положительного и отрицательного контролей. Таким образом, было определено, что фрагмент Fab гуманизированного антитела F1 обладает нейтрализующей активностью по отношению к человеческому ИФН-γ, IC50 в тесте на клетках U937 составила менее 1,5 нМ.
Перечень последовательностей
SEQ ID NO:1
> 1
> 123
>PRT
> Artificial sequence
> Humanized VH fragment of heavy chain
QVQLVQSGAEVKKPGASVKVSCKASGYTFSSYWIEWVRQAPGQRLEWMGEILPGNTNTNYNGKFKGRVTFTADTSASTAYMELSSLRSEDTAVYYCARGADYGGDYYAMDYWGQGTTVTVSSA
SEQ ID NO:2
> 113
>PRT
> Artificial sequence
> Humanized VL fragment of light chain
DIVMTQSPDSLAVSLGERATINCKSSQSLLYSSNQKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQYYSYPYTFGQGTKLEIK
> 3 (SEQ ID NO:3 - VH gene, murine, DNA)
> DNA
> Mouse Balb/c
caggttcagctgcagcagtctggagctgagctgatgaagcctggggcctcagtgaagatatcctgcaaggcaactggctacacattcagtagctactggatagagtggataaagcagaggcctggacatggccttgagtggattggagagattttacctggaaacactaatactaactacaatgagaagttcaagggcaaggccacattcactgcagatacaacttccaacacagcctacatgcaactcagcagcctgacatctgaagactctgccgtctattactgtgcaagaggggcggattacggcggggattactatgctatggactactggggtcaaggaacctcagtcaccgtctcctcagcc
> 4 (SEQ ID NO:4 - VL gene, murine, DNA)
> DNA
> Mouse Balb/c
gacattgtgatgtcacagtctccatcctccctagctgtgtcaattggagagaaggttactatgagctgcaagtccagtcagagccttttatatagtagcaatcaaaagaactacttggcctggtaccagcagaaaccagggcagtctcctaaactgctgatttactgggcatccactagggaatctggggtccctgatcgcttcacaggcagtggatctgggacagatttcactctcaccatcagcagtatgaaggctgaagacctggcagtttattactgtcagcaatattatagctatccgtacacgttcggaggggggaccaagctggaaatcaaa
> 5 (SEQ ID NO:5 - VH seq, murine, AA)
> PRT
> Mouse Balb/c
QVQLQQSGAELMKPGASVKISCKATGYTFSSYWIEWIKQRPGHGLEWIGEILPGNTNTNYNEKFKGKATFTADTTSNTAYMQLSSLTSEDSAVYYCARGADYGGDYYAMDYWGQGTSVTVSSA
> 6 (SEQ ID NO:6 - VL seq, murine, AA)
> PRT
> Mouse Balb/c
DIVMSQSPSSLAVSIGEKVTMSCKSSQSLLYSSNQKNYLAWYQQKPGQSPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSMKAEDLAVYYCQQYYSYPYTFGGGTKLEIK
> 7 (SEQ ID NO:7 -Heavy chain seq, humanized Fab, AA)
> PRT
> Artificial sequence
> Heavy chain of humanized Fab
QVQLVQSGAEVKKPGASVKVSCKASGYTFSSYWIEWVRQAPGQRLEWMGEILPGNTNTNYNGKFKGRVTFTADTSA
STAYMELSSLRSEDTAVYYCARGADYGGDYYAMDYWGQGTTVTVSSAKGPSVFPLAPSSKSTSGGTAALGCLVKDY
FPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCLEHHH
HHHHHHHHH
> 8 (SEQ ID NO:8 -Light chain seq, humanized Fab, humanized antibody, AA)
> PRT
> Artificial sequence
> Light chain of humanized Fab
DIVMTQSPDSLAVSLGERATINCKSSQSLLYSSNQKNYLAWYQQKPGQPPKLLIYWASTRESGVPDRFSGSGSGTD
FTLTISSLQAEDVAVYYCQQYYSYPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQKLKSGTASVVCLLNNFYPREAK
VQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
> 9 (SEQ ID NO:9 VH humanized, DNA)
> 369
> DNA
> Artificial sequence
caggtccagcttgtgcagtctggggctgaggtgaagaagcctggggcctcagtgaaggtttcctgcaaggcttctggctacacattcagtagctactggatagagtgggtgcgccaggcccccggacaaaggcttgagtggatgggagagattttacctggaaacactaatactaactacaatgagaagttcaagggcagagtcaccttcaccgccgacacatccgcgagcacagcctacatggagctgagcagcctgcgttctgaagacacggctgtgtattactgtgcgagaggggcggattacggcggggattactatgctatggactactggggtcaaggaaccacggtcaccgtctcctcagcc
> 10 (SEQ ID NO:10 VL humanized, DNA)
> 339
> DNA
> Artificial sequence
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaagtccagtcagagccttttatatagtagcaatcaaaagaactacttggcctggtaccagcagaaaccagggcagcctcctaagctgctcatttactgggcatccactagggaatctggggtccctgaccgattcagtggcagcgggtctgggacagatttcactctcaccatcagcagcctgcaggctgaagatgtggcagtttattactgtcagcaatattatagctatccgtacacgtttggccaggggaccaagctggagatcaaa
> SEQ ID NO:11 (Heavy chain Fab humanized DNA)
> 711
> DNA
> Artificial sequence
caggtccagcttgtgcagtctggggctgaggtgaagaagcctggggcctcagtgaaggtttcctgcaagg cttctggctacacattcagtagctactggatagagtgggtgcgccaggcccccggacaaaggcttgagtg gatgggagagattttacctggaaacactaatactaactacaatgagaagttcaagggcagagtcaccttc accgccgacacatccgcgagcacagcctacatggagctgagcagcctgcgttctgaagacacggctgtgt attactgtgcgagaggggcggattacggcggggattactatgctatggactactggggtcaaggaaccac ggtcaccgtctcctcagccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctggg
ggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcag gcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcag cgtggtgaccgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagc aacaccaaggtggacaagagagttgagcccaaatcttgtctcgagcatcaccatcaccatcaccatcacc atcaccatcacc
> SEQ ID NO:12 (Light chain humanized Fab DNA, humanized antibody DNA)
> 660
> DNA
> Artificial sequence
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgca agtccagtcagagccttttatatagtagcaatcaaaagaactacttggcctggtaccagcagaaaccagg gcagcctcctaagctgctcatttactgggcatccactagggaatctggggtccctgaccgattcagtggc agcgggtctgggacagatttcactctcaccatcagcagcctgcaggctgaagatgtggcagtttattact gtcagcaatattatagctatccgtacacgtttggccaggggaccaagctggagatcaaacggactgtggc
tgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgc
ctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggta actcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgct gagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgccc gtcacaaagagcttcaacaggggagagtgt
> SEQ ID NO:13 (Heavy chain humanized antibody DNA)
caggtccagcttgtgcagtctggggctgaggtgaagaagcctggggcctcagtgaaggtttcctgcaagg cttctggctacacattcagtagctactggatagagtgggtgcgccaggcccccggacaaaggcttgagtg gatgggagagattttacctggaaacactaatactaactacaatgagaagttcaagggcagagtcaccttc accgccgacacatccgcgagcacagcctacatggagctgagcagcctgcgttctgaagacacggctgtgt attactgtgcgagaggggcggattacggcggggattactatgctatggactactggggtcaaggaaccac ggtcaccgtctcctcagccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgggtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga
> SEQ ID NO:14 (Heavy chain humanized antibody, AA)
QVQLVQSGAEVKKPGASVKVSCKASGYTFSSYWIEWVRQAPGQRLEWMGEILPGNTNTNYNGKFKGRVTFTADTSA
STAYMELSSLRSEDTAVYYCARGADYGGDYYAMDYWGQGTTVTVSSAKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK