Результат интеллектуальной деятельности: ЛИОФИЛИЗИРОВАННЫЙ СОСТАВ НА ОСНОВЕ HGF
Вид РИД
Изобретение
[0001]
Настоящее изобретение относится к лиофилизированному составу, содержащему фактор роста гепатоцитов.
УРОВЕНЬ ТЕХНИКИ
[0002]
Фактор роста гепатоцитов (HGF) представляет собой биологически активный пептид, обладающий пролиферативной активностью по отношению к паренхимным клеткам печени и обнаруженный у различных видов животных. У людей фактор роста гепатоцитов человека (hHGF) был обнаружен в плазме крови у пациентов с фульминантным гепатитом (патентный источник 1), и в последние годы рекомбинантный фактор роста гепатоцитов человека (rhHGF) может быть произведен в большом количестве с помощью биотехнологии (непатентный источник 1). Предполагается, что такие факторы роста гепатоцитов могут применяться в качестве терапевтических и профилактических средств, эффективных в отношении гепатита и цирроза за счет увеличения количества нормальных паренхимных клеток печени, а также за счет их различных биологических функций, в качестве лекарственных средств при почечной недостаточности и патологических изменениях в желудке, двенадцатиперстной кишке, кожи и т. п., возникающих вследствие побочных действий противораковых средств.
[0003]
Лиофилизированный состав, содержащий фактор роста гепатоцитов, который был раскрыт в патентном источнике 2, содержит фактор роста гепатоцитов и стабилизирующее средство, такое как глицин, аланин, сорбит, маннит или декстрана сульфат.
В патентном источнике 3 раскрывается лиофилизированный состав, содержащий фактор роста гепатоцитов в концентрации до менее 5 мг/мл, что является пригодным для медикаментов, этот состав содержит стабилизирующее средство, такое как аргинин, лизин, гистидин, глутаминовая кислота или аспарагиновая кислота.
В патентном источнике 4 раскрывается лиофилизированный состав, содержащий фактор роста гепатоцитов и стабилизирующее средство, такое как очищенная сахароза.
ПЕРЕЧЕНЬ ЦИТИРОВАННЫХ ИСТОЧНИКОВ
ПАТЕНТНАЯ ЛИТЕРАТУРА
[0004]
[Патентный источник 1] Патентная публикация JP-A-S63-22526
[Патентный источник 2] Патентная публикация JP-A-H9-25241
[Патентный источник 3] WO 2000/072873
[Патентный источник 4] WO 2008/102849
НЕПАТЕНТНАЯ ЛИТЕРАТУРА
[0005]
[Непатентный источник 1] Nature, vol.342, p.440-443, 1989
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, РЕШАЕМЫЕ С ПОМОЩЬЮ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0006]
Однако лиофилизированные составы, содержащие фактор роста гепатоцитов, которые были раскрыты в патентных публикациях JP-A-H9-25241, WO 2000/072873 и WO 2008/102849, которые предназначены для увеличения стабильности фактора роста гепатоцитов, все еще не способны обеспечить достаточную устойчивость при хранении.
Кроме того, не известно, как уменьшить образование примесей вместе с фактором роста гепатоцитов, или как сохранить установленное перед хранением соотношение изоформ в лиофилизированных составах, содержащих фактор роста гепатоцитов.
[0007]
Следовательно, задачей настоящего изобретение является получение лиофилизированного состава, обладающего улучшенной устойчивостью при хранении фактора роста гепатоцитов по сравнению с традиционными лиофилизированными составами.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧИ
[0008]
Авторы настоящего изобретения провели тщательное изучение достижения вышеописанной задачи и, вследствие этого, было обнаружено, что возможно достичь цели в отношении лиофилизированного состава, содержащего (1) фактор роста гепатоцитов, (2) трегалозу и (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей. Таким образом, авторами настоящего изобретения реализовано настоящее изобретение.
[0009]
Настоящее изобретение предусматривает следующее:
[1] лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, (2) трегалозу и (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей;
[2] способ получения лиофилизированного состава, включающий стадии:
(I) перед добавлением (1) фактора роста гепатоцитов регулирования pH водного раствора, содержащего по меньшей мере (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, до pH 4,5-6,5, и получения водного раствора, содержащего (1) фактор роста гепатоцитов, (2) трегалозу и (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей; и
(II) лиофилизации водного раствора, содержащего фактор роста гепатоцитов, полученного на стадии (I);
[3] способ стабилизации фактора роста гепатоцитов посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов;
[4] способ стабилизации фактора роста гепатоцитов посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, с целью уменьшения образования агрегатов фактора роста гепатоцитов, уменьшения образования примесей вместе с фактором роста гепатоцитов и/или сохранения установленного перед хранением соотношения изоформ;
[5] способ стабилизации фактора роста гепатоцитов посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, с целью уменьшения образования агрегатов фактора роста гепатоцитов;
[6] способ стабилизации фактора роста гепатоцитов посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, с целью уменьшения образования примесей вместе с фактором роста гепатоцитов;
[7] способ стабилизации фактора роста гепатоцитов посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, с целью сохранения установленного перед хранением соотношения изоформ фактора роста гепатоцитов; и
[8] пункты [1]-[7], описанные выше, где фактор роста гепатоцитов содержит аминокислотную последовательность, представленную SEQ ID NO: 1.
ПОЛЕЗНЫЙ ЭФФЕКТ
[0010]
С помощью настоящего изобретения можно получить лиофилизированный состав, обладающий улучшенной устойчивостью при хранении фактора роста гепатоцитов по сравнению с традиционными лиофилизированными составами.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0011]
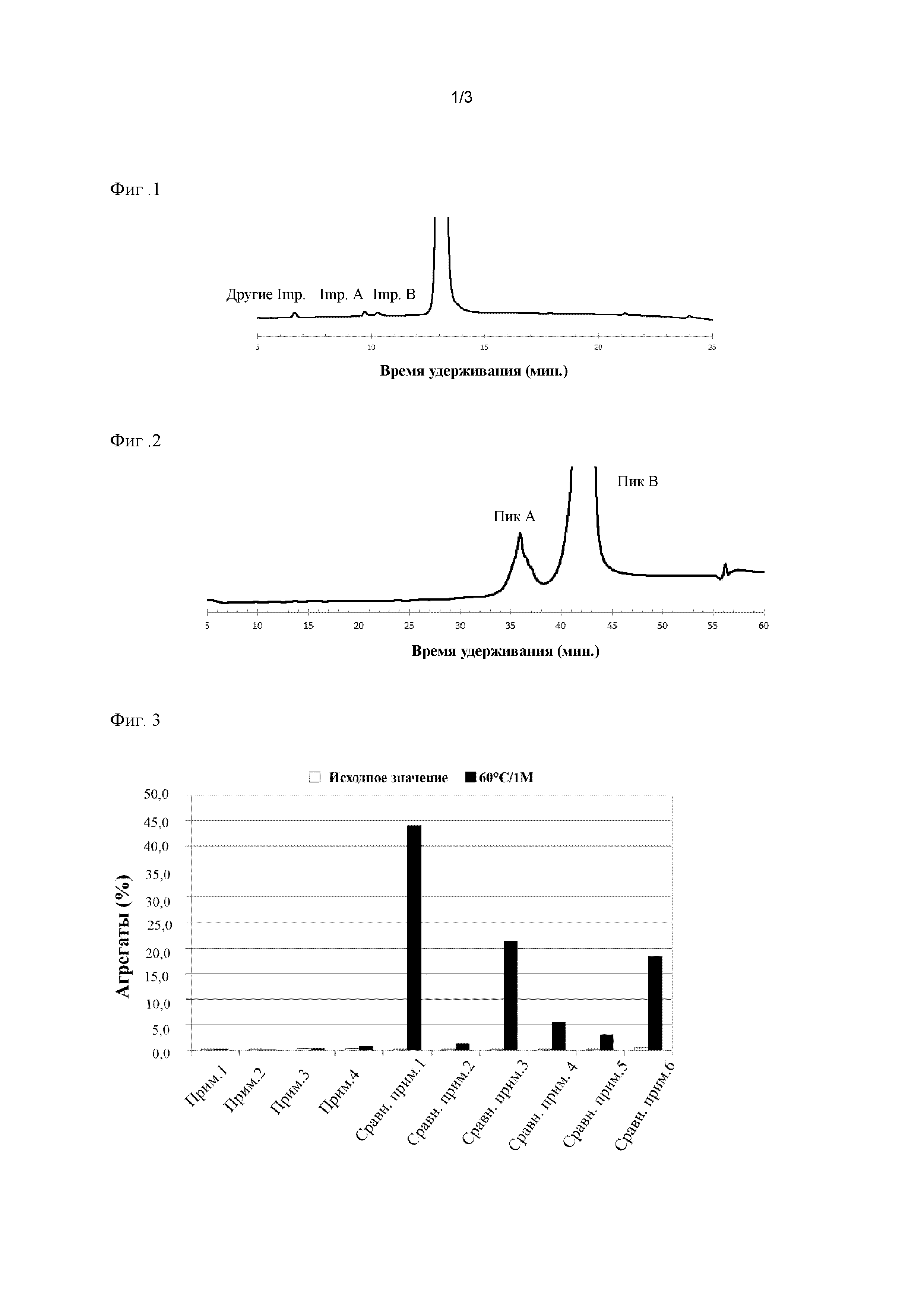
Фиг. 1 представляет собой иллюстративную хроматограмму примесей вместе с фактором роста гепатоцитов;
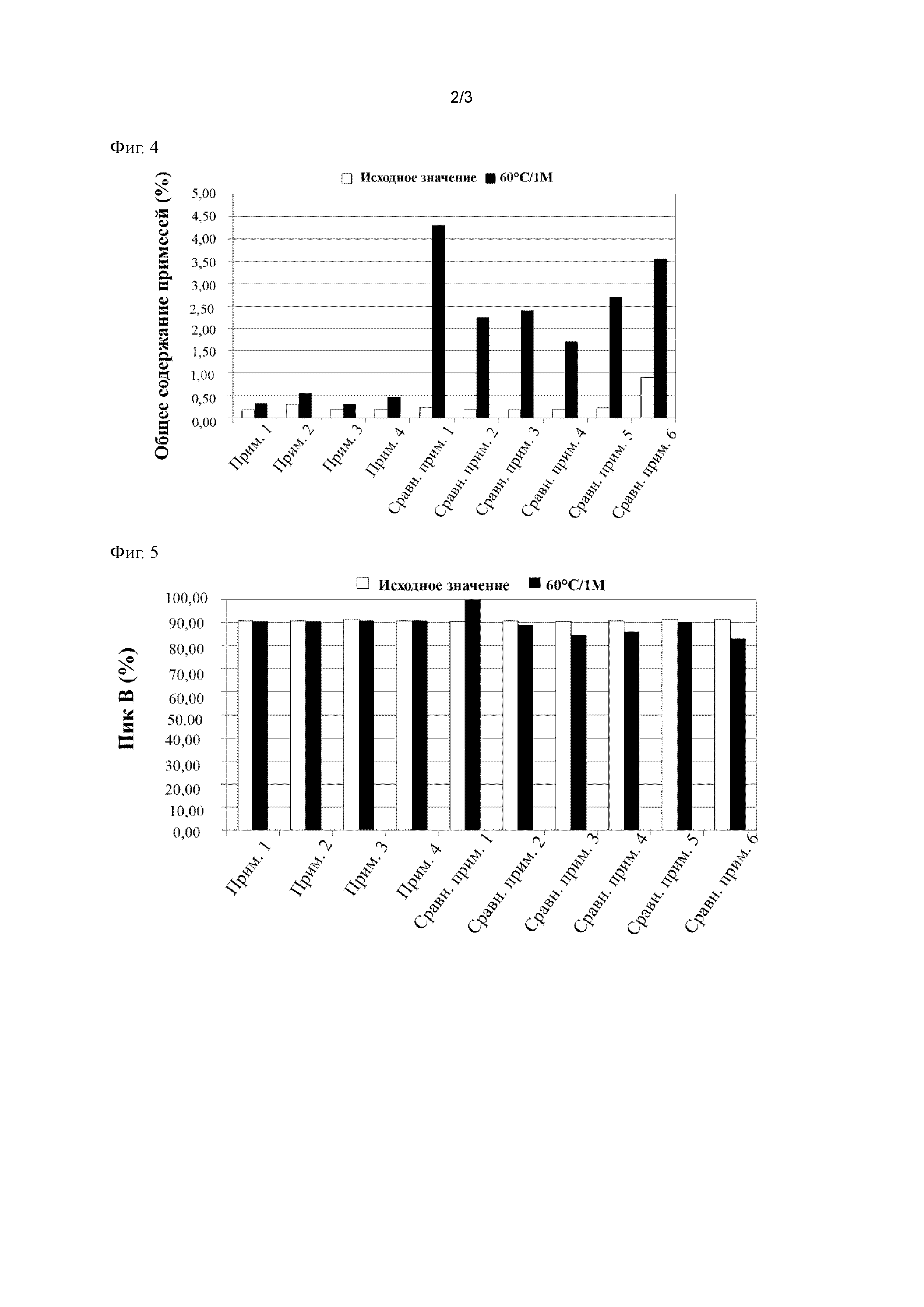
фиг. 2 представляет собой иллюстративную хроматограмму изоформ фактора роста гепатоцитов;
на фиг. 3 показано количество растворимых агрегатов в лиофилизированных составах, испытываемых в испытательном примере 2, в исходном состоянии и после хранения при 60°C в течение 1 месяца;
на фиг. 4 показано общее количество примесей в лиофилизированных составах, испытываемых в испытательном примере 3, в исходном состоянии и после хранения при 60°C в течение 1 месяца;
на фиг. 5 показано соотношение пика В по отношению к изоформам в лиофилизированных составах, испытываемых в испытательном примере 4, в исходном состоянии и после хранения при 60°C в течение 1 месяца;
на фиг. 6 показана корреляция между содержанием трегалозы и соотношением пика В по отношению к изоформам в лиофилизированных составах, испытываемых в испытательном примере 4; и
на фиг. 7 показана корреляция между содержанием аргинина и соотношением пика В по отношению к изоформам в лиофилизированных составах, испытываемых в испытательном примере 4.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0012]
Варианты осуществления настоящего изобретения конкретно описаны далее в данном документе. Настоящее изобретение не ограничено вариантами осуществления, описанными ниже, и может быть различным образом модифицировано в пределах объема настоящего изобретения.
[0013]
Лиофилизированный состав согласно настоящему изобретению содержит (1) фактор роста гепатоцитов, (2) трегалозу и (3) одно или несколько соединений (далее в данном документе также называемых "соединение (3)"), выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей.
Фактор роста гепатоцитов для применения в настоящем изобретении представляет собой белок, обладающий активностью в отношении стимуляции роста паренхимных клеток печени и конкретно не ограничен степенью очистки, при которой он может быть использован в качестве лекарственного препарата. Например, в качестве ссылки может быть приведена патентная публикация JP-A-H11-56382.
[0014]
Фактор роста гепатоцитов может представлять собой любой таковой, естественно встречающийся в тканях органов, таких как печень, селезенка и почки млекопитающих, или в жидких тканях, таких как плазма и сыворотка крови, или таковой, модифицированный вариантной аминокислотной последовательностью и/или вариантными углеводными цепями. Примеры млекопитающих включают людей, крыс, кроликов, коров, лошадей, овец и т.п., среди которых люди являются предпочтительными. Примеры аминокислотных последовательностей фактора роста гепатоцитов человека включают SEQ ID NO: 1.
Фактор роста гепатоцитов может быть извлечен и очищен из тканей органов, таких как печень, селезенка и почки млекопитающих, и из жидких тканей, таких как плазма и сыворотка крови, или выделен из клеток, продуцирующих фактор роста гепатоцитов.
Фактор роста гепатоцитов может быть получен посредством введения в соответствующую клетку-хозяин соответствующего вектора, в который был введен полинуклеотид, кодирующий фактора роста гепатоцитов, с помощью методики генной инженерии. Вектор конкретно не ограничен тем, что он обеспечивает экспрессию полинуклеотида, кодирующего фактор роста гепатоцитов. Примеры вектора включают вектор, содержащий селективный маркер, который представляет собой ген устойчивости к антибиотикам, таким как неомицин, вектор, содержащий ген, кодирующий дигидрофолатредуктазу (DHFR) или глутаминсинтетазу (GS), который может быть амплифицирован в животных клетках и т.п., среди которых векторы pCI (доступные от Promega) и векторы pcDNA (доступные от Invitrogen) являются предпочтительными. Клетка-хозяин конкретно не ограничена тем, что она обеспечивает трансформацию с помощью вектора и экспрессию рекомбинантного фактора роста гепатоцитов. Примеры клетки-хозяина включают Escherichia coli, Bacillus subtilis, дрожжи, мицелиальные грибы, растительные клетки, клетки насекомых, клетки животных и т.п., среди которых клетки животных являются предпочтительными, и при этом клетки яичников китайских хомяков (CHO) являются особенно предпочтительными.
Фактор роста гепатоцитов, полученный с помощью методики генной инженерии, может представлять собой, например, рекомбинантный фактор роста гепатоцитов без особого ограничения. Например, в качестве ссылки может быть приведена патентная публикация JP-A-H3-285693. Применяемый фактор роста гепатоцитов может представлять собой, например, рекомбинантный фактор роста гепатоцитов человека (rhHGF), полученный из клетки-хозяина, которая представляет собой клетку CHO.
Фактор роста гепатоцитов может представлять собой модифицированный фактор роста гепатоцитов, который модифицирован с помощью замены, делеции, добавления или вставки или их комбинации с использованием одного или нескольких, предпочтительно 1-10 аминокислотных остатков в аминокислотной последовательности встречающегося в природе фактора роста гепатоцитов в таком диапазоне, чтобы модифицированная аминокислотная последовательность сохраняла активность фактора роста гепатоцитов. Модифицированный фактор роста гепатоцитов может представлять собой таковой, характеризующийся, например, 80%,предпочтительно 85%, более предпочтительно 90% и наиболее предпочтительно 95% гомологией по отношению к аминокислотной последовательности встречающегося в природе фактора роста гепатоцитов. Например, в качестве ссылки могут быть приведены патентная публикация WO 90/010651, патентная публикация JP-A-H4-030000 и патентная публикация JP-A-H5-111383.
[0015]
Концентрация фактора роста гепатоцитов до лиофилизации конкретно не ограничена и может составлять, например, 5 мг/мл или меньше, предпочтительно 3 мг/мл или меньше и более предпочтительно 1 мг/мл или меньше.
[0016]
Лиофилизированный состав по настоящему изобретению вводят пациентам парентерально.
Когда лиофилизированный состав применяют для ингаляционного введения, лиофилизированный состав по настоящему изобретению растворяют перед применением и вводят пациенту с помощью распылителя.
Когда лиофилизированный состав применяют для инъекций, лиофилизированный состав по настоящему изобретению растворяют перед применением и вводят пациенту внутривенно, подкожно или внутримышечно.
Концентрация фактора роста гепатоцитов в водном растворе, полученном с помощью растворения лиофилизированного состава, конкретно не ограничена и может составлять, например, 5 мг/мл или меньше. Вода для растворения лиофилизированного состава по настоящему изобретению конкретно не ограничена, поскольку она представляет собой воду, применяемую в медицинской практике, и примеры которой включают воду для инъекций, стерилизованную очищенную воду, физиологический раствор и т.п.
[0017]
Трегалоза для применения в настоящем изобретении конкретно не ограничена степенью очистки, при которой она может быть фармацевтически приемлема, и примеры таковой включают ангидрид трегалозы,гидроксид трегалозы и т.п. Примеры гидроксида трегалозы включают, без особого ограничения, гидроксид трегалозы (дигидрат трегалозы), приведенный в Японской фармакопее 16-го издания, и т.п.
Количество трегалозы, добавленное в лиофилизированный состав, является таким, что массовое соотношение фактора роста гепатоцитов и трегалозы (далее в данном документе, в данном разделе в пересчете на эквивалентное количество ангидрида трегалозы) составляет, например, от 1:4 до 1:460, предпочтительно от 1:4 до 1:370 и более предпочтительно от 1:8 до 1:280. В качестве альтернативы, общая масса лиофилизированного состава по твердым частицам составляет 100,0 частей по массе, трегалоза составляет, например, 20,0-95,0 частей по массе и предпочтительно 30,0-94,0 частей по массе. Также, в водном растворе, содержащем 1,0 мг/мл фактора роста гепатоцитов, полученном посредством растворения лиофилизированного состава, концентрация трегалозы составляет, например, от 4,0 мг/мл до 460,0 мг/мл и предпочтительно от 8,0 мг/мл до 280,0 мг/мл.
[0018]
Соединение (3) для применения в настоящем изобретении выбрано из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей.
Соединение (3) конкретно не ограничено степенью очистки, при которой оно может быть фармацевтически приемлемым. Может применяться один, или два, или более видов соединений (3).
Соединение (3) предпочтительно, учитывая уменьшение образования агрегатов и примесей, представляет собой одно или несколько, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей.
Соединение (3) включает в качестве основного вещества аргинин, гистидин, лизин и меглюмин, и при этом предпочтительным является одно или несколько соединений, выбранных из аргинина, гистидина и лизина. Количество соединения (3), которое добавляют в лиофилизированный состав может находиться в таком диапазоне концентрации, который позволит растворить фактор роста гепатоцитов без агрегации в водном растворе, содержащем фактор роста гепатоцитов, который применяют для получения лиофилизированного состава, или в водном растворе, содержащем фактор роста гепатоцитов, полученном посредством растворения лиофилизированного состава.
Количество соединения (3), добавляемое в лиофилизированный состав, является таким, чтобы массовое соотношение фактора роста гепатоцитов и соединения (3) (далее в данном документе, в данном разделе в пересчете на эквивалентное количество свободной формы) составляет, например, от 1:1 до 1:50, предпочтительно от 1:1 до 1:40 и более предпочтительно от 1:2 до 1:35. В качестве альтернативы, общая масса лиофилизированного состава по твердым частицам составляет 100,0 частей по массе, Количество соединения (3) составляет, например, 1,5-60,0 частей по массе и предпочтительно 3,0-59,0 частей по массе. Также, в водном растворе, содержащем 1,0 мг/мл фактора роста гепатоцитов, полученном посредством растворения лиофилизированного состава, количество соединения (3) составляет, например, от 1,0 мг/мл до 50,0 мг/мл, предпочтительно от 1,0 мг/мл до 40,0 мг/мл и более предпочтительно от 2,0мг/мл до 35,0 мг/мл.
[0019]
Соединение (3) по настоящему изобретению может представлять собой его фармацевтически приемлемую соль. Примеры фармацевтически приемлемой соли включают гидрохлорид, ацетатную соль, натриевую соль, калиевую соль, магниевую соль и т.п.
[0020]
В настоящем изобретении в лиофилизированном составе, содержащем (1) фактор роста гепатоцитов, дополнительно содержащем (2) трегалозу и (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, устойчивость при хранении фактора роста гепатоцитов может быть улучшена по сравнению с традиционными лиофилизированными составами. Устойчивость при хранении, применяемая в данном документе, относится к уменьшению образования агрегатов фактора роста гепатоцитов, уменьшению образования примесей вместе с фактором роста гепатоцитов и/или сохранению установленного перед хранением соотношения изоформ.
Настоящее изобретение обеспечивает способ стабилизации фактора роста гепатоцитов, посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов.
А именно, настоящее изобретение обеспечивает способ стабилизации фактора роста гепатоцитов посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, с целью уменьшения образования агрегатов фактора роста гепатоцитов.
Настоящее изобретение также обеспечивает способ стабилизации фактора роста гепатоцитов, посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, с целью уменьшения образования примесей в лиофилизированном составе, содержащем (1) фактор роста гепатоцитов, вместе с фактором роста гепатоцитов.
Настоящее изобретение также обеспечивает способ стабилизации фактора роста гепатоцитов, посредством включения (2) трегалозы и (3) одного или нескольких соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, в лиофилизированный состав, содержащий (1) фактор роста гепатоцитов, с целью сохранения установленного перед хранением соотношения изоформ фактора роста гепатоцитов.
[0021]
Термин "агрегаты", применяемый в данном документе, относится к агрегатам фактора роста гепатоцитов, и при этом их примеры включают растворимые агрегаты, такие как димеры и тримеры, и нерастворимые агрегаты, образованные посредством взаимодействий.
В настоящем изобретении количество агрегатов может быть оценено, например, с помощью измерения количества растворимых агрегатов с помощью эксклюзионной хроматографии.
В настоящем изобретении количество растворимых агрегатов, когда, например, количество агрегатов оценивается для лиофилизированного состава после хранения при 60°C в течение 1 месяца с помощью эксклюзионной хроматографии, составляет, например, менее 1,4% и предпочтительно составляет 1,0% или меньше. В качестве альтернативы, количество агрегатов, измеряемое для лиофилизированного состава после хранения при 60°C в течение 1 месяца с помощью эксклюзионной хроматографии, например, является кратным 4,6 или меньше, предпочтительно кратным 4 или меньше, более предпочтительно кратным 3,5 или меньше и еще более предпочтительно кратным 3 или меньше от количества агрегатов до хранения.
Количество нерастворимых агрегатов может быть оценено в отношении крупных нерастворимых агрегатов с размером 1 мкм или больше с помощью способа поглощения света нерастворимой частицей вещества, описанного в Японской фармакопее 16-го издания, или с помощью микропроточного способа визуализации, и в отношении нерастворимых агрегатов с размером от 1 мкм или меньше с помощью способа рассеяния света или способа ультрацентрифугирования.
[0022]
Термин "примесь" или "примеси", применяемые в данном документе, относятся к одному или нескольким веществам, соответствующим одному или нескольким пикам, которые наблюдаются при хроматографии с обращенной фазой, за исключением пика фактора роста гепатоцитов.
Количество примесей оценивают с помощью хроматографии с обращенной фазой. Например, для лиофилизированного состава, применяемого в примерах в настоящем описании, наблюдали два пика (далее в данном документе называемые "ImpA" и "ImpB", соответственно) при времени удерживания приблизительно 10 минут и другие примеси, отличные от ImpA и ImpB (далее в данном документе называемые "другие imp"), при времени удерживания от 6 до 7 минут, как показано на фиг. 1.
В настоящем изобретении количество примесей, например, когда количество примесей оценивается для лиофилизированного состава после хранения при 60°C в течение 1 месяца с помощью хроматографии с обращенной фазой, составляет, например, 1,7% или меньше, предпочтительно 1,5% или меньше, более предпочтительно 1,3% или меньше и еще более предпочтительно 1,0% или меньше. В качестве альтернативы, количество примесей, измеренное для лиофилизированного состава после хранения при 60°C в течение 1 месяца с помощью хроматографии с обращенной фазой, является кратным, например, менее 9, более предпочтительно 7 или меньше, более предпочтительно 5 или меньше и еще более предпочтительно 3 или меньше количеству примесей до хранения.
[0023]
Термин "изоформа", применяемый в данном документе, относится к отличающимся зарядами вариантам фактора роста гепатоцитов и ряду белков, обладающих различным зарядовым состоянием.
Соотношения изоформ может быть оценено, например, c помощью ионообменной хроматографии. Например, для лиофилизированных составов, применяемых в примерах в настоящем описании, наблюдали два пика (далее в данном документе называемые "пик A" и "пик B", соответственно) со временем удерживания от 35 до 45 минут, как показано на фиг. 2. Термин "соотношение изоформ", применяемый в данном документе, относится к соотношению каждой изоформы и общего количества изоформ.
[0024]
Биологическая активность фактора роста гепатоцитов в настоящем изобретении может быть оценена согласно клеточному анализу, с помощью которого оценивают пролиферацию эпителиальных клеток легкого норки (клетки Mv.1.Lu) или клетки 4BMr5 в присутствии трансформированного фактора роста β-1 (TGFβ-1) (см. Journal of Immnological Methods. vol. 258, p. 1-11, 2001 и т.п.) и может быть выражена как 50% эффективная концентрация (EC50). Изменение биологической активности лиофилизированного состава во время хранения может быть выражено как относительный титр (%), полученный посредством деления EC50 до хранения на EC50 после хранения.
[0025]
С целью сохранения постоянного pH водного раствора, содержащего фактор роста гепатоцитов, применяемого для получения лиофилизированного состава, или водного раствора, содержащего фактор роста гепатоцитов, полученного посредством растворения лиофилизированного состава, лиофилизированный состав может содержать буферное средство.
Буферное средство для применения в настоящем изобретении конкретно не ограничено тем, насколько оно фармацевтически приемлемо, и его примеры включают фосфорную кислоту, натрия дигидрофосфат, натрия дигидрофосфат моногидрат, гидрат лимонной кислоты, гидрат цитрата натрия, двунатриевый цитрат, уксусную кислоту, ледяную уксусную кислоту, гидрат ацетата натрия, гидрат карбоната натрия, гидрокарбонат натрия, глицин, глицил-глицин и т.п.
Буферное средство может применяться в форме буферного раствора, который обычно применяется, такого как фосфатный буферный раствор, цитратный буферный раствор и ацетатный буферный раствор.
Количество буферного средства в лиофилизированном составе составляет в пересчете на концентрацию в водном растворе, содержащем фактор роста гепатоцитов, до лиофилизации например, 1-100 мМ. Посредством регулирования концентрации в этом диапазоне может быть достигнут постоянный pH водного раствора, содержащего фактор роста гепатоцитов, полученного посредством растворения лиофилизированного состава.
[0026]
Фактор роста гепатоцитов обладает различной растворимостью в зависимости от pH, при этом минимум растворимости находится вблизи изоэлектрической точки. Следовательно pH может быть выбран, при этом учитывая изоэлектрическую точку, так, что фактор роста гепатоцитов может быть растворен без агрегации в водном растворе, содержащем фактор роста гепатоцитов, применяемом для получения лиофилизированного состава, или в водном растворе, содержащем фактор роста гепатоцитов, полученном посредством растворения лиофилизированного состава.
В настоящем изобретении фактор роста гепатоцитов, применяемый в примерах в настоящем описании, например, обладает минимальной растворимостью 0,1-0,2 мг/мл вблизи нейтрального pH, который представляет собой изоэлектрическую точку, и обладает растворимостью 1,6 мг/мл или выше вблизи pH 5. Следовательно, водный раствор перед лиофилизацией и водный раствор, полученный посредством растворения лиофилизированного состава, характеризуются pH, например, от 4,5 до 6,5 и предпочтительно от 5,0 до 6,0.
В способе получения лиофилизированного состава на основе фактора роста гепатоцитов по настоящему изобретению средство регулирования pH, отличное от буферного средства, может быть применено с целью регуляции pH водного раствора перед лиофилизацией.
[0027]
Средство регулирования pH для применения в настоящем изобретении конкретно не ограничено тем, насколько оно фармацевтически приемлемо, и его примеры включают соляную кислоту, безводную лимонную кислоту, гидрат лимонной кислоты, натрия гидроксицитрат, глицин, янтарную кислоту, уксусную кислоту, ледяную уксусную кислоту, гидроксиацетат натрия, винную кислоту,гидроксид натрия, гидрокарбонат натрия, гидроксикарбонат натрия, сухой карбонат натрия, моноэтаноламин, триэтаноламин, молочную кислоту, лактат натрия, фосфорную кислоту, динатрийфосфат гидрат, безводный моногидрофосфат натрия, дигидрофосфат натрия, безводный натрия дигидрофосфат, кристаллический дигидрофосфат натрия, тринатрий фосфат, дикалийфосфат, дигидрофосфат калия и т.п.
[0028]
С целью предотвращения уменьшения содержания фактора роста гепатоцитов в составе лекарственного средства, подлежащего введению, вследствие адсорбции фактора роста гепатоцитов на стекле или полимере, из которого состоит контейнер, после повторного растворения лиофилизированного состава лиофилизированный состав может содержать поверхностно-активное вещество.
Поверхностно-активное вещество для применения в настоящем изобретении конкретно не ограничено тем, насколько оно фармацевтически приемлемо, и его примеры включают неионогенные поверхностно-активные вещества, конкретно включающие полисорбат 80, полисорбат 20, полоксамеры, полиэтиленгликоль, HCO-40, HCO-60 и т.п.
Количество поверхностно-активного вещества в лиофилизированном составе в водном растворе, содержащем 1,0 мг/мл фактора роста гепатоцитов, полученном посредством растворения лиофилизированного состава, составляет, например, от 0,020 до 1,0 мг/мл, предпочтительно от 0,050 до 1,0 мг/мл, более предпочтительно от 0,075 до 0,5 мг/мл и еще более предпочтительно от 0,075 до 0,2 мг/мл.
[0029]
Лиофилизированный состав по настоящему изобретению при том, что общая масса лиофилизированного состава по твердым частицам составляет 100,0 частей по массе, содержит от 0,1 до 4,5 частей по массе фактора роста гепатоцитов, от 20,0 до 95,0 частей по массе трегалозы (далее в данном документе, в данном разделе в пересчете на эквивалентное количество ангидрида трегалозы), и от 1,5 до 60,0 частей по массе соединения (3) (далее в данном документе, в данном разделе в пересчете на эквивалентное количество свободной формы). В одном варианте осуществления при том, что общая масса лиофилизированного состава по твердым частицам составляет 100,0 частей по массе, фактор роста гепатоцитов составляет от 0,3 до 4,4 частей по массе,трегалоза составляет от 30,0 до 94,0 частей по массе и соединение (3) составляет от 3,0 до 59,0 частей по массе. В другом варианте осуществления на фактор роста гепатоцитов составляет от 0,3 до 4,4 частей по массе, трегалоза составляет от 30,0 до 94,0 частей по массе, соединение (3) составляет от 3,0 до 59,0 частей по массе и полисорбат 80 составляет от 0,026 до 0,7 частей по массе.
[0030]
В настоящем изобретении лиофилизированный состав может дополнительно содержать,если необходимо, добавку, такую как носитель, средство регуляции тоничности, и антиоксидант.
[0031]
Способ получения лиофилизированного состава по настоящему изобретению включает стадии:
(I) перед добавлением (1) фактора роста гепатоцитов регулирования pH водного раствора, содержащего по меньшей мере (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, до pH 4,5-6,5, и получения водного раствора, содержащего (1) фактор роста гепатоцитов, (2) трегалозу и (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей; и
(II) лиофилизации водного раствора, содержащего фактор роста гепатоцитов, полученного на стадии (I).
Лиофилизированный состав по настоящему изобретению может быть получен способом получения.
[0032]
На стадии (I) pH водного раствора, содержащего по меньшей мере (3) одно или несколько соединений, выбранных из группы, состоящей из аргинина, гистидина, лизина, меглюмина, глутаминовой кислоты, аспарагиновой кислоты, пролина, креатина, креатинина, трис(гидроксиметил)метиламина и их фармацевтически приемлемых солей, регулируют до pH 4,5-6,5 и предпочтительно до pH 5,0-6,0.
Перед регулированием pH водный раствор может содержать (2) трегалозу, но не содержит (1) фактор роста гепатоцитов. Именно после регулирования pH водного раствора, содержащего по меньшей мере соединение (3), до pH 4,5-6,5 в него добавляют (1) фактор роста гепатоцитов или в него добавляют одновременно или последовательно (1) фактор роста гепатоцитов и (2) трегалозу.
С целью регулирования pH может применяться буферное средство и/или средство регулирования pH. Температура реакции во время регулирования pH конкретно не ограничена.
Водный раствор, содержащий по меньшей мере соединение (3), может быть получен посредством растворения соединения (3) в растворителе.
Растворитель для получения водного раствора, содержащего по меньшей мере соединение (3), конкретно не ограничен тем, что он представляет собой, например, фармацевтически приемлемую воду. Его примеры включают воду для инъекций, стерилизованную очищенную воду и т.п.
[0033]
(1) Фактор роста гепатоцитов и (2) трегалозу можно добавлять в том виде, в котором они есть, или в форме водного раствора. Растворитель для получения водного раствора может быть таким же или отличным от растворителя для получения водного раствора, содержащего по меньшей мере соединение (3). Температура во время добавления (1) фактора роста гепатоцитов и (2) трегалозы конкретно не ограничена.
[0034]
На стадии (I) можно добавлять, если необходимо, поверхностно-активное вещество, другие добавки (носитель, средство, регулирующее тоничность, антиоксидант и т.п.) и т.п.
[0035]
На стадии (II) лиофилизируют водный раствор, содержащий фактор роста гепатоцитов, полученный на стадии (I).
Водный раствор, содержащий фактор роста гепатоцитов, может быть лиофилизирован согласно общепринятому способу после выливания водного раствора, содержащего фактор роста гепатоцитов, в виалу или ампулу.
Предпочтительным является водный раствор, содержащий фактор роста гепатоцитов, стерилизованный посредством фильтрации через фильтр или т.п. и лиофилизированный.
Примеры способа лиофилизации включают способ, включающий три однократные операции, а именно стадию замораживания для охлаждения и замораживания ниже номинального давления, стадию первичного высушивания для сублимации и высушивания свободной воды, которая не захвачена растворенными веществами, при пониженном давлении, и стадию вторичного высушивания для удаления адсорбированной воды и кристаллической воды, связанной с растворенными веществами (для справок можно сослаться на Pharm. Tech. Japan, vol.8, no.1, p.75-87, 1992, и т.п.).
Температура во время стадии замораживания составляет, например, 40°C или меньше. Температура во время стадии первичной сушки составляет, например, от -20°C до 10°C. Температура во время стадии вторичной сушки составляет, например, от 20°C до 30°C. Пониженное давление составляет, например, 10 Па или меньше.
[0036]
Термин "осадок", применяемый в данном документе, относится к пористой твердой частице в лиофилизированном составе. Характеристики лиофилизированного состава могут быть оценены с помощью визуального наблюдения пористой структуры или цвета осадка, или растворимости лиофилизированного состава в воде, или визуального наблюдения полученного таким образом водного раствора.
Для лиофилизированного состава по настоящему изобретению обычно приемлемым является белый осадок и характерно быстрое растворение в воде с получением прозрачного и бесцветного водного раствора.
С другой стороны, водный раствор, полученный посредством растворения традиционного лиофилизированного состава, может быть мутным, вероятно, вследствие образования нерастворимых агрегатов, которые могут представлять собой производные фактора роста гепатоцитов и т.п. Таким образом, характеристики водного раствора, полученного посредством растворения лиофилизированного состава, могут указывать на образование нерастворимых агрегатов. Тот факт, что водный раствор является прозрачным после хранения лиофилизированного состава, говорит о том, что образование нерастворимых агрегатов уменьшается.
ПРИМЕРЫ
[0037]
Настоящее изобретение более конкретно описано далее в данном документе с помощью примеров, которые не ограничивают настоящее изобретение.
[0038]
Фактор роста гепатоцитов, применяемый в настоящих примерах, получали с помощью полного синтеза гена на основе информации о аминокислотной последовательности, раскрытой в патентной публикации JP-A-H11-056382, встраивания гена в вектор, экспрессии белка в клетках CHO, и выделения, и очистки белка.
[0039]
(Примеры 1-25 и сравнительные примеры 1-7)
Лиофилизированные составы из примеров и сравнительных примеров получали с помощью способа, описанного ниже в данном документе. В таблицах 1-4 показаны количества (мг) компонентов на мл каждого из водных растворов, содержащих фактор роста гепатоцитов. Значения в таблицах округляли до одного знака после запятой. Водные растворы, содержащие фактор роста гепатоцитов, получали в объеме в диапазоне от 100 мл до 250 мл.
[0040]
Таблица 1
|
[0041]
Таблица 2
|
[0042]
Таблица 3
|
[0043]
Таблица 4
|
[0044]
<Получение буфера для смешивания>
Согласно объему каждого водного раствора, содержащего фактор роста гепатоцитов, и концентрации, указанной в таблицах 1-4, компоненты, отличающиеся от фактора роста гепатоцитов или полисорбата 80, смешивали и встряхивали с необходимым количеством воды для инъекций (приблизительно 80% от объема водного раствора, содержащего фактор роста гепатоцитов). После визуального подтверждения растворения pH регулировали до 5,5 с помощью соляной кислоты и/или гидроксида натрия и регулировали объем с помощью воды для инъекций с получением буфера для смешивания.
<Получение водного раствора, содержащего фактор роста гепатоцитов>
Водный раствор, содержащий фактор роста гепатоцитов, получали с помощью следующей процедуры.
(a) Водный раствор, содержащий фактор роста гепатоцитов, регулировали, чтобы получить концентрацию фактора роста гепатоцитов, как указано в таблице 1, с помощью ультрафильтрации с применением буфера для смешивания. Концентрацию фактора роста гепатоцитов рассчитывали по следующей формуле (A) после определения оптической плотности при 280 нм на спектрофотометре в ультрафиолетовой и видимой области спектра (с применением клетки с толщиной светопоглощающего слоя приблизительно 1 см):
Концентрация белка (мг/мл)=(A280/1,73) × D (A),
где
A280: оптическая плотность при 280 нм;
1,73: теоретическая оптическая плотность исследуемого раствора с концентрацией 0,1%, с толщиной светопоглощающего слоя приблизительно 1 см и при 280 нм; и
D: кратность разведения при измерении.
(b) После этого добавляли полисорбат 80, чтобы достичь требуемой концентрации, как указано в таблице 1, с последующей фильтрацией через стерилизующий фильтр (наименование изделия: фильтр с размером пор 0,22 мкм MILLEX GV, доступный от Millipore) с получением водного раствора, содержащего фактор роста гепатоцитов.
<Стадия лиофилизации>
Водный раствор, содержащий фактор роста гепатоцитов, разделяли по 1 мл в 5-мл стеклянные виалы, которые затем частично закрывали резиновыми колпачками. После лиофилизации согласно плану, показанному в таблице 5, каждую виалу полностью закрывали резиновым колпачком. Алюминиевый колпачок затем прикрепляли к стеклянной виале с получением лиофилизированного состава.
Сравнительный пример 5 представляет собой лиофилизированный состав, полученный согласно составу, раскрытому в WO 2000/072873. Сравнительный пример 6 представляет собой лиофилизированный состав, полученный согласно составу, раскрытому в WO 2008/102849.
[0045]
Таблица 5
|
[0046]
(Испытательный пример 1)
Полученные лиофилизированные составы в примерах 1-11 и сравнительных примерах 1-6 проверяли в отношении характеристик лиофилизированных составов, растворимости лиофилизированных составов в воде для инъекций и характеристик водных растворов, полученных после растворения, согласно следующим процедурам.
<Способ>
Каждый полученный лиофилизированный состав визуально наблюдали (образование осадка и цвета) на белом и черном фонах в окружающей среде при 1000-3000 лк. Затем добавляли воду для инъекций (1 мл) в каждый лиофилизированный состав, который затем выдерживали перед визуальным наблюдением растворимости лиофилизированного состава и цвета полученного раствора.
Термин "быстро растворимый", показанный в таблице 6, относится к составу, который полностью растворялся в течение 1 минуты, и термин "малорастворимый" относится к составу, который неполностью растворялся даже через 1 минуту.
[0047]
<Результаты>
Результаты для образцов из примеров 1-4 и сравнительных примеров 1-6 показаны в таблице 6. В примерах 1-4 образовывались белые осадки, и при этом была продемонстрирована приемлемая растворимость. В сравнительном примере 1, содержащем ксилит, и в сравнительном примере 3, содержащем сорбит, не образовывались осадки, и при этом наблюдались белые или бесцветные расплавленные твердые вещества. Сравнительный пример 5, который не включал сахарид, представлял собой белое твердое вещество без образования осадка, который обычно наблюдали для лиофилизированных составов. В примерах 5-11 также образовывались белые осадки, аналогично примерам 1-4, и при этом была продемонстрирована приемлемая растворимость.
[0048]
Таблица 6
|
[0049]
Полученные лиофилизированные составы хранили в термостатической камере при 25°C, 40°C или 60°C в течение 2 недель или 1 месяца, после чего следовали следующие испытания.
[0050]
(Испытательный пример 2)
Количество растворимых агрегатов в примерах 1-25 и сравнительных примерах 1-7 оценивали следующим образом.
<Способ>
Воду для инъекций (1 мл) добавляли в каждый лиофилизированный состав из примеров и сравнительных примеров для растворения при ледяном охлаждении. Раствор умеренно встряхивали для получения однородного раствора, который затем выдерживали в течение 5 минут. Полученный раствор распределяли в 250-мкл микровставки, которые расположены в виалах для HPLC, для получения образцов.
Проводили измерение каждого образца с помощью эксклюзионной хроматографии при следующих аналитических условиях для определения количества растворимых агрегатов до и после хранения и количество растворимых агрегатов рассчитывали с помощью способа процентной площади.
Детектор: УФ 280 нм;
Колонка: защитная колонка (торговое наименование: TSKgel G3000SWXL, доступный от Tosoh Corporation);
Температура колонки: 30°C;
Подвижная фаза: получена посредством растворения 39 г натрия дигидрофосфат дигидрата, 87,5 г хлорида натрия и 5,0 г лаурилсульфата натрия в 5000 мл воды и регулирования pH раствора до 7,5 с помощью 2 моль/л раствора гидроксида натрия;
Образец пробы: 50 мкл; и
Расход: 1 мл/мин.
[0051]
<Результаты>
Результаты измерения количества растворимых агрегатов в образцах в исходном состоянии (до хранения) и после хранения при 25°C, 40°C или 60°C в течение 2 недель или 1 месяца показаны в таблицах 7-9. Результаты измерения количества растворимых агрегатов в образцах из примеров 1-4 и сравнительных примеров 1-6 в исходном состоянии и после хранение при 60°C в течение 1 месяца показаны на фиг. 3. Кроме того, корреляция между содержанием трегалозы в лиофилизированных составах и количеством растворимых агрегатов показана в таблице 10,
[0052]
Согласно таблице 7 количество растворимых агрегатов в сравнительных примерах 1-6 увеличивалось с увеличением срока хранения и температуры хранения. Количество растворимых агрегатов значительно увеличивалось после хранение при 60°C в течение 1 месяца.
Кроме того, согласно таблицам 7 и 8 такое значительное изменение в количестве растворимых агрегатов, как в сравнительных примерах, не наблюдалось для примеров 1-11 при тестируемых условиях хранения. Таким образом, образование растворимых агрегатов уменьшалось в примерах 1-11 даже при условиях хранения 60°C.
[0053]
Согласно таблицам 9 и 10, количество растворимых агрегатов значительно увеличивалось в сравнительном примере 7, который не включал трегалозу.
Кроме того, незначительное изменение количества растворимых агрегатов наблюдалось в примерах 12-15, содержащих различные количества фактора роста гепатоцитов, и примерах 23-25, содержащих различные количества аргинина.
[0054]
Таблица 7
|
[0055]
Таблица 8
|
[0056]
Таблица 9
|
[0057]
Таблица 10
|
[0058]
(Испытательный пример 3)
Количество примесей в примерах 1-25 и сравнительных примерах 1-7 оценивали следующим образом.
<Способ>
Применяемые образцы представляли собой таковые в виалах для HPLC, полученные для оценки количества растворимых агрегатов.
Проводили измерение каждого образца с помощью хроматографии с обращенной фазой при следующих аналитических условиях для определения количества примесей до и после хранения и рассчитывали количество примесей с помощью способа процентной площади.
Детектор: УФ 215 нм;
Колонка: колонка с обращенной фазой (торговое наименование: Inertsil WP300-C8, доступный от GL Sciences Inc.), приложенная к защитной колонке GL Cart;
Температура колонки: 40°C;
Подвижная фаза A: вода/трифторуксусная кислота (1000:1);
Подвижная фаза B: ацетонитрил/трифторуксусная кислота (1000:0,85);
Образец пробы: 25 мкл;
Расход: 1 мл/мин.; и
Градиент: объемное отношение подвижной фазы B к общему количеству подвижной фазы A и подвижной фазы B: 15% (исходное значение) - 70% (27,5 мин.) - 70% (30 мин.) - 15% (30,01 мин.) - 15% (35 мин.).
[0059]
<Результаты>
Результаты измерения количества примесей в образцах из примеров 1-11 и сравнительных примеров 1-6 в исходном состоянии (до хранения) и после хранения при 25°C, 40°C или 60°C в течение 2 недель или 1 месяца показаны в таблицах 11-12. Результаты измерения общего количества примесей в образцах из примеров 1-4 и сравнительных примеров 1-6 в исходном состоянии и после хранение при 60°C в течение 1 месяца показаны на фиг. 4.
[0060]
Согласно таблице 11 общее количество примесей в примерах 1-4 практически не изменялось при условиях хранения при 25°C и 40°C. Согласно таблицам 11 и 12 увеличение общего количества примесей в примерах 1-11 составляло не более чем 2-кратное относительно исходного значения даже при условиях хранения 60°C, в то время как увеличение количества в составах всех сравнительных примеров составляло почти 10-кратное или больше. При условиях хранения 60°C было обнаружено, что любой из ImpA, ImpB и других imp увеличивался в составах всех сравнительных примеров. Таким образом, образование примесей уменьшалось в примерах 1-11 даже при условиях хранения 60°C.
В примерах 12-25 незначительное изменение общего количества примесей наблюдалось при любых условиях хранения.
[0061]
Таблица 11
|
[0062]
Таблица 12
|
[0063]
(Испытательный пример 4)
Соотношение изоформ в примерах 1-25 и сравнительных примерах 1-7 оценивали следующим образом.
<Способ>
Применяемые образцы представляли собой таковые в виалах для HPLC, полученные для оценки количества агрегатов.
Проводили измерение каждого образца с помощью ионообменной хроматографии при следующих аналитических условиях для определения количества изоформ до и после хранения и рассчитывали соотношение изоформ с помощью способа процентной площади.
Детектор: УФ 215 нм;
Колонка: торговое наименование: Agilent Bio SCX NP5 PK, доступный от Agilent Technologies;
Температура колонки: 30°C;
Подвижная фаза A: 50 ммоль/л Трис-HCl буфер (pH 9,0);
Подвижная фаза B: 50 ммоль/л Трис-HCl буфер (pH 9,0), 1 моль/л NaCl
Образец пробы: 50 мкл;
Расход: 0,5 мл/мин.; и
Градиент: объемное отношение подвижной фазы B к общему количеству подвижной фазы A и подвижной фазы B: 20% (исходное значение) - 60% (50 мин.) - 80% (51 мин.) - 80% (60 мин.) - 20% (60,01 мин.) - 20% (80 мин.).
[0064]
<Результаты>
Результаты измерения изменения количества изоформ в пересчете на отношение пика B к сумме пика A и пика B в образцах в исходном состоянии (до хранения) и после хранения при 25°C, 40°C или 60°C в течение 2 недель или 1 месяца показаны в таблицах 13-15. Результаты измерения изменения соотношения изоформ в пересчете на соотношение пика B в образцах из примеров 1-4 и сравнительных примеров 1-6 в исходном состоянии и после хранение при 60°C в течение 1 месяца показаны на фиг. 5. Кроме того, корреляция между содержанием трегалозы в лиофилизированных составах и соотношением пика В показана на фиг. 6, и при этом корреляция между содержанием аргинина и соотношением пика В показана на фиг. 7.
[0065]
Согласно таблицам 13 и 14 небольшое изменение в соотношении изоформ пика B наблюдалось в примерах 1-11 и сравнительном примере 5 при тестируемых условиях хранения, в то время как соотношение изоформ пика B значительно изменялось в других сравнительных примерах при условиях хранения 60°C. Таким образом, изменение соотношения изоформ уменьшалось в примерах 1-11 даже при условиях хранения 60°C. В сравнительном примере 1 наблюдалось значительное изменение после хранения, а именно изоформа пика A исключалась, так чтобы обнаруживаемая изоформа составляла только пик B и пик, который не представлял собой изоформу, которая наблюдалась.
[0066]
Согласно фиг. 6 было обнаружено, что соотношение изоформ пика B уменьшалось с увеличением содержания трегалозы в составах. Аналогично, уменьшение соотношения изоформ пика B также наблюдалось для состава сравнительного примера 7, который не включал трегалозу.
Согласно фиг. 7 было обнаружено, что соотношение изоформ пика B уменьшалось с уменьшением содержания аргинина в составах при условиях хранения при 60°C в течение 1 месяца.
Кроме того, не наблюдалось изменение соотношения изоформ в зависимости от изменения содержания фактора роста гепатоцитов в составах.
[0067]
Таблица 13
|
[0068]
Таблица 14
|
[0069]
Таблица 15
|
[0070]
(Испытательный пример 5)
Количество нерастворимых агрегатов в примерах 1-25 и сравнительных примерах 1-7 оценивали следующим образом.
<Способ>
Воду для инъекций (1 мл) добавляли в каждый лиофилизированный состав, который выдерживали и затем растворяли в воде для инъекций, или каждый водный раствор плацебо с получением образца. Количество нерастворимых микрочастиц до и после хранения в каждом образце измеряли на анализаторе визуализации потока частиц и рассчитывали количество нерастворимых микрочастиц согласно следующей формуле:
Количество микрочастиц (количество/виала)=P × 1000 × V/(n × v),
где
P: количество обнаруженных частиц;
V: объем образца раствора (мл);
n: количество измерений; и
v: объем образца на измерение.
[0071]
<Результаты>
Результаты измерения количества нерастворимых агрегатов в образцах из примеров 1-11 и сравнительных примеров 1-6 в исходном состоянии (до хранения) и после хранения при 60°C в течение 2 недель или 1 месяца показаны в таблицах 16 и 17.
[0072]
Согласно таблице 16 количество нерастворимых агрегатов в сравнительных примерах 1-6 увеличивалось после хранения при 60°C в течение 1 месяца. Кроме того, согласно таблицам 16 и 17 такое значительное изменение количества растворимых агрегатов, как в сравнительных примерах, не наблюдалось для примеров 1-11. Таким образом, образование нерастворимых агрегатов уменьшалось в примерах 1-11 даже при условиях хранения при 60°C в течение 1 месяца. Незначительное изменение количества нерастворимых агрегатов наблюдалось для примеров 12-25.
[0073]
Таблица 16
|
[0074]
Таблица 17
|
[0075]
(Испытательный пример 6)
Биологическую активность в примере 1, сравнительном примере 5 и сравнительном примере 6 оценивали следующим образом.
<Способ>
Эпителиальные клетки легкого норки (клетки Mv.1.Lu) культивировали, жизнеспособность клеток была подтверждена, и затем получали раствор клеток 1 × 105/мл. Раствор трансформированного фактора роста β-1 (TGFβ-1) добавляли в каждую лунку 96-луночного аналитического планшета и образец раствора добавляли в каждую лунку, содержащую фактор роста гепатоцитов, в концентрации 0,125, 0,25, 0,5, 1, 2, 4, 8, 16, 32, 64 или 128 нг/мл. Затем добавляли раствор клеток 1 × 105/мл и инкубировали планшет в 5% углекислотном инкубаторе при 37°C в течение 69 часов. Набор для подсчета клеток (10мкл), доступный от Dojindo Molecular Technologies, Inc. добавляли в планшет, который затем инкубировали в течение 3 часов, и измеряли оптическую плотность при 450 нм.
Полученное значение оптической плотности наносили на вертикальную ось по отношению к концентрации HGF в образцах (горизонтальная ось) и рассчитывали EC50 образцов с помощью аналитического программного обеспечения (SoftMax Pro доступный от Molecular Devices) с использованием анализа параллельных линий и 4-мерного логического анализа. Относительный титр (%) рассчитывали посредством деления EC50 до хранения на EC50 после хранения.
[0076]
<Результаты>
Относительный титр EC50 образцов примера 1 и сравнительных примеров 5 и 6 после хранения при 60°C в течение 1 месяца показан в таблице 18.
[0077]
Согласно таблице 18 уменьшение относительного титра наблюдалось для сравнительных примеров 5 и 6 после хранения при 60°C в течение 1 месяца.
Кроме того, уменьшение относительного титра не наблюдалось для примера 1, указывая на то, что биологическая активность сохранялась даже при условиях хранения при 60°C в течение 1 месяца.
[0078]
Таблица 18
|
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
[0079]
Промышленная применимость лиофилизированного состава по настоящему изобретению состоит в том, что в медицинской практике могут быть получены составы фактора роста гепатоцитов, обладающие высоким качеством.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ В РАЗВЕРНУТОМ ВИДЕ
[0080]
SEQ ID NO: 1 представляет собой аминокислотную последовательность фактора роста гепатоцитов человека.