Результат интеллектуальной деятельности: Конъюгаты полисахарида стрептококка группы В и белка, способы получения конъюгатов, иммуногенные композиции, содержащие конъюгаты, и их применения
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к иммуногенным конъюгатам полисахарида и белка, содержащим капсульный полисахарид (КП) Streptococcus agalactiae, обычно называемый стрептококком группы В (GBS), и белок-носитель, где КП выбран из группы, состоящей из серотипов Ia, Ib, II, III, IV, V, VI, VII, VIII и IX, и где КП имеет уровень сиаловой кислоты, превышающий примерно 60%. Изобретение также относится к способам получения конъюгатов и иммуногенных композиций, содержащих конъюгаты. Изобретение также относится к иммуногенным композициям, содержащим конъюгаты полисахарида и белка, где конъюгаты содержат КП GBS серотипа IV и по меньшей мере одного дополнительного серотипа. Изобретение также относится к способам индукции иммунного ответа у субъектов, направленного против GBS, и/или способам облегчения или предупреждения у субъекта инвазивного заболевания GBS, с применением композиций, раскрытых здесь. Полученные антитела можно использовать в лечении или предупреждении инфекции GBS посредством пассивной иммунотерапии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Streptococcus agalactiae представляют собой грамположительные организмы, имеющие полисахаридные капсулы, которые также известны под названием стрептококков группы В (GBS). Они являются обычными симбионтами желудочно-кишечного тракта и половых путей человека, а также вызывают серьезные заболевания у младенцев и лиц пожилого возраста (Baker, C.J., Vaccine, 31 (Suppl. 4): D3-D6 (2013)). Основным фактором риска инфицирования GBS у младенцев является колонизация материнского организма (Dillon, H.C., et al., J. Pediatr., 110(1):31-36 (1987)). Практически у каждой четвертой женщины имеет место вагинально-ректальное носительство GBS с возможным инфицированием амниотической жидкости или ребенка до или во время родов, вызывающим сепсис, пневмонию и менингит (Baker 2013; Heath, P.T., et al., BMJ Clin. Evid. (Online), pii:0323 (2014)). Двадцать пять процентов младенцев, выживших после менингита, вызванного GBS, страдают неврологическими нарушениями, при этом у 19% отмечается задержка умственного развития, церебральный паралич, слепота и потеря слуха (Libster, R., et al., Pediatrics, 130(1):е8-152012 (2012)). GBS также может стать причиной прерывания беременности и преждевременных родов и связан с рождением мертвого плода (McDonald, H.M., et al., Infectious Diseases in Obstetrics and Gynecology, 8(5-6):220-227 (2000); Randis, T.M., et al., The Journal of Infectious Diseases, 210(2):265-273 (2014): Kessous, R., et al., J. Matern. Fetal Neonatal Med., 25(10);1983-1986 (2012)). У младенцев, имевших при рождении очень низкий вес, риск инфицирования более высокий, вплоть до 3%, а смертность доходит практически до 30%, даже при незамедлительном начале антибиотикотерапии (Heath 2014).
Введение в конце 1990-х в США скрининга на GBS и интранатальной антибиотикопрофилактики (ИАП) продемонстрировало снижение неонатальной заболеваемости в первую неделю жизни (заболевание с ранним началом (ЗРН)), но не оказало значимого влияния на частоту заболевания с поздним началом (ЗПН), возникающего впоследствии в течение первых 3 месяцев жизни. В США частота случаев ЗРН и ЗПН в настоящее время составляет 0,25 и 0,27 на 1000 рождений, соответственно (Центры по контролю и профилактике заболевания (ЦБП), отчет по активному эпидемиологическому надзору за ключевыми бактериальными патогенами (КБП) (2013), доступный по адресу в интернете http://www.cdc.gov/abcs/reports-findings/survreports/gbs13.pdf). После введения конъюгатных пневмококковых вакцин для профилактики инвазивных пневмококковых заболеваний, включая бактериемию и менингит, и несмотря на ИАП для предупреждения заболевания GBS, GBS стал единственной наиболее распространенной в США причиной неонатального сепсиса (ЗРН) и менингита (меньше 2 мес) у младенцев. (Verani, J.R., et al., MMWR, 59(RR10); 1-32 (2010);
Thigpen, M.C, et al., New England Journal of Medicine, 364(21):2016-2025 (2011)). В отличие от США, введение рекомендаций по профилактике инвазивных инфекций, вызванных GBS, и ИАП не привели к снижению ЗРН в Нидерландах и Великобритании (Bekker, V., et al., The Lancet Infectious Diseases, 14(11):1083-1089 (2014); Lamagni, T.L, et al., Clin. Infect. Dis., 57(5):682-688 (2013)). Такое отсутствие эффекта можно объяснить отсутствием универсального скрининга и применением ИАП только у матерей в группах наиболее высокого риска (например, при лихорадке, преждевременном разрыве плодных оболочек). Частота ЗРН существенно выше в странах, не использующих ИАП, при этом средняя заболеваемость составляет 0,75 на 1000 рожденных живых детей (95% ДИ 0,58-0,89) (Edmond, K.M, et al., Lancet, 379(9815):547-556 (2012)).
Другой популяцией с повышенным риском GBS являются пожилые люди. Факторы риска включают хронические медицинские проблемы, такие как сахарный диабет, рак, сердечная недостаточность, неврологические и урологические заболевания. Согласно данным ЦБП по надзору за КБП, в 2013 году в США частота инвазивных заболеваний GBS составила 0,28 на 1000 взрослого населения или 12400 случаев в год среди взрослого населения в возрасте 65 лет и старше. Указанная заболеваемость приближается по частоте к инвазивной пневмококковой инфекции у пожилых лиц (0,30 на 1000 для лиц старше 65 лет). Предполагают, что указанная частота будет продолжать увеличиваться как в США, так и в Европе (ЦБП 2013; Lamagni 2013).
Одним из подходов к профилактике заболеваний, вызванных GBS, у младенцев и лиц пожилого возраста является применение вакцин на основе полисахаридов. Внедрение в США вакцин для профилактики GBS у матерей способно предупредить заболевания, вызванные GBS, среди младенцев независимо от применения ИАП. Несмотря на то, что полисахариды сами по себе могут быть иммуногенными, для улучшения иммуногенности, в частности, у младенцев и пожилых, применяют конъюгирование полисахаридов с белковыми носителями. Вакцины на основе конъюгатов полисахарида и белка получают с использованием полисахаридов, как правило, из поверхностной оболочки бактерий, связанных с белковыми носителями. Полисахарид, химически присоединенный к белку-носителю, индуцирует иммунный ответ против бактерий, несущих на своей поверхности полисахарид, содержащийся в вакцине, таким образом, предупреждая заболевание. Соответственно, вакцинация с применением полисахаридов патогенных бактерий является возможной стратегией для повышения иммунитета организма-хозяина.
Полисахариды, покрывающие бактерии, существенно отличаются даже внутри одного вида бактерий. Например, у GBS выделяют десять различных серотипов в зависимости от разновидности полисахаридных капсул бактерий. Таким образом, желательно, чтобы вакцины на основе полисахаридов содержали панель полисахаридов для обеспечения широкого спектра защиты против различных циркулирующих штаммов.
Белок-носитель может представлять собой либо родственный белковый антиген патогена-мишени, усиливающий специфический иммунный ответ на данный патоген, либо белок, в принципе являющийся иммуногенным, который служит в большей степени адъювантом или общим стимулятором иммунного ответа.
В клинических исследования 1 и 2 фазы у небеременных взрослых лиц изучали отдельные моновалентные конъюгаты полисахарида серотипов GBS Ia, Ib, II, III и V с белком (Brigtsen, A.K., et al., Journal of Infectious Diseases, 185(9):1277-1284 (2002); Baker, C.J., et al., J. Infect. Dis, 188(1):66-73 (2003); Baker, C.J, et al., J. Infect. Dis., 189(6):1103-1112 (2004); Baker, C.J., et al., Vaccine, 25(1):55-63 (2007)). Также изучали двухвалентные вакцины на основе гликоконъюгатов II-TT и III-TT и трехвалентные вакцины, содержащие гликоконъюгаты Ia-CRM197, Ib-CRM197 и III-CRM197 (Baker JID 2003; Clicaltrials.gov NCT01193920, NCT01412801 и NCT01446289). Однако в настоящее время не существует одобренных к применению вакцин против GBS.
Более того, тогда как трехвалентные вакцины покрывают более 90% инвазивных штаммов, вызывающих заболевания новорожденных в Южной Африке (Madzivhandila, M., et al., PloS One, 6(3):e17861 (2011)), эти же серотипы представляют только 62% и 66% инвазивных изолятов в Северной Америке и Европе, соответственно, о чем свидетельствуют данные надзора за недавно выделенными у новорожденных изолятами из всемирной коллекции, включающей 901 образец, собранный с 2004 по 2013 в рамках исследования TEST (Tigecycline Evaluation and Surveillance Trial, http://www.testsurveillance.com/).
Анализ штаммов, полученных из образцов TEST, показал, что 95% собранных штаммов принадлежали одному из пяти основных зарегистрированных серотипов (Ia, Ib, II, III и V), и еще 3% относились к серотипу IV. Серия публикаций также подтвердила появление серотипа IV в последнее десятилетие в Северной и Южной Америке и в Европе (Diedrick, M.J., et al., J. Clin. Microbiol, 48(9):3100-3104 (2010); Teatero (2014); Meehan, M. et al., European Journal of Clinical Microbiology & Infectious Diseases, 33(7):1155-1162 (2014); Florindo, С., et al., Euro Surveillance: Bulletin European sur les Maladies Transmissibles (European Communicable Disease Bulletin), 19(23) (2014); Palmiero, J.K., et al., Journal of Clinical Microbiology, 48(12):4397-4403 (2010)). Исследование с наблюдением за вагинально-ректальным носительством у взрослых, представляющим собой фактор риска трансмиссии GBS новорожденному, также обнаружило принадлежность 97% изолятов одному из шести указанных серотипов, среди которых серотип IV встречался с частотой около 4%. Исследование было запланировано для отслеживания носительства бета-гемолитических стрептококков (включая GBS), Clostridium difficile и Staphylococcus aureus у здоровых взрослых в США (см. Matson, M.A., et al, ICAAC, Abstract I-306 (Washington, DC, Sep.5-9, 2014)).
Аналогично, анализ образцов TEST показал, что 98% изолятов, выделенных из крови пожилых лиц 65 лет и старше, принадлежат тем же самым шести преобладающим серогруппам. Наиболее заметным различием между изолятами, выделенными у пожилых лиц и других популяций, является распределение серогрупп. Среди изолятов, выделенных у лиц пожилого возраста, наибольшую группу составляют штаммы серотипа V (34% по сравнению с 18% у новорожденных или 18% у взрослых носителей штаммов).
Другие исследования выявили существование географической вариации распространения серотипов. Например, было показано, что изоляты серотипов VI и VIII преимущественно колонизируют здоровых беременных женщин в Японии (Lachenauer, C.S., et al., JID 179(4):1030-1033 (1999).
Соответственно, существует потребность в вакцинах на основе конъюгатов полисахарида и белка или в моноклональных антителах для обеспечения пассивного иммунитета у широких слоев населения во всем мире, как средства профилактики или лечения заболеваний, вызываемых GBS, включая те, которые вызывает появившийся серотип IV.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым иммуногенным конъюгатам полисахарида GBS и белка, способам получения конъюгатов и иммуногенным композициям, содержащим такие конъюгаты, и включает изобретение, изложенное в предварительной заявке на патент США 62/156500, поданной 4 мая 2015; предварительной заявке на патент США 62/237813, поданной 4 мая 2015; и предварительной заявке на патент США 62/237820, поданной 6 октября 2015, включенных в данное описание во всей полноте путем ссылки.
Следующие параграфы описывают некоторые аспекты воплощений изобретения.
В одном аспекте изобретение относится к иммуногенному конъюгату полисахарид-белок, включающему капсульный полисахарид стрептококка группы В (GBS) и белок-носитель, где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 60%, выше примерно 95% или примерно 100%. В другом воплощении капсульный полисахарид может быть десиалирован вплоть до примерно 40% (уровень сиалирования выше примерно 60%). В другом воплощении капсульный полисахарид выбран из группы, состоящей из серотипов Ia, Ib, II, III, IV, V, VI, VII, VIII и IX.
В дополнительном аспекте иммуногенный конъюгат полисахарид-белок содержит капсульный полисахарид, имеющий примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9 или 0,95 мМ сиаловой кислоты на мМ полисахарида.
В другом аспекте изобретения иммуногенный конъюгат содержит капсульный полисахарид, имеющий молекулярную массу от примерно 5 кДа до примерно 1000 кДа, от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 200 кДа или от примерно 100 кДа до примерно 400 кДа.
В следующем воплощении иммуногенный конъюгат по изобретению имеет молекулярную массу от примерно 300 кДа до примерно 20000 кДа, например, от примерно 1000 кДа до примерно 15000 кДа или от примерно 1000 кДа до примерно 10000 кДа.
В одном воплощении иммуногенный конъюгат содержит капсульный полисахарид, имеющий O-ацетилирование от примерно 0% до примерно 40%, например, менее примерно 5%, менее примерно 4%, менее примерно 3%, менее примерно 2% или менее примерно 1% O-ацетилирования.
В одном воплощении иммуногенный конъюгат содержит капсульный полисахарид, имеющий по меньшей мере примерно 0,1, 0,2, 0,3, 0,35 или примерно 0,4 мМ O-ацетата на мМ повторяющейся сахаридной единицы. В другом воплощении иммуногенный конъюгат содержит капсульный полисахарид, имеющий менее примерно 0,01, 0,02, 0,03, 0,04 или 0,05 мМ O-ацетата на мМ повторяющейся сахаридной единицы.
В одном воплощении иммуногенный конъюгат содержит в качестве белка-носителя CRM197 или столбнячный анатоксин. В конкретном воплощении белок-носитель представляет собой CRM197.
В дополнительном аспекте изобретение относится к способам выделения капсульного полисахарида, включающим реакцию органического реагента с культуральной средой, содержащей бактерию, продуцирующую капсульный полисахарид. В одном воплощении способ дополнительно включает стадию центрифугирования. В другом воплощении способ дополнительно включает стадию фильтрования. В конкретном воплощении бактерия, продуцирующая капсульный полисахарид, выбрана из группы, состоящей из Streptococcus agalactiae, Streptococcus pneumoniae, Staphylococcus aureus, Neisseria meningitidis, Escherichia coli, Salmonella typhi, Haemophilus influenzae, Klebsiella pneumoniae, Enterococcus faecium и Enterococcus faecalis. В одном воплощении гидроксиламин выбран из группы, состоящей из аминов, перечисленных в Таблице 2. В дополнительном воплощении гидроксиламин выбран из группы, состоящей из дибензилгидроксиламина; диэтилгидроксиламина; гидроксиламина; этилендиамина; триэтилентетрамина; 1,1,4,7,10,10-гексаметилтриэтилентетрамина; и 2,6,10-триметил-2,6,10-триазаундекана. В еще одном воплощении концентрация гидроксиламина составляет от примерно 5 мМ до примерно 200 мМ. В следующем воплощении рН реакционной среды составляет от примерно 5,5 до примерно 9,5. В дополнительном воплощении реакция протекает при температуре от примерно 20°С до примерно 85°С. В другом воплощении время реакции составляет от примерно 10 часов до примерно 90 часов.
В одном аспекте изобретение относится к иммуногенной композиции, содержащей конъюгаты полисахарид-белок, где конъюгаты содержат капсульные полисахариды стрептококка группы В (GBS) серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В другом воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере двух дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В другом воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере трех дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В другом воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере четырех дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В конкретном воплощении конъюгаты содержат капсульный полисахарид серотипов Ia, Ib, II, III и IV. В следующем воплощении композиция содержит GBS серотипа V. В конкретном воплощении конъюгаты содержат капсульный полисахарид серотипов Ia, Ib, II, III и V. В еще одном воплощении иммуногенная композиция содержит шесть конъюгатов полисахарида и белка, где конъюгаты содержат капсульный полисахарид стрептококка группы В серотипов Ia, Ib, II, III, IV и V. Один аспект изобретения относится к иммуногенной композиции, которая не демонстрирует иммунной интерференции.
В одном воплощении иммуногенная композиция дополнительно содержит фармацевтически приемлемый эксципиент, буфер, стабилизатор, адъювант, криопротектор, соль, двухвалентный катион, неионный детергент, ингибитор свободнорадикального окисления, носитель или их смесь. В дополнительном воплощении содержит буфер. Буфер может представлять собой HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), PIPES (пиперазин-N,N'-бис(2-этансульфоновая кислота)), MES (2-(N-морфолино)этансульфоновая кислота), Tris (триметамин), фосфатный, ацетатный, боратный, цитратный, глициновый, гистидиновый или сукцинатный буфер. В предпочтительном воплощении буфер представляет собой гистидиновый буфер.
В другом воплощении иммуногенная композиция дополнительно содержит поверхностно-активное вещество. Поверхностно-активное вещество может представлять собой сложный эфир полиоксиэтиленсорбитана и жирной кислоты, полисорбат-80, полисорбат-60, полисорбат-40, полисорбат-20 или простой алкиловый эфир полиоксиэтилена. В предпочтительном воплощении поверхностно-активное вещество представляет собой полисорбат-80.
В следующем воплощении иммуногенная композиция дополнительно содержит эксципиент. Эксципиент выбран из группы, состоящей из крахмала, глюкозы, лактозы, сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита, палатинита, желатина, солода, риса, муки, мела, силикагеля, стеарата натрия, моностеарата глицерина, талька, глицина, аргинина, лизина, хлорида натрия (NaCl), сухого обезжиренного молока, глицерина, пропиленгликоля, воды и этанола. В предпочтительном воплощении эксципиент представляет собой хлорид натрия.
В еще одном воплощении иммуногенная композиция дополнительно содержит адъювант. В одном таком воплощении адъювант представляет собой адъювант на основе алюминия или QS-21. В предпочтительном воплощении адъювант выбран из группы, состоящей из фосфата алюминия, гидроксифосфата алюминия и гидроксида алюминия. В более предпочтительном воплощении адъювант представляет собой фосфат алюминия.
В одном аспекте изобретения иммуногенная композиция содержит буфер, поверхностно-активное вещество, эксципиент и возможно адъювант, где композиция забуферена до рН от примерно 6,0 до примерно 7,0. В другом аспекте иммуногенная композиция содержит гистидин, полисорбат-80, хлорид натрия и возможно фосфат алюминия, где композиция забуферена до рН от примерно 6,0 до примерно 7,0. В предпочтительном воплощении иммуногенная композиция содержит от примерно 10 мМ до примерно 25 мМ гистидина, от примерно 0,01% до примерно 0,03% (об./мас.) полисорбата-80, от примерно 10 мМ до примерно 250 мМ хлорида натрия (NaCl) и возможно от примерно 0,25 мг/мл до примерно 0,75 мг/мл алюминия в виде фосфата алюминия. В следующем аспекте изобретения иммуногенная композиция содержит дозу от примерно 5 мкг/мл до примерно 50 мкг/мл.
В другом аспекте изобретения иммуногенная композиция является лиофилизированной, возможно в присутствии по меньшей мере одного эксципиента. В одном воплощении по меньшей мере один эксципиент выбран из группы, состоящей из крахмала, глюкозы, лактозы, сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита, палатинита, желатина, солода, риса, муки, мела, силикагеля, стеарата натрия, моностеарата глицерина, талька, глицина, аргинина, лизина, хлорида натрия (NaCl), сухого обезжиренного молока, глицерина, пропиленгликоля, воды и этанола. В предпочтительном воплощении по меньшей мере один эксципиент выбран из группы, состоящей из сахарозы, маннита и глицина. В конкретном воплощении по меньшей мере один эксципиент представляет собой сахарозу. В одном аспекте лиофилизированная композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) по меньшей мере одного эксципиента, предпочтительно, более чем примерно 5,5% (масс./об.). В другом воплощении лиофилизированная композиция содержит дополнительный эксципиент. В одном таком воплощении дополнительный эксципиент представляет собой маннит или глицин. В предпочтительном воплощении лиофилизированная композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) дополнительного эксципиента. В еще одном воплощении лиофилизированную композицию разводят водой, водой для инъекций (WFI), суспензией адъюванта или физиологическим раствором. В конкретном воплощении разбавитель представляет собой суспензию любого описанного в данном документе адъюванта, такого как суспензия адъюванта на основе алюминия, предпочтительно суспензию фосфата алюминия.
В другом аспекте изобретение относится к способу индукции иммунного ответа против GBS, включающему введение субъекту эффективного количества иммуногенной композиции, описанной в данном документе. В одном воплощении изобретение относится к способу предупреждения или ослабления у субъекта заболевания или состояния, связанного со GBS, включающему введение субъекту эффективного количества иммуногенной композиции, описанной в данном документе. В конкретном воплощении субъектом является женщина, планирующая забеременеть, или беременная женщина. В одном таком воплощении беременная женщина находится во второй половине беременности, например, по меньшей мере на 20 неделе или по меньшей мере на 27 неделе беременности. В предпочтительном воплощении беременная женщина находится на 27-36 неделе беременности. В другом воплощении субъектом является человек старшей возрастной категории, такой как человек в возрасте 50 лет или старше, 65 лет или старше и 85 лет или старше. В следующем воплощении субъект имеет ослабленный иммунитет. В одном аспекте субъект может иметь патологическое состояние, выбранное из группы, состоящей из ожирения, диабета, ВИЧ-инфекции, рака, сердечно-сосудистого заболевания или заболевания печени. В предпочтительном воплощении стрептококк группы В представляет собой Streptococcus agalactiae.
Дополнительный аспект изобретения относится к антителам, которые связываются с капсульным полисахаридом в иммуногенной композиции по данному изобретению. В некоторых воплощениях антитела вырабатываются в ответ на введение субъекту иммуногенной композиции. Другой аспект относится к композиции, содержащей антитела по данному изобретению.
Следующий аспект изобретения относится к способу обеспечения пассивного иммунитета у субъекта, включающий стадии (а) получения препарата антитела с использованием иммуногенной композиции, описанной в данном документе; и (б) введение препарата антитела субъекту для обеспечения пассивного иммунитета.
Один аспект изобретения относится к способам приготовления иммуногенных конъюгатов полисахарида и белка по данному изобретению, включающим стадии: (а) реакции капсульного полисахарида GBS с окисляющим агентом с получением в результате активированного полисахарида; и (б) реакции активированного полисахарида с белком-носителем с получением в результате конъюгата полисахарид-белок, где стадию (б) осуществляют в полярном апротонном растворителе. Растворитель может представлять собой диметилсульфоксид (DMSO), сульфолан, диметилформамид (DMF) и гексаметилфосфорамид (НМРА). В предпочтительном воплощении растворитель представляет собой диметилсульфоксид (DMSO).
В одном воплощении полисахарид взаимодействует с 0,01-10,0 молярными эквивалентами окисляющего агента. В конкретном воплощении окисляющий агент представляет собой периодат. В одном таком воплощении периодат представляет собой периодат натрия.
В другом воплощении реакция окисления составляет от 1 часа до 50 часов. В следующем воплощении температуру реакции окисления поддерживают между примерно 2°С и примерно 25°С. В следующем воплощении реакция окисления протекает в буфере, выбранном из группы, состоящей из фосфата натрия, фосфата калия, 2-(N-морфолино)этансульфоновой кислоты (MES) и Bis-Tris. В одном таком воплощении буфер имеет концентрацию от примерно 1 мМ до примерно 500 мМ. В конкретном воплощении реакция окисления протекает при рН от примерно 4,0 до примерно 8,0.
В следующем аспекте изобретения окисляющий агент представляет собой 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO). В одном таком воплощении N-хлоросукцинимид (NCS) представляет собой соокислитель.
В одном воплощении стадия (а) приготовления иммуногенного конъюгата полисахарид-белок по данному изобретению дополнительно включает остановку реакции окисления путем добавления агента-гасителя.
В другом воплощении концентрация полисахарида составляет от примерно 0,1 мг/мл до примерно 10,0 мг/мл.
В дополнительном воплощении степень окисления (DO) активированного полисахарида составляет от 5 до 25.
В другом аспекте изобретения способ дополнительно включает стадию лиофилизирования активированного полисахарида. В одном воплощении активированный полисахарид лиофилизируют в присутствии сахарида, выбранного из группы, состоящей из сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита и палатинита.
В следующем аспекте изобретения стадия (б) приготовления иммуногенного конъюгата полисахарид-белок по данному изобретению включает: (1) приготовление смеси активированного полисахарида и белка-носителя и (2) реакцию полученной смеси активированного полисахарида и белка-носителя с восстанавливающим агентом с образованием конъюгата капсульного полисахарида GBS и белка-носителя. В одном воплощении концентрация активированного полисахарида на стадии (2) составляет от примерно 0,1 мг/мл до примерно 10,0 мг/мл. В дополнительном воплощении исходное соотношение (по массе) активированного полисахарида и белка-носителя составляет от 5:1 до 0,1:1. В другом воплощении восстанавливающий агент выбран из группы, состоящей из цианборгидрида натрия (NaBH3CN), триацетоксиборгидрида натрия, боргидрида натрия или цинка в присутствии кислот Брёнстеда или Льюиса, аминоборанов, таких как пиридинборан, 2-пиколинборан, 2,6-диборан-метанол, диметиламин-боран, t-BuMeiPrN-ВН3, бензиламин-ВН3 или 5-этил-2-метилпиридинборан (РЕМВ). В предпочтительном воплощении восстанавливающий агент представляет собой (NaBH3CN). В еще одном воплощении количество восстанавливающего агента составляет от примерно 0,1 до примерно 10,0 молярных эквивалентов. В следующем воплощении продолжительность реакция восстановления стадии (2) составляет от 1 часа до 60 часов. В другом воплощении температуру в ходе реакции восстановления поддерживают между 10°С и 40°С.
В дополнительном аспекте изобретения способ приготовления иммуногенного конъюгата полисахарид-белок дополнительно включает стадию (стадию в)) блокирования непрореагировавшего альдегида посредством добавления боргидрида. В одном воплощении количество боргидрида составляет от примерно 0,1 до примерно 10,0 молярных эквивалентов. В другом воплощении боргидрид выбран из группы, состоящей из боргидрида натрия (NaBH4), цианборгидрида натрия, боргидрида лития, боргидрида калия, боргидрида тетрабутиламмония, боргидрида кальция и боргидрида магния. В предпочтительном воплощении боргидрид представляет собой боргидрид натрия (NaBH4). В следующем воплощении продолжительность стадии блокирования составляет от 0,1 часа до 10 часов. В еще одном воплощении температуру в ходе стадии блокирования поддерживают между примерно 15°С и примерно 45°С.
В другом аспекте изобретения способ дополнительно включает стадию очистки конъюгата полисахарид-белок. В одном воплощении конъюгат полисахарид-белок содержит менее примерно 40% свободного полисахарида относительно общего количества полисахарида. В другом воплощении соотношение (по массе) полисахарида и белка-носителя в конъюгате составляет от примерно 0,5 до примерно 3,0. В следующем воплощении степень конъюгации в конъюгате составляет от 2 до 15.
В еще одном аспекте изобретение относится к способам приготовления иммуногенных конъюгатов полисахарид-белок по данному изобретению, включающим стадии: (а) реакции выделенного капсульного полисахарида GBS с окисляющим агентом; (б) остановки реакции окисления стадии (а) путем добавления агента-гасителя с получением в результате активированного капсульного полисахарида GBS; (в) приготовления смеси активированного капсульного полисахарида GBS с белком-носителем, (г) реакции приготовленной смеси активированного капсульного полисахарида GBS и белка-носителя с восстанавливающим агентом с образованием конъюгата капсульного полисахарида GBS и белка-носителя и (д) блокирования непрореагировавшего альдегида посредством добавления боргидрида натрия (NaBH4), где стадии (в), (г) и (д) осуществляют в DMSO.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1 Сравнение опсонизирующей активности сыворотки и выделенного IgG мышей, иммунизированных моновалентными вакцинами GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197.
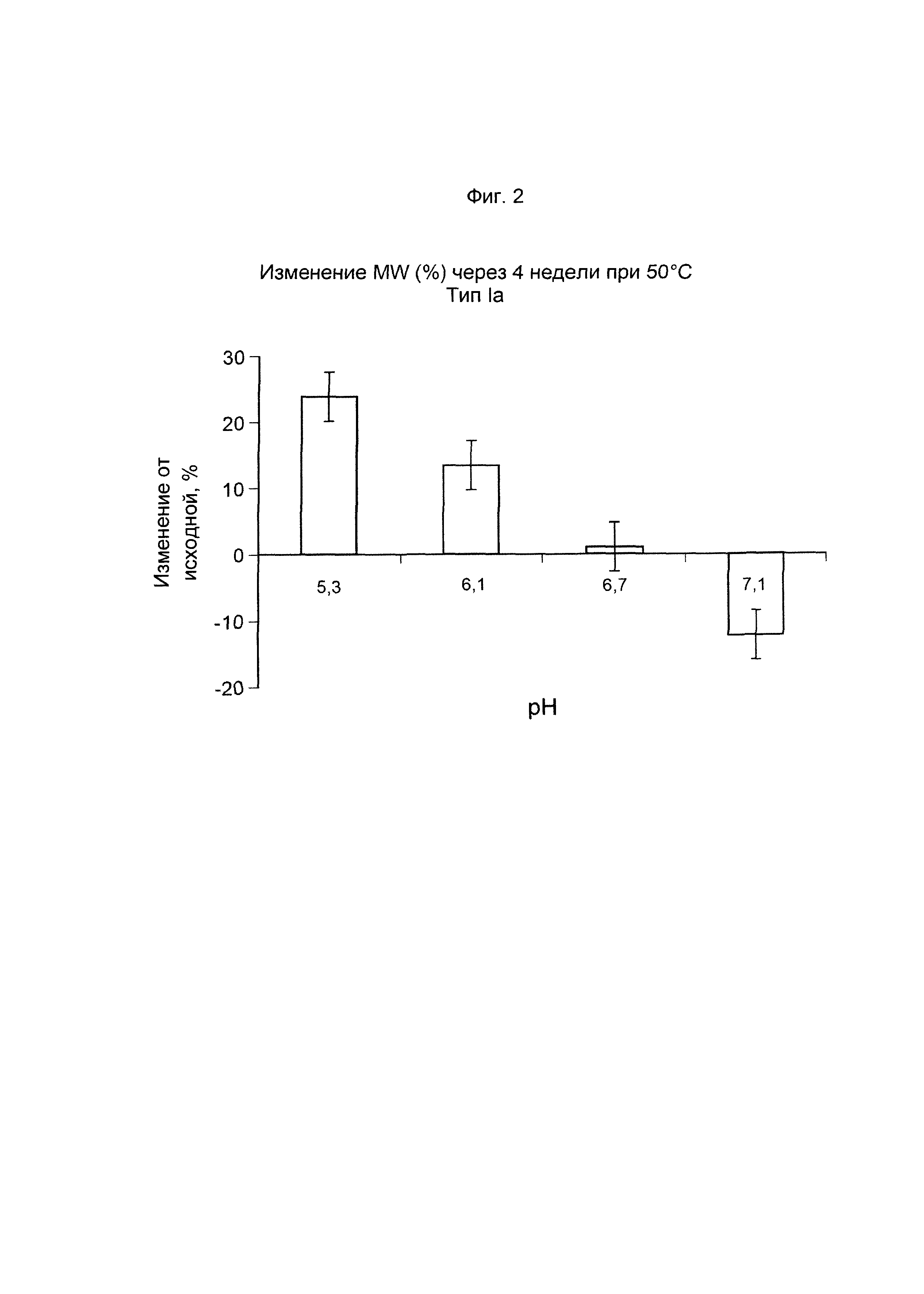
ФИГ. 2 Стабильность GBS Ia-CRM197 (показана как изменение молекулярной массы, выраженное в %, по данным SEC MALLS (гель-хроматография с детекцией многоуглового лазерного рассеивания)) после ускоренного старения (4 недели) при 50°С.
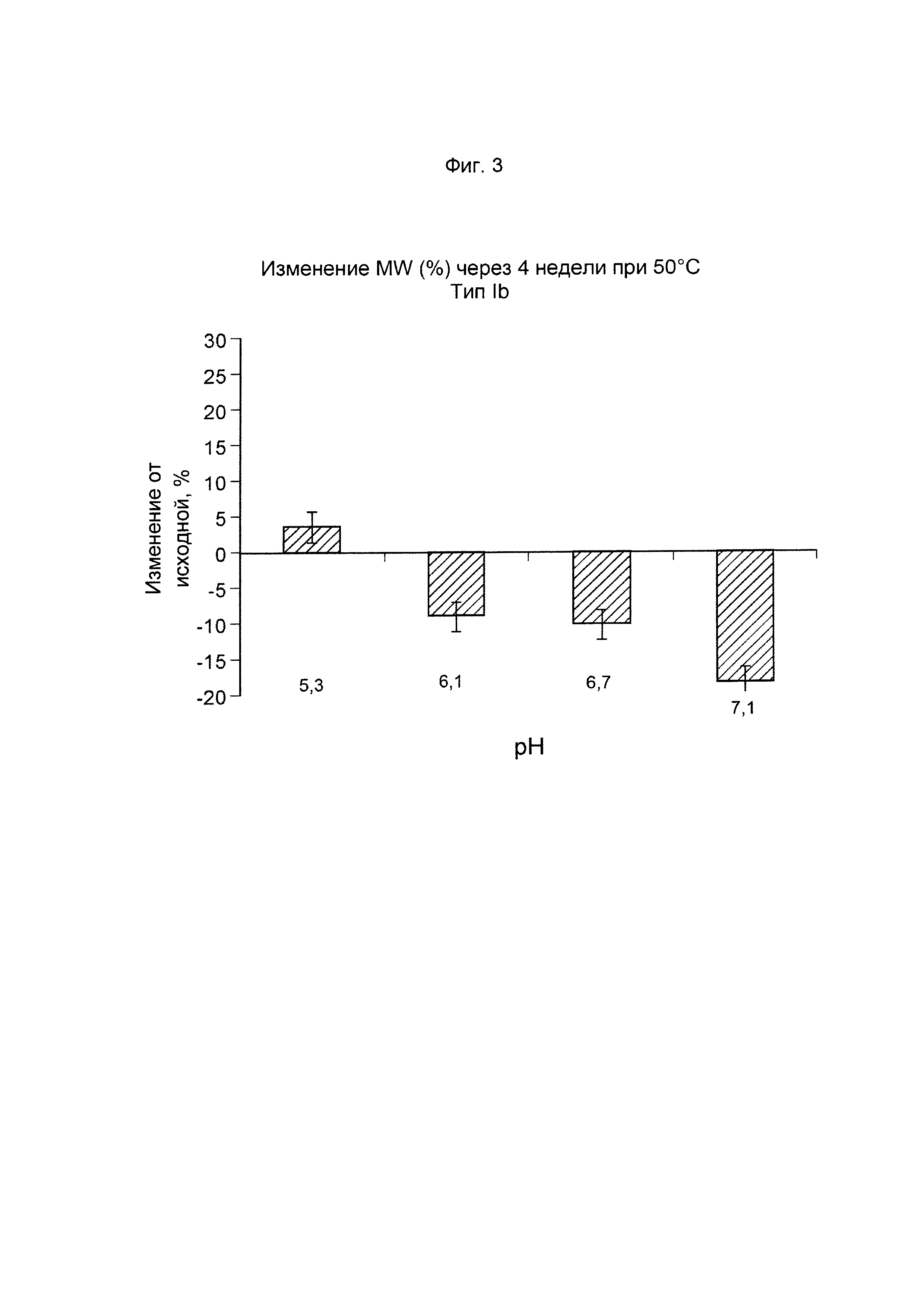
ФИГ. 3 Стабильность GBS Ib-CRM197 (показана как изменение молекулярной массы, выраженное в %, по данным SEC MALLS) после ускоренного старения (4 недели) при 50°С.
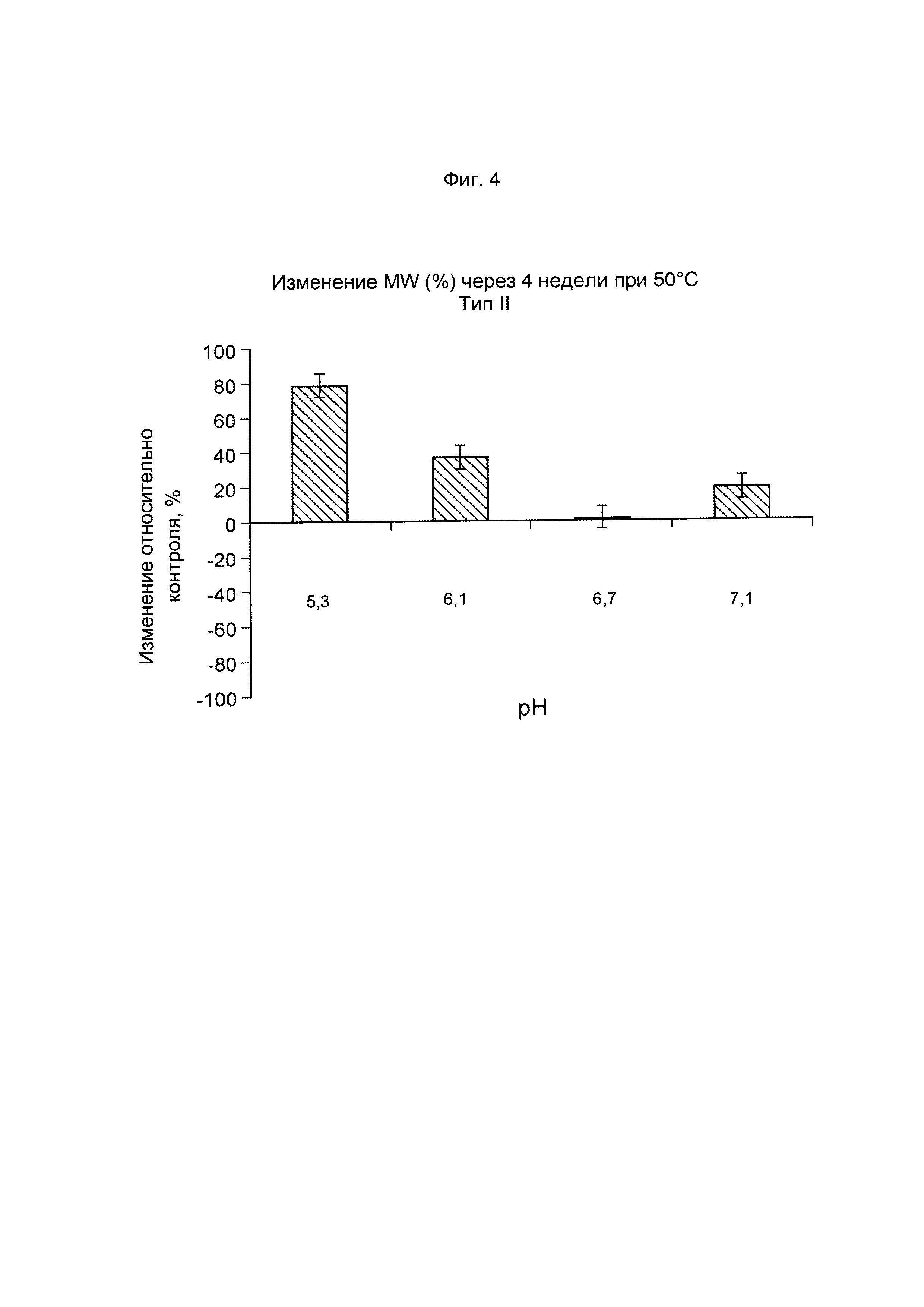
ФИГ. 4 Стабильность GBS II-CRM197 (показана как изменение молекулярной массы, выраженное в %, по данным SEC MALLS) после ускоренного старения (4 недели) при 50°С.
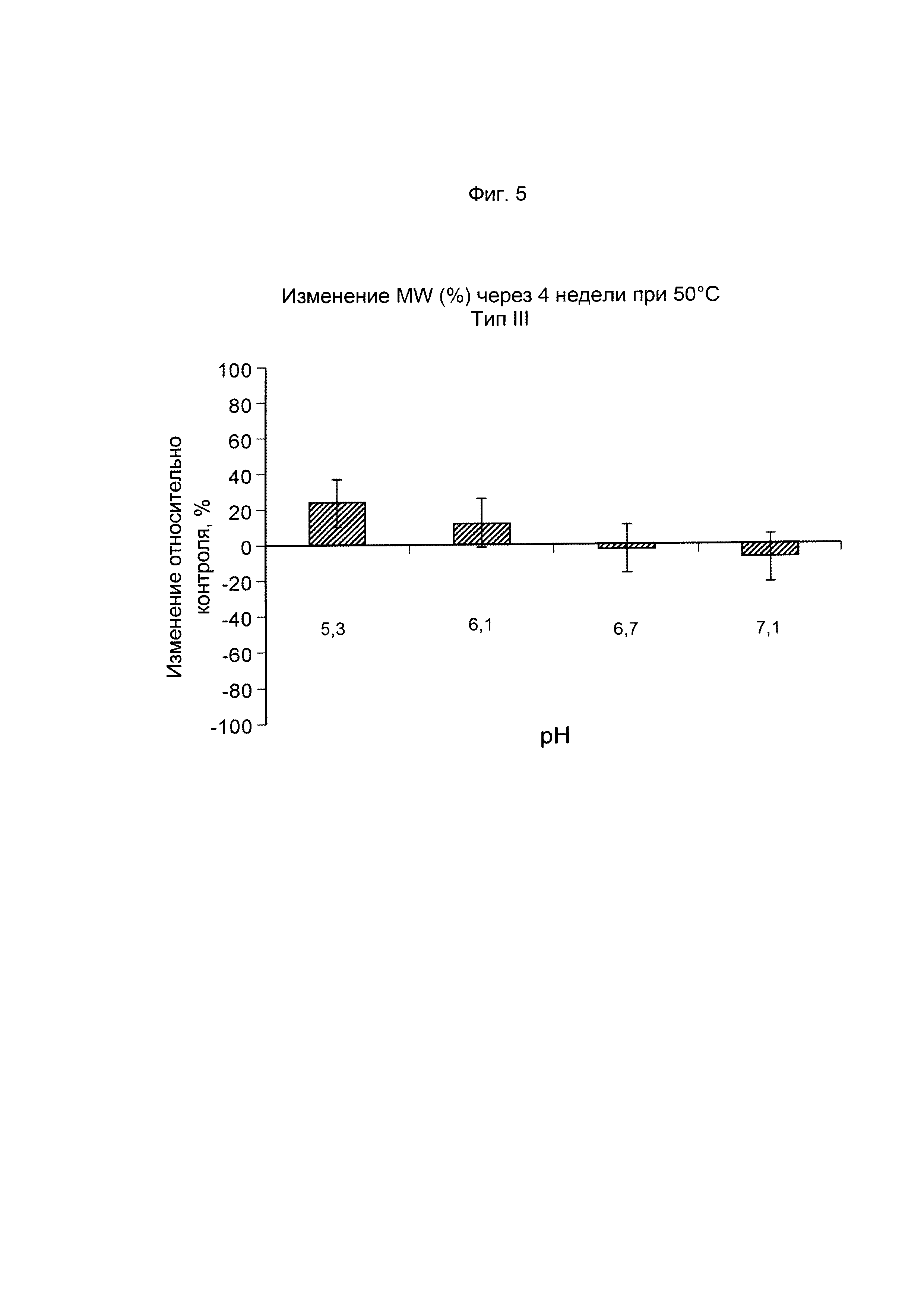
ФИГ. 5 Стабильность GBS III-CRM197 (показана как изменение молекулярной массы, выраженное в %, по данным SEC MALLS) после ускоренного старения (4 недели) при 50°С.
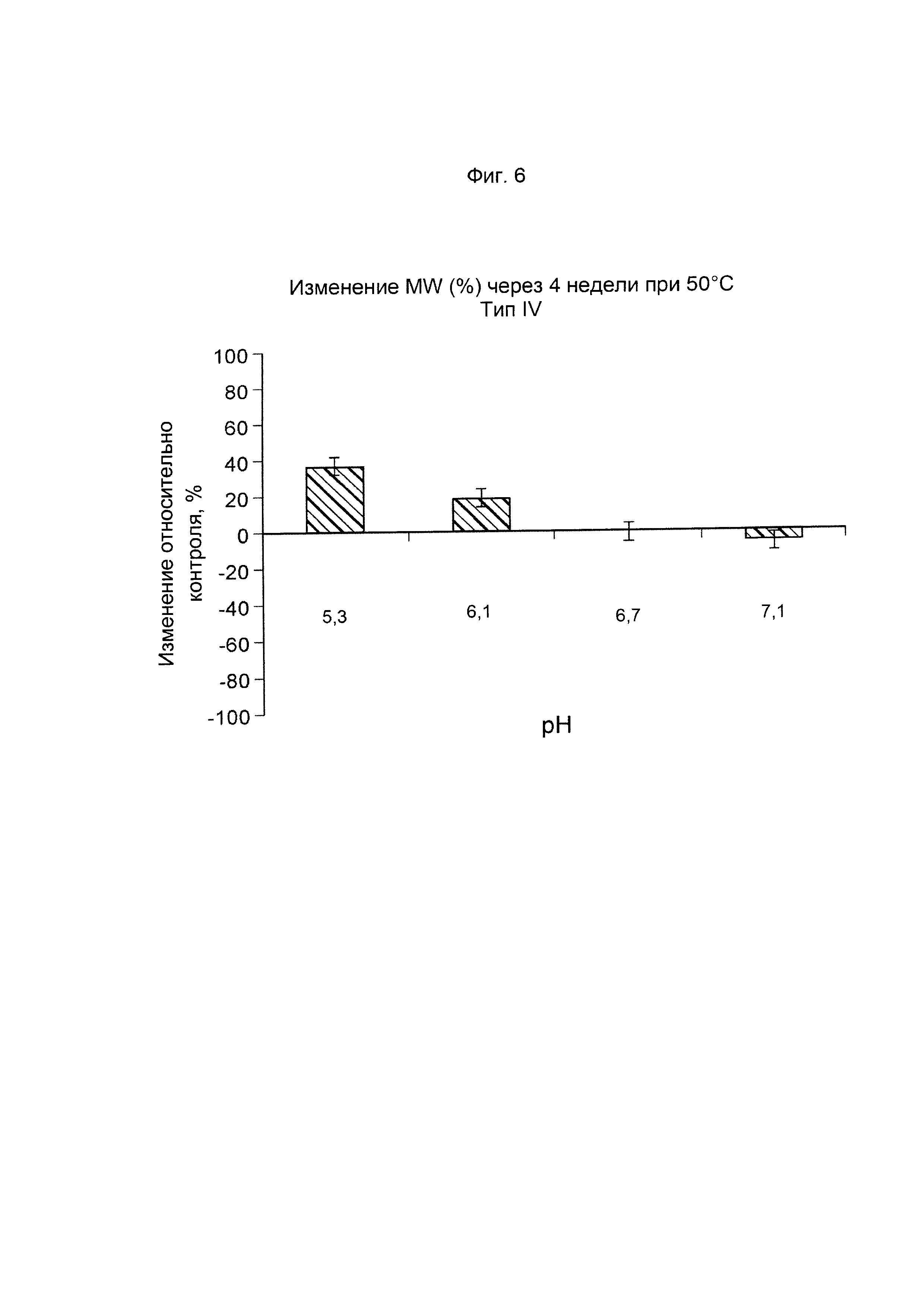
ФИГ. 6 Стабильность GBS IV-CRM197 (показана как изменение молекулярной массы, выраженное в %, по данным SEC MALLS) после ускоренного старения (4 недели) при 50°С.
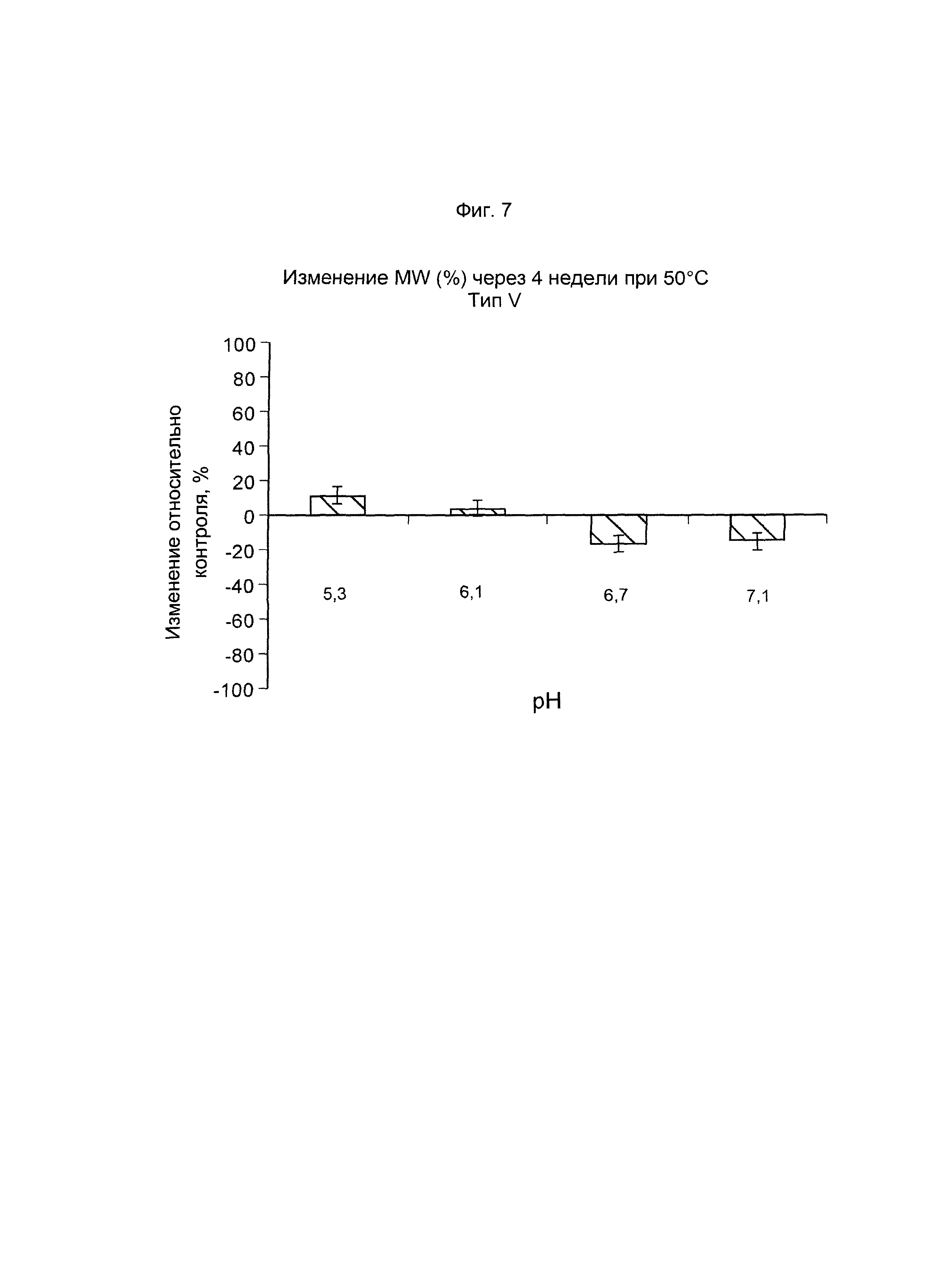
ФИГ. 7 Стабильность GBS V-CRM197 (показана как изменение молекулярной массы, выраженное в %, по данным SEC MALLS) после ускоренного старения (4 недели) при 50°С.
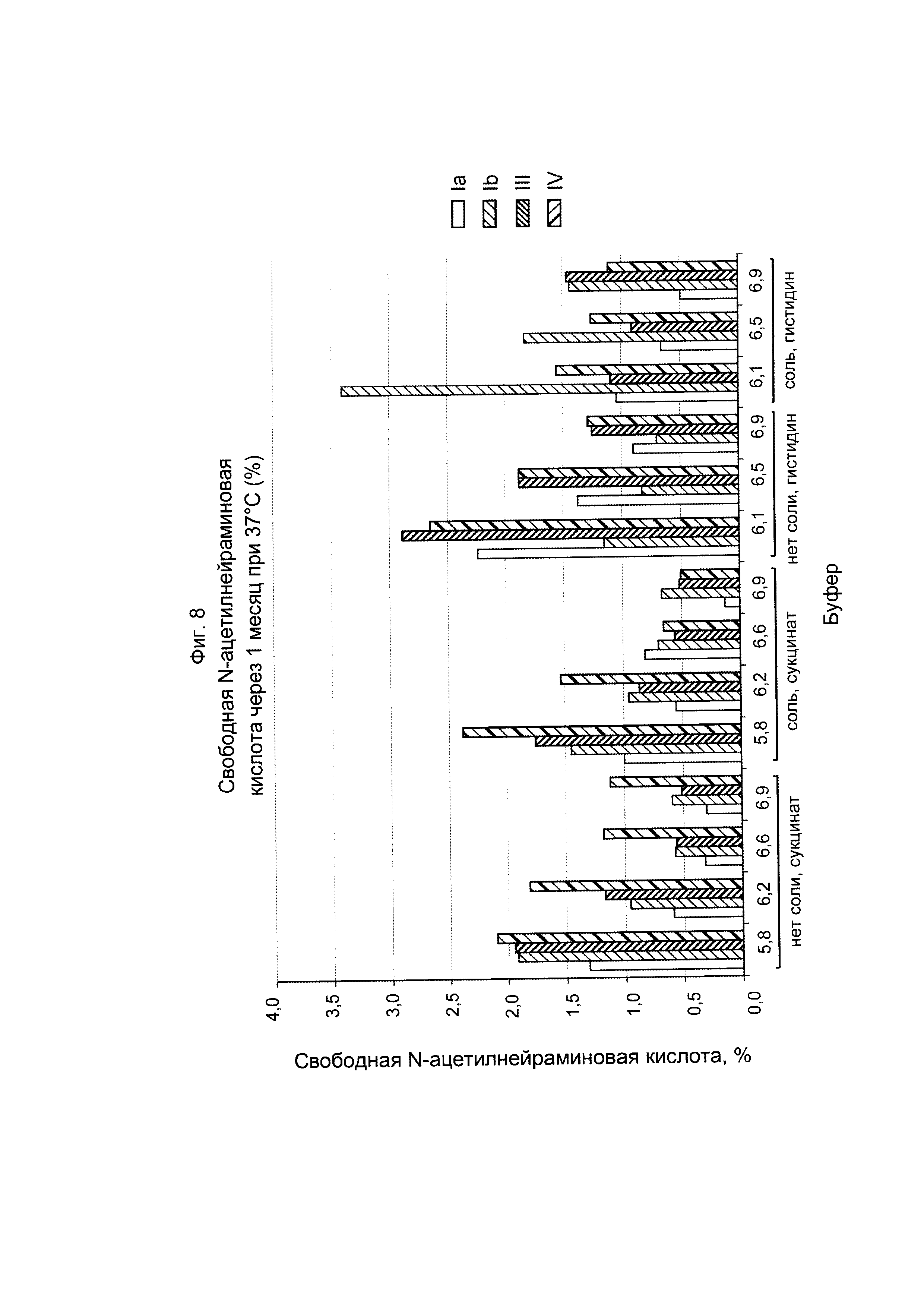
ФИГ. 8 Стабильность GBS Ia-CRM197, GBS Ib-CRM197, GBS III-CRM197 и GBS IV-CRM197 (показана как свободная сиаловая кислота) после хранения при 37°С.
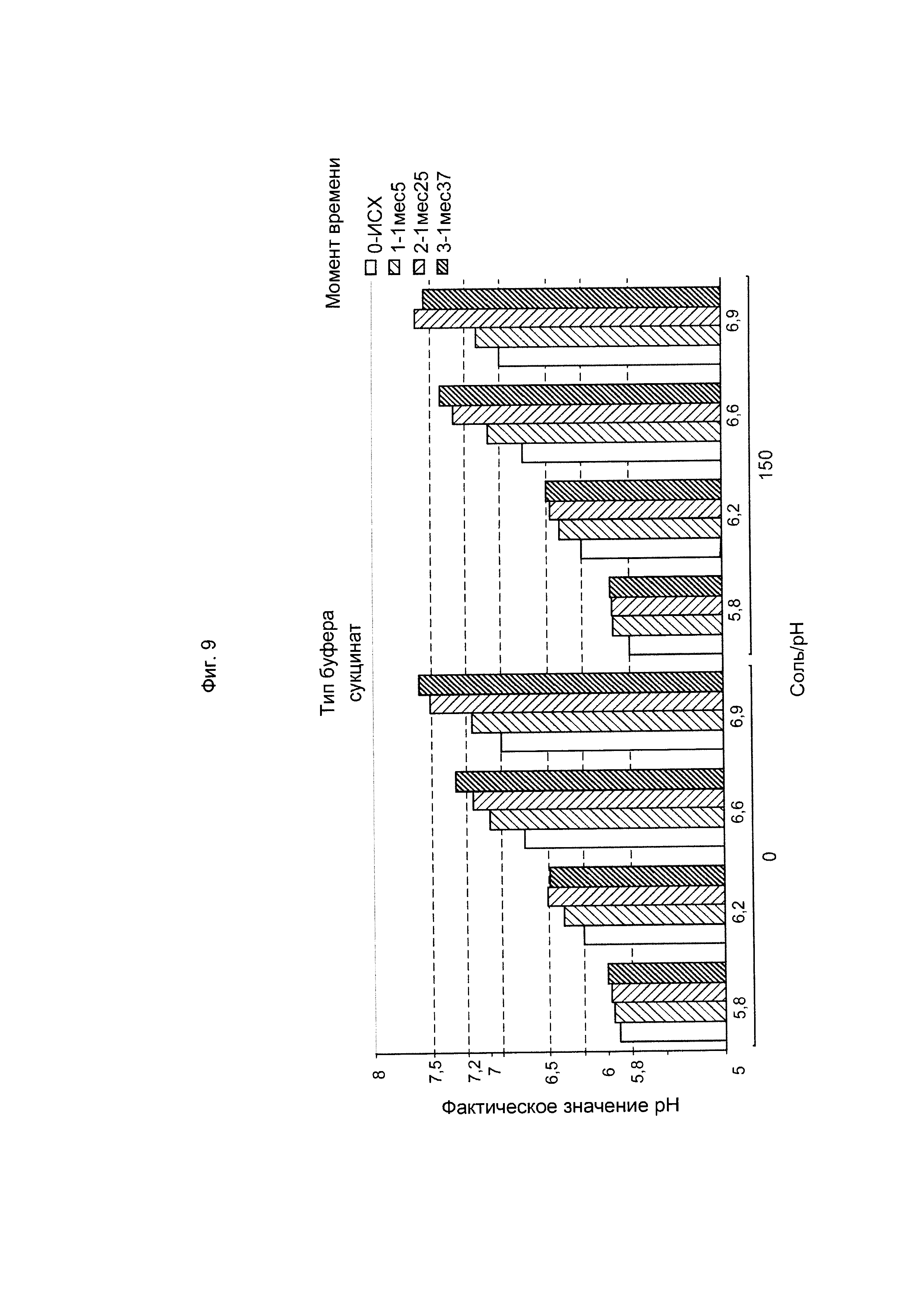
ФИГ. 9 Стабильность рН шестивалентной вакцины (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) при использовании сукцината в качестве буфера.
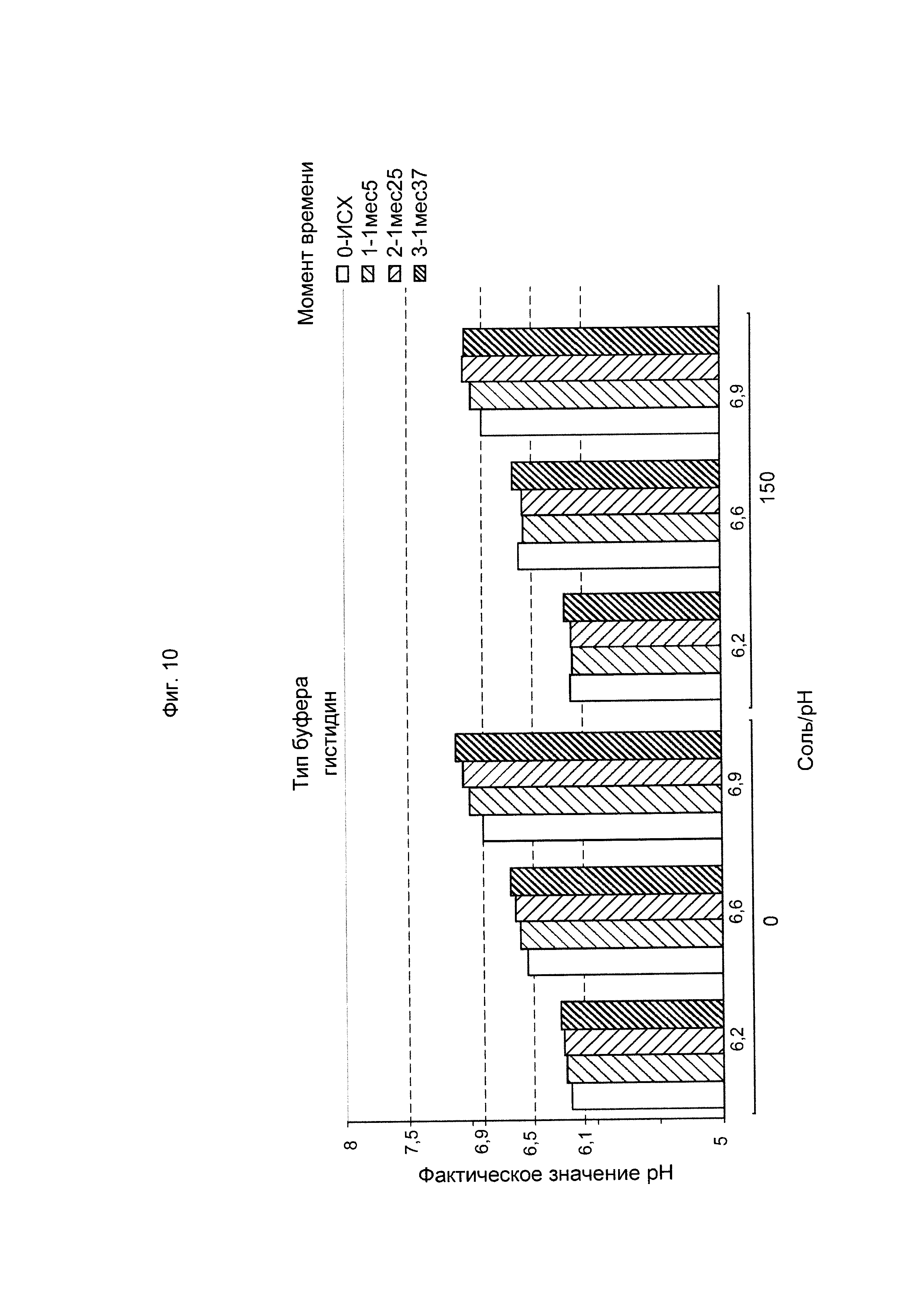
ФИГ. 10 Стабильность рН шестивалентной вакцины (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) при использовании гистидина в качестве буфера.
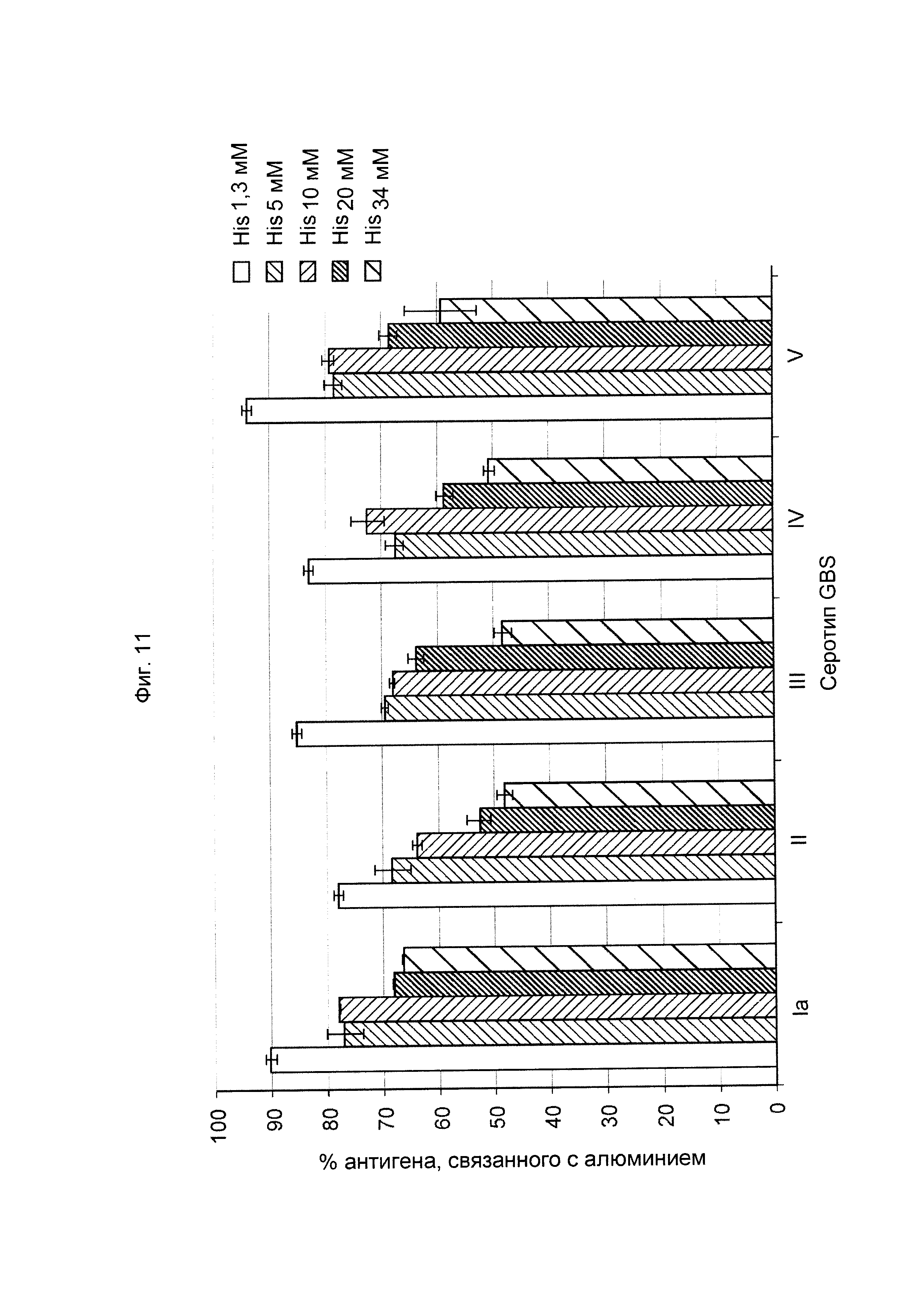
ФИГ. 11 Влияние концентрации гистидинового буфера в шестивалентной вакцине (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на связывание конъюгатов GBS с алюминием в дозе 10 мкг/мл.
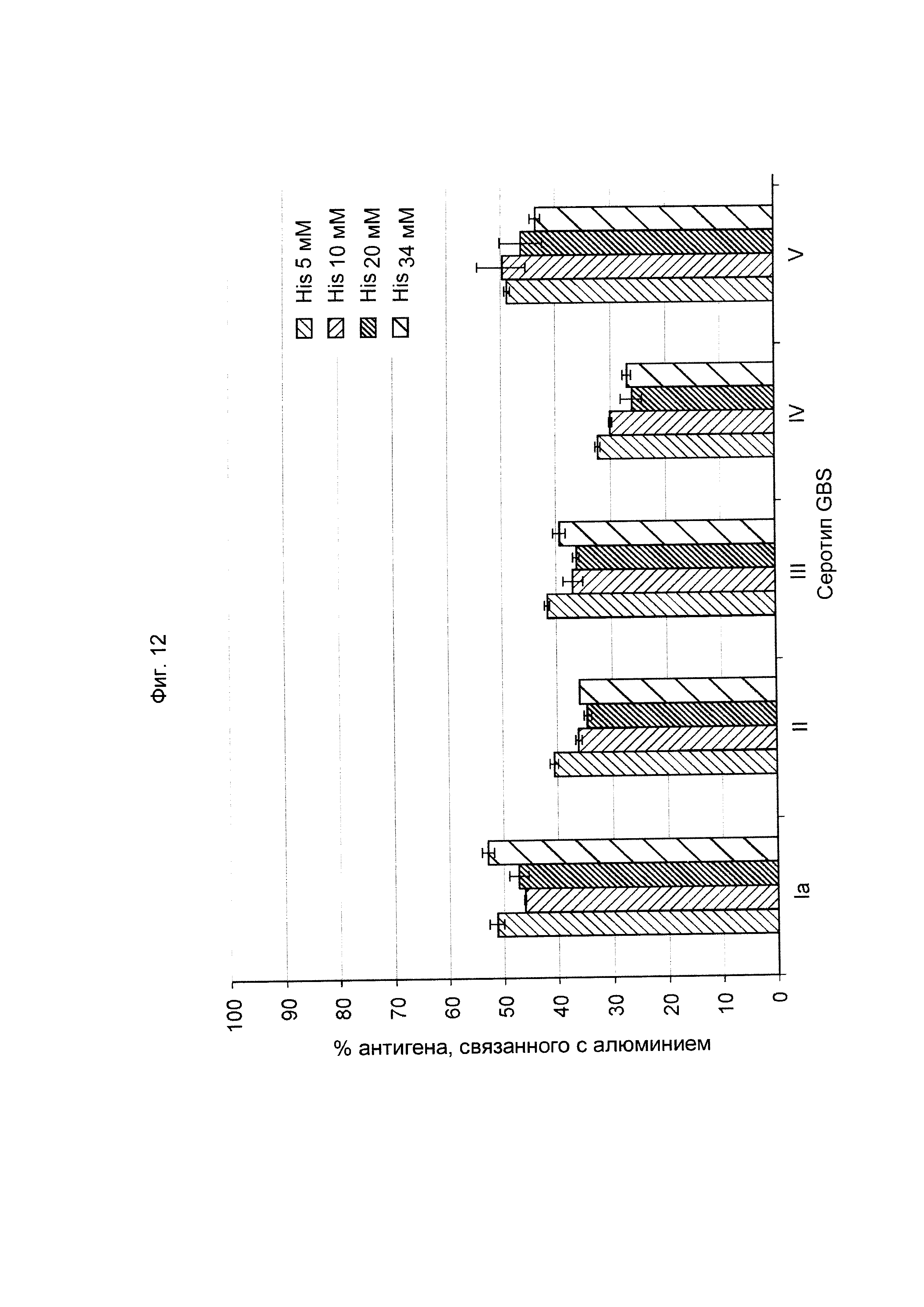
ФИГ. 12 Влияние концентрации гистидинового буфера в шестивалентной вакцине против GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на связывание конъюгатов GBS с алюминием в дозе 40 мкг/мл.
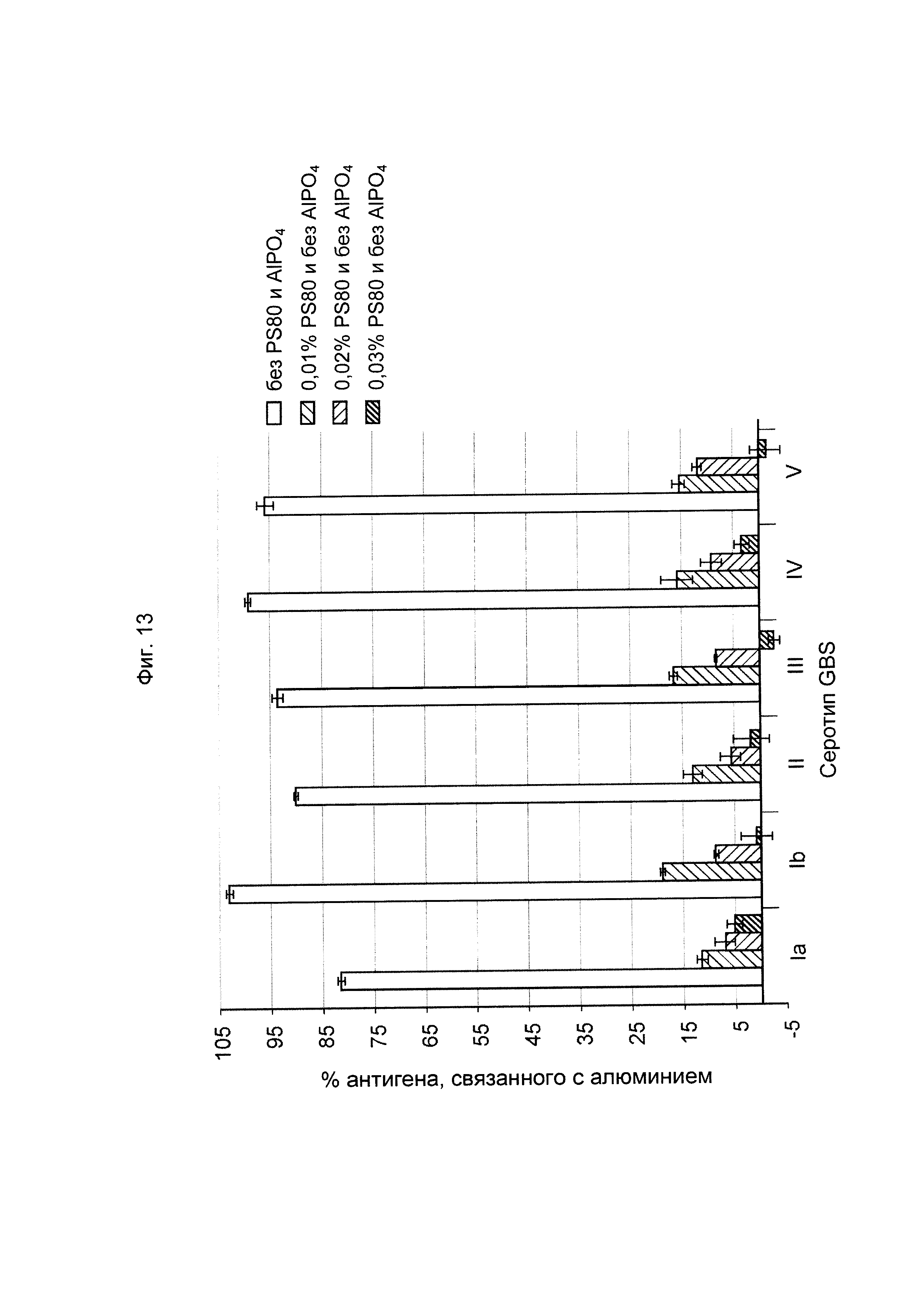
ФИГ. 13 Влияние концентрации полисорбата-80 в шестивалентной вакцине против GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на снижение общей антигенности, выраженное в %, при стрессе, вызванном перемешиванием.
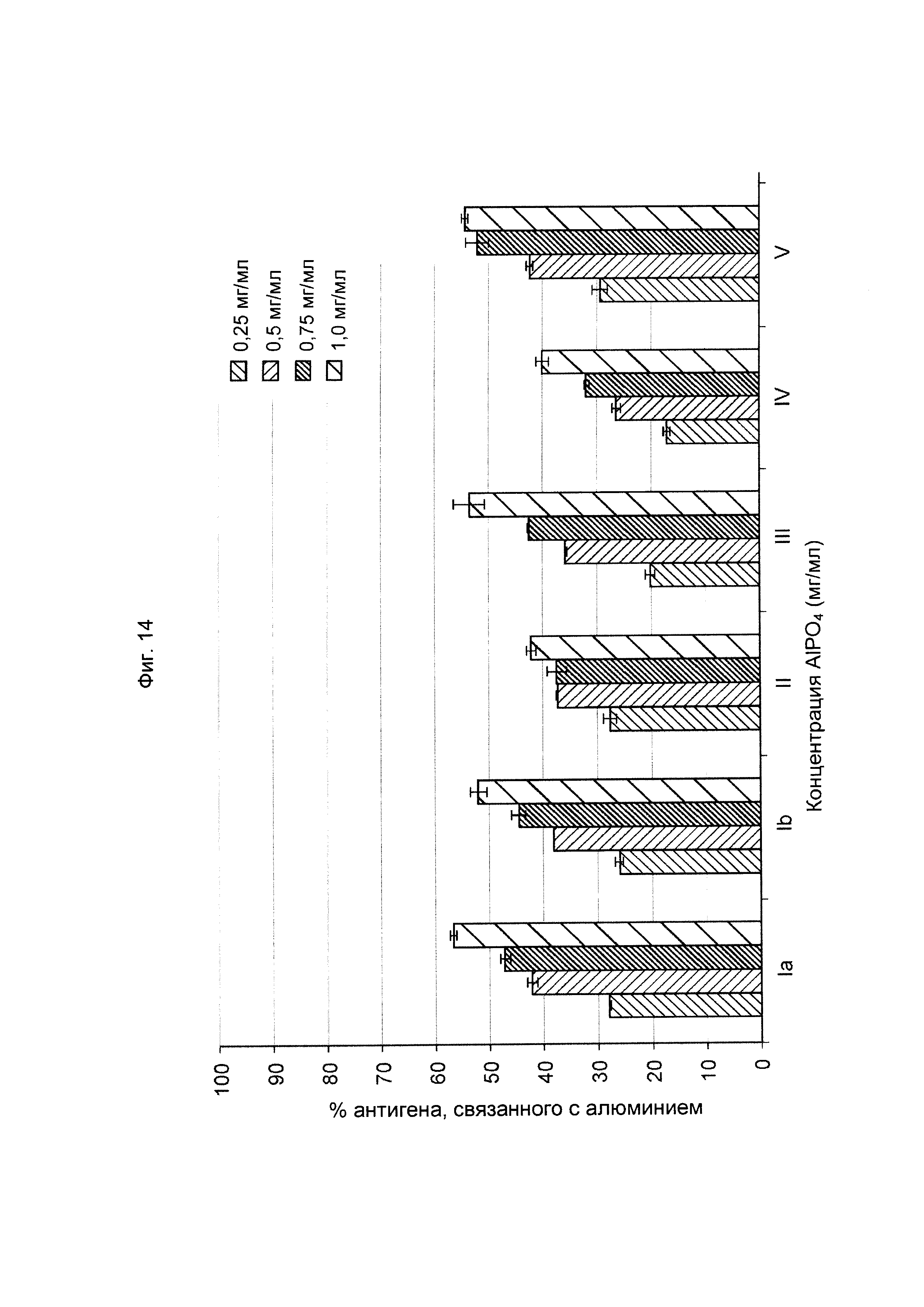
ФИГ. 14 Влияние концентрации алюминия в шестивалентной вакцине против GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на связывание конъюгатов GBS с алюминием.
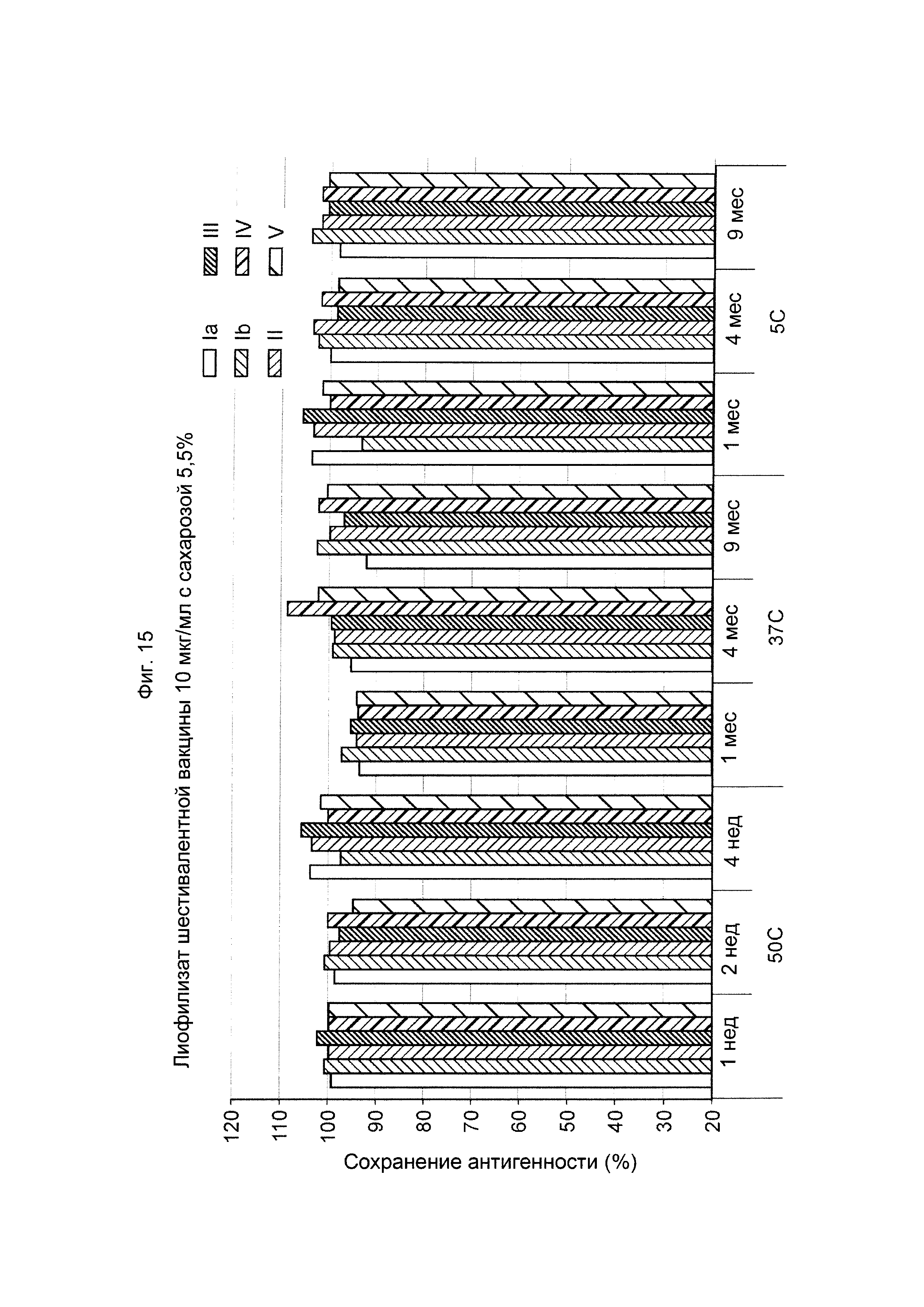
ФИГ. 15 Влияние 5,5% (масс./об.) сахарозы в 10 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
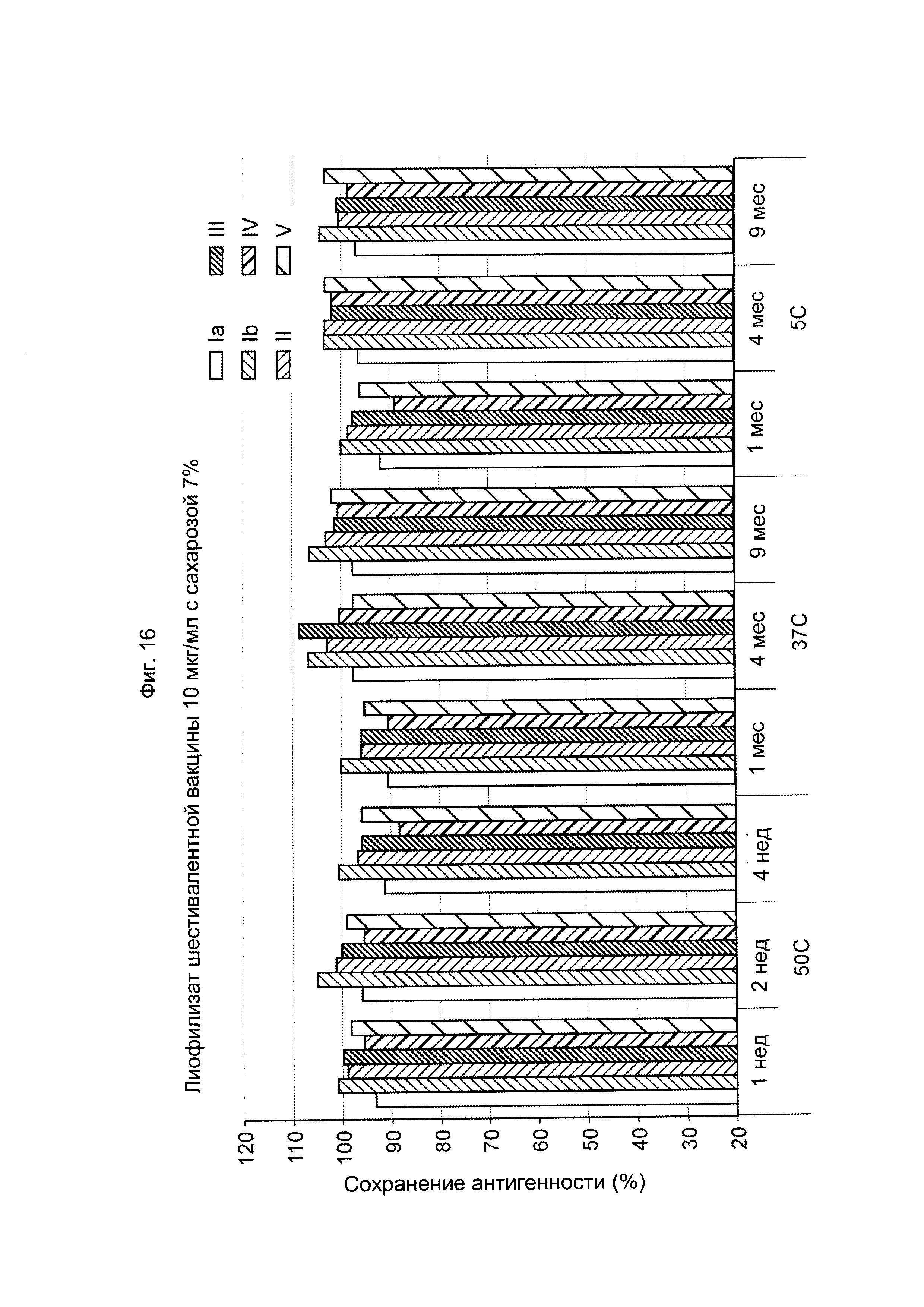
ФИГ. 16 Влияние 7,0% (масс./об.) сахарозы в 10 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
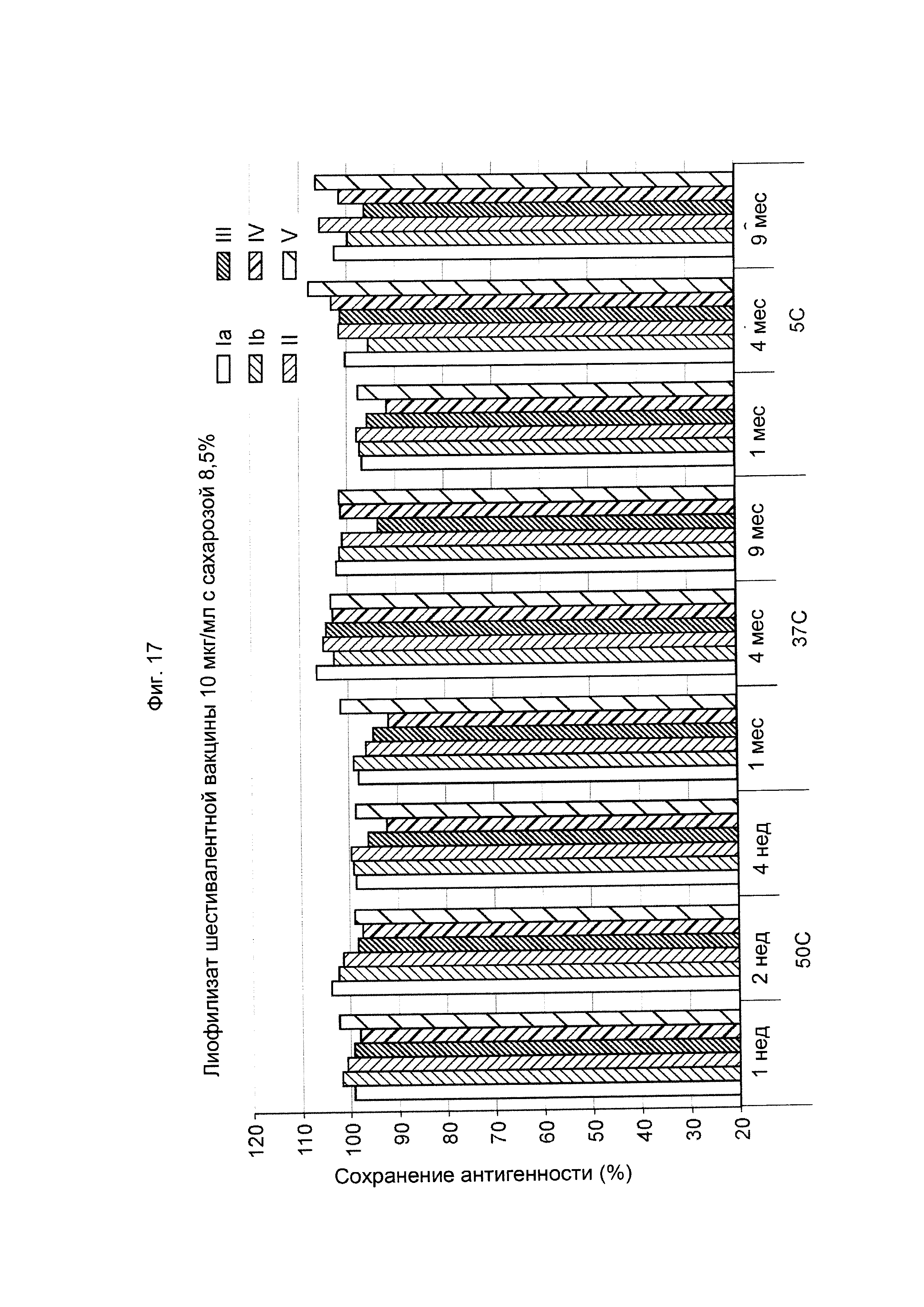
ФИГ. 17 Влияние 8,5% (масс./об.) сахарозы в 10 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
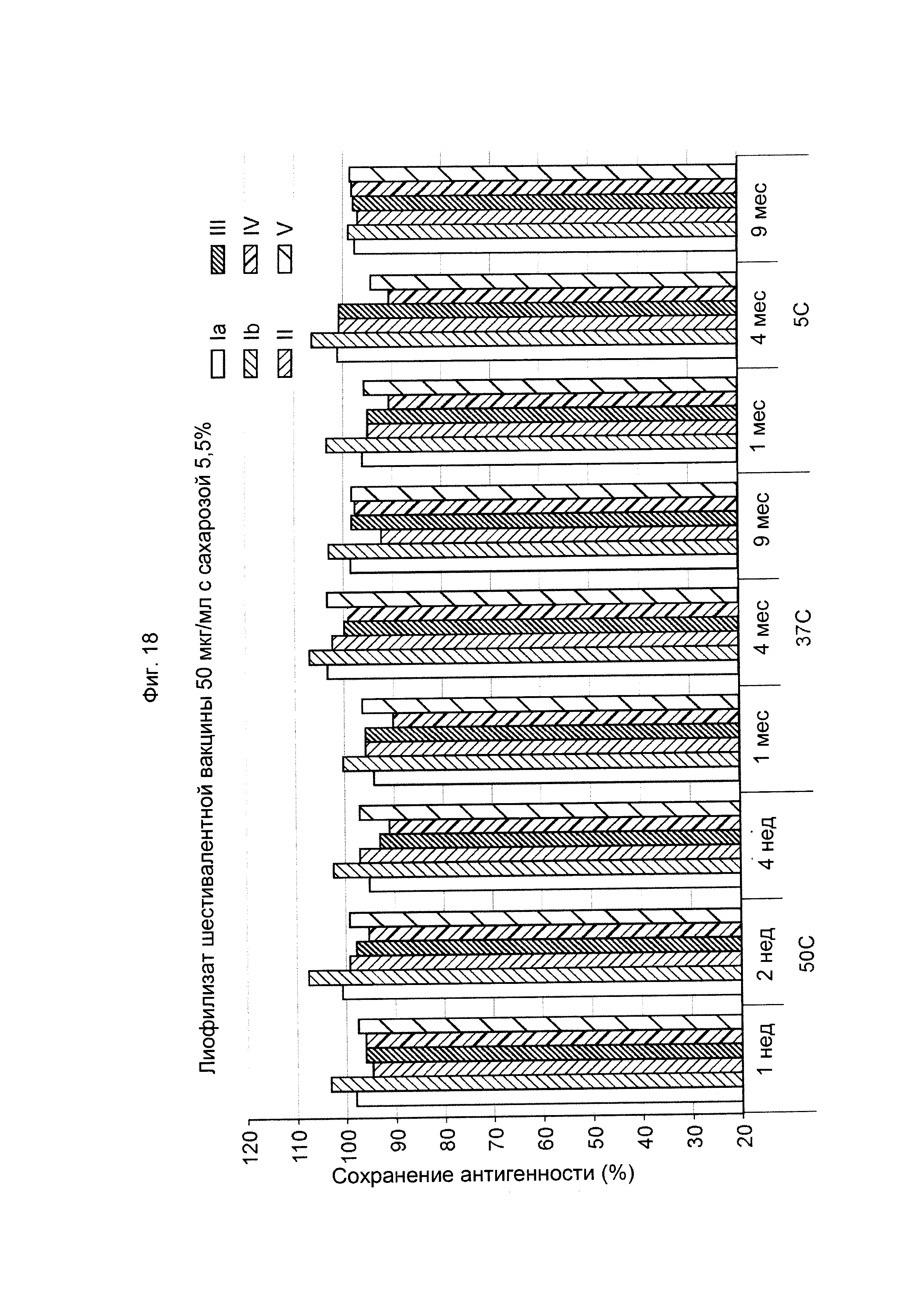
ФИГ. 18 Влияние 5,5% (масс./об.) сахарозы в 50 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
ФИГ. 19 Влияние 7,0% (масс./об.) сахарозы в 50 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
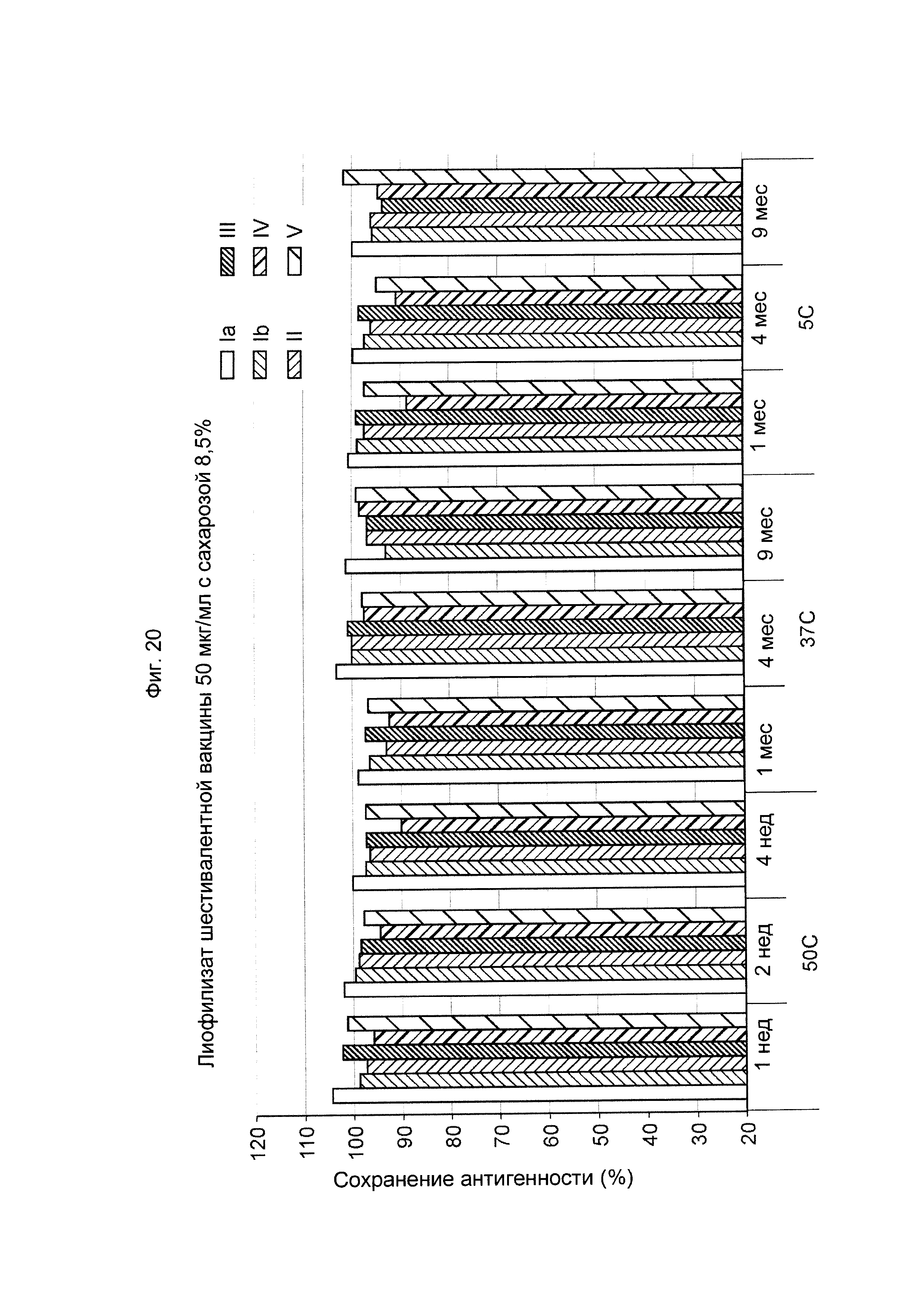
ФИГ. 20 Влияние 8,5% (масс./об.) сахарозы в 50 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197,GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
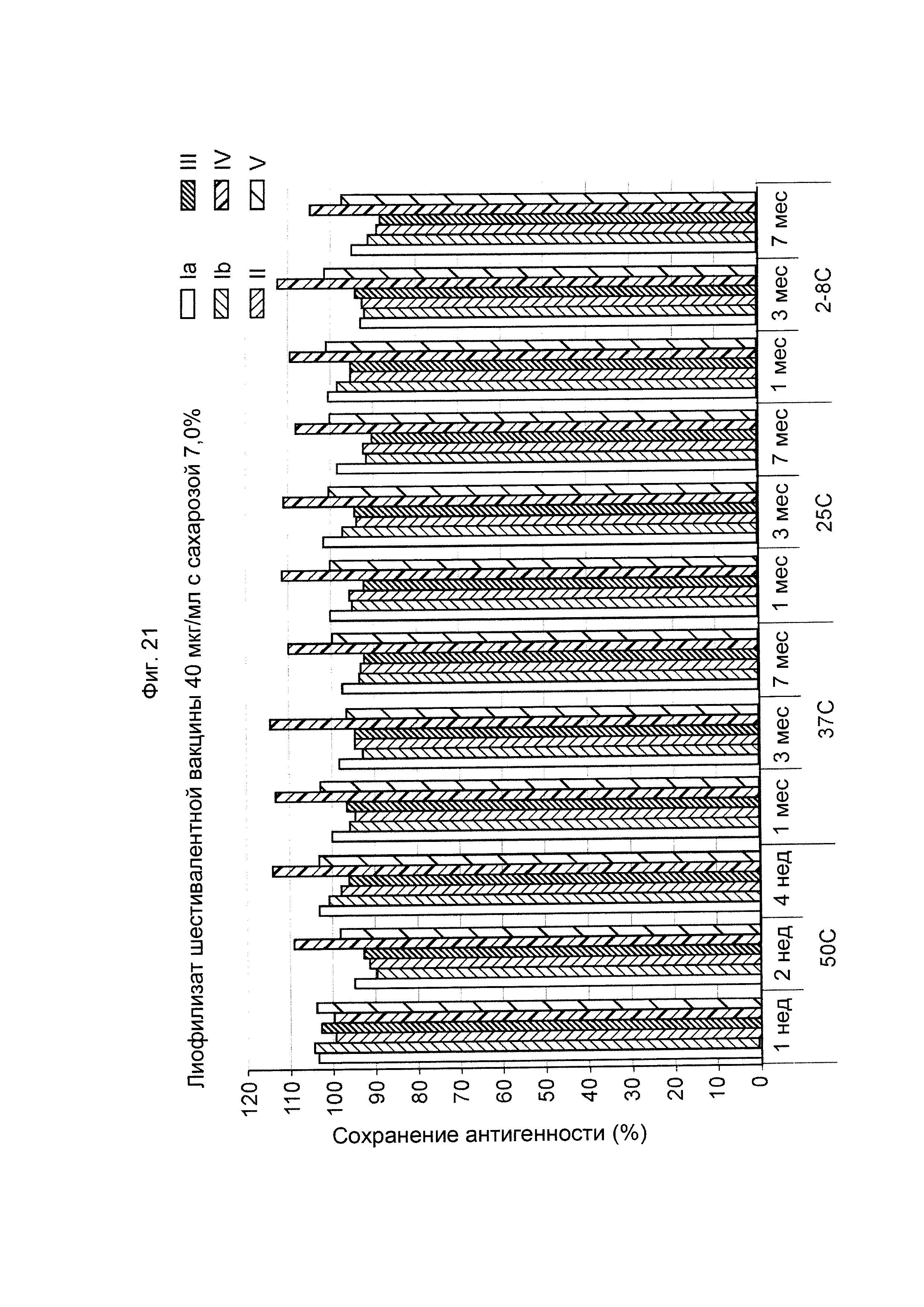
ФИГ. 21 Влияние 7,0% (масс./об.) сахарозы в 40 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
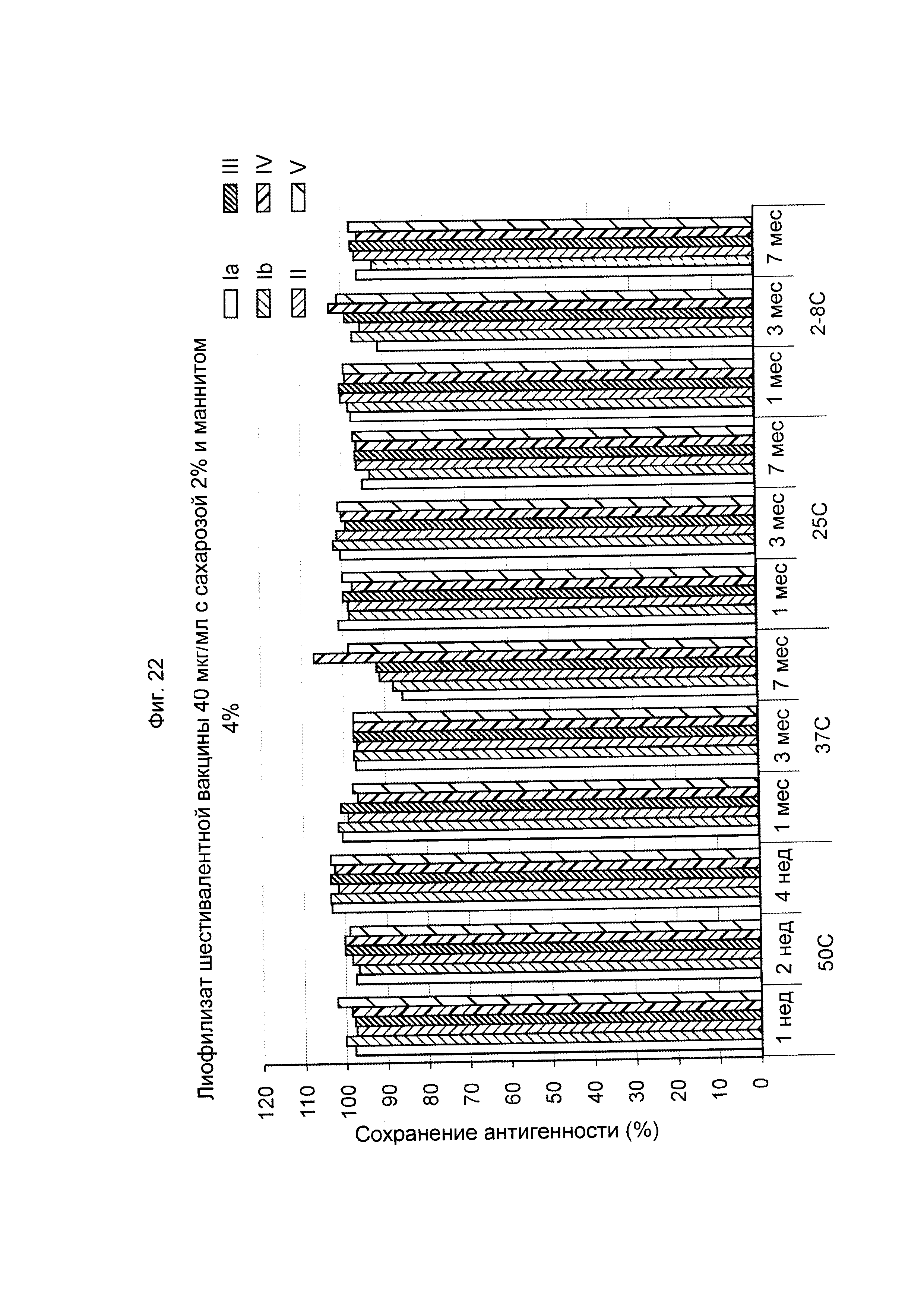
ФИГ. 22 Влияние 2,0% (масс./об.) сахарозы и 4,0% (масс./об.) маннита в 40 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
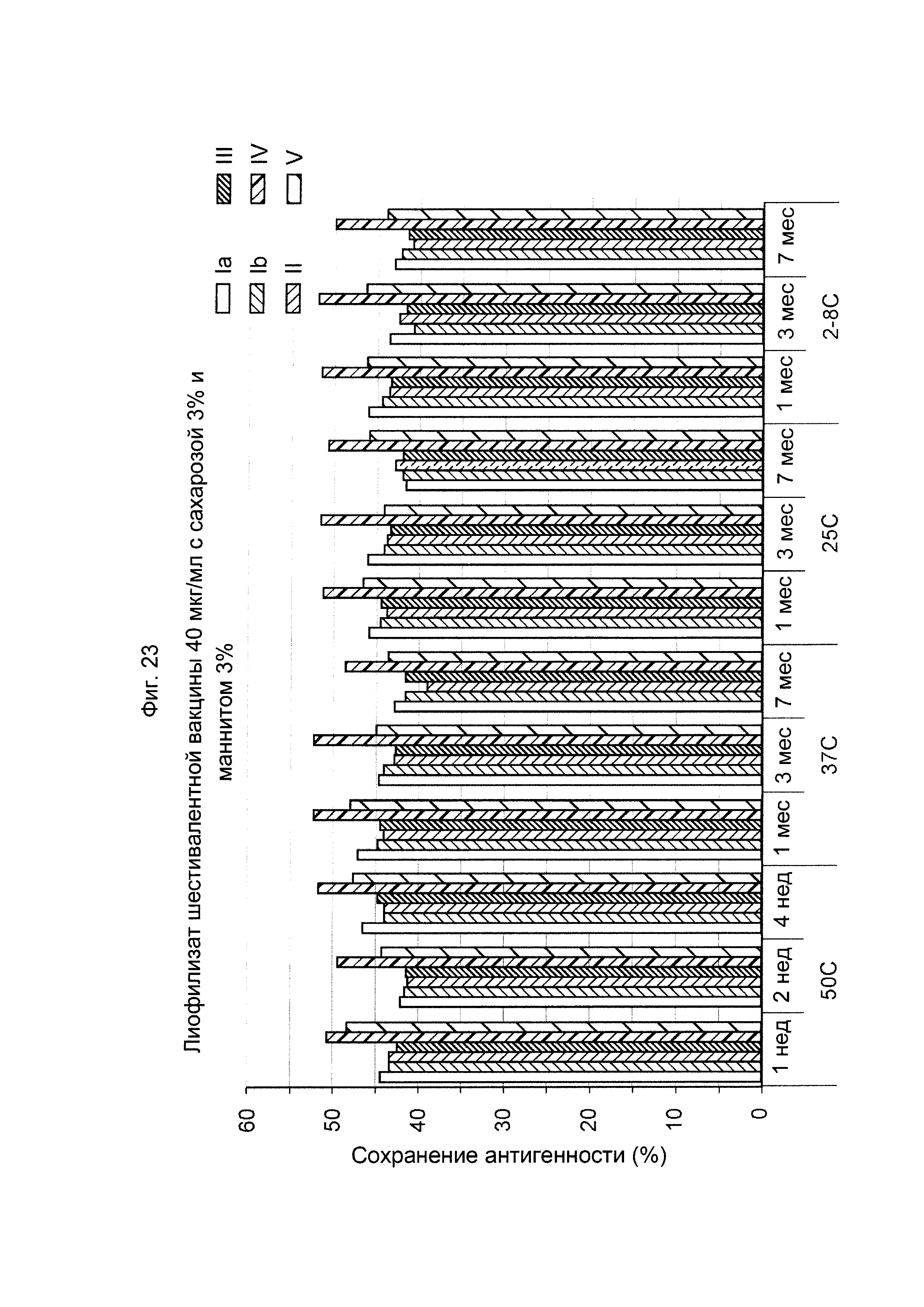
ФИГ. 23 Влияние 3,0% (масс./об.) сахарозы и 3,0% (масс./об.) маннита в 40 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
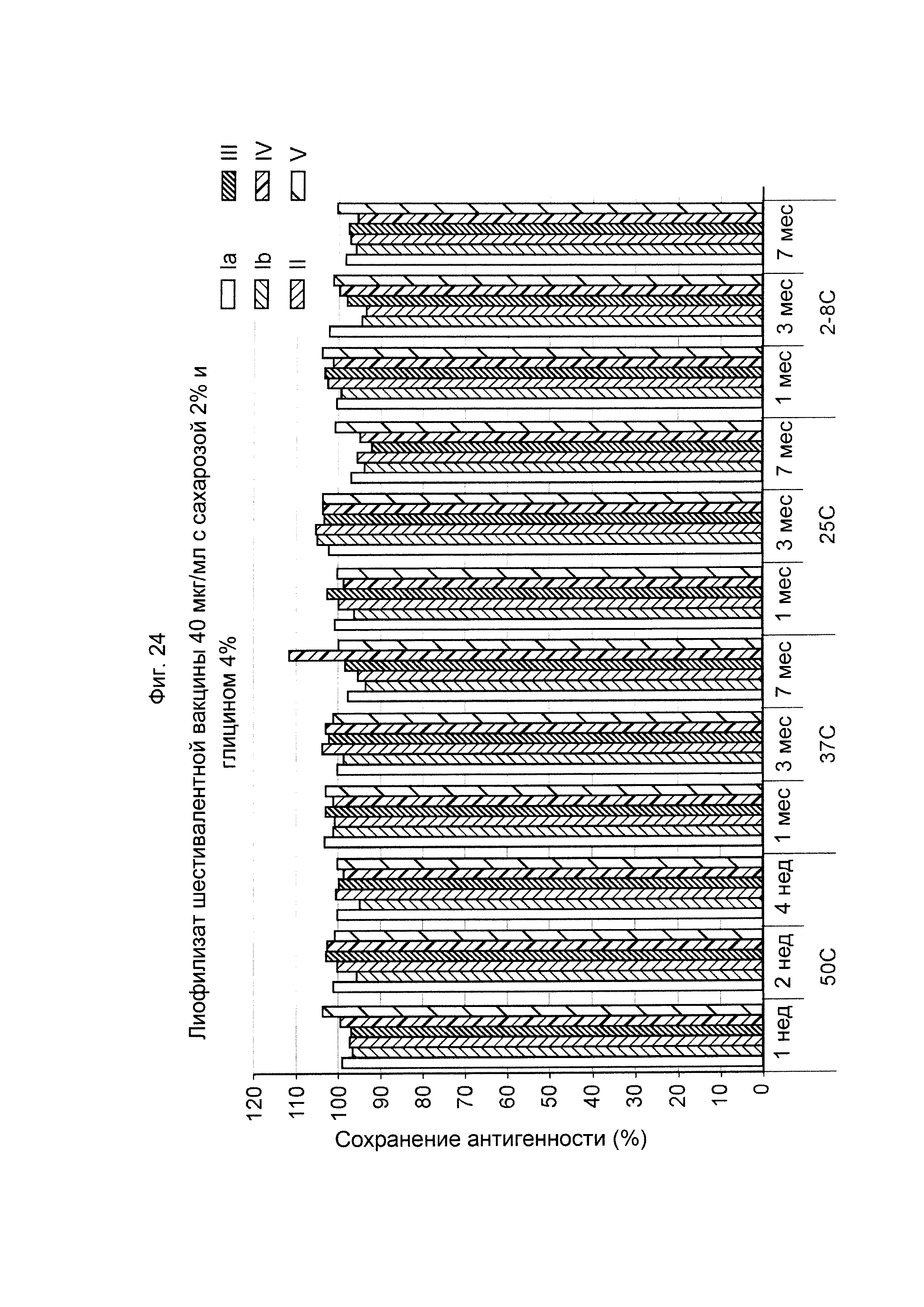
ФИГ. 24 Влияние 2,0% (масс./об.) сахарозы и 4,0% (масс./об.) глицина в 40 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
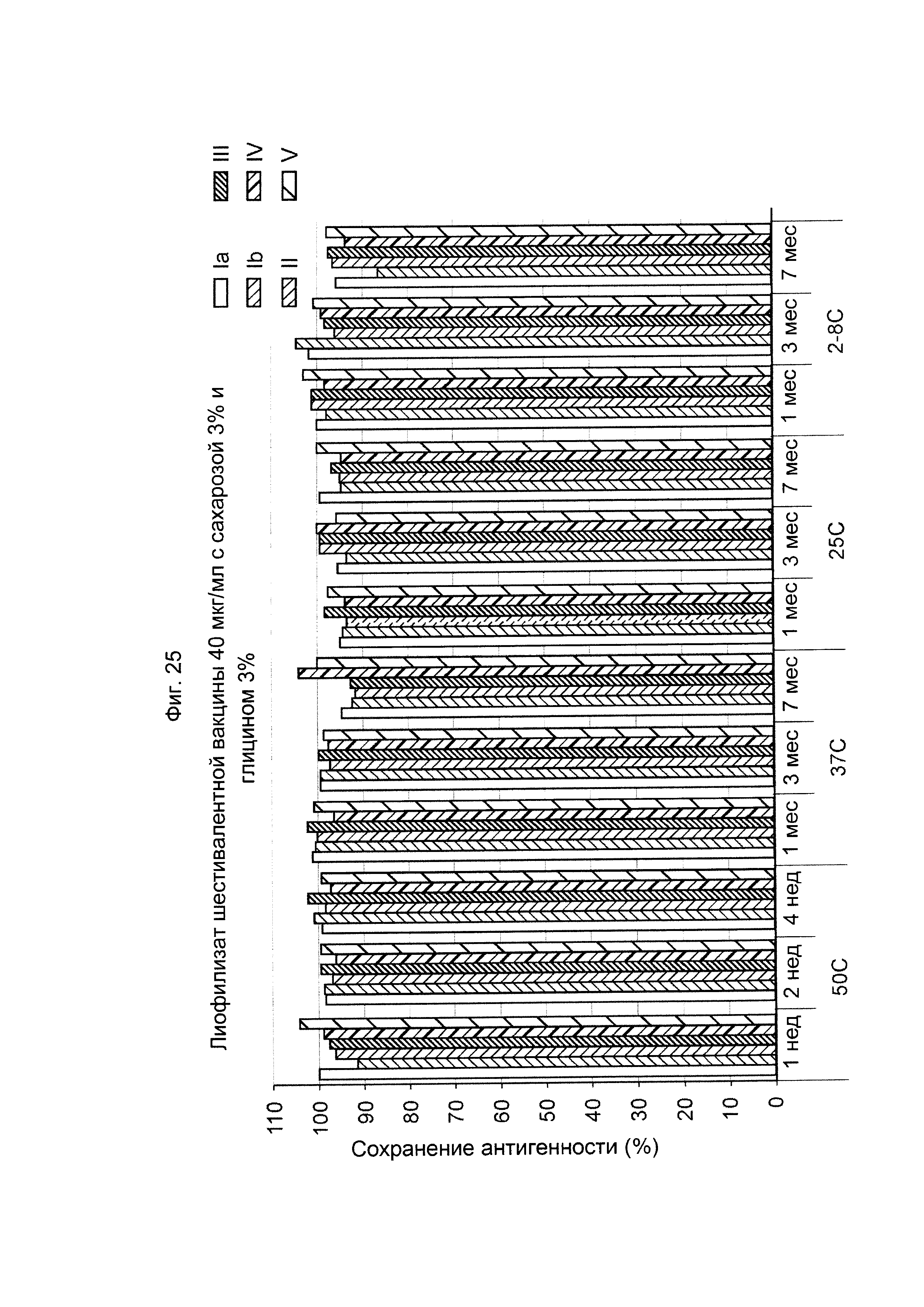
ФИГ. 25 Влияние 3,0% (масс./об.) сахарозы и 3,0% (масс./об.) глицина в 40 мкг/мл дозе лиофилизированной шестивалентной вакцины GBS (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197) на сохранение антигенности, показанное для каждого серотипа.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что данное изобретение не ограничено конкретными способами и описанными условиями эксперимента, поскольку указанные способы и условия могут варьировать. Также следует понимать, что использованная в данном документе терминология служит исключительно для целей описания конкретных воплощений и не является ограничивающей.
Ниже будут приведены предпочтительные способы и вещества, однако для воплощения или испытания данного изобретения можно применять способы и вещества, аналогичные или эквивалентные описанным в данном документе. Все процитированные публикации включены во всей полноте путем ссылки.
Термины, используемые в данном описании, имеют общепринятое значение, известное специалистам в области техники, однако в целях удобства и полноты, ниже приводятся конкретные термины, используемые в данном документе, и их значение.
В описании и формуле изобретения все термины в единственном числе охватывают указанные объекты во множественном числе, за исключением случаев, когда из контекста явным образом не следует противоположное. Так, например, упоминание «способа» охватывает один или более способов и/или стадий, которые приведены в данном описании и/или которые станут очевидны специалисту в области техники при прочтении данного описания, и т.д.
Термин «примерно» или «приблизительно» означает значения в пределах статистически значимого диапазона. Такой диапазон может быть в пределах одного порядка, обычно в пределах 20%, чаще в пределах 10%, и еще чаще в пределах 5% от заданного значения или диапазона. Допустимые колебания, охватываемые термином «примерно» или «приблизительно», зависят от конкретной изучаемой системы и будут понятны специалистам в области техники. При упоминании в данном документе диапазона, каждое целое значение, входящее в данный диапазон, также считают воплощением изобретения.
Следует отметить, что в данном описании такие термины, как «содержит», «содержащийся», «содержащий» и т.п. имеют значение, которое им приписывается в патентном законодательстве США, например они могут обозначать «включает», «включенный», «включая» и т.п. Такие термины обозначают включение конкретных ингредиентов или комбинаций ингредиентов, без исключения каких-либо иных ингредиентов. Такие термины как «по существу состоящий из» и «по существу состоит из» имеют значение, которое им приписывается в патентном законодательстве США, например они допускают включение дополнительных ингредиентов или стадий, которые не наносят ущерб новым или основным характеристикам изобретения, т.е. они исключают дополнительные неперечисленные ингредиенты или стадии, которые наносят ущерб новым или основным характеристикам изобретения, и они исключают ингредиенты или стадии, известные в уровне техники, например, изложенные в процитированных или включенных путем ссылки документах предшествующего уровня техники, поскольку задачей данного изобретения является характеристика воплощений, которые являются патентоспособными, например, новыми, неочевидными, имеющими изобретательский уровень относительно документов уровня техники, например, процитированных или включенных путем ссылки документов. Термины «состоит из» и «состоящий из» имеют значение, которое им приписывается в патентном законодательстве США, а именно, указанные термины являются терминами закрытого типа. Соответственно, указанные термины обозначают включение конкретных ингредиентов или комбинаций ингредиентов и исключение всех иных ингредиентов.
Термин «антиген», как правило, относится к биологической молекуле, обычно, белку, пептиду, полисахариду, липиду или конъюгату, который содержит по меньшей мере один эпитоп, с которым может избирательно связываться распознающее его антитело; или, в некоторых случаях, к иммуногенной субстанции, которая может стимулировать у животного выработку антител или Т-клеточный ответ, или и то, и другое, включая композиции, которые вводят животному путем инъекций или абсорбции. Иммунный ответ может вырабатываться на целую молекулу или на одну или несколько различных частей молекулы (например, эпитоп или гаптен). Термин может использоваться для обозначения отдельных молекул или гомогенных или гетерогенных популяций молекул, обладающих антигенными свойствами. Антиген распознается антителами, Т-клеточными рецепторами или другими элементами специфического гуморального и/или клеточного иммунитета. Термин «антиген» включает все родственные антигенные эпитопы. Эпитопы данного антигена можно идентифицировать, используя любое количество способов картирования эпитопов, хорошо известных в области техники (см., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, NJ). Например, линейные эпитопы можно определять путем, например, одновременного синтеза большого количества пептидов, соответствующих частям молекулы белка, на твердых носителях, и взаимодействия пептидов с антителами, пока пептиды еще присоединены к носителям. Такие способы известны в области техники и изложены, например, в патенте США 4708871; Geysen, H.M., et al., Proc. Natl. Acad. Sci. USA, 81:3998-4002 (1984); Geysen, H.M., et al., Molec. Immunol., 23(7):709-715 (1986), включенных в данное описание во всей полноте путем ссылки. Аналогично, конформационные эпитопы можно идентифицировать путем определения пространственной конформации аминокислот, например, с помощью рентгеновской кристаллографии и 2-мерного ядерного магнитного резонанса (см., например, Epitope Mapping Protocols, выше). Кроме того, в данном изобретении термин «антиген» может также использоваться для обозначения белка, который включает модификации, такие как делеции, вставки и замены (как правило, консервативные по природе, но которые также могут быть неконсервативными) в нативной последовательности, при условии, что белок сохраняет способность вызывать иммунный ответ. Данные модификации могут быть преднамеренными, например, в результате сайт-специфического мутагенеза или определенных способов синтеза или генно-инженерного подхода, или случайными, например, в результате мутаций хозяев, продуцирующих антигены. Кроме того, антиген может иметь происхождение, может быть получен или изолирован из микроорганизма, например, бактерии, или может представлять собой целый организм. Аналогично, термин также охватывает олигонуклеотид или полинуклеотид, который экспрессирует антиген, например, как при иммунизации нуклеиновыми кислотами. Термин также охватывает синтетические антигены, например, полиэпитопы, фланкирующие эпитопы и другие рекомбинантные или полученные синтетическими способами антигены (Bergmann, С., et al., Eur. J. Immunol., 23(11):2777-2781 (1993); Bergmann, С.С., et al., J. Immunol., 157(8):3242-3249(1996); Suhrbier, A., Immunol. and Cell Biol, 75(4):402-408 (1997)).
Термины «вакцина» или «вакцинная композиция», используемые взаимозаменяемо, относятся к фармацевтическим композициям, содержащим по меньшей мере одну иммуногенную композицию, которая индуцирует у животного иммунный ответ.
Капсульные полисахариды
В данном описании термин «сахарид» относится к одиночным сахарным группировкам или моносахаридным единицам, а также к комбинациям двух или более одиночных сахарных группировок или моносахаридных единиц, ковалентно связанных с образованием дисахаридов, олигосахаридов и полисахаридов. Термин «сахарид» может использоваться взаимозаменяемо с термином «углевод». Полисахарид может быть линейным или разветвленным.
«Моносахарид» в данном описании относится к одиночному сахарному остатку в олигосахариде. Термин «дисахарид» в данном описании относится к полисахаридам, состоящим из двух моносахаридных единиц или группировок, связанных друг с другом посредством гликозидной связи.
В одном воплощении полисахарид представляет собой олигосахарид (OS). «Олигосахарид» в данном описании относится к соединению, содержащему две или более моносахаридных единиц или группировок. В контексте олигосахарида, отдельной мономерной единицей или группировкой является моносахарид, который связан или может быть связан через свою гидроксильную группу с другой моносахаридной единицей или группировкой. Олигосахариды могут быть получены либо путем химического синтеза из защищенных простых углеводов или в результате химического расщепления полисахаридов, полученных биологическим способом. В альтернативном варианте олигосахариды могут быть получены in vitro ферментативными способами.
В предпочтительном воплощении полисахарид представляет собой полисахарид (PS), который относится к линейному или разветвленному полимеру по меньшей мере из 5 моносахаридных единиц или группировок. Для ясности, большее количество повторяющихся единиц, где n превышает примерно 5, например, превышает примерно 10, в данном описании будет обозначаться полисахаридом.
В одном воплощении полисахарид представляет собой полисахарид клеточной поверхности. Полисахарид клеточной поверхности относится к полисахариду, имеющему по меньшей мере часть, расположенную на наружной клеточной мембране бактерий или клеточной поверхности бактерий, включающей слой пептидогликанов, клеточную стенку и капсулу. Обычно полисахарид клеточной поверхности ассоциирован с индукцией иммунного ответа in vivo. Полисахарид клеточной поверхности может представлять собой «полисахарид клеточной стенки» или «капсульный полисахарид». Полисахарид клеточной стенки обычно образует прерывистый слой на поверхности бактерий.
В одном воплощении полисахарид представляет собой капсульный полисахарид. Капсульный полисахарид относится к гликополимеру, который включает повторяющиеся единицы из одного или более моносахаридов, соединенных гликозидными связями. Капсульный полисахарид обычно формирует капсуло-подобный слой вокруг бактериальной стенки. «Капсульный полисахарид» или «полисахарид капсулы» относится к полисахаридной капсуле, которая находится с внешней стороны относительно клеточной стенки большинства изолятов стрептококков. Например, все капсульные полисахариды GBS имеют разветвленную повторяющуюся структуру с концевой сиаловой кислотой, присоединенной α2-3-связью, необходимой для вирулентности бактерий. Ассоциированная с капсулой сиаловая кислота (количественно определяемая методом ВЭЖХ), обнаружена более чем у 94% инвазивных неонатальных изолятов TEST, культивируемых in vitro.
Авторы данного изобретения обнаружили, что уровень сиаловой кислоты в капсульных полисахаридах GBS является важной характеристикой для развития иммунного ответа. В источниках предшествующего уровня техники содержится противоречивая информация относительно уровней сиаловой кислоты у серотипа V, имеются сведения, что преимущественно встречается десиалированный серотип V (опубликованная международная заявка на патент WO 2012/035519), и что содержание сиаловой кислоты у серотипа V может составлять более 50% (опубликованная международная заявка на патент WO 2014/053612). Однако в приведенных источниках нет сведений, указывающих на важность уровней сиаловой кислоты для иммуногенности по меньшей мере большинства полисахаридов GBS. Авторы данного изобретения неожиданно обнаружили, что капсульным полисахаридам GBS перед конъюгацией необходимо примерно 60% или более сиаловой кислоты для обеспечения иммунного ответа, сопоставимого с таковым на полисахариды, имеющие нативные уровни сиаловой кислоты (т.е. 100% или более примерно 95%). Даже уровни сиаловой кислоты 58%, которые находятся в пределах диапазона, указанного для серотипа V в документах предшествующего уровня техники, отрицательным образом влияли на иммуногенность.
Соответственно, в одном воплощении изобретения капсульные полисахариды имеют свой природный уровень сиаловой кислоты, такой как примерно 100% или выше примерно 95%. В другом воплощении капсульные полисахариды могут быть десиалированы примерно до 40% (уровень сиалирования выше примерно 60%), например примерно до 35% (уровень сиалирования выше примерно 65%), примерно до 30% (уровень сиалирования выше примерно 70%), примерно до 25% (уровень сиалирования выше примерно 75%), примерно до 20% (уровень сиалирования выше примерно 80%), примерно до 15% (уровень сиалирования выше примерно 85%), примерно до 10% (уровень сиалирования выше примерно 90%) и примерно до 5% (уровень сиалирования выше примерно 95%).
Следует отметить, что уровень сиаловой кислоты 100% соответствует примерно 1,0 мМ сиаловой кислоты на мМ полисахарида. Таким образом, капсульный полисахарид может содержать примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Концевые остатки сиаловой кислоты капсульных полисахаридов (КП) некоторых серотипов являются частично O-ацетилированными (ОАс) (Lewis, A.L, et al., Proceedings of the National Academy of Sciences USA, 101 (30):11123-8 (2004)). Серотипы Ib, III, IV, V, VI и IX частично O-ацетилированы (вплоть до примерно 40%), тогда как серотипы Ia, II и VII имеют небольшую степень O-ацетилирования (менее примерно 5%) или не имеют его (Lewis 2004). В одном воплощении изобретения капсульный полисахарид имеет свой природный уровень O-ацетилирования (от примерно 0% до примерно 40%). В другом воплощении капсульный полисахарид может быть де-O-ацетилирован (менее примерно 5%). Степень O-ацетилирования полисахарида или олигосахарида можно определить любым способом, известным в области техники, например, протонным ЯМР (Lemercinier, X., et al., Carbohydrate Research, 296:83-96 (1996); Jones, С., et al., Journal of Pharmaceutical and Biomedical Analysis, 30:1233-1247 (2002); опубликованные международные заявки на патент WO 2005/033148 и WO 00/56357). Другой распространенный способ описан Hestrin, S., J. Biol. Chem., 180:249-261 (1949).
Следует также отметить, что уровень O-ацетата 100% соответствует примерно 1,0 мМ O-ацетата на мМ повторяющейся сахаридной единицы. Соответственно, частично O-ацетилированные полисахариды содержат по меньшей мере примерно 0,1, 0,2, 0,3, 0,35 или примерно 0,4 мМ O-ацетата на мМ повторяющейся сахаридной единицы. Де-O-ацетилированный полисахарид содержит менее примерно 0,01, 0,02, 0,03, 0,04 или 0,05 мМ O-ацетата на мМ повторяющейся сахаридной единицы.
Стрептококковые микроорганизмы, способные вызывать инвазивное заболевание, обычно также способны продуцировать КП, инкапсулирующий бактерию и усиливающий ее резистентность к элиминации врожденной иммунной системой организма. КП служит для окружения бактериальной стенки защитной капсулой, которая придает бактерии резистентность к фагоцитозу и гибели внутри клетки. Бактерии, не имеющие капсулы, в большей степени подвержены фагоцитозу. Капсульные полисахариды часто являются важным фактором вирулентности для множества бактериальных патогенов, включая Haemophilus influenzae, Streptococcus pneumoniae, Neisseria meningitidis и Staphylococcus aureus.
Капсульные полисахариды могут использоваться для серотипирования конкретных видов бактерий. Типирование обычно осуществляют с помощью реакции со специфической антисывороткой или моноклональным антителом, выработанным на специфическую структуру или уникальный эпитоп, присущие капсульному полисахариду. Существует десять серотипов GBS: Ia, Ib и II-IX (Ferrieri, P., et al., Emerg. Infect. Dis. [Internet], 19(4) (2013), доступно по интернет-адресу http://wwwnc.cdc.gov/eid/article/19/4/12-1572_article.
В одном воплощении изобретения полисахарид выделен из Streptococcus agalactiae. Полисахарид может быть выделен из любого инкапсулированного штамма S. agalactiae, такого как 090, А909 (номер доступа АТСС ВАА-1138), 515 (номер доступа АТСС BAA-1177), B523, CJB524, MB 4052 (номер доступа АТСС 31574), Н36 В (номер доступа АТСС 12401), S40, S42, MB 4053 (номер доступа АТСС 31575), М709, 133, 7357, PFEGBST0267, MB 4055 (номер доступа АТСС 31576), 18RS21 (номер доступа АТСС BAA-1175), S16, S20, V8 (номер доступа АТСС 12973), DK21, DK23, UAB, 5401, PFEGBST0708, MB 4082 (номер доступа АТСС 31577), М132, 110, М781 (номер доступа АТСС BAA-22), D136C(3) (номер доступа АТСС 12403), М782, S23, 120, MB 4316 (М-732; номер доступа АТСС 31475), М132, К79, СОН1 (номер доступа АТСС BAA-1176), PFEGBST0563, 3139 (номер доступа АТСС 49446), CZ-NI-016, PFEGBST0961, 1169-NT1, CJB111 (номер доступа АТСС BAA-23), CJB112, 2603 V/R (номер доступа АТСС ВАА-611), NCTC 10/81, CJ11, PFEGBST0837, 118754, 114852, 114862, 114866, 118775, В 4589, В 4645, SS1214, CZ-PW-119, 7271, CZ-PW-045, JM9130013, JM9130672, IT-NI-016, IT-PW-62 и IT-PW-64.
Полисахариды, описанные в данном документе, могут быть выделены любым известным в области техники способом, включая, например, способы, описанные в данном документе. В данном документе «выделенный» означает полученный и извлеченный из конкретного источника. Термин «выделенный» также означает не находящийся в своей естественной форме, состоянии и/или окружении. Например, «выделенный из стрептококка» относится к субстанции, которая была получена и извлечена из клетки стрептококка. Выделенный полисахарид не встречается в природе. Термин «выделенный» означает, что вещество удалено из среды его происхождения (например, природной среды, если оно встречается в природе, или из организма его хозяина, если оно является рекомбинантным, или перенесено из одной среды в другую среду). Например, «выделенный» капсульный полисахарид, белок или пептид является по существу свободным от клеточного материала или других загрязняющих белков из клетки-источника или ткани-источника, из которой происходит белок, или по существу свободным от химических предшественников или других химических веществ, если он синтезирован химически или присутствует иным образом в смеси как часть химической реакционной среды. В данном изобретении белки или полисахариды могут быть выделены из бактериальной стенки или из клеточного дебриса, таким образом, что они представлены в форме, пригодной для изготовления иммуногенной композиции. Термин «выделенный» или «выделение» может включать процесс очистки или очистку, включая способы очистки выделенного полисахарида, известные в области техники и/или способы, описанные в данном документе. Выражение «по существу свободный от клеточного материала» включает препараты полипептида/белка, в которых полипептид/белок отделен от клеточных компонентов клеток, из которых он выделен или получен рекомбинантным способом. Так, капсульный полисахарид, белок или пептид, который является по существу свободным от клеточного материала, охватывает препараты капсульного полисахарида, белка или пептида, имеющие менее примерно 30%, 20%, 10%, 5%, 2,5% или 1% (по сухой массе) контаминирующего белка или полисахарида или другого клеточного материала. Когда полипептид/белок получают рекомбинантным способом, он также предпочтительно по существу свободен от культуральной среды, т.е. культуральная среда представляет менее примерно 20%, 10% или 5% от объема препарата белка. Когда полипептид/белок или полисахарид получают путем химического синтеза, он предпочтительно по существу свободен от химических предшественников или других химических веществ, т.е. он отделен от химических предшественников или других химических веществ, которые задействованы в синтезе белка или полисахарида. Соответственно, такие препараты полипептида/белка или полисахарида имеют менее примерно 30%, 20%, 10%, 5% (по сухой массе) химических предшественников или соединений, отличных от полипептида/белка или фрагмента полисахарида, представляющих интерес.
В одном воплощении изобретения полисахарид выделен из бактерии. В другом воплощении изобретения полисахарид получен рекомбинантным способом. В следующем воплощении полисахарид является синтетическим или химически синтезирован стандартными способами. В еще одном воплощении изобретения полисахарид получен в результате экспрессии в суррогатном хозяине после клонирования и экспрессии биосинтетического пути для продуцирования полисахарида. В одном воплощении полисахарид является иммуногенным. Например, авторы изобретения обнаружили, что каждый полисахарид, описанный в данном документе, способен вызывать или индуцировать иммунный ответ. Термин «иммуногенный» относится к способности инициировать, запускать, вызывать, усиливать, улучшать и/или повышать гуморальный и/или клеточно-опосредованный иммунный ответ у млекопитающего. В одном аспекте млекопитающим является человек, примат, кролик, свинья, мышь и т.д.
Молекулярную массу капсульного полисахарида следует принимать во внимание при применении иммуногенных композиций. Высокомолекулярные капсульные полисахариды способны индуцировать определенные гуморальные иммунные ответы вследствие высокой валентности эпитопов, присутствующих на поверхности антигена. Выделение и очистку высокомолекулярных капсульных полисахаридов можно использовать в конъюгатах, композициях и способах по данному изобретению.
Однако в одном воплощении полисахарид может быть доведен до нужного размера, так что молекулярная масса (MW) полисахарида будет находиться в диапазоне, ниже чем молекулярная масса нативного капсульного полисахарида до конъюгации с белком-носителем. Размер очищенного капсульного полисахарида уменьшен для создания конъюгатов, обладающих свойствами, улучшающими фильтруемость и/или выход.
В одном таком воплощении размер очищенного капсульного полисахарида уменьшен посредством гомогенизации под высоким давлением. Гомогенизация под высоким давлением позволяет достичь высоких скоростей сдвига благодаря прохождению технологического потока через проточный канал достаточно малых размеров. Скорость сдвига увеличивается при использовании более высокого давления гомогенизации, а время воздействия может увеличиваться в результате рециркуляции технологического потока через гомогенизатор.
В одном воплощении описанный полисахарид способен индуцировать опсоническую активность. В другом воплощении описанный полисахарид способен индуцировать опсоническую активность и фагоцитарную активность (например, опсонофагоцитарную активность).
Опсоническая активность или опсонизация относится к процессу, благодаря которому опсонин (например антитело или фактор комплемента) связывается с антигеном (например выделенным полисахаридом по данному изобретению), что облегчает присоединение антигена к фагоциту или фагоцитирующей клетке (например макрофагу, дендритной клетке и полиморфноядерному лейкоциту (PMNL). Некоторые бактерии, например, такие как инкапсулированные бактерии, которые обычно не фагоцитируются из-за наличия капсулы, будут с большей вероятностью распознаваться фагоцитами, будучи покрытыми опсонизирующим антителом. В одном воплощении полисахарид индуцирует иммунный ответ, например, такой как опсонизирующее антитело. В одном воплощении опсоническая активность направлена против грамположительных кокков, предпочтительно против видов Streptococcus, более предпочтительно против по меньшей мере одного штамма S. agalactiae.
В следующем воплощении описанный полисахарид способен индуцировать бактерицидный иммунный ответ. В одном воплощении бактерицидная активность направлена против грамположительных кокков, предпочтительно, против видов Streptococcus, более предпочтительно против по меньшей мере одного штамма S. agalactiae.
В области техники известны способы определения опсонизации, фагоцитоза и/или бактерицидной активности, например, такие как измерение уменьшения бактериальной нагрузки in vivo (например, путем измерения уровней бактериемии у млекопитающих, инфицированных видами Streptococcus) и/или определение гибели бактериальных клеток in vitro (например, в анализе опсонофагоцитарной активности in vitro). В одном воплощении полисахарид способен индуцировать опсоническую, фагоцитарную и/или бактерицидную активность по сравнению с соответствующим контролем, например, по сравнению с антисывороткой против грамположительных кокков, убитых нагреванием.
Серотип Ia
Одно воплощение включает капсульный полисахарид GBS серотипа Ia.
Структуру серотипа Ia можно изобразить следующим образом:
а)
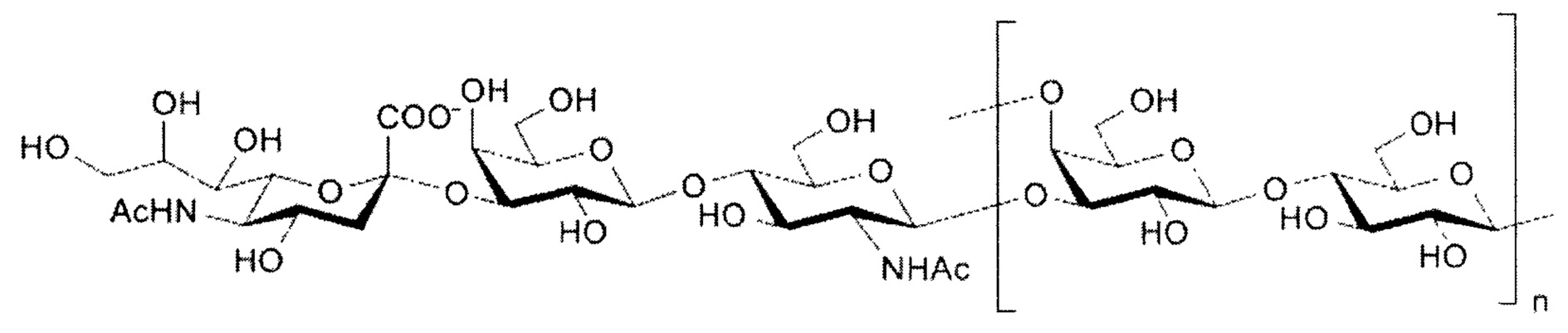
или
б)
Молекулярная масса капсульных полисахаридов серотипа Ia до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 500 кДа, от примерно 25 кДа до примерно 450 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 350 кДа, от примерно 25 кДа до примерно 300 кДа, от примерно 25 кДа до примерно 250 кДа, от примерно 25 кДа до примерно 200 кДа, от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 «Да, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. В одном предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 25 кДа до примерно 200 кДа. В другом предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 100 кДа до примерно 400 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В конкретном воплощении процесс гомогенизации под высоким давлением используют для уменьшения размера нативного капсульного полисахарида GBS серотипа Ia, при сохранении структурных характеристик полисахарида, таких как сиаловая кислота.
В одном воплощении изобретения капсульный полисахарид серотипа Ia имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или выше примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например, до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа Ia до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа Ia имеют O-ацетилирование менее примерно 5%. Некоторые приведенные в качестве примера штаммы серотипа Ia с капсульными полисахаридами по изобретению включают 090, А909 (номер доступа АТСС ВАА-1138), 515 (номер доступа АТСС BAA-1177), B523, CJB524 и MB 4052 (номер доступа АТСС 31574).
Серотип Ib
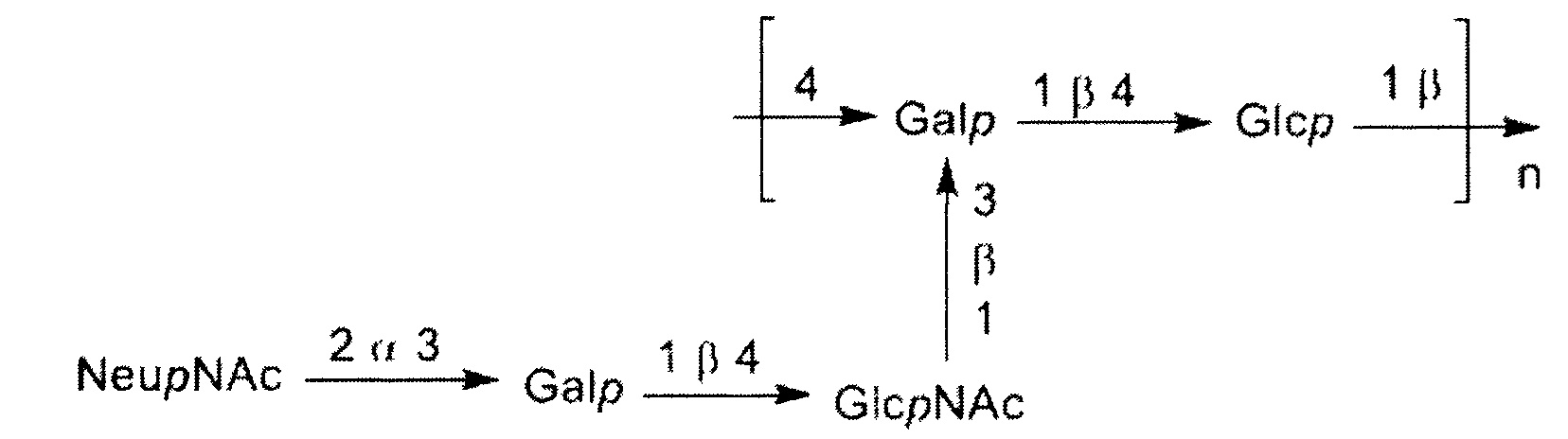
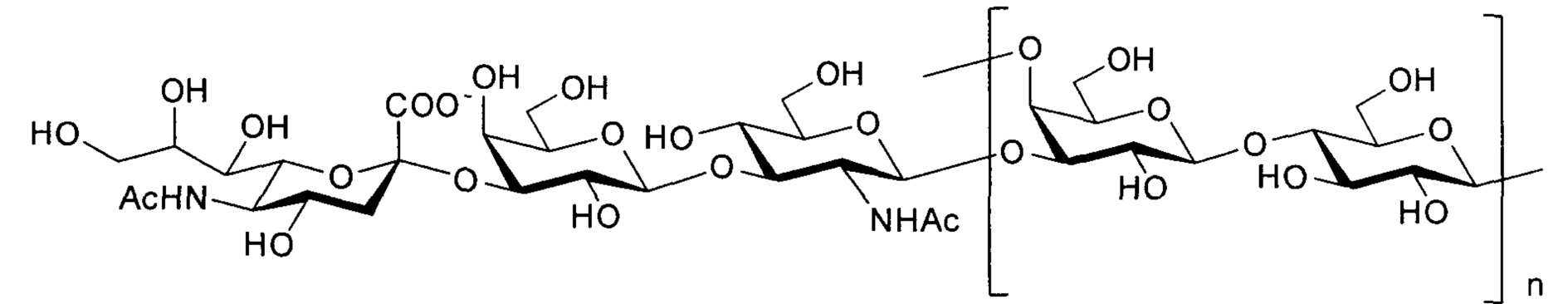
Одно воплощение включает капсульный полисахарид GBS серотипа Ib. Структуру серотипа Ib можно изобразить следующим образом:
а)
или
б)
Молекулярная масса капсульных полисахаридов серотипа Ib до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например, от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 500 кДа, от примерно 25 кДа до примерно 450 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 350 кДа, от примерно 25 кДа до примерно 300 кДа, от примерно 25 кДа до примерно 250 кДа, от примерно 25 кДа до примерно 200 кДа, от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. В одном предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 25 кДа до примерно 400 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа Ib имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или превышающий примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа Ib до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа Ib O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее чем примерно на 5%). Некоторые приведенные в качестве примера штаммы серотипа Ib с капсульными полисахаридами по изобретению включают Н36В (номер доступа АТСС 12401), S40, S42, MB 4053 (номер доступа АТСС 31575), М709, 133, 7357 и PFEGBST0267.
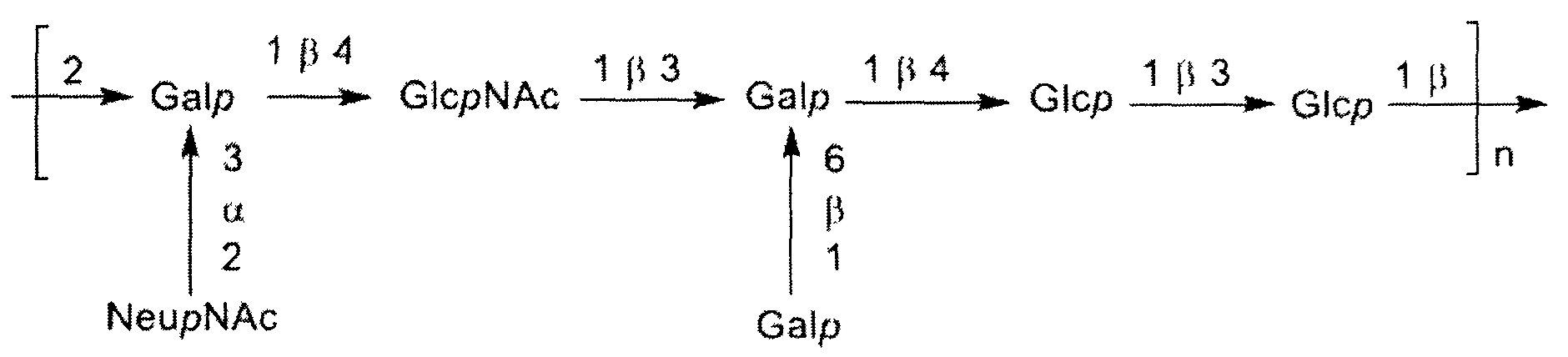
Серотип II
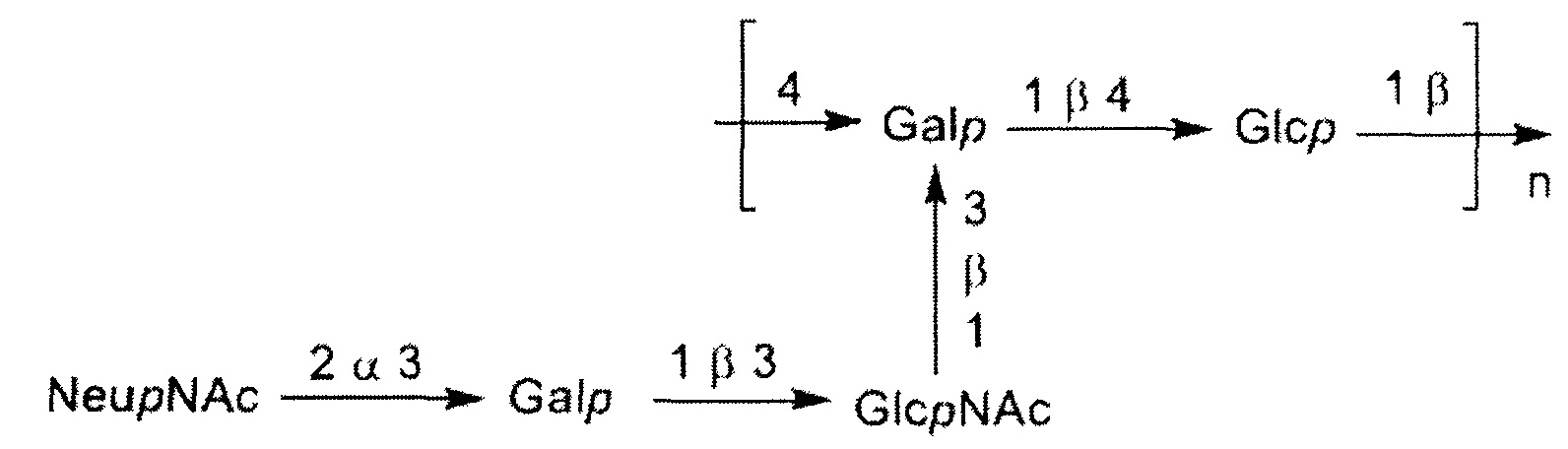
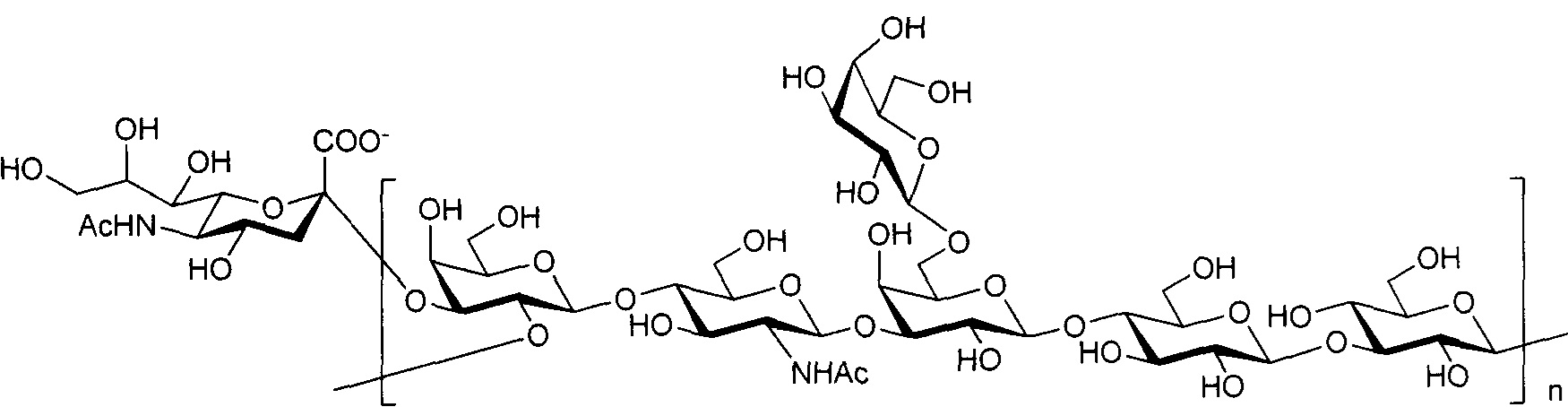
Одно воплощение включает капсульный полисахарид GBS серотипа II. Структуру серотипа II можно изобразить следующим образом:
а)
или
б)
Молекулярная масса капсульных полисахаридов серотипа II до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 500 кДа, от примерно 25 кДа до примерно 450 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 350 кДа, от примерно 25 кДа до примерно 300 кДа, от примерно 25 кДа до примерно 250 кДа, от примерно 25 кДа до примерно 200 кДа, от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. В одном предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 25 кДа до примерно 400 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа II имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или превышающий примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например, до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа II до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа II имеют O-ацетилирование менее примерно 5%. Некоторые приведенные в качестве примера штаммы серотипа II с капсульными полисахаридами по изобретению включают MB 4055 (номер доступа АТСС 31576), 18RS21 (номер доступа АТСС BAA-1175), S16, S20, V8 (номер доступа АТСС 12973), DK21, DK23, UAB, 5401 и PFEGBST0708.
Серотип III
Одно воплощение включает капсульный полисахарид GBS серотипа III. Структуру серотипа III можно изобразить следующим образом:
а)
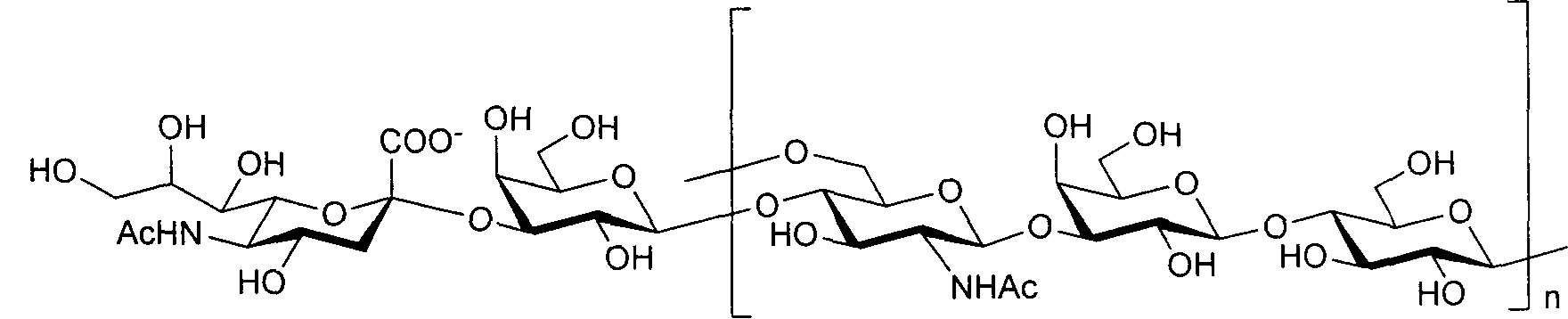
или
б)
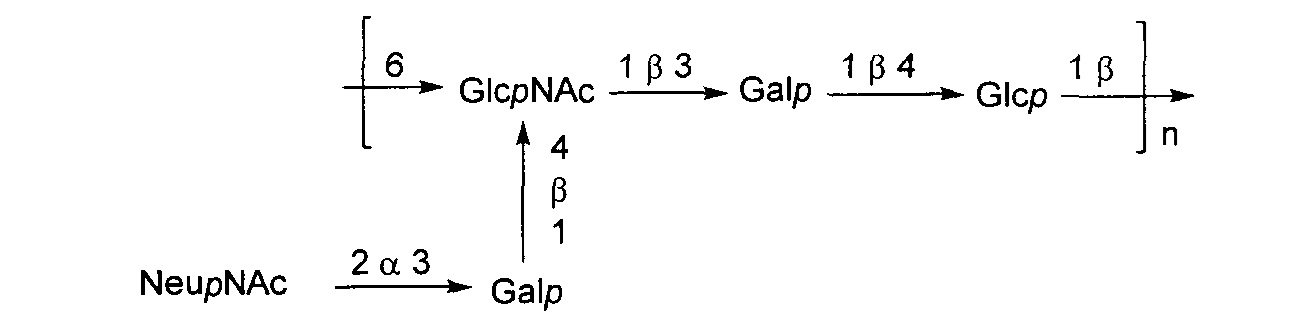
Молекулярная масса капсульных полисахаридов серотипа III до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например, от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 500 кДа, от примерно 25 кДа до примерно 450 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 350 кДа, от примерно 25 кДа до примерно 300 кДа, от примерно 25 кДа до примерно 250 кДа, от примерно 25 кДа до примерно 200 кДа, от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. В одном предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 25 кДа до примерно 200 кДа. В другом предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 100 кДа до примерно 400 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В конкретном воплощении процесс гомогенизации под высоким давлением используют для уменьшения размера нативного капсульного полисахарида GBS серотипа III, при сохранении структурных характеристик полисахарида, таких как сиаловая кислота.
В одном воплощении изобретения капсульный полисахарид серотипа III имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или выше примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например, до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа III до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа III O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее чем примерно на 5%). Некоторые приведенные в качестве примера штаммы серотипа III с капсульными полисахаридами по изобретению включают MB 4082 (номер доступа АТСС 31577), М132, 110, М781 (номер доступа АТСС BAA-22), D136C(3) номер доступа АТСС 12403), М782, S23, 120, MB 4316 (М-732; номер доступа АТСС 31475), М132, К79, СОН1 (номер доступа АТСС ВАА-1176) и PFEGBST0563.
Серотип IV
Одно воплощение включает капсульный полисахарид GBS серотипа IV. Структуру серотипа IV можно изобразить следующим образом:
а)
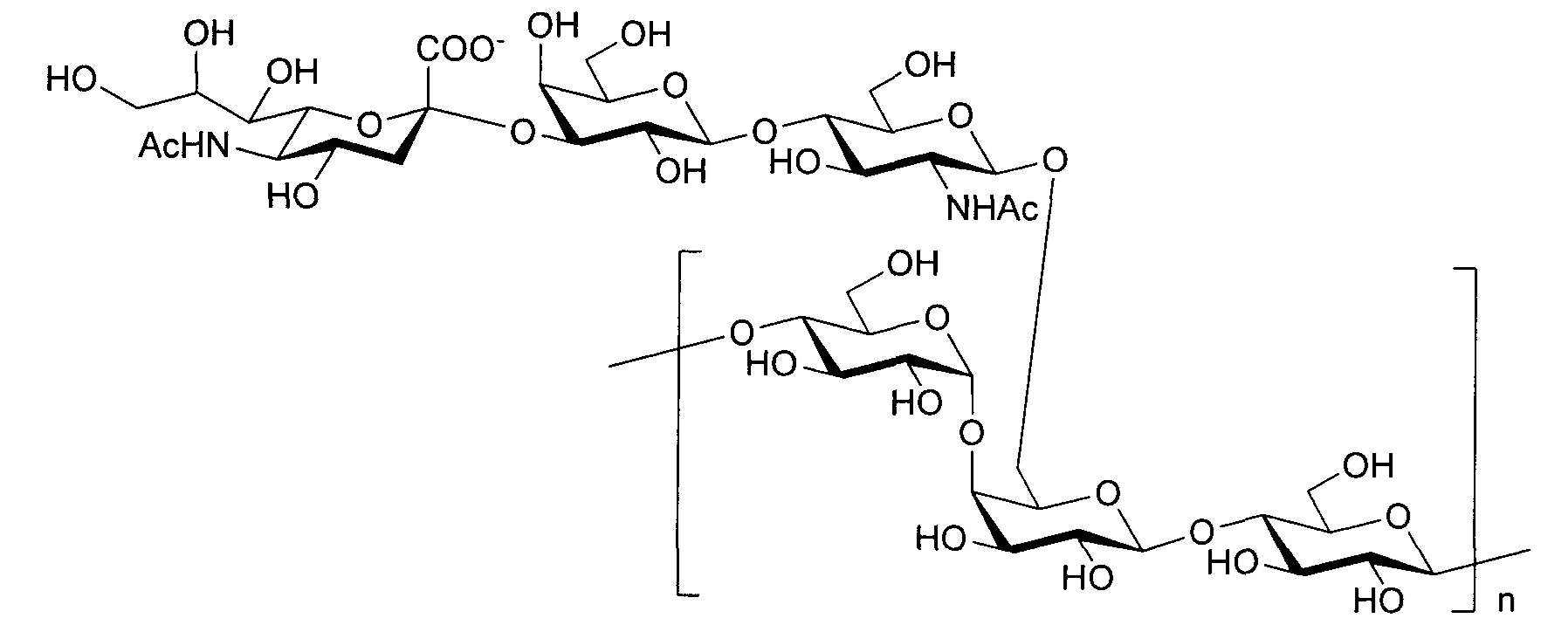
или
б)

Молекулярная масса капсульных полисахаридов серотипа IV до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 500 кДа, от примерно 25 кДа до примерно 450 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 350 кДа, от примерно 25 кДа до примерно 300 кДа, от примерно 25 кДа до примерно 250 кДа, от примерно 25 кДа до примерно 200 кДа, от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. В одном предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 25 кДа до примерно 400 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа IV имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или выше примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например, до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа IV до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа IV O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее примерно 5%). Некоторые приведенные в качестве примера штаммы серотипа IV с капсульными полисахаридами по изобретению включают 3139 (номер доступа АТСС 49446), CZ-N1-016 и PFEGBST0961.
Серотип V
Одно воплощение включает капсульный полисахарид GBS серотипа V. Структуру серотипа V можно изобразить следующим образом:
а)
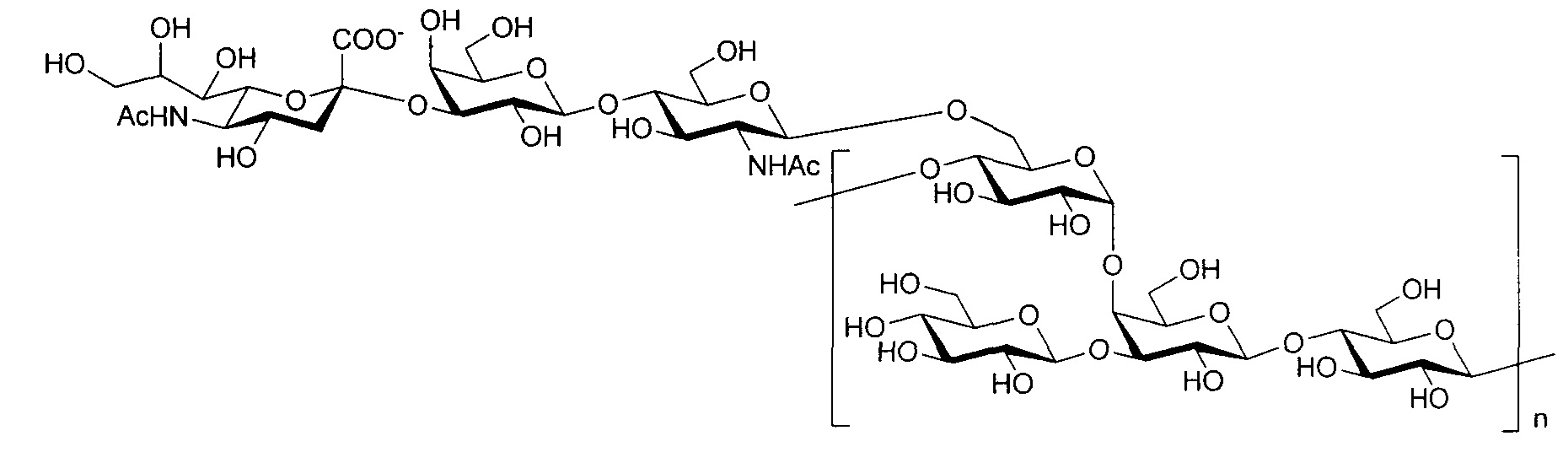
или
б)
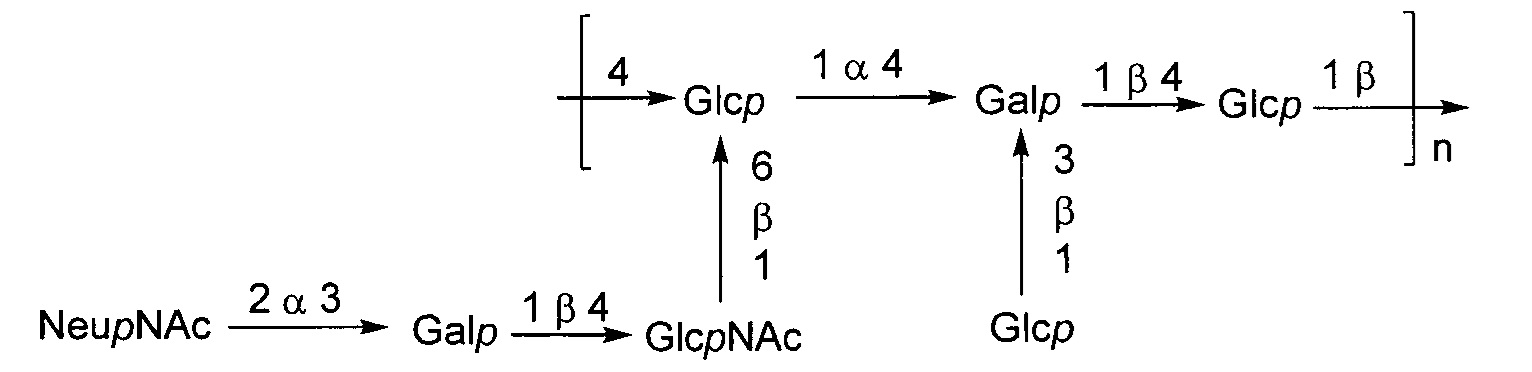
Молекулярная масса капсульных полисахаридов серотипа V до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 25 кДа до примерно 750 кДа, от примерно 25 кДа до примерно 500 кДа, от примерно 25 кДа до примерно 450 кДа, от примерно 25 кДа до примерно 400 кДа, от примерно 25 кДа до примерно 350 кДа, от примерно 25 кДа до примерно 300 кДа, от примерно 25 кДа до примерно 250 кДа, от примерно 25 кДа до примерно 200 кДа, от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. В одном предпочтительном воплощении молекулярная масса капсульного полисахарида до конъюгирования составляет от примерно 25 кДа до примерно 400 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа V имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или превышающий примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа V до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа V O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее примерно 5%). Некоторые приведенные в качестве примера штаммы серотипа V с капсульными полисахаридами по изобретению включают 1169-NT1, CJB111 (номер доступа АТСС 1 BAA-23), CJB112, 2603 V/R (номер доступа АТСС BAA-611), NCTC 10/81, CJ11 и PFEGBST0837.
Серотип VI
Капсульные полисахариды GBS серотипа VI описаны в публикации von Hunolstein, С., et al., Infection and Immunity, 6194):1272-1280 (1993), содержание которой включено во всей полноте путем ссылки. Структуру серотипа VI можно изобразить следующим образом:
а)
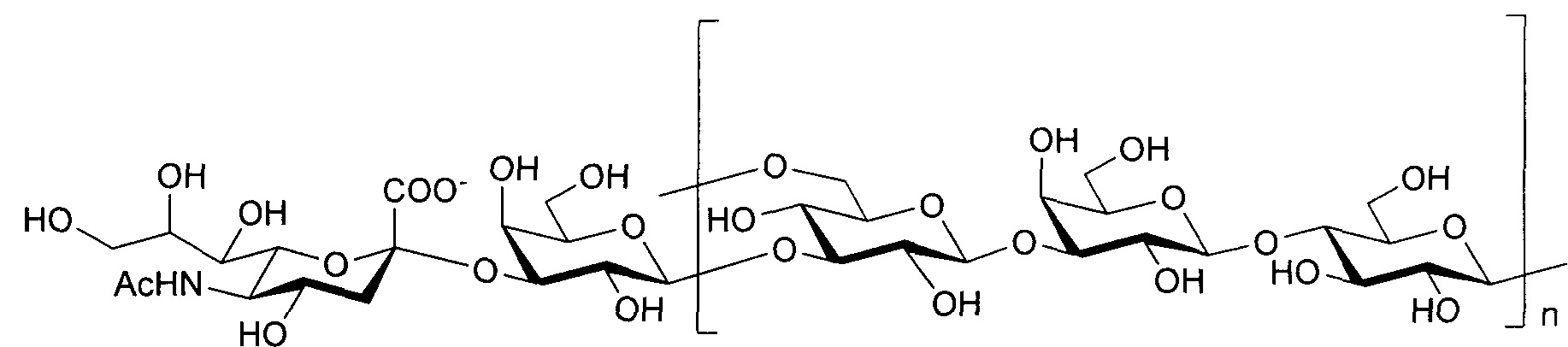
или
б)
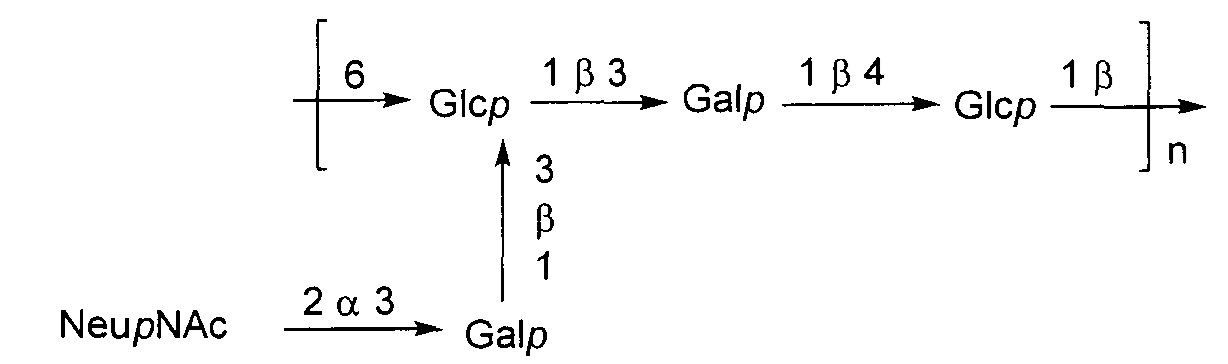
Молекулярная масса капсульных полисахаридов серотипа VI до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа VI имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или превышающий примерно 95%. В другом воплощении капсульные полисахариды до конъюгирования могут быть десиалированы примерно до 40% (уровень сиалирования выше примерно 60%), например, до примерно до 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа VI до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ сахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа VI O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее примерно 5%). Некоторые приведенные в качестве примера штаммы серотипа VI с капсульными полисахаридами по изобретению включают 118754, 114852, 114862, 114866, 118775, В 4589, В 4645, SS1214 и CZ-PW-119.
Серотип VII
Капсульные полисахариды GBS серотипа VII описаны в публикации Kogan, G., et al., Carbohydrate Research, 277(1):1-9 (1995), содержание которой включено во всей полноте путем ссылки. Повторяющейся единицей серотипа VII является:
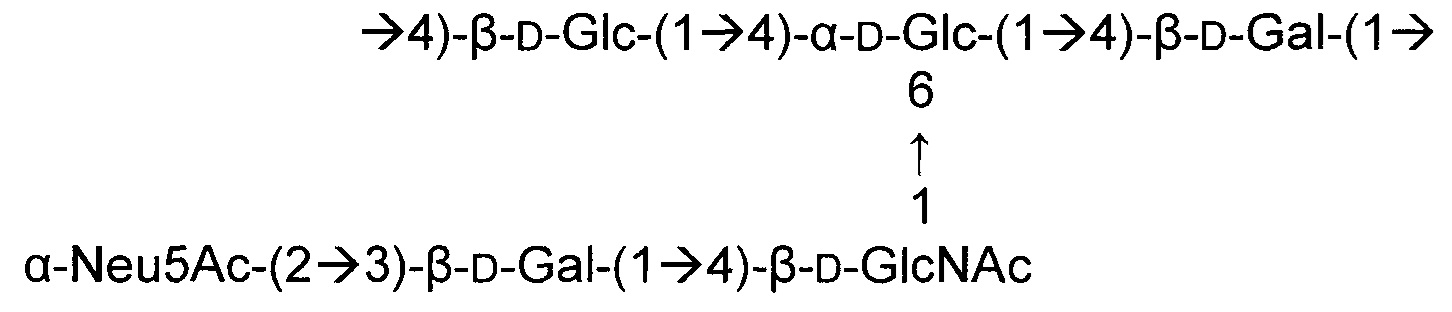
Молекулярная масса капсульных полисахаридов серотипа VII до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа VII имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или превышающий примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа VII до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа VII O-ацетилированы менее примерно 5%. Некоторые приведенные в качестве примера штаммы серотипа VII с капсульными полисахаридами по изобретению включают 7271 и CZ-PW-045.
Серотип VIII
Капсульные полисахариды GBS серотипа VIII описаны в публикации Kogan, G., et al., The Journal of Biological Chemistry, 271(15):8786-8790 (1996), содержание которой включено во всей полноте путем ссылки. Повторяющейся единицей серотипа VIII является:
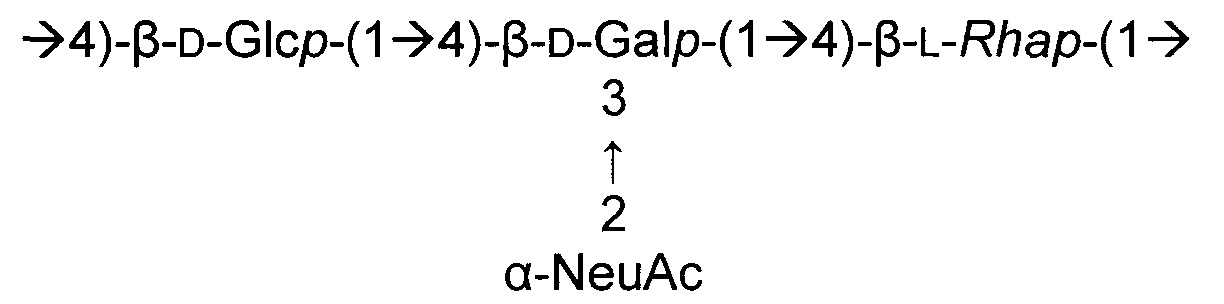
Молекулярная масса капсульных полисахаридов серотипа VIII до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа VIII имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или выше примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа VIII до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа VIII O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее примерно 5%). Некоторые приведенные в качестве примера штаммы серотипа VIII с капсульными полисахаридами по изобретению включают JM9130013 и JM9130672.
Серотип IX
Капсульные полисахариды GBS серотипа IX описаны в публикации Berti, F., et al., The Journal of Biological Chemistry, 289(34):23437-2348 (2014), содержание которой включено во всей полноте путем ссылки. Структуру серотипа IX можно изобразить следующим образом:
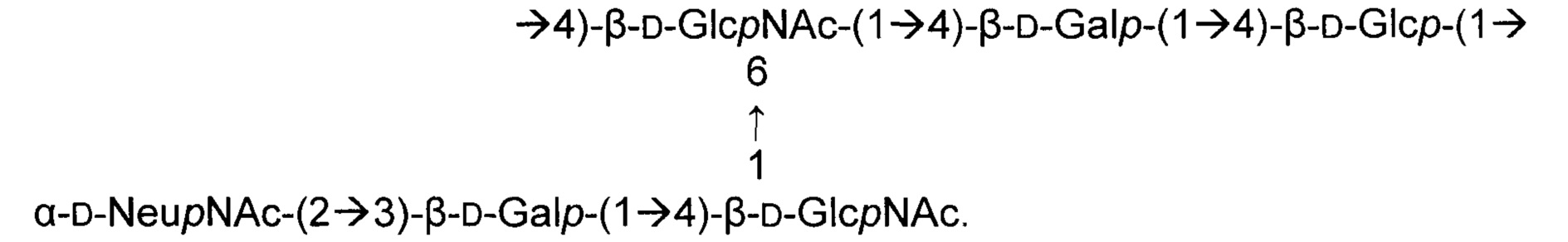
Молекулярная масса капсульных полисахаридов серотипа IX до конъюгирования составляет от примерно 5 кДа до примерно 1000 кДа, например от примерно 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении изобретения капсульный полисахарид серотипа IX имеет свой природный уровень сиаловой кислоты, такой как примерно 100% или превышающий примерно 95%. В другом воплощении капсульный полисахарид до конъюгирования может быть десиалирован примерно до 40% (уровень сиалирования выше примерно 60%), например до примерно 35% (уровень сиалирования выше примерно 65%), до примерно 30% (уровень сиалирования выше примерно 70%), до примерно 25% (уровень сиалирования выше примерно 75%), до примерно 20% (уровень сиалирования выше примерно 80%), до примерно 15% (уровень сиалирования выше примерно 85%), до примерно 10% (уровень сиалирования выше примерно 90%) или до примерно 5% (уровень сиалирования выше примерно 95%).
В другом воплощении капсульный полисахарид серотипа IX до конъюгирования имеет примерно 1,0 мМ сиаловой кислоты на мМ полисахарида, например по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида. В следующем воплощении капсульный полисахарид до конъюгирования может иметь по меньшей мере примерно 0,6 мМ сиаловой кислоты на мМ полисахарида, например, по меньшей мере примерно 0,65 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,7 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,75 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,8 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,85 мМ сиаловой кислоты на мМ полисахарида, по меньшей мере примерно 0,9 мМ сиаловой кислоты на мМ полисахарида или по меньшей мере примерно 0,95 мМ сиаловой кислоты на мМ полисахарида.
Капсульные полисахариды серотипа IX O-ацетилированы примерно от 0% до примерно 40%. В одном воплощении изобретения полисахарид де-O-ацетилирован (т.е. O-ацетилирован менее примерно 5%). Некоторые приведенные в качестве примера штаммы серотипа IX с капсульными полисахаридами по изобретению включают IT-NI-016, IT-PW-62 и IT-PW-64.
Конъюгаты полисахарида и белка
В данном описании «конъюгаты» содержат капсульный полисахарид с молекулярной массой, как правило, находящейся в нужном диапазоне, и белок-носитель, где капсульный полисахарид конъюгирован с белком-носителем. Конъюгаты могут содержать или не содержать некоторое количество свободного капсульного полисахарида. В данном описании «свободный капсульный полисахарид» относится к капсульному полисахариду, который нековалентно ассоциирован с (т.е. нековалентно связан с, абсорбирован или захвачен) конъюгированным капсульным полисахаридом-белком-носителем. Термины «свободный капсульный полисахарид», «свободный полисахарид» и «свободный сахарид» могут использоваться взаимозаменяемо и имеют одинаковое значение. Независимо от природы молекулы-носителя, она может быть конъюгирована с капсульным полисахаридом либо непосредственно, либо через линкер. В данном описании «конъюгировать», «конъюгированный» и «конъюгирование» относятся к процессу, благодаря которому бактериальный капсульный полисахарид ковалентно связан с молекулой-носителем. Конъюгирование усиливает иммуногенность бактериального капсульного полисахарида. Конъюгирование можно осуществлять способами, описанными ниже или известными в области техники.
«Конъюгированная иммуногенная композиция» в данном описании относится к иммуногенной композиции, где иммуногенный материал включает полисахаридный антиген, ковалентно связанный с белком-носителем для образования конъюгата полисахарида и белка. В одном воплощении конъюгат полисахарида и белка по изобретению может находиться в мультивалентной иммуногенной композиции.
В данном описании термин «молекулярная масса» полисахарида или конъюгата белка-носителя с полисахаридом относится к молекулярной массе, определенной при помощи эксклюзионной хроматографии (SEC) с детектированием многоуглового рассеивания лазерного излучения (MALLS).
В данном описании «конъюгат полисахарид-белок» относится к молекуле полисахарида, конъюгированной с молекулой белка-носителя посредством одной или нескольких ковалентных связей. Может быть желательно конъюгировать полисахарид с белком другого биологического вида, который, как известно, является иммуногенным в отношении целевого хозяина. Соответственно, в одном воплощении молекула-носитель представляет собой белок-носитель. В данном описании указанный чужеродный белок обозначается «белок-носитель». Белки-носители служат для усиления антигенности и иммуногенности полисахарида. В данном описании термин «эффект носителя» относится к процессу, в котором антигенность и иммуногенность слабо иммуногенной или неиммуногенной молекулы усиливаются в результате присоединения к более иммуногенной молекуле, являющейся носителем (например гетерологичному белку). В этом случае полисахарид в комбинированном конъюгате полисахарид-белок становится более иммуногенным, чем если бы он находился сам по себе. Белки-носители содержат эпитопы, распознаваемые Т-клетками, для стимулирования участия Т-клеток в развитии гуморального иммунного ответа.
«Белок-носитель» или «белковый носитель» в данном описании относится к любой белковой молекуле, которая может быть конъюгирована с антигеном (таким как капсульные полисахариды), против которых необходим иммунный ответ. Конъюгирование антигена, такого как полисахарид, с белком-носителем, может придать антигену иммуногенность. Белки-носители предпочтительно представляют собой белки, которые нетоксичны и не вызывают иммунологической реакции, которые можно получать в достаточном количестве и с достаточной степенью чистоты. Примерами белков-носителей являются токсины, анатоксины или любой мутантный перекрестно-реагирующий материал (CRM197) столбнячного, дифтерийного, коклюшного токсинов, токсинов видов Pseudomonas, Е.coli, видов Staphylococcus и видов Streptococcus. Белки-носители должны быть пригодны для стандартных процедур конъюгирования. В конкретном воплощении данного изобретения в качестве белка-носителя используют CRM197.
Перекрестно-реагирующий материал, или CRM, является особенно пригодным для некоторых воплощений данного изобретения. Можно получать генетически-модифицированные белки, которые по антигенности аналогичны некоторым бактериальным токсинам, но не токсичны. Их обозначают «перекрестно-реагирующим материалом», или CRM. CRM197 (Wyeth/Pfizer Inc., Sanford, NC) заслуживает отдельного упоминания, поскольку он имеет одну аминокислотную замену по сравнению с нативным дифтерийным токсином и иммунологически не отличим от него. См. Pappenheimer, A.M., et al., Immunochem., 9(9):891-906 (1972); патент US 5614382, содержание которых включено во всей полноте путем ссылки. CRM197 является нетоксичным вариантом (т.е. анатоксином) дифтерийного токсина, выделенного из культур штамма С7 (β197) Corynebacterium diphtheriae, выращиваемого в среде на основе казаминовых кислот и дрожжевого экстракта. CRM197 выделяют при помощи ультрафильтрации, преципитации сульфатом аммония и ионообменной хроматографии. Культура штамма С. diphtheriae C7 (β197), продуцирующего белок CRM197, была депонирована в Американской коллекции типовых культур, Роквилл, Мэриленд, и ей был присвоен номер АТСС 53281. Другие дифтерийные анатоксины также подходят для применения в качестве белков-носителей. CRM3201 является генетически модифицированным вариантом коклюшного токсина. См. публикацию Black, W.J., et al., Science, 240(4852):656-659 (1988), содержание которой включено во всей полноте путем ссылки.
Помимо дифтерийного анатоксина (DT), CRM197 и коклюшного анатоксина, другие примеры белков-носителей включают столбнячный анатоксин (ТТ), холерный анатоксин (например, описанные в опубликованной заявке на международный патент 2004/083251), термолабильный анатоксин Е.coli (LT), термостабильный анатоксин Е.coli (ST), пневмолизин S. pneumonia (дикого типа или мутантный с пониженной токсичностью), поверхностный белок А пневмококка (PspA), белок А адгезина пневмококка А (PsaA), пептидазу С5а Streptococcus, гемолизин Staphylococcal aureus, нетипируемые белки Haemophilus influenzae (NTHi), белок D Haemophilus influenzae, экзотоксины/анатоксин Clostridium perfringens, поверхностный антиген гепатита В, коровый антиген гепатита В, белок ротавируса VP 7 и белки F и G респираторного синцитиального вируса, яичный альбумин, гемоцианин фиссуреллы (KLH), бычий сывороточный альбумин (BSA), очищенное белковое производное туберкулина (PPD) и экзотоксин Pseudomonas или его производные, включая рекомбинантный нетоксический мутантный экзотоксин А Pseudomonas aeruginosa. Также можно использовать белки внешней мембраны бактерий, такие как комплекс белков наружной мембраны (ОМРС), порины, трансферрин-связывающие белки или энтеротоксин (токсин А) и цитотоксин (токсин В) С. difficile. В качестве белков-носителей также можно использовать другие белки, такие как яичный альбумин, гемоцианин фиссуреллы (KLH), бычий сывороточный альбумин (BSA) или очищенное белковое производное туберкулина (PPD). В предпочтительном воплощении белок-носитель представляет собой дифтерийный анатоксин. Более предпочтительно, белок-носитель представляет собой CRM197. В другом воплощении изобретения белок-носитель представляет собой столбнячный анатоксин.
Для синтеза мультивалентной иммуногенной композиции конъюгата конъюгаты полисахарид-белок можно получать путем конъюгирования смеси полисахаридов, выделенных из бактерий двух различных видов, с белком-носителем. Альтернативно, мультивалентная иммуногенная композиция конъюгата может быть получена посредством комбинирования полисахаридов, выделенных из бактерий двух или более различных серотипов одного вида бактерий, и конъюгирования их смеси с белком-носителем. Альтернативно, конъюгаты полисахарид-белок, полученные взаимодействием полисахарида одного типа с белком-носителем в отдельных реакциях с использованием разных полисахаридов, могут быть смешаны. Таким образом, мультивалентная иммуногенная композиция может включать в себя белок-носитель, несущий гомогенную или гетерогенную популяцию связанных полисахаридов.
После конъюгирования капсульного полисахарида с белком-носителем, конъюгаты полисахарид-белок очищают (обогащают по количеству конъюгата полисахарид-белок) различными методами. Такие методы включают, например, операции концентрирования/диафильтрации, преципитации/элюирования, колоночной хроматографии и глубинного фильтрования.
Как описано выше, данное изобретение относится к конъюгатам, содержащим капсульные полисахариды GBS, конъюгированные с белками-носителями. В одном воплощении изобретения предложены конъюгаты, содержащие капсульный полисахарид GBS серотипа IV, конъюгированный с белком-носителем, и по меньшей мере один дополнительный конъюгат, содержащий капсульный полисахарид GBS серотипа Ia, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа Ib, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа II, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа III, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа V, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа VI, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа VII, конъюгированный с белком-носителем, капсульный полисахарид GBS серотипа VIII, конъюгированный с белком-носителем, или капсульный полисахарид GBS серотипа IX, конъюгированный с белком-носителем. В одном аспекте изобретения полисахариды имеют молекулярную массу от примерно 5 кДа до 1000 кДа; конъюгаты имеют молекулярную массу от примерно 300 кДа до примерно 20000 кДа; и конъюгаты содержат менее примерно 40% свободного полисахарида относительно общего количества полисахарида. В одном воплощении конъюгаты содержат менее примерно 30%, менее примерно 25%, менее примерно 20%, менее примерно 15%, менее примерно 10% или менее примерно 5% свободного полисахарида относительно общего количества полисахарида.
В одном воплощении полисахариды серотипа Ia, Ib, II, III, IV, V, VI, VII, VIII и/или IX до конъюгирования имеют молекулярную массу от примерно 5 кДа до примерно 1000 кДа, такую как от примерно от 50 кДа до примерно 750 кДа, от примерно 50 кДа до примерно 500 кДа, от примерно 50 кДа до примерно 450 кДа, от примерно 50 кДа до примерно 400 кДа, от примерно 50 кДа до примерно 350 кДа, от примерно 50 кДа до примерно 300 кДа, от примерно 50 кДа до примерно 250 кДа, от примерно 50 кДа до примерно 200 кДа, от примерно 75 кДа до примерно 750 кДа, от примерно 75 кДа до примерно 500 кДа, от примерно 75 кДа до примерно 450 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 350 кДа, от примерно 75 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 250 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 750 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 650 кДа, от примерно 100 кДа до примерно 600 кДа, от примерно 100 кДа до примерно 550 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 450 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 350 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до 750 кДа, от примерно 200 кДа до примерно 700 кДа, от примерно 200 кДа до примерно 650 кДа, от примерно 200 кДа до примерно 600 кДа, от примерно 200 кДа до примерно 550 кДа, от примерно 200 кДа до примерно 500 кДа, от примерно 200 кДа до примерно 450 кДа, от примерно 200 кДа до примерно 400 кДа, от примерно 250 кДа до примерно 750 кДа, от примерно 250 кДа до примерно 700 кДа, от примерно 250 кДа до примерно 650 кДа, от примерно 250 кДа до примерно 600 кДа, от примерно 250 кДа до примерно 550 кДа, от примерно 250 кДа до примерно 500 кДа, от примерно 250 кДа до примерно 450 кДа, от примерно 250 кДа до примерно 400 кДа, от примерно 300 кДа до 750 кДа, от примерно 300 кДа до примерно 700 кДа, от примерно 300 кДа до примерно 650 кДа, от примерно 300 кДа до примерно 600 кДа, от примерно 300 кДа до примерно 550 кДа или от примерно 300 кДа до примерно 500 кДа. Любое целое значение, входящее в указанные выше диапазоны, также считают воплощением изобретения.
В одном воплощении конъюгат имеет молекулярную массу от примерно 300 кДа до примерно 20000 кДа, такую как от примерно 300 кДа до примерно 15000 кДа, от примерно 300 кДа до примерно 10000 кДа, от примерно 300 кДа до примерно 9000 кДа, от примерно 300 кДа до примерно 8000 кДа, от примерно 300 кДа до примерно 7000 кДа, от примерно 300 кДа до примерно 6000 кДа, от примерно 300 кДа до примерно 5000 кДа, от примерно 300 кДа до примерно 4000 кДа, от примерно 300 кДа до примерно 3000 кДа, от примерно 300 кДа до примерно 2000 кДа, от примерно 300 кДа до примерно 1000 кДа, от примерно 500 кДа до примерно 20000 кДа, от примерно 500 кДа до примерно 15000 кДа, от примерно 500 кДа до примерно 10000 кДа, от примерно 500 кДа до примерно 9000 кДа, от примерно 500 кДа до примерно 8000 кДа, от примерно 500 кДа до примерно 7000 кДа, от примерно 500 кДа до примерно 6000 кДа, от примерно 500 кДа до примерно 5000 кДа, от примерно 500 кДа до примерно 4000 кДа, от примерно 500 кДа до примерно 3000 кДа, от примерно 500 кДа до примерно 2000 кДа, от примерно 500 кДа до примерно 1000 кДа, от примерно 1000 кДа до примерно 20000 кДа, от примерно 1000 кДа до примерно 15000 кДа, от примерно 1000 кДа до примерно 10000 кДа, от примерно 1000 кДа до примерно 9000 кДа, от примерно 1000 кДа до примерно 8000 кДа, от примерно 1000 кДа до примерно 7000 кДа, от примерно 1000 кДа до примерно 6000 кДа, от примерно 1000 кДа до примерно 5000 кДа, от примерно 1500 кДа до примерно 20000 кДа, от примерно 1500 кДа до примерно 15000 кДа, от примерно 1500 кДа до примерно 10000 кДа, от примерно 1500 кДа до примерно 9000 кДа, от примерно 1500 кДа до примерно 8000 кДа, от примерно 1500 кДа до примерно 7000 кДа, от примерно 1500 кДа до примерно 6000 кДа, от примерно 1500 кДа до примерно 5000 кДа, от примерно 2000 кДа до примерно 20000 кДа, от примерно 2000 кДа до примерно 15000 кДа, от примерно 2000 кДа до примерно 10000 кДа, от примерно 2000 кДа до примерно 9000 кДа, от примерно 2000 кДа до примерно 8000 кДа, от примерно 2000 кДа до примерно 7000 кДа, от примерно 2000 кДа до примерно 6000 кДа, от примерно 2500 кДа до примерно 20000 кДа, от примерно 2500 кДа до примерно 15000 кДа, от примерно 2500 кДа до примерно 10000 кДа, от примерно 2500 кДа до примерно 9000 кДа, от примерно 2500 кДа до примерно 8000 кДа, от примерно 2500 кДа до примерно 7000 кДа, от примерно 2500 кДа до примерно 6000 кДа, от примерно 3000 кДа до примерно 20000 кДа, от примерно 3000 кДа до примерно 15000 кДа, от примерно 3000 кДа до примерно 10000 кДа, от примерно 3000 кДа до примерно 9000 кДа, от примерно 3000 кДа до примерно 8000 кДа, от примерно 3000 кДа до примерно 7000 кДа или от примерно 3000 кДа до примерно 6000 кДа.
В воплощении конъюгат капсульного полисахарида GBS серотипа IV имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа Ia имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа Ib имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа II имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа III имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа V имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа VI имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа VII имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа VIII имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В воплощении конъюгат капсульного полисахарида GBS серотипа IX имеет молекулярную массу, находящуюся в любом из указанных диапазонов.
В одном воплощении конъюгаты по изобретению имеют по меньшей мере примерно 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 0,95, 0,97 или 0,98 мМ сиаловой кислоты на мМ полисахарида. В предпочтительном воплощении конъюгаты имеют по меньшей мере 0,9 или 0,95 мМ сиаловой кислоты на мМ полисахарида.
В воплощении конъюгат капсульного полисахарида GBS серотипа IV имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа Ia имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа Ib имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа II имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа III имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа V имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа VI имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа VII имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа VIII имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа IX имеет содержание сиаловой кислоты на уровне по меньшей мере любого из указанных значений.
В воплощении конъюгаты по изобретению содержат менее примерно 0,01, 0,02, 0,03, 0,04 или 0,05 мМ O-ацетата на мМ повторяющейся сахаридной единицы. В другом воплощении конъюгат содержит по меньшей мере примерно 0,1, 0,2, 0,3, 0,35 или примерно 0,4 мМ O-ацетата на мМ повторяющейся сахаридной единицы.
В воплощении конъюгат капсульного полисахарида GBS серотипа IV имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа Ia имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа Ib имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа II имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа III имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа V имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа VI имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа VII имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа VIII имеет содержание O-ацетата на уровне любого из указанных значений.
В воплощении конъюгат капсульного полисахарида GBS серотипа IX имеет содержание O-ацетата на уровне любого из указанных значений.
В следующем воплощении иммуногенный конъюгат содержит менее примерно 40%, менее примерно 35%, менее примерно 30%, менее примерно 25%, менее примерно 20%, менее примерно 15%, менее примерно 10% или менее примерно 5% свободного капсульного полисахарида GBS относительно общего количества капсульного полисахарида GBS. В предпочтительном воплощении иммуногенный конъюгат содержит менее примерно 5% непрореагировавшего свободного полисахарида относительно общего количества капсульного полисахарида GBS.
В еще одном воплощении соотношение (по массе) капсульного полисахарида GBS и белка-носителя в конъюгате составляет от примерно 0,5 до примерно 3,0. В одном аспекте соотношение капсульного полисахарида GBS и белка-носителя в конъюгате составляет от примерно 0,5 до примерно 2,0, от примерно 0,5 до примерно 1,5, от примерно 0,5 до примерно 1,0, от примерно 1,0 до примерно 1,5 или от примерно 1,0 до примерно 2,0. В предпочтительном воплощении соотношение капсульного полисахарида GBS и белка-носителя в конъюгате составляет от примерно 0,8 до примерно 1,0.
В другом воплощении степень конъюгирования конъюгата составляет от 2 до 15, от 2 до 13, от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 5, от 2 до 4, от 3 до 15, от 3 до 13, от 3 до 10, от 3 до 8, от 3 до 6, от 3 до 5, от 3 до 4, от 5 до 15, от 5 до 10, от 8 до 15, от 8 до 12, от 10 до 15 или от 10 до 12. В предпочтительном воплощении степень конъюгации конъюгата составляет от 2 до 5.
Конъюгирование
Конъюгирование может быть непосредственным, когда атомы полисахарида ковалентно связываются с атомами поверхности белка. В альтернативном варианте конъюгирование может быть опосредовано молекулой линкера, которая вступает в реакцию и с полисахаридом, и с белком, и соединяет их обоих, прикрепляя углевод к белку.
Когда носитель конъюгирован (т.е. ковалентно связан) с одним или более антигенами, такими как полисахарид, конъюгирование можно осуществлять с помощью любого химического способа, процесса или метода генной технологии, известных в области техники. Например, белок-носитель и один или более антигенов, выбранных из группы, включающей углевод, олигосахарид, липид, липоолигосахарид, полисахарид, конъюгат олигосахарид-белок, конъюгат полисахарид-белок, конъюгат пептид-белок, конъюгат олигосахарид-пептид, конъюгат полисахарид-пептид, конъюгат белок-белок, конъюгат липоолигосахарид-белок, конъюгат полисахарид-белок или любую их комбинацию, могут быть конъюгированы способами, включающими, без ограничения: (1) непосредственное связывание через функциональные группы белка (например, связь тиол-тиол, амин-карбоксил, амин-альдегид, непосредственное ферментативное присоединение); (2) гомобифункциональное связывание аминов (например, с использованием бис-альдегидов); (3) гомобифункциональное связывание тиолов (например, с использованием бис-малеимидов); (4) гомобифункциональное связывание с использованием фотоактивируемых реагентов; (5) гетеробифункциональное связывание аминов с тиолами (например, с использованием малеимидов); (6) гетеробифункциональное связывание с использованием фотоактивируемых реагентов (например, β-диазокарбонильных соединений); (7) внедрение групп, способных вступать в реакцию с аминогруппами, в поли- или олигосахариды при помощи активации бромцианом или карбоксиметилирования; (8) внедрение групп, способных вступать в реакцию с тиоловыми группами, в поли- или олигосахариды с использованием гетеробифункциональных соединений, таких как малеимидо-гидразид; (9) конъюгирование белок-липид посредством внедрения гидрофобной группы в белок и (10) конъюгирование белок-липид посредством внедрения реакционноспособной группы в липид. Также подразумеваются способы гетеробифункционального «нековалентного связывания», такие как взаимодействие авидин-биотин. Другие способы конъюгирования олигосахаридов и полисахаридов с иммуногенными белками-носителями, хорошо известные в области техники, также входят в объем некоторых воплощений изобретения.
В одном воплощении конъюгаты капсульного полисахарида GBS и белка получают путем активации полисахарида тетрафторборатом 1-циано-4-диметиламинопиридиния (CDAP) для образования цианатного сложного эфира. Активированный полисахарид может быть присоединен к аминогруппе белка-носителя напрямую или опосредовано через спейсерную (линкерную) группу. Например, спейсер может представлять собой цистамин или цистеамин для образования тиолированного полисахарида, который может быть присоединен к носителю посредством тиоэфирной связи, образованной в результате реакции с активированным малеимидом белком-носителем (например, с использованием GMBS) или галоацетилированным белком-носителем (например, с использованием иодацетамида, SIB, SIAB, sulfo-SIAB, SIA или SBAP).
В одном аспекте цианатный эфир (возможно полученный с использованием CDAP) присоединяют к гександиамину или гидразиду адипиновой кислоты (ADH), а дериватизированный аминогруппами сахарид конъюгируют с карбоксильной группой белка-носителя с использованием карбодиимида (например, EDAC или EDC). Такие конъюгаты описаны, например, в опубликованных заявках на международный патент WO 93/15760, WO 95/08348 и WO 96/29094.
В других подходящих способах используют карбодиимиды, гидразиды, активные эфиры, норборан, пара-нитробензойную кислоту, N-гидроксисукцинимид, S-NHS (N-гидроксисульфосукцинимид), EDC (1-этил-3(3-диметиламинопропил)карбодиимид гидрохлорид) и TSTU. Многие описаны, например, в опубликованной международной заявке на патент WO 98/42721. В конъюгировании может быть задействован карбонильный линкер, который может быть образован в результате реакции свободной гидроксильной группы сахарида с 1,1-карбонилдиимидазолом (CDI) или 1,1-карбонил-ди-1,2,4-триазолом (CDT) (см. Bethell, et al., J. Biol. Chem., 254:2572-2574 (1979); Hearn, et al., J. Chromatogr., 218:509-518 (1981)) с последующей реакцией с белком с образованием карбаматной связи. Это может включать восстановление аномерной концевой группы в первичную гидроксильную группу, возможную защиту/снятие защиты первичной гидроксильной группы, реакцию первичной гидроксильной группы с CDI/CDT с образованием промежуточного карбамата CDI/CDT и связывание промежуточного карбамата CDI/CDT с аминогруппой белка.
В предпочтительных воплощениях конъюгаты капсульного полисахарида GBS-белка по изобретению получают с использованием восстановительного аминирования. Восстановительное аминирование включает две стадии: (1) окисление полисахарида с образованием альдегидных функциональных групп из вицинальных диолов в отдельных гексасахаридных единицах и (2) восстановление активированного полисахарида и белка-носителя с образованием конъюгата.
В одном воплощении капсульный полисахарид GBS активирован (окислен) способом, включающим стадии:
(а) реакции выделенного капсульного полисахарида GBS с окисляющим агентом; и
(б) остановки реакции окисления путем добавления агента-гасителя с получением в результате активированный капсульный полисахарид GBS.
В одном аспекте изобретения концентрация выделенного капсульного полисахарида составляет от примерно 0,1 мг/мл до примерно 10,0 мг/мл, например от примерно 0,5 мг/мл до примерно 5,0 мг/мл, от примерно 1,0 мг/мл до примерно 3,0 мг/мл или примерно 2,0 мг/мл.
В конкретном воплощении окисляющий агент представляет собой периодат. Периодат окисляет вицинальные гидроксильные группы с образованием карбонильных или альдегидных групп и приводит к расщеплению С-С связи. Термин «периодат» охватывает как периодат, так и йодную кислоту. Данный термин также охватывает метапериодат (IO4-) и ортопериодат (IO65-). Термин «периодат» также охватывает различные соли периодаты, включая периодат натрия и периодат калия. В предпочтительном воплощении окисляющий агент представляет собой периодат натрия. В предпочтительном воплощении периодат, используемый для окисления капсульного полисахарида GBS, представляет собой метапериодат. В предпочтительном воплощении периодат, используемый для окисления капсульного полисахарида GBS серотипа, представляет собой метапериодат натрия.
В другом воплощении полисахарид вступает в реакцию с 0,01-10,0, 0,05-5,0, 0,1-1,0, 0,5-1,0, 0,7-0,8, 0,05-0,5 или 0,1-0,3 молярного эквивалента окисляющего агента. В конкретном воплощении полисахарид вступает в реакцию с примерно 0,05, с примерно 0,1, с примерно 0,15, с примерно 0,2, с примерно 0,25, с примерно 0,3, с примерно 0,35, с примерно 0,4, с примерно 0,45, с примерно 0,5, с примерно 0,55, с примерно 0,6, с примерно 0,65, с примерно 0,7, с примерно 0,75, с примерно 0,8, с примерно 0,85, с примерно 0,9 или с примерно 0,95 молярного эквивалента окисляющего агента. В следующем воплощении полисахарид вступает в реакцию с примерно 0,1 молярного эквивалента окисляющего агента. В следующем воплощении полисахарид вступает в реакцию с примерно 0,15 молярного эквивалента окисляющего агента. В следующем воплощении полисахарид вступает в реакцию с примерно 0,25 молярного эквивалента окисляющего агента. В еще одном воплощении полисахарид вступает в реакцию с примерно 0,5 молярного эквивалента окисляющего агента. В альтернативном воплощении полисахарид вступает в реакцию с примерно 0,6 молярного эквивалента окисляющего агента. В следующем воплощении полисахарид вступает в реакцию с примерно 0,7 молярного эквивалента окисляющего агента.
В одном аспекте изобретения продолжительность реакции окисления составляет от примерно 1 часа до примерно 50 часов, от примерно 10 часов до примерно 30 часов, от примерно 15 часов до примерно 20 часов, от примерно 15 часов до примерно 17 часов или примерно 16 часов.
В следующем аспекте изобретения температуру реакции окисления поддерживают между примерно 2°С и примерно 25°С, между примерно 2°С и примерно 8°С, или между примерно 20°С и примерно 25°С. В одном предпочтительном воплощении температуру реакции поддерживают примерно при 23°С. В другом предпочтительном воплощении температуру реакции поддерживают примерно при 5°С.
В следующем воплощении реакцию окисления осуществляют в буфере, выбранном из группы, состоящей из фосфата натрия, фосфата калия, 2-(N-морфолино)этансульфоновой кислоты (MES) и Bis-Tris. В предпочтительном воплощении буфер представляет собой фосфат калия.
В дополнительном аспекте буфер имеет концентрацию от примерно 1 мМ до примерно 500 мМ, от примерно 1 мМ до примерно 300 мМ или от примерно 50 мМ до примерно 200 мМ. В предпочтительном воплощении буфер имеет концентрацию примерно 100 мМ.
В одном аспекте реакцию окисления осуществляют при рН от примерно 4,0 до примерно 8,0, от примерно 5,0 до примерно 7,0 или от примерно 5,5 до примерно 6,5. В предпочтительном воплощении рН составляет примерно 6,0.
В одном воплощении активированный капсульный полисахарид GBS получают путем реакции между примерно 0,5 мг/л - 5,0 мг/мл выделенного капсульного полисахарида с примерно 0,05-0,3 молярного эквивалента периодата при температуре примерно от 20°С до 25°С.
В другом воплощении активированный капсульный полисахарид GBS получают путем реакции между примерно 0,5 мг/л - 5,0 мг/мл выделенного капсульного полисахарида с примерно 0,05-0,3 молярных эквивалентов периодата при температуре примерно от 2°С до 8°С.
В другом воплощении активированный капсульный полисахарид GBS очищают способами, известными специалистам в области техники, такими как гель-фильтрация (GPC), диализ или ультрафильтрация/диафильтрация. Например, активированный капсульный полисахарид очищают путем концентрирования и диафильтрации с использованием ультрафильтрационного аппарата.
В одном воплощении степень окисления активированного капсульного полисахарида GBS составляет от 5 до 25, например от 5 до 15, от 5 до 10, от 10 до 25, от 10 до 20, от 10 до 15. В предпочтительном воплощении степень окисления активированного капсульного полисахарида GBS составляет от 10 до 20, от 11 до 19, от 12 до 18, от 13 до 17 или от 14 до 16.
В другом воплощении активированный капсульный полисахарид GBS имеет молекулярную массу от примерно 5 кДа до примерно 1000 кДа, такую как от примерно 50 кДа до примерно 300 кДа, от примерно 75 кДа до примерно 400 кДа, от примерно 75 кДа до примерно 200 кДа, от примерно 100 кДа до примерно 700 кДа, от примерно 100 кДа до примерно 500 кДа, от примерно 100 кДа до примерно 400 кДа, от примерно 100 кДа до примерно 300 кДа, от примерно 200 кДа до примерно 400 кДа и от примерно 300 кДа до примерно 700 кДа. В предпочтительном воплощении активированный капсульный полисахарид GBS имеет молекулярную массу от примерно 75 кДа до примерно 400 кДа.
В одном воплощении активированный капсульный полисахарид GBS лиофилизирован, возможно в присутствии сахарида. В предпочтительном воплощении сахарид выбран из сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита и палатинита. В предпочтительном воплощении сахарид представляет собой сахарозу. Лиофилизированный активированный капсульный полисахарид затем может быть смешан с раствором, содержащим белок-носитель.
В другом воплощении активированный капсульный полисахарид GBS смешивают с белком-носителем и лиофилизируют, возможно в присутствии сахарида. В одном аспекте сахарид выбран из сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита и палатинита. В предпочтительном воплощении сахарид представляет собой сахарозу. Совместно лиофилизированные полисахарид и белок-носитель затем могут быть ресуспендированы в растворе и подвергнуты взаимодействию с восстанавливающим агентом.
Активированный капсульный полисахарид GBS может быть конъюгирован с белком-носителем способом, включающим стадии:
(а) приготовления смеси активированного капсульного полисахарида GBS с белком-носителем и
(б) реакции полученной смеси активированного капсульного полисахарида GBS и белка-носителя с восстанавливающим агентом с образованием конъюгата капсульного полисахарида GBS с белком.
Конъюгирование активированного капсульного полисахарида GBS с белком-носителем путем восстановительного аминирования в полярном апротонном растворителе подходит для поддержания низких уровней свободного полисахарида по сравнению, например, с восстановительным аминированием в водном растворе, где уровень непрореагировавшего (свободного) полисахарида существенно повышен. В предпочтительном воплощении стадию (а) и стадию (б) осуществляют в полярном апротонном растворителе.
В одном воплощении стадия (а) включает растворение лиофилизированного капсульного полисахарида GBS в растворе, содержащем белок-носитель и полярный апротонный растворитель. В другом воплощении стадия (а) включает растворение совместно лиофилизированных капсульного полисахарида и белка-носителя в полярном апротонном растворителе.
В одном воплощении полярный апротонный растворитель выбран из группы, состоящей из диметилсульфоксида (DMSO), сульфолана, диметилформамида (DMF) и гексаметилфосфорамида (НМРА). В предпочтительном воплощении полярный апротонный растворитель представляет собой DMSO.
Когда стадии (а) и (б) осуществляют в водном растворе, стадии (а) и (б) осуществляют в буферной водной среде, предпочтительно выбранной из PBS (забуференный фосфатом физиологический раствор), MES, HEPES, Bis-tris, ADA (2-[(2-амино-2-оксоэтил)-(карбоксиметил)амино]уксусная кислота), PIPES, MOPSO (3-морфолино-2-гидроксипропансульфоновая кислота), BES (N,N-бис(2-гидроксиэтил)-2-аминоэтансульфоновая кислота), MOPS (3-(N-морфолин)-пропансульфоновая кислота), DIPSO (3-(N,N-бис(2-гидроксиэтил)амино)-2-гидроксипропансульфоновая кислота), MOBS, HEPPSO (4-(2-гидроксиэтил)-1-пиперазинпропансульфоновая кислота), POPSO (дигидрат пиперазин-1,4-бис(2-гидроксипропансульфоновой кислоты)), TEA (Трис-ацетат-ЭДТА), EPPS, бицина или НЕРВ с рН от примерно 6,0 до примерно 8,5, от примерно 7,0 до примерно 8,0 или от примерно 7,0 до примерно 7,5. В предпочтительном воплощении буфер представляет собой PBS. В предпочтительном воплощении рН составляет примерно 7,3.
В одном воплощении концентрация активированного капсульного полисахарида GBS на стадии (б) составляет от примерно 0,1 мг/мл до примерно 10,0 мг/мл, например от примерно 0,5 мг/мл до примерно 5,0 мг/мл или от примерно 0,5 мг/мл до примерно 2,0 мг/мл. В предпочтительном воплощении концентрация активированного капсульного полисахарида GBS на стадии (б) составляет примерно 0,1 мг/мл, примерно 0,2 мг/мл, примерно 0,3 мг/мл, примерно 0,4 мг/мл, примерно 0,5 мг/мл, примерно 0,6 мг/мл, примерно 0,7 мг/мл, примерно 0,8 мг/мл, примерно 0,9 мг/мл, примерно 1,0 мг/мл, примерно 1,1 мг/мл, примерно 1,2 мг/мл, примерно 1,3 мг/мл, примерно 1,4 мг/мл, примерно 1,5 мг/мл, примерно 1,6 мг/мл, примерно 1,7 мг/мл, примерно 1,8 мг/мл, примерно 1,9 мг/мл, примерно 2,0 мг/мл, примерно 2,1 мг/мл, примерно 2,2 мг/мл, примерно 2,3 мг/мл, примерно 2,4 мг/мл, примерно 2,5 мг/мл, примерно 2,6 мг/мл, примерно 2,7 мг/мл, примерно 2,8 мг/мл, примерно 2,9 мг/мл или примерно 3,0 мг/мл.
В предпочтительном воплощении исходное соотношение (по массе) активированного полисахарида GBS серотипа к белку-носителю составляет от 5:1 до 0,1:1, от 2:1 до 0,1:1, от 2:1 до 1:1, от 1,5:1 до 1:1, от 0,1:1 до 1:1, от 0,3:1 до 1:1, от 0,6:1 до 1:1. В предпочтительном воплощении исходное соотношение (массы к массе) активированного полисахарида GBS серотипа к белку-носителю составляет примерно 0,4:1, 0,5:1, 0,6:1, 0,7:1, 0,8:1, 0,9:1, 1:1, 1,1:1, 1,2:1, 1,3:1, 1,4:1, 1,5:1, 1,6:1, 1,7:1, 1,8:1, 1,9:1, 2:1.
В воплощении восстанавливающий агент представляет собой цианборгидрид натрия, триацетоксиборгидрид натрия, боргидрид натрия или цинка в присутствии кислот Брёнстеда или Льюиса, аминобораны, такие как пиридинборан, 2-пиколинборан, 2,6-диборан-метанол, диметиламин-боран, t-BuMeiPrN-ВН3, бензиламин-ВН3 или 5-этил-2-метилпиридинборан (РЕМВ). В предпочтительном воплощении восстанавливающий агент представляет собой цианборгидрид натрия.
В другом воплощении количество восстанавливающего агента, использованного на стадии (б), составляет от примерно 1,0 до примерно 10,0 молярных эквивалентов, от примерно 0,5 до примерно 5,0 молярных эквивалентов или от примерно 1,0 до примерно 2,0 молярных эквивалентов. В предпочтительном воплощении количество восстанавливающего агента, использованного на стадии (б) составляет примерно 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2,0 молярных эквивалента.
В предпочтительном воплощении продолжительность стадии (б) составляет от 1 до 60 часов, от 10 до 50 часов, от 40 часов до 50 часов или от 42 часов до 46 часов. В предпочтительном воплощении продолжительность стадии (б) составляет примерно 44 часа.
В следующем воплощении температуру реакции на стадии (б) поддерживают между 10°С и 40°С, между 15°С и 30°С, или между 20°С и 26°С. В одном предпочтительном воплощении температуру реакции на стадии (б) поддерживают примерно при 23°С.
В дополнительном воплощении способ получения иммуногенного конъюгата, содержащего капсульный полисахарид GBS, ковалентно связанный с белком-носителем, дополнительно включает стадию (стадию (в)) блокирования непрореагировавших альдегидов (нейтрализации) посредством добавления боргидрида.
В одном воплощении блокирующий реагент представляет собой боргидрид, выбранный из группы, состоящей из боргидрида натрия (NaBH4), цианборгидрида натрия, боргидрида лития, боргидрида калия, боргидрида тетрабутиламмония, боргидрида кальция и боргидрида магния. В предпочтительном воплощении блокирующий агент представляет собой боргидрид натрия.
В еще одном воплощении количество боргидрида, использованного на стадии (в), составляет от примерно 0,1 до примерно 10,0 молярных эквивалентов, от примерно 0,5 до примерно 5,0 молярных эквивалентов или от примерно 1,0 до примерно 3,0 молярных эквивалентов. В предпочтительном воплощении количество боргидрида на стадии (в) составляет примерно 2,0 молярных эквивалента.
В одном предпочтительном воплощении боргидрид, использованный на стадии (в), представляет собой NaBH4 в концентрации примерно 2,0 молярных эквивалента.
В одном воплощении продолжительность стадии (в) составляет от 0,1 до 10 часов, от 0,5 часов до 5 часов, от 2 часов до 4 часов. В предпочтительном воплощении продолжительность стадии (в) составляет примерно 3 часа.
В другом воплощении температуру реакции на стадии (в) поддерживают между примерно 15°С и примерно 45°С, между примерно 15°С и примерно 30°С или между примерно 20°С и примерно 26°С. В предпочтительном воплощении температуру реакции на стадии (в) поддерживают около 23°С.
После конъюгирования капсульного полисахарида GBS с белком-носителем и блокирования, конъюгат полисахарид-белок может быть очищен (обогащен по количеству конъюгата полисахарид-белок) множеством способов, известных специалистам в области техники. Такие способы включают диализ, операции концентрирования/диафильтрации, фильтрование тангенциальным потоком, преципитацию/элюирование, колоночную хроматографию (ДЭАЭ или хроматографию гидрофобного взаимодействия) и глубинную фильтрацию.
В следующем воплощении иммуногенный конъюгат содержит менее примерно 40%, менее примерно 35%, менее примерно 30%, менее примерно 25%, менее примерно 20%, менее примерно 15%, менее примерно 10% или менее примерно 5% свободного капсульного полисахарида GBS относительно общего количества капсульного полисахарида GBS. В предпочтительном воплощении иммуногенный конъюгат содержит менее примерно 5% непрореагировавшего свободного полисахарида относительно общего количества капсульного полисахарида GBS.
В предпочтительном воплощении конъюгат полисахарида GBS и белка имеет молекулярную массу от примерно 300 кДа до примерно 20000 кДа, например от примерно 1000 кДа до примерно 15000 кДа или от примерно 1000 кДа до примерно 10000 кДа.
В еще одном воплощении соотношение (по массе) капсульного полисахарида GBS и белка-носителя в конъюгате составляет от примерно 0,5 до примерно 3,0. В одном аспекте соотношение капсульного полисахарида GBS и белка-носителя в конъюгате составляет от примерно 0,5 до примерно 2,0, от примерно 0,5 до примерно 1,5, от примерно 0,5 до примерно 1,0, от примерно 1,0 до примерно 1,5 или от примерно 1,0 до примерно 2,0. В предпочтительном воплощении соотношение капсульного полисахарида GBS и белка-носителя в конъюгате составляет от примерно 0,8 до примерно 1,0.
В другом воплощении степень конъюгации в конъюгате составляет от 2 до 15, от 2 до 13, от 2 до 10, от 2 до 8, от 2 до 6, от 2 до 5, от 2 до 4, от 3 до 15, от 3 до 13, от 3 до 10, от 3 до 8, от 3 до 6, от 3 до 5, от 3 до 4, от 5 до 15, от 5 до 10, от 8 до 15, от 8 до 12, от 10 до 15 или от 10 до 12. В предпочтительном воплощении степень конъюгации в конъюгате составляет от 2 до 5.
В одном аспекте изобретения конъюгаты капсульного полисахарида GBS и белка получают способом восстановительного аминирования, описанным выше. Например, в одном аспекте данного изобретения предложены конъюгаты капсульного полисахарида GBS и белка, содержащие полисахарид, конъюгированный с белком-носителем, которые получены или могут быть получены способом, включающим стадии:
(а) реакции выделенного капсульного полисахарида GBS с окисляющим агентом;
(б) остановки реакции окисления путем добавления агента-гасителя с получением активированного капсульного полисахарида;
(в) приготовления смеси активированного капсульного полисахарида GBS с белком-носителем,
(г) реакции приготовленной смеси активированного капсульного полисахарида GBS и белка-носителя с восстанавливающим агентом с образованием конъюгата капсульного полисахарида GBS с белком и возможно
(д) блокирования непрореагировавшего альдегида путем добавления боргидрида натрия (NaBH4).
В предпочтительном воплощении стадии (в) и (г) осуществляют в DMSO.
В другом аспекте изобретения конъюгаты капсульного полисахарида GBS и белка по изобретению получают с использованием восстановительного аминирования, как описано выше, но с использованием свободного радикала 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO) и N-хлорсукцинимида (NCS) в качестве соокислителя на стадии активации/окисления. См. опубликованную международную заявку на патент WO 2014/097099, содержание которой включено во всей полноте путем ссылки. В одном таком воплощении гликоконъюгаты капсульных полисахаридов GBS получают с использованием свободного радикала TEMPO для окисления первичных спиртовых групп сахарида до альдегидных групп с использованием NCS в качестве соокислителя (далее «окисление TEMPO/NCS»), как описано в Примере 7 и в опубликованной заявке WO 2014/097099. Таким образом, в одном аспекте конъюгаты капсульных полисахаридов GBS можно получить способом, включающим стадии: (а) реакции капсульного полисахарида GBS с TEMPO и NCS в растворителе для получения активированного сахарида; и б) реакции активированного сахарида с белком-носителем, содержащим одну или более аминогрупп (далее «восстановительное аминирование TEMPO/NCS»). В одном воплощении растворитель может быть водным растворителем или DMSO.
В одном аспекте конъюгаты капсульного полисахарида GBS и белка получают указанным способом. Например, в одном аспекте данного изобретения предложен конъюгат капсульный полисахарид GBS - белок, содержащий полисахарид, конъюгированный с белком-носителем, который получен или который можно получить способом, включающим стадии: (а) реакции сахарида с 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO) и N-хлорсукцинимидом (NCS) в растворителе с получением активированного сахарида; и б) реакции активированного сахарида с белком-носителем, содержащим одну или более аминогрупп. В одном воплощении растворитель может быть водным растворителем или DMSO.
Иммуногенные композиции
После очистки отдельных конъюгатов, их можно комбинировать для получения иммуногенной композиции по данному изобретению, которую можно применять, например, в вакцине. Составление иммуногенной композиции по данному изобретению можно осуществлять способами, известными в области техники.
«Иммунный ответ» на иммуногенную композицию представляет собой развитие у субъекта гуморального и/или клеточно-опосредованного иммунного ответа на молекулы, присутствующие в композиции, представляющей интерес (например, на антиген, такой как белок или полисахарид). Для целей данного изобретения «гуморальный иммунный ответ» представляет собой антитело-опосредованный иммунный ответ и включает выработку антител с аффинностью к антигенам, присутствующим в иммуногенных композициях по изобретению, тогда как «клеточно-опосредованный иммунный ответ» опосредован Т-лимфоцитами и/или другими лейкоцитами. «Клеточно-опосредованный иммунный ответ» вырабатывается в ответ на презентацию эпитопов антигена в ассоцииации с молекулами I или II класса главного комплекса гистосовместимости (МНС). Это приводит к активации антиген-специфических CD4+ Т-хелперных клеток или CD8+ цитотоксических Т-лимфоцитов (CTL). CTL обладают специфичностью в отношении пептидных или липидных антигенов, которые ассоциированы с белками, кодируемыми МНС, или CD1 и экспрессируются на поверхности клеток. CTL способствуют индукции и усиливают разрушение внутриклеточных микроорганизмов внутри клеток или лизис клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антиген-специфический ответ Т-хелперных клеток. Т-хелперы стимулируют функцию и фокусируют активность неспецифических эффекторных клеток на клетках, экспонирующих на своей поверхности пептидные антигены, ассоциированные с классическими или неклассическими молекулами МНС. «Клеточно-опосредованный иммунный ответ» также относится к продукции цитокинов, хемокинов и других подобных молекул, продуцируемых активированными Т-клетками и/или другими лейкоцитами, включая производимые CD4+ и CD8+ Т-клетками. Способность конкретного антигена или композиции стимулировать клеточно-опосредованный иммунный ответ можно определять с помощью целого ряда тестов, таких как лимфопролиферативные тесты (с активацией лимфоцитов), анализ цитотоксических Т-лимфоцитов (CTL) с исследованием специфических к антигену Т-лимфоцитов сенсибилизированного субъекта, или путем определения продукции цитокинов Т-клетками в ответ на повторную стимуляцию антигеном. Такие тесты хорошо известны в области техники. См., например, Erickson, A.L, et al., J. Immunol., 151(8):4189-4199 (1993); Doe, В., et al., Eur. J. Immunol. 24(10):2369-2376 (1994).
Термин «иммуногенный» относится к способности антигена или вакцины вызывать иммунный ответ, гуморальный или клеточно-опосредованный, либо тот и другой.
«Иммуногенное количество», или «иммунологически эффективное количество», или «доза», используемые в данном документе взаимозаменяемо, обычно относятся к количеству антигена или иммуногенной композиции, достаточному для выработки иммунного ответа, клеточного (Т-клеточного) или гуморального (В-клеточного или гуморального) ответа, или и того, и другого, по результатам стандартных тестов, известных специалистам в области техники.
Термины «иммунная интерференция» или «значимая иммунная интерференция», используемые в данном описании, относятся к статистически значимому снижению иммунного ответа на отдельный антиген в мультивалентной или многокомпонентной вакцине по сравнению с иммунным ответом на тот же антиген, при введении в составе моновалентной вакцины.
«Защитный» иммунный ответ относится к способности иммуногенной композиции вызывать иммунный ответ, гуморальный или клеточно-опосредованный, служащий для защиты субъекта от инфекции. Обеспечиваемая защита не должна быть абсолютной, т.е. не требуется полное предотвращение или эрадикация инфекции, если имеет место статистически значимое улучшение по сравнению с контрольной популяцией субъектов, например, инфицированных животных, которым не вводили вакцину или иммуногенную композицию. Защита может ограничиваться уменьшением тяжести или быстроты развития симптомов инфекции. В области техники известно несколько тестов для определения, указывает ли иммунный ответ на «защитный иммунный ответ». Например, повышение уровней антител можно определять в тестах связывания, таких как тест ELISA с использованием цельных клеток, описанный ниже. Другие тесты включают определение функционального ответа антител, такого как облегчение уничтожения бактерий, который можно проанализировать с помощью опсонофагоцитарного теста (ОРА), как описано ниже. В конкретных ситуациях «защитный иммунный ответ» может включать индукцию двукратного повышения уровней антител или четырехкратного повышения уровней антител, специфических в отношении конкретного антигена по меньшей мере у 50% субъектов. В другой ситуации «защитный иммунный ответ» может включать снижение количества бактерий по меньшей мере на 10%, 25%, 50%, 65%, 75%, 80%, 85%, 80%, 90%, 95% или более.
Количество конкретного конъюгата в композиции обычно рассчитывают по общему количеству полисахарида, конъюгированного и неконъюгированного, для указанного конъюгата. Например, конъюгат капсульного полисахарида GBS с 20% свободного полисахарида в дозе капсульного полисахарида GBS 100 мкг/мл будет иметь примерно 80 мкг/мл конъюгированного капсульного полисахарида GBS и примерно 20 мкг/мл неконъюгированного капсульного полисахарида GBS. При расчете дозы конъюгата вклад белка-носителя в конъюгат обычно не учитывают. Количество конъюгата может варьировать в зависимости от серотипа стрептококка. Как правило, каждая доза будет содержать от примерно 0,01 мг/мл до примерно 100 мкг/мл каждого полисахарида, в частности, от примерно 1 мкг/мл до примерно 70 мкг/мл, более конкретно, от примерно 5 мкг/мл до примерно 50 мкг/мл. «Иммуногенное количество» различных полисахаридных компонентов в иммуногенной композиции может различаться, и каждая может содержать примерно 0,01 мкг/мл, примерно 0,1 мкг/мл, примерно 0,25 мкг/мл, примерно 0,5 мкг/мл, примерно 1 мкг/мл, примерно 2 мкг/мл, примерно 3 мкг/мл, примерно 4 мкг/мл, примерно 5 мкг/мл, примерно 6 мкг/мл, примерно 7 мкг/мл, примерно 8 мкг/мл, примерно 9 мкг/мл, примерно 10 мкг/мл, примерно 15 мкг/мл, примерно 20 мкг/мл, примерно 25 мкг/мл, примерно 30 мкг/мл, примерно 40 мкг/мл, примерно 50 мкг/мл, примерно 60 мкг/мл, примерно 70 мкг/мл, примерно 80 мкг/мл, примерно 90 мкг/мл или примерно 100 мкг/мл любого конкретного полисахаридного антигена. Доза или иммуногенное количество мультивалентной иммуногенной композиции будет указывать дозу каждого полисахарида, если не указано иное. Например, доза шестивалентной иммуногенной композиции 10 мкг/мл будет содержать 10 мкг/мл каждого из шести полисахаридов.
Эффективность антигена в качестве иммуногена можно установить путем определения уровня В-клеточной активности путем определения уровней циркулирующих антител, специфических к антигену в сыворотке при помощи иммунологических тестов, анализа иммунопреципитации, функциональных тестов антител, таких как анализ опсонической активности in vitro и многих других тестов, известных в области техники. Другой показатель эффективности антигена в качестве иммуногена для Т-клеток можно оценивать в исследованиях пролиферации, цитолитических исследованиях, таких как анализ высвобождения хрома для определения способности Т-клеток лизировать ее специфическую клетку-мишень. Кроме того, в данном изобретении «иммуногенное количество» можно также определять путем измерения сывороточных уровней антиген-специфического антитела, индуцированного введением антигена, или путем измерения способности антител, индуцированных таким образом, усиливать опсонофагоцитарную способность конкретных лейкоцитов, согласно данному описанию. Уровень защиты иммунного ответа можно определять при заражении иммунизированного хозяина антигеном, инъекцию которого осуществляли. Например, если антиген, на который требуется вызвать иммунный ответ, представляет собой бактерию, уровень защиты, обеспеченной «иммуногенным количеством» антигена, можно определить путем определения жизнеспособности, выраженной в процентах, или гибели, выраженной в процентах, после заражения животных бактериальными клетками. В одном воплощении степень защиты можно определить путем оценки по меньшей мере одного симптома, ассоциированного с бактериальной инфекцией, например, лихорадки, ассоциированной с инфекцией. Количество каждого из антигенов в мультиантигенной или многокомпонентной вакцине или иммуногенных композициях будет варьировать по отношению к каждому из других компонентов и может быть определено способами, известными специалистам в области техники. Такие способы будут включать, например, процедуры определения иммуногенности и/или эффективности in vivo.
Термин «иммуногенная композиция» относится к любой фармацевтической композиции, содержащей антиген, например, микроорганизм или его компонент, которую можно применять для индукции иммунного ответа у субъекта. Иммуногенные композиции по данному изобретению можно использовать для лечения людей, подверженных инфекции GBS, путем введения иммуногенных композиций системно через кожу или через слизистую. Такое введение может включать внутримышечную (в/м), внутрибрюшинную (в/б), внутрикожную (в/к) или подкожную инъекцию; введение с помощью пластыря или иного средства трансдермальной доставки или посредством введения через слизистую в ротовую полость/пищеварительный, дыхательный или урогенитальный тракты. В одном воплощении иммуногенную композицию можно использовать в изготовлении вакцины или для выработки поликлональных или моноклональных антител, которые можно использовать для пассивной защиты или лечения животного.
В одном аспекте данное изобретение относится к иммуногенным композициям, которые включают эффективное количество по меньшей мере одного полисахарида, олигосахарида, конъюгата полисахарид-белок или их биологических эквивалентов, согласно данному описанию. Например, в одном воплощении иммуногенная композиция включает в себя конъюгаты полисахарид-белок, где капсульный полисахарид выбран из группы, состоящей из стрептококка группы В серотипов Ia, Ib, II, III, IV, V, VI, VII, VIII и IX, и где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 60%. В другом примере иммуногенная композиция содержит конъюгаты полисахарид-белок, содержащие капсульные полисахариды стрептококка группы В серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В другом воплощении иммуногенная композиция содержит конъюгаты полисахарид-белок, содержащие капсульные полисахариды стрептококка группы В серотипа IV и по меньшей мере двух дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В еще одном воплощении иммуногенная композиция содержит конъюгаты полисахарид-белок, содержащие капсульные полисахариды стрептококка группы В серотипа IV и по меньшей мере трех дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В следующем воплощении иммуногенная композиция содержит конъюгаты полисахарид-белок, содержащие капсульные полисахариды стрептококка группы В серотипа IV и по меньшей мере четырех дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В конкретном воплощении иммуногенной композиции конъюгатов полисахарид-белок конъюгаты содержат капсульные полисахариды стрептококка группы В серотипов Ia, Ib, II, III и V. В другом воплощении иммуногенной композиции конъюгатов полисахарид-белок конъюгаты содержат капсульные полисахариды стрептококка группы В серотипов Ia, Ib, II, III и IV. В еще одном воплощении иммуногенной композиции конъюгатов полисахарид-белок конъюгаты содержат капсульные полисахариды стрептококка группы В серотипа IV и по меньшей мере пяти дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В одном таком воплощении иммуногенная композиция содержит шесть конъюгатов полисахарид-белок, где конъюгаты содержат капсульный полисахарид стрептококка группы В серотипов Ia, Ib, II, III, IV и V.
В одном воплощении иммуногенная композиция по изобретению содержит от 2 до 10 различных серотипов S. agalactiae. Таким образом, в одном воплощении иммуногенная композиция по изобретению представляет собой 2, 3, 4, 5, 6, 7, 8, 9 или 10-валентную композицию конъюгата GBS. В одном таком воплощении иммуногенная композиция представляет собой 5-валентную композицию конъюгата GBS. В другом воплощении иммуногенная композиция представляет собой 6-валентную композицию конъюгата GBS. В еще одном таком воплощении иммуногенная композиция представляет собой 7-валентную композицию конъюгата GBS. В следующем воплощении иммуногенная композиция представляет собой 8-валентную композицию конъюгата GBS.
В отличие от существующих в уровне техники сведений о применении менее шести, менее пяти или менее четырех антигенов GBS в композиции (см. опубликованные международные заявки на патент WO 2006/082527 и WO 2006/082530) и свидетельств иммунной интерференции, в частности, при использовании серотипа V в мультивалентных композициях (см. опубликованную международную заявку на патент WO 2012/035519), данное изобретение не продемонстрировало какой-либо значимой иммунной интерференции ни при использовании четырех или более антигенов GBS, ни при использовании серотипа V в мультивалентной композиции. Таким образом, данное изобретение относится к мультивалентным иммуногенным композициям, содержащим конъюгаты полисахарид-белок, содержащие капсульные полисахариды GBS по меньшей мере четырех серотипов, например капсульные полисахариды по меньшей мере пяти серотипов GBS, капсульные полисахариды по меньшей мере шести серотипов GBS, капсульные полисахариды по меньшей мере семи серотипов GBS, капсульные полисахариды по меньшей мере восьми серотипов GBS или капсульные полисахариды по меньшей мере девяти серотипов GBS, где композиция не демонстрирует значимой иммунной интерференции. В конкретном воплощении иммуногенная композиция содержит капсульный полисахарид GBS серотипа V.
Конъюгаты полисахарид-белок могут содержать одинаковые или различные белки-носители. В одном воплощении конъюгаты содержат одинаковые белки-носители, и сахариды конъюгированы с одной и той же молекулой белка-носителя (молекулы-носители имеют 2 или более различных конъюгированных с ней полисахаридов) (см., например, опубликованную международную заявку на патент WO 2004/083251). В другом воплощении полисахариды индивидуально конъюгированы с разными молекулами белковых носителей (каждая молекула белкового носителя имеет только один тип конъюгированного с ней полисахарида). В указанном воплощении капсульные сахариды индивидуально конъюгированы с белком-носителем.
Оптимальные количества компонентов для конкретной иммуногенной композиции могут быть установлены в стандартных исследованиях, включающих изучение у субъектов соответствующих иммунных ответов. После первоначальной вакцинации субъекты могут получать одну или более бустерных иммунизации с надлежащими интервалами.
Кроме ряда конъюгатов капсульного полисахарида и белка иммуногенные композиции по изобретению могут дополнительно содержать один или более консервантов. Согласно требованиям FDA (Управление по контролю пищевых продуктов и лекарственных средств), биологические препараты в многодозовых упаковках должны содержать консервант, за несколькими исключениями. Данное изобретение предполагает применение таких многодозовых упаковок. Вакцинные препараты, содержащие консерванты, включают вакцины, содержащие хлорид бензетония (сибирская язва), 2-феноксиэтанол (АКДС, гепатит А, болезнь Лайма, полиомиелит (парентеральные)) и фенол (пневмококковая, тифозная (парентеральные)). Консерванты, одобренные для применения в инъекционных препаратах, включают, например, хлорбутанол, мета-крезол, метилпарабен, пропилпарабен, 2-феноксиэтанол, хлорид бензетония, хлорид бензалкония, бензойную кислоту, бензойный спирт, фенол и нитрат фенилртути.
В другом аспекте изобретение относится к композиции, включающей по меньшей мере один из любых описанных здесь полисахаридов и фармацевтически приемлемый эксципиент, буфер, стабилизатор, адъювант, криопротектор, соль, двухвалентный катион, неионный детергент, ингибитор свободнорадикального окисления, разбавитель или носитель, или их смесь.
Иммуногенная композиция возможно может содержать один или более физиологически приемлемых буферов, выбранных из HEPES, PIPES, MES, Tris (триметамин), фосфатного, ацетатного, боратного, цитратного, глицинового, гистидинового и сукцинатного буферов, не ограничиваясь ими. В предпочтительном воплощении буфер представляет собой гистидиновый буфер.
В одном воплощении иммуногенная композиция содержит буфер в концентрации от примерно 5 мМ до примерно 50 мМ, от примерно 5 мМ до примерно 40 мМ, от примерно 5 мМ до примерно 30 мМ, от примерно 5 мМ до примерно 20 мМ, от примерно 5 мМ до примерно 10 мМ, от примерно 10 мМ до примерно 50 мМ, от примерно 10 мМ до примерно 40 мМ, от примерно 10 мМ до примерно 35 мМ, от примерно 10 мМ до примерно 30 мМ, от примерно 10 мМ до примерно 25 мМ, от примерно 10 мМ до примерно 20 мМ, от примерно 10 мМ до примерно 15 мМ, от примерно 15 мМ до примерно 50 мМ, от примерно 15 мМ до примерно 40 мМ, от примерно 15 мМ до примерно 35 мМ, от примерно 15 мМ до примерно 30 мМ, от примерно 15 мМ до примерно 25 мМ или от примерно 15 мМ до примерно 20 мМ. В предпочтительном воплощении иммуногенная композиция содержит буфер в концентрации от примерно 10 мМ до примерно 25 мМ, и наиболее предпочтительно примерно 20 мМ.
В одном предпочтительном воплощении иммуногенная композиция содержит гистидин в концентрации примерно 20 мМ.
В некоторых воплощениях композиция забуферена и имеет значение рН в диапазоне от примерно 5,0 до примерно 7,1, например от примерно 5,3 до примерно 7,1, от примерно 5,5 до примерно 7,0, от примерно 6,0 до примерно 7,0, от примерно 6,0 до примерно 6,5, от примерно 6,3 до примерно 7,0, или от примерно 6,5 до примерно 7,0. В другом воплощении композиция забуферена и имеет значение рН примерно 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 или 7,0. В предпочтительном воплощении композиция забуферена и имеет значение рН в диапазоне от примерно 6,0 до примерно 7,0 и, наиболее предпочтительно, примерно 6,5.
Иммуногенная композиция возможно может содержать один или более неионных поверхностно-активных веществ, включая, без ограничения, сложные эфиры полиоксиэтиленсорбитана и жирной кислоты, полисорбат-80 (TWEEN 80), полисорбат-60 (TWEEN 60), полисорбат-40 (TWEEN 40), полисорбат-20 (TWEEN 20) и простые алкиловые эфиры полиоксиэтилена, включая, без ограничения BRIJ 58, BRIJ 35, а также другие поверхностно-активные вещества, такие как TRITON X-100; TRITON X-114, NP40, SPAN 85 и неионные поверхностно-активные вещества серии PLURONIC (например, PLURONIC 121). В одном воплощении иммуногенная композиция содержит полисорбат-80 или полисорбат-40, предпочтительно полисорбат-80 (PS80).
В одном воплощении иммуногенная композиция содержит поверхностно-активное вещество в концентрации от примерно 0,001% до примерно 2% (об./мас.), от примерно 0,001% до примерно 1%, от примерно 0,001% до примерно 0,5%, от примерно 0,001% до примерно 0,1%, от примерно 0,001% до примерно 0,05%, от примерно 0,001% до примерно 0,01%, от примерно 0,001% до 0,005%, от примерно 0,005% до примерно 2%, от примерно 0,005% до примерно 1%, от примерно 0,005% до примерно 0,5%, от примерно 0,005% до примерно 0,1%, от примерно 0,005% до примерно 0,05%, от примерно 0,005% до примерно 0,01%, от примерно 0,01% до примерно 2%, от примерно 0,01% до примерно 1%, от примерно 0,01% до примерно 0,5%, от примерно 0,01% до примерно 0,1%, от примерно 0,01% до примерно 0,05%, от примерно 0,01% до примерно 0,04%, от примерно 0,01% до примерно 0,03%, от примерно 0,015% до примерно 2%, от примерно 0,015% до примерно 1%, от примерно 0,015% до примерно 0,5%, от примерно 0,015% до примерно 0,1%, от примерно 0,015% до примерно 0,05%, от примерно 0,015% до примерно 0,04%, от примерно 0,015% до примерно 0,03%, от примерно 0,02% до примерно 2%, от примерно 0,02% до примерно 1%, от примерно 0,02% до примерно 0,5%, от примерно 0,02% до примерно 0,1%, от примерно 0,02% до примерно 0,05%, от примерно 0,02% до примерно 0,04%, от примерно 0,02% до примерно 0,03%, от примерно 0,05% до примерно 2%, от примерно 0,05% до примерно 1%, от примерно 0,05% до примерно 0,5%, от примерно 0,05% до примерно 0,1%, от примерно 0,1% до примерно 2%, от примерно 0,1% до примерно 1%, от примерно 0,1% до примерно 0,5% или от примерно 0,1% до примерно 0,25%. В предпочтительном воплощении иммуногенная композиция содержит поверхностно-активное вещество в концентрации от примерно 0,01% до примерно 0,03% и наиболее предпочтительно примерно 0,02%.
В другом воплощении иммуногенная композиция содержит полисорбат-80 в концентрации от примерно 0,001% до примерно 2% (предпочтительно до примерно 0,25%) или полисорбат-40 в концентрации от примерно 0,001% до 1% (предпочтительно до примерно 0,5%).
В предпочтительном воплощении иммуногенная композиция содержит PS80 в концентрации примерно 0,02%.
Фармацевтически приемлемые носители не следует путать с «белками-носителями», которые используют для присоединения углевода по изобретению к белку и модифицируют иммунный ответ на указанный углевод. Во избежание путаницы с белками-носителями, описанными в данном документе, более предпочтительным будет термин фармацевтически приемлемый разбавитель, нежели фармацевтически приемлемые носители, однако, в ряде случаев указанные термины могут использоваться взаимозаменяемо. Термин «фармацевтически приемлемый носитель» означает носитель, одобренный федеральными, региональными или иными органами регулирования или включенный в фармакопею США или другую общепризнанную фармакопею для применения у животных, и в частности, у людей, а также у млекопитающих, не являющихся людьми. Термин «носитель» обозначает разбавитель, адъювант, эксципиент или несущую среду, с которыми вводят фармацевтическую композицию. Подходящие фармацевтически приемлемые разбавители включают любые стандартные растворители, диспергирующие среды, наполнители, твердые носители, водные растворы, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и т.п. Такие фармацевтически приемлемые разбавители могут представлять собой стерильные жидкости, такие как вода и масла, включая минеральные, животные, растительные или синтетические масла. В качестве жидких носителей, в частности, для инъекционных растворов, могут применяться вода, вода для инъекций (WFI), стерильные изотонические физиологические растворы, фосфатно-солевые буферы, суспензии адъювантов, водные растворы декстрозы и глицерина, а также их комбинации. Фармацевтически приемлемые разбавители могут дополнительно содержать незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты или буферы, которые увеличивают срок годности или эффективность в организме. Получение и применение фармацевтически приемлемых разбавителей хорошо известно в области техники. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" под редакцией E.W. Martin. В одном воплощении разбавитель представляет собой воду, воду для инъекций (WFI), суспензию адъюванта или физиологический раствор. В конкретном воплощении разбавитель представляет собой суспензию любого описанного в данном документе адъюванта. В предпочтительном воплощении разбавитель представляет собой суспензию адъюванта на основе алюминия, такую как суспензия фосфата алюминия.
Подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, трегалозу, раффинозу, стахиозу, мелицитозу, декстран, маннит, лактит, палатинит, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, глицин, аргинин, лизин, хлорид натрия (NaCl), сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и т.п. В предпочтительном воплощении эксципиент представляет собой NaCl.
В одном воплощении иммуногенная композиция содержит эксципиент в концентрации от примерно 10 мМ до примерно 500 мМ, от примерно 10 мМ до примерно 450 мМ, от примерно 10 мМ до примерно 400 мМ, от примерно 10 мМ до примерно 350 мМ, от примерно 10 мМ до примерно 300 мМ, от примерно 10 мМ до примерно 250 мМ, от примерно 10 мМ до примерно 200 мМ, от примерно 10 мМ до примерно 150 мМ, от примерно 10 мМ до примерно 100 мМ, от примерно 10 мМ до примерно 50 мМ, от примерно 10 мМ до примерно 30 мМ, от примерно 10 мМ до примерно 20 мМ, от примерно 20 мМ до примерно 500 мМ, от примерно 20 мМ до примерно 450 мМ, от примерно 20 мМ до примерно 400 мМ, от примерно 20 мМ до примерно 350 мМ, от примерно 20 мМ до примерно 300 мМ, от примерно 20 мМ до примерно 250 мМ, от примерно 20 мМ до примерно 200 мМ, от примерно 20 мМ до примерно 150 мМ, от примерно 20 мМ до примерно 100 мМ, от примерно 20 мМ до примерно 50 мМ, от примерно 20 мМ до примерно 30 мМ, от примерно 50 мМ до примерно 500 мМ, от примерно 50 мМ до примерно 450 мМ, от примерно 50 мМ до примерно 400 мМ, от примерно 50 мМ до примерно 350 мМ, от примерно 50 мМ до примерно 300 мМ, от примерно 50 мМ до примерно 250 мМ, от примерно 50 мМ до примерно 200 мМ, от примерно 50 мМ до примерно 150 мМ, от примерно 50 мМ до примерно 100 мМ, от примерно 100 мМ до примерно 500 мМ, от примерно 100 мМ до примерно 450 мМ, от примерно 100 мМ до примерно 400 мМ, от примерно 100 мМ до примерно 350 мМ, от примерно 100 мМ до примерно 300 мМ, от примерно 100 мМ до примерно 250 мМ, от примерно 100 мМ до примерно 200 мМ, от примерно 100 мМ до примерно 150 мМ, от примерно 150 мМ до примерно 500 мМ, от примерно 150 мМ до примерно 450 мМ, от примерно 150 мМ до примерно 400 мМ, от примерно 150 мМ до примерно 350 мМ, от примерно 150 мМ до примерно 300 мМ, от примерно 150 мМ до примерно 250 мМ, от примерно 150 мМ до примерно 200 мМ, от примерно 200 мМ до примерно 500 мМ, от примерно 200 мМ до примерно 450 мМ, от примерно 200 мМ до примерно 400 мМ, от примерно 200 мМ до примерно 350 мМ, от примерно 200 мМ до примерно 300 мМ, от примерно 200 мМ до примерно 250 мМ, от примерно 250 мМ до примерно 500 мМ, от примерно 250 мМ до примерно 450 мМ, от примерно 250 мМ до примерно 400 мМ, от примерно 250 мМ до примерно 350 мМ, от примерно 250 мМ до примерно 300 мМ, от примерно 300 мМ до примерно 500 мМ, от примерно 300 мМ до примерно 450 мМ, от примерно 300 мМ до примерно 400 мМ, от примерно 300 мМ до примерно 350 мМ, от примерно 350 мМ до примерно 500 мМ, от примерно 350 мМ до примерно 450 мМ, от примерно 350 мМ до примерно 400 мМ, от примерно 400 мМ до примерно 500 мМ, от примерно 400 мМ до примерно 450 мМ или от примерно 450 мМ до примерно 500 мМ. В предпочтительном воплощении иммуногенная композиция содержит эксципиент в концентрации от примерно 10 мМ до примерно 250 мМ и наиболее предпочтительно примерно 150 мМ.
В одном предпочтительном воплощении эксципиент представляет собой NaCl в концентрации примерно 150 мМ.
При необходимости композиция может также содержать незначительное количество смачивающего, объемообразующего, эмульгирующего агентов или буферных агентов для поддержания рН. Эти композиции могут находиться в форме растворов, суспензий, эмульсий, лиофилизированных порошков или таблеток и т.п. Лекарственная форма должна соответствовать способу введения. За исключением случаев, когда какие-либо стандартные среды или агенты несовместимы с активным ингредиентом, предусмотрено их применение в иммуногенных композициях по данному изобретению.
В одном воплощении иммуногенная композиция лиофилизирована, возможно в присутствии по меньшей мере одного эксципиента. В предпочтительном воплощении по меньшей мере один эксципиент выбран из группы, состоящей из крахмала, глюкозы, лактозы, сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита, палатинита, желатина, солода, риса, муки, мела, силикагеля, стеарата натрия, моностеарата глицерина, талька, глицина, аргинина, лизина, хлорида натрия (NaCl), сухого обезжиренного молока, глицерина, пропиленгликоля, воды и этанола. В предпочтительном воплощении по меньшей мере один эксципиент выбран из группы, состоящей из сахарозы, маннита и глицина. В конкретном воплощении по меньшей мере один эксципиент представляет собой сахарозу. В другом воплощении лиофилизированная композиция содержит дополнительный эксципиент. В одном таком воплощении дополнительный эксципиент представляет собой маннит или глицин.
В другом воплощении лиофилизированная композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) по меньшей мере одного сахарида, например примерно 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% или 10,0%. В предпочтительном воплощении лиофилизированная композиция содержит более примерно 5,5% (масс./об.) по меньшей мере одного эксципиента, например более чем примерно 7,0% (масс./об.). В следующем воплощении лиофилизированная композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) дополнительного эксципиента, например, примерно 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% или 10,0%. В предпочтительном воплощении лиофилизированная композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) по меньшей мере одного эксципиента и от примерно 1% (масс./об.) до примерно 10% (масс./об.) дополнительного эксципиента.
В еще одном воплощении лиофилизированную композицию разбавляют водой, водой для инъекций (WFI), суспензией адъюванта или физиологическим раствором. В предпочтительном воплощении разбавитель представляет собой суспензию адъюванта на основе алюминия, такую как суспензия фосфата алюминия.
В одном воплощении композиция включает выделенный полисахарид, описанный в данном документе, и молекулу-носитель. Подходящие молекулы-носители могут включать белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, агрегаты липидов (такие как капли масла или липосомы) и неактивные вирусные частицы. Примеры корпускулярных носителей включают носители на основе полимеров полиметилметакрилата, а также микрочастиц на основе полилактидов и сополимеров лактида и гликолида, известных как PLG.
Иммуногенные композиции по данному изобретению могут дополнительно содержать один или более дополнительных «иммуномодуляторов», которые представляют собой агенты, возбуждающие или изменяющие иммунную систему таким образом, что наблюдается усиление или ослабление гуморального и/или клеточно-опосредованного иммунитета. В одном конкретном воплощении предпочтительно усиление гуморального и/или клеточно-опосредованного компонентов иммунной системы. Примеры некоторых иммуномодуляторов включают, например, адъювант или цитокин, или ISCOMATRIX (CSL Limited, Parkville, Австралия), описанные в патенте US 5254339, помимо прочих. Термин «адъювант» относится к соединению или смеси, которая усиливает иммунный ответ на антиген, как описано ниже.
Неограничивающие примеры адъювантов, которые можно использовать в композиции по данному изобретению, включают систему адъювантов RIBI (Ribi Inc., Hamilton, Mont); минеральные гели, такие как гель гидроксида алюминия; эмульсии вода-в-масле, такие как полный и неполный адъюванты Фрейнда; блок-сополимеры (CytRx, Atlanta Ga.); SAF-M (Chiron, Emeryville, Calif.); адъювант AMPHIGEN®; сапонин; Quil А или другие фракции сапонинов; монофосфорил-липид А и липид-аминный адъювант авридин. Неограничивающие примеры эмульсий масло-в-воде, которые можно использовать в качестве адъювантов в вакцине по изобретению, включают MF59 (патент US 6299884), содержащий 5% сквалена, 0,5% полисорбата 80 и 0,5% Span 85 (возможно содержащий различное количество МТР-РЕ) в виде частиц субмикронного размера, полученных с помощью микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Newton, MA), и SAF (содержащий 10% сквалена, 0,4% полисорбата 80, 5% блочного полимера pluronic L121 и thr-MDP, либо в виде субмикронной эмульсии, полученной методом микрофлюидизации, либо в виде эмульсии частиц более крупного размера, полученной перемешиванием на вортексе); модифицированный SEAM62 (содержащий 5% (об./об.) сквалена (Sigma), 1% (об./об.) детергента SPAN® 85 (ICI Surfactants), 0,7% (об./об.) детергента полисорбат 80 (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil A, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина) и модифицированный SEAM 1/2 (содержащий 5% (об./об.) сквалена, 1% (об./об.) детергента SPAN® 85, 0,7% (об./об.) детергента полисорбат 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil А и 50 мкг/мл холестерина).
Подходящие адъюванты, применяемые для усиления иммунного ответа, также включают MPL™ (3-O-деацетилированный монофосфорил-липид А, Corixa, Hamilton, MT), описанный в патенте US 4912094, не ограничиваясь им. Для применения в качестве адъювантов также подходят синтетические аналоги липида А или соединения аминоалкил-глюкозамин-фосфата (AGP) или их производные или аналоги, предлагаемые Corixa (Hamilton, MT) и описанные в патенте US 6113918. Одним из таких AGP является 2-[(R)-3-тетрадеканоилокси-тетрадеканоил-амино]-этил-2-дезокси-4-O-фосфоно-3-O-[(R)-3-тетрадеканоилокси-тетрадеканоил]-2-[(R)-3-тетрадеканоилокси-тетрадеканоил-амино]-b-D-глюкопиранозид, известный также как 529 (ранее обозначавшийся RC529). Этот адъювант 529 находится в водной форме (AF) или в форме стабильной эмульсии (SE).
Другие адъюванты включают производные циклодекстрина (патент US 6165995); полианионный полимер (патент US 6610310); мурамилпептиды, такие как N-ацетил-мурамил-L-треонил-D-изоглутамин (thr-MDP) и N-ацетил-нормурамил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидрокси-фосфорилокси)-этиламин (МТР-РЕ); амфиген; авридин; L121/сквален; D-лактид-полилактид/гликозид; полиолы pluronic; убитая Bordetella; сапонины, такие как Stimulon™ QS-21 (Antigenics, Framingham, MA), описанный в патенте US 5057540; Mycobacterium tuberculosis; бактериальные липополисахариды; синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие мотив CpG (например, патент US 6207646); IC-31 (Intercell AG, Vienna, Австрия), описанный в патентах ЕР 1296713 и 1326634; коклюшный токсин (РТ) или его мутантная форма, холерный токсин или его мутантная форма (например, патенты US 7285281, 7332174, 7361355 и 7384640) или термолабильный токсин Е.coli (LT) или его мутантная форма, в частности, LT-K63, LT-R72 (например, патенты US 6149919, 7115730 и 7291588).
Другие «иммуномодуляторы», которые могут входить в состав вакцины, включают, например, один или более из интерлейкинов 1-α, 1-β, 2, 4, 5, 6, 7, 8, 10, 12 (см., например, патент US 5723127), 13, 14, 15, 16, 17 и 18 (и его мутантные формы); интерфероны-α, β и γ; гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (см., например, патент US 5078996 и номер АТСС 39900); макрофагальный колониестимулирующий фактор (M-CSF); гранулоцитарный колониестимулирующий фактор (G-CSF) или факторы некроза опухоли α и β. Другие адъюванты, которые можно использовать в иммуногенных композициях, описанных в данном документе, включают хемокины, включая, без ограничения, МСР-1, MIP-1α, MIP-1β и RANTES; молекулы адгезии, такие как селектин, например, L-селектин, Р-селектин и Е-селектин; муцин-подобные молекулы, например, CD34, GlyCAM-1 и MadCAM-1; представителей семейства интегринов, таких как LFA-1, VLA-1, Мас-1 и р150.95; представителей суперсемейства иммуноглобулинов, таких как РЕСАМ (молекула адгезии тромбоцит-эндотелиальных клеток), ICAM (молекула межклеточной адгезии), например, ICAM-1, ICAM-2 и ICAM-3, CD2 и LFA-3; ко-стимулирующие молекулы, такие как В7-1, В7-2, CD40 и CD40L; факторы роста, включая фактор роста сосудов, фактор роста нервов, фактор роста фибробластов, эпидермальный фактор роста, PDGF (фактор роста тромбоцитов), BL-1 и фактор роста сосудистого эндотелия; молекулы рецепторов, включая Fas, рецептор TNF (фактор некроза опухоли), Flt, Apo-1, р55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2 и DR6; а также каспазу (ICE).
Следует понимать, что решение о применении иммуномодулятора и/или адъюванта или выбор иммуномодулятора и/или адъюванта для применения будет зависеть от субъекта, которому будут вводить вакцину или иммуногенную композицию, способа введения и количества инъекций, которые необходимо сделать. Например, если субъект подвергался естественному воздействию патогена, адъювант может не требоваться, поскольку антигены вакцины могут эффективно вызывать вторичный иммунный ответ. В некоторых воплощениях иммуногенная композиция будет включать один или более адъювантов. В одном воплощении иммуногенная композиция содержит адъювант на основе алюминия. В одном таком воплощении адъювант на основе алюминия представляет собой гидроксид алюминия, фосфат алюминия или гидроксифосфат алюминия. В конкретном воплощении адъювант представляет собой фосфат алюминия. В другом воплощении изобретения иммуногенная композиция содержит в качестве адъюванта QS-21.
В одном воплощении иммуногенная композиция содержит адъювант в концентрации от примерно 0,1 мг/мл до примерно 1,0 мг/мл, от примерно 0,1 мг/мл до примерно 0,9 мг/мл, от примерно 0,1 мг/мл до примерно 0,8 мг/мл, от примерно 0,1 мг/мл до примерно 0,7 мг/мл, от примерно 0,1 мг/мл до примерно 0,6 мг/мл, от примерно 0,1 мг/мл до примерно 0,5 мг/мл, от примерно 0,1 мг/мл до примерно 0,4 мг/мл, от примерно 0,1 мг/мл до примерно 0,3 мг/мл, от примерно 0,1 мг/мл до примерно 0,2 мг/мл, от примерно 0,25 мг/мл до примерно 0,95 мг/мл, от примерно 0,25 мг/мл до примерно 0,85 мг/мл, от примерно 0,25 мг/мл до примерно 0,75 мг/мл, от примерно 0,25 мг/мл до примерно 0,65 мг/мл, от примерно 0,25 мг/мл до примерно 0,55 мг/мл, от примерно 0,25 мг/мл до примерно 0,45 мг/мл, от примерно 0,25 мг/мл до примерно 0,35 мг/мл, от примерно 0,5 мг/мл до примерно 1,0 мг/мл, от примерно 0,5 мг/мл до примерно 0,9 мг/мл, от примерно 0,5 мг/мл до примерно 0,8 мг/мл, от примерно 0,5 мг/мл до примерно 0,75 мг/мл, от примерно 0,5 мг/мл до примерно 0,7 мг/мл, от примерно 0,5 мг/мл до примерно 0,65 мг/мл, от примерно 0,5 мг/мл до примерно 0,6 мг/мл, от примерно 0,75 мг/мл до примерно 1,0 мг/мл, от примерно 0,75 мг/мл до примерно 0,95 мг/мл, от примерно 0,75 мг/мл до примерно 0,9 мг/мл и от примерно 0,75 мг/мл до примерно 0,85 мг/мл. В предпочтительном воплощении иммуногенная композиция содержит адъювант в концентрации от примерно 0,25 мг/мл до примерно 0,75 мг/мл и наиболее предпочтительно примерно 0,5 мг/мл.
В предпочтительном воплощении адъювант представляет собой адъювант на основе алюминия в концентрации примерно 0,5 мг/мл. В одном таком воплощении адъювант на основе алюминия представляет собой фосфат алюминия или гидроксифосфат алюминия.
В одном воплощении иммуногенная композиция содержит конъюгат полисахарид-белок, описанный в данном документе, буфер, поверхностно-активное вещество, эксципиент и возможно адъювант, где композиция забуферена до рН от примерно 6,0 до примерно 7,0.
В одном таком воплощении иммуногенная композиция содержит конъюгат полисахарида GBS и белка, буфер, поверхностно-активное вещество, эксципиент и возможно адъювант, где композиция забуферена до рН от примерно 6,0 до примерно 7,0, и где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 60%.
В одном конкретном воплощении иммуногенная композиция содержит конъюгат полисахарида GBS и белка, гистидин, полисорбат-80, хлорид натрия и возможно фосфат алюминия, где композиция забуферена до рН от примерно 6,0 до примерно 7,0, и где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 60%.
В предпочтительном воплощении иммуногенная композиция содержит от примерно 5 мкг/мл до примерно 50 мкг/мл конъюгата полисахарида GBS и белка, от примерно 10 мМ до примерно 25 мМ гистидина, от примерно 0,01% до примерно 0,03% (об./мас.) полисорбата-80, от примерно 10 мМ до примерно 250 мМ хлорида натрия и возможно от примерно 0,25 мг/мл до примерно 0,75 мг/мл алюминия в виде фосфата алюминия, где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 60%.
В одном таком воплощении иммуногенная композиция содержит по меньшей мере два конъюгата полисахарида GBS и белка, буфер, поверхностно-активное вещество, эксципиент и возможно адъювант, где композиция забуферена до рН от примерно 6,0 до примерно 7,0, и где конъюгаты содержат капсульные полисахариды стрептококка группы В (GBS) серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из Ia, Ib, II, III, V, VI, VII, VIII и IX.
В одном конкретном воплощении иммуногенная композиция содержит по меньшей мере два конъюгата полисахарида GBS и белка, гистидин, полисорбат-80, хлорид натрия и возможно фосфат алюминия, где композиция забуферена до рН от примерно 6,0 до примерно 7,0, и где конъюгаты содержат капсульные полисахариды стрептококка группы В (GBS) серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из Ia, Ib, II, III, V, VI, VII, VIII и IX.
В предпочтительном воплощении иммуногенная композиция содержит от примерно 5 мкг/мл до примерно 50 мкг/мл каждого из по меньшей мере двух конъюгатов полисахарида GBS и белка, от примерно 10 мМ до примерно 25 мМ гистидина, от примерно 0,01% до примерно 0,03% (об./мас.) полисорбата-80, от примерно 10 мМ до примерно 250 мМ хлорида натрия и возможно от примерно 0,25 мг/мл до примерно 0,75 мг/мл алюминия в виде фосфата алюминия, где конъюгаты содержат капсульные полисахариды стрептококка группы В (GBS) серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из Ia, Ib, II, III, V, VI, VII, VIII и IX.
Оценка иммуногенных композиций
Для оценки иммуногенности иммуногенных композиций по изобретению применяют различные тесты in vitro. Например, исследование опсонической активности in vitro выполняют при совместной инкубации смеси клеток стрептококка, инактивированной нагреванием сыворотки, содержащей специфические антитела к интересующим антигенам, и экзогенного источника комплемента. В ходе инкубации свежевыделенных полиморфноядерных клеток (PMN) или дифференцированных эффекторных клеток, таких как HL60, и смеси антитело/комплемент/клетки стрептококка происходит опсонофагоцитоз. В результате опсонофагоцитоза происходит гибель бактериальных клеток, покрытых антителом и комплементом. Колониеобразующие единицы (cfu) бактерий, выживших после опсонофагоцитоза, определяют путем посева исследуемой смеси. Титры выражают в виде значения, обратного максимальному разведению, при котором происходит гибель 50% бактериальных клеток, при сравнении с контролями.
Для оценки иммуногенности in vitro и экспрессии антигена на поверхности можно также применять ELISA с использованием цельных клеток, где бактериальный штамм, представляющий интерес (S. agalactiae), наносят на планшет, например, 96-луночный планшет, а исследуемая сыворотка иммунизированного животного вступает в реакцию с бактериальными клетками. Если антитело, специфическое в отношении исследуемого антигена, реагирует с экспонированным на поверхности эпитопом антигена, его можно детектировать стандартными способами, известными специалистам в области техники. В альтернативном варианте для анализа экспрессии антигенов капсульных полисахаридов на поверхности и специфичности антител, включая моноклональные антитела, можно применять проточную цитометрию.
Антиген, демонстрирующий желаемую активность in vitro, затем можно тестировать на модели стимуляции антигеном животных in vivo. В некоторых воплощениях иммуногенные композиции также используют для иммунизации животного (например, мыши), применяя способы и пути иммунизации, известные специалистам в области техники (например, интраназальный, парентеральный, пероральный, ректальный, вагинальный, чрескожный, внутрибрюшинный, внутривенный, подкожный и т.д.). После иммунизации животного иммуногенной композицией GBS, животное заражают штаммом Streptococcus agalactiae и анализируют устойчивость к стрептококковой инфекции.
В одном воплощении иммунизируют свободных от патогенов мышей и заражают S. agalactiae. Например, мышей иммунизируют одной или более дозами необходимого антигена в иммуногенной композиции. Затем мышей заражают S. agalactiae и оценивают выживаемость с течением времени после инфицирования.
Способы использования
Термин «с ослабленным иммунитетом» относится к субъекту, имеющему нарушения клеточного и/или гуморального компонентов иммунной системы. Соответственно, подразумевается степень нарушения иммунной функции, варьирующая от легкого нарушения в иммунном процессе до полного подавления иммунитета.
Термин «субъект» относится к млекопитающему, птице, рыбе, рептилии или любому другому животному. Термин «субъект» также включает человека. Термин «субъект» также включает домашних животных. Неограничивающие примеры домашних животных включают: собак, кошек, свиней, кроликов, крыс, мышей, песчанок, хомяков, морских свинок, хорьков, птиц, змей, ящериц, рыб, черепах и лягушек. Термин «субъект» также включает домашний скот. Неограничивающие примеры домашнего скота включают: альпак, бизонов, верблюдов, крупный рогатый скот, оленей, свиней, лошадей, лам, мулов, ослов, овец, коз, кроликов, северных оленей, яков, кур, гусей и индеек.
В данном описании «лечение» (включая его варианты, например, «лечить» или «подлежащий лечению») относится к одному или более из следующего: (i) предупреждению инфицирования или повторного инфицирования, как при традиционной вакцинации, (ii) уменьшению тяжести или устранению симптомов и (iii) существенной или полной элиминации патогена или существенному, или полному устранению нарушения, о котором идет речь. Так, лечение может быть профилактическим (до инфицирования) или терапевтическим (после инфицирования). В данном изобретении может использоваться профилактическое или терапевтическое лечение. Согласно конкретному воплощению данного изобретения, предложены композиции и способы, которые лечат, включая профилактическую и/или терапевтическую иммунизацию, животного-хозяина от микробной инфекции (например, бактериальной, такой как S. agalactiae). Способы по данному изобретению могут найти применение в обеспечении профилактического и/или терапевтического иммунитета субъекта. Способы по данному изобретению могут также практиковаться на субъектах в биомедицинских исследовательских целях.
В другом аспекте изобретение относится к способу индукции у субъекта иммунного ответа против GBS, посредством введения субъекту эффективного количества иммуногенной композиции, описанной в данном документе. В одном воплощении изобретение относится к способу предупреждения или ослабления заболевания или состояния, связанного со стрептококком группы В, у субъекта посредством введения субъекту эффективного количества иммуногенной композиции, описанной в данном документе. В одном аспекте изобретение относится к иммуногенной композиции, описанной в данном документе, для применения в качестве лекарственного средства. В одном аспекте изобретение относится к иммуногенной композиции, описанной в данном документе, для применения в способе индукции у субъекта иммунного ответа против GBS. В конкретном воплощении субъектом является женщина, планирующая забеременеть, или беременная женщина. В одном таком воплощении беременная женщина находится на третьем триместре беременности, например, по меньшей мере на 20 неделе или по меньшей мере на 27 неделе беременности. В предпочтительном воплощении беременная женщина находится на 27-36 неделе беременности. В другом воплощении субъектом является пожилой человек, такой как человек в возрасте 50 лет или старше, 65 лет или старше и 85 лет или старше. В следующем воплощении субъект имеет ослабленный иммунитет. В одном аспекте субъект может иметь патологическое состояние, выбранное из группы, состоящей из ожирения, диабета, ВИЧ-инфекции, рака, сердечно-сосудистого заболевания или заболевания печени. В предпочтительном воплощении стрептококк группы В представляет собой S. agalactiae.
В одном воплощении иммуногенная композиция содержит конъюгаты полисахарид-белок, содержащие GBS серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В другом воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере двух дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В дополнительном воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере трех дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В еще одном воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере четырех дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В конкретном воплощении конъюгаты содержат GBS серотипов Ia, Ib, II, III и IV. В следующем воплощении конъюгаты содержат GBS серотипа IV и по меньшей мере пяти дополнительных серотипов, выбранных из группы, состоящей из серотипов Ia, Ib, II, III, V, VI, VII, VIII и IX. В следующем воплощении композиция содержит GBS серотипа V. В конкретном воплощении конъюгаты содержат GBS серотипов Ia, Ib, II, III и V. В предпочтительном воплощении иммуногенная композиция содержит шесть конъюгатов полисахаридов GBS серотипов Ia, Ib, II, III, IV и V и белка. Один аспект изобретения относится к иммуногенной композиции, которая не демонстрирует иммунной интерференции.
Иммуногенное или эффективное количество иммуногенной композиции можно определить, проводя исследование зависимости доза-эффект, в котором для определения оптимальной дозы субъектов иммунизируют постепенно увеличивающимися количествами иммуногенной композиции и анализируют иммунный ответ. Отправные точки для исследования можно вывести, исходя из результатов иммунизации, полученных в моделях на животных. Размер дозы может варьировать в зависимости от конкретного состояния индивидуума. Размер дозы можно определить в обычных исследованиях способами, известными специалистам в области техники.
Для выработки иммунного ответа субъекту вводят иммунологически эффективное количество иммуногенной композиции в подходящем количестве доз. Размер дозы может варьировать в зависимости от конкретных характеристик индивидуума, таких как возраст и масса тела. Этот размер дозы можно определить в обычных исследованиях способами, известными специалистам в области техники.
В одном воплощении пациенты, которым вводят иммуногенные композиции по изобретению, демонстрируют снижение уровней носительства S. agalactiae. Такое снижение уровней носительства или увеличение временного интервала, в течение которого отсутствует носительство после введения иммуногенной композиции, является существенным в плане необходимости медицинской помощи. Например, снижение общего носительства S. agalactiae у носителей можно оценивать после однократного введения дозы иммуногенной композиции по изобретению. Например, за 1 день до введения иммуногенной композиции можно провести скрининг в группе взрослых в возрасте 18-50 лет на предмет носительства путем взятия мазков из полости носа, зева, пазух, прямой кишки, промежности и вагины и последующего культивирования для определения статуса носительства. Затем группа может получить иммуногенную композицию по изобретению, наряду с группой, получающей контроль. Мазки из полости носа, зева, пазух, прямой кишки, промежности и вагины берут каждую неделю в течение 12 недель и каждый месяц вплоть до 6 месяцев после введения иммуногенной композиции и сравнивают с плацебо. Одной первичной конечной точкой является сравнение уровней носительства у пациентов после введения иммуногенной композиции по сравнению с плацебо с 3-месячными интервалами после иммунизации.
Антитела
«Антитело» представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. В данном документе, если из контекста не следует противоположное, термин охватывает не только интактные поликлональные или моноклональные антитела, но также сконструированные антитела (например, химерные, гуманизированные и/или дериватизированные для изменения эффекторной функции, стабильности и других видов биологической активности), а также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные (scFv) и доменные антитела, включая акульи и верблюжьи антитела) и слитые белки, содержащие часть антитела, мультивалентные антитела, мультиспецифические антитела (например, биспецифические антитела при условии, что они проявляют желаемую биологическую активность) и фрагменты антител, описанных в данном документе, а также любые другие молекулы иммуноглобулина с модифицированной конфигурацией, которые содержат сайт распознавания антигена. Антитело охватывает антитело любого класса, такое как IgG, IgA или IgM (или их подклассы), и антитело не обязательно должно относиться к какому-то конкретному классу. В зависимости от аминокислотной последовательности константной области тяжелых цепей иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут далее подразделяться на подклассы (изотипы), например, у человека IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначают альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Фрагменты антитела» содержат только часть интактного антитела, где часть предпочтительно сохраняет по меньшей мере один, предпочтительно большинство или все функции, обычно связанные с указанной частью, когда она присутствует в интактном антителе.
«Функциональная активность» антитела или «функциональное антитело» в данном описании относятся к антителу, которое, как минимум, может специфически связываться с антигеном. Дополнительные функции известны специалистам в области техники и могут включать дополнительные компоненты иммунной системы, которые влияют на выведение или уничтожение патогена посредством опсонизации, ADCC или комплемент-опосредованной цитотоксичности. После связывания любые последующие функции антитела могут быть опосредованы Fc областью антитела. Исследование опсонофагоцитарной активности (ОРА) антитела представляет собой исследование in vitro, разработанное для оценки in vitro Ig комплемент-опосредованного уничтожения бактерий эффекторными клетками (лейкоцитами), имитирующее биологический процесс. Связывание антитела может также непосредственно ингибировать биологическую функцию антигена, с которым оно связывается. В некоторых воплощениях «функциональное антитело» относится к антителу, которое является функциональным, что определяют по гибели бактерий в модели на животных для оценки эффективности или в исследовании опсонофагоцитарной активности, демонстрирующем, что антитела вызывают гибель бактерий.
В одном аспекте изобретение относится к выделенному антителу или его фрагменту, которые специфически связываются с полисахаридом, описанным в данном документе. «Выделенное» антитело в данном описании относится к антителу, которое было идентифицировано и отделено и/или изолировано от компонентов его естественного окружения. Контаминирующие компоненты его естественного окружения представляют собой вещества, которые будут интерферировать с диагностическими или терапевтическими применениями антитела и могут включать ферменты, гормоны и другие белковые и небелковые растворенные вещества. В приведенных в качестве примера воплощениях антитело будет очищено (1) более чем до 95% по массе антитела, при определении методом Лоури и, наиболее предпочтительно, более чем до 99% по массе, (2) до степени, достаточной для определения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности при использовании секвенатора с вращающимся стаканом или (3) до гомогенности при проведении SDS-PAGE в восстанавливающих или невосстанавливающих условиях с окрашиванием Кумасси синим или, предпочтительно, серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент естественного окружения антитела будет отсутствовать. Однако, как правило, выделенное антитело будет получено с использованием по меньшей мере одной стадии выделения.
Антитело, которое «специфически связывается с» или «является специфическим» к конкретному полисахариду или эпитопу конкретного полисахарида, представляет собой антитело, которое связывается с указанным конкретным полисахаридом или эпитопом конкретного полисахарида без существенного связывания с каким-либо другим полисахаридом или эпитопом полисахарида.
Слово «метка», используемое в данном документе, относится к детектируемому соединению или композиции, конъюгированной с антителом напрямую или опосредовано с образованием «меченого» антитела. Метка может быть детектируемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментной метки, может катализировать химическое превращение субстрата - детектируемого соединения или композиции.
В изобретении также предложены антитела и композиции антител, которые специфически и избирательно связываются с одним или более антигенами иммуногенной композиции по данному изобретению. В некоторых воплощениях антитела вырабатываются в ответ на введение субъекту иммуногенной композиции по данному изобретению. В некоторых воплощениях изобретения предложены очищенные или выделенные антитела, направленные против одного или более антигенов, входящих в состав иммуногенной композиции по данному изобретению. В некоторых воплощениях антитела по данному изобретению являются функциональными, если оценивать по гибели бактерий либо в модели на животных по изучению эффективности, либо в исследовании опсонофагоцитарной активности. В некоторых воплощениях антитела по изобретению обеспечивают у субъекта пассивный иммунитет. В данном изобретении также предложены молекулы полинуклеотидов, кодирующие антитело или фрагмент антитела по изобретению, а также клетка или клеточная линия (такие как клетки гибридомы или другие генномодифицированные клеточные линии для рекомбинантной продукции антител) и трансгенное животное, продуцирующее антитело или композицию антитела по изобретению, с использованием способов, известных специалистам в области техники.
Антитела или композиции антител по изобретению можно использовать в способе лечения или предупреждения стрептококковой инфекции, заболевания или состояния, ассоциированного со S. agalactiae, у субъекта, включающем получение препарата поликлонального или моноклонального антитела и использование указанного антитела или композиции антитела для обеспечения у субъекта пассивного иммунитета. Антитела по изобретению также могут найти применение в способах диагностики, например, определения присутствия или уровней одного или более антигенов иммуногенных композиций по данному изобретению.
Гуморальные ответы на повторяющиеся структуры, такие как полисахариды по данному изобретению, могут иметь некоторые уникальные особенности. Например, регулярность повторяющихся единиц может означать, что антитела, специфические в отношении полисахарида, могут связывать молекулы антигенов, существенно различающиеся по молекулярной массе. Во-вторых, повторяющиеся структуры полисахаридов большей длины способны индуцировать гуморальные ответы, независимые от Т-клеток. Таким образом, применение полисахаридов, конъюгированных с белковыми носителями, имеющими эпитопы, распознаваемые Т-хелперными клетками, может стимулировать гуморальные ответы как независимые от Т-клеток, так и зависимые от Т-клеток. Таким образом, иммунный ответ может быть модифицирован посредством соответствующего выбора размера полисахаридов, а также использованием или отсутствием белка-носителя.
Поликлональные антитела
В некоторых воплощениях антитело к полисахариду представляет собой поликлональное антитело. Поликлональные антитела, согласно данному описанию, относятся к смеси антител, распознающих различные антигенные детерминанты, выделенных из препарата сыворотки и образованных различными клонами В-клеток. Получение и характеристика поликлональных антител известны в области техники.
Поликлональные антитела образуются у субъекта, например, у млекопитающего, в результате введения одной или более инъекций иммуногена или иммуногенной композиции, описанной в данном документе, и, при необходимости, адъюванта, буфера и/или разбавителя. Для получения специфической антисыворотки можно использовать различные виды животных. Обычно животное, которое используют для получения поликлональной антисыворотки к сахаридам, представляет собой примата, не являющегося человеком, козу, овцу, кролика, мышь, крысу, хомяка или морскую свинку. Обычно млекопитающему осуществляют введение нескольких инъекций иммуногена или иммуногенной композиции с адъювантом или без адъюванта. Иммуногенный материал может включать в себя полисахарид, олигосахарид, конъюгат полисахарид-белок, описанный в данном документе, или больший набор иммуногенов. Как правило, начиная со 2-6 недели после первой иммунизации, у иммунизированного животного берут кровь, дают ей свернуться и получают сыворотку. Сыворотка содержит поликлональные антитела иммунизированного животного к сахариду и часто называется антисывороткой.
Моноклональные антитела
Моноклональное антитело к сахариду можно получить с использованием известной гибридомной технологии. Как правило, получение моноклональных антител включает первую иммунизацию подходящего целевого животного-хозяина выбранным иммуногеном, содержащим полисахарид, олигосахарид, полисахарид или конъюгат полисахарид-белок по данному изобретению. При необходимости можно включать адъювант, буфер и/или разбавители. Иммунизацию осуществляют способом, достаточным для того, чтобы индуцировать продукцию или экспрессию В лимфоцитами антител, которые специфически связываются с полисахаридом или его конъюгатом. В альтернативном варианте лимфоциты иммунизируют in vitro.
Затем лимфоциты сливают с иммортализованной клеточной линией, используя подходящий агент, вызывающий слияние клеток, такой как полиэтиленгликоль, с образованием клеток гибридомы. Будут ли моноклональные антитела иметь человеческое или животное происхождение зависит от источника лимфоцитов. Как правило, если необходимы антитела и клетки человеческого происхождения, используют лимфоциты периферической крови (PBL), а если нужны источники, не являющиеся человеческими, используют клетки селезенки или клетки лимфатических узлов.
Иммортализованные клеточные линии обычно представляют собой трансформированные клетки млекопитающих, в частности, клетки миеломы, происходящие от грызунов, коров и человека. Обычно используют клетки миеломы крыс или мышей. Клетки гибридомы культивируют в подходящей культуральной среде, которая предпочтительно содержит одно или более веществ, ингибирующих рост или выживаемость не прошедших слияние иммортализованных клеток. Например, если в родительских клетках отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом обычно будет включать гипоксантин, аминоптерин и тимидин (среда HAT), эти вещества предотвращают рост клеток, не имеющих HGPRT.
Иммортализованные клеточные линии выбирают с учетом практических соображений, таких как вид, от которого они происходят, характеристики слияния и роста. Например, подходящими иммортализованными клеточными линиями будут те, которые эффективно сливаются, поддерживают стабильно высокий уровень экспрессии антитела выбранными антитело-продуцирующими клетками и чувствительны к среде, такой как среда HAT. Примеры иммортализованных клеточных линий включают линии миеломных клеток грызунов. Для получения моноклональных человеческих антител также описаны линии клеток миеломы человека и гетеромиеломы мышь-человек.
Клетки гибридомы секретируют моноклональное антитело в культуральную среду. Затем культуральную среду анализируют на предмет наличия моноклональных антител, распознающих и связывающихся с полисахаридом. Специфичность связывания с полисахаридами конкретных моноклональных антител, продуцируемых клетками гибридомы, определяют одним из многочисленных способов, хорошо известных в области техники. Например, специфичность связывания антитела можно определять с помощью иммунопреципитации, радиоиммунологического анализа (RIA), вестерн-блоттинга, иммуноферментного анализа (ELISA) или поверхностного плазменного резонанса (например, Biacore). Конкретный эпитоп, распознаваемый моноклональным антителом, определяют путем картирования эпитопов. Такие способы хорошо известны в области техники.
После идентификации клеток гибридомы, продуцирующих антитела с необходимой специфичностью, выполняют субклонирование клонов с помощью предельного разведения и культивируют стандартными способами. Культуральные среды, подходящие для этой цели, включают, например, среду Игла в модификации Дульбекко и среду RPMI-1640. В альтернативном варианте клетки гибридомы выращивают in vivo в асците млекопитающего. Моноклональные антитела, секретируемые субклонами, выделяют или очищают из культуральной среды или асцитной жидкости с помощью стандартных методов очистки иммуноглобулинов, например, таких как хроматография на сефарозе с иммобилизованным белком А, хроматография на гидроксиапатите, гель-электрофорез, диализ или аффинная хроматография.
В альтернативном варианте антитела, обладающие необходимой специфичностью и происходящие от нужных биологических видов, могут быть получены с использованием библиотек фагового дисплея. Кроме того, в области техники можно найти примеры способов и реагентов, в частности, подходящих для применения в создании и скрининге библиотек антител.
Применения антител
В одном аспекте изобретение относится к применению иммуногенной композиции, описанной в данном документе, для получения антитела и/или фрагмента антитела к GBS. Описанные в данном документе конъюгаты полисахарид-белок и/или антитела, выаботанные к ним, могут использоваться в различных иммунодиагностических методах, известных специалистам в области техники, включая ELISA и методы на основе микрочиповой технологии. Кроме того, данные реагенты можно использовать для оценки гуморального ответа, включая уровень антител в сыворотке, например, к иммуногенным конъюгатам полисахарида и белка. Методологии исследований по изобретению могут включать применение меток, таких как флуоресцентные, хемилюминесцентные, радиоактивные, ферментные метки или молекулы красителей, и/или вторичных иммунологических реагентов для прямой или опосредованной детекции комплекса между антигеном или антителом в биологическом образце и соответствующим антителом или антигеном, связанным с твердым носителем.
Полученное антитело или фрагмент антитела могут также использоваться в пассивной иммунотерапии или в профилактике стрептококковой инфекции.
Способы получения полисахарида
В другом аспекте изобретение относится к способу получения полисахаридов, описанных в данном документе. Способ включает культивирование GBS и сбор полисахарида, продуцированного бактерией. В одном воплощении GBS включает S. agalactiae. Бактерия может представлять собой любой штамм S. agalactiae. В предпочтительном воплощении бактерия представляет собой инкапсулированный штамм S. agalactiae. Штаммы S. agalactiae для применения в данном изобретении включают 090, А909 (номер доступа АТСС ВАА-1138), 515 (номер доступа АТСС ВАА-1177), В523, CJB524, MB 4052 (номер доступа АТСС 31574), Н36В (номер доступа АТСС 12401), S40, S42, MB 4053 (номер доступа АТСС 31575), М709, 133, 7357, PFEGBST0267, MB 4055 (номер доступа АТСС 31576), 18RS21 (номер доступа АТСС ВАА-1175), S16, S20, V8 (номер доступа АТСС 12973), DK21, DK23, UAB, 5401, PFEGBST0708, MB 4082 (номер доступа АТСС 31577), М132, 110, М781 (номер доступа АТСС ВАА-22), D136C(3) (номер доступа АТСС 12403), М782, S23, 120, MB 4316 (М-732; номер доступа АТСС 31475), М132, K79, СОН1 (номер доступа АТСС ВАА-1176), PFEGBST0563, 3139 (номер доступа АТСС 49446), CZ-NI-016, PFEGBST0961, 1169-NT1, CJB111 (номер доступа АТСС ВАА-23), CJB112, 2603 V/R (номер доступа АТСС ВАА-611), NCTC 10/81, CJ11, PFEGBST0837, 118754, 114852, 114862, 114866, 118775, В 4589, В 4645, SS1214, CZ-PW-119, 7271, CZ-PW-045, JM9130013, JM9130672, IT-NI-016, IT-PW-62 и IT-PW-64.
Полисахарид, описанный в данном документе, может быть получен посредством культивирования GBS в соответствующей среде. Соответствующая среда может включать бульон Колумбия. Среда может включать декстрозу, гемин и/или глюкозу. Предпочтительно, среда включает бульон Колумбия и декстрозу. Если S. agalactiae культивируют с использованием бульона Колумбия и декстрозы, предпочтительно, температура культивирования составляет от 20 до 40°С, предпочтительно 37°С. В предпочтительном воплощении бактерию культивируют в аэробных условиях. В другом предпочтительном воплощении бактерии культивируют от 12 до 60 часов.
Полисахарид можно выделять из полученной культуры способами, известными в области техники для выделения из культуры целевого вещества, такими как, например, нагревание, ферментативная обработка, центрифугирование, преципитация, обработка активированным углем и/или фильтрование. (См., например, опубликованные заявки на патент США 2006/0228380, 2006/0228381, 2007/0184071, 2007/0184072, 2007/0231340 и 2008/0102498; опубликованную международную заявку на патент WO 2008/118752). В одном воплощении культуру, содержащую бактерию и полисахарид, центрифугируют и обрабатывают ферментом, таким как, например, лизоцим, РНКаза, ДНКаза, проназа, мутанолизин и их комбинации. Например, в одном воплощении к полученной надосадочной жидкости добавляют соответствующий органический растворитель для преципитации белков и удаляют преципитат центрифугированием. Затем можно вызывать преципитацию полисахарида за счет последующего добавления к надосадочной жидкости органического растворителя и собирать полисахарид путем центрифугирования. Более конкретно, описанный в данном документе полисахарид может быть получен путем добавления к надосадочной жидкости, из которой удалили бактерии, этанола в конечной концентрации примерно 25% об., удаления преципитата, содержащего белок, путем центрифугирования, последующего добавления этанола до конечной концентрации примерно 75% об. и затем сбора преципитата путем центрифугирования. Полученный преципитат может быть высушен в азоте. Полученный преципитат можно ресуспендировать в Tris с 0,05% азидом Na.
В следующем аспекте изобретения предложен новый способ с применением органических реагентов, таких как дериватизированные соединения гидроксиламина, для выделения в большой степени интактных высокомолекулярных КП с сохранением N- и О-ацетильных групп. Поскольку данный способ не вызывает лизис клеток, контаминация КП, выделяемых при центрифугировании, внутриклеточными компонентами будет минимальной и общий выход может быть более высоким. Более того, поскольку примеси антигенов стрептококка группы В имеют множество фосфодиэфирных связей, указанные реагенты могут вызвать их расщепление на очень мелкие фрагменты, которые могут быть легко удалены посредством диафильтрации.
В одном воплощении КП выделяют при реакции гидроксиламина с клеточной суспензией, содержащей бактерии, продуцирующие капсульный полисахарид. В конкретном воплощении способ дополнительно включает стадию центрифугирования. В другом воплощении способ дополнительно включает стадию фильтрования. В еще одном воплощении бактерия, продуцирующая капсульный полисахарид, выбрана из группы, состоящей из Streptococcus agalactiae, Streptococcus pneumoniae, Staphylococcus aureus, Neisseria meningitidis, Escherichia coli, Salmonella typhi, Haemophilus influenzae, Klebsiella pneumoniae, Enterococcus faecium и Enterococcus faecalis.
В одном аспекте изобретения гидроксиламин может представлять собой перечисленный в Таблице 2 в Примере 2. В предпочтительном воплощении гидроксиламин выбран из группы, состоящей из дибензилгидроксиламина; диэтилгидроксиламина; гидроксиламина; этилендиамина; триэтилена; 1,1,4,7,10,10-гексаметилтриэтилентетрамина и 2,6,10-триметил-2,6,10-триазаундекана.
В одном аспекте изобретения концентрация гидроксиламина составляет от примерно 5 мМ до примерно 200 мМ, например от примерно 5 мМ до примерно 150 мМ, от примерно 5 мМ до примерно 100 мМ, от примерно 5 мМ до примерно 75 мМ, от примерно 5 мМ до примерно 50 мМ, от примерно 5 мМ до примерно 25 мМ, от примерно 5 мМ до примерно 10 мМ, от примерно 10 мМ до примерно 200 мМ, например, от примерно 10 мМ до примерно 150 мМ, от примерно 10 мМ до примерно 100 мМ, от примерно 10 мМ до примерно 75 мМ, от примерно 10 мМ до примерно 50 мМ, от примерно 10 мМ до примерно 25 мМ, от примерно 25 мМ до примерно 200 мМ, от примерно 25 мМ до примерно 150 мМ, от примерно 25 мМ до примерно 100 мМ, от примерно 25 мМ до примерно 75 мМ, от примерно 25 мМ до примерно 50 мМ, от примерно 50 мМ до примерно 200 мМ, от примерно 50 мМ до примерно 150 мМ, от примерно 50 мМ до примерно 100 мМ и от примерно 50 мМ до примерно 75 мМ.
В другом аспекте поддерживают рН реакции от 5,5 до примерно 9,5, например от примерно 5,5 до примерно 9,0, от примерно 5,5 до примерно 8,5, от примерно 5,5 до примерно 8,0, от примерно 5,5 до примерно 7,5, от примерно 5,5 до примерно 7,0, от примерно 5,5 до примерно 6,5, от примерно 6,0 до примерно 9,5, от примерно 6,0 до примерно 9,0, от примерно 6,0 до примерно 8,5, от примерно 6,0 до примерно 8,0, от примерно 6,0 до примерно 7,5, от примерно 6,0 до примерно 7,0, от примерно 6,5 до примерно 9,5, от примерно 6,5 до примерно 8,5, от примерно 6,5 до примерно 8,0, от примерно 6,5 до примерно 7,5, от примерно 7,0 до примерно 9,5, от примерно 7,0 до примерно 9,0, от примерно 7,0 до примерно 8,5 и от примерно 7,0 до примерно 8,0.
В следующем аспекте изобретения реакцию осуществляют при температуре от примерно 20°С до примерно 85°С, например от примерно 20°С до примерно 80°С, от примерно 20°С до примерно 75°С, от примерно 20°С до примерно 70°С, от примерно 20°С до примерно 65°С, от примерно 20°С до примерно 60°С, от примерно 20°С до примерно 55°С, от примерно 20°С до примерно 50°С, от примерно 25°С до примерно 85°С, от примерно 25°С до примерно 80°С, от примерно 25°С до примерно 75°С, от примерно 25°С до примерно 70°С, от примерно 25°С до примерно 65°С, от примерно 25°С до примерно 60°С, от примерно 25°С до примерно 55°С, от примерно 25°С до примерно 50°С, от примерно 30°С до примерно 85°С, от примерно 30°С до примерно 80°С, от примерно 30°С до примерно 75°С, от примерно 30°С до примерно 70°С, от примерно 30°С до примерно 65°С, от примерно 30°С до примерно 60°С, от примерно 30°С до примерно 55°С, от примерно 30°С до примерно 50°С, от примерно 35°С до примерно 85°С, от примерно 35°С до примерно 80°С, от примерно 35°С до примерно 75°С, от примерно 35°С до примерно 70°С, от примерно 35°С до примерно 65°С, от примерно 35°С до примерно 60°С, от примерно 35°С до примерно 55°С, от примерно 40°С до примерно 85°С, от примерно 40°С до примерно 80°С, от примерно 40°С до примерно 75°С, от примерно 40°С до примерно 70°С, от примерно 40°С до примерно 65°С, от примерно 40°С до примерно 60°С, от примерно 45°С до примерно 85°С, от примерно 45°С до примерно 80°С, от примерно 45°С до примерно 75°С, от примерно 45°С до примерно 70°С, от примерно 45°С до примерно 65°С, от примерно 50°С до примерно 85°С, от примерно 50°С до примерно 80°С, от примерно 50°С до примерно 75°С, от примерно 50°С до примерно 70°С, от примерно 55°С до примерно 85°С, от примерно 55°С до примерно 80°С, от примерно 55°С до примерно 75°С, от примерно 60°С до примерно 85°С и от примерно 65°С до примерно 85°С.
В еще одном аспекте время реакции составляет от примерно 10 часов до примерно 90 часов, например от примерно 10 часов до примерно 85 часов, от примерно 10 часов до примерно 80 часов, от примерно 10 часов до примерно 75 часов, от примерно 10 часов до примерно 70 часов, от примерно 10 часов до примерно 60 часов, от примерно 10 часов до примерно 50 часов, от примерно 10 часов до примерно 40 часов, от примерно 10 часов до примерно 30 часов, от примерно 10 часов до примерно 25 часов, от примерно 10 часов до примерно 20 часов, от примерно 10 часов до примерно 15 часов, от примерно 15 часов до примерно 90 часов, от примерно 15 часов до примерно 85 часов, от примерно 15 часов до примерно 80 часов, от примерно 15 часов до примерно 75 часов, от примерно 15 часов до примерно 70 часов, от примерно 15 часов до примерно 60 часов, от примерно 15 часов до примерно 50 часов, от примерно 15 часов до примерно 40 часов, от примерно 15 часов до примерно 30 часов, от примерно 15 часов до примерно 20 часов, например, от примерно 20 часов до примерно 90 часов, от примерно 20 часов до примерно 85 часов, от примерно 20 часов до примерно 80 часов, от примерно 20 часов до примерно 75 часов, от примерно 20 часов до примерно 70 часов, от примерно 20 часов до примерно 60 часов, от примерно 20 часов до примерно 50 часов, от примерно 20 часов до примерно 40 часов, от примерно 20 часов до примерно 30 часов и от примерно 20 часов до примерно 25 часов.
В альтернативном варианте, в другом воплощении изобретения полисахарид синтезирован химически. Полисахарид может быть химически синтезирован стандартными способами.
В еще одном воплощении изобретения полисахарид получен в результате экспрессии в суррогатном хозяине после клонирования и экспрессии биосинтетического пути для продуцирования полисахарида. Например, клетка-хозяин может быть модифицирована для получения полисахарида, обладающего структурным сходством с полисахаридом, описанным в данном документе, где повторяющаяся единица полисахарида, полученного в клетке-хозяине, частично идентична повторяющейся единице полисахарида, описанного в данном документе. Полисахарид обладает структурным сходством с полисахаридом, описанным в данном документе, если, например, повторяющаяся единица полисахарида имеет отсутствующую ветвь, гетерогенна по размеру и/или гетерогенна по расположению ветвей по сравнению с повторяющейся единицей полисахарида, описанного в данном документе. Предпочтительно, клетка-хозяин представляет собой бактериальную клетку-хозяина.
ПРИМЕРЫ
Приведенные ниже примеры демонстрируют некоторые воплощения данного изобретения. Однако следует понимать, что данные примеры служат только в качестве иллюстрации и не претендуют на то, чтобы быть исчерпывающими в том, что касается условий и объема данного изобретения. Следует понимать, что когда указаны типичные условия реакции (например, температура, время реакции и т.д.), можно применять условия, находящиеся как выше, так и ниже указанных диапазонов, однако это, как правило, менее удобно. Все доли и процентные содержания в данном описании указаны в весовом отношении, а температура указана в градусах Цельсия, если не указано иное.
Кроме того, приведенные ниже примеры осуществляли с использованием стандартных методов, которые хорошо известны и являются рутинными для специалистов в области техники, за исключением случаев, когда не приведено другое подробное описание. Как отмечено выше, приведенные примеры служат исключительно для иллюстративных целей и не должны рассматриваться как ограничивающие объем данного изобретения каким-либо образом.
Пример 1. Получение конъюгатов полисахарида и белка с де-О- ацетилированными полисахаридами
Штаммы S. agalactiae соответствующих серотипов культивировали методом глубинной культуры с контролируемым рН в среде определенного состава. Использованные способы и среды были оптимизированы в ходе экспериментов и представляли собой развитие основных методик, описанных ранее von Hunolstein, С. et al., Appl. Micro. Biotech. 38(4): 458-462 (1993). Капсульный полисахарид извлекали из клеток посредством обработки NaOH. После стадии осветления, серий ультрафильтрации/диафильтрации, преципитации и фильтрования через слой угля получали очищенный полисахарид. См., например, патент US 8652480. Для конъюгирования активированного полисахарида с CRM197 применяли восстановительное аминирование. См., например, патент US 5360897.
Пример 2. Выделение О-ацетилированных полисахаридов
Суспензию убитых нагреванием клеток GBS с капсульным полисахаридом (КП) серотипа Ia, полученную центрифугированием культуральной жидкости (1,2 л), ресуспендировали в 175 мл 25 мМ калий-фосфатного буфера (25 мМ, рН 6,9). Суспензию смешивали с водным раствором гидроксиламин-О-сульфоновой кислоты до конечной концентрации 10 мМ. Определяли рН суспензии, составившее примерно 5,8. Суспензию перемешивали при 55°С в течение 72 часов. Затем суспезию центрифугировали примерно при 10000 об/мин и собирали надосадочную жидкость. Надосадочную жидкость, содержащую неочищенные отщепленные КП, использовали для анализа молекулярной массы и выхода. Оставшуюся часть подвергали очистке путем диафильтрации с использованием мембраны с НОММ (номинальное отсечение по молекулярной массе) 30 кДа, используя воду для инъекций (WFI). Затем анализировали молекулярную массу очищенного полисахарида с помощью эксклюзионной хроматографии с детекцией многоуглового рассеивания лазерного излучения (SEC-MALS) (Таблица 1).

Проводили скрининг активности нескольких гидроксиламинов, замещенных азотом и кислородом, используя описанный выше способ. Выход рассчитывали с использованием гель-проникающей хроматографии неочищенных супернатантов с детекцией многоуглового рассеивания лазерного излучения (GPC-MALS), используя показатель преломления (RI) и квадрат значения удельного инкремента показателя преломления (dn/dc) 0,135. Выход зависел от типа гидроксиламинов и оптимизации условий, таких как концентрация, температура и время реакции (см. Таблицу 2). Как правило, выход улучшался при увеличении концентрации гидроксиламина, повышении температуры и увеличении времени реакции.
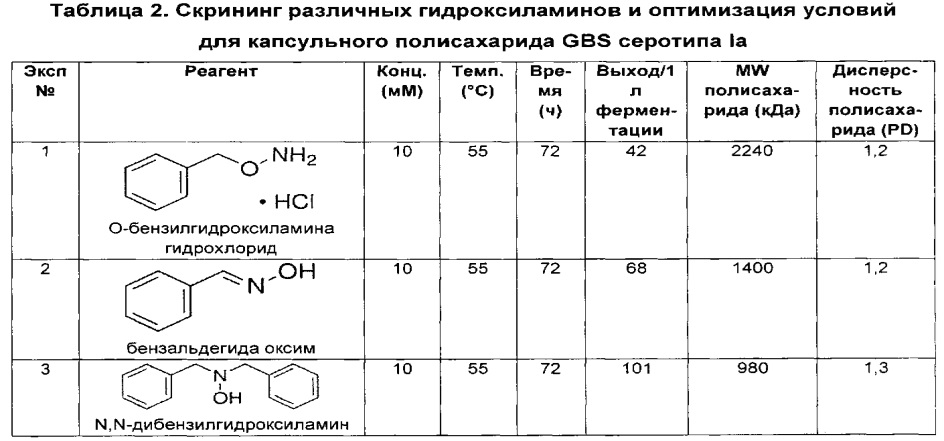
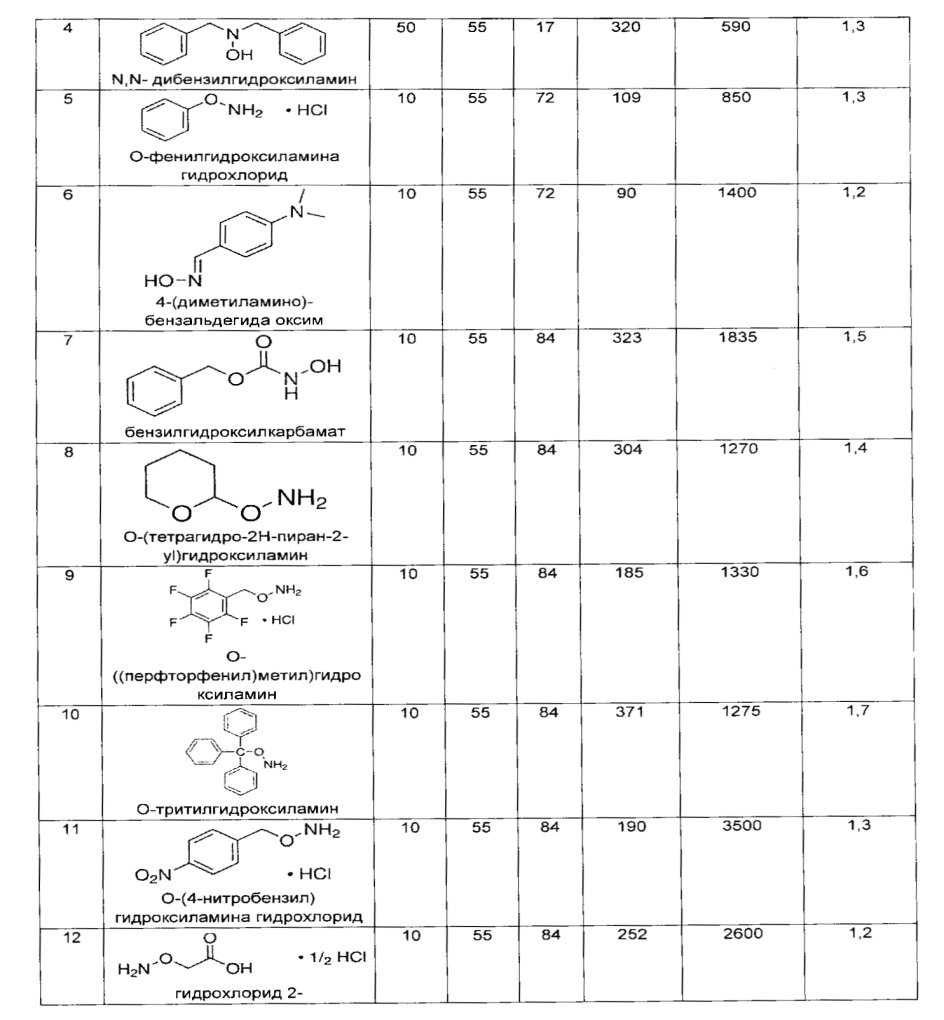
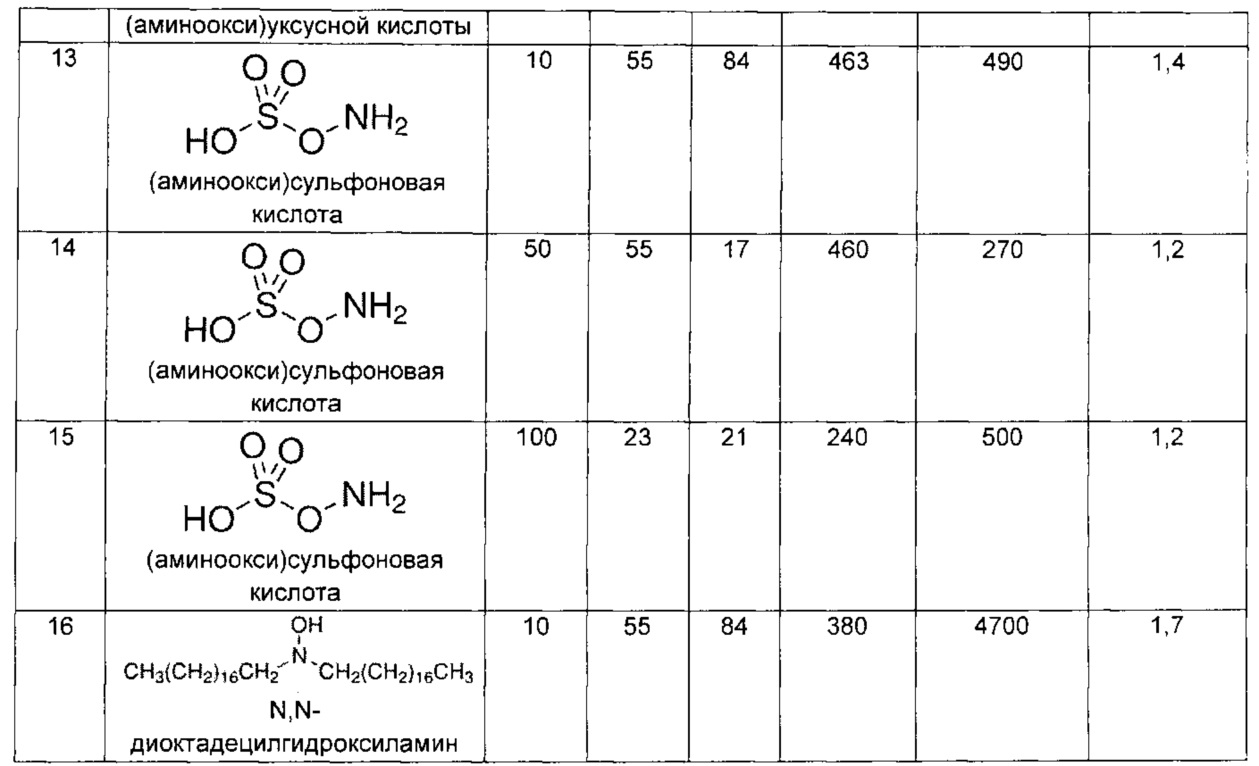
Как обнаружили, замещенные и незамещенные гидроксиламины являются очень эффективными для высвобождения капсульного полисахарида GBS из клеточной стенки. Данный подход позволяет выделить высокомолекулярные КП, сохраняя N- и О-ацетильные группы. Среди нескольких соединений, скрининг которых был проведен, наиболее эффективным оказался дибензилгидроксиламин. Данные приведены в Таблице 3 ([дибензилгидроксиламин] - 50 мМ; рН - 7-8; температура - 50°С; время - 24 часа).
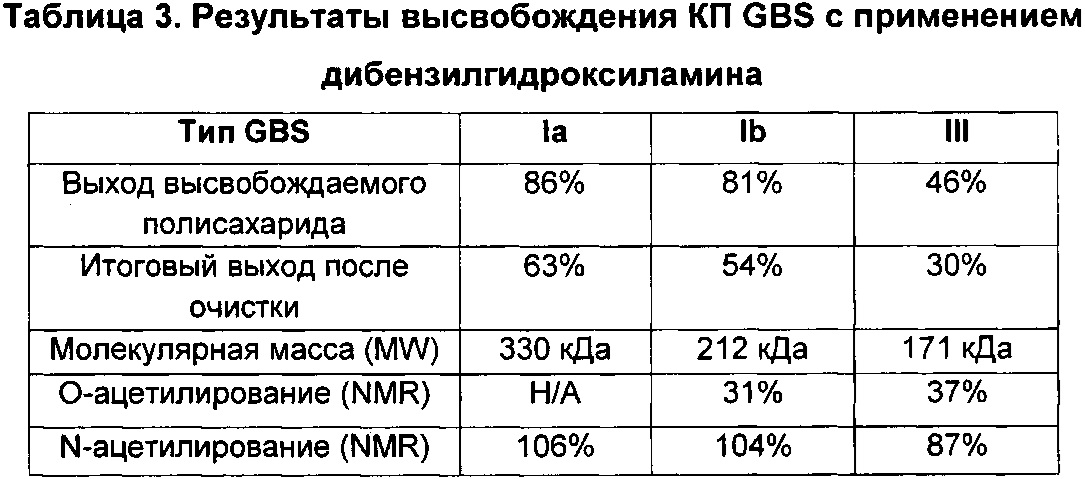
НА - серотип Ia не является О-ацетилированным
Поскольку дибензилгидроксиламин плохо растворим в воде, необходимо альтернативное производное гидроксиламина, которое хорошо растворяется в воде и имеет аналогичную или более высокую активность, чем дибензилгидроксиламин. После скрининга нескольких соединений хорошей альтернативой оказался диэтилгидроксиламин. Данные приведены в Таблице 4 ([диэтилгидроксиламин] - 100 мМ; рН - 7-8; температура - 60°С; время - 19 часов).
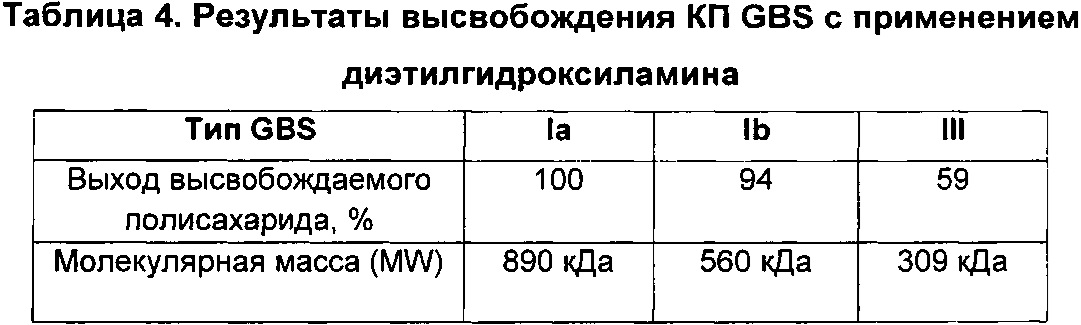
Гидроксиламин (NH2-OH) также оказался эффективным при отщеплении КП от клеточной стенки. Данные приведены в Таблице 5 ([гидроксиламин] - 100 мМ; рН - 7-7,5; температура - 65°С; время - 17 часов). Для серотипа III выход через 17 часов составил 54%; однако, через 3,5 суток выход увеличивался до 70%.

Скрининг олигоаминов на предмет высвобождения капсульного полисахарида GBS из клеток
Гидроксиламин и его замещенные производные оказались очень эффективными при отщеплении капсульных полисахаридов GBS от клеточной стенки. Однако они оказались менее эффективными для серотипов II и V. Поэтому были протестированы олигоамины, исходя из предположения, что они могут оказаться более активными, поскольку имеют множество функциональных аминогрупп.
Этилендиамин оказался эффективным для высвобождения капсульных полисахаридов всех серотипов. Данные приведены в Таблице 6 ([этилендиамин] - 50 или 100 мМ; рН - 8,0; 16 ч; 80°С; 25 мМ EDTA).
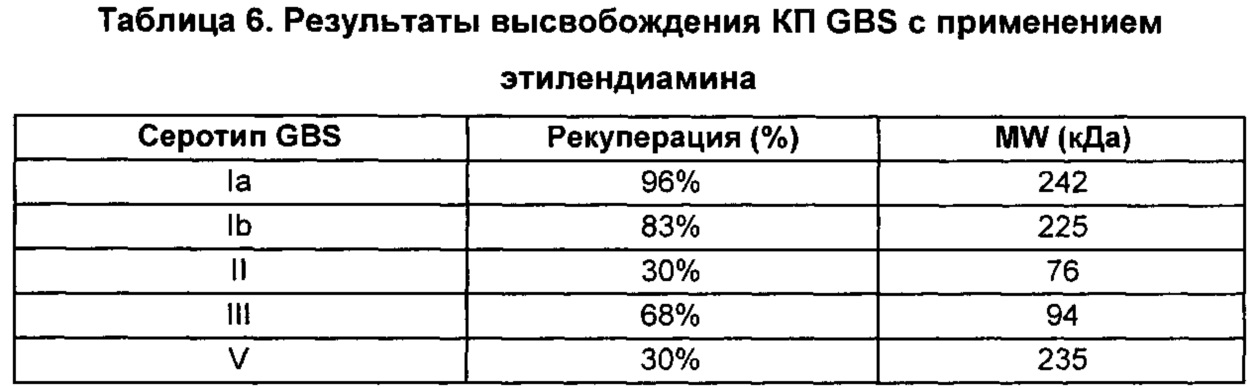
Исследовали активность других репрезентативных олигоаминов, используя клеточные суспензии серотипов Ia и V, однако они также оказались менее эффективны в отношении серотипа V. Данные приведены в Таблицах 7 ([триэтилентетрамин] - 100 мМ; рН - 8,9; температура - 60°С; время - 15 ч), 8 ([1,1,4,7,10,10 гексаметилтриэтилентетрамин] - 10 мМ; рН - 6,3; температура - 60°С; время - 20 ч) и 9 ([2,6,10-триметил-2,6,10-триазаундекан] - 10 мМ; рН - 7-8; температура - 60°С; время - 19 ч).
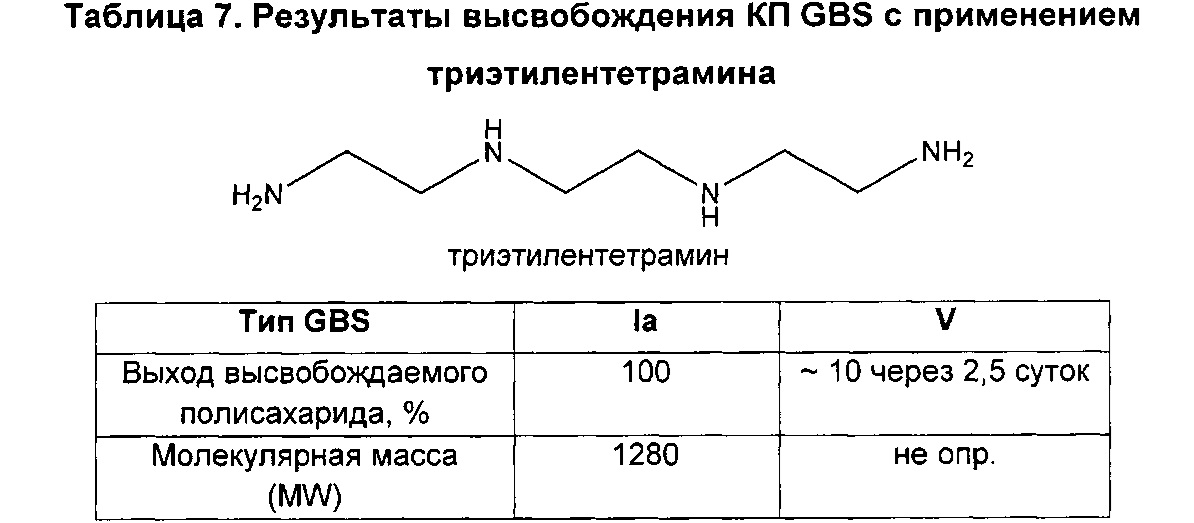
не опр = не определяли
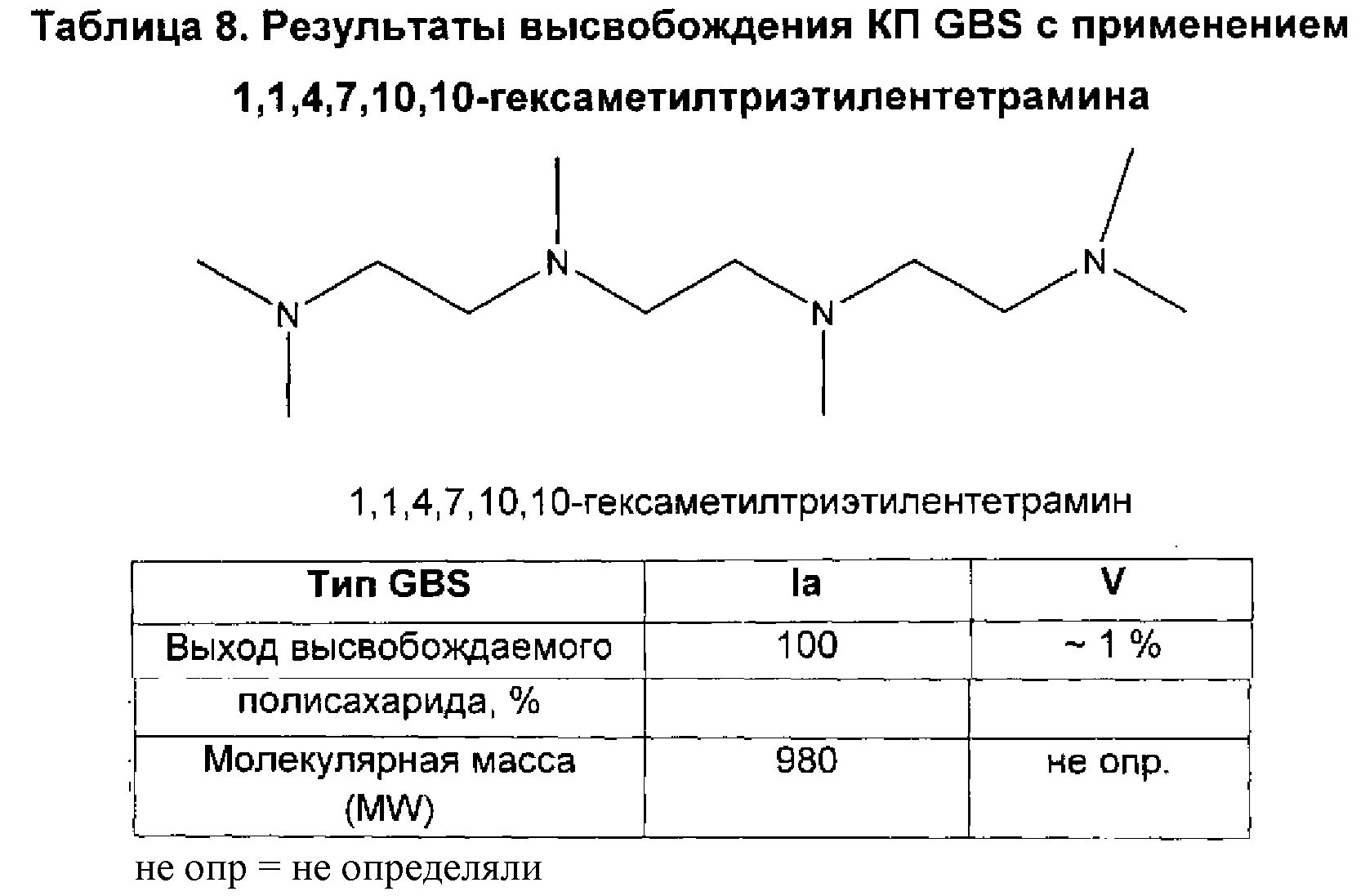
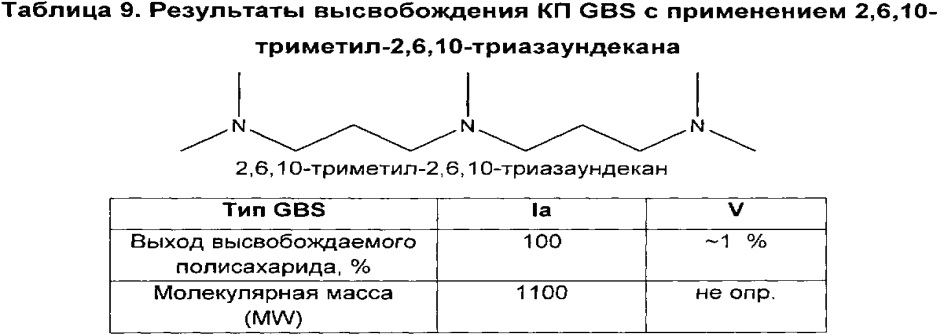
не опр = не определяли
Пример 3. Конъюгирование капсульных полисахаридов GBS при помощи восстановительного аминирования
Активация полисахарида
Окисление полисахарида проводили в 100 мМ калий-фосфатном буфере (рН 6,0±0,5), последовательно добавляя рассчитанное количество 500 мМ калий-фосфатного буфера (рН 6,0) и воды для инъекций (WFI) для получения итоговой концентрации полисахарида 2,0 г/л. При необходимости рН реакции доводили до примерно рН 6,0. После доведения рН температуру реакции доводили до 23°С. Реакцию окисления инициировали добавлением примерно 0,25 молярных эквивалентов периодата натрия. Реакцию окисления проводили при 5±3°С в течение примерно 16 часов.
Концентрирование и диафильтрацию активированного полисахарида выполняли с использованием кассет для ультрафильтрации с НОММ 5К. Диафильтрацию проводили против 20-кратных диаобъемов WFI. Затем очищенный активированный полисахарид хранили при 5±3°С. Очищенный активированный сахарид характеризуется, в частности, (i) концентрацией сахарида по результатам колориметрического определения; (ii) концентрацией альдегида по результатам колориметрического определения; (iii) степенью окисления и (iv) молекулярной массой по результатам SEC-MALLS.
Степень окисления (DO = количество молей повторяющихся сахаридных единиц/количество молей альдегида) активированного полисахарида определяли следующим образом:
Количество молей повторяющихся сахаридных единиц определяют с помощью различных колориметрических методов, например, антроновым методом. В антроновом методе полисахарид сначала расщепляют на моносахариды под действием серной кислоты и нагревания. Антроновый реагент вступает в реакцию с гексозами с образованием комплекса желто-зеленой окраски, интенсивность поглощения которого определяют спектрофотометрически при длине волны 625 нм. В исследуемом диапазоне интенсивность поглощения прямо пропорциональна содержанию гексоз.
Одновременно определяют количество молей альдегида, используя колориметрический метод с МВТН. Метод с МВТН включает образование азина в результате реакции альдегидных групп (в исследуемом образце) с гидразоном 3-метил-2-бензотиазолинона (реагентом МВТН). Избыток гидразона 3-метил-2-бензотиазолинона окисляется с образованием реакционноспособного катиона. Реакционноспособный катион и азин вступают в реакцию с образованием хромофора, обусловливающего синюю окраску. Образовавшийся хромофор затем определяют спектрофотометрически при длине волны 650 нм.
Приготовление смеси активированного полисахарида с эксципиентом сахарозой и лиофилизация
Готовили смесь активированного полисахарида с сахарозой в соотношении 25 граммов сахарозы на грамм активированного полисахарида. Затем флакон с составленной смесью лиофилизировали. После лиофилизации флаконы, содержащие лиофилизированный активированный полисахарид, хранили при -20±5°С. Расчетное количество белка CRM197 раздельно подвергали замораживанию во вращающемся сосуде и лиофилизации. Лиофилизированный CRM197 хранили при -20±5°С.
Разведение лиофилизированного активированного полисахарида и белка-носителя
Лиофилизированный активированный полисахарид разводили безводным диметилсульфоксидом (DMSO). После полного растворения полисахарида к лиофилизированному CRM197 добавляли равное количество безводного DMSO для разведения.
Конъюгирование и блокирование
Перед началом конъюгирования с использованием цианборгидрида натрия, разведенный активированный полисахарид объединяли в реакционном сосуде с разведенным CRM197 и затем тщательно перемешивали для получения прозрачного раствора. Конечная концентрация полисахарида в реакционном растворе составляла примерно 1 г/л. Конъюгирование инициировали путем добавления к реакционной смеси 1,0-1,5 МЭкв цианборгидрида натрия и инкубировали при 23±2°С в течение 20-48 ч. Реакцию конъюгирования останавливали добавлением 2 Мэкв боргидрида натрия (NaBH4) для блокирования непрореагировавших альдегидных групп. Указанная реакция блокирования продолжалась при 23±2°С в течение 3±1 ч.
Очистка конъюгата
При подготовке к очистке фильтрацией в тангенциально-поточном режиме с использованием мембран с НОММ 100-300 К раствор конъюгата разводили 1:10 охлажденным 5 мМ сукцинатом - 0,9% физиологическим раствором (рН 6,0).
Разведенный раствор конъюгата пропускали через 5 мкм фильтр и проводили диафильтрацию с использованием в качестве среды 5 мМ сукцината/0,9% физиологического раствора (рН 6,0). После завершения диафильтрации ретентат конъюгата пропускали через фильтр 0,22 мкм. Затем конъюгат разводили 5 мМ сукцинатом/0,9% физиологическим раствором (рН 6) до целевой концентрации сахарида примерно 0,5 мг/мл. В альтернативном варианте конъюгат очищали с использованием 20 мМ гистидина - 0,9% физиологического раствора (рН 6,5) фильтрацией в тангенциально-поточном режиме с использованием мембран с НОММ 100-300 К. Для получения иммуногенного конъюгата выполняли последнюю стадию фильтрования через мембрану с размером пор 0,22 мкм.
Пример 4. Влияние различных условий конъюгирования на конъюгаты полисахарида GBS и CRM197
Конъюгаты GBS серотипов Ia, Ib, II, III, IV и V были получены в результате специального варьирования условий окисления периодатом/восстановительного аминирования (PO/RAC), включения растворителя для реагента (водная среда или DMSO), варьирования уровней сиаловой кислоты в исходном полисахариде и изменения степени окисления/модификации эпитопов сахаридов. В целом оказалось, что конъюгаты, полученные с использованием DMSO в качестве растворителя, имели более низкие уровни непрореагировавшего (свободного) полисахарида, более высокую молекулярную массу конъюгатов и более высокое соотношение сахарид/белок по сравнению с конъюгатами, полученными с использованием водной среды.
Процесс конъюгирования, который позволяет получить конъюгаты с более низким уровнем непрореагировавшего (свободного) полисахарида, обладает преимуществом и является предпочтительным. Известно, что высокие уровни непрореагировавшего (свободного) полисахарида могут вызывать избыточный независимый от Т-клеток иммунный ответ, что потенциально может ослабить зависимый от Т-клеток ответ, вызываемый конъюгатом полисахарида и белка, таким образом снижая иммунный ответ, вызванный конъюгатом.
Выбранные полисахариды GBS подвергали химическому десиалированию способами, известными в области техники (см. Chaffin, D.O, et al., J Bacteriol 187(13): 4615-4626 (2005)) с получением вариантов конъюгата для определения влияния % десиалирования на иммуногенность. Десиалирование более чем на 40% (т.е. уровни сиаловой кислоты меньше примерно 60%) отрицательно сказывались на иммуногенности.
Аналогично, в большинстве случаев степень окисления менее примерно 5, или модификация эпитопов сахарида выше примерно 20%, оказывали отрицательное влияние на иммуногенность. Поскольку окисление затрагивает сиаловую кислоту в капсульном полисахариде, результат указывает, что модификация эпитопов сахарида выше примерно 20%, снижает содержание сиаловой кислоты, что приводит к снижению иммуногенности.
Напротив, конъюгаты, имеющие различные соотношения сахарид/белок или различную молекулярную массу полисахаридов, вызывали иммунный ответ у мышей, свидетельствующий о допустимой вариации данных параметров в относительно широком диапазоне.
Также были получены дополнительные варианты конъюгатов с использованием альтернативных химических путей. Один альтернативный химический способ включал создание конъюгатов в результате реакции полисахарида с карбонилдитриазолом (CDT) и проведения реакции конъюгации в DMSO. В другом альтернативном химическом способе конъюгаты получали путем окисления полисахарида с использованием реагента TEMPO [(2,2,6,6-тетраметилпиперидин-1-ил)окси] (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования (TEMPO/RAC) в DMSO, как подробно описано выше в Примере 3. Все конъюгаты, полученные указанными альтернативными химическими способами, продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных химических путей помимо PO/RAC. Однако, некоторые химические способы получения конъюгатов оказались лучше для некоторых серотипов, чем другие.
ОРА проводили, как описано Nanra, J.S., et al., Hum. Vaccin. Immunother., 9(3): 480-487 (2013), заменяя изоляты Staphylococcus aureus изолятами стрептококка группы В и опуская стадию пре-опсонизации. Титры ОРА после третьего введения (PD3) представлены как среднее геометрическое для группы 10-20 мышей, которых при каждом введении иммунизировали 1 мкг/мл соответствующего конъюгата.
Конъюгаты полисахарида GBS серотипа Ia и CRM197
Конъюгаты, полученные с помощью PO/RAC и активированных полисахаридов, имеющих DO 16-17 (модификация эпитопов сахаридов примерно 6%), демонстрировали иммуногенность (конъюгаты 1 и 3). Однако, использование активированных полисахаридов, имеющих DO примерно 5,4 (модификация эпитопов сахаридов примерно 19%), оказывало отрицательное влияние на иммуногенность (конъюгат 2). Аналогично, уровень сиаловой кислоты 50% приводил практически к отсутствию иммунного ответа (конъюгат 4). Результаты приведены в Таблице 10.
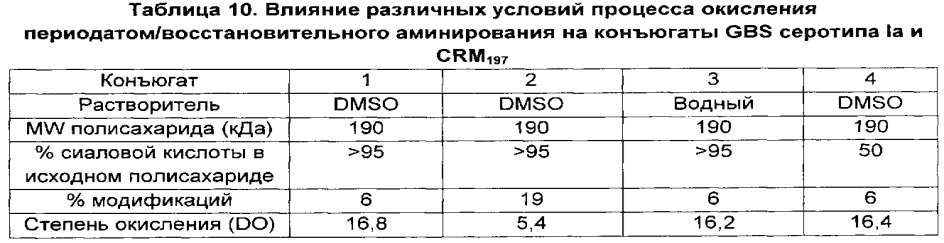

Дополнительные варианты конъюгатов были получены с использованием альтернативных вариантов химического конъюгирования и молекулярных характеристик конъюгатов (результаты приведены в Таблице 11). Конъюгат 5 получили посредством реакции между полисахаридом и карбонилдитриазолом (CDT), реакцию конъюгации проводили в DMSO. Конъюгат 6 получили посредством окисления полисахарида с использованием реагента TEMPO (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования в DMSO, как подробно описано выше в Примере 3. Конъюгат 7 получили посредством PO/RAC, преднамеренно варьируя параметры конъюгации для получения конъюгата с высоким соотношением сахарид/белок (SPR). Конъюгат 8 получили посредством PO/RAC, используя полисахарид с низкой молекулярной массой (40 кДа). Все указанные конъюгаты продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных вариантов химического конъюгирования, помимо окисления периодатом/восстановительного аминирования, а также альтернативных характеристик конъюгатов, таких как SPR и низкая молекулярная масса исходного полисахарида.
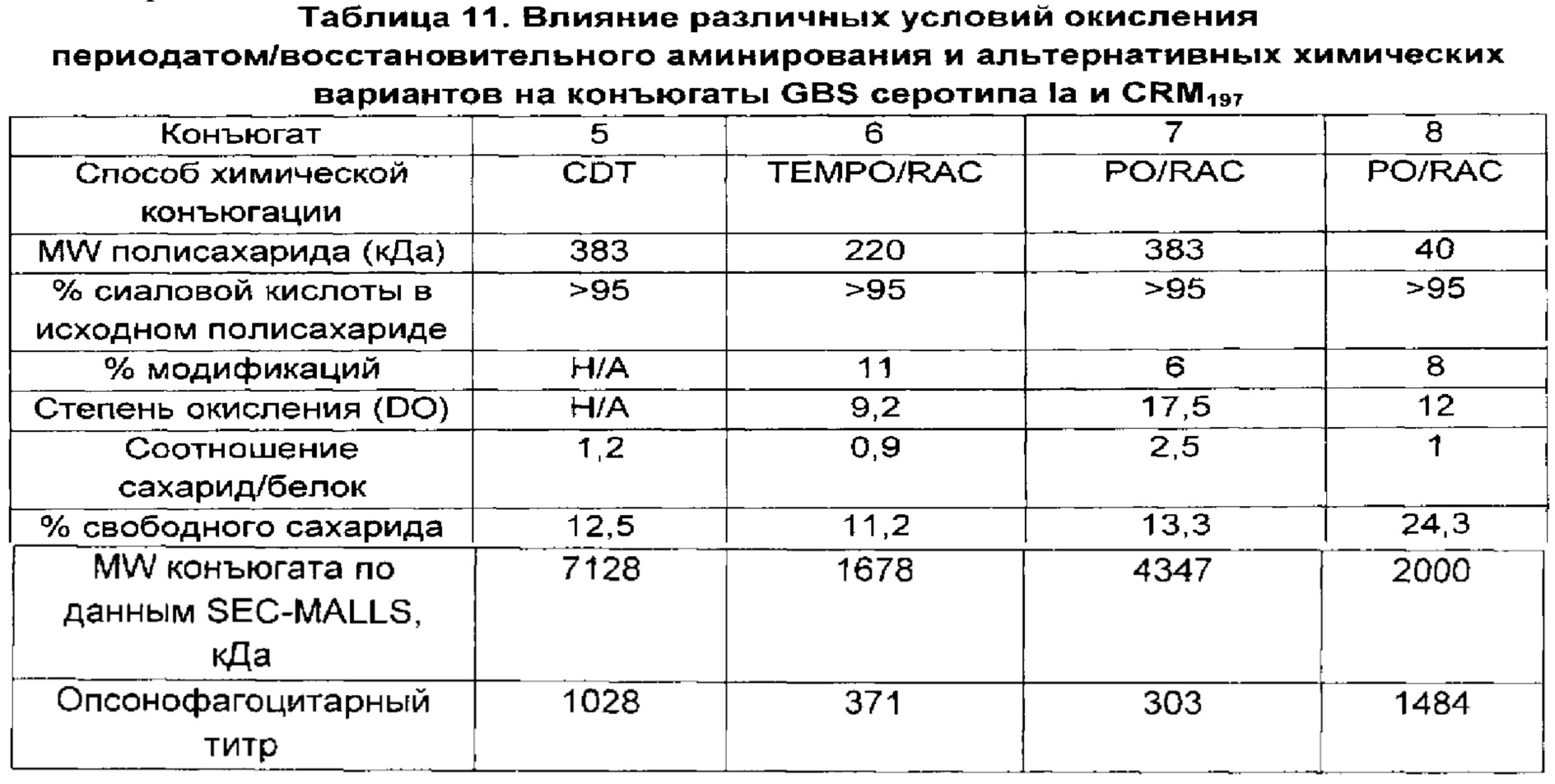
Конъюгаты полисахарида GBS серотипа Ib и CRM197
Конъюгаты, полученные с помощью PO/RAC и активированных полисахаридов, имеющих DO 15,8 (модификация эпитопов сахаридов примерно 6%) в DMSO, продемонстрировали иммуногенность у мышей (конъюгаты 9 и 11). Конъюгаты, полученные с помощью PO/RAC в DMSO были немного более иммуногенны, чем конъюгаты, полученные с помощью PO/RAC в водной среде, при том, что остальные молекулярные характеристики конъюгатов были аналогичны (конъюгаты 9 и 11, соответственно). Однако использование активированных полисахаридов, имеющих DO примерно 4,7 (модификация эпитопов сахаридов примерно 21%), оказывало отрицательное влияние на иммуногенность (конъюгат 10). Конъюгат, полученный с помощью PO/RAC и полисахаридов, десиалированных на 95% (уровень сиаловой кислоты 5%) практически полностью терял иммуногенность (вызывал ответ всего у нескольких особей) (конъюгат 12). Результаты приведены в Таблице 12.
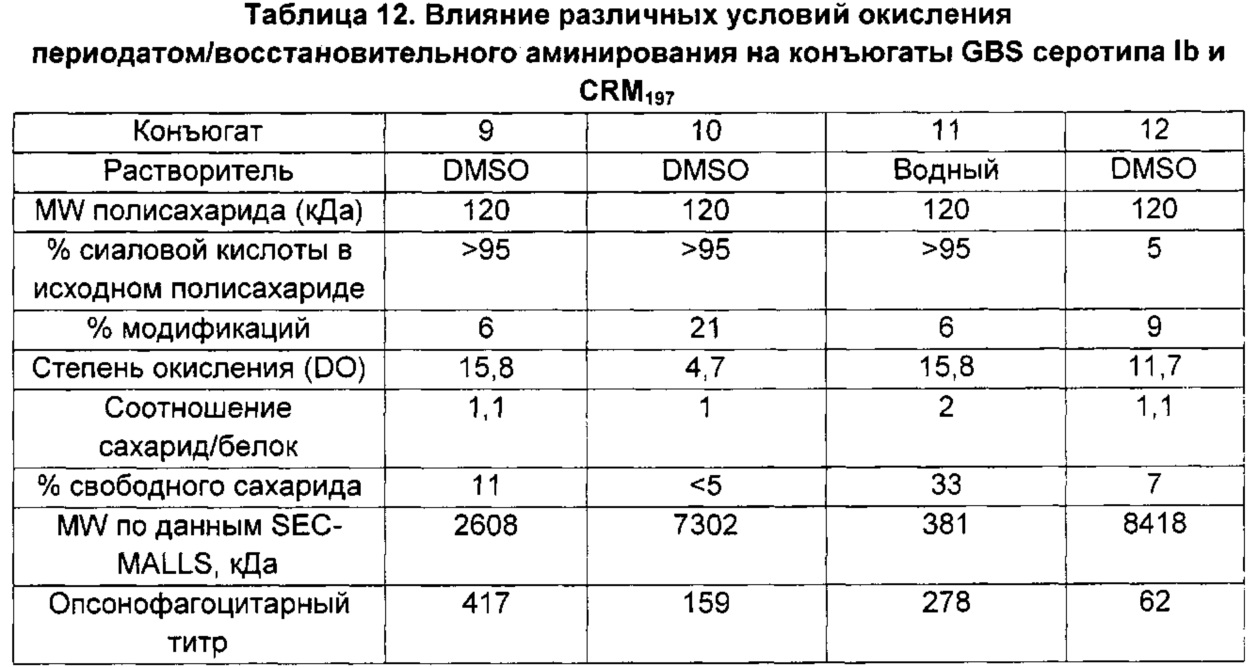
Дополнительные варианты конъюгатов были получены с использованием альтернативных вариантов химического конъюгирования и молекулярных характеристик конъюгатов (результаты приведены в Таблице 13). Конъюгат 13 получили посредством PO/RAC, используя полисахарид с низким уровнем сиалирования исходного полисахарида. Конъюгат 14 получили посредством PO/RAC, преднамеренно варьируя параметры конъюгации для получения конъюгата с высоким соотношением сахарид/белок (SPR). Конъюгат 15 получили посредством реакции между полисахаридом и карбонилдитриазолом (CDT), реакцию конъюгации проводили в DMSO. Конъюгат 16 получили посредством окисления полисахарида с использованием реагента TEMPO (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования в DMSO, как подробно описано выше в Примере 3. Все указанные конъюгаты продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных вариантов химического конъюгирования, помимо окисления периодатом/восстановительного аминирования, а также альтернативных характеристик конъюгатов, таких как SPR и низкая молекулярная масса исходного полисахарида.
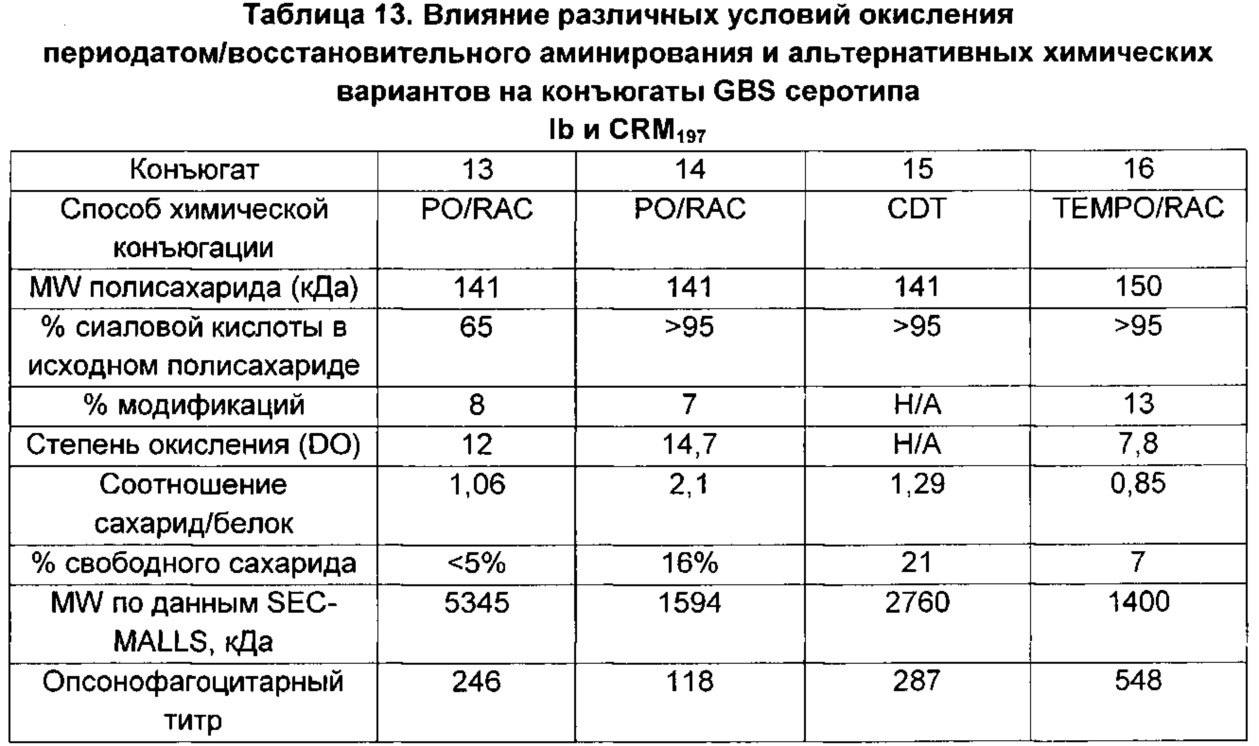
Конъюгаты полисахарида GBS серотипа II и CRM197
Конъюгаты, полученные с помощью PO/RAC и активированных полисахаридов, имеющих DO 4-15 (модификация эпитопов сахаридов примерно 7-23%), продемонстрировали иммуногенность у мышей (конъюгаты 17-20). Конъюгат, полученный с помощью PO/RAC и полисахарида с уровнем сиалирования 74% (десиалированного на 26%) также продемонстрировал иммуногенность (конъюгат 20). Результаты приведены в Таблице 14.
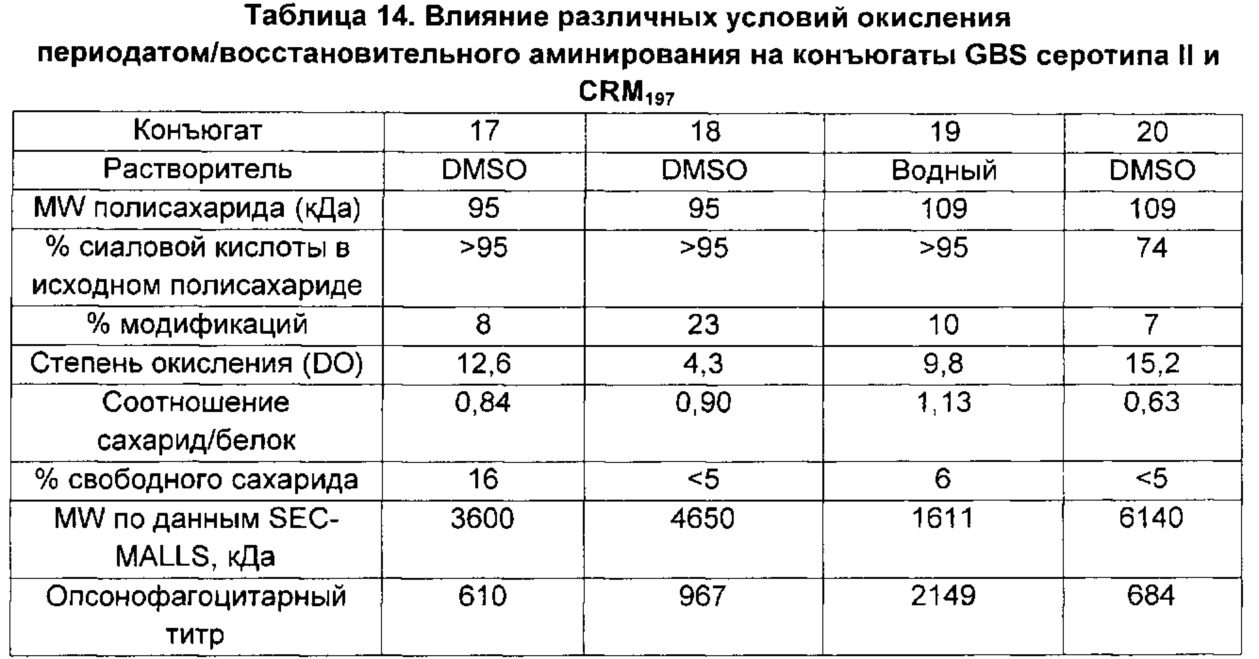
Дополнительные варианты конъюгатов были получены с использованием альтернативных вариантов химического конъюгирования и молекулярных характеристик конъюгатов (результаты приведены в Таблице 15). Конъюгаты 21 и 22 получили посредством PO/RAC, специально варьируя параметры конъюгации для получения конъюгата с низким и высоким соотношением сахарид/белок (SPR), соответственно. Конъюгат 23 получили посредством окисления полисахарида с использованием реагента TEMPO (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования в DMSO, как подробно описано выше в Примере 3. Конъюгат 24 получили посредством реакции между полисахаридом и карбонилдитриазолом (CDT), реакцию конъюгации проводили в DMSO. Все указанные конъюгаты продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных вариантов химического конъюгирования, помимо окисления периодатом/восстановительного аминирования, а также альтернативных характеристик конъюгатов, таких как SPR.
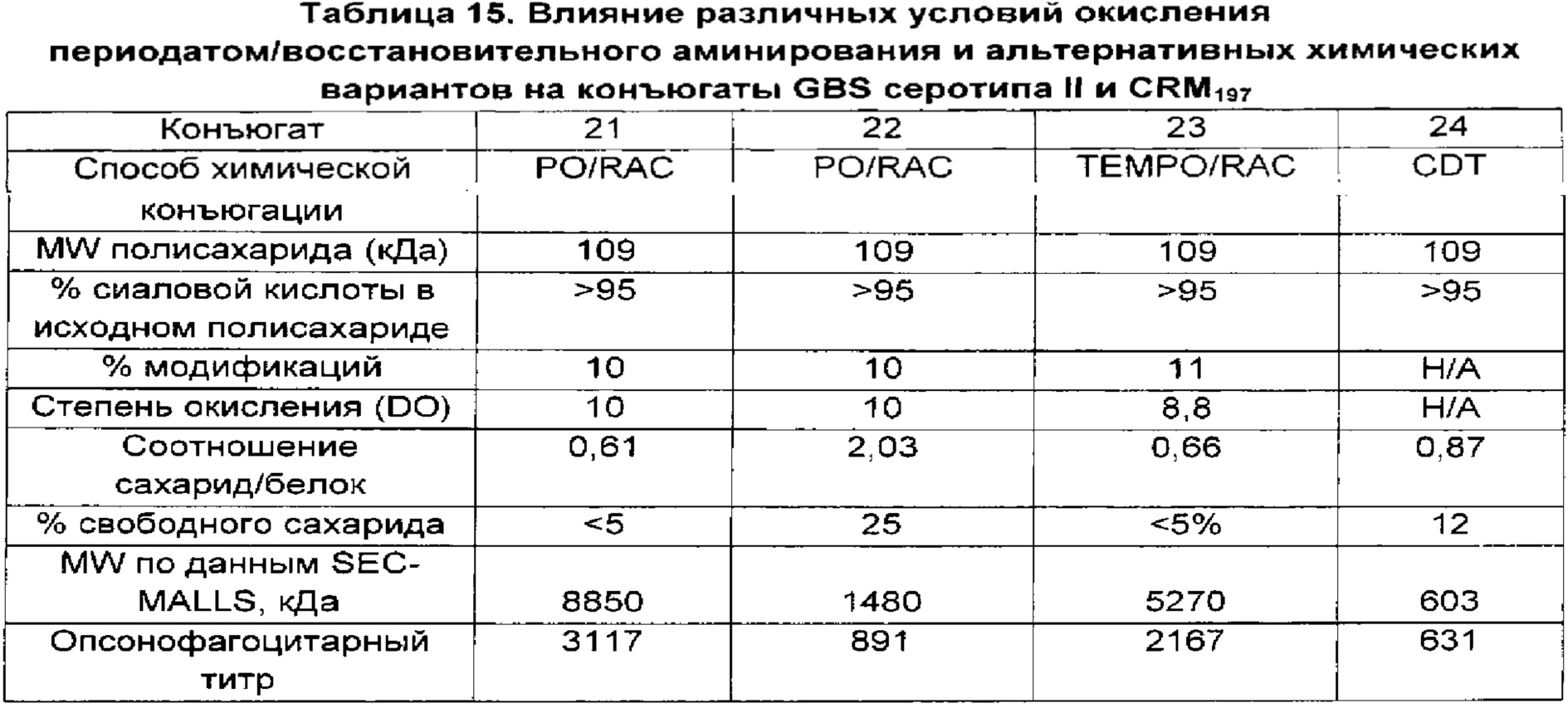
Конъюгаты полисахарида GBS серотипа III и CRM197
Конъюгаты, полученные с помощью PO/RAC и активированных полисахаридов, имеющих DO 10-17 (модификация эпитопов сахаридов примерно 6-10%), продемонстрировали иммуногенность у мышей (конъюгаты 25 и 30). Конъюгаты, имеющие DO примерно 2,9 (модификация эпитопов сахаридов примерно 34%) или высокое соотношение сахарид/белок (2,1) (конъюгаты 26 и 27, соответственно) оказались относительно менее иммуногенными. Конъюгаты, полученные с помощью PO/RAC и полисахарида с уровнем сиалирования 81% (десиалированного на 19%) также продемонстрировали иммуногенность (конъюгат 30). Однако конъюгат, полученный с использованием полисахарида с уровнем сиалирования 58% (десиалированного на 42%) продемонстрировал плохую иммуногенность (конъюгат 29). Конъюгаты, полученные с помощью PO/RAC в DMSO были несколько более иммуногенны, чем конъюгаты, полученные с помощью PO/RAC в водной среде, при том, что остальные молекулярные характеристики конъюгатов были аналогичны (конъюгаты 25 и 28, соответственно). Результаты приведены в Таблице 16.
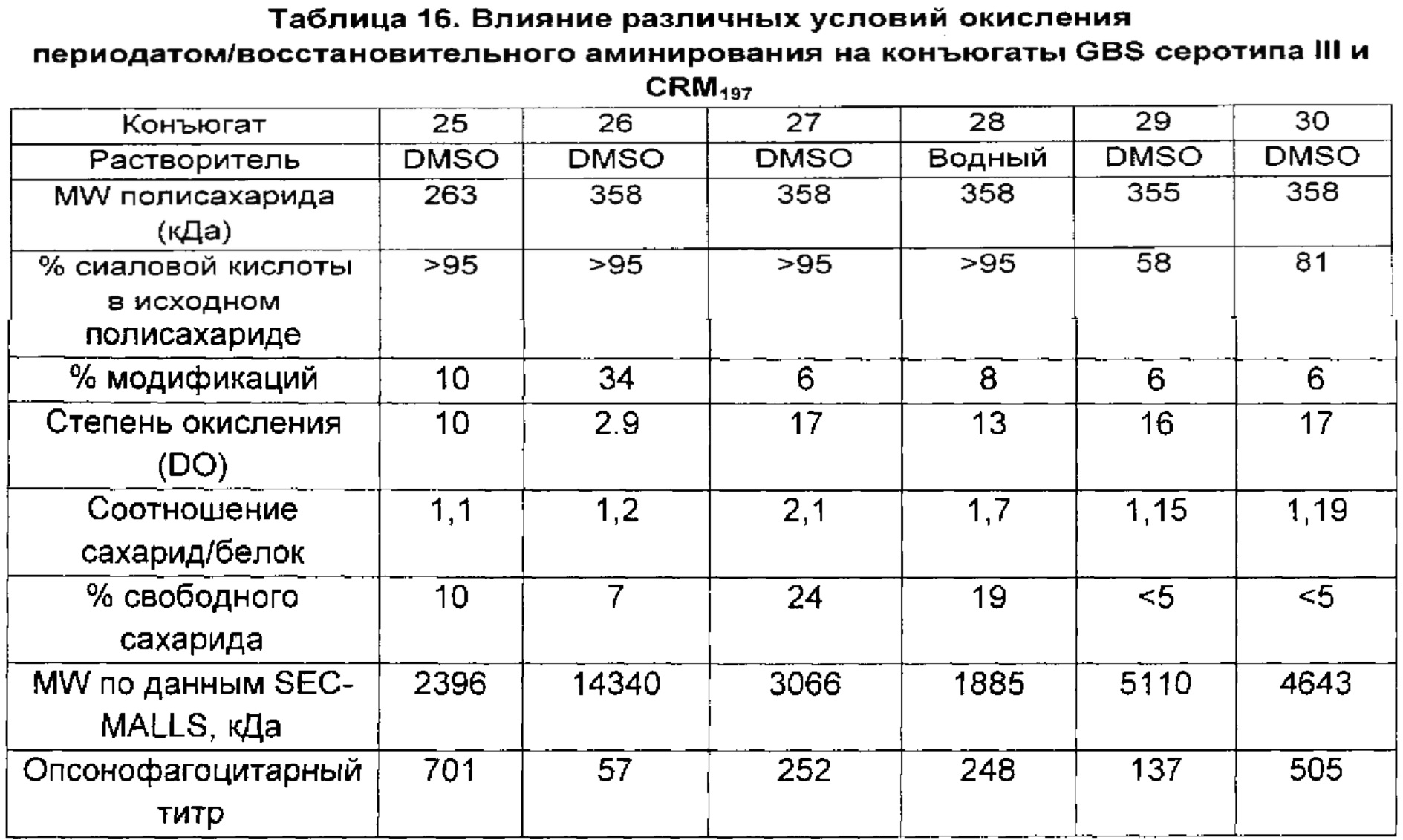
Дополнительные варианты конъюгатов были получены с использованием альтернативных вариантов химического конъюгирования и молекулярных характеристик конъюгатов (результаты приведены в Таблице 17). Конъюгаты 31-35 получили посредством PO/RAC, преднамеренно варьируя параметры конъюгации для получения конъюгатов с различной молекулярной массой (MW). Конъюгат 36 получили посредством реакции между полисахаридом и карбонилдитриазолом (CDT), реакцию конъюгации проводили в DMSO. Конъюгат 37 получили посредством окисления полисахарида с использованием реагента TEMPO (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования в DMSO, как подробно описано выше в Примере 3. Все указанные конъюгаты продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных вариантов химического конъюгирования, помимо окисления периодатом/восстановительного аминирования, а также альтернативных характеристик конъюгатов, таких как MW. Конъюгаты, полученные при DO всего лишь 5 (модификация эпитопов сахаридов примерно 20%) оказывались все еще иммуногенными у мышей (конъюгат 32 в Таблице 17) в отличие от конъюгатов, полученных при DO 2,9 (модификация эпитопов сахаридов примерно 34%) (конъюгат 26 в Таблице 16 выше).
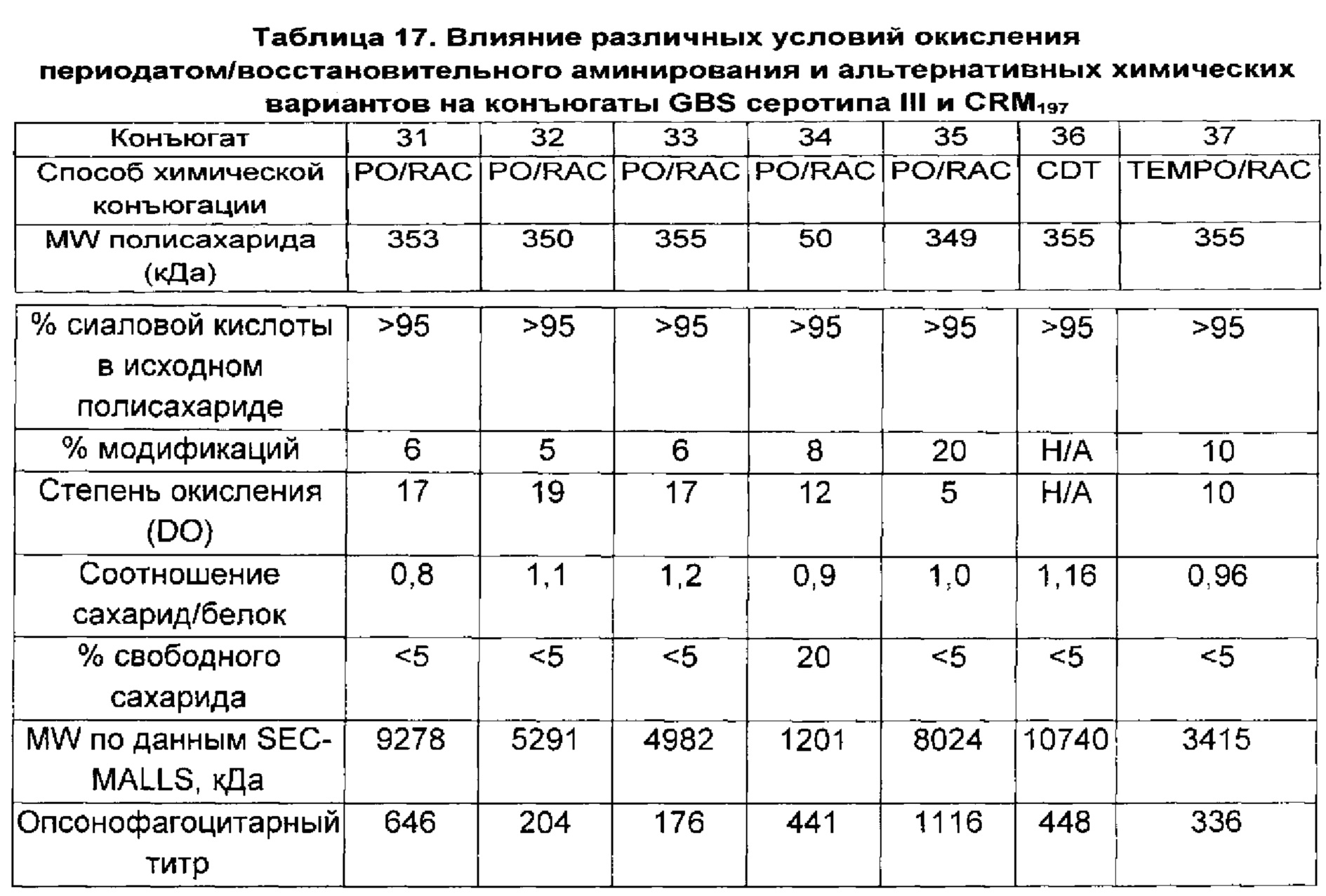
Конъюгаты полисахарида GBS серотипа IV и CRM197
Конъюгаты, полученные с помощью PO/RAC и активированных полисахаридов, имеющих DO 6,9-14,2 (модификация эпитопов сахаридов примерно 7-14%), продемонстрировали иммуногенность у мышей (конъюгаты 38-41). Конъюгат, полученный с помощью PO/RAC и полисахарида с уровнем сиалирования 60% (десиалированного на 40%), также продемонстрировали иммуногенность (конъюгат 41). Результаты приведены в Таблице 18.
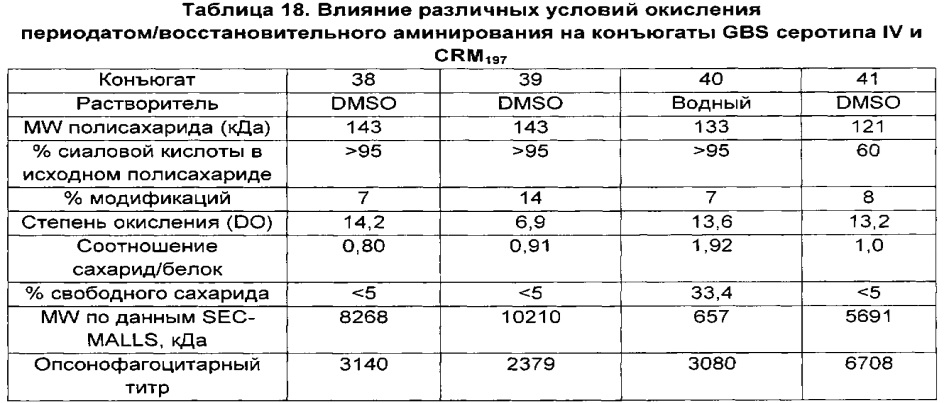
Дополнительные варианты конъюгатов были получены с использованием альтернативных вариантов химического конъюгирования и молекулярных характеристик конъюгатов. Результаты приведены в Таблице 19. Конъюгаты 42 и 45 получили посредством PO/RAC, преднамеренно варьируя параметры конъюгации для получения конъюгатов с высоким значением DO (более низким уровнем окисления) и высоким SPR, соответственно. Конъюгат 43 получили посредством реакции между полисахаридом и карбонилдитриазолом (CDT), реакцию конъюгации проводили в DMSO. Конъюгат 44 получили посредством окисления полисахарида с использованием реагента TEMPO (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования в DMSO, как подробно описано выше в Примере 3. Все конъюгаты серотипа IV продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных вариантов химического конъюгирования, помимо окисления периодатом/восстановительного аминирования, а также вариантов характеристик конъюгатов, таких как SPR. Конъюгаты, полученные с DO по меньшей мере до 20 (менее окисленные) (модификация эпитопов сахаридов примерно 5%) оказывались все еще иммуногенными у мышей.
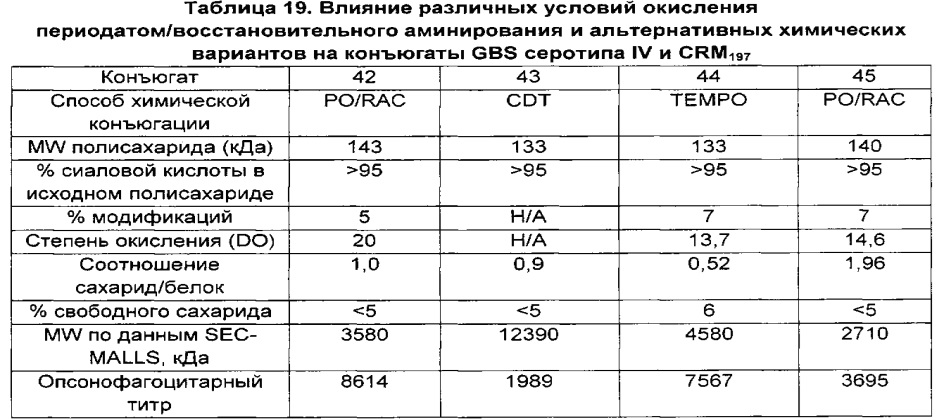
Конъюгаты полисахарида GBS серотипа V и CRM197
Конъюгаты, полученные с помощью PO/RAC и активированных полисахаридов, имеющих DO 4,4-14,6 (модификация эпитопов сахаридов примерно 7-23%), продемонстрировали иммуногенность у мышей (конъюгаты 46 и 47). Десиалированный (уровень сиалирования 5%) конъюгат оказался неиммуногенным (конъюгат 49), а конъюгат, полученный с использованием процесса PO/RAC и водного растворителя вызывал низкий иммунный ответ (конъюгат 48). Результаты приведены в Таблице 20.
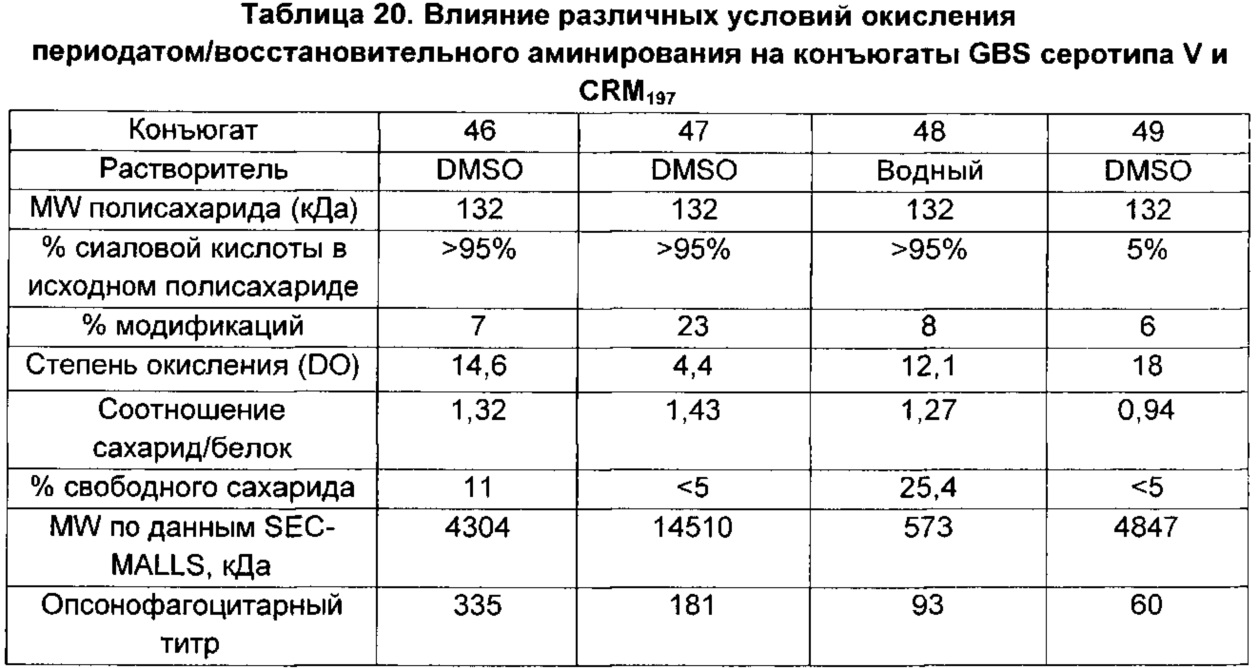
Дополнительные варианты конъюгатов были получены с использованием альтернативных вариантов химического конъюгирования и молекулярных характеристик конъюгатов. Результаты приведены в Таблице 21. Конъюгаты 50 и 53 получили посредством PO/RAC, преднамеренно варьируя параметры конъюгации для получения конъюгатов с более низким уровнем сиалирования (сиалирование 81%) и низкой MW, соответственно. Конъюгат 51 получили посредством реакции между полисахаридом и карбонилдитриазолом (CDT), реакцию конъюгации проводили в DMSO. Конъюгат 52 получили посредством окисления полисахарида с использованием реагента TEMPO (вместо периодата натрия) с последующим конъюгированием с использованием восстановительного аминирования в DMSO, как подробно описано выше в Примере 3. Все конъюгаты серотипа V, за исключением конъюгата, полученного с использованием CDT, продемонстрировали иммуногенность у мышей, что свидетельствовало о возможности использования альтернативных вариантов химического конъюгирования, помимо окисления периодатом/восстановительного аминирования, и альтернативных характеристик конъюгатов, таких как MW. Конъюгат, полученный с использованием CDT, оказался существенно менее иммуногенным по сравнению с другими конъюгатами, полученными с использованием RAC. Конъюгат с уровнем сиалирования 81% (конъюгат 50) вызывал иммунный ответ, который был ниже, чем у конъюгата с уровнем сиалирования >95% (конъюгат 53), но выше, чем у конъюгата с уровнем сиалирования 5% (конъюгат 49 в Таблице 20 выше).
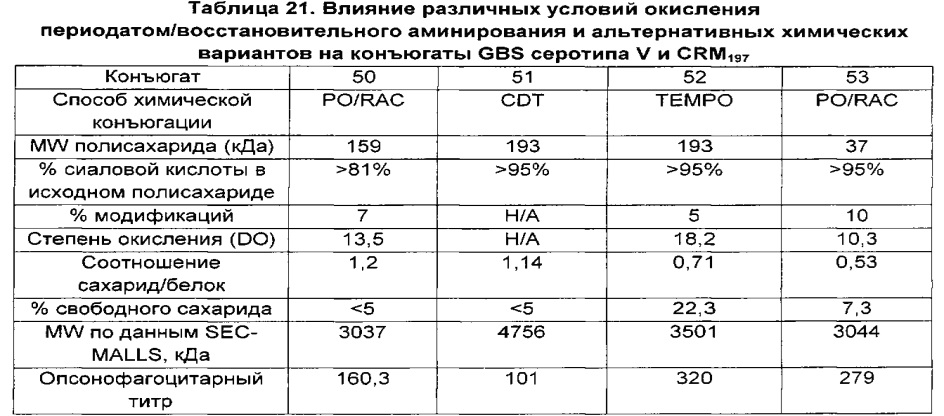
Пример 5. Моновалентные вакцины на основе конъюгатов GBS III-CRM197 и GBS V-CRM197 вызывают опсонофагоцитарный ответ у мышей
Самок мышей CD-1 иммунизировали 1 мкг, 0,1 мкг или 0,01 мкг стрептококка группы В (GBS) серотипа III, конъюгированного с CRM197 (GBS III-CRM197), или GBS серотипа V, конъюгированного с CRM197 (GBS V-CRM197), три раза подкожно на 0, 3 и 6 неделе. После третьей иммунизации (PD3) проводили анализ опсонофагоцитарной активности сыворотки (ОРА). ОРА проводили, как описано в Примере 4. Оба конъюгата индуцировали опсонофагоцитарные ответы у мышей (Таблица 22). Образцам без детектируемого опсонофагоцитарного ответа присваивали значение 50.

Пример 6. Моновалентные вакцины на основе конъюгатов GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197 вызывают опсонофагоцитарный ответ у мышей
Шесть групп самок мышей CD-1 иммунизировали три раза подкожно вакциной, содержащей 1 мкг индивидуального капсульного полисахарида GBS (КП), конъюгированного с CRM197, на 0, 3 и 6 неделе. Первоначальные исследования показали, что у мышей изначально не обнаруживались ОРА титры к какому-либо из шести тестируемых серотипов. Анализировали опсонофагоцитарную активность сыворотки после PD3 против распознаваемого серотипа GBS, содержащегося в вакцине. ОРА проводили, как описано в Примере 4. Результаты приведены в Таблицах 23 и 24 ниже.
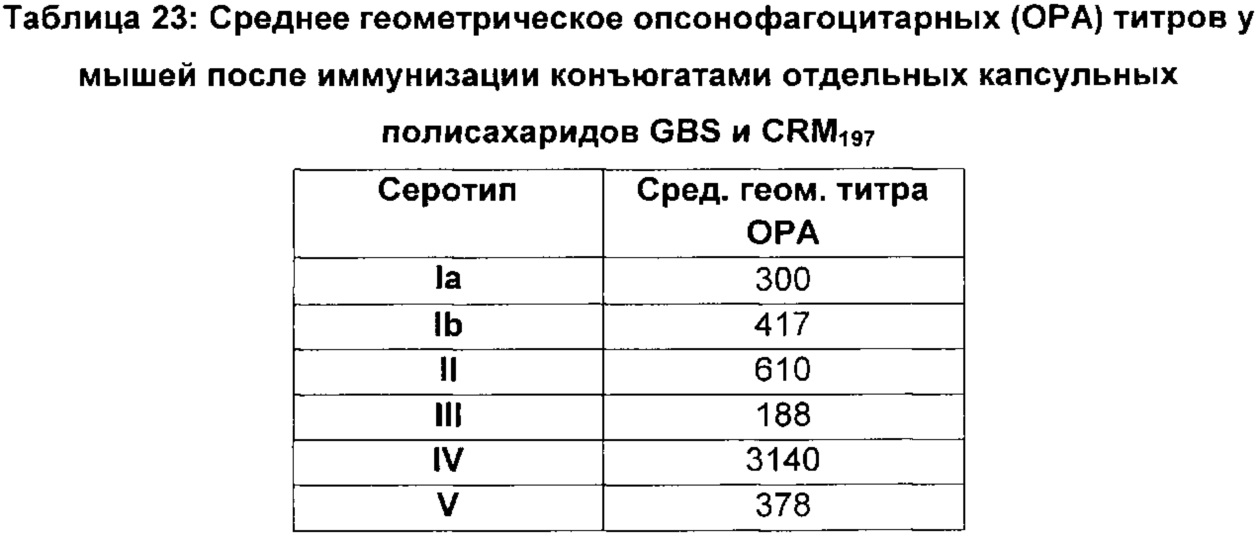
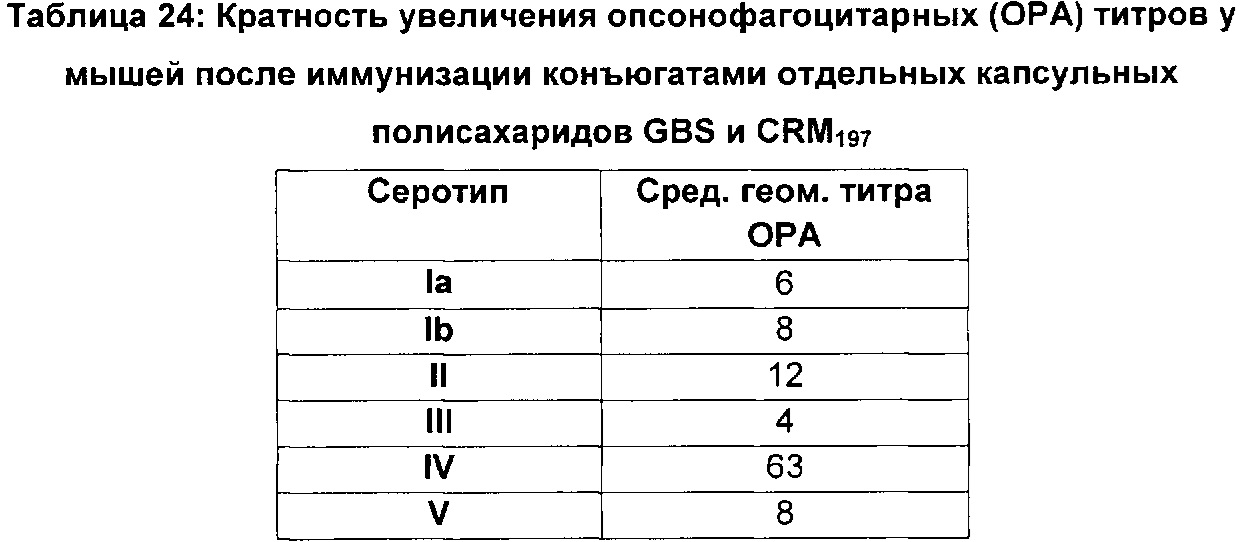
Прим.: Кратность увеличения рассчитывают, исходя из того, что мыши не имели исходно существующего титра.
Пример 7. Сравнение опсонической активности сыворотки и выделенного IgG мышей, иммунизированных моновалентными вакцинами на основе конъюгатов GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197
Самок мышей CD-1 или BALB/c иммунизировали три раза подкожно 1 мкг индивидуального КП GBS, конъюгированного с CRM197 на 0, 3 и 6 неделе. В качестве адъюванта использовали AlPO4 или QS-21. Исследовали специфическую к серотипу опсонофагоцитарную активность сыворотки PD3, затем выделяли фракцию иммуноглобулина G и исследовали опсонофагоцитарную активность. Опсонофагоцитарную активность очищенных IgG нормализовали к 5 мг/мл (в пределах количества IgG в нормальной мышиной сыворотке). Все шесть конъюгатов КП GBS индуцировали антитела IgG, проявляющие опсоническую активность (Фиг. 1).
Пример 8. Моновалентные вакцины на основе конъюгатов GBS Ia- ТТ, GBS Ib-TT, GBS II-ТТ, GBS III-TT, GBS IV-TT и GBS V-TT вызывают опсонофагоцитарный ответ у кроликов
Кроликов иммунизировали три раза 50 мкг/мл полисахарида GBS серотипа Ia, конъюгированного со столбнячным анатоксином, 10 мкг/мл полисахарида GBS серотипа Ib, конъюгированного со столбнячным анатоксином, 50 мкг/мл полисахарида GBS серотипа II, конъюгированного со столбнячным анатоксином, 50 мкг/мл полисахарида GBS серотипа III, конъюгированного со столбнячным анатоксином, 50 мкг/мл полисахарида GBS серотипа IV, конъюгированного со столбнячным анатоксином, или 50 мкг/мл полисахарида GBS серотипа V, конъюгированного со столбнячным анатоксином, с полным адъювантом Фрейнда при первом введении и неполным адъювантом Фрейнда при втором и третьем введениях. Конъюгаты получали с использованием полисахаридов, имеющих уровень сиаловой кислоты выше 95%, и CDAP (тетрафторборат 1-циано-4-диметиламинопиридина). Иммунный ответ PD3 оценивали по опсонофагоцитарной активности, как описано в Примере 4. Сывороточные титры приведены в Таблице 25, а титры очищенных IgG приведены в Таблице 26 ниже. Полисахариды GBS серотипов Ia, Ib, II, III, IV и V, конъюгированные с ТТ, демонстрировали высокую иммуногенность у кроликов.
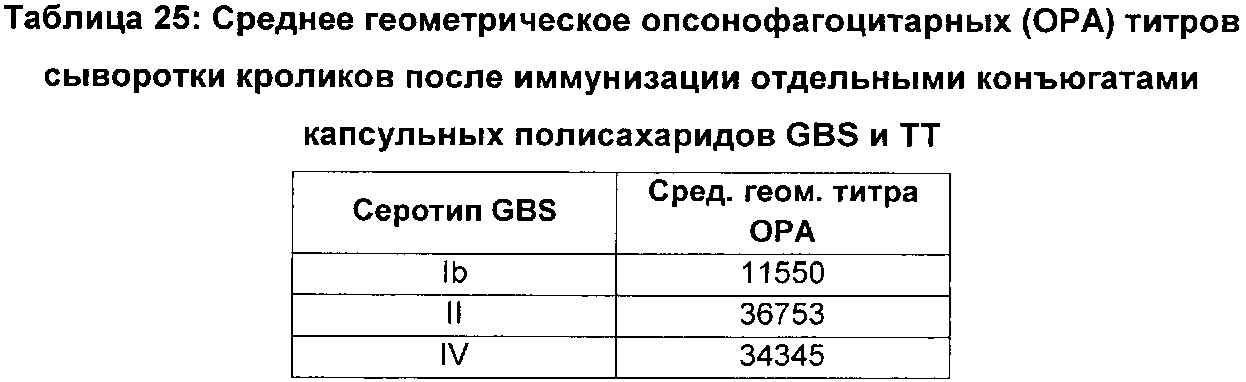

Пример 9. Шестивалентные вакцины на основе конъюгатов GBS вызывают опсонофагоцитарный ответ у приматов, не являющихся человеком
Три группы макак - резус иммунизировали шестивалентной вакциной на основе стрептококка группы В (GBS6) три раза внутримышечно на 0, 4 и 8 неделях. Вакцина GBS6 содержала GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197. Две группы получали в качестве адъюванта фосфат алюминия (AlPO4) и каждый конъюгат в дозе 5 мкг либо 50 мкг. Третья группа получала каждый конъюгат в дозе 5 мкг и не получала адъювант. В Таблице 27 описана схема иммунизации.

Анализировали опсонофагоцитарную активность сыворотки до иммунизации и после PD3 против всех шести серотипов GBS, содержащихся в вакцине. Анализ ОРА проводили, как описано в Примере 4. Результаты приведены в Таблицах 28 и 29 ниже. Составы с адъювантом AlPO4 вызывали измеримый опсонофагоцитарный ответ (увеличение титров от значений перед иммунизацией до PD3, или кратность увеличения больше 1) против всех шести серотипов. Конъюгат в дозе 5 мкг без адъюванта вызывал измеримый опсонофагоцитарный ответ против пяти из шести серотипов.
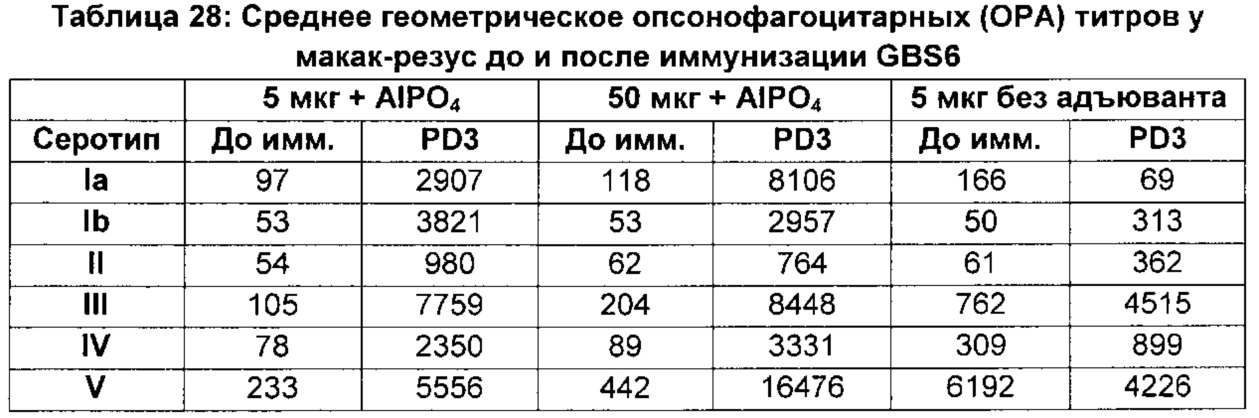
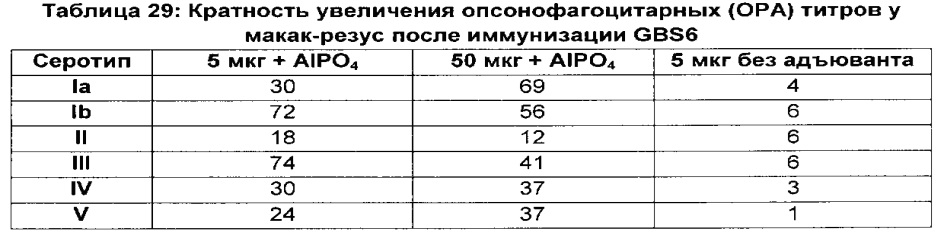
Пример 10. Шестивалентная вакцина на основе конъюгатов GBS вызывает опсонофагоцитарный ответ у крыс
Самок крыс Sprague-Dawley иммунизировали дважды подкожно 5 мкг/мл каждого конъюгата в составе вакцины GBS6 на основе конъюгатов полисахаридов, как описано в Примере 9, составленной либо с фосфатом алюминия (AlPO4), либо без него. Определяли опсонофагоцитарный титр сыворотки в отношении всех шести распознаваемых серотипов GBS до иммунизации (исходно) и после второй иммунизации. Опсонофагоцитарные титры в отношении каждого серотипа GBS определяли в 384-луночном формате и рассчитывали кратность увеличения. Крысы, которым вводили вакцину GBS6, синтезировали функционально активные антитела на каждый серотип после второй иммунизации; в отсутствие AlPO4 наблюдалось усиление ответа в 7-205 раз, в зависимости от серотипа, тогда как в его присутствии кратность увеличения варьировала от 11 до 294 (Таблица 30).

Пример 11. Иммунизация беременных самок моновалентной или шестивалентной вакциной на основе гликоконъюгата GBS показала защитный эффект против инфекции GBS III или V у их потомства после рождения
Самок мышей CD-1 иммунизировали три раза подкожно вакциной GBS6, как описано в Примере 9, содержащей 5 мкг/мл каждого конъюгата и 100 мкг/мл AlPO4, моновалентной вакциной на основе гликоконъюгата GBS III или V (каждая содержала 10 мкг/мл конъюгата и 100 мкг/мл AlPO4) или только несущей средой, служившей контролем. Мышей скрещивали до третьей иммунизации. Потомство иммунизированных мышей заражали летальной дозой бактерий GBS серотипа III или GBS серотипа V, в соответствии с полученной вакциной, и оценивали выживаемость на протяжении 90 часов. Иммунизация беременных самок GBS6+AlPO4 или GBS III-CRM197+AlPO4 достоверно обеспечивала защиту их детенышей от воздействия летальной дозы GBS серотипа III (p<0,0001). Аналогично, иммунизация беременных самок GBS V-CRM197+AlPO4 достоверно обеспечивала защиту их детенышей от воздействия летальной дозы GBS серотипа V (p<0,0001). Результаты приведены в Таблице 31.

Пример 12. Пассивная иммунизация детенышей крыс моноклональными антителами к GBS III демонстрировала защитный эффект
Моноклональные антитела (mAb) к стрептококку группы В серотипа III (GBS III) получали путем иммунизации мышей пятивалентной вакциной, включающей серотипы Ia, Ib, II, III и V. Отбирали клоны GBS III-специфических mAb и получали mAb, распознающие КП GBS III, с помощью стандартных способов. Детенышам крыс пассивно вводили mAb к GBS серотипа III (по 10 в группе; приведены 2 независимых эксперимента) за 16 часов до заражения клиническим изолятом GBS III. Через четыре часа после заражения брали кровь и подсчитывали CFU. Введение mAb к GBS III снижало количество CFU у детенышей крыс на 4 log или более (Таблица 32).

Пример 13. Пассивная иммунизация беременных мышей моноклональными антителами к GBS Ib, III, и V демонстрировала защитный эффект у их потомства после рождения
Моноклональные антитела получали от мышей, иммунизированных пятивалентной вакциной (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197 и GBS V-CRM197), в соответствии со стандартными процедурами. Затем установили, что mAb специфически распознают капсульные полисахариды каждого из пяти серотипов. Беременным мышам пассивно вводили mAb к GBS серотипа Ib (GBS Ib), mAb к GBS серотипа III (GBS III), mAb к GBS серотипа V (GBS V) или изотипическое контрольное mAb в дозе 500 мкг/мл примерно за 24-48 часов до родов. Через 24-48 ч после рождения потомство иммунизированных самок мышей заражали летальной дозой бактерий GBS Ib, GBS III или GBS V. Оценивали выживаемость в течение 96 часов. Выживаемость после заражения GBS у детенышей, рожденных от самок, иммунизированных mAb к GBS Ib, mAb к GBS III или mAb к GBS V, была достоверно выше по сравнению с контрольным mAb (Таблица 33).

Пример 14. Стабильность конъюгатов GBS
Для тестирования стабильности конъюгатов в условиях ускоренного старения каждый в отдельности из GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197 находился в 10 мМ сукцинате-фосфате и 155 мМ NaCl с различными значениями рН. Через 4 недели хранения при 50°С измеряли изменение молекулярной массы, выраженное в процентах, которое определяли с помощью SEC MALLS. Результаты приведены на Фиг. 2-7.
Исследовали стабильность сиалирования конъюгатов GBS Ia-CRM197, GBS Ib-CRM197, GBS III-CRM197 и GBS IV-CRM197 в различных буферах, представленных в Таблице 34. Свободную сиаловую кислоту (N ацетилнейраминовую кислоту, NANA) определяли с помощью HPLC через 1 месяц хранения при 37°С. Результаты приведены на Фиг. 8.
Оба исследования позволили предположить, что для конъюгатов были предпочтительны значения рН выше 6,0, оптимально примерно рН 6,5.
Пример 15. Композиция GBS6
Чтобы определиться с выбором буфера, приготовили составы, включающие GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197 (GBS6), используя те же буферные системы, которые указаны в Таблице 33 выше. Фактические значения рН составов исследовали в следующие моменты времени: 0 (когда состав был приготовлен), через 1 месяц при 5°С, через 1 месяц при 25°С и через 1 месяц при 37°С. В составах, приготовленных с применением сукцината в качестве буфера, наблюдали сдвиг рН, тогда как в составах, приготовленных с применением гистидина в качестве буфера, сдвига не наблюдалось. Результаты показаны на Фиг. 9-10.
Также исследовали влияние концентрации гистидинового буфера на связывание конъюгатов GBS с алюминием. Состав, содержащий 150 мМ NaCl, 0,01% полисорбата-80 с рН 6,5 и 0,5 мг/мл алюминия в виде AlPO4, исследовали при двух различных концентрациях конъюгатов (10 мкг/мл и 40 мкг/мл каждого серотипа) и нескольких различных концентрациях гистидина. Процент конъюгатов, связанных с алюминием, определяли посредством измерения общего количества каждого из конъюгатов, входящих в состав вакцины, и количества каждого из конъюгатов, связанных с алюминием. Связанные конъюгаты определяли путем центрифугирования композиции вакцины, ресуспендирования осадка алюминия, солюбилизации алюминия и определения связанных конъюгатов посредством нефелометрии с использованием поликлональных антител, специфических к серотипу, направленных против каждого из серотипов. Результаты показаны на Фиг. 11-12. Обнаружили, что концентрация гистидинового буфера влияла на процент каждого серотипа, связанного с алюминием, и влияние было более выраженным при низкой дозе, чем при более высокой дозе.
Для определения необходимого количества полисорбата-80 (PS80) проводили исследование с перемешиванием. Исследовали снижение общей антигенности композиций GBS6, содержащих 20 мМ гистидина, 150 мМ NaCl, 0,5 мг/мл AlPO4 (если таковой присутствовал) либо без PS80, либо с 0,01% PS80, 0,02% PS80 или 0,03% PS80 с pH 6,5, при стрессе, вызванном перемешиванием. Шприцы, предварительно заполненные композициями, подвергали перемешиванию при 500 об/мин в течение 72 часов при комнатной температуре. Контрольные образцы находились при комнатной температуре в течение 72 ч (без перемешивания). Результаты показаны на Фиг. 13.
Также исследовали концентрацию алюминия в композициях GBS6 для определения влияния на связывание конъюгатов GBS6 с алюминием. Исследовали процент конъюгата, связанного с алюминием, в композициях GBS6, содержащих 10 мМ гистидина, 150 мМ NaCl, 0,02% PS80, либо с 0,25 мг/мл, 0,5 мг/мл, 0,75 мг/мл или 1,0 мг/мл алюминия в виде фосфата алюминия (AlPO4) с рН 6,5. Процент связывания с AlPO4 увеличивался при повышении концентрации AlPO4. Результаты показаны на Фиг. 14.
Пример 16. Лиофилизированная композиция GBS6
Исследовали стабильность ряда лиофилизированных композиций GBS6 (GBS Ia-CRM197, GBS Ib-CRM197, GBS II-CRM197, GBS III-CRM197, GBS IV-CRM197 и GBS V-CRM197). Лиофилизировали композиции с низкой (10 мкг/мл) и высокой дозой (50 мкг/мл), содержащие 20 мМ гистидин с рН 6,5, 0,02% PS80, примерно 28 мМ NaCl и либо 5,5%, либо 7,0%, либо 8,5% (масс./об.) сахарозы. Стабильность лиофилизированных композиций исследовали путем определения рН и влажности через 4 месяца нахождения при температуре 5°С, 4 месяца нахождения при температуре 37°С и 1 месяц нахождения при температуре 50°С. Все композиции демонстрировали стабильность по показателям рН и влажности (результаты не приведены). Кроме того, для каждого серотипа исследовали выраженное в процентах сохранение антигенности во всех композициях через 1, 4 и 9 месяцев при 5°С и 37°С, а также через 1, 2 и 4 недели при 50°С. Результаты показаны на Фиг. 15-20.
Также подготовили следующие варианты эксципиентов и исследовали их при дозе 40 мкг/мл композиции GBS6: 1) 7% (масс./об.) сахарозы, 2) 2% (масс./об.) сахарозы и 4% (масс./об.) маннита, 3) 3% (масс./об.) сахарозы и 3% (масс./об.) маннита, 4) 2% (масс./об.) сахарозы и 4% (масс./об.) глицина или 5) 3% (масс./об.) сахарозы и 3% (масс./об.) глицина. У всех пяти композиций рН и влажность оказались стабильны через 3 месяца нахождения при температуре 5°С, 3 месяца нахождения при температуре 25°С и 1 месяц нахождения при температуре 50°С (результаты не приведены). Кроме того, для каждого серотипа исследовали выраженное в процентах сохранение антигенности во всех композициях через 1, 3 и 7 месяцев при 2-8°С, 25°С и 37°С, а также через 1, 2 и 4 недели при 50°С. Результаты показаны на Фиг. 21-25.
Процент антигена, связанного с адъювантом фосфатом алюминия, в составе вакцины GBS6 в восстановленной лиофилизированной композиции и жидкой композиции исследовали с помощью нефелометрии. Как лиофилизированная, так и жидкая композиции, содержащие 20 мМ гистидина, 0,02% PS80, 7,0% (масс./об.) сахарозы и 500 мкг/мл алюминия в виде фосфата алюминия, были приготовлены в низкой (10 мкг/мл) и высокой (50 мкг/мл) дозах. Также исследовали различные концентрации хлорида натрия (NaCl) для определения влияния на связывание антигена. Результаты для лиофилизированных композиций и жидких композиций приведены в Таблицах 35 и 36, соответственно. Низкодозовые композиции в лиофилизированной и жидкой форме демонстрировали сопоставимые результаты при применении NaCl в концентрациях примерно 150 мМ и выше.
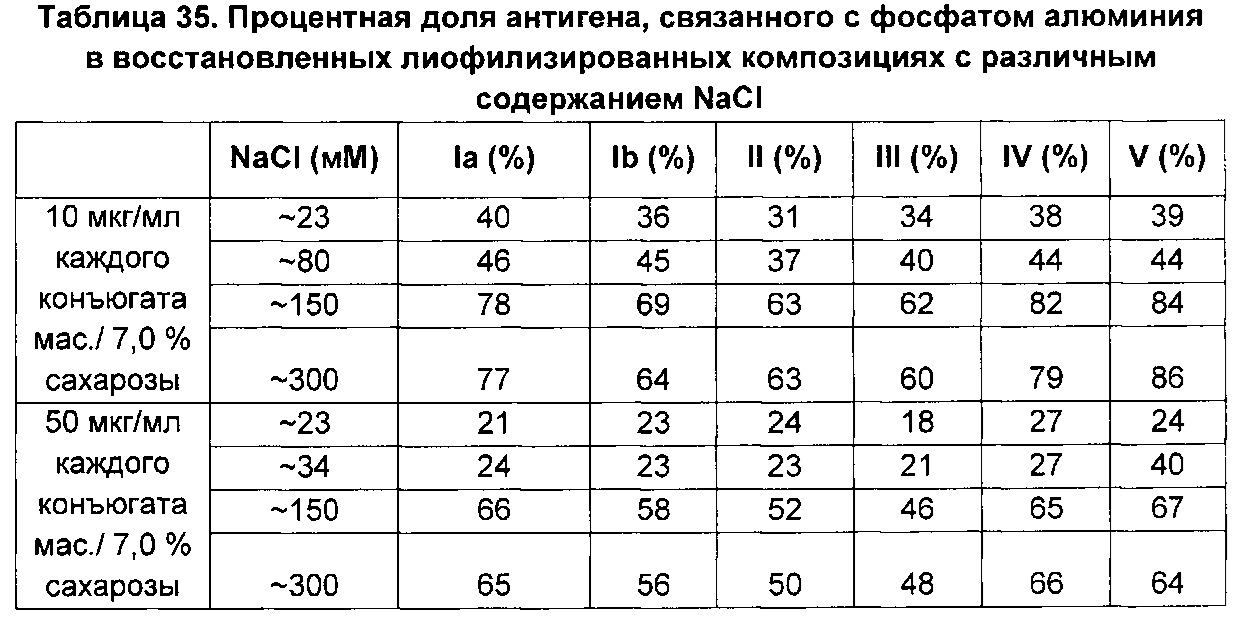
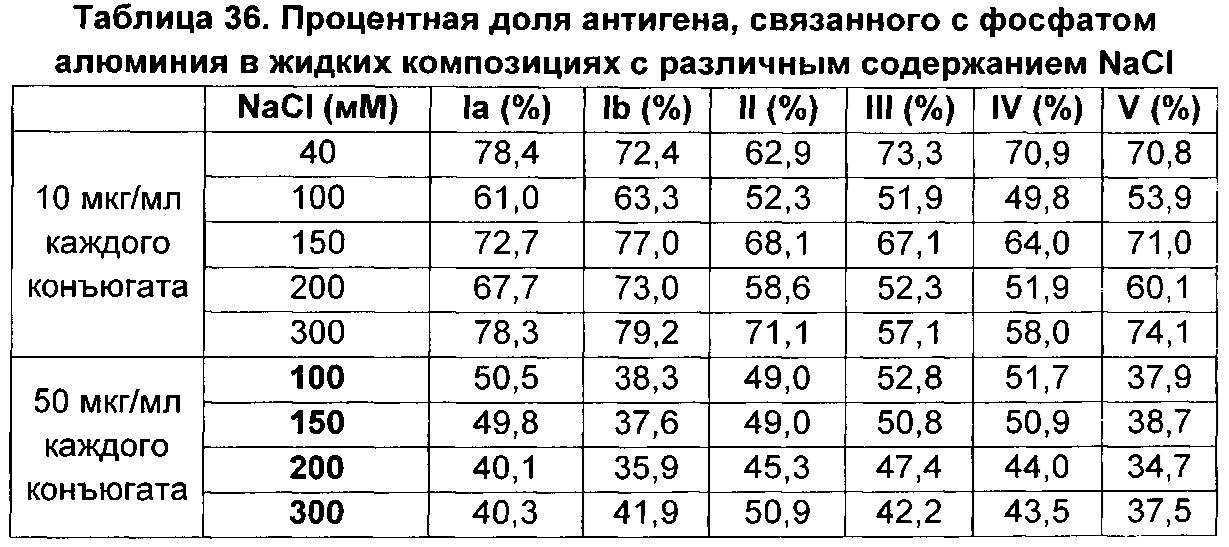
Аспекты изобретения
Ниже перечислены дополнительные воплощения изобретения.
С1. Иммуногенный конъюгат полисахарид-белок, содержащий капсульный полисахарид стрептококка группы В (GBS) и белок-носитель, где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 60%.
С2. Иммуногенный конъюгат по С1, где капсульный полисахарид выбран из группы, состоящей из серотипов Ia, Ib, II, III, IV, V, VI, VII, VIII и IX.
С3. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип Ia.
С4. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип Ib.
С5. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип II.
С6. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип III.
С7. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип IV.
С8. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип V.
С9. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип VI.
С10. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип VII.
С11. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип VIII.
С12. Иммуногенный конъюгат по С2, где капсульный полисахарид имеет серотип IX.
С13. Иммуногенный конъюгат по любому из С1-С12, где капсульный полисахарид имеет уровень сиаловой кислоты выше примерно 95%.
С14. Иммуногенный конъюгат по любому из С1-С13, где капсульный полисахарид имеет уровень сиаловой кислоты примерно 100%.
С15. Иммуногенный конъюгат по любому из С1-С14, где капсульный полисахарид имеет по меньшей мере 0,6 мМ сиаловой кислоты на мМ полисахарида.
С16. Иммуногенный конъюгат по любому из С1-С15, где капсульный полисахарид имеет по меньшей мере 0,65 мМ сиаловой кислоты на мМ полисахарида.
С17. Иммуногенный конъюгат по любому из С1-С16, где капсульный полисахарид имеет по меньшей мере 0,7 мМ сиаловой кислоты на мМ полисахарида.
С18. Иммуногенный конъюгат по любому из С1-С17, где капсульный полисахарид имеет по меньшей мере 0,75 мМ сиаловой кислоты на мМ полисахарида.
С19. Иммуногенный конъюгат по любому из С1-С18, где капсульный полисахарид имеет по меньшей мере 0,8 мМ сиаловой кислоты на мМ полисахарида.
С20. Иммуногенный конъюгат по любому из С1-С19, где капсульный полисахарид имеет по меньшей мере 0,85 мМ сиаловой кислоты на мМ полисахарида.
С21. Иммуногенный конъюгат по любому из С1-С20, где капсульный полисахарид имеет по меньшей мере 0,9 мМ сиаловой кислоты на мМ полисахарида.
С22. Иммуногенный конъюгат по любому из С1-С21, где капсульный полисахарид имеет по меньшей мере 0,95 мМ сиаловой кислоты на мМ полисахарида.
С23. Иммуногенный конъюгат по любому из С1-С22, где капсульный полисахарид имеет молекулярную массу от примерно 5 кДа до примерно 1000 кДа.
С24. Иммуногенный конъюгат по любому из С1-С23, где капсульный полисахарид имеет молекулярную массу от примерно 25 кДа до примерно 750 кДа.
С25. Иммуногенный конъюгат по любому из С1-С24, где капсульный полисахарид имеет молекулярную массу от примерно 25 кДа до примерно 400 кДа.
С26. Иммуногенный конъюгат по любому из С1-С25, где капсульный полисахарид имеет молекулярную массу от примерно 25 кДа до примерно 200 кДа.
С27. Иммуногенный конъюгат по любому из С1-С25, где капсульный полисахарид имеет молекулярную массу от примерно 100 кДа до примерно 400 кДа.
С28. Иммуногенный конъюгат по любому из С1-С27, где молекулярная масса конъюгата составляет от примерно 300 кДа до примерно 20000 кДа.
С29. Иммуногенный конъюгат по любому из С1-С28, где молекулярная масса конъюгата составляет от примерно 1000 кДа до примерно 15000 кДа.
С30. Иммуногенный конъюгат по любому из С1-С29, где молекулярная масса конъюгата составляет от примерно 1000 кДа до примерно 10000 кДа.
С31. Иммуногенный конъюгат по любому из С1-С30, где капсульный полисахарид имеет О-ацетилирование от примерно 0% до примерно 40%.
С32. Иммуногенный конъюгат по любому из С1-С31, где капсульный полисахарид имеет О-ацетилирование менее примерно 5%.
С33. Иммуногенный конъюгат по любому из С1-С32, где капсульный полисахарид имеет О-ацетилирование менее примерно 4%.
С34. Иммуногенный конъюгат по любому из С1-С33, где капсульный полисахарид имеет О-ацетилирование менее примерно 3%.
С35. Иммуногенный конъюгат по любому из С1-С34, где капсульный полисахарид имеет О-ацетилирование менее примерно 2%.
С36. Иммуногенный конъюгат по любому из С1-С35, где капсульный полисахарид имеет О-ацетилирование менее примерно 1%.
С37. Иммуногенный конъюгат по любому из С1-С36, где капсульный полисахарид содержит по меньшей мере 0,1 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С38. Иммуногенный конъюгат по любому из С1-С37, где капсульный полисахарид содержит по меньшей мере 0,2 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С39. Иммуногенный конъюгат по любому из С1-С38, где капсульный полисахарид содержит по меньшей мере 0,3 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С40. Иммуногенный конъюгат по любому из С1-С39, где капсульный полисахарид содержит по меньшей мере 0,35 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С41. Иммуногенный конъюгат по любому из С1-С40, где капсульный полисахарид содержит примерно 0,4 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С42. Иммуногенный конъюгат по любому из С1-С41, где капсульный полисахарид содержит менее примерно 0,01 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С43. Иммуногенный конъюгат по любому из С1-С42, где капсульный полисахарид содержит менее примерно 0,05 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С44. Иммуногенный конъюгат по любому из С1-С43, где капсульный полисахарид содержит менее примерно 0,04 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С45. Иммуногенный конъюгат по любому из С1-С44, где капсульный полисахарид содержит менее примерно 0,03 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С46. Иммуногенный конъюгат по любому из С1-С45, где капсульный полисахарид содержит менее примерно 0,02 мМ О-ацетата на мМ повторяющейся сахаридной единицы.
С47. Иммуногенный конъюгат по любому из С1-С46, где каждый из полисахаридов независимо конъюгирован с белком-носителем.
С48. Иммуногенный конъюгат по любому из С1-С47, где белок-носитель представляет собой CRM197 или столбнячный анатоксин.
С49. Иммуногенный конъюгат по любому из С1-С48, где белок-носитель представляет собой CRM197.
С50. Способ выделения капсульного полисахарида, включающий реакцию органичеого реагента с культуральной средой, содержащей бактерию, продуцирующую капсульный полисахарид.
С51. Способ по С50, где не осуществляют лизис бактерии.
С52. Способ по С50 или С51, где бактерию уничтожают нагреванием.
С53. Способ по любому из С50-С52, где способ дополнительно включает стадию центрифугирования для получения клеточной суспензии.
С53. Способ по любому из С50-С53, где способ дополнительно включает стадию фильтрования.
С55. Способ по С54, где указанная стадия фильтрования представляет собой диафильтрацию.
С56. Способ по любому из С50-С56, где бактерия, продуцирующая капсульный полисахарид, выбрана из группы, состоящей из Streptococcus agalactiae, Streptococcus pneumoniae, Staphylococcus aureus, Neisseria meningitidis, Escherichia coli, Salmonella typhi, Haemophilus influenzae, Klebsiella pneumoniae, Enterococcus faecium и Enterococcus faecalis.
C57. Способ по C56, где бактерия представляет собой Streptococcus agalactiae.
C58. Способ по любому из С50-С57, где указанные органические реагенты являются дериватизированными соединениями гидроксиламина.
С59. Способ по любому из С50-С58, где гидроксиламин представляет собой любой гидроксиламин, указанный в Таблице 2 Примера 2.
С60. Способ по любому из С50-С59, где гидроксиламин выбран из группы, состоящей из дибензил гидроксиламина; диэтилгидроксиламина; гидроксиламина; этилендиамина; триэтилентетрамина; 1,1,4,7,10,10-гексаметилтриэтилентетрамина и 2,6,10-триметил-2,6,10-триазаундекана.
С61. Способ по любому из С50-С60, где концентрация гидроксиламина составляет от примерно 5 мМ до примерно 200 мМ.
С62. Способ по любому из С50-С61, где рН реакции составляет от примерно 5,5 до примерно 9,5.
С63. Способ по любому из С50-С62, где реакция протекает при температуре от примерно 20°С до примерно 85°С.
С64. Способ по любому из С50-С63, где время реакции составляет от примерно 10 часов до примерно 90 часов.
С65. Способ получения иммуногенного конъюгата полисахарида и белка по любому из С1-С49, где капсульный полисахарид выделен способом по любому из С50-С64.
С66. Иммуногенный конъюгат полисахарид-белок, содержащий капсульный полисахарид, полученный способом по любому из С50-С64.
С67. Иммуногенная композиция, содержащая иммуногенный конъюгат полисахарид-белок по любому из С1-С49 или С66.
С68. Иммуногенная композиция, содержащая конъюгаты полисахарид-белок, где конъюгаты содержат капсульные полисахариды стрептококка группы В (GBS) серотипа IV и по меньшей мере одного дополнительного серотипа, выбранного из группы, состоящей из Ia, Ib, II, III, V, VI, VII, VIII и IX.
С68. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой Ia.
С70. Иммуногенная композиция по С69, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа Ib.
С71. Иммуногенная композиция по С69 или С70, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа II.
С72. Иммуногенная композиция по любому из С69-С71, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа III.
С73. Иммуногенная композиция по любому из С69-С72, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа V.
С74. Иммуногенная композиция по любому из С69-С73, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VI.
С75. Иммуногенная композиция по любому из С69-С74, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VII.
С76. Иммуногенная композиция по любому из С69-С75, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С77. Иммуногенная композиция по любому из С69-С76, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С78. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой Ib.
С79. Иммуногенная композиция по С78, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа II.
С80. Иммуногенная композиция по С78 или С79, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа III.
С81. Иммуногенная композиция по любому из С78-С80, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа V.
С82. Иммуногенная композиция по любому из С78-С81, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VI.
С83. Иммуногенная композиция по любому из С78-С82, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VII.
С84. Иммуногенная композиция по любому из С78-С83, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С85. Иммуногенная композиция по любому из С78-С84, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С86. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой II.
С87. Иммуногенная композиция по С86, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа III.
С88. Иммуногенная композиция по С86 или С87, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа V.
С89. Иммуногенная композиция по любому из С86-С88, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VI.
С90. Иммуногенная композиция по любому из С86-С89, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VII.
С91. Иммуногенная композиция по любому из С86-С90, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С92. Иммуногенная композиция по любому из С86-С91, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С93. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой III.
С94. Иммуногенная композиция по С93, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа V.
С95. Иммуногенная композиция по С93 или С94, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VI.
С96. Иммуногенная композиция по любому из С93-С95, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VII.
С97. Иммуногенная композиция по любому из С93-С96, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С98. Иммуногенная композиция по любому из С93-С97, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С99. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой V.
С100. Иммуногенная композиция по С99, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VI.
С101. Иммуногенная композиция по С99 или С100, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VII.
С102. Иммуногенная композиция по любому из С99-С101, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С103. Иммуногенная композиция по любому из С99-С102, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С104. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой VI.
С105. Иммуногенная композиция по С104, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VII.
С106. Иммуногенная композиция по С104 или С105, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С107. Иммуногенная композиция по любому из С104-С106, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С108. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой VII.
С109. Иммуногенная композиция по С108, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа VIII.
С110. Иммуногенная композиция по любому из С108 или С109, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С111. Иммуногенная композиция по С68, где по меньшей мере один дополнительный серотип представляет собой VIII.
С112. Иммуногенная композиция по С111, где композиция дополнительно содержит конъюгат, содержащий капсульный полисахарид GBS серотипа IX.
С113. Иммуногенная композиция по С112, где по меньшей мере один дополнительный серотип представляет собой IX.
С114. Иммуногенная композиция, содержащая конъюгаты полисахарид-белок, где конъюгаты содержат капсульные полисахариды GBS серотипов Ia, Ib, II, III и IV.
С115. Иммуногенная композиция, содержащая конъюгаты полисахарид-белок, где конъюгаты содержат капсульные полисахариды GBS серотипов Ia, Ib, II, III и V.
С116. Иммуногенная композиция, содержащая конъюгаты полисахарид-белок, где конъюгаты содержат капсульные полисахариды GBS серотипов Ia, Ib, II, III, IV и V.
С117. Иммуногенная композиция, содержащая конъюгаты полисахарид-белок, содержащие по меньшей четыре капсульных полисахарида GBS серотипов, выбранных из группы, состоящей из Ia, Ib, II, III, IV, V, VI, VII, VIII и IX.
С118. Иммуногенная композиция по С117, где композиция содержит по меньшей мере пять серотипов капсульных полисахаридов GBS.
С119. Иммуногенная композиция по С117 или С118, где композиция содержит по меньшей мере шесть серотипов капсульных полисахаридов GBS.
С120. Иммуногенная композиция по любому из С117-С119, где композиция содержит по меньшей мере семь серотипов капсульных полисахаридов GBS.
С121. Иммуногенная композиция по любому из С117-С120, где композиция содержит по меньшей мере восемь серотипов капсульных полисахаридов GBS.
С122. Иммуногенная композиция по любому из С117-С121, где композиция содержит по меньшей мере девять серотипов капсульных полисахаридов GBS.
С123. Иммуногенная композиция по любому из С117-С122, где композиция содержит капсульный полисахарид GBS серотипа V.
С124. Иммуногенная композиция по любому из С117-С123, где композиция не демонстрирует иммунной интерференции.
С125. Иммуногенная композиция по любому из С67-С124, где композиция дополнительно содержит фармацевтически приемлемый эксципиент, буфер, стабилизатор, адъювант, криопротектор, соль, двухвалентный катион, неионный детергент, ингибитор свободнорадикального окисления, носитель или их смесь.
С126. Иммуногенная композиция по любому из С67-С125, где композиция дополнительно содержит буфер.
С127. Иммуногенная композиция по С126, где буфер выбран из группы, состоящей из HEPES, PIPES, MES, Tris (триметамин), фосфатного, ацетатного, боратного, цитратного, глицинового, гистидинового и сукцинатного.
С128. Иммуногенная композиция по С127, где буфер представляет собой гистидиновый буфер.
С129. Иммуногенная композиция по любому из С67-С128, где композиция дополнительно содержит поверхностно-активное вещество.
С130. Иммуногенная композиция по С129, где поверхностно-активное вещество выбрано из группы, состоящей из сложных эфиров полиоксиэтиленсорбитана и жирной кислоты, полисорбата-80, полисорбата-60, полисорбата-40, полисорбата-20 и алкиловых эфиров полиоксиэтилена.
С131. Иммуногенная композиция по С130, где поверхностно-активное вещество представляет собой полисорбат-80.
С132. Иммуногенная композиция по любому из С67-С131, где композиция дополнительно содержит эксципиент.
С133. Иммуногенная композиция по С132, где эксципиент выбран из группы, состоящей из крахмала, глюкозы, лактозы, сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита, палатинита, желатина, солода, риса, муки, мела, силикагеля, стеарата натрия, моностеарата глицерина, талька, глицина, аргинина, лизина, хлорида натрия (NaCl), сухого обезжиренного молока, глицерина, пропиленгликоля, воды, этанола.
С134. Иммуногенная композиция по С133, где эксципиент представляет собой хлорид натрия.
С135. Иммуногенная композиция по любому из С67-С134, где композиция дополнительно содержит адъювант.
С136. Иммуногенная композиция по любому из С135, где адъювант представляет собой адъювант на основе алюминия или QS-21.
С137. Иммуногенная композиция по любому из С136, где адъювант на основе алюминия выбран из группы, состоящей из фосфата алюминия, гидроксифосфата алюминия и гидроксида алюминия.
С138. Иммуногенная композиция по любому из С137, где адъювант представляет собой фосфат алюминия.
С139. Иммуногенная композиция по любому из С138, где адъювант представляет собой гидроксифосфат алюминия.
С140. Иммуногенная композиция по любому из С67-С139, где композиция содержит буфер, поверхностно-активное вещество, эксципиент и возможно адъювант, где композиция забуферена до рН от примерно 6,0 до примерно 7,0.
С141. Иммуногенная композиция по любому из С67-С140, где композиция содержит гистидин, полисорбат-80, хлорид натрия и возможно фосфат алюминия, где композиция забуферена до рН от примерно 6,0 до примерно 7,0.
С142. Иммуногенная композиция по любому из С67-С141, где композиция содержит от примерно 10 мМ до примерно 25 мМ гистидина, от примерно 0,01% до примерно 0,03% (об./мас.) полисорбата-80, от примерно 10 мМ до примерно 250 мМ хлорида натрия и возможно от примерно 0,25 мг/мл до примерно 0,75 мг/мл алюминия в виде фосфата алюминия.
С143. Иммуногенная композиция по любому из С67-С142, где композиция содержит дозу от примерно 5 мкг/мл до примерно 50 мкг/мл.
С144. Иммуногенная композиция по любому из С67-С143, где композиция лиофилизирована, возможное присутствии по меньшей мере одного эксципиента.
С145. Иммуногенная композиция по С144, где по меньшей мере один эксципиент выбран из группы, состоящей из крахмала, глюкозы, лактозы, сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита, палатинита, желатина, солода, риса, муки, мела, силикагеля, стеарата натрия, моностеарата глицерина, талька, глицина, аргинина, лизина, хлорида натрия (NaCl), сухого обезжиренного молока, глицерина, пропиленгликоля, воды и этанола.
С146. Иммуногенная композиция по С145, где по меньшей мере один эксципиент представляет собой сахарозу.
С147. Иммуногенная композиция по любому из С144-С146, где композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) по меньшей мере одного эксципиента.
С148. Иммуногенная композиция по любому из С144-С147, где композиция содержит дополнительный эксципиент.
С149. Иммуногенная композиция по С148, где дополнительный эксципиент представляет собой маннит или глицин.
С150. Иммуногенная композиция по С148 или С149, где композиция содержит от примерно 1% (масс./об.) до примерно 10% (масс./об.) дополнительного эксципиента.
С151. Иммуногенная композиция по любому из С143-С150, где композиция разведена водой, водой для инъекций (WFI), суспензией адъюванта или физиологическим раствором.
С152. Иммуногенная композиция по любому из С67-С151 для применения в качестве лекарственного средства.
С153. Иммуногенная композиция по любому из С67-С152 для применения в способе индукции у субъекта иммунного ответа против GBS.
С154. Иммуногенная композиция по С153, где субъектом является женщина, планирующая забеременеть, или беременная женщина.
С155. Иммуногенная композиция по С154, где женщина находится во второй половине беременности.
С156. Иммуногенная композиция по С155, где беременная женщина находится по меньшей мере на 20 неделе беременности.
С157. Иммуногенная композиция по С156, где беременная женщина находится на 27-36 неделе беременности.
С158. Иммуногенная композиция по С157, где субъектом является взрослый в возрасте 50 лет или старше.
С159. Иммуногенная композиция по С158, где субъектом является взрослый в возрасте 65 лет или старше.
С160. Иммуногенная композиция по С159, где субъектом является взрослый в возрасте 85 лет или старше.
С161. Иммуногенная композиция по любому из С153-С160, где субъект имеет ослабленный иммунитет.
С162. Иммуногенная композиция по С161, где субъект имеет патологическое состояние, выбранное из группы, состоящей из ожирения, диабета, ВИЧ-инфекции, рака, сердечно-сосудистого заболевания или заболевания печени.
С163. Иммуногенная композиция по любому из С153-С162, где стрептококк группы В представляет собой Streptococcus agalactiae.
С164. Способ индукции иммунного ответа против стрептококка группы В, включающий введение субъекту эффективного количества иммуногенной композиции по любому из С67-С150.
С165. Способ профилактики или ослабления заболевания или состояния, связанного со стрептококком группы В, у субъекта, включающий введение субъекту эффективного количества иммуногенной композиции по любому из С67-С151.
С166. Способ по С164 или С165, где субъектом является женщина, планирующая забеременеть, или беременная женщина.
С167. Способ по С166, где женщина находится во второй половине беременности.
С168. Способ по С166 или С167, где беременная женщина находится по меньшей мере на 20 неделе беременности.
С169. Способ по любому из С166-С168, где беременная женщина находится на 27-36 неделе беременности.
С170. Способ по С164 или С165, где субъектом является взрослый в возрасте 50 лет или старше.
С171. Способ по С170, где субъектом является взрослый в возрасте 65 лет или старше.
С172. Способ по С170 или С171, где субъектом является взрослый в возрасте 85 лет или старше.
С173. Способ по любому из С164-С171, где субъект имеет ослабленный иммунитет.
С174. Способ по С173, где субъект имеет патологическое состояние, выбранное из группы, состоящей из ожирения, диабета, ВИЧ-инфекции, рака, сердечно-сосудистого заболевания или заболевания печени.
С175. Способ по любому из С164-С174, где стрептококк группы В представляет собой Streptococcus agalactiae.
С176. Антитело, которое связывается с капсульным полисахаридом в составе иммуногенного конъюгата по любому из С1-С49 или С66.
С177. Композиция, содержащая антитело по С176.
С178. Способ получения антитела, включающий введение субъекту иммуногенной композиции по любому из С67-С151.
С179. Антитело, полученное способом по С178.
С180. Способ обеспечения пассивного иммунитета субъекту, включающий стадии:
(а) получения препарата антитела с применением иммуногенной композиции по любому из С67-С151 и
(б) введения препарата антитела субъекту для обеспечения пассивного иммунитета.
С181. Способ получения иммуногенного конъюгата полисахарида и белка по любому из С1-С49 или С66, включающий стадии:
(а) реакции капсульного полисахарида GBS с окисляющим агентом, в результате чего образуется активированный полисахарид, и
(б) реакции активированного полисахарида с белком-носителем, в результате чего образуется конъюгат полисахарида и белка.
С182. Способ по С181, где стадию (б) осуществляют в полярном апротонном растворителе.
С183. Способ по С182, где растворитель выбран из группы, состоящей из диметилсульфоксида (DMSO), сульфолана, диметилформамида (DMF) и гексаметилфосфорамида (НМРА).
С184. Способ по С183, где растворитель представляет собой диметилсульфоксид (DMSO).
С185. Способ по любому из С181-С184, где полисахарид вступает в реакцию с 0,01-10,0 молярными эквивалентами окисляющего агента.
С186. Способ по любому из С181-С185, где окисляющий агент представляет собой периодат.
С187. Способ по С186, где периодат представляет собой периодат натрия.
С188. Способ по любому из С181-С187, где реакция окисления стадии (а) составляет от 1 часа до 50 часов.
С189. Способ по любому из С181-С188, где температуру реакции окисления поддерживают между примерно 2°С и примерно 25°С.
С190. Способ по любому из С181-С189, где реакция окисления протекает в буфере, выбранном из группы, состоящей из фосфата натрия, фосфата калия, 2-(N-морфолино)этансульфоновой кислоты (MES) и Bis-Tris.
С191. Способ по С190, где буфер имеет концентрацию от примерно 1 мМ до примерно 500 мМ.
С192. Способ по любому из С181-С191, где реакция окисления протекает при рН от примерно 4,0 до примерно 8,0.
С193. Способ по С181, где окисляющий агент представляет собой 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO).
С194. Способ по С193, где N-хлорсукцинимид (NCS) представляет собой соокислитель.
С195. Способ по любому из С181-С194, где стадия (а) дополнительно включает остановку реакции окисления путем добавления агента-гасителя.
С196. Способ по любому из С182-С195, где концентрация полисахарида составляет от примерно 0,1 мг/мл до примерно 10,0 мг/мл.
С197. Способ по любому из С181-С196, где степень окисления (DO) активированного полисахарида составляет от 5 до 25.
С198. Способ по любому из С181-С197, где способ дополнительно включает стадию лиофилизации активированного полисахарида.
С199. Способ по С188, где активированный полисахарид лиофилизируют в присутствии сахарида, выбранного из группы, состоящей из сахарозы, трегалозы, раффинозы, стахиозы, мелицитозы, декстрана, маннита, лактита и палатинита.
С200. Способ по любому из С181-С199, где стадия (б) включает:
(1) приготовление смеси активированного полисахарида с белком-носителем и
(2) реакцию приготовленной смеси активированного полисахарида и белка-носителя с восстанавливающим агентом для образования конъюгата капсульного полисахарида GBS и белка.
С201. Способ по С20, где концентрация активированного полисахарида на стадии (2) составляет от примерно 0,1 мг/мл до примерно 10,0 мг/мл.
С202. Способ по С200 или С201, где исходное соотношение (массы к массе) активированного полисахарида и белка-носителя составляет от 5:1 до 0,1:1.
С203. Способ по любому из С200-С202, где восстанавливающий агент выбран из группы, состоящей из цианборгидрида натрия, триацетоксиборгидрида натрия, боргидрида натрия или цинка в присутствии кислот Брёнстеда или Льюиса, пиридинборана, 2-пиколинборана, 2,6-диборан-метанола, диметиламин-борана, t-BuMeiPrN-BH3, бензиламин-ВН3 или 5-этил-2-метилпиридинборана (РЕМВ).
С204. Способ по С203, где восстанавливающий агент представляет собой цианборгидрид натрия.
С205. Способ по любому из С200-С204, где количество восстанавливающего агента составляет от примерно 0,1 до примерно 10,0 молярных эквивалентов.
С206. Способ по любому из С200-С205, где продолжительность реакции стадии (2) составляет от 1 часа до 60 часов.
С207. Способ по любому из С200-С206, где температуру в ходе реакции восстановления поддерживают между 10°С и 40°С.
С208. Способ по любому из С200-С207, где способ дополнительно включает стадию (стадию (в)) блокирования непрореагировавшего альдегида посредством добавления боргидрида.
С209. Способ по С208, где количество боргидрида составляет от примерно 0,1 до примерно 10,0 молярных эквивалентов.
С210. Способ по С208, где боргидрид выбран из группы, состоящей из боргидрида натрия (NaBH4), цианборгидрида натрия, боргидрида лития, боргидрида калия, боргидрида тетрабутиламмония, боргидрида кальция и боргидрида магния.
С211. Способ по С292, где боргидрид представляет собой боргидрид натрия (NaBH4).
С212. Способ по любому из С207-С211, где продолжительность стадии блокирования составляет от 0,1 часа до 10 часов.
С213. Способ по любому из С207-С212, где температуру стадии блокирования поддерживают между примерно 15°С и примерно 45°С.
С214. Способ по любому из С181-С213, где способ дополнительно включает стадию очистки конъюгата полисахарида и белка.
С215. Способ по любому из С181-С214, где конъюгат полисахарида и белка содержит менее примерно 40% свободного полисахарида относительно общего количества полисахарида.
С216. Способ по любому из С181-С215, где соотношение (по массе) полисахарида и белка-носителя в конъюгате составляет от примерно 0,5 до примерно 3,0.
С217. Способ по любому из С181-С216, где степень конъюгации конъюгата составляет от 2 до 15.
С218. Способ приготовления конъюгата полисахарид-белок, включающий стадии:
(а) реакции выделенного капсульного полисахарида GBS с окисляющим агентом;
(б) остановки реакции окисления стадии (а) путем добавления агента-гасителя с получением активированного капсульного полисахарида GBS;
(в) приготовления смеси активированного капсульного полисахарида GBS с белком-носителем,
(г) реакции приготовленной смеси активированного капсульного полисахарида GBS и белка-носителя с восстанавливающим агентом с образованием конъюгата капсульного полисахарида GBS и белка-носителя, и
(д) блокирования непрореагировавшего альдегида посредством добавления боргидрида натрия (NaBH4),
где стадии (в) и (г) осуществляют в DMSO.