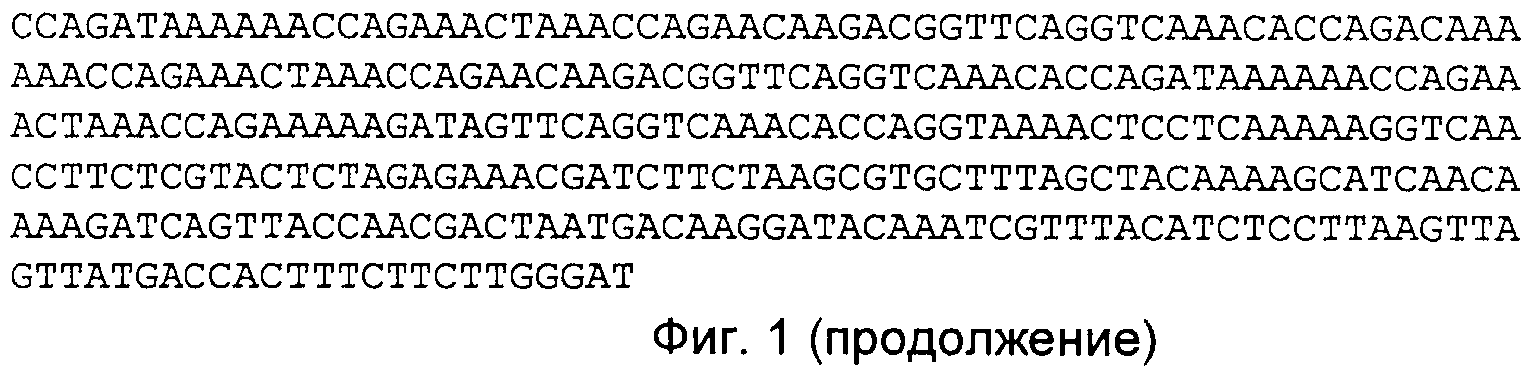Результат интеллектуальной деятельности: МНОГОКОМПОНЕНТНАЯ ИММУНОГЕННАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЯ, ВЫЗВАННОГО β-ГЕМОЛИТИЧЕСКИМИ СТРЕПТОКОККАМИ (БГС)
Вид РИД
Изобретение
Область изобретения
Это изобретение в целом относится к полипептидам и полинуклеотидам β-гемолитических стрептококков (БГС), в частности полипептидам и полинукпеотидам Streptococcus pyogenes, и их применению в многокомпонентных иммуногенных композициях для предупреждения заболевания, вызванного БГС. Более конкретно, изобретение относится к полипептидам Streptococcus pyogenes, которые локализованы на поверхности. Изобретение дополнительно относится к иммуногенным композициям и способам иммунизации против инфекции, вызванной β-гемолитическими стрептококками, и ослабления такой инфекции, включающим комбинацию двух или более полипептидов.
Предшествующий уровень техники
Традиционные фенотипические критерии классификации стрептококков включают как гемолитические реакции, так и серологическое типирование по Лэнсфилд. Однако с развитием таксономии стало известно, что неродственные виды β-гемолитических (определяемых по полному лизису эритроцитов овец на чашках с агаром) стрептококков (БГС) могут продуцировать идентичные антигены по Лэнсфилд, и что штаммы, генетически родственные на уровне вида, могут иметь гетерогенные антигены по Лэнсфилд. Несмотря на эти исключения из традиционных правил таксономии стрептококков, гемолитические реакции и серологические тесты по Лэнсфилд все еще могут быть использованы для разделения стрептококков на основные группы в качестве первой стадии при идентификации клинических изолятов (Ruoff, K.L, R.A.Whiley, and D. Beighton. 1999. Streptococcus. In P.R.Murray, E.J.Baron, M.A.Pfaller, F.C.Tenover, and R.H.Yolken (eds.), Manual of Clinical Microbiology. American Society of Microbiology Press, Washington D.C.).
Изоляты β-гемолитического стрептококка с групповыми антигенами А, С или G по Лэнсфилд могут быть подразделены на две группы: микроорганизмы, образующие крупные колонии (>0,5 мм в диаметре) и мелкие колонии (<0,5 мм в диаметре). Образующие крупные колонии штаммы групп A (Streptococcus pyogenes), С и G являются "пиогенными" стрептококками с множеством эффективных механизмов вирулентности. Streptococcus agalactiae (группа В) достоверно идентифицируют еще по продуцированию им группового антигена В по Лэнсфилд или по другим фенотипическим особенностям.
Сходства между видами БГС включают не только факторы вирулентности, но также и проявления заболеваний. Последние включают пневмонию, артрит, абсцессы, ринофарингит, метрит, послеродовой сепсис, неонатальную септицемию, раневые инфекции, менингит, перитонит, целлюлит, пиодермию, некротизирующий фасцит, синдром токсического шока, септицемию, инфекционный эндокардит, перикардит, гломерулонефрит и остеомиелит.
Streptococcus pyogenes являются грамположительными диплококками, которые колонизируют глотку и кожу людей, участки, которые затем служат первичным резервуаром для этого организма. Как облигатный паразит эта бактерия переносится либо посредством прямого контакта с респираторными секретами, либо по схеме из рук в рот. Большинство инфекций, вызванных Streptococcus pyogenes, являются сравнительно легкими заболеваниями, такими как фарингит или импетиго. В настоящее время зафиксировано от двадцати до тридцати пяти миллионов случаев фарингита только в США, обходящихся примерно в 2 миллиарда долларов, затрачиваемых на визиты врачей и другие связанные с этим расходы. Кроме того, негнойные осложнения, такие как ревматическая лихорадка, скарлатина и гломерулонефрит, являются результатом инфекций, вызванных Streptococcus pyogenes. В мировом масштабе острая ревматическая лихорадка (ОРЛ) является самой распространенной причиной детской болезни сердца (1997. Case definitions for Infectious Conditions Under Public Health Surveillance. CDC.).
Из первоначальных входных ворот, глотки и кожи, Streptococcus pyogenes может диссеминировать в другие части организма, где бактерии обычно не встречаются, например, кровь, глубокая мышечная и жировая ткань или легкие, и может вызывать инвазивные инфекции. Две из наиболее тяжелых, но наименее распространенных форм инвазивного заболевания, вызванного Streptococcus pyogenes, представляют собой некротизирующий фасцит и синдром стрептококкового токсического шока (ССТШ). Некротизирующий фасцит (описанный в средствах массовой информации как вызываемый "плотоядными бактериями") представляет собой деструктивную инфекцию мышечной и жировой ткани. ССТШ представляет собой быстро прогрессирующую инфекцию, вызывающую шок и повреждение внутренних органов, таких как почки, печень и легкие. Большая часть этого повреждения происходит в результате токсемии, а не локального повреждения вследствие бактериального роста.
В 1995 инвазивные инфекции, вызванные Streptococcus pyogenes, и ССТШ стали заболеваниями, подлежащими обязательной регистрации. В отличие от миллионов индивидуумов, которые заболевают фарингитом и импетиго, отчет центров по контролю и профилактике заболеваний в США (CDC) о регистрируемых случаях показывает, что в 1997 году зарегистрировано от 15000 до 20000 случаев инвазивного заболевания, вызванного Streptococcus pyogenes, в Соединенных Штатах, приводя к более чем 2000 случаев со смертельным исходом (1997. Case definitions for Infectious Conditions Under Public Health Surveillance. CDC.). В других отчетах подсчитано, что инвазивное заболевание составляет до 10-20 случаев на 100000 индивидуумов в год (Stevens, D.L. 1995. Streptococcal toxic-shock syndrome: spectrum of disease, pathogenesis, and new concepts in treatment. Emerg Infect Dis. 1:69-78). Более конкретно, из 15000-20000 случаев инвазивного заболевания 1100-1500 являются случаями некротизирующего фасцита и 1000-1400 являются случаями ССТШ, с коэффициентом смертности 20% и 60% соответственно. Также в тяжелое инвазивное заболевание включены случаи миозита, который приводит к коэффициенту смертности от 80% до 100%. Дополнительные 10%-15% индивидуумов умирают от других форм инвазивного заболевания, вызванного стрептококками группы А. Эти числа возросли с 1995 года, когда были введены отчеты о случаях заболевания, и отражают общую тенденцию, которая имеет место на протяжении последнего десятилетия или двух. Кроме того, по общему мнению, строгость критериев при выявлении случаев заболевания приводит к заниженному и, таким образом, ошибочному числу, поскольку многие случаи успешно разрешаются благодаря ранней диагностике и лечению до того, как проведена идентификация.
Хотя Streptococcus pyogenes остается чувствительным к пенициллину и его производным, лечение не всегда уничтожает этот организм. Приблизительно от 5% до 20% населения являются носителями в зависимости от сезона (Stevens, D.L. 1995. Streptococcal toxic-shock syndrome: spectrum of disease, pathogenesis, and new concepts in treatment. Emerg Infect Dis. 1:69-78), несмотря на антибиотикотерапию. Причины этого не вполне ясны и могут включать множество механизмов. В случаях тяжелых инвазивных инфекций лечение часто требует агрессивного оперативного вмешательства. Для этих случаев, включающих ССТШ или родственное заболевание, клиндамицин (ингибитор синтеза белка) является предпочтительным антибиотиком, так как он хорошо проникает в ткани и предотвращает выработку экзотоксина. Имеются сообщения о некоторой резистентности к тетрациклину, сульфамидным препаратам и, совсем недавно, эритромицину. Очевидно, что остается потребность в композициях для предупреждения и лечения инфекции, вызванной бета-гемолитическим стрептококком.
Идентифицированы многочисленные факторы вирулентности Streptococcus pyogenes, некоторые секретируемые, а некоторые локализованы на поверхности. Хотя он инкапсулирован, капсула состоит из гиалуроновой кислоты и не подходит в качестве антигена-кандидата для включения в иммуногенные композиции, так как обычно экспрессируется клетками млекопитающих и является неиммуногенной (Dale, J.В., R.G.Washburn, M.В.Marques, and M.R.Wessels. 1996. Hyaluronate capsule and surface M protein in resistance to opsonization of group A streptococci. Infect Immun. 64:1495-501). T-антиген и групповой углевод являются другими кандидатами, но могут также вызывать образование перекрестных антител к ткани сердца. Липотейхоевая кислота присутствует на поверхности Streptococcus pyogenes, но индуцирует факторы опасности аналогичные ЛПС (липополисахариду).
Наиболее распространенные поверхностные белки принадлежат к семейству белков, называемых М или «М-подобные» белки из-за их структурного сходства. Хотя члены этого класса имеют сходные биологические роли в ингибировании фагоцитоза, каждый из них обладает уникальными свойствами субстратного связывания. Наиболее охарактеризованным белком этого семейства является спиральный М-белок. Было показано, что антитела к гомологичным М штаммам являются опсоническими и защитными (Dale, J.В., R.W.Baird, H.S.Courtney, D.L.Hasty, and М.S.Bronze. 1994. Passive protection of mice against group A streptococcal pharyngeal infection by lipoteichoic acid. J Infect Dis. 169:319-23, Dale, J.В., М.Simmons, E.C.Chiang, and E.Y.Chiang. 1996. Recombinant, Ellen, R.P., and R.J.Gibbons. 1972. M protein-associated adherence of Streptococcus pyogenes to epithelial surfaces: prerequisite for virulence. Infect Immun. 5:826-830). Сложность использования М-белка в качестве антигена-кандидата состоит в том, что существует приблизительно 100 различных идентифицированных серотипов по М-белку при еще нескольких нетипированных. Типично, М-серотипы класса I, представленные серотипами М1, М3, М6, М12 и М18, ассоциированы с фарингитом, скарлатиной и ревматической лихорадкой и не экспрессируют белки, связывающие иммуноглобулины. М-серотипы класса II, такие как М2 и М49, ассоциированы с кожными инфекциями более распространенной локализации и осложнениями гломерулонефрита и экспрессируют белки, связывающие иммуноглобулины (Podbielski, A., A.Flosdorff, and J.Weber-Heynemann. 1995. The group A streptococcal virR49 gene controls expression of four structural vir regulon genes. Infect Immun. 63:9-20). Важно отметить, что существует небольшая, если вообще существует, гетерологичная перекрестная реактивность антител к М-серотипам. Не менее важна и та роль, которую эти антитела играют при ревматической лихорадке. Специфические участки М-белка вызывают образование антител, которые перекрестно реагируют с тканью сердца хозяина, вызывая или по меньшей мере внося вклад в повреждение клеток (Cunningham, М.W., and A. Quinn. 1997. Immunological crossreactivity between the class I epitope of streptococcal M protein and myosin. Adv Exp Med Biol. 418:887-921, Quinn, A., K Ward, V.A.Fischetti, M.Hemric, and M.W.Cunningham. 1998. Immunological relationship between the class I epitope of streptococcal M protein and myosin. Infect Immun. 66:4418-24).
M и М-подобные белки принадлежат большому семейству поверхностных белков, которые характеризуются специфичным к сортазе мотивом LPXTG (Mazmanian, S.К., G.Liu, H.Ton-That, and O.Schneewind. 1999. Staphylococcus aureus sortase, an enzyme that anchors surface proteins to the cell wall. Science. 285:760-3, Ton-That, H., G.Liu, S.K.Mazmanian, K.F.Faull, and O.Schneewind. 1999. Purification and characterization of sortase, the transpeptidase that cleaves surface proteins of Staphylococcus aureus at the LPXTG motif. Proc Natl Acad Sci USA. 96:12424-12429). Этот мотив, расположенный вблизи карбокси-конца белка, сначала расщепляется сортазой между треониновым и глициновым остатками мотива LPXTG. Сразу после расщепления белок ковалентно присоединяется через карбоксильную группу треонина к свободной аминогруппе аминокислотного поперечного мостика в пептидогликане, тем самым происходит необратимое присоединение белка к поверхности бактериальной клетки. В это семейство специфичных к сортазе белков включены: пептидаза С5а (Chen, С.С., and P.P.Cleary. 1989. Cloning and expression of the streptococcal С5а peptidase gene in Escherichia соli: linkage to the type 12 M protein gene. Infect. Immun. 57:1740-1745, Chmouryguina, I., A.Suvorov, P.Ferrieri, and P.P.Cleary. 1996. Conservation of the С5а peptidase genes in group A and В streptococci. Infect. Immun. 64:2387-2390), адгезины для фибронектина (Courtney, H.S., Y.Li, J.B.Dale, and D.L.Hasty. 1994. Cloning, sequencing, and expression of a fibronectin/fibrinogen-binding protein from group A streptococci. Infect Immun. 62:3937-46, Fogg, G.C., and M.G.Caparon. 1997. Constitutive expression of fibronectin binding in Streptococcus pyogenes as a result ofanaerobic activation of rofA. J Bacteriol. 179:6172-80, Hanski, E., and M. Caparon. 1992. Protein F, a fibronectin-binding protein, is an adhesion of the group A streptococcus Streptococcus pyogenes. Proc Natl Acad Sci., USA. 89:6172-76, Hanski, E., P.A.Horwitz, and M.G.Caparon. 1992. Expression of protein F, the fibronectin-binding protein of Streptococcus pyogenes JRS4, in heterologous streptococcal and enterococcal strains promotes their adherence to respiratory epithelial cells. Infect Immun. 60:5119-5125), витронектин и коллаген IV типа, и другие М-подобные белки, которые связывают плазминоген, IgA (иммуноглобулин A), IgG (иммуноглобулин G) и альбумин (Kihiberg, В.M., M. Collin, A. Olsen, and L. Bjorck. 1999. Protein H, an antiphagocytic surface protein in Streptococcus pyogenes. Infect Immun. 67:1708-14).
Описаны многочисленные секретируемые белки, некоторые из которых, как считают, являются токсинами. Большинство изолятов Streptococcus pyogenes от больных с тяжелым инвазивным заболеванием и синдромом стрептококкового токсического шока (ССТШ) продуцируют стрептококковые пиогенные экзотоксины (SPE) А и С (Cockerill, F.R., 3rd, R.L.Thompson, J.M.Musser, Р.M.Schlievert, J.Talbot, K.E.Holley, W.S.Harmsen, D.M.llstrup, P.C.Kohner, M.H.Kirn, B.Frankfort, J.M.Manahan, J.M.Steckelberg, F.Roberson, and W.R.Wilson. 1998. Molecular, serological, and clinical features of 16 consecutive cases of invasive streptococcal disease. Southeastern Minnesota Streptococcal Working Group. Clin Infect Dis. 26:1448-58). Также были идентифицированы и охарактеризованы другие пиогенные экзотоксины в геномной последовательности Streptococcus pyogenes, расшифрованной в университете Оклахомы, переданной в банк генов GenBank и которой присвоен номер доступа АЕ004092 (Proft, Т., S. Louise Moffatt, С.J. Berkahn, and J. D. Fraser. 1999. Identification and Characterization of Novel Superantigens from Streptococcus pyogenes. J Exp Med. 189:89-102). Другие токсины, такие как токсин, вызывающий стрептококковый токсический шокоподобный синдром, стрептококковый суперантиген (Reda, K.В., V.Kapur, D.Goela, J.G.Lamphear, J.M.Musser, and R.R.Rich. 1996. Phylogenetic distribution of streptococcal superantigen SSA allelic variants provides evidence for horizontal transfer of ssa within Streptococcus pyogenes. Infect Immun. 64:1161-5) и митогенный фактор (Yutsudo, Т., K.Okumura, M.Iwasaki, А.Наrа, S.Kamitani, W.Minamide, H.Igarashi, and Y.Hinuma. 1994. The gene encoding a new mitogenic factor in a Streptococcus pyogenes strain is distributed only in group A streptococci. Infection and Immunity. 62:4000-4004), играют менее определенные роли при заболевании. Стрептолизин О также можно считать возможным антигеном-кандидатом, поскольку он вызывает высвобождение интерлейкина IL-β. Кроме того, также идентифицировано множество секретируемых ферментов, которые включают цистеиновую протеазу (Lukomski, S., С.A.Montgomery, J.Rurangirwa, R.S.Geske, J.P.Barrish, G.J.Adams, and J.M.Musser. 1999. Extracellular cysteine protease produced by Streptococcus pyogenes participates in the pathogenesis of invasive skin infection and dissemination in mice. Infect Immun. 67:1779-88, Matsuka, Y.V., S.Pillai, S.Gubba, J.M.Musser, and S.B.Olmsted. 1999. Fibrinogen cleavage by the Streptococcus pyogenes extracellular cysteine protease and generation of antibodies that inhibit enzyme proteolytic activity. Infect Immun. 67:4326-33), стрептокиназу (Huang, Т.Т., Н.Maike, and J.J.Ferretti. 1989. The streptokinase gene of group A streptococci: cloning, expression in Escherichia соli, and sequence analysis. Mol Microbiol. 3:197-205, Nordstrand, A., W.M.McShan, J.J.Ferretti, S.E.Holm, and M.Norgren. 2000. Allele substitution of the streptokinase gene reduces the nephritogenic capacity of group A streptococcal strain NZ131. Infect Immun. 68:1019-25) и гиалуронидазу (Hynes, W.L, A.R.Dixon, S.L.Walton, and L.J.Aridgides. 2000. The extracellular hyaluronidase gene (hylA) of Streptococcus pyogenes. FEMS Microbiol Lett. 184:109-12, Hynes, W.L., L.Hancock, and J.J.Ferretti. 1995. Analysis of a second bacteriophage hyaluronidase gene from Streptococcus pyogenes: evidence for a third hyaluronidase involved in extracellular enzymatic activity. Infect Immun. 63:3015-20).
Принимая во внимание количество известных факторов вирулентности, продуцируемых Streptococcus pyogenes, ясно, что важной характерной особенностью эффективной иммуногенной композиции (3-гемолитических стрептококков должна быть ее способность стимулировать ответную реакцию, которая будет предотвращать или ограничивать колонизацию на ранних стадиях инфекционного процесса. Эта защитная реакция должна или блокировать адгезию, и/или увеличивать клиренс клеток посредством опсонофагоцитоза. Показано, что антитела к М-белку являются опсоническими и обуславливают механизм преодоления антифагоцитарных свойств белка (Jones, K.F., and V.A.Fischetti. 1988. The importance of the location of antibody binding on the M6 protein for opsonization and phagocytosis of group A M6 streptococci. J Exp Med. 167:1114-23) примерно таким же способом, каким капсулярные антитела против серотипа В демонстрируют защиту от заболевания, вызванного Haemophilus influenzae В (Madore, D.V. 1998. Characterization of immune response as an indicator of Haemophilus influenzae type b vaccine efficacy. Pediatr Infect Dis J. 17:3207-10). Кроме того, показано, что антитела, специфичные к белку F, блокируют адгезию и интернализацию клетками культуры ткани (Molinari, G., S.R.Talay, P.Valentin-Weigand, M.Rohde, and G.S. Chhatwal. 1997. The fibronectin-binding protein of Streptococcus pyogenes, Sfbl, is involved in the internalization of group A streptococci by epithelial cells. Infect Immun. 65:1357-63).
Остается потребность в разработке иммуногенных композиций и способов для предупреждения или уменьшения симптомов инфекций, вызванных β-гемолитическими стрептококками, включая группы А, В, С и G. Также остается потребность в создании иммуногенных композиций, которые обеспечивают иммунитет к широкому спектру бактерий БГС.
Краткое изложение сущности изобретения
Исходя из этих и других потребностей и учитывая задачи изобретения согласно настоящему изобретению предложены иммуногенные композиции для защиты восприимчивых млекопитающих от колонизации или инфицирования β-гемолитическими стрептококками, включая стрептококки группы А, В, С и/или D, в том числе стрептококки вида Streptococcus pyogenes. Эти иммуногенные композиции содержат смесь двух или более полипептидов, которые описаны ниже более подробно. Согласно изобретению также предложены способы предупреждения или уменьшения симптомов такой колонизации у восприимчивого млекопитающего путем введения эффективного количества иммуногенной композиции для выработки антител к специфическим полипептидам, содержащимся в иммуногенной композиции. Согласно изобретению дополнительно предложены полипептиды и полинуклеотиды Streptococcus pyogenes, рекомбинантные вещества и способы их получения. Другой аспект изобретения относится к способам применения таких полипептидов и полинуклеотидов Streptococcus pyogenes. Полипептиды и полинуклеотиды могут также быть использованы в производстве лекарственного средства для предупреждения или уменьшения симптомов инфекции, вызванной β-гемолитическими стрептококками.
Полипептиды, используемые в иммуногенных композициях по изобретению, включают выделенные полипептиды, содержащие по меньшей мере одну аминокислотную последовательность согласно любой из Фиг.2, 4, 6, 8 или 10. Изобретение также включает аминокислотные последовательности, которые имеют по меньшей мере 90% идентичность любой из вышеприведенных аминокислотных последовательностей, и их зрелые полипептиды. Изобретение дополнительно включает иммуногенные фрагменты и биологические эквиваленты этих полипептидов. Также предложены антитела, которые иммуноспецифически связываются с полипептидами по изобретению.
Полинуклеотиды по изобретению включают выделенные полинуклеотиды, которые содержат нуклеотидные последовательности, которые кодируют полипептид по изобретению. Эти полинуклеотиды включают выделенные полинуклеотиды, содержащие по меньшей мере одну нуклеотидную последовательность согласно любой из Фиг.1, 3, 5, 7 или 9, и также включают другие нуклеотидные последовательности, которые в результате вырожденности генетического кода также кодируют полипептид по изобретению. Изобретение также включает выделенные полинуклеотиды, содержащие нуклеотидную последовательность, которая имеет по меньшей мере 90% идентичность нуклеотидной последовательности, которая кодирует полипептид по изобретению, и выделенные полинуклеотиды, содержащие нуклеотидную последовательность, которая имеет по меньшей мере 90% идентичность любой из вышеприведенных нуклеотидных последовательностей. Кроме того, выделенные полинуклеотиды по изобретению включают нуклеотидные последовательности, которые гибридизуются в строгих условиях гибридизации с нуклеотидной последовательностью, которая кодирует полипептид по изобретению, нуклеотидные последовательности, которые гибридизуются в строгих условиях гибридизации с нуклеотидной последовательностью любой из вышеприведенных последовательностей, и нуклеотидные последовательности, которые полностью комплементарны этим полинуклеотидам. Кроме того, изобретение включает экспрессирующие векторы и клетки-хозяева, содержащие эти полинуклеотиды.
Согласно изобретению также предложены иммуногенные композиции, которые содержат иммуногенное количество по меньшей мере двух или более компонентов (выбранных из SCP (Фиг.2 (SEQ ID NO:2)) и пептидов, кодируемых открытой рамкой считывания (ОРС) 554 (пептидилпропилизомераза (Фиг.4 (SEQ ID NO:4)), ОРС 1218 (гипотетический белок (Фиг.6 (SEQ ID NO:6)), ОРС 1358 (предполагаемый адгезивный белок (Фиг.8 (SEQ ID NO:8)) и ОРС 2459 (поверхностный липопротеин (Фиг.10 (SEQ ID NO:10)), каждый из которых содержит полипептид по изобретению в количестве, эффективном для предупреждения или уменьшения симптомов β-гемолитической стрептококковой колонизации или инфекции у восприимчивого млекопитающего. Каждый компонент может содержать сам полипептид или может содержать полипептид и любое другое вещество (например один или более чем один химический агент, белок и так далее), которое может помочь в предупреждении и/или уменьшении симптомов β-гемолитической стрептококковой колонизации или инфекции. Эти иммуногенные композиции могут дополнительно содержать по меньшей мере часть полипептида, возможно конъюгированного или связанного с пептидом, полипептидом или белком или с полисахаридом.
Изобретение также включает способы защиты восприимчивого млекопитающего от β-гемолитической стрептококковой колонизации или инфекции. В одном воплощении способ включает введение млекопитающему эффективного количества двух- или более компонентной иммуногенной композиции, содержащей иммуногенное количество полипептида по изобретению, которое эффективно для предупреждения или уменьшения симптомов β-гемолитической стрептококковой колонизации или инфекции у восприимчивого млекопитающего. Такие комбинации компонентов, как было обнаружено, эффективны для обеспечения такой защиты для широкого диапазона групп и обычно обеспечивают более сильный иммунный ответ, чем отдельные компоненты, вводимые раздельно. Иммуногенные композиции по изобретению могут быть введены любым обычным путем, например посредством подкожной или внутримышечной инъекции, перорального приема или интраназально.
Согласно изобретению дополнительно предложены иммуногенные композиции. В одном воплощении иммуногенная композиция содержит по меньшей мере один полипептид по изобретению. В другом воплощении иммуногенная композиция содержит по меньшей мере один полинуклеотид по изобретению.
Следует понимать, что вышеприведенное общее описание и последующее подробное описание являются иллюстративными, а не ограничивающими изобретение.
Краткое описание графических материалов
На Фиг.1 представлена последовательность нуклеиновых кислот, кодирующая пептидазу С5а ("SCP"; SEQ ID NO:1).
На Фиг.2 представлена аминокислотная последовательность SCP (SEQ ID NO:2).
На Фиг.3 представлена последовательность нуклеиновых кислот ОРС 554, кодирующая пептидилпропилизомеразу (SEQ ID NO:3).
На Фиг.4 представлена аминокислотная последовательность пептидилпропилизомеразы (SEQ ID NO:4),
На Фиг.5 представлена последовательность нуклеиновых кислот ОРС 1218, кодирующая гипотетический белок (SEQ ID NO:5).
На Фиг.6 представлена аминокислотная последовательность гипотетического белка (SEQ ID NO:6).
На Фиг.7 представлена последовательность нуклеиновых кислот ОРС 1358, кодирующая предполагаемый адгезивный белок (SEQ ID NO:7).
На Фиг.8 представлена аминокислотная последовательность предполагаемого адгезивного белка (SEQ ID NO:8).
На Фиг.9 представлена последовательность нуклеиновых кислот ОРС 2459, кодирующая поверхностный липопротеин (SEQ ID NO:9).
На Фиг.10 представлена аминокислотная последовательность поверхностного липопротеина (SEQ ID NO:10).
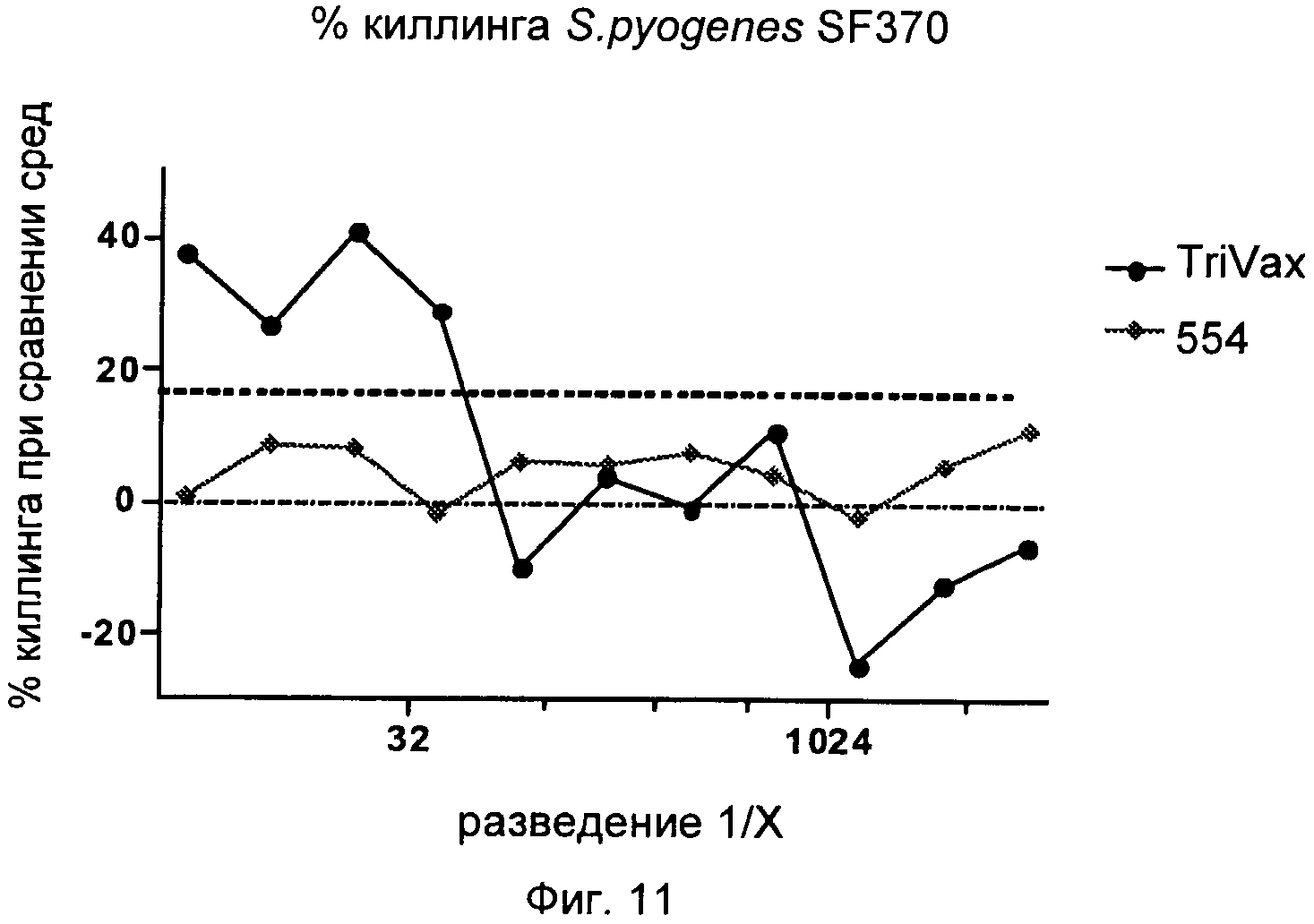
На Фиг.11 графически представлен процент киллинга при сравнении сред трехкомпонентной ("Trivax" означает SCP, пептидилпропилизомеразу (ОРС 554) и предполагаемый адгезивный белок (ОРС 1358)) и однокомпонентной ("554" означает пептидилпропилизомеразу (ОРС 554)) иммуногенных композиций, исследуемых в Примере 2.
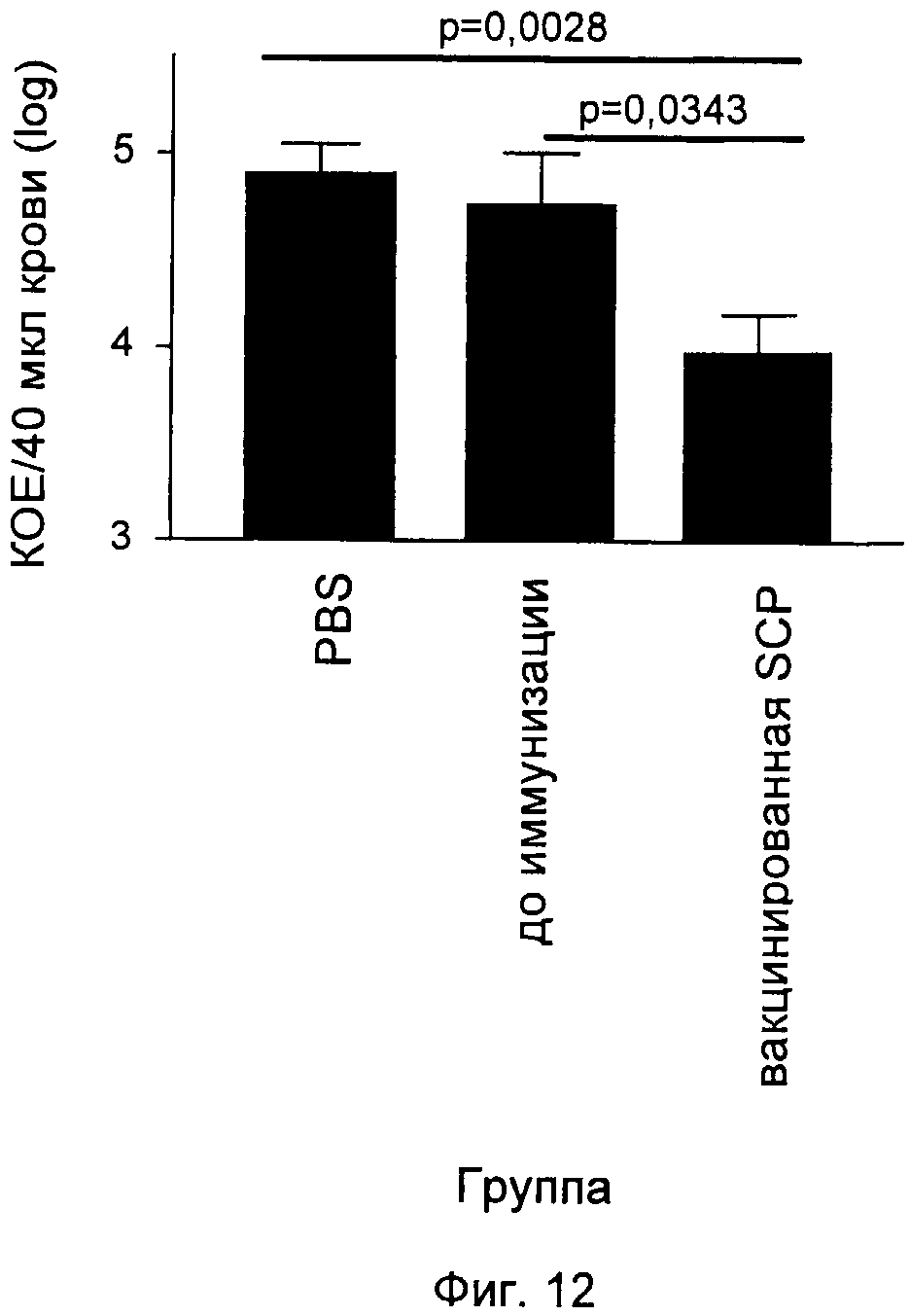
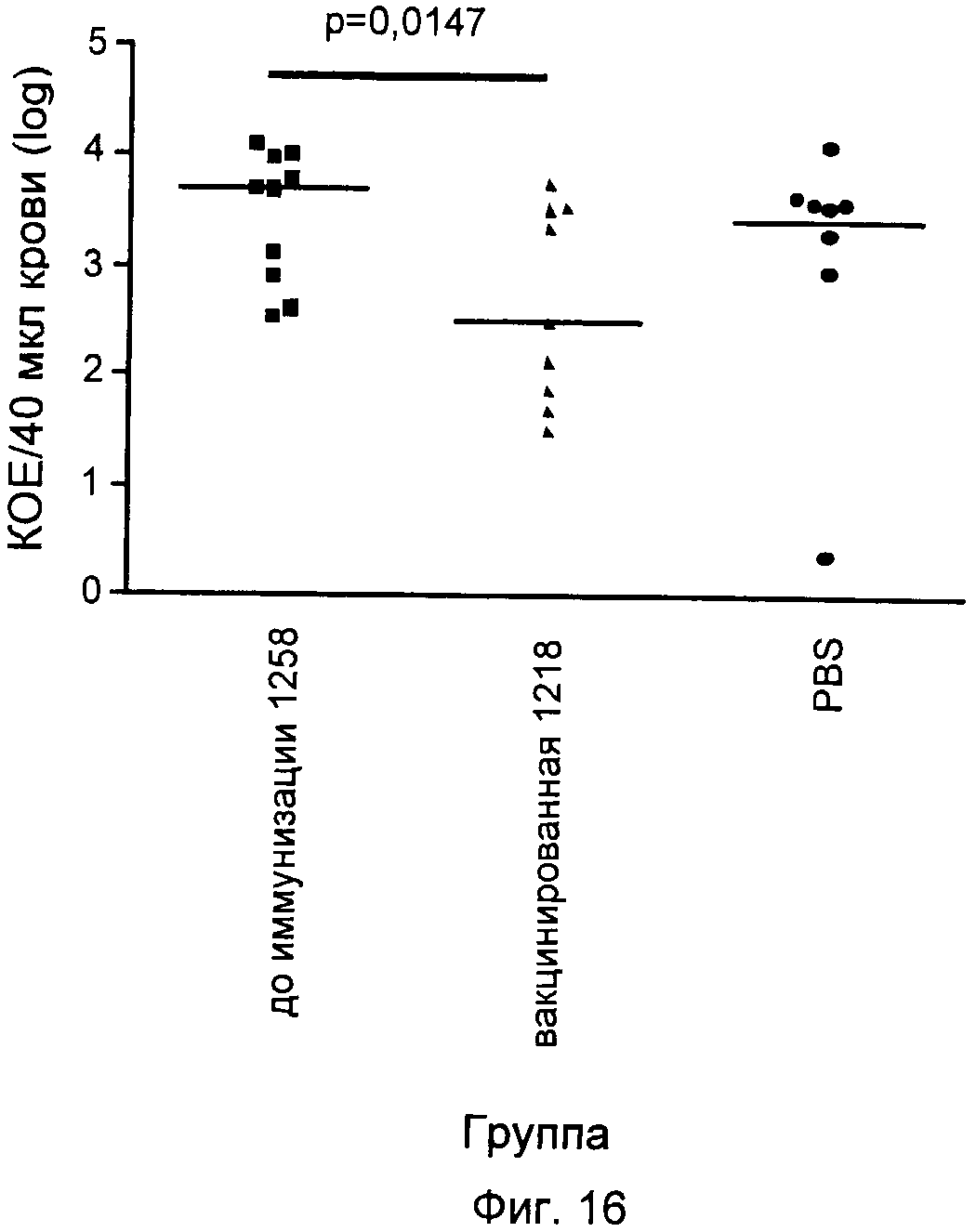
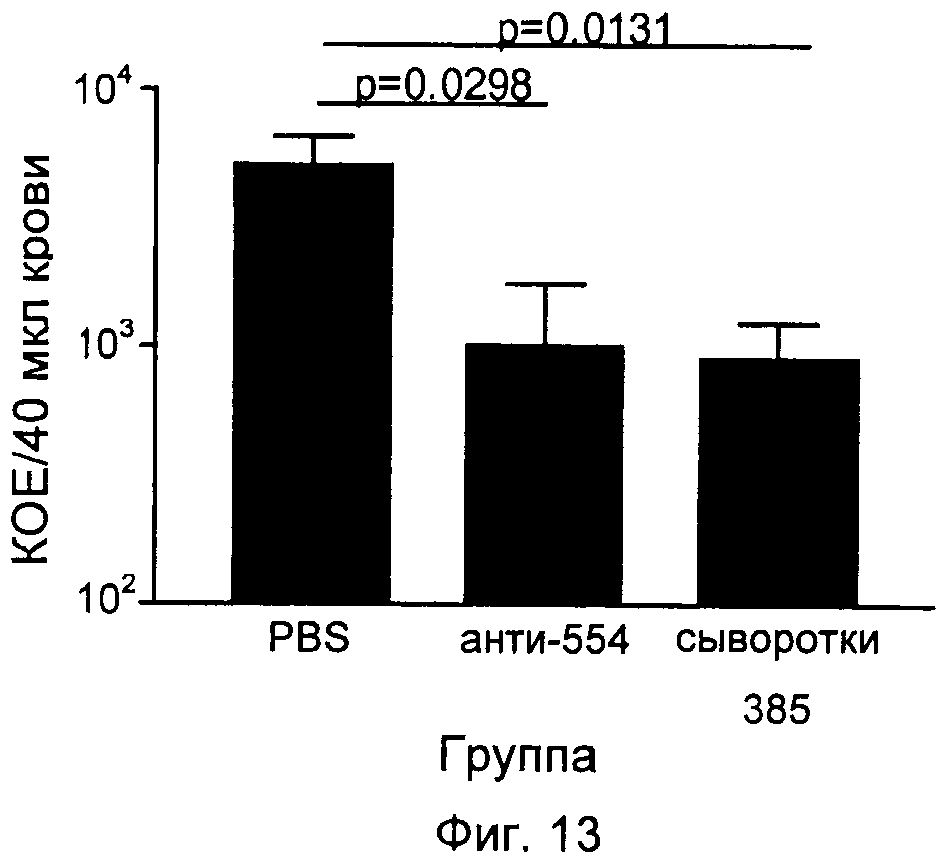
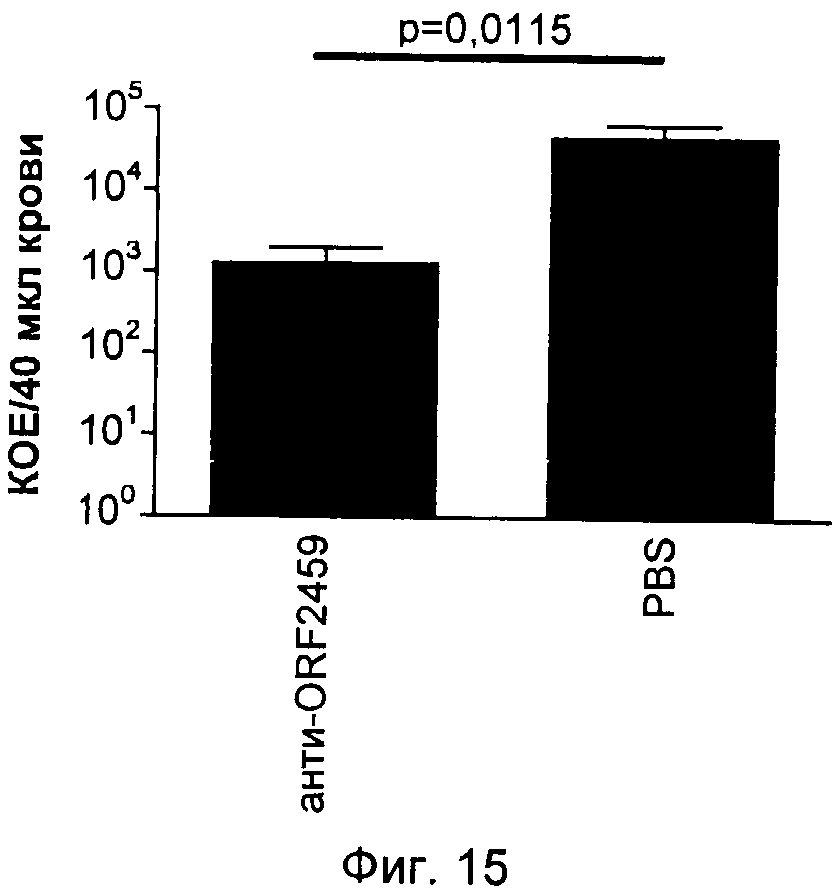
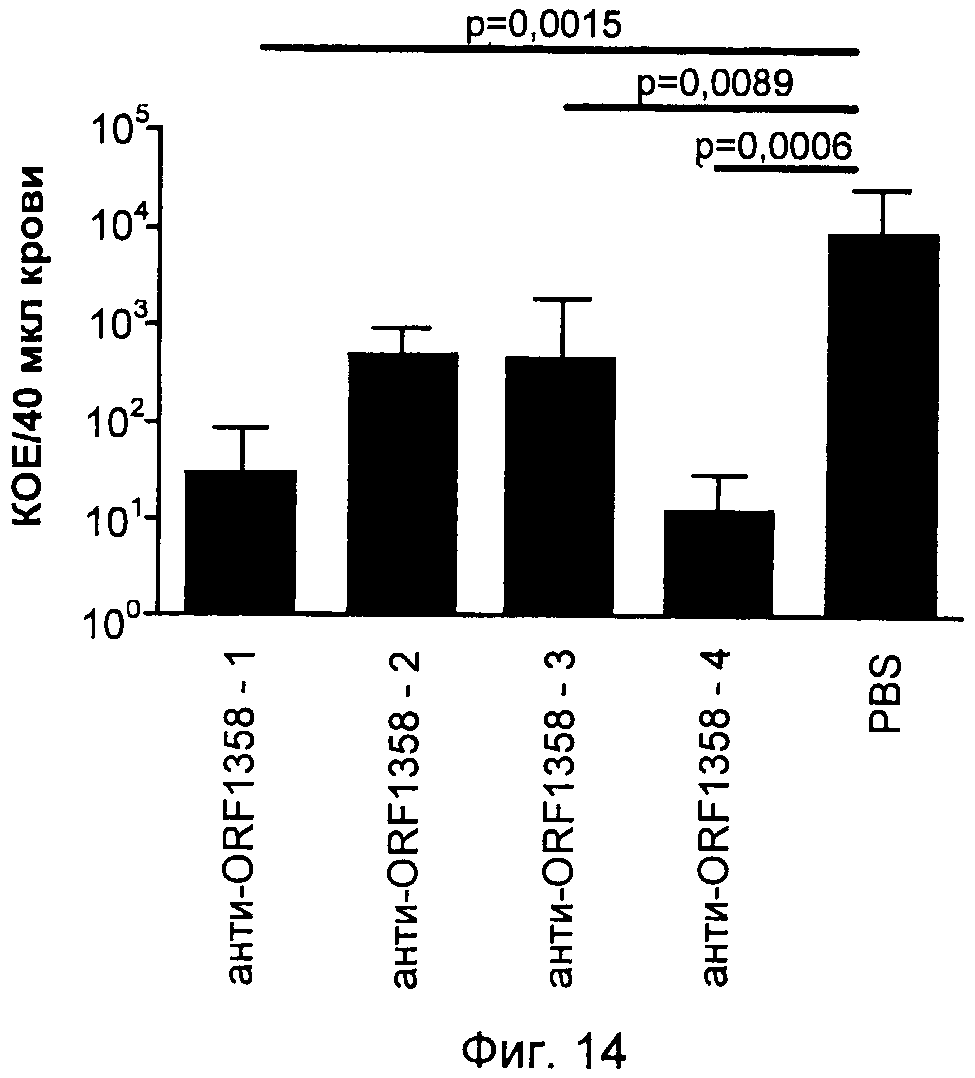
На Фиг.12-16 графически продемонстрированы результаты переноса пассивного иммунитета согласно Примеру 3. КОЕ означает колониеобразующие единицы.
Подробное описание изобретения
Согласно настоящему изобретению предложены иммуногенные композиции для предупреждения или уменьшения симптомов инфекций, вызванных β-гемолитическими стрептококками, включая стрептококки групп А, В, С и G. Два или более полипептида, перечисленные здесь, объединены вместе для создания иммуногенной композиции.
Конкретно, в одном воплощении иммуногенная композиция по этому изобретению содержит смесь двух или более чем двух полипептидов, каждый из которых кодируется последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот, выбранной из группы, состоящей из:
а) пептидазы С5а ("SCP") (Фиг.1 (SEQ ID NO:1));
б) открытой рамки считывания ("ОРС") 554 (Фиг.3 (SEQ ID NO:3));
в) ОРС 1218 (Фиг.5 (SEQ ID NO:5));
г) ОРС 1358 (Фиг.7 (SEQ ID NO:7));
д) ОРС 2459 (Фиг.9 (SEQ ID NO:9)).
В другом воплощении иммуногенная композиция по этому изобретению содержит смесь двух или более чем двух полипептидов, каждый из которых имеет по меньшей мере 90% идентичность аминокислотной последовательности, выбранной из группы, состоящей из:
а) SCP (Фиг.2 (SEQ ID NO: 2));
б) пептидилпропилизомеразы (Фиг.4 (SEQ ID NO:4));
в) гипотетического белка (Фиг.6 (SEQ ID NO:6));
г) предполагаемого адгезивного белка (Фиг.8 (SEQ ID NO:8)); и
д) поверхностного липопротеина (Фиг.10 (SEQ ID NO:10)). В еще одном воплощении иммуногенная композиция по этому изобретению содержит смесь:
а) полипептида SCP, кодируемого последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот согласно Фиг.1 (SEQ ID NO:1);
б) полипептида пептидилпропилизомеразы, кодируемого последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот согласно Фиг.3 (SEQ ID NO:3) и
в) по меньшей мере одного другого полипептида, кодируемого последовательностью нуклеиновых кислот, имеющей по меньшей мере 90% идентичность последовательности нуклеиновых кислот, выбранной из группы, состоящей из последовательности согласно (1) Фиг.5 (SEQ ID NO:5); (2) Фиг.7 (SEQ ID NO:7); и (3) Фиг.9 (SEQ ID NO:9).
В еще одном воплощении иммуногенная композиция по этому изобретению содержит смесь:
а) полипептида SCP, имеющего по меньшей мере 90% идентичность аминокислотной последовательности согласно Фиг.2 (SEQ ID NO:2);
б) полипептида пептидилпропилизомеразы, имеющего по меньшей мере 90% идентичность аминокислотной последовательности согласно Фиг.4 (SEQ ID NO:4);
в) по меньшей мере одного другого полипептида, имеющего по меньшей мере 90% идентичность аминокислотной последовательности, выбранной из группы, состоящей из последовательности согласно (1) Фиг.6 (SEQ ID NO:6);
(2) Фиг.8 (SEQ ID NO:8) и (3) Фиг.10 (SEQ ID NO:10).
Термины «полинуклеотид», «нуклеиновая кислота» и «фрагмент нуклеиновой кислоты» использованы здесь взаимозаменяемым образом. Эти термины охватывают нуклеотиды, соединенные фосфодиэфирными связями. «Полинуклеотид» может представлять собой полимер рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК), который является одно- или двухцепочечным, который возможно содержит синтетические, неприродные или измененные нуклеотидные основания. Полинуклеотид в форме полимера ДНК может содержать один или более чем один сегмент кДНК, геномной ДНК, синтетической ДНК или их смеси. Нуклеотидные основания обозначены здесь с помощью однобуквенного кода: аденин (А), гуанин (G), тимин (Т), цитозин (С), инозин (I) и урацил (U).
Полинуклеотиды стрептококков, описанные здесь, могут быть получены с использованием стандартных методик клонирования и скрининга. Эти полинуклеотиды могут быть получены, например, из геномной ДНК, из библиотеки кДНК, полученной на основе мРНК, из библиотеки геномной ДНК, или могут быть синтезированы с использованием хорошо известных и коммерчески доступных методик, таких как, например, посредством ПЦР из библиотеки кДНК или с помощью ОТ-ПЦР (полимеразная цепная реакция с обратной транскрипцией).
Существует несколько доступных и хорошо известных специалистам в данной области техники способов получения полноразмерных кДНК или удлинения короткой кДНК, таких как, например, способы, основанные на методе быстрой амплификации концов кДНК (RACE). См. Frohman et al., Proc. Natl. Acad. Sci. USA 85, 8998-9002, 1988. Недавние модификации методики, примером которых является, например, технология MARATHON™ (Clontech Laboratories Inc.) значительно упрощают поиск более длинных кДНК. В технологии MARATHON™ кДНК получают из мРНК, экстрагированной из выбранной ткани, и «адапторной» последовательности, лигированной по каждому концу. Затем проводят амплификацию нуклеиновой кислоты (ПЦР), чтобы амплифицировать «недостающий» 5'-конец кДНК, используя комбинацию генспецифических и адаптор-специфических олигонуклеотидных праймеров. Реакцию ПЦР затем повторяют с использованием «вложенных» праймеров, то есть праймеров, сконструированных для отжига в амплифицированном продукте (как правило, адаптер-специфического праймера, который отжигается далее 3'-конца в адапторной последовательности, и генспецифического праймера, который отжигается далее 5'-конца в известной последовательности генов). Продукты этой реакции можно затем проанализировать с помощью секвенирования ДНК и конструировать полноразмерную кДНК либо посредством присоединения продукта непосредственно к существующей кДНК с получением полной последовательности, либо посредством проведения отдельной полноразмерной ПЦР при использовании новой информации о нуклеотидных последовательностях для разработки 5'-праймера.
Термин «рекомбинантный» означает, например, что полинуклеотид создан посредством искусственного объединения двух или более, в иных условиях разделенных, сегментов полинуклеотидов, например посредством химического синтеза или посредством манипуляции с выделенными полинуклеотидами с использованием методик генной инженерии. «Конструкция рекомбинантной ДНК» содержит любые выделенные полинуклеотиды по настоящему изобретению, функционально связанные с по меньшей мере одним регуляторным элементом.
Ортологические или аллельные варианты полинуклеотидов стрептококков могут быть легко идентифицированы с использованием способов, хорошо известных в данной области техники. Аллельные варианты и ортологи полинуклеотидов могут содержать нуклеотидную последовательность, которая, как правило, является по меньшей мере на 90-95% или более идентичной любой одной или более чем одной нуклеотидной последовательности, показанной на нечетных Фиг.1-9 (нечетные SEQ ID NO:1-9), или ее фрагментам. Аллельные варианты и ортологи этих полинуклеотидов могут кодировать полипептид, который содержит аминокислотную последовательность, которая является по меньшей мере на 90% идентичной аминокислотной последовательности, показанной на любой одной или более чем одной четной Фиг.2-10 (четные SEQ ID NO:2-10). Такие полинуклеотиды могут быть легко идентифицированы как способные к гибридизации в строгих условиях с любым одним или более чем одним полинуклеотидом, имеющим нуклеотидную последовательность, показанную на Фиг.1-9 (нечетные SEQ ID NO:1-9), или ее фрагменты.
Специалисту в данной области техники будет совершенно ясно, что много уровней идентичности последовательностей полезно при идентификации родственных полинуклеотидных и полипептидных последовательностей. Выравнивание последовательностей и расчеты процента идентичности могут быть проведены с использованием программы MEGALIGN™ пакета компьютерных программ биоинформатики LASERGENE™ (DNASTAR Inc., Madison, Wis.). Множественное выравнивание последовательностей может быть проведено с использованием метода выравнивания Clustal (Higgins and Sharp, Gene, 73(1):237-44, 1988) со значениями параметров по умолчанию, например, GAP PENALTY (штраф за делецию) равен 10 и GAP LENGTH PENALTY (штраф за продолжение делеции) равен 10. Значения параметров по умолчанию для парных выравниваний при использовании метода Clustal могут представлять собой, например, KTUPLE (размер идентичного участка) равен 1, GAP PENALTY (штраф за делецию) равен 3, WINDOW (окно) равно 5 и DIAGONALS SAVED (баллы за сохраненные диагонали) равны 5.
Полипептидная последовательность по изобретению может быть идентична приведенной последовательности, то есть идентична на 100%, или может включать некоторое количество аминокислотных изменений по сравнению с эталонной последовательностью, так что процент идентичности составляет менее 100%. Такие изменения включают по меньшей мере одну аминокислотную делецию, замену, включая консервативную и неконсервативную замену, или вставку. Изменения могут встречаться в амино- или карбокси-концевых положениях эталонной полипептидной последовательности или где-то между этими концевыми положениями, рассеянные либо отдельно среди аминокислот в эталонной аминокислотной последовательности, либо одной или более чем одной сплошной группой в пределах эталонной аминокислотной последовательности.
Таким образом, согласно изобретению также предложены выделенные полипептиды, обладающие идентичностью последовательности аминокислотным последовательностям, содержащимся в приведенных последовательностях. В зависимости от конкретной последовательности, степень идентичности последовательности составляет предпочтительно более чем 90% (например 90%, 95%, 97%, 99% или более). Эти гомологичные белки включают мутанты и алелльные варианты.
«Идентичность», как известно в данной области техники, представляет собой родство между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, которое определяют посредством сравнения последовательностей. В данной области техники «идентичность» также означает степень сходства последовательности между полипептидными или полинуклеотидными последовательностями, в зависимости от обстоятельств, как определяют посредством сопоставления между цепочками таких последовательностей. «Идентичность» и «сходство» могут быть легко подсчитаны известным способами, включая те, которые описаны в Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part I, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994;
Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; и Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M Stockton Press, New York, 1991; и Carillo, H., and Lipman, D., SIAM J. Applied Math., 48: 1073 (1988), но не ограничиваясь ими. Предпочтительные способы определения идентичности разработаны так, чтобы обеспечить наибольшее сопоставление между исследуемыми последовательностями. Способы определения идентичности и сходства систематизированы в общедоступных компьютерных программах. Предпочтительные способы определения идентичности и сходства между двумя последовательностями с помощью компьютерных программ включают пакет программ GCG (Devereux, J., et al. 1984), BLASTP, BLASTN и FASTA (Altschul, S.F., et al., 1990), но не ограничены ими. Программа BLASTX общедоступна в Национальном центре биотехнологической информации (NCBI) и других источниках (BLAST Manual, Altschul, S., et al., NCBI NLM NIH Bethesda, Md. 20894; Altschul, S., et al., 1990). Для определения идентичности можно также использовать хорошо известный алгоритм Smith Waterman.
Например, количество аминокислотных изменений для данного % идентичности может быть определено путем умножения общего количества аминокислот, представленных в одной из четных Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10), на число процентов соответствующей процентной идентичности (деленное на 100) и затем вычитания этого результата из указанного общего количества аминокислот, представленных в одной из четных Фиг.2-10 (SEQ ID NO:2,4,6, 8 и 10), или;
na≤xa-(xa·y),
где na равен количеству аминокислотных изменений, xa равен общему количеству аминокислот, представленных в одной из четных Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10), и у равен, например, 0,90 для 90%, 0,95 для 95%, 0,97 для 97% и так далее, и где любой результат умножения xa и у, не представляющий собой целое число, округляют в меньшую сторону до ближайшего целого числа перед вычитанием его из xа.
Согласно настоящему изобретению также предложены выделенные полипептиды, которые являются по существу консервативными среди штаммов β-гемолитических стрептококков. Кроме того, выделенные полипептиды, которые являются по существу консервативными среди штаммов β-гемолитических стрептококков и которые эффективны в предупреждении или уменьшении симптомов β-гемолитической стрептококковой колонизации или инфекции у восприимчивого субъекта, также предусмотрены настоящим изобретением. Использованный здесь термин «консервативный» относится, например, к количеству аминокислот, которые не подвергаются вставкам, замене и/или делециям, в процентах от общего количества аминокислот в белке. Например, если белок консервативен на 90% и имеет, например, 263 аминокислоты, тогда имеется 237 положений аминокислот в белке, в которых аминокислоты не подвергаются замене. Аналогичным образом, если белок консервативен на 95% и имеет, например, 280 аминокислот, тогда имеется 14 положений аминокислот, в которых аминокислоты могут подвергаться замене и 266 (то есть 280 минус 14) положений аминокислот, в которых аминокислоты не подвергаются замене. Согласно одному из воплощений настоящего изобретения выделенный полипептид предпочтительно по меньшей мере примерно на 90% консервативен среди штаммов β-гемолитических стрептококков, более предпочтительно по меньшей мере примерно на 95% консервативен среди этих штаммов, даже более предпочтительно по меньшей мере примерно на 97% консервативен среди этих штаммов и наиболее предпочтительно по меньшей мере примерно на 99% консервативен среди этих штаммов, без ограничения.
В структуре полипептидов можно провести модификации и изменения и все еще получить полипептиды, обладающие активностью и/или антигенностью β-гемолитических стрептококков и/или Streptococcus pyogenes. Например, некоторые аминокислоты могут быть заменены на другие аминокислоты в последовательности без существенной потери активности и/или антигенности. Поскольку именно способность к взаимодействию и природа полипептида определяют биологическую и функциональную активность полипептида, некоторые замещения последовательности аминокислот можно осуществить в полипептидной последовательности (или, конечно, ее исходной кодирующей последовательности ДНК), и тем не менее получить полипептид с подобными свойствами.
Изобретение включает любой выделенный полипептид, который является биологическим эквивалентом полипептиду, обеспечиваемому требуемую реактивность, как описано здесь. Термин «требуемая реактивность» относится к реактивности, которая может быть оценена специалистом в данной области техники как полезный результат для целей данного изобретения. Примеры требуемой реактивности описаны здесь, включая, без ограничения, требуемые степени защиты, требуемые титры антител, требуемую опсонофагоцитирующую активность и/или требуемую перекрестную реактивность, такие, которые могут быть оценены специалистом в данной области техники как полезные для целей данного изобретения. Требуемая опсонофагоцитирующая активность обозначена в виде процента киллинга бактерий, который измеряют по уменьшению колониеобразующих единиц (КОЕ) в анализе опсонофагоцитирующей активности (ОРА) против отрицательного контроля. Без ограничений, требуемая опсонофагоцитирующая активность составляет предпочтительно по меньшей мере примерно 15%, более предпочтительно по меньшей мере примерно 20%, даже более предпочтительно по меньшей мере примерно 40%, даже более предпочтительно по меньшей мере примерно 50% и наиболее предпочтительно по меньшей мере примерно 60%.
Изобретение включает полипептиды, которые являются вариантами полипептидов, содержащих аминокислотную последовательность, представленную на четных Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10). Использованный здесь термин «вариант» включает полипептид, который отличается от эталонного полипептида, но сохраняет основные свойства. В целом отличия содержатся в ограниченном количестве, так что последовательности эталонного полипептида и варианта очень сходны в целом, а на многих участках являются идентичными (то есть биологически эквивалентны). Вариант и эталонный полипептид могут отличаться в аминокислотной последовательности на одну или более чем одну замену, вставку или делецию в любой комбинации. Замененный или вставленный аминокислотный остаток может быть или может не быть остатком, кодируемым генетическим кодом. Вариант полипептида может быть встречающимся в природе, таким как аллельный вариант, или это может быть вариант, о котором неизвестно, что он встречается в природе. Не встречающиеся в природе варианты полипептидов могут быть получены посредством прямого синтеза или методами мутагенеза.
При осуществлении таких изменений может быть учтен индекс гидрофобности аминокислот. Важность индекса гидрофобности аминокислот в обеспечении биологической функции взаимодействий полипептида широко известна в данной области техники (Kyte & Doolittle, 1982). Известно, что некоторые аминокислоты могут быть заменены другими аминокислотами, имеющими сходный индекс или показатель гидрофобности и все еще давая полипептид с подобной биологической активностью. Каждой аминокислоте присвоен индекс гидрофобности на основе ее гидрофобности и характеристик зарядов. Эти индексы перечислены в круглых скобках после каждой аминокислоты, как изложено ниже: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин
(+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5).
Полагают, что относительный гидрофобный характер аминокислотного остатка обуславливает вторичную и третичную структуру получаемого полипептида, которая в свою очередь определяет взаимодействие полипептида с другими молекулами, такими как ферменты, субстраты, рецепторы, антитела, антигены и тому подобное. В данной области техники известно, что аминокислота может быть заменена другой аминокислотой, имеющей сходный индекс гидрофобности и все еще давая функционально эквивалентный полипептид. При таких изменениях замена аминокислот, индексы гидрофобности которых находятся в пределах +1-2, является предпочтительной, те, которые находятся в пределах +/-1, являются особо предпочтительными, а те, которые находятся в пределах +/-0,5, являются даже еще более предпочтительными.
Замену подобных аминокислот можно также осуществить на основе гидрофильности, особенно когда создаваемый таким образом биологически функциональный эквивалент полипептида или пептида предназначен для применения в иммунологических воплощениях. В патенте США №4554101, включенном здесь посредством ссылки, указано, что наивысшая локальная средняя гидрофильность полипептида, регулируемая гидрофильностью соседних аминокислот, коррелирует с его иммуногенностью и антигенностью, то есть с биологическим свойством полипептида.
Как подробно описано в патенте США №4554101, включенном здесь посредством ссылки, аминокислотным остаткам присвоены следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0±1); глутамат (+3,0±1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); пролин (-0,5±1); треонин (-0,4); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5) и триптофан (-3,4). Следует понимать, что аминокислота может быть заменена другой аминокислотой, имеющей сходное значение гидрофильности и все еще давая биологически эквивалентный и, в частности, иммунологически эквивалентный полипептид. При таких изменениях замена аминокислот, значения гидрофильности которых находятся в пределах ±2, является предпочтительной, те, которые находятся в пределах ±1, являются особо предпочтительными, а те, которые находятся в пределах ±0,5, являются еще более предпочтительными.
Как указано выше, аминокислотные замены в основном, таким образом, основаны на относительном сходстве заместителей в боковой цепи аминокислоты, например, их гидрофобности, гидрофильности, заряда, размера и тому подобного. Примеры замен, которые учитывают различные указанные выше характеристики, хорошо известны специалистам в данной области техники и включают: аргинин и лизин; глутамат и аспартат; серии и треонин; глутамин и аспарагин; и валин, лейцин и изолейцин. Как показано в Таблице 1 ниже, подходящие аминокислотные замены включают следующие:
|
Таким образом, изобретение включает функциональные или биологические эквиваленты полипептидов последовательностей, представленных в четных Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10), которые содержат одну или более чем одну аминокислотную замену.
Биологические или функциональные эквиваленты полипептида могут также быть получены с использованием сайт-специфического мутагенеза. Сайт-специфический мутагенез представляет собой методику, полезную при получении второго поколения полипептидов или биологически функционально эквивалентных полипептидов, полученных на основе их последовательностей, при помощи специфического мутагенеза исходной ДНК. Как указано выше, такие изменения могут быть желательны, когда желательны аминокислотные замены. Эта методика дополнительно обеспечивает быструю возможность получения и тестирования вариантов последовательностей, например, учитывая один или более чем один из вышеизложенных факторов, посредством внесения одного или более чем одного изменения нуклеотидной последовательности в ДНК. Сайт-специфический мутагенез делает возможным получение мутантов в результате использования специфических олигонуклеотидных последовательностей, которые кодируют последовательность ДНК, содержащую требуемую мутацию, а также достаточного количества смежных нуклеотидов для создания последовательности праймера достаточного размера и сложности последовательности для образования стабильного дуплекса по обеим сторонам проводимого после делеции сочленения. Типично, праймер длиной примерно от 17 до 25 нуклеотидов является предпочтительным, при этом примерно от 5 до 10 остатков по обеим сторонам сочленения последовательности изменены.
В основном, методика сайт-специфического мутагенеза хорошо известна в данной области техники. Как будет понятно, в этой методике типично используют фаговый вектор, который может существовать как в однонитевой, так и в двунитевой форме. Типично, сайт-направленный мутагенез в соответствии с этим проводят сначала путем получения однонитевого вектора, в последовательность которого включена последовательность ДНК, кодирующая всю или часть выбранной полипептидной последовательности Streptococcus pyogenes. Олигонуклеотидный праймер, несущий требуемую мутантную последовательность, получают, например, хорошо известными методиками (например, синтетически). Этот праймер затем отжигают с однонитевым вектором и достраивают, используя ферменты, такие как фрагмент Кленова ДНК-полимеразы I E.соli, чтобы завершить синтез несущей мутацию нити. Таким образом, гетеродуплекс образуется, когда одна нить кодирует исходную немутантную последовательность, а вторая нить несет требуемую мутацию. Этот гетеродуплексный вектор затем используют для трансформации соответствующих клеток, таких как клетки Е.соli, и отбирают клоны, которые содержат рекомбинантные векторы, несущие мутацию. Имеющиеся в продаже наборы обеспечивают необходимые реагенты.
Понятно, что полипептиды и полипептидные антигены по изобретению включают любой полипептид, обладающий существенным сходством последовательностей, структурным сходством и/или функциональным сходством с полипептидом, содержащим аминокислотную последовательность, представленную в любой четной Фиг.2-10 (SEQ ID NO:2, 4, 6, 8 и 10). Кроме того, полипептид и полипептидный антиген по изобретению не ограничены конкретным источником. Таким образом, согласно изобретению предусмотрена общая детекция и выделение полипептидов из различных источников.
Полипептиды по изобретению могут находиться в форме «зрелого» белка или могут составлять часть более крупного белка, такого как слитый белок. Часто оказывается преимущественным включение дополнительной аминокислотной последовательности, которая содержит, например, секреторные или лидерные последовательности, пропоследовательности, последовательности, которые способствуют очистке, такие как множественные гистидиновые остатки, или дополнительную последовательность для стабильности во время получения рекомбинантов.
Термин «иммуногенная композиция», как он использован здесь, относится к любому типу биологического агента в подходящей для введения форме, способного стимулировать иммунный ответ у субъекта, инокулированного иммуногенной композицией. Иммунный ответ может включать индуцирование антител и/или индуцирование Т-клеточного ответа. Термин «защита» при использовании применительно к иммуногенной композиции относится к уменьшению (либо частичному, либо полному) любых симптомов, ассоциированных с рассматриваемым заболеванием или состоянием. Таким образом, защита субъектов от инфекции, вызванной видами Streptococcus, такими как S. dysgalactiae (включая подвиды Dysgalactiae и Equisimilis) с помощью иммуногенных композиций по настоящему изобретению обычно приводит к уменьшению бактериального роста и/или одного или более чем одного клинического симптома, ассоциированного с стрептококковой инфекцией, включая артрит, эндокардит, менингит, полисерозит, бронхопневмонию, менингит, долговременную потерю слуха и септический шок.
Способы, раскрытые здесь, могут включать индуцирование иммунного ответа против одного или более чем одного патогена, который включает виды Streptococcus (например Streptococcus dysgalactiae, S. dysgalactiae подвид Equisimilis, S. dysgalactiae подвид Dysgalactiae, S. pyogenes, S. agalactiae, S. anginosus, S. constellatus, S. equisimilis и S. intennedius.) Например, способы могут включать индуцирование образования поликлональных антител против одного или более чем одного стрептококкового патогена, такого как, например, S. dysgalactiae подвид Equisimilis.
Как обсуждалось выше, иммуногенные композиции содержат два или более полипептида по изобретению. Для этого один или более чем один полипептид доводят до соответствующей концентрации, и он может быть приготовлен в виде препарата с любым подходящим адъювантом, разбавителем, фармацевтически приемлемым носителем или любой их комбинацией. Используемое здесь выражение «фармацевтически приемлемый носитель» предназначено включать все и любые растворители, дисперсионные среды, оболочки, антибактериальные и противогрибковые агенты, изотонические агенты и замедляющие всасывание агенты, эксципиенты и тому подобные, подходящие для фармацевтического применения. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. Физиологически приемлемые носители могут быть использованы в качестве носителей и/или разбавителей. Понятно, что фармацевтически приемлемый носитель означает соединение или комбинацию соединений, входящих в состав фармацевтической или иммуногенной композиции, которые не вызывают побочных эффектов и которые дают возможность, например, облегчить введение активного соединения, увеличить продолжительность его действия и/или его эффективность в организме, увеличить его растворимость в растворе или, альтернативно, повысить его сохранность. Эти фармацевтически приемлемые носители хорошо известны и могут быть подобраны специалистами в данной области техники в соответствии с природой и способом введения выбранного активного соединения. Они включают воду, раствор Рингера, соответствующую изотоническую среду, глицерин, этанол и другие традиционные растворители, забуференный фосфатом физиологический раствор и тому подобное, но не ограничиваются ими.
Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсий. Подходящие носители для внутривенного введения включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или забуференный фосфатом физиологический раствор (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей в тех случаях, когда существует удобная возможность введения через шприц. Она должна быть стабильной в условиях производства и хранения и ее следует предохранять от контаминации микроорганизмами, такими как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, использованием оболочки, такой как лецитин, поддерживанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Предотвращение воздействия микроорганизмов может быть достигнуто с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, аскорбиновой кислоты и тому подобного. Во многих случаях в композицию включают изотонические агенты, например сахара, полиспирты, такие как маннит, сорбит, и/или хлорид натрия. Длительная абсорбция инъекционных композиций может быть достигнута посредством включения в композицию агента, который замедляет абсорбцию, например, моностеарата алюминия и желатина.
Стерильные инъекционные растворы могут быть приготовлены посредством включения полипептидов в требуемом количестве в соответствующий растворитель с одним из перечисленных выше ингредиентом или их комбинацией в случае необходимости, с последующей фильтрующей стерилизацией. Обычно дисперсии готовят посредством включения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие требуемые ингредиенты из перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами получения являются вакуумная сушка и лиофильная сушка, что дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его раствора, предварительно простерилизованного фильтрацией.
Иммуногенные композиции, которые описаны здесь, также содержат, в некоторых воплощениях, один или более чем один адъювант. Адъювант представляет собой вещество, которое усиливает иммунный ответ при введении вместе с иммуногеном или антигеном. Ряд цитокинов или лимфокинов, как было показано, обладают иммуномодулирующей активностью и поэтому являются полезными в качестве адъювантов, включая интерлейкины 1-α, 1-β, 2, 4, 5, 6, 7, 8 и 10, 12 (см., например, патент США №5723127), 13, 14, 15, 16, 17 и 18 (и его мутантные формы); интерфероны-α, β и γ; гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) (см., например, патент США №5078996 и номер доступа АТСС (Американской коллекции типовых культур) 39900); макрофагальный колониестимулирующий фактор (М-КСФ); гранулоцитарный колониестимулирующий фактор (Г-КСФ); и факторы некроза опухоли α и β, но не ограничиваясь ими. Другие адъюванты, которые полезны для иммуногенных композиций, описанных здесь, включают хемокины, в том числе, без ограничения, МСР-1 (моноцитарный хемотаксический белок-1), MIP-1α (макрофагальный белок воспаления-1а), МIР-1β и RANTES (регулируемый активацией фактор, нормально экспрессируемый и секретируемый Т-клетками); молекулы адгезии, такие как селектин, например L-селектин, Р-селектин и Е-селектин; муциноподобные молекулы, например CD34, GlyCAM-1 и MadCAM-1; член семейства интегринов, такой как LFA-1, VLA-1 (очень поздний антиген-1), Мас-1 и р150.95; член суперсемейства иммуноглобулинов, такой как РЕСАМ (тромбоцитарно-эндотелиальная молекула адгезии), ICAMs (молекулы межклеточной адгезии), например ICAM-1, ICAM-2 и ICAM-3, CD2 и LFA-3; костимулирующие молекулы, такие как CD40 и CD40L; факторы роста, включая фактор роста сосудов, фактор роста нервной ткани, фактор роста фибробластов, эпидермальный фактор роста, В7.2, PDGF (тромбоцитарный фактор роста), BL-1 и фактор роста эндотелия сосудов; рецепторные молекулы, включая Fas, рецептор ФНО (фактора некроза опухоли), Fit, Apo-1, p55, WSL-1, DR3, TRAMP, Apo-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2 и DR6; и каспазу (ICE (интерлейкин-конвертирующий фермент)).
Подходящие адъюванты, используемые для усиления иммунного ответа, дополнительно включают, без ограничения, MPL™ (3-0-деацилированный монофосфориллипид A, Corixa, Hamilton, MT), который описан в патенте США №4912094. Также подходящими для применения в качестве адъювантов являются синтетические аналоги липида А или соединения аминоалкилглюкозаминфосфата (AGP) или их производные или аналоги, которые есть в наличии у Corixa (Hamilton, MT) и которые описаны в патенте США №6113918. Одно такое соединение AGP представляет собой 2-[(R)-3-тетрадеканоилокситетрадеканоиламино]-этил-2-дезокси-4-O-фосфоно-3-O-[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоил-амино]-b-D-глюкопиранозид, которое также известно как 529 (ранее известное как RC529). Этот адъювант 529 готовят в виде водной формы (AF) или в виде стабильной эмульсии (SE).
Другие адъюванты включают мурамил-пептиды, такие как N-ацетил-мурамил-b-треонил-D-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ); эмульсии «масло-в-воде», такие как MF59 (патент США №6299884) (содержащая 5% сквалена, 0,5% Твин 80 и 0,5% Span 85 (сорбитан триолеат) (возможно содержащая различные количества МТР-РЕ), приготовленная в виде субмикронных частиц при использовании микрофлуидайзера, такого как микрофлуидайзер модели HOY (Microfluidics, Newton, MA)), и SAF (содержащая 10% сквалена, 0,4% Твин 80, 5% блок-сополимера плуроник L121 и thr-MDP, либо микрофлуидизированная в субмикронную эмульсию, либо обработанная вихревым перемешиванием для получения эмульсии с частицами большего размера); соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия; амфиген; авридин; L121/сквален; D-лактид-полилактид/гликозид; полиолы плуроники; убитые бактерии Bordetella; сапонины, такие как Stimulon™ QS-21 (Antigenics, Framingham, МА.), описанный в патенте США №5057540, ISCOMATRIX (CSL Limited, Parkville, Australia), описанный в патенте США №5254339, и иммуностимулирующие комплексы (ИСКОМ); Mycobacterium tuberculosis; бактериальные липополисахариды; синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие CpG-мотив (например патент США №6207646); IC-31 (Intercell AG, Vienna, Austria), описанный в европейских патентах №1296713 и №1326634; коклюшный токсин (РТ) или его мутант, холерный токсин или его мутант (например, патенты США №7285281, 7332174, 7361355 и 7384640); или термолабильный токсин Е.соli (LT) или его мутант, в частности LT-K63, LT-R72 (например, патенты США №6149919, 7115730 и 7291588).
Полипептид может также включать по меньшей мере часть полипептида, возможно конъюгированного или связанного с пептидом, полипептидом или белком или с полисахаридом. Также допускают, что иммуногенные композиции могут содержать другие компоненты, такие как полисахариды, отдельно или конъюгированные с белками, которые могут усиливать иммунный ответ.
Различные исследования используют для оценки иммуногенности полипептидов in vitro, содержащихся в иммуногенных композициях по изобретению. Например, анализ опсонической активности in vitro проводят путем совместного инкубирования смеси клеток Streptococcus sp., инактивированной нагреванием сыворотки, содержащей специфические антитела к рассматриваемому полипептиду, и источника экзогенного комплемента. Опсонофагоцитоз происходит во время инкубирования свежевыделенных полиморфноядерных клеток (ПМЯ) и смеси антитела/комплемент/клетки Streptococcus sp. Бактериальные клетки, которые покрыты антителами и комплементом, уничтожаются посредством опсонофагоцитоза. Колониеобразующие единицы (KОЕ) выживших бактерий, которые избежали опсонофагоцитоза, определяют посредством посева анализируемой смеси на чашки. Титры представляют как обратную величину наибольшего разведения, которое дает S50% бактериальный киллинг, как определяют путем сравнения с анализируемыми контрольными пробами. Образцы, которые демонстрируют менее чем 50% киллинг при наименьшем исследуемом разведении сыворотки (1:8), представляют как имеющие титр антител при опсонофагоцитозе (ОРА), равный 4. Способ, описанный выше, является модификацией метода Грея (Gray, Conjugate Vaccines Supplement, p.694-697,1990).
Контрольную пробу исследуемой сыворотки, которая содержит исследуемую сыворотку плюс бактериальные клетки и инактивированный нагреванием комплемент, включают для каждой конкретной сыворотки. Эту контрольную пробу используют для того, чтобы оценить способно ли присутствие антибиотиков или других компонентов сыворотки вызывать киллинг бактериального штамма непосредственно (то есть в отсутствие комплемента или ПМЯ). Человеческую сыворотку с известным опсоническим титром используют в качестве положительного контроля человеческой сыворотки. Опсонический титр антител для каждой неизвестной сыворотки подсчитывают как обратную величину начального разведения сыворотки, которое дает 50% уменьшение КОЕ по сравнению с контрольной пробой без сыворотки.
Твердофазный иммуноферментный анализ (ELISA) целых клеток также может быть использован для in vitro оценки иммуногенности и экспонирования полипептидного антигена на поверхности, где интересующий бактериальный штамм наносят на поверхность планшета, такого как 96-луночный планшет, и исследуемые сыворотки иммунизированного животного подвергают взаимодействию с бактериальными клетками. Если какое-либо антитело, специфичное к исследуемому полипептидному антигену, является активным по отношению к экспонированному на поверхности эпитопу полипептидного антигена, это может быть определено стандартными способами, известными специалисту в данной области техники. Аналогичным подходом является мониторинг антигена на клеточной поверхности с использованием проточной цитометрии и антигенспецифических антител.
Любой полипептид, демонстрирующий требуемую активность in vitro, можно затем исследовать на животной модели in vivo с контрольным заражением. В некоторых воплощениях иммуногенные композиции используют при иммунизации животного (например мыши) способами и путями иммунизации, известными специалистам в данной области техники (например интраназального, парентерального, внутримышечного, перорального, ректального, вагинального, трансдермального, внутрибрюшинного, внутривенного, подкожного и так далее). После иммунизации животного стрептококковой иммуногенной композицией животное заражают одним или более чем одним видом стрептококка и оценивают резистентность к инфекции, вызванной Streptococcus spp.
Комбинированные иммуногенные композиции создают путем включения двух или более чем двух полипептидов по изобретению, а также путем объединения одного или более чем одного полипептида по изобретению с одним или более чем одним известным полипептидом Streptococcus pyogenes, включая М-белки, адгезины и тому подобное, но не ограничиваясь ими.
Приготовленные в виде препарата иммуногенные композиции могут быть введены непосредственно субъекту, доставлены ex vivo в клетки, полученные от субъекта, или in vitro для экспрессии рекомбинантных белков. Для доставки непосредственно субъекту введение можно осуществлять посредством любой традиционной формы, например интраназально, парентерально, перорально, внутрибрюшинно, внутривенно, подкожно или местно наносить на любую слизистую поверхность, например, носовой полости, ротовой полости, глаза, легкого, вагинальную или ректальную поверхность, например, с помощью аэрозоля.
Удобно готовить пероральные или парентеральные композиции в виде стандартной лекарственной формы для простоты введения и однородности дозирования. Термин «стандартная лекарственная форма», как он использован здесь, относится к физически дискретным единицам, подходящим в качестве стандартных доз для субъекта, которого лечат, причем каждая единица содержит предварительно определенное количество активного соединения, рассчитанное для обеспечения требуемого терапевтического действия, в сочетании с необходимым фармацевтическим носителем. Спецификация на стандартные лекарственные формы по изобретению обусловлена и непосредственно зависит от специфических свойств активного соединения и конкретного терапевтического действия, которого нужно достичь, и ограничений, характерных для приготовления такого активного соединения для лечения индивидуумов.
Инъекционные препараты, например стерильные инъекционные водные или масляные суспензии, готовят в соответствии с известным уровнем техники с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле.
Для парентерального введения иммуногенные композиции по изобретению могут быть введены в виде инъекционных доз в физиологически приемлемом разбавителе с фармацевтически приемлемым носителем, который может представлять собой стерильную жидкость, такую как вода, масла, физиологический раствор, глицерин или этанол. Кроме того, вспомогательные вещества, такие как увлажняющие или эмульгирующие агенты, поверхностно-активные вещества, забуферивающие рН вещества и тому подобное, могут присутствовать в композициях. Другие компоненты могут включать вещества нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло и минеральное масло. В основном, гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются предпочтительными жидкими носителями, особенно для инъекционных растворов.
Типично, композиции готовят в виде инъекционных препаратов, либо в виде жидких растворов или суспензий; также могут быть приготовлены твердые формы, подходящие для растворения или суспендирования в жидких носителях перед инъекцией. Препарат можно также эмульгировать или инкапсулировать в липосомы или микрочастицы, такие как полилактид, полигликолид или сополимер, для усиления действия адъювантов, которые рассмотрены выше (см. Langer, Science 249: 1527 (1990) и Hanes, Advanced Drug Delivery Reviews 28:97 (1997)). Иммуногенные композиции по этому изобретению могут быть введены в форме депо-препарата для инъекции или имплантата, который может быть приготовлен таким образом, чтобы сделать возможным продолжительное или пульсирующее высвобождение активного ингредиента.
Субъекты обычно представляют собой человека. Иммунологически эффективное количество иммуногенной композиции в соответствующем количестве доз вводят субъекту для усиления иммунного ответа. Термин «иммунологически эффективное количество», как он использован здесь, означает введение такого количества млекопитающему-хозяину (предпочтительно человеку), либо в однократной дозе, либо в виде части от некоторого числа доз, которое является достаточным для того чтобы по меньшей мере заставить иммунную систему индивидуума, которого лечат, генерировать иммунный ответ, снижающий клинические проявления бактериальной инфекции. Термин «иммунный ответ» или «иммунологический ответ» включает развитие гуморального (антителоопосредованного) и/или клеточного (опосредованного антигенспецифическими Т-клетками или продуктами их секреции) ответа. Иммунитет может быть обеспечен посредством однократной дозы иммуногенной композиции или может потребоваться введение нескольких доз, в дополнение к бустерным дозам антигена позднее, для поддержания иммунитета. Он может варьировать от минимального снижения бактериальной нагрузки до предупреждения инфекции. Оптимально, индивидуум, которого лечат, не должен проявлять более тяжелых клинических проявлений β-гемолитической стрептококковой инфекции. Количество дозировки может варьировать в зависимости от конкретных характеристик индивидуума, таких как возраст и вес. Это количество может быть определено в обычных испытаниях с помощью средств и способов, известных специалистам в данной области техники.
При профилактическом применении иммуногенные композиции вводят субъекту, восприимчивому к бета-гемолитической стрептококковой инфекции или, в ином случае, имеющему риск такой инфекции, в количестве, достаточном для устранения или снижения риска, облегчения тяжести или задержки начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, ассоциированные с инфекцией, его осложнений и промежуточных патологических фенотипов, присутствующих во время развития заболевания. При терапевтическом применении композиции вводят пациенту, у которого подозревают или который уже страдает таким заболеванием, в количестве, достаточном для выздоровления или по меньшей мере частичного купирования симптомов заболевания (биохимических, гистологических и/или поведенческих), включая его осложнения и промежуточные патологические фенотипы при развитии заболевания.
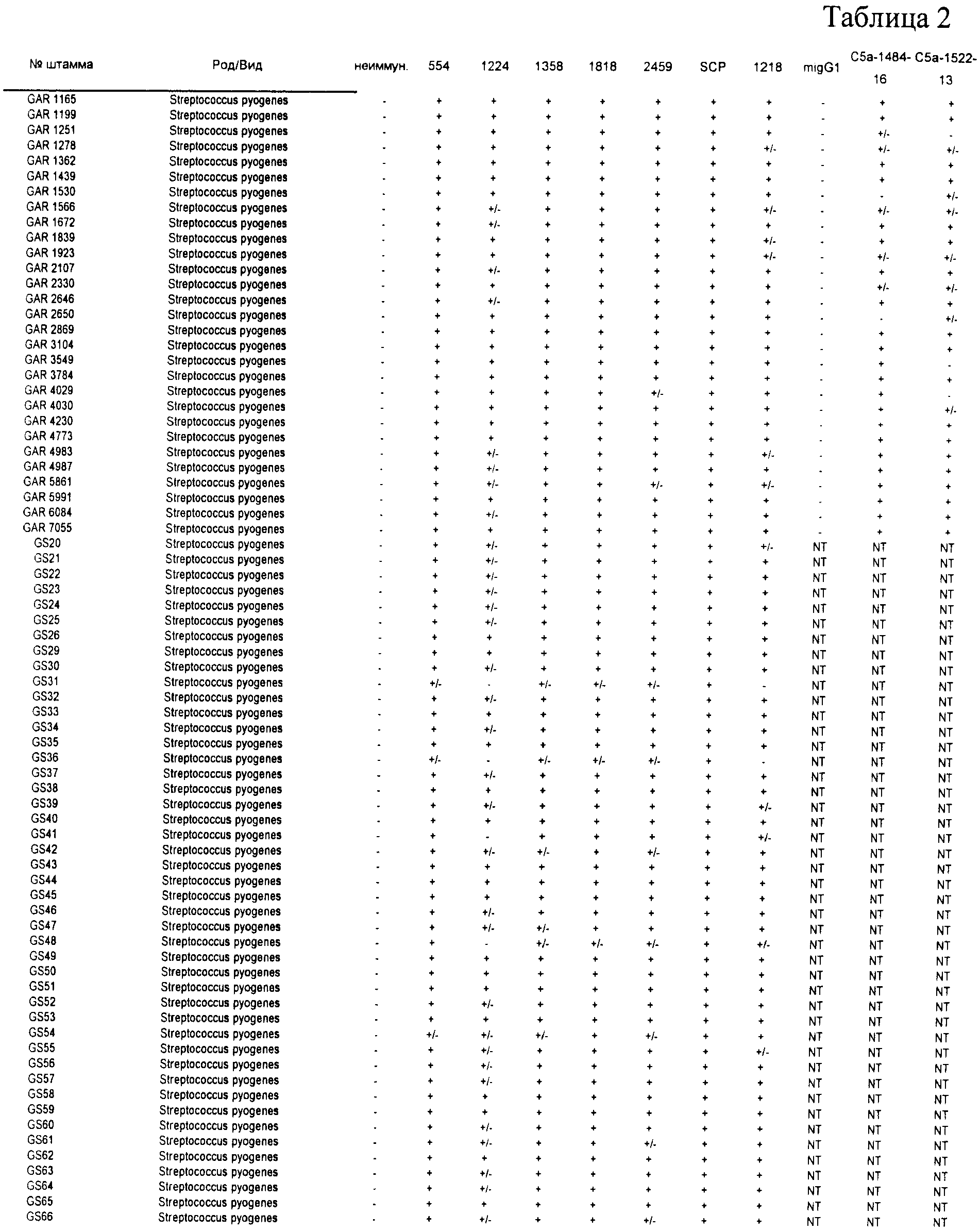
Согласно наблюдениям, не существует единой пептидной последовательности, которая обеспечивает защиту всех штаммов БГС, включая группы А, В, С и G. Как показано в Таблице II (представленной в Примере 1 ниже) ниже, каждый антиген обеспечивает иммунный ответ против субпопуляции этих групп.
В целом, любая комбинация двух или более чем двух экспрессируемых на поверхности антигенов БГС, как ожидается, обеспечит усиленный иммунный ответ, описанный выше. Они могут включать антигены, рассмотренные выше, капсулярные антигены БГС, М-белок, АВС-переносчик или любой другой экспонированный на поверхности антиген. Однако было установлено, что следующие антигены проявляют особенно полезные свойства для получения иммуногенных композиций:
SCP (пептидаза С5а);
пептидилпропилизомераза (кодируемая ОРС 554);
предполагаемый адгезивный белок (кодируемый ОРС 1358);
поверхностный липопротеин (кодируемый ОРС 2459);
гипотетический белок (кодируемый ОРС 1218).
Комбинации двух или более чем двух этих антигенов в одной многокомпонентной иммуногенной композиции обеспечивают усиленную защиту против одной или более чем одной группы БГС и вызывают усиленный иммунный ответ на них.
Примеры
Следующие примеры являются иллюстративными и не предназначены для ограничения настоящего изобретения.
ПРИМЕР 1. СВЯЗЫВАНИЕ АНТИТЕЛ
Связывание антител с бактериями - процесс, известный как опсонизация, может приводить к поглощению и киллингу бактерий фагоцитами. Скрининг таких антител используют для определения эффективности антител, индуцированных против конкретных серотипов, при киллинге бактерий, экспрессирующих или не экспрессирующих этот серотип на поверхности.
Для каждого отобранного серотипа антитела индуцировали у мышей против антител, кодируемых описанными ОРС. Затем проводили скрининг антител против различных штаммов БГС. Скрининг антител осуществляли посредством флуоресцентной сортировки клеток (FACS). Вкратце, убитые нагреванием стрептококки инкубировали с описанным антителом на льду в течение 45 минут с двумя последующими промывками. Стрептококки затем инкубировали с козьим антимышиным антителом, конъюгированным с флуорохромом Alexa-488 (Molecular Probes, Eugene, OR) в течение 30 минут на льду с двумя последующими промывками. Обработанные таким образом клетки пропускали через флуоресцентный аппарат сортировки клеток FACS (например, см. DeMaster et al., Infect. Immun., 70(1): 350-359, 2002). Результаты суммированы в Таблице 2.
В ходе скрининга этих антисывороток против бета-гемолитических стрептококков и моноклональных антител против различных штаммов бета-гемолитических стрептококков (БГС) было отмечено, что некоторые антисыворотки и антитела являются перекрестно-реактивными по отношению ко многим штаммам БГС, включая членов вида Streptococcus pyogenes (стрептококки группы A), Streptococcus agalactiae (стрептококки группы В) и стрептококки группы С и группы G (которые включают виды стрептококков Streptococcus anginosus, Streptococcus constellatus, Streptococcus intermedius, Streptococcus dysgalactiae подвид Equisimilis и Streptococcus dysgalactiae подвид Dysgalactiae). Эта перекрестная реактивность также означает, что описанные полипептиды или полипептиды, кодируемые соответствующей ОРС, могут быть использованы в иммуногенной композиции для индуцирования иммунного ответа, эффективного для защиты от инфекции, вызванной стрептококками группы А или группы В, а также стрептококками группы С или группы G.
В Таблице 2, символ "+" означает, что антитела реагируют с антигеном, по меньшей мере с трехкратным превышением базового уровня; символ "+/-" означает, что антитела реагируют с антигеном, в два-три раза превышая базовый уровень; и символ "-" означает, что детекция сигнала от антитела находится на уровне базового или ниже.
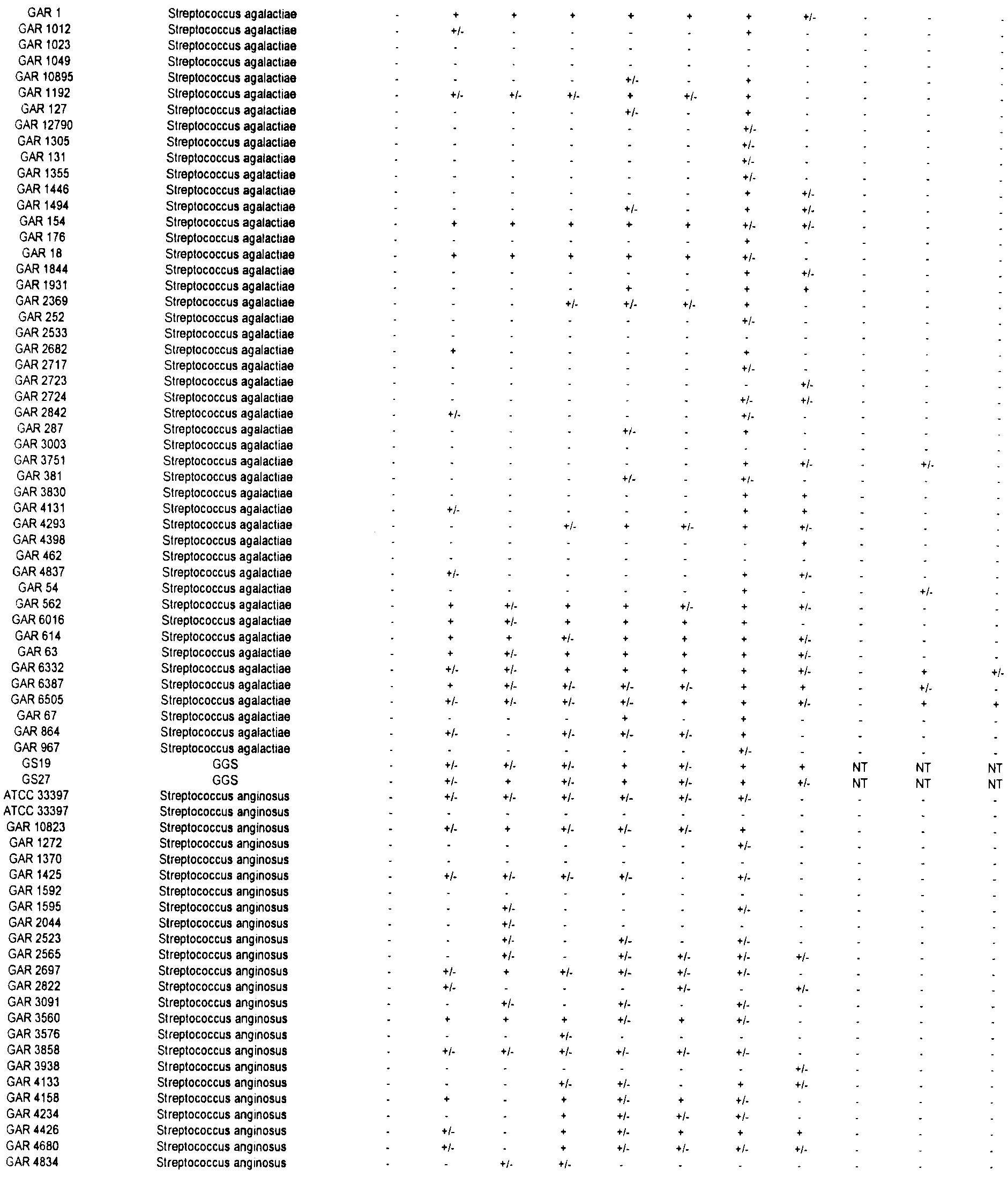
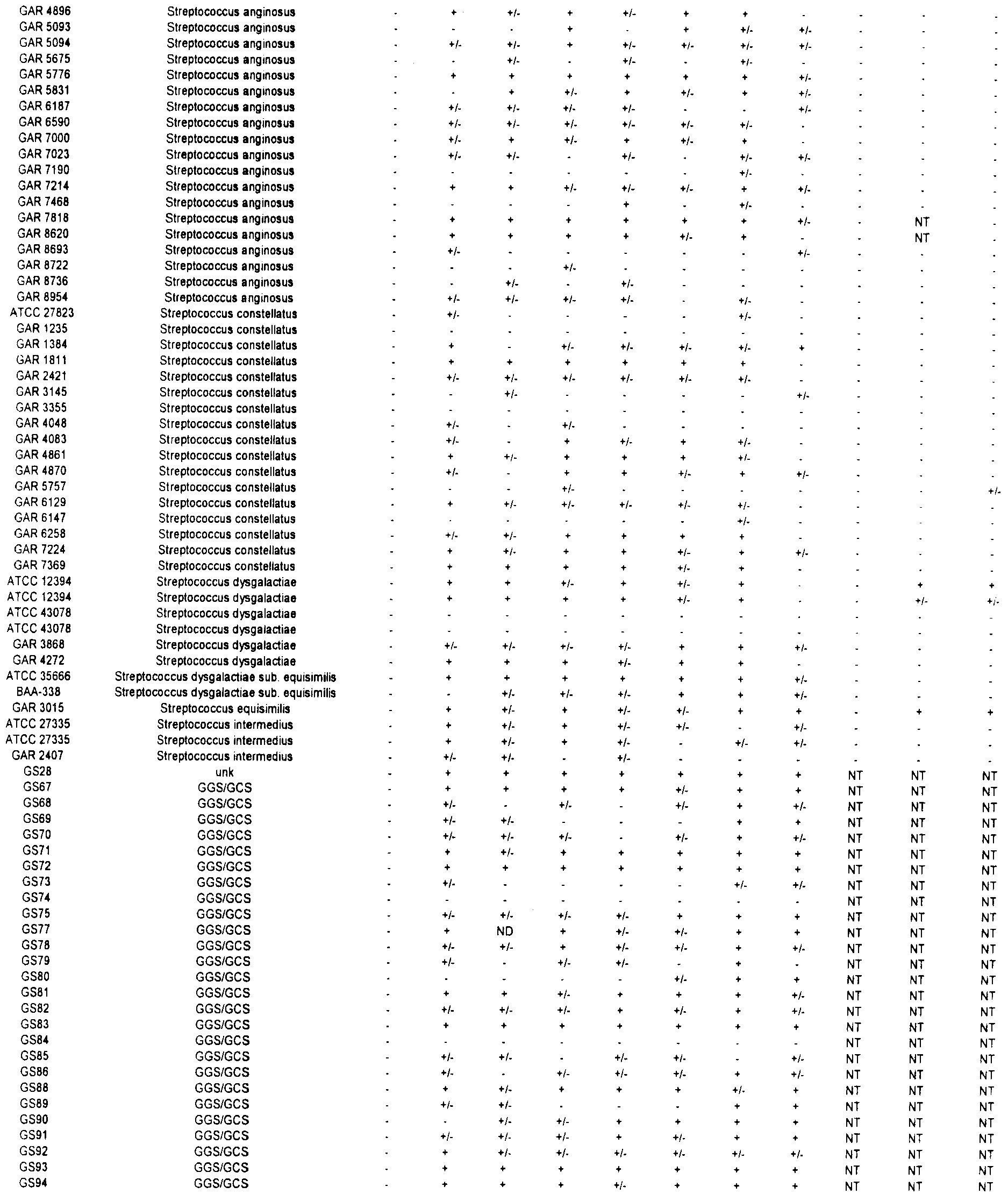
ПРИМЕР 2. ПРИМЕНЕНИЕ ТРЕХКОМПОНЕНТНОЙ ИММУНОГЕННОЙ КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ ИММУННЫХ СЫВОРОТОК
Готовили трехвалентную иммуногенную композицию, состоящую из SCP, полипептида, кодируемого ОРС 554, и полипептида, кодируемого ОРС 1358, с добавленным в качестве адъюванта фосфатом алюминия, и эту иммуногенную композицию использовали для получения гипериммунной кроличьей сыворотки посредством трех подкожных инокуляций с промежутком 2-4 недели с последующим кровоизвлечением; моновалентную иммуногенную композицию, состоящую из полипептида, кодируемого ОРС 554, с аналогичным адъювантом использовали в качестве контроля. Провели скрининг сывороток на опсонофагоцитирующую активность (ОРА) в отношении S. pyogenes SF370 при различных разведениях. Вкратце, бактерии инкубировали с 10 мкл сывороток в течение одного часа в присутствии комплемента (комплемент крольчат-сосунков) и затем разбавляли 1:10 и высевали на чашки с кровяным агаром. Результаты представлены на Фиг.11.
Как показано, можно наблюдать, что Trivax вызывает повышенную опсонофагоцитирующую активность по сравнению с иммуногенной композицией 554, что служит признаком гораздо лучшего киллинга бактерий.
ПРИМЕР 3. ПЕРЕНОС ПАССИВНОГО ИММУНИТЕТА
Антитела индуцировали против каждого из следующих антигенов, которые описаны выше: SCP и полипептиды, кодируемые ОРС 554, 1358, 2459 и 1218. Эти антитела затем вводили посредством инъекции крысятам, не обладающим полностью функционирующей иммунной системой. Обработанных крыс затем заражали S. pyogenes и повторно выделенные бактерии подсчитывали через четыре часа после заражения. Отрицательным контролем служил PBS, а положительным человеческим контролем - сыворотки 385.
Результаты показаны на Фиг.12-16. Вкратце, эти результаты продемонстрировали, что антитела, индуцированные каждым из антигенов, значительно снижали бактериемию у крысят.
Хотя изобретение проиллюстрировано и описано выше на основании конкретных воплощений, показанные подробности тем не менее не направлены на ограничение изобретения. Точнее, могут быть сделаны различные модификации в деталях в объеме и ряде эквивалентов в формуле изобретения, не выходя за пределы сущности изобретения.