Результат интеллектуальной деятельности: Рекомбинантный штамм VV-NS1-dGF вируса осповакцины, продуцирующий белок NS1 парвовируса H-1 и обладающий онколитической активностью в отношении глиобластомы человека
Вид РИД
Изобретение
Изобретение относится к рекомбинантному штамму вируса осповакцины, продуцирующему белок NS1 парвовируса крыс Н-1, обладающему противоопухолевой активностью, и может быть использовано в биотехнологии, в частности, в генетической инженерии для разработки лекарственных средств нового поколения для борьбы с онкологическими заболеваниями, в частности с опухолями головного мозга человека.
Глиобластома - самая агрессивная первичная опухоль головного мозга человека с крайне неблагоприятным прогнозом. Средний безрецидивный период у больных глиобластомой составляет 6 мес., а средняя продолжительность жизни не превышает 9-12 мес. [1]. Несмотря на внедрение множества новых методов лечения, за последние 30 лет средняя продолжительность жизни больных увеличилась всего лишь на 2-3 мес. [2,3].
Лечение глиом представляет особую сложность. В настоящее время общепринятой в большинстве случаев является тактика комбинированного лечения, включающего хирургическую резекцию и последующую химио- и радиотерапию [4]. Основным ограничением в нейрохирургии глиом является недостаточная визуализация границ опухоли вследствие ее инфильтративного роста и расположения в функционально значимых областях головного мозга. Прогрессирование заболевания и неизбежный рецидив после проведенного лечения обусловлены, по-видимому, уцелевшими стволовыми клетками глиомы (СКГ), обладающими повышенной инвазивностью и устойчивостью к радио- и химиотерапевтическим воздействиям [1, 5].
Таким образом, существующие методы лечения глиом малоэффективны. В связи с этим актуальны работы по разработке улучшенных методов лечения. Применение онколитических вирусов (ОВ) является одним из перспективных инновационных подходов к терапии опухолей, в частности, к терапии глиом [5].
Терапия с применением онколитических вирусов обеспечивает избирательный лизис опухолевых клеток, а также высвобождение опухолеассоциированных антигенов и презентацию их иммунной системе хозяина. Малая вероятность формирования внутренней резистентности в опухолевых клетках к ОВ и отсутствие значительных побочных эффектов даже при высоких дозах системного введения, делает ОВ особо привлекательными для генно-инженерной разработки улучшенных вариантов с высокой терапевтической активностью для лечения онкологических больных [2,6]. Ряд онколитических вирусов в настоящее время уже проходят клинические испытания за рубежом в качестве новых противоопухолевых средств для лечения глиом.
На основе вируса кори был создан рекомбинантный онколитический штамм MV-CEA, который экспрессирует раково-эмбриональный антиген (CEA) - секретируемый белок, по уровню которого в сыворотке больного можно оценивать активность вируса в организме [7]. Вирус хорошо реплицировался и вызывал апоптоз при заражении различных культур клеток глиобластом человека. При испытании in vivo на модели глиобластомы человека U87, культивируемой на бестимусных мышах, вирус оказывал выраженное терапевтическое действие в отношении как подкожных, так и внутричерепных опухолей [7]. Вирус MV-CEA не обладал токсичностью при внутричерепном введении мышам и макакам-резус [7]. В октябре 2006 г.началась первая фаза клинических испытаний штамма MV-CEA на больных глиобластомой, итоговые результаты этих испытаний планируется опубликовать летом 2018 года. (https://www.clinicaltrials.gov/ct2/show/NCT00390299).
На основе онколитического герпесвируса был сконструирован штамм HSV1716, в котором делетирован ген ICP34.5, являющийся фактором нейровирулентности вируса. В доклинических исследованиях этот штамм селективно реплицировался в клетках глиом, а в нормальных клетках его репликация была блокирована. Штамм HSV1716 прошел три клинических испытания первой фазы среди пациентов с рецидивирующей глиомой. Испытания показали отсутствие токсичности и латентной герпесвирусной инфекции, а также замедление или прекращение прогрессии опухоли и увеличение продолжительности жизни у некоторых пациентов [8].
Другой штамм герпесвируса G207 несет как делецию обеих копий гена ICP34.5, так и инактивирующую инсерцию репортерного гена LacZ в области гена ICP6, кодирующего рибонуклеотид-редуктазу. Удаление этих трех генов еще более повышает аттенуацию вируса в отношении нормальных клеток и дополнительно усиливает его онкоселективность по сравнению со штаммом HSV1716. Штамм G207 прошел клинические испытания фазы 1а и 1b в группе пациентов с рецидивирующей глиобластомой. Препарат не оказывал токсического эффекта. У восьми больных из 21 был отмечен положительный ответ на терапию, у одного пациента продолжительность жизни после терапии составила 5,5 лет [1,9].
Среди онколитических аденовирусов, клинические испытания на пациентах с глиобластомами прошел пока только один рекомбинантный штамм dl1520, также известный как ONYX-015, способный избирательно реплицироваться в опухолевых клетках. Селективный онколитический эффект этого штамма достигается за счет делеции гена, кодирующего белок Е1В-55K и подавляющего активность опухолевого супрессора р53, что, в свою очередь, препятствует запуску апоптоза в зараженной клетке до окончания вирусного цикла. В случае делеции гена Е1В-55K репликация вируса будет успешной только в тех клетках, где р53 дефектен или отсутствует [10]. В первой фазе клинических испытаний штамма ONYX-015 участвовали 24 больных глиобластомой, дефектной по статусу р53. Результаты проведенных клинических испытаний показали, что препарат не вызывал серьезных побочных явлений. У одного больного прекратился рост опухоли, еще у одного замедлилась скорость роста опухоли, трое оставались живыми в течение более 19 мес. [11]. В настоящее время препарат HI01 (Oncorine) на основе штамма d1l520 (прототип ONYX-015) получил лицензию на применение в Китае. Хотя изначально этот препарат предназначался для лечения глиом, наибольшую эффективность он продемонстрировал при терапии злокачественных опухолей головы и шеи.
С использованием вышеперечисленных препаратов у большинства пациентов отчетливой положительной динамики не наблюдалось, однако, вместе с тем сообщается об отдельных случаях клинического улучшения после терапии ОВ. Такие результаты могут быть связаны с тем, что для I/II фазы клинических испытаний отбираются пациенты с 3-4 стадией онкологического заболевания при условии неэффективности для этих пациентов всех использованных ранее традиционных методов лечения опухоли (хирургического, химиотерапевтического и лучевого лечения). Также применяются довольно консервативные режимы терапии и невысокие дозы вируса.
Наиболее успешным в применении против глиобластом стал препарат ParvOryx, созданный на основе парвовируса HI [12,13]. В 2011 году в Германии были начаты I-II фазы клинических испытаний ParvOryx, которые показали его безопасность и признаки иммуногенной активности в отношении опухолей в группе пациентов с мультиформной рецидивирующей глиобластомой [14]. По результатам доклинических испытаний этого препарата до 80% животных с глиомой С6 после локального, системного или интраназального лечения препаратом ParvOryx полностью выздоравливали [13]. При комбинировании ParvOryx с предварительной радиотерапией цитотоксическое действие вирусного препарата еще более возрастало [15]. Таким образом, данный вирусный препарат на сегодняшний день можно считать одним из наиболее перспективных для лечения глиом.
Однако онколитический потенциал парвовируса является недостаточным для лизиса плотной массы солидной опухоли, а маленький размер его генома (5 тыс. п.н.) ограничивает возможности генно-инженерной модификации по усилению противоопухолевой активности препаратов на его основе. Мы в своей работе решили объединить онколитический потенциал парвовируса Н-1 и вируса осповакцины в отношении глиом. Вирус осповакцины (ВОВ), как онколитический агент, обладает целым рядом преимуществ относительно других вирусов, на основе которых были созданы противоглиомные препараты. Он реплицируется в цитоплазме инфицированных клеток в автономных образованиях «вирусных фабриках», не контактирует с клеточным генетическим материалом, не встраивается в хромосомы, не имеет онкогенного потенциала. ВОВ обладает высоким литическим потенциалом для раковых клеток, хорошо передается от клетки к клетке через непосредственные мембранные контакты, что особенно важно для плотно агрегированных солидных опухолей [16]. ВОВ способен системно распространяться по организму, что обеспечивает его эффективную доставку к отдаленным опухолям и метастазам [17]. Исследование известных к настоящему времени штаммов ВОВ на способность реплицироваться в нормальных и опухолевых клетках показало, что уровень репликации всех штаммов в опухолевых клетках выше, чем в нормальных [18]. Для еще большего усиления селективных свойств в отношении опухолевых клеток, используют аттенуированные штаммы ВОВ [19]. Аттенуация может быть достигнута удалением одного или нескольких генов факторов вирулентности VACV, в частности, гена вирусного ростового фактора (virus growth factor, VGF). Ген VGF кодирует секретируемый белок, который стимулирует метаболическую активность, рост и деление окружающих неинфицированных клеток, обеспечивая эффективное распространение инфекции. Таким образом, делеция гена VGF обеспечит как аттенуацию вируса, так и его онкоселективность, поскольку экспрессия этого гена несущественна для репликации вируса в быстро делящихся клетках раковой опухоли.
Размер генома ВОВ позволяет встраивать до 25000 пар оснований чужеродной ДНК, не нарушая инфекционности вируса. Способность нести большое количество введенных инородных генов (трансгенов) используют для того, чтобы усилить онколитические свойства поксвирусов.
Перспективным трансгеном для усиления онколитической активности аттенуированных штаммов ВОВ в отношении глиом является неструктурный белок NS1 парвовируса крыс Н-1. При доклиническом исследовании ParvOryx было показано, что главным фактором, ответственным за онколитическую и цитотоксическую активность парвовирусов, является именно белок NS1, который способен специфически запускать апоптоз в раковых клетках человека. Опухолевые клетки мозга оказались особенно уязвимы к прямому цитотоксическому действию NS1 [14].
Наиболее близким аналогом (прототипом) представленного изобретения является рекомбинантный штамм BOB VVdGF-ApoS24/2 со встройкой синтетического гена апоптина вируса лейкоза кур, который способен индуцировать апоптоз широкого спектра раковых и трансформированных клеток. Рекомбинантный штамм VVdGF-ApoS24/2 имеет значимо большую цитотоксическую активность для ряда раковых клеток по сравнению с исходным родительским штаммом (Патент РФ №2492238) [20]. Однако наибольшую эффективность штамм VVdGF-ApoS24/2 проявил в отношении эпидермоидной карциномы кожи человека.
Техническим результатом заявляемого изобретения является рекомбинантный штамм BOB VV-NS1-dGF со встройкой синтетического гена NS1 парвовируса Н-1, обладающий специфической онколитической активностью в отношении глиобластом человека.
Указанный технический результат достигается конструированием рекомбинантного штамма VV-NS1-dGF на основе российского штамма Л-ИВП ВОВ, содержащего делецию фрагмента гена вирусного ростового фактора (VGF) между позициями 7770 и 8071 п.н. (GenBank Асе. KP233807.1), в район которой встроен синтетически полученный трансген NS1, структура которого соответствует позициям 264 - 2280 п.н. генома парвовируса Н-1 (GenBank Асс. Х01457.1) с добавлением на С-конце белка последовательности, кодирующей эпитоп FLAG с мотивом DYKDDDDK, для иммунодетекции белка; трансген NS1 экспрессируется под контролем синтетического промотора PE/L ВОВ и продуцирует рекомбинантный белок NS1 с молекулярной массой 100 кДа; штамм VV-NS1-dGF обладает высокой онколитической активностью в отношении клеток глиобластомы человека и депонирован в Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор» под номером V-808.
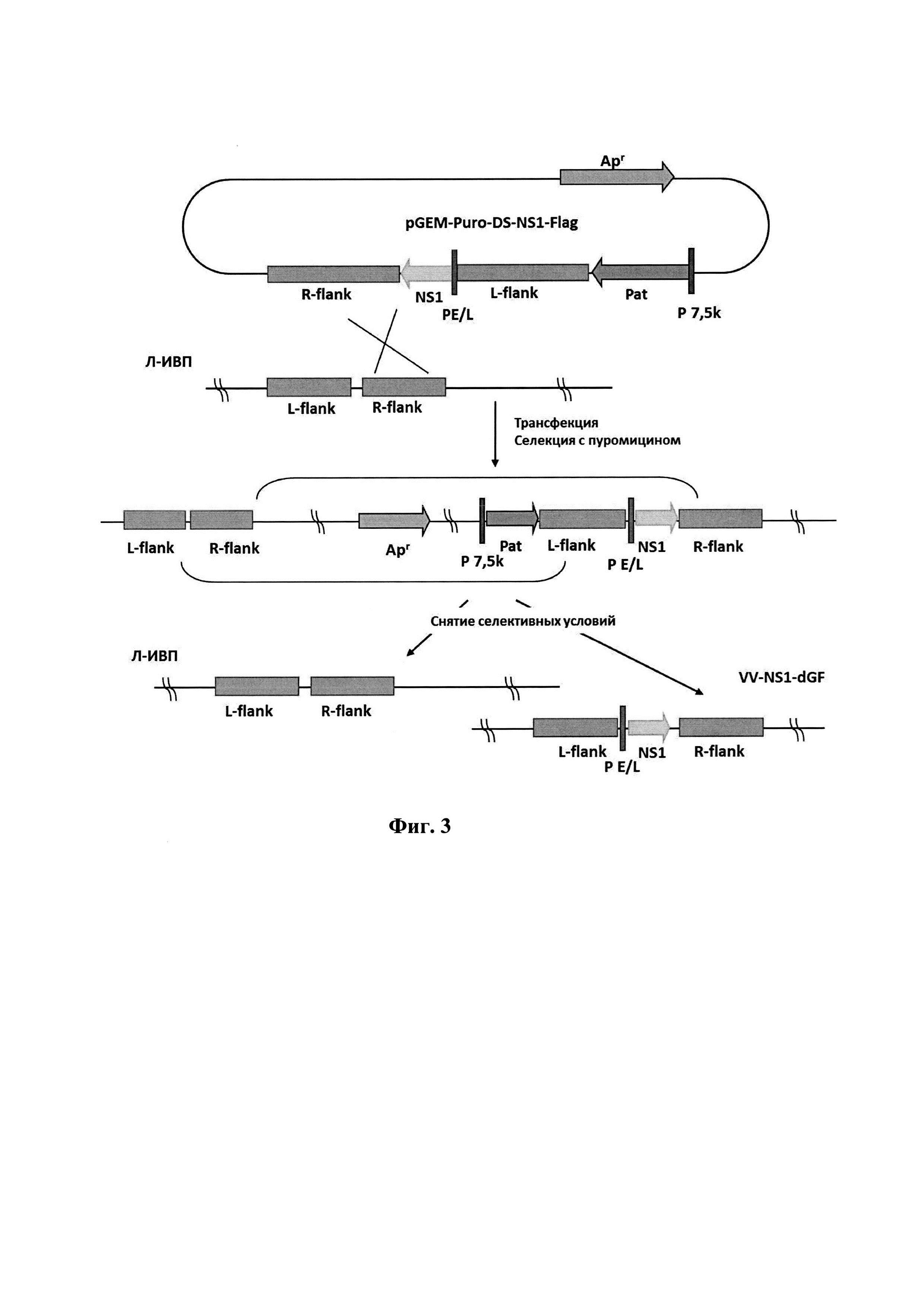
Штамм VV-NS1-dGF образуется за счет одиночного кроссинговера между ДНК штамма Л-ИВП и плазмидной ДНК pGEM-Puro-NS1-Flag (фиг. 1) в цитоплазме клеток CV-1, последующей селекции полученной нестабильной конструкции с добавлением в культуральную среду пуромицина за счет наличия в ней гена устойчивости к этому антибиотику (Pat) [21] и внутримолекулярной рекомбинации после снятия селективных условий (фиг. 3). Последовательность гена NS1 парвовируса Н-1 с дополнительным фрагментом, кодирующим эпитоп FLAG, и фланкирующими сайтами рестрикции ApaI и NotI была синтезирована коммерчески. Далее эта последовательность по сайтам рестрикции ApaI и NotI была клонирована в плазмиду pGEM-Puro-UN-DS [21] под контроль ранне-позднего синтетического промотора PE/L ВОВ с получением плазмиды pGEM-Puro-DS-NS1-Flag. Эта плазмида использована для встройки гена NS1 и одновременной делеции гена VGF штамма Л-ИВП ВОВ.
Встройка в качестве трансгена гена NS1 в район делеции гена VGF способствует как дополнительной аттенуации (ослаблению) вируса в отношении нормальных клеток, так и усилению его литической (цитотоксической) активности в отношении клеток опухолей головного мозга.
Штамм VV-NS1-dGF характеризуется следующими признаками:
Морфологические признаки. Штамм обладает свойствами типичного представителя ВОВ, но в отличие от исходного штамма Л-ИВП имеет фенотип VGF-NS1+. Показано, что при заражении клеток глиобластомы U87MG штамм VV-NS1-dGF продуцирует белок NS1 парвовируса Н-1 с молекулярной массой 100 кДа, детектируемый в иммуноблоте по наличию эпитопа FLAG.
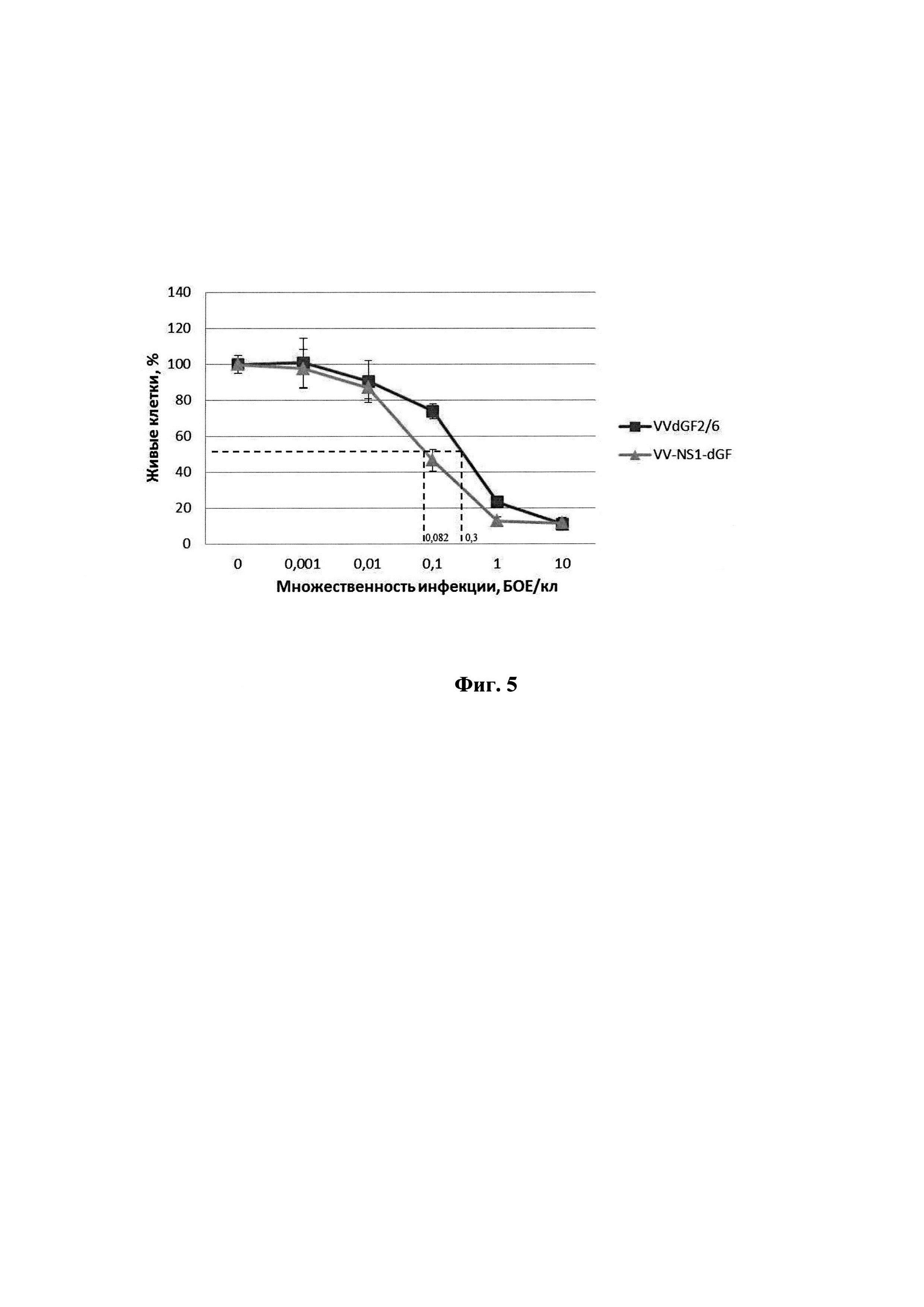
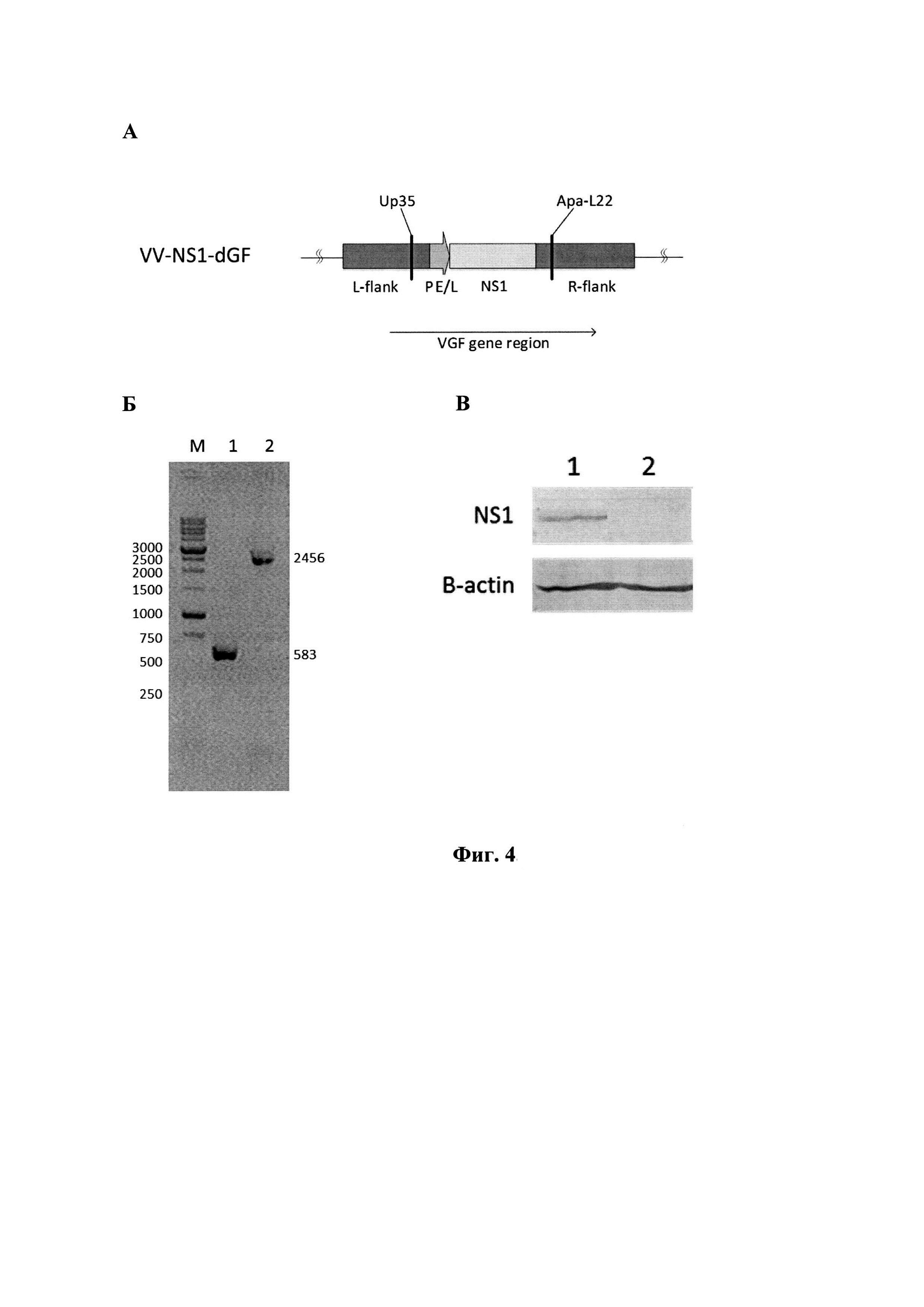
Физиолого-биохимические характеристики и культуральные свойства штамма. ДНК рекомбинантного штамма VV-NS1-dGF имеет длину около 200000 п.н. Наличие в его геноме целевой вставки длиной 2058 п.н подтверждено с помощью метода ПНР (фиг. 3), экспрессия гена NS1 подтверждена Western blot анализом лизатов клеток U87MG, инфицированных рекомбинантным штаммом VV-NS1-dGF (фиг. 4). Рекомбинантный штамм VV-NS1-dGF со встройкой гена NS1 имеет значимо (Р<0.05) большую цитотоксическую активность в отношении клеток глиобластомы человека U87MG по сравнению с аналогичным образом аттенуированным рекомбинантом VVdGF2/6 с делецией гена VGF, но не содержащим встройку трансгена NS1 [21]. Рекомбинантный штамм VVdGF2/6 является более адекватным контролем для оценки вклада трансгена NS1 в онколитическую активность рекомбинанта VV-NS1-dGF, чем родительский не аттенуированный штамм Л-ИВП. ЦТД50 рекомбинантных штаммов VV-NS1-dGF и VVdGF2/6 составляет 0,082 и 0,3 БОЕ/клетку, соответственно.
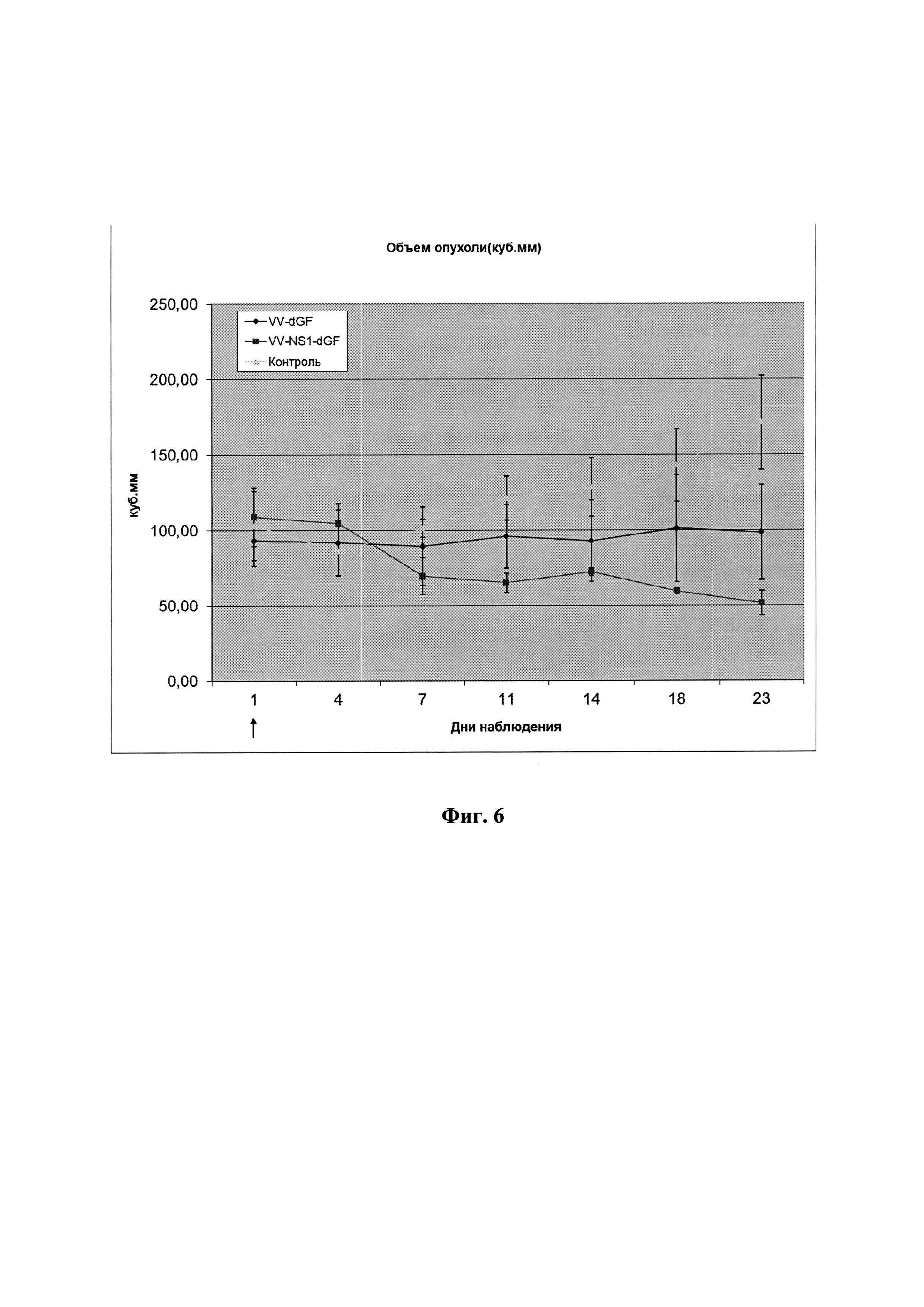
Противоопухолевая активность рекомбинантного штамма VV-NS1-dGF in vivo на модели nude мышей с подкожными ксенографтами клеток глиобластомы человека U87MG оказалась также выше по сравнению со штаммом VVdGF2/6, не содержащим встройку NS1. Однократное введение в район опухоли рекомбинантного штамма VV-NS1-dGF приводит к значимому уменьшению размеров ксенографтов (фиг. 7). Нужно отметить, что никакого токсического эффекта при введении иммунодефицитным мышам высоких доз рекомбинантных штаммов VV-NS1-dGF и VVdGF2/6 (107 БОЕ/мышь) выявлено не было, что свидетельствует об аттенуации штаммов. При этом дополнительное введение трансгена NS1 усиливает адресную литическую активность вируса в отношении клеток глиобластомы человека.
Изобретение иллюстрируется следующими фигурами графических изображений:
Фиг. 1. Нуклеотидная последовательность синтетического гена NS1 с заложенными по краям последовательности сайтами рестрикции ApaI и NotI (подчеркнуты и выделены цветом).
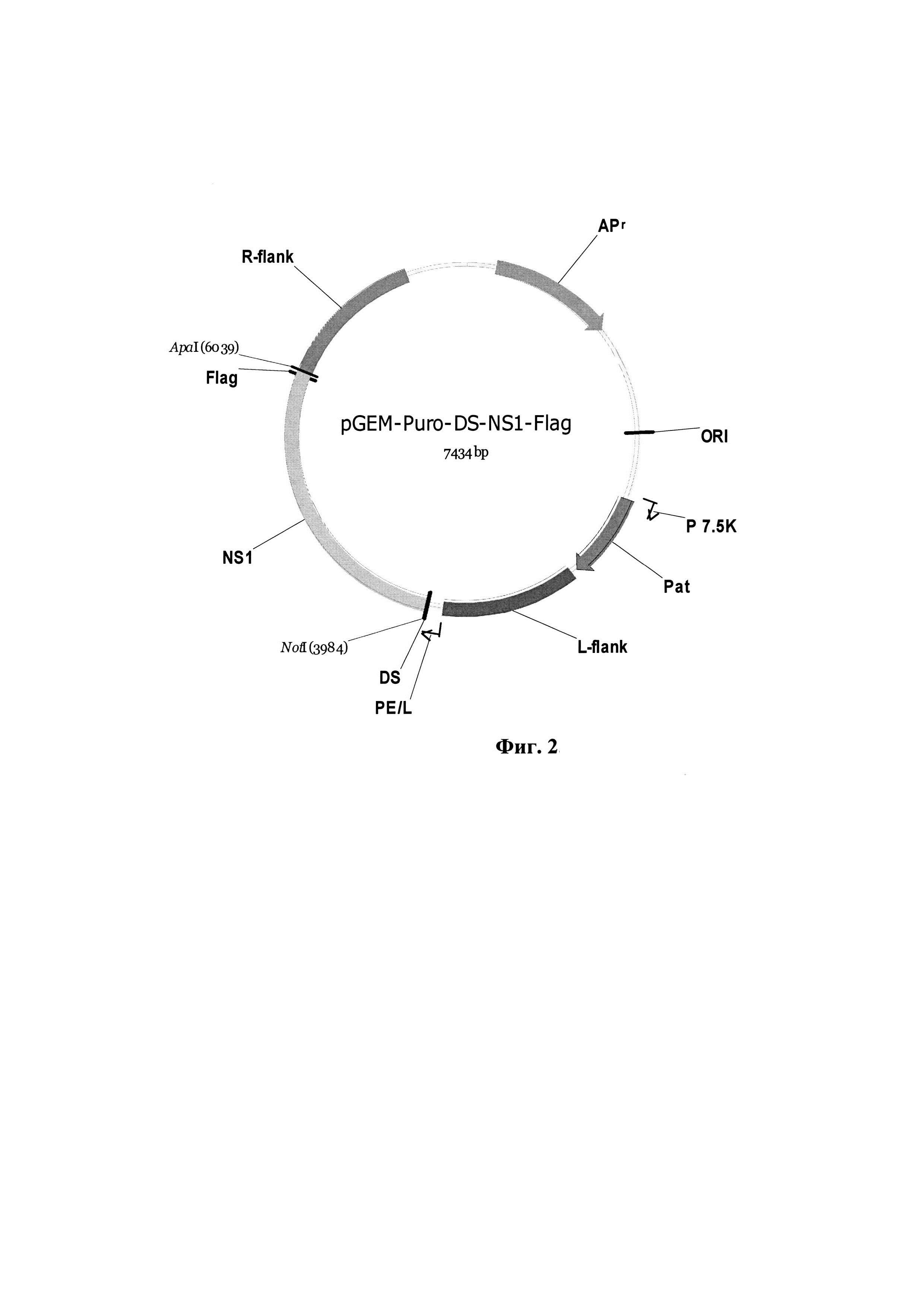
Фиг. 2. Физическая и генетическая карта плазмиды pGEM-Puro-DS-NS1-Flag. L-flank - фрагмент генома ВОВ штамма Л-ИВП длиной 939 п.н., расположенный слева от гена VGF; R-flank - фрагмент генома ВОВ длиной 980 п.н., расположенный справа от гена вирусного ростового фактора; Р7.5К (36 п.н.) и PE/L (42 п.н.) - синтетические ранний и ранне-поздний промоторы ВОВ [22]; NS1- синтетический ген NS1 парвовируса Н-1 с заложенными по краям последовательности сайтами рестрикции ApaI и NotI, размер 2058 п.н; Pat - ген пуромицин N-ацетилтрансферазы, определяющий устойчивость к пуромицину; APr - ген β-лактамазы, определяющий устойчивость к ампициллину; ORI - область начала репликации.
Фиг. 3. Схема конструирования рекомбинантного штамма VV-NS1-dGF ВОВ методом временной доминантной селекции с использованием в качестве маркера гена устойчивости к пуромицину (Pat). L-flank и R-flank -фрагменты генома ВОВ, штамм Л-ИВП, фланкирующие ген VGF слева и справа соответственно (как на фиг. 2); NS1 - ген NS1 парвовируса Н-1 (как на фиг. 2); Р7.5К и PE/L - синтетические промоторы ВОВ (как на фиг. 2);
Фиг. 4. Структура рекомбинантного штамма VV-NS1-dGF. А - схема генома с указанием позиций праймеров (подписи как на фиг. 3). Б - результаты ГЩР-анализа рекомбинантов с использованием пары праймеров Up35×Apa-L22.
Мв - контроли молекулярных весов; 1 - исходный штамм Л-ИВП (583 п.н.); 2 - рекомбинант VV-NS1-dGF (2456 п.н.). В - Вестерн-блот анализ с использованием коммерческих антител на эпитоп FLAG, введенный в С-конец рекомбинантного белка NS1, а также с антителами к структурному белку P-actin в качестве контроля, где: 1 - лизат клеток U87G, инфицированных VV-NS1-dGF; 2 - лизат клеток U87G, инфицированных Л-ИВП.
В качестве специфических антител использовали ANTI-FLAG BioM2 (Sigma-Aldrich, США). В качестве вторичных антител - антимышиные IgG (целая молекула), конъюгированные с щелочной фосфатазой (Sigma-Aldrich, США). В качестве субстрата использовали BCIP (5-bromo-4-chloro- 3-indolyl phosphate) и NBT (Nitro Blue tetrazolium).
Фиг. 5. Онколитическая активность рекомбинантного штамма VV-NS1-dGF в клетках глиобластомы человека в сравнении с аналогичным рекомбинантом VVdGF2/6, не содержащим встройки NS1. Клетки выращивали в 96-ти луночных планшетах, инфицировали 10-кратными разведениями вируса в диапазоне доз 0,001-10 БОЕ на клетку и рассчитывали 50%-ную цитотоксическую дозу для каждого вируса (ЦТД50) в фотометрическом тесте с использованием субстрата для митохондриальных дегидрогеназ 2,3-бис-(2-метокси-4-нитро-5-сульфо-фенил)-2Н-тетразолий-5-карбоксанилида (реагент ХТТ).
Фиг. 6. Ингибирование роста ксенографтов глиобластомы человека U87MG рекомбинантным штаммом VV-NS1-dGF и штаммом сравнения VVdGF2/6. Стрелкой указана точка введения вируса и начала измерения (1 сутки). Дни наблюдения на оси абсцисс указывают период, прошедший после начала «лечения» (введение вируса). Различия между всеми группами достоверны на 23 сутки эксперимента на уровне значимости Р<0,05.
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pGEM-Puro-NS1-Flag.
Плазмида pGEM-Puro-NS1-Flag была получена на основе pGEM-Puro-UN-DS [21]. Ген NS1 парвовируса Н-1 получен синтетическим путем в соответствии со структурой, представленной в GenBank под номером Х01457.1, позиции нуклеотидов 264-2280 (DNA2.0, США). К С-концу гена NS1 была добавлена последовательность, кодирующая эпитоп FLAG с мотивом DYKDDDDK, для иммунодетекции синтезируемого NS1 с помощью коммерческих антител. Также по краям последовательности гена NS1 были заложены сайты рестрикции ApaI и NotI (фиг. 1).. Конструирование целевой плазмиды заключалось в лигировании фрагмента NS1/NotI-ApaI в векторную плазмиду pGEM-Puro-UN-DS/NotI-ApaI.
Полученная рекомбинантная плазмида pGEM-Puro-NS1-Flag (фиг. 2) была наработана в препаративных количествах из 1000 мл среды Лурия-Бертани и выделена с использованием набора лабораторных реагентов для выделения плазмидной ДНК, очищенной от эндотоксинов «EndoFree Plasmid Maxi Kit» (Qiagen). Данная плазмида использована для встройки трансгена NS1 в район делеции гена VGF в геноме ВОВ.
Пример 2. Трансфекция клеток CV-1 рекомбинантной плазмидой pGEM-Puro-NS1-Flag и получение рекомбинантного штамма BOB VV-NS1-dGF.
Рекомбинантный штамм VV-NS1-dGF получен в результате однократного кроссинговера между геномной ДНК штамма Л-ИВП ВОВ и гомологичной последовательностью одного из фланков VGF-гена плазмидной ДНК pGEM-Puro-NS1-Flag (пример - R-flank на фиг. 3). В результате кроссинговера образуется нестабильная вирусная конструкция, которая, за счет встройки гена Pat, обладает устойчивостью к пуромицину. Количество образующихся рекомбинантов невелико, однако уже через три селективных пассажа с добавлением в культуральную среду пуромицина вирусная популяция практически полностью состоит из рекомбинантных вариантов. После снятия селективных условий за счет внутримолекулярной рекомбинации по гомологичным участкам плазмидной и вирусной ДНК происходит расщеплнние нестабильной конструкции на исходный вариант с геномом штамма Л-ИВП и искомый вариант VV-NS1-dGF (фиг. 3).
Для получения рекомбинантного штамма вируса VV-NS1-dGF использовали реагент для трансфекции Lipofectamine™ LTX и реагент Plus (Invitrogen). Трансфекцию проводили на 90%-ном монослое клеток CV-1, выращенном в шестилуночных планшетах (Greiner). Клетки инфицировали вирусом осповакцины с множественностью 0,05 БОЕ/клетка и через 1 час инкубации при 37°С добавляли смесь плазмидной ДНК (5 мгк)+липофектамин (20 мкл)+Реагент Plus в соответствии с рекомендацией производителя в 1 мл среды Opti-MEM (Invitrogen). Через 1 час инкубации при 37°С в лунки добавляли 2 мл среды Opti-MEM и инкубировали при 37°С в атмосфере 5% СО2 24-36 часов до развития цитопатического действия (ЦПД). Материал трижды замораживали-оттаивали и обрабатывали ультразвуком для получения гомогенной вирусной суспензии. Далее проводили селекцию рекомбинантов путем трехкратного пассирования на монослое клеток CV-1 с добавлением пуромицина (Sigma) в концентрации 10 мкг/мл среды DMEM (Invitrogen). Вирус клонировали методом бляшек под твердым агаровым покрытием и анализировали на наличие встройки гена NS1 методом ГЩР с использованием праймеров Up35 5'-GTAAGCAAAGAATATAAGAATGAAGCGGTAATGAT-3' и Apa-L22 5'-CGAGCACAATACCGGGAGATGG-3' (позиции праймеров указаны на фиг. 4А). Вирусную ДНК для проведения ГЩР выделяли с использованием наборов «РИБО-сорб» (ЗАО «Интерлабсервис»). Размер амплифицированного фрагмента ДНК исходного ВОВ составлял 583 п.н. (фиг. 4), а рекомбинантного вируса со встройкой гена NS1 - 2456 п.н. (фиг. 4Б). Отобранный рекомбинантный вариант VV-NS1-dGF дважды реклонировали, чтобы избежать следовых примесей исходного вируса, нарабатывали на монослое клеток CV-1 и очищали центрифугированием в градиенте плотности сахарозы (25-40%). Титр вируса определяли методом бляшек на монослое клеток CV-1, окрашенном фиксирующим раствором кристаллического фиолетового (2 г/л кристаллический фиолетовый, 50 мл/л формальдегид, 100 мл/л этанол, вода). Очищенный рекомбинантный штамм BOB VV-NS1-dGF с титром 109 БОЕ/мл хранится в расфасованном виде при -80°С и используется для проведения дальнейших исследований.
Пример 3. Оценка экспрессии гена NS1 рекомбинантным штаммом ВОВ VV-NS1-dGF.
Экспрессию трансгена NS1 в составе рекомбинантов анализировали методом Вестерн-блот с использованием коммерческих антител на эпитоп FLAG, введенный в С-конец рекомбинантного белка (фиг. 1). Размер транскрипта, включающего последовательность гена NS1 и эпитопа FLAG, составляет 2163 п.н. Расчетная молекулярная масса полипептида составляет 75-80 кДа. По данным литературы в инфицированных парвовирусом Н-1 клетках регистрируется две формы белка NS1 - с молекулярной массой 84 кДа и 100 кДа [24]. Увеличение молекулярной массы обуславливается разной степенью фосфорилирования белка. Форма NS1 с молекулярной массой 100 кДа является наиболее полной его модификацией, необходимой для выполнения множественных функций этого белка, включая онкотоксические функции.
Вестерн - блот анализ проводили следующим образом. Монослой клеток U87G (90% поверхности), выращенный в культуральном матрасе объемом 650 мл (Greiner), инфицировали рекомбинантным штаммом ВОВ VV-NS1-dGF с множественностью 1 БОЕ/кл. Инкубировали 24 часа при 37°С в атмосфере 5% CO2 в среде ДМЕМ с 2% фетальной бычьей сыворотки, затем среду удаляли, клетки разрушали лизирующим буфером (50 мМ Трис-HCl рН 7.5, 150 мМ NaCl, 1% Triton Х-100, 5 мМ MgCl2, смесь ингибиторов протеаз (proteases inhibitor cocktail)) в объеме 7 мл. Проводили три раунда замораживания-оттаивания и обработку ультразвуком (3 раза по 20 с при 200-300 Вт с охлаждением (10 с) после каждой обработки), центрифугировали (14000 об/мин, 30 мин, 4°С). Супернатант анализировали методом электрофореза с последующим переносом белков на мембрану (Вестерн-блот) с использованием в качестве первичных антител ANTI-FLAG BioM2 (Sigma-Aldrich, США), а в качестве вторичных - антимышиные IgG (целая молекула), конъюгированные с щелочной фосфатазой (Sigma-Aldrich, США). Электрофоретическое разделение белков проводили в камере «BioRad» в 5% концентрирующем и 12% разделяющем акриламидном геле при V=100. Перенос белков с геля осуществляли в камере Mini Trans-Blot cell «BioRad» на мембрану Immun-BlotTMPVDF Membrane for Protein Blotting 0,2 μm при V=100 1 час 20 минут.Затем мембрану промывали буфером для переноса и помещали в блокирующий раствор - TBS рН 7,4 с 5% молоком (Skim Milk Powder, Biochemika, Fluka) на 1 час при комнатной температуре (КТ) на качалке. Отмывали мембрану 3 раза по 5 минут TBS рН 7,4 на качалке и инкубировали 16 часов, при +4°С с первичными антителами в рабочей концентрации 0,2 мкг/мл, в TBS рН 7,4 с 0,1% Tween-20 и 5% молока. После связывания с первичными антителами мембраны отмывали 3 раза по 5 минут TBS рН 7,4 с 0,1% Tween-20 на качалке, затем проводили связывание со вторичными антителами в рабочем разведении 1:5000 в TBS рН 7,4 с 0,1% Tween-20 и 5% молока в течение 1 часа при КТ на качалке. После связывания с коньюгатом отмывали 3 раза по 5 минут TBS рН 7,4 с 0,1% Tween-20 на качалке. В качестве субстрата использовали BCIP (5-bromo-4-chloro-3-indolyl phosphate) и NBT (Nitro Blue tetrazolium). Останавливали реакцию промыванием мембраны в дистиллированной воде.
Результаты эксперимента представлены на фиг. 4 В, из которого следует, что в лизатах клеток, инфицированных штаммом VV-NS1-dGF выявляется белок с молекулярной массой 100 кДа, который позитивно реагирует с антителами к эпитопу FLAG (фиг. 4 В, дорожка 1). В лизатах клеток, инфицированных исходным штаммом Л-ИВП специфический белок не выявляется (фиг. 4 В, дорожка 2). Таким образом, сконструированный нами рекомбинантный штамм VV-NS1-dGF экспрессируют белок NS1 в форме, наиболее близкой к его природной полноразмерной модификации.
Пример 4. Оценка онколитической активности рекомбинантного штамма BOB VV-NS1-dGF в отношении клеток глиобластомы человека.
Исследование онколитической активности рекомбинантного варианта VV-NS1-dGF in vitro в отношении клеток глиобластомы человека U87MG проводили микрометодом на 96-луночных культуральных планшетах (Greiner) с использованием субстрата для митохондриальных дегидрогеназ 2,3-бис-(2-метокси-4-нитро-5-сульфо-фенил)-2Н-тетразолий-5-карбоксанилида (реагент ХТТ) (Sigma). В качестве отрицательного контроля использовали рекомбинантный штамм VVdGF2/6, с делецией гена VGF, но не содержащий встройку трансгена NS1 [21]. Рекомбинантный штамм VVdGF2/6 является более адекватным контролем для оценки онколитической активности рекомбинанта VV-NS1-dGF, чем родительский неаттенуированный штамм Л-ИВП. Онколитическую активность вирусов выражали как ЦТД50 - эффективная концентрация вируса, выраженная в количестве бляшкообразующих единиц на клетку (БОЕ/кл.), необходимая для гибели 50% клеток. Для определения ЦТД50 в лунки планшета с 50%-ным монослоем клеток вносили десятикратные разведения вирусной суспензии с множественностью инфекции от 10 до 0,001 БОЕ/кл. (multiplicity of infection, MOI) в 100 мкл среды 199 (Биолот) с добавлением 2% фетальной сыворотки коров (HyClone). Планшеты помещали в термостат при температуре 37°С, 5% СО2, влажности 85% и инкубировали 72 часа. После инкубации в каждую тестируемую лунку добавляли по 50 мкл реагента ХТТ и феназин-метасульфата (PMS) (Sigma), который получали добавлением к рабочему раствору с содержанием ХТТ 1 мг/мл раствора PMS 1,25 мМ из расчета: на каждый 1 мл ХТТ - 20 мкл PMS. Планшет инкубировали еще 3 часа и определяли оптическую плотность ОП490/620 на планшетном спектрофотометре SpectraCount (Packard). Строили график зависимости ОП от MOI и определяли ЦТД50 - концентрацию вируса, при которой величина ОП490/620, измеренная в зараженных лунках, составляет 50% от величины ОП490/620, измеренной в лунках с незараженной культурой. Сравнивали ЦТД50 рекомбинантного штамма BOB VV-NS1-dGF с ЦТД50 контрольного штамма W-dGF2/6 (фиг. 5). ЦТД50 рекомбинантного штамма VV-NS1-dGF (0,082 БОЕ/кл.) значимо ниже ЦТД50 контрольного штамма VVdGF2/6 (0,3 БОЕ/кл.) (Р<0,05), что свидетельствует об усилении онколитической активности вируса в результате встройки трансгена NS1 в отношении клеток глиобластомы человека.
Пример 5. Оценка онколитической активности патентуемого штамма BOB VV-NS1-dGF и рекомбинанта сравнения VVdGF2/6 in vivo на ксенографтах глиобластомы человека U87MG, привитых подкожно мышам линии nude.
В работе использовали самок nude мышей в возрасте 6-8 нед, весом 18-20 г.Для формирования опухолей мышам вводили суспензию клеток U87MG. С этой целью суспензию клеток U87MG (1,0×10 клеток/мл) в 0,9% NaCl смешивали с Matrigel (BD Bioscience, США) в соотношении 2:1 и 100 мкл этой суспензии вводили подкожно в правый бочок мыши ближе к бедру. Время формирования опухолей (ксенографтов) составляло 20 дней, после которых в эксперимент было отобрано 15 мышей с опухолями объемом 80-120 мм3. Мышей разделили на три равные группы (n=5). Первым двум группам вводили рекомбинантные штаммы VV-NS1-dGF и VVdGF2/6 в область опухоли в дозе 107 БОЕ/мышь в 100 мкл стерильного 0,9%-го NaCl. Мышам третьей контрольной группы аналогично вводили 100 мкл 0,9%-го NaCl. Мониторинг состояния мышей осуществляли 2 раза в неделю, объем опухоли рассчитывали по формуле L×W2×0,5 [23]. Общий период наблюдения после введения вируса составил 24 дня. В течение эксперимента размеры ксенографтов у мышей контрольной группы, не подвергавшейся виротерапии, постепенно увеличивались, достигая в среднем 170 мкл к концу эксперимента (фиг. 6). Однократное введение в район опухоли рекомбинантного штамма VVdGF2/6 приводит к полному торможению роста ксенографтов. Введение же штамма VV-NS1-dGF в той же самой дозе приводит не только к торможению роста, но и к значимому уменьшению размеров ксенографтов (Р<0,05) (фиг. 6).
Таким образом, выше изложенные результаты (примеры 1-5) подтверждают достижение заявляемого технического результата, а именно, создан рекомбинантный штамм VV-NS1-dGF вируса осповакцины, продуцирующий синтетический ген NS1 парвовируса Н-1 и обладающий онколитической активностью в отношении глиобластомы человека.
Источники научно-технической и патентной информации
1. Губанова Н.В. и др. Онколитические вирусы в терапии глиом // Молекулярная Биология. - 2012. - №. 46. - С. 874-886.
2. Wollmann G., Ozduman К., van den Pol A.N. Oncolytic Virus Therapy for Glioblastoma Multiforme // Cancer J. - 2012. - Vol. 18. - No. 1. - P. 69-81.
3. Liu C. et al. Mosaic analysis with double markers reveals tumor cell of origin in glioma // Cell. 2011. - Vol. 146. - No. 2. - P. 209-221.
4. Mirimanoff R.O. et al. Radiotherapy and temozolomide for newly diagnosed glioblastoma: Recursive partitioning analysis of the EORTC 26981/22981-NCIC CE3 phase III randomized trial // J. Clin. Oncol. - 2006. - Vol. 24. - No. 16. - P. 2563-2569.
5. Баклаушев В.П. и др. Онколитические вирусы в лечении низкодифференцированных глиом // Клиническая практика. - 2015. - №. 2. - С. 46-59.
6. Cheema Т.A. et al. Multifaceted oncolytic virus therapy for glioblastoma in an immunocompetent cancer stem cell model. // Proc. Natl. Acad. Sci. U. S. A. -2013. - Vol. 110. - No. 29. - P. 12006-12011.
7. Phuong L.K. et al. Use of a vaccine strain of measles virus genetically engineered to produce carcinoembryonic antigen as a novel therapeutic agent against glioblastoma multiforme // Cancer Res. - 2003. - Vol. 63. - No. 10. - P. 2462-2469.
8. Rampling R. et al. Toxicity evaluation of replication-competent herpes simplex virus (ICP 34.5 null mutant 1716) in patients with recurrent malignant glioma // Gene Ther. - 2000. - Vol. 7. - No. 10. - P. 859-866.
9. Markert J.M. et al. Phase lb trial of mutant herpes simplex virus G207 inoculated pre- and post-tumor resection for recurrent GBM // Mol. Ther. - 2009. - Vol. 17. - No. l. - P. 199-207.
10. Bischoff J.R. et al. An Adenovirus Mutant That Replicates Selectively in p53-Deficient Human Tumor Cells // Science. - 1996. - Vol. 274. - No. 5286. - P. 373-376.
11. Chiocca E.A. et al. A phase I open-label, dose-escalation, multi-institutional trial of injection with an E1B-attenuated adenovirus, ONYX-015, into the peritumoral region of recurrent malignant gliomas, in the adjuvant setting // Mol. Ther. - 2004. - Vol. 10. - No. 5. - P. 958-966.
12. Geletneky K. et al. Phase I/IIa study of intratumoral/intracerebral or intravenous/intracerebral administration of Parvovirus H-1 (ParvOryx) in patients with progressive primary or recurrent glioblastoma multiforme: ParvOryx01 protocol //BMC Cancer. - 2012. - Vol. 12. - doi: 10.1186/1471-2407-12-99.
13. Rommelaere J. et al. Oncolytic parvoviruses as cancer therapeutics // Cytokine Growth Factor Rev. Elsevier Ltd. - 2010. - Vol. 21. - No. 2-3. - P. 185-195.
14. Geletneky K. et al. Oncolytic H-l Parvovirus Shows Safety and Signs of Immunogenic Activity in a First Phase I/IIa Glioblastoma Trial // Mol. Ther. - 2017. - Vol. 25. - No. 12. - P. 2620-2634.
15. Geletneky K. et al. Improved killing of human high-grade glioma cells by combining ionizing radiation with oncolytic parvovirus H-l infection // J. Biomed. Biotechnol. - 2010. - Vol. 2010. - doi: l0.1155/2010/350748.
16. Fields B.N., Knipe D.M., Howley P.M. Fields Virology, 5th Edition // Fields Virology. - 2007. - Vol. 2. - No. 1. 3177 p.
17. Breitbach С J. et al. Intravenous delivery of a multi-mechanistic cancer-targeted oncolytic poxvirus in humans // Nature. - 2011. - Vol. 477. - No. 7362. - P. 99-104.
18. Thorne S.H. et al. Rational strain selection and engineering creates a broad-spectrum, systemically effective oncolytic poxvirus, JX-963 // J. Clin. Invest. - 2007. - Vol.117. - No. 11. - P. 3350-3358.
19. McCart J.A., Bartlett D.L., Moss B. Combined Growth Factor-deleted And Thymidine Kinase-deleted Vaccinia Virus Vector // US 20070154458 A1. опубл. 2007.
20. Чумаков П.М. и др. Рекомбинантная плазмидная ДНК pGEM-Puro-DS-Apo, содержащая синтетический ген апоптина, фланкированный последовательностями генома вируса осповакцины из района C10L-C12L, и рекомбинантный штамм VVdGF-ApoS24/2 вируса осповакцины, продуцирующий апоптин. // Патент РФ №2492238 Опубликован 10.09.2013. -Бюл.. №25. (прототип).
21. Кочнева Г.В. и др. Apoptin enhances the oncolytic activity of vaccinia virus in vitro // Mol. Biol. - 2013. - Vol. 47. - No. 5. - P. 733-742.
22. Merchlinsky M. et al. Construction and characterization of vaccinia direct ligation vectors // Virology. - 1997. - Vol. 238. - No. 2. - P. 444-451.
23. Yu Z. et al. Oncolytic vaccinia therapy of squamous cell carcinoma // Mol. Cancer. - 2009. - Vol.8. - doi: 10.1186/1476-4598-8-45.
24. Rhode S.L., Paradiso P.R. Parvovirus replication in normal and transformed human cells correlates with the nuclear translocation of the early protein NS1. // J. Virol. - 1989. - Vol. 63. - No. 1. - P. 349-355.
Рекомбинантный штамм VV-NS1-dGF вируса осповакцины (ВОВ), депонированный в ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-803 и обладающий онколитической активностью в отношении глиобластомы человека.