Результат интеллектуальной деятельности: УЛУЧШЕННАЯ ВАКЦИНА ПРОТИВ ND-IBD НА ОСНОВЕ ВЕКТОРА HVT
Вид РИД
Изобретение
Настоящее изобретение относится к области ветеринарных вакцин, а именно, к вакцинам для домашней птицы против ND и IBD, на основе рекомбинантного вируса герпеса индеек (HVT) в качестве вирусного вектора. В частности, изобретение относится к экспрессирующей кассете рекомбинантной ДНК, к рекомбинантному HVT, содержащему экспрессирующую кассету рекомбинантной ДНК, к вакцине для домашней птицы на основе рекомбинантного HVT или к клеткам-хозяевам, содержащим рекомбинантный HVT. Кроме того, изобретение относится к способам и применениям экспрессирующей кассеты, рекомбинантнного HVT и клеток-хозяев для получения и применения вакцины.
Болезнь Марека (MD) представляет собой высокоинфекционное заболевание домашней птицы, встречающееся во всем мире и характеризующееся присутствием Т-клеточных лимфом в различных органах и нервах. Это приводит к ряду симптомов, в том числе параличу и гибели. Новорожденных птенцов можно защищать посредством полученных у иммунных матерей антител (MDA). Причиной MD является вирус болезни Марека (MDV), принадлежащий семейству Alphaherpesvirideae и роду Mardivirus. Вирион заключен в оболочку, и его размер составляет приблизительно 160 нм. В капсиде содержится большой геном линейной двухцепочечной ДНК размером от 100 до 200 т.п.н.
Существуют различные серотипы MDV, каждый с различными характеристиками. Несмотря на то, что MDV 1 серотипа (MDV1) и MDV2 патогенны для домашней птицы, MDV3 таким не является. MDV3 более известен как: вирус герпеса индеек 1, герпесвирус индеек, но, как правило, как вирус герпеса индеек (HVT). HVT описан в 1970 году (Witter et al., 1970, Am. J. Vet. Res., vol. 31, p. 525) как вирус герпеса индеек, непатогенный для кур. С тех пор такие штаммы HVT, как PB1 или FC-126, широко используют для вакцинации кур против MD, вызываемой MDV1 или MDV2. И в случае необходимости защиты от более вирулентных вариантов MDV1, HVT используется в сочетании с вакцинным штаммом MDV2, например, SB1, как в Nobilis™ Marexine CA126+SB1 (MSD Animal Health), или с аттенуированным MDV1 вакцинным штаммом, таким как Rispens, например, в Nobilis™ RISMAVAC+CA126 (MSD Animal Health).
HVT реплицируется в лимфоцитах периферической крови птиц (PBL) и, таким образом, представляет собой системный вирус, который индуцирует долговременный иммунный ответ, который в основном ориентирован на клеточную иммунную систему.
Вакцины HVT коммерчески доступны в виде замороженных клеток, инфицированных HVT, и их можно применять у кур в раннем возрасте, так как они относительно нечувствительны к антителам к HVT, таким как в составе MDA. Так как новорожденный цыпленок сталкивается с инфекционным давлением MDV, начиная с первых суток его жизни, то вакцины HVT инокулируют цыплятам как можно раньше; например, в сутки их вылупления из яйца (первые сутки) или даже до вылупления, когда они еще находятся в яйце. Этот последний подход, так называемая, "вакцинация in ovo", представляет собой форму вакцинации эмбрионов, которую, как правило, наносят на 18 сутки эмбрионального развития (ED), приблизительно за 3 суток до вылупления.
Кроме непосредственного использования в качестве вакцины, HVT также используют в качестве вакцины на основе вирусного вектора для экспрессии и доставки домашней птице различных иммуногенных белков, см. например, WO 87/04463. Как правило, экспрессируемый ген кодирует защитный антиген микроорганизма (его часть), патогенного для домашней птицы, против которого необходима вакцинация. В течение нескольких лет в векторах HVT экспрессировано множество гетерологичных генов, таких как гены: вируса болезни Ньюкасла (NDV) (Sondermeijer et al., 1993, Vaccine, vol. 11, p. 349-358), вируса инфекционного бурсита (IBDV) (Darteil et al., 1995, Virology, vol. 211, p. 481-490) и паразитарного антигена (Cronenberg et al., 1999, Acta Virol., vol. 43, p. 192-197).
Таким образом, введение домашней птице вакцины на основе вектора HVT вызывает иммунный ответ против экспрессируемого гетерологичного гена, а также против HVT, что обеспечивает защиту от MD. Это используют в ряде коммерческих продуктов вакцин на основе вектора HVT, например: с геном белка F NDV: Innovax™-ND (MSD Animal Health) и Vectormune™ HVT-NDV (Ceva); или с геном VP2 IBDV: Vaxxitek™ HVT+IBD (Merial; ранее называемая: Gallivac™ HVT-IBD) и Vectormune™ HVT-IBD (Ceva).
Альтернативно вектор HVT можно использовать для экспрессии и доставки терапевтического белка, например, цитокина, для воздействия на иммунный ответ кур (WO 2009/156,367; Tarpey et al., 2007, Vaccine, vol. 25, p. 8529-8535).
Геномная нуклеотидная последовательность HVT доступна, например, в GenBank™ как: AF291866 (штамм FC-126). Описано несколько способов встраивания гетерологичных генов в HVT, например, с использованием гомологичной рекомбинации (Sondermeijer et al., выше), космидной регенерации (US 5961982) или бакмид (бактериальные искусственные хромосомы) (Baigent et al., 2006, J. of Gen. Virol., vol. 87, p. 769-776).
Исследовано множество генетических положений для вставки конструкции гетерологичного гена в геном HVT, и описано несколько подходящих неосновных локусов, например, в уникальной короткой (US) области генома HVT (EP 431668) или в уникальной длинной (UL) области HVT (EP 794257).
Для контроля экспрессии гетерологичного гена в экспрессирующей кассете для HVT использовали различные промоторы, такие как: промотор gpX PRV (WO 87/04463), промотор LTR вируса саркомы Рауса, промотор ранних генов SV40, промотор гена бета-актина кур (EP 1298139) или промотор предраннего гена 1 цитомегаловируса человека (hCMV IE1) или мыши (mCMV IE1), см.: EP 728842. Недавно описана вакцина на основе вектора HVT, которая экспрессирует антигены NDV и IBDV с одной конструкции: WO 2013/057235.
При конструировании рекомбинантных векторов гетерологичная нуклеиновая кислота, которую необходимо вставить в геном вектора, как правило, содержит по меньшей мере один гетерологичный ген или кодирующую область, которые кодируют антиген (по меньшей мере его иммунногенную часть). Также конструкция может содержать промоторную последовательность для контроля экспрессии гетерологичного гена и регуляторные сигналы, например, энхансер или терминатор транскрипции. Такую комбинированную вставку часто обозначают как "экспрессирующая кассета".
Влияние вставки экспрессирующей кассеты в геном вектора отличается в зависимости от положения и способа ее вставки: размер генома вектора может увеличиться, остаться таким же или уменьшиться в зависимости от того, является ли конечным результатом воздействия на геном добавление, замена или удаление генетического материала, соответственно. Также влияние может оказывать положение вставки: расположение внутри кодирующей, некодирующей или регуляторной областей генома. Эти варианты, наряду с другими, влияют на характеристики конечной вакцины на основе вектора в отношении ее способности к репликации и экспрессии и ее генетической стабильности.
Какова бы ни была точная конструкция, вставленная экспрессирующая кассета должна обеспечивать живому рекомбинантному вирусному вектору преодоление ряда биологических воздействий на его стабильность и эффективность: во-первых, способность к репликации и производству потомства после введения гетерологичной вставки. Это означает, что сам вирус рекомбинантного вектора по прежнему является жизнеспособным, несмотря на вставку в его геном. Во-вторых, способность к репликации in vitro в линии клеток-хозяев в течение множества циклов при сохранении правильной и полной репликации и экспрессии гетерологичной вставки. Это означает, что репликация рекомбинанта не была ослаблена вставкой и вставленная экспрессирующая кассета стабильно поддерживается и экспрессируется. В-третьих, репликацию и экспрессию in vivo. Это означает, что рекомбинантный вирус может преодолевать сильное давление отбора у живого животного, такого как обеспечивает его иммунная система. В этом окружении потеря экспрессии гетерологичного гена вектором может благоприятствовать более быстрой репликации у животного; такие "ускользающие мутанты" могут нести приобретенные мутации или большие делеции в чужеродном гене или в его регуляторных последовательностях, и этот мутант может превзойти в росте интактные вирусные векторы. В заключение и наиболее важно, репликация вектора и экспрессия гетерологичного гена у подвергаемого воздействию индивидуума должны являться способными вызывать эффективный иммунный ответ против микроорганизма, который являлся донором гетерологичной вставки, которую экспрессирует вектор.
Таким образом, вакцина на основе рекомбинантного вектора должна обеспечивать хорошую репликацию вектора и его вставки in vitro и in vivo и эффективную экспрессию гетерологичного гена(ов) in vivo, предпочтительно на высоком уровне и устойчивую в течение длительного времени, чтобы индуцировать и поддерживать у мишени защитный иммунный ответ.
Эта комбинация характеристик позволяет проводить значительное количество циклов репликации in vitro, которые необходимы для крупномасштабного производства, а также для продолжительной экспрессии и презентации встроенного чужеродного гена иммунной системе хозяина, когда вакцина на основе вектора реплицируется у вакцинированного животного, являющегося целью воздействия. Кроме того, такая стабильность репликации и экспрессии необходимы для того, чтобы вакцине на основе вектора соответствовала очень высоким стандартам безопасности и биологической стабильности, которым должен удовлетворять рекомбинантный вирус, подлежащий применению в данной области в качестве коммерческого продукта после получения регистрационного удостоверение от правительственных или регулирующих органов.
Болезнь Ньюкасла (ND) и инфекционный бурсит (IBD) представляют собой опасные заболевания домашней птицы, встречающееся во всем мире и способные приводить к тяжелым негативным последствиям в птицеводстве в отношении благополучия животных и экономики производственного процесса. Это описано, например, в таких руководствах, как: "The Merck veterinary manual" (2010, 10th ed., 2010, C.M. Kahn edt., ISBN: 091191093X) и: "Disease of poultry" (2008, 12th ed., Y. Saif ed., Iowa State Univ. press, ISBN-10: 0813807182).
ND вызывают вирусы болезни Ньюкасла (NDV), которые принадлежат порядку Mononegavirales, конкретно семейству Paramyxoviridae, и которые в соответствии с их вирулентностью можно подразделить на четко выраженные патотипы: непатогенный лентогенный тип NDV почти не вызывает симптомов у домашней птицы. В отличие от этого, мезогенный (обладающий средней патогенностью) и велогенный (обладающий высокой патогенностью) штаммы NDV вызывают серьезное заболевание и смертность, и, таким образом, являются причиной заболеваний, подлежащих регистрации во многих странах. Симптомы заболевания включают нарушения дыхательной и нервной систем, среди которых наиболее заметными признаками являются затрудненное дыхание и искривление шеи.
В коммерческом птицеводстве защиту от инфекций и/или заболеваний, вызываемых патогенными штаммами NDV, обеспечивают посредством плановой вакцинации домашней птицы, как правило, на первые сутки после вылупления, живыми лентогенными штаммами NDV, такими как Nobilis™ ND Clone 30 (MSD Animal Health).
NDV содержит геном, который состоит из несегментированной одноцепочечной РНК с отрицательной полярностью длиной приблизительно 15 т.п.н. и содержит шесть генов, в числе которых находится ген гликопротеина слияния (F). F-белок участвует в прикреплении NDV к клеткам-хозяевам и внедрении в них и в качестве иммунодоминантного белка он может представлять собой основу эффективного иммунного ответа против NDV. F-белок NDV экспрессируется в виде нативного белка F0, который активируется после расщепления внеклеточными пептидазами.
IBD вызывают вирусы инфекционного бурсита (IBDV), также называемые "вирусами болезни Гамборо", являющиеся представителями семейства Birnaviridae. Эти вирусы содержат геном, который состоит из двух сегментов (A и B) двухцепочечной РНК. Более протяженный сегмент A кодирует полипротеин массой 110 кДа, который затем посредством аутопротеолиза расщепляется с формированием зрелых вирусных белков VP2, VP3 и VP4. Из них VP2 и VP3 представляют собой структурные белки капсида вириона, и VP2 представляет собой основной иммуноген для иммунной системы хозяина.
В случае IBDV существуют два серотипа, серотипы 1 и 2. Эти серотипы можно различать посредством реакции нейтрализации вирусов (VN). Показано, что вирусы серотипа 1 являются патогенными для кур, тогда как IBDV серотипа 2 вызывают только подострое заболевание у индеек.
Исторически вирусы IBDV серотипа 1 состоял только из одного типа, который известен как "классический" вирус IBD. Позднее появились так называемые "варианты" штаммов IBDV, которые можно идентифицировать и различать посредством реакция нейтрализации вируса с использованием панели моноклональных антител или посредством ОТ-ПЦР; это описано в Wu et al. (2007, Avian Diseases, vol. 51, p. 515-526). Хорошо известные классические штаммы IBDV представляют собой: D78, Faragher 52/70 и STC.
IBDV вызывает острую высококонтагиозную вирусную инфекцию лимфоидной ткани птиц, которая в качестве первичной мишени поражает важнейший орган иммунной системы птиц: сумку Фабрициуса. Уровень заболеваемости в восприимчивых стаях является высоким с быстрой потерей массы и с уровнем смертности от умеренного до высокого. Птицы, выздоравливающие после заболевания, могут приобретать иммунодефицит вследствие разрушения (участков) сумки Фабрициуса. Это делает их восприимчивыми к вторичным инфекциям.
Плановую вакцинацию против IBD у домашней птицы проводят как можно в более раннем возрасте с использованием аттенуированных штаммов IBDV, однако ее можно проводить только тогда, когда уровень MDA к IBDV снижается в достаточной степени, что, как правило, происходит в пределах от 15 до 20 суток после вылупления. Коммерчески доступно множество "живых" или инактивированных вакцин IBDV, например, "живая" вакцина, такая как Nobilis™ Gumboro D78 (MSD Animal Health).
Общим подходом для достижения экономической эффективности является разработка ветеринарных вакцин, содержащих комбинации антигенов. Таким образом, один цикл вакцинации может одновременно иммунизировать животных против ряда заболеваний. Это помогает не только сохранить время и сократить затраты, но также уменьшает у вакцинируемых животных дискомфорт и стресс, которые наблюдались бы в иных случаях вследствие повторных вакцинаций. Это еще более применимо для вакцин, которые необходимо вводить посредством инъекции индивидууму, например, вакцин на основе рекомбинантного HVT в качестве вирусного вектора, таким образом, в этом случае комбинированные вакцины также являются крайне желательными, и способность к одновременной защите от нескольких различных заболеваний, в дополнение к защите от MDV, обеспечиваемой самим вектором HVT, могла бы давать значительное преимущество. Однако в прошлом простая комбинация двух отдельных векторов HVT со вставками единичных гетерологичных генов оказалось неудачной: интерференция между реплицирующимися векторами вызывала у вакцинированного хозяина супрессию одного из них или обоих. Таким образом, исследование было сфокусировано на комбинированной экспрессии и доставке более одного гетерологичного антигена в одном рекомбинантном векторе HVT.
Векторные конструкции HVT, содержащие вставки нескольких генов, описаны в нескольких публикациях, например: в WO 93/025665 и WO 96/005291, где описаны двухвалентные и трехвалентные "вакцины". Аналогично: EP719864 и EP1026246. Однако большинство из описываемых конструкций из нескольких генов только предположены, и только некоторые из рекомбинантных векторов с несколькими вставками фактически сконструированы и выделены. Очень немногие были когда-либо протестированы на курах. В целом результатов по их стабильности при репликация или уровням экспрессии чужеродных генов не приведено, не говоря уже о каких-либо данных по индукции эффективной иммунной защиты у являющихся целью воздействия животных.
Фактически, из множества публикаций предшествующего уровня техники по полигенным вакцинам на основе векторов HVT, конструкциями, которые тщательно тестировали и продемонстрировали их эффективность в качестве вакцин на основе векторов против более чем двух патогенов птиц, являются только конструкция HVT, содержащая ген F NDV и ген VP2 IBDV, как описано в WO 2013/057,235, и вакцина против ILT-ND на основе вектора HVT, как описано в WO 2013/057236.
К сожалению, в результате длительного тестирования при разработке продукта одна из основных конструкций, как описано в WO 2013/057235, называемая HVP309, не продемонстрировала достаточной генетической стабильности и устойчивой экспрессии гетерологичных вставок. Этот рекомбинантный вектор HVT HVP309 содержит экспрессирующую кассету с геном F NDV под контролем основного промотора предраннего гена 1 цитомегаловируса человека с последующим нижерасположенным геном VP2 IBDV под контролем основного промотора гена бета-актина кур.
Нестабильность векторной конструкции HVP309 стала очевидной после ее репликации in vitro и in vivo, так как было выявлено, что от 1 до 3% вируса HVP309 больше не экспрессируют один или оба гетерологичных гена. Это является нежелательным с точки зрения эффективности вакцины, и это является преградой для получения регистрационного удостоверения от государственных органов. Таким образом, в настоящее время все еще отсутствует безопасная и эффективная вакцина против ND и IBD на основе вектора HVT с постоянной и надежной генетической стабильностью.
Целью изобретения является обеспечение этой потребности в данной области и впервые предоставление рекомбинантной вакцины на основе вектора HVT, которая обеспечивает эффективную иммунизацию домашней птицы против ND и IBD и которая обладает постоянной и надежной генетической стабильностью.
Сначала авторы изобретения были разочарованы, узнав что конструкция HVP309 обладает этой неустранимой генетической нестабильностью, приводящей к потере экспрессии вставок в нее гетерологичных генов. В отсутствие руководств на предшествующем уровне техники по способам преодоления этой нестабильности при сохранении эффективности вакцины и уровней репликации вирусов им пришлось полностью переконструировать эту векторную вакцину.
Это было совсем непросто и требовало осуществления неочевидных выборов и отборов. Это видно по множеству рекомбинантных конструкций HVT, которые были получены и протестированы, но не продемонстрировали желаемой комбинации приемлемых характеристик. Хотя периодически одна из новых конструкций в одном из аспектов, таком как виремия или уровень экспрессии одного из вставленных генов демонстрировала улучшение; однако затем выявляли отсутствие других свойств или отсутствие приемлемой генетической стабильности. Примеры описаны ниже в настоящем изобретении.
Поэтому авторы изобретения неожиданно обнаружили, одна конкретная вакцина на основе рекомбинантного HVT продемонстрировала хорошую репликацию вирусного вектора, устойчивую экспрессию генов F NDV и VP2 IBDV и эффективную иммунологическую защиту от ND и IBD, а также обладала улучшенной генетической стабильностью относительно конструкций на предшествующем уровне техники. Фактически в настоящее время стабильность является такой, что неэкспрессирующих бляшек более нельзя найти даже после 15 последовательных пересевов в культуре клеток и после одного пересева у птиц. Кроме того, относительно предыдущих векторных конструкций был немного (для ND) или даже значительно (для IBDV) улучшен уровень эффективности вакцины против ND и IBDV.
Ввиду потенциально большого масштаба, в котором такую векторную вакцину можно использовать в промышленном птицеводстве, эти эффекты и улучшения являются значимыми, и являются неожиданным техническим эффектом, имеющим большую коммерческую значимость. Следовательно, таким образом, можно добиться цели изобретения, и таким образом, можно преодолеть недостатки предшествующего уровня техники.
Причины, вследствие которых новая рекомбинантная вакцина против ND-IBD на основе вектора HVT обладает характеристиками улучшенной эффективности и улучшенной стабильности в настоящее время не известны.
Хотя авторы изобретения не хотят связывать себя какой-либо теорией или моделью, которые могли бы объяснить эти наблюдения, они предполагают, что выбор используемых элементов и их конкретное расположение в экспрессирующей кассете, содержащейся в этом вирусе HVT, так или иначе обеспечивают новый рекомбинантный вектор HVT, лучше соответствующий экспрессии гетерологичных генов при репликации in vitro или in vivo. Возможно это и является тем, что делает новый вектор генетически стабильным и иммунологически эффективным.
Таким образом, в первом аспекте изобретение относится к экспрессирующей кассете рекомбинантной ДНК содержащей в направлении от 5' к 3' и в указанном порядке:
a. промотор предраннего гена 1 цитомегаловируса мыши (IE1 mCMV),
b. ген вирусного белка 2 (VP2) вируса инфекционного бурсита (IBDV),
c. терминатор транскрипции,
d. промотор предраннего гена 1 цитомегаловируса человека (IE1 hCMV),
e. ген белка слияния (F) вируса болезни Ньюкасла (NDV).
Экспрессирующую кассету рекомбинантной ДНК по изобретению можно использовать для получения вирусной вакцины на основе рекомбинантного вектора HVT, которая эффективна для профилактики или снижения инфекции IBDV и NDV или ассоциированных симптомов заболевания, и обладает постоянной и надежной генетической стабильностью при пересеве in vitro и in vivo.
"Рекомбинантными" являются молекула нуклеиновой кислоты или микроорганизм генетический материал которых был модифицирован относительно его исходного или нативного состояния с получением генетических характеристик, которыми он исходно не обладал.
"Экспрессирующая кассета" по изобретению содержит гены и регуляторные элементы, как описано и определено в настоящем изобретении. Также экспрессирующая кассета необязательно может содержать другие элементы ДНК, которые могут способствовать ее получению и обработке, такие как участки распознавания рестрикционных ферментов или праймеров для ПЦР, обеспечивающие молекулярное клонирование. Хотя экспрессирующая кассета может существовать в форме ДНК или РНК, вследствие ее предусмотренного применения в векторе HVT, таким образом, экспрессирующую кассету используют в виде ДНК.
Как очевидно специалисту, экспрессирующая кассета представляет собой автономный экспрессирующий модуль, таким образом, ее ориентация в геноме вирусного вектора, как правило, не важна. Это означает, что кассету как целое можно встраивать, например, в область US генома HVT в любой из двух ориентаций: считываемой в направлении TR или в направлении IR. В этом отношении на фигуре 1 приведена только одна из этих двух возможных ориентаций. Однако если желательна конкретная ориентация, можно использовать экспрессирующую кассету с фланкирующими участками из генома вектора, которые могут направлять ее встраивание в конкретный участок генома вектора и в желательной ориентации.
Получение, конструирование и сборку экспрессирующей кассеты рекомбинантной ДНК по изобретению и других генетических элементов, описываемых в настоящем изобретении, можно проводить хорошо известными молекулярно-биологическими способами, включающими клонирование, трансфекцию, рекомбинацию, селекцию и амплификацию. Эти и других способы во всех подробностях описаны в стандартных пособиях, подобных Sambrook & Russell: "Molecular Cloning: A Laboratory Manual" (2001, Cold Spring Harbour Laboratory Press; ISBN: 0879695773); Ausubel et al., in: Current Protocols in Molecular Biology (J. Wiley and Sons Inc, NY, 2003, ISBN: 047150338X); C. Dieffenbach & G. Dveksler: "PCR primers: a laboratory manual" (CSHL Press, ISBN 0879696540); и "PCR protocols", by: J. Bartlett and D. Stirling (Humana press, ISBN: 0896036421).
В рамках изобретения, термин "содержащий" (а также такие варианты, как "содержат", "содержит" и "содержащийся") предназначен для обозначения всех элементов и в любой возможной комбинации, возможных по изобретению, которые предусмотрены или включены в текстовый раздел, абзац, пункт формулы изобретения и т.д., в которых используют этот термин, даже если такие элементы и комбинации явно не перечислены; и не исключает ни одного из таких элементов или комбинаций.
Поэтому, любой из таких текстовых разделов, параграфов, пунктов формулы изобретения и т.д., таким образом, также может относиться к одному или нескольким вариантам осуществления, где термин "содержащий" (или его варианты) заменен такими терминами, как "состоят из", "состоящий из" или "по существу состоит из".
Термин "в направлении от 5' к 3'", также известный как: "в нисходящем направлении", хорошо известен в данной области. Вместе с термином "в указанном порядке" он служит для указания относительной ориентации, в которой должны быть расположены элементы, которые приведены далее, относительно друг друга, чтобы функционировать совместно с механизмом экспрессии генов клетки-хозяина, в которой реплицируется и экспрессируется рекомбинантный HVT, содержащий экспрессирующую кассету по изобретению. Как понятно специалисту, это направление относится к цепи ДНК двухцепочечного ДНК-содержащего генома HVT, которая представляет собой "кодирующую цепь", и относится к кодируемой молекуле иРНК, которая находится в "+" или "смысловой" ориентации.
Однако и без ущерба для раздела выше: на комплементарной цепи генома HVT из дцДНК, "матричной" цепи, относительный порядок перечисляемых элементов является таким же, но на этой цепи ДНК направление этих элементов представляет собой от 3' к 5'.
Термин "ген" используют для указания участка ДНК, способного к кодированию белка. Ген по изобретению предпочтительно кодирует полный белок. Однако ген также может кодировать участок белка, например, кодируя только зрелую форму белка, т.е. без "лидерной", "якорной" или "сигнальной" последовательностей. В этом отношении ген, в рамках изобретения, соответствует открытой рамке считывания или ORF. Ген может кодировать даже конкретный участок белка, такой как участок, содержащий иммунопротективный эпитоп.
В этом отношении "белок" по изобретению представляет собой молекулярную цепь аминокислот. Белок может представлять собой нативный или зрелый белок, пре- или пробелок или функциональный фрагмент белка. В числе прочего в определение белка включены: пептиды, олигопептиды и полипептиды.
Хорошо известно, что "промотор" по изобретению представляет собой функциональную область генома организма, который контролирует транскрипцию расположенной ниже кодирующей области. Таким образом, промотор находится выше гена.
Синтез иРНК, контролируемый промотором, начинается с "точки инициации транскрипции" (TSS). Продуцируемая иРНК в свою очередь транслируется в белок, начиная со стартового кодона гена, который представляет собой первую последовательность ATG в открытой рамке считывания (первую AUG в иРНК). Как правило, TSS расположена на 30-40 нуклеотидов выше старт-кодона. TSS можно определять, секвенируя 5'-конец иРНК гена, например, способом RACE.
Как правило, промоторы содержатся в пределах приблизительно 1000 нуклеотидов выше положения A старт-кодона, которое, как правило, обозначают как A+1, а большинство промоторов расположены между нуклеотидами -500 и A+1.
Как правило, номенклатура промоторов основывается на генах, экспрессию которых они контролируют. Например, термин "промотор гена IE1 mCMV" относится к промотору, который в природе контролирует экспрессию гена IE1 mCMV, и, таким образом, расположен непосредственно перед этим геном. Так как ген IE1 является хорошо задокументированным и четко распознаваемым геном и так как секвенированы геномы нескольких mCMV (полностью или частично), такой промотор можно легко идентифицировать стандартными способами. Например, в основном протоколе промотор можно легко определить посредством стандартного субклонирования области между двумя последовательными генами, например, от сигнала поли-A вышерасположенного гена до TSS нижерасположенного гена. Затем промотор можно идентифицировать стандартными способами, например, посредством экспрессии маркерного гена со все меньшими и меньшими частями предполагаемого промотора.
Как правило, промоторы содержат ряд распознаваемых регуляторных областей, таких как энхансерная область, которые участвуют в связывании регуляторных факторов, которые влияют на время, длительность, условия и уровень транскрипции. Хотя, как правило, энхансерная область расположена выше, промотор также содержит расположенную более низко область, которая участвует в связывании факторов транскрипции и контроле самой РНК-полимеразы. Эта нижерасположенная область, как правило, содержит ряд консервативных элементов промоторной последовательности, таких как TATA-бокс, CAAT-бокс и GC-бокс.
Промотор, содержащий энхансерную и нижерасположенную область, называют "полным" промотором; промотор, содержащий только нижерасположенную область, называют "основным" промотором.
Промотору для экспрессии (гетерологичного) гена в (вирусном) векторе необходима способность эффективно контролировать транскрипцию этой расположенной ниже кодирующей области. Как правило, это обозначают как промотор, являющийся "функционально связанным" с геном, так, что ген находится "под контролем" промотора или является "регулируемым" промотором. Как правило, это означает, что в экспрессирующей кассете промотор и ген связаны на одной и той же ДНК в эффективной близости и с отсутствием между ними сигналов или последовательностей, которые могут препятствовать эффективной транскрипции.
Таким образом, в экспрессирующей кассете рекомбинантной ДНК по изобретению промотор гена IE1 mCMV и промотор гена IE1 hCMV по изобретению "функционально связаны" с расположенными ниже них генами, соответственно, с геном VP2 IBDV и геном F NDV.
"Терминатор транскрипции" представляет собой регуляторный элемент ДНК, участвующий в терминации транскрипции кодирующей области в РНК. Как правило, такой элемент кодирует участок со вторичной структурой, например, шпилькой, которая вызывает остановку транскрипции комплексом РНК-полимеразы. Таким образом, терминатор транскрипции всегда расположен ниже стоп-кодона транслируемой области, в 3'-нетранслируемой области. Также терминатор может содержать сигнал полиаденилирования или сигнал поли-A. Это приводит к полиаденилированию, которое происходит у большинства эукариотических иРНК и которое имеет отношение к транспорту и стабильности молекул иРНК.
При использовании по изобретению терминатор транскрипции между двумя гетерологичными генами обеспечивает эффективное разделение их экспрессии, предотвращая возможное сквозное прохождение транскрипции РНК.
При использовании по изобретению ген является "гетерологичным" рекомбинантному вектору HVT, который его несет, если этот ген не присутствует в исходном HVT, который использовали для получения рекомбинантного вектора HVT.
Промоторы генов IE1 mCMV или IE1 hCMV хорошо известны в данной области, и их можно легко получить в ряде коммерческих источников, таких как поставщики коммерческих плазмид для клонирования и экспрессии. Ген IE1 также называют "основной ген IE".
Белок IE1 mCMV также называют pp89. Промотор гена IE1 mCMV описан в 1985 году (K. Dörsch-Häsler, et al., 1985, PNAS, vol. 82, p. 8325). Использование этого промотора для гетерологической экспрессии описано в WO 87/03905 и EP 728842. Нуклеотидная последовательность полного локуса IE mCMV доступна в GenBank под номером доступа L06816.1 (с марта 2004 года). Сам mCMV доступен в ATCC: исходно под номером доступа VR-194, и позднее он сохранен под номером доступа VR-1399.
Размер промотора гена IE1 hCMV в его полной версии составляет приблизительно 1,5 т.п.н., и он состоит из энхансера, основного промотора и интрона, причем активность промотора переходит в область интрона, см. Koedood et al. (1995, J. of Virol., vol. 69, p. 2194-2207).
Промотор гена IE1 hCMV можно получать из генома вируса hCMV (который широко доступен), посредством субклонирования геномной области перед геном IE1 стандартными молекулярно-биологическими средствами и способами. Альтернативно промотор можно получать, например, из экспрессирующих плазмид, таких как pl.17, описанной в Cox et al. (2002, Scand. J. Immunol., vol. 55, p. 14-23) или из экспрессирующих векторов для млекопитающих, таких как серии pCMV (Clontech) или pCMV-MCS (Stratagene; номер доступа GenBank™ AF369966).
На основании промотора гена IE1 hCMV известно множество сходных версий, например, в GenBank. Такие гомологи и варианты находятся в объеме изобретения.
"Ген белка F NDV" по изобретению хорошо известен и информация о последовательности широко доступна на предшествующем уровне техники. Ген белка F можно получать из ряда общедоступных плазмидных конструкций. Альтернативно, его можно получать из NDV, выделенного из природного источника, стандартными способами обработки РНК-содержащих вирусов. NDV можно легко идентифицировать серологическими или молекулярно-биологическими способами.
При использованию по изобретению в одинаковой степени пригодными являются гомологи гена белка F NDV, а также варианты, например, из NDV лентогенного, мезогенного или велогенного типов, так как сама последовательность гена белка F является высококонсервативной в этих различных патотипах NDV.
В одном из вариантов осуществления экспрессирующей кассеты по изобретению промотор гена IE1 mCMV представляет собой полный промотор, содержащий область основного промотора, а также энхансерную область гена IE1 mCMV. Размер полного промотора гена IE1 mCMV приблизительно составляет 1,4 т.п.н.
Как хорошо известно специалисту, может существовать определенная вариабельность длины промотора гена IE1 mCMV, а также других элементов, которые составляют экспрессирующую кассету рекомбинантной ДНК по изобретению. Это может являться результатом различий в точных условиях, которые используют для клонирования и конструирования; например, вследствие использования различных участков распознавания рестрикционных ферментов, праймеров для клонирования посредством ПЦР; или различных условий для адаптации концов используемых клонирующих молекул. Таким образом, могут существовать определенная вариабельность длины составляющих элементов - большая или меньшая - без влияния на стабильность и эффективность всей экспрессирующей кассеты. В этом случае эти различия длины являются несущественными и входят в объем изобретения.
Таким образом, в отношении промотора гена IE1 mCMV по изобретению "приблизительно 1,4 т.п.н." означает: 1,4 т.п.н. ± приблизительно 25%, предпочтительно ± приблизительно 20, 15, 12, 10, 8, 6, 5, 4, 3, 2 или даже ± приблизительно 1% в указанном порядке предпочтения.
Подобным образом, можно использовать гомологи или варианты промоторного элемента, которые являются в равной степени эффективными и стабильными.
Таким образом, в одном из вариантов осуществления промотор гена IE1 mCMV по изобретению представляет собой молекулу ДНК длиной приблизительно 1,4 т.п.н., содержащую нуклеотидную последовательность, которая по меньшей мере на 95% идентична по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 630-2020 SEQ ID NO:1. Более предпочтительна идентичность нуклеотидных последовательностей по меньшей мере 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления промотор гена IE1 mCMV представляет собой область нуклеотидов 630-2020 SEQ ID NO:1.
В одном из вариантов осуществления экспрессирующей кассеты по изобретению ген VP2 IBDV по изобретению кодирует белок VP2 IBDV классического типа. Такие гены хорошо известны и информация об их последовательности легкодоступна на предшествующем уровне техники, см. например, номера доступа GenBank: D00869 (F52/70), D00499 (STC) или AF499929 (D78). Альтернативно, этот ген можно получать из генома классического IBDV, выделяемого в природе, способами обработки Birnavirus. IBDV классического типа можно легко идентифицировать серологическими и молекулярно-биологическими способами.
Так как гомологи или варианты гена VP2 IBDV могут обладать равной эффективностью и стабильность, то в одном из вариантов осуществления ген белка VP2 IBDV по изобретению по меньшей мере на 90% идентичен по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 2052-3410 SEQ ID NO:1. Предпочтительно идентичность нуклеотидных последовательностей составляет по меньшей мере 92, 94, 95, 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления ген белка VP2 IBDV по изобретению получают из классического штамма IBDV Faragher 52/70.
В одном из вариантов осуществления ген белка VP2 IBDV по изобретению представляет собой область из нуклеотидов 2052-3410 SEQ ID NO:1.
Выбор терминатора транскрипции конкретного типа для экспрессирующей кассеты по изобретению не является решающим при условии, что обеспечена эффективная терминация транскрипции РНК.
В одном из вариантов осуществления экспрессирующей кассеты по изобретению терминатор транскрипции содержит область терминатора и область поли-A.
В одном из вариантов осуществления терминатор транскрипции получен из вируса обезьян 40 (SV40), предпочтительно из позднего гена SV40. Этот терминатор и его использование для гетерологической экспрессии применяли в молекулярной вирусологии в течение многих лет, и их коммерциализировала фирма Clontech в ее клонирующих плазмидах "pCMVβ", которые коммерчески доступны, начиная с конца 1980х годов.
В одном из вариантов осуществления терминатор транскрипции получают из позднего гена SV40, и его размер составляет приблизительно 0,2 т.п.н.
Так как точный размер не является решающим, то в отношении терминатора транскрипции по изобретению "приблизительно 0,2 т.п.н." означает: 0,2 т.п.н. ± приблизительно 25%, предпочтительно ± приблизительно 20, 15, 12, 10, 8, 6, 5, 4, 3, 2 или даже ± приблизительно 1% в указанном порядке предпочтения.
В одном из вариантов осуществления терминатор транскрипции, полученный из позднего гена SV40 и с размером приблизительно 0,2 т.п.н., содержит нуклеотидную последовательность, которая по меньшей мере на 95% идентична по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 3441-3650 SEQ ID NO:1. Более предпочтительно идентичность нуклеотидной последовательности составляет по меньшей мере 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления терминатор транскрипции из позднего гена SV40 представляет собой область из нуклеотидов 3441-3650 SEQ ID NO:1.
В одном из вариантов осуществления экспрессирующей кассеты по изобретению промотор гена IE1 hCMV представляет собой основной промотор. Как правило, размер такого основного промотора составляет менее 1 т.п.н.; предпочтительно приблизительно 0,4 т.п.н.
Как описано, точный размер не является решающим, таким образом, в отношении основного промотора гена IE1 hCMV по изобретению "приблизительно 0,4 т.п.н." означает: 0,4 т.п.н. ± приблизительно 25%, предпочтительно ± приблизительно 20, 15, 12, 10, 8, 6, 5, 4, 3, 2 или даже ± приблизительно 1% в указанном порядке предпочтения.
В одном из вариантов осуществления промотор гена IE1 hCMV по изобретению представляет собой молекулу ДНК приблизительно 0,4 т.п.н., содержащую нуклеотидную последовательность, которая по меньшей мере на 95% идентична по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 3789-4149 SEQ ID NO:1. Более предпочтительно идентичность нуклеотидной последовательности составляет по меньшей мере 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления основной промотор гена IE1 hCMV представляет собой область из нуклеотидов 3789-4149 SEQ ID NO:1.
В одном из вариантов осуществления экспрессирующей кассеты по изобретению ген белка F NDV получают из NDV лентогенного типа.
Предпочтительно ген белка F NDV из лентогенного штамма NDV получают из штамма NDV Clone 30.
В одном из вариантов осуществления ген белка F NDV по изобретению по меньшей мере на 90% идентичен по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 4174-5835 SEQ ID NO:1. Предпочтительна идентичность нуклеотидной последовательности составляет по меньшей мере 92, 94, 95, 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления ген белка F NDV по изобретению представляет собой область из нуклеотидов 4174-5835 SEQ ID NO:1.
В одном из вариантов осуществления экспрессирующая кассета по изобретению содержит дополнительный терминатор транскрипции, расположенный ниже гена белка F NDV.
Дополнительный терминатор транскрипции, расположенный ниже гена белка F NDV, может являться таким же или отличаться от терминатора транскрипции, который находится в экспрессирующей кассете по изобретению между геном белка VP2 IBDV и промотором IE1 hCMV, при условии, что обеспечена должная терминация транскрипции и не затрагиваются стабильность и экспрессия.
В одном из вариантов осуществления дополнительный терминатор транскрипции получают из гена IE1 hCMV. Предпочтительно размер дополнительного терминатора транскрипции составляет приблизительно 0,3 т.п.н.
Так как точный размер не является решающим, то в отношении дополнительного терминатора транскрипции, получаемого из гена IE1 hCMV, "приблизительно 0,3 т.п.н." означает: 0,3 т.п.н. ± приблизительно 25%, предпочтительно ± приблизительно 20, 15, 12, 10, 8, 6, 5, 4, 3, 2 или даже ± приблизительно 1% в указанном порядке предпочтения.
В одном из вариантов осуществления дополнительный терминатор транскрипции, получаемый из гена IE1 hCMV и с размером приблизительно 0,3 т.п.н., содержит нуклеотидную последовательность, которая по меньшей мере на 95% идентична по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 5847-6127 SEQ ID NO:1. Более предпочтительно идентичность нуклеотидной последовательности составляет по меньшей мере 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления дополнительный терминатор транскрипции, получаемый из гена IE1 hCMV, представляет собой область из нуклеотидов 5847-6127 SEQ ID NO:1.
В одном из вариантов осуществления экспрессирующей кассеты рекомбинантной ДНК по изобретению одно, или несколько, или все из применяемых условий выбраны из группы, состоящей из:
- промотор гена IE1 mCMV представляет собой полный промотор,
- ген VP2 IBDV кодирует белок VP2 IBDV классического типа,
- терминатор транскрипции содержит область терминатора и область поли-A,
- терминатор транскрипции получают из вируса обезьян 40 (SV40),
- промотор гена IE1 hCMV представляет собой основной промотор,
- ген F NDV получают из лентогенного штамма NDV,
- экспрессирующая кассета содержит дополнительный терминатор транскрипции, расположенный ниже гена F NDV, и
- дополнительный терминатор транскрипции получают из гена IE1 hCMV.
В одном из вариантов осуществления экспрессирующая кассета рекомбинантной ДНК по изобретению содержит 5'- и/или 3'-фланкирующие области гена HVT. Эти фланкирующие области обеспечивают гомологичную рекомбинацию для контроля вставки в являющийся мишенью локус генетической вставки в геноме вектора и в желаемой ориентации.
В предпочтительном варианте осуществления экспрессирующая кассета рекомбинантной ДНК по изобретению на обеих сторонах фланкирована участками гена US2 HVT.
Примером является последовательность ДНК, как представлено в SEQ ID NO:1.
Таблица 1: Элементы SEQ ID NO:1:
|
В одном из вариантов осуществления длина экспрессирующей кассеты рекомбинантной ДНК по изобретению составляет приблизительно 5,5 т.п.н. Учитывая, как описано, что точный размер не является решающим, таким образом, в отношении экспрессирующей кассеты рекомбинантной ДНК по изобретению, ее размер составляет приблизительно 5,5 т.п.н., что означает 5,5 т.п.н. ± приблизительно 25%, предпочтительно ± приблизительно 20, 15, 12, 10, 8, 6, 5, 4, 3, 2 или даже ± приблизительно 1% в указанном порядке предпочтения.
Как описано, гомологи или варианты элементов экспрессирующей кассеты рекомбинантной ДНК по изобретению могут являться равным образом безопасными, стабильными и эффективными.
Таким образом, в одном из вариантов осуществления экспрессирующая кассета рекомбинантной ДНК по изобретению представляет собой молекулу ДНК размером приблизительно 5,5 т.п.н., содержащую нуклеотидную последовательность, которая по меньшей мере на 95% идентична по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 630-6127 SEQ ID NO:1. Более предпочтительно идентичность нуклеотидной последовательности составляет по меньшей мере 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления экспрессирующая кассета рекомбинантной ДНК по изобретению представляет собой область из нуклеотидов 630-6127 SEQ ID NO:1.
Для облегчения удобного конструирования, обработки и использования экспрессирующей кассеты рекомбинантной ДНК по изобретению, она сама может содержаться в молекуле ДНК.
Таким образом, в дополнительном аспекте изобретение относится к молекуле рекомбинантной ДНК, содержащей экспрессирующую кассету рекомбинантной ДНК по изобретению.
В одном из вариантов осуществления молекула рекомбинантной ДНК по изобретению состоит из клонирующей плазмиды, содержащей экспрессирующую кассету рекомбинантной ДНК по изобретению. Примеры распространенных клонирующих плазмид представляют собой, например, плазмиды из рядов pBR322 или pUC. Они являются широкодоступными в виде коммерческих продуктов.
В одном из вариантов осуществления плазмиды, которая представляет собой молекулу рекомбинантной ДНК по изобретению, плазмида может содержать регуляторные последовательности, которые обеспечивают стабильное поддержание больших вставок и которые поддерживают небольшое количество копий плазмид при амплификации в бактериях. Такие клонирующие плазмиды для больших вставок общеизвестны как космиды или бакмиды.
Когда молекула рекомбинантной ДНК по изобретению необходимо использовать в протоколах трансфекции, как правило, ее обозначают как "переносящий вектор", "челночный вектор" или "донорная плазмида". В этом случае молекула рекомбинантной ДНК по изобретению содержит экспрессирующую кассету рекомбинантной ДНК по изобретению, а кассета на обеих сторонах может быть фланкирована последовательностями, получаемыми из генома вектора, для контроля вставки.
Как правило, переносящий вектор, который используют при трансфекции, сам не интегрируется в геном вектора, он только облегчает интеграцию экспрессирующей кассеты, которую он несет.
В одном из вариантов осуществления молекула рекомбинантной ДНК по изобретению содержит область из нуклеотидов 630-6127 SEQ ID NO:1.
В одном из вариантов осуществления молекула рекомбинантной ДНК по изобретению содержит молекулу ДНК, как представлено в SEQ ID NO:1.
Экспрессирующую кассету рекомбинантной ДНК по изобретению предпочтительно используют для получения вирусной вакцины на основе рекомбинантного вектора HVT.
Таким образом, в дополнительном аспекте, изобретение относится к рекомбинантному вирусу герпеса индеек (HVT), содержащему экспрессирующую кассету рекомбинантной ДНК по изобретению, где экспрессирующая кассета встроена в область US генома рекомбинантного HVT.
Термин "вирус герпеса индеек" (HVT) относится к вирусному микроорганизму, который демонстрирует характерные признаки представителей своей таксономической группы, такие как морфологические, геномные и биохимические характеристики, а также биологические характеристики этой группы, такие как их физиологические, иммунологические или патологические свойства. Он также включает HVT, подразделенные тем или иным образом, например, как подвид, штамм, изолят, генотип, вариант, подтип, серотип, патотип или подгруппа и т.п.
Специалисту очевидно, что текущая таксономическая классификация микроорганизмов, описываемых в настоящем изобретении, таких как HVT, MDV, NDV или IBDV по изобретению, может меняться во времени, так как новая информация приводит к переклассификации в новые или различные таксономические группы. Однако так как это не изменяет сам микроорганизм или его биологические свойства, а только его научное наименование или классификацию, такие переклассифицированные микроорганизмы остаются в объеме изобретения.
При использовании по изобретению "содержащий экспрессирующую кассету рекомбинантной ДНК" относится к вставке экспрессирующей кассеты рекомбинантной ДНК по изобретению в геном HVT. Эту вставку по существу можно проводить любым доступным способом, и она может приводить к вставке, замене или удалению относительно генома вектора HVT, при условии, что получаемый рекомбинантный HVT способен демонстрировать свои положительные эффекты безопасной, стабильной и эффективной экспрессии поливалентного антигена. Подробности и примеры описаны ниже в настоящем изобретении.
Рекомбинантный HVT по изобретению содержит экспрессирующую кассету рекомбинантной ДНК по изобретению в одном генетическом локусе и в области своего генома, которая известна как уникальная короткая область, или US. Область US HVT хорошо известна и легко идентифицируема; она расположена между двумя хорошо известными повторяющимися элементами в геноме HVT, IRS и TRS.
Для области US HVT известно несколько локусов вставок и все они по существу пригодны для использования по изобретению, при условии, что вставленная экспрессирующая кассета и полученный рекомбинантный HVT способны демонстрировать свои стабильные и эффективные свойства.
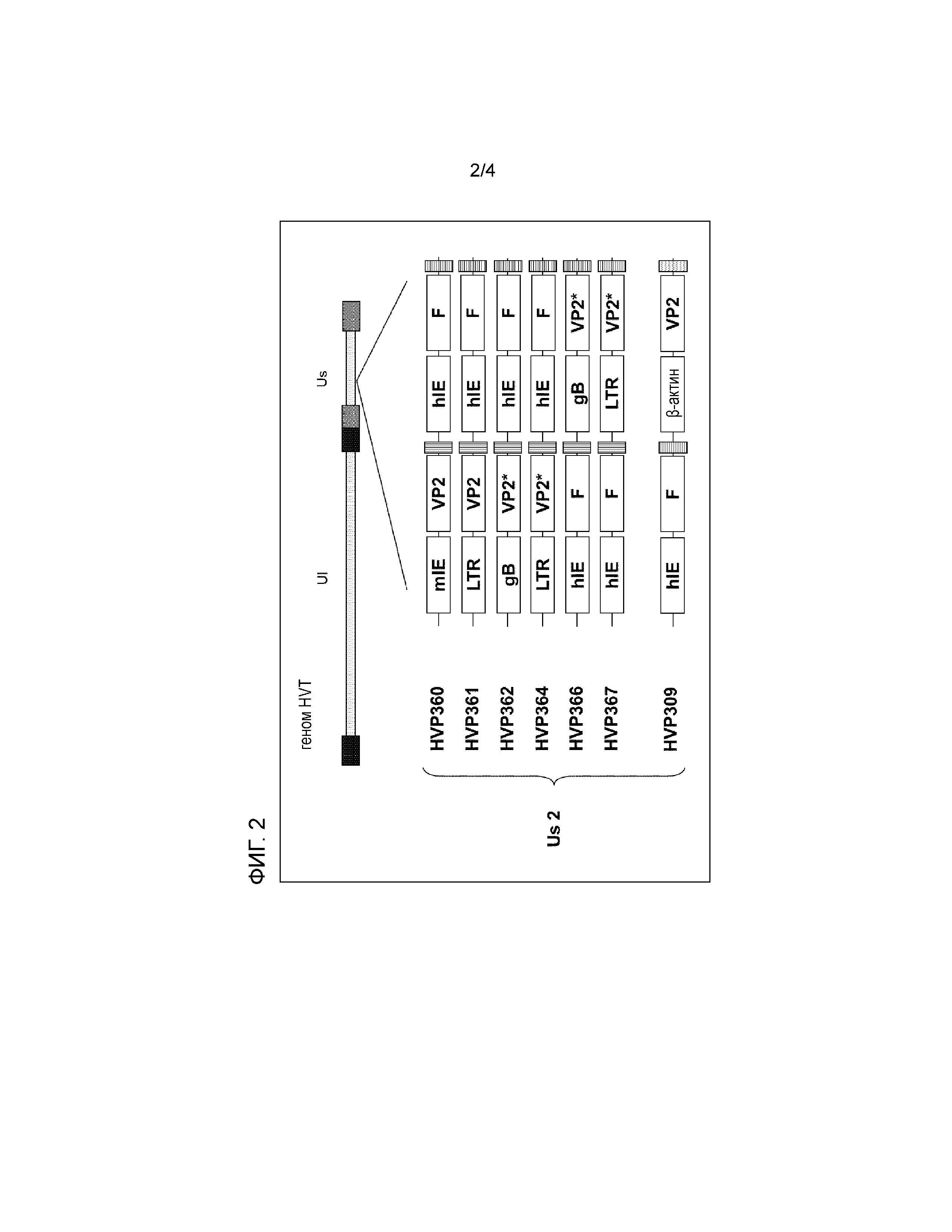
В одном из вариантов осуществления рекомбинантный HVT по изобретению содержит экспрессирующую кассету рекомбинантной ДНК по изобретению, вставленную в ген US2 или US10 генома рекомбинантного HVT.
В частности стабильные и эффективные рекомбинантные векторы HVT по изобретению можно получать с использованием в качестве единственного локуса вставки в геном по изобретению гена US2 генома HVT.
Таким образом, в одном из вариантов осуществления рекомбинантного HVT по изобретению экспрессирующая кассета рекомбинантной ДНК по изобретению вставлена в ген US2 генома рекомбинантного HVT.
При использовании по изобретению термины "в гене US2" или "в гене US10" предназначены для указания того, что вставка проведена в область генома HVT, содержащую гены US2 или US10, соответственно; они могут относиться к промоторам генов или к их кодирующим областям. Также, конечным эффектом вставки относительно генома HVT может являться вставка, замена или удаление, как описано. Ожидаемым следствием такой вставки является то, что нормальная кодирующая функция генов US2 и US10, соответственно, в полученном рекомбинантном HVT будет нарушена или даже полностью устранена.
В одном из вариантов осуществления вставка экспрессирующей кассеты рекомбинантной ДНК в область US HVT представляет собой вставку; т.е. за исключением нескольких нуклеотидов, которые могут быть потеряны или заменены в результате процесса клонирования, не происходит значимого удаления области генома US. Таким образом, при конечном увеличении размера этот способ приводит к рекомбинантному HVT с размером генома, превосходящим геном своего родителя.
В одном из вариантов осуществления рекомбинантный HVT по изобретению содержит молекулу ДНК размеров приблизительно 5,5 т.п.н., содержащую нуклеотидную последовательность, которая по меньшей мере на 95% идентична по нуклеотидной последовательности с полноразмерной областью из нуклеотидов 630-6127 SEQ ID NO:1. Более предпочтительно идентичность нуклеотидной последовательности составляет по меньшей мере 96, 97, 98 или даже 99% в указанном порядке предпочтения.
В одном из вариантов осуществления рекомбинантный HVT по изобретению содержит область из нуклеотидов 630-6127 SEQ ID NO:1.
В одном из вариантов осуществления рекомбинантный HVT по изобретению содержит нуклеотидную последовательность, как представлено в SEQ ID NO:1.
Для получения безопасного для применения в качестве вакцины рекомбинантного HVT по изобретению, рекомбинантный HVT можно получать на основе исходного HVT, который представляет собой широко известный вакцинный штамм HVT, который хорошо реплицируется и известен как подходящий для инокуляции молодняку или в эмбрионы птицы, например, вакцинные штаммы HVT PB1 или FC-126. В основном они доступны: FC-126 из ATCC: VR № 584-C, а PB1 является коммерчески доступным например, в MSD Animal Health. Встраивание экспрессирующей кассеты рекомбинантной ДНК по изобретению не увеличивает вирулентность или патогенность исходного HVT (наоборот), и восстановления вирулентности не ожидают, так как HVT является от природы непатогенным.
Таким образом, в одном из вариантов осуществления исходным HVT, используемым для получения рекомбинантного HVT по изобретению, является вакцинный штамм HVT; предпочтительно вакцинный штамм HVT штаммов PB1 или FC-126.
Рекомбинантный HVT по изобретению представляет собой живой рекомбинантный микроорганизм-носитель, или "векторный" вирус, который преимущественно можно использовать для вакцинации домашней птицы. В нем сочетаются характеристики безопасной и эффективной вакцины против ND и IBD, и кроме того он является генетически стабильным.
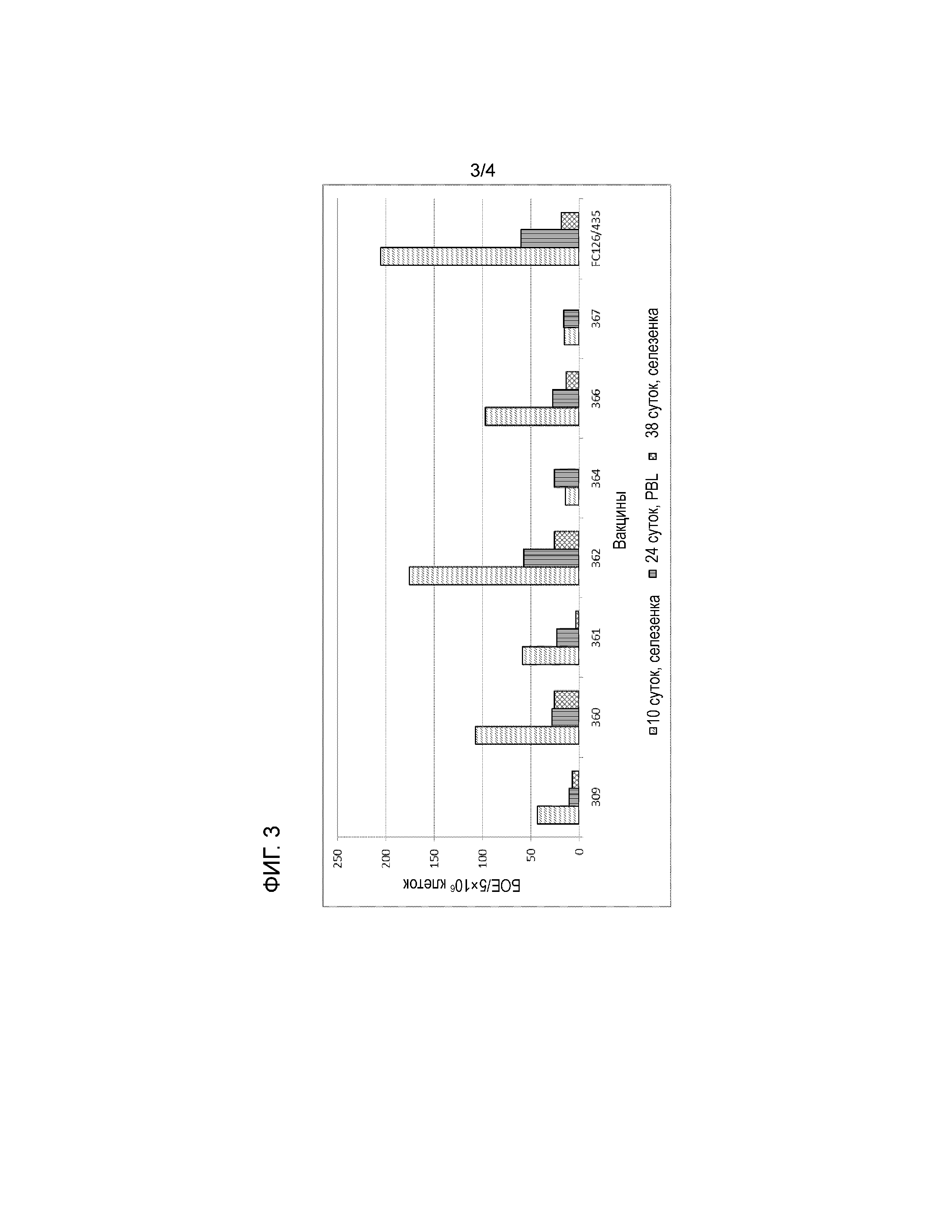
"Генетически стабильный" по изобретению означает, что генетический состав рекомбинантного HVT по изобретению не изменяется в последовательных циклах репликации вируса или по меньшей мере не изменяется настолько, чтобы это можно было выявить. В альтернативном варианте нестабильные конструкции могут приводить к потере экспрессии одного или обоих вставленных гетерологичных генов. Эту стабильность в целях удобства можно контролировать стандартными способами, например, подвергая рекомбинантный HVT по изобретению последовательному пересеву в культуре клеток с последующим пересевом у животных. Вирус, повторно выделяемых на этих этапах, можно наносить на чашки с культурой клеток, покрывать агаром и инкубировать до получения видимых специфичных для HVT бляшек; проводя все стандартными способами. Затем бляшки можно окрашивать на экспрессию белков F или VP2 с использованием подходящих препаратов антител по протоколу иммунофлуоресцентного анализа (IFA) и с соответствующими положительными и отрицательными контролями. Количество бляшек, у которых не выявляют флуоресценции можно регистрировать, таким образом, следует контролировать по меньшей мере 100 отдельных бляшек в конкретном образце.
Строгим тестом генетической стабильности рекомбинантного HVT по изобретению является проведение 15 последовательных пересевов в тканевой культуре с последующей инокуляцией исследуемым животным, повторным выделением и контрольной инфекцией. Подробности описаны ниже в настоящем изобретении.
Неожиданно выявлено, что рекомбинантный HVT по изобретению в строгом тест стабильности, как описано выше, сохранял присутствие и экспрессию обоих генов белков F NDV и VP2 IBDV во всех тестируемых бляшках и в течение 15 пересевов в культуре клеток, а также в течение одного пересева у животных. Подробности описаны в примерах.
Это является серьезным и высоко значимым улучшением по сравнению с результатами, полученными с рекомбинантными HVT на предшествующем уровне техники, и по сравнению с другими рекомбинантами, полученными и протестированными в ходе экспериментов по изобретению.
Рекомбинантный HVT по изобретению можно амплифицировать широко известными способами, в основном посредством репликации в культурах первичных клеток кур in vitro, как правило, фибробластов эмбрионов кур (CEF). Их можно получать посредством трипсинизации эмбрионов кур, как хорошо известно в данной области. CEF высевают в монослоях и инфицируют HVT. Этот способ можно масштабировать до получения в промышленных количествах.
Как правило, рекомбинантные HVT получают, посредством сбора инфицированных клеток-хозяев, которые содержат рекомбинантный HVT в его ассоциированной с клеткой форме. Эти клетки помещают в носитель подходящего состава для обеспечения стабилизации при замораживании и хранении. Затем инфицированные клетки, как правило, помещают в стеклянные ампулы, которые герметизируют, замораживают и хранят в жидком азоте.
Хотя хранение HVT в ассоциированной с клетками форме является предпочтительным, в тех случаях, когда использование жидкого азота невозможно, альтернативой является использование лиофилизации: при этом используют благоприятствующую характеристику HVT, которая позволяет его выделять из его клеток-хозяев посредством разрушения клеток, например, посредством френч-пресса или ультразвукового дезинтегратора с использованием цельной культуры. Полученную смесь можно очищать посредством центрифугирования, и затем помещать в стабилизатор и лиофилизировать для длительного хранения.
Таким образом, в дополнительном аспекте, изобретение относится к клетке-хозяину, содержащей рекомбинантный HVT по изобретению.
"Клетка-хозяин" по изобретению представляет собой клетку, которая восприимчива к инфекции и репликации HVT. Примеры таких клеток представляют собой клетки птиц и, в частности, лимфоциты или фибробласты.
В одном из вариантов осуществления клетка-хозяин по изобретению представляет собой первичную клетку птицы; т.е. клетку, которая получена непосредственно у животного или из органа животного, а не из линии клеток. Как правило, первичные клетки могут претерпевать только небольшое и ограниченное количество клеточных делений, тогда как клетки из линий клеток эффективно иммортализованы и, в подходящих условиях, могут продолжать делиться.
В одном из вариантов осуществления первичная клетка птицы-хозяин по изобретению представляет собой первичный фибробласт эмбриона курицы (CEF).
В одном из вариантов осуществления клетка-хозяин по изобретению представляет собой иммортализованную клетку птицы. Описано несколько видов иммортализованных клеток птиц, например, в WO 97/044443 и WO 98/006824.
В предпочтительном варианте осуществления иммортализованная клетка птицы-хозяин по изобретению представляет собой иммортализованный CEF; предпочтительно иммортализованный CEF, как описано в EP 14196345.
Экспрессирующую кассету рекомбинантной ДНК по изобретению можно различными способами клонирования и трансфекции использовать для получения рекомбинантного HVT по изобретению, содержащего экспрессирующую кассету, стабильно интегрированную в область US генома рекомбинантного HVT.
Таким образом, дополнительный аспект изобретения относится к способу конструирования рекомбинантного HVT по изобретению, где указанный способ включает вставку экспрессирующей кассеты рекомбинантной ДНК по изобретению в область US генома рекомбинантного HVT.
Вставку экспрессирующей кассеты рекомбинантной ДНК по изобретению в геном HVT с получением рекомбинантного HVT по изобретению можно проводить различными способами, которые все известны в данной области. Один из удобных способов является использование переносящего вектора; в одном из вариантов осуществления он может представлять собой молекулу рекомбинантной ДНК по изобретению.
Прямая вставка экспрессирующей кассеты рекомбинантной ДНК по изобретению в геном HVT представляет собой предпочтительный способ получения рекомбинантного HVT по изобретению. Однако существуют другие хорошо известные способы, которыми можно получать такой рекомбинантный HVT. Например, посредством непрямой вставки, при которой в HVT в одном или нескольких циклах трансфекции вставляют части экспрессирующей кассеты. Эти части можно разрабатывать таким образом, чтобы после интеграции всех частей полноразмерная вставка формировала целую экспрессирующую кассету, например, посредствоми использования перекрывающихся областей для управления порядком и ориентацией частей. Альтернативой является использование бакмид, как описано в EP 996738.
Предпочтительный способ вставки для получения рекомбинантного HVT по изобретению является использование регенерации космид, например, как описано в WO 93/25665. По существу в этом способе используют набор больших перекрывающихся субгеномных фрагментов генома HVT с восстановлением полного генома HVT посредством совместной трансфекции в клетки-хозяева. Так как одна из космид сконструирована содержащей экспрессирующую кассету рекомбинантной ДНК по изобретению, она становится стабильно интегрированной в геном рекомбинантного HVT.
Как описано, предпочтительным применением рекомбинантного HVT по изобретению, является применение в вакцине для домашней птицы.
Таким образом, в дополнительном аспекте изобретение относится к вакцине для домашней птицы, содержащей рекомбинантный HVT по изобретению и/или клетку-хозяина по изобретению и фармацевтически приемлемый носитель.
Хорошо известно, что "вакцина" представляет собой композицию, содержащую иммунологически активное соединение в фармацевтически приемлемом носителе. "Иммунологически активное соединение" или "антиген" представляет собой молекулу, которую распознает иммунная система привитого животного и которая индуцирует иммунный ответ. Ответ может являться результатом действия системы врожденного или приобретенного иммунитета и может быть клеточным и/или гуморальным.
Вакцина по изобретению предоставляет безопасную и раннюю защиту кур от ND и IBD. Этого эффекта добиваются, предотвращая или снижая развитие или пролиферацию продуктивной инфекции посредством полевой инфекции NDV или IBDV в соответствующих им органах-мишенях. Этого достигают, например, снижая вирусную нагрузку или укорачивая длительность репликации вируса. В свою очередь это приводит к снижению у являющегося целью воздействия животного количества, интенсивности или тяжести очагов повреждений и ассоциированных клинических симптомов заболевания, вызываемых вирусной инфекцией. Такую вакцину в разговорной речи обозначают как вакцина "против" NDV или IBDV.
В дополнение к эффективности вакцины против ND и IBD вакцина по изобретению также эффективна против MD вследствие способности к вакцинации самого HVT. Это свойство вставкой экспрессирующей кассеты рекомбинантной ДНК по изобретению в область US не снижается. Однако в зависимости от вирулентности полевого вируса MDV в конкретной области для полной эффективности в качестве вакцины против MDV необходимым может являться добавление дополнительного компонента вакцины против MD, как описано.
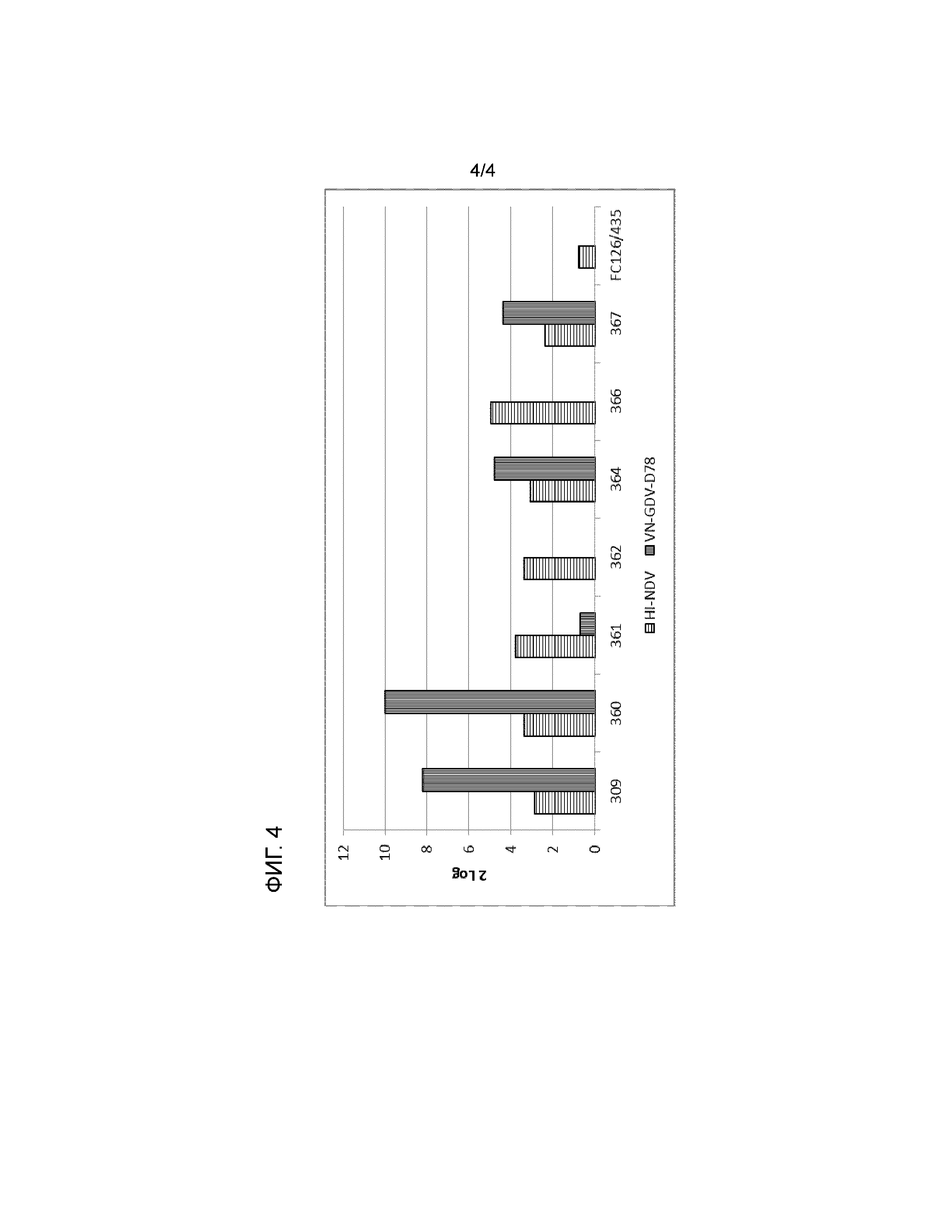
Определение эффективности вакцины по изобретению хорошо известно практикующему врачу, и его можно проводить, например, определяя иммунный ответ после вакцинации или тестируя проявление клинических симптомов или смертность после контрольной инфекции, например, определяя признаки заболевания, клинические показатели, серологические параметры у являющегося целью воздействия животного или посредством повторного выделения контрольного патогена и сравнения этих результатов с ответом на контрольное заражение после вакцинации, наблюдаемым у вакцинированных пустым вектором животных. Для оценки эффективности вакцины против ND подходящим определением является выживания после контрольного заражения; для IBD в целях удобства можно использовать клинические признаки заболевания в сумке Фабрициуса.
Ниже приведены варианты осуществления, предпочтения и примеры вакцины по изобретению.
Термин "домашняя птица" по изобретению относится к видам птиц значимых для ветеринарной практики, и к видам, восприимчивым к вакцинации HVT; предпочтительные виды домашней птицы представляют собой: курицу, индейку и перепела. Наиболее предпочтительным видом являются куры.
При использовании по изобретению домашняя птица может быть любого типа или породы, такого как: яйценоская птица, племенная птица, мясная птица, комбинированные породы или родительские линии любых таких пород. Предпочтительными типами являются: мясная птица, племенная птица и яйценоская птица. Наиболее предпочтительными являются мясные куры, так как для этого типа птицы ранняя защита от ND и IBD приводит к улучшению выживания, скорости роста и конверсии корма.
"Фармацевтически приемлемый носитель" предназначен для помощи в стабилизации и введении вакцины, при этом являясь безвредным и хорошо переносимым являющимся целью воздействия животным. Такой носитель может представлять собой, например, стерильную воду или стерильный физиологический раствор. В более сложной форме носитель может представлять собой, например, буфер, который может содержать дополнительные добавки, такие как стабилизаторы или консерванты. Подробности и примеры описаны, например, в хорошо известных руководствах, таких как: "Remington: the Science and Practice of Pharmacy" (2000, Lippincott, USA, ISBN: 683306472) и: "Veterinary vaccinology" (P. Pastoret et al. ed., 1997, Elsevier, Amsterdam, ISBN 0444819681).
По настоящему изобретению, когда вакцина представляет собой ассоциированный с клетками HVT, фармацевтически приемлемый носитель предпочтительно представляет собой смесь среды для культивирования, и приблизительно 10% сыворотки, и приблизительно 6% DMSO. Сыворотка может представлять собой любую сыворотку, как правило, используемую для культивирования клеток, такую как эмбриональная телячья сыворотка или сыворотка новорожденных телят.
Вакцину по изобретению получают из рекомбинантного HVT по изобретению описанными в настоящем изобретении способами, которые может легко использовать специалист в данной области. Например, рекомбинантный HVT по изобретению конструируют посредством вставки рекомбинантной экспрессирующей кассеты по изобретению посредством трансфекции и рекомбинации. Затем производят отбор желаемого рекомбинантного HVT, и проводят промышленную амплификацию в меньшем или большем объемах, предпочтительно в культурах клеток, например, CEF, in vitro. Из таких культур получают содержащую вирус суспензию в виде целых инфицированных клеток или в виде бесклеточного препарата, получаемого посредством разрушения клеток. Эту суспензию формулируют в вакцину и упаковывают конечный продукт. Затем ассоциированную с клетками вакцину хранят в жидком азоте и в виде лиофилизированной вакцины при -20 или при +4°C. После многостороннего тестирования на качество, количество и стерильность вакцинный продукт выпускают в продажу.
Основные способы и учитываемые факторы, которые используют для получения вакцин, хорошо известны в данной области и описаны, например, в регулирующих правительственных документах (фармакопея) и в руководствах, таких как: "Veterinary vaccinology" и: "Remington" (оба см. выше).
В одном из вариантов осуществления вакцина по изобретению представляет собой ассоциированную с клетками вакцину.
"Ассоциированная с клетками" означает содержащая клетки-хозяева по изобретению, которые инфицируют рекомбинантным HVT по изобретению. Таким образом, вакцина этого типа содержит клетки-хозяева, а также рекомбинантный HVT по изобретению.
В одном из вариантов осуществления вакцина по изобретению представляет собой бесклеточную вирусную вакцину.
"Бесклеточная" означает содержащую рекомбинантный HVT по изобретению и по существу не содержащую клеток-хозяев по изобретению. Однако бесклеточная вакцина может содержать (очень) небольшие количества фрагментов клеток-хозяев, остающихся после процесса разрушения клеток. Бесклеточная вакцина предпочтительно находится в лиофилизированной форме. Способы лиофилизации известны специалистам в данной области и оборудование для лиофилизации в различных масштабах доступно коммерчески.
Таким образом, в одном из вариантов осуществления бесклеточная вирусная вакцина по изобретению находится в лиофилизированной форме.
Для восстановления лиофилизированной вакцины ее суспендируют в физиологически приемлемом разбавителе. Как правило, это проводят непосредственно перед введением для получения вакцины лучшего качества. Разбавитель может представлять собой, например, стерильную воду или физиологический раствор. Разбавитель, используемый для восстановления вакцина сам может содержать дополнительные соединения, такие как адъювант.
В дополнительном варианте осуществления лиофилизированной бесклеточной вакцины по изобретению разбавитель для вакцина поставляют отдельно от лиофилизированной массы, содержащей активную вакцинную композицию. В этом случае, лиофилизированная вакцина и композиция разбавителя формируют составной набор, который совместно представляет собой вакцину по изобретению.
Таким образом, в предпочтительном варианте осуществления лиофилизированной бесклеточной вакцины по изобретению вакцина представляет собой составной набор по меньшей мере с двумя типами контейнеров, где один контейнер содержит лиофилизированную вакцину, и один контейнер содержит водный разбавитель.
Являющееся целью для вакцинации по изобретению животное по существу может являться здоровым или больным и может являться позитивным или негативным на наличие NDV или IBDV или на антитела к NDV или IBDV. Также у являющегося целью воздействия животного может быть любая масса, пол или возраст, с которыми оно восприимчиво к вакцинации. Однако явно предпочтительно вакцинировать здоровых, неинфицированных животных и вакцинировать их как можно раньше для предотвращения любой полевой инфекции и ее последствий.
Таким образом, вакцину по изобретению можно использовать в качестве профилактического или в качестве терапевтического лечения или обоих, так как она препятствует развитию и прогрессированию инфекции NDV или IBDV.
В этом отношении дополнительным положительным действием снижения вирусной нагрузки вакциной по изобретению является профилактика или снижение of выделения и, таким образом, распространения вируса, вертикально потомству и горизонтально в пределах стаи или популяции и в пределах географической области. Таким образом, использование вакцины по изобретению приводит к снижению распространенности NDV или IBDV.
Таким образом, дополнительными аспектами изобретения являются:
- использование вакцины по изобретению для снижения распространенности NDV или IBDV в популяции или в географической области, и
- вакцина по изобретению для снижения распространенности NDV или IBDV в популяции или в географической области.
Вакцину по изобретению по существу можно вводить являющейся целью воздействия домашней птице различными способами введения и в различные моменты их жизни, при условии, что инокулируемый рекомбинантный HVT может обеспечить защитную инфекцию.
Однако так как инфекция NDV или IBDV может развиваться уже в очень молодом возрасте предпочтительно использовать вакцину по изобретению как можно раньше. Таким образом, вакцину по изобретению можно применять на сутки вылупления ("сутки 1") или in ovo, например, на сутки 18 ED.
Таким образом, в одном из вариантов осуществления вакцину по изобретению вводят in ovo.
Оборудование для автоматизированной инъекции вакцины в яйцо в промышленном масштабе доступно коммерчески. Это обеспечивает как можно более раннюю защиту, минимизируя трудозатраты. Известны различные способы инокуляции in ovo, такие как инокуляция в желточный мешок, эмбрион или полость аллантоисной жидкости; их по мере необходимости можно оптимизировать. Предпочтительно инокуляция in ovo проводят так, чтобы игла фактически прикасалась к эмбриону.
В одном из вариантов осуществления вакцину по изобретению вводят посредством парентерального маршрута. Предпочтительно посредством внутримышечного или подкожного маршрутов.
Вакцину по изобретению можно получать в форме, подходящей для введения являющейся целью воздействия домашней птице, и соответствующей желаемому маршруту введения и желаемому действию.
Предпочтительно вакцину по изобретению формулируют в виде инъецируемой жидкости, подходящей для инъекции in ovo или парентеральным способом; например, в виде: суспензии, раствора, дисперсии или эмульсии. Как правило, такие вакцины получают стерильными.
В зависимости от маршрута введения вакцины по изобретению состав вакцины может являться необходимым адаптировать. Это известно специалисту и, как правило, включает тонкую регулировку эффективности или безопасности вакцины. Это можно проводить посредством адаптации дозы, количества, частоты, маршрута вакцины, использованием вакцины в другой форме или в другом составе, посредством адаптации других составляющих вакцины (например, стабилизатора или адъюванта).
Например, чтобы являться подходящей для применения in ovo вакцинной композиции необходимо являться очень безопасной, чтобы не снижать выводимости из яиц. Однако даже тогда все еще может происходить определенное снижение выводимости, например, в результате механического повреждения эмбриона посредством самой инокуляции или в результате инфекции и т.д.
Точное количество рекомбинантного HVT по изобретению на дозу вакцины по изобретению для одного животного не является таким важным, как это важно для вакцины инактивированного типа; это происходит вследствие того, что рекомбинантный HVT может реплицироваться и, таким образом, размножаться у являющегося целью воздействия животного до уровня виремии, который является биологически устойчивым. По существу дозы вакцины должно быть достаточно только для инициации такой продуктивной инфекции. Более высокая инокулируемая доза не сокращает время, необходимое для достижения оптимальной виремической инфекции у хозяина. Таким образом, очень высокие дозы являются неэффективными и, кроме того, непривлекательными по экономическим причинам.
Таким образом, предпочтительная инокулируемая доза составляет от 1×10 до 1×105 бляшкообразующих единиц (БОЕ) рекомбинантного HVT по изобретению на дозу для животного, более предпочтительно от 1×102 до 1×104 БОЕ/дозу, даже более предпочтительно от 500 до 5000 БОЕ/дозу; наиболее предпочтительно приблизительно от 1000 до приблизительно 3000 БОЕ/дозу.
Когда вакцина по изобретению ассоциирована с клетками, эти количества рекомбинантного HVT содержатся в инфицированных клетках-хозяевах.
Способы подсчета вирусных частиц рекомбинантного HVT по изобретению хорошо известны.
Объем рекомбинантного HVT по изобретению в расчете на дозу для животного можно оптимизировать в зависимости от планируемого маршрута введения: инокуляцию in ovo, как правило, проводят с дозой приблизительно от 0,01 до приблизительно 0,5 мл/яйцо, а парентеральную инъекцию, как правило, проводят с дозой приблизительно от 0,1 до приблизительно 1 мл/птицу.
Определение того, что является иммунологически эффективным количеством вакцины по изобретению, или оптимизация объема вакцины на дозу также хорошо известны специалисту.
Режим дозирования для введения вакцины по изобретению являющемуся целью воздействия организму может представлять собой одну или несколько доз способом, совместимым с составом вакцины и в таком количестве, которое будет иммунологически эффективным.
Предпочтительно, режим введения вакцины по изобретению интегрирован в существующие схемы вакцинации у других вакцин, которые могут являться необходимыми являющейся целью воздействия домашней птице, для снижения стресса у животных и снижения трудозатрат. Эти другие вакцины можно вводить одновременно, совместно или последовательно способом, совместимым с их зарегистрированным применением.
Понятно, что в объем изобретения также входит примешивание в вакцины по изобретению других соединений, таких как стабилизаторы, носители, адъюванты, разбавители, эмульсии и т.п. Таки добавки описаны в хорошо известных руководствах, таких как: "Remington" и "Veterinary Vaccinology" (оба см. выше).
Таким образом, эффективность вакцины по изобретению для защиты домашней птицы с использованием одной вакцинации против ND, IBD и MD в очень раннем возрасте можно дополнительно оптимизировать.
Вакцина по изобретению фактически представляет собой "маркерную вакцину" для NDV и IBDV, так как она формирует иммунитет, направленный только против одного из белков этих вирусов. Это позволяет проводить "дифференциацию инфицированных и вакцинированных животных", так называемый подход DIVA. В целях удобство это можно детектировать серологическим анализом, таким как ELISA или анализ иммунофлуоресценции.
Вакцина по изобретению уже обеспечивает множественный иммунитет: против NDV и IBDV посредством экспрессии гетерологичных вставок и, кроме того, против MDV посредством самого вектора HVT. Однако предпочтительным может являться получение дополнительных комбинаций посредством дополнительных иммуноактивных компонентов. Это может служить усилению уже предоставляемой иммунологической защиты или распространению на другие патогены.
Таким образом, в одном из вариантов осуществления вакцина по изобретению содержит по меньшей мере один дополнительный иммуноактивный компонент.
Такой "дополнительный иммуноактивный компонент" может представлять собой антиген, иммуностимулирующее вещество, цитокин, вакцину или их любое сочетание. Это обеспечивает преимущества в отношении стоимости, эффективности и благополучия животных. Альтернативно саму вакцину по изобретению можно добавлять к вакцине.
В одном из вариантов осуществления по меньшей мере один дополнительный иммуноактивный компонент представляет собой иммуностимулирующее соединение; предпочтительно цитокин или иммуностимулирующий олигодезоксинуклеотид.
Иммуностимулирующий олигодезоксинуклеотид предпочтительно представляет собой иммуностимулирующий неметилированный CpG-содержащий олигодезоксинуклеотид (INO). Предпочтительный INO представляет собой агонист Toll-подобного рецептора (TLR) птиц 21, как описано в WO 2012/089800 (семейства X4), WO 2012/160183 (семейства X43) или WO 2012/160184 (семейства X23).
В одном из вариантов осуществления по меньшей мере один дополнительный иммуноактивный компонент представляет собой антиген, получаемый из микроорганизма, патогенного для домашней птицы. Его можно "получать" любым подходящим способом, например, в качестве "живого" аттенуированного, инактивированного или субъединицы антигена этого микроорганизма, патогенного для домашней птицы.
Дополнительный антиген, получаемый из микроорганизма, патогенного для домашней птицы, предпочтительно получают у одного или нескольких микроорганизмов, выбранных из приводимой ниже группы, состоящей из:
- вирусов: вируса инфекционного бронхита, NDV, аденовируса, вируса синдрома снижения яйценоскости, IBDV, вируса анемии кур, вируса энцефаломиелита птиц, вируса оспы птиц, вируса ринотрахеита индеек, вируса чумы уток (вирусного энтерита уток), вируса чумы голубей, MDV, вируса лейкоза птиц, ILTV, пневмовируса птиц и реовируса;
- бактерий: Escherichia coli, Salmonella, Ornitobacterium rhinotracheale, Haemophilus paragallinarum, Pasteurella multocida, Erysipelothrix rhusiopathiae, Erysipelas, Mycoplasma и Clostridium;
- паразитов: Eimeria; и
- грибов: Aspergillus.
Дополнительный антиген может являться дополнительной вакциной на основе вектора HVT.
Все эти комбинации возможны при условии, что отсутствует негативное влияние на эффективность, безопасность и стабильность вакцины по изобретению.
В одном из вариантов осуществления вакцины по изобретению дополнительный антиген, получаемый из микроорганизма, патогенного для домашней птицы, представляет собой "живой" аттенуированный вакцинный штамм MDV, NDV или IBDV. Это служит улучшению и расширению иммуногенности вакцины по изобретению, и это выгодно в тех случаях или географических областях, где преобладают очень вирулентные полевые штаммы MDV, NDV или IBDV.
В этом отношении известна комбинация HVT с MDV1, MDV2 или HVT; при использовании по изобретению в качестве дополнительного иммуноактивного компонента предпочтителен MDV штамма Rispens (MDV1), штамма SB1 (MDV2) или штаммов FC-126 или PB1 (HVT).
Для улучшения ответа против NDV, рекомбинантный HVT по изобретению можно комбинировать с вакцинным штаммом NDV, таким как умеренный живой вакцинный штамм NDV C2.
Подобным образом, для улучшения ответа против IBDV рекомбинантный HVT по изобретению можно комбинировать с умеренными живыми вакцинными штаммами IBDV, такими как D78, PBG98, Cu-1, ST-12 или 89-03.
Как понятно специалисту эти "комбинации" также включают схемы вакцинаций, где рекомбинантный HVT по изобретению и дополнительный иммуноактивный компонент не применяют одновременно, но совместно или последовательно; например, рекомбинантный HVT можно применять in ovo, NDV C2 на первые сутки, а IBDV штамма 89-03 на сутки 17.
Таким образом, в одном из вариантов осуществления вакцины по изобретению, содержащей по меньшей мере один дополнительный иммуноактивный компонент, по меньшей мере один дополнительный иммуноактивный компонент представляет собой микроорганизм, выбранный из группы, состоящей из вакцинного штамма из: MDV, NDV и IBDV или любого их сочетания.
Более предпочтительно дополнительный иммуноактивный компонент выбран из группы, состоящей из: MDV Rispens, MDV SB1, NDV C2, IBDV D78 и IBDV 89-03.
Такие комбинированные вакцины можно получать рядом способов: комбинируя препараты вируса или клеток-хозяев или их смесь; где все они находятся в объеме изобретения. В предпочтительном варианте осуществления компоненты для такой комбинированной вакцины в целях удобства получают раздельно, а затем комбинируют, помещая в один и тот же контейнер для вакцины.
Вакцину по изобретению можно получать способами, описанными выше и приводимыми далее в настоящем изобретении в качестве примеров.
Таким образом, дополнительный аспект изобретения относится к способу получения вакцины по изобретению, где указанный способ включает этапы:
- инфицирования клеток-хозяев рекомбинантным HVT по изобретению,
- сбора инфицированных клеток-хозяев и
- смешивания собранных инфицированных клеток-хозяев с фармацевтически приемлемым носителем.
Подходящие клетки-хозяева и фармацевтически приемлемые носители по изобретению описаны выше. Также подходящие способы для инфицирования, культивирования и сбора хорошо известны в данной области и описаны и приведены в настоящем изобретении в качестве примера.
Как подробно описано выше, рекомбинантный HVT по изобретению преимущественно можно применять в вакцине для домашней птицы, при условии безопасности, стабильности и эффективной вакцинации против MD, ND и IBD или ассоциированных симптомов заболевания, и можно вводить домашней птица в очень раннем возрасте.
Таким образом, дополнительный аспект изобретения относится к рекомбинантному HVT по изобретению для применения в вакцине для домашней птицы.
Выше приведены различные аспекты и варианты осуществления "применения в вакцине" рекомбинантного HVT по изобретению, и они включают применение в качестве не содержащегося в клетках или в качестве ассоциированного с клетками вируса в различных вакцинных композициях для инокуляции домашней птице.
Таким образом, различные аспекты и варианты осуществления изобретения преимущественно можно использовать для получения безопасной, стабильной и эффективной вакцины для домашней птицы.
Таким образом, в дополнительном аспекте изобретение относится к применению экспрессирующей кассеты, молекулы рекомбинантной ДНК, рекомбинантного HVT или клетки-хозяина, всех по изобретению, или любого их сочетания для получения вакцины для домашней птицы.
Как описано выше и приведено далее в настоящем изобретении в качестве примера, вакцину по изобретению преимущественно можно применять для профилактики или снижения инфекции IBDV и/или NDV или ассоциированных симптомов заболевания посредством одной вакцинации в очень раннем возрасте.
Таким образом, дополнительные аспекты изобретения представляют собой:
- применение вакцины по изобретению для профилактики или снижения инфекции IBDV и/или NDV или ассоциированных симптомов заболевания.
- способ профилактики или снижения инфекции IBDV и/или NDV или ассоциированных симптомов заболевания, где способ включает введение вакцины по изобретению домашней птице.
- способ вакцинации домашней птицы, включающий этап вакцинации указанной домашней птицы вакциной по изобретению.
Подробности применения вакцины по изобретению посредством вакцинации домашней птицы описаны выше; конкретно, вакцинации посредством внутримышечной или подкожной вакцинации суточных цыплят, и вакцинации in ovo эмбрионов на 18 сутки.
Далее изобретение дополнительно описано на основании приводимых ниже неограничивающих примеров.
Примеры
1. Различные протестированные вставки экспрессирующих кассет
В поиске стабильного и эффективного рекомбинантного HVT, экспрессирующего F NDV и VP2 IBDV, авторы изобретения сконструировали ряд конструкции рекомбинантных HVT с различными вставленными в US2 экспрессирующими кассетами с использованием различных элементов и ориентаций. На фигуре 2 приведена графическая иллюстрация (изображенная не в масштабе) значимых элементов характерного ряда сходных протестированных конструкций. Для сравнения также представлена конструкция HVP309 предшествующего уровня техники.
Протестированные варианты заключались в порядке генов белков, в различных используемых промоторах и в типе используемого вставляемого гена.
Более подробно: ген VP2 IBDV связывали со следующими промоторами:
- промотор гена IE1 mCMV (включая энхансерную и основную области),
- промотор из длинного концевого повтора (LTR) 3'-конца вируса саркомы Рауса (штамм Schmidt-Ruppin D) и
- промотор гена gB вируса псевдобешенства, из вакцинного штамма Bartha (номер доступа GenBank: BK001744)
Также ген VP2 тестировали в природном варианте и в варианте с оптимизированными кодонами и использованием таблицы кодонов HVT.
Кроме того, в ряде конструкций гетерологичные гены были направлены в противоположном порядке относительно друг друга.
Все эти различные рекомбинантные HVT конструировали, трансфицировали и амплифицировали. Затем их выбирали посредством тестирования на экспрессию in vitro в клетках CEF и на экспрессию и виремию in vivo посредством инокуляции экспериментальным животным.
2. Виремия и серология различных конструкций рекомбинантных HVT
В экспериментах на животных тестировали виремию и серологический ответ, индуцируемые различными конструкциями рекомбинантных HVT. Эксперименты на животных проводили по существу как описано в WO 2013/057235. В кратком изложении: односуточных яйценоских кур SPF внутримышечно вакцинировали и содержали в изоляции при давлении ниже атмосферного. На 10, 24 и 38 сутки после вакцинации из селезенки (10 и 38 сутки) или из образцов крови (24 сутки; лимфоциты периферической крови: PBL) повторно выделяли вирус HVT для тестирования виремии. Серологический ответ определяли в образцах крови, получаемых на 37 сутки после вакцинации. Результаты представлены в таблице 2 и на фигурах 3 и 4.
Таблица 2: Виремия и серологический ответ различных конструкций рекомбинантных HVT, тестируемых у яйценоских SPF, внутримышечно вакцинированных на в возрасте 1 суток.
|
VP2*=ген VP2 IBDV с оптимизированными для HVT кодонами
(1) Виремия выражена в БОЕ/5×106 клеток селезенки
Все рекомбинантные HVT реплицировались у вакцинированных кур. Уровни виремии HVP364 и ее зеркальной конструкции HVP367 по сравнению с другими рекомбинантами являлись низкими. Часть бляшек обоих вирусов при тестировании виремии на 10 и 24 сутки в IF анализах не демонстрировала экспрессии VP2 и/или F. Таким образом, уровни виремии на 38 сутки не определяли и HVP364 и HVP367 исключили из дальнейших исследований.
Все другие рекомбинанты демонстрировали экспрессию VP2 и F во всех тестируемые бляшках во все моменты времени.
Определяли серологический ответ, индуцируемый после вакцинации экспериментальных животных: для F NDV значения ELISA являлись неразличимыми, таким образом, в качестве средства отбора использовали гемагтлютинацию (HI) NDV (Clone 30); для IBDV использовали нейтрализацию (VN) D78; фигура 4.
Несмотря на то, что у HVP364 и HVP367 выявлены неэкспрессирующие бляшки для них определяли индукцию антител. Рекомбинантный HVT HVP362 обеспечивал превосходную виремию, но для него наблюдали отсутствие ответа против VP2 IBDV в сыворотке. Подобным образом, HVP361 и HVP366 обеспечивали сероконверсию против NDV, но обеспечивали очень низку сероконверсию или вообще не обеспечивали ее против IBDV. Таким образом, эти три рекомбинанта также исключали из дальнейших исследований.
Неожиданно только конструкция HVP360 обеспечивала хорошие виремию и серологические уровни, и, таким образом, для дальнейших исследований был выбран этот рекомбинантный HVT.
3. Характеристика рекомбинантного HVT: HVP360
3.1. Введение
HVP360 представляет собой рекомбинантный HVT по изобретению и экспрессирует ген VP2 IBDV и ген F NDV. Для вставки его экспрессирующей кассеты в локус гена US2 генома HVT использовали набор космид на основе HVT FC-126.
В HVP360 ген VP2 IBDV выделяли из штамма F52/70 классического типа, и он находится под контролем промотора гена IE1 mCMV штамма ATCC VR-194. Ген F происходит из вакцинного штамма NDV Clone 30 и находится под контролем промотора гена IE1 hCMV штамма AD169. Также HVP360 содержит сигнал терминации SV40 и терминатор гена IE1 hCMV, как определено в настоящем изобретении. На фигуре 1 представлено схематическое изображение экспрессирующей кассеты в HVP360 со всеми элементами, приведенными в масштабе, и фланкирующими последовательностями гена US2 HVT. В этом примере описана конструкция и приведена характеристика HVP360
3.2. Материалы и способы
3.2.1. Конструирование рекомбинантов HVP:
Конструирование HVP360, вставку экспрессирующей кассеты рекомбинантной ДНК в локус гена US2 HVT проводили с набором перекрывающихся получаемых из космид фрагментов ДНК из вакцинного штамма HVT FC-126, посредством которого после трансфекции в CEF восстанавливал инфекционный вирус, как описано в WO 2013/057235. Также в качестве вектора для переноса использовали плазмиду на основе pBR322. Где было возможно, использовали уникальные участки расщепления рестрикционными ферментами; когда возможности не было, их вносили посредством вставки с помощью ПЦР синтетической линкерной последовательности, которая содержала такой уникальный участок.
Фрагменты вирусной ДНК из космидных векторов и из плазмиды для переноса вырезали посредством расщепления соответствующими рестрикционными ферментами. Затем линейные фрагменты ДНК трансфицировали в клетки CEF посредством осаждения с фосфатом кальция. После вхождения ДНК в клетки, инфекционный вирус HVT восстанавливался посредством гомологичной рекомбинации между перекрывающимися последовательностями фрагментов ДНК, таким образом образуя геном интактного HVT FC-126, содержащий экспрессирующую кассету в US2. Эту вирусную конструкцию называли HVP360.
Потомство трансфицированных культур однократно амплифицировали на свежих CEF и проверяли на присутствие HVT, экспрессирующих VP2 и F посредством иммунофлуоресцентного анализа (IFA) с использованием моноклональной антисыворотки к этим антигенам. Рекомбинант вирус выделяли посредством выделения отдельных бляшек: монослои инфицированных CEF покрывали агарозой в среде для культивирования, когда CPE HVT становился отчетливо видимыми. Несколько бляшек случайным образом накалывали и два раза пересевали на CEF с последующим сбором и хранением в виде препарата ассоциированного с клетками вируса.
Затем каждый из двух параллельных изолятов бляшек HVP360 (A1 и B1) пятнадцать раз пересевали в последовательных культурах клеток CEF и подвергали скринингу на экспрессию VP2 и F посредством IFA на различных уровнях пересева.
3.2.2. Анализ ДНК
Для подробной характеристики конструкции HVP360 проводили несколько анализов ДНК плазмидной ДНК вектора для переноса и тотальной ДНК культур CEF, инфицированных FC-126 или HVP360 после 5 пересева из двух параллельных изолятов. Для подтверждения корректной интеграции в US2 и генетической стабильности при пересеве проводили анализ последовательностей и анализ саузерн-блот кодирующей нуклеотидной последовательности вставленной кассеты и фланкирующих областей US2 HVT. Анализ саузерн-блот также проводили для всего генома HVP360 для подтверждения корректной рекомбинации всех перекрывающихся областей фрагментов ДНК HVT из набора космид, который использовали для восстановления вируса.
ДНК HVT выделяли из культур клеток CEF, инфицированных HVP360 или контрольным исходным HVT FC-126, который также собирали из набора космид, который использовали для HVP360, но без экспрессирующей кассеты US2; его использовали в качестве контрольного вируса в последующих экспериментах и назвали HVT FC-126/435. Маточные растворы вирусов однократно пересевали на CEF и выделяли тотальную ДНК с использованием набора Easy-DNA™ (Invitrogen). Плазмидную ДНК переносящего вектора выделяли из культур E. coli, трансформированных вектором для переноса, и ДНК выделяли с использованием набора Quantum Prep™ Plasmid Midiprep (Bio-Rad).
3.2.3. Характеристика посредством саузерн-блоттинга
Саузерн-блоттинг проводили для углубленного анализа структуры генома HVP360 для проверки того, что сборка вируса была точно такой, как предполагалось, и при восстановлении вируса не произошло непредусмотренных вставок или делеций.
ДНК вируса HVT расщепляли рестрикционными ферментами PvuI и AatII; или BamHI, KpnI, BglII и EcoRI. ДНК плазмиды для переноса расщепляли рестрикционными ферментами PvuI и AatII.
После расщепления фрагменты ДНК наносили в несколько параллельных дорожек на гели с 0,7% агарозой/TAE, подвергали электрофорезу и переносили на нитроцеллюлозную мембрану. Блоты разрезали на идентичные части и отдельно гибридизовали с одним из меченных 32P зондов HVT и с зондом, детектирующим маркер размера ДНК (Smartladder™, Eurogentec). После инкубации в течение 16 часов избыток зонда удаляли двумя этапами отмывки и блот экспонировали на рентгеновскую пленку. После проявки радиоавтографа, рестрикционные фрагменты ДНК, специфически гибридизующиеся с зондом, становились видимыми.
Для детекции встраивания в рекомбинантный HVT любой из частей клонирующих плазмид получали зонд посредством расщепления плазмиды pBR322 на меньшие фрагменты посредством HaeIII. Эти фрагменты метили 32P. Все клонирующие векторы, используемые для восстановления HVT, являются производными pBR322 и их можно детектировать этим зондом, если векторные последовательности присутствуют. Также в одной из дорожек при саузерн-блоттинге в качестве положительного контроля детекции плазмидных последовательностей использовали плазмиду для переноса в HVP360.
Для проверки корректной сборки по перекрывающимся областям космидных вставок и повторяющимся областям генома HVT конструировали пары праймеров для гибридизации в этих значимых областях и получали зонды посредством ПЦР с ДНК вируса HVT FC-126, получаемой из инфицированных культур клеток CEF. Ампликоны расщепляли на меньшие фрагменты Sau3AI, метили 32P и использовали в качестве зондов при гибридизации в саузерн-блоттинге.
Затем различные зонды гибридизовали с ДНК HVP360, которую расщепляли BamHI, KpnI, BglII или EcoRI.
Длины рестрикционных фрагментов, детектируемых при саузерн-блоттинге сравнивали с длинами, ожидаемыми на основе опубликованной последовательности штамма HVT FC-126 (номер доступа GenBank AF291866).
3.2.4. Характеристика посредством анализа последовательностей
Для подтверждения корректной вставки и стабильности кодирующих последовательностей проводили анализ всей последовательности ДНК экспрессирующей кассеты и фланкирующих областях US2 HVT.
Для проведения секвенирования ДНК посредством ПЦР с использованием специфических праймеров амплифицировали специфические фрагменты ДНК HVT. Ампликоны очищали с использованием набора Qiaquick™ (Qiagen). Затем проводили секвенирование ПЦР с этими ампликонами с использованием набора Big Dye Terminator™ v.3.1 Cycle Sequencing kit (Applied Biosystems) по инструкциям производителя. Секвенирование проводили с использованием устройства Genetic Analyzer™ серии 3500 (Applied Biosystems). Считывания последовательностей анализировали с использованием программного обеспечения Sequencher™ v. 5.0 (Gene Codes Corporation).
Из перекрывающихся считываний последовательностей собирали непрерывную последовательность. Все неопределенности разрешали посредством повторных реакций секвенирования и сопоставления нескольких считываний последовательностей.
3.2.5. Характеристика экспрессии посредством IFA
После трансфекции, выделения бляшек и серийного пересева у изолятов для обоих параллельных изолятов HVP360 на уровнях пересева 5, 10 и 15 проверяли сохранение экспрессии встроенных генов посредством IFA. Монослои CEF инфицировали рекомбинантными изолятами, инкубировали в течение 2-3 суток до отчетливой видимости CPE, а затем фиксировали 80% этанолом. Экспрессию VP2 IBDV или F NDV детектировали моноклональными антителами в качестве первого реагента и меченным флуоресцеинизотиоцианатом (FITC) конъюгатом в качестве вторичного антитела и проводили считывание посредством УФ-микроскопии.
3.3. Результаты
3.3.1. Результаты гибридизаций саузерн-блоттинга
Генетические гомогенность и стабильность подтверждали посредством анализа саузерн-блоттинга с использованием специфических зондов. Блоты, которые гибридизовали с зондом из плазмиды pBR322, в полосах, содержащих рестрицированную ДНК штамма HVP360 и FC-126, не давали сигнала с зондом из плазмиды. Однако зонд из плазмиды положительно реагировал в полосах, содержащих рестрицированную ДНК из плазмиды для переноса, выявляя фрагменты, специфичные для плазмидного каркаса как спрогнозировано. Также зонд из плазмиды был положителен для большинства полос маркера размера ДНК.
Затем тот же блот гибридизовали с зондом, специфичным для локуса вставки US2, снова выявляя рестрикционные фрагменты как спрогнозировано.
Как и ожидалось, для области генома, где была вставлена экспрессирующая кассета наблюдали различные, ожидаемые, профили полос.
Гибридизация продемонстрировала, что вирусный геном HVP360 был корректно восстановлен и соответствовал профилю, наблюдаемому для исходного восстановленного из космид штамма HVT FC-126/435.
При гибридизации с зондами, которые детектировали перекрывающиеся последовательности и области повторов, выявлено, что профили для HVP360 и FC-126 были в основном идентичны, хотя в некоторых областях выявленные профили немного отличались от спрогнозированного профиля гибридизации саузерн-блоттинга для соединений между уникальными областями длинных концевых повторов на основе опубликованной последовательности ДНК для HVT FC-126. Однако профиль в этих областях являлся идентичным для рекомбинантных и исходных вирусных штаммов.
Таким образом, эти различия были обусловлены различиями последовательности вирусного генома исходного штамма HVT FC-126 и опубликованной последовательности, а не перестановками при сборке вирусного генома посредством технологии восстановления из космид.
3.3.2. Результаты характеристики посредством анализа последовательностей
Полную последовательность ДНК вставленной кассеты и фланкирующих областей используемой плазмиды для переноса определяли посредством ПЦР-секвенирования. Для обоих изолятов A1 и B1 проводили выравнивание с получением консенсусной последовательности для вставок в геном вируса HVP360, и проводили сравнение с последовательностью в плазмиде для переноса, а также с последовательностью области вставки исходного штамма FC-126. Результат выравнивания подтвердил, что у изолятов A1 и B1 последовательности вставленные в HVP360, идентичны.
Кроме того, показано, что эта последовательность идентична исходной экспрессирующей кассете в плазмиде для переноса. Также продемонстрировано, что фланкирующие области локуса вставки US2 плазмиды для переноса у A1 и B1 HVP360 и FC-126 являются идентичными по последовательности ДНК.
3.3.3. Результаты характеристики экспрессии посредством IFA
Выделенный из бляшек вирус HVP360 для обоих параллельных изолятов и на всех трех уровнях пересева 5, 10 и 15 подвергали скринингу посредством IFA на экспрессию VP2 и F. Все протестированные бляшки продемонстрировали полную экспрессию генов F и VP2. Это подтвердило функциональную и стабильную экспрессию VP2 и F до (по меньшей мере) уровня пересева в клетках 15.
3.4. Выводы
HVP360 представляет собой рекомбинантный HVT, экспрессирующий VP2 IBDV и F NDV. Подробная характеристика посредством IFA, анализа саузерн-блоттинга вирусной ДНК и секвенирования ДНК областей вставки и фланкирующих областей подтвердила, что два независимых изолята HVP360 A1 и B1 содержат корректно интегрированную в область US2 HVT FC-126 экспрессирующую кассету и функционально экспрессируют гены VP2 IBDV и F NDV в инфицированных культурах CEF в течение 15 последовательных пересевов в клетках CEF после выделения бляшек.
Экспрессирующая кассета и тотальный геном изолятов A1 и B1 HVP360 являлись корректными в том смысле, что в профилях рестрикционного расщепления, полученных после гибридизации саузерн-блоттинга с рядом специфичных для HVT геномных зондов, не детектировали делеций, перестановок или дополнительных чужеродных последовательностей. В область US2 встраивалась только одна копия вставки.
После подробного анализа последовательностей экспрессирующих кассет и фланкирующих областей локуса вставки US2 было сделано заключение, что A1 и B1 HVP360 идентичны друг другу, последовательности в векторе для переноса и исходному вирусу FC-126.
4. Эксперимент по вакцинации-контрольному заражению с использованием HVP360
Эксперимент по вакцинации-контрольному заражению проводили с рекомбинантным HVT HVP360. В кратком изложении: односуточных яйценоских SPF внутримышечно вакцинировали параллельными изолятами HVP360 A1 или B1.
На 3 или 4 неделе после вакцинации индуцированную защиту определяли по отношению к нескольким контрольным инфекциям IBDV или NDV: для IBDV штамм для контрольного заражения CS89 инокулировали при 3000 CID50 в 0,1 мл посредством окулярного введения в каждый глаз; для NDV штамм Herts 33/56 вводили при 6 Log 10 ELD50 в 0,2 мл на животное посредством внутримышечного введения. Уровень виремии вакцины и контрольного вируса определяли посредством повторного выделения вируса из селезенки инокулированных животных. Результаты представлены в таблице 3.
Уровень защиты при контрольном заражении определяли следующим способом:
Для контрольного заражения NDV определяли отношение живых и мертвых животных на 2 неделе после контрольного заражения в/в на 3 или 4 неделе. Например: 18 выживших из 20 животных в группе обеспечивает индекс защиты от NDV 90%.
Для контрольного заражения IBDV на основании клинических симптомов сумки Фабрициуса при вскрытии через 10 суток после контрольного заражения формировали индекс от 0 до 5, отражающий от отсутствия до тяжелого дефицита лимфоцитов. Животных с индексом 0-2 рассматривали как защищенных, а с индексом 3-5 как незащищенных. Защита от IBD представляет собой процент животных, которые являлись защищенными (клинический индекс на основании симптомов сумки Фабрициуса 0-2), от количества животных в группе.
Результаты продемонстрировали, что в этом эксперименте, в/м вакцинация HVP360 защищала односуточных кур от ND через 3 недели после вакцинации на уровне от 59 до 73%. Через 4 недели защита от ND составляла от 79 до 93%. Защита от IBD через 3-4 недели после вакцинации составляла от 93 до 100%.
Таблица 3: Виремия, серология и защита при контрольном заражении от IBDV и NDV у яйценоских SPF, внутримышечно вакцинированных HVP360 в возрасте 1 сутки.
|
(1) Виремия выражена в БОЕ/5×106 клеток селезенки
5. Начало действия и длительность иммунитета против ND и против IBD
В последующем эксперимента с вакцинацией-контрольным заражением с использованием в качестве вакцины HVP360 и контрольного заражения NDV или IBDV определяли начало действия иммунитета и длительность иммунитета. Вакцинный вирус HVP360 брали на уровне пересева 13; животные представляли собой яйценоских SPF в возрасте одних суток; маршрут вакцинирования представлял собой: подкожный; доза вакцины составляла дозу от 1500 до 2500 БОЕ/животного объемом 0,2 мл. Вирус для контрольного заражения представлял собой IBDV CS89 или NDV Herts 33/56. Контрольным животным п/к инокулировали HVT FC-126/435.
Таблица 4: Защита HVP360 от контрольной инфекции NDV или IBDV у односуточных цыплят посредством подкожной вакцинации с дозой приблизительно 1500-2500 БОЕ/животное.
|
Результаты продемонстрировали, что после вакцинации HVP360 при контрольном заражении NDV через 4 недели после вакцинации односуточных цыплят п/к маршрутом получали защиту более 90%. Это удовлетворяет требованиям фармакопейной статьи PhEur 0450 для живой вакцины против ND.
Даже лучшей защиты достигали при контрольном заражении IBDV: при контрольном заражение через 2 недели после вакцинации HVP360 получали защиту более 90%. Это удовлетворяет требованиям фармакопейной статьи PhEur 0587 для вакцины против IBD.
Также эти результаты демонстрируют, что длительность иммунопротекции составляла (по меньшей мере) 8 недель после вакцинации на уровне 100% защиты от ND и от IBD.
6. Тестирование дозы-ответа против ND и различных маршрутов введения
В экспериментах на животных использовали вакцинацию различными дозами HVP360, и тестировали различные маршруты: in ovo (io) и подкожный (sc), с тестированием ответа против контрольной инфекции NDV на основе этих доз и этих маршрутов. Кроме того, в различных группах обработки у вакцинированных животных определяли уровни виремии вакцины HVP360 и контрольного вируса FC-126 после повторного выделения.
После вакцинации содержащих эмбрионы яиц яйценоских SPF на сутки 18 (io) или односуточных яйценоских SPF посредством п/к маршрута животным проводили контрольное заражение в возрасте 3 или 4 недели NDV Herts 33/56. Из селезенки или образцов крови на 4, 11 или 17 сутки повторно выделяли вакцину/контрольный вирус для определения достигаемых уровней виремии. Результаты представлены в таблице 5. Виремия представлена двумя способами: один раз в виде количества птиц, положительных при повторном выделении вакцины/контрольного вируса, от общего количества птиц в этой группе, и один раз в виде среднего БОЕ вируса на 2×106 клеток селезенки.
В столбце "доза" представлена фактическая инокулируемая доза, определяемая посредством обратного титрования остатков инокулята после вакцинации.
Таблица 5: Виремия и защита от NDV при контрольном заражении у яйценоских SPF, вакцинированных in ovo или подкожно различными дозами HVP360.
|
Подкожная вакцинация оказалась мало зависима от используемой дозы; все дозы от 500 до 2500 БОЕ/животное обеспечивали удовлетворительные уровни иммунопротекции.
По сути оба маршрута (io и п/к) могут стимулировать одинаковую защиту через 3 и 4 недели, на уровнях 65-70% и 84-90%, соответственно.
Легенды к фигурам
Фигура 1
Схематическое изображение участка вставки предпочтительной молекулы рекомбинантной ДНК по изобретению, содержащей экспрессирующую кассету и фланкирующие последовательности гена US2, которые использовали для получения HVP360, предпочтительного рекомбинантного HVT по изобретению. Элементы экспрессирующей кассеты приведены в масштабе.
Сокращения (слева направо): 5'-US2: фланкирующие вышерасположенные последовательности из гена US2 HVT; mIE: промотор гена IE1 CMV мыши; VP2: ген VP2 IBDV; термин: терминатор транскрипции SV40; hIE: основной промотор гена IE1 CMV человека; F: ген F NDV; терминатор: терминатор гена IE1 hCMV; 3'-US2: фланкирующие нижерасположенные последовательности из гена US2 HVT.
Фигура 2:
Графическое представление (изображенное не в масштабе) значимых элементов характерного ряда протестированных конструкций рекомбинантного HVT. Для сравнения также представлена конструкция HVP309 предшествующего уровня техники.
Фигура 3:
Уровни виремии различных рекомбинантных HVT через 10, 24 и 38 суток после вакцинации односуточных яйценоских SPF в виде среднего на группу.
Фигура 4:
Серологический ответ, индуцируемый различными рекомбинантными HVT через 37 суток после вакцинации односуточных яйценоских SPF в виде среднего на группу.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Intervet International BV
<120> УЛУЧШЕННАЯ ВАКЦИНА ПРОТИВ ND-IBD НА ОСНОВЕ ВЕКТОРА HVT
<130> 23888
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 6674
<212> ДНК
<213> Искусственная последовательность
<220>
<223> экспрессирующая кассета HVP360 с фланкирующими областями
<220>
<221> ген
<222> (1)..(399)
<223> Вышерасположенная часть гена US2 HVT; AF291866, нуклеотиды 140143-140541
<220>
<221> промотор
<222> (630)..(2020)
<223> промотор-энхансер предраннего гена 1 цитомегаловируса мыши
<220>
<221> ген
<222> (2052)..(3410)
<223> штамм IBDV 52/70, ген VP2
<220>
<221> сигнал поли-A
<222> (3441)..(3650)
<223> сигнал поли-А + терминатор SV40
<220>
<221> промотор
<222> (3805)..(4149)
<223> основной промотор предраннего гена 1 цитомегаловируса человека
<220>
<221> ген
<222> (4174)..(5835)
<223> ген F NDV Clone 30
<220>
<221> терминатор
<222> (5815)..(6127)
<223> терминатор гена IE hCMV
<220>
<221> ген
<222> (6156)..(6674)
<223> Нижерасположенная часть гена US2 HVT; AF291866, нуклеотиды 140541-141059
<400> 1
atctactgtc ttaacgccca tgggaacgga ggcgtcgtcg tcatgtattg gacggcaaca 60
taggcagcaa cacaaattgc gtttaggtgg ggtgcatgtg gactcgatac caagcccctg 120
cagctgggga acgtctggtg gagagccgat aatttgatat acgcacgcca tattactgtc 180
gttgaagtac gccttatctt ctatgttttc aaatttaggt tcccaagtgg acgtgagaag 240
tgtttgtatc tcacatggaa tggcccaagg cattccagcc caggtgcctg gtactttaat 300
ggcaaacaaa cgttttggta gaggtattga ttctattgca gttctgcaga tatctgcagc 360
cccgagtatc cacaggctat acgatacgtt atcggaggca agctgcggcc gctctagaac 420
tagtggatcc cccgggctgc agcccaatgt ggaattcgcc cttgcacatt gttactcctg 480
catcttaaaa atatatcctg tagtaatttt cacagcaatg tcataacatc atctcgctaa 540
agaatgacct gggattggag aagtaatgaa tatttgcaac caatgcattg aataaactaa 600
cattaaacga attcactagt ggatccccca actccgcccg ttttatgact agaaccaata 660
gtttttaatg ccaaatgcac tgaaatcccc taatttgcaa agccaaacgc cccctatgtg 720
agtaatacgg ggacttttta cccaatttcc caagcggaaa gccccctaat acactcatat 780
ggcatatgaa tcagcacggt catgcactct aatggcggcc catagggact ttccacatag 840
ggggcgttca ccatttccca gcataggggt ggtgactcaa tggcctttac ccaagtacat 900
tgggtcaatg ggaggtaagc caatgggttt ttcccattac tggcaagcac actgagtcaa 960
atgggacttt ccactgggtt ttgcccaagt acattgggtc aatgggaggt gagccaatgg 1020
gaaaaaccca ttgctgccaa gtacactgac tcaataggga ctttccaatg ggtttttcca 1080
ttgttggcaa gcatataagg tcaatgtggg tgagtcaata gggactttcc attgtattct 1140
gcccagtaca taaggtcaat agggggtgaa tcaacaggaa agtcccattg gagccaagta 1200
cactgcgtca atagggactt tccattgggt tttgcccagt acataaggtc aataggggat 1260
gagtcaatgg gaaaaaccca ttggagccaa gtacactgac tcaataggga ctttccattg 1320
ggttttgccc agtacataag gtcaataggg ggtgagtcaa caggaaagtc ccattggagc 1380
caagtacatt gagtcaatag ggactttcca atgggttttg cccagtacat aaggtcaatg 1440
ggaggtaagc caatgggttt ttcccattac tggcacgtat actgagtcat tagggacttt 1500
ccaatgggtt ttgcccagta cataaggtca ataggggtga atcaacagga aagtcccatt 1560
ggagccaagt acactgagtc aatagggact ttccattggg ttttgcccag tacaaaaggt 1620
caataggggg tgagtcaatg ggtttttccc attattggca cgtacataag gtcaataggg 1680
gtgagtcatt gggtttttcc agccaattta attaaaacgc catgtacttt cccaccattg 1740
acgtcaatgg gctattgaaa ctaatgcaac gtgaccttta aacggtactt tcccatagct 1800
gattaatggg aaagtaccgt tctcgagcca atacacgtca atgggaagtg aaagggcagc 1860
caaaacgtaa caccgccccg gttttcccct ggaaattcca tattggcacg cattctattg 1920
gctgagctgc gttctacgtg ggtataagag gcgcgaccag cgtcggtacc gtcgcagtct 1980
tcggtctgac caccgtagaa cgcagagctc ctcgctgcag gcggccgctc tagaactcgt 2040
cgatcgcagc gatgacaaac ctgcaagatc aaacccaaca gattgttccg ttcatacgga 2100
gccttctgat gccaacaacc ggaccggcgt ccattccgga cgacaccctg gagaagcaca 2160
ctctcaggtc agagacctcg acctacaatt tgactgtggg ggacacaggg tcagggctaa 2220
ttgtcttttt ccctggattc cctggctcaa ttgtgggtgc tcactacaca ctgcagagca 2280
atgggaacta caagttcgat cagatgctcc tgactgccca gaacctaccg gccagctaca 2340
actactgcag actagtgagt cggagtctca cagtgaggtc aagcacactc cctggtggcg 2400
tttatgcact aaacggcacc ataaacgccg tgaccttcca aggaagcctg agtgaactga 2460
cagatgttag ctacaatggg ttgatgtctg caacagccaa catcaacgac aaaattggga 2520
atgtcctggt aggggaaggg gtcactgtcc tcagcctacc cacatcatat gatcttgggt 2580
atgtgaggct tggtgacccc attcccgcta tagggcttga cccaaaaatg gtagctacat 2640
gcgacagcag tgacaggccc agagtctaca ccataactgc agccgatgat taccaattct 2700
catcacagta ccaaccaggt ggggtaacaa tcacactgtt ctcagccaac attgatgcta 2760
tcacaagcct cagcattggg ggagagctcg tgtttcaaac aagcgtccaa ggccttgtac 2820
tgggcgccac catctacctt ataggctttg atgggactgc ggtaatcacc agagctgtag 2880
ccgcagataa tgggctgacg gccggcaccg acaatcttat gccattcaat cttgtcattc 2940
caaccaatga gataacccag ccaatcacat ccatcaaact ggagatagtg acctccaaaa 3000
gtggtggtca ggcaggggat cagatgtcat ggtcggcaag tgggagccta gcagtgacga 3060
tccatggtgg caactatcca ggggccctcc gtcccgtcac actagtagcc tacgaaagag 3120
tggcaacagg atccgtcgtt acggtcgctg gggtgagtaa cttcgagctg attccaaatc 3180
ctgaactagc aaagaacctg gttacagaat acggccgatt tgacccagga gccatgaact 3240
acacaaaatt gatactgagt gagagggacc gtcttggcat caagaccgtc tggccaacaa 3300
gggagtacac tgattttcgt gagtacttca tggaggtggc cgacctcaac tctcccctga 3360
agattgcagg agcatttggc ttcaaagaca taatccgggc tataaggagg taagcttgat 3420
ctagagcggc cgcggggatc cagacatgat aagatacatt gatgagtttg gacaaaccac 3480
aactagaatg cagtgaaaaa aatgctttat ttgtgaaatt tgtgatgcta ttgctttatt 3540
tgtaaccatt ataagctgca ataaacaagt taacaacaac aattgcattc attttatgtt 3600
tcaggttcag ggggaggtgt gggaggtttt ttcggatcct ctagagtcga caattatttc 3660
atttaataac atatagccca aagacctcta tgaacattta gtttcccgta tactcaacgg 3720
cgcgtgtaca cacaagggcg aattccacag tggatatcaa gcttaattaa gtaccgagct 3780
cgaattggcg cgccaggtca attccctggc attatgccca gtacatgacc ttatgggact 3840
ttcctacttg gcagtacatc tacgtattag tcatcgctat taccatggtg atgcggtttt 3900
ggcagtacat caatgggcgt ggatagcggt ttgactcacg gggatttcca agtctccacc 3960
ccattgacgt caatgggagt ttgttttggc accaaaatca acgggacttt ccaaaatgtc 4020
gtaacaactc cgccccattg acgcaaatgg gcggtaggcg tgtacggtgg gaggtctata 4080
taagcagagc tcgtttagtg aaccgtcaga tcgcctggag acgccatcca cgctgttttg 4140
acctccatag aagacaccgg gcgcgccgga tccatgggcc ccagaccttc taccaagaac 4200
ccagtaccta tgatgctgac tgtccgagtc gcgctggtac tgagttgcat ctgtccggca 4260
aactccattg atggcaggcc tcttgcggct gcaggaattg tggttacagg agacaaagcc 4320
gtcaacatat acacctcatc ccagacagga tcaatcatag ttaagctcct cccgaatctg 4380
cccaaggata aggaggcatg tgcgaaagcc cccttggatg catacaacag gacattgacc 4440
actttgctca ccccccttgg tgactctatc cgtaggatac aagagtctgt gactacatct 4500
ggagggggga gacaggggcg ccttataggc gccattattg gcggtgtggc tcttggggtt 4560
gcaactgccg cacaaataac agcggccgca gctctgatac aagccaaaca aaatgctgcc 4620
aacatcctcc gacttaaaga gagcattgcc gcaaccaatg aggctgtgca tgaggtcact 4680
gacggattat cgcaactagc agtggcagtt gggaagatgc agcagtttgt taatgaccaa 4740
tttaataaaa cagctcagga attagactgc atcaaaattg cacagcaagt tggtgtagag 4800
ctcaacctgt acctaaccga attgactaca gtattcggac cacaaatcac ttcacctgct 4860
ttaaacaagc tgactattca ggcactttac aatctagctg gtggaaatat ggattactta 4920
ttgactaagt taggtgtagg gaacaatcaa ctcagctcat taatcggtag cggcttaatc 4980
accggtaacc ctattctata cgactcacag actcaactct tgggtataca ggtaactcta 5040
ccttcagtcg ggaacctaaa taatatgcgt gccacctact tggaaacctt atccgtaagc 5100
acaaccaggg gatttgcctc ggcacttgtc ccaaaagtgg tgacacaggt cggttctgtg 5160
atagaagaac ttgacacctc atactgtata gaaactgact tagatttata ttgtacaaga 5220
atagtaacgt tccctatgtc ccctggtatt tattcctgct tgagcggcaa tacgtcggcc 5280
tgtatgtact caaagaccga aggcgcactt actacaccat acatgactat caaaggttca 5340
gtcatcgcca actgcaagat gacaacatgt agatgtgtaa accccccggg tatcatatcg 5400
caaaactatg gagaagccgt gtctctaata gataaacaat catgcaatgt tttatcctta 5460
ggcgggataa ctttaaggct cagtggggaa ttcgatgtaa cttatcagaa gaatatctca 5520
atacaagatt ctcaagtaat aataacaggc aatcttgata tctcaactga gcttgggaat 5580
gtcaacaact cgatcagtaa tgctttgaat aagttagagg aaagcaacag aaaactagac 5640
aaagtcaatg tcaaactgac tagcacatct gctctcatta cctatatcgt tttgactatc 5700
atatctcttg tttttggtat acttagcccg attctagcat gctacctaat gtacaagcaa 5760
aaggcgcaac aaaagacctt attatggctt gggaataata ctctagatca gatgagagcc 5820
actacaaaaa tgtgaggatc tctcgaggaa ttctagatcc cacgtcacta ttgtatactc 5880
tatattatac tctatgttat actctgtaat cctactcaat aaacgtgtca cgcctgtgaa 5940
accgtactaa gtctcccgtg tcttcttatc accatcaggt gacatcctcg cccaggctgt 6000
caatcatgcc ggtatcgatt ccagtagcac cggccccacg ctgacaaccc actcttgcag 6060
cgttagcagc gcccctctta acaagccgac ccccaccagc gtcgcggtta ctaacactcc 6120
tctccccgac ctgcaactag tgcggccgca gcttgcctcc gattctagca ttacatagcc 6180
ggtcagtaga tcctgccatt cggtagcgca accggctaca tcttcaaaca gtctcacgat 6240
aaatgcatct ctcgttcctg ccaatccgga accgggcata ccactcccgc ctgccgattt 6300
aattctcaca attgggcgat gccggcgggg caaaacgaat gtggatttgg caaaccgaca 6360
caggtctgct gtacggacta atatgggcac acccacatca ttcttcagat gctccatgca 6420
ttgttctatg agaaagatcc atagggtgga ggcagcgtca cgagatcgcc caggcaatcg 6480
atcgcattcg tctagtaaag tgacgagagt tatcatgcac acacccatgc ccacgccttc 6540
cgaataactg gagctgtgga agatcggaaa cgtctttttg actgccggtc tcgtactact 6600
ttcgcacagg tgtatacccg gacgcgtact atatatttta tatcatccaa cgtcccgaaa 6660
ttacatacgt ggcg 6674