Результат интеллектуальной деятельности: АЛКИЛИРОВАНИЕ СУЛЬФОНАТОМ АЛКИЛФТОРАЛКИЛА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится, в общем, к области химической технологии, и в частности к способу получения активного фармацевтического ингредиента (АФИ) или его промежуточных соединений с применением сульфоната алкилфторалкила. В частности, данное изобретение относится к способу получения химического соединения, включающему стадию взаимодействия нуклеофила с сульфонатом алкилфторалкила в присутствии основания. Данное изобретение также относится к способу получения сульфоната алкилфторалкила. Данное изобретение также относится к применению основания в химической реакции, включающей сульфонат алкилфторалкила. Способы и применение, описанные здесь, подходят для получения химических соединений, реагентов или их промежуточных соединений и, в частности, для получения АФИ или реагентов, таких как, например, эверолимус, и реактивов или реагентов, применяемых для его получения.
УРОВЕНЬ ТЕХНИКИ
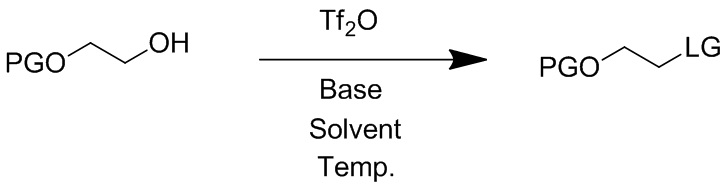
Сложные эфиры сульфоната применяют в синтетической органической химии, так как они обладают высокой реакционной способностью в отношении нуклеофилов в реакциях замещения. Примером превосходной сульфонатной уходящей группы является трифторметансульфонатная группа, в которой крайне электроотрицательные атомы фтора делают анионную уходящую группу особенно стабильной. В принципе, любой фторированный алкилсульфонат, например, трифторэтилсульфонат, нанофторбутилсульфонат или подобные, могут применяться в качестве высоко реакционноспособных уходящих групп.
Трифторметансульфонатная группа (CF3SO3-; также называемая трифлат) особенно предпочтительна в синтетической органической химии благодаря ее способности функционировать и как инертный анион, и как очень хорошая уходящая группа. Относительно хорошая доступность, безопасность и стабильность аниона способствует полезности трифторметансульфонатной группы в качестве уходящей группы в синтетической органической химии. Широко применяемым реагентом для введения трифторметансульфонатной группы в спирт является высоко реакционноспособный трифторметансульфоновый ангидрид ((CF3SO2)2O), который может быть получен P2O5-медиированной дегидратацией трифторметансульфоновой кислоты (Hendrickson J. B., Sternbach D. D., Bair K. W., Acc Chem Res, 1977, 10, 306).
Сульфонат алкилфторалкила, особенно трифторметансульфонат (также известный под наименованием трифлат), может быть получен с применением различных способов. Например, сульфонат алкилфторалкила может быть получен взаимодействием спирта с подходящим ангидридом фторалкилсульфоновой кислоты (Hendrickson J. B., Sternbach D. D., Bair K. W., Acc Chem Res, 1977, 10, 306).
Сульфонат алкилфторалкила также можно применять в синтезе химических соединений, действующих в качестве активных фармацевтических ингредиентов. Два из них, Эверолимус и Умиролимус (торговое наименование Biolimus®), могут быть получены с применением фторалкилсульфонатной химии. Эверолимус (RAD-001), 40-O-(2-гидрокси)этилрапамицин формулы (1), является синтетическим производным рапамицина (сиролимуса), который является известным макролидным антибиотиком, произведенным Streptomyces hygroscopicus. Эверолимус является иммунодепрессивным и противораковым лекарственным средством, которое ингибирует внутриклеточный mTOR ("цель рапамицина у млекопитающих"). Он показывает свое действие через взаимодействие с внутриклеточным рецептором FKBP12 (FK506-связывающий белок 12) и через модулирование трансляции специфических мРНК. Эверолимус является коммерческим продуктом компании Novartis и продается в качестве лекарства для трансплантации под торговыми наименованиями Zortress® (USA) и Certican® (внутри США) и в онкологии как Afinitor®.
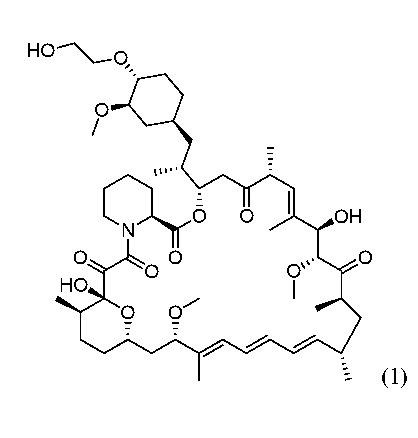
В WO2012/066502 описан способ получения эверолимуса взаимодействием сиролимуса (рапамицина) с 4 или 8 эквивалентами трифлата 2-(-трет-бутилдиметилсилил)оксиэтила в дихлорметане в присутствии основания, предпочтительно, 2,6-лутидина, с последующим отщеплением трет-бутилдиметилсилильной защитной группы. Общий выход с двух стадий составляет 45% максимум. Существует множество примеров, в которых выход намного ниже. Например, если в качестве растворителя на стадии алкилирования используют толуол, выход из 2-стадиной реакции от рапамицина до эверолимуса падает до ниже 30%. Если в качестве растворителя на стадии алкилирования используют этилацетат, выход падает до около 30%. В WO2012/103959 описан способ получения эверолимуса, который основан на реакции рапамицина с трифлатом 2-(трет-гексилдиметилсилилокси)этила в инертном растворителе в присутствии основания, такого как 2,6-лутидин, трис(2-метилпропил)амина или N,N-диизопропилэтиламина. Полученное силилированное промежуточное соединение затем подвергают отщеплению силильной группы с получением эверолимуса. В единственном экспериментальном примере, описанном в документе, показано превращение рапамицина в эверолимус с общим выходом 53%: здесь рапамицин подвергают взаимодействию с 4 эквивалентами предварительно полученного трифлата 2-(трет-гексилдиметилсилилокси)этила (трифлат получают с применением трис(2-метилпропил)амина в качестве основания) в присутствии N,N-диизопропилэтиламина в смеси растворителей, содержащей 15% 1,2-диметоксиэтана и 85% толуола при 70°C. Одним недостатком этой реакции является низкая стабильность сложных эфиров трифлата, а также Рапамицина при высоких температурах. Еще одним недостатком является применение 1,2-диметоксиэтана, который является растворителем, неблагоприятным для окружающей среды. Полученное таким образом промежуточное соединение подвергают отщеплению силильной группы с применением хлористоводородной кислоты в метаноле. В статье в Journal of Labelled Compounds and Radiopharmaceuticals, 42, 29-41 (1999) описана моно-трет-бутилдифенилсилильная защитная группа в синтезе эверолимуса. В US2005/192311 A1 и US2009/292118 A1 описан способ получения Умиролимуса (40-O-[(2’-этокси)этил]рапамицина). Умиролимус получают из рапамицина (сиролимус) через реакцию алкилирования взаимодействием трифлатного реагента в присутствии N,N-диизопропилэтиламина (выход с 1 стадии алкилирования составляет 30-45%).
Объектом данного изобретения является новый способ алкилирования, который позволяет применять сульфонат алкилфторалкила для получения химического соединения за короткое время, с высоким выходом и улучшенным, более экономичным и упрощенным образом. Конкретные аспекты данного изобретения могут применяться для получения эверолимуса или реагентов, вовлеченных в его получение.
Сущность изобретения
Так как фторалкилсульфонатные группы, в частности, трифторметансульфонат, трифторэтилсульфонат и нонафторбутилсульфонат, являются превосходными уходящими группами, разложение реагентов in situ, содержащих эти функциональные группы, в присутствии основания является потенциальной проблемой их применения. Разложение реагентов, таких как фторалкилсульфонаты, например, алкилтрифторметансульфонат, снижает выход способа или повышает стоимость способа, когда требуется избыток реагента сульфоната алкилфторалкила, например, реагента алкилтрифторметансульфоната. Такое разложение может происходить, например, кватернизацией третичного аминового основания, которое обычно используют в реакции или исключением сульфонатной уходящей группы. Проблемы разложения и побочных реакций являются характерными для реакций нуклеофильного замещения, которые требуют более длительного времени реакции. Одним из примеров такой реакции является алкилирование затрудненных спиртов. Побочные реакции в реакционной смеси могут начаться немедленно, и чем дольше проходит реакция, тем сильнее воздействие на эффективность и выход реакции. Например, проблема особенно очевидна, когда для реакции требуется более 1 часа, более 2 часов, более 10 часов, особенно более 18 часов, например, более 24 часов для завершения.
Для осуществления указанного выше объекта, в данном изобретении представлен способ по пункту 1 формулы изобретения. В данном изобретении также представлен способ по пункту 8 и применение специально определенного основания в реакции, содержащей сульфонат алкилфторалкила по пункту 28. Предпочтительные варианты представлены в подпунктах.
Неожиданно было обнаружено, что в способе получения химического соединения, в котором нуклеофил подвергают взаимодействию с сульфонатом алкилфторалкила в присутствии основания, основание формулы NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с получением кольца;
демонстрирует значительно пониженную реакционную способность в отношении реагента сульфоната алкилфторалкила. Выбор основания указанной выше формулы предотвращает ненужное разложение фторалкилсульфонатных реагентов в реакционной смеси, снижает необходимость в большом избытке реагента сульфоната алкилфторалкила в реакционной смеси, повышает экономичность реакции и выход и делает способ дешевле. Кроме того, при защите стабильности реагента сульфоната алкилфторалкила с помощью основания, сама реакция протекает чище, что делает последующие стадии очистки легче и более эффективными. Выбор основания в сочетании с определенной защитной группой может также улучшать эффективность способа.
Оказалось неожиданным, что повышение пространственного затруднения более часто применяемых оснований, таких как N,N-диизопропилэтиламин и трис(2-метилпропил)амин, вызовет такое различие в стабильности сульфоната алкилфторалкила в способе, в котором нуклеофил подвергают взаимодействию с сульфонатом алкилфторалкила в присутствии основания. Затрудненные основания, описанные здесь, не являются коммерчески доступными и поэтому не принимаются во внимание. В частности, предпочтительное основание, применяемое в соответствии с данным изобретением, не будет восприниматься как основа выбора в контексте предотвращения побочных реакций как показано здесь.
Аспекты, преимущественные характеристики и предпочтительные варианты данного изобретения суммированы в следующих абзацах, соответственно, по отдельности или в сочетании, способствуют решению задачи данного изобретения.
1. Способ получения химического соединения, включающий взаимодействие нуклеофила с сульфонатом алкилфторалкила в присутствии основания, где основание имеет формулу NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с получением кольца.
2. Способ получения химического соединения, включающий взаимодействие нуклеофила с сульфонатом алкилфторалкила по пункту 1, где фторалкилсульфонатная часть сульфоната алкилфторалкила содержит C1-C4 алкил, замещенный, по крайней мере, одним фторидом, где, предпочтительно, сульфонатом алкилфторалкила является алкилтрифторметилсульфонат, алкилтрифторэтилсульфонат или алкилнонафторбутилсульфонат, предпочтительно, алкилтрифторметансульфонат.
3. Способ получения химического соединения по пунктам 1 или 2, где алкильная часть сульфоната алкилфторалкила замещена функциональной группой, где функциональная группа защищена защитной группой.
4. Способ получения химического соединения по любому из пунктов 1-3, где нуклеофил имеет функциональную группу -OH, -NH2 или -SH, предпочтительно, -OH.
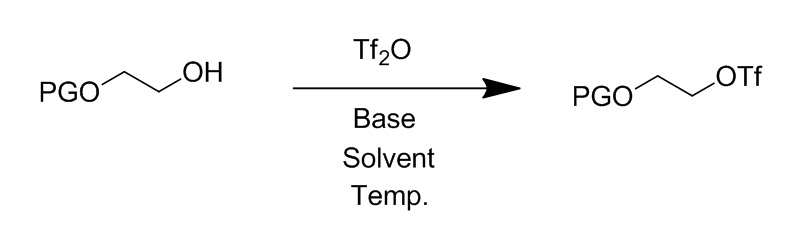
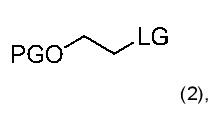
5. Способ получения химического соединения по любому из пунктов 1-4, где сульфонатом алкилфторалкила является соединение формулы (2):
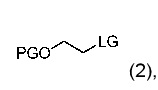
где
• PG является защитной группой; и
• LG является фторалкилсульфонатом.
6. Способ получения химического соединения по любому из пунктов 1-5, где фторалкилсульфонатной частью сульфоната алкилфторалкила является трифторметилсульфонат, трифторэтилсульфонат или нонафторбутилсульфонат, предпочтительно, фторалкилсульфонатом является трифторметилсульфонат.
7. Способ получения химического соединения по любому из пунктов 3-6, также включающий стадию удаления защитной группы.
8. Способ получения сульфоната алкилфторалкила взаимодействием спирта с ангидридом фторалкилсульфоновой кислоты в присутствии основания, где основание имеет формулу NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с получением кольца.
9. Способ получения сульфоната алкилфторалкила по пункту 8, где получают соединение формулы (2), где способ включает стадию взаимодействия соединения формулы (3)
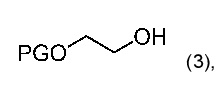
где PG является защитной группой;
с ангидридом фторалкилсульфоновой кислоты, предпочтительно, с ангидридом трифторметилсульфоновой кислоты.
10. Способ получения соединения формулы (2) по пункту 9, где молярное отношение соединения формулы (3) к основанию составляет от 0,5 до 2, предпочтительно, от 0,80 до 1, более предпочтительно, около 0,9.
11. Способ получения соединения формулы (2) по пункту 9 или 10 при температуре от -10°C до 25°C, предпочтительно, около 0°C.
12. Способ получения соединения формулы (2) по любому из пунктов 9-11, где растворителем, применяемым в способе, является апротонный органический растворитель.
13. Способ получения химического соединения, включающий взаимодействие нуклеофила с сульфонатом алкилфторалкила в присутствии основания по любому из пунктов 1-7 или способ получения сульфоната алкилфторалкила по любому из пунктов 8-12, где способ проводят в растворителе, выбранном из группы, включающей толуол, трифторметилтолуол, ксилол, дихлорметан, гептан, пентан, ацетонитрил и трет-бутилметиловый эфир, предпочтительно, растворителем является толуол.
14. Способ получения химического соединения по любому из пунктов 1-7, где нуклеофилом является рапамицин.
15. Способ получения химического соединения по любому из пунктов 1-7 и 14, где химическим соединением является эверолимус, где способ включает стадии:
(a) взаимодействие рапамицина с соединением формулы (2) в присутствии основания
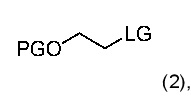
где
• PG является защитной группой; и
• LG является фторалкилсульфонатом,
(b) удаление защитной группы с получением эверолимуса.
16. Способ получения химического соединения по пункту 15, где LG является трифторметилсульфонат, трифторэтилсульфонат или нонафторбутилсульфонат, предпочтительно, LG является трифторметилсульфонат.
17. Способ получения химического соединения по пункту 15, также включающий стадию получения соединения формулы (2).
18. Способ получения химического соединения по пункту 16, где соединение формулы (2) получают по любому из пунктов 9-13.
19. Способ получения химического соединения по пункту 14 при температуре от 25°C до 70°C, предпочтительно, от 40°C до 50°C, особенно предпочтительно, при 45°C.
20. Способ получения химического соединения по любому из пунктов 15-17, где рапамицин на стадии (a) подвергают взаимодействию при температуре от 25°C до 70°C, предпочтительно, от 40°C до 50°C, особенно предпочтительно, при 45°C.
21. Способ получения химического соединения по любому из пунктов 14-20, где рапамицин подвергают взаимодействию в органическом апротонном растворителе, предпочтительно, выбранном из группы, включающей толуол, трифторметилтолуол, ксилол, дихлорметан, гептан, пентан и их смеси, в частности, в толуол.
22. Способ получения химического соединения по любому из пунктов 7 или 15-21, где защитную группу удаляют кислотой.
23. Способ получения химического соединения по любому из пунктов 7 или 15-22, где защитную группу удаляют HF.пиридином, фторидом аммония, HF.триэтиламином, гексафторизопропанолом, уксусной кислотой, трифторуксусной кислотой, хлористоводородной кислотой, серной кислотой или их сочетанием, предпочтительно, HF.пиридином или гексафторизопропанолом.
24. Способ получения химического соединения по любому из пунктов 7 или 15-23, где защитную группу удаляют в растворителе, выбранном из группы, включающей тетрагидрофуран, метилтетрагидрофуран, ацетон, гептан, метанол, ацетонитрил и гексафторизопропанол, предпочтительно, в тетрагидрофуране или гексафторизопропаноле.
25. Способ получения химического соединения по любому из пунктов 7 или 15-24, где защитную группу удаляют при температуре от -78°C до 70°C, предпочтительно, от 0°C до 70°C.
26. Способ получения химического соединения по любому из пунктов 3-25, где защитную группу выбирают из группы, включающей триизопропилсилил, трет-бутилдиметилсилил, диметилтрет-гексилсилил, трет-бутилдифенилсилил, тритил, бензгидрил, диметоксилтритил и дифенилметил, предпочтительно, выбирают из группы, включающей трет-бутилдиметилсилил, трет-бутилдифенилсилил, тритил и дифенилметил, более предпочтительно, она является трет-бутилдиметилсилилом или трет-бутилдифенилсилилом, особенно предпочтительно, она является трет-бутилдифенилсилилом.
27. Способ по любому из представленных выше пунктов, где растворитель, применяемый в способе, не содержит N,N-диметилформамид, 1,2-диэтоксиэтан, 1,2-диметоксиэтан, N,N-диметилацетамид, бис(2-метоксиэтиловый) эфир и 1-метил-2-пирролидин.
28. Применение основания, имеющего формулу NR1R2R3, где:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с получением кольца;
в химической реакции, содержащей сульфонат алкилфторалкила.
29. Применение основания, имеющего формулу NR1R2R3 по пункту 28, где фторалкилсульфонатная часть сульфоната алкилфторалкила содержит C1-C4 алкил, замещенный, по крайней мере, одним фторидом, предпочтительно, где сульфонатом алкилфторалкила является алкилтрифторметилсульфонат, алкилтрифторэтилсульфонат или алкилнонафторбутилсульфонат, предпочтительно, сульфонатом алкилфторалкила является алкилтрифторметилсульфонат.
30. Применение основания, имеющего формулу NR1R2R3 по пункту 28 или 29, где алкильная часть сульфоната алкилфторалкила замещена функциональной группой, где функциональная группа защищена защитной группой.
31. Применение основания, имеющего формулу NR1R2R3 по пунктам 30 или 31, где функциональной группой является -OH, -SH или -NH2 группа, предпочтительно, -OH.
32. Применение основания, имеющего формулу NR1R2R3 по любому из пунктов 28-31, где сульфонатом алкилфторалкила является алкилтрифторметансульфонат.
33. Применение основания, имеющего формулу NR1R2R3 по пункту 28-32, где сульфонатом алкилфторалкила является сульфонат алкилфторалкила формулы (2):
где
• PG является защитной группой; и
• LG является фторалкилсульфонатом.
34. Применение основания, имеющего формулу NR1R2R3 по пункту 33, где фторалкилсульфонсульфонатом является трифторметилсульфонат, трифторэтилсульфонат или нонафторбутилсульфонат, предпочтительно, фторалкилсульфонатом является трифторметилсульфонат.
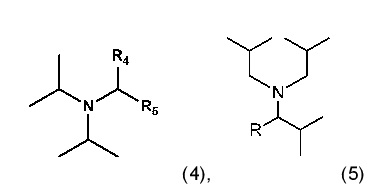
35. Способ по любому из пунктов 1-27, или применение по любому из пунктов 28-34, где основание имеет формулу (4)
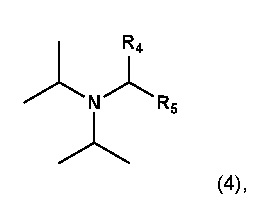
где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с получением кольца;
или формулу (5)
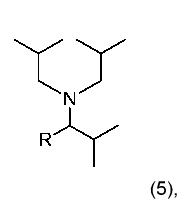
где R является алкилом.
36. Способ по пункту 35, или применение по пункту 35, где R4 и R5 оба являются этилом или оба являются бутилом; или R является изопропилом.
37. Способ по пункту 35 или 36, или применение по пункту 35 или 36, где R4, R5 являются пропилом.
38. Способ по любому из пунктов 1-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизопропилпентан-3-амин.
39. Способ получения химического соединения по любому из пунктов 3-13 или 15-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизопропилпентан-3-амин и защитную группу выбирают из группы, включающей трет-бутилдифенилсилил, диметилтрет-гексилсилил, трет-бутилдиметилсилил и тритил, предпочтительной, трет-бутилифенилсилил.
40. Способ получения химического соединения по любому из пунктов 3-13 или 15-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизопропилпентан-3-амин и защитной группой является тритил.
41. Способ получения химического соединения по любому из пунктов 14-27 или 36-39, где молярное отношение алкилтрифторметансульфоната к рапамицину составляет от 4 до 1,5, предпочтительно, от 2 до 3, более предпочтительно, 2,5.
42. Способ получения химического соединения по любому из пунктов 3-13 или 15-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизопропилнонан-5-амин и защитную группу выбирают из группы, включающей трет-бутилифенилсилил, диметилтрет-гексилсилил, трет-бутилдиметилсилил и тритил, предпочтительно, трет-бутилдифенилсилил.
43. Способ получения химического соединения по любому из пунктов 3-13 или 15-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизопропилнонан-5-амин и защитной группой является тритил.
44. Способ получения химического соединения по любому из пунктов 3-13 или 15-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизобутил-2,4-диметилпентан-3-амин и защитную группу выбирают из группы, включающей трет-бутилдифенилсилил, диметилтрет-гексилсилил, трет-бутилдиметилсилил и тритил, предпочтительно, трет-бутилдифенилсилил.
45. Способ получения химического соединения по любому из пунктов 3-13 или 15-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизобутил-2,4-диметилпентан-3-амин и защитной группой является тритил.
46. Способ по любому из пунктов 1-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизопропилнонан-5-амин.
47. Способ по любому из пунктов 1-27, или применение по любому из пунктов 28-33, где основанием является N,N-диизобутил-2,4-диметилпентан-3-амин.
48. Способ получения фармацевтической композиции, где способ включает стадии получения химического соединения по любому из пунктов 1-7, 14-27 или 35-47, и смешивания химического соединения с, по крайней мере, одним фармацевтически приемлемым наполнителем.
49. Способ по пункту 48, где химическим соединением является эверолимус.
Подробное описание изобретения
Неожиданно был обнаружен способ получения химического соединения, включающий взаимодействие нуклеофила с сульфонатом алкилфторалкила в присутствии основания, где основание имеет формулу NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с образованием кольца. То же основание можно применять в способе получения сульфоната алкилфторалкила в качестве конечного химического соединения или реагента для полследующего применения. Для получения сульфоната алкилфторалкила соответствующий спирт подвергают взаимодействию с ангидридом фторалкилсульфоновой кислоты в присутствии основания. Фактически, это основание будет предпочтительным при применении в качестве основания в любой химической реакции, содержащей сульфонат алкилфторалкила в качестве реагента, так как это улучшает эффективность реакции через предотвращение возникновения побочных реакций.
Основания, определенные здесь, являются необычными основаниями, но они неожиданно улучшают стабильность сульфоната алкилфторалкила в реакционной смеси по сравнению с другими основаниями. До сих пор основания, такие как 2,6-лутидин, пиридин, триэтиламин, диизопропиламин или N,N-диизопропилэтиламин, были описаны для подобных методов алкилирования в химической литературе. Однако указанные основания могут вызвать разложение сульфоната алкилфторалкила во время реакции, что приводит к образованию ненужных побочных продуктов. С другой стороны, применением оснований, показанных здесь, позволяет химическому синтезу проходить с меньшим количеством побочных реакций, тем самым снижая количество получаемых побочных продуктов. Новый способ дает указанные выше основные результаты с более высоким выходом и с меньшим количеством примесей, что делает дальнейшую обработку для выделения и очистке продукта химической реакции легче и более эффективной.
Заместители основания R4, R5 и R в соответствии с данным изобретением являются алкилами, или R4 и R5 вместе образуют циклоалкил. Термин “алкил” в данном описании означает прямую или разветвленную (однократно, при желании и возможности, больше раз) углеродную цепь C2-C10-алкила, такого как C2-C5-алкил, в частности, разветвленный C2-C5-алкил, такой как изопропил или линейный C2-C5-алкил, такой как этил. Термин “C2-C10-“ определяет группу, содержащую вплоть до, и максимально 10, особенно вплоть до, и максимально 5, атомов углерода, где указанная группа разветвлена (один или более раз) или является прямой и связана через концевой или не концевой атом углерода. C2-C10-алкилом, например, является н-пентил, н-гексил или н-гептил или, предпочтительно, C2-C5-алкилом, особенно, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, н-гексилом и, в частности, этилом, н-пропилом, изо-пропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом; предпочтительно, этилом, изопропилом или н-бутилом. В одном варианте, R4 и R5 оба являются этилом. В другом варианте, R4 и R5 оба являются бутилом. “Циклоалкил” означает варианты когда, альтернативно, R4 и R5 алкилы образуют кольцо с, например, C5 или C6 атомами углерода. Одним примером возможного циклоалкила является циклогексил. Более конкретно, основания, которые показали наилучшие результаты, и, поэтому, являются предпочтительными в соответствии с данным изобретением, изображены ниже:
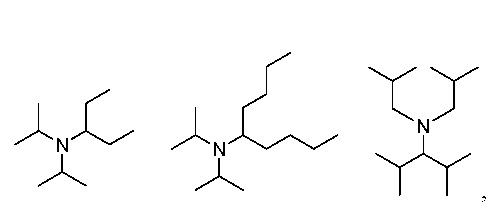
т.е. основаниями являются N,N-диизопропилпентан-3-амин, N,N-диизопропилнонан-5-амин и N,N-диизобутил-2,4-диметилпентан-3-амин, соответственно. В данном описании изобутил и 2-метилпропил взаимозаменяемы. Описанные здесь основания могут быть получены, например, способом, описанным в Liebigs Ann. Chem. 1985, 2178-2193 or Liebigs Ann. Chem. 1974, 1543 - 1549.
В соответствии с данным изобретением, основания применяют в способе, в котором нуклеофил подвергают взаимодействию с сульфонатом алкилфторалкила в присутствии основания. Нуклеофилом в контексте данного изобретения является исходный материал, имеющий реакционноспособную нуклеофильную часть. Нуклеофилом или реакционноспособной нуклеофильной частью является любое химическое вещество, которое отдает электронную пару электрофилу с получением химической связи в реакции. Любой нейтральный нуклеофил подходит для способа в соответствии с данным изобретением. Нуклеофилами являются, например, кислородные нуклеофилы, такие как вода, спирты, перекись водорода; серные нуклеофилы, такие как сероводород, тиолы (RSH), азотные нуклеофилы включают аммиак, азид, амины и нитрилы. В контексте данного изобретения нуклеофил подвергают взаимодействию с сульфонатом алкилфторалкила для того, чтобы добавить алкильную группу к нуклеофилу. Реакция с нуклеофилом может дать следующий реагент, промежуточное соединение или конечное соединение. Реакционноспособная нуклеофильная часть химического соединения может быть единственной реакционноспособной группой соединения. Нуклеофил, т.е. исходный материал, может иметь другие реакционноспособные группы, которые необязательно защищены защитной группой. Исходный материал, содержащий нуклеофильную часть, может иметь молярную массу, например, от 17 г/моль до 10000 г/моль. В случае, когда исходное химическое соединение является полимером, молярная масса превышает 10000 г/моль, и может быть, например, вплоть до 50000 г/моль. Данный способ может эффективно применяться к соединению с молярной массой от 800 г/моль до 1500 г/моль, в частности, от 900 до 1000 г/моль. В частности, способ в соответствии с данным изобретением может применяться, если рапамицин (сиролимус) применяют в качестве исходного материала.
”Фторалкилсульфонат” означает сульфонатную группу формулы -O-S(O)2-фторалкил, содержащую, по крайней мере, моно фторированный C1-C4 алкильный компонент. Очевидно, что чем более фторирован C1-C4 фторалкильный компонент, тем более лучшую уходящую группу он образует, и, таким образом, более подвержен разложению неправильно выбранным основанием. Наилучшими уходящими группами являются перфторалкилсульфонаты. В предпочтительном варианте, применяют трифторметилсульфонат, нонафторбутилсульфонат или трифторэтилсульфонат. Молярное отношение сульфоната алкилфторалкила к нуклеофилу в способе в соответствии с данным изобретением обычно составляет от 4 до 1,5, предпочтительно, от 2 до 3, и более предпочтительно, около 2,5.
Алкильная часть спирта, который эстерифицирован фторалкилсульфоновой кислотой с получением сульфоната алкилфторалкила, описана термином “алкил”, таким как определен выше. Алкильная часть (т.е. спиртовая часть) сульфоната алкилфторалкила может быть далее замещена. В одном варианте, алкильная часть замещена функциональной группой, которая может быть, например, -OH, -SH или -NH2 группой. Если функциональной группой является -OH или -NH2 или любая другая реакционноспособная группа, лучше всего, чтобы она была защищена защитной группой, в противном случае она может вызвать другие побочные реакции. В одном варианте, алкильной частью сульфоната алкилфторалкила является этан, замещенный -OH. В основном варианте, -OH группа защищена защитной группой. В предпочтительном варианте, применяемым здесь сульфонатом алкилфторалкила является алкилтрифторметилсульфонат, алкилнонафторбутилсульфонат или алкилтрифторэтилсульфонат, в частности, алкилтрифторметилсульфонат. Если алкильной частью является PG-O-этил-, сульфонат алкилфторалкила образует соединение формулы (2). В частности, реагенты PG-O-этилтрифторметилсульфонат, PG-O-этилнонафторбутилсульфонат или PG-O-этилтрифторэтилсульфонат могут применяться в способе в соответствии с данным изобретением; предпочтительно, реагентом является PG-O-этилтрифторметилсульфонат. Защитной группой может быть, например, триизопропилсилил, трет-бутилдиметилсилил, диметилтрет-гексилсилил, трет-бутилдифенилсилил, тритил, бензгидрил, диметоксилтритил. Защитные группы необязательно могут быть введены согласно следующим ссылкам: трет-бутилдиметилсилил согласно WO2007/124898 A1, 2007 или Org. Lett., 2006, 8, 5983-5986; трет-бутилдифенилсилил согласно Tetrahedron Lett., 2000, 41, 4197-4200; триизопропилсилил согласно J. Med. Chem. 2006, 49, 2333 -2338; диметил-трет-гексилсилил согласно WO2012/103959 A1, 2012; бензгидрил согласно Org. Biomol. Chem., 2012, 10, 1300; и тритил согласно J. Org. Chem. 1992, 57, 6678-6680. В любом случае в указанных выше и ниже реакциях защитные группы могут применяться, когда они уместны или желательны, даже если это отдельно не упомянуто, для защиты функциональных групп, которые не должны участвовать в данной реакции, и они могут быть введены и/или удалены на подходящих или делаемых стадиях. Реакции, включающие применение защитных групп, поэтому включены сюда как возможные, во всех случаях, когда реакции без отдельного упоминания о защите и/или снятии защиты описаны в данном описании. В объеме данного изобретения, только легко удаляемые группы, которые не являются составляющими конкретного желаемого конечного продукта, обозначены как "защитные группы", если в контексте не указано иначе. Защита функциональных групп такими защитными группами, сами защитные группы и реакции, подходящие для из введения и удаления, описаны, например, в стандартных ссылочных работах, таких как J. F. W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, в T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999, в "The Peptides"; Volume 3 (editors: E. Gross and J. Meienhofer), Academic Press, London and New York 1981, в "Methoden der organischen Chemie" (Methods of Organic Chemistry), Houben Weyl, 4th edition, Volume 15/I, Georg Thieme Verlag, Stuttgart 1974.
Так как сульфонат алкилфторалкила является чувствительным к разложению, и потенциально нуклеофильный исходный материал также является нестабильным в применяемых условиях реакции, растворители, выбранные для способа, предпочтительно являются растворителями, которые не реакционноспособны в отношении применяемого сульфоната алкилфторалкила или нуклеофила, и который сам по себе не реакционноспособен в применяемых условиях реакции. Обычно растворителем может быть инертный растворитель, такой как органический апротонный растворитель, предпочтительно, не полярный апротонный растворитель. Примеры таких нереакционноспособных растворителей включают, но не ограничены ими, те, которые выбраны из группы, включающей алифатические, циклические или ароматические углеводороды, включая, но не ограничиваясь ими, выбранные из группы, включающей гексан, пентан, гептан, толуол, циклогексан, октан, их смеси, и т.д.; хлорированные углеводороды, включая, но не ограничиваясь ими, выбранные из группы, включающей дихлорметан, алифатический (линейный или разветвленный) или циклический простой эфир, включающий от 4 до 10 атомов углерода, и от 1 до 3 атомов кислорода, и алкилнитрил и их смеси. Предпочтительно, растворителем является толуол, трифторметилтолуол, ксилол, дихлорметан, гептан, пентан, ацетонитрил или трет-бутилметиловый эфир, иди их смеси. Более предпочтительно, растворителем является толуол. Растворители необязательно могут быть полностью лишены воды, поэтому они могут храниться или обрабатываться влагопоглотителями. Дополнительно, растворитель может быть деаэрирован инертным газом, таким как, например, азот или аргон. Температура реакции может быть скорректирована в соответствии с выбранными реагентами в реакционной смеси, но, предпочтительно, составляет от -80°C до 90°C, более предпочтительно, от -50°C до 70°C. В зависимости от наилучших условий реакции, температура реакции может составлять от -10°C до 25°C, или от 25°C до 50°C.
Предпочтительно, растворитель, применяемый в реакции, не содержит N,N-диметилформамид, 1,2-диэтоксиэтан, 1,2-диметоксиэтан, N,N-диметилацетамид, бис(2-метоксиэтиловый) эфир, 1-метил-2-пирролидиндиметоксиэтан или подобные полярные апротонные растворители. Указанные полярные апротонные растворители обычно применяют в реакциях нуклеофильного замещения для улучшения реакционной способности. Однако, в способе в соответствии с данным изобретением, указанных растворителей необходимо избегать. Полярные апротонные растворители усиливают побочные реакции и, таким образом, разложение реагентов сульфоната алкилфторалкила. Кроме того, применение растворителей, лишенных полярных апротонных растворителей, перечисленных выше, благоприятно для здоровья человека и окружающей среды.
Предпочтительные варианты данного изобретения
Предпочтительные варианты в соответствии с данным изобретением относятся к способам в соответствии с данным изобретением получения активного фармацевтического ингредиента (АФИ), в частности, эверолимуса. Было показано, что при замене оснований, которые обычно применяли в химических реакциях, включающих сульфонаты алкилфторалкила, основаниями, описанными здесь, АФИ, такой как эверолимус, может быть получен с высоким выходом с меньшим содержанием примесей и более эффективно. Эти аспекты особенно важны в области фармацевтики, где профиль примесей АФИ особенно важен. Кроме того, большая эффективность способа способствует пересчету технологического процесса на полномасштабную установку что, в свою очередь, позволяет получить объемы производства, которые могут удовлетворить потребности.
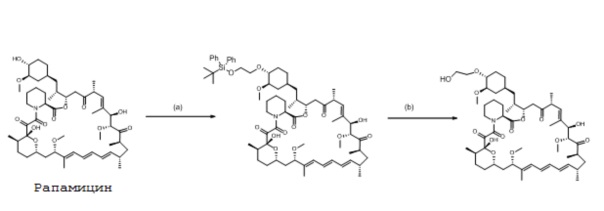
Способ получения эверолимуса сначала дает защищенное промежуточное соединение, где рапамицин подвергают взаимодействию с сульфонатом алкилфторалкила в присутствии основания, где основание имеет формулу NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с образованием кольца. Применяются все характеристики второй стадии, описанные ниже.
В общем, способ получения эверолимуса может включать стадии:
(a) взаимодействия рапамицина с соединением формулы (2) (вторая стадия, такая как описана ниже).
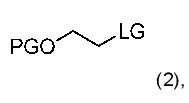
где
• PG является защитной группой; и
• LG является фторалкилсульфонатом,
в присутствии основания формулы NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с образованием кольца,
(b) удаления защитной группы с получением эверолимуса. К этому способу может быть добавлена первая стадия получения соединения формулы (2).
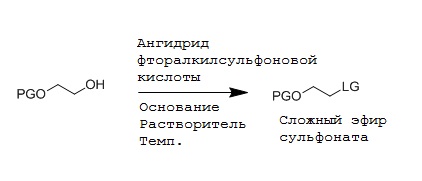
На первой стадии реагент, т.е. сульфонат алкилфторалкила, может быть получен способом взаимодействия спирта с ангидридом фторалкилсульфоновой кислоты в присутствии основания, как определено выше. В общем, даже другие основания, такие как, например, N,N-диизопропилэтиламин, могут применяться на этой стадии. Такие способы позволяют получить соединение формулы (2)
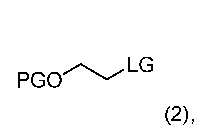
где LG означает фторалкилсульфонат, т.е. уходящую группу формулы -O-S(O)2-фторалкил, и PG является защитной группой. Предпочтительно, LG является трифторметилсульфонатом, нонафторбутилсульфонатом или трифторэтилсульфонатом. В конкретном варианте, LG означает трифторметилсульфонат. Реакция может проводиться способом, включающим стадию взаимодействия соединения формулы (3)
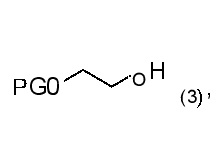
где PG является защитной группой; с ангидридом фторалкилсульфоновой кислоты следующим образом:
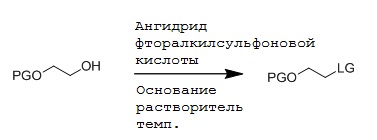
В предпочтительном варианте ангидридом фторалкилсульфоновой кислоты является ангидрид трифторметилсульфоновой кислоты, ангидрид нонафторбутилсульфоновой кислоты или ангидрид трифторэтилсульфоновой кислоты. Предпочтительно, ангидридом фторалкилсульфоновой кислоты является ангидрид трифторметилсульфоновой кислоты. Выбор ангидрида фторалкилсульфоновой кислоты определяет получение соответствующей фторалкилсульфонатной уходящей группы (LG), представленной -O-S(O)2-фторалкилом на соединении формулы (2). Основанием может быть любое подходящее основание со слабой нуклеофильностью, но для обеспечивания стабильности продукта, улучшения выхода реакции, снижения образования побочных продуктов и более простой очистки, применяют основание формулы NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с образованием кольца.
Особенно предпочтительными основаниями являются N,N-диизопропилпентан-3-амин, N,N-диизопропилнонан-5-амин или N,N-диизобутил-2,4-диметилпентан-3-амин. Молярное отношение соединения формулы (3) к основанию составляет от 0,5 до 2, предпочтительно, от 0,80 до 1, более предпочтительно, около 0,9. Реакционную температуру способа доводят до интервала от -10°C до 25°C, предпочтительно, около 0°C. Применяемым растворителем является растворитель, описанный выше, т.е. инертный растворитель, такой как органический апротонный растворитель, предпочтительно, не полярный апротонный растворитель. Предпочтительно, растворитель выбирают из группы, включающей толуол, трифторметилтолуол, ксилол, дихлорметан, гептан, пентан, ацетонитрил и трет-бутилметиловый эфир и их смеси. Наиболее предпочтительно, растворителем является толуол.
Защитной группой, применяемой в способе получения соединения формулы (2), является, как описано выше, любая защитная группа, которую специалист в данной области техники выберет на основе общих ссылок. Особенно предпочтительны следующие защитные группы: триизопропилсилил, трет-бутилиметилсилил, диметилтрет-гексилсилил, трет-бутилдифенилсилил, тритил, бензгидрил, диметоксилтритил и дифенилметил, предпочтительно, защитную группу выбирают из группы, включающей трет-бутилдиметилсилил, трет-бутилдифенилсилил, тритил, диметокситритил и дифенилметил, более предпочтительно, трет-бутилдиметилсилил или трет-бутилдифенилсилил, особенно предпочтительно, трет-бутилдифенилсилил. В качестве общего принципа получения соединения формулы (2), методика может быть следующей:
К раствору защищенного производного этиленгликоля (1 эквив.) в растворителе (0,57 M) добавляют аминовое основание (1,05-1,14 эквив.). Затем раствор охлаждают до 0°C и добавляют ангидрид трифторметансульфоновой кислоты (0,97-1,0 эквив.) по каплям так, чтобы температура сохранялась на уровне от -2°C до 2°C. Реакционную смесь нагревают до температуры окружающей среды и перемешивают в течение еще 1 ч. ГХ-МС анализ показывает, что образование трифлата завершено в этот момент времени.
Способ получения соединения формулы (2) оптимально проводить при сочетании следующих условий: защитной группой является трет-бутилдиметилсилил, растворителем является толуол и основанием является N,N-диизопропилэтиламин; или защитной группой является трет-бутилдифенилсилил, растворителем является толуол и основанием является N,N-диизопропилпентан-3-амин.
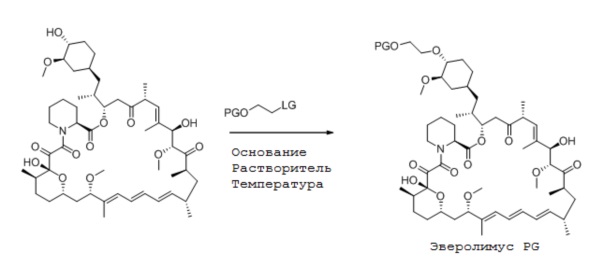
На второй стадии нуклеофил рапамицин алкилируют с соединением формулы (2) в присутствии основания, где основание имеет формулу NR1R2R3:
• R1 и R2 независимо являются 2-метилпропилом или изопропилом; и
• R3 является -CH(R4)(R5), где R4 и R5 являются одинаковыми или разными алкилами, которые необязательно соединены с образованием кольца.
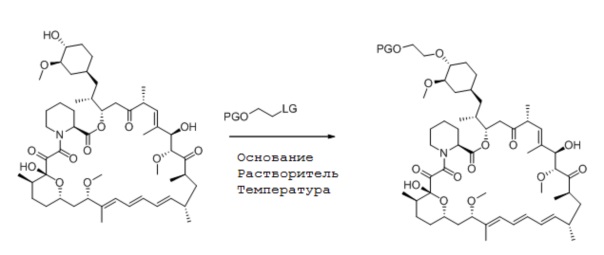
Особенно предпочтительными основаниями являются N,N-диизопропилпентан-3-амин, N,N-диизопропилнонан-5-амин или N,N-диизобутил-2,4-диметилпентан-3-амин. Способ взаимодействия рапамицина с соединением формулы (2) оптимально проводить при температуре от 25°C до 70°C, предпочтительно, от 40°C до 50°C, в частности, при 40°C в органическом апротонном растворителе, таком как описан выше. Особенно хорошо проводить способ в толуоле, трифторметилтолуоле, ксилоле, дихлорметане, гептане, пентане, или их смеси. Наиболее предпочтительным растворителем для реакции является толуол. Защитная группа, подходящая для способа, включает, но не ограничена ими, триизопропилсилил, трет-бутилдиметилсилил, трет-гексилдиметилсилил, трет-бутилдифенилсилил, тритил, диметоксилтритил и бензгидрил. Например, реакция может быть проведена следующим способом:
К раствору трифлата, полученного на первой стадии выше (от 1,5 до 5 эквив.), добавляют основание (от 1,73 до 5,75 эквив.), затем рапамицин (1 эквив.). Дополнительное количество растворителя используют для промывания до получения конечной концентрации 0,11 M по отношению к рапамицину. Реакционную смесь нагревают до подходящей температуры и отслеживают ВЭЖХ.
Наилучшим сочетанием условий реакции для этой стадии является сочетание N,N-диизопропилпентан-3-аминового основания, трет-бутилдифенилсилильной защитной группы и растворителя толуола. Наилучшей температурой, выбираемой для указанных выше конкретных условий для второй стадии, является температура от около 40°C до 50°C.
Защищенное промежуточное соединение в реакционной смеси может быть очищено хроматографией на силикагеле. Особенно эта методика подходит для очистки неочищенной реакционной смеси защищенного силилом эверолимуса. Растворителями, применяемыми для очистки, может быть смесь сложного эфира, такого как этилацетат или изопропилацетат, и неполярного алифатического растворителя, такого как н-гептан, н-гексан, изомер гептана, изомер гексана, или их смеси. Эти системы растворителей обеспечивают достаточную растворимость неочищенного продукта, его отделение и элюирование. Системы на основе толуола и метилизобутилкетона, метилэтилкетона, изопропанола и этанола не работают из-за субоптимальной силы растворителя, растворимости сорастворителя или растворимости неочищенного продукта в этих растворителях. Добавление полярного и протонного сорастворителя, такого как вода или метанол, в количестве вплоть до 5% объемных (например, от 1 до 5% объемных) повышает стабильность целевой молекулы в неподвижной фазе через ослабление кислотности силанольных групп. Кроме того, реакционная смесь может быть предварительно обработана осаждением или кристаллизацией соединений соли, образованных в качестве побочных продуктов. Затем побочные продукты могут быть адсорбированы в силикагель и удалены фильтрацией, затем может быть проведена очистка на основе хроматографии на силикагеле с нормальной фазой. Селективное осаждение (кристаллизация) и адсорбция могут улучшать долговременную стабильность стационарной фазы и позволяют избежать необходимой трудоемкой очистки на месте между прогонами, или дополнительной предварительной обработки реакционной смеси с помощью одноразовых фильтровальных картриджей для удаления соединений соли. Улучшенная чистота достигается выбором неподвижной фазы, которая обладает приемлемой селективностью. В общем, очистка между стадиями реакции позволяет эффективно удалять определенные побочные продукты, которые образуются при химическом превращении примесей исходного материала. Чистота конечного химического соединения зависит также от эффективности удаления указанного побочного продукта уже на этой стадии.
Эта стадия очистки позволяет контролировать предшественник критической примеси, этил-эверолимуса, на уровнях около 0,2%. В то же время, она обеспечивает стабильность целевого продукта в процессе очистки. Кроме того, она является устойчивым процессом и может быть расширена до полных коммерческих партий в промышленных установках.
Следующей стадией получения эверолимуса является отщепление защитной группы. Поэтому способ получения эверолимуса может включать стадии:
(a) взаимодействия рапамицина с соединением формулы (2) в присутствии основания,
(b) удаления защитной группы с получением эверолимуса.
Способ получения эверолимуса может быть расширен далее до составления фармацевтической композиции, содержащей полученный эверолимус.
Удаление защитной группы может проводиться в стандартных условиях реакции, известных в данной области техники, если не указано иначе, предпочтительно, в таких, которые упомянуты специально, в отсутствие или, обычно, в присутствии кислот или оснований, предпочтительно, кислот или оснований, которые вызывают удаление защитной группы, но при этом не вызывают химического разложения эверолимуса. Предпочтительно, защитную группу удаляют кислотой. Особенно подходящими кислотами для удаления защитной группы с эверолимуса являются HF.пиридин, фторид HF.триэтиламинаммония, гексафторизопропанол, уксусная кислота, трифторуксусная кислота, хлористоводородная кислота, серная кислота или их сочетание, предпочтительно, кислотой является HF.пиридин или гексафторизопропанол. Удаление защитной группы может проходить в том же растворителе, который применяют на предыдущих стадиях реакции. Однако растворитель может быть заменен таким, который способствует удалению защитной группы. В качестве примера, защитная группа может быть удалена в растворителе, выбранном из группы, включающей тетрагидрофуран, метилтетрагидрофуран, ацетон, гептан, метанол, ацетонитрил и гексафторизопропанол, предпочтительно, в тетрагидрофуране или гексафторизопропаноле. Защитную группу удаляют при температуре от -78°C до 70°C, предпочтительно, от 0°C до 70°C. Реакция снятия защиты наилучшим образом проходит с применением HF.Пиридина в тетрагидрофуране, необязательно при температуре окружающей среды.
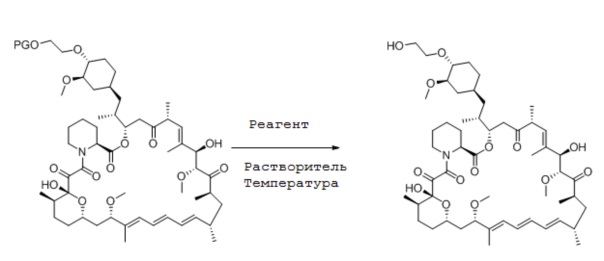
Неожиданно было обнаружено, что конкретные защитные группы могут увеличить общий выход реакции при применении в сочетании с определенными основаниями, как описано здесь. Такие защитные группы могут быть выбраны из группы, включающей триизопропилсилил, трет-бутилдиметилсилил, диметилтрет-гексилсилил, трет-бутилдифенилсилил, тритил, бензгидрил, диметоксилтритил или дифенилметил, предпочтительно, ее выбирают из группы, включающей трет-бутилдиметилсилил, трет-бутилдифенилсилил, тритил и дифенилметил, более предпочтительно, трет-бутилдиметилсилил и трет-бутилдифенилсилил, и особенно предпочтительно, трет-бутилдифенилсилил. Выбор основания, описанного в соответствии с данным изобретением, для получения эверолимуса в определенном сочетании с триизопропилсилильной, трет-бутилдиметилсилильной, диметилтрет-гексилсилильной, трет-бутилдифенилсилильной, тритильной, бензгидрильной или дифенилметильной защитной группой, предпочтительно, трет-бутилдиметилсилильной или трет-бутилдифенилсилильной, особенно предпочтительно, трет-бутилдифенилсилильной защитной группой, позволяет проводить способ получения эверолимуса с преимущественно высокими выходами, особенно при сочетании с N,N-диизопропилпентан-3-аминовым, N,N-диизопропилнонан-5-аминовым или N,N-диизобутил-2,4-диметилпентан-3-аминовым основанием, в частности, N,N-диизопропилпентан-3-амином.
В конкретном варианте, N,N-диизопропилпентан-3-амин и защитную группу трет-бутилдифенилсилил выбирают для способа получения эверолимуса в соответствии с данным изобретением.
В другом конкретном варианте, N,N-диизопропилпентан-3-амин и защитную группу трет-бутилдиметилсилил выбирают для способа получения эверолимуса.
В еще одном варианте, N,N-диизопропилпентан-3-амин и защитную группу тритил выбирают для способа получения эверолимуса.
В другом варианте, основание N,N-диизопропилнонан-5-амин применяют в способе в соответствии с данным изобретением в сочетании с трет-бутилдифенилсилильной защитной группой. N,N-диизопропилнонан-5-амин также может применяться в сочетании с тритильной защитной группой.
Кроме того, также N,N-диизобутил-2,4-диметилпентан-3-амин может применяться в способе в соответствии с данным изобретением в сочетании с трет-бутилдифенилсилильной защитной группой. Сочетание N,N-диизобутил-2,4-диметилпентан-3-амина с тритильной защитной группой также отдельно указано в данном изобретении. N,N-диизобутил-2,4-диметилпентан-3-амин и N,N-диизопропилнонан-5-амин также могут применяться вместе с трет-бутилдиметилсилильной защитной группой.
После завершения реакции снятия защиты, процесс обработки и очистки выбирают подходящим образом согласно физико-химическим свойствам полученного химического соединения. Для соединений, таких как Эверолимус, реакционную смесь нейтрализуют и продукт (такой как эверолимус) экстрагируют смешиваемым с водой органическим растворителем и выделяют из органической фазы. После выделения продукт (т.е. эверолимус) может быть далее промыт, высушен и очищен способами, известными специалистам в данной области техники. Применение оснований, определенных в пункте 1, необязательно в сочетании с предпочтительной защитной группой, в способе в соответствии с данным изобретением, позволяет повысить чистоту синтезированного продукта. Это упрощает очистку, так как требуется меньшее количество стадий очистки. Полученный продукт может применяться для дальнейшего синтеза или как конечный продукт. Могут быть добавлены наполнители, такие как, например, красители или антиоксиданты. Если продукт является АФИ, как в случае эверолимуса, соединение может быть далее стабилизировано антиоксидантом (таким как, например, 2,6-ди-трет-бутил-4-метилфенол, известный также как бутилгидрокситолуол или БГТ) и упаковано вроссыпь и/или составлено в фармацевтическую композицию. Составление фармацевтической композиции, в общем, означает смешивание полученного АФИ, такого как эверолимус, с, по крайней мере, одним фармацевтически приемлемым наполнителем, например, подходящим носителем и/или разбавителем. Наполнители включают, но не ограничены ими, наполнители, связующие агенты, разрыхлители, стабилизаторы текучести, смазывающие агенты, сахара или подсластители, отдушки, консерванты, стабилизаторы, смачивающие агенты и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. В зависимости от формы фармацевтической композиции и способа введения, специалист в данной области техники сможет выбрать подходящие наполнители. Формой фармацевтической композиции может быть, например, таблетка в оболочке или без оболочки, капсула, (впрыскиваемый) раствор, раствор для вливания, твердый раствор, суспензия, дисперсия, твердые дисперсии, крем, гель, мазь, паста, вдыхаемый порошок, пена, настойка, суппозиторий или стент (или слой стента). Точно так же, специалист в данной области техники знает, как выбрать подходящий способ введения: например, вводить АФИ или фармацевтическую композицию энетрально или парентерально, или через медицинское устройство, например, для местной доставки в случае стента.
Представленные ниже примеры служат для иллюстрации изобретения, не ограничивая его объем, хотя с другой стороны они представляют предпочтительные варианты стадий реакции, промежуточных соединений и/или способа производства продукта в форме свободного основания или в виде его фармацевтически приемлемой соли.
Пример 1 (ТБС или трет-бутилдиметилсилильная защитная группа)
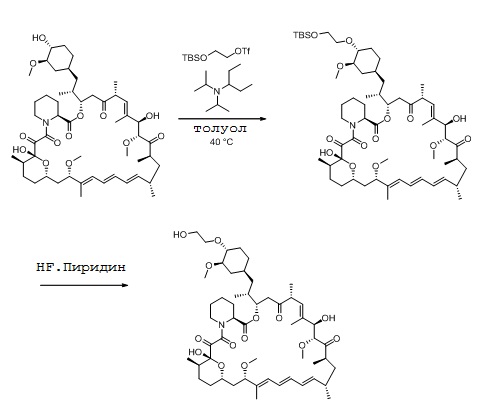
К раствору 2-((трет-бутилдиметилсилил)окси)этанола (8,04 г, 43,8 ммоль) в толуоле (55 г) добавляют N,N-диизопропилэтиламин (5,94 г, 45,9 ммоль). Прозрачный раствор затем охлаждают до 0°C и ангидрид трифторметансульфоновой кислоты (11,97 г, 42,4 ммоль) добавляют по каплям так, чтобы температура оставалась на уровне (-2°C-2°C). После добавления дополнительную порцию толуола (5 г) применяют для промывания.
Через 30 минут добавляют N,N-диизопропилпентан-3-амин (7,871 г, 45,9 ммоль), затем толуол (3 г) и рапамицин (10,0 г, 10,9 ммоль), промывают толуолом (18,4 г). Затем реакционную смесь нагревают до 40°C и перемешивают при этой температуре в течение 42 ч, на этот момент менее 5% площади рапамицина остается согласно ВЭЖХ анализу. Реакционную смесь охлаждают до температуры окружающей среды и затем добавляют пиридин (2,6 г) для остановки реакции, которую перемешивают в течение еще 30 мин. Реакционную смесь фильтруют и разбавляют изопропилацетатом. Органический раствор промывают 1M раствором лимонной кислоты, 10% раствором бикарбоната натрия, затем водой, сушат (MgSO4) и концентрируют в вакууме. Остаток делят на две части.
К половине неочищенного остатка (9,66 г) добавляют ТГФ (100 мл), и этот раствор затем добавляют по каплям при 0°C к раствору HF*пиридина (1:1, 17,7 г). Другую часть ТГФ (20 мл) применяют для промывания. Реакционную смесь нагревают до 45°C в течение 1,5 ч, затем охлаждают до температуры окружающее среды и разбавляют изопропилацетатом (150 г). Затем реакционную смесь медленно добавляют к 8% водному раствору бикарбоната натрия и затем промывают изопропилацетатом (250 г). Органическую фазу затем отделяют и промывают насыщенным водным раствором хлорида натрия, сушат (MgSO4) и концентрируют в вакууме.
Остаток разбавляют изопропилацетатом, добавляют бутилгидрокситолуол (БГТ; 0,2% м/м), и выход эверолимуса определяют ВЭЖХ анализом против внешнего стандарта (2,96 г, 57%).
Пример 2 (ТБДФС или трет-бутилдифенилсилильная защитная группа).
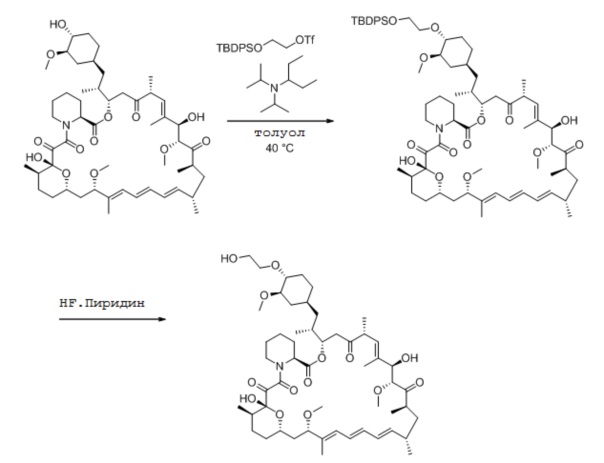
К раствору 2-((трет-бутилдифенилсилил)окси)этанола (13,1 г, 43,8 ммоль) в толуоле (51 г) добавляют N,N-диизопропилпентан-3-амин (8,7 г, 50,3 ммоль). Прозрачный раствор затем охлаждают до 0°C и по каплям добавляют ангидрид трифторметансульфоновой кислоты (12,3 г, 43,8 ммоль) так, чтобы температура оставалась на уровне (-2°C-2°C). После добавления, другую порцию толуола (5 г) применяют для промывания.
Через 1,5 ч добавляют N,N-диизопропилпентан-3-амин (8,7 г, 50,3 ммоль), затем толуол (3 г) и рапамицин (10,0 г, 10,9 ммоль), промывают толуолом (18 г). Реакционную смесь затем нагревают до 40°C и перемешивают при этой температуре в течение 22,5 ч, на этот момент менее 5% площади рапамицина остается согласно ВЭЖХ анализу. Реакционную смесь охлаждают до температуры окружающей среды и затем добавляют пиридин (1,0 мл) для остановки реакции, которую перемешивают в течение еще 30 мин. Реакционную смесь фильтруют и разбавляют изопропилацетатом. Органический раствор промывают 1M раствором лимонной кислоты, 10% раствором бикарбоната натрия, затем водой, сушат (MgSO4) и концентрируют в вакууме. К неочищенному остатку (35,6 г) добавляют ТГФ (240 мл), и этот раствор затем добавляют по каплям при 0°C к раствору HF*пиридина (1:1, 38,1 г). Реакционную смесь нагревают до 45°C в течение 3,5 ч, затем охлаждают до температуры окружающей среды и разбавляют изопропилацетатом (300 г). Реакционную смесь затем добавляют медленно к 8% водному раствору бикарбоната натрия и затем промывают изопропилацетатом (250 г). Органическую фазу затем отделяют и промывают насыщенным водным раствором хлорида натрия, сушат (MgSO4) и концентрируют в вакууме. Остаток разбавляют изопропилацетатом, добавляют БГТ (0,2% м/м), и выход эверолимуса определяют ВЭЖХ анализом против внешнего стандарта (6,81 г, 65%).
Пример 3 (Диметокситритильная защитная группа)
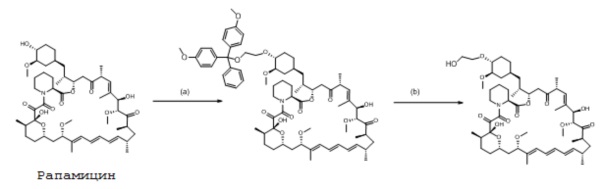
Стадия (a)
2-(бис(4-метоксифенил)(фенил)метокси)этанол (3,049 г, 8,366 ммоль) растворяют в толуоле (10,2 г) и затем добавляют N,N-диизопропилпентан-3-амин (1,648 г, 9,621 ммоль) с последующим добавлением толуола (0,5 г). Реакционную смесь охлаждают до 0°C и ангидрид трифторметансульфоновой кислоты (1,376 мл, 8,145 ммоль) добавляют по каплям, с последующим добавлением толуола (1 г). Реакционную смесь нагревают до комнатной температуры и перемешивают еще 1 ч при этой температуре. Затем добавляют другую порцию N,N-диизопропилпентан-3-амина (1,648 г, 9,621 ммоль) с последующим добавлением толуола (1 г). Затем добавляют рапамицин (2 г, 2,092 ммоль) одной порцией и промывают толуолом (3,7 г). Реакционную смесь затем нагревают до 40°C в течение 18 ч, затем охлаждают до температуры окружающей среды и добавляют пиридин (0,20 г). Реакционную смесь затем перемешивают в течение 30 минут и разбавляют изопропилацетатом (50 мл). Эту органическую фазу затем промывают 1M лимонной кислотой (2×40 мл) с водным раствором бикарбоната натрия (8%, 26 г) и, наконец, водой (2×20 мл), затем сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт растворяют в минимальном количестве дихлорметана и очищают флэш-хроматографией на колонке (15-100% этилацетат в гептане) с получением желаемого продукта в виде желтого масла.
Стадия (b)
Это промежуточное соединение затем растворяют в ацетоне (8,2 мл) и гептане (9 мл), затем добавляют воду (4,6 г). Двухфазную смесь затем охлаждают до 10°C и уксусную кислоту (3,45 мл) добавляют по каплям. Реакционную смесь перемешивают при этой температуре в течение 18 ч, затем разбавляют изопропилацетатом (15 г) и охлаждают до 0°C. Затем добавляют водный раствор гидроксида натрия (15%, 17 г) по каплям и фазы разделяют. Водную фазу экстрагируют изопропилацетатом (2×7,2 г), и объединенные органические фракции промывают водой, сушат (MgSO4) и концентрируют в вакууме с получением бесцветного масла.
ВЭЖХ анализ продукта эверолимуса против внешнего стандарта показал выход 381 мг, 19% за две стадии.
Пример 4 (Диметокситритильная защитная группа)
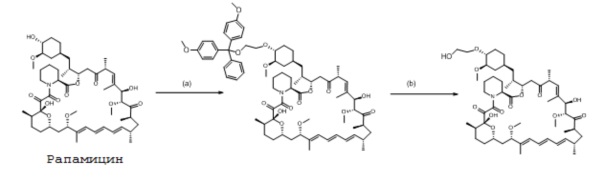
Стадию (a) проводят как описано выше, и затем полученное промежуточное соединение после хроматографии растворяют в гексафторизопропаноле (26 мл). Реакционную смесь нагревают в течение 1,5 ч при 50°C и затем охлаждают до 0°C и гасят насыщенным водным раствором бикарбоната натрия (26 мл). Органическую фазу отделяют и промывают насыщенным водным раствором хлорида натрия, водой, сушат (MgSO4) и концентрируют. ВЭЖХ анализ продукта эверолимуса против внешнего стандарта показал выход 621 мг, 31% за две стадии.
Пример 5 (Трет-бутилдифенилсилильная защитная группа)
Стадия (a)
К раствору 2-((трет-бутилдифенилсилил)окси)этанола (8,22 г, 27,3 ммоль) в толуоле (15 г) добавляют N,N-диизопропилпентан-3-амин (5,39 г, 31,4 ммоль). Прозрачный раствор затем охлаждают до 0°C и ангидрид трифторметансульфоновой кислоты (7,3 г, 26,0 ммоль) добавляют по каплям так, чтобы температура оставалась на уровне (-2°C-2°C). Затем добавляют другую порцию толуола (5 г) применяют для промывания.
Через 1,5 ч добавляют N,N-диизопропилпентан-3-амин (5,39 г, 31,4 ммоль), затем толуол (2,5 г) и рапамицин (10,0 г, 10,9 ммоль), промывают толуолом (12,5 г). Реакционную смесь затем нагревают до 45°C и перемешивают при этой температуре в течение 21 ч, на этот момент менее 5% площади рапамицина остается согласно ВЭЖХ анализу. Реакционную смесь охлаждают до температуры окружающей среды и затем добавляют пиридин (1,0 мл) для остановки реакции, которую перемешивают в течение еще 30 мин. Реакционную смесь фильтруют и разбавляют изопропилацетатом. Органический раствор промывают 1M раствором лимонной кислоты, 10% раствором бикарбоната натрия, затем водой, сушат (MgSO4) и концентрируют в вакууме. Реакционную смесь делят на две порции, одну из которых очищают флэш-хроматографией на колонке (0-100% этилацетат в гептане)с получением желтого масла около 5,7 г.
Стадия (b)
Пиридин (12,2 г, 154,4 ммоль) охлаждают до 0°C и затем 65%раствор HF*Пиридина (5,5 г) добавляют по каплям в течение 30 минут. Полученный раствор затем нагревают до температуры окружающей среды, и затем защищенное силилом производное эверолимуса (5,7 г) добавляют по каплям в виде раствора в ТГФ (120 мл). Желтый раствор нагревают до 40°C в течение 2 ч и затем охлаждают до температуры окружающей среды и разбавляют изопропилацетатом (150 г). Реакционную смесь затем добавляют медленно к 8% водному раствору бикарбоната натрия (500 г) и затем разбавляют изопропилацетатом (250 г). Органическую фазу затем отделяют и промывают насыщенным водным раствором хлорида натрия, сушат (MgSO4) и концентрируют в вакууме. Остаток разбавляют изопропилацетатом, добавляют бутилгидрокситолуол (БГТ; 0,2% м/м), и выход эверолимуса определяют ВЭЖХ анализом против внешнего стандарта (3,14 г, 60,0% из рапамицина). Этот продукт затем перекристаллизовывают из этилацетата/гептана с получением эверолимуса высокой чистоты (2,05 г, 65%).
Пример 6 (Тритильная защитная группа)
Стадия (a)
К раствору 2-(тритилокси)этанола (10,7 г, 35,2 ммоль) в толуоле (42,8 г) добавляют N,N-диизопропилпентан-3-амин (7,0 г, 40,4 ммоль). Прозрачный раствор затем охлаждают до 0°C и ангидрид трифторметансульфоновой кислоты (10,0 г, 35,2 ммоль) добавляют по каплям так, чтобы температура оставалась на уровне (-2°C-2°C).
Через 2 ч N,N-диизопропилпентан-3-амин (7,0 г, 40,4 ммоль) добавляют к реакционной смеси, затем толуол (14,4 г) и рапамицин (8,24 г, 8,79 ммоль), промывая толуолом (2,4 г). Реакционную смесь затем нагревают до 40°C и перемешивают при этой температуре в течение 21 ч, на этот момент менее 5% площади рапамицина остается согласно ВЭЖХ анализу. Реакционную смесь охлаждают до температуры окружающей среды и затем добавляют пиридин (0,8 мл) для остановки реакции, которую перемешивают в течение еще 30 мин. Реакционную смесь фильтруют и разбавляют изопропилацетатом. Органический раствор промывают 1M раствором лимонной кислоты, 10% раствором бикарбоната натрия, затем водой, сушат (MgSO4) и концентрируют в вакууме. Реакционную смесь очищают с применением флэш-хроматографии на колонке (этилацетат в гептане) с получением желтого масла (6,85 г, 65% выход).
Стадия (b)
Защищенное тритилом производное эверолимуса (5,0 г, 4,165 ммоль) затем растворяют в гексафторизопропаноле и нагревают до 58°C в течение 3,5 ч. Затем реакционную смесь охлаждают до температуры окружающей среды и разбавляют этилацетатом (50 мл) и концентрируют в вакууме. Эту методику разбавления/концентрации повторяют еще один раз и затем неочищенный продукт фильтруют над силикагелем (25 г), элюируя гептаном/этилацетатом. Перекристаллизация из гептана/этилацетата дает желаемый продукт в виде белых кристаллов (1,60 г, 40,1%). ВЭЖХ анализ маточной жидкости против внешнего стандарта показывает в ней содержится еще 12% выход эверолимуса.
Пример 7
Сравнение действия, которое выбор основания оказывает на выход реакции
Стадия 1:
Стадия 2:
Основания:
|
Реакции проводят как описано в спецификации с различными сочетаниями оснований, защитных групп и молярных отношений сульфонат алкилфторалкила (т.е. сложный эфир сульфоната)/рапамицин. Применяемым растворителем всегда является толуол. На стадии 1 получают сульфонат алкилфторалкила. На стадии 2, рапамицин алкилируют для получения защищенного эверолимуса. Столбец “Площадь ВЭЖХ Эверолимус-PG” показывает уровни полученного защищенного эверолимуса. Затем защитную группу отщепляют с получением эверолимуса. Столбец “Выход* неочищенный эверолимус” показывает общий выход реакции. R, R4 и R5 относятся к заместителям в основаниях соединений формулы (4) и (5). Например, если R4=R5=этилом, это означает, что применяемым основанием является N,N-диизопропилпентан-3-амин. Важно отметить, что все реакции дают более 95% превращение (остается менее 5% рапамицина).
Метод ВЭЖХ Площадь % 3: Macherey-Nagel CC 250/4 Nucleosil 120-3 C18 Кат. №: 721666,40, Подвижная фаза: от 80:20 метанол:вода до 100:0 метанол:вода в течение более 35 минут, скорость потока 1 мл/мин, длина волны определения = 275 нм.
* Выход определяют ВЭЖХ анализом против внешнего стандарта чистого Эверолимуса
Определение выхода способом ВЭЖХ: Atlantis-dC18, 3,0 мкм, длина 150 мм, внутренний диаметр 3,0 мм (Waters no. 186001307) или эквивалентная колонке, подвижная фаза реагент ацетата аммония + вода + метанол + ацетонитрил (160+160+320+360) (об./об./об./об.), скорость потока 1,2 мл/мин
Длина волны определения = 278 нм, время прогона = 25 минут.
Результаты показывают, что трис(2-метилпропил)амин дает значительно меньший выход неочищенного Эверолимуса (вход 12, 47%) по сравнению с двумя основаниями, описанными в данном изобретении (вход 9, 65% и вход 10, 61%). Кроме того, применение таких затрудненных оснований, как описано здесь, позволяет применять меньшее количество эквивалентов сульфоната алкилфторалкила (вход 11, 2,5 эквивалента применяемого трифлата). Реакция, описанная во входе 12, с применением трис(2-метилпропил)амина в качестве основания с 4 эквивалентами трифлата была намного медленней при 40°C, чем аналогичная реакция с применением N,N-диизопропилпентан-3-амина, и это происходит по той причине, что реакцию необходимо проводить при 50°C для того, чтобы получить превращение >95%. Для ясности, если реакцию в присутствии трис(2-метилпропил)амина проводят при 40°C, выход, измеренный в те же моменты времени, будет даже ниже по сравнению с выходом, полученным в присутствии оснований, определенных в соответствии с данным изобретением. То же самое наблюдение было сделано относительно N,N-диизопропилэтиламина в качестве основания (вход 13). Для проведения реакции до завершения требуется температура 50°C и всего 6 эквивалентов сульфоната алкилфторалкила. Эта методика также дает продукт с выходом 50%, значительно меньше, чем выход, полученный с применением двух оснований, описанных в соответствии с данным изобретением (входы 9 и 10). Поэтому основания, применяемые в соответствии с данным изобретением, позволяют в способе получить более высокий выход даже при более мягких условиях (т.е. низшей температуре реакции). Кроме того, меньший молярный избыток сульфонатов алкилфторалкила требуется для достижения лучшего выхода.