Результат интеллектуальной деятельности: КОМПОЗИЦИЯ АНТИГЕН-ГКГС-НАНОЧАСТИЦ ДЛЯ ИНДУЦИРОВАНИЯ ПРОТИВОВОСПАЛИТЕЛЬНОГО ОТВЕТА В КИШЕЧНИКЕ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
[0001] В соответствии с 35 U.S.C. § 119(e) в данной заявке испрашивается приоритет предварительной заявки на патент США 61/615743, поданной 26 марта 2012, включенной сюда во всей полноте путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Данное изобретение относится к композициям и способам в области иммунотерапии и медицины. В частности, данное изобретение относится к терапевтическим средствам для лечения воспаления, например, воспаления желудочно-кишечного тракта.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0003] Воспалительными заболеваниями кишечника (ВЗК) обозначают группу нарушений, вызывающих воспаление кишечника (покраснение и отечность). Ежегодно более 600000 американцев страдают той или иной формой воспалительных заболеваний кишечника. Заболевания этой группы зачастую имеют хроническую природу и связаны с такими симптомами как боль в животе, тошнота, диарея, ректальное кровотечение, тяжелые внутренние судороги/мышечные спазмы в области таза и потеря веса. Симптомы, связанные с ВЗК, могут негативно сказываться на качестве жизни и ежедневно доставлять беспокойство тем, кто страдает этим недугом.
[0004] Методы лечения ВЗК в основном включают иммунодепрессанты, которые подавляют общий иммунитет пациента. Такое лечение несет в себе определенный риск и зачастую подвергает пациента угрозе инфицирования и развития заболевания вследствие ослабления иммунитета.
[0005] Таким образом, существует необходимость в таргетной терапии для лечения заболевания без подавления общего иммунитета пациента. В данном описании предложено решение этой проблемы и показаны связанные с ним преимущества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] В данном документе описаны способы лечения и композици, активирующие и усиливающие существующие эндогенные механизмы, направленные на подавление хронического воспалительного ответа. В одном аспекте предложены композиции и способы для лечения воспаления желудочно-кишечного тракта.
[0007] Один аспект относится к способу индукции противовоспалительного ответа в клетке или ткани путем введения эффективного количества комплекса антиген-ГКГС-наночастица; где антиген представлет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Также предложен комплекс антиген-ГКГС-наночастица для индукции противовоспалительного ответа в клетке или ткани, где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Кроме того, предложено применение комплекса антиген-ГКГС-наночастица для изготовления лекарственного препарата, пригодного для индукции противовоспалительного ответа в клетке или ткани, где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген.
[0008] В другом аспекте предложен способ лечения воспаления у нуждающегося в этом пациента путем введения комплекса антиген-ГКГС-наночастица в эффективном количестве; при этом антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Также предложен комплекс антиген-ГКГС-наночастица для лечения воспаления у нуждающегося в этом пациента, где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Кроме того, предложено применение комплекса антиген-ГКГС-наночастица для изготовления лекарственного препарата для лечения воспаления желудочно-кишечного тракта у нуждающегося в этом пациента, где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген.
[0009] В следующем аспекте предложен способ аккумуляции противовоспалительных Т клеток у нуждающегося в этом пациента путем введения комплекса антиген-ГКГС-наночастица в эффективном количестве; где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Также предложен комплекс an антиген-ГКГС-наночастица для применения при аккумуляции противовоспалительных Т клеток у нуждающегося в этом пациента, где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Кроме того, предложено применение комплекса антиген-ГКГС-наночастица в изготовлении лекарственного препарата, пригодного для аккумуляции противовоспалительных Т клеток у нуждающегося в этом пациента, где антиген представляет собой антиген, происходящий из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген.
[0010] Другие аспекты относятся к комплексу, содержащему, по существу состоящему или также состоящему из наночастицы, белка ГКГС и антигена, происходящего из микроорганизма, заселяющего или инфицирующего желудочно-кишечный тракт или представляющего собой ЖКТ-ассоциированный антиген. Также предложены композиции, содержащие, по существу состоящие или также состоящие из описанного здесь комплекса антиген-ГКГС-наночастица и носителя.
[0011] Кроме того, предложен набор, содержащий или в альтернативном случае по существу состоящий или также состоящий из композиции, описанной в данном документе, и инструкции для применения композиций для целевого назначения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0012] Следующие рисунки являются частью данного описания и включены для наглядного представления некоторых аспектов данного изобретения. Ссылки на графические материалы в сочетании с подробным описанием воплощений, представленным в данном документе, дают возможность лучше понять изобретение.
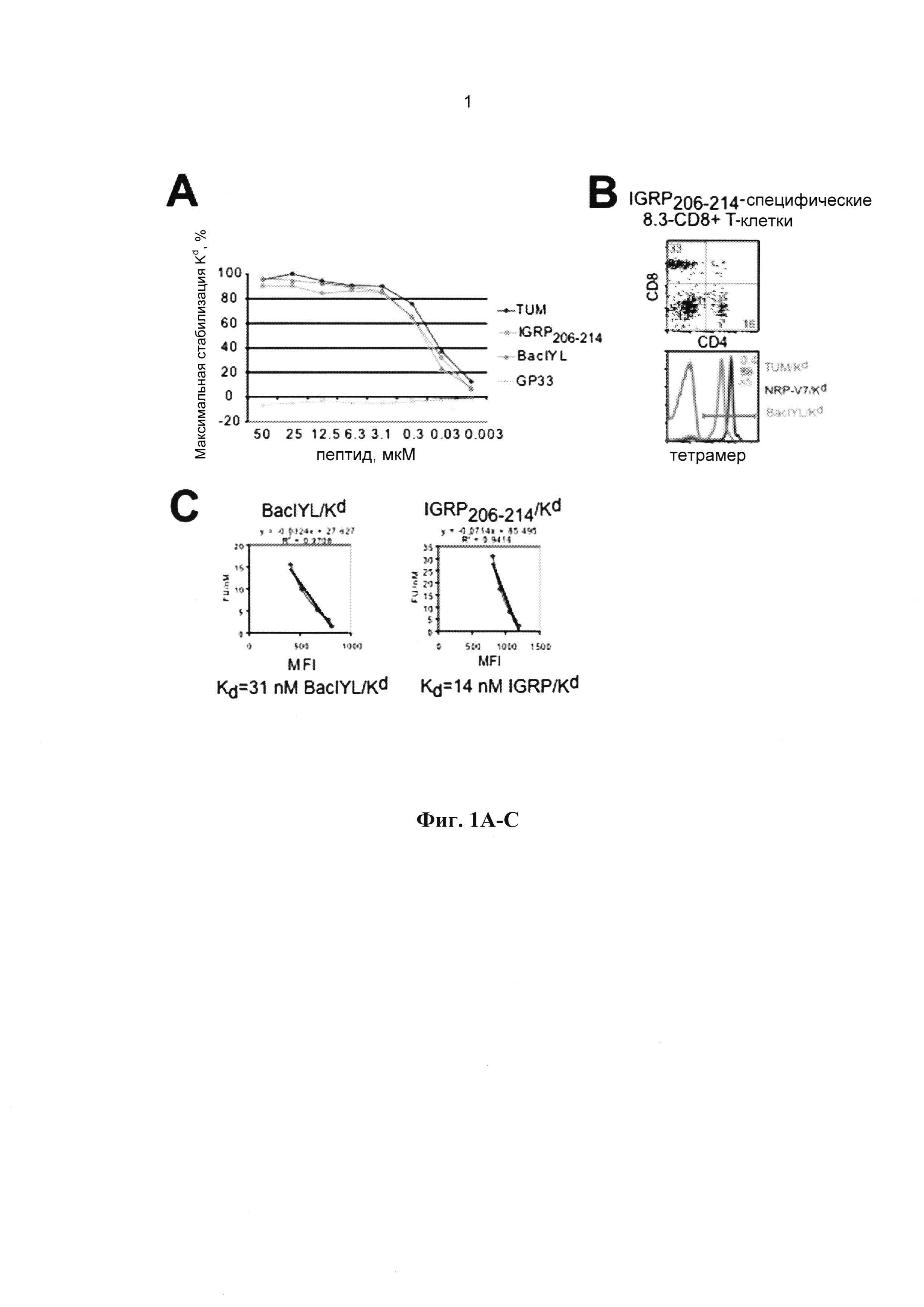
[0013] На Фиг. 1А-1С показано высокоаффинное связывание BaclYL с H-2Kd и связывание полученного комплекса пГКГС с IGRP206-214-специфическими Т-клетками. А, Пептид-индуцированная стабилизация молекул Kd на клетках RMA-SKd. TUM является положительным контролем, а Gp33 отрицательным контролем (связывающим Db). В и С, тетрамеры BaclYL/Kd специфически связываются с 8.3-CD8+ Т-клетками, хотя и с более низкой авидностью по сравнению с тетрамерами NRP-V7/Kd.
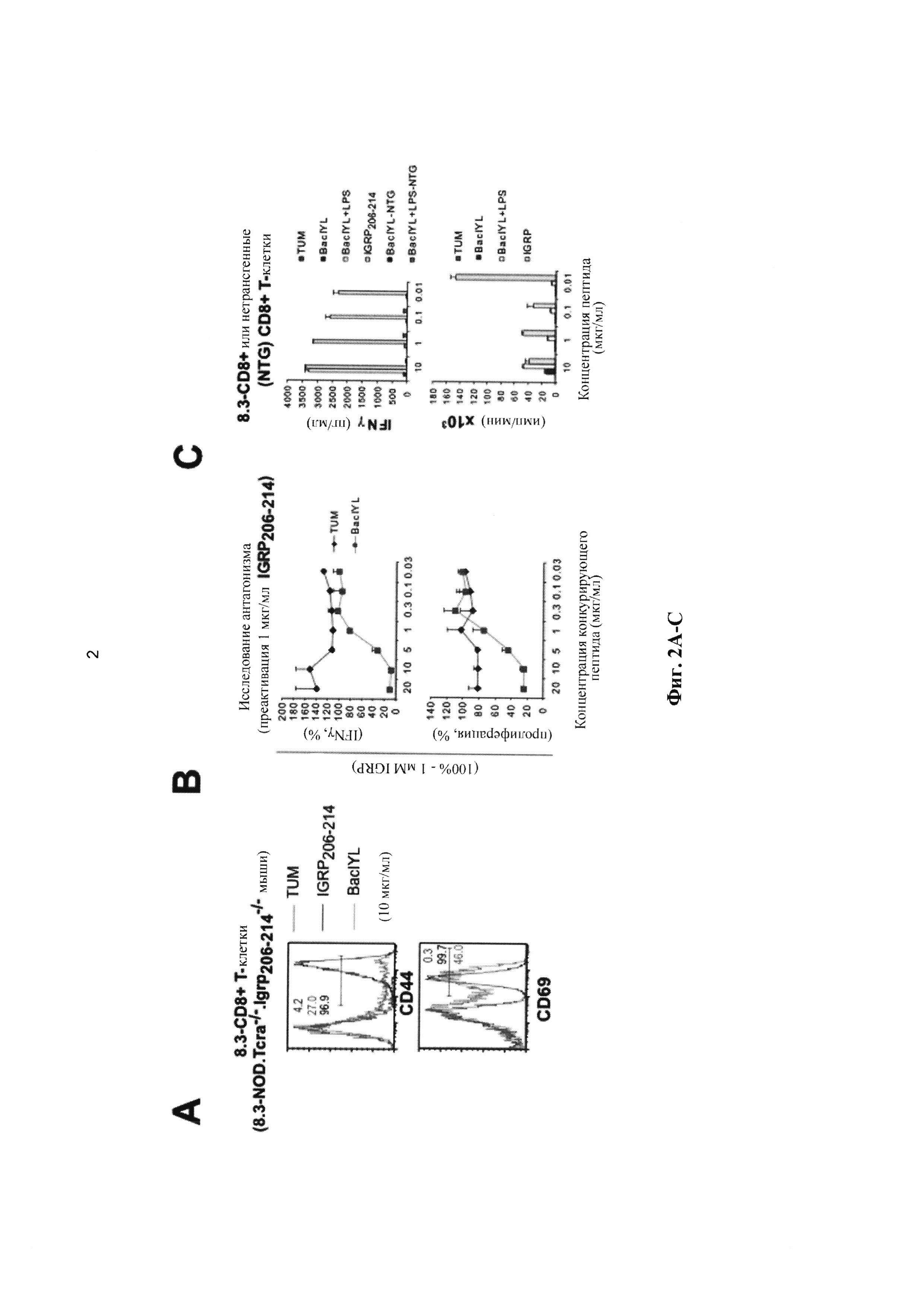
[0014] На Фиг. 2A-2D показано, что BaclYL в изолированном виде является антагонистом, но в присутствии липополисахарида (LPS, от англ. lipopolysaccharide) является частичным агонистом, а дендритные клетки эффективно кросс-презентируют его белок-донор. А, экспрессия CD44 и CD69 в 8.3-CD8+ Т-клетках, культивируемых в присутствии BaclYL, IGRP206-214 (положительный контроль) или TUM (отрицательный контроль). В, исследование антагонизма. TUM служит отрицательным контролем. Увеличение концентраций BaclYL (но не TUM, отрицательного контроля, связывающегося с Kd) противодействует IGRP206-214-индуцированному ответу 8.3-CD8+ Т-клеток (секреции интерферона-гамма (IFNg, от англ. interferon gamma), вверху, и пролиферации, внизу). С, BaclYL является агонистом в присутствии LPS. NTG, не-трансгенные (CD8+ Т-клетки). D, дендритные клетки способны к отщеплению (процессингу) BaclYL или BACIGRP206-214-подобных эпитопов от рекомбинантной интегразы дикого типа или рекомбинантной мутантной интегразы (где эпитоп BaclYL вследствие мутации кодирует IGRP206-214).
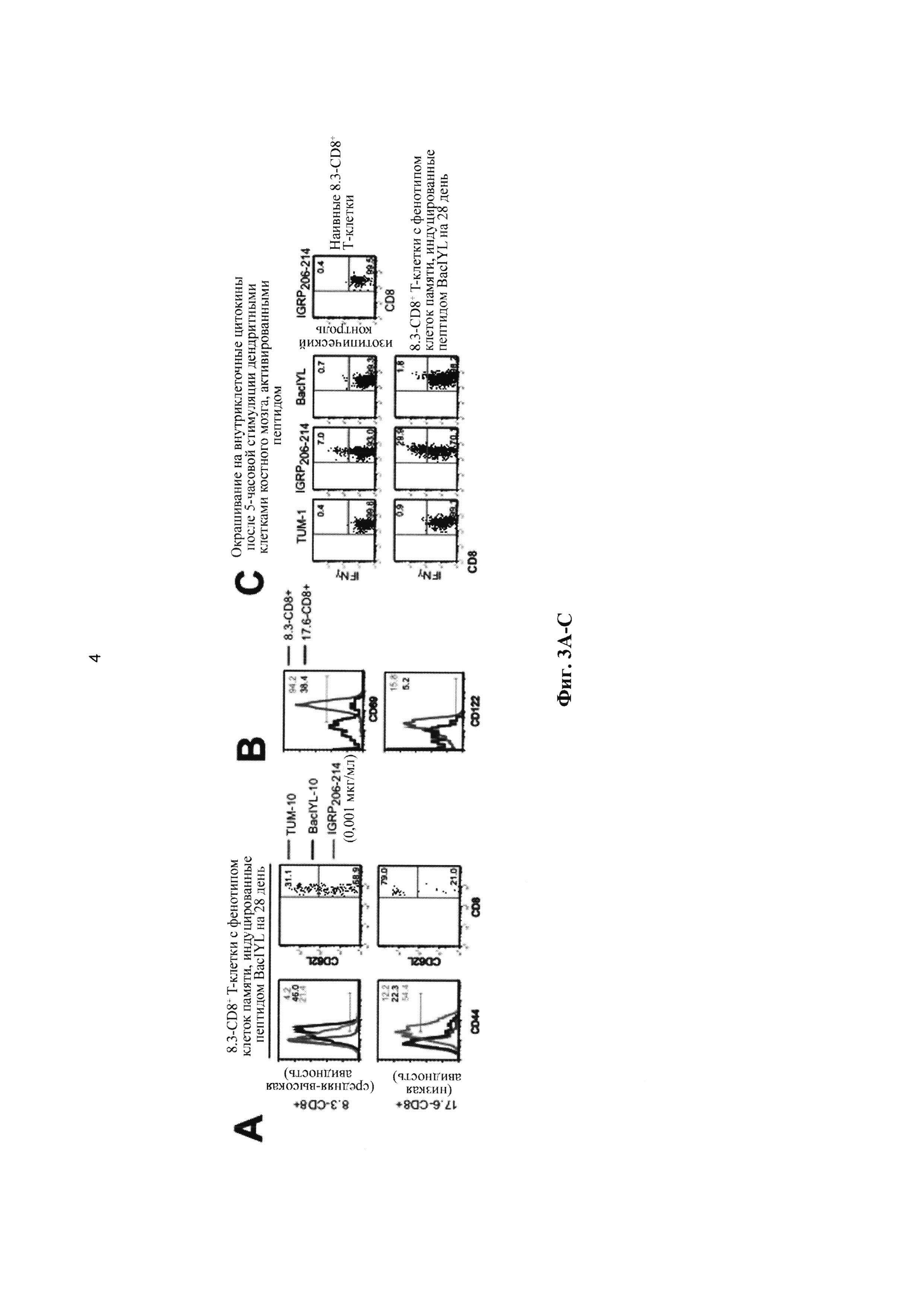
[0015] На Фиг. 3A-3D показано, что пептид BaclYL индуцирует образование CD8+ Т-клеток памяти in vitro. А и В, фенотип 8.3-CD8+ Т-клеток на 28 день культивирования в присутствии дендритных клеток, активированных пептидом (10 или 0,001 мкг/мл). 17.6-CD8+ Т-клетки представляют собой IGRP206-214-специфические CD8+ Т-клетки с очень низкой авидностью; как и следовало ожидать, они остаются наивными после 28 дней культивирования с BaclYL. С, внутриклеточное содержание IFNγ в ответ на стимуляцию пептидом. Культивируемые в присутствии BaclYL 8.3-CD8+ Т-клетки быстро вырабатывают IFNγ в ответ на стимуляцию IGRP206-214. D, секреция IFNγ и пролиферация 8.3-CD8+ Т-клеток, подобных клеткам памяти (после индукции BaclYL) в ответ на стимуляцию пептидом.
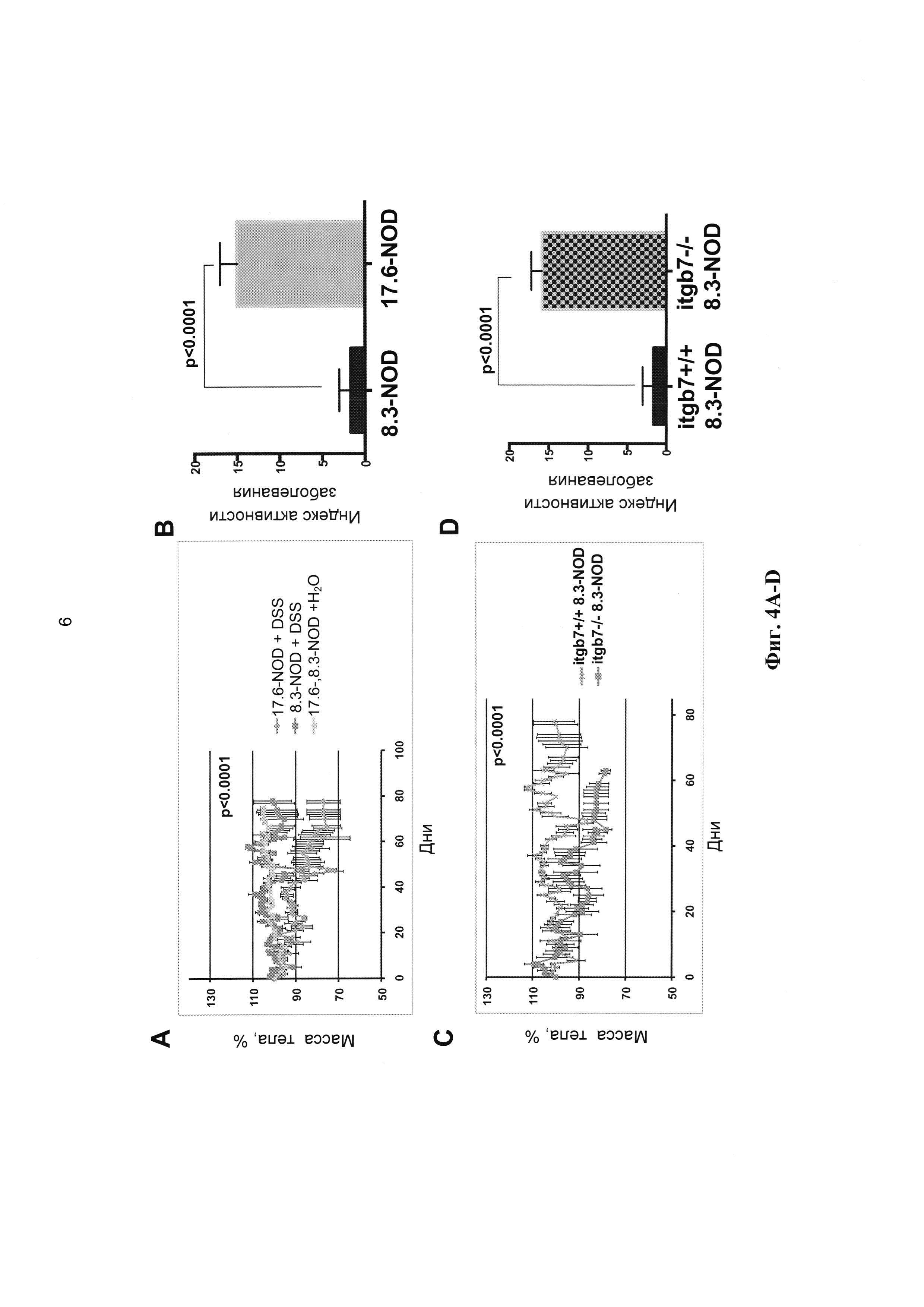
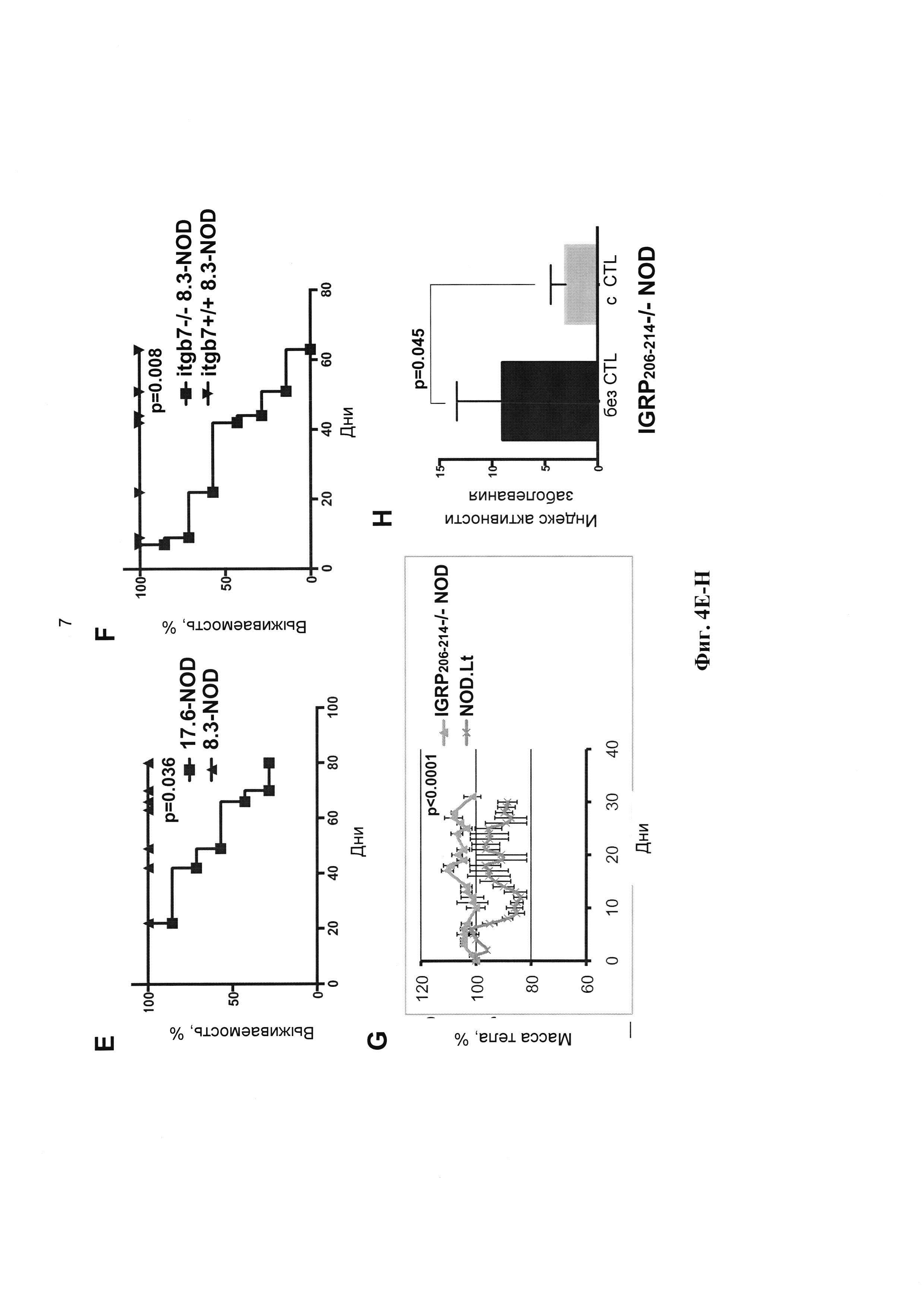
[0016] На Фиг. 4А-4Н показано, что ответ CD8+ Т-клеток, способных реагировать на BaclYL36-44, обеспечивает защиту при DSS-индуцированном колите. На Фиг. А и В приведены кривые массы тела (А) и индекс активности заболевания (В) у мышей 8.3-NOD, 17.6-NOD, получавших DSS, по сравнению с мышами, не получавшими его. На Фиг. С и D приведены кривые массы тела (С) и индекс активности заболевания (D) мышей 8.3-NOD и мышей Itgβ7-/- 8.3-NOD, получавших DSS. На Фиг. Е и F приведены кривые выживаемости мышей, изучавшихся на A-D. На Фиг. G показано, что мыши IGRP206-214-/- NOD, в отличие от мышей NOD, резистентны к потере веса при индукции колита 4% DSS. На Фиг. Н показано, что адоптивный перенос CD8+ CTL, способных перекрестно реагировать с BaclYL36-44, мышам IGRP206-214-/- NOD вызывает достоверное снижение индекса активности заболевания по сравнению с их сородичами, которым не проводили трансфузию CTL.
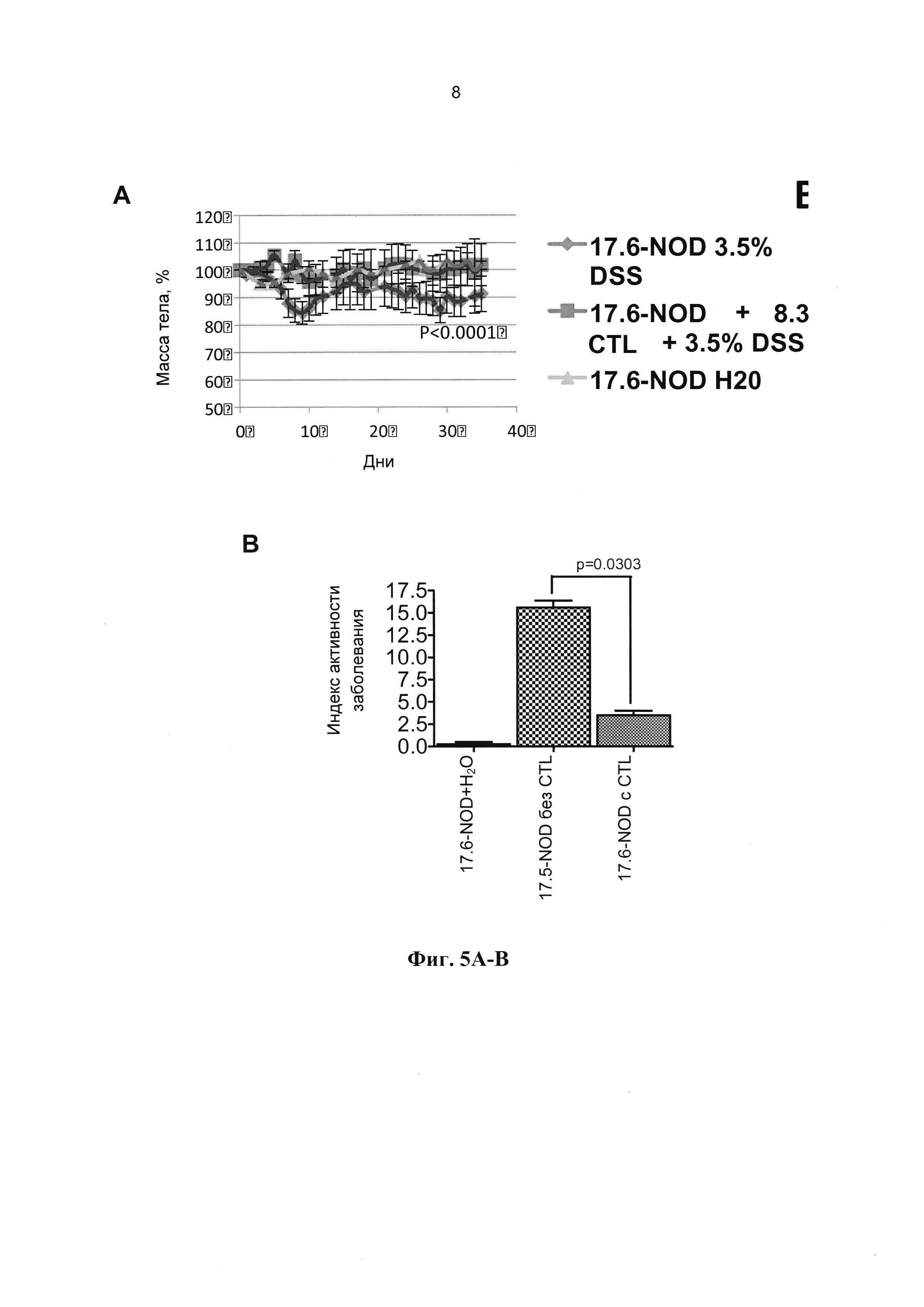
[0017] На Фиг. 5А-5В показано, что BaclYL36-44-реактивные CD8+ CTL защищают мышей 17.6-NOD от DSS-индуцированного колита. На Фиг. 5А приведены кривые массы тела, а на Фиг. 5В показан индекс активности заболевания у мышей 17.6-NOD в ответ на DSS и перенос 8.3-CTL по сравнению с воздействием DSS в отдельности и с отсутствием воздействия. Адоптивный перенос CD8+ CTL, способных перекрестно реагировать с BaclYL36-44, мышам 17.6- NOD достоверно снижает индекс активности заболевания и сокращает потерю веса в ответ на DSS по сравнению с их сородичами, которым не проводили трансфузию CTL.
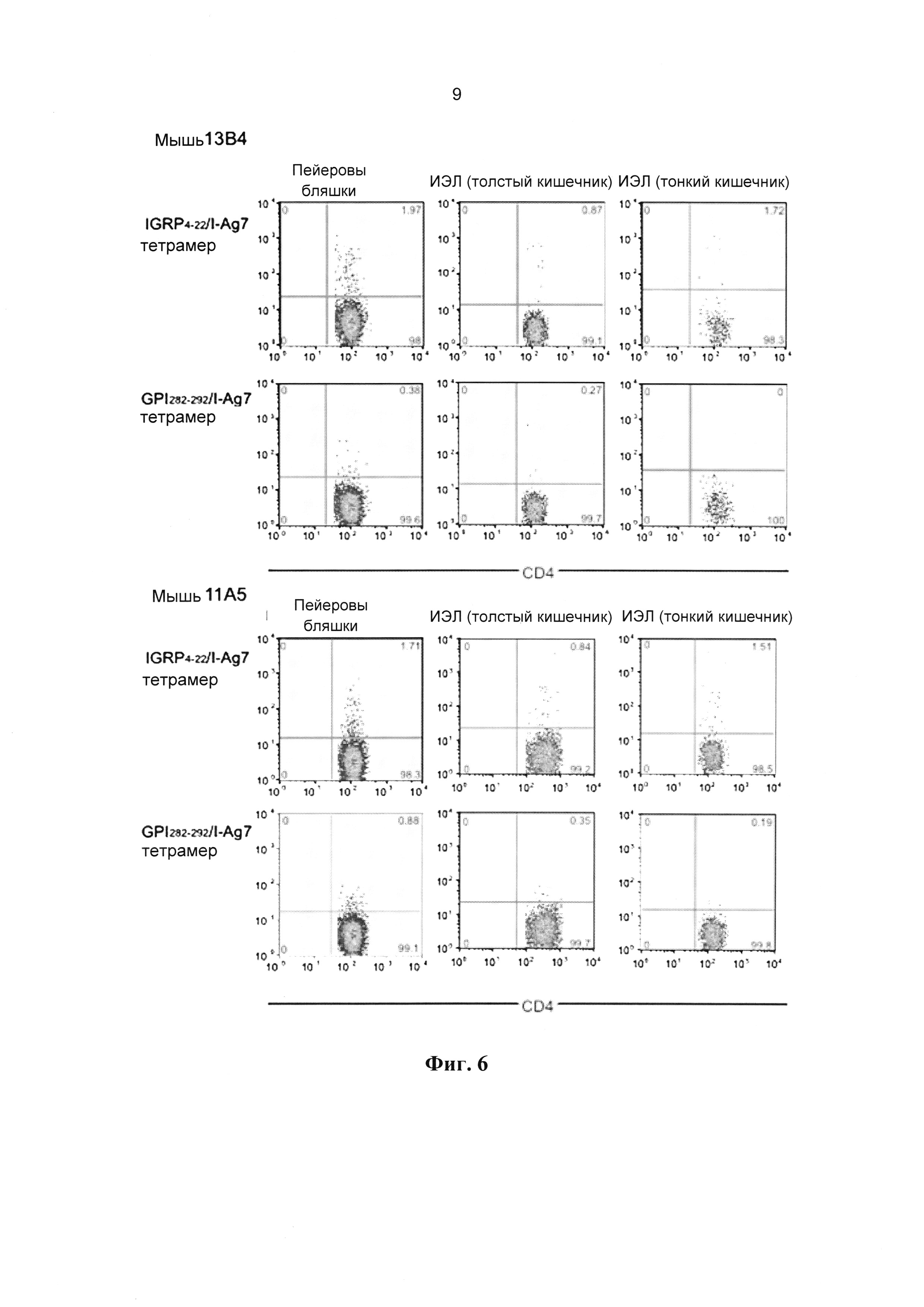
[0018] На Фиг. 6 показана мобилизация Tr1-подобных ауторегуляторных CD4+ Т-клеток в кишечно-ассоциированной лимфоидной ткани мышей NOD, получавших IGRP4-22/I-Ag7-НЧ. Приведены данные для двух мышей.
[0019] На Фиг. 7 приведена карта Baclnt40-54-I-Ab-C-Jun в составе рМТ/V5. ДНК конструкция, помещенная между сайтами рестрикции Nco I (854) и Xho I (1738) кодирует химерный белок HA-Baclnt40-54-I-Abeta (b)-C-Jun (293 а.к). Химерный белок содержит лидерную последовательность гемагглютинина (НА, от англ. hemagglutinin) длиной 15 а.к., за которой следует пептид Baclnt40-54 (TNV) (15 а.к.). Последовательность ДНК, кодирующая пептид, соединена с I-Abeta (b) (199 а.к.) при помощи GS линкера длиной 16 а.к. С-конец I-Abeta (b) соединен с последовательностью C-Jun (40 а.к.) при помощи GS линкера длиной 8 а.к. а.к. = аминокислота.
[0020] На Фиг. 8 показана аминокислотная последовательность и последовательность ДНК конструкции Baclnt40-54-I-Abeta (b)-C-Jun. Последовательности отдельных компонентов в составе химерного белка представлены лидерной последовательностью НА (подчеркнута), за которой следует последовательность пептида Baclnt40-54 (двойное подчеркивание), I-Abeta (b) (пунктирное подчеркивание) и последовательность C-Jun. GS линкер не выделен.
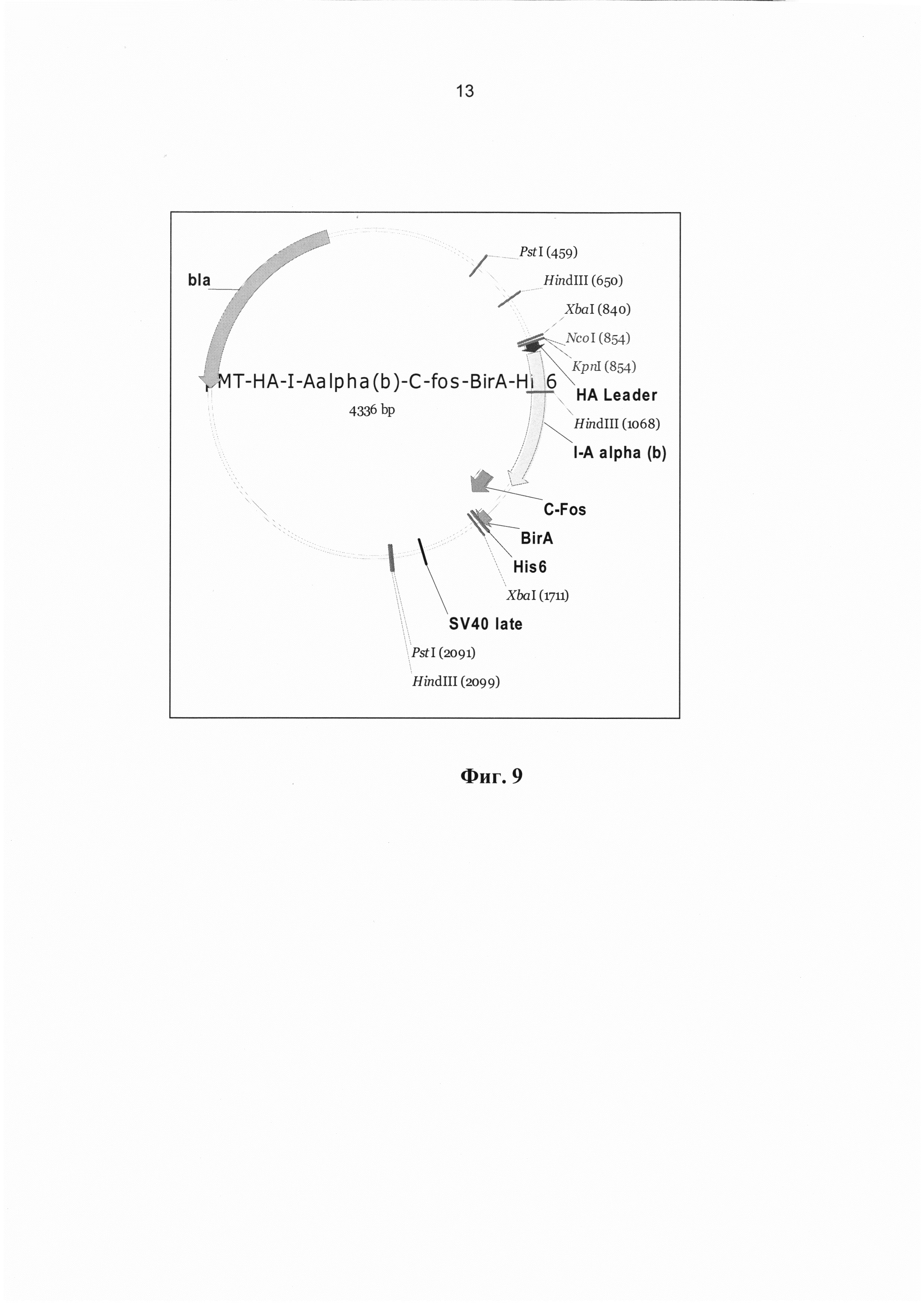
[0021] На Фиг. 9 показана карта I-Aalpha (b)-C-Fos-BirA-His6 в составе рМТ/V5. ДНК конструкцию, кодирующую химерный белок, представляющий собой НА лидер- I-Aalpha (b)-C-Fos-BirA-His X 6 (284 а.к.) клонировали в состав вектора рМТ/V5, обеспечивающего экспрессию в клетках дрозофилы, между сайтами Nco I (854) и Xba I (1711). В составе химерного белка находится I-Aalpha (d) (195 а.к.), за которым следует последовательность C-Fos, присоединенная при помощи GS линкера (6 а.к.) и последовательности BirA и 6 X His.
[0022] На Фиг. 10 показана аминокислотная последовательность и последовательность ДНК конструкции I-Aalpha (b)-C-Fos. Последовательности отдельных компонентов в составе химерного белка представлены лидерной последовательностью НА (подчеркнута), за которой следуют последовательности I-Aalpha (b) (двойное подчеркивание), C-Fos (пунктирное подчеркивание), BirA (заштрихована) и 6 X His. GS линкеры не выделены.
[0023] На Фиг. 11 показана карта Baclnt81-95-I-Ab-C-Jun в составе рМТ/V5. ДНК конструкция, расположенная между сайтами Nco I (854) и Xho I (1738), кодирует химерный белок HA-Baclnt81-95-I-Abeta (b)-C-Jun (293 а.к). Химерный белок включает лидерную последовательность НА длиной 15 а.к., за которой следует последовательность пептида Beclnt81-95 (LGY) (15 а.к.). Последовательность ДНК, кодирующая пептид, соединена с I-Abeta (b) (199 а.к.) при помощи GS линкера длиной 16 а.к.. С-конец I-Abeta (b) соединен с последовательностью C-Jun (40 а.к.) при помощи GS линкера длиной 8 а.к..
[0024] На Фиг. 12 показаны аминокислотная последовательность и последовательность ДНК конструкции Baclnt81-95-I-Abeta (b)-C-Jun. Последовательности отдельных компонентов в составе химерного белка представлены лидерной последовательностью НА (подчеркнута) за которой следуют последовательности пептида Baclnt81-95 (двойное подчеркивание), I-Abeta (b) (пунктирное подчеркивание) и C-Jun (заштрихована). GS линкеры не выделены.
[0025] На Фиг. 13 показана карта Baclnt365-379-I-Ab-C-Jun в составе рМТ/V5. ДНК конструкция, расположенная между сайтами Nco I (854) и Xho I (1738) кодирует химерный белок HA-Baclnt365-379-I-Abeta (b)-C-Jun (293 а.к.). Химерный белок включает лидерную последовательность НА длиной 15 а.к., за которой следует последовательность пептида Baclnt365-379 (TQI) (15 а.к.). Последовательность ДНК, кодирующая пептид, соединена с I-Abeta (b) (199 а.к.) при помощи GS линкера длиной 16 а.к. С-конец I-Abeta (b) соединен с последовательностью C-Jun (40 а.к.) при помощи GS линкера длиной 8 а.к.
[0026] На Фиг. 14 показана аминокислотная последовательность и последовательность ДНК конструкции Baclnt365-379-I-Abeta (b)-C-Jun. Последовательности отдельных компонентов в составе химерного белка представлены лидерной последовательностью НА (подчеркнута), за которой следуют последовательности пептида Baclnt365-379 (двойное подчеркивание), I-Abeta (b) (пунктирное подчеркивание) и C-Jun (заштрихована). GS линкеры не выделены.
[0027] На Фиг. 15 показана карта Baclnt57-71-I-Ab-C-Jun в составе рМТ/V5. ДНК конструкция, расположенная между сайтами Nco I (854) и Xho I (1738) кодирует химерный белок HA-Baclnt57-71-I-Abeta (b)-C-Jun (293 а.к). Химерный белок включает лидерную последовательность НА длиной 15 а.к., за которой следует последовательность пептида Baclnt57-71 (INH) (15 а.к.). Последовательность ДНК, кодирующая пептид, соединена с I-Abeta (b) (199 а.к.) при помощи GS линкера длиной 16 а.к. С-конец I-Abeta (b) соединен с последовательностью C-Jun (40 а.к.) при помощи GS линкера длиной 8 а.к.
[0028] На Фиг. 16 показана аминокислотная последовательность и последовательность ДНК конструкции Baclnt57-71-I-Abeta (b)-C-Jun. Последовательности отдельных компонентов в составе химерного белка выделены следующим образом: лидерная последовательность НА (подчеркнута) за которой следуют последовательности пептида Baclnt57-71 (двойное подчеркивание), I-Abeta (b) (пунктирное подчеркивание) и C-Jun (заштрихована). GS линкеры не выделены.
[0029] На Фиг. 17 показана карта Baclnt88-102-I-Ab-C-Jun в составе рМТ/V5. ДНК конструкция, расположенная между сайтами Nco I (854) и Xho I (1738) кодирует химерный белок HA-Baclnt88-102-I-Abeta (b)-C-Jun (293 а.к). Химерный белок включает лидерную последовательность НА длиной 15 а.к., за которой следует последовательность пептида Baclnt88-102 (IPA) (15 а.к.). Последовательность ДНК, кодирующая пептид, соединена с I-Abeta (b) (199 а.к.) при помощи GS линкера длиной 16 а.к. С-конец I-Abeta (b) соединен с последовательностью C-Jun (40 а.к.) при помощи GS линкера длиной 8 а.к.
[0030] На Фиг. 18 показана аминокислотная последовательность и последовательность ДНК конструкции Baclnt88-102-I-Abeta (b)-C-Jun. Последовательности отдельных компонентов в составе химерного белка выделены следующим образом: лидерная последовательность НА (подчеркнута), за которой следуют последовательности пептида Baclnt88-102 (двойное подчеркивание), I-Abeta (b) (пунктирное подчеркивание) и C-Jun (заштрихована). GS линкеры не выделены.
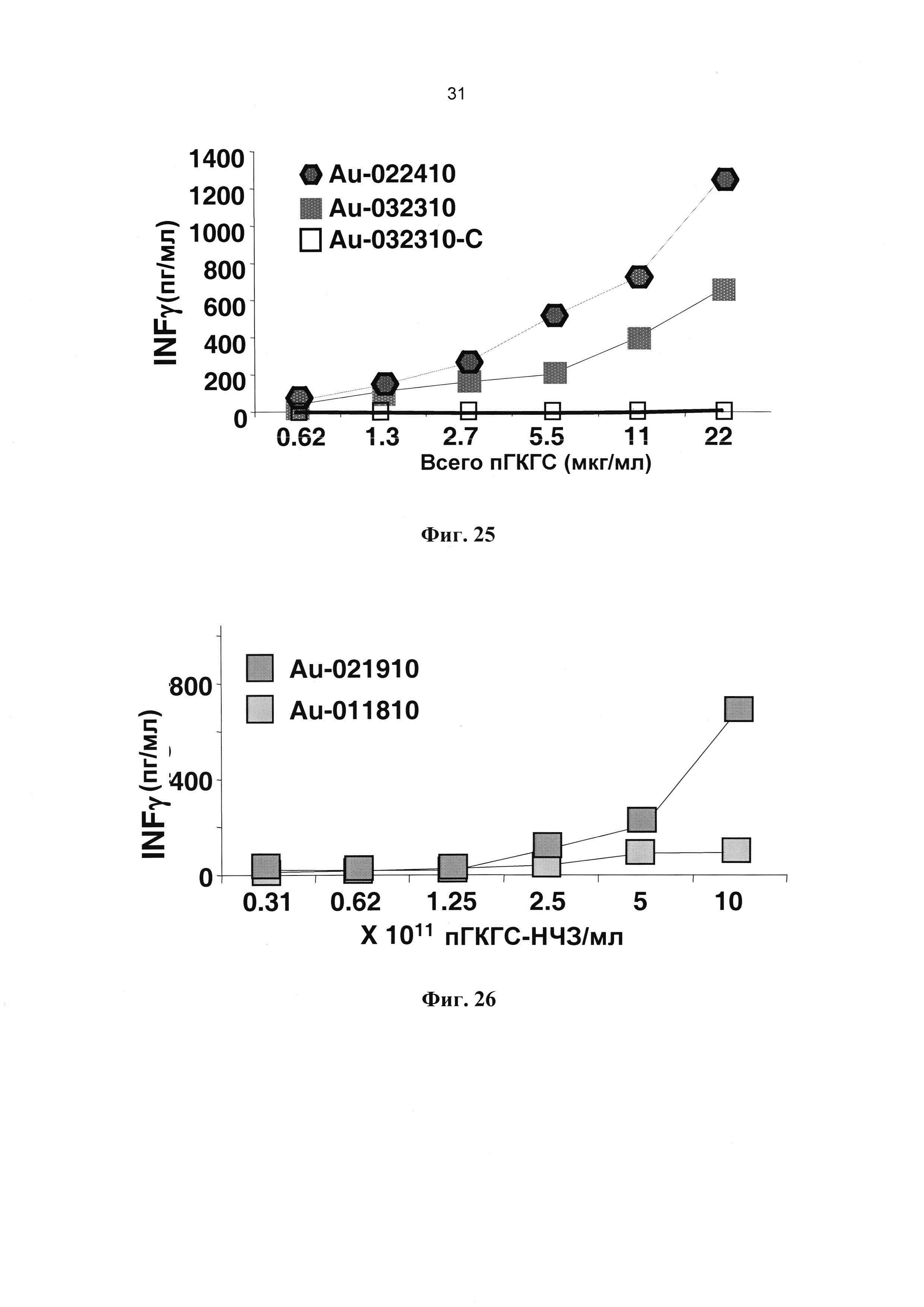
[0031] На Фиг. 19 показаны полученные при помощи просвечивающей электронной микроскопии репрезентативные изображения монодиспергированных покрытых пГКГС наночастиц золота (~14 нм) в высокой концентрации (~5×1013/мл). Увеличение: 50.000Х.
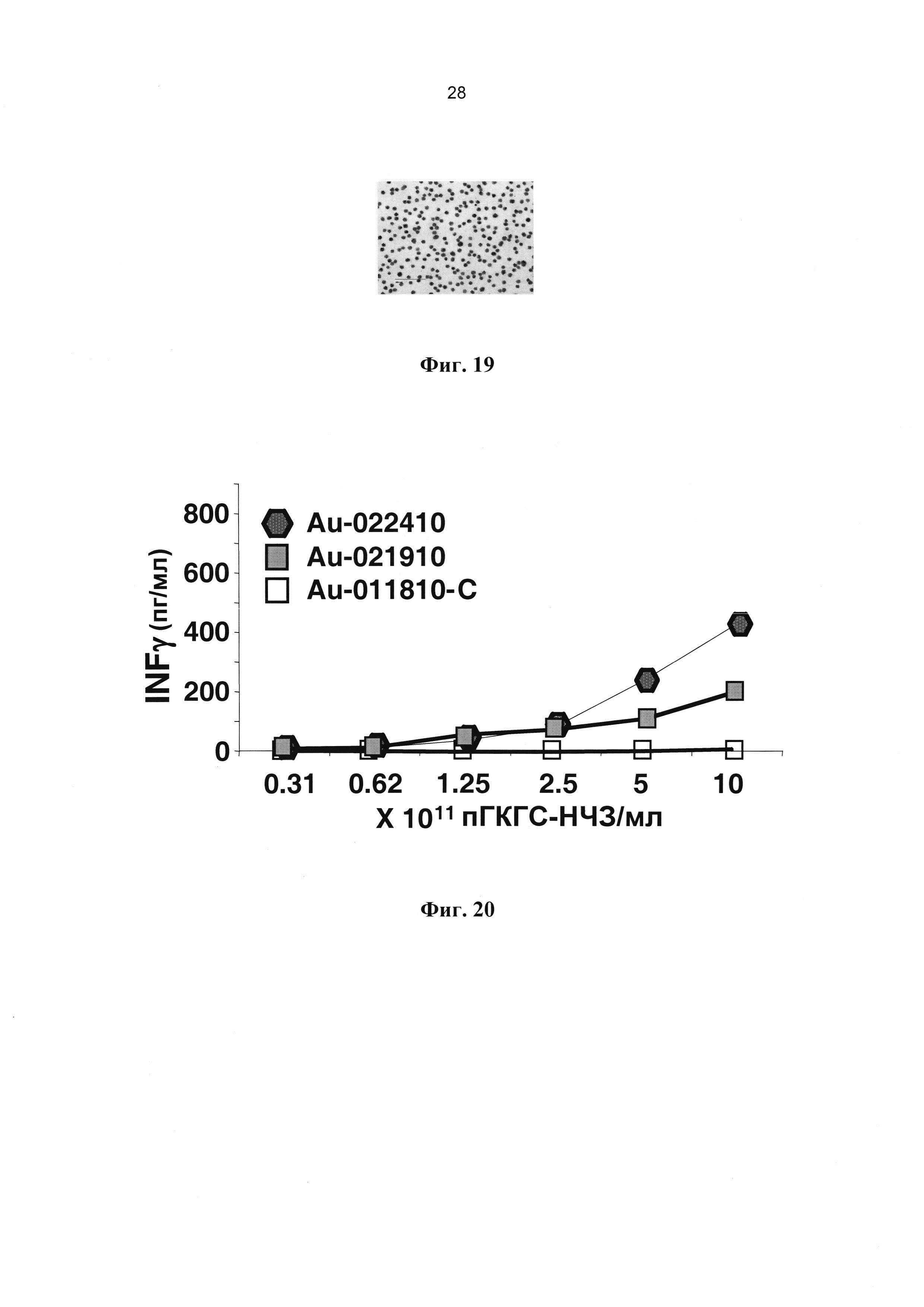
[0032] На Фиг. 20 показано влияние концентрации пГКГС (НЧ3) и валентности НЧ по пГКГС на агонистические свойства покрытых пГКГС наночастиц золота. Сравнивается количество IFNγ, секретируемого в ответ на два различных образца пГКГС-НЧ3 (оба содержат приблизительно 2×1013 наночастиц золота диаметром 14 нм/мл) распознающими их 8.3-CD8+ Т-клетками. Au-022410 и Au-21910 несут приблизительно по 250 и 120 пГКГС на наночастицу золота, соответственно. Au-011810-С несут приблизительно по 120 контрольных пГКГС на НЧ3.
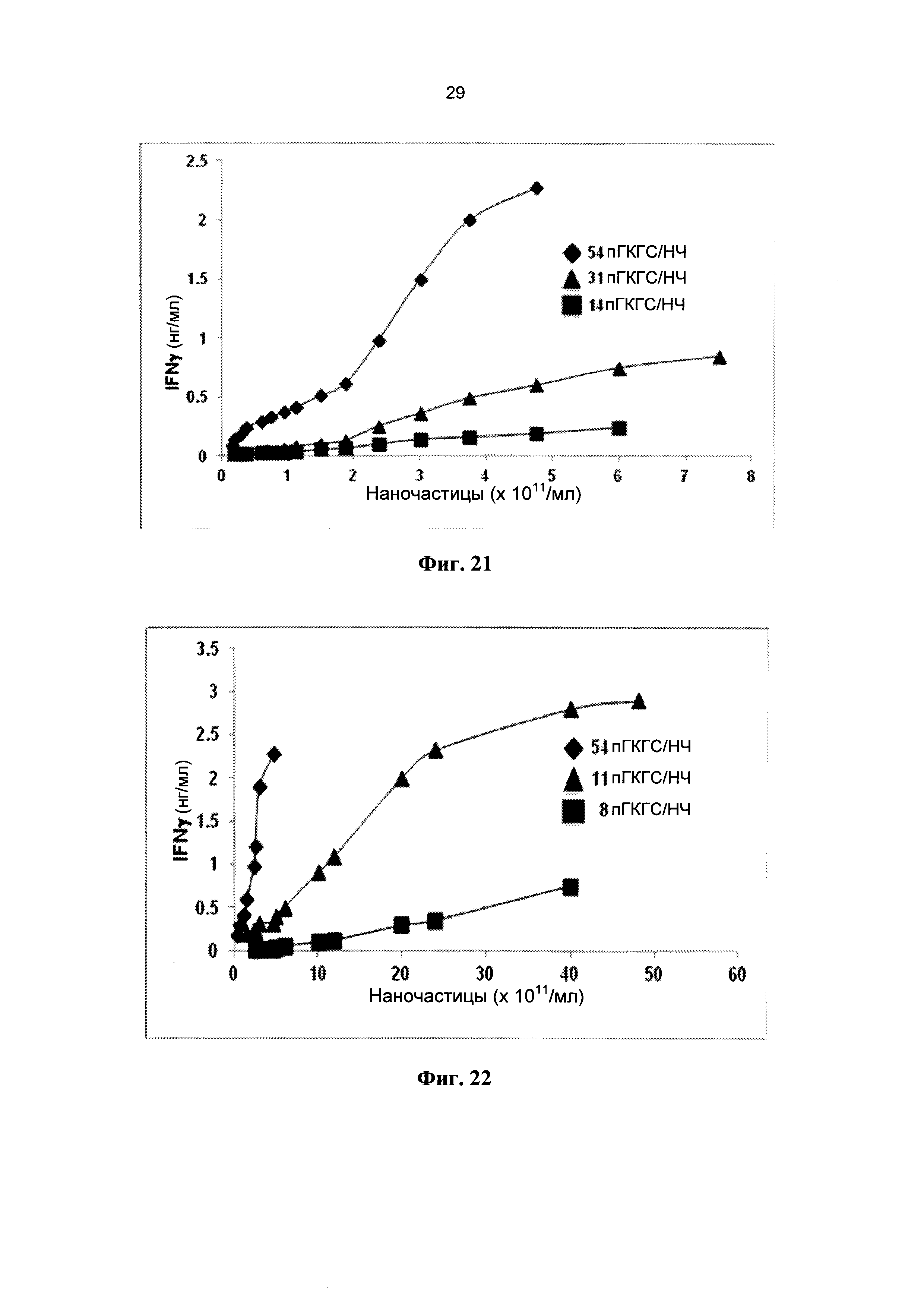
[0033] На Фиг. 21 показана секреция IFNγ 8.3-CD8+ Т клетками, индуцированная пГКГС-НЧ, в зависимости от валентности НЧ по пГКГС. 8.3-CD8+ Т-клетки (2,5×105 клеток/мл) культивировали с возрастающим количеством наночастиц, покрытых IGRP206-214/Kd с тремя различными валентностями.
[0034] На Фиг. 22 показано, что более низкая агонистическая активность пГКГС-НЧ может быть компенсирована увеличением концентрации пГКГС-НЧ, но только в том случае, если валентность НЧ по пГКГС превышает определенное пороговое значение. Сравнивается агонистическая активность трех различных препаратов пГКГС-НЧ (с тремя различными валентностями) в диапазоне концентраций наночастиц. Наночастицы, несущие по 8 пГКГС, в отличие от тех, что несут по 11 пГКГС, не способны запускать адекватную секрецию IFNγ даже при высоких концентрациях пГКГС-НЧ, в отличие от наночастиц, несущих по 54 пГКГС.
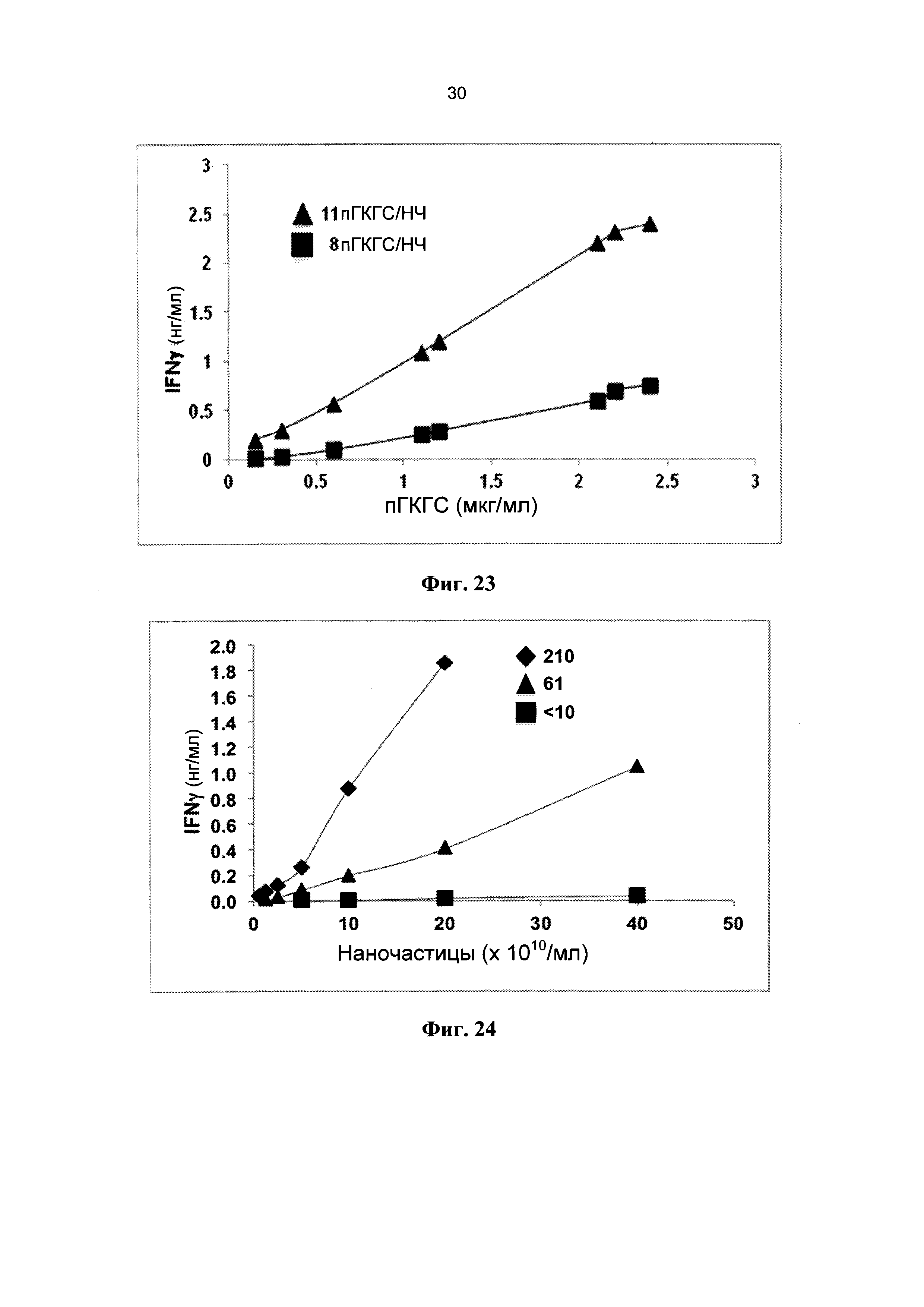
[0035] На Фиг. 23 показано влияние порогового значения валентности НЧ по пГКГС на агонистические свойства пГКГС-НЧ в зависимости от общего количества вводимых пГКГС.
[0036] На Фиг. 24 показано влияние валентности НЧ по пГКГС на агонистическую активность пГКГС-НЧ, полученных с наночастицами оксида железа большего размера.
[0037] На Фиг. 25 показано влияние размера наночастиц на агонистическую активность. Au-0224-15 представляли собой покрытые пГКГС наночастицы золота размером 14 нм с относительно низкой валентностью, но находящиеся в большей концентрации; Au-0323-40 представляли собой покрытые пГКГС наночастицы золота размером 40 нм с высокой валентностью, но находящиеся в низкой концентрации. Au-0224-15 обладали более выраженной агонистической активностью по сравнению с образцом Au-0323-40.
[0038] На Фиг. 26 показано влияние защитных молекул ПЭГ на свойства пГКГС-НЧ3. Au-021910 представляли собой наночастицы золота диаметром 14 нм в концентрации ~2×1013/мл, защищенные 2 кДа тиол-ПЭГ и несущие приблизительно по 120 пГКГС на НЧ3. Наночастицы Au-012810 (также с диаметром 14 нм и концентрацией ~2×1013/мл) были защищены 5 кДа тиол-ПЭГ и несли приблизительно по 175 пГКГС на НЧ3. Образец Au-021910 обладал более выраженной агонистической активностью.
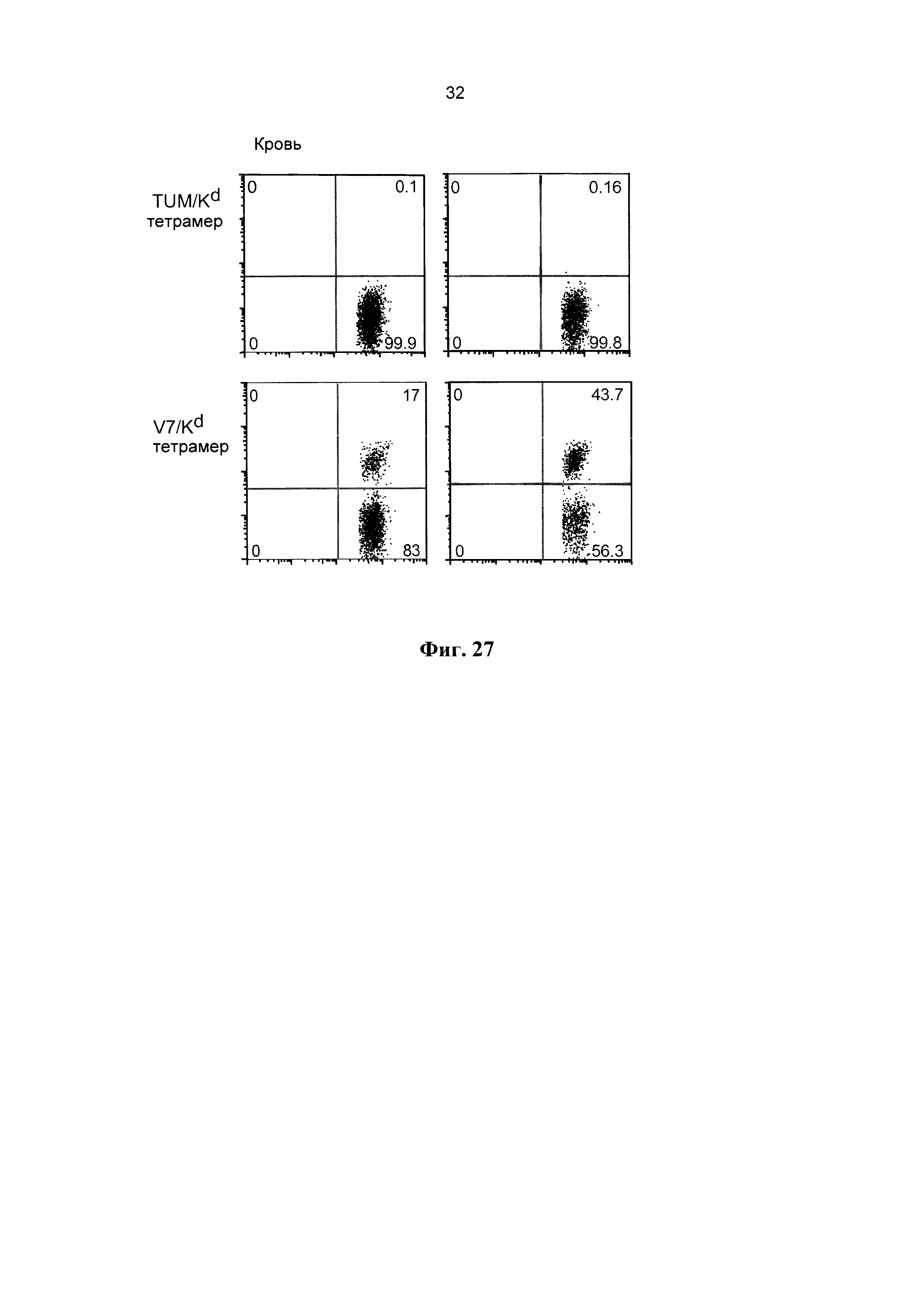
[0039] Фиг. 27 демонстрирует эффективное увеличение популяции NRP-V7-реактивных CD8+ Т-клеток в присутствии наночастиц золота, покрытых NRP-V7/Kd. Использовали 3×1012 наночастиц (размером ~10 нм), несущих 25 мкг пГКГС (по 150 пГКГС/наночастицу). Мыши NOD с преддиабетом в возрасте 10 недель получали еженедельно две инъекции в неделю наночастиц золота, покрытых NRP-V7/kd, в течение 5 недель. Тетрамер TUM/Kd служил отрицательным контролем. Каждая вертикальная панель соответствует разным мышам.
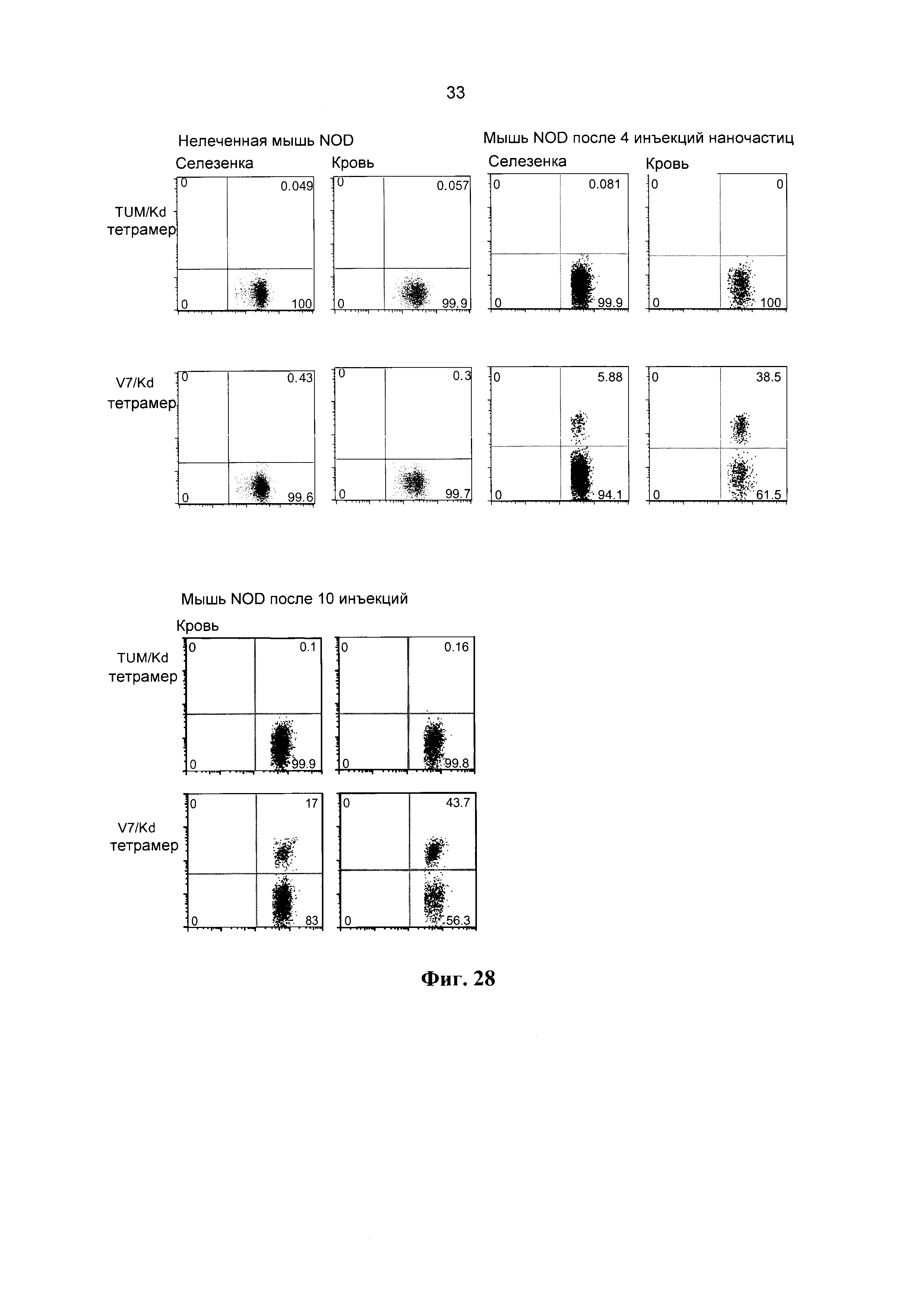
[0040] Фиг. 28 демонстрирует у мышей выраженное увеличение численности CD8+ Т-клеток, распознающих наночастицы золота, покрытые пГКГС. Использовали 3×1012 IGRP206-214/Kd-НЧ (размером ~10 нм), несущих 25 мкг пГКГС (по 150 пГКГС/наночастицу). Верхняя панель: данные для мыши, подвергнутой эвтаназии после введения 4 доз. Нижняя панель: данные для двух различных мышей после 10 инъекций (только кровь; животные были живы на время подачи данной заявки).
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0041] Следует понимать, что данное изобретение не исчерпывается конкретными описанными воплощениями, поскольку они, безусловно, могут варьироваться. Также следует понимать, что используемая здесь терминология использована только в целях описания конкретных воплощений и не является исчерпывающей, поскольку рамки данного изобретения ограничены только прилагаемой формулой.
[0042] Следует отметить, что используемые в описании и в прилагаемой формуле изобретения существительные в единственном числе также подразумевают их множественное число, если из контекста явно не следует противоположное. Так, например, упоминание «эксципиент» подразумевает множество эксципиентов.
I. Определения
[0043] Все технические или научные термины в данном документе имеют такое же значение, как и в общепринятом понимании специалистов в той области, к которой относится изобретение, если не указано иначе. Следующие термины в данном документе имеют следующее значение.
[0044] Термин «содержать» или «содержащий», используемый здесь, означает, что композиции или способы включают перечисленные элементы, не исключая других. «По существу состоящий из» при определении композиций и способов будет означать исключение других элементов, имеющих принципиальное значение для комбинации в указанных целях. Так, композиция, по существу состоящая из элементов, указанных в данном документе, не будет исключать другие материалы или этапы, которые не влияют существенным образом на основы и новые характеристики заявленного изобретения, такие как способность лечить воспалительное заболевание кишечника у пациента, нуждающегося в таком лечении, и/или индукция противовоспалительного ответа. «Состоящий из» будет означать по отношению к веществу, что вещество может содержать лишь следовые примеси других веществ, а по отношению к способу, что способ не содержит других существенных стадий. Воплощения, обозначенные любым из указанных родственных терминов, находятся в рамках данного изобретения.
[0045] Под «биологически совместимыми» понимают компоненты системы доставки, которые не будут вызывать повреждение тканей или повреждение биологических систем человеческого организма. Для обеспечения биологической совместимости предпочтительно применять полимеры и эксципиенты, для которых ранее была продемонстрирована безопасность применения у человека или которые признаны безвредными (Generally Accepted As Safe). Под биологической совместимостью подразумевают, что ингредиенты и эксципиенты, используемые в композициях, в конечном итоге будут «биоабсорбированы» или выведены организмом без побочных эффектов на организм. Композиция считается биологически совместимой и нетоксичной, если она не оказывает токсичного влияния на клетки. Аналогично, термин «биоабсорбируемые» обозначает наночастицы, изготовленные из материалов, которые проходят биоабсорбцию in vivo за такой период времени, который позволяет избежать долговременного накопления материала у пациента. В предпочтительном воплощении биологически совместимые наночастицы абсорбируются за период времени менее 2 лет, предпочтительно менее 1 года и еще более предпочтительно менее 6 месяцев. Скорость биоабсорбции зависит от размера частиц, использованного материала и других факторов, хорошо известных специалистам. Для изготовления наночастиц, применявшихся в данном изобретении, можно применять смесь биоабсорбируемых, биологически совместимых материалов. В одном воплощении может применяться комбинация оксида железа и биологически совместимого биоабсорбируемого полимера. Например, для изготовления наночастиц можно использовать комбинацию оксида железа и PGLA.
[0046] Комплекс антиген/ГКГС/наносфера относится к презентации пептида, углевода, липида или другого антигенного сегмента, фрагмента или эпитопа молекулы антигена или белка (т.е. собственного пептида или аутоантигена) на поверхности, такой как поверхность биологически совместимой биодеградируемой наносферы. «Антиген» в данном документе обозначает часть, фрагмент, сегмент молекулы или целую молекулу, способные вызвать иммунный ответ у субъекта или увеличение числа антипатогенных клеток.
[0047] Термин «приблизительно» при употреблении перед численным значением, например, температуры, времени, количества и концентрации, включая диапазоны, означает приближенное значение, которое может варьировать в большую сторону или в меньшую сторону на 10%, 5% или 1%.
[0048] «Миметик» представляет собой аналог указанного лиганда или пептида, причем аналог обладает существенным сходством с лигандом. «Существенное сходство» означает, что аналог имеет схожий с лигандом профиль связывания, при этом миметик имеет одну или несколько функциональных групп или модификаций, общая доля которых занимает менее чем приблизительно 50%, менее чем приблизительно 40%, менее чем приблизительно 30%, менее чем приблизительно 20%, менее чем приблизительно 10%, или менее чем приблизительно 5% молекулярного веса лиганда.
[0049] Термин "иммунная клетка" относится к клетке иммунной системы. Клетки иммунной системы включают, например, спленоциты взрослого человека, Т лимфоциты, В лимфоциты и клетки костномозгового происхождения, например, антиген-презентирующие клетки млекопитающего, обладающие активностью в отношении организма, в котором они были произведены. Термин также охватывает клетки врожденной иммунной системы, например, такие как естественные киллерные клетки, тучные клетки, эозинофилы, базофилы и фагоцитирующие клетки, такие как макрофаги, нейтрофилы и дендритные клетки.
[0050] Термин "противовоспалительная Т клетка" обозначает Т клетку, которая способствует противовоспалительному ответу. Противовоспалительная функция Т клеток может реализовываться через продукцию и/или секрецию противовоспалительных белков, цитокинов, хемокинов и т.п. Противовоспалительные белки также охватывают антипролиферативные сигналы, подавляющие иммунные ответы. Противовоспалительные белки включают IL-4, IL-10, IL-13, IFN-α, TGF-β, IL-1ra, G-CSF и растворимые рецепторы TNF и IL-6. Термин также охватывает противовоспалительные клетки, обладающие воспалительным фенотипом, но уничтожающие антиген-презентирующие клетки, координирующие конкретный аутоиммунный ответ. В некоторых воплощениях эти клетки вырабатывают IFNγ и TNFα, помимо прочих цитокинов. В некоторых воплощениях противовоспалительная Т клетка является клеткой, распознающей эпитоп бактерий кишечника с низкой авидностью. В других воплощениях противовоспалительная Т клетка является цитотоксической Т клеткой.
[0051] Термин "IL-10" или "интерлейкин-10" обозначает цитокин, кодируемый геном IL-10. Последовательности IL-10 представлены в GenBank под номерами: NM_000572.2 (мРНК) и НЧ_000563.1 (белок).
[0052] Термин "TGF-β" или "трансформирующий фактор роста бета" обозначает белок, способный оказывать противовоспалительное действие. TGF-β является секретируемым белком, существующим по меньшей мере в трех изоформах, обозначаемых TGF-β1, TGF-β2 и TGF-β3. Это было первоначальным названием TGF-β1, главного представителя данного семейства. Семейство TGF-β является частью суперсемейства белков, известных как суперсемейство трансформирующего фактора роста бета, включающего ингибины, активин, анти-мюллеров гормон, костный морфогенетический белок, декапентаплегический транскрипт и Vg-1.
[0053] Термин "желудочно-кишечный тракт" относится как к верхнему, так и к нижнему отделам желудочно-кишечного тракта. Верхний отдел желудочно-кишечного тракта состоит из пищевода, желудка и 12-перстной кишки. Нижний отдел желудочно-кишечного тракта включает тонкую и толстую кишку.
[0054] Термин "микроорганизм" обозначает одноклеточный микроскопический организм. Микроорганизмы включают, например, бактерии, грибы, архебактерии и простейшие.
[0055] «Эффективное количество» представляет собой количество, достаточное для достижения намеченной цели, например, для запуска иммунного ответа, регуляции иммунного ответа, подавления иммунного ответа и регуляции активности Т клеток или популяций Т клеток. В одном аспекте эффективное количество представляет собой количество, которое позволяет достичь указанной цели терапии, например, является терапевтически эффективным количеством. Как здесь подробно описано, эффективное количество или доза зависят от цели и от композиции, компонента, и могут быть установлены, исходя из данного описания.
[0056] Употребление существительных в единственном числе в сочетании с термином «содержащий» в формуле изобретения и/или описании может означать «один», но также предполагает значение «один или более», «по меньшей мере один» и «один или несколько».
[0057] Термин "интеграза" обозначает белок, экспрессируемый представителями рода Bacteroides. Последовательности интегразы соответствует номер GenBank YP_001300081.1. Данная последовательность представлена в SEQ ID No. 2. SEQ ID No. 3 представляет кодирующую последовательность ДНК интегразы. SEQ ID No. 1 соответствует эпитопу белка интегразы. Это эпитоп IYLKTNVYL (SEQ ID No. 1). Штаммы Bacteroides, которые имеют эпитоп IYLKTNVYL (SEQ ID No. 1) включают, например, Bacteroides sp.9_1_42FAA, Bacteroides sp. D4, Bacteroides sp. 3_1_33FAA, Bacteroides dorei 5_1_36/D4, Bacteroides dorei DSM 17855, Bacteroides vulgatus ATCC 8482, Bacteroides sp. 4_3_47FAA, Bacteroides vulgatus PC510.
[0058] Под «наносферой», «НЧ», или «наночастицей» в данном описании понимают мелкие дискретные частицы, которые вводят соответствующим образом в единственном или множественном числе субъекту, в клеточный образец или в образец ткани. В некоторых воплощениях наносферы имеют по существу сферическую форму. Термин «по существу сферический» в данном документе означает, что форма частиц не отклоняется от сферы более чем приблизительно на 10%. В некоторых воплощениях наночастица не является липосомой или вирусной частицей. В других воплощениях наночастица является твердой. Различные известные антигенные или пептидные комплексы данного изобретения можно наносить на поверхность частиц. Наносферы в данном изобретении могут иметь размер приблизительно от 1 нм до 1 мкм, предпочтительно приблизительно от 10 нм до 1 мкм, а в некоторых аспектах эти цифры означают средний диаметр или медиану диаметра множества наносфер, когда подразумевают множество наносфер. Более мелкие наночастицы могут быть получены, например, при помощи фракционирования, когда более крупным частицам дают возможность осесть в водном растворе. После этого собирают верхнюю фракцию раствора с помощью способов, известных специалистам в данной области. Эта верхняя фракция обогащена более мелкими частицами. Процесс можно повторять до получения желаемого среднего размера.
[0059] Употребление термина «или» в формуле изобретения означает «и/или», если явно не указано, что он обозначает только альтернативный вариант, или если альтернативные варианты являются взаимоисключающими, причем описание содержит определения, которые относятся только к альтернативным вариантам и к «и/или».
[0060] Используемое здесь выражение «иммунный ответ» или его эквивалент «иммунологический ответ» обозначают развитие клеточно-опосредованного ответа (опосредованного антиген-специфическими Т клетками или продуктами их секреции), направленного против антигенов, специфических для микроорганизмов желудочно-кишечного тракта, или против соответствующего эпитопа антигенов, специфических для микроорганизмов желудочно-кишечного тракта. Клеточный иммунный ответ вызывает презентация полипептидных эпитопов, связанных с молекулами ГКГС класса I или II, для активации антиген-специфических CD4+ Т хелперных клеток и/или CD8+ цитотоксических Т клеток. Ответ может также включать активацию других компонентов.
[0061] Термины "воспалительный ответ" и "воспаление" в данном документе обозначают сложный биологический ответ сосудистых тканей индивида на повреждающий стимул, например, на патогены, поврежденные клетки или раздражители, и включают секрецию цитокинов, а более конкретно - провоспалительных цитокинов, т.е. цитокинов, которые преимущественно продуцируются активированными иммунными клетками и участвуют в развитии воспалительных реакций. Примеры провоспалительных цитокинов включают IL-1, IL-6, TNF-a, IL-17, IL21, IL23 и TGF-β, но не ограничиваются ими. Примеры воспаления включают острое воспаление и хроническое воспаление. Острое воспаление обозначает кратковременный процесс, характеризующийся классическими признаками воспаления (отечностью, покраснением, болью, повышенной температурой и потерей функции) вследствие проникновения в ткани плазмы и лейкоцитов. Острое воспаление как правило развивается при появлении повреждающего стимула и прекращается сразу после его устранения, разрушения или отгораживания путем рубцевания (фиброз). Хроническое воспаление указывает на состояние, характеризуемое сопутствующим активным воспалением, деструкцией ткани и попытками репарации. Для хронического воспаления не характерны классические признаки острого воспаления, перечисленные выше. Напротив, хроническое воспаление в тканях характеризуется инфильтрацией мононуклеарных клеток иммунной системы (моноцитами, макрофагами, лимфоцитами и плазматическими клетками), разрушением ткани и попытками репарации, включая ангиогенез и фиброз. Данное изобретение предусматривает подавление воспаления за счет воздействия на любое событие, являющееся частью сложного биологического ответа, связанного с воспалением в организме индивида, в частности, посредством его ингибирования.
[0062] Термины «эпитоп» и «антигенная детерминанта» используются взаимозаменяемо для обозначения сайта антигена, на который отвечают или который распознают В и/или Т клетки. В-клеточные эпитопы могут быть образованы как последовательно расположенными аминокислотами, так и не прилегающими друг к другу аминокислотами, сближенными благодаря третичной укладке белка. Эпитопы, образованные прилегающими друг к другу аминокислотами, как правило, сохраняются при воздействии денатурирующих агентов, тогда как эпитопы, существующие благодаря третичной укладке, как правило, разрушаются при обработке денатурирующими агентами. Эпитоп, как правило, включает по меньшей мере 3, чаще по меньшей мере 5 или 8-10 аминокислот, имеющих уникальную пространственную конформацию. Способы определения пространственной конформации эпитопов включают, например, рентгеновскую кристаллографию и двумерный ядерно-магнитный резонанс. См, например, Glenn Е. Morris, Epitope Mapping Protocols (1996). Т-клетки распознают линейные эпитопы размером приблизительно 9 аминокислот в случае CD8 клеток или приблизительно 13-15 аминокислот в случае CD4 клеток. Т клетки, распознающие эпитоп, могут быть идентифицированы при помощи in vitro тестов, в которых определяют антиген-зависимую пролиферацию, например, определяя включение 3Н-тимидина в примированные Т клетки в ответ на эпитоп (Burke et al., J. Inf. Dis., 170:1110-1119, 1994), антиген-зависимый киллинг (исследование цитотоксических Т лимфоцитов, Tigges et al., J. Immunol., 156(10):3901-3910, 1996) или секрецию цитокинов. Наличие клеточно-опосредованного иммунологического ответа можно определить, исследуя пролиферацию (CD4+ Т клеток) или исследуя CTL (цитотоксические Т лимфоциты).
[0063] Как вариант, антиген или предпочтительно, эпитоп антигена можно химически конъюгировать или экспрессировать в составе химерного белка, объединив его с другими белками, такими как белки ГКГС и белки, подобные молекулам ГКГС.
[0064] В данном описании термины "пациент" и "субъект" используются взаимозаменяемо и обозначают млекопитающего. В некоторых воплощениях пациент является человеком. В других воплощениях пациент или субъект является млекопитающим, обычно используемым в лабораториях, например, мышью, крысой, обезьяной, собакой, кошкой, коровой, лошадью или овцой.
[0065] В данном описании термин "полинуклеотид" обозначает молекулу нуклеиновой кислоты, которая либо является рекомбинантной, либо была выделена из всей совокупности нуклеиновых кислот генома. Термин "полинуклеотид" охватывает олигонуклеотиды (нуклеиновые кислоты длиной 100 остатков или менее), рекомбинантные векторы, включая, например, плазмиды, космиды, фаги, вирусы и т.п. в некоторых аспектах полинуклеотиды включают регуляторные последовательности, по существу выделенные из существующих в естественных условиях генов или последовательностей, кодирующих белки. Полинуклеотиды могут представлять собой РНК, ДНК, их аналоги или их комбинации. Нуклеиновая кислота, кодирующая весь полипептид или его часть, может содержать сплошную последовательность нуклеиновой кислоты, кодирующую весь полипептид или его часть, и состоять из 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000, 1010, 1020, 1030, 1040, 1050, 1060, 1070, 1080, 1090, 1095, 1100, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 9000, 10000 или более нуклеотидов, нуклеозидов или пар оснований. Также предполагают, что конкретный полипептид из определенного биологического вида может кодироваться нуклеиновыми кислотами, имеющими естественные различия, что нуклеиновые кислоты, последовательность которых незначительно различается, могут тем не менее кодировать такой же или существенно схожий белок, полипептид или пептид.
[0066] Полинуклеотид представляет собой определенную последовательность, состоящую из четырех оснований: аденина (А); цитозина (С); гуанина (G); тимина (Т) и урацила (U), заменяющего тимин в том случае, если полинуклеотидом является РНК. Таким образом, термин "полинуклеотидная последовательность" представляет собой буквенное обозначение молекулы полинуклеотида. Такое буквенное обозначение можно вводить в базы данных компьютера с центральным обрабатывающим модулем и использовать в биоинформатических приложениях, таких как функциональная геномика и поик гомологии.
[0067] Термин "выделенный" или "рекомбинантный", используемый в данном документе в отношении нуклеиновых кислот, таких как ДНК или РНК, обозначает молекулы, отделенные от других ДНК или РНК, соответственно, присутствующих в естественном источнике макромолекул, а также в отношении полипептидов. Термин "выделенная или рекомбинантная нуклеиновая кислота" включает фрагменты нуклеиновых кислот, которые не существуют в естественных условиях в виде фрагментов и не встречаются в природе. Термин "выделенный" также обозначает полинуклеотиды, полипептиды и белки, которые отделены от других клеточных белков, и охватывает как очищенные, так и рекомбинантные полипептиды. В других воплощениях термин "выделенный или рекомбинантный" означает отделенный от компонентов, клеточных и иных, когда клетки, ткани, полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты в природе обычно связаны. Например, выделенная клетка представляет собой клетку, которая отделена от ткани или клеток с отличающимся фенотипом или генотипом. Выделенный полинуклеотид отделен от смежных с ним нуклеотидов в направлении 3' и 5', с которыми он обычно связан в своем естественном или природном окружении, например, в составе хромосомы. Для специалиста в данной области очевидно, что для того, чтобы отличить полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты, не имеющие естественного происхождения, от аналогов естественного происхождения их "выделение" не требуется.
[0068] Если полинуклеотид или участок полинуклеотида (или полипептид или участок полипептида) имеют некоторый показатель "идентичности" с другой последовательностью, выраженный в процентах (например, 80%, 85%, 90% или 95%), это означает, что при выравнивании процентное содержание оснований (или аминокислот) одинаково в двух сравниваемых последовательностях. Выровнять последовательности и определить их показатель гомологии или идентичности, выраженный в процентах, можно с помощью программного обеспечения, известного в области техники, например, тех, которые описаны в руководстве Current Protocols in Molecular Biology (Ausubel et al., eds. 1987) приложение 30, раздел 7.7.18, таблица 7.7.1. Предпочтительно, для выравнивания использовать параметры по умолчанию. Предпочтительно для выравнивания использовать программу BLAST с параметрами по умолчанию. В частности, предпочтительными программами являются BLASTN и BLASTP, в которых используют следующие параметры по умолчанию: Genetic code = standard; filter = none; strand = both; cutoff = 60; expect = 10; Matrix = BLOSUM62; Descriptions = 50 sequences; sort by = HIGH SCORE; Databases = non-redundant, GenBank + EMBL + DDBJ + PDB + GenBank CDS translations + SwissProtein + SPupdate + PIR. Подробное описание данных программ можно найти по следующему электронному адресу: ncbi.nlm.nih.gov/cgi-bin/BLAST.
[0069] Когда данное изобретение относится к полипептиду, белку, полинуклеотиду или антителу, это следует трактовать таким образом, что его эквивалент или биологический эквивалент также находятся в рамках изобретения, даже если последние не перечислены явным образом, при условии, что не указано обратное. В данном описании термин "биологический эквивалент" является синонимом "эквивалента" референтного белка, антитела, фрагмента, полипептида или нуклеиновой кислоты, и охватывает даже те из них, которые обладают минимальной гомологией, при условии, что они сохраняют желаемую структуру или функцию. Если явным образом не указано обратное, подразумевают, что любой полинуклеотид, полипептид или белок, упомянутые в данном документе, также включают их эквиваленты. В одном аспекте эквивалент полинуклеотида представляет собой полинуклеотид, гибридизующийся в жестких условиях или комплементарный полинуклеотиду, описанному в данном документе, для применения в описанных методах. В другом аспекте эквивалент антитела или антигенсвязывающего полипептида охватывает те из них, которые связываются с аффинностью, составляющей по меньшей мере 70% или в альтернативном случае по меньшей мере 75%, в альтернативном случае по меньшей мере 80%, в альтернативном случае по меньшей мере 85%, в альтернативном случае по меньшей мере 90%, в альтернативном случае по меньшей мере 95% или выше по сравнению с референтным антителом или антегенсвязыающим фрагментом. В другом аспекте эквивалент конкурирует с антителом или антигенсвязывающим фрагментом за связывание с антигеном в условиях конкурентного ИФА. В другом аспекте эквивалент означает по меньшей мере 80% гомологию или идентичность или в альтернативном случае по меньшей мере 85%, или в альтернативном случае по меньшей мере 90%, или в альтернативном случае по меньшей мере 95%, или в альтернативном случае 98% гомологию или идентичность и проявляет по существу аналогичную биологическую активность по сравнению с референтным белком, полипептидом или нуклеиновой кислотой.
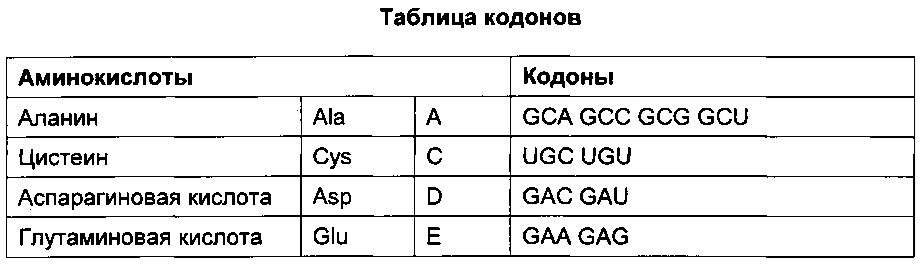
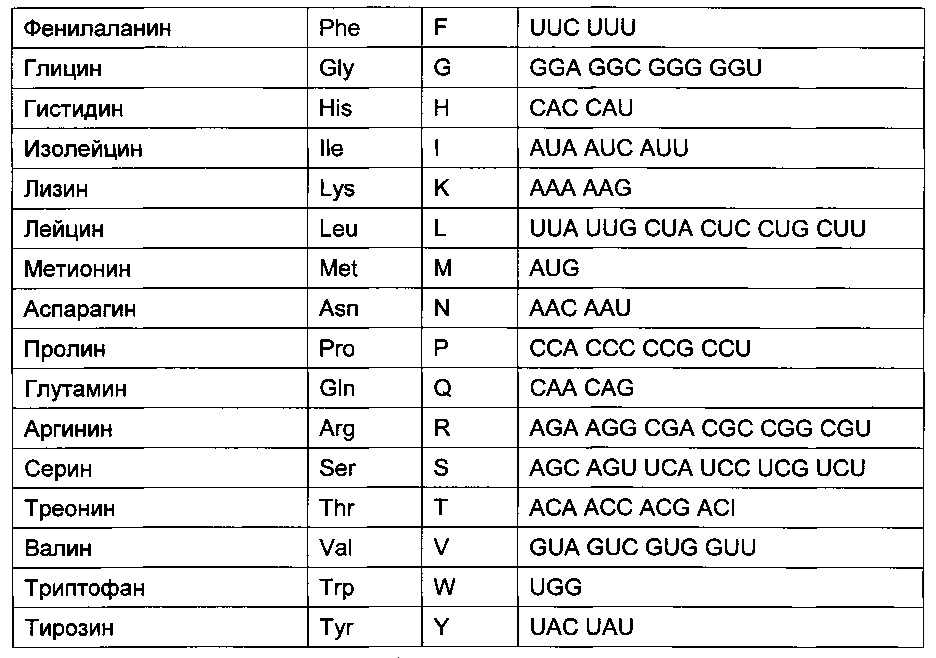
[0070] "Гибридизация" обозначает реакцию, в ходе которой один или несколько полинуклеотидов вступают в реакцию с формированием комплекса, стабилизируемого водородными связями между основаниями нуклеотидных остатков. Водородные связи могут возникать при спаривании по Уотсону-Крику, спариванию по Хугстину, или любым другим способом, основанным на специфичности последовательности. Комплекс может содержать две цепи, образующие дуплекс, три или более цепей, формирующих многоцепочечный комплекс, одну самогибридизующуюся цепь или любую комбинацию вышеперечисленного. Реакция гибридизации может представлять собой этап более масштабного процесса, например, инициацию полимеразной цепной реакции или ферментативное расщепление полинуклеотида рибозимом.
[0071] Примеры жестких условий гибридизации включают: инкубацию при температурах приблизительно от 25°С до 37°С; использование буфера для гибридизации с концентрацией приблизительно от 6х SSC до 10x SSC; формамида с концентрацией приблизительно от 0% до 25% и отмывочного раствора с концентрацией приблизительно от 4х SSC до 8х SSC. Примеры умеренных условий гибридизации включают: инкубацию при температурах приблизительно от 40°С до 50°С; использование буфера для гибридизации с концентрацией приблизительно от 9х SSC до 2х SSC; формамида с концентрацией приблизительно от 30% до 50% и отмывочного раствора приблизительно с концентрацией от 5х SSC до 2х SSC. Примеры гибридизации в условиях высокой жесткости включают: инкубацию при температурах приблизительно от 55°С до 68°С; использование буфера для гибридизации с концентрацией приблизительно от Ix SSC до 0,1х SSC; формамида с концентрацией приблизительно от 55% до 75% и отмывочного раствора с концентрацией приблизительно Ix SSC, 0,1х SSC или деионизованной воды. Как правило, время инкубации при гибридизации составляет от 5 минут до 24 часов, с 1, 2 или большим числом этапов отмывки, время инкубации при отмывке составляет приблизительно 1, 2 или 15 минут. SSC представляет собой 15 мМ цитратный буферный раствор с добавлением 0,15 М NaCl. Очевидно, что могут использоваться другие буферные системы, эквивалентые SSC.
[0072] "Гомология" или "идентичность" или "сходство" обозначает сходство последовательностей двух пептидов или двух молекул нуклеиновых кислот. Гомологию можно установить путем сравнения позиций в каждой последовательности, которые можно выровнять для целей сравнения. Если позиция в сравниваемой последовательности занята таким же основанием или аминокислотой, в этой позиции молекулы являются гомологичными. Степень гомологии между последовательностями является функцией от числа совпадающих или гомологичных позиций у этих последовательностей. "Неродственные" или "негомологичные" последовательности идентичны менее чем на 40%, или в альтернативном случае менее чем на 25% с одной из последовательностей данного изобретения.
[0073] "Гомология" или "идентичность" или "сходство" может также обозначать две молекулы нуклеиновой кисоты, которые гибридизуются в жестких условиях.
[0074] В данном описании термины "лечить", "лечение" и им подобные обозначают достижение желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим и выражаться в полном или частичном предупреждении нарушения или его признаков или симптомов, и/или может быть терапевтическим и выражаться в частичном или полном излечении нарушения и/или нежелательного эффекта, приписываемого нарушению. В одном аспекте лечение обозначает подавление воспаления у пациента. Способы его оценки включают исследование вазодиляции, выработки маркеров воспаления и прекращения инфильтрации лейкоцитами, но не ограничиваются ими. Маркеры воспаления включают, например, IL-6, IL-8, IL-18, TNF-альфа и CRP. В области техники известно множество способов, подходящих для определения и мониторинга таких маркеров.
[0075] Предупреждение означает предупреждение нарушения или эффекта in vitro или in vivo в системе или у субъекта, предрасположенного к нарушению или к эффекту.
[0076] "Композиция" обозначает комбинацию активного агента и другого компонента или композиции, инертного (например, детектируемого агента или метки) или активного, такого как адъювант.
[0077] "Фармацевтическая композиция" включает комбинацию активного агента с носителем, инертным или активным, что делает композицию подходящей для диагностического или терапевтического применения in vitro, in vivo или ex vivo.
[0078] Термин «функционально эквивалентный кодон» здесь используется для обозначения кодонов, кодирующих одинаковые аминокислоты, например, шести кодонов для аргинина или серина, а также обозначает кодоны, кодирующие биологически эквивалентные аминокислоты (см. Таблицу ниже).
[0079] В данном документе «белок» или «полипептид» или «пептид» относятся к молекуле, содержащей, по меньшей мере, пять аминокислотных остатков.
[0080] Другие объекты, признаки и преимущества данного изобретения станут очевидны исходя из следующего ниже подробного описания. Однако следует понимать, что подробное описание и определенные примеры, демонстрирующие определенные воплощения изобретения, приведены только в качестве иллюстраций, поскольку различные изменения и модификации, находящиеся в духе и в рамках изобретения, основанные на этом подробном описании, будут очевидны для специалистов в данной области.
ОПИСАНИЕ ВОПЛОЩЕНИЙ ИЗОБРЕТЕНИЯ
[0081] Ранее было неизвестно, что антигенные пептиды симбиотических бактерий желудочно-кишечного тракта специфически распознаются эндогенными Т-клетками хозяина после процессинга специализированными антиген-презентирующими клетками (АПК, такими как дендритные клетки, или ДК), и что это опосредованное антигенами взаимодействие между АПК и распознающей Т-клеткой и может подавлять ВЗК. Не связываясь какой-либо теорией, авторы изобретения считают, что белки бактерий, заселяющих или инфицирующих желудочно-кишечный тракт, подвергаются процессингу протеасомами или в эндосомах, а полученные пептиды переносятся в эндоплазматический ретикулум для связывания с эндогенными молекулами ГКГС класса I или класса II, которые затем переносятся на плазматическую мембрану АПК, что впоследствии активирует распознающие их Т-клетки.
[0082] По мнению Заявителей в данном документе впервые указано, что антигены бактерий желудочно-кишечного тракта подвергаются процессингу и презентируются распознающим их эндогенным Т-клеткам, обеспечивая возможность подавлять воспалительные заболевания кишечника и, таким образом, заявители считают, что эти антигены могут служить мишенями, которые будут способствовать мобилизации и аккумуляции ауторегуляторных (противовоспалительных) Т-клеток, например, в кишечнике при воспалительных заболеваниях кишечника. Ранее было продемонстрировано, что комплексы антиген-ГКГС-наночастица позволяют увеличить популяцию Т клеток, обеспечивающих терапевтический эффект, при других заболеваниях (см., например, публикации US 2009/0155292), однако было неизвестно, что данная технология позволяет подавлять воспаление, например, в желудочно-кишечном тракте или лечить воспалительные заболевания кишечника. Описанные здесь композиции и способы могут найти применение при подавлении воспаления и при лечении связанных с ним заболеваний.
II. СПОСОБЫ
[0083] Способы, описанные в данном документе, включают или в альтернативном случае по существу состоят или также состоят из введения комплекса антиген-ГКГС-наночастица в эффективном количестве в клетку, ткань или субъекту для одной или нескольких следующих целей: (1) индукции противовоспалительного ответа в клетке или ткани; (2) лечения или подавления воспаления у нуждающегося в этом пациента; (3) аккумуляции ауторегуляторных противовоспалительных Т клеток у нуждающегося в этом пациента и/или (4) переноса цитотоксических Т-лимфоцитов, нацеленных на эпитопы бактерий кишечника у нуждающегося в этом пациента. В одном воплощении цитотоксические Т-лимфоциты распознают эпитопы бактерий кишечника с низкой авидностью.
[0084] В одном воплощении воспаление желудочно-кишечного тракта подавляется или излечивается. Способы оценки и мониторинга терапии известны в области техники и кратко описаны в данном документе. При доставке in vitro введение осуществляют путем приведения композиции в контакт с тканью или клеткой надлежащим способом, например, путем введения в среду для культивирования клеток или тканей, что можно использовать в качестве скрининга для определения эффективности терапии для индивида или скрининга альтернативных терапевтических средств, которые будут использоваться взамен или в комбинации с описанными композициями. При введении in vivo введение может быть системным или локальным. In vivo способы можно применять в отношении животных, отличных от человека, для скрининга альтернативных терапевтических средств, которые будут использоваться взамен или в комбинации с описанными композициями, перед введением человеку. Они также подходят для лечения заболевания или нарушения у человека или животного, отличного от человека.
[0085] В некоторых воплощениях пациент, которому предстоит лечение с использованием способов, описанных в данном документе, страдает желудочно-кишечным заболеванием, симптомами или проявлениями которого является воспаление ткани ЖКТ. Не являющиеся исчерпывающими примеры желудочно-кишечных заболеваний включают воспалительные заболевания кишечника, колит, болезнь Крона, аллергические реакции в желудочно-кишечном тракте, пищевые аллергии, эозинофильные заболевания желудочно-кишечного тракта, синдром раздраженного кишечника, целиакию и желудочные кровотечения. В одном воплощении заболевание выбрано из группы: воспалительного заболевания кишечника, колита, болезни Крона, аллергического воспаления желудочно-кишечного тракта и целиакии. В другом воплощении заболевание представляет собой воспалительное заболевание кишечника.
[0086] Описанные здесь способы могут найти применение для индукции противовоспалительного ответа в клетке или ткани. В одном воплощении клетка или ткань представляет собой клетку или ткань желудочно-кишечного тракта. Верхние отделы желудочно-кишечного тракта состоят из пищевода, желудка и 12-перстной кишки. Границы, разделяющие "верхний" и "нижний" отделы, могут варьироваться. На вскрытии 12-перстная кишка может представлять собой единый орган, но часто подразделяется на две части с учетом ее функции, кровоснабжения или с точки зрения эмбриологии. Нижний отдел желудочно-кишечного тракта включает тонкий кишечник и толстый кишечник. Тонкий кишечник имеет три отдела: двенадцатиперстную кишку, тощую кишку и подвздошную кишку. В двенадцатиперстной кишке происходит смешивание пищеварительных ферментов поджелудочной железы и желчного пузыря (желчи). Пищеварительные ферменты расщепляют белки, а желчь эмульгирует жиры с образованием мицелл. В двенадцатиперстной кишке содержатся Бруннеровы железы, выделяющие бикарбонат, а панкреатический сок, содержащий бикарбонат, обеспечивает нейтрализацию соляной кислоты, вырабатываемой в желудке. Тощая кишка является средней частью кишечного тракта, соединяющей двенадцатиперстную кишку с подвздошной кишкой. Она имеет круговые складки и ворсинки, увеличивающие площадь этой части ЖКТ. В ворсинках подвздошной кишки все растворимые молекулы абсорбируются в кровь (кровеносные и лимфатические капилляры). Толстый кишечник подразделяется на три отдела: слепую кишку, ободочную кишку и прямую кишку. От слепой кишки отходит червеобразный аппендикс. Ободочная кишка состоит из восходящей, поперечной, нисходящей и сигмовидной ободочной кишки. Главной функцией ободочной кишки является абсорбция воды, но в ней также находятся бактерии, производящие полезные витамины.
[0087] В другом воплощении осуществляют индукцию противовоспалительного ответа, опосредованного иммунными клетками или тканями, содержащими их. Иммунные клетки включают, например, взрослые спленоциты, Т лимфоциты, В лимфоциты и клетки костно-мозгового происхождения, например, дефектные антиген-презентирующие клетки млекопитающего, активность которых направлена против организма, из которого происходят иммунные клетки.
[0088] ГКГС в составе комплекса антиген-ГКГС-наночастица может представлять собой ГКГС I, ГКГС II или неклассический ГКГС. Белки ГКГС описаны в данном документе. В одном воплощении ГКГС в составе комплекса антиген-ГКГС-наночастица представляет собой ГКГС класса I. В другом воплощении ГКГС представляет собой ГКГС класса II. В других воплощениях компонент ГКГС комплекса антиген-ГКГС-наночастица представляет собой ГКГС класса II или неклассическую молекулу ГКГС, согласно данному описанию.
[0089] В одном из аспектов способа предложен способ аккумуляции противовоспалительных (специфических в отношении микроорганизмов кишечника или специфических в отношении микроорганизмов желудочно-кишечного тракта) Т клеток у нуждающегося в этом пациента. В одном воплощении производят аккумуляцию Т клеток в желудочно-кишечном тракте пациента. В другом воплощении Т клетка представляет собой обычную CD8+ Т-клетку, распознающую любой антиген микроорганизма желудочно-кишечного тракта. В другом воплощении Т клетка представляет собой ауторегуляторную CD8+ Т клетку, подобную клетке памяти. Еще в одном воплощении Т клетка представляет собой CD4+ Т клетку. В другом воплощении Т клетка секретирует IL-10 или TGFβ.
[0090] Подробности, касающиеся способов введения in vitro и in vivo, описаны ниже.
III. КОМПЛЕКСЫ АНТИГЕН-ГКГС-НАНОЧАСТИЦА
[0091] Некоторые аспекты относятся к способам получения специфических в отношении антигенов кишечника лекарственных препаратов против ВЗК, специфически воздействующих на воспаление без подавления иммунной системы. В Примере 2 описано получение комплексов антиген-ГКГС-наночастица. Комплексы антиген-ГКГС-наночастица, которые могут найти применение в данном изобретении, содержат антиген, полученный из микроорганизма желудочно-кишечного тракта. Считается, что введение пациенту наночастиц, покрытых комплексами специфического для кишечника антигена и ГКГС, приведет к увеличению популяции циркулирующих Т клеток, специфических в отношении антигена кишечника, составляющих приблизительно от 0,5% до 90% от общего количества циркулирующих Т клеток, или приблизительно от 1% до 80%, или приблизительно от 5% до 80%, или приблизительно от 10% до 80%, или приблизительно от 10% до 50%, или приблизительно от 50% до 90%, или приблизительно от 20% до 50%, или приблизительно от 30% до 60%, или приблизительно от 35% до 65%, или приблизительно от 40% до 70%, или приблизительно от 45% до 75%, или приблизительно от 50% до 80%, или приблизительно от 25% до 55%, или приблизительно от 0,5% до 1%, или приблизительно от 1% до 2,5%, или приблизительно от 2,5% до 5%, или приблизительно от 0,1% до 5%, или приблизительно от 1% до 5%, или приблизительно от 0,1% до 10%.
А. Полипептиды и полинуклеотиды
[0092] Следующие аспекты относятся к выделенному или очищенному полипептиду, содержащему или по существу состоящему или также имеющему в своем составе аминокислотную последовательность SEQ ID No. 1, или полипептиду, последовательность которого идентична по меньшей мере на 80% или в альтернативном случае по меньшей мере на 85%, или в альтернативном случае по меньшей мере на 90%, или в альтернативном случае по меньшей мере на 95%, или в альтернативном случае по меньшей мере на 98% последовательности SEQ ID No. 1. Также предожены выделенные и очищенные полинуклеотиды, кодирующие полипептид, соответствующий SEQ ID No. 1, идентичный по меньшей мере на 80% последовательности SEQ ID No. 1, или в альтернативном случае по меньшей мере на 85%, или в альтернативном случае по меньшей мере на 90%, или в альтернативном случае по меньшей мере на 95%, или в альтернативном случае по меньшей мере на 98% последовательности SEQ ID No. 1, или эквивалент, или полинуклеотид, гибридизующийся в жестких условиях с полинуклеотидом, его эквивалентом или комплементарным ему полинуклеотидом, выделенные или очищенные полипептиды, кодируемые этими полинуклеотидами.
[0093] Другие аспекты относятся к выделенному или очищенному полипептиду, содержащему или по существу состоящему или имеющему в своем составе аминокислотную последовательность SEQ ID Nos. 4, 5, 6, 7 или 8 или полипептид, последовательность которого идентична по меньшей мере на 80% последовательностям SEQ ID No. 4-8, или в альтернативном случае по меньшей мере на 85%, или в альтернативном случае по меньшей мере на 90%, или в альтернативном случае по меньшей мере на 95%, или в альтернативном случае по меньшей мере на 98% последовательностям SEQ ID Nos. 4-8. Также предложены выделенные и очищенные полинуклеотиды, кодирующие полипептид, соответствующий последовательностям SEQ ID Nos. 4-8, или эквивалент или полинуклеотид, гибридизующийся в жестких условиях с полинуклеотидом, его эквивалентом или комплементарным ему нуклеотидом, и выделенные или очищенные полипептиды, кодируемые этими полинуклеотидами или имеющими последовательность, идентичную по меньшей мере на 80% полинуклеотидам, кодирующим SEQ ID No. 4-8, или в альтернативном случае по меньшей мере на 85%, или в альтернативном случае по меньшей мере на 90%, или в альтернативном случае по меньшей мере на 95%, или в альтернативном случае по меньшей мере на 98% последовательности полинуклеотидов, кодирующих SEQ ID Nos. 4-8.


[0094] Антигены, включая их сегменты, фрагменты, а также другие молекулы, полученные на основе антигенов, включая, помимо прочих, пептиды, углеводы, липиды или другие молекулы, презентируемые классическими и неклассическими молекулами ГКГС по изобретению, как правило, находятся в комплексе или функционально связаны с молекулой ГКГС или ее производным. Распознавание антигена Т лимфоцитами рестриктировано главным комплексом гистосовместимости. Указанный Т лимфоцит будет распознавать антиген, только если тот связан с определенной молекулой ГКГС. Как правило, стимуляция Т лимфоцитов происходит только в присутствии собственных молекул ГКГС, а антиген распознается в виде фрагментов антигена, связанных с собственными молекулами ГКГС. ГКГС-рестрикция определяет специфичность Т лимфоцитов в отношении распознаваемого антигена и молекулы ГКГС, которая связывается с его антигенным(и) фрагментом(ами). В конкретных аспектах некоторые антигены будут соединяться с некоторыми молекулами ГКГС или полипептидами, образованными на их основе.
[0095] Термин «функционально связан» или «покрыт» в данном документе обозначает ситуацию, когда отдельные полипептиды (например, ГКГС) и компоненты антигена (например, пептид) объединяются и формируют активный комплекс перед тем как связаться с целевым сайтом, например, клеткой иммунной системы. Сюда же относятся и ситуации, когда отдельные компоненты полипептидного комплекса синтезированы или получены рекомбинантным способом, а затем выделены и объединены с формированием комплекса in vitro, перед введением субъекту; ситуации, когда химерный или гибридный полипептид (т.е. все отдельные белковые компоненты комплекса находятся в составе одной полипептидной цепи) синтезирован или получен рекомбинантным способом в виде интактного комплекса. Как правило, полипептидные комплексы добавляют к наночастицам для получения наночастиц с адсорбированными на их поверхности или присоединенными полипептидными комплексами, где соотношение числа молекул к числу наносфер от приблизительно, по меньшей мере приблизительно, или не более чем приблизительно 0,1, 0,5, 1, 3, 5, 7, 10, 15, 20, 25, 30, 35, 40, 50, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 600, 700, 800, 900, 1000, 1500 или более к 1, чаще от 0,1:1, 1:1 до 50:1 или 300:1. В конкретном воплощении соотношение количества комплексов антиген-молекула ГКГС к числу наночастиц составляет приблизительно от 10:1 до 1000:1. Содержание полипептидов в наносферах может быть определено при помощи стандартных методик.
[0096] Пептиды и белки, описанные в данном документе, также могут найти применение в стандартных способах лечения воспаления желудочно-кишечного тракта. Соответственно, некоторые аспекты относятся к способам индукции противовоспалительного ответа в клетке или ткани, включая приведение клетки или ткани в контакт с эффективным количеством антигена, где антиген представляет собой антиген, полученный из микроорганизма, живущего в клетке или ткани желудочно-кишечного тракта (ЖКТ) или инфицирующего клетку или ткань ЖКТ или представляющего собой ЖКТ-ассоциированный антиген. Другой аспект относится к способу лечения воспаления у нуждающегося в этом пациента, включающий введение пациенту антигена в эффективном количестве, при этом антиген получен из микроорганизма, живущего в клетке или ткани желудочно-кишечного тракта (ЖКТ) или инфицирующего клетку или ткань ЖКТ или представляющего собой ЖКТ-ассоциированный антиген. Следующий аспект относится к способу аккумуляции противовоспалительных Т клеток в ЖКТ нуждающегося в этом пациента, включающий введение пациенту антигена в эффективном количестве, где антиген представляет собой антиген, полученный из микроорганизма, живущего в клетке или ткани желудочно-кишечного тракта (ЖКТ) или инфицирующего клетку или ткань ЖКТ или представляющего собой ЖКТ-ассоциированный антиген. Антиген может, например, представлять собой антиген, соответствующий пептиду, последовательность которого идентична по меньшей мере на 80% пептидным последовательностям группы: SEQ ID Nos. 1, 2, 4, 5, 6, 7 или 8. В некоторых воплощениях антиген объединяют в комплекс с молекулами ГКГС перед введением. В других воплощениях антиген вводят вместе с адъювантом. Примеры подходящих адъювантов включают полный и неполный адъювант Фрейнда, минеральные соли и полинуклеотиды, но не ограничиваются ими. Другие не являющиеся исчерпывающими примеры подходящих адъювантов включают монофосфорил-липид A (MPL), мутантные производные термолабильного энтеротоксина Е. coli, мутантные производные холерного токсина, CPG-олигонуклеотиды и адъюванты на основе сквалена.
В. Молекулы ГКГС
[0097] Внутриклеточные и внеклеточные антигены представляют достаточно различные стимулы для иммунной системы, как в плане распознавания, так и в плане возможного ответа. Презентация антигенов Т клеткам опосредована двумя различными классами молекул ГКГС, класса I (ГКГС-I) и класса II (ГКГС-II), которые используют различные пути процессинга антигенов. Пептиды, представляющие собой производные внутриклеточных антигенов, презентируют CD8+ Т клеткам молекулы ГКГС класса I, которые экспрессируют практически все клетки, тогда как пептиды, являющиеся производными внеклеточных антигенов, презентируют CD4+ Т клеткам молекулы ГКГС-II. Однако существуют некоторые исключения из этого правила. В ряде исследований было показано, что пептиды из частиц, поглощенных путем эндоцитоза, или растворимые белки презентируются молекулами ГКГС-I макрофагов, а также дендритных клеток. В некоторых воплощениях изобретения конкретный антиген идентифицируется и презентируется в составе комплекса антиген-ГКГС-наночастица, будучи связанным с соответствующими полипептидами ГКГС класса I или II. В некоторых аспектах можно оценить генотип субъекта для определения, какие полипептиды ГКГС следует применять для конкретного пациента и конкретного набора пептидов.
[0098] В составе комплексов ГКГС по данному изобретению также возможно применение неклассических молекул ГКГС. Неклассические молекулы ГКГС являются неполиморфными, консервативными у разных видов и имеют узкие, глубокие гидрофобные «карманы» для связывания лигандов. Эти связывающие «карманы» способны презентировать гликолипиды и фосфолипиды естественным киллерным Т (NKT) клеткам или некоторым субпопуляциям CD8+ Т-клеток, например, Qa1 или HLA-E-рестриктированным CD8+ Т-клеткам. NKT клетки представляют уникальную популяцию лимфоцитов, которая ко-экспрессирует маркеры NK клеток и полуинвариантный Т-клеточный рецептор (TCR). Они задействованы в регуляции иммунных ответов, связанных с широким спектром заболеваний.
С. Антигенные компоненты
[0099] Некоторые аспекты изобретения включают способы и композиции, касающиеся антигенных композиций, включая сегменты, фрагменты или эпитопы полипептидов, пептидов, нуклеиновых кислот, углеводов, липидов и других молекул, провоцирующих или индуцирующих антигенный ответ и, в общем обозначаемых антигенами. В частности, для получения комплекса антиген-ГКГС-наночастица по данному описанию можно использовать антигенные сегменты или фрагменты антигенных детерминант, которые вызывают деструкцию клетки, опосредованную аутоиммунным ответом. Воплощения изобретения включают композиции и способы для модуляции иммунного ответа в клетке или ткани организма.
[0100] Полипептиды и пептиды по изобретению можно модифицировать при помощи делеций, вставок и/или замен различных аминокислот. В конкретных воплощениях модифицированные полипептиды и/или пептиды способны модулировать иммунный ответ у субъекта. В некоторых воплощениях используют вариант белка или пептида дикого типа, однако во многих воплощениях изобретения для создания комплекса антиген-ГКГС-наночастица используют модифицированный белок или полипептид. Комплекс антиген-ГКГС-наночастица можно применять для того, чтобы вызвать противовоспалительный иммунный ответ, модифицировать популяцию Т клеток иммунной системы (т.е. переобучить иммунную систему) и/или способствовать мобилизации и аккумуляции противовоспалительных Т клеток в конкретной ткани, например, такой как ткань желудочно-кишечного тракта. Описанные выше термины в данном документе могут употребляться взаимозаменяемо. «Модифицированный белок» или «модифицированный полипептид» или «модифицированный пептид» обозначают белок или полипептид, чья химическая структура, в частности аминокислотная последовательность, были изменены по сравнению с белком или полипептидом дикого типа. В некоторых воплощениях модифицированный белок или полипептид или пептид обладают, по меньшей мере, одной измененной активностью или функцией (с учетом того, что у белков или полипептидов или пептидов может быть множество активностей или функций). В частности, предполагается, что у модифицированного белка или полипептида или пептида в составе комплекса ГКГС-наночастица может быть изменена одна активность или функция, но в остальном сохранена активность или функция дикого типа, например, иммуногенность или способность взаимодействовать с другими клетками иммунной системы.
[0101] Антигены по изобретению включают антигены, полученные из белков микроорганизма, свойственного желудочно-кишечному тракту. Микроорганизмы, свойственные желудочно-кишечному тракту включают, например, Achromobacter spp, Acidaminococcus fermentans, Acinetobacter cacoaceticus, Actinomyces spp, Actinomyces viscosus, Actinomyces naeslundii, Aeromonas spp, Aggregatibacter actinomycetemcomitans, Alistipes putredinis, Anaerotruncus colihominis, Anaerobiospirillum spp, Alcaligenes faecalis, Arachnia propionica, Bacillus spp, Bacteroides spp, Bacteroides caccae, Bacteriodes capillosus, Bacteroides dorei, Bacteroides eggerthii, Bacteroides gingivalis, Bacteroides finegoldii, Bacteroides fragilis, Bacteroides intermedius, Bacteroides intestinalis, Bacteroides melaninogenicus, Bacteroides ovatus, Bacteroides pectinophilus, Bacteroides pneumosintes, Bacteroides stercoris, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides vulgatus, Bacteroides xylanisolvens, Bacterionema matruchotii, Blautia hansenii, Corynebacterium matruchotii, Bifidobacterium spp, Buchnera aphidicola, Butyrivibrio crossotus, Butyriviberio fibrosolvens, Campylobacter spp, Campylobacter coli, Campylobacter sputorum, Campylobacter upsaliensis, Candida albicans, Capnocytophaga spp, Clostridium spp, Citrobacter freundii, Clostridium asparagiforme, Clostridium difficile, Clostridium leptum, Clostridium nexile, Clostridium scindens, Clostridium sordellii, Collinsella aerofaciens, Coprococcus comes, Coprococcus eutactus, Corynebacterium spp, Dorea formicigenerans, Dorea longicatena, Eikenella corrodens, Enterobacter cloacae, Enterococcus spp, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, Eubacterium spp, Eubacterium hallii, Eubacterium rectale, Eubacterium siraeum, Eubacterium ventriosum, Faecalibacterium prausnitzii, Flavobacterium spp, Fusobacterium spp, Fusobacterium nucleatum, Gordonia Bacterium spp, Haemophilius parainfluenzae, Haemophilus paraphrophilus, Holdemania filiformis, Lactobacillus spp, Leptotrichia buccalis, Morganella morganii, Mycobacteria spp, Mycoplasma spp, Micrococcus spp, Mycoplasma spp, Mycobacterium chelonae, Neisseria spp, Neisseria sicca, Parabacteroides distasonis, Parabacteroides johnsonii, Parabacteroides merdae, Peptococcus spp, Peptostreptococcus spp, Plesiomonas shigelloides, Porphyromonas gingivalis, Propionibacterium spp, Propionibacterium acnes, Providencia spp, Pseudomonas aeruginosa, Roseburia intestinalis, Ruminococcus bromii, Ruminococcus gnavus, Ruminococcus torques, Ruminococcus lactaris, Ruminococcus obeum, Rothia dentocariosa, Ruminococcus spp, Sarcina spp, Staphylococcus aureus, Staphylococcus epidermidis, Streptococcus anginosus, Streptococcus mutans, Streptococcus oralis, Streptococcus pneumoniae, Streptococcus sobrinus, Streptococcus thermophilus, Streptococcus viridans, Subdoligranulum variabile, Torulopsis glabrata, Treponema denticola, Treponema refringens, Veillonella spp, Vibrio spp, Vibrio sputorum, Wolinella succinogenes и Yersinia enterocolitica. Бактерии, преобладающие в желудочно-кишечном тракте, описаны в публикации Qin et al., (2010) Nature, Vol. 464:4. В некоторых воплощениях антиген получен из бактерий, принадлежащих родам группы: Bacteroides, Clostridium, Dorea, Fusobacterium, Eubacterium, Ruminococcus, Peptococcus, Peptostreptococcus и Bifidobacterium. В другом воплощении антиген получен из Bacteroides. В следующем воплощении антиген получен из белка Bacteroides. Еще в одном воплощении антиген получен из белка интеграза. В следующем воплощении антиген соответствует пептиду, последовательность которого идентична по меньшей мере на 80%, или по меньшей мере приблизительно на 80% последовательности SEQ ID No. 1, или в альтернативном случае идентична по меньшей мере на 85%, или в альтернативном случае по меньшей мере на 90%, или в альтернативном случае по меньшей мере на 95%, или в альтернативном случае по меньшей мере на 98% пептидной последовательности SEQ ID No. 1. В других воплощениях антиген соответствует пептиду, последовательность которого идентична по меньшей мере на 80% пептидным последовательностям SEQ ID Nos. 4-8. Другие антигены, которые могут найти применение включают антигены, индуцирующие Т клетки, способные перекрестно реагировать с антигеном микроорганизма кишечника. Например, эпитоп IGRP206-214 (экспрессируемый бета клетками поджелудочной железы) и NRP-V7 или NRP-A7 (миметик IGRP206-214) можно применять для индукции 8.3-подобных CD8+ Т-клеток, способных перекрестно реагировать с последовательностью BaclYL.
[0102] Антигены по изобретению также включают ЖКТ-ассоциированые антигены, например, известные антигены, связанные с воспалительными заболеваниями кишечника (например, овальбумин), пищевые антигены, такие как маннан дрожжей, глиадин, и известные антигены, связанные с целиакией, такие как глиадин из глютена.
[0103] В некоторых воплощениях размеры белка или полипептида (дикого типа или модифицированного), включая любые комплексы белка или пептида, представляющего интерес, и в частности, гибрида ГКГС-пептид, могут составлять 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1750, 2000, 2250, 2500 молекул аминокислот или более, включая любые диапазоны или значения, которые можно из этого вывести, а также их производные, но не ограничиваться ими. В некоторых аспектах в качестве антигенов могут применяться 5, 6, 7, 8, 9, 10 или более смежных аминокислот, включая их производные, а также фрагменты антигена, такие как аминокислотные последовательности, описанные и упомянутые в данном документе. Предполагается, что полипептиды могут подвергаться мутациям с удалением их части, с их укорочением по сравнению с соответствующей формой дикого типа, а также они могут быть модифицированы путем сшивания или конъюгирования с последовательностью гетерологичного белка, выполняющей конкретную функцию (например, для презентации белкового комплекса, для усиления иммуногенности и т.д.).
[0104] Белковые композиции можно получать любым способом, известным специалистам в данной области, включая (i) экспрессию белков, полипептидов или пептидов при помощи стандартных методов молекулярной биологии, (ii) выделение белковых соединений из естественных источников или (iii) химический синтез белкового материала. Нуклеотидные, а также белковые, полипептидные и пептидные последовательности для различных генов были описаны ранее и могут быть найдены в известных компьютеризированных базах данных. Одной из таких баз данных является базы данных GenBank и GenPept Национального Центра Биотехнологической Информации (National Center for Biotechnology Information) (веб-адрес: ncbi.nlm.nih.gov/). Кодирующие участки этих генов целиком или частично могут быть амплифицированы и/или экспрессированы при помощи методик, описанных здесь или известных специалистам в данной области.
[0105] Варианты аминокислотных последовательностей аутоантигенных эпитопов и других полипептидов в составе данных композиций могут представлять собой варианты с заменами, вставками или делециями. Модификации полипептида по изобретению могут затрагивать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или более смежных или несмежных аминокислот пептида или полипептида по сравнению с вариантом дикого типа.
[0106] В вариантах с делециями, как правило, отсутствует один или более остатков нативной аминокислотной последовательности или последовательности дикого типа. Можно осуществлять делеции как отдельных остатков, так и нескольких смежных аминокислот. Для создания укороченного белка в кодирующую нуклеотидную последовательность может быть введен стоп-кодон (путем замены или вставки). Мутанты со вставками обычно имеют добавочный материал в неконцевых участках полипептида. Сюда могут входить вставки одного или более остатков. Кроме того, могут быть созданы варианты с концевыми надстройками, называемые гибридными белками.
[0107] Варианты с заменами, как правило, имеют замещение одной аминокислоты на другую в одном или более участках белка и могут создаваться для изменения одного или более свойств полипептида, с потерей или без потери других функций или свойств. Замены могут быть консервативными, т.е. одна аминокислота замещается другой аминокислотой со схожей структурой и зарядом. Консервативные замены хорошо известны в области техники и включают, например, замены аланина на серин; аргинина на лизин; аспарагина на глутамин или гистидин; аспартата на глутамат; цистеина на серин; глутамина на аспарагин; глутамата на аспартат; глицина на пролин; гистидина на аспарагин или глутамин; изолейцина на лейцин или валин; лейцина на валин или изолейцин; лизина на аргинин; метионина на лейцин или изолейцин; фениланалина на тирозин, лейцин или метионин; серина на треонин; треонина на серин; триптофана на тирозин; тирозина на триптофан или фенилаланин; и валина на изолейцин или лейцин. В альтернативном случае, замены могут быть неконсервативными, т.е. затрагивать функцию или активность полипептида или пептида, такие как авидность или аффинность к клеточным рецепторам. Неконсервативные замены, как правило, включают замещение остатка на другой, отличающийся по химическим характеристикам, например, замену полярных или заряженных аминокислот на неполярные или незаряженные аминокислоты и наоборот.
[0108] Белки по изобретению могут быть рекомбинантными или синтезированными in vitro. В альтернативном случае рекомбинантный белок может быть выделен из бактерий или других клеток-хозяев.
[0109] Следует понимать, что последовательности аминокислот и нуклеиновых кислот могут включать дополнительные остатки, например, дополнительные N- или C-концевые аминокислоты или 5' или 3' последовательности нуклеиновых кислот, соответственно, и, тем не менее, по существу представлять собой одну из указанных здесь последовательностей, при условии, что последовательность соответствует указанным выше критериям, включая сохранение биологической активности белка (например, иммуногенности). Добавление концевых последовательностей, в частности, распространяется на последовательности нуклеиновых кислот, которые могут, например, содержать различные некодирующие последовательности, фланкирующие либо 5', либо 3' участки кодирующей области.
[0110] Предполагается, что композиции по изобретению содержат приблизительно от 0,001 мг до 10 мг общего белка на миллилитр. Таким образом, концентрация белка в композиции может составлять приблизительно, по меньшей мере приблизительно или не более чем приблизительно 0,001, 0,010, 0,050, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1.0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 50, 100 мкг/мл или мг/мл или более (или любой диапазон, который можно из этого вывести). При этом, комплекс антиген-ГКГС-наночастица может составлять приблизительно, по меньшей мере приблизительно или не более чем приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94,95,96,97,98,99,100%.
[0111] В данном изобретении предусматривается введение комплекса антиген-ГКГС-наночастица для осуществления лечения, направленного против заболевания или патологического состояния, связанного с воспалением желудочно-кишечного тракта.
[0112] Кроме того, патент US 4,554,101 (Hopp), включенный сюда во всей полноте путем ссылки, описывает идентификацию и получение эпитопов, исходя из первичной аминокислотной последовательности, на основании гидрофильных свойств. Способы, описанные Hopp, позволяют специалистам идентифицировать возможные эпитопы в составе аминокислотной последовательности и подтвердить их иммуногенность. Ряд научных публикаций также были посвящены расчетам вторичной структуры и идентификации эпитопов на основании анализа аминокислотных последовательностей (Chou & Fasman, Adv. Enzymol., 47:45-148, 1978; Chous and Fasman, Annu, Rev. Biochem., 47:251-276, 1978, Chou and Fasman, Biochemistry, 13(2):211-222, 1974; Chau and Fasman, Biochemistry, 13(2):222-245, 1974, Chou and Fasman, Biophys. J., 26(3):385-399, 1979). При необходимости, любые из них могут применяться в качестве дополнения к описанию Hopp в патенте US 4,554,101.
[0113] Кроме пептидов в качестве антигенов или антигенных фрагментов в комплексах с молекулами ГКГС могут применяться другие молекулы, включая углеводы, липиды, низкомолекулярные молекулы и т.п., но не ограничиваясь ими. Углеводы являются основными компонентами внешней поверхности многих клеток. Некоторые углеводы характерны для различных стадий дифференцировки и очень часто эти углеводы распознаются специфичными антителами. Экспрессия отдельных углеводов может быть ограничена определенным типом клеток.
D. Субстраты/Наночастицы
[0114] В некоторых аспектах комплексы антиген/ГКГС функционально связаны с субстратом. Субстрат может находиться в форме наночастицы, содержащей биологически совместимый биоабсорбируемый материал. Соответственно, в одном воплощении наночастица является биосовместимой и/или биоабсорбируемой. Субстрат может также быть в форме наночастицы, например, такой как описанная ранее в публикации US 2009/0155292, включенной сюда во всей полноте путем ссылки. Наночастицы могут иметь различные размеры и быть известны под названием наносфер, наночастиц или биологически совместимых биодеградируемых наносфер или биологически совместимых биодеградируемых наночастиц. Такие препараты на основе частиц, содержащие комплекс антиген/ГКГС, могут быть образованы путем ковалентного или нековалентного связывания комплекса с наносферой.
[0115] Обычно наносферы содержат по существу сферическое ядро и могут иметь один или более слоев. Ядро может иметь различный размер и состав. Кроме ядра наносферы могут иметь один или несколько слоев, придающих функциональные свойства, соответствующие практическому применению. Толщина слоев, если таковые имеются, может варьироваться в зависимости от нужд конкретных применений. Например, слои могут придавать необходимые оптические свойства.
[0116] Слои могут также придавать химические или биологические функциональные свойства и обозначаться в данном документе как химически активные или биологически активные слои; для этого слой или слои, как правило, имеют толщину от приблизительно 0,001 микрометра (1 нанометра) до приблизительно 10 микрометров или более (в зависимости от требуемого диаметра наносферы), эти слои обычно наносят на внешнюю поверхность наночастицы.
[0117] Состав ядра и слоев может варьироваться. Подходящие материалы для частиц или для ядра включают полимеры, керамические материалы, стекло, минералы и т.п., но не ограничиватся ими. Примеры включают обычное стекло и стекло специального назначения, двуокись кремния, полистирен, полиэфир, поликарбонат, акриловые полимеры, полиакриламид, полиакрилонитрил, полиамид, фторполимеры, силикон, целлюлозы, кремний, металлы (например, железо, золото, серебро), минералы (например, корунд), наночастицы (например, наночастицы золота, коллоидные частицы, оксиды металлов, сульфиды металлов, селениды металлов и магнитные материалы, такие как оксид железа) и их комбинации, но не ограничиваются ими. Ядро может иметь гомогенный состав или быть комбинацией двух или более классов материалов, в зависимости от требуемых свойств. В некоторых аспектах применяются металлические наночастицы. Эти металлические частицы или наночастицы могут состоять из Au, Pt, Pd, Cu, Ag, Co, Fe, Ni, Mn, Sm, Nd, Pr, Gd, Ti, Zr, Si и In, прекурсоров, их двукомпонентных сплавов, их трехкомпонентных сплавов и их интерметаллических соединений. См. патент US 6,712,997, включенный сюда во всей полноте путем ссылки. В некоторых воплощениях могут быть предложены композиции ядра и слоев, придающие наночастицам биосовместимость и биоабсорбируемость. Ядро может иметь гомогенный состав или быть комбинацией двух или более классов материалов в зависимости от требуемых свойств. В некоторых аспектах применяются металлические наносферы. Эти металлические наночастицы могут состоять из Fe, Са, Ga и т.п.
[0118] Как указано ранее, кроме ядра наночастицы могут иметь один или несколько слоев. Наночастицы могут иметь слой, состоящий из биодеградируемого углевода или другого полимера. Примеры биодеградируемых слоев включают декстран; поли(этилен гликоль); поли(этиленоксид); маннитол; поли(эфиры) на основе полилактида (PLA), полигликолида (PGA), поликапролактона (PCL); поли(гидроксалканоата) класса PHB-PHV; и другие модифицированные поли(сахариды), такие как крахмал, целлюлоза и хитозан, но не ограничиваются ими. Кроме того, наночастицы могут иметь слой с поверхностью, подходящей для присоединения химических функциональных группировок в сайтах химического связывания или присоединения.
[0119] Слои на наночастицах могут быть получены различными способами, известными специалистам. Примеры включают методы золь-гелевой химии, такие как описанные Her, Chemistry of Silica, John Wiley & Sons, 1979; Brinker and Scherer, Sol-gel Science, Academic Press, (1990). Другие способы получения слоев на наночастицах включают методы химии поверхностных явлений и инкапсулирования, такие как описанные Partch and Brown, J. Adhesion, 67:259-276, 1998; Pekarek et al., Nature, 367:258, (1994); Hanprasopwattana, Langmuir, 12:3173-3179, (1996); Davies, Advanced Materials, 10:1264-1270, (1998); и в указанных в них ссылках. Также могут применяться технологии газофазного осаждения; см., например Golman and Shinohara, Trends Chem. Engin., 6:1-6, (2000); и патент US 6,387,498. Другие способы включают методики послойной самосборки, например, описанные Sukhorukov et al., Polymers Adv. Tech., 9(10-11):759-767, (1998); Caruso et al., Macromolecules, 32(7):2317-2328, (1998); Caruso et al., J. Amer. Chem. Soc., 121(25):6039-6046, (1999); в патенте US 6,103,379 и приведенных в них ссылках.
[0120] Наночастицы могут быть образованы при взаимодействии водной фазы, содержащей комплекс антиген/ГКГС /ко-стимулярующая молекула и полимер, с безводной фазой, с последующим выпариванием безводной фазы, обеспечивающим коалесценцию частиц в водной фазе, согласно описанию в патенте US 4,589,330 или US 4,818,542. Предпочтительные полимеры для таких препаратов представляют собой естественный или синтетические сополимеры или полимеры, выбранные из группы, состоящей из желатина, агара, крахмала, арабиногалактана, альбумина, коллагена, полигликолевой кислоты, полимолочной кислоты, гликолид-L(-) лактид поли(эпсилон-капролактона), поли(эпсилон-капролактон-CO-молочной кислоты), поли(эпсилон-капролактон-CO-гликолевой кислоты), поли(β-гидроксимасляной кислоты), поли(этиленоксида), полиэтилена, поли(алкил-2-цианоакрилата), поли(гидроксиэтилметакрилата), полиамидов, поли(аминокислот), поли(2-гидроксиэтил DL-аспартамида), поли(эфирмочевины), поли(L-фенилаланин/этилен гликоль/1,6-диизоцианатогексана) и поли(метилметакрилата). Наиболее предпочтительными полимерами являются полиэфиры, такие как полигликолевая кислота, полимолочная кислота, гликолид-L(-) лактид поли(эпсилон-капролактон), поли(эпсилон-капролактон-CO-молочная кислота) и поли(эпсилон-капролактон-CO-гликолевая кислота). Растворители, подходящие для растворения полимеров, включают: воду, гексафлуороизопропанол, метиленхлорид, тетрагидрофуран, гексан, бензол или гексафлуороацетон полуторагидрат.
[0121] Размер наночастиц может варьироваться приблизительно от 1 нм до 1 мкм. В некоторых воплощениях размер наночастицы менее чем приблизительно 1 мкм. В других воплощениях размер наночастицы менее чем приблизительно 500 нм, менее чем приблизительно 400 нм, менее чем приблизительно 300 нм, менее чем приблизительно 200 нм, менее чем приблизительно 100 нм, или менее чем приблизительно 50 нм. В следующих воплощениях размер наночастицы составляет приблизительно от 1 нм до 15 нм или приблизительно до 30 нм, 50 нм, 75 нм или 100 нм. В следующих воплощениях размер наночастицы составляет приблизительно от 5 нм до 50 нм. В другом воплощении наночастица имеет диаметр приблизительно от 5 до 15 нм.
Е. Связывание комплекса антиген-ГКГС с наночастицей
[0122] Для связывания субстрата или наносфер с комплексами антиген-ГКГС могут использоваться следующие способы.
[0123] Связывание можно осуществлять при помощи химической модификации субстрата или наночастицы, что как правило, включает создание на поверхности «функциональных групп», причем указанные функциональные группы способны связываться с комплексами антиген-ГКГС, и/или присоединение ковалентно или нековалентно связанных так называемых «линкерных молекул» к возможно химически модифицированной поверхности субстрата или наночастицы с последующим вступлением в реакцию комплекса антиген-ГКГС и полученных наночастиц.
[0124] Термин «линкерная молекула» означает вещество, способное присоединяться к субстрату или наночастице, а также способное присоединяться к комплексу антиген-ГКГС.
[0125] Термин «функциональные группы», использованный ранее в данном описании, не ограничивается реакционноспособными химическим группами, образующими ковалентные связи, но также включает химические группы, обеспечивающие ионные взаимодействия или водородные связи в составе комплекса антиген-ГКГС. Кроме того, следует отметить, что строгое разделение между «функциональными группами», образованными на поверхности, и линкерными молекулами, несущими «функциональные группы», невозможно, поскольку в некоторых случаях для модификации поверхности требуется взаимодействие с поверхностью наносферы более мелких линкерных молекул, таких как этиленгликоль.
[0126] Функциональные группы или несущие их линкерные молекулы могут быть выбраны из аминогрупп, карбоксильных групп, тиолов, тиоэфиров, дисульфидов, гуанидинов, гидроксильных групп, аминогрупп, вицинальных диолов, альдегидов, групп альфа-галоацетила, ртутьорганических соединений, эфирных групп, галоидангидрида, тиоэфиров кислот, ангидридов кислот, изоцианатов, изотиоцианатов, галидов сульфоновой кислоты, имидоэфиров, диазоацетатов, солей диазония, 1,2-дикетонов, фосфоновых кислот, эфиров фосфорной кислоты, сульфоновой кислоты, азолидов, имидазолов, индолов, N-малеимидов, альфа-бета-ненасыщенных карбонильных соединений, арилгалогенидов или их производных.
[0127] Другими не являющимися исчерпывающими примерами линкерных молекул с более высоким молекулярным весом являются молекулы нуклеиновых кислот, полимеры, сополимеры, полимеризуемые связывающие агенты, кремний, белки и молекулы цепочечного типа, имеющие поверхность с зарядом противоположным по отношению к субстрату или наносфере. Нуклеиновые кислоты могут образовывать связи с молекулами, обладающими аффинностью, в свою очередь содержащими молекулы нуклеиновых кислот, последовательность которых комплементарна по отношению к линкерной молекуле.
[0128] Конкретный пример ковалентного линкера включает поли(этилен)гликоль (ПЭГ). ПЭГ-линкер может представлять собой линкер тиол-ПЭГ-NH2.
[0129] В некоторых воплощениях описанный в данном документе линкер имеет определенную длину. В некоторых воплощениях длина линкера составляет менее чем приблизительно 10 кДа, менее чем приблизительно 5 кДа, менее чем приблизительно 4,5 кДа, менее чем приблизительно 4 кДа, менее чем приблизительно 3,5 кДа, менее чем приблизительно 3 кДа, менее чем приблизительно 2,5 кДа, менее чем приблизительно 2 кДа или менее чем приблизительно 1 кДа. В следующих воплощениях длина линкера составляет приблизительно от 0,5 кДа до 5, 4,5, 4, 3,5, 3, 2,5, 2, 1,5 или 1 кДа. В других воплощениях длина линкера составляет приблизительно от 1 до 4,5, 4, 3,5, 3, 2,5, 2 или 1,5 кДа.
[0130] В качестве примеров полимеризуемых связывающих агентов можно назвать диацетилен, сополимер бутадиена и стирола, винилацетат, акрилат, акриламид, винильные соединения, стирол, оксид кремния, оксид бора, оксид фосфора, бораты, пиррол, полипиррол и фосфаты.
[0131] Поверхность субстрата или наночастицы может быть химически модифицирована, например, путем присоединения производных фосфоновой кислоты, имеющих реакционноспособные функциональные группировки. Одним из примеров производных фосфоновой кислоты или эфиров фосфоновой кислоты является имино-бис(метиленфосфоно)угольная кислота, которая может быть синтезирована в ходе реакции Манниха. Эта реакция связывания может быть проведена с субстратом или наносферой, как непосредственно полученными в ходе процесса изготовления, так и после предварительной обработки (например, триметилсилилбромидом). В первом случае производные (эфиров) фосфоновой кислоты могут, например, вытеснять компоненты реакционной среды, которые по-прежнему связаны с поверхностью. Такое замещение может быть усилено при более высоких температурах. С другой стороны, считается, что триметилсилилбромид деалкилирует комплексообразующие агенты на основе фосфора, содержащие алкильные группы, таким образом, способствуя образованию новых сайтов связывания для производных (эфиров) фосфоновой кислоты. Производное (эфиров) фосфоновой кислоты или связанные с ним линкерные молекулы могут экспонировать те же функциональные группы, которые указаны выше. Другой пример обработки поверхности субстрата или наносферы включает нагревание в диоле, таком как этилен гликоль. Следует отметить, что такая обработка может быть излишней, если синтез уже проведен в диоле. В этом случае продукт синтеза, полученный напрямую, скорее всего будет обладать необходимыми функциональными группами. Такая обработка, тем не менее, может применяться для субстрата или наночастицы, которые были получены в N- или P-содержащих комплексообразующих агентах. Если такой субстрат или частица подвергаются последующей обработке этиленгликолем, компоненты реакционной среды (например, комплексообразующий агент) по-прежнему связывающиеся с поверхностью, могут быть заменены на диол и/или могут быть деалкилированы.
[0132] Возможно также заменить N-содержащие комплексообразующие агенты, все еще связанные с поверхностью частицы, на производные первичных аминов, имеющие вторую функциональную группу. Поверхность субстрата или наночастицы также может быть покрыта кремнием. Кремний позволяет относительно просто осуществлять химическую конъюгацию органических молекул, поскольку кремний легко реагирует с органическими линкерами, такими как триэтоксисилан или хлоросилан. Поверхность наночастицы может также быть покрыта гомо- или сополимерами. Примерами полимеризуемых связывающих агентов являются N-(3-аминопропил)-3-меркаптобензамидин, 3-(триметоксисилил)пропилгидразид и 3-триметоксисилил)пропилмалеимид. Здесь упомянуты другие, не являющиеся исчерпывающими примеры полимеризуемых связывающих агентов. Эти связывающие агенты могут применяться по-отдельности или в комбинации, в зависимости от типа сополимера, который требуется получить в качестве покрытия.
[0133] Другим способом модификации поверхности, который может применяться к субстратам или наночастицам, содержащим оксидные соединения переходных металлов, является конверсия оксидных соединений переходных металлов в соответствующие оксихлориды под воздействием газообразного хлора или органических хлорирующих агентов. Такие оксихлориды способны вступать в реакцию с нуклеофилами, такими как гидрокси- или аминогруппы, часто встречающиеся в биомолекулах. Эта методика позволяет осуществить непосредственное конъюгирование с белками, например, через аминогруппу боковой цепи лизина. Конъюгирование с белками после модификации поверхности с помощью оксихлоридов также можно осуществить с использованием бифункционального линкера, такого как гидразид малеимидопропионовой кислоты.
[0134] Для методов нековалентного связывания особенно подходят молекулы цепочечного типа, имеющие полярность или заряд, противоположный по отношению к поверхности субстрата или наносферы. Примеры линкерных молекул, которые могут быть нековалентно связаны с наносферами типа ядро/оболочка, включают анионные, катионные или цвиттер-ионные сурфактанты, кислые или основные белки, полиамины, полиамиды, полисульфоны или поликарбоновую кислоту. Необходимую связь может обеспечить гидрофобное взаимодействие между субстратом или наносферой и амфифильным реагентом, имеющим реакционноспособную функциональную группу. В частности, можно применять молекулы цепочечного типа с амфифильными свойствами, такие как фосфолипиды или производные полисахаридов, которые могут быть связаны друг с другом. Абсорбирования этих молекул на поверхности можно легко добиться при совместной инкубации. Образование связи между молекулами, обладающими аффинностью, и субстратом или наночастицей также может быть основано на нековалентных самоорганизующихся связях. Один из таких примеров включает простые детекторные зонды с биотином в качестве линкерной молекулы и авидин- или стрептавидин-связанными молекулами.
[0135] Протоколы реакций для связывания функциональных групп с биологическими молекулами могут быть найдены в литературе, например, в "Bioconjugate Techniques" (Greg Т. Hermanson, Academic Press 1996). Биологические молекулы (например, молекула ГКГС или ее производные) могут быть связаны с линкерной молекулой, ковалентно или нековалентно, в соответствии со стандартными методами органической химии, такими как окисление, галогенизация, алкилирование, ацилирование, присоединение, замещение или амидирование. Эти способы присоединения ковалентно или нековалентно связанных линкерных молекул могут осуществляться до или после связывания линкерной молекулы с субстратом или наносферой. Кроме того, при помощи инкубации можно добиться прямого связывания молекул с субстратом или наносферами, предварительно обработанными соответствующим образом (например, триметилсилил бромидом), и имеющими модифицированную поверхность вследствие такой предварительной обработке (например, поверхность с более высоким зарядом или полярностью).
F. Получение белков
[0136] В данном изобретении описаны полипептиды, пептиды и белки для применения в различных воплощениях данного изобретения. Например, оценивается способность определенных белков и их комплексов вызывать или модулировать иммунный ответ. В определенных воплощениях все или часть пептидов или белков по изобретению могут быть синтезированы в растворе или на твердой основе в соответствии с известными методами. Различные устройства, обеспечивающие автоматический синтез, доступны для приобретения и могут применяться в соответствии с известными протоколами. См., например, Stewart and Young, Solid Phase Peptide Synthesis, 2nd. Ed., Pierce Chemical Co. I, (1984); Tam et al., J. Am. Chem. Soc, 105:6442, (1983); Merrifield, Science, 232(4748):341-347, (1986); and Barany and Merrifield, The Peptides, Gross and Meinhofer (Eds.), Academic Press, NY, 1-284, (1979), включенные сюда путем ссылки. Альтернативно, может использоваться технология рекомбинантных ДНК, когда нуклеотидная последовательность, кодирующая пептид по изобретению, встраивается в вектор экспрессии, после чего им трансформируют или трансфецируют соответствующую клетку-хозяина и проводят культивирование при условиях, обеспечивающих экспрессию.
[0137] Одно воплощение изобретения включает перенос генов в клетки, в том числе микроорганизмы, для продукции белков. Геном нужного белка можно трансфецировать соответствующие клетки-хозяева с последующим культивированием клеток при соответствующих условиях. Можно использовать нуклеиновую кислоту, кодирующую по существу любой полипептид. Конструирование рекомбинантных векторов экспрессии и входящих в их состав элементов, известно специалистам в данной области и кратко описано в данном документе. Примеры линий клеток-хозяев млекопитающих включают клетки Vera и HeLa, другие В- и T-клеточные линии, такие как СЕМ, 721.221, Н9, Jurkat, Raji, а также линии клеток яичников китайского хомячка, W138, BHK, COS-7, 293, HepG2, 3Т3, RIN и MDCK, но не ограничиваются ими. Кроме того, можно выбрать линию клеток-хозяев, которая будет регулировать экспрессию встроенных последовательностей или модифицировать и осуществлять процессинг генного продукта необходимым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут иметь важное значение для функций белка. Различные клетки-хозяева имеют характерные и специфичные механизмы пост-трансляционного процессинга и модификации белков. Соответствующие клеточные линии или системы клеток-хозяев можно выбирать для обеспечения надлежащей модификации и процессинга экспрессируемого чужеродного белка.
[0138] Можно применять ряд систем селекции, включая гены HSV тимидин киназы, гипоксантин-гуанин фосфорибозилтрансферазы и аденин фосфорибозилтрансферазы в tk-, hgprt- или aprt-клетках, соответственно, но не ограничиваться ими. Кроме того, селекция может быть основана на использовании устойчивости к антиметаболитам: гена dhfr, обусловливающего устойчивость к триметоприму и метотрексату; gpt, обусловливающего устойчивость к микофеноловой кислоте; neo, обусловливающего устойчивость к аминогликозиду G418; и hygro, обусловливающего устойчивость к гигромицину.
G. Нуклеиновые кислоты
[0139] Данное изобретение может включать рекомбинантные полинуклеотиды, кодирующие белки, полипептиды и пептиды по изобретению, например, такие как SEQ ID No. 1, 2 или 3. Последовательности нуклеиновых кислот приведенных в качестве примера антигенов и молекул ГКГС, презентирующих антигены, находятся в рамках изобретения и могут применяться для получения комплексов антиген-ГКГС.
[0140] В конкретных воплощениях изобретение касается выделенных сегментов нуклеиновых кислот и рекомбинантных векторов, в которые встроены последовательности нуклеиновых кислот, кодирующие аутоантиген и/или молекулу ГКГС. Термин «рекомбинантный» может употребляться в отношении полипептида или названия определенного полипептида и, как правило, обозначает полипептид, кодируемый молекулой нуклеиновой кислоты, с которой были проведены манипуляции in vitro или которая является продуктом репликации подобной молекулы.
[0141] Сегменты нуклеиновых кислот, применяемых в данном изобретении, независимо от длины самой кодирующей последовательности, можно комбинировать с другими последовательностями нуклеиновых кислот, например, промоторами, сигналами полиаденилирования, дополнительными сайтами рестрикции, сайтами множественного клонирования, другими кодирующими сегментами и т.п., при этом их общая длина может существенно варьироваться. Таким образом, предполагается, что можно использовать фрагмент нуклеиновой кислоты практически любой длины, предпочтительно, общая длина будет ограничиваться удобством получения и применения в необходимых протоколах, касающихся рекомбинантных нуклеиновых кислот. В некоторых случаях последовательность нуклеиновой кислоты может кодировать полипептидную последовательность с дополнительными гетерологичными кодирующими последовательностями, например, обеспечивающими очистку полипептида, транспорт, секрецию, пост-трансляционные модификации или преимущества при терапии, например, адресное воздействие или эффективность. К последовательности, кодирующей модифицированный полипептид, может быть добавлена метка (тэг) или иной гетерологичный пептид, в этом случае «гетерологичный» будет обозначать полипептид, отличающийся от модифицированного полипептида.
IV. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ВВЕДЕНИЕ
[0142] В данном описании предложены фармацевтические композиции, котрые могут найти применение в лечении заболевания.
А. Фармацетические композиции
[0143] В обычной практике композиции по изобретению можно вводить парентерально, путем инъекции, например, внутривенно, подкожно или внутримышечно. Другие композиции, которые подходят для других способов введения, включают оральные препараты. Композиии для орального введения включают такие обычно применяемые эксципиенты, как, например, маннитол, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния фармацевтической степени чистоты и т.п. Эти композиции могут находиться в форме растворов, суспензий, таблеток, пилюль, капсул, препаратов с пролонгированным высвобождением или порошков и содержать приблизительно от 10% до приблизительно 95% активного ингредиента, предпочтительно приблизительно от 25% до приблизительно 70%. Приготовление водной композиции, содержащей комплекс антиген-ГКГС-наночастица, влияющий на иммунную систему субъекта, будет очевидным для специалиста в данной области в свете данного описания. В некоторых воплощениях композицию можно ввдить путем ингалации (например, патент US 6,651,655, включенный сюда во всей полноте путем ссылки). В одном воплощении комплекс антиген-ГКГС-наночастица вводят системно.
[0144] Обычно композиции по изобретению вводят способом, подходящим для лекарственных форм, и в количестве, которое будет обеспечивать терапевтическую эффективность и иммуномодулирующий эффект. Количество, которое требуется ввести, зависит от субъекта, которому проводится лечение. Точное количество активного ингредиента, которое требуется ввести, определяется специалистом-практиком. При этом подходящий диапазон дозировок составляет от десяти до нескольких сотен нанограммов или микрограммов комплекса антиген-ГКГС-наночастица на одно введение. Режимы, подходящие для первоначального и бустерного введения, также могут варьироваться, но обычно за первоначальным введением следуют повторные введения.
[0145] Во многих случаях необходимо многократное введение комплексов пептид-ГКГС-наночастица, приблизительно, не более чем, или по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10 или более введений. Введения, как правило, занимают интервал от 2 дней до двенадцати недель, чаще от одной до двух недель. Для поддержания необходимого состояния иммунной системы может быть полезным периодически повторять введения с интервалом 0,5-5 лет, обычно через 2 года. После курса введений можно провести оценку воспалительного иммунного ответа и/или активности ауторегуляторных противовоспалительных Т клеток.
[0146] В некоторых воплощениях субъекту вводят фармацевтические композиции. Различные аспекты данного изобретения включают введение субъекту эффективного количества композиции, содержащей комплексы антиген-ГКГС-наночастица. Кроме того, такие композиции можно вводить в сочетании с иммуномодуляторами. Такие композиции, как правило, бывают растворены или диспергированы в фармацевтически приемлемом носителе или водной среде.
[0147] Выражения «фармацевтически приемлемый» или «фармакологически приемлемый» обозначают молекулярные частицы и композиции, которые не вызывают нежелательных, аллергических или иных побочных реакций при введении животному или человеку. В данном документе «фармацевтически приемлемый носитель» включает любые возможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие всасывание агенты и т.п. Применение таких сред и агентов для фармацевтически активных субстанций хорошо известно в данной области техники. За исключением случаев, когда какая-либо стандартная среда или агент несовместимы с активными ингредиентами, подразумевается их применение в иммунногенных и терапевтических композициях.
[0148] Лекарственные формы, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии; препараты, содержащие кунжутное масло, арахисовое масло или водный раствор пропиленгликоля; а также стерильные порошки для приготовления стерильных растворов или дисперсий для инъекций непосредственно перед введением. В любом случае, лекарственные формы должны быть стерильны и должны быть жидкими до такой степени, чтобы их можно было легко инжектировать. Они также должны сохранять стабильность в условиях производства и хранения и должны быть защищены от контаминирующего действия микроорганизмов, таких как бактерии и грибы.
[0149] Композиции могут быть изготовлены в нейтральной форме или в форме солей. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (образованные при участии свободных аминогрупп белков) и образованные при участии неорганических кислот, например, таких как соляная или фосфорная кислоты, или таких органических кислот, как уксусная, щавелевая, винная, миндальная и т.п. Соли, образованные при участии свободных карбоксильных групп, могут также быть производными неорганических оснований, например, таких как оксиды натрия, калия, аммония, кальция и железа, и таких органических оснований как изопропиламин, триметиламин, гистидин, прокаин и т.п.
[0150] Носитель может также представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерол, пропиленгликоль и жидкий поли(этиленгликоль) и т.п.), их соответствующие смеси и растительные масла. Необходимое жидкое состояние можно поддерживать, например, при помощи покрытия, такого как лецитин, за счет поддержания требуемого размера частиц в случае дисперсий и за счет применения сурфактантов. Предупредить воздействие микроорганизмов можно при помощи различных антибактериальных и противогрибковых агентов, например, парабенов, хлоробутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительным включение изотонических агентов, например, сахара или хлорид натрия. Пролонгированного всасывания инъекционных композиций можно добиться за счет использования в композициях агентов, замедляющих всасывание, например, моностеарата алюминия и желатина.
[0151] Стерильные инъекционные растворы изготавливают путем включения активных соединений в необходимом количестве в соответствующий растворитель с другими различными ингредиентами, перечисленными выше, при необходимости, с последующей стерилизацией. Стерилизация раствора должна выполняться таким образом, чтобы не снижать антипатогенных свойств комплекса антиген-ГКГС-наночастица. Как правило, дисперсии изготавливают путем включения различных стерилизованных активных ингредиентов в стерильный носитель, содержащий основную дисперсионную среду и другие необходимые ингредиенты из тех, что были перечисленных выше. В случае, когда стерильные инъекционные растворы изготавливают из стерильных порошков, предпочтительными способами изготовления являются методы вакуумной сушки и сублимационной сушки, которые позволяют получить активный ингредиент в виде порошка, также содержащего любой дополнительный подходящий ингредиент из предварительно стерилизованного раствора. Одним из таких способов стерилизации раствора является стерилизация фильтрованием, однако, данное изобретение предусматривает любой способ стерилизации, который существенным образом не снижает антипатогенных свойств комплексов антиген-ГКГС-наночастица. Способы стерилизации, включающие интенсивное нагревание и давление, такие как автоклавирование, могут нарушить третичную структуру комплекса, таким образом существенно понизив терапевтические свойства комплексов антиген-ГКГС-наночастица.
[0152] Эффективное количество терапевтической композиции определяется в зависимости от намеченной цели. Термин «разовая доза» или «доза» обозначает физически дискретные единицы, пригодные для применения у субъекта, каждая единица содержит предопределенное количество композиции, рассчитанное для получения желаемого ответа на фоне ее введения, как обсуждалось выше, т.е. при соответствующем способе и режиме. Количество, которое необходимо ввести, в том числе количество процедур и доз, зависит от желаемого результата и/или желаемой степени защиты. Точное количество композиции также зависит от мнения лечащего врача и является индивидуальным для каждого субъекта. Факторы, влияющие на дозу, включают физическое и клиническое состояние индивида, способ введения, желаемую цель лечения (облегчение симптомов или излечение), а также активность, стабильность и токсичность конкретной композиции. После изготовления растворы вводят подходящим для дозированного состава способом в количестве, которое будет терапевтически или профилактически эффективным. Препараты удобно вводить в виде различных лекарственных форм, например, в виде инъекционных препаратов, описанные выше.
В. Комбинированная терапия
[0153] Композиции и способы данного изобретения, в частности введение комплексов антиген-ГКГС-наночастица, можно также применять в комбинации с введением стандартных лекарственных средств. Они включают противовоспалительные лекарства, такие как сульфасалазин, кортикостероиды, такие как преднизон, и иммунодепрессанты, такие как азатиоприн и меркаптопурин. Антибиотик, например, метронидазол, может также способствовать уничтожению возбудителей инфекции в кишечнике.
[0154] Для большей эффективности лечения симптомов врач может назначить противодиарейные средства, слабительные, обезболивающие или другие отпускаемые без рецепта препараты. Людям, страдающим более болезнью Крона в более тяжелой форме, обычно назначают стероиды. При более агрессивных заболеваниях стероиды можно применять наряду с иммунодепрессантами или с новым препаратом под названием инфликсимаб.
[0155] При использовании комбинированной терапии можно применять различные комбинации, например, "А" обозначает введение комплекса антиген-ГКГС-наночастица, а "В" обозначает дополнительный агент:

[0156] Введение пациенту/субъекту композиций, содержащих комплексы пептид-ГКГС по данному изобретению, будет следовать общепринятым протоколам введения таких соединений, учитывая токсичность, если таковая существует. Циклы лечения можно повторять по мере необходимости. В сочетании с описанной терапией также можно проводить различные виды стандартной терапии, например, гидратирование.
С. Введение In Vitro или Ex Vivo
[0157] В данном документе термин введение in vitro обозначает манипуляции, проводимые с клетками, извлеченными из организма субъекта, или вне организма субъекта, включая, но не ограничиваясь культурами клеток. Термин введение ех vivo обозначает клетки, с которыми были проведены манипуляции in vitro, и которые затем вводят субъекту. Термин введение in vivo включает все манипуляции, проводимые внутри организма субъекта, включая введение.
[0158] В некоторых аспектах данного изобретения композиции можно вводить либо in vitro, ex vivo, либо in vivo. В некоторых in vitro воплощениях с композициями по данному изобретению инкубируют аутологичные Т клетки. Затем клетки можно применять в исследованиях in vitro, или в альтернативном случае, для введения ех vivo.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0159] Следующие примеры приведены в целях иллюстрации различных воплощений изобретения и никоим образом не ограничивают рамки данного изобретения. Специалисты без труда определят, что данное изобретение способно обеспечить реализацию назначений и достижение результатов и преимуществ, указанных в данном описании, а также назначений, результатов и преимуществ, присущих данному изобретению. Данные примеры в совокупности с описанными здесь способами, являются репрезентативными для предпочтительных воплощений, приводятся в качестве примеров и не ограничивают рамки изобретения. Специалистам в данной области могут быть очевидны модификации и другие применения, находящиеся в духе изобретения, границы которого определены формулой изобретения.
Пример 1. Интеграза Bacteroides как антиген-мишень ауторегуляторных Т-клеток, подобных клеткам памяти
[0160] Исследовали способность нового эпитопа интегразы Bacteroides (BaclYL: SEQ ID No. 1) связываться с молекулой H-2Kd главного комплекса гистосовместимости класса I мышей NOD в большом диапазоне концентраций, в сравнении с TUM (положительным контролем), IGRP206-214 и Gp33, кодируемого вирусом лимфоцитарного хориоменингита (LCMV, от англ. lymphocytic choriomeningitis virus) (Db-связывающий отрицательный контроль). Как показано на Фиг. 1А, последовательность BaclYL (SEQ ID No. 1) связывалась с молекулами Kd на поверхности клеток RMA-SKd, не имеющих транспортера, связанного с процессингом антигена (ТАР, от англ. Transporter-Associated with Antigen-Processing), также эффективно, как IGRP206-214 и TUM.
[0161] Для выяснения, может ли комплекс BaclYL/Kd пептид-ГКГС (пГКГС) распознаваться IGRP206-214-реактивными CD8+ Т-клетками, наивные CD8+ Т-клетки селезенки 8.3-TCR-трансгенных мышей NOD (8.3-NOD) окрашивали конъюгированными с флуорохромом тетрамерами TUM/Kd (отрицательный контроль), NRP-V7/Kd (положительный контроль) и BaclYL/Kd пГКГС. Как показано на Фиг. 1В, 8.3-CD8+ Т-клетки эффективно связывались с тетрамерами Bac-IYL/Kd, хотя и с более низкой средней интенсивностью флуоресценции (MFI, от англ. mean fluorescence intensity), чем с тетрамерами IGRP206-214/Kd, что позволяло предположить, что 8.3-TCR связывается с этим комплексом пГКГС с низкой аффинностью. Это подтвердили с помощью распределения Скэтчарда, отражающего равновесное связывание тетрамеров. Как показано на Фиг. 1С, авидность связывания тетрамеров Bac-IYL/Kd с 8.3-CD8+ Т-клетками была ниже приблизительно в 2 раза.
[0162] Для исследования, обладает ли последовательность Bac-IYL агонистической активностью в отношении наивных 8.3-CD8+ Т-клеток, наивные 8.3-CD8+ Т-клетки культивировали в присутствии TUM (отрицательный контроль), IGRP206-214 (положительный контроль) и Bac-IYL в течение 24h. В отличие от IGRP206-214, который повышал экспрессию как CD44, так и CD69, Bac-IYL повышал экспрессию только CD69 (Фиг. 2А). Это указывает, что Bac-IYL обладает свойствами частичного агониста, что согласуется с низкой авидностью связывания соответствующих тетрамеров, как показано на Фиг. 1С. Поскольку дифференцированные 8.3-цитотоксические Т-лимфоциты (8.3-CTL) не уничтожают BaclYL-активированные мишени или клетки HEK293-Kd, трансфецированные кДНК, кодирующей интегразу, эти данные свидетельствуют, что BaclYL может связывать и 'приводить в действие' 8.3-TCR, не запуская большинство программ активации Т-клеток в сигнальном пути TCR.
[0163] Поскольку некоторые лиганды, связывающие TCR с низкой авидностью, проявляют антагонистические свойства (помимо свойств частичного агониста при высокой плотности лиганда), исследовали способность Bac-IYL быть антагонистом IGRP206-214-индуцированного ответа 8.3-CD8+ Т-клеток. Как показано на Фиг. 2В, Bac-IYL, но не TUM (Kd-связывающий пептид, не распознающийся 8.3-TCR) был антагонистом IGRP206-214-индуцированного ответа 8.3-CD8+ Т-клеток (секреции IFNγ и пролиферации) в диапазоне концентраций (выше 1 мкМ). Следовательно, при презентации 8.3-CD8+ Т-клеткам в изолированном виде Bac-IYL связывается с 8.3-подобными TCR с низкой авидностью, является антагонистом агонист-индуцированного ответа при относительно низкой плотности лиганда и действует как частичный агонист при высокой плотности лиганда.
[0164] Не будучи связанным какой-либо теорией, считается что in vivo Bac-IYL, кодируемый доминирующими штаммами бактерий кишечника, презентируется не в изолированном виде, а скорее в присутствии лигандов бактериальных toll-подобных рецепторов, таких как LPS. Это в свою очередь может нивелировать антагонистические свойства Bac-IYL и способствовать проявлению его агонистической активности. Наивные 8.3-CD8+ Т-клетки демонстрировали эффективную секрецию IFNγ и пролиферацию в ответ на Bac-IYL в присутствии LPS (Фиг. 2С), что согласовывалось с данной гипотезой.
[0165] Антигенные пептиды, кодируемые бактериями, должны отщепиться от полноразмерного белка-донора специализированными антигенпрезентирующими клетками (АПК, такими как дендритные клетки - ДК). В случае пептида Bac-IYL, его белок-донор, интеграза Bacteroides, дожна подвергнуться процессингу протеасомой и полученные пептиды транспортироваться в ЭПР для связывания с эндогенными молекулами ГКГС (Kd), которые затем переносятся на плазматическую мембрану АПК для презентации Т-клеткам. Для исследования способности ДК процессировать белок интегразу Bacteroides с образованием комплексов Bac-IYL/Kd, способных запускать активацию 8.3-CD8+ Т-клеток, были получены и очищены рекомбинантные препараты меченой GST интегразы, кодирующие последовательность Bac-IYL дикого типа или мутантный эпитоп Bac-IYL, идентичный IGRP206-214. Затем рекомбинантные белки «скормили» дендритным клеткам (в присутствии LPS), которые в свою очередь привели в контакт с 8.3-CD8+ Т-клетками для измерения активации 8.3-CD8+ Т-клеток. Как показано на Фиг. 2D, оба типа рекомбинантных препаратов интегразы вызывали активацию 8.3-CD8+ Т-клеток, в особенности препарат, кодирующий IGRP206-214, как и предполагалось. Таким образом, ДК способны процессировать интегразу Bacteroides, при этом образуются эпитопы, способные запускать активацию распознающих их Т-клеток.
[0166] Поскольку в ответ на хроническую аутоантигенную стимуляцию низкоавидные аутореактивные Т-клетки склонны дифференцироваться в подобные клеткам памяти энергичные (не пролиферирующие, но секретирующие цитокины) ауторегуляторные (подавляющие аутоиммунные заболевания) Т-клетки, предположили, что Bac-IYL может индуцировать in vitro 8.3-CD8+ Т-клетки, подобные клеткам памяти. Как показано на Фиг. 3А, 8.3-CD8+ Т-клетки (но не низкоавидные IGRP206-214-реактивные 17.6-CD8+ Т-клетки), культивируемые в присутствии пептида Bac-IYL в течение 28 дней, экспрессируют поздний маркер активации Т-клеток CD44 и низкий уровень маркера наивных Т-клеток CD62L. Кроме этого, эти клетки экспрессируют ранний маркер активации CD69 и CD122, маркер Т-клеток памяти (Фиг. 3B). В функциональном отношении эти клетки вели себя как Т-клетки памяти. Так, они быстро вырабатывали IFNg в ответ на активированные агонистом (IGRP206-214) ДК (Фиг. 3C и D). Однако, в отличие от обычных CD8+ Т-клеток, подобных клеткам памяти, и аналогично ауторегуляторным CD8+ Т-клеткам, они демонстрировали отсутствие пролиферативного ответа (анергию) при сравнении с наивными 8.3-CD8+ Т-клетками (Фиг. 3D). Следовательно, эти активированные Bac-IYL CD8+ Т-клетки несут все отличительные признаки ауторегуляторных CD8+ Т-клеток, которые спонтанно образуются in vivo в ответ на хроническую аутоантигенную стимуляцию.
[0167] Было отмечено, что у мышей TCRa-/- ВЗК могут развиваться спонтанно (см., например, Mombaerts, P., et al. (1993) Cell 75:274-282.) или в ответ на DSS (см., например, Mahler, М., et al. (1998) Am J Physiol 274:G544-551.), и линия NOD также подвержена DSS-индуцированным ВЗК (см., например, Mahler, М., et al. (1998) Am J Physiol 274:G544-551.). Известно, что в инициации, прогрессировании и регуляции ВЗК играют роль несколько факторов, например, наследственные факторы, факторы внешней среды, состав микрофлоры кишечника, структура эпителиального слоя кишечника, а также элементы врожденного и адаптивного иммунитета, хотя механизмы их влияния мало изучены. ВЗК определяют как воспаление подслизистого и эпителиального слоев стенки кишечника (см., например, Nell, S., et al. Nat Rev Microbiol 8:564-577; Maloy, K.J., et al. Nature 474:298-306; Khor, В., et al. Nature 474:307-317; and Kaser, A., et al. (2010) Annu Rev Immunol 28:573-621). Для исследования биологической значимости распознавания BaclYL36-44 соответствующими CD8+ Т-клетками при ВЗК, заявители сравнили подверженность заболеванию 8.3- и 17.6-TCR-трансгенных мышей NOD.IGRP206-214-/- (несущих IGRP206-214-специфические CD8+ Т-клетки, способные распознавать или не распознавать BaclYL36-44, соответственно). Мыши получали 2% DSS в питьевой воде в течение 1 недели, что приводило к нарушению целостности эпителия кишечника и контакту микробиоты кишечника с кишечно-ассоциированной лимфоидной тканью (КАЛТ) без развития явных признаков заболевания (кровотечения или потери веса). После недельного промежутка (0% DSS) эти мыши получали три цикла 3,5% DSS (неделя 1)/0% DSS (недели 2 и 3). Как показано на Фиг. 4А, 4В и 4Е, у мышей 8.3-NOD наблюдалась значительная резистентность к колиту и отсутствие летальных исходов в отличие от мышей 17.6-NOD, что позволяло предположить, что актиация 8.3-CD8+ клеток in vivo под воздействием эпитопа Bac-IYL36-44 делала хозяев резистентными к колиту. Кроме того, мыши 8.3-NOD, у которых отсутствовал интегрин β7, были подвержены высокому риску развития колита (Фиг. 4С, 4D и 4F). Эти результаты подтверждают предположение, что для реализации анти-колитогенного эффекта 8.3-CD8+ Т-клеток необходима мобилизация в КАЛТ.
[0168] Приведенные выше данные позволили предположить, что мыши NOD.IGRP206-214-/-, у которых имеет место экспорт повышенного количества высокоавидных IGRP206-214-реактивных (способных перекрестно реагировать с BaclYL36-44) CD8+ клеток на периферию, будут относительно резистентны к DSS-индуцированному колиту по сравнению с мышами NOD дикого типа, у которых значительная фракция этих CD8+ Т-клеток с более высокой авидностью, отсутствует. Действительно, как показано на Фиг. 4G, мыши NOD.IGRP206-214-/-, в отличие от мышей NOD, были резистентны к потере веса, вызванной 4% DSS. Чтобы непосредственно оценить, какую роль в резистентности к колиту играет ответ цитотоксических CD8+ Т-клеток, направленный против нагруженных BaclYL36-44 АПК, хозяевам NOD.IGRP206-214-/- давали 4% DSS наряду с внутривенными инъекциями дифференцированных in vitro 8.3-CTL (цитотоксических Т лимфоцитов). Как показано на Фиг. 4Н, индекс активности заболевания был ниже у хозяев, которым проводили трансфузию 8.3-CTL, по сравнению с мышами, которым не делали трансфузии.
[0169] Чтобы подтвердить полученные результаты заявители исследовали способность 8.3-CTL защищать от заболевания мышей 17.6-NOD, чрезвычайно подверженных DSS-индуцированному колиту. Как показано на Фиг. 5А, у мышей 17.6-NOD, получавших 8.3-CTL (одна трансфузия CTL в неделю) не отмечалось значительной потери веса в ходе 35-дневного наблюдения, в отличие от мышей 17.6-NOD, не получавших CTL. Кроме того, трансфузия 8.3-CTL существенно снижала индекс активности заболевания у этих животных (Фиг. 5В). Вместе эти данные подтверждают предположение, что ответ CTL, направленный против эпитопа бактерий кишечника, обеспечивает резистентность к колиту. Следовательно, подходы, позволяющие добиться активации и увеличения популяции специфических в отношении микробиоты кишечника CTL in vivo, будут иметь большое терапевтическое значение для ВЗК.
[0170] Приведенные здесь данные убедительно свидетельствуют, что интеграза Bacteroides представляет собой надежную антигенную мишень для Т-клеток с анти-ВЗК активностью в кишечно-ассоциированной лимфоидной ткани. Следовательно, этот антиген можно использовать в качестве мишени для мобилизации и аккумуляции в кишечнике ауторегуляторных (противовоспалительных) Т-клеток при воспалительных заболеваниях кишечника. В одном воплощении системное введение субъектам наночастиц, покрытых комплексами пептид-ГКГС класса I, индуцирует антиген-специфические CD8+ Т клетки (8.3-подобные лимфоциты, как обычные, так и ауторегуляторные подобные клеткам памяти). В другом воплощении системное введение субъектам наночастиц, покрытых комплексами пептид-ГКГС класса II, индуцирует антиген-специфические регуляторные Т-клетки 1 типа (продуцирующие IL-10/TGFb) CD4+ Т-клетки. Действительно, Tr1-подобные CD4+ Т-клетки, популяция которых увеличилась под воздействием наночастиц, покрытых молекулами I-Ag7 ГКГС класса II мышей NOD, презентирующими аутоантигенный эпитоп, полученный из IGRP, накапливаются в кишечно-ассоциированной лимфоидной ткани, включая Пейеровы бляшки и агрегаты интраэпителиальных лимфоцитов (ИЭЛ). На Фиг. 6 приведены данные по двум мышам, излечившимся от диабета в результате лечения наночастицами, покрытыми IGRP4-22/I-Ag7, этих мышей исследовали в возрасте 50 недель; GPI/I-Ag7 тетрамер использовали в качестве отрицательного контроля).
[0171] Аналогично, наночастицы, покрытые молекулами ГКГС класса I и/или II, презентирующими эпитопы интегразы Bacteroides, вызывают увеличение популяции специфических в отношении интегразы CD8+ или Tr1-подобных CD4+ Т-клеток, большинство которых будут аккумулироваться в кишечнике, способствуя восстановлению иммунного баланса у индивидов, страдающих ВЗК. Таким образом, композиции по данному изобретению также обеспечивают данный способ лечения.
Пример 2. Способ получения комплексов антиген-ГКГС-наночастица.
[0172] Неорганические наночастицы (наночастицы оксида железа = НЧОЖ; наночастицы золота = НЧЗ) желаемого размера. НЧОЖ получали при помощи теплового разложения. НЧОЖ, синтезированные таким образом, являются биосовместимыми и могут быть ПЭГилированы для конъюгации с белками. Для нанесения пГКГС и/или других белков на НЧОЖ, покрытые сурфактантом НЧ вводят в реакцию с функционализированными ПЭГ-линкерами надлежащей длины. Линкеры очищают при помощи ВЭЖХ и характеризуют при помощи 1Н-ЯМР, МАЛДИ/ГПХ и гель-проникающей хроматографии для уточнения химической принадлежности, чистоты, молекулярного веса и полидисперсности. Аналогичные линкеры и подходы можно применять для покрытия НЧЗ, за исключением того, что линкеры будут иметь тиольную группу (SH) на конце, связывающемся с наночастицей.
Пример 3. Размер, концентрация и экспонирование наночастиц, покрытых пГКГС.
I. Синтез и характеристика покрытых пГКГС наночастиц на основе золота.
[0173] Синтезировали наночастицы золота (НЧЗ) определенного размера. Размер, плотность, поверхностный заряд и монодисперсность препаратов НЧЗ определяли при помощи спектрофотометрии, просвечивающей электронной микроскопии (ПЭМ) и динамического рассеяния света. Образцы НЧЗ затем концентрировали и конъюгировали с моноспецифическими комплексами пГКГС, используя различные подходы, описанные ниже. Заявители разработали способы для количественного определения валентности НЧЗ по пГКГС и концентрирования препаратов покрытых пГКГС НЧЗ различного размера до высокой плотности (~1014/мл) без нарушения монодисперсности (Фиг. 19).
II. Исследование способности НЧЗ связывать пГКГС.
[0174] Комплексы пГКГС наносили на НЧЗ разных рамеров, используя два различных подхода: (i) случайное связывание пГКГС с поверхностью НЧЗ вследствие электростатического взаимодействия; и (ii) упорядоченное связывание при помощи линкера тиол-ПЭГ-NH2 (в этом случае, в качестве стабилизатора НЧЗ для предупреждения агрегации использовали дополнительный линкер тиол-ПЭГ). Предполагали, что первый подход позволит добиться высокой плотности лигандов (пГКГС на одну НЧЗ), но при этом ориентация пГКГС будет нарушена (т.е. доступной для распознавания соответствующими Т-лимфоцитами может оказаться только часть молекул). Второй подход был направлен на создание НЧЗ, покрытых пГКГС в более низкой плотности, но они были присоединены упорядоченно, своими С-концами. Оба подхода протестировали на НЧЗ различного диаметра, который варьировал от 14 до 40 нм. Подтвердили, что при использовании обоих подходов способность НЧЗ связывать пГКГС зависит от их размера, а более конкретно - от площади поверхности (с наночастицами большего размера связывается больше пГКГС). Неожиданно было обнаружено, что связывание, опосредованное ПЭГ, не только обеспечивает упорядоченное связывание, но также увеличивает связывающую способность отдельных НЧЗ (в противоположность исходным предположениям). В Таблице 1 обобщены полученные данные.
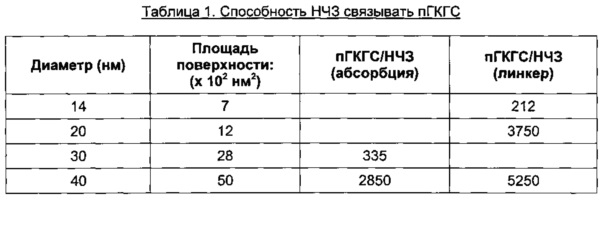
III. Агонистическая активность в зависимости от содержания пГКГС.
[0175] Исследовали влияние валентности пГКГС, размера НЧЗ, плотности НЧЗ и принципа нанесения покрытия на функциональную (агонистическую) активность НЧЗ, покрытых пГКГС, in vitro. Сравнивали способность различных препаратов IGRP206-214-Kd-НЧЗ активировать распознающие их (IGRP206-214-специфические) наивные CD8+ Т клетки (обозначаемые в данном документе как '8.3-CD8+ Т-клетки'), полученные из организма трансгенных по T-клеточному рецептору (TCR) мышей NOD (или мышей 8.3-NOD). Первая группа экспериментов была направлена на изучение влияния валентности по IGRP206-214-Kd (пГКГС) в диапазоне концентраций НЧЗ в культуре. НЧЗ, конъюгированные с контрольным (нераспознающимся) комплексом пГКГС (Tum-Kd), использовали в качестве отрицательного контроля. Как и ожидалось, покрытые IGRP206-214-Kd (в отличие от покрытых TUM-Kd) НЧЗ активировали эти Т клетки (о чем свидетельствовала продукция IFNγ), и степень активации зависела от концентрации НЧЗ (а следовательно, и пГКГС). На Фиг. 20 показан эксперимент с использованием ~14 нм НЧЗ, покрытых молекулами пГКГС в различной плотности с использованием линкера. На Фиг. 20 сравнивается количество IFNγ, секретированного в ответ на два различных образца пГКГС-НЧЗ (оба из которых содержали НЧЗ диаметром 14 нм в концентрации ~2×1013/мл) распознающими их 8.3-CD8+ Т-клетками. Au-022410 и Au-21910 несли приблизительно по 250 и 120 пГКГС на НЧЗ, соответственно. Au-011810-C несли приблизительно по 120 контрольных пГКГС на НЧЗ. НЧЗ, несущие приблизительно в 2 раза больше комплексов пГКГС на наночастицу, обладали более выраженной агонистической активностью. Таким образом, агонистическая активность НЧЗ, покрытых пГКГС, зависит от общего содержания пГКГС (НЧЗ). Эти результаты казались парадоксальными, поскольку согласно существующим представлениям, в отсутствие костимулирующих молекул на наночастицах увеличение числа pMHCs на отдельных наночастицах также должно повышать авидность и способствовать элиминации (клеточной гибели), а не пролиферации распознающих их Т-клеток и секреции ими цитокинов. Это справедливо как для низкоавидных, так и для высокоавидных Т-клеток. Например, предыдущая работа заявителей (Han et al., Nature Medicine, 2005) и работы других исследователей указывают, что пептиды, распознающиеся с высокой авидностью, или пептиды, распознающиеся с низкой авидностью, но присутствующие в высоких концентрациях, обладают повышенной способностью к элиминации распознающих их Т клеток in vivo. Так, в случае внутривенного введения в терапевтических целях наночастиц, покрытых комплексами антиген-ГКГС, или растворимых пептидов, распознающие их Т-клетки подвергаются элиминации, которая носит дозозависимый и зависящий от аффинности пептида характер. Данные, приведенные на Фиг. 20, не подтвердили эти предположения.
IV. Пороговая валентность и агонистическая активность комплексов пептид-ГКГС-наночастица
[0176] Для дальнейшего изучения роли валентности, обеспечиваемой комплексами пептид-ГКГС (пГКГС), в агонистических свойствах наночастиц, конъюгированных с пГКГС (пГКГС-НЧ), сравнивали способность наночастиц оксида железа (Fe3O4) диаметром 8 нм, ковалентно связанных с разным количеством мономеров IGRP206-214/Kd пГКГС, запускать секрецию IFN-гамма (IFNγ) распознающими их (IGRP206-214/Kd-специфическими) CD8+ Т клетками (обозначенными здесь как 8.3-CD8+ Т-клетки) in vitro. Как показано в Таблице 2, 8.3-CD8+ Т клетки продуцировали пренебрежимо малое количество IFNγ при культивировании в присутствии наночастиц, покрытых мономерами пГКГС в количестве 8 мономеров на наночастицу, но продуцировали существенно большее количество IFNγ в ответ на покрытые пГКГС наночастицы с более высокой валентностью, даже если она составляла всего лишь 11 мономеров пГКГС на наночастицу, демонстрируя дозозависимость.
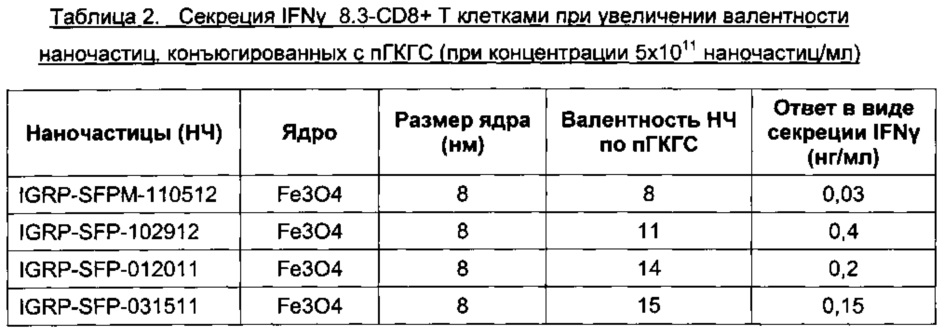
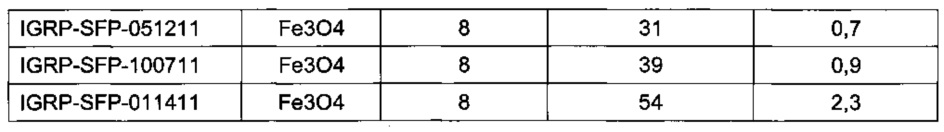
[0177] Такое позитивное влияние валентности по пГКГС на агонистическую активность пГКГС-НЧ наблюдалось в диапазоне концентраций пГКГС-НЧ (Фиг. 21). При этом следует отметить, что если 25×1011 наночастиц (в мл), несущих по 11 пГКГС на НЧ, демонстрировали агонистическую активность, которая была сопоставима с активностью 5×1011 наночастиц (в мл), несущих по 54 пГКГС на НЧ, то увеличение концентрации наночастиц, несущих по 8 пГКГС на НЧ, до уровня 40×1011 НЧ/мл сопровождалось минимальным эффектом (Фиг. 22). Вместе эти результаты указывают, что существует пороговое значение валентности по пГКГС, находящееся между 9 и 11 пГКГС/НЧ, ниже которого относительно небольшое увеличение числа наночастиц (например, в 5 раз) не позволяет компенсировать низкую агонистическую активность пГКГС-НЧ, имеющих низкую валентность (отмечено, что применение >50×1011 наночастиц в этих экспериментах in vitro не информативно вследствие токсичности для клеток наночастиц в высоких концентрациях).
[0178] Этот эффект пороговой валентности по пГКГС продемонстрирован и на Фиг. 23, где секреция IFNγ нормализована к общей концентрации пГКГС, доставленных покрытыми наночастицами в культуру. Наночастицы, несущие по 11 пГКГС на НЧ, вызывали значительно более выраженный ответ в виде секреции IFNγ в диапазоне концентраций пГКГС по сравнению с наночастицами, несущими по 8 пГКГС на НЧ. Кроме того, различия в агонистических свойствах этих двух препаратов наночастиц значительно усиливались с увеличением общего содержания пГКГС. Иными словами, при концентрации 2,4 мкг/мл различия в агонистических свойствах пГКГС, доставленных наночастицами в виде октамеров либо монодекамеров, были более выражены, чем различия в агонистических свойствах тех же самых препаратов, когда общая концентрация пГКГС была в 10 раз ниже.
[0179] На Фиг. 24 показано, что такое значительное влияние валентности по пГКГС на агонистические свойства пГКГС-НЧ наблюдается и при использовании наночастиц большего размера (которые могут иметь более высокую валентность по пГКГС по сравнению с наночастицами размером 8 нм, представленными на Фиг. 21-23) при более низкой концентрации (для нормализации общего содержания оксида железа в культуре). Тогда как наночастицы диаметром 18 нм, несущие <10 пГКГС/НЧ практически не проявляли биологическую активность до концентрации 4×1011 НЧ/мл, агонистическая активность наночастиц диаметром 18 нм, имеющих более высокую валентность по пГКГС, линейно повышалась с увеличением концентрации наночастиц. Сравнение Фиг. 23 и 24 также указывает, что 2×1011 наночастиц размером 18 нм, несущих по 61 пГКГС на НЧ, проявляют такую же агонистическую активность, как и 2×1011 наночастиц размером 8 нм, несущих сопоставимое количество (54) пГКГС на НЧ, что указывает, что влияние валентности по пГКГС не зависит существенным образом от объема наночастиц.
[0180] Вместе эти данные демонстрируют, что покрытые пГКГС наночастицы приобретают мощную агонистическую активность, когда их валентность по пГКГС превышает некое пороговое значение (находящееся между 9 и 11 пГКГС/НЧ). Увеличение валентности по пГКГС или концентрации наночастиц позволяет усилить агонистические свойства пГКГС-НЧ, имеющих "пороговую" или "сверхпороговую" валентность по пГКГС, но не агонистические свойства наночастиц, имеющих "подпороговую" валентность по пГКГС.
V. Агонистическая активность в зависимости от размера и концентрации наночастиц.
[0181] Дальнейший анализ показал, что общее содержание пГКГС является не единственным фактором, влияющим на агонистическую активность пГКГС-НЧ in vitro, и что размер наночастиц также играет важную и независимую роль. Это было обнаружено при сравнении агонистической активности двух образцов пГКГС-НЧЗ с различным размером (14 и 40 нм в диаметре, соответственно) и различной валентностью по пГКГС при одинаковом общем содержании пГКГС. В эксперименте, отображенном на Фиг. 25, использовали наночастицы золота размером 14 нм, несущие приблизительно по 200 молекул пГКГС на НЧЗ, и наночастицы золота размером 40 нм, несущие приблизительно по 5000 пГКГС на НЧЗ. Концентрацию наночастиц золота в этих двух образцах подобрали так (3×1013 и 1012 НЧЗ/мл, соответственно), чтобы общее содержание пГКГС в каждом образце составляло приблизительно 450 мкг/мл. Стоит отметить, что в данном диапазоне содержания пГКГС, 8.3-CD8+ Т клетки существенно лучше отвечали на состав пГКГС/НЧЗ с диаметром 14 нм, чем на состав с диаметром 40 нм, несмотря на то, что в последнем варианте количество комплексов пГКГС на наночастицу было гораздо больше. Это позволило предположить, что определяющей является концентрация НЧЗ (большее число НЧЗ, приходящихся на распознающую их Т-клетку). Другими словами, 4×40 нм наночастиц, несущих по 1000 пГКГС на НЧЗ (4000 пГКГС) менее предпочтительны, чем 40×10 нм наночастиц, несущих по 100 пГКГС на НЧЗ (4000 пГКГС). Вместе, эти данные позволяют предположить, что оптимальные препараты пГКГС-НЧЗ представляют собой препараты, содержащие мелкие НЧЗ с высокой плотностью пГКГС. Увеличение валентности по пГКГС у этих мелких наночастиц еще больше усиливает их поразительные и неожиданные агонистические свойства.
VI. Агонистическая активность в зависимости от экспонирования пГКГС.
[0182] Как отмечено выше, покрытые пГКГС наночастицы золота получали при помощи одновременного нанесения на НЧЗ 3,4 кДа линкера тиол-ПЭГ-NH2 (выполняющего роль акцептора карбокси-концов пГКГС) и линкера тиол-ПЭГ, служившего стабилизатором НЧЗ. Чтобы изучить влияние длины стабилизирующего линкера тиол-ПЭГ на его способность препятствовать агрегации НЧЗ, сравнивали способность линкера тиол-ПЭГ-NH2 связывать молекулы пГКГС и/или агонистические свойства НЧЗ, покрытых пГКГС, при этом покрытые пГКГС наночастицы золота получали с использованием стабилизирующих линкеров различного размера (2 кДа и 5 кДа, короче и длиннее чем линкер-акцептор пГКГС, соответственно). Обнаружили, что оба линкера демонстрировали одинаковые антиагрегационные свойства, и что линкер длиной 5 кДа не ингибировал связывание пГКГС с более коротким линкером тиол-PEG-NH2 длиной 3,4 кДа. Однако, стоит отметить, что пГКГС-НЧЗ, защищенные более коротким (2 кДа) тиол-ПЭГ, демонстрировали более выраженную агонистическую активность in vitro, чем наночастицы, на которые наносили более длинный (5 кДа) тиол-ПЭГ (Фиг. 26). Это позволяет предположить, что длинные защитные линкеры тиол-ПЭГ экранируют молекулы пГКГС, присоединенные к линкеру-акцептору, мешая их презентации распознающим их Т клеткам.
VII. Мелкие наночастицы, ковалентно связанные с пГКГС в высокой плотности, обеспечивают максимальное увеличение численности ауторегуляторных Т-клеток in vivo.
[0183] Наночастицы, имеющие средний диаметр приблизительно 10 нм и связанные либо с NRP-V7/Kd (также обозначаемым IGRP206-214- Kd) или TUM/Kd (контроль) получали согласно описанным здесь способам и тестировали их способность индуцировать увеличение численности распознающих их ауторегуляторных CD8+ Т клеток in vivo. На Фиг. 27 приведены результаты эксперимента, в котором антиген-ГКГС-НЧЗ вводили при помощи внутривенной инъекции мышам NOD дикого типа в возрасте 10 недель дважды в неделю на протяжении 5 недель. Изменение размера популяции распознающих их Т-клеток в циркуляции и в различных лимфоидных тканях в ответ на терапию оценивали путем окрашивания клеточной суспензии флуоресцентно-меченными тетрамерами антиген-ГКГС (как распознающимися, так и нерелевантными контрольными тетрамерами). Введение в 10-100 раз меньшего количества НЧЗ по сравнению с описанным ранее в области техники (см., например, Tsai et al., Immunity, 2010, исследовавших введение наночастиц, покрытых 1-8 пГКГС), но несущих по 150 комплексов антиген-ГКГС на НЧЗ, вызывало значительно более выраженное увеличение численности клеток (Фиг. 27). Увеличение численности CD8+ Т-клеток in vivo (до 44% от всей популяции циркулирующих CD8+ Т-клеток) в несколько раз превышало уровень, который обычно достигался с использованием наночастиц, у которых валентность по пГКГС составляла приблизительно 8 пГКГС (1-2% клеток крови; см., например, Tsai et al., Immunity, 2010, Фиг. 1С). Приведенные выше данные указывают, что мелкие покрытые комплексами антиген-ГКГС наночастицы с высокой валентностью вызывают максимальное увеличение численности Т-клеток. Эти результаты оказались неожиданными. Следовательно, терапевтический эффект обусловлен не общей авидностью взаимодействия пГКГС-НЧ с Т-клетками, а скорее авидностью популяции предшественников, дающей начало Т-клеткам, численность которых увеличивается в ответ на терапию с применением пГКГС-НЧ. Данное объяснение согласуется с результатами, приведенными в данном документе, и означает, что валентность НЧ по пГКГС должна повышать терапевтическую эффективность пГКГС-НЧ.
Пример 4
[0184] пГКГС-НЧЗ с высокой валентностью по пГКГС вызывают выраженное увеличение численности распознающих их CD8+ Т-клеток. Затем определяли способность пГКГС-НЧ вызывать массивную экспансию распознающих их Т-клеток in vivo. Для этого мышам выполняли несколько инъекций по 3×1012 наночастиц размером 10-14 нм, несущих в общем 25 мкг пГКГС (приблизительно по 150 IGRP206-214/Kd молекул на НЧ). Как показано на Фиг. 28, у мышей, получавших 10 доз (дважды в неделю на протяжении 10 недель), наблюдали выраженное увеличение популяции соответствующих IGRP206-214 (NRP-V7)-реактивных CD8+ Т-клеток в периферической крови по сравнению с их нелеченными собратьями (от <0,4 до >17 или 47% CD8+ Т-клеток) (нижняя панель). Такое увеличение численности клеток наблюдалось у мышей, которых подвергали эвтаназии после введения всего лишь 4 доз пГКГС-НЧ (верхняя панель). Клетки, численность которых увеличилась в ответ на пГКГС-НЧ, специфически связывали распознаваемые ими (NRP-V7/Kd), но не связывали нерелевантные (TUM/Kd) тетрамеры пГКГС.
Пример 5. Получение наночастиц золота, конъюгированных с пГКГС
[0185] Получение наночастиц золота, конъюгированных с пГКГС (пГКГС-НЧЗ, 12 и 30 нм). Получение наночастиц золота. Наночастицы золота получали путем нагревания бидистиллированной воды (200 мл) в круглодонной колбе в бане с силиконовым маслом до кипения. Затем в кипящую воду добавляли 1% раствор HAuCL4 (4 мл). Раствор нагревали в течение 10 мин перед добавлением 1% раствора цитрата натрия. Для получения наночастиц размером 12 нм добавляли 12 мл раствора цитрата натрия. Для наночастиц размером 30 нм добавляли 12 мл раствора цитрата натрия. Сразу после добавления раствора цитрата натрия разивалась окраска бордового цвета. Для завершения реакции раствор НЧЗ перемешивали еще в течение 30 минут. Эта модификация способа, описанного в публикации Levy, R. et al. ("Rational and combinatorial design of peptide capping ligands for gold nanoparticles." J Am Chem Soc 126, 10076-84 (2004)), включенной сюда во всей полноте путем ссылки.
[0186] Модификация поверхности НЧЗ. Для пегилирования НЧЗ к раствору НЧЗ добавляли 25 мМ тиол-PEG-NH2 (M.W. 3400) и 50 мМ тиол-PEG (M.W. 2000, соотношение ПЭГ/НЧЗ 10000:1). Затем раствор перемешивали в течение 5 часов при комнатной температуре. Пегилированные НЧЗ затем отмывали стерильной бидистиллированной водой 3 X 30 мл для удаления избытка ПЭГ и ресуспендировали в 40 мл 100 мМ буфера MES (C6H13NO4S.xH2O), pH 5,5.
[0187] Конъюгация с пГКГС. пГКГС (IGRP206-214/Kd, 4 мг) добавляли к раствору пегилированных НЧЗ по каплям при слабом перемешивании при комнатной температуре. Смесь перемешивали в течение часа перед добавлением 20 мг 1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC). Смесь перемешивали еще в течение 4 часов. Конъюгаты пГКГС-НЧЗ затем отмывали 40 мл фосфатно-солевого буфера (ФСБ, РН 7,2-7,4) три раза и ресуспендировали в 8 мл ФСБ.
Пример 6. Получение наночастиц золота, конъюгированных с пГКГС
[0188] Получение наночастиц золота, конъюгированых с пГКГС (пГКГС-НЧЗ, 2-10 нм). Получение НЧЗ (2-5 нм). Наночастицы золота размером 2-5 нм получали путем растворения 250 мг (для наночастиц размером 2 нм) или 50 мг (для наночастиц размером 4 нм) додециламина в 10 мл раствора DDAB (100 мМ дидодецилдиметиламмоний бромид (DDAB) в толуоле). Затем в 4 мл раствора DDAB растворяли 100 мг тетрабутиламмоний борогидрида (ТВАВ). После этого растворы додециламина и ТВАВ смешивали в 50 мл трехгорлой колбе, перемешивая в токе азота. 34 мг AuCl3 растворяли в 4,5 мл раствора DDAB и быстро инжектировали в смесь растворов ТВАВ и додециламина. Раствор немедленно приобретал глубокий красный цвет, указывающий на формирование НЧЗ. Смесь непрерывно перемешивали в течение 30 мин и добавляли к смеси 15 мл этанола. Затем смесь центрифугировали при 4100×g в течение 12 мин для преципитации НЧЗ.
[0189] Получение НЧЗ (6-10 нм). Для получения НЧЗ размером 6-10 нм декановую кислоту (172 мг) вначале растворяли в 10 мл толуола, а затем смешивали с разным количеством раствора ТВАВ (4 и 1 мл для НЧЗ размером 6 и 10 нм, соответственно) в 50 мл трехгорлой колбе при перемешивании в токе азота. Затем в смесь растворов ТВАВ и декановой кислоты быстро инжектировали AuCl3 (34 мг растворенного в 4,5 мл матричного раствора DDAB). Раствор немедленно приобретил глубокий красный цвет. Смесь непрерывно перемешивали в течение 30 мин, к смеси добавляли 15 мл этанола. Затем смесь центрифугировали при 4100×g в течение 12 мин для преципитации НЧЗ.
[0190] Модификация поверхности НЧЗ. НЧЗ ресуспенировали в 20 мл 0,1 М меркаптопропановой кислоты (МРА) в метаноле, pH 10 и перемешивали в течение одного часа при комнатной температуре. Затем добавляли 10 мл этилацетата. Далее смесь перемешивали при 4100×g в течение 15 мин. После этого преципитировавшие НЧЗ отмывали 30 мл стерильной бидистиллированой воды три раза и ресуспендировали в 20 мл 100 мМ буфера MES (C6H13NO4S.xH2O), pH 5,5. К этой смеси добавляли растворы 0,5 М полиоксиэтилен бис(амина) (при соотношении ПЭГ/НЧЗ 10000:1) и 0,1М 1-этил-3-(3-диметиламинопропил) карбодиимида (EDC) (конечная концентрация EDC 2 мМ). Затем смесь перемешивали в течение 4 часов. Пегилированные НЧЗ отмывали 3 X 30 мл стерильной бидистиллированной воды для удаления избытка ПЭГ и EDC.
[0191] Конъюгация с пГКГС. Пегилированные НЧЗ ресуспендировали в 20 мл 100 мМ буфера MES (C6H13NO4S.xH2O), pH 5,5. Затем пГКГС (5 мг/мл, всего 10-30 мг) добавляли по каплям к ресуспендированным НЧЗ (в соотношении пГКГС/НЧЗ 500:1) и перемешивали в течение 1 часа при комнатной температуре перед добавлением 0,1 М 1-этил-3-(3-диметиламинопропил) карбодиимида (EDC) (конечная концентрация EDC 2 мМ). Смесь перемешивали более 4 часов. Конъюгаты пГКГС-НЧЗ отмывали три раза 40 мл фосфатно-солевого буфера (ФСБ, РН 7,2-7,4) и затем ресуспендировали в 10-20 мл ФСБ.
[0192] Следует понимать, что для раскрытия данного изобретения приведены предпочтительные воплощения и возможные признаки, специалисты в данной области техники могут модифицировать, усовершенствовать и привнести изменения в воплощения изобретений, изложенные в данном документе, но при этом указанные модификации, усовершенствования и изменения будут находиться в рамках данного изобретения. Материалы, способы и примеры, приведенные в данном документе, репрезентативные для предпочтительных воплощений, являются иллюстративными и не ограничивают объем изобретения.
[0193] Изобретение было описано в общих терминах. Любые частные воплощения, подпадающие под общее раскрытие, также являются частью изобретения. Это распространяется также на общее описанию изобретение с исключениями и негативными признаками, когда любой объект може быть исключен, независимо от того, указано ли это конкретно в описании изобретения.
[0194] Кроме того, если признаки или аспекты изобретения представлены группой Маркуша, специалисты в данной области должны понимать, что изобретение также представлено каждым отдельным представителем или подгруппой представителей группы Маркуша.
[0195] В данном описании процитированы различные публикации, заявки на патенты и описания патентов. Все публикации, заявки на патенты, патенты и другие процитированные документы явным образом включены во всей полноте путем ссылки, в той же мере, как если бы каждый из них в отдельности был включен путем ссылки. В случае конфликта должно рассматриваться данное описание, включая все определения.