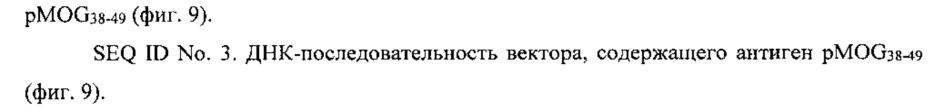Результат интеллектуальной деятельности: СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА И СВЯЗАННЫХ С НИМ ЗАБОЛЕВАНИЙ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение касается композиций и способов, связанных с иммунотерапией и медициной. В частности, настоящее изобретение касается лекарственных средств для лечения рассеянного склероза и связанных с ним заболеваний.
Уровень техники
Рассеянный склероз (MS) является потенциально истощающим заболеванием, при котором иммунная система организма разрушает защитную оболочку, покрывающую нервы. При этом нарушаются связи между мозгом и остальной частью организма. В конечном счете, это может привести к разрушению самих нервов, причем этот процесс необратим.
Статистика показывает, что примерно у 250000-350000 человек в США установлен диагноз этого заболевания. Симптомы его сильно варьируют, в зависимости от степени повреждения и того, какие нервы поражены. При тяжелых случаях рассеянного склероза люди могут терять способность ходить или говорить. Симптомы MS включают онемение рук или ног, боли, потерю зрения, мышечную слабость или тремор, паралич, головокружение, усталость, затруднения с речью, дисфункции мочевого пузыря, депрессию, потерю слуха и зуд.
Не существует лекарства от MS, но некоторые препараты ослабляют приступы MS и могут замедлить развитие болезни. Способы лечения направлены на восстановление функции после приступа, предотвращение новых приступов и предотвращение инвалидности. Лекарства от MS могут обладать нежелательным действием или могут плохо переноситься. Соответственно, в данной области существует потребность в хорошо переносимых, более эффективных способах лечения MS.
Раскрытие изобретения
В ответ на существующую потребность здесь описаны способы лечения и композиции для лечения или профилактики рассеянного склероза или связанных с рассеянным склерозом заболеваний. Один из аспектов изобретения касается способа экспансии и/или выработки популяций антипатогенных аутореактивных Т-клеток у лиц с рассеянным склерозом или связанными с рассеянным склерозом заболеваниями, который включает, в основном состоит из или же заключается во введении данному лицу комплекса антиген-МНС-наночастицы, причем антигеном служит связанный с рассеянным склерозом антиген.
Другой аспект касается способа лечения рассеянного склероза или связанных с рассеянным склерозом заболеваний у нуждающихся в этом лиц, который включает, в основном состоит из или же заключается во введении данному лицу эффективного количества комплекса антиген-МНС-наночастицы, причем антигеном служит связанный с рассеянным склерозом антиген. Также предусмотрено применение комплекса антиген-МНС-наночастицы при получении лекарственных средств для лечения рассеянного склероза или для экспансии и/или выработки популяций антипатогенных аутореактивных Т-клеток, причем антигеном служит связанный с рассеянным склерозом антиген.
Другие аспекты касаются комплексов, включающих, в основном состоящих или же состоящих из наночастиц; белка МНС; и связанного с рассеянным склерозом антигена. Также предусмотрены композиции, включающие, в основном состоящие или же состоящие из описанного здесь комплекса антиген-МНС-наночастицы и носителя. Следующие аспекты касаются наборов, включающих, в основном состоящих или же состоящих из описанных здесь композиций антиген-МНС-наночастицы и инструкций по применению.
Краткое описание чертежей
Следующие чертежи входят в состав настоящего описания и включены для дальнейшего раскрытия некоторых аспектов настоящего изобретения. Изобретение лучше понимается при обращении к одному или нескольким из этих чертежей в сочетании с подробным описанием представленных здесь конкретных воплощений.
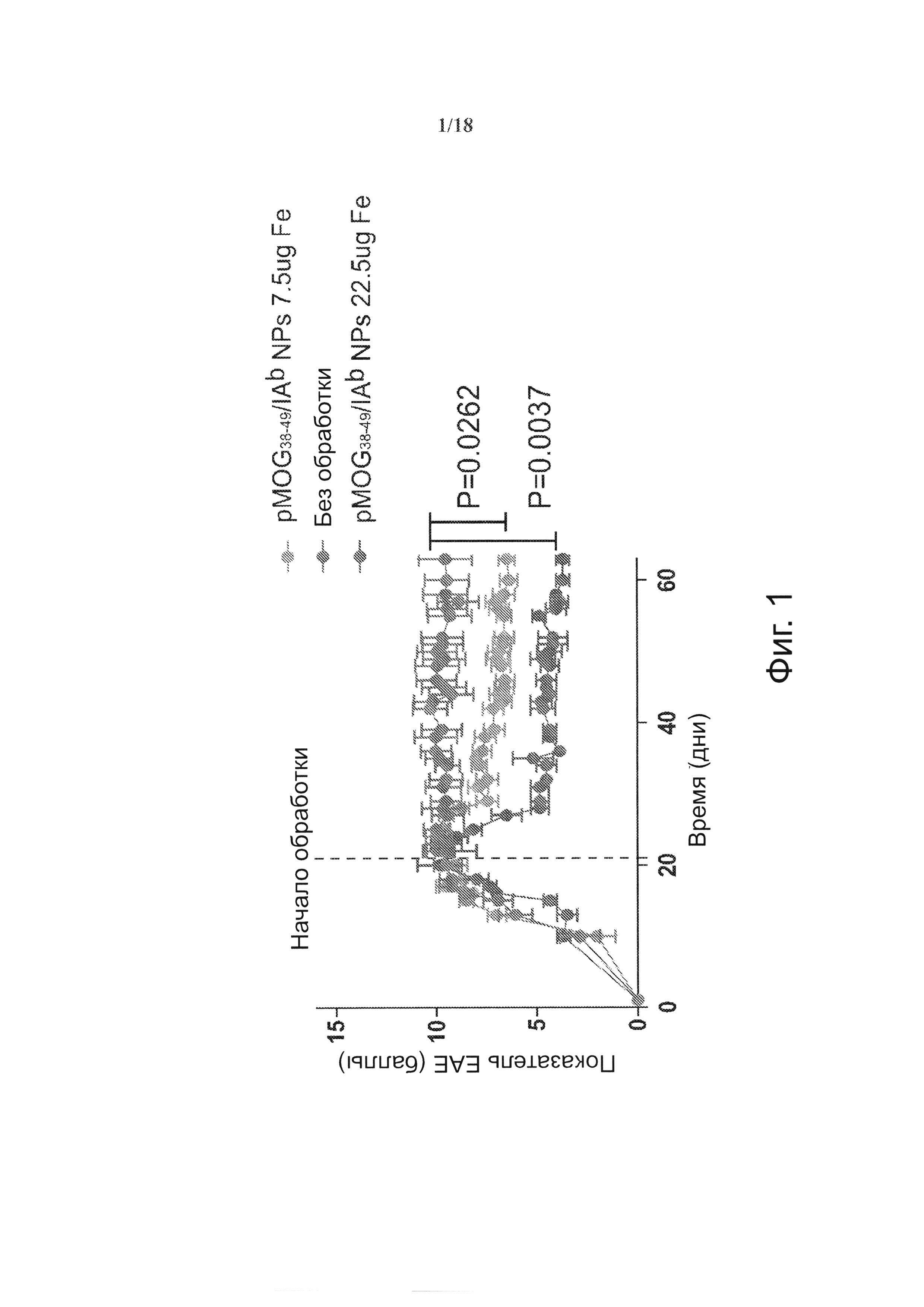
На фиг. 1 видно, что терапия наночастицами (NPs) с рМНС класса II уменьшает тяжесть хронического экспериментального аллергического энцефаломиелита (ЕАЕ) у мышей C57BL/6. Мышей В6 иммунизировали PMOG35-55 в CFA и вводили коклюшный токсин внутривенно. У мышей отмечали признаки ЕАЕ согласно установленным критериям по 15-балльной шкале. Пораженных мышей обрабатывали двумя еженедельными дозами по 7,5-22,5 мкг NPs, покрытых pMOG38-49/IAb, начиная с 21-го дня после иммунизации.
На фиг. 2 видно, что у мышей с хроническим ЕАЕ, получавших терапию NPs с рМНС класса II (NPs, покрытые pMOG38-49/I-Ab), увеличивался вес по сравнению с необработанными мышами с ЕАЕ.
На фиг. 3 представлена фотография обработанных и необработанных мышей с ЕАЕ. Обработанные мыши (NABACIM) выглядят более здоровыми, чем необработанные мыши.
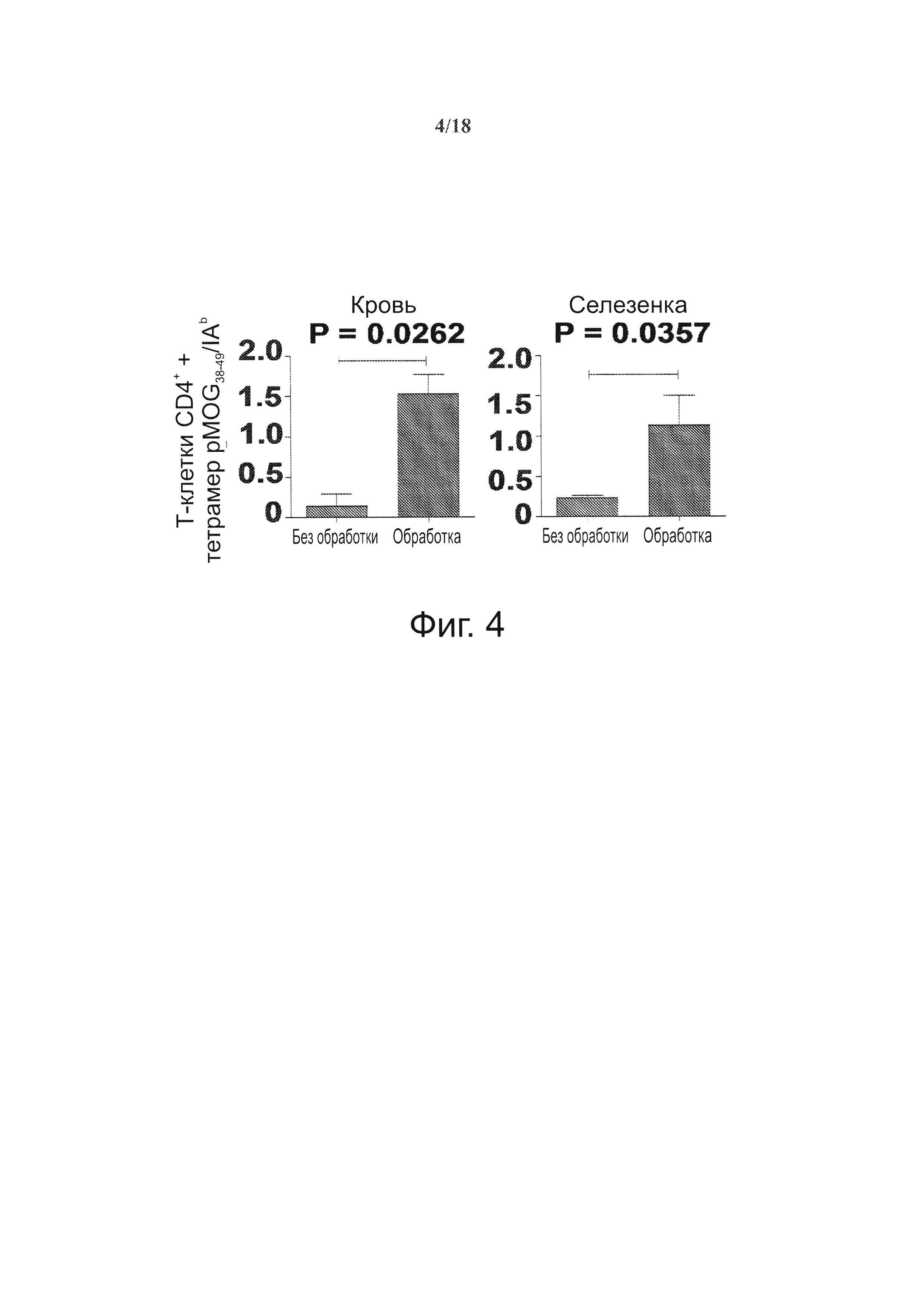
На фиг. 4 представлена системная экспансия когнатных ауторегуляторных Т-клеток CD4+ под действием покрытых pMOG38-49/IAb NPs у пораженных ЕАЕ мышей C57BL/6. Степень экспансии на этой модели сравнима с отмеченной у мышей NOD, обработанных NPs, покрытыми относящимся к диабету 1-го типа рМНС класса II (например, см. U.S. Pat. No. 8,354,110, включенный сюда путем ссылки во всей полноте).
На фиг. 5 представлен спинной мозг необработанных мышей. У необработанных мышей проявляется значительная демиелинизация и плотные инфильтраты мононуклеарных клеток в белом веществе.
На фиг. 6 представлен спинной мозг мышей, получавших NPs с pMOG38-49/IAb. У обработанных pMHC-NP мышей наблюдалась значительно меньшая демиелинизация и меньше инфильтратов мононуклеарных клеток.
На фиг. 7 представлены репрезентативные примеры краев спинного мозга у 2 необработанных мышей с ЕАЕ.
На фиг. 8 представлены репрезентативные примеры краев спинного мозга у 2 мышей с ЕАЕ, получавших NPs с pMOG38-49/IAb. У обработанных pMHC-NP мышей наблюдалась значительно меньшая демиелинизация, а также уменьшение инфильтрации мононуклеарных клеток.
На фиг. 9 представлены последовательности белка (SEQ IN NO: 2) и ДНК (SEQ ID NO: 3) конструкции pMOG36-55-I-Abeta(b)-C-Jun (SEQ ID NOS: 2-3). Последовательности отдельных компонентов у слитого белка: лидер НА (подчеркнут), а затем последовательность пептида pMOG38-49 (дважды подчеркнута) и последовательности I-Abeta (b) (подчеркнута пунктиром) и C-Jun (выделена затенением). Линкеры GS не выделены ничем.
На фиг. 10 представлена карта ДНК содержащего антиген вектора. Сайты ДНК-конструкции, кодирующие слитый белок лидерНА-I-Aalpha(b)С-Fos-BirA-His×6 (284 а.к.) («His X6», раскрытая как SEQ ID NO: 18), клонировали в экспрессирующий вектор для клеток насекомых pMT/V5 между Nco I (854) и Xba I (1711). Слитый белок включает I-Aalpha (d) (195 а.к.), а затем C-Fos через GS-линкер (6 а.к.), а затем последовательность BirA и 6×His (SEQ ID NO: 18).
На фиг. 11 представлен ТЕМ-снимок покрытых рМНС золотых наночастиц (~14 нм), концентрированных при высокой плотности (~5×1013/мл) и монодисперсных. Увеличение: ×50000.
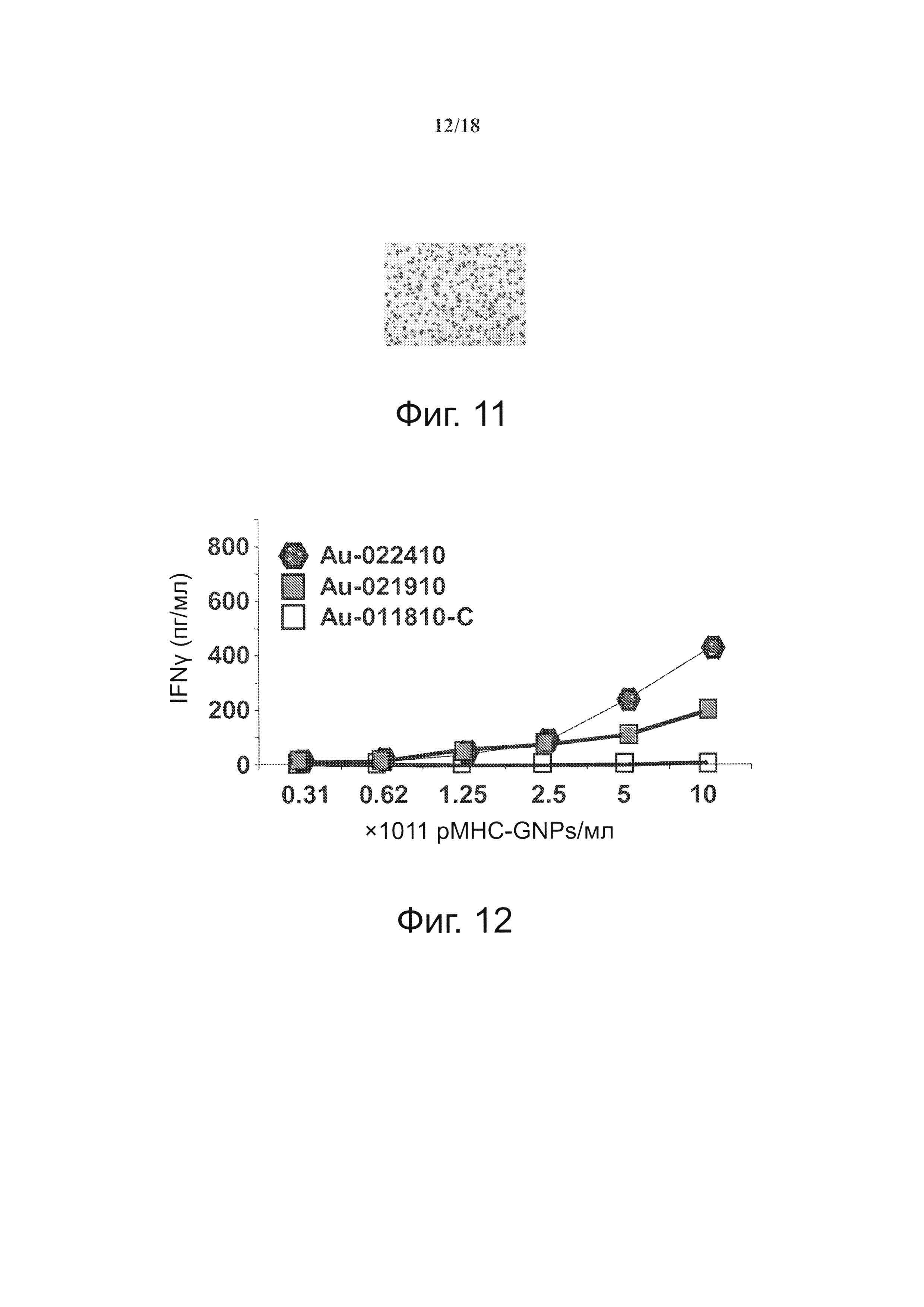
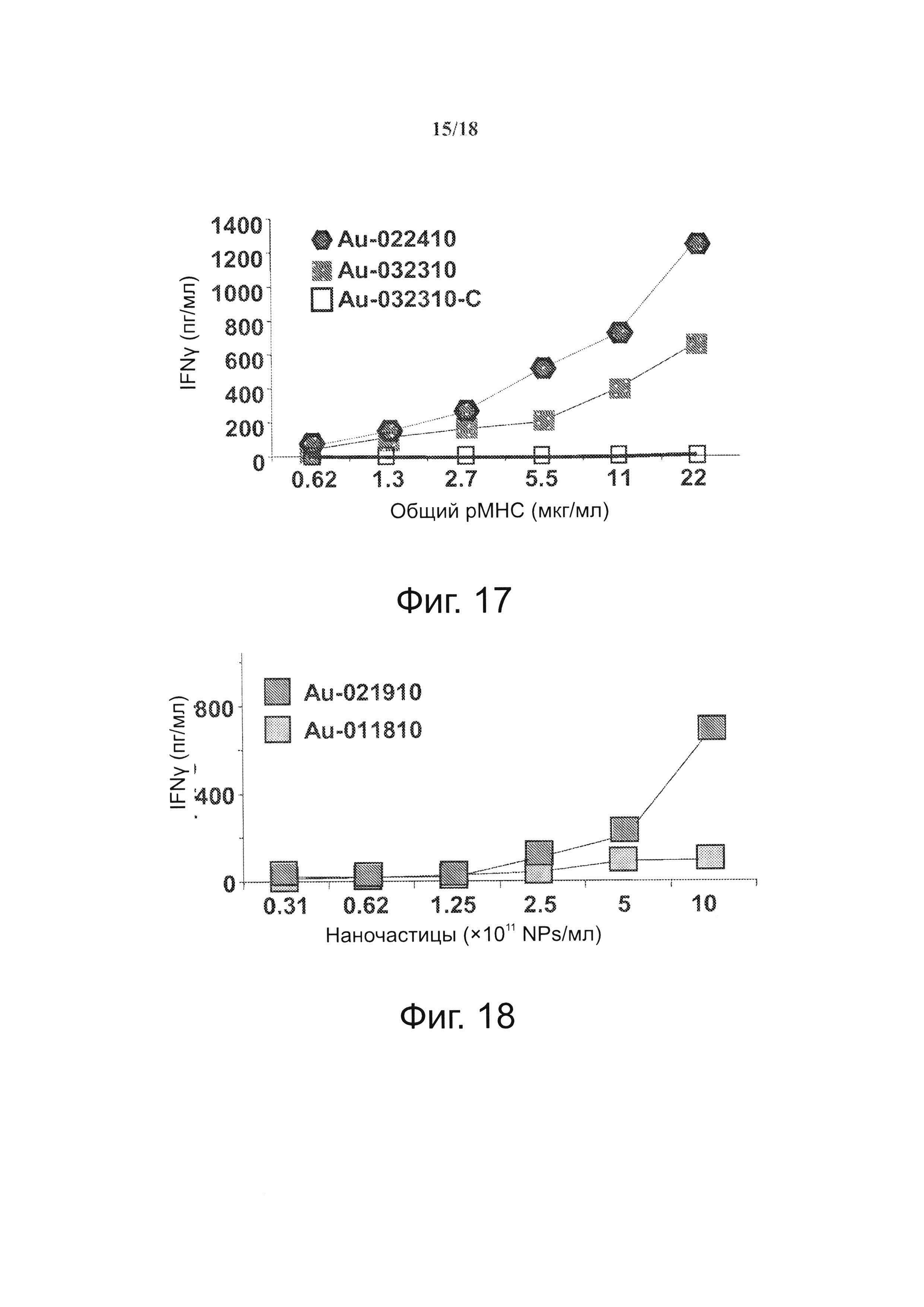
На фиг. 12 представлено влияние дозы рМНС (GNP) и валентности рМНС на агонистические свойства покрытых рМНС наночастиц (NPs). Представлено сравнение количества IFNγ, секретируемого когнатными Т-клетками 8.3-CD+ в ответ на два разных образца pMHC-NP (оба содержат по ~2×1013 NPs/мл диаметром 14 нм). Au-022410 и Au-21910 несут по ~250 и ~120 pMHCs/NP, соответственно. Au-011810-C несет по ~120 контрольных pMHCs/NP.
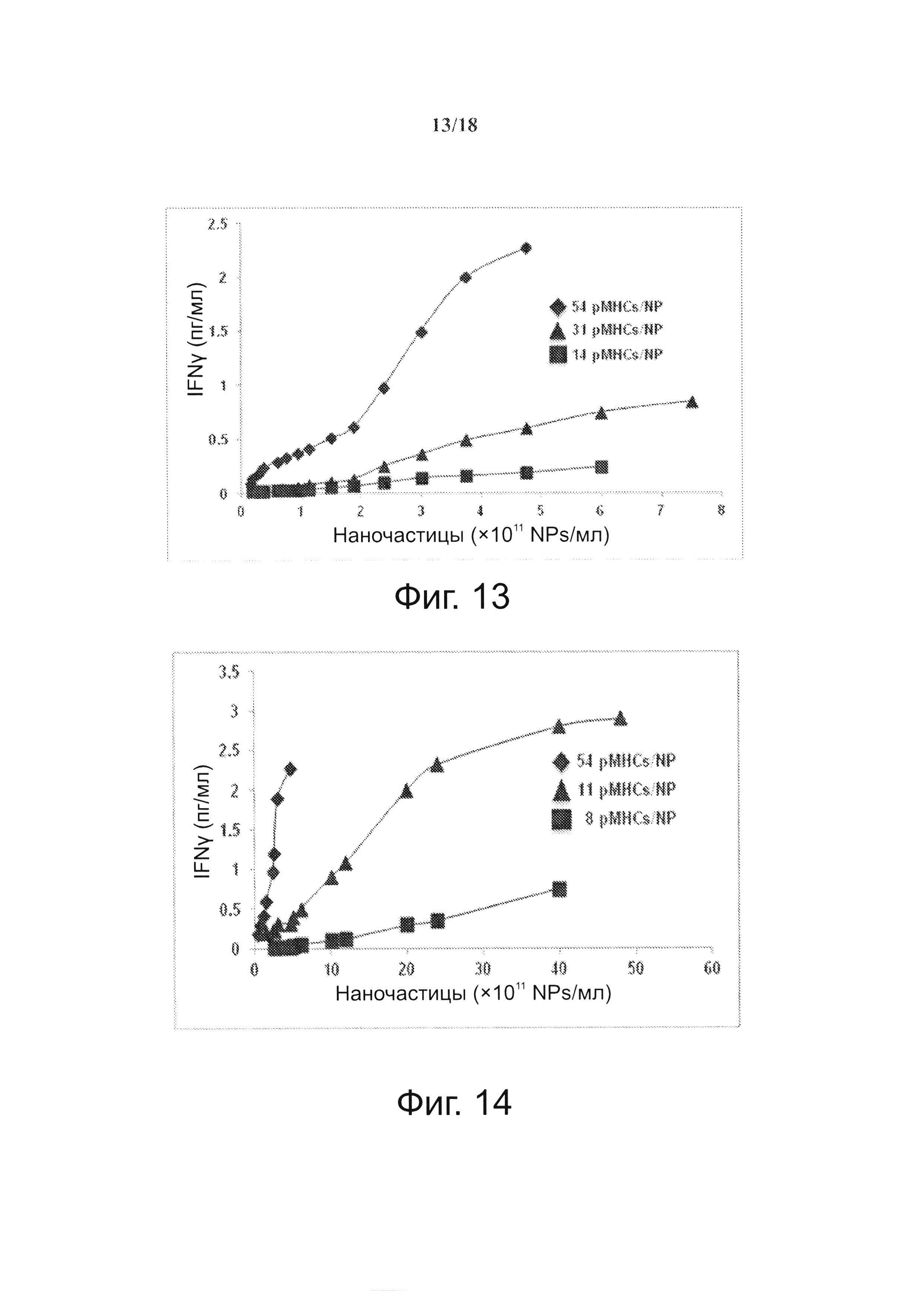
На фиг. 13 представлена индуцированная pMHC-NP секреция IFNγ Т-клетками 8.3-CD8+ в зависимости от валентности рМНС. Т-клетки 8.3-CD8+ (2,5×105 клеток/мл) культивировали при возрастающем количестве NPs, покрытых при трех различных валентностях IGRP206-214/Kd. IGRP206-214 включает в себя антигенный пептид VYLKTNVFL (SEQ ID NO: 19).
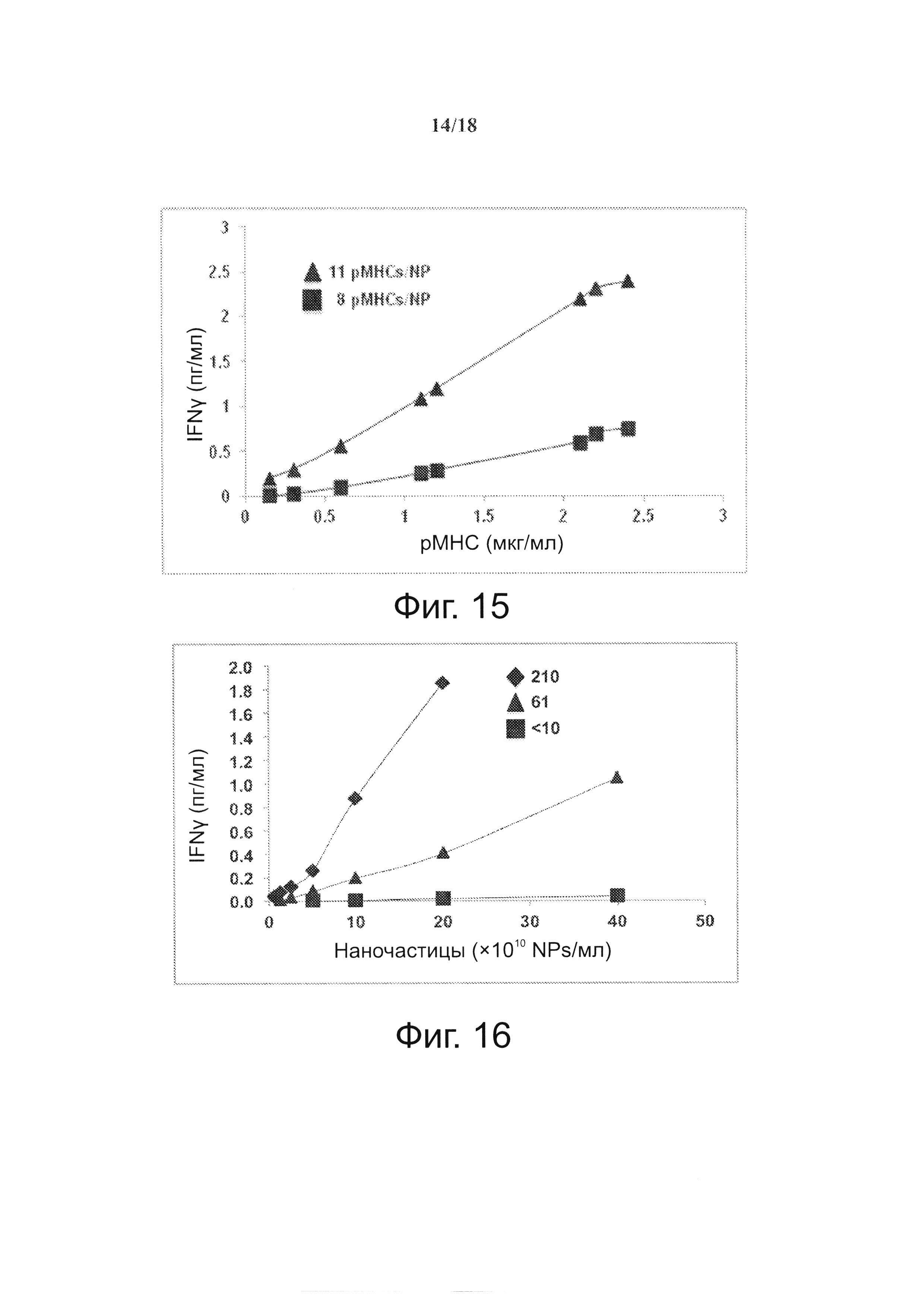
На фиг. 14 видно, что более низкая агонистическая активность pMHC-NPs может компенсироваться увеличением плотности pMHC-NPs, но только выше порога валентности рМНС. На графике представлено сравнение агонистической активности у трех разных препаратов pMHC-NP (при трех различных валентностях рМНС) при различной плотности NP. Отметим, что NPs, несущие 8 pMHCs, в отличие от несущих 11 pMHCs, не могут адекватно запускать секрецию IFNγ даже при высокой плотности pMHC-NP, по сравнению с NPs, несущими 11 и 54 pMHCs на NP.
На фиг. 15 представлено влияние порога валентности рМНС на агонистические свойства pMHC-NPs в зависимости от общего количества рМНС.
На фиг. 16 представлено влияние валентности рМНС на агонистическую активность pMHC-NPs, произведенных с более крупными ядрами NP из оксида железа.
На фиг. 17 представлено влияние размера на агонистическую активность. Au-0224-15 - это GNPs на 14 нм, покрытые при относительно низкой валентности рМНС, но полученные при высокой плотности; Au-0323-40 - это GNPs на 40 нм, покрытые при высокой валентности рМНС, но при низкой плотности. Au-0224-15 обладали лучшей агонистической активностью, чем образец Au-0323-40.
На фиг. 18 представлено влияние защитного PEG на функции pMHC-GNPs. Au-021910 содержат по ~2×1013 GNPs/мл диаметром 14 нм, защищенных тиол-PEG в 2 кДа и покрытых при ~120 pMHCs/GNP. GNPs Au-012810 (тоже при ~2×1013 GNPs/мл) были защищены тиол-PEG в 5 кДа и покрыты при ~175 pMHCs/GNP. Образец Au-021910 обладал наилучшей агонистической активностью.
На фиг. 19 представлена эффективность экспансии NRP-V7-реактивных Т-клеток CD8+ покрытыми NRP-V7/Kd золотыми наночастицами. Использовали 3×1012 NPs (размером ~10 нм), несущих 25 мкг рМНС (150 pMHC/NP). Предиабетическим 10-недельным мышам NOD делали еженедельно по две инъекции покрытых NRP-V7/Kd золотых NPs в течение 5 недель. Отрицательным контролем служил тетрамер TUM/Kd. Каждый столбец у панелей соответствует другой мыши.
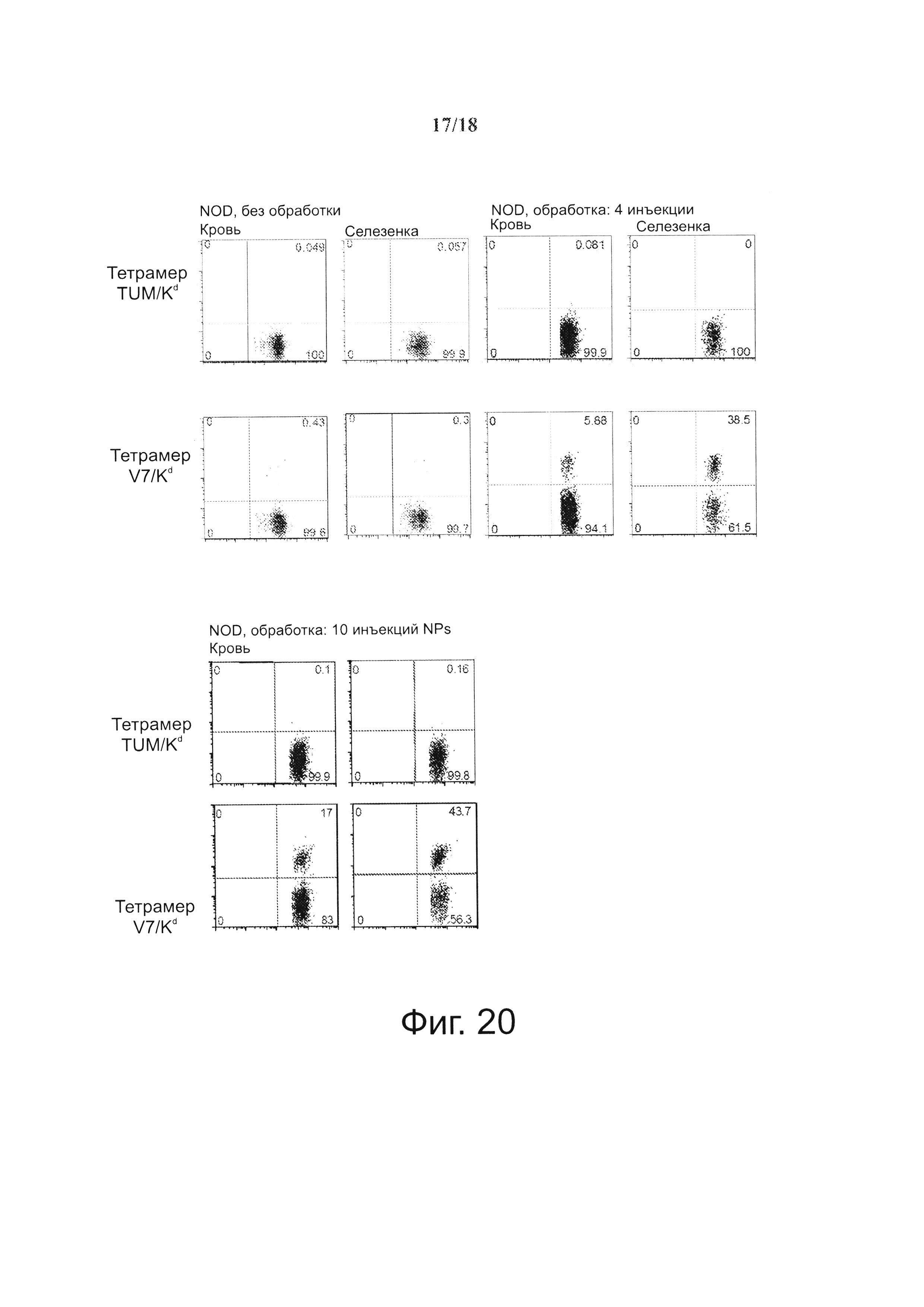
На фиг. 20 представлена сильная экспансия когнатных Т-клеток CD8+ у мышей, получавших покрытые рМНС NPs. Использовали 3×1012 NPs с IGRP206-214/Kd размером ~10 нм), несущих 25 мкг рМНС (150 pMHC/NP). Верхняя панель: профиль у мыши, забитой после 4 доз. Нижняя панель: профиль у двух разных мышей после 10 инъекций (только кровь).
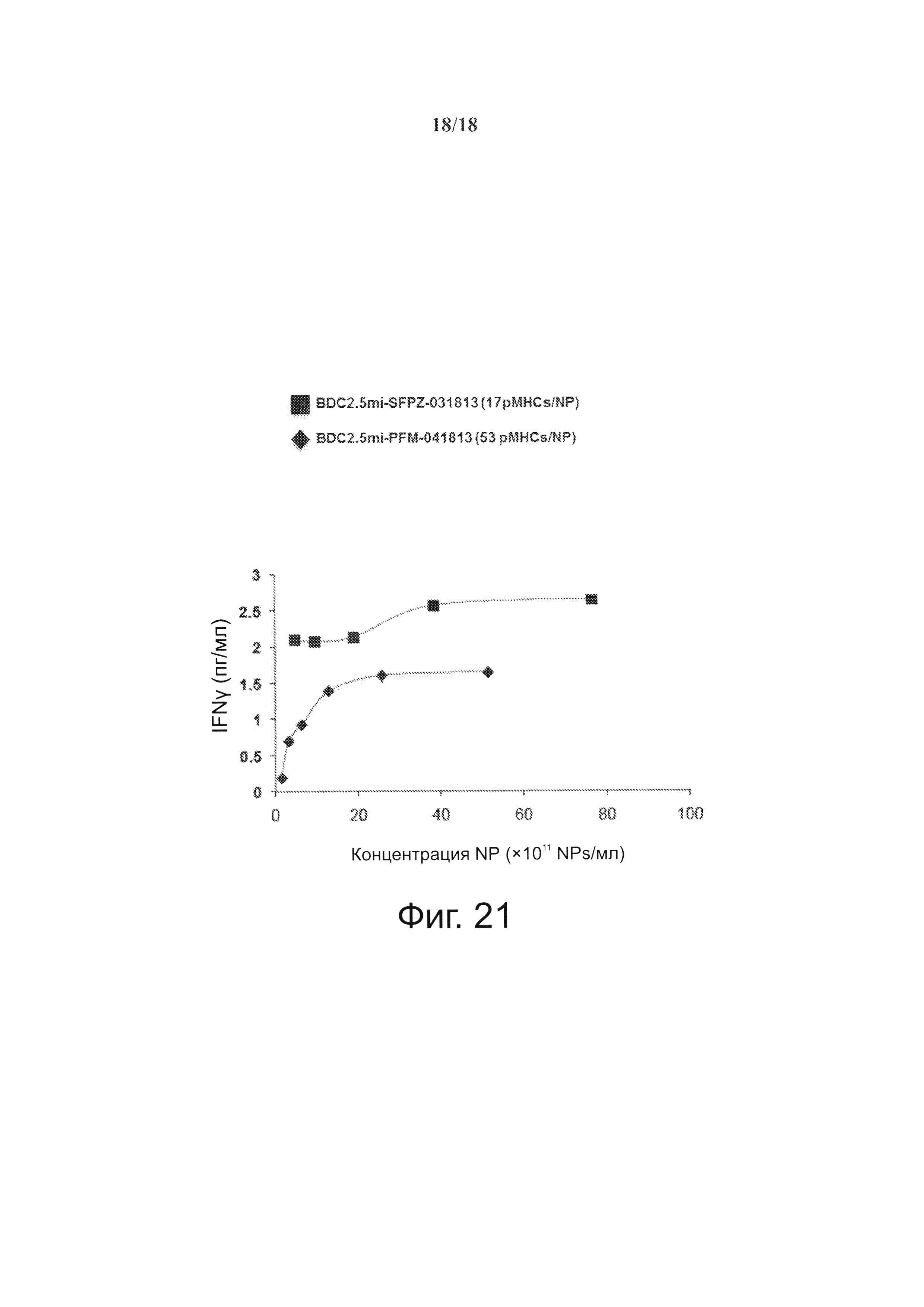
На фиг. 21 видно, что те же принципы, что и для комплексов NP с МНС класса I, применимы к покрытым рМНС класса II NPs (см. фиг. 18). Отметим, что NPs с рМНС класса II (покрытые BDC2.5mi наночастицы на 6-8 нм (SFPZ), покрытые при 17 pMHCs, обладают более высокой агонистической активностью, чем частицы PFM (20-25 нм), покрытые при 53 pMHCs на 1 NP. Это говорит о том, что в обоих случаях NPs с рМНС класса I и NPs с рМНС класса II имеет значение не абсолютная валентность рМНС, а скорее плотность рМНС, о чем свидетельствует повышение индуцированной pMHC-NP секреции IFNγ Т-клетками CD4+ в зависимости от плотности рМНС.
Осуществление изобретения
Следует иметь в виду, что настоящее изобретение не ограничивается приведенными конкретными воплощениями, так как они, конечно, могут варьироваться. Также следует иметь в виду, что используемая здесь терминология предназначается только для описания конкретных воплощений, а не для ограничения, поскольку объем настоящего изобретения должен ограничиваться только прилагаемой формулой изобретения.
Следует отметить, что используемые в данном описании и в прилагаемой формуле изобретения формы единственного числа включают в себя и значения множественного числа, если из контекста явно не следует иное. Так, например, ссылка на "наполнитель" включает в себя множество наполнителей.
Определения
Если не указано иначе, все технические и научные термины в настоящем описании имеют те значения, которые обычно понимаются рядовыми специалистами в той области, к которой относится данное изобретение. В настоящем описании следующие термины имеют следующие значения.
В настоящем описании термин "включающий" или "включает в себя" означает то, что композиции и способы включают указанные элементы, но не исключают другие. "Состоящий в основном из" при определении композиций и способов должен означать исключение других элементов, имеющих существенное значение для комбинации в указанных целях. Так, композиция, состоящая в основном из элементов, определенных в настоящем описании, не исключает другие материалы или стадии, не оказывающие существенного влияния на основные и новые характеристики заявленного изобретения, как-то композиции для лечения или профилактики рассеянного склероза. "Состоит из" означает исключение даже маловажных элементов из других ингредиентов и существенных стадий способа. Воплощения, определяемые каждым из этих переходных терминов, входят в рамки настоящего изобретения.
Под "биосовместимым" подразумевается то, что компоненты системы доставки не должны вызывать повреждения тканей или биологической системы человека. Для придания биосовместимости следует преимущественно использовать такие полимеры и наполнители, которые имели историю безопасного применения на людях или со статусом GRAS (Generally Accepted As Safe, т.е. в общем считаются безопасными). Под биосовместимостью подразумевается то, что используемые в композиции ингредиенты и наполнители в конечном итоге должны "биоабсорбироваться" или удаляться из организма без каких-либо побочных эффектов на организм. Для того чтобы композиция была биологически совместимой и считалась нетоксичной, она не должна вызывать токсичности для клеток. Точно так же термин "биоабсорбируемый" относится к тому, что наночастицы делаются из материалов, которые подвергаются биоабсорбции in vivo за определенный период времени с тем, чтобы избежать долгосрочного накопления материала у пациента. В предпочтительном воплощении биосовместимые наночастицы подвергаются биоабсорбции за период менее 2 лет, предпочтительно менее 1 года и еще более предпочтительно менее 6 месяцев. Скорость биоабсорбции зависит от размера частиц, используемого материала и других факторов, хорошо известных специалистам. Для получения наночастиц, используемых в настоящем изобретении, можно использовать смесь из биоабсорбируемых, биосовместимых материалов. В одном воплощении можно комбинировать оксид железа и биосовместимый, биоабсорбируемый полимер. Например, для получения наночастиц можно комбинировать оксид железа и PGLA.
Комплекс антиген-МНС-наночастицы относится к презентации пептида, углевода, липида или другого антигенного сегмента, фрагмента или эпитопа антигенной молекулы или белка (то есть, самого пептида или аутоантигена) на поверхности типа биосовместимых биоразлагаемых наносфер. "Антиген" в настоящем описании относится ко всей молекуле либо части, фрагменту или сегменту молекулы, которые могут индуцировать иммунный ответ у субъекта или экспансию антипатогенных клеток.
Термин "примерно" при использовании его перед числовым обозначением, например, температуры, времени, количества и концентрации, включающим диапазон, означает приближение, которое может отклоняться на (+) или (-) 10%, 5% или 1%.
"Миметик" является аналогом данного лиганда или пептида, причем аналог существенно аналогичен лиганду. "Существенно аналогичный" означает то, что аналог имеет профиль связывания, близкий лиганду, за исключением того, что миметик имеет одну или несколько функциональных групп или модификаций, которые в совокупности составляют менее 50%, менее 40%, менее 30%, менее 20%, менее 10% или менее 5% от молекулярной массы лиганда.
Рассеянный склероз (MS) также известен как "множественный склероз", "рассеянный энцефаломиелит" или "аллергический энцефаломиелит". MS представляет собой воспалительное заболевание, при котором повреждаются жировые миелиновые оболочки вокруг аксонов головного и спинного мозга, что приводит к демиелинизации и рубцеванию, а также целому ряду признаков и симптомов. Связанные с рассеянным склерозом заболевания включают, к примеру, оптиконевромиелит (NMO), увеит, невропатические боли и др.
"Гликопротеин миелина олигодендроцитов" (MOG) - это гликопротеин, который считается важным в процессе миелинизации нервов в центральной нервной системе (ЦНС). У человека этот белок кодируется геном MOG. Предположительно, он служит в качестве необходимой "молекулы адгезии", обеспечивающей структурную целостность миелиновой оболочки, и появляется на олигодендроцитах на поздней стадии. Номера доступа в GenBank NM 001008228.2 и NP 001008229.1 представляют последовательность мРНК и белка, соответственно, гена MOG. Последовательности, связанные с каждым из этих номеров доступа в GenBank, включены сюда путем ссылки на все случаи.
Термин "антипатогенные аутореактивные Т-клетки" относится к Т-клеткам с антипатогенными свойствами (т.е. Т-клеткам, противодействующим MS). Эти Т-клетки могут включать в себя противовоспалительные Т-клетки, эффекторные Т-клетки, Т-клетки памяти, Т-клетки с низкой авидностью, хелперные Т-клетки, ауторегуляторные Т-клетки, цитотоксические Т-клетки, нормальные киллерные Т-клетки, Т-клетки CD4+, Т-клетки CD8+ и др.
Термин "противовоспалительные Т-клетки" относится к таким Т-клеткам, которые способствуют противовоспалительной реакции. Противоспалительная функция Т-клеток может осуществляться путем выработки и/или секреции противовоспалительных белков, цитокинов, хемокинов и т.п. Противовоспалительные белки также охватывают антипролиферативные сигналы, подавляющие иммунные реакции. Противовоспалительные белки включают IL-4, IL-10, IL-13, IFN-α, TGF-β, IL-1ra, G-CSF и растворимые рецепторы для TNF и IL-6. В определенных воплощениях введение комплекса наночастицы-антиген-МНС приводит к экспансии и или повышенной индукции противовоспалительных Т-клеток, что эффективно для лечения рассеянного склероза. Соответственно, некоторые аспекты изобретения касаются способов лечения у пациентов воспаления, связанного с MS, причем способ включает, в основном состоит из или же заключается во введении пациенту комплекса антиген-МНС-наночастицы, причем антигеном служит антиген, связанный с рассеянным склерозом.
Термин "IL-10" или "интерлейкин-10" относится к цитокину, который кодируется геном IL-10. Последовательность IL-10 представлена в GenBank под номером доступа NM_000572.2 (мРНК) и NP_000563.1 (белок).
Термин "TGF-β" или "трансформирующий фактор роста бета" обозначает белок, который может обладать противовоспалительным действием. TGF-β представляет собой секретируемый белок, который существует по меньшей мере в трех изоформах, называемых TGF-β1, TGFβ2 и TGFβ3. Первоначально это название относилось к TGF-β1, который был основателем этого семейства. Семейство TGF-β входит в состав надсемейства белков, известных как суперсемейство трансформирующих факторов роста бета, которое включает ингибины, активин, антимюллеровский гормон, морфогенетический белок костной ткани, декапентаплегический морфоген и VG-1.
"Эффективное количество" означает количество, достаточное для достижения поставленной цели, а неограничительные примеры таковых включают: запуск иммунной реакции, модулирование иммунной реакции, подавление воспалительной реакции и модулирование активности Т-клеток или Т-клеточных популяций. В одном аспекте эффективным количеством является такое количество, которое работает на достижение заявленной терапевтической цели, например, терапевтически эффективное количество. Как описано далее более подробно, эффективное количество, или дозировка, зависит от цели и состава компонентов и может быть установлено в соответствии с настоящим описанием.
Использование единственного числа в связи с термином "содержащий" в формуле изобретения и/или описании может означать "одно", но также согласуется со значением "одно или несколько", "по меньшей мере одно" и "одно или более одного".
Под "наносферами", "ΝΡ" или "наночастицами" в настоящем описании подразумеваются небольшие дискретные частицы, которые вводятся по отдельности или во множестве субъектам, в образцы клеток или образцы ткани, как потребуется. В некоторых воплощениях наночастицы имеют практически сферическую форму. В некоторых воплощениях наночастицы не являются липосомами или вирусными частицами. В других воплощениях наночастицы являются твердыми. Термин "практически сферические" в настоящем описании означает то, что форма частиц не отклоняется от сферической более чем на 10%. На частицы могут наноситься различные известные антигены или пептидные комплексы по изобретению. Размеры наночастиц по изобретению составляют от 1 нм до 1 мкм, предпочтительно от 1 нм до 100 нм, и в некоторых аспектах относятся к среднему или медианному диаметру у множества наночастиц, когда имеется в виду множество наночастиц. Более мелкие наночастицы могут быть получены, к примеру, методом фракционирования, при этом более крупные частицы в водном растворе оседают на дно. После этого верхнюю часть раствора извлекают способами, известными специалистам в данной области. Эта верхняя часть обогащена частицами меньшего размера. Этот процесс можно повторять до тех пор, пока не получится требуемый средний размер.
Термин "или" в формуле изобретения применяется в значении "и/или", если явно не указано, что он относится только к одной альтернативе или же варианты являются взаимоисключающими, хотя в описании допускается определение, которое относится только к одной из альтернатив и "и/или".
В настоящем описании выражение "иммунный ответ" или эквивалентное "иммунологическая реакция" относится к возникновению клеточного ответа (опосредованного антиген-специфичными Т-клетками или продуктами их секреции). Клеточный иммунный ответ возникает при презентации полипептидных эпитопов вместе с молекулами МНС класса I или класса II, при этом активируются антиген-специфичные хелперные Т-клетки CD4+ и/или цитотоксические Т-клетки CD8+. Реакция также может включать активацию и других компонентов.
Термины "воспалительная реакция" и "воспаление" в настоящем описании обозначают сложные биологические реакции сосудистых тканей организма на вредные раздражители, такие как патогены, поврежденные клетки или раздражители, и включают секрецию цитокинов, в частности провоспалительных цитокинов, т.е. таких цитокинов, которые вырабатываются преимущественно активированными иммунными клетками и участвуют в усилении воспалительных реакций. Примеры провоспалительных цитокинов включают, без ограничения, IL-1, IL-6, TNF-α, IL-17, IL-21, IL-23 и TGF-β. Примеры воспаления включают острое воспаление и хроническое воспаление. Острое воспаление означает краткосрочный процесс, характеризующийся классическими признаками воспаления (отек, покраснение, боль, жар и потеря функции) вследствие инфильтрации тканей плазмой и лейкоцитами. Острое воспаление обычно возникает тогда, когда есть вредный раздражитель, и прекращается после того, как раздражитель будет удален, разрушен или отгорожен рубцами (фиброз). Хроническое воспаление означает такое состояние, которое характеризуется одновременно активным воспалением, разрушением ткани и попытками восстановления. Хроническое воспаление не характеризуется классическими признаками острого воспаления, перечисленными выше. Вместо этого хронически воспаленная ткань характеризуется инфильтрацией мононуклеарных иммунных клеток (моноциты, макрофаги, лимфоциты и плазматические клетки), разрушением ткани и попытками излечения, которые включают ангиогенез и фиброз. Воспаление может быть подавлено, в смысле настоящего описания, путем воздействия, в частности, подавления любого из событий, формирующих сложную биологическую реакцию в связи с воспалением в организме.
Термины "эпитоп" и "антигенная детерминанта" применяются взаимозаменяемо для обозначения того места на антигене, с которым реагируют В- и/или Т-клетки или которое они распознают. В-клеточные эпитопы могут состоять из смежных аминокислот либо из несмежных аминокислот, приходящих в соприкосновение при третичной укладке белка. Эпитопы, состоящие из смежных аминокислот, как правило, сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образовавшиеся при третичной укладке, обычно теряются при обработке денатурирующими растворителями. Как правило, эпитоп включает по меньшей мере 3, а чаще по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Методы определения пространственной конформации эпитопов включают, к примеру, рентгеновскую кристаллографию и 2-мерный ядерный магнитный резонанс. Например, см. Glenn Ε. Morris, Epitope Mapping Protocols (1996). Т-клетки распознают непрерывные эпитопы из 9 аминокислот для клеток CD8 или 13-15 аминокислот для клеток CD4. Распознающие эпитоп Т-клетки можно идентифицировать методами анализа in vitro, в которых измеряется антиген-зависимая пролиферация по включению 3Н-тимидина примированными Т-клетками в ответ на эпитоп (Burke et al., J. Inf. Dis., 170: 1110-1119, 1994), по антиген-зависимой гибели клеток (определение цитотоксических Т-лимфоцитов, Tigges et al., J. Immunol., 156(10): 3901-3910, 1996) или по секреции цитокинов. Наличие иммунологической клеточной реакции можно определить методом анализа пролиферации (Т-клетки CD4+) или анализа CTL (цитотоксические Т-лимфоциты).
Необязательно антиген или предпочтительно эпитоп антигена можно химически конъюгировать или экспрессировать в виде слитого белка с другими белками типа МНС и родственных МНС белков.
В настоящем описании термины "пациент" и "субъект" применяются как синонимы и относятся к млекопитающим. В некоторых воплощениях пациентом является человек. В других воплощениях пациентом являются млекопитающие, которые обычно используются в лаборатории, такие как мыши, крысы, обезьяны, собаки, кошки, коровы, лошади или овцы.
В настоящей заявке термин "полинуклеотид" относится к таким молекулам нуклеиновой кислоты, которые либо являются рекомбинантными, либо были выделены свободными от общей геномной нуклеиновой кислоты. Термин "полинуклеотид" охватывает олигонуклеотиды (нуклеиновые кислоты длиною в 100 остатков или меньше), рекомбинантные векторы, в том числе, к примеру, плазмиды, космиды, фаги, вирусы и т.п. В некоторых аспектах полинуклеотиды включают регуляторные последовательности, существенно выделенные из своих природных генов или последовательностей, кодирующих белок. Полинуклеотиды могут представлять собой РНК, ДНК, их аналоги либо их комбинации. Нуклеиновая кислота, кодирующая весь полипептид или часть его, может содержать непрерывную последовательность нуклеиновой кислоты, кодирующей весь полипептид или часть такого полипептида, следующей длины: 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340, 350, 360, 370, 380, 390, 400, 410, 420, 430, 440, 441, 450, 460, 470, 480, 490, 500, 510, 520, 530, 540, 550, 560, 570, 580, 590, 600, 610, 620, 630, 640, 650, 660, 670, 680, 690, 700, 710, 720, 730, 740, 750, 760, 770, 780, 790, 800, 810, 820, 830, 840, 850, 860, 870, 880, 890, 900, 910, 920, 930, 940, 950, 960, 970, 980, 990, 1000, 1010, 1020, 1030, 1040, 1050, 1060, 1070, 1080, 1090, 1095, 1100, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 9000, 10000 или более нуклеотидов, нуклеозидов или пар оснований. Кроме того, предусматривается, что определенный полипептид из данного вида может кодироваться нуклеиновыми кислотами, содержащими природные варианты, имеющие несколько различные последовательности нуклеиновой кислоты, но тем не менее кодирующие тот же самый или существенно близкий белок, полипептид или пептид.
Полинуклеотиды состоят из определенной последовательности четырех основных нуклеотидов: аденина (А); цитозина (С); гуанина (G); тимина (Т); и урацила (U) вместо тимина, если полинуклеотид представлен РНК. Таким образом, термин "последовательность полинуклеотида" означает буквенное представление молекулы полинуклеотида. Такое буквенное представление можно вводить в базы данных в компьютере, имеющем центральный процессор, и использовать для биоинформатических приложений, таких как функциональная геномика и поиск по гомологии.
Термин "выделенный" или "рекомбинантный" в применении к таким нуклеиновым кислотам, как ДНК или РНК, относится к молекулам, отделенным от других ДНК или РНК, соответственно, присутствующих в природном источнике макромолекулы, а также полипептидов. Термин "выделенная или рекомбинантная нуклеиновая кислота" служит для обозначения таких фрагментов нуклеиновых кислот, которые не встречаются в природе в виде фрагментов и вообще не встречаются в естественном состоянии. Термин "выделенный" также применяется для обозначения таких полинуклеотидов, полипептидов и белков, которые отделены от других клеточных белков, и охватывает как очищенные, так и рекомбинантные полипептиды. В других воплощениях термин "выделенный или рекомбинантный" означает отделенный от таких компонентов, клеточных и прочих, с которыми клетки, ткани, полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты обычно связаны в природе. Например, выделенной является такая клетка, которая отделена от ткани или клеток с другим фенотипом или генотипом. Выделенный полинуклеотид отделен от смежных 3'- и 5'-нуклеотидов, с которыми он обычно связан в своем природном окружении, например, на хромосоме. Как должно быть известно специалистам, не встречающиеся в природе полинуклеотиды, пептиды, полипептиды, белки, антитела или их фрагменты не требует "выделения", чтобы отличить их от природных аналогов.
Полинуклеотид или участок полинуклеотида (либо полипептид или участок полипептида), имеющий определенный процент (к примеру, 80%, 85%, 90% или 95%) "идентичности последовательности" с другой последовательностью, означает то, что при совмещении этот процент оснований (или аминокислот) будет одинаковым при сравнении этих двух последовательностей. Совмещение и степень гомологии или идентичности последовательностей можно определить с помощью программ, известных в данной области, например, описанных в Current Protocols in Molecular Biology (Ausubel et al., eds. 1987) Supplement 30, раздел 7.7.18, таблица 7.7.1. Предпочтительно для совмещения используют параметры по умолчанию. Предпочтительной программой для совмещения выравнивания является программа BLAST с параметрами по умолчанию. В частности, в предпочтительных программах BLASTN и BLASTP используются следующие параметры по умолчанию: генетический код = стандартный; фильтр = нет; нить = обе; отсечка = 60; ожидание = 10; матрица = BLOSUM62; описания = 50 последовательностей; сортировка по = высокий показатель; базы данных = без избыточности, GenBank + EMBL + DDBJ + PDB + GenBank, трансляции CDS + SwissProtein + SPupdate + PIR. Подробную информацию об этих программах можно получить по следующему адресу в Интернете: ncbi.nlm.nih.gov/cgi-bin/BLAST.
Следует иметь в виду без прямого указания и если не предусмотрено иначе, что, когда настоящее изобретение касается полипептида, белка, полинуклеотида или антитела, то в рамки настоящего изобретения входят эквиваленты или биологические эквиваленты таковых. В настоящем изобретении термин "биологический эквивалент" является синонимом "эквивалента" в отношении контрольного белка, антитела, фрагмента, полипептида или нуклеиновой кислоты и означает то, что он имеет минимальную гомологию при сохранении требуемой структуры или функции. Если это специально не указано, то предусматривается, что любой приведенный здесь полинуклеотид, полипептид или белок также включает свои эквиваленты. В одном аспекте эквивалентным является такой полинуклеотид, который гибридизуется в строгих условиях с полинуклеотидом или комплементарным ему полинуклеотидом, как описано здесь для применения в описанных способах. В другом аспекте эквивалентное антитело или антиген-связывающий полипептид означает такой, который связывается с контрольным антителом или антиген-связывающим фрагментом со сродством по меньшей мере в 70% или же 75% или же 80% или же 85% или же 90% или же 95% или больше. В другом аспекте такой эквивалент конкурирует за связывание антитела или антиген-связывающего фрагмента со своим антигеном при конкурентном анализе ELISA. В другом аспекте эквивалент означает гомологичность или идентичность по меньшей мере на 80% или же на 85% или же на 90% или же на 95% или же на 98% процентов и проявляет биологическую активность, практически эквивалентную контрольному белку, полипептиду или нуклеиновой кислоте.
"Гибридизация" означает такую реакцию, при которой один или несколько полинуклеотидов взаимодействуют с образованием комплекса, который стабилизуется путем образования водородных связей между основаниями нуклеотидных остатков. Водородные связи могут образовываться путем спаривания оснований по Уотсону-Крику, связывания по Hoogstein или любым иным специфичным для последовательности образом. Комплекс может включать две нити, образующие двойную спираль, три или несколько нитей, образующих мультицепочечный комплекс, одну самогибридизующуюся нить или любую комбинацию из них. Реакция гибридизации может составлять одну стадию в более широком процессе типа инициации реакции ПЦР или ферментативного расщепления полинуклеотида рибозимом.
Примеры строгих условий гибридизации включают: температура при инкубации от 25°С до 37°С; концентрация буфера для гибридизации от 6×SSC до 10×SSC; концентрация формамида от 0% до 25%; и раствор для отмывки от 4×SSC до 8×SSC. Примеры умеренных условий гибридизации включают: температура при инкубации от 40°С до 50°С; концентрация буфера от 9×SSC до 2×SSC; концентрация формамида от 30% до 50%; и раствор для отмывки от 5×SSC до 2×SSC. Примеры условий высокой строгости включают: температура при инкубации от 55°С до 68°С; концентрация буфера от 1×SSC до 0,1×SSC; концентрация формамида от 55% до 75%; и раствор для отмывки 1×SSC, 0,1×SSC или деионизированная вода. В общем, время инкубации при гибридизации составляет от 5 минут до 24 часов при 1, 2 или нескольких стадиях отмывки, а время инкубации при отмывке составляет 1, 2 или 15 минут. SSC означает 0,15 M NaCl и 15 мМ цитратный буфер. Предполагается, что можно использовать эквиваленты SSC с другими буферными системами.
"Гомологичность" или "идентичность" или "сходство" относится к сходству последовательностей между двумя пептидами или между двумя молекулами нуклеиновой кислоты. Гомологичность можно определить путем сравнения положений в каждой из последовательностей, которые совмещаются в целях сравнения. Если положение в сравниваемой последовательности занимают одинаковые основания или аминокислоты, то эти молекулы являются гомологичными в этом положении. Степень гомологии между последовательностями зависит от количества совпадающих или гомологичных положений у этих последовательностей. "Неродственные" или "не гомологичные" последовательности менее чем на 40% идентичны или же менее чем на 25% идентичны одной из последовательностей настоящего изобретения.
"Гомологичность" или "идентичность" или "сходство" также может относиться к двум молекулам нуклеиновых кислот, гибридизующихся в строгих условиях.
В настоящем изобретении термины "лечить", "лечение" и подобные им применяются в значении получения требуемого фармакологического и/или физиологического эффекта. Эффект может быть терапевтическим в смысле частичного или полного излечения заболевания и/или неблагоприятного эффекта, относящегося к заболеванию. В одном аспекте лечение означает ослабление признаков болезни по установленной шкале.
В настоящем изобретении термин "связанное с рассеянным склерозом заболевание" означает такое заболевание, которое проявляется вместе с восприимчивостью к MS или самим MS. Неограничительные примеры таковых включают оптиконевромиелит (NMO), увеит, нейропатические боли, атеросклероз, артериосклероз, рассеянный системный склероз, оптикоспинальный MS, первичный прогрессирующий MS (PPMS) и рецидивирующий-ремиттирующий MS (RRMS), прогрессирующий системный склероз и атаксический склероз.
IGRP, который кодируется геном, находящимся на хромосоме 2q28-32 и перекрывающим локус подверженности T1D, IDDM7 (2q31), также недавно идентифицирован как бета-клеточный аутоантиген, потенциально имеющий отношение к T1D человека. Два связывающих HLA-A*0201 эпитопа IGRP человека (hIGRP228-236 и hIGRP265-273) распознаются связанными с островками клетками CD8 у дефектных по МНС класса I мышей NOD, экспрессирующих трансген HLA-A*0201. IGRP206-214 включает в себя антигенный пептид VYLKTNVFL.
"Профилактика" означает предотвращение заболевания или эффекта в системе in vitro или in vivo у системы или субъекта, предрасположенного к этому заболеванию или эффекту.
"Композиция" означает комбинацию из активного вещества и другого соединения или состава, инертного (например, детектируемый реагент или метка) или активного, типа адъюванта. В некоторых воплощениях композиция не содержит адъюванта.
"Фармацевтическая композиция" означает комбинацию активного вещества с носителем, инертным или активным, что делает композицию пригодной для диагностического или терапевтического применения in vitro, in vivo или ex vivo.
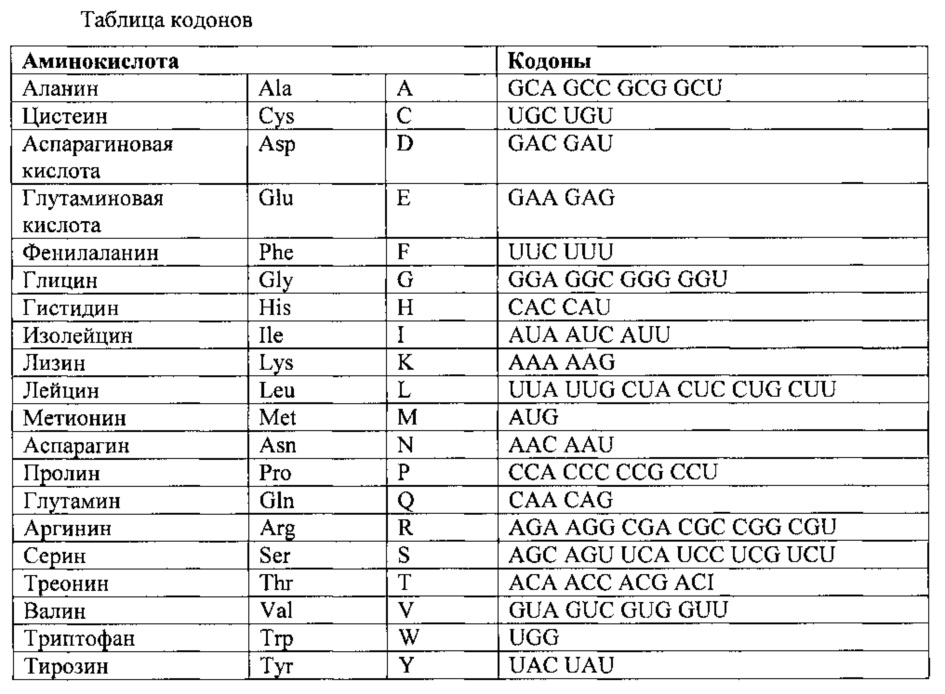
Термин "функционально эквивалентный кодон" применяется для обозначения кодонов, кодирующих одну и ту же аминокислоту, как-то 6 кодонов для аргинина или серина, а также относится к кодонам, кодирующим биологически эквивалентные аминокислоты (см. таблицу ниже).
В настоящем изобретении термин "белок" или "полипептид" или "пептид" относится к молекулам, содержащим по меньшей мере 5 аминокислотных остатков.
Другие цели, особенности и преимущества настоящего изобретения станут понятными из нижеследующего подробного описания. Однако следует иметь в виду, что подробное описание и конкретные примеры, хотя в них и изложены конкретные воплощения изобретения, приводятся только в качестве иллюстрации, так как из данного подробного описания специалистам должны стать очевидными различные изменения и модификации в пределах сущности и объема изобретения. Описание воплощений
Настоящее описание основывается на открытии того, что наночастицы, соединенные с комплексами относящихся к MS антигенов с МНС, ослабляют симптомы MS или энцефаломиелита (ЕАЕ) (пример 1).
Способы
Описанные здесь способы включают или состоят в основном или же заключаются во введении эффективного количества комплекса антиген-МНС-наночастицы в клетки, ткани или субъектам в целях: (1) экспансии и/или выработки антипатогенных (или анти-MS) аутореактивных Т-клеток; и/или (2) лечения или профилактики рассеянного склероза или связанных с рассеянным склерозом заболеваний у пациентов с рассеянным склерозом или связанными с рассеянным склерозом заболеваниями либо у пациентов, восприимчивых к рассеянному склерозу или связанным с рассеянным склерозом заболеваниям, в одном аспекте без ослабления системного иммунитета. Антигеном в этом комплексе служит связанный с рассеянным склерозом антиген. Методы определения и мониторинга терапии известны в данной области и вкратце описаны здесь. При введении in vitro введение осуществляется путем контактирования композиции с тканью или клетками любым подходящим способом, например, введением в среду для культуры клеток или тканей, что применимо при скрининге на предмет того, подойдет ли терапия для данного лица, или при скрининге альтернативных терапий, которые можно использовать в качестве замены или в комбинации с описанными композициями. При введении in vivo введение осуществляется системно или локально. In vivo способы могут выполняться на животных, а не на людях, для скрининга альтернативных терапий, которые можно использовать в качестве замены или в комбинации с описанными композициями перед введением людям. Они также применимы для лечения заболеваний у человека или других млекопитающих.
Способы требуют введения эффективного количества комплекса, включающего, состоящего в основном или же состоящего из наночастиц; белка МНС; и связанного с рассеянным склерозом антигена.
МНС у комплекса антиген-МНС-наночастицы может представлять собой МНС I, МНС II или неклассический МНС. Белки МНС описаны здесь. В одном воплощении МНС у комплекса антиген-МНС-наночастицы представлен МНС класса I. В другом воплощении МНС представлен МНС класса И. В других воплощениях МНС-компонент у комплекса антиген-МНС-наночастицы представлен МНС класса II или неклассической молекулой МНС, как описано здесь. В одном аспекте антиген включает или же состоит в основном из или же состоит из полипептида GWYRSPFSRVVH (SEQ ID NO: 1) или эквивалента SEQ ID NO: 1. Другие антигены, которые можно использовать в данном изобретении, включают полипептиды, включающие или же состоящие в основном из или же состоящие из полипептидов группы: 
 или эквивалентов каждого из них либо их комбинаций.
или эквивалентов каждого из них либо их комбинаций.
Размер наночастиц может составлять от 1 нм до 1 мкм. В некоторых воплощениях диаметр наночастиц составляет менее 1 мкм. В других воплощениях диаметр наночастиц составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях диаметр наночастиц составляет от 1 нм до 10 нм, 15 нм, 20 нм, 25 нм, 30 нм, 40 нм, 50 нм, 75 нм или 100 нм. В определенных воплощениях диаметр наночастиц составляет от 1 нм до 100 нм, от 1 нм до 50 нм, от 1 нм до 20 нм или от 5 нм до 20 нм.
Размер комплекса может составлять от 5 нм до 1 мкм. В некоторых воплощениях диаметр комплекса составляет менее 1 мкм или же менее 100 нм. В других воплощениях диаметр комплекса составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В определенных воплощениях диаметр комплекса составляет от 10 нм до 50 нм или от 20 нм до 75 нм или от 25 нм до 60 нм или от 30 нм до 60 нм, а в одном аспекте около 55 нм.
Заявитель обнаружил, что плотность комплексов антиген-МНС на наночастицах способствует терапевтическому эффекту. Таким образом, как изложено здесь, комплекс антиген-МНС-наночастицы может иметь заданную плотность в пределах от 0,05 молекул МНС на 100 нм2 площади поверхности наночастицы, полагая по меньшей мере 2 МНС или же по меньшей мере 8 или же по меньшей мере 9 или же по меньшей мере 10 или же по меньшей мере 11 или же по меньшей мере 12 МНС в комплексе с наночастицами. В одном аспекте комплекс имеет плотность МНС от 0,01 МНС на 100 нм2 (0,05 МНС/100 нм2) до 30 МНС/100 нм2 или же от 0,1 МНС/100 нм2 до 25 МНС/100 нм2 или же от 0,3 МНС/100 нм2 до 25 МНС/100 нм2 или же от 0,4 МНС/100 нм2 до 25 МНС/100 нм2 или же от 0,5 МНС/100 нм2 до 20 МНС/100 нм2 или же от 0,6 МНС/100 нм2 до 20 МНС/100 нм2 или же от 1,0 МНС/100 нм2 до 20 МНС/100 нм2 или же от 5,0 МНС/100 нм2 до 20 МНС/100 нм2 или же от 10,0 МНС/100 нм2 до 20 МНС/100 нм2 или же от 15 МНС/100 нм2 до 20 МНС/100 нм2 либо по меньшей мере 0,5 или же по меньшей мере 1,0 или же по меньшей мере 5,0 или же по меньшей мере 10,0 или же по меньшей мере 15,0 МНС/100 нм2. В одном аспекте, когда в комплексе с наночастицами находится 9 или по меньшей мере 9 МНС, диапазон плотности составляет от 0,3 МНС/100 нм2 до 20 МНС/100 нм2.
В одном из аспектов способа предусмотрен способ накопления противовоспалительных Т-клеток у нуждающихся в этом пациентов. В другом воплощении Т-клетки представлены Т-клетками CD4+ или CD8+. В родственном воплощении Т-клетки секретируют IL-10 или TGF-β. Способ включает, в основном состоит из или же заключается во введении нуждающимся в этом пациентам эффективного количества описанного здесь комплекса антиген-МНС-наночастицы.
В одном из воплощений описанные здесь способы предназначены для лечения связанных с рассеянным склерозом заболеваний. Способ включает, в основном состоит из или же заключается во введении нуждающимся в этом пациентам эффективного количества описанного здесь комплекса антиген-МНС-наночастицы. В родственном воплощении связанные с рассеянным склерозом заболевания выбирают из группы, состоящей из оптиконевромиелита (NMO), увеита и невропатической боли.
Детали касательно способов введения in vitro и in vivo описаны ниже.
Комплексы антиген-МНС-наночастицы
Некоторые аспекты относятся к процессам получения специфичных к антигенам MS лекарственных средств, которые специфично лечат MS без ослабления системного иммунитета. В примере 2 описано получение комплексов антиген-МНС-наночастицы. Комплексы антиген-МНС-наночастицы, используемые в данном изобретении, содержат относящийся к MS антиген.
А. Полипептиды и полинуклеотиды
Следующие аспекты касаются выделенных или очищенных полипептидов, включающих или в основном состоящих или же состоящих из аминокислотной последовательности SEQ ID NO: 1, либо полипептидов, у которых последовательность по меньшей мере на 80% или же по меньшей мере на 85% или же по меньшей на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% идентична последовательности SEQ ID NO: 1, либо полипептидов, кодируемых полинуклеотидами, у которых последовательность по меньшей мере на 80% или же по меньшей мере на 85% или же по меньшей мере на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% идентична последовательности полинуклеотида, кодирующего SEQ ID NO: 1, или комплементарного ему, либо полипептидов, кодируемых полинуклеотидами, гибридизующимися в условиях умеренной или высокой строгости с полинуклеотидом, кодирующим SEQ ID NO: 1, или комплементарным ему. Также предусмотрены выделенные и очищенные полинуклеотиды, кодирующие полипептиды, соответствующие SEQ ID NO: 1 или последовательности, по меньшей мере на 80% или же по меньшей мере на 85% или же по меньшей на 90% или же по меньшей мере на 95% или же по меньшей мере на 98% идентичной SEQ ID NO: 1 или ее эквивалентам, либо полинуклеотиды, гибридизующиеся в строгих условиях с этими полинуклеотидами, их эквиваленты или комплементарные им, а также выделенные или очищенные полипептиды, кодируемые этими полинуклеотидами. Такие полипептиды и полинуклеотиды можно комбинировать с не встречающимися в природе веществами, с которыми они не связаны в природе, например, носителями, фармацевтически приемлемыми носителями, векторами и молекулами МНС, наночастицами, известными в данной области и описанными здесь.
Антигены, в том числе сегменты, фрагменты и другие молекулы, происходящие из различных антигенов, включая, без ограничения, пептиды, углеводы, липиды и другие молекулы, презентируемые классическими и неклассическими молекулами МНС по изобретению, как правило, образуют комплекс или функционально соединяются с молекулами МНС или их производными. Распознавание антигенов Т-лимфоцитами ограничивается главным комплексом гистосовместимости (МНС). Антигены распознаются Т-лимфоцитами только тогда, когда они связаны с определенной молекулой МНС. В общем, Т-лимфоциты стимулируются только в присутствии своих молекул МНС, а антигены распознаются как фрагменты антигена, связанные со своими молекулами МНС. МНС-рестрикция определяет специфичность Т-лимфоцитов и в отношении распознаваемых антигенов, и в отношении молекул МНС, связывающих свои антигенные фрагменты. В определенных аспектах некоторые антигены образуют пары с определенными молекулами МНС или происходящими из них полипептидами.
Термин "функционально соединенный" или "покрытый" в настоящем изобретении относится к тому, что отдельные полипептиды (например, МНС) и компоненты антигенов (например, пептиды) сочетаются с образованием активного комплекса перед связыванием в заданном сайте, например, с иммунными клетками. Сюда относятся ситуации, когда отдельные компоненты полипептидного комплекса синтезируются или рекомбинантно экспрессируются, а затем выделяются и сочетаются с образованием комплекса in vitro, до введения субъектам; ситуации, когда химерные или слитые полипептиды (т.е. каждый дискретный белковый компонент комплекса содержится в одной полипептидной цепи) синтезируются или рекомбинантно экспрессируются в виде интактного комплекса. Как правило, полипептидные комплексы добавляются к наночастицам, образуя наночастицы с адсорбированными или присоединенными полипептидными комплексами, у которых соотношение количества молекул на 1 наночастицу составляет примерно, не менее или не более 0,1, 0,5, 1, 3, 5, 7, 10, 15, 20, 25, 30, 35, 40, 50, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 600, 700, 800, 900, 1000, 1500 или больше, чаще всего от 0,1:1, 1:1 до 50:1 или 300:1. Содержание полипептида в наночастицах можно определить стандартными методами. В. Молекулы МНС
Внутриклеточные и внеклеточные антигены представляют совершенно разные проблемы для иммунной системы, как в отношении распознавания, так и надлежащего реагирования. Презентация антигенов Т-клеткам опосредуется двумя различными классами молекул: МНС класса I (МНС-I) и МНС класса II (МНС-II) (которые здесь также обозначаются как "рМНС"), которые используют разные пути процессинга антигенов. Пептиды, происходящие из внутриклеточных антигенов, презентируются Т-клеткам CD8+ молекулами МНС класса I, которые экспрессируются практически во всех клетках, тогда как пептиды происходящие из внеклеточных антигенов, презентируются Т-клеткам CD4+ молекулами МНС-II. Однако есть некоторые исключения из этой дихотомии. Некоторые исследования показали, что пептиды, происходящие из эндоцитированных частиц или растворимых белков, презентируются на молекулах МНС-I как в макрофагах, так и в дендритных клетках. В некоторых воплощениях изобретения определенные антигены представлены в комплексе антиген-МНС-наночастицы в контексте соответствующего полипептида МНС класса I или II. В некоторых аспектах может проводиться оценка генетической структуры субъекта для определения того, какой полипептид МНС следует использовать для данного пациента и данного набора пептидов. В некоторых воплощениях компонент МНС класса I содержит все молекулы HLA-A, HLA-B, HLA-C, HLA-E, HLA-F, HLA-G или CD-I или часть из них. В тех воплощениях, в которых компонент МНС представлен МНС класса II, компонент МНС класса II может содержать все HLA-DR, HLA-DQ или HLA-DP или часть из них.
Также предусмотрено использование неклассических молекул МНС в комплексах МНС по изобретению. Неклассические молекулы МНС неполиморфны и консервативны у разных видов и имеют узкие, глубокие, гидрофобные карманы для связывания лигандов. Эти связывающие карманы способны презентировать гликолипиды и фосфолипиды Т клеткам нормальных киллеров (NKT) или определенным подмножествам Т-клеток CD8+, таким как Qal или подвергающиеся рестрикции HLA-E Т-клетки CD8+. Клетки NKT представляют собой уникальную популяцию лимфоцитов, которая совместно экспрессирует клеточные маркеры NK и полуинвариантный Т-клеточный рецептор (TCR). Они участвуют в регуляции иммунных реакций, связанных с широким спектром болезней.
С. Антигенные компоненты
Некоторые аспекты изобретения включают в себя способы и композиции в связи с антигенными композициями, включающими сегменты, фрагменты или эпитопы полипептидов, пептидов, нуклеиновых кислот, углеводов, липидов и других молекул, вызывающих или индуцирующих антигенные реакции, которые обычно именуются антигенами. В частности, можно идентифицировать антигенные сегменты или фрагменты антигенных детерминант, приводящие к разрушению клеток посредством аутоиммунных реакций, и использовать их при создании описанного здесь комплекса антиген-МНС-наночастицы. Воплощения изобретения включают композиции и способы модулирования иммунного ответа в клетках или тканях организма.
Полипептиды и пептиды по изобретению могут быть модифицированы различными делециями, вставками и/или заменами аминокислот. В определенных воплощениях модифицированные полипептиды и/или пептиды обладают способностью модулировать иммунные реакции у субъектов. В некоторых воплощениях используются варианты дикого типа белка или пептида, однако во многих воплощениях изобретения используются модифицированные белки или полипептиды для получения комплекса антиген-МНС-наночастицы. Комплекс антиген-МНС-наночастицы может применяться для выработки противовоспалительного иммунного ответа, для модификации Т-клеточных популяций иммунной системы (т.е. перевоспитания иммунной системы) и/или для стимуляции привлечения и накопления противовоспалительных Т-клеток в определенной ткани. При этом приведенные выше термины могут применяться взаимозаменяемо. "Модифицированный белок" или "модифицированный полипептид" или "модифицированный пептид" означает такой белок или полипептид, химическая структура которого, в частности его аминокислотная последовательность, изменена по отношению к белку или полипептиду дикого типа. В некоторых воплощениях модифицированный белок или полипептид или пептид имеет по меньшей мере одну модифицированную активность или функцию (учитывая, что белки или полипептиды или пептиды могут иметь несколько активностей или функций). Специально предусмотрено, что модифицированный белок или полипептид или пептид может быть изменен в отношении одной активности или функции, хотя в других отношениях сохраняется активность или функция дикого типа, как-то иммуногенность или способность взаимодействовать с другими клетками иммунной системы в контексте комплекса МНС-наночастицы.
Антигены по изобретению, включают антигены, связанные с рассеянным склерозом. Такие антигены включают, к примеру, приведенные в US Pat. Арр. No. 2012-0077686, и антигены, происходящие из основного белка миелина, связанного с миелином гликопротеина, белка миелина олигодендроцитов, белка протеолипида, олигопротеида миелина олигодендроцитов, связанного с миелином основного белка олигодендроцитов, специфического белка олигодендроцитов, белков теплового шока, специфических белков олигодендроцитов NOGO А, гликопротеина Ро, периферического белка миелина 22 и 3'-фосфодиэстераза 2',3'-циклических нуклеотидов. В некоторых воплощениях антиген происходит из гликопротеина миелина олигодендроцитов (MOG). В родственном воплощении антиген соответствует такому полипептиду, который по меньшей мере на 80% идентичен полипептиду, включающему последовательность SEQ ID NO: 1, либо такому полипептиду, который кодируется полинуклеотидом, гибридизирующимся в условиях умеренной или высокой строгости с полинуклеотидом, кодирующим последовательность SEQ ID NO: 1 или такую последовательность, которая по меньшей мере на 80% идентична последовательности SEQ ID NO: 1, либо с комплементарным ему полинуклеотидом.
В некоторых воплощениях размер белка или полипептида (дикого типа или модифицированного), включая любые комплексы данного белка или пептида, в частности, слитые белки МНС-пептид, может составлять, без ограничения, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975, 1000, 1100, 1200, 1300, 1400, 1500, 1750, 2000, 2250, 2500 аминокислот или больше, включая любые интервалы или выводимые из них значения или их производные. В некоторых аспектах, в качестве антигенов могут использоваться 5, 6, 7, 8, 9, 10 или больше смежных аминокислот, включая их производные, а также фрагменты антигенов типа приведенных здесь аминокислотных последовательностей. Предусматривается, что полипептиды могут видоизменяться путем усечения, что делает их короче, чем соответствующие формы дикого типа, а также они могут быть видоизменяться путем слияния или конъюгации с последовательностью гетерологичного белка с определенной функцией (например, для презентации в виде белкового комплекса, для повышения иммуногенности и пр.).
Белковые композиции могут быть получены любым способом, известным специалистам в данной области, включая (i) экспрессию белков, полипептидов или пептидов стандартными методами молекулярной биологии, (ii) выделение белковых соединений из природных источников и (iii) химический синтез белковых материалов. Нуклеотидные, а также белковые, полипептидные и пептидные последовательности для различных генов были описаны ранее и могут быть найдены в признанных компьютерных базах данных. Одними из таких баз данных являются базы данных GenBank и GenPept из National Center for Biotechnology Information (во всемирной сети на ncbi.nlm.nih.gov/). Все кодирующие областей для этих генов или их части могут быть амплифицированы и/или экспрессированы с помощью методов, изложенных здесь или известных рядовым специалистам в данной области.
Варианты аминокислотной последовательности аутоантигенных эпитопов и других полипептидов в этих композициях могут быть получены путем замещения, вставки или делеции. Модификации у полипептидов по изобретению могут затрагивать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500 или больше несмежных или смежных аминокислот пептида или полипептида по сравнению с диким типом.
У подвергнутых делеции вариантов обычно не хватает одного или нескольких остатков из нативной или аминокислотной последовательности дикого типа. Делеции могут подвергаться отдельные остатки или несколько смежных аминокислот. В кодирующую последовательность нуклеиновой кислоты может вводиться стоп-кодон (путем замены или вставки), чтобы получить усеченный белок. Мутанты со вставками, как правило, включают добавление материала по неконцевой точке полипептида. Это может включать введение одного или нескольких остатков. Также могут быть получены вставки по концам, которые называют слитыми белками.
Варианты с замещением обычно содержат замены одной аминокислоты на другую по одному или нескольким сайтам в белке и могут быть разработаны так, чтобы они модулировали одно или несколько свойств полипептида, с потерей или без потери других функций или свойств. Замены могут быть консервативными, то есть одна аминокислота заменяется на другую с похожей же формой и зарядом. Консервативные замены хорошо известны в данной области и включают, к примеру, замены: аланина на серии; аргинина на лизин; аспарагина на глутамин или гистидин; аспартата на глутамат; цистеина на серии; глутамина на аспарагин; глутамата на аспартат; глицина на пролин; гистидина на аспарагин или глутамин; изолейцина на лейцин или валин; лейцина на валин или изолейцин; лизина на аргинин; метионина на лейцин или изолейцин; фенилаланина на тирозин, лейцин или метионин; серина на треонин; треонина на серии; триптофана на тирозин; тирозина на триптофан или фенилаланин; и валина на изолейцин или лейцин. С другой стороны, замены могут быть не консервативными, а такими, что затрагивают функцию или активность полипептида или пептида, как-то авидность или сродство к клеточным рецепторам. Неконсервативные замены обычно включают замены одного остатка на такие, которые отличаются химически, типа замены полярной или заряженной аминокислоты на неполярную или незаряженную аминокислоту и наоборот.
Белки по изобретению могут быть рекомбинантными или синтезированы in vitro. С другой стороны, рекомбинантный белок может быть выделен из бактерий или других клеток хозяина.
Кроме того, следует иметь в виду, что аминокислотные и последовательности нуклеиновых кислот могут включать дополнительные остатки, как-то дополнительные N-или С-концевые аминокислоты либо 5'- или 3'-последовательности нуклеиновых кислот, соответственно, и тем не менее в основном соответствовать приведенным здесь последовательностям, если только они удовлетворяют изложенным выше критериям, включая сохранение биологической активности белка (например, иммуногенности). Добавление концевых последовательностей в особенности применимо к последовательностям нуклеиновых кислот, которые могут включать, к примеру, различные некодирующие последовательности, фланкирующие 5'- либо 3'-участки кодирующей области.
Предусматривается, что в композициях по изобретению содержится от 0,001 мг до 10 мг общего белка на мл. Так, концентрация белка в композиции может составлять примерно, не менее или не более 0,001, 0,010, 0,050, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 50, 100 мкг/мл или мг/мл или больше (или в любом интервале из них). При этом примерно, не менее или не более 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% может составлять комплекс антиген-МНС-наночастицы.
Настоящим изобретением предусматривается введение комплекса антиген-МНС-наночастицы для лечения MS или и/или воспаления, связанного с MS.
Кроме того, в U.S. Patent No. 4,554,101 (Норр), который включен сюда путем ссылки, представлена идентификация и получение эпитопов из первичных аминокислотных последовательностей на основе гидрофильности. Методами, изложенными в Норр, специалисты смогут идентифицировать потенциальные эпитопы внутри аминокислотной последовательности и проверить их иммуногенность. Многочисленные научные публикации также посвящены предсказанию вторичной структуры и идентификации эпитопов путем анализа аминокислотных последовательностей (Chou & Fasman, Adv. Enzymol., 47: 45-148, 1978; Chou and Fasman, Annu. Rev. Biochem., 47: 251-276, 1978; Chou and Fasman, Biochemistry, 13(2): 211-222, 1974; Chou and Fasman, Biochemistry, 13(2): 222-245, 1974; Chou and Fasman, Biophys. J., 26(3): 385-399, 1979). Любой из них можно использовать, если нужно, в дополнение к Норр in U.S. Pat. No. 4,554,101.
Помимо пептидов, можно использовать и другие молекулы в качестве антигенов или антигенных фрагментов в комплексе с молекулами МНС. Такие молекулы включают, без ограничения, углеводы, липиды, небольшие молекулы и др. Углеводы являются основными компонентами внешней поверхности различных клеток. Некоторые углеводы характерны для различных стадий дифференцировки, причем очень часто эти углеводы распознаются специфическими антителами. Экспрессия отдельных углеводов может ограничиваться определенными типами клеток.
D. Субстраты/наночастицы
В некоторых аспектах комплексы антиген/МНС оперативно связаны с субстратом, с которым они соединяются ковалентно или не ковалентно. Субстрат может быть в виде наночастиц, необязательно содержащих биосовместимый и/или биоабсорбируемый материал. Соответственно, в одном воплощении наночастицы являются биосовместимыми и/или биоабсорбируемыми. Субстрат также может быть в виде таких наночастиц, как описанные ранее в US Patent Pub. No.: 2009/0155292, включенной сюда путем ссылки во всей полноте, которые в одном аспекте не являются липосомами. Наночастицы могут иметь структуру с переменными размерами и известны по-разному как наносферы, наночастицы или биосовместимые биоразлагаемые наносферы или биосовместимые биоразлагаемые наночастицы. Такие композиции в виде частиц, содержащих комплекс антиген/МНС, могут быть получены путем ковалентного или нековалентного присоединения комплекса к наночастицам.
Наночастицы, как правило, состоят из практически сферического ядра и, необязательно, одного или нескольких слоев. Ядро может варьироваться по размеру и составу. Наряду с ядром, наночастицы могут содержать один или несколько слоев, обеспечивающих функциональные возможности, подходящие для данного применения. Толщина слоев, если они есть, может изменяться в зависимости от потребностей конкретного применения. Например, слои могут придавать полезные оптические свойства.
Слои также могут придавать химические или биологические функциональности, поэтому они называются здесь химически активными или биологически активными слоями, а для этих функциональностей толщина слоя или слоев, как правило, составляет от 0,001 мкм (1 нм) до 10 мкм или больше (в зависимости от требуемого диаметра наночастиц), причем эти слои обычно наносятся на внешнюю поверхность наночастиц.
Состав ядра и слоев может варьироваться. Подходящими материалами для частиц или ядра являются, без ограничения, полимеры, керамика, стекло, минералы и т.п. Примеры их включают, без ограничения, стандартные и специальные стекла, диоксид кремния, полистирол, полиэфир, поликарбонат, акриловые полимеры, полиакриламид, полиакрилонитрил, полиамид, фторполимеры, силикон, целлюлозы, кремний, металлы (например, железо, золото, серебро), минералы (например, рубин), наночастицы (например, золотые наночастицы, коллоидные частицы, оксиды металлов, сульфиды металлов, селениды металлов и такие магнитные материалы, как оксид железа) и их композиты. Ядро может быть однородного состава или состоять из двух или нескольких классов материалов в зависимости от требуемых свойств. В некоторых аспектах применяются металлические наночастицы. Эти металлические частицы или наночастицы могут состоять из Au, Pt, Pd, Cu, Ag, Со, Fe, Ni, Mn, Sm, Nd, Pr, Gd, Ti, Zr Si, In, предшественников, их бинарных сплавов, тройных сплавов и интерметаллических соединений. См. U.S. Patent 6,712,997, который включен сюда путем ссылки во всей полноте. В некоторых воплощениях состав ядра и слоев может отличаться при условии, что наночастицы будут биосовместимыми и биоабсорбируемыми. Ядро может быть однородного состава или состоять из двух или нескольких классов материалов в зависимости от требуемых свойств. В некоторых аспектах применяются металлические наносферы. Такие металлические наночастицы могут состоять из Fe, Са, Ga и др. В некоторых воплощениях наночастицы содержат ядро, содержащее металл или оксид металла.
Как указано ранее, наночастицы, наряду с ядром, могут включать в себя один или несколько слоев. Наночастицы могут содержать слой, состоящий из биоразлагаемого сахарида или другого полимера. Примеры биоразлагаемых слоев включают, без ограничения, декстран; полиэтиленгликоль; полиэтиленоксид; маннит; поли(сложные эфиры) на основе полилактида (PLA), полигликолида (PGA), поликапролактона (PCL); поли(гидроксалканоаты) из класса PHB-PHV; и другие модифицированные полисахариды, такие как крахмал, целлюлоза и хитозан. Кроме того, наночастицы могут включать в себя слой с подходящей поверхностью для прикрепления химических функциональностей для сайтов химического связывания или конъюгирования.
Слои могут наноситься на наночастицы различными способами, известными специалистам в данной области. Примеры включают такие методы химии золь-гель, как описанные в Her, Chemistry of Silica, John Wiley & Sons, 1979; Brinker and Scherer, Sol-Gel Science, Academic Press (1990). Другие подходы к получению слоев на наночастицах включают методы поверхностной химии и инкапсулирования типа описанных в Partch and Brown, J. Adhesion, 67: 259-276, 1998; Pekarek et al., Nature, 367: 258, (1994); Hanprasopwattana, Langmuir, 12: 3173-3179, (1996); Davies, Advanced Materials, 10: 1264-1270, (1998); и приведенные в них ссылки. Также могут применяться методы осаждения из паров; к примеру, см. Golman and Shinohara, Trends Chem. Engin., 6: 1-6, (2000); и U.S. Pat. No. 6,387,498. Еще другие подходы включают в себя методы послойной самосборки типа описанных в Sukhorukov et al., Polymers Adv. Tech., 9(10-11): 759-767, (1998); Caruso et al., Macromolecules, 32(7): 2317-2328, (1998); Caruso et al., J. Amer. Chem. Soc, 121(25): 6039-6046, (1999); U.S. Pat. No. 6,103,379; и приведенные в них ссылки.
Наночастицы могут быть получены путем контактирования водной фазы, содержащей комплекс антиген/МНС/костимулирующая молекула и полимер, и неводной фазы с последующим выпариванием неводной фазы, вызывающим коалесценцию частиц из водной фазы, как изложено в U.S. Pat. No. 4,589,330 или 4,818,542. Предпочтительными полимерами для таких препаратов являются природные или синтетические сополимеры или полимеры, выбранные из группы, состоящей из желатина, агара, крахмала, арабиногалактана, альбумина, коллагена, полигликолевой кислоты, полимолочной кислоты, гликолида-L(-)лактида-поли(ε-капролактона), поли(ε-капролактона-с-молочной кислотой), поли(ε-капролактона-с-гликолевой кислотой), поли(β-гидроксимасляной кислоты), полиэтиленоксида, полиэтилена, поли(алкил-2-цианоакрилата), поли(гидроксиэтилметакрилата), полиамидов, полиаминокислот, поли(2-гидроксиэтил-DL-аспартамида), поликарбамида, поли(L-фенилаланин/этиленгликоль/1,6-диизоцианатогексана) и поли (метилметакрилата). Особенно предпочтительными полимерами являются полиэфиры, такие как полигликолевая кислота, полимолочная кислота, гликолид-L(-)лактид-поли(ε-капролактон), поли(ε-капролактон-с-молочной кислотой) и поли(ε-капролактон-с-гликолевой кислотой). Растворители, применимые для растворения полимеров, включают: воду, гексафторизопропанол, метиленхлорид, тетрагидрофуран, гексан, бензол или полутораводный гексафторацетон.
Размер наночастиц может составлять от 1 нм до 1 мкм. В некоторых воплощениях диаметр наночастиц составляет менее 1 мкм. В других воплощениях диаметр наночастиц составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях диаметр наночастиц составляет от 1 нм до 10 нм, 15 нм, 20 нм, 25 нм, 30 нм, 40 нм, 50 нм, 75 нм или 100 нм. В определенных воплощениях размер наночастиц составляет от 1 нм до 100 нм, от 1 нм до 50 нм, от 1 нм до 20 нм или от 5 нм до 20 нм.
Размер комплекса может составлять от 5 нм до 1 мкм. В некоторых воплощениях диаметр комплекса составляет менее 1 мкм или же менее 100 нм. В других воплощениях диаметр комплекса составляет менее 500 нм, менее 400 нм, менее 300 нм, менее 200 нм, менее 100 нм или менее 50 нм. В других воплощениях диаметр комплекса составляет от 10 нм до 50 нм или от 20 нм до 75 нм или от 25 нм до 60 нм или от 30 нм до 60 нм, а в одном аспекте около 55 нм.
Ε. Конъюгирование комплекса антиген-МНС с наночастицами
Для конъюгирования субстрата или наносфер с комплексами антиген-МНС могут применяться следующие методы.
Связывание может осуществляться путем химической модификации субстрата или наночастиц, которое обычно включает создание "функциональных групп" на поверхности, причем данные функциональные группы способны связываться с комплексом антиген-МНС и/или соединять необязательно модифицированную химически поверхность субстрата или наночастиц со связанными ковалентно или нековалентно так называемыми "соединительными молекулами" с последующей реакцией комплекса антиген-МНС с полученными наночастицами.
Термин "соединительная молекула" означает вещество, способное связываться с субстратом или наночастицами и также способное связываться с комплексом антиген-МНС. В некоторых воплощениях комплекс антиген-МНС соединяется с наночастицами через линкер. Неограничительные примеры подходящих линкеров включают линкеры типа дофамин (DPA)-полиэтиленгликоль (PEG), такие как DPA-PEG-эфир NHS, DPA-PEG-ортопиридил-дисульфид (OPSS) и/или DPA-PEG-азид. Другие линкеры включают пептидные линкеры, этиленгликоль, биотин и стрептавидин.
Термин "функциональные группы" в настоящем изобретении не ограничивается реакционноспособными химическими группами, образующими ковалентные связи, но также включает химические группы, вступающие в ионные взаимодействия или водородные связи с комплексом антиген-МНС. Кроме того, следует отметить, что строгое разграничение между "функциональными группами", образующимися на поверхности, и соединительными молекулами, несущими "функциональные группы", невозможно, так как иногда модифицирование поверхности требует реакции небольших соединительных молекул типа этиленгликоля с поверхностью наносфер.
Функциональные группы или несущие их соединительные молекулы можно выбирать из аминогрупп, карбоксильных групп, тиолов, тиоэфиров, дисульфидов, гуанидино, гидроксильных групп, аминогрупп, вицинальных диолов, альдегидов, альфа-галоацетильных групп, органических соединений ртути, сложноэфирных групп, галоангидридов, тиоэфиров, ангидридов кислот, изоцианатов, изотиоцианатов, галоангидридов сульфоновых кислот, имидоэфиров, диазоацетатов, солей диазония, 1,2-дикетонов, фосфоновых кислот, эфиров фосфорной кислоты, сульфоновых кислот, азолидов, имидазолов, индолов, N-малеимидов, α-β-ненасыщенных карбонильных соединений, арилгалогенидов и их производных.
Неограничительные примеры других соединительных молекул с более высоким молекулярным весом включают молекулы нуклеиновых кислот, полимеры, сополимеры, полимеризующиеся конденсирующие реагенты, диоксид кремния, белки и цепеобразные молекулы, поверхность которых имеет противоположную полярность по отношению к субстрату или наночастицам. Нуклеиновые кислоты могут обеспечить связь с обладающими сродством молекулами, которые сами содержат молекулы нуклеиновых кислот, но с комплементарной последовательностью по отношению к соединительной молекуле.
Конкретные примеры ковалентных линкеров включают полиэтиленгликоль (PEG). PEG-линкер может представлять собой линкер типа тиол-PEG-NH2.
В некоторых воплощениях описанный здесь линкер имеет определенный размер. В некоторых воплощениях размер линкера составляет менее 10 кДа, менее 5 кДа, менее 4,5 кДа, менее 4 кДа, менее 3,5 кДа, менее 3 кДа, менее 2,5 кДа, менее 2 кД или менее 1 кД. В других воплощениях линкер составляет от 0,5 кДа до 5, 4,5, 4, 3,5, 3, 2,5, 2, 1,5 или 1 кДа. А еще в других воплощениях линкер составляет от 1 до 4,5, 4, 3,5, 3, 2,5, 2 или 1,5 кДа.
В качестве примера полимеризующихся конденсирующих реагентов можно привести диацетилен, бутадиен-стирол, винилацетат, акрилат, акриламид, соединения винила, стирол, оксид кремния, оксид бора, оксид фосфора, бораты, пиррол, полипиррол и фосфаты.
Поверхность субстрата или наночастиц может быть подвергнута химической модификации, к примеру, путем связывания производных фосфоновой кислоты, содержащих функциональные реакционноспособные группы. Одним из примеров таких производных фосфоновой кислоты или сложного эфира фосфоновой кислоты является имино-бис (метиленфосфоно)карбокислота, которую можно синтезировать по реакции "Mannich-Moedritzer". Эта реакция связывания может проводиться с субстратом или наносферами, полученными прямо в процессе приготовления, или после предварительной обработки (например, тримети л си лил бромидом). В первом случае производное (эфира) фосфоновой кислоты, к примеру, может вытеснять компоненты реакционной среды, которые все еще связаны с поверхностью. Такое вытеснение может усиливаться при повышении температуры. С другой стороны, триметилсилилбромид может деалкилировать содержащие алкильные группы фосфорные комплексообразователи, создавая тем самым новые сайты связывания для производного (эфира) фосфоновой кислоты. Производные (эфиров) фосфоновой кислоты или связанные с ними соединительные молекулы могут нести такие же функциональные группы, как указано выше. Следующий пример обработки поверхности субстрата или наносфер включает нагревание в диоле типа этиленгликоля. Следует отметить, что такая обработка может быть избыточной, если синтез уже проходил в диоле. В таких обстоятельствах непосредственно полученный продукт синтеза должен нести необходимые функциональные группы. Однако такая обработка применима к субстрату или наночастицам, полученным в N- или Р-содержащих комплексообразователях. Если такой субстрат или частицы подвергнуть последующей обработке этиленгликолем, то ингредиенты реакционной среды (например, комплексообразователи), все еще связанные с поверхностью, будут вытесняться диолом и/или подвергаться деалкилированию.
Также можно заменять N-содержащие комплексообразователи, все еще связанные с поверхностью частиц, на производные первичных аминов, содержащие вторую функциональную группу. Поверхность субстрата или наночастиц также может быть покрыта диоксидом кремния. Кремнезем позволяет относительно просто проводить химическую конъюгацию органических молекул, так как диоксид кремния легко вступает в реакцию с органическими линкерами типа триэтоксисилана или хлорсилана. Поверхность наночастиц также может быть покрыта гомо- или сополимерами. Примеры полимеризующихся конденсирующих реагентов включают N-(3-аминопропил)-3-меркаптобензамидин, 3-(триметоксисилил)пропилгидразид и 3-триметоксисилил)пропилмалеимид. При этом приводятся и другие неограничительные примеры полимеризующихся конденсирующих реагентов. Такие конденсирующие реагенты могут применяться по отдельности или в сочетании в зависимости от типа сополимера, образующего покрытие.
Другой метод модификации поверхности, который может применяться для субстратов или наночастиц, содержащих оксидные соединения переходных металлов, состоит в преобразовании оксидных соединений переходных металлов газообразным хлором или органическими хлорирующими реагентами в соответствующие оксихлориды. Эти оксихлориды способны вступать в реакцию с такими нуклеофилами, как гидрокси- или аминогруппы, которые часто встречаются в биомолекулах. Этот метод позволяет проводить прямую конъюгацию с белками, например, через аминогруппы боковых цепей лизина. Конъюгирование с белками после модификации поверхности оксихлоридами также может осуществляться с помощью бифункционального линкера типа гидразида малеимидопропионовой кислоты.
Для методов нековалентного связывания особенно подходят молекулы типа цепочек, имеющих полярность или заряд, противоположный поверхности субстрата или наносфер. Примеры соединительных молекул, способных нековалентно связываться с ядром/оболочкой наносфер, включают анионные, катионные или цвиттерионные детергенты, кислые или основные белки, полиамины, полиамиды, полисульфоновые или поликарбоновые кислоты. При гидрофобном взаимодействии между субстратом или наносферами и амфифильным реагентом, содержащим функциональную реакционноспособную группу, может образоваться нужная связь. В частности, можно использовать молекулы типа цепочек амфифильной природы, как-то фосфолипиды или модифицированные полисахариды, которые могут сшиваться друг с другом. Абсорбция этих молекул на поверхности может осуществляться путем совместной инкубации. Связывание между обладающей сродством молекулой и субстратом или наночастицами также может основываться на нековалентных, самоорганизующихся связях. Один из таких примеров включает простые детектирующие зонды с биотином в качестве соединительной молекулы и соединенные с авидином или стрептавидином молекулы.
В литературе приводятся методики реакций конденсации функциональных групп с биологическими молекулами, например, в "Bioconjugate Techniques" (Greg T. Hermanson, Academic Press, 1996). Биологические молекулы (например, молекулы МНС или их производные) можно конъюгировать с соединительной молекулой, ковалентно или нековалентно, по стандартным методикам органической химии, таким как окисление, галогенирование, алкилирование, ацилирование, присоединение, замещение или амидирование. Эти методы конъюгирования ковалентно или нековалентно связанных соединительных молекул могут применяться перед присоединением соединительной молекулы к субстрату или наносферам или после него. Кроме того, при помощи инкубации можно осуществлять прямое связывание молекул с соответствующим предварительно обработанным (к примеру, триметилсилилбромидом) субстратом или наночастицами с модифицированной при такой обработке поверхностью (например, с более высоким зарядом или полярностью).
F. Получение белков
В настоящем изобретении описаны полипептиды, пептиды и белки для применения в различных воплощениях настоящего изобретения. Например, определенные пептиды и их комплексы подвергаются анализу на их способность вызывать или модулировать иммунный ответ. В определенных воплощениях все или часть пептидов или белков по изобретению также можно синтезировать в растворе или на твердом субстрате в соответствии со стандартными методами. Коммерчески доступны различные автоматические синтезаторы, которые могут использоваться в соответствии с известными методиками. Например, см. Stewart and Young, Solid Phase Peptide Synthesis, 2nd Ed., Pierce Chemical Co., (1984); Tarn et al., J. Am. Chem. Soc, 105: 6442, (1983); Merrifield, Science, 232(4748): 341-347, (1986); и Barany and Merrifield, The Peptides, Gross and Meinhofer (Eds.), Academic Press, NY, 1-284, (1979), каждый из которых включен сюда путем ссылки. С другой стороны, можно использовать технологию рекомбинантной ДНК, в которой последовательность нуклеотидов, кодирующая пептид по изобретению, вводится в экспрессионный вектор, которым трансформируются или трансфецируются подходящие клетки хозяина, которые культивируются в условиях, подходящих для экспрессии.
Одно из воплощений изобретения включает использование переноса генов в клетки, в том числе микроорганизмы, для получения белков. Ген нужного белка может быть перенесен в соответствующие клетки хозяина, после чего клетки культивируют при соответствующих условиях. Можно использовать нуклеиновые кислоты, кодирующие практически любые полипептиды. Получение рекомбинантных экспрессирующих векторов и включенных в них элементов известно специалистам и вкратце описано здесь. Примеры линий клеток хозяина млекопитающих включают, без ограничения, клетки Vero и HeLa, другие В- и Т-клеточные линии, такие как СЕМ, 721.221, Н9, Jurkat, Raji, а также линии клеток яичников китайского хомячка, клетки W138, ВНК, COS-7, 293, HepG2, 3Т3, RIN и MDCK. Кроме того, можно выбрать такой штамм клеток хозяина, который модулирует экспрессию вставленных последовательностей или модифицирует и процессирует генный продукт требуемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важными для функции белка. Различные клетки хозяина имеют характерные и специфические механизмы для посттрансляционного процессинга и модификации белков. Для обеспечения правильной модификации и процессинга экспрессируемого чужеродного белка можно выбрать соответствующие линии клеток или системы хозяина.
Может быть использован целый ряд систем отбора в том числе, но без ограничения, гены тимидинкиназы HSV, гипоксантин-гуанин-фосфорибозилтрансферазы и аденин-фосфорибозилтрансферазы в клетках tk-, hgprt- или aprt-, соответственно. Также в качестве основы для отбора можно использовать устойчивость к метаболитам: dhfr, придающий устойчивость к триметоприму и метотрексату; gpt, придающий устойчивость к микофеноловой кислоте; neo, придающий устойчивость к аминогликозиду G418; и hygro, придающий устойчивость к гигромицину.
G. Нуклеиновые кислоты
Настоящее изобретение может включать в себя рекомбинантные полинуклеотиды, кодирующие белки, полипептиды, пептиды по изобретению, такие, к примеру, как SEQ ID NO: 1 или 2.
В определенных воплощениях изобретение касается выделенных сегментов нуклеиновых кислот и рекомбинантных векторов, включающих в себя последовательности нуклеиновых кислот, кодирующие аутоантиген и/или молекулу МНС.
Термин "рекомбинантный" может применяться в сочетании с полипептидом или названием определенного полипептида, причем это обычно относится к полипептидам, полученным из молекул нуклеиновых кислот, подвергавшихся манипулированию in vitro или являющихся продуктами репликации таких молекул.
Сегменты нуклеиновых кислот, используемые в настоящем изобретении, независимо от длины самой кодирующей последовательности, могут комбинироваться с другими последовательностями нуклеиновых кислот, такими как промоторы, сигналы полиаденилирования, дополнительные сайты рестрикционных ферментов, сайты множественного клонирования, другие кодирующие сегменты и т.п., так что их общая длина может существенно варьироваться. Поэтому предусмотрено, что можно использовать фрагменты нуклеиновой кислоты практически любой длины, причем общая длина предпочтительно ограничивается легкостью их получения и применения по данной методике рекомбинантных нуклеиновых кислот. В некоторых случаях последовательность нуклеиновой кислоты может кодировать последовательность полипептида с дополнительными гетерологичными кодирующими последовательностями, к примеру, чтобы облегчить очистку полипептида, транспорт, секрецию, посттрансляционную модификацию или такие терапевтические преимущества, как таргетинг или эффективность. К модифицированной последовательности, кодирующей полипептид, может быть добавлен тег или другой гетерологичный полипептид, при этом "гетерологичный" означает такой полипептид, который не идентичен модифицируемому полипептиду.
Фармацевтические композиции и способы введения
Далее представлены фармацевтические композиции, применимые для лечения заболеваний.
А. Фармацевтические композиции
Комплексы антиген-МНС-наночастицы могут вводиться по отдельности или в сочетании с носителем типа фармацевтически приемлемых носителей в композициях. Композиции по изобретению обычно вводятся парентерально, посредством инъекции, к примеру, внутривенно, подкожно или внутримышечно. Другие лекарственные формы, которые подходят для других способов введения, включают пероральные формы. Пероральные формы включают такие обычно используемые наполнители, к примеру, как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и др. Эти композиции имеют вид растворов, суспензий, таблеток, пилюль, капсул, форм с замедленным высвобождением или порошков и содержат от 10% до 95% активного ингредиента, предпочтительно от 25% до 70%. Приготовление водных композиций, содержащих комплекс антиген-МНС-наночастицы, который модифицирует состояние иммунной системы у субъектов, должно быть известно специалистам в свете настоящего описания. В некоторых воплощениях композиция вводится путем ингаляции (например, US Patent No. 6,651,655,, который специально включен сюда путем ссылки во всей полноте). В одном воплощении комплекс антиген-МНС-наночастицы вводится системно.
Как правило, композиции по изобретению вводятся способом, совместимым с дозовой формой, и в таком количестве, которое будет терапевтически эффективным и иммуномодифицирующим. Количество, подлежащее введению, зависит от субъекта, подлежащего лечению. Точное количество активного ингредиента, нужное для введения, зависит от суждения лечащего врача. Однако подходящий диапазон доз составляет порядка от десяти до нескольких сотен нанограмм или мкг комплекса антиген-МНС-наночастицы за одно введение. Подходящие режимы начального введения и бустеров тоже вариабельны, но типичным будет начальное введение с последующим дальнейшим введением.
Во многих случаях желательно проводить многократное введение комплекса пептид-МНС-наночастицы, примерно, не более или не менее 3, 4, 5, 6, 7, 8, 9, 10 или более раз. Введение обычно проводится с интервалами от 2 дней до 12 недель, чаще всего от 1 до 2 недель. Для поддержания состояния иммунной системы может понадобиться периодическое повторение (бустеры) с интервалом в 0,5-5 лет, обычно 2 года. За курсом введения могут последовать анализы на воспалительные иммунные реакции и/или активность ауторегуляторных Т-клеток.
В некоторых воплощениях субъектам вводятся фармацевтические композиции. Различные аспекты настоящего изобретения включают введение субъектам эффективного количества комплекса антиген-МНС-наночастицы. Кроме того, такие композиции могут вводиться в сочетании с модификаторами иммунной системы. Такие композиции обычно растворяют или диспергируют в фармацевтически приемлемом носителе или в водной среде.
Выражения "фармацевтически приемлемый" или "фармакологически приемлемый" относятся к таким молекулярным частицам и композициям, которые не дают отрицательных, аллергических или других неблагоприятных реакций при введении животным или человеку. В настоящем изобретении "фармацевтически приемлемый носитель" охватывает всевозможные растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические и задерживающие всасывание вещества и др. Применение таких сред и средств для фармацевтически активных веществ хорошо известно в данной области. За исключением тех случаев, когда обычные среды или средства несовместимы с активными ингредиентами, предусмотрено их применение в иммуногенных и терапевтических композициях.
Лекарственные формы, подходящие для применения в виде инъекций, включают стерильные водные растворы или дисперсии; составы, включающие кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для приготовления ex temporo стерильных растворов или дисперсий для инъекций. Во всех случаях форма должна быть стерильной и должна быть жидкой в такой степени, чтобы она легко вводилась. Она также должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия таких микроорганизмов, как бактерии и грибы.
Композиции могут быть приготовлены в виде нейтральной или солевой формы. Фармацевтически приемлемые соли включают соли с кислотами (которые образуются со свободными аминогруппами белка), которые образованы с неорганическими кислотами, такими, к примеру, как соляная кислота или фосфорная кислота, или органическими кислотами, такими как уксусная, щавелевая, винная, миндальная и др. Соли, которые образуются со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких, к примеру, как гидроокись натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и др.
Носителем может быть растворитель или дисперсионная среда, содержащие, к примеру, воду, этанол, полиол (например, глицерин, пропиленгликоль или жидкий полиэтиленгликоль и др.), подходящие смеси из них и растительные масла. Надлежащая текучесть может поддерживаться, к примеру, при помощи покрытия типа лецитина, путем поддержания требуемого размера частиц в случае дисперсий и с помощью поверхностно-активных веществ. Предотвращение действия микроорганизмов может осуществляться с помощью различных противобактериальных и противогрибковых средств, к примеру, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и др. Во многих случаях предпочтительно следует включать изотонические вещества, к примеру, сахара или хлорид натрия. Пролонгированное всасывание композиций для инъекций может осуществляться с применением в композициях средств, задерживающих всасывание, к примеру, моностеарата алюминия или желатина.
Стерильные растворы для инъекций получают путем введения активных соединений в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, по необходимости, с последующей стерилизацией. Стерилизация раствора должна проводиться таким образом, чтобы она не ухудшала терапевтические свойства комплекса антиген-МНС-наночастицы. Как правило, дисперсии получают путем введения различных стерильных активных ингредиентов в стерильный носитель, содержащий основную дисперсионную среду и требуемые другие ингредиенты из числа перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами получения являются методы вакуумной сушки и сушки вымораживанием, которые дают порошок активного ингредиента плюс любых дополнительных желательных ингредиентов из предварительно стерилизованного раствора. Одним из методов стерилизации растворов является стерилизация фильтрованием, однако настоящее изобретение включает любые способы стерилизации, не вызывающие значительного ухудшения терапевтических свойств комплексов антиген-МНС-наночастицы. Методы стерилизации, включающие сильное нагревание и давление, как при автоклавировании, могут ухудшить третичную структуру комплекса и тем самым значительно ухудшить терапевтические свойства комплексов антиген-МНС-наночастицы.
Эффективное количество терапевтической композиции определяется на основании предназначения. Термины "единица дозы" или "дозировка" относятся к физически дискретным единицам, подходящим для применения на субъектах, причем каждая единица содержит заданное количество композиции, рассчитанное на получение описанных выше желательных реакций при их введении, т.е. соответствующим способом и по схеме. Вводимое количество, в соответствии с количеством процедур и дозировкой, зависит от нужного результата и/или защиты. Точное количество композиции также зависит от суждения лечащего врача и специфично для каждого индивида. Факторы, влияющие на дозировку, включают физическое и клиническое состояние субъекта, способ введения, намеченную цель лечения (ослабление симптомов или же излечение) и силу действия, стабильность и токсичность конкретной композиции. После приготовления растворы должны вводиться способом, совместимым с дозовой формой, и в таком количестве, которое будет терапевтически или профилактически эффективным. Препараты легко вводятся в различных дозовых формах типа растворов для инъекций, описанных выше.
В. Комбинированная терапия
Композиции и связанные с ними способы настоящего изобретения, в частности введение комплекса антиген-МНС-наночастицы, могут применяться и в комбинации с введением традиционных средств терапии. Они включают, без ограничения, Avonex (интерферон β-1a), Betaseron (интерферон β-1b), Copaxone (глатирамер ацетат), Novantrone (митоксантрон), Rebif (интерферон β-1a), Tysabri (натализумаб), Gilenya (финголимод), Glatiramer, стероиды, цитоксан, имуран, баклофен, глубокую стимуляцию мозга, Ampyra (дальфампридин), акупунктуру и физическую терапию.
При комбинированной терапии могут применяться различные комбинации, к примеру, где "А" означает введение комплекса антиген-МНС-наночастицы, а "В" - дополнительного средства:
Введение пациентам/субъектам композиций с комплексом пептид-МНС по настоящему изобретению должно соответствовать общим методикам введения таких соединений, с учетом токсичности, если она есть. Предполагается, что циклы лечения могут повторяться при необходимости. Также предусматривается, что в комбинации с описанной терапией могут применяться различные стандартные методы лечения, такие как гидратация.
С. Введение in vitro или ex vivo
В настоящем изобретении термин "введение in vitro" относится к манипуляциям, проводящимся на клетках, извлеченных из или находящихся вне субъекта, включая, без ограничения, клетки в культуре. Термин "введение ex vivo" относится к клеткам, с которыми проводились манипуляции in vitro и которые впоследствии вводятся субъектам. Термин "введение in vivo" включает в себя все манипуляции, проводящиеся на субъектах, в том числе введение.
В некоторых аспектах настоящего изобретения композиции могут вводиться in vitro, ex vivo или in vivo. В некоторых воплощениях in vitro с композициями по изобретению инкубируют аутологичные Т-клетки. Клетки или ткани могут затем использоваться для анализа in vitro или же для введения ex vivo.
Примеры
Следующие примеры приводятся с целью иллюстрации различных воплощений изобретения и не должны ограничивать настоящее изобретение никоим образом. Специалистам в данной области должно быть хорошо известно, что настоящее изобретение хорошо приспособлено для выполнения целей и получения указанных результатов и преимуществ, а также свойственных ему предметов, целей и преимуществ. Настоящие примеры, вместе с описанными здесь способами, представляют типичные воплощения и не должны рассматриваться как ограничивающие объем изобретения. Специалистам должны быть известны такие изменения и другие применения, которые входят в рамки сущности изобретения, как определено объемом формулы изобретения.
Пример 1. NP с рМНС класса II на модели хронического аутоиммунного заболевания ЕАЕ
В этом примере описано применение наночастиц, покрытых комплексами типа связанный с MS антиген-МНС, для лечения ЕАЕ на модели ЕАЕ у мышей. Этот новый терапевтический подход может применяться для системной доставки наночастиц, покрытых комплексами одного соответствующего MS пептида с МНС (рМНС) (т.е. один комплекс рМНС на 1 заболевание). Это открытие способствует рациональной разработке специфичных для заболеваний "нановакцин", способных притупить аутоиммунность без ущерба для системного иммунитета, к чему уже давно стремятся при лечении таких заболеваний. Из фиг. 1 видно, что моноспецифичные, соответствующие MS нановакцины, покрытые рМНС класса II, могут обратить развитие хронического экспериментального аллергического энцефаломиелита (ЕАЕ) у обоих мышей C57BL/6. Этот подход также применим к комплексам рМНС у человека, известным как мишень для аутореактивных Т-клеток CD4+ у больных MS. Демонстрация клинической эффективности на этих доклинических моделях должна проложить путь для клинических испытаний на людях и, возможно, к разработке лекарства от MS.
ЕАЕ требует получения аутореактивных клеток CD4+ вместе с разрушением гематоэнцефалического барьера, что позволяет привлечение энцефалитогенных клеток в ЦНС. Иммунизация мышей C57BL/6 (В6) с помощью pMOG36-55 (200 мкг) в CFA с добавлением 10 мкг/мл Mycobacterium tuberculosis подкожно (у основания хвоста) вместе с 300 нг коклюшного токсина внутрибрюшинно, а затем еще одной дозы коклюшного токсина на 2-й день, индуцирует форму хронического ЕАЕ (>60 дней) у всех заболевших животных (~70% в нашей колонии).
Как видно из фиг. 1, терапия NP с рМНС класса II (покрытые pMOG38-49/IAb NPs) уменьшает тяжесть хронического ЕАЕ у мышей C57BL/6. Мышей В6 иммунизировали с помощью PMOG35-55 в CFA и обрабатывали коклюшным токсином внутривенно. Мышей оценивали на признаки ЕАЕ согласно установленным критериям по 15-балльной шкале. Пораженным мышам вводили две еженедельные дозы по 7,5-22,5 мкг наночастиц, покрытых pMOG38-49, начиная с 21-го дня после иммунизации. Важно отметить, что этот эффект связан с системной экспансией когнатных аутореактивных Т-клеток (фиг. 4). Более того, в то время как спинной мозг необработанных мышей проявлял значительную демиелинизацию и плотные инфильтраты мононуклеарных клеток в белом веществе (фиг. 5), у обработанных pMHC-NP мышей наблюдалась значительно меньшая демиелинизация и меньше инфильтратов одноядерных клеток (фиг. 6). На фиг. 7 и 8 показаны репрезентативные примеры краев спинного мозга (по 2 мыши). При этом опять же у обработанных pMHC-NP мышей значительно снижалась демиелинизация, а также уменьшалась инфильтрация мононуклеарных клеток. Таким образом, терапевтический подход pMHC-NP вызывает клинически значимые реакции на моделях различных заболеваний (T1D, ЕАЕ) у животных и на различном генетическом фоне (NOD, C57BL/6).
Эти опыты свидетельствуют о дозозависимой эффективности и осуществимости лечения MS с помощью комплексов связанный с MS антиген-МНС-наночастицы.
Пример 2. Способ получения комплексов антиген-МНС-наночастицы
Неорганические наночастицы (из оксида железа = IONP; золота = GNP) требуемого размера. Наночастицы IONP производятся посредством термического разложения. При этом синтезированные IONP являются биосовместимыми и могут быть ПЭГилированы для конъюгирования белка. Для нанесения рМНС и/или других белков на IONPs покрытые поверхностно-активным веществом наночастицы подвергают реакции с функционализированными PEG линкерами соответствующей длины. Линкеры очищают методом HPLC и характеризуют методами 1H-ЯМР, MALDI/GPC и GPC для проверки химической идентичности, чистоты, молекулярной массы и полидисперсности. Аналогичные линкеры и подходы можно использовать для покрытия GNP, за исключением того, что линкеры должны содержать тиоловую (SH) группу на своем NP-связывающем конце.
Пример 3. Размер, плотность и диспозиция покрытых рМНС наночастиц
1. Синтез и характеристика покрытых рМНС золотых наночастиц
Синтезировали золотые наночастицы (GNP) определенных размеров. Измеряли размеры, плотность, поверхностный заряд и монодисперсность препаратов GNP методами спектрофотометрии, трансмиссионной электронной микроскопии (ТЕМ) и динамического светорассеяния. Затем образцы GNP концентрировали и конъюгировали с моноспецифичными комплексами рМНС с использованием различных подходов, как описано ниже. Заявители разработали методы количественного определения валентности рМНС per GNP и концентрирования покрытых рМНС препаратов GNP различного размера при высокой плотности (~1014/мл) без ущерба для монодисперсности (фиг. 11).
2. Характеристика рМНС-связывающей способности GNP
Комплексы рМНС наносили на GNP различных размеров с использованием двух разных подходов: (i) случайное связывание рМНС с поверхностью GNPs посредством электростатических взаимодействий; и (ii) направленное связывание через линкер тиол-PEG-NH2 (при этом использовали дополнительный линкер тиол-PEG для стабилизации GNPs и предотвращения агрегации). Считалось, что первый подход обеспечит очень высокую плотность лиганда (рМНС per GN), но ухудшит направленность связывания рМНС (т.е. лишь часть молекул станет доступной для распознавания когнатными Т-лимфоцитами). Второй подход направлен на получение покрытых рМНС GNP с меньшей плотностью рМНС, но связанных направленно, через их С-концы. Оба подхода тестировали на GNP различного диаметра, от 14 до 40 нм. Было подтверждено, что при обоих подходах рМНС-связывающая способность GNP является функцией размера, а более конкретно - площади поверхности (большее количество рМНС на более крупных NPS). Неожиданно оказалось, что опосредованное ПЭГ связывание не только обеспечивает направленность связывания, но также повышает связывающую способность индивидуальных GNPs (вопреки первоначальным ожиданиям). Данные приведены ниже в таблице 1.
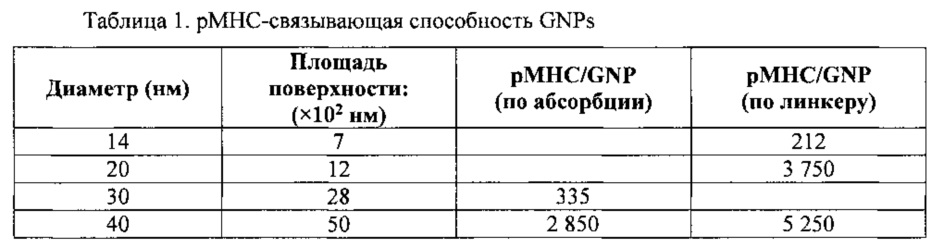
3. Агонистическая активность в зависимости от содержания рМНС Исследовали эффекты валентности рМНС, размера GNP, плотности GNP и метода покрытия на функциональную (агонистическую) активность покрытых рМНС GNP in vitro. Сравнивали способность различных препаратов IGRP206-214-Kd-GNP активировать когнатные (IGRP206-214-специфичные) наивные Т-клетки CD8+ (именуются здесь как "Т-клетки 8.3-CD8+"), полученные из трансгенных по Т-клеточным рецепторам (TCR) мышей NOD (или мышей 8.3-NOD). Первая группа экспериментов была направлена на сравнение эффектов валентности IGRP206-214-Kd (рМНС) при различной плотности GNP в культуре. В качестве отрицательного контроля использовали GNP, конъюгированные с контрольным (не когнатным) комплексом рМНС (Tum-Kd). Как и ожидалось, покрытые IGRP206-214-Kd (но не покрытые TUM-Kd) GNP активировали эти Т-клетки (судя по продукции IFNγ), и делали это зависящим от дозы GNP (а тем самым и от дозы рМНС) образом. На фиг. 12 представлен эксперимент, в котором использовали GNPs на ~14 нм, покрытые различным количеством молекул pMHC/GNP с помощью линкера. На фиг. 12 представлено сравнение количества IFNγ, секретируемого когнатными Т-клетками 8.3-CD8+ в ответ на два разных образца pMHC-GNP (оба состояли из - 2×1013 GNPs/мл диаметром 14 нм). Au-022410 и Au-21910 содержали ~250 и ~120 pMHCs/GNP, соответственно. Au-011810-C содержал ~120 контрольных pMHC/GNP. Наночастицы GNP, покрытые в 2 раза большим количеством комплексов pMHC/GNP, обладали лучшей агонистической активностью. Таким образом, агонистическая активность покрытых рМНС GNP является функцией общего содержания рМНС (GNP). Эти результаты были нелогичными, так как в данной области считалось, что в отсутствие костимуляторных молекул на NPs возрастание количества рМНС на наночастицах должно вызывать повышение авидности и способствовать удалению (гибели клеток), а не пролиферации и выделению цитокинов из когнатных Т-клеток. Это должно быть верным для Т-клеток как с низкой, так и с высокой авидностью. Например, в предыдущей работе заявителей (Han et al., (2005) Nature Medicine 11(6): 645-652) и других было показано, что пептиды, распознаваемые с высокой авидностью, или пептиды, распознаваемые с низкой авидностью, но при высокой концентрации, обладают повышенной способностью к удалению когнатных Т-клеток in vivo. Таким образом, в контексте терапевтической внутривенной доставки покрытых комплексом антиген-МНС наночастиц или растворимых пептидов, когнатные Т-клетки должны подвергаться истощению зависящим от сродства к пептиду и дозы образом. Это ожидание не подтверждается данными, представленными на фиг. 12.
4. Порог валентности у агонистической активности комплексов пептид-МНС-наночастицы
Для дальнейшего исследования роли валентности комплексов пептид-МНС (рМНС) на агонистические свойства конъюгированных с рМНС наночастиц (pMHC-NP), сравнивали способность NPs из оксида железа (Fe3O4) диаметром 8 нм, ковалентно связанных с возрастающим количеством мономеров рМНС IGRP206-214/Kd, вызывать секрецию IFN-гамма (IFNγ) когнатными (специфичными к IGRP206-214/Kd) Т-клетками CD8+ (именуются здесь как Т-клетки 8.3-CD8+) in vitro. Как видно из таблицы 2, Т-клетки 8.3-CD8+ вырабатывали незначительное количество IFNγ при культивировании в присутствии наночастиц, покрытых 8 мономерами рМНС на NP, но вырабатывали значительно большее количество IFNγ в ответ на наночастицы, покрытые при более высокой валентности рМНС, даже при всего лишь 11 мономерах pMHC/NP, зависимым от дозы образом.
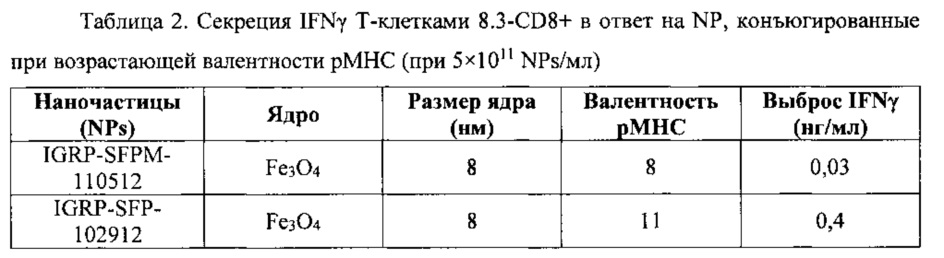
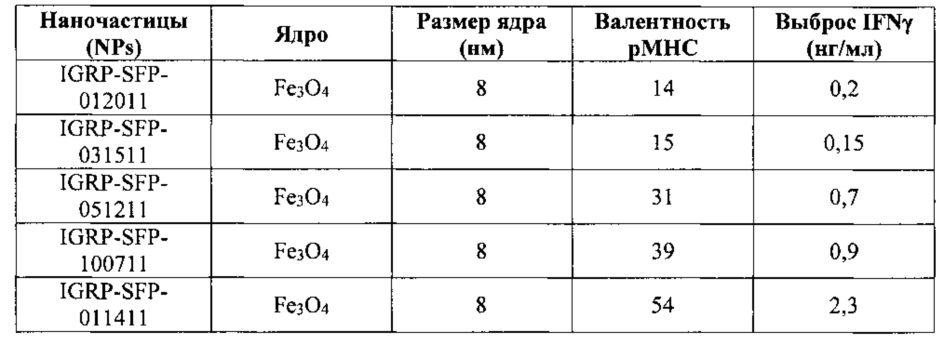
Этот положительный эффект валентности рМНС на агонистическую активность pMHC-NPs сохранялся при ряде плотностей pMHC-NP (фиг. 13). Примечательно, однако, что в то время, как 25×1011 NP (в 1 мл), содержащих 11 pMHC/NP, давали такую же агонистическую активность, что и 5×1011 NP (в 1 мл), содержащих 54 pMHC/NP, то увеличение количества NPs, содержащих 8 pMHC/NP, до значений, достигающих 40×1011 NPs/мл, оказывало минимальное действие (фиг. 14). В целом эти результаты показывают, что существует порог валентности рМНС, находящийся между 9 и 11 pMHC/NP, ниже которого сравнительное большое увеличение количества NP (т.е. 5-кратное) не может превзойти низкую агонистическую активность pMHC-NP, покрытых при низкой валентности (следует отметить, что использование >50×1011 NP в этих экспериментах in vitro не информативно вследствие клеточной токсичности при высокой плотности NP).
Этот пороговый эффект валентности рМНС дополнительно показан на фиг. 15, где данные по секреции IFNγ нормированы по общей концентрации рМНС, доставленного покрытыми наночастицами в культуры. Наночастицы, содержащие 11 pMHC/NP, дают значительно более высокий выброс IFNγ в диапазоне концентраций рМНС, чем NP, содержащие 8 pMHC/NP. Кроме того, различия в агонистических свойствах этих двух препаратов NP существенно возрастали при повышении общего содержания рМНС. То есть, различия в агонистических свойствах при 2,4 мкг/мл рМНС, доставленных NP в виде октамеров по сравнению с монодекамерами, была значительно выше, чем различия в агонистических свойствах тех же составов при в 10 раз меньшей общей концентрации рМНС.
Из фиг. 16 видно, что такие сильные эффекты валентности рМНС на агонистические свойства pMHC-NP также проявляются при использовании более крупных NP (которые могут принимать значительно более высокие валентности рМНС, чем наночастицы на 8 нм, приведенные на фиг. 13-15), но при меньшей плотности NP (при нормализации по общему содержанию оксида железа в культурах). В то время как NP диаметром 18 нм, содержащие <10 pMHC/NP, практически не обладали биологической активностью вплоть до 4×1011 NP/мл, агонистическая активность наночастиц диаметром 18 нм с более высокой валентностью рМНС возрастала линейно с повышением плотности NP. Сравнение фиг. 15 и 16 также показывает, что 2×1011 NP на 18 нм, содержащих 61 pMHC/NP, обладали такой же агонистической активностью, что и 2×1011 NPs на 8 нм, содержащих близкое количество (54) pMHC/NP, указывая на то, что объем NPs не оказывает существенного влияния на эффекты валентности рМНС.
В целом эти данные показывают, что наночастицы, покрытые рМНС, приобретают сильную агонистическую активность выше определенного порога валентности рМНС (лежащего между 9 и 11 pMHC/NP). Повышение как валентности рМНС, так и плотности NP может усиливать агонистические свойства pMHC-NP при "пороговой" или "выше пороговой" валентности рМНС, но не агонистические свойства наночастиц при "ниже пороговой" валентности рМНС.
5. Агонистическая активность в зависимости от размера и плотности NP Дальнейший анализ показал, что общее содержание рМНС является не единственным фактором, влияющим на агонистическую активность pMHC-NP in vitro, и что размер NP также играет важную самостоятельную роль. Это исследовали путем сравнения агонистической активности двух образцов pMHC-GNP разного размера (диаметром 14 и 40 нм, соответственно) при различной валентности рМНС, но в условиях близкого общего содержания рМНС. В эксперименте, представленном на фиг. 17, использовали GNP на 14 нм, содержащие ~200 молекул pMHC/GNP, и GNPs на 40 нм, содержащие ~5000 pMHCs/GNP. Плотности GNP в этих двух образцах доводили до 3×1013 и 1012 GNP/мл, соответственно, чтобы довести общее содержание рМНС в каждом образце до ~450 мкг/мл. Было отмечено, что Т-клетки 8.3-CD8+ значительно лучше реагировали на частицы pMHC/GNP в 14 нм, чем на частицы в 40 нм на всем диапазоне общего содержания рМНС, несмотря на то, что последние были покрыты значительно большим количеством комплексов рМНС, чем первые. Это означает, что главное - это плотность GNP (больше GNP на 1 когнатную Т-клетку). Иными словами, 4 наночастицы по 40 нм, содержащие 1000 pMHC/GNP (4000 рМНС), менее желательны, чем 40 наночастиц по 10 нм, содержащих 100 pMHC/GNP (4000 рМНС). Таким образом, эти данные в целом свидетельствуют, что оптимальными являются такие препараты pMHC-GNP, которые состоят из небольших GNP и используются при высокой плотности рМНС. Повышение валентности рМНС на этих небольших NP еще больше усиливает их поразительные и неожиданные агонистические свойства.
6. Агонистическая активность в зависимости от диспозиции рМНС
Как отмечалось выше, покрытые рМНС образцы GNP получают путем совместного покрытия GNP линкером тиол-PEG-NH2 в 3,4 кДа (в качестве акцептора карбоксильных концов рМНС) вместе с линкером тиол-PEG, функционирующим в качестве стабилизатора GNP. Чтобы исследовать, как длина стабилизирующего линкера тиол-PEG влияет на антиагрегационные свойства GNP, способность линкера тиол-PEG-NH2 к связыванию молекул рМНС и/или агонистические свойства покрытых рМНС GNP, сравнивали покрытые рМНС GNP, полученные с использованием стабилизирующих линкеров разного размера (2 кДа и 5 кДа, т.е. более короткие и более длинные, чем рМНС-акцепторный линкер, соответственно). Как оказалось, оба линкера обладали близкими антиагрегационные свойствами, а линкер в 5 кДа не ингибирует связывание рМНС с более коротким линкером тиол-PEG-NH2 в 3,4 кДа. Примечательно, однако, что pMHC-GNP, защищенные более коротким (2 кДа) линкером тиол-PEG, обладали лучшей агонистической активностью in vitro, чем те, которые были совместно покрыты более длинным (5 кДа) линкером тиол-PEG (фиг. 18). Это свидетельствует о том, что длинные защитные линкеры тиол-PEG экранируют молекулы рМНС, связанные с акцепторным линкером, от взаимодействия с когнатными Т-клетками.
7. Небольшие наночастицы, ковалентно связанные при высокой плотности рМНС, обеспечивают максимальную экспансию ауторегуляторных Т-клеток in vivo
Наночастицы со средним диаметром около 10 нм и соединенные с NRP-V7/Kd (также именуется IGRP206-214-Kd) либо с TUM/Kd (контроль) получали в соответствии с описанными здесь способами и проверяли на их способность индуцировать экспансию когнатных ауторегуляторных Т-клеток CD8+ in vivo. На фиг. 19 представлены результаты эксперимента, в котором антиген-MHC-GNP вводили внутривенно 10-недельным мышам NOD дикого типа по 2 раза в неделю на протяжении 5 недель. Оценивали изменения размеров циркулирующей популяции когнатных Т-клеток и различных лимфоидных тканей в ответ на терапию путем окрашивания клеточных суспензий флуоресцентно мечеными тетрамерами антиген-МНС (как когнатными, так и посторонними контрольными тетрамерами). Введение в 10-100 раз меньше GNP, чем то, что было ранее показано в этой области (например, см. Tsai et al. (2010) Immunity 32(4): 568-580), где исследовали наночастицы, покрытые 1-8 рМНС), но покрытых 150 комплексами антиген-МНС на GNP, приводило к существенному повышению экспансии (фиг. 19). Они вызывали экспансию Т-клеток CD8+ in vivo до уровня в несколько раз выше (вплоть до 44% всех циркулирующих Т-клеток CD8+), чем уровень, который мы обычно получали с наночастицами, покрытыми рМНС при валентности около 8 (1-2% клеток в крови; к примеру, см. Tsai et al., Immunity, 2010, фиг. 1С). Вышеприведенные данные показывают, что небольшие наночастицы, покрытые при высокой валентности антиген-МНС, вызывают максимальную экспансию Т-клеток. Эти результаты были неожиданными. Соответственно, за терапевтический эффект отвечает не общая авидность взаимодействия pMHC-NP с Т-клетками, а скорее авидность популяции предшественников, которая порождает Т-клетки при экспансии в ответ на терапию pMHC-NP. Эта интерпретация согласуется с описанными здесь данными и предполагает, что валентность рМНС на наночастицах должна повышать терапевтическую эффективность pMHC-NP.
Пример 4. Сильная экспансия когнатных Т-клеток CD8+ под воздействием pMHC-GNP, покрытых при более высокой валентности рМНС
Далее определяли, обладают ли pMHC-NP способностью вызывать массовую экспансию когнатных Т-клеток in vivo. Это делалось путем обработки мышей несколькими инъекциями по 3×1012 наночастиц на 10-14 нм, содержащих 25 мкг общего рМНС (~150 молекул IGRP206-214/Kd на 1 NP). Как видно из фиг. 20, мыши, получавшие 10 доз (2 раза в неделю на протяжении 10 недель) проявляли массивную экспансию когнатных IGRP206-214 (NRP-V7)-реактивных Т-клеток CD8+ в периферической крови по сравнению с необработанными мышами (от <0,4 до >17 или 47% Т-клеток CD8+) (нижние панели). Такая экспансия уже наблюдалась у мыши, забитой после 4 доз pMHC-NP (верхние панели). При вызванной pMHC-NPs экспансии клетки специфически связывали когнатные, но не посторонние тетрамеры рМНС (т.е. NRP-V7/Kd или TUM/Kd, соответственно).
Пример 5. Получение конъюгированных с рМНС золотых наночастиц
Получение конъюгированных с рМНС GNPs (pMHC-GNP, 12 и 30 нм)
Получение GNP. GNP получали при нагревании дважды дистиллированной (d.d.) воды (200 мл) в круглой колбе на силиконовой масляной бане до кипения. В кипящую воду добавляли 1% раствор HAuCl4 (4 мл). Раствор перемешивали в течение 10 мин, а затем добавляли 1% раствор цитрата натрия. Для GNP на 12 нм добавляли 12 мл раствора цитрата натрия. Для GNPs на 30 нм добавляли 12 мл раствора цитрата натрия. Сразу же после добавления цитрата натрия появлялась винная окраска. Для завершения реакции раствор GNP перемешивали еще 30 минут. Это модификация метода, описанного Levy R. et al. ("Rational and combinatorial design of peptide capping ligands for gold nanoparticles" J Am Chem Soc 126, 10076-84 (2004)), который включен сюда путем ссылки.
Модификация поверхности GNP. GNP подвергали ПЭГилированию добавлением в раствор GNP 25 мМ тиол-PEG-NH2 (м.в. 3400) и 50 мМ тиол-PEG (м.в. 2000, соотношение PEG/GNP = 10000:1). Раствор перемешивали 5 часов при комнатной температуре. Затем ПЭГилированные GNP промывали 3 раза по 30 мл стерильной d.d. воды, чтобы удалить избыток ПЭГ, и ресуспендировали в 40 мл 100 мМ буфера MES (C6H13NO4S⋅H2O), рН 5,5.
Конъюгирование с рМНС. В раствор ПЭГилированных GNP по каплям добавляли pMHCs (IGRP206-214/Kd, 4 мг) с легким перемешиванием при комнатной температуре. Смесь перемешивали 1 час, а затем добавляли 20 мг 1-этил-3-(3-диметиламинопропил) карбодиимида (EDC). Смесь перемешивали еще 4 часа. Затем конъюгаты pMHC-GNP три раза промывали 40 мл фосфатно-солевого буфера (PBS, рН 7,2-7,4) и ресуспендировали в 8 мл PBS.
Пример 5. Получение конъюгированных с рМНС золотых наночастиц
Получение конъюгированных с рМНС GNPs (pMHC-GNP, 2-10 нм)
Получение GNP (2-5 нм). GNP на 2-5 нм получали растворением 250 мг (для GNP на 2 нм) или 50 мг (для GNPs на 4 нм) додециламина в 10 мл раствора DDAB (100 мМ дидодецилдиметиламмония бромида (DDAB) в толуоле). Во-вторых, растворяли 100 мг боргидрида тетрабутиламмония (ТВАВ) в 4 мл раствора DDAB. Затем растворы додециламина и ТВАВ смешивали в трехгорлой колбе на 50 мл с перемешиванием в атмосфере азота. Растворяли 34 мг AuCl3 в 4,5 мл раствора DDAB и быстро вводили в смесь ТВАВ и раствора додециламина. Раствор сразу же приобретал темно-красную окраску, что указывает на образование GNP. Смесь непрерывно перемешивали в течение 30 мин, а затем добавляли 15 мл этанола. После этого смесь центрифугировали при 4100×g в течение 12 мин для осаждения GNP.
Получение GNP (6-10 нм). Для получения GNP на 6-10 нм сначала растворяли декановую кислоту (172 мг) в 10 мл толуола, а затем смешивали с различным количеством раствора ТВАВ (4 и 1 мл для GNP на 6 и 10 нм, соответственно) в трехгорлой колбе на 50 мл с перемешиванием в атмосфере азота. Затем в смесь ТВАВ и раствора декановой кислоты быстро вводили AuCl3 (34 мг, растворенный в 4,5 мл маточного раствора DDAB). Раствор сразу же приобретал темно-красную окраску. Смесь непрерывно перемешивали в течение 30 мин, а затем добавляли 15 мл этанола. После этого смесь центрифугировали при 4100×g в течение 12 мин для осаждения GNP.
Модификация поверхности GNP. GNP ресуспендировали в 20 мл 0,1 M меркаптопропановой кислоты (MPA) в метаноле, рН 10, и перемешивали 1 час при комнатной температуре. Затем добавляли 10 мл этилацетата. После этого смесь центрифугировали при 4100×g в течение 15 мин. Осадок GNP три раза промывали 30 мл стерильной d.d. воды и ресуспендировали в 20 мл 100 мМ буфера MES (C6H13NO4S⋅Н2О), рН 5,5. В эту смесь добавляли 0,5 M раствор полиоксиэтилен-бис(амина) (в соотношении PEG/GNP = 10000:1) и 0,1 M раствор 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) (конечная концентрация 2 мМ EDC). Затем перемешивали смесь 4 часа. ПЭГилированные GNP промывали 3 раза по 30 мл стерильной d.d. воды, чтобы удалить избыток ПЭГ и EDC.
Конъюгирование с рМНС. ПЭГилированные GNP ресуспендировали в 20 мл 100 мМ буфера MES (C6H13NO4S⋅Н2О), рН 5,5. Затем к ресуспендированным GNP (соотношение pMHC/GNP = 500:1) по каплям добавляли рМНС (5 мг/мл, всего 10-30 мг) и перемешивали 1 час при комнатной температуре, после чего добавляли 0,1 M 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) (конечная концентрация 2 мМ EDC). Смесь перемешивали еще 4 часа. Конъюгаты pMHC-GNP 3 раза промывали 40 мл фосфатно-солевого буфера (PBS, рН 7,2-7,4), а затем ресуспендировали в 10-20 мл PBS.
Оптимизация рМНС. Оптимальная конструкция pMHC-NP состоит из мелких частиц, покрытых мономерами рМНС при максимально возможной плотности, что дает комплексы рМНС, отстоящие друг от друга на 3-4 нм. Разработанные по этим принципам pMHC-NP обладают оптимальной эффективностью (максимальная агонистическая активность и способность к экспансии ауторегуляторных Т-клеток при низких общих дозах рМНС). Это было установлено экспериментально в отношении наночастиц с рМНС класса I и также оказалось верным для покрытых рМНС класса II NP. Если использовать их при оптимальной плотности и дозе рМНС, то и покрытые рМНС класса I, и класса II NPs способны вызывать экспансию когнатных ауторегуляторных Т-клеток. Таким образом, идеальная конструкция pMHC-NP включает способность наночастиц доставлять на себе плотно упакованные рМНС.
Это подтверждается двумя экспериментальными наблюдениями: (1) более крупные наночастицы, покрытые таким же количеством рМНС, что и мелкие NP, особенно при пороговых значениях валентности (т.е. 10 pMHC/NP), обладали значительно меньшей агонистической активностью, независимо от общего количества рМНС, причем для разводки индивидуальных рМНС на пороговое значение в 10 нм требуется 60 pMHC/NP, а для расстояния в 3-4 нм нужно >120 рМНС; и (2) небольшие наночастицы, покрытые при очень высокой плотности рМНС, обладают наибольшей агонистической активностью, также независимо от общего количества рМНС. Таким образом, уменьшение расстояния между рМНС (т.е. от порогового расстояния в 10 нм до 2-4 нм) путем повышения плотности рМНС ведет к повышению общей авидности и TCR-сигнальной способности при взаимодействии pMHC-NP с Т-клетками. Таким образом, порог для агонистической активности определяется не количеством молекул рМНС, а молекулярной плотностью рМНС (расстоянием между молекулами рМНС) на поверхности наночастиц.
В совокупности, это закладывает фундамент для оптимального проектирования составов pMHC-NP, направленных на экспансию аутоантиген-специфичных регуляторных Т-клеток in vivo для лечения аутоиммунных заболеваний. Заявитель показал, что оптимальные составы могут обеспечивать обширную экспансию аутоантиген-специфичных регуляторных Т-клеток in vivo до таких высоких частот, как 1 на 2 циркулирующие Т-клетки CD8+ или CD4+ при очень низких дозах pMHC-NP. Поскольку терапевтические уровни значительно ниже, чем те, что вызывают такую массивную экспансию, то этот подход выигрывает от большого порога безопасности и эффективности, что должно способствовать лечению агрессивных аутоиммунных заболеваний.
Следует иметь в виду, что хотя настоящее изобретение было конкретно раскрыто на предпочтительных воплощениях и необязательных особенностях, специалисты в этой области могут прибегать к модификации, усовершенствованию и изменению приведенных здесь воплощений изобретения, причем такие модификации, усовершенствования и изменения считаются входящими в рамки настоящего изобретения. Приведенные здесь материалы, методы и примеры представляют предпочтительные воплощения, являются иллюстративными и не предназначены для ограничения объема настоящего изобретения.
Изобретение было описано здесь в широком и общем смысле. Каждые из более узких разновидностей и более мелких группировок, входящих в общее раскрытие, также входят в состав настоящего изобретения. Это охватывает и общее описание изобретения с оговорками или отрицательными ограничениями, исключающими из него любые объекты изобретения, независимо от того, будет ли исключенный материал специально в нем приведен.
Кроме того, если какие-то признаки или аспекты изобретения описаны в терминах групп Маркуша, то специалисты в этой области должны понимать, что изобретение тем самым также описано в терминах любых отдельных элементов или подгрупп членов группы Маркуша.
По всему описанию приводятся различные публикации, патенты и опубликованные патентные заявки, снабженные идентифицирующими ссылками. Все приведенные здесь публикации, патентные заявки, патенты и другие ссылки прямо включены сюда путем ссылки во всей полноте и в той же степени, как если бы каждая из них была включена в качестве ссылки отдельно. В случае противоречия должно возобладать настоящее описание, включая определения.