Результат интеллектуальной деятельности: Способ анализа дифференциально метилированных геномных участков в биологических образцах костного мозга и крови детей с острым миелоидным лейкозом
Вид РИД
Изобретение
Настоящее изобретение относится к биотехнологии/биомедицине, в частности к онкологии, и может быть использовано для определения изменений метилирования ДНК в бластных клетках костного мозга, подвергшихся злокачественной трансформации, до лечения и в процессе лечения лейкоза, а также для профилирования клональной принадлежности опухолевых клеток.
Способ основан на одном из патогенетических факторов канцерогенеза - нарушении процессов метилирования без нарушения структуры ДНК.
На сегодняшний день сертифицированных тест-систем и способов ДНК-диагностики маркеров метилирования при остром миелоидном лейкозе (ОМЛ) у детей не существует.
Из существующих способов изучения ген-специфического анализа метилирования, в случае, когда объект исследования - аномальное метилирование CpG-островков, известна группа методов, основанных на бисульфитной конверсии участков ДНК (US 20060134643 А1, 19.06.2000), таких как прямое секвенирование (Frommer М, McDonald LE, Millar DS, Collis CM, Watt F, Grigg GW, Molloy PL, Paul CL. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proceedings of the National Academy of Sciences of the United States of America. 1992; 89 (5):1827-1831), пиросеквенирование (Colella S, Shen L, Baggerly KA, Issa JP, Krahe R. Sensitive and quantitative universal Pyrosequencing methylation analysis of CpG sites. BioTechniques. 2003; 35(1):146-150.), метил-специфическая полимеразная цепная реакция (МС-ПЦР) (US 5786146 А, 3.06.1996).
Недостатками этой группы методов являются: сложность в исполнении протоколов, низкая воспроизводимость результатов. Артефакты могут возникать по причине неполной конверсии цитозина в области CpG-богатых участков генома, которые особенно трудно подвергаются денатурации, что приводит к ложноположительным результатам, а также случайной конверсии 5-метилцитозина исходной матрицы. Точность методов, основанных на обработке ДНК бисульфитом натрия, сильно зависит от дизайна праймеров для МС-ПЦР (является аллель-специфической ПЦР и обладает всеми ее недостатками). Если праймер подобран к участку ДНК, содержащему несколько CpG-пap, нужно учитывать влияние каждого CpG-динуклеотида на связывание праймера. То есть, множественные CpG-пары в области связывания праймеров, увеличивают специфичность реакции только тогда, когда эти сайты имеют одинаковый статус метилирования. При этом необходимо учесть, что результаты, полученные при использовании метил-специфической ПЦР, отражают статус метилирования только CG-пap, входящих в состав праймера. Серьезным недостатком методов, основанных на ПЦР-анализе конвертированной ДНК, является возможность различий в эффективности амплификации метилированной и неметилированной последовательностей. Также обработка бисульфитом приводит к значительной деградации ДНК вследствие депуринизации. Поскольку бисульфит действует только на одноцепочечную ДНК, необходимо проводить реакцию в таких условиях, в которых ДНК оставалась бы одноцепочечной, причем проводить ее достаточное для успешной конверсии время. Однако, такие условия, а именно высокая температура и длительный период инкубации, могут привести к деградации до 90% всей ДНК. Кроме того, у млекопитающих широко распространена модификация ДНК 5-гидроксиметилцитозин. При обработке бисульфитом 5-гидроксиметилцитозин превращается в цитозин-5-метилсульфонат, который при секвенировании опознаётся как цитозин. Таким образом, методы, основанные на бисульфитной обработке не могут различить 5-гидроксиметилцитозин и метилцитозин, а потому не могут рассматриваться как методы, чувствительные только к метилированию ДНК.
Другой известный способ заключается в применении высокоразрешающих чиповых технологий. Единственные на сегодняшний день чипы, предназначенные для анализа метилирования CpG-сайтов генома человека с известной локализацией: Infinium® HumanMethylation450 BeadChip (WO 2015110664 A1, 27.01.2014) и Infinium® MethylationEPIC BeadChip (WO 2017106481 A1, 17.12.2015).
К недостаткам метода относится то, что подавляющее большинство точек на чипах не являются информативными с точки зрения идентификации дифференциального метилирования ДНК при ОМЛ, так как системы не являются специфичными в отношении конкретных типов опухолей. Сложность интерпретации результатов и стоимость проведения реакции не позволяет использовать технологию в рутинной онкологической практике.
Также известен метод метил-чувствительной ПЦР (МЧ-ПЦР), основанный на способности метилчувствительных рестриктаз гидролизовать ДНК, не содержащую метилированные основания и не затрагивать участки, содержащие метилированные цитозины (US 20070160991 A1, 30.09.2003). Методы, основанные на использовании МЧ-ПЦР, обладают чувствительностью, которая на порядок выше, чем у МС-ПЦР. МЧ-ПЦР требует очень небольшого количества исходного материала и может использоваться с гетерогенными образцами. Несомненными достоинствами метода являются меньшая сложность и трудоемкость при исследовании, возможность мультиплексирования реакции и использования сразу нескольких контролей в каждой пробирке. При этом метод МЧ-ПЦР на порядок быстрее и дешевле, чем МС-ПЦР. Все это свидетельствует о том, что он может быть использован для высокопроизводительного анализа клинического материала.
На настоящий момент описано лишь 3 системы для определения аномального метилирования методом многолокусной МЧ-ПЦР, для использования в диагностике, в том числе онкологических заболеваний. Одна состоит из 7 генов (Li Y, Melnikov AA, Levenson V, Guerra E, Simeone P, Alberti S, Deng Y. A seven-gene CpG-island methylation panel predicts breast cancer progression. BMC Cancer. 2015; 15:417), другая представлена несколькими панелями и состоит из 56 генов (Melnikov AA, Scholtens DM, Wiley EL, Khan SA, Levenson VV. Array-based multiplex analysis of DNA methylation in breast cancer tissues. The Journal of Molecular Diagnostics. 2008; 10:93-101) - обе предназначены для использования при раке молочной железы. Третья панель состоит из 10 генов, выявленных по результатам анализа Infinium® HumanMethylation450 BeadChip, для определения аномального метилирования биологических жидкостей, таких как сперма, слизь из влагалища, слюна, венозная и менструальная кровь (Lin YC, Tsai LC, Lee JC, Su CW, Tzen JT, Linacre A, Hsieh HM. Novel identification of biofluids using a multiplex methylation sensitive restriction enzyme-PCR system. Forensic Science International: Genetics. 2016; 25(11):157-165).
Проблемой, разрешаемой с помощью настоящего изобретения, является создание способа анализа метилирования геномных участков в клетках, подвергшихся злокачественной трансформации, а также профилирования клональной принадлежности опухолевых клеток, в том числе при анализе образцов костного мозга и крови детей (пациентов до 18 лет) с острым миелоидным лейкозом.
Технический результат, обеспечивающий разрешение указанной проблемы состоит в том, что определен оптимальный целевой набор маркеров, ассоциированный с острым миелоидным лейкозом у детей; обеспечена возможность идентификации всех молекулярных подтипов опухоли; реализована высокая чувствительность метода по отношению к выявлению аномального метилирования в избытке нормального биологического материала (1 опухолевая клетка на 1000 клеток нормального биологического материала) [2]. Технический результат достигается созданием многолокусной метилчувствительной тест-системы из ограниченного набора маркеров метилирования ДНК, перекрывающей все молекулярные подтипы острого миелоидного лейкоза у детей путем анализа дифференциально метилированных геномных участков в биологических образцах костного мозга и крови детей с острым миелоидным лейкозом.
Сущность изобретения состоит в том, что способ анализа аномально метилированных геномных участков в биологических материалах пациентов с острым миелоидным лейкозом осуществляется путем выявления метилирования, при котором проводят выделение образцов геномной ДНК из биологического материала пациента с добавлением экстракционного буфера и протеиназы K, после добавления экстракционного буфера и протеиназы K последовательно проводят экстракцию ДНК равными объемами фенола, смеси фенол-хлороформа (1:1) и хлороформа, затем осаждают ДНК 2,5 объемами холодного 96% этанола, выдерживают образец 30 мин при температуре - 70°C, после чего образцы растворенной ДНК центрифугируют 15 мин с ускорением 12000 g, высушивают осадок ДНК на воздухе и растворяют в 200 мкл ТЕ-буфера (Tris-EDTA) pH 8.0, причем в отношении выделенных образов геномной ДНК последовательно осуществляют гидролиз метилчувствительной эндонуклеазой рестрикции, после чего подвергают амплификации, используя для этого метилчувствительную полимеразную цепную реакцию с праймерами:
5'-ggc-ggg-acc-ggc-gag-cag-tag-c-3', 5'-aag-cca-ggc-gca-cca-ccc-gga-c-3', 5'-ggg-cgc-gct-cac-ctc-gga-cag-g-3', 5'-tcc-cca-tcc-cgc-gga-ccc-ctc-c-3', 5'-cgg-cgc-gct-caa-agc-caa-gcc-g-3', 5'-cac-acc-cca-ggc-gct-gcc-ctc-c-3', 5'-gcg-gcc-ggg-agg-gag-ttg-tcg-g-3', 5'-gcg-gag-gct-act-gag-gcg-gcg-g-3', 5'-gac-gcc-gct-acc-tca-gcc-gcc-g-3', 5'-tgg-ccc-gca-ggg-cgg-taa-gtg-c-3', 5'-ggg gct cgg gtg cct gag atc g-3', 5'-ggg cgg gct ccg gaa cag tgt c-3', 5'-gtc gcc cgc ccc ggg aaa gga c-3', 5'-gca ggg gcc ctt ggg ggt cag g-3', 5'-ccc agg ctg cgc ggt ttc ccg a-3', 5'-cgt tct cgc ctc cag ccc cgc c-3', 5'-agc gct ggg tgc ggg gtt tcg g-3', 5'-gcg gag gct act gag gcg gcg g-3', 5'-cgg gcg cca gcg act cac cct c-3', 5'-ggc ggc ctt ctc cag gcg gtg g-3', 5'-gcg agg agt gaa ggt ttc ag-3', 5'-gga aac acg ggt agt tcc aa-3', 5'-ccc ata ccc acc agt acc ac-3', 5'-gtc ctt gcc tcc cat ctt ct-3', 5'-gat agg ggg aag ggt gaa ag-3', 5'-gat tag ccg aag cca caa ac-3', 5'-aga agg ccg cga act tga ac-3', 5'-tat ggc gat ttt gcc ctg tg-3', 5'-cag ccc gct cgg tat tat ga-3', 5'-gca aca gcg gag gct act ga-3', а для детекции аномального метилирования фрагментов ДНК, полученных в результате метилчувствительной полимеразной цепной реакции с праймерами, производят визуализацию продуктов полимеразной цепной реакции в полиакриламидном геле (ПААГ).
Предпочтительно, проводят выделение образца геномной ДНК из биологического материала пациента из группы: венозная кровь или гомогенизированный костный мозг.
Предпочтительно, визуализацию метилирования проводят разделением фрагментов ДНК методом аналитического вертикального электрофореза в 8% ПААГ, с последующей окраской нитратом серебра.
Предпочтительно, для проведения амплификации метилчувствительной полимеразной цепной реакцией производят разделение образца на три части с образованием трех пулов, каждый из которых подвергают амплификации метилчувствительной полимеразной цепной реакцией с одной из групп праймеров:
- Пул 1: 100 нг ДНК, 2,6 мМ MgCl2, 68 мМ Tris-HCl, 16,8 мМ (NH4)2SO4, 0.01% Tween-20, 8% глицерин, 0,1 мг/мл бычий сывороточный альбумин (сокращённо БСА, англ. Bovine Serum Albumin, BSA), 3 мкл диметилсульфоксид (сокращенно ДМСО, англ. Dimethyl sulfoxide, DMSO), по 2 мкл каждого 2,5мМ дезоксинуклеотидтрифосфата (сокращенно англ. dNTP), по 0,5 мкл 10 пмоль прямого (F) и обратного (R) праймеров ABCG4_F: 5'-ggc-ggg-acc-ggc-gag-cag-tag-c-3', ABCG4_R: 5'-aag-cca-ggc-gca-cca-ccc-gga-c-3'; DLK2_F: 5'-ggg-cgc-gct-cac-ctc-gga-cag-g-3', DLK2_R: 5'-tcc-cca-tcc-cgc-gga-ccc-ctc-c-3'; SOX8_F: 5'-cgg-cgc-gct-caa-agc-caa-gcc-g-3', SOX8_R: 5'-cac-acc-cca-ggc-gct-gcc-ctc-c-3'; CTRL_RESTR_P1_SNRK_F: 5'-gcg-gcc-ggg-agg-gag-ttg-tcg-g-3', CTRL_RESTR_P1_SNRK_R: 5'-gcg-gag-gct-act-gag-gcg-gcg-g-3'; CTRL_POS_CUX1_P1_F: 5'-gac-gcc-gct-acc-tca-gcc-gcc-g-3'; CTRL_POS_CUX1_P1_R: 5'-tgg-ccc-gca-ggg-cgg-taa-gtg-c-3', деионизованной воды до 25 мкл;
- Пул 2: 100 нг ДНК, 0,6 мМ MgCl2, 68 мМ Tris-HCl, 16,8 мМ (NH4)2SO4, 0.01% Tween-20, 8% глицерин, 0,1 мг/мл BSA, 3 мкл DMSO, по 2 мкл каждого 2,5мМ dNTP, по 0,5 мкл 10 пмоль прямого (F) и обратного (R) праймеров GSGL1_F: 5'-ggg gct cgg gtg cct gag atc g-3', GSGL1_R: 5'-ggg cgg gct ccg gaa cag tgt c-3'; CXCL14_F: 5'-gtc gcc cgc ccc ggg aaa gga c-3', CXCL14_R: 5'-gca ggg gcc ctt ggg ggt cag g-3'; TMEM176A/TMEM176B_F: 5'-ccc agg ctg cgc ggt ttc ccg a-3', TMEM176A/TMEM176B_R: 5'-cgt tct cgc ctc cag ccc cgc c-3'; CTRL_RESTR_P3_SNRK_F: 5'-agc gct ggg tgc ggg gtt tcg g-3', CTRL_RESTR_P3_SNRK_R: 5'-gcg gag gct act gag gcg gcg g-3'; CTRL_POS_P3_CUX1_F: 5'-cgg gcg cca gcg act cac cct c-3'; CTRL_POS_P3_CUX1_R: 5'-ggc ggc ctt ctc cag gcg gtg g-3', деионизированной воды до 25 мкл.;
- Пул 3: 100 нг ДНК, 2,6 мМ MgCl2, 68 мМ Tris-HCl, 16,8 мМ (NH4)2SO4, 0.01% Tween-20, 8% глицерин, 0,1 мг/мл BSA, 3 мкл DMSO, 2 мкл β-меркаптоэтанола, по 2 мкл каждого 2,5мМ dNTP, по 0,5 мкл 10 пмоль прямого (F) и обратного (R) праймеров F-EGFLAM: 5'-gcg agg agt gaa ggt ttc ag-3', R-EGFLAM: 5'-gga aac acg ggt agt tcc aa-3'; F-TMEM200B: 5'-ccc ata ccc acc agt acc ac-3', R-TMEM200B: 5'-gtc ctt gcc tcc cat ctt ct-3'; F-CLDN7: 5'-gat agg ggg aag ggt gaa ag-3', R-CLDN7: 5'-gat tag ccg aag cca caa ac-3'; CTRL_POS_P4_CUX1_F: 5'-aga agg ccg cga act tga ac-3', CTRL_POS_P4_CUX1_R: 5'-tat ggc gat ttt gcc ctg tg-3'; CTRL_RESTR_P4_SNRK_F : 5'-cag ccc gct cgg tat tat ga-3'; CTRL_RESTR_P4_SNRK_R: 5'-gca aca gcg gag gct act ga-3', деионизированной воды до 25 мкл.
Предпочтительно, для осуществления метилчувствительной полимеразной цепной реакции с праймерами каждый из пулов прогревают при 95°C в течение 5 мин., добавляют 2,5 ед. термостабильной Taq-полимеразы, и проводят 33 цикла с параметрами: денатурация: 95°C - 1 мин; отжиг: 63°C - 45 c; элонгация: 72°C - 30 сек., осуществляют финальную инкубацию при 72°C в течение 10 мин. с последующей визуализацией системы маркеров дифференциального метилирования ДНК в полиакриламидном геле.
Предпочтительно:
- в отношении пула 1 производится мультиплексная МЧ-ПЦР для праймеров «ABCG4, DLK2, SOX8». с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции;
- в отношении пула 2 производится мультиплексная МЧ-ПЦР для праймеров «CXCL14, GSGL1, TMEM176A/TMEM176B». Реакции проведены с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции;
- в отношении пула 3 производится мультиплексная МЧ-ПЦР для праймеров «CLDN7, EGFLAM, TMEM200B». с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции.
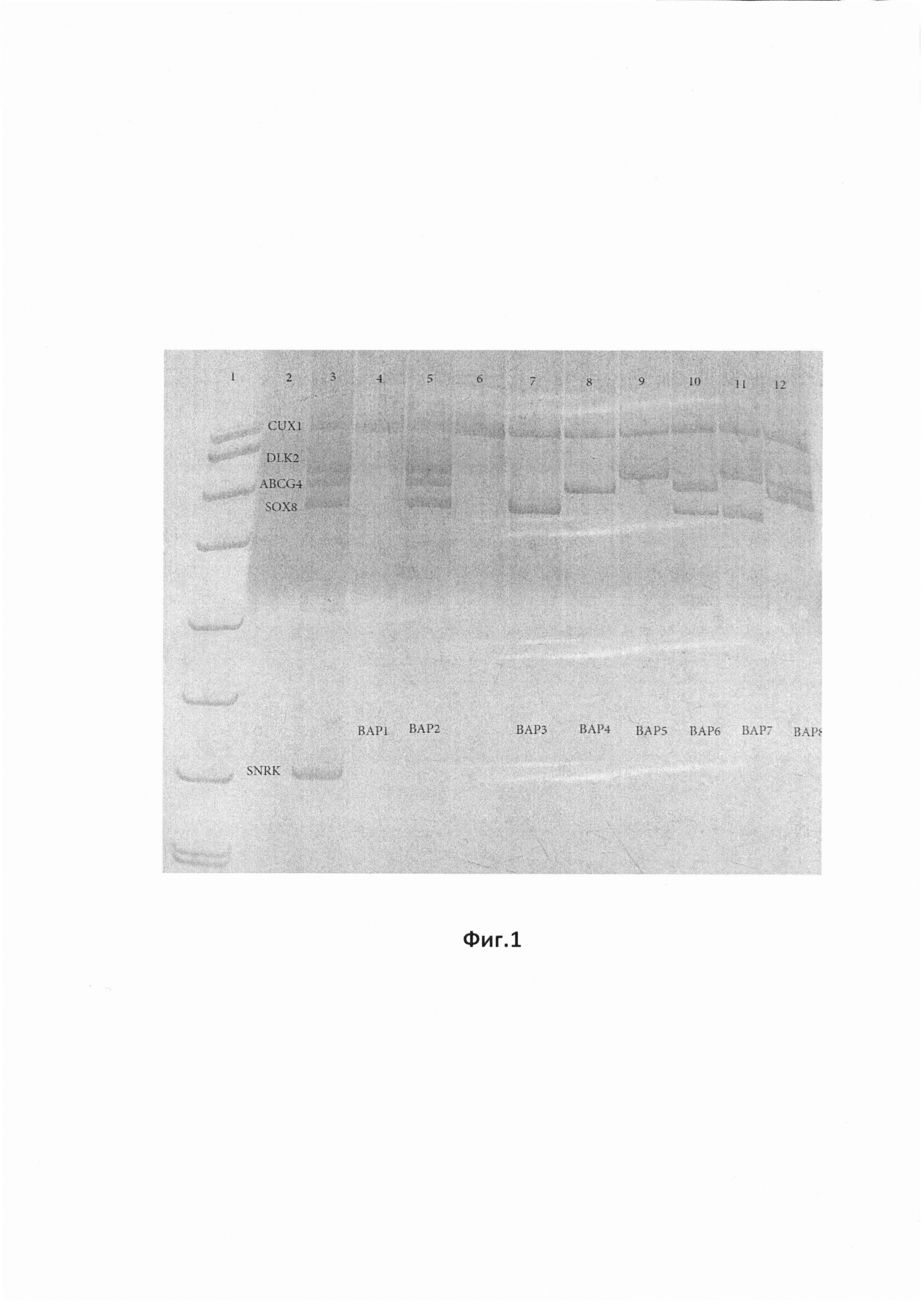
На фиг.1 представлена фотография ПААГ для продуктов Пула 1, в отношении которого проведена мультиплексная МЧ-ПЦР для праймеров «ABCG4, DLK2, SOX8». Реакция проведена с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции.
На фиг.2 представлена фотография ПААГ для продуктов Пула 2, в отношении которого проведена мультиплексная МЧ-ПЦР для праймеров «CXCL14, GSGL1, TMEM176A/TMEM176B». Реакции проведены с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции
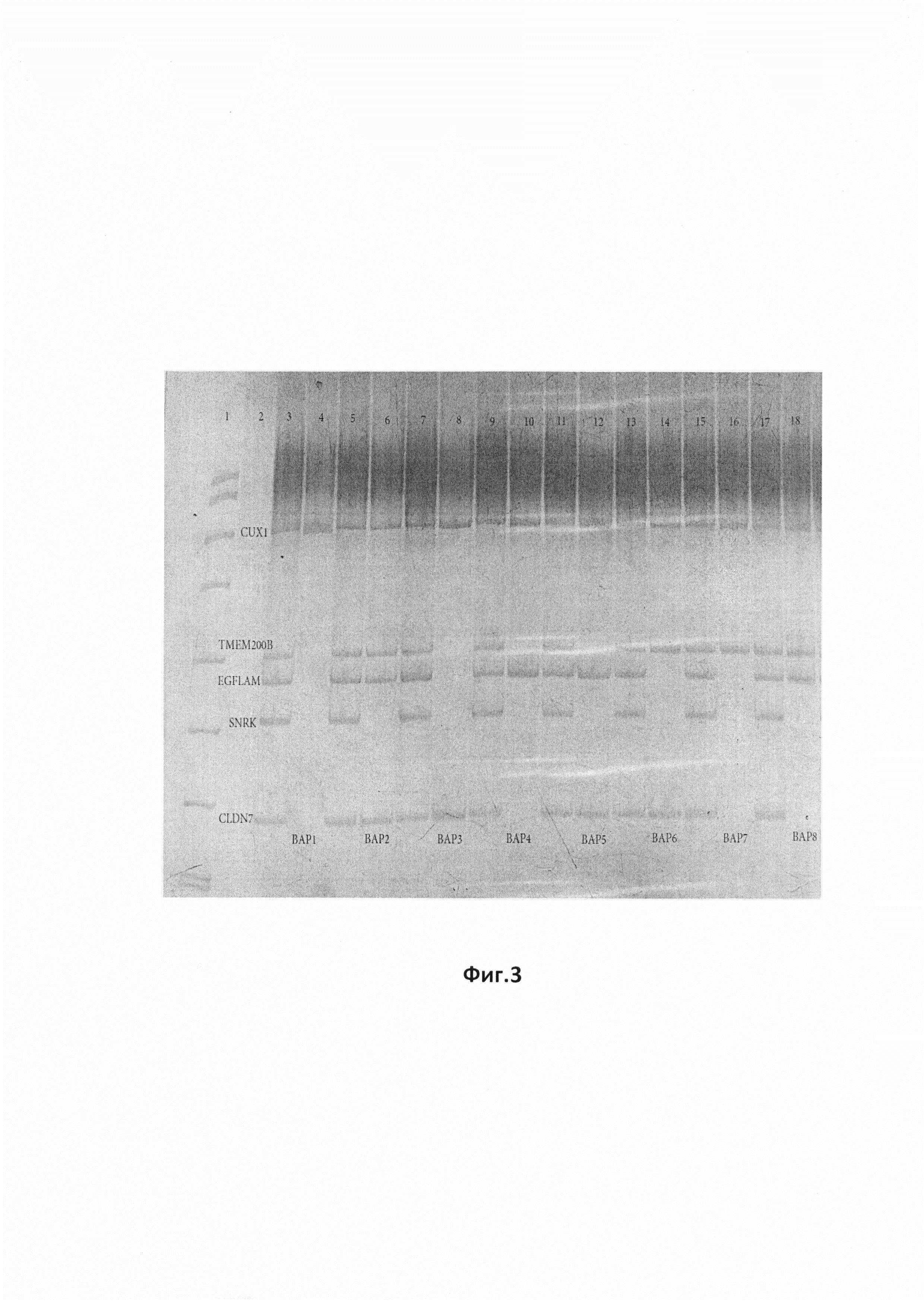
На фиг.3 представлена фотография ПААГ для продуктов Пула 3, в отношении которого проведена мультиплексная МЧ-ПЦР для праймеров «CLDN7, EGFLAM, TMEM200B». Реакции проведены с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции.
Способ практически осуществляется следующим образом.
Этапы осуществления способа: (1) выделение геномной ДНК; (2) сайт-специфический метилчувствительный гидролиз ДНК; (3) проведение метилчувствительной полимеразной цепной реакции (МЧ-ПЦР) со специфическими праймерами; (4) аналитический гель-элекрофорез.
Для выделения геномной ДНК к 700 мкл венозной крови или к 500 мкл гомогенизированной ткани костного мозга, взятых у детей с острым миелоидным лейкозом, добавляют 500-700 мкл экстракционного буфера (10 мМ Tris-HCl, 2 мМ этилендиаминтетрауксусная кислота (ЭДТА), 4 мМ NaCl, pH=8,0), протеиназу К до концентрации 50 мкг/мл и додецилсульфат натрия (англ. sodium dodecyl sulfate, SDS) до 0.5%. Образец тщательно перемешивают, инкубируют 2 часа при 37°C. Последовательно проводят экстракцию ДНК равными объемами фенола, смеси фенол-хлороформ (1:1) и хлороформом. Затем к образцу добавляют 1/10 объема 5М ацетата натрия, pH 5,3, перемешивают и осаждают ДНК 2,5 объемами холодного 96% этанола, выдерживают образец 30 мин при температуре - 70°C. Пробу центрифугируют 15 мин с ускорением 12000 g. Высушивают осадок ДНК на воздухе и растворяют в 200 мкл ТЕ-буфера pH 8.0.
Для создания пула (набора) метилированных фрагментов образцы ДНК подвергаются гидролизу метилчувствительной рестриктазой BstHHI. В рестрикционную смесь с общим объемом 20 мкл добавляют 1 мкг нативной ДНК, 2 мкл соответствующего 10-кратного буфера и 20 единиц рестриктазы BstHHl. Смесь инкубируют 16 часов при температуре 50°C. Для инактивации фермента смесь термостатируют в течение 20 минут при 75°C.
Полимеразную цепную реакцию проводят параллельно в трех пробирках, в каждой со своим отдельным пулом праймеров. Цель использования трех пулов праймеров не в одной пробирке, а параллельно в трех различных - минимизация неспецифических продуктов реакции, снижение эффекта преимущественной амплификации более легких фрагментов ДНК и улучшение качества визуализируемой картины с целью оптимизации использования системы в рутинной клинико-лабораторной практике [1].
Состав реакционной смеси и условия ПЦР для каждого из пулов:
Пул 1: 100 нг ДНК, 2,6 мМ MgCl2, 68 мМ Tris-HCl, 16,8 мМ (NH4)2SO4, 0.01% Tween-20, 8% глицерин, 0,1 мг/мл BSA, 3 мкл DMSO, по 2 мкл каждого 2,5 мМ dNTP, по 0,5 мкл 10 пмоль прямого (F) и обратного (R) праймеров ABCG4_F: 5'-ggc-ggg-acc-ggc-gag-cag-tag-c-3', ABCG4_R: 5'-aag-cca-ggc-gca-cca-ccc-gga-c-3'; DLK2_F: 5'-ggg-cgc-gct-cac-ctc-gga-cag-g-3', DLK2_R: 5'-tcc-cca-tcc-cgc-gga-ccc-ctc-c-3'; SOX8_F: 5'-cgg-cgc-gct-caa-agc-caa-gcc-g-3', SOX8_R: 5'-cac-acc-cca-ggc-gct-gcc-ctc-c-3'; CTRL_RESTR_P1_SNRK_F: 5'-gcg-gcc-ggg-agg-gag-ttg-tcg-g-3', CTRL_RESTR_P1_SNRK_R: 5'-gcg-gag-gct-act-gag-gcg-gcg-g-3'; CTRL_POS_CUX1_P1_F: 5'-gac-gcc-gct-acc-tca-gcc-gcc-g-3'; CTRL_POS_CUX1_P1_R: 5'-tgg-ccc-gca-ggg-cgg-taa-gtg-c-3', деионизованной воды до 25 мкл. Смесь прогревают при 950С в течение 5 мин., добавляют 2,5 ед. термостабильной Taq-полимеразы, и проводят 33 цикла с параметрами: денатурация: 95°С - 1 мин; отжиг: 63°С - 45 c; элонгация: 72°С - 30 сек. Финальную инкубацию проводят при 72° в течение 10 мин.
В результате амплификации ДНК, не подвергавшейся гидролизу, образуются все пять продуктов мультилокусной МЧ-ПЦР, таким образом, в соответствующих дорожках геля будут наблюдаться пять фрагментов соответствующих длин.
В случае, если в ДНК имеет место аномальное метилирование CpG-динуклеотидов исследуемой области, остатки цитозина заменены на 5-метилцитозин, в том числе, в сайтах узнавания BstHHI. В этом случае рестриктаза не в состоянии гидролизовать геномную ДНК в сайтах узнавания, и матрица для МЧ-ПЦР остается интактной. В результате, в окрашенном геле видны фрагменты, соответствующие участку промоторных областей генов ABCG4, DLK2, SOX8, а также фрагмент гена CUX1 (положительный контроль ПЦР). Фрагмент, соответствующий гену SNRK должен отсутствовать, отражая полный гидролиз ДНК (отрицательный контроль ПЦР).
В тех образцах, где метилирование этих CpG-островков отсутствует, происходит гидролиз геномной ДНК в сайтах узнавания BstHHI, матрица для ПЦР разрушается и ПЦР-продукт, соответствующий участку промотора, отсутствует в ПААГ. Пример анализа геля представлен (фиг.1). Фигура 1. Мультиплексная МЧ-ПЦР для праймеров «ABCG4, DLK2, SOX8». Реакция проведена с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции.
Результаты обработки Пула 1, в отношении которого проведена мультиплексная МЧ-ПЦР для праймеров «ABCG4, DLK2, SOX8». Результаты реакции, проведенной с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции, отражены на дорожках, обозначенных на фиг.1, где:
Дорожка 1. Маркер молекулярного веса pUC19/MspI
Дорожка 2. Отрицательный контроль - ПЦР реакция без матрицы (без ДНК)
Дорожка 3. Нерезаная ДНК: представлены все маркеры пула 1 (DLK2,ABCG4,SOX8), а также гены контроля (CUX1, SNRK).
Дорожка 4. ВАР1-Резанная ДНК: вариант отсутствия метилированных маркеров (нет продукта), а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 5. ВАР2-Резанная ДНК: вариант метилирования всех трех маркеров (DLK2,ABCG4,SOX8), а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 7. ВАР3-Резанная ДНК: вариант метилирования маркера SOX8, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 8. ВАР4-Резанная ДНК: вариант метилирования маркера ABCG4, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 9. ВАР5-Резанная ДНК: вариант метилирования маркера DLK2, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 10. ВАР6-Резанная ДНК: вариант метилирования маркеров ABCG4 и SOX8, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 11. ВАР7-Резанная ДНК: вариант метилирования маркеров DLK2 и SOX8, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 12. ВАР8-Резанная ДНК: вариант метилирования маркеров ABCG4 и DLK2, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Пул 2: 100 нг ДНК, 0,6 мМ MgCl2, 68 мМ Tris-HCl, 16,8 мМ (NH4)2SO4, 0.01% Tween-20, 8% глицерин, 0,1 мг/мл BSA, 3 мкл DMSO, по 2 мкл каждого 2,5мМ dNTP, по 0,5 мкл 10 пмоль прямого (F) и обратного (R) праймеров GSGL1_F: 5'-ggg gct cgg gtg cct gag atc g-3', GSGL1_R: 5'-ggg cgg gct ccg gaa cag tgt c-3'; CXCL14_F: 5'-gtc gcc cgc ccc ggg aaa gga c-3', CXCL14_R: 5'-gca ggg gcc ctt ggg ggt cag g-3'; TMEM176A/TMEM176B_F: 5'-ccc agg ctg cgc ggt ttc ccg a-3', TMEM176A/TMEM176B_R: 5'-cgt tct cgc ctc cag ccc cgc c-3'; CTRL_RESTR_P3_SNRK_F: 5'-agc gct ggg tgc ggg gtt tcg g-3', CTRL_RESTR_P3_SNRK_R: 5'-gcg gag gct act gag gcg gcg g-3'; CTRL_POS_P3_CUX1_F: 5'-cgg gcg cca gcg act cac cct c-3'; CTRL_POS_P3_CUX1_R: 5'-ggc ggc ctt ctc cag gcg gtg g-3', деионизированной воды до 25 мкл. Смесь прогревают при 950С в течение 5 мин., добавляют 2,5 ед. термостабильной Taq-полимеразы, и проводят 33 цикла с параметрами: денатурация: 95°С - 1 мин; отжиг: 63°С - 45 c; элонгация: 72°С - 30 сек. Финальную инкубацию проводят при 720С в течение 10 мин.
В результате амплификации ДНК, не подвергавшейся гидролизу, образуются все пять продуктов мультилокусной МЧ-ПЦР, таким образом, в соответствующих дорожках геля будут наблюдаться пять фрагментов соответствующих длин.
В случае, если в ДНК имеет место аномальное метилирование CpG-динуклеотидов исследуемой области, остатки цитозина заменены на 5-метилцитозин, в том числе, в сайтах узнавания BstHHI. В этом случае рестриктаза не в состоянии гидролизовать геномную ДНК в сайтах узнавания, и матрица для МЧ-ПЦР остается интактной. В результате, в окрашенном геле видны фрагменты, соответствующие участку промоторных областей генов CXCL14, GSGL1, TMEM176A/TMEM176B а также фрагмент гена CUX1 (положительный контроль ПЦР). Фрагмент, соответствующий гену SNRK должен отсутствовать, отражая полный гидролиз ДНК (отрицательный контроль ПЦР).
В тех образцах, где метилирование этих CpG-островков отсутствует, происходит гидролиз геномной ДНК в сайтах узнавания BstHHI, матрица для ПЦР разрушается и ПЦР-продукт, соответствующий участку промотора, отсутствует в ПААГ.
Результаты обработки Пула 2, в отношении которого проведена мультиплексная МЧ-ПЦР для праймеров «CXCL14, GSGL1, TMEM176A/TMEM176B». Реакции проведены с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции , отражены на дорожках, обозначенных на фиг.2, где:
Дорожка 1. Маркер молекулярного веса pUC19/MspI
Дорожка 2. Отрицательный контроль - ПЦР реакция без матрицы (без ДНК)
Дорожка 3. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 4. ВАР1-Резанная ДНК: вариант отсутствия метилированных маркеров (нет продукта), а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 5. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 6. ВАР2-Резанная ДНК: вариант метилирования всех трех маркеров (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 7. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 8. ВАР3-Резанная ДНК: вариант метилирования маркера TMEM176A/TMEM176B, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 9. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 10. ВАР4-Резанная ДНК: вариант метилирования маркера GSGL1, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 11. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 12. ВАР5-Резанная ДНК: вариант метилирования маркеров GSGL1 и TMEM176A/TMEM176B, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 13. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 14. ВАР6-Резанная ДНК: вариант метилирования маркера CXCL14, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 15. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 16. ВАР7-Резанная ДНК: вариант метилирования маркеров CXCL14 и TMEM176A/TMEM176B, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 17. Нерезаная ДНК: представлены все маркеры пула 2 (CXCL14, GSGL1, TMEM176A/TMEM176B), а также гены контроля (CUX1, SNRK).
Дорожка 18. ВАР8-Резанная ДНК: вариант метилирования маркеров CXCL14 и GSGL1, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Пул 3: 100 нг ДНК, 2,6 мМ MgCl2, 68 мМ Tris-HCl, 16,8 мМ (NH4)2SO4, 0.01% Tween-20, 8% глицерин, 0,1 мг/мл BSA, 3 мкл DMSO, 2 мкл β-меркаптоэтанола, по 2 мкл каждого 2,5мМ dNTP, по 0,5 мкл 10 пмоль прямого (F) и обратного (R) праймеров F-EGFLAM: 5'-gcg agg agt gaa ggt ttc ag-3', R-EGFLAM: 5'-gga aac acg ggt agt tcc aa-3'; F-TMEM200B: 5'-ccc ata ccc acc agt acc ac-3', R-TMEM200B: 5'-gtc ctt gcc tcc cat ctt ct-3'; F-CLDN7: 5'-gat agg ggg aag ggt gaa ag-3', R-CLDN7: 5'-gat tag ccg aag cca caa ac-3'; CTRL_POS_P4_CUX1_F: 5'-aga agg ccg cga act tga ac-3', CTRL_POS_P4_CUX1_R: 5'-tat ggc gat ttt gcc ctg tg-3'; CTRL_RESTR_P4_SNRK_F : 5'-cag ccc gct cgg tat tat ga-3'; CTRL_RESTR_P4_SNRK_R: 5'-gca aca gcg gag gct act ga-3', деионизированной воды до 25 мкл. Смесь прогревают при 950С в течение 5 мин., добавляют 2,5 ед. термостабильной Taq-полимеразы, и проводят 33 цикла с параметрами: денатурация: 95 0С - 1 мин; отжиг: 63°С - 45 c; элонгация: 72°С - 30 сек. Финальную инкубацию проводят при 720С в течение 10 мин.
В результате амплификации ДНК, не подвергавшейся гидролизу, образуются все пять продуктов мультилокусной МЧ-ПЦР, таким образом, в соответствующих дорожках геля будут наблюдаться пять фрагментов соответствующих длин.
В случае, если в ДНК имеет место аномальное метилирование CpG-динуклеотидов исследуемой области, остатки цитозина заменены на 5-метилцитозин, в том числе, в сайтах узнавания BstHHI. В этом случае рестриктаза не в состоянии гидролизовать геномную ДНК в сайтах узнавания, и матрица для МЧ-ПЦР остается интактной. В результате, в окрашенном геле видны фрагменты, соответствующие участку промоторных областей генов CLDN7, EGFLAM, TMEM200B, а также фрагмент гена CUX1 (положительный контроль ПЦР). Фрагмент, соответствующий гену SNRK должен отсутствовать, отражая полный гидролиз ДНК (отрицательный контроль ПЦР).
В тех образцах, где метилирование этих CpG-островков отсутствует, происходит гидролиз геномной ДНК в сайтах узнавания BstHHI, матрица для ПЦР разрушается и ПЦР-продукт, соответствующий участку промотора, отсутствует в ПААГ.
Результаты обработки Пула 3, в отношении которого проведена мультиплексная МЧ-ПЦР для праймеров «CLDN7, EGFLAM, TMEM200B». Реакции проведены с использованием внутренних контролей. «pUC/MspI» - маркер молекулярной массы, «k-» отрицательный контроль, «k+» - контрольный образец, «CUX1» - внутренний контроль на наличие амплификации, «SNRK» - внутренний контроль на полноту рестрикции , отражены на дорожках, обозначенных на фиг.3, где:
Дорожка 1. Маркер молекулярного веса pUC19/MspI
Дорожка 2. Отрицательный контроль - ПЦР реакция без матрицы (без ДНК)
Дорожка 3. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 4. ВАР1-Резанная ДНК: вариант отсутствия метилированных маркеров (нет продукта), а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 5. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 6. ВАР2-Резанная ДНК: вариант метилирования всех трех маркеров (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 7. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 8. ВАР3-Резанная ДНК: вариант метилирования маркера CLDN7, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 9. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 10. ВАР4-Резанная ДНК: вариант метилирования маркера EGFLAM, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 11. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 12. ВАР5-Резанная ДНК: вариант метилирования маркеров EGFLAM и CLDN7, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 13. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 14. ВАР6-Резанная ДНК: вариант метилирования маркеров TMEM200B и CLDN7, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 15. Нерезанная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 16. ВАР7-Резанная ДНК: вариант метилирования маркера TMEM200B, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Дорожка 17. Нерезаная ДНК: представлены все маркеры пула 3 (TMEM200B,EGFLAM,CLDN7), а также гены контроля (CUX1, SNRK).
Дорожка 18. ВАР8-Резанная ДНК: вариант метилирования маркеров EGFLAM и TMEM200B, а также гены контроля (CUX1 - есть продукт, свидетельствует о нормальном прохождении ПЦР-реакции, SNRK - нет продукта, свидетельствует о нормальном прохождении рестрикции геномной ДНК).
Визуализацию продуктов реакции для каждого пула 1-3 проводят их разделением методом вертикального электрофореза в полиакриламидном геле с последующей окраской нитратом серебра.
Определяющими свойствами предлагаемого способа, по сравнению с аналогами, являются одновременно: возможность идентификации всех молекулярных подтипов опухоли - визуализация результатов представлена фиг. 1-3); целевой набор маркеров, ассоциированный с опухолью; высокая чувствительность метода по отношению к выявлению аномального метилирования в избытке нормального биологического материала (возможность определения аномального метилирования 1 опухолевой клетки на 1000 нормального биологического материала).
В случае, если в ДНК имеет место аномальное метилирование CpG-динуклеотидов исследуемой области, остатки цитозина заменены на 5-метилцитозин, в том числе, в сайтах узнавания BstHHI. В этом случае рестриктаза не в состоянии гидролизовать геномную ДНК в сайтах узнавания, и матрица для МЧ-ПЦР остается интактной. В результате, в окрашенном геле видны фрагменты, соответствующие участку промоторной области генов ABCG4, CLDN7, CXCL14, DLK2, EGFLAM, GSGL1, SOX8, TMEM176A/TMEM176B, TMEM200B, а также фрагмент гена CUX1 (положительный контроль ПЦР). Фрагмент, соответствующий гену SNRK должен отсутствовать, отражая полный гидролиз ДНК. Наличие аномального метилирования анализируемых участков генов, свидетельствует о выявлении наличия злокачественного процесса в анализируемом материале и степени его выраженности. Система предназначена для изучения фундаментальной роли аномального метилирования в процессах лейкемогенеза с перспективой дальнейшего использования полученных результатов в клинической онкологической практике, в том числе для определения минимальной остаточной болезни и клонального состава опухоли для определения препаратов терапевтического вмешательства.
Дифференциальное метилирование - метилирование по одним локусам и отсутствие метилирования по другим. Все локусы демонстрируют неметилированный статус в образцах нормального биологического материала.
Профилирование клональной принадлежности предполагается осуществить при изучение образцов биологического материала в процессе лечения при анализе изменений метилирования (стабильно на одной из стадий, изменено при другой, при этом будет учтено содержание бластных клеток, определяемое морфологически, много бластных клеток предполагает наличие более чем одного клона, сравнение с профилем метилирования образцов, содержащих меньшее количество бластных клеток позволит сделать предположение о профиле метилирования отдельных клонов.