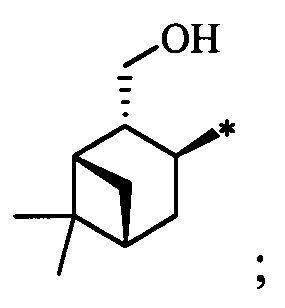
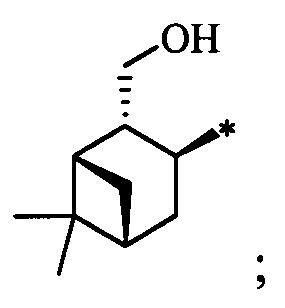
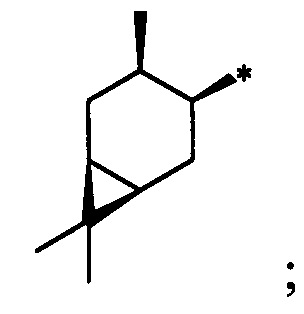
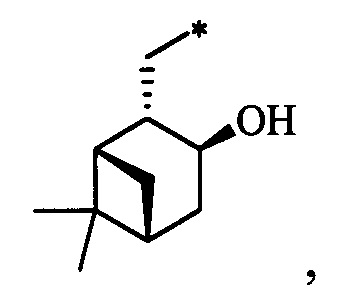
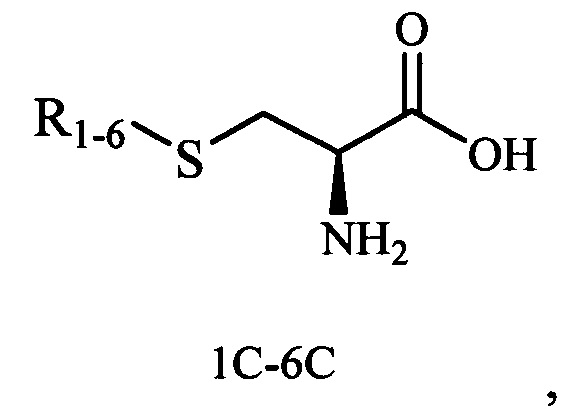
Результат интеллектуальной деятельности: Хиральные S-монотерпенилцистеины
Вид РИД
Изобретение
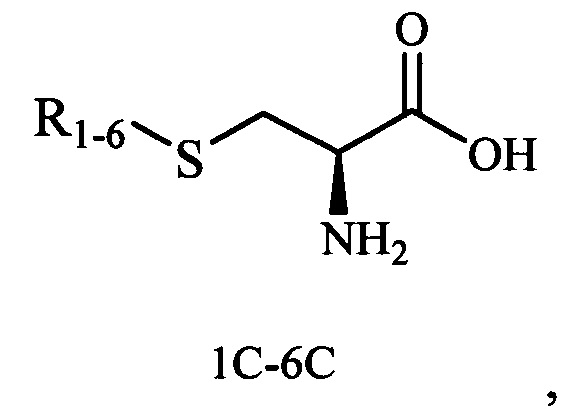
Изобретение относится к синтезу новых терпеновых сульфидов на основе тиолов карановой, ментановой, барнановой и пинановой структуры, содержащие остаток аминокислоты (L-серина), которые могут быть использованы в органическом синтезе для получения биологически активных веществ и в фармацевтической промышленности как промежуточные продукты в синтезе лекарственных препаратов.
Согласно литературным данным, наиболее известные аналоги соединений к нашему изобретению, являются производные цистеина. Например, S-аллилцистеин, входящий в состав чеснока посевного (Allium sativum), который проявляет антиоксидантную [Т. Yamasaki, L. Li, В.Н. S. Lau, Phytother. Res., 8, 408 (1994); N. Ide, В.Н. S. Lau, Drug. Dev Ind. Pharm., 25, 619 (1999)], противомикроб-ную [P. S. Ruddock, M. Liao, В. C. Foster, L. Lawson, J. T. Arnason, J.-A. R. Dillon, Phytother. Res., 19, 327 (2005)], антидиабетическую [G. Saravanan, P. Ponmurugan, G. P. S. Kumar, T. Rajarajan, J. Appl. Biomed., 7, 151 (2009); G. Saravanan, P. Ponmurugan, M. S. Begum, J. Trace Elem. Med. Biol., 27, 143 (2013)], противораковую [H. Sumiyoshi, M. J. Wargovich, Cancer Res., 50, 5084 (1990); H. Amagase, J. A. Milner, Carcinogenesis, 14, 1627 (1993); Z. Liu, M. Li, K. Chen, J. Yang, R. Chen, T. Wang, J. Liu, W. Yang, Z. Ye, Mol. Med. Rep., 5, 439 (2011)] активности, а также является перспективным для лечения гастрита [М. Iimuro, Н. Shibata, Т. Kawamori, Т. Matsumoto, Т. Arakawa, Т. Sugimura, К. Wakabayashi, Cancer Lett., 187, 61 (2002); W. -С.You, L. Zhang, M. H. Gail, J. -L. Ma, Y. -S. Chang, W. J. Blot, J. -Y. Li, C. -L. Zhao, W. -D. Liu, H. -Q. Li, Y.-R. Hu, J. C. Bravo, P. Correa, G.-W. Xua, J. F. Frau-meni, Int. J. Epidemiol, 27, 941 (1998)].
Известный хиральный S-арил-L-цистеин, сочетающий мощную противовирусную активность с хорошей фармакокинетикой используется для лечении вируса иммунодефицита человека ВИЧ [S.W. Kaldor, et al. A Potent, Orally Bioavailable Inhibitor of HIV-1 Protease. J. Med. Chem. 1997. V. 40. P. 3979-3985],
Наиболее близким аналогом соединения является сложный конъюгат цистеина и полипренола - N-ацетил-S-фарнезил-L-цистеин, модулятор G-белка, проявляет эффективное противовоспалительное действие не только в клеточных моделях, но и in vivo, ингибируя развитие экспериментального контактного дерматита у лабораторных животных [J. S. Gordon, P. М. Wolanin, А. V. Gonzalez, D. A. Fela, G. Sarngadharan, К. Rouzard, Е. Perez, J. В. Stock, М. В. Stock, J. Investig. Dermatol., 128, 643 (2008)].
Задачей, на решение которой направлено изобретение, является получение новых S-монотерпенилцистеинов с расширением сферы их применения. Полученные соединения не проявляют цитотоксичность по отношению к эритроцитам крови лабораторных мышей, обладают статистически значимой мембранопротекторной и антиоксидантной активностью и могут быть использованы в органическом синтезе для получения биологически активных веществ и в фармацевтической промышленности как промежуточные продукты в синтезе лекарственных препаратов. В этом и состоит технический результат.
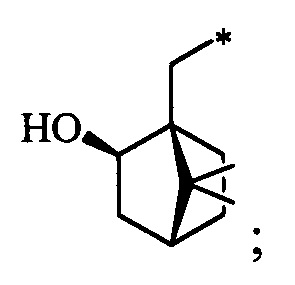
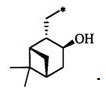
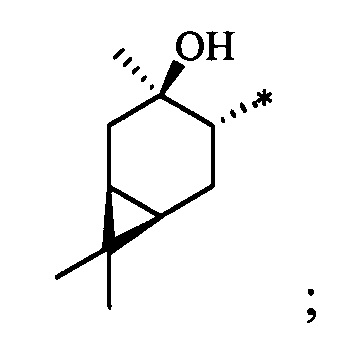
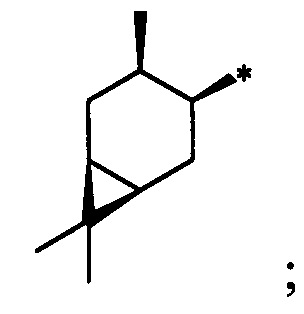
Технический результат достигается тем, что новые хиральные S-монотерпенилцистеины являются более доступными соединениями для получения биологически активных веществ, которые определены как:
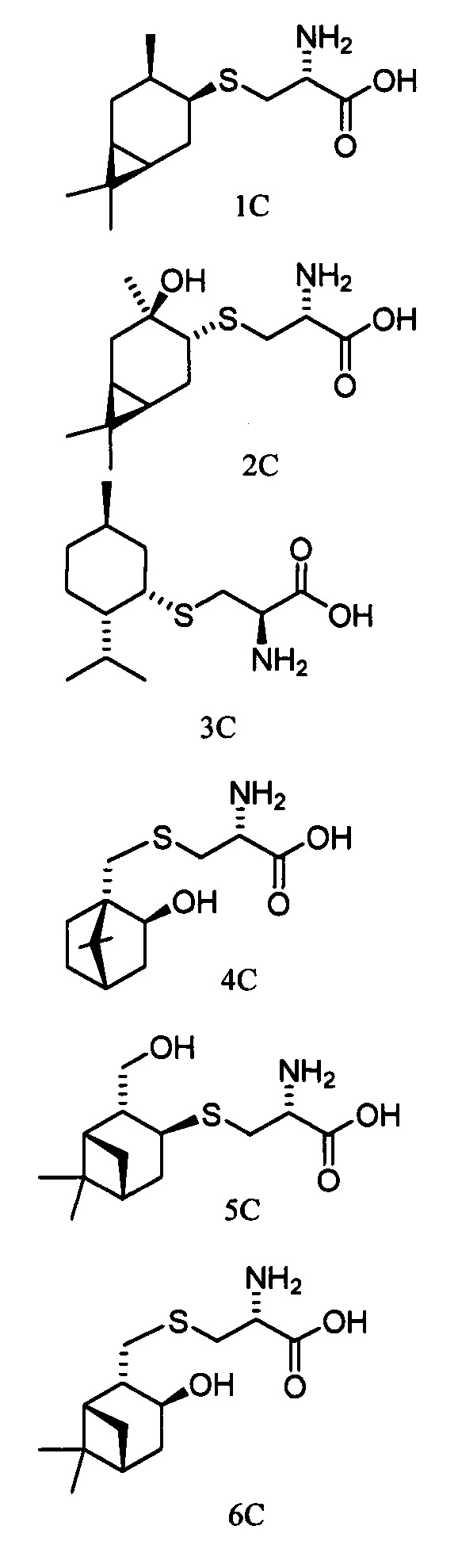
Способ получения S-монотерпенилцистеинов осуществляется следующим образом.
К раствору 1.66 ммоль соответствующего тиола и 205 мг (1.66 ммоль) L-3-хлораланина в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 105 мг (2.49 ммоль) 57%-ного NaH. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюенты - EtOH, CHCl3:МеОН - 5:1, CH2Cl2:EtOH - 2:1). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном фильтре и фильтрат упаривали при пониженном давлении.
Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллизацией (MeOH-Et2O).
Таким образом, для заявленного способа в том виде, в каком он охарактеризован в описании, подтверждена возможность его осуществления в одну стадию.
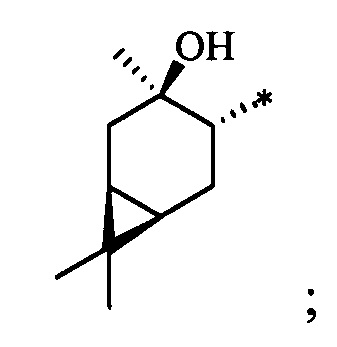
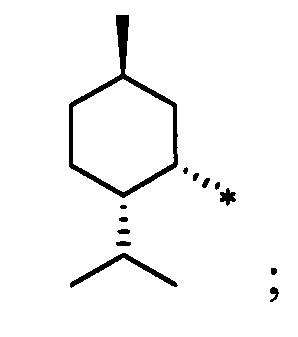
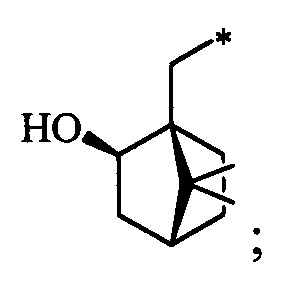
Синтез S-монотерпенилцистеинов проводили с использованием полученных ранее оптически чистых тиолов: (1R,3S,4R,6S)-4,7,7-триметилбицикло[4.1.0]гептан-3-тиола (4-карантиол) [A. Banach, J. Scianowski, P. Ozimek, Phosphorus Sulfur Silicon Relat. Elem., 189, 274 (2014)], (1S,3R,4R,6R)-4-меркапто-3,7,7-триметилбицикло[4.1.0]гептан-3-ол (3-гидроксиизокарантиол) [О.A. Banina, D.V. Sudarikov, P.A. Slepukhin, L.L. Frolova, A.V. Kuchin, Chem. Nat. Compd., 52, 240 (2016)], (1S,2S,5R)-2-изопропил-5-метилциклогексан-1-тиол (неоментантиол) [E. S. Izmest'ev, D. V. Sudarikov, S. A. Rubtsova, P. A. Slepukhin, A. V. Kuchin, Russ. J. Org. Chem., 48, 184 (2012)], (1R,2S,4S)-1 -(меркаптометил)-7,7-диметилбицикло[2.2.1]гептан-2-ол (10-тиоизоборнеол) [О. D. Lucchi, V. Lucchini, С.Marchioro, G. Valle, G. Modena, J. Org. Chem., 51, 1457 (1986)], ((1S,2R,3S,5R)-3-меркапто-6,6-диметилбицикло[3.1.1]гептан-2-ил)метанол (10-гидроксиизокамфенилтиол) [О. A. Banina, D. V. Sudarikov, Y. V. Krymskaya, L. L. Frolova, A. V. Kuchin, Chem. Nat. Compd, 51, 261 (2015)], (1S,2S,3S,5R)-2-(меркаптометил)-6,6-диметилбицикло[3.1.1]гептан-3-ол (10-тиоизокамфеол) [F. Martinez-Ramos, M. E.  , L.
, L. 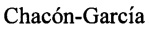 , J. Tamariz, P. Joseph-Nathan, L. G. Zepeda, Tetrahedron: Asymmetry, 12, 3095 (2001)], а также L-3-хлорананина [С.Cerny, R. Guntz-Dubini, Food Chem., 141, 1078 (2013)].
, J. Tamariz, P. Joseph-Nathan, L. G. Zepeda, Tetrahedron: Asymmetry, 12, 3095 (2001)], а также L-3-хлорананина [С.Cerny, R. Guntz-Dubini, Food Chem., 141, 1078 (2013)].
Для подбора оптимальных условий реакции варьировали такие параметры, как температура охлаждающей бани, объем сухого жидкого ДМФА, время перемешивания, и соотношение тиол - гидрид натрия. Было отмечено, что наилучшие результаты достигаются при соотношении субстрат: реагент, равному 1-1.5 соответвенно. При более высоких температурах при добавлении NaH идет большее образование побочных продуктов. Более низкие температуры увеличивают выход конечных продуктов. Варьирование объема сухого жидкого ДМФА дало более приемлемые условия для проведения реакции (в частности, нормальное перемешивание в реакционной колбе, обеспечение гомогенности при выпадении осадка).
ИК-спектры регистрировали на ИК-Фурье спектрометре Shimadzu IR Prestige 21 в таблетках KBr. Температуры плавления определяли на приборе Gallencamp-Sanyo. Спектры ЯМР 1Н и 13С регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1Н и 75.48 МГц для 13С) в CD3OD и D2O+NaOD с использованием сигналов дейтерометанола и DDS в качестве внутренних стандартов. Спектры ЯМР 13С регистрировали в режиме J-модуляции. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1Н-1Н COSY, 1Н-1Н NOESY) и гетеро-ядерных экспериментов 1Н-13С HSQC, 1H-13С НМВС). Масс-спектры регистриро-вали на приборе GCMS-QP 2010 Plus фирмы Shimadzu, прямой ввод; температура ионного источника 200°С, диапазон сканируемых масс m/z 2-800; способ ионизации - электронный удар (70 эВ). Угол оптического вращения измеряли на автоматизированном цифровом поляриметре PolAAr3001 фирмы Optical Activity. Для тонкослойной хроматографии использовали пластины Sorbfil, элюенты - EtOH, CHCl3:МеОН - 5:1, CH2Cl2:EtOH - 2:1, в качестве проявителей - растворы KMnO4, ванилина, раствор нингидрина. Растворители использовали без дополнительной очистки. Для колоночной хроматографии применяли силикагель Alfa Aesar (0.06-0.2 мм), элюент - CHCl3:МеОН - 5:1.
Новые соединения демонстрируются следующими примерами.
Пример 1.
К раствору 4-карантиола (0.283 г, 1.66 ммоль) и L-3-хлораланина (0.205 г, 1.66 ммоль) в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 57%-ного NaH (0.105 г, 2.49 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюент - EtOH). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном пористом фильтре и фильтрат упаривали при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллизацией (MeOH-Et2O).
S-((1R,3S,4R,6S)-4,7,7-Триметилбицикло[4.1.0]гептан-3-ил)-L-цистеин (1С).
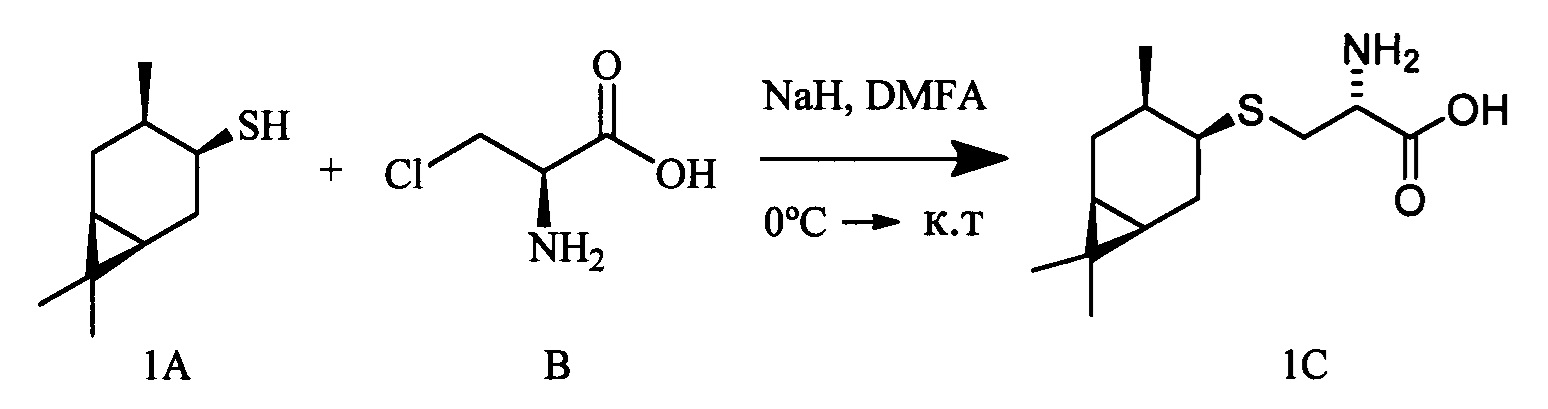
Белый порошок. Выход 39% (0,167 г). Т. пл. 160°С (разл), 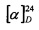 -12.4° (с 0.8; МеОН). ИК-спектр, (KBr, ν, см-1): 3138, 1126 (N-H), 1508 (NH3+), 1633 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 257 (М+,3). Спектр ЯМР 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.59-0.79 (2Н, м, Н-6, Н-1), 0.84-0.97 (1H, м, Н-2α), 1.01 (3Н, д, J=6.5, СН3-10), 1.02 (3Н, с, СН3-8), 1.05 (3Н, с, СН3-9), 1.42 (1Н, ддд, J=15.1, 7.2, 5.3, Н-5α), 1.81-2.08 (2Н, м, Н-2β, Н-3), 2.30 (1Н, дт, J=15.3, 7.6, Н-5β), 2.93-3.17 (3Н, м, Н-4, 2Н-11), 3.72 (1H, дд, J=8.2, 3.5, Н-12), 4.92 (3Н, уш.с, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 14.9 (СН3, С-9), 17.2 (С, С-7). 17.7 (СН3, С-10), 20.5 (СН, С-6), 21.1 (СН, С-1), 24.5 (СН2, С-2), 25.0 (СН2, С-5), 27.6 (СН3, С-8), 30.6 (СН, С-3), 33.0 (СН2, С-11), 45.8 (СН, С-4), 54.3 (СН, С-12), 171.4 (С, С-13).
-12.4° (с 0.8; МеОН). ИК-спектр, (KBr, ν, см-1): 3138, 1126 (N-H), 1508 (NH3+), 1633 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 257 (М+,3). Спектр ЯМР 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.59-0.79 (2Н, м, Н-6, Н-1), 0.84-0.97 (1H, м, Н-2α), 1.01 (3Н, д, J=6.5, СН3-10), 1.02 (3Н, с, СН3-8), 1.05 (3Н, с, СН3-9), 1.42 (1Н, ддд, J=15.1, 7.2, 5.3, Н-5α), 1.81-2.08 (2Н, м, Н-2β, Н-3), 2.30 (1Н, дт, J=15.3, 7.6, Н-5β), 2.93-3.17 (3Н, м, Н-4, 2Н-11), 3.72 (1H, дд, J=8.2, 3.5, Н-12), 4.92 (3Н, уш.с, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 14.9 (СН3, С-9), 17.2 (С, С-7). 17.7 (СН3, С-10), 20.5 (СН, С-6), 21.1 (СН, С-1), 24.5 (СН2, С-2), 25.0 (СН2, С-5), 27.6 (СН3, С-8), 30.6 (СН, С-3), 33.0 (СН2, С-11), 45.8 (СН, С-4), 54.3 (СН, С-12), 171.4 (С, С-13).
Пример 2.
К раствору 3-гидроксиизокарантиола (0.309 г, 1.66 ммоль) и L-3-хлораланина (0.205 г, 1.66 ммоль) в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 57%-ного NaH (0.105 г, 2.49 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюент - EtOH). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном пористом фильтре и фильтрат упаривали при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллизацией (МеОН-Et2O).
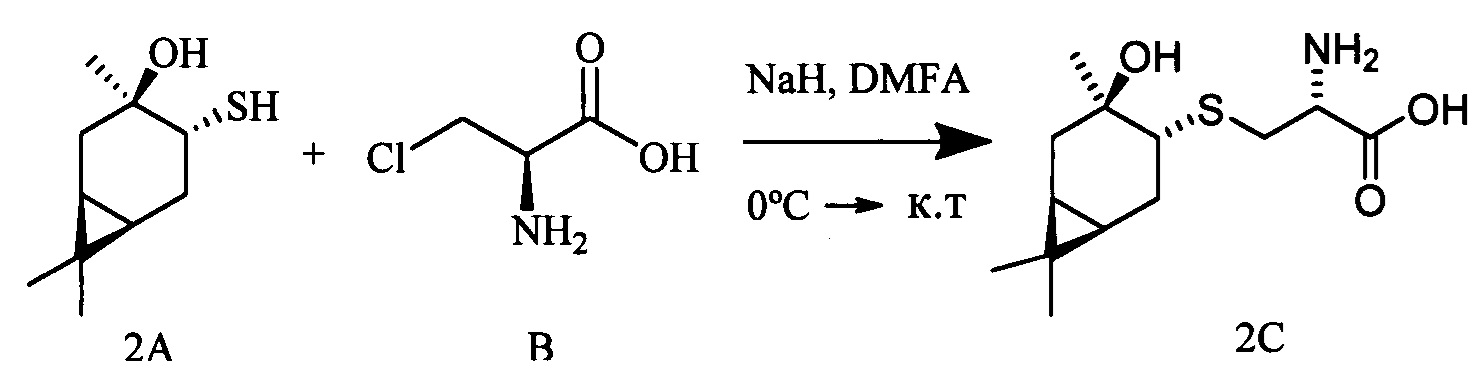
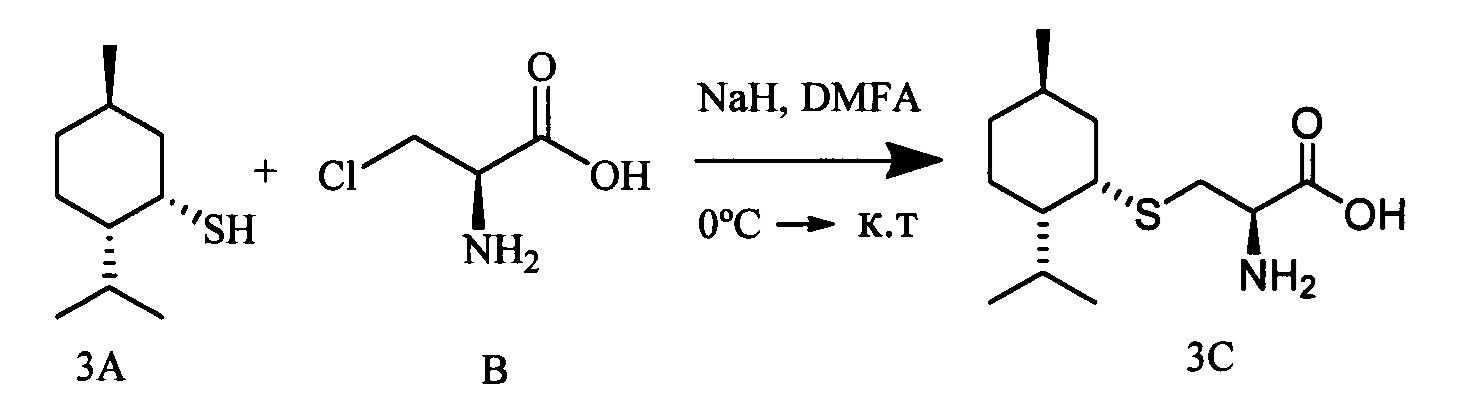
S-((1R,3R,4R,6S)-4-Гидрокси-4,7,7-триметилбицикло[4.1.0]гептан-3-ил)-L-цистеин (2С). Светло-желтый порошок. Выход 40% (0,182 г). Т. пл. 161°С, 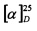 -77.8° (с 0.4; МеОН). ИК-спектр, (KBr, v, см-1): 3143, 1114 (N-H), 1494 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+,4). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.63 (1Н, т, J=8.5, Н-6), 0.83 (1Н, тд, J=9.5, 5.0, Н-1), 1.02 (3Н, с, СН3-9), 1.09 (3Н, с, СН3-8), 1.26 (3Н, д, J=6.5, СН3-10), 1.36 (1Н, дд, J=14.4, 5.0, Н-2α), 1.84 (1Н, ддд, J=14.8, 12.8, 8.2, Н-5α), 2.08 (1Н, дд, J=14.1, 10.0, Н-2β), 2.31 (1H, дд, J=15.2, 7.1, Н-5β), 2.50 (1H, дд, J=12.3, 7.0, H-4), 3.04-3.22 (2H, м, 2Н-11), 3.79 (1H, дд, J=8.2, 4.1, Н-12), 4.89 (3Н, уш.с, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 14.3 (СН3, С-9), 17.4 (С, С-7), 20.0 (СН, С-6), 20.1 (СН, С-1), 20.3 (СН3, С-10), 27.7 (СН3, С-8), 28.7 (СН2, С-5), 34.1 (СН2, С-11), 35.0 (СН2, С-2), 53.8 (СН, С-4), 54.0 (СН, С-12), 68.2 (С, С-3), 171.5 (С, С-13).
-77.8° (с 0.4; МеОН). ИК-спектр, (KBr, v, см-1): 3143, 1114 (N-H), 1494 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+,4). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.63 (1Н, т, J=8.5, Н-6), 0.83 (1Н, тд, J=9.5, 5.0, Н-1), 1.02 (3Н, с, СН3-9), 1.09 (3Н, с, СН3-8), 1.26 (3Н, д, J=6.5, СН3-10), 1.36 (1Н, дд, J=14.4, 5.0, Н-2α), 1.84 (1Н, ддд, J=14.8, 12.8, 8.2, Н-5α), 2.08 (1Н, дд, J=14.1, 10.0, Н-2β), 2.31 (1H, дд, J=15.2, 7.1, Н-5β), 2.50 (1H, дд, J=12.3, 7.0, H-4), 3.04-3.22 (2H, м, 2Н-11), 3.79 (1H, дд, J=8.2, 4.1, Н-12), 4.89 (3Н, уш.с, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 14.3 (СН3, С-9), 17.4 (С, С-7), 20.0 (СН, С-6), 20.1 (СН, С-1), 20.3 (СН3, С-10), 27.7 (СН3, С-8), 28.7 (СН2, С-5), 34.1 (СН2, С-11), 35.0 (СН2, С-2), 53.8 (СН, С-4), 54.0 (СН, С-12), 68.2 (С, С-3), 171.5 (С, С-13).
Пример 3.
К раствору неоментантиола (0.286 г, 1.66 ммоль) и L-3-хлораланина (0.205 г, 1.66 ммоль) в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 57%-ного NaH (0.105 г, 2.49 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюент - СН2Сl2:EtOH - 2:1). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном пористом фильтре и фильтрат упаривали при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллизацией (MeOH-Et2O).
S-((1S,2S,5R)-2-Изопропил-5-метилциклогексил)-L-цистеин (3С). Светло-желтый порошок. Выход 50% (0,215 г). Т. пл. 209°С, 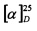 +26.2° (с 1.0; МеОН). ИК-спектр, (KBr, ν, см-1): 3134, 1128 (N-H), 1475 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 259 (М+, 5). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.86-1.00 (1H, м, Н-4а), 0.94 (6Н, д, J=6.5, СН3-7, СН3-10), 1.00 (3Н, д, J=6.5, СН3-9), 1.10-1.37 (3Н, м, Н-3а, Н-2, Н-6а), 1.58-1.82 (3Н, м, Н-3е, Н-4е, Н-8), 1.88-2.09 (2Н, м, Н-6е, Н-5), 3.05-3.22 (2Н, м, Н-11), 3.29-3.39 (1Н, м, Н-1); 4.17-4.28 (1Н, м, Н-12), 4.99 (3Н, уш.с, NH3+). Спектр 13С ЯМР (75 МГц, CD3OD, δ, м.д.): 20.0 (СН3, С-10), 20.0 (СН3, С-9), 21.1 (СН3, С-7), 25.5 (СН2, С-3), 26.2 (СН, С-5), 29.7 (СН, С-8), 31.2 (СН2, С-11), 35.1 (СН2, С-4), 40.2 (СН2, С-6), 48.1 (СН, С-2), 49.0 (СН, С-1), 52.7 (СН, С-12), 168.9 (С, С-13).
+26.2° (с 1.0; МеОН). ИК-спектр, (KBr, ν, см-1): 3134, 1128 (N-H), 1475 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 259 (М+, 5). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.86-1.00 (1H, м, Н-4а), 0.94 (6Н, д, J=6.5, СН3-7, СН3-10), 1.00 (3Н, д, J=6.5, СН3-9), 1.10-1.37 (3Н, м, Н-3а, Н-2, Н-6а), 1.58-1.82 (3Н, м, Н-3е, Н-4е, Н-8), 1.88-2.09 (2Н, м, Н-6е, Н-5), 3.05-3.22 (2Н, м, Н-11), 3.29-3.39 (1Н, м, Н-1); 4.17-4.28 (1Н, м, Н-12), 4.99 (3Н, уш.с, NH3+). Спектр 13С ЯМР (75 МГц, CD3OD, δ, м.д.): 20.0 (СН3, С-10), 20.0 (СН3, С-9), 21.1 (СН3, С-7), 25.5 (СН2, С-3), 26.2 (СН, С-5), 29.7 (СН, С-8), 31.2 (СН2, С-11), 35.1 (СН2, С-4), 40.2 (СН2, С-6), 48.1 (СН, С-2), 49.0 (СН, С-1), 52.7 (СН, С-12), 168.9 (С, С-13).
Пример 4.
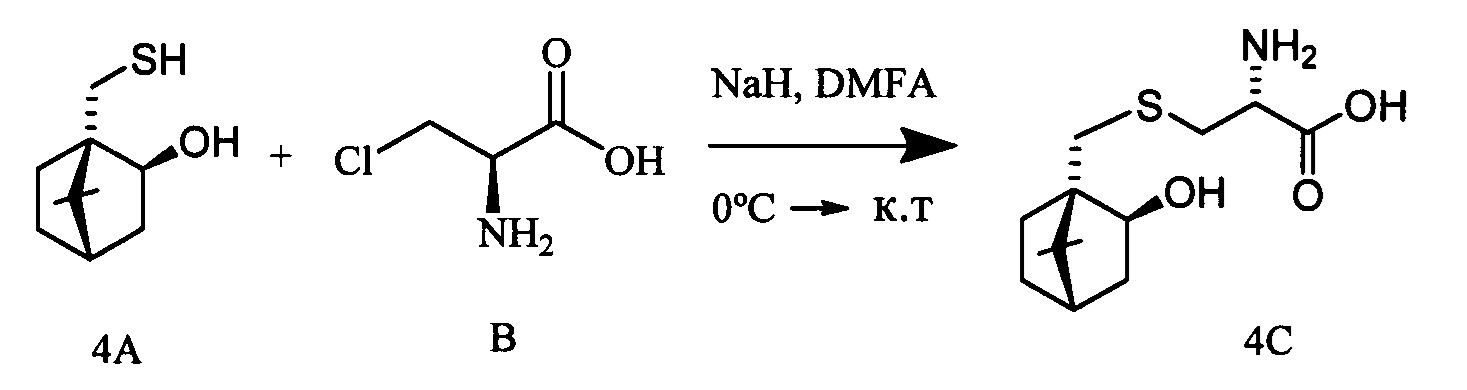
К раствору 10-тиоизоборнеола (0.309 г, 1.66 ммоль) и L-3-хлораланина (0.205 г, 1.66 ммоль) в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 57%-ного NaH (0.105 г, 2.49 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюент - СН2Сl2:EtOH - 2:1). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном пористом фильтре и фильтрат упаривали при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллизацией (MeOH-Et2O).
S-(((1S,2R,4R)-2-Гидрокси-7,7-диметилбицикло[2.2.1]гептан-1-ил)метил)-L-цистеин (4С). Светло-желтый порошок. Выход 58% (0,263 г). Т. пл. 203°С (разл.), 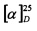 -1.8° (с 1.0; МеОН). ИК-спектр, (KBr, v, см-1): 3238, 1070 (N-H), 1481 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+,4). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.92 (3Н, с, СН3-9), 1.11 (3Н, с, СН3-8), 0.90-1.33 (2Н, м, Н-5а, Н-6а), 1.52-1.86 (5Н, м, H-5b, Н-6b, Н-3а, Н-3b, Н-4), 2.62-3.32 (4Н, м, Н-10а, Н-10b, Н-11а, Н-11b), 3.76-3.88 (1Н, м, Н-12), 3.84-3.97 (1H, м, Н-2), 4.96 (4Н, уш.с, ОН, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 19.3 (СН3, С-9), 19.9 (СН3, С-8), 26.6 (СН2, С-5), 30.6 (СН2, С-6), 31.6 (СН2, С-10), 34.0 (СН2, С-11), 39.9 (СН2, С-3), 45.4 (СН, С-4), 47.4 (С, С-7), 52.2 (С, С-1), 54.4 (СН, С-12), 75.8 (СН, С-2), 170.6 (С, С-13).
-1.8° (с 1.0; МеОН). ИК-спектр, (KBr, v, см-1): 3238, 1070 (N-H), 1481 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+,4). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.92 (3Н, с, СН3-9), 1.11 (3Н, с, СН3-8), 0.90-1.33 (2Н, м, Н-5а, Н-6а), 1.52-1.86 (5Н, м, H-5b, Н-6b, Н-3а, Н-3b, Н-4), 2.62-3.32 (4Н, м, Н-10а, Н-10b, Н-11а, Н-11b), 3.76-3.88 (1Н, м, Н-12), 3.84-3.97 (1H, м, Н-2), 4.96 (4Н, уш.с, ОН, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 19.3 (СН3, С-9), 19.9 (СН3, С-8), 26.6 (СН2, С-5), 30.6 (СН2, С-6), 31.6 (СН2, С-10), 34.0 (СН2, С-11), 39.9 (СН2, С-3), 45.4 (СН, С-4), 47.4 (С, С-7), 52.2 (С, С-1), 54.4 (СН, С-12), 75.8 (СН, С-2), 170.6 (С, С-13).
Пример 5.
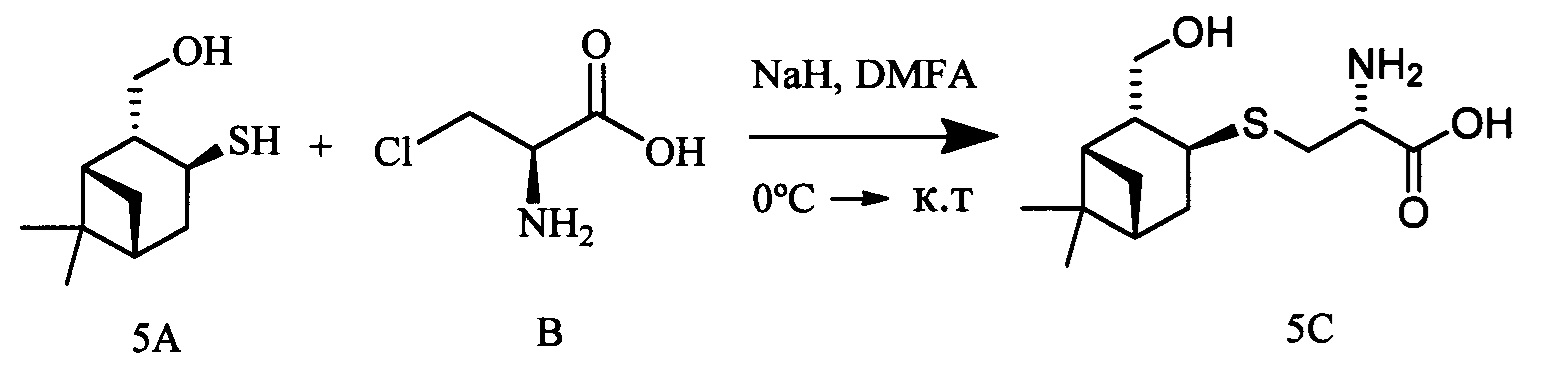
К раствору 10-гидроксиизокамфенилтиола (0.309 г, 1.66 ммоль) и L-3-хлораланина (0.205 г, 1.66 ммоль) в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 57%-ного NaH (0.105 г, 2.49 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюент - EtOH). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном пористом фильтре и фильтрат упаривали при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллиза-цией (MeOH-Et2O).
S-((1S,2R,3S,5R)-2-(Гидроксиметил)-6,6-диметилбицикло[3.1.1]гептан-3-ил)-L-цистеин (5С). Белый порошок. Выход 42% (0,191 г). Т. пл. 205°С (разл.), 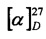 +43.4° (с 0.6; МеОН). ИК-спектр, (KBr, v, см-1): 3216, 1134 (N-H), 1496 (NH3+), 1629 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+, 6). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 1.00 (3Н, с, СН3-8), 1.11 (1H, д, J=9.4, Н-7а), 1.25 (3Н, с, СН3-9), 1.94-2.20 (4Н, м, Н-5, Н-1, Н-4а, Н-2), 2.39-2.50 (1Н, м, Н-7b), 2.62-2.74 (1Н, м, Н-4b), 3.10-3.29 (3Н, м, Н-3, Н-11а, Н-11b), 3.56-3.88 (3Н, м, Н-12, Н-10а, Н-10b), 4.94 (4Н, уш.с, ОН, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 22.5 (СН3, С-8), 26.6 (СН3, С-9), 31.9 (СН2, С-7), 32.0 (СН2, С-11), 36.6 (СН, С-3), 37.3 (СН2, С-4), 38.1 (С, С-6), 41.9 (СН, С-5), 42.7 (СН, С-1), 52.7 (СН, С-2), 54.1 (СН, С-12), 64.9 (СН2, С-10), 172.5 (С, С-13).
+43.4° (с 0.6; МеОН). ИК-спектр, (KBr, v, см-1): 3216, 1134 (N-H), 1496 (NH3+), 1629 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+, 6). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 1.00 (3Н, с, СН3-8), 1.11 (1H, д, J=9.4, Н-7а), 1.25 (3Н, с, СН3-9), 1.94-2.20 (4Н, м, Н-5, Н-1, Н-4а, Н-2), 2.39-2.50 (1Н, м, Н-7b), 2.62-2.74 (1Н, м, Н-4b), 3.10-3.29 (3Н, м, Н-3, Н-11а, Н-11b), 3.56-3.88 (3Н, м, Н-12, Н-10а, Н-10b), 4.94 (4Н, уш.с, ОН, NH3+). Спектр ЯМР 13С (75 МГц, CD3OD, δ, м.д.): 22.5 (СН3, С-8), 26.6 (СН3, С-9), 31.9 (СН2, С-7), 32.0 (СН2, С-11), 36.6 (СН, С-3), 37.3 (СН2, С-4), 38.1 (С, С-6), 41.9 (СН, С-5), 42.7 (СН, С-1), 52.7 (СН, С-2), 54.1 (СН, С-12), 64.9 (СН2, С-10), 172.5 (С, С-13).
Пример 6.
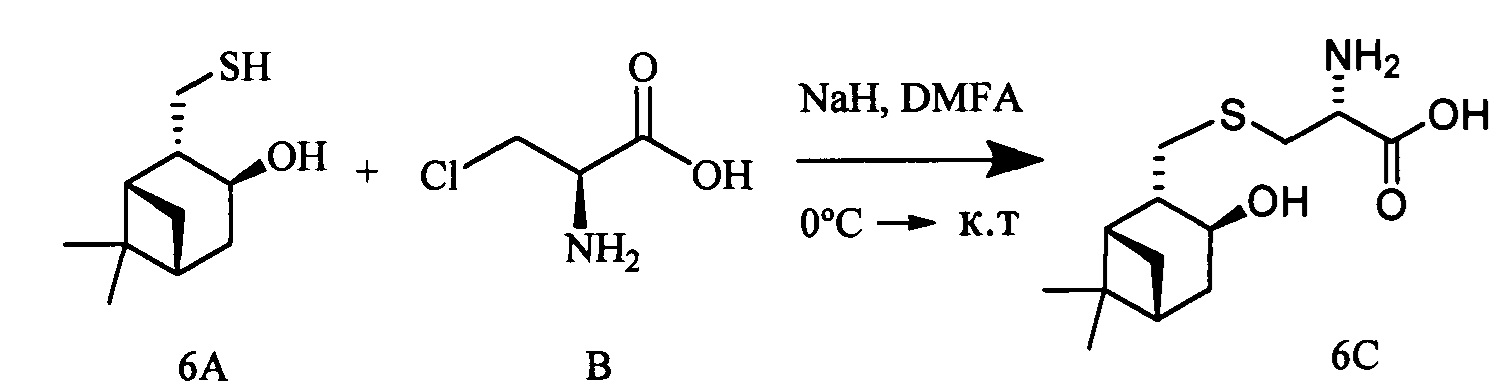
К раствору 10-тиоизокамфеола (0.309 г, 1.66 ммоль) и L-3-хлораланина (0.205 г, 1.66 ммоль) в 10 мл сухого ДМФА, охлажденного до 0°С, в атмосфере азота добавляли небольшими порциями 57%-ного NaH (0.105 г, 2.49 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Ход реакции контролировали методом ТСХ (элюент - CHCl3:МеОН - 5:1). Затем смесь подкисляли NaHSO4 до рН 6.8-7.0, отфильтровывали на стеклянном пористом фильтре и фильтрат упаривали при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле и перекристаллизацией (MeOH-Et2O).
S-(((1S,2S,3S,5R)-3-Гидрокси-6,6-диметилбицикло[3.1.1]гептан-2-ил)метил)-L-цистеин (6С). Светло-желтый порошок. Выход 43% (0,196 г). Т. пл. 199°С (разд.), 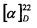 +9.6° (с 0.2; МеОН). ИК-спектр, (KBr, ν, см-1): 3212, 1119 (N-H), 1482 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+, 4). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.94 (3Н, с, СН3-8), 1.14 (1H, д, J=9.4, Н-7а), 1.26 (3Н, с, СН3-9), 1.72-2.19 (4Н, м, Н-5, Н-1, Н-4а, Н-2), 2.37-2.71 (3Н, м, Н-7b, Н-4b, Н-10а), 2.82-3.22 (3Н, м, Н-11а, Н-11b, H-10b), 3.76-3.85 (1Н, м, Н-12), 4.07-4.19 (1H, м, Н-3), 4.88 (4Н, уш.с, ОН, NH3+). Спектр ЯМР, 13С (75 МГц, CD3OD, δ, м.д.): 22.7 (СН3, С-8), 26.5 (СН3, С-9), 32.7 (СН2, С-11), 32.8 (СН2, С-7), 36.7 (СН2, С-10), 37.8 (С, С-6), 38.1 (СН2, С-4), 41.6 (СН, С-5), 44.4 (СН, С-1), 51.9 (СН, С-2), 53.9 (СН, С-12), 68.6 (СН, С-3), 172.1 (С, С-13).
+9.6° (с 0.2; МеОН). ИК-спектр, (KBr, ν, см-1): 3212, 1119 (N-H), 1482 (NH3+), 1631 (С(О)О-). Масс-спектр (ЭУ, 70 эВ), m/z (Ioтн, %): 273 (М+, 4). Спектр 1Н (300 МГц, CD3OD, δ, м.д., J/Гц): 0.94 (3Н, с, СН3-8), 1.14 (1H, д, J=9.4, Н-7а), 1.26 (3Н, с, СН3-9), 1.72-2.19 (4Н, м, Н-5, Н-1, Н-4а, Н-2), 2.37-2.71 (3Н, м, Н-7b, Н-4b, Н-10а), 2.82-3.22 (3Н, м, Н-11а, Н-11b, H-10b), 3.76-3.85 (1Н, м, Н-12), 4.07-4.19 (1H, м, Н-3), 4.88 (4Н, уш.с, ОН, NH3+). Спектр ЯМР, 13С (75 МГц, CD3OD, δ, м.д.): 22.7 (СН3, С-8), 26.5 (СН3, С-9), 32.7 (СН2, С-11), 32.8 (СН2, С-7), 36.7 (СН2, С-10), 37.8 (С, С-6), 38.1 (СН2, С-4), 41.6 (СН, С-5), 44.4 (СН, С-1), 51.9 (СН, С-2), 53.9 (СН, С-12), 68.6 (СН, С-3), 172.1 (С, С-13).
Таким образом, получены новые хиральные S-монотерпенилцистеины, на основе природной L-аминокислоты и синтетически доступных терпеновых тиолов карановой, ментановой, барнановой и пинановой структуры, не проявившие цитотоксичность по отношению к эритроцитам крови лабораторных мышей, и обладающие статистически значимой мембранопротекторной и антиоксидантной активностью, которые могут быть использованы в органическом синтезе для получения биологически активных веществ и в фармацевтической промышленности как промежуточные продукты в синтезе лекарственных препаратов.