Результат интеллектуальной деятельности: Рекомбинантный штамм Streptococcus pyogenes (pT7ErmEMM) - ингибитор опухолевого роста
Вид РИД
Изобретение
Изобретение относится к области микробиологии, молекулярной генетики и медицины и может быть использовано в терапии злокачественных новообразований.
Традиционные противораковые методы лечения, такие как хирургическое вмешательство, лучевая терапия и химиотерапия, эффективны при лечении солидных опухолей, только в некоторой степени. Кроме того, они часто связаны с серьезными побочными эффектами. Альтернативой этим методам лечения является использование некоторых бактерий в качестве иммуномодуляторов и цитолитиков с прямой противоопухолевой активностью.
Терапевтический эффект от использования бактерий в лечении рака был продемонстрирован более 100 лет назад [Nowotny A. Handbook of Endotoxin. Vol. 3. Elsevier Science; Amsterdam: 389-448 (1985)]. А в 1890 нью-йоркский врач Coley обнаружил, что у нескольких пациентов с неоперабельными опухолями наблюдалась регрессия роста опухоли после введения Streptococcus pyogenes (СГА) [Coley W.B. Clin Orthop Relat Res: 3-11 (1991)].
Известен штамм Streptococcus pyogenes, введение которого мышам в ранее привитую опухоль (рак поджелудочной железы) приводило к регрессии последней [Maletzki C, Linnebacher М, Kreikemeyer B, Emmrich J. Gut. 57(4): 483-491 (1998)].
Однако бактерии Streptococcus pyogenes являются широко распространенным патогеном для человека и приматов, инфицируя, главным образом, назофарингеальную слизистую и кожу.
Известен штамм Streptococcus pyogenes М39 «Гуров», обладающий противоопухолевой активностью [Черешнев В.А. Биологические законы и жизнеспособность человека: метод многофункциональной восстановительной биотерапии: научное издание: 2-е изд., перераб. и доп. / В.А. Черешнев, А.А. Морова, И.Н. Рямзина. - Пермь, 2006. - 215 с. Библиогр.: С. 215.], однако и этот штамм также проявляет довольно высокую патогенность.
Задачей настоящего изобретения явилось создание рекомбинантного штамма Streptococcus pyogenes на основе вышеупомянутого штамма «Гуров», обладающего такой же противоопухолевой активностью, но в то же время низкой патогенностью для человека.
В основу решения указанной задачи положена модификация нуклеотидной последовательности гена, кодирующего М белок, путем интеграции в него специально сконструированной плазмиды pT7ErmEMM.
М белок является одним из основных факторов вирулентности СГА, способствующий устойчивости СГА к фагоцитозу [Maxted W.R. The British Journal of Experimental Pathology. №37(4): 415-422 (1954).]. Впоследствии было доказано, что антифагоцитарную активность М белка обеспечивает область, расположенная на его N-терминальном конце [Cunningham М.W., Beachey Е.Н. Infection and Immunity. №9 (2): 244-248 (1974); Beachey E.H., Campbell G.L., Ofek I. Infection and Immunity. №9 (5): 891-896 (1947).].
Получена интегративная плазмида pT7ErmEMM со вставкой гена, кодирующего участок на N-терминальном конце М белка, которая интегрируется в нуклеотидную последовательность исходного штамма «Гуров».
Генетическую модификацию осуществляют следующим образом:
Проводят анализ гена emm, кодирующего N-терминальный конец М белка, с целью выбора фрагмента, отвечающего за антифагоцитарные свойства М белка. Конструируют пары праймеров, фланкирующих выбранную область на гене emm, включая сайты рестрикции для эндонуклеаз HindIII и EcoRI с целью последующего клонирования в интегративный вектор. С помощью полимеразной цепной реакции (ПЦР) и специфических праймеров получают необходимый фрагмент ДНК.
Клонирование выбранной последовательности ДНК, проводят в интегративный вектор p7ermB, который был любезно предоставлен Робертом МакЛохланом (США), по сайтам рестрикции эндонуклеаз HindIII и EcoRI с получением интегративной плазмиды pT7ErmEMM. Плазмида содержит: фрагмент, несущий ген устойчивости к эритромицину, промотор и терминатор РНК-полимеразы фага T7, фрагмент гена emm. Полученной плазмидой трансформируют штамм Streptococcus pyogenes М39 «Гуров» с получением рекомбинантного штамма.
Заявляемый штамм Streptococcus pyogenes (pT7ErmEMM) - ингибитор опухолевого роста депонирован и хранится в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» ФБУН ГНЦ ПМБ, регистрационный №174 от 17 ноября 2016 г. и характеризуется следующими признаками:
Морфологические признаки. Клетки шаровидной или овоидной формы, растущие чаще в виде цепочек, неспороносные, грамположительные.
Культуральные признаки. Бактериальные клетки хорошо растут на питательных средах с добавлением крови или сыворотки крови. При выращивании на 5% кровяном агаре образуют очень мелкие колонии с образованием зоны β-гемолиза. На жидких средах (Todd-Hewitt) рост придонно-пристеночный в виде крошковатого осадка, бульон чаще прозрачен.
Физико-биологические признаки. Клетки растут при оптимуме температуры +37°C и оптимальных значениях pH от 7.2 до 7.6. Не растут при 10°C и 45°C, в бульоне с 6,5% хлорида натрия, при pH 9,6, в молоке с 0,1% метиленового синего. Ферментируют глюкозу, лактозу, сахарозу, салицин, трегалозу, не ферментируют инулин, сорбит, глицерин, гиппурат натрия. Оптимальная среда для культивирования - среда Todd-Hewitt с 5% CO2.
На фиг. 1 показана схема получения интегративной плазмиды pT7ErmEMM. Фрагмент ДНК, кодирующий выбранную область М белка, получают с помощью полимеразной цепной реакции и специально сконструированных праймеров. Синтезированный фрагмент ДНК очищают с использованием набора для очистки ПЦР-продуктов (PCR Purification Kit, Qiagen, Германия), расщепляют эндонуклеазами HindIII и EcoRI и лигируют с вектором p7ermB, обработанным такими же ферментами.
Интегративная плазмида pT7ErmEMM содержит: фрагмент, несущий ген устойчивости к эритромицину, промотор и терминатор РНК-полимеразы фага Т7, фрагмент гена emm.
Полученной плазмидой трансформируют клетки Streptococcus pyogenes М39 «Гуров» по протоколу, описанному Суворовым А.Н. (Suvorov A.N., Kok J. and Venema G. FEMS Microbiol. Lett. - №56. - C. 95-100 (1988)). Для электропорации используют прибор GenePulser (BioRad, США) при разности потенциалов 2500 вольт и продолжительности импульса - 4.2 миллисекунды и расстоянием между электродами - 1 мм, при 2 мкг внесенной в кювету для электропорации ДНК pT7ErmEMM. Трансформанты высевают на агаризованную среду (1% ТНВ агара) с добавлением эритромицина и выращивают в течение 48-72 часов при 37°C. Выросшие колонии анализируют при помощи ПЦР на наличие фрагмента ДНК, кодирующего М белок. В результате ПЦР было установлено, что в область гена М белка произошло встраивание интегративной плазмиды, что прерывало открытую рамку считывания данного гена. Таким образом, получают рекомбинантный штамм Streptococcus pyogenes (pT7ErmEMM) нуклеотидная последовательность которого полностью определена путем геномного секвенирования, а область интеграции приведена в Перечне последовательностей под номером SEQ ID NO: 1, где встроенная плазмида представлена в позициях с 498 по 3463.
Полученный рекомбинантный штамм сохраняет групповую принадлежность, характерную морфологию, адгезивную способность к клеткам эпителия и другие свойства S. pyogenes и при этом обладает противоопухолевой активностью.
Исследование противоопухолевой активности полученного штамма проводили in vivo на лабораторных животных (мыши-самцы линии С3НА и беспородные мыши весом 16-18 г, полученные из питомника «Рапполово»). Для получения солидных опухолей мышам линии С3НА подкожно вводят в область спины 2×105 клеток сингенной гепатомы 22а в объеме 0,2 мл физиологического раствора, а беспородным мышам - аналогичное количество клеток саркомы S37. Контрольные животные получают инъекцию физиологического раствора. Оценку выживаемости проводят в группах по 10 животных, опыты повторяют три раза.
Суспензию живых S. pyogenes, приготовленную в физиологическом растворе pH-7,4 в концентрации 106 бактерий/мл в объеме 50 мкл двукратно вводят внутрь опухолей. Первую инъекцию осуществляют через 9 суток от начала инокуляции опухолевых клеток, при достижении опухолевым узлом размера 2-3 мм. Повторную инъекцию проводят с интервалом 5 суток. Контрольным животным вводят подкожно 50 мкл физиологического раствора. Спустя 5 суток после второй инъекции (19 суток после инокуляции опухоли) опухоли измеряют в двух взаимно перпендикулярных направлениях и вычисляют средний диаметр опухоли по формуле:  где "а" - наибольший, "b" - наименьший размер опухоли, а 1 мм - толщина кожной складки.
где "а" - наибольший, "b" - наименьший размер опухоли, а 1 мм - толщина кожной складки.
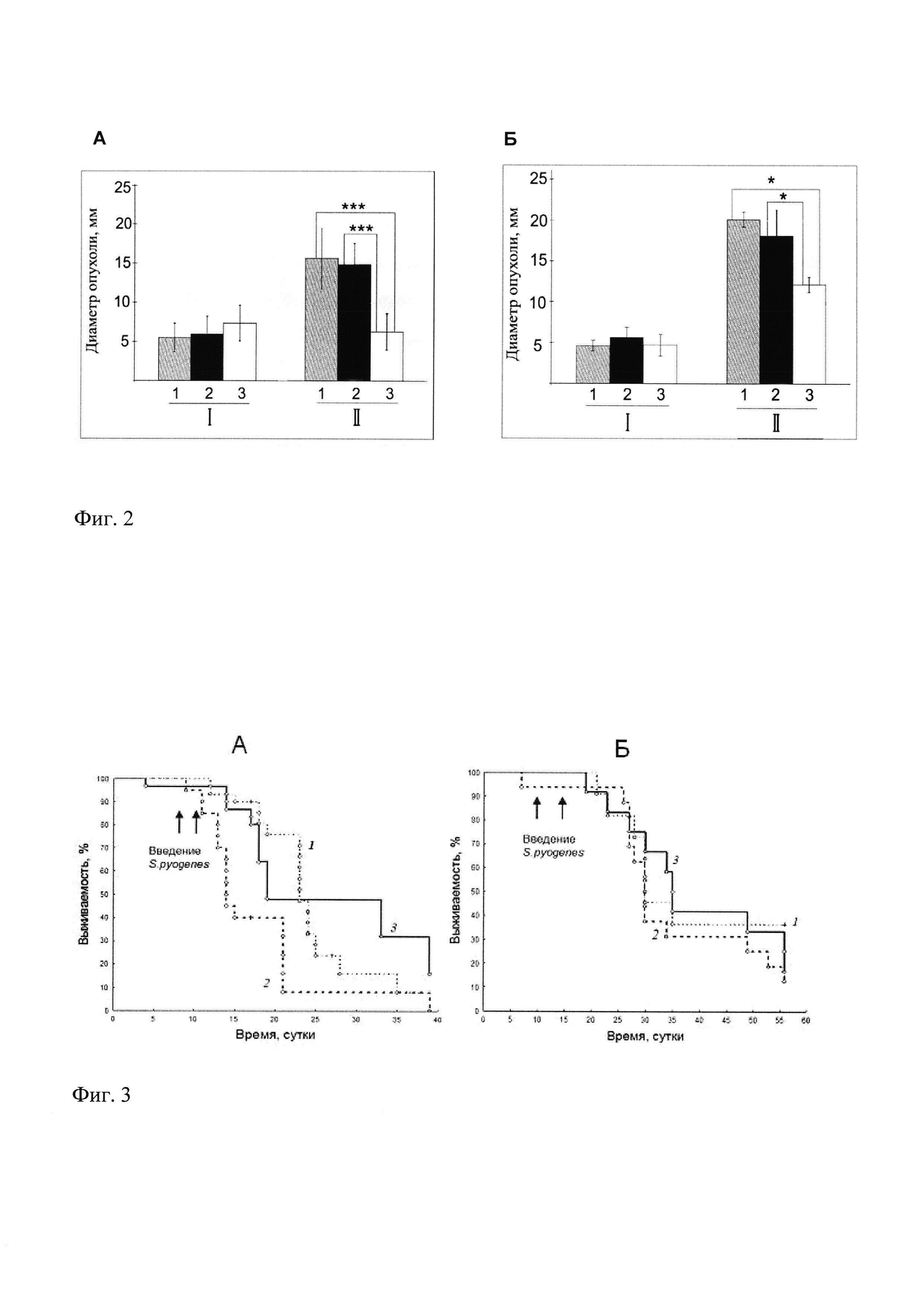
Введение штамма Streptococcus pyogenes М39 «Гуров» животным с гепатомой 22а или саркомой S37 не давало положительного эффекта и не вызывало замедления роста опухоли по сравнению с контрольной группой (фиг. 2). При этом выживаемость мышей с саркомой S37 не улучшалась, а у животных с гепатомой 22а наблюдали даже ухудшение выживаемости по отношению к группе контроля (фиг. 3).
При введении животным рекомбинантного штамма Streptococcus pyogenes (pT7ErmEMM) отмечали выраженный терапевтический эффект, который заключался в достоверной задержке опухолевого роста, как по отношению к контрольной группе, так и в отношении группы животных, которым вводили исходный штамм Streptococcus pyogenes М39 «Гуров». Сдерживание опухолевого роста регистрировали на 10 сутки после начала лечения на обеих используемых экспериментальных моделях (фиг. 2). При этом выживаемость мышей при введении штамма Streptococcus pyogenes М39 «Гуров» оказалась выше по сравнению с контрольной группой и с группой животных, которым вводили исходный штамм,
Этот эффект наблюдался только при росте гепатомы 22а (фиг. 3, фрагмент А) и не проявлялся при росте саркомы S37 (фиг. 3, фрагмент Б).
Фиг. 2 демонстрирует влияние внутриопухолевого введения S.pyogenes на размер опухолей мышей с гепатомой 22а (фрагмент А) и саркомой S37 (фрагмент Б).
По оси ординат: средний диаметр опухоли, мм. I - размер опухоли до начала введения бактерий; II - размер опухоли через 10 дней после начала лечения. 1 - группа контрольных мышей, 2 - животные, получающие внутриопухолевое введение Streptococcus pyogenes М39 «Гуров», 3 - Streptococcus pyogenes (pT7ErmEMM). В каждой группе по 30 мышей. Достоверность различий между группами *<0,05; **<0,01; ***<0,001
На фиг. 3 показано влияние внутриопухолевого введения S.pyogenes на выживаемость мышей с гепатомой 22а (А) и саркомой S37 (Б). 1 - группа контрольных мышей, 2 - животные, получающие внутриопухолевое введение Streptococcus pyogenes М39 «Гуров», 3 - Streptococcus pyogenes (pT7ErmEMM). Достоверность различий по критерию Гехана при росте гепатомы 22а (А): между 1 и 2 p<0,001, между 2 и 3 p<0,01, между 1 и 3 не достоверно. При росте саркомы S37 (Б) различия не достоверны. Медиана выживаемости: (А) 1 - 24, 2 - 14, 3 - 34; (Б) 1 - 40, 2 - 40, 3 - 54 суток.
На основании полученных данных можно сделать вывод, что рекомбинантный штамм Streptococcus pyogenes (pT7ErmEMM) является более эффективным ингибитором опухолевого роста клеток по сравнению с исходным штаммом «Гуров», проявляя при этом меньшую патогенность и лучшую выживаемость.
Рекомбинантный штамм бактерии Streptococcus pyogenes М39 «Гуров», характеризующийся нуклеотидной последовательностью SEQ ID NO: 1, проявляющий выраженную противоопухолевую активность в отношении опухолей гепатомы и саркомы, содержащий плазмиду pT7ErmEMM, полученную на основе вектора p7ermB путем встраивания по сайтам HindIII и EcoRI фрагмента гена emm и имеющую последовательность, представленную в SEQ ID NO: 1 в позициях с 498 по 3463, и полученный на основе штамма Streptococcus pyogenes «Гуров» путем его трансформации плазмидой pT7ErmEMM.