Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической комбинации ингибитора mdm2/4 и ингибитора циклин-зависимой киназы 4/6 (CDK4/6). В дополнение, настоящее изобретение относится к фармацевтическим комбинированным продуктам. Данное изобретение также относится к соответствующим фармацевтическим композициям, их применениям и способам лечения, включающим ингибитор mdm2/4 или ингибитор циклин-зависимой киназы 4/6 (CDK4/6).
Предпосылки создания изобретения
р53 опосредует свою функцию в качестве супрессора опухоли через транскрипционную позитивную регуляцию генов, требующихся для индукции блокировки клеточного цикла или апоптоза (Vousden, 2007, Nat. Rev. MCB; 8(4): 275-83). Считают, что около 50% всех опухолей утратили или несут инактивирующую мутацию в р53 (Soussi, 2001, Nature Rev. Cancer; 1(3): 233-240). В случае остающихся 50% опухолей р53 инактивирован посредством различных других способов, включая усиленную экспрессию его отрицательного регулятора MDM2. Ингибиторы MDM2 могут содействовать восстановлению функции ТР53.
Метаболический путь D-циклин-CDK4/6-INK4a-pRb часто нарушен при раковом заболевании в пользу клеточной пролиферации. Восемьдесят процентов неоплазм человека сохраняют функциональный pRb и взамен увеличивают активность CDK4/6-киназы для поддерживания pRb, инактивированного через многочисленные аберрации. Каждый год во всем мире имеются выше 130000 новых случаев саркомы, что составляет приблизительно от 1% до 3% от всех злокачественных опухолей. Известны ингибиторы CDK4/6, которые улучшают эффекты сверхактивированной CDK4/6-киназной активности в опухолях.
Липосаркома (LPS) является редким и гетерогенным заболеванием, которое представляет собой наиболее часто саркому мягкой ткани у взрослых, что составляет приблизительно 12,8% относительно всех сарком (Gadgeel, 2009, Cancer; 115(12): 2744-2754). Годовой коэффициент заболеваемости оценивают как составляющий 2,5 на 1 миллион жителей при базирующихся на популяции исследованиях (Kindblom, 1975, Acta Pathol. Microbiol. Scand. Suppl. (253: 1-71). LPS представляет собой злокачественную мезенхимальную неоплазму, которая состоит из изменяющейся доли развившейся адипоцитной пролиферации и степени клеточной атипии. В соответствии с гистологией, LPS может быть подразделена на пять подтипов, то есть, на полностью дифференцированную липосаркому (WDLPS), дедифференцированную липосаркому (DDLPS), слизеподобную липосаркому, круглоклеточную липосаркому и плеоморфную липосаркому, в соответствии с тремя главными биологическими группами. Среди них, наиболее широко распространенными являются WDLPS (40-45% от всех LPS) и DDLPS (5% от всех LPS). WDLPS/DDLPS рассматривают как двухфазное заболевание, причем дедифференцированный компонент является более агрессивным и приводящим к метастазированию. Этот компонент может или возникать вновь или проистекать от медленно растущего полностью дифференцированного компонента опухоли.
Несмотря на многочисленные варианты лечения пациентов с конкретными типами ракового заболевания, остается необходимость в эффективных и безопасных комбинированных терапиях, которые можно назначать для эффективного долговременного лечения ракового заболевания.
Краткое изложение сущности изобретения
Как ингибиторы MDM2, так и ингибиторы CDK4/6, в качестве монотерапии, демонстрируют антипролиферативную и цитотоксическую активности при in vitro и in vivo преклинических анализах. Неожиданно было найдено, что, в комбинации, ингибиторы MDM2, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он (Соединение А) или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (Соединение В), и ингибитор CDK4/6, диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (Соединение С), достигают большей противоопухолевой активности, чем и то и другое лекарственное средство индивидуально. Этот эффект подтвержден на производимой от пациента in vivo модели полностью дифференцированной липосаркомы (WDLPS), где комбинация (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она и диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты вызывает регрессию опухоли. Соединение А, подобно Соединению В, представляет собой эффективный и селективный, имеющий небольшую молекулу, ингибитор взаимодействия р53:MDM2 и оба соединения совместно имеют точно один и тот же механизм действия.
В случае производимой от пациента in vivo модели WDLPS, HSAX2655, которая не только несет амплификацию MDM2-гена, но также и CDK4-гена, комбинация ингибиторов MDM2 и CDK4, в результате, приводит к регрессиям. Суточная (каждые 24 часа) терапия (перорально) с помощью Соединения А, в дозе 30 мг/кг, или с помощью Соединения С, в дозе 75 мг/кг, значительно замедляет рост опухоли (Т/С составляет 6% и 18%, соответственно) у несущей опухоль мыши. Однако, комбинация двух лекарственных средств при этих концентрациях вызывает регрессию 36% опухоли, что значительно лучше, чем в случае и той и другой монотерапий. Терапии, как отдельным агентом, так и комбинацией, являются хорошо переносимыми мышами.
Базируясь на оптимистических выводах, комбинация (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-она с диметиламидом 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты представляет собой «жизнеспособный» вариант для лечения пролиферативного заболевания, такого как раковое заболевание. Генетический статус ракового заболевания может, далее, влиять на полезность комбинации. Наилучших результатов можно ожидать при лечении раковых заболеваний с повышенной активностью mdm2 и/или CDK4. Далее, может содействовать статус дикого типа р53.
Саркома мягкой ткани представляет собой гетерогенное заболевание, подразделяемое на пять гистологических подтипов, которые включают полностью дифференцированную липосаркому (WDLPS) и дедифференцированную липосаркому (DDLPS), наиболее распространенные липосаркомы. Девяносто процентов WDLS и DDLS проявляют статус дикого типа для р53 вместе с амплификацией онкогенов MDM2 и CDK4. Как следствие, комбинация соединений А или В вместе с соединением С является хорошей терапевтической стратегией для таких раковых заболеваний.
Это мнение может быть расширено для комбинации других ингибиторов mdm2/4 с другими ингибиторами CDK4/6.
Следовательно, более конкретно, настоящее изобретение относится к следующим аспектам, полезным свойствам и конкретным воплощениям, соответственно, индивидуально или в комбинации, как перечислено в следующих пунктах.
1. Фармацевтическая комбинация, содержащая:
(i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, и
(ii) диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемую соль.
2. Фармацевтическая комбинация по п.1, где фармацевтическая комбинация содержит (i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, и (ii) диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемую соль, отдельно или вместе.
3. Фармацевтическая комбинация по пп.1 или 2 для одновременного или последовательного применения (i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-она, или его фармацевтически приемлемой соли, и (ii) диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой соли, в качестве лекарственного средства.
4. Фармацевтическая комбинация по любому одному из пп.1-3, дополнительно, содержащая, по меньшей мере, один фармацевтически приемлемый носитель.
5. Фармацевтическая комбинация по любому одному из пп.1-4, в форме фиксированной комбинации.
6. Фармацевтическая комбинация по любому одному из пп.1-5, в форме фармацевтической композиции.
7. Фармацевтическая комбинация по любому одному из пп.1-6, в форме набора компонентов для комбинированного введения, где (i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, и (ii) диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемую соль, вводят совместно или независимо в одно и то же время или раздельно во временные интервалы.
8. Фармацевтическая комбинация по любому одному из пп.1-7, для применения в качестве лекарственного средства.
9. Фармацевтическая комбинация по любому одному из пп.1-7, для применения при лечении ракового заболевания.
10. Фармацевтическая комбинация для применения при лечении ракового заболевания по п.9, где раковое заболевание представляет собой ER-позитивные раковые зпаболевания молочной железы, меланому, злокачественную палочковидную опухоль, нейробластому, лимфому, лимфому клеток мантийной зоны или липосаркому.
11. Фармацевтическая комбинация для применения при лечении ракового заболевания по пп.9 или 10, где раковое заболевание представляет собой липосаркому.
12. Фармацевтическая комбинация для применения при лечении ракового заболевания по любому одному из пп.9-11, где раковое заболевание представляет собой полностью дифференцированную липосаркому (WDLPS) и дедифференцированную липосаркому (DDLPS).
13. Фармацевтическая комбинация для применения при лечении ракового заболевания по любому одному из пп.9-12, где раковое заболевание включает со-амплифицированный MDM2 и/или CDK4.
14. Фармацевтическая комбинация для применения при лечении ракового заболевания по любому одному из пп.9-13, где раковое заболевание включает функциональный р53 или дикий тип р53.
15. Фармацевтическая комбинация по любому одному из пп.1-14, в виде комбинированного продукта или в виде фармацевтической композиции.
16. Фармацевтическая комбинация по любому одному из пп.1-15, для получения лекарственного средства или фармацевтического продукта для лечения ракового заболевания.
17. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения в качестве лекарственного средства, где (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, вводят, одновременно или последовательно, с диметиламидом 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой солью.
18. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания, где (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, вводят, одновременно или последовательно, с диметиламидом 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой солью.
19. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по п.18, где раковое заболевание представляет собой ER-позитивные раковые заболевания молочной железы, меланому, злокачественную палочковидную опухоль, нейробластому, лимфому, лимфому клеток мантийной зоны или липосаркому.
20. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по пп.18 или 19, где раковое заболевание представляет собой липосаркому.
21. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по любому одному из пп.18-20, где раковое заболевание представляет собой полностью дифференцированную липосаркому (WDLPS) и дедифференцированную липосаркому (DDLPS).
22. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по любому одному из пп.18-21, где раковое заболевание включает со-амплифицированный MDM2 и/или CDK4.
23. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по любому одному из пп.18-22, где раковое заболевание включает функциональный р53 или дикий тип р53.
24. Способ лечения ракового заболевания у пациента, включающий введение терапевтически эффективного количества (i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-она, или его фармацевтически приемлемой соли, и (ii) диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой соли.
25. Способ лечения ракового заболевания по п.24, где (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, и диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемую соль, вводят пациенту одновременно или последовательно.
26. Способ лечения ракового заболевания по пп.24 или 25, где раковое заболевание представляет собой такое, как описано в любом из пп.19-23.
27. Фармацевтическая комбинация по любому одному из пп.1-16, где фармацевтическая комбинация состоит из (i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-она, или его фармацевтически приемлемой соли, и (ii) диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой соли.
28. Фармацевтические комбинации, соответствующие любому одному из пп.1-27, где исключена тройная комбинация (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она и диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты с LDK378.
29. Фармацевтические комбинации, соответствующие любому одному из пп.1-27, где исключена тройная комбинация из 50 мг/кг, каждый день, перорально, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она и диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты с 50 мг/кг, каждый день, перорально, LDK378.
30. Фармацевтические комбинации, соответствующие любому одному из пп.1-29, где партнерами комбинации являются (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он, или его фармацевтически приемлемая соль, и диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемая соль.
31. Фармацевтические комбинации, соответствующие любому одному из пп.1-29, где партнерами комбинации являются (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, и диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемая соль.
32. Фармацевтическая комбинация по любому одному из пп.1-16 или 27-29, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения в качестве лекарственного средства по любому одному из пп.17, 28 или 29, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по любому одному из пп.18-23, 28 или 29, способ лечения ракового заболевания по любому одному из пп.24-26, 28 или 29, включающий использование:
(i) (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-она, или его фармацевтически приемлемой соли, и
(ii) диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой соли.
33. Фармацевтическая комбинация по любому одному из пп.1-16 или 27-29, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения в качестве лекарственного средства по любому одному из пп.17, 28 или 29, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемая соль, для применения при лечении ракового заболевания по любому одному из пп.18-23, 28 или 29, способ лечения ракового заболевания по любому одному из пп.24-26, 28 или 29, включающий использование:
(i) (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-она, или его фармацевтически приемлемой соли, и
(ii) диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемой соли.
Краткое описание чертежей
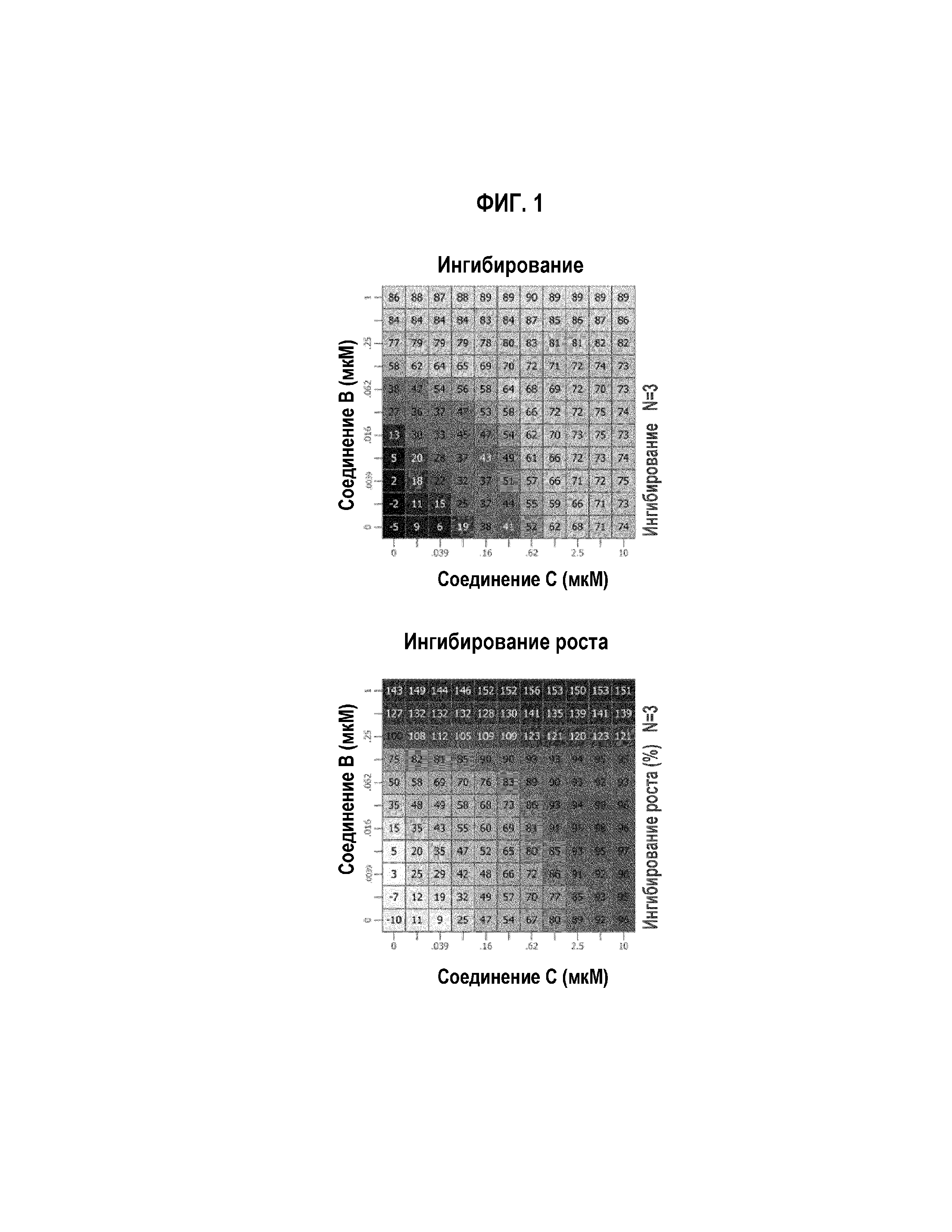
Фиг.1 Графическое изображение in vitro воздействия на пролиферацию комбинации соединений В и С, в случае клеточной линии липосаркомы LP6.
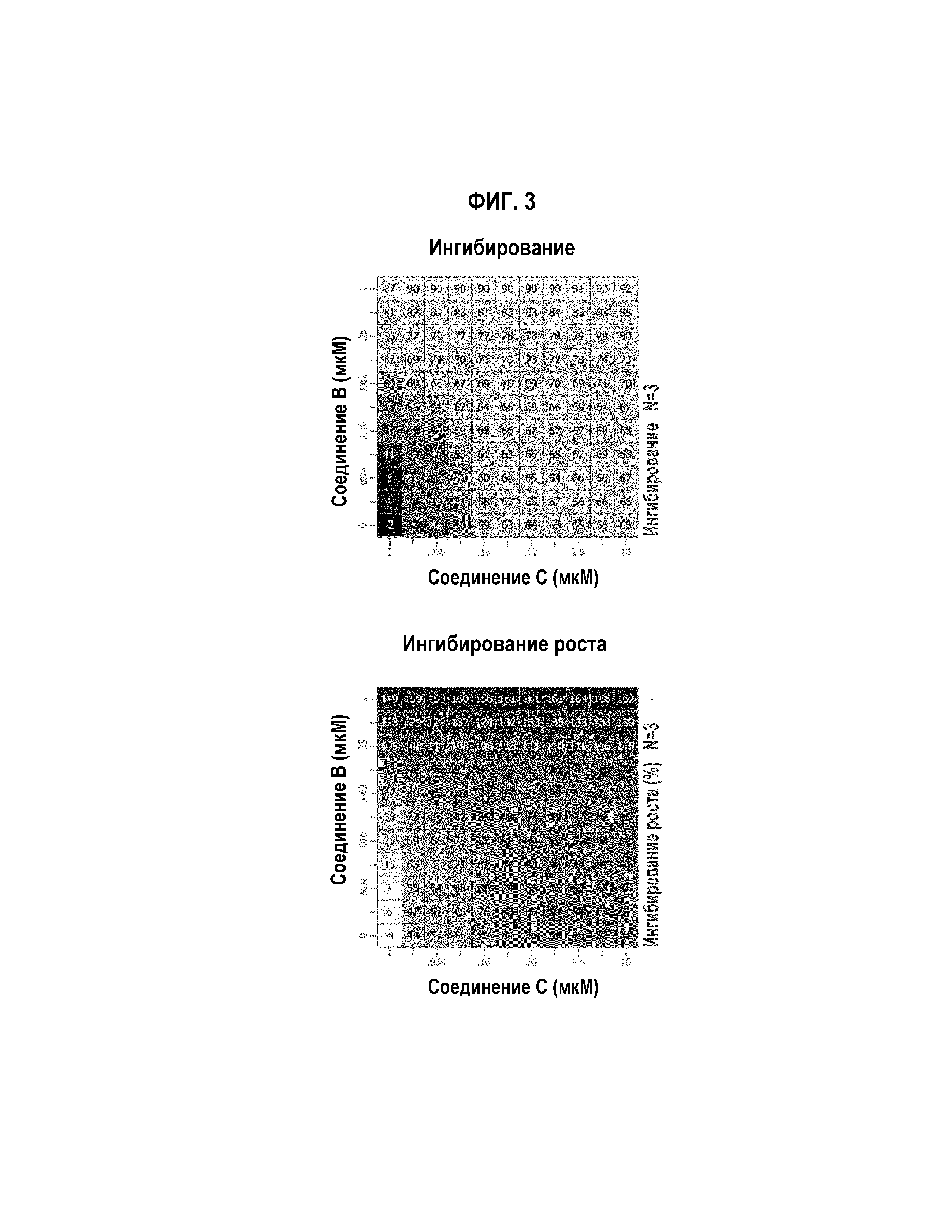
Фиг.2 Графическое изображение in vitro воздействия на пролиферацию комбинации соединений В и С, в случае клеточной линии липосаркомы 449b.
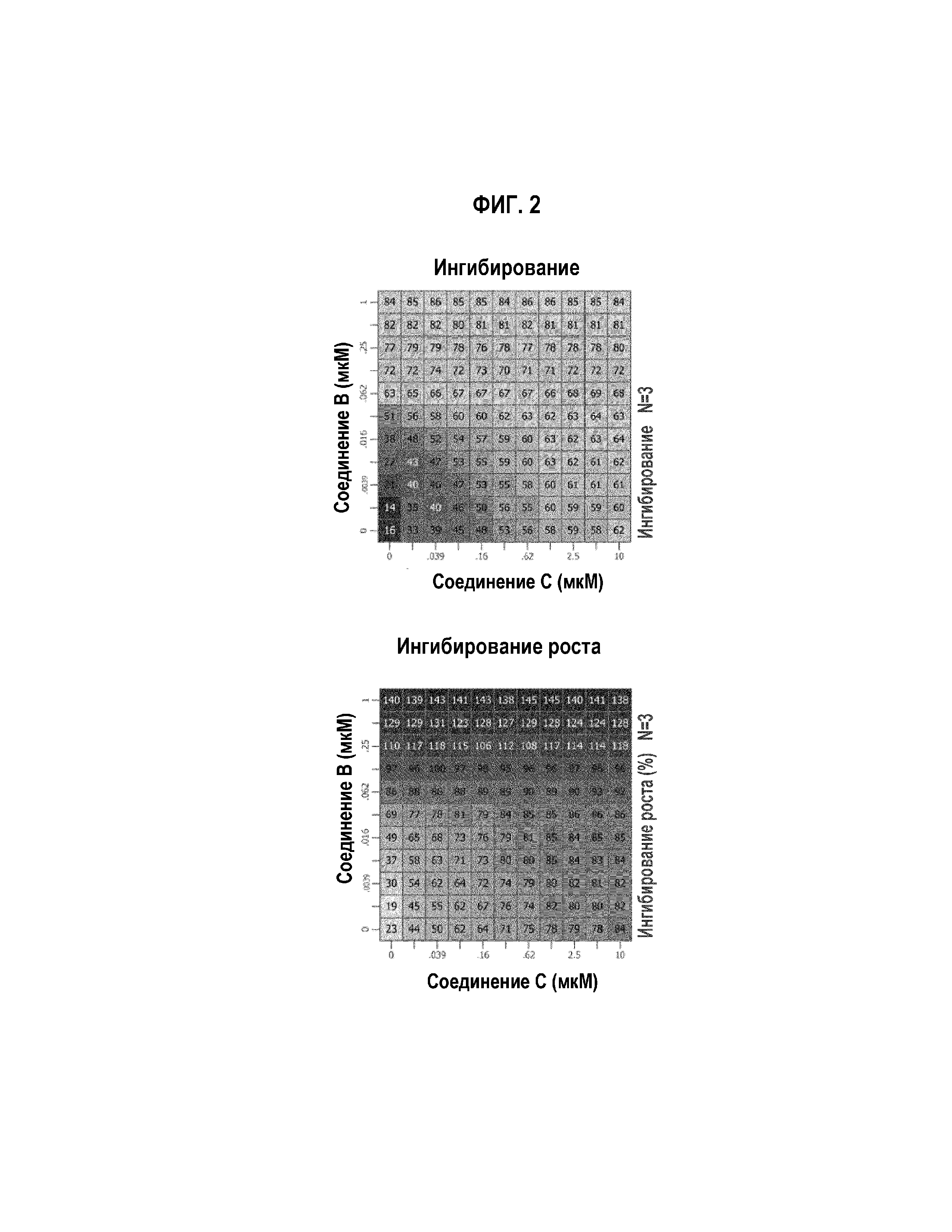
Фиг.3 Графическое изображение in vitro воздействия на пролиферацию комбинации соединений В и С, в случае клеточной линии липосаркомы Т778.
Подробное описание изобретения
Настоящее изобретение относится к фармацевтической комбинации, включающей (i) ингибитор mdm2/4 и (ii) ингибитор CDK4/6, где ингибитор mdm2/4 представляет собой или (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он, или его фармацевтически приемлемую соль, или (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он, или его фармацевтически приемлемую соль, а ингибитор CDK4/6 представляет собой диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, или его фармацевтически приемлемую соль.
Установлено, что эту комбинацию можно использовать для эффективного лечения ракового заболевания.
Ингибитор mdm2, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он (Соединение А), можно получать в соответствии с заявкой на патент под номером WO 2011/076786. Соединение А раскрыто в заявке на патент под номером WO 2011/076786, в примере 106. (S)-1-(4-Хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он (Соединение А) представлен формулой I:
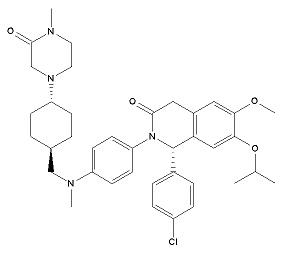
Формула (I).
(S)-5-(5-Хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он (Соединение В) ингибирует взаимодействие между MDM2 и р53, в то время как данное соединение также ингибирует взаимодействие между MDM4 и р53. Его получение раскрыто в заявке на патент под номером WO 2013/111105.
Данное соединение может быть представлено формулой II:
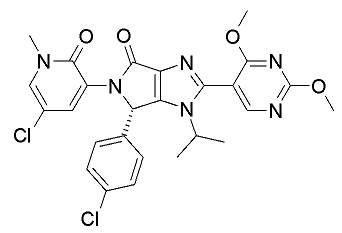
Формула (II).
Ингибитор mdm2/4, который можно комбинировать с соединением С или использовать для лечения ракового заболевания, как раскрыто в данном контексте, также может быть, например, соединением, выбираемым из группы, состоящей из:
Кайлин-1, Кайлин-2, HLI373 и SC204072.
Диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (Соединение С) представляет собой ингибитор CDK4/6 формулы III:
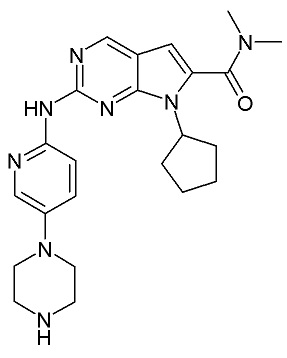
Формула (III),
который раскрыт в заявке на патент под номером WO 2010/020675.
Соединения настоящей комбинации можно использовать в виде фармацевтически приемлемой соли, гидрата или сольвата. Как используется в данном контексте, термин «фармацевтически приемлемая соль» относится к производным описанных соединений, где исходное соединение модифицируют путем превращения существующего кислотного или основного остатка в его солевую форму. Примеры фармацевтически приемлемых солей включают, но не ограничиваясь этим, соли минеральных или органических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и т.п. Фармацевтически приемлемые соли согласно настоящему изобретению включают обычные нетоксичные соли исходного соединения, образованные, например, с нетоксичными неорганическими или органическими кислотами. Подходящие органические кислоты представляют собой, например, карбоновые кислоты или сульфоновые кислоты, такие как уксусная кислота, янтарная кислота, фумаровая кислота или метансульфоновая кислота. Фармацевтически приемлемые соли согласно настоящему изобретению можно синтезировать из исходного соединения, которое содержит основной или кислотный остаток, с помощью стандартных химических способов. Обычно, такие соли можно получать путем введения во взаимодействие форм свободной кислоты или основания этих соединений со стехиометрическим количеством соответствующего основания или кислоты, в воде или в органическом растворителе, или в смеси их обоих; обычно, предпочтительными являются неводные среды, подобные диэтиловому эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу. Перечни подходящих солей находятся в источниках Remington's Pharmaceutical Sciences, 17-ое изд., Mack Publishing Company, Easton, Pa., 1985, с.1418, и Journal of Pharmaceutical Science, 66, 2 (1977), каждый из которых включен во всей его полноте в данный контекст путем ссылки. Например, соль представляет собой сульфат или бисульфат. В другом воплощении, соль представляет собой сукцинат. Далее, предполагают, что также можно использовать гидраты или сольваты трех соединений А, В и С.
Соединения фармацевтической комбинации могут быть вместе или раздельно. Это означает, что «фармацевтическая комбинация» Соединений (А или В) и С относится к использованию, применению или композициям из отдельных партнеров, с или без инструкций в отношении комбинированного использования или в отношении комбинированных продуктов. Партнеры комбинации, таким образом, можно вводить полностью раздельно или в виде полностью раздельных фармацевтических лекарственных форм. Партнеры комбинации могут представлять собой фармацевтические композиции, которые также продаются независимо друг от друга и где в упаковочном оборудовании предусмотрены как раз инструкции для их комбинированного использования, как, например, листовка или т.п., или в виде другой информации, например, предусмотренной для лечащего врача и медперсонала (например, передачи речевых сообщений, сообщения в письменной форме или т.п.), в отношении одновременного или последовательного использования для совместного действия. Таким образом, это может относиться или к фиксированной комбинации в форме единой унифицированной дозы, или к комплекту частей для комбинированного введения, где Соединение А или Соединение В можно вводить независимо от Соединения С, в одно и то же время или раздельно, во временные интервалы, в особенности, когда эти временные интервалы позволяют, чтобы партнеры комбинации проявляли объединенный (= совместный) эффект. В одном воплощении, эффект данной комбинации является синергическим.
Термины «совместное введение» или «комбинированное введение» или «комбинированное применение» или т.п., как используется в данном контексте, охватывают введение выбранного партнера комбинации отдельному субъекту, нуждающемуся в этом (как, например, пациент), и включают схемы лечения, при которых агенты необязательно вводят одним и тем же путем введения и/или в одно и то же время.
В одном воплощении, фармацевтическая комбинация представляет собой фиксированную комбинацию. Термин «фиксированная комбинация» означает, что активные ингредиенты, например, Соединение А или Соединение В, оба, вводят пациенту одновременно с Соединением С, в форме разового объекта или разовой дозы. В других выражениях: активные ингредиенты присутствуют в одной лекарственной форме, например, в одной таблетке или в одной капсуле.
Термин «нефиксированная комбинация» означает, что активные ингредиенты, оба, вводят пациенту в виде раздельных объектов или одновременно, совместно или последовательно, без конкретной привязки по времени, где такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также относится к коктейль-терапии, например, введению трех или более активных ингредиентов. Термин «нефиксированная комбинация», таким образом, в особенности, определяет введение, использование, композицию или получение в том смысле, что партнеры комбинации, например, (i) ингибитор mdm2 (Соединение А или В) и (ii) ингибитор CDK4 (Соединение С), как описано в данном контексте, можно дозировать независимо друг от друга или путем использования различных фиксированных комбинаций с определенными количествами партнеров комбинаций, то есть, одновременно или в различные моменты времени, где партнеры комбинации также можно использовать в виде полностью раздельных фармацевтических лекарственных форм или фармацевтических композиций, которые также продаются независимо друг от друга и точные инструкции относительно их комбинированного применения предусмотрены в упаковочном оборудовании, как, например, листовка или т.п., или в виде другой информации, например, предусмотренной для лечащих врачей и медперсонала. Независимые готовые лекарственные формы или части готовых лекарственных форм, продукт или композицию можно затем вводить, например, одновременно или в хронологическом порядке, то есть, в различные моменты времени и с одинаковыми или различными временными интервалами, для любой части набора частей. В особенности, временные интервалы выбирают так, чтобы воздействие на подвергаемое лечению заболевание при комбинированном использовании частей было больше, чем воздействие, которое должно быть получено за счет использования только любого одного из партнеров комбинации (i) и (ii), таким образом, являющегося совместно активным. Это может быть, между прочим, определено, следуя уровням крови, показывающим, что оба соединения присутствуют в крови человека, подвергаемого лечению, по меньшей мере, в течение некоторых временных интервалов. Соотношение общих количеств партнера комбинации (i) к партнеру комбинации (ii), вводимых в виде комбинированного лекарственного средства, можно варьировать, например, для того, чтобы справиться с раковым заболеванием подвергаемой лечению или нуждающейся в этом субпопуляции пациентов, подвергаемого лечению или нуждающегося в этом одного пациента, различные потребности в случае которых могут быть вследствие возраста, гендерного признака, массы тела и т.д. пациентов.
При комбинированных терапиях согласно данному изобретению, соединения, пригодные в соответствии с данным изобретением, могут быть, таким образом, получены и/или произведены одним и тем же или разными производителями. Кроме того, партнеры комбинации могут быть введены вместе при комбинированной терапии: (i) перед высвобождением продукта комбинации лечащими врачами (например, в случае комплекта, содержащего соединение согласно данному изобретению и другой терапевтический агент); (ii) самими лечащими врачами (или по рекомендации лечащего врача), незадолго до введения; (iii) самими пациентами, например, во время последовательного введения соединения согласно данному изобретению и другого терапевтического агента.
В одном воплощении, предусмотрен носитель информации, содержащий информацию об использовании (i) ингибитора mdm2 и (ii) ингибитора CDK4/6, одновременно или последовательно. Носитель информации, например, в форме информационного листка или этикетки, упаковки, брошюры или инструкции в виде веб-страницы, можно использовать в отношении инструкции по введению (i) Соединения А или Соединения В, или их фармацевтически приемлемых солей, и (ii) Соединения С, или его фармацевтически приемлемой соли, одновременно или последовательно, при лечении ракового заболевания. Носитель информации, в особенности, пригоден в случае двух партнеров комбинации, не получаемых вместе и поставляемых или приобретаемых раздельно. Каждый из партнеров можно поставлять с носителем информации, или они даже имеют отдельный или предусмотренный отдельно носитель информации, который содержит информации и инструкции о возможности применения партнера комбинации в фармацевтической комбинации согласно настоящему изобретению. Носитель информации можно использовать для такой же цели также в случае фиксированных комбинаций или ситуаций, когда оба партнера поставляют или приобретают вместе.
Настоящее изобретение, далее, относится к коммерческой упаковке, включающей, в качестве терапевтических агентов, комбинацию, содержащую: (а) Соединение А или Соединение В, и (b) Соединение С, и, необязательно, по меньшей мере, один фармацевтически приемлемый носитель, для использования при получении фармацевтической композиции, вместе с инструкциями по одновременному, раздельному или последовательноому их введению для применения при лечении ракового заболевания.
Фармацевтические комбинации могут, также, включать, по меньшей мере, один фармацевтически приемлемый носитель. Как используется в данном контексте, термин «носитель» или «фармацевтически приемлемый носитель» включает любой и все растворители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, агенты замедления абсорбции, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие вещества, эксципиенты, дезинтегрирующие агенты, смазочные вещества, подсластители, вкусовые добавки, красители и т.п., и их комбинации, как известно квалифицированному специалисту в данной области (см., например, Remington's Pharmaceutical Sciences, 18-ое изд., Mack Printing Company, 1990, сс.1289-1329). За исключением случаев, когда какой-либо стандартный носитель является несочетаемым с активным ингредиентом, рассматривают его использование в терапевтических или фармацевтических композициях.
Выражение «фармацевтически приемлемый», употребляемое в данном контексте, относится к таким соединениям, веществам, композициям и/или лекарственным формам, которые, в рамках тщательной медицинской оценки, являются пригодными для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергического ответа или других проблем или осложнений, соразмерных с приемлемым соотношением польза/риск.
Обычно, термин «фармацевтическая композиция», определенный в данном контексте, относится к смеси или раствору, содержащей(му), по меньшей мере, один терапевтический агент для введения субъекту, например, млекопитающему или человеку. Фармацевтические комбинации согласно настоящему изобретению можно получать в виде подходящих фармацевтических композиций для энтерального или парентерального введения, которые представляют собой, например, таковые в виде единичных лекарственных форм, таких как покрытые сахаром таблетки, таблетки, капсулы или суппозитории, или ампулы. Если не указано иное, эти формы получают само по себе известным образом, например, посредством различного стандартного смешивания, измельчения, прямого прессования, гранулирования, нанесения покрытия из сахара, растворения, процессов лиофилизации или технологий производства, без труда очевидных для квалифицированного специалиста в данной области. Должно быть понятно, что единичная доля партнера комбинации, содержащегося в индивидуальной дозе каждой лекарственной формы, не представляет, само по себе, необходимое эффективное количество, так как требуемого эффективного количества можно достигать путем введения множества унифицированных доз. Фармацевтическая композиция может содержать от примерно 0,1% до примерно 99,9%, предпочтительно, от примерно 1% до примерно 60%, терапевтического(их) агента(ов). Квалифицированный специалист в данной области может выбирать один или более из вышеуказанных носителей, принимая во внимение конкретные желательные свойства лекарственной формы, путем рутинного экспериментирования и без каких-либо чрезмерных трудностей. Количество каждого из используемых носителей можно варьировать внутри диапазона, стандартного в данной области. Следующие ссылки раскрывают способы и эксципиенты, используемые для получения пероральных лекарственных форм. См., The Handbook of Pharmaceutical Excipients, 4-ое изд., Rowe и др., изд., American Pharmaceuticals Association (2003); и Remington: the Science and Practice of Pharmacy, 20-ое изд., Gennaro, изд., Lippincott Williams & Wilkins (2003). Эти необязательные дополнительные стандартные носители можно включать в пероральные лекарственные формы или путем включения одного или более стандартного(ых) носителя(ей) в исходную смесь, перед гранулированием или во время гранулирования, или путем комбинирования одного или более стандартного(ых) носителя(ей) с гранулами, содержащими комбинацию агентов или индивидуальные агенты из комбинации агентов в пероральной лекарственной форме. В последнем воплощении, комбинированную смесь можно, далее, смешивать, например, посредством V-блендера и затем прессовать или формовать в таблетку, например, монолитную таблетку, инкапсулировать в капсулу или заполнять саше. Несомненно, фармацевтические комбинации согласно настоящему изобретению можно использовать для получения лекарственных средств.
Настоящее изобретение относится к таким фармацевтическим комбинациям, которые особенно пригодны в качестве лекарственного средства. В особенности, эти комбинации можно применять при лечении или предупреждении пролиферативного заболевания, такого как раковое заболевание. Раковое заболевание может представлять собой, например, ER-позитивный рак молочной железы, меланому, злокачественную палочковидную опухоль, нейробластому, лимфому, лимфому клеток мантийной зоны или липосаркому. В предпочтительном воплощении, раковое заболевание представляет собой липосаркому. В особенности, раковое заболевание представляет собой полностью дифференцированную липосаркому (WDLPS) и дедифференцированную липосаркому (DDLPS). Комбинация позволяет достигать превосходных эффектов при раковых заболеваниях с со-амплифицированными MDM2 и/или CDK4. В дополнение, функциональный р53 или дикий тип р53 может способствовать увеличению эффективности комбинации. Термин «лечащий» или «лечение», как используется в данном контексте, включает лечение в виде ослабления, уменьшения или облегчения, по меньшей мере, одного симптома у субъекта, или эффективного воздействия в отношении замедления прогрессирования заболевания. Например, лечение может вызывать уменьшение одного или нескольких симптома(ов) нарушения или полностью ликвидацию нарушения, как например раковое заболевание. В смысле настоящего изобретения, термин «лечить» также указывает на остановку, замедление начала (то есть, период перед клиническим проявлением заболевания) и/или уменьшение риска развития или ухудшения заболевания. Термин «защищать», используемый в данном контексте, означает предупреждение, замедление или лечение, или все сразу, как подходит, развития или продолжительности или усугубления заболевания у субъекта, например, у млекопитающего или у человека. Термин «предупреждать», «предупреждающий» или «предупреждение», как используется в данном контексте, включает предупреждение, по меньшей мере, одного симптома, связанного с или вызванного состоянием, заболеванием или нарушением, которое предупреждают.
Природа ракового заболевания является мультифакториальной. При некоторых обстоятельствах, лекарственные средства с различными механизмами действия можно комбинировать. Однако, только что рассматриваемая какая-либо комбинация терапевтических агентов, имеющих различный способ действия, необязательно приводит к комбинации с полезными эффектами. Введение фармацевтической комбинации согласно настоящему изобретению, в результате, может приводить не только к благоприятному эффекту, как, например, синергический терапевтический эффект, например, в отношении облегчения, замедления прогрессирования или ингибирования симптомов, но также к дальнейшим неожиданным благоприятным эффектам, например, к меньшему числу побочных эффектов, улучшению качества жизни или снижению заболеваемости, по сравнению с монотерапией, применяющей только один из фармацевтических терапевтических агентов, используемых в комбинации согласно данному изобретению. Дальнейшим преимуществом является то, что можно использовать более низкие дозы терапевтических агентов комбинации согласно данному изобретению, например, то, что часто необходимы дозы не только более маленькие, но и также менее часто применяемые, или которые могут быть использованы для уменьшения процента побочных эффектов, наблюдаемых от одного из партнеров комбинации. Это в соответствии с желаниями и потребностями пациентов, подвергаемых лечению. На общепринятых тест-моделях может быть продемонстрировано, что комбинация согласно данному изобретению, в результате, приводит к полезным эффектам, описанным в данном контексте ранее. Квалифицированный специалист в данной области вполне способен выбрать подходящую тест-модель для доказательства таких полезных эффектов. Фармакологическую активность комбинации согласно данному изобретению можно, например, продемонстрировать при клиническом исследовании или при процедуре тестирования, как, по существу, раскрыто в дальнейшем. Партнеры комбинации (i) и (ii), в любом воплощении настоящего изобретения, предпочтительно получают или используют в отношении того, что являются совместно (профилактически или, в особенности, терапевтически) активными. Это означает, в особенности, что имеются, по меньшей мере, один полезный эффект, например, совместное усиление эффекта партнеров комбинации (i) и (ii), в особенности, синергизм, например, более, чем аддитивный эффект, дополнительные полезные эффекты (например, дальнейший терапевтический эффект не найден в случае любого из отдельных соединений), меньшее количество побочных эффектов, комбинированный терапевтический эффект при неэффективной дозировке одного или обоих из партнеров комбинации (i) и (ii), и, очень предпочтительно, отчетливый синергизм партнеров комбинации (i) и (ii). Например, соединения можно давать отдельно или последовательно (привычным ступенчатым образом, в особенности, последовательно-специфическим образом), в такие интервалы времени, в которые они предпочтительны, в случае теплокровного животного, в особенности, человека, подвергаемого лечению, и еще проявляют (предпочтительно, синергическое) взаимодействие (совместный терапевтический эффект). Совместный терапевтический эффект можно, между прочим, определять, следуя уровням крови, показывающим, что оба соединения присутствуют в крови человека, подвергаемого лечению, по меньшей мере, в течение некоторых интервалов времени, но это не исключает случая, когда соединения совместно активны, хотя они не присутствуют в крови одновременно.
Термин «фармацевтически эффективное количество» или «клинически эффективное количество» комбинации из партнеров комбинации означает количество, достаточное для обеспечения наблюдаемого улучшения через посредство базисных клинически наблюдаемых знаков и симптомов нарушения, подвергаемого лечению с помощью комбинации.
Термин «синергический эффект», как используется в данном контексте, относится к действию двух терапевтических агентов, таких как, например, Соединение А, в качестве ингибитора mdm2, и Соединение С, в качестве ингибитора CDK4/6, вызывающему эффект, например, замедление симптоматического прогрессирования пролиферативного заболевания, в особенности, ракового заболевания, или его симптомов, который больше, чем простое сложение эффектов каждого лекарственного средства, вводимого отдельно. То же самое применяют к комбинации Соединений В и С. Синергический эффект можно рассчитывать, например, используя подходящие способы, такие как уравнение Sigmoid-Emax (Holford, N.H.G. and Scheiner, L.B., Clin. Pharmacokinet., 6: 429-453 (1981)), уравнение аддитивности Loewe (Loewe, S. and Muischnek, H., Arch. Exp. Pathol Pharmacol., 114: 313-326 (1926)) и уравнение медианного эффекта (Chou, T.C. and Talalay, P., Adv. Enzyme Regul., 22: 27-55 (1984)). Каждое вышеуказанное уравнение можно применять к экспериментальным данным для создания соответствующего графика, чтобы способствовать оценке эффектов комбинации лекарственных веществ. Соответствующие графики, связанные с вышеуказанными уравнениями, представляют собой кривую «концентрация-эффект», кривую изоболограммы и кривую коэффициента комбинации, соответственно.
Настоящее изобретение относится также к способу лечения субъекта, имеющего пролиферативное заболевание, а именно, раковое заболевание, включающему стадию введения вышеуказанному субъекту фармацевтической комбинации, содержащей (i) Соединение А или Соединение В и (ii) Соединение С, и, необязательно, по меньшей мере, один фармацевтически приемлемый носитель, в количестве, которое является совместно терапевтически эффективным против ракового заболевания.
Термин «субъект» или «пациент», как используется в данном контексте, включает животных, которые способны страдать от ракового заболевания или поражены раковым заболеванием или любым нарушением, включая, непосредственно или косвенно, раковое заболевание. Примеры субъектов включают млекопитающих, как, например, люди, собаки, коровы, лошади, свиньи, овцы, козы, кошки, мыши, кролики, крысы, и трансгенных, без отношения к человеку, животных. В предпочтительном воплощении, субъектом является человек.
В одном воплощении, терапевтически эффективное количество каждого из партнеров комбинации согласно данному изобретению можно вводить одновременно или последовательно и в любом порядке, и компоненты можно вводить раздельно или в виде фиксированной комбинации. Например, способ лечения пролиферативного заболевания согласно данному изобретению может включать (i) введение первого агента (а) в свободной форме или в виде фармацевтически приемлемой соли и (ii) введение агента (b) в свободной форме или в виде фармацевтически приемлемой соли, одновременно или последовательно, в любом порядке, в совместных терапевтически эффективных количествах, предпочтительно, в синергически эффективных количествах, например, в суточных или периодических дозах, соответствующих количествам, раскрытым в данном контексте. Индивидуальную комбинацию партнеров комбинации согласно данному изобретению можно вводить раздельно, в различные моменты времени, во время курса терапии, или одновременно, в виде форм разделенной или единой комбинации. Кроме того, термин «введение» также охватывает применение пролекарственной формы партнера комбинации, которая превращается in vivo в партнера комбинации как такового. Кроме того, должно быть понятно, что настоящее изобретение включает все такие режимы одновременного или альтернативного лечения, и термин «введение», таким образом, объяснен.
Вообще, доза соединения А, В и С, применяемая к теплокровному животному, зависит от множества факторов, включая тип, вид, возраст, массу тела, гендерный признак и медицинское состояние пациента; тяжесть подвергаемого лечению состояния,; путь введения; функцию почек и печени пациента; и конкретное используемое соединение. Квалифицированный лечащий врач, клиницист или ветеринарный врач без труда может определить и прописать эффективное количество лекарственного средства, необходимое для предупреждения, противодействия или остановки прогрессирования данного состояния. Оптимальная точность в достигаемой концентрации лекарственного средства внутри диапазона, в котором достигается эффективность без токсичности, является необходимой для режима, базирующегося на кинетиках доступности лекарственных средств участкам-мишеням. Это влечет за собой рассмотрение распределения, равновесия и элиминации лекарственного средства. Частота дозировки может варьироваться в зависимости от используемого соединения и конкретного состояния, которое подвергают лечению или предупреждают. Вообще, предпочтительным является использование минимальной дозировки, которая является достаточной для обеспечения эффективной терапии. Пациентов можно, как правило, контролировать в отношении терапевтической эффективности, используя анализы, подходящие для состояния, которое подвергают лечению или предупреждают, что должно быть хорошо известно квалифицированному специалисту в данной области.
Соединения А и В можно, как правило, вводить в унифицированной дозе примерно 1-5000 мг активного(ых) ингредиента(ов) для субъекта с массой тела примерно 50-70 кг, или от примерно 1 мг до 3 г или примерно 1-250 мг или примерно 1-150 мг или примерно 0,5-100 мг или примерно 1-50 мг активного ингредиента. Унифицированную дозу можно вводить один раз или неоднократно в течение одних и тех же суток или в течение недели. Более конкретно, суточная доза, равная 100-1500 мг, в особенности, 300-1000 мг, может подходить для Соединения А. Для Соединения В могут подходить дозы, равные 10-1000 мг. Суточная доза, равная 50-1500 мг, в особенности, 400-900 мг, предпочтительно, примерно 600 мг, ожидается эффективной для соединения С. При суточных дозах соединений могут требоваться свободные дни от приема лекарственных средств. Например, дозировочный режим может включать 3 недели приема лекарственного средства и 1 неделю без него. Партнеры комбинации можно не вводить в соответствии с одним и тем же дозировочным режимом. Терапевтически эффективная доза соединения, фармацевтической композиции или их комбинации зависит от типа субъекта, массы тела, возраста и индивидуального состояния, нарушения или заболевания, которое подвергают лечению, или его тяжести. Квалифицированный лечащий врач, клиницист или ветеринарный врач без труда может определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или ингибирования прогрессирования нарушения или заболевания.
Комбинированный продукт согласно данному изобретению, кроме того или в дополнение, можно применять, в особенности, в случае терапии ракового заболевания, в комбинации с химиотерапией, радиотерапией, иммунотерапией, хирургическим вмешательством или их комбинацией. Долговременная терапия в равной степени возможна в качестве вспомогательной терапии, в контексте других стратегий лечения, как раскрыто выше. Другие возможные лечения представляют собой терапию для поддерживания статуса пациента после регрессии опухоли или даже химиопрофилактическую терапию, например, у пациентов с риском.
Настоящее изобретение, далее, относится к коммерческой упаковке, содержащей комбинацию терапевтических агентов согласно настоящему изобретению вместе с инструкциями для одновременного, раздельного или последовательного ее введения, в целях применения для замедления прогрессирования или лечения пролиферативного заболевания у субъекта, нуждающегося в этом.
Следующие примеры иллюстрируют данное изобретение, раскрытое выше; однако, эти примеры не подразумевают каким-либо путем ограничение рамок данного изобретения. Полезные эффекты фармацевтической комбинации согласно настоящему изобретению можно также определять с помощью других тест-моделей, известных, как таковые, квалифицированному специалисту в области техники.
Соединение А: (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-{метил[4-(4-метил-3-оксопиперазин-1-ил)трансциклогексилметил]амино}фенил)-1,4-дигидро-2Н-изохинолин-3-он.
Соединение В: (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидро-1Н-пирроло[3,4-d]имидазол-4-он.
Соединение С: диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (возможная форма представляет собой сукцинат [7-циклопентил-N,N-диметил-2-{[5-(пиперазин-1-ил)пиридин-2-ил]амино}-7Н-пирроло[2,3-d]пиримидин-6-карбоксамида].
Пример 1: Производимая от пациента in vivo модель полностью дифференцированной липосаркомы (WDLPS), HSAX2655
PDX-Опухоли индуцировали путем трансплантирования подкожно замороженных частей опухолей в правый бок «голых» мышей Harlan. Спустя несколько недель роста, животных-доноров умерщвляли и опухоли удаляли и разрезали на части величиной 3×3×3 мм2. Каждую часть опухоли трансплантировали подкожно в правый бок незараженных «голых» мышей Harlan. Эксперимент на эффективность начинали спустя 30 суток после трансплантации.
Соединения А и С использовали свежеполученными для каждого введения. Соединения растворяли в 0,5%-ной метилцеллюлозе. Для экспериментов на эффективность, мышей рандомизировали на группы по n=5 и подвергали терапии в течение 14 суток. Соединение А инъецировали в количестве 30 мг/кг, а соединение С инъецировали в количестве 75 мг/кг, 150 мг/кг и 250 мг/кг. Мышей подвергали терапии ежедневно (каждые 24 часа), перорально, при использовании 10 мл/кг в случае обоих лекарственных средств. В последний день эксперимента, мышей из каждой, подвергнутой терапии, группы умерщвляли спустя 4 и 24 часа после последней терапии и опухоли моментально замораживали.
Эффективность и толерабельность оценивали путем определения объема опухоли и массы тела, соответственно. Объем опухоли (T/Vol), определяемый по измерениям с помощью штангенциркуля (используя формулу 1*w*h*π/6), измеряли три раза в неделю. Канцерогенный эффект определяли количественно по изменению объема опухоли (конечное минус исходное значение в мм3) в виде Т/С, то есть,

В случае регрессии опухоли, канцерогенный эффект определяли количественно по проценту регрессии от исходного TVol, то есть,

Массу тела (BW) мышей определяли три раза в неделю, принимая во внимание расчет в каждый конкретный момент времени относительно дня начала терапии (день 0) и тем и другим соединением по изменению в процентах BW (Δ%B).
Различия между средними значениями TVol и BW оценивали по конечной точке ΔTVol или Δ%BW, используя 1-направленный ANOVA с post-hoc тестами Dunnet или Tukey. Линейные корреляции исследовали путем определения коэффициента корреляции Pearson с Р<0,05, рассматриваемым как значимый.
Нестатистический анализ эффектов комбинации относительно терапии на эффективность рассчитывали, используя модификацию способа, описанного Clark (1997), для получения индекса комбинации (CI). Таким образом, мультипликацию AUC-T/Cs для индивидуальных агентов А и В сравнивали с AUC-T/C, получаемым для актуальной комбинации А+В.
Когда Т/СА * Т/СВ > Т/САВ, тогда может быть предположено положительное взаимодействие (CI<1,0).
Когда Т/СА * Т/СВ < Т/САВ, тогда может быть предположено отрицательное взаимодействие (CI>1,0).
Такой же анализ может быть выполнен по индукции AUC относительно мРНК. Однако, в таком случае, авторы настоящей заявки работали с соотношением 1/CI, так как они оценивали индукцию, а не ингибирование.
По аналогии с in vitro анализами взаимодействий комбинации по Chou (1991), более пригодной интерпретацией является то, что CI, составляющий 0,7-1,3, указывает на аддитивность, <0,7 указывает на синергизм и >1,3 указывает на антагонизм.
В случае производимой от пациента in vivo модели WDLPS, HSAX2655, которая несет не только амплификацию MDM2-гена, но и также CDK4-гена, комбинация ингибиторов MDM2 и CDK4 приводит, в результате, к регрессиям. Ежедневная (каждые 24 часа) терапия (перорально) с помощью соединения А, в количестве 30 мг/кг, или соединения С, в количестве 75 мг/кг, значительно замедляет рост опухоли (Т/С составляет 6% и 18%, соответственно), в случае несущих опухоль мышей. Однако, комбинация из двух лекарственных средств при этих концентрациях индуцирует регрессию 36% опухоли, что значительно лучше, чем с помощью обеих монотерапий (Таблица 1). Терапии, как индивидуальным агентом, так и комбинацией, хорошо переносимы мышами.
|
P<0,05 означает значительное различие для разбавителя (а), соединения А (b) и соединения С (с) (однонаправленный ANOVA по Tukey).
Пример 2: Комбинация соединения В и соединения С в случае клеточных линий липосаркомы
Соединения В и С растворяли в 100% ДМСО (Sigma, номер по каталогу D2650), в концентрациях 10 мМ, и хранили при температуре -20°С, до использования. Соединения вводили в глубокие, по 300 мкл, лунки 384-луночных планшетов (BrandTec, номер по каталогу 701355), в 8Х самой высокой конечной концентрации. Разведения «в ряд» и «в колонку» получали раздельно, используя жидкостной манипулятор Bravo (Agilent Technologies). Разведения осуществляли в соотношении 1:2, получая сумму из 10 разведений для каждого соединения. Как только завершали разведение «в ряд» и «в колонку», планшеты комбинировали 1:1, получая конечный штампованный планшет с 4Х концентрацией.
Клеточные линии 449b, 778 и LP6 культивировали в среде RPMI1640 (АТСС, номер по каталогу 30-2110), дополненной с помощью 10% FBS (Hyclone, номер по каталогу SH30071.03), при температуре 37°С и в присутствии 5% СО2. Во всех случаях, клетки оттаивали из замороженного материала, увеличивали за счет≥1 пассирования, используя разведения 1:6. Клетки подсчитывали и оценивали на жизнеспособность, используя счетчик ViCell (Beckman-Counter). Идентичность всех клеточных линий подтверждали SNP-профилированием.
Все клетки высевали в концентрации 3,33×104 клеток/мл, в 30 мкл среды RPMI1640, используя устройство BioTek MicroFill (BioTek). На клеточную линию приготовляли четыре 384-луночных планшета (Greiner bio-оne, номер по каталогу 781091). На следующий день добавляли соединение, используя жидкостной манипулятор Bravo. В один из четырех планшетов (планшет «день 0»), используемый для определения базовой линии клеточной выживаемости, не вводили соединение, а его немедленно фиксировали и пермебиализировали (как описано ниже). В другие планшеты добавляли соединение и планшеты инкубировали в течение 72 часов. После периода инкубации, удаляли 10 мкл среды, используя устройство для мойки микропланшетов EL×405 (BioTek/Thermo Scientific). Клетки затем фиксировали и пермеабилизировли в течение 1 часа (при комнатной температуре) путем добавления 20 мкл раствора для фиксации-пермеабилизации, содержащего 10% параформальдегида (SIGMA, P6148) и 0,3% Triton X-100 (Electron Microscopy Sciences, 22140) в забуференном фосфатом физиологическом растворе (PBS) (SIGMA, P3744), используя диспенсер для планшета WellMate (Matrix/Thermo Scientific, 201-10001), со стандартной 8-канальной кассетой (Matrix/Thermo Scientific, 201-30001).
Фиксированные клетки промывали три раза путем удаления 20 мкл из лунок с помощью устройства для мойки микропланшетов и путем добавления 60 мкл PBS с помощью диспенсера для планшета. Затем, после удаления 60 мкл из лунок, клеточные ДНК и актин окрашивали, используя красители Hoechst 33342 (Invitrogen, H3570, 10 мг/мл исходного раствора в воде) и Alexa Fluor 488 фаллоидин (A12379, Invitrogen, 6,6 мкМ исходный раствор в метаноле), соответственно. Оба красителя разводили в соотношении 1:1000 в PBS и в каждую лунку добавляли 40 мкл, используя диспенсер для планшета, и инкубировали в течение 30 минут (при комнатной температуре). В качестве последней стадии, клетки промывали три раза с помощью 60 мкл PBS. Планшеты заклеивали, используя приспособление для термического заклеивания микропланшетов PlateLoc (Agilent Technologies, G5402A), с помощью прокалываемых уплотнений из алюминия (Agilent Technologies, 06644-001) при температуре 178°С, в течение 2,2 сек. Планшеты визуализировали с помощью анализатора InCell Analyzer 2000 (GE Healthcare, 28-9534-63), используя 4х объектив и фильтры возбуждение/эмиссия DAPI, причем все ядра клеток захватывались в одно изображение.
Изображения на анализаторе InCell Analyser 2000 (GE Healthcare, 28-9534-63) были в формате TIFF и имели размер 2048×2048 пикселей, захватывая целую лунку 384-луночного планшета. Создавали автоматизированный «конвейер» анализа изображения, используя сделанные по заказу скрипты на исходном языке статистического программирования R, и функции BioConductor package EBImage. Целью являлось определение количества жизнеспособных ядер (клеток) на лунку, в качестве приближения к клеточной жизнеспособности. «Конвейер» включал семь стадий: (I.) выравнивание изображения для уменьшения числа пиков интенсивности, (II.) применение пороговой функции для отделения приоритетного сигнала от фона (шум), (III.) идентификация локальных максимумов в приоритетном сигнале, которые служат в качестве начальных чисел для ядер, (IV.) фильтрация локальных максимумов с точным приближением, (V.) распространение ядер из остающихся локальных максимумов, (VI.) и выделение признаков объекта из распространенных ядер (количества ядер, признаки размера и признаки интенсивности). В качестве последней стадии (VII.), исключается дебрис (например, фрагментированные ядра) из подсчета, объекты, идентифицированные в лунках, обработанных ДМСО и стауроспорином, использовали для получения распределений признаков для жизнеспособных и фрагментированных ядер, соответственно. Их использовали для установления прекращения дифференцировки между жизнеспособными и фрагментированными ядрами. Число фрагментированных ядер вычитали из общего числа идентифицированных объектов и результат сообщали как конечный подсчет для этой лунки.
Данные включали трехкратные измерения для состояния каждой обработки (соединение) и 189 повторений относительно обработанных ДМСО лунок. Данные нормировали к среднему значению из ДМСО-измерений и суммировали путем расчета средних значений из трехкратных измерений. Анализ данных осуществляли, используя анализатор Chalice, как описано Lehar и др., 2009. Вкратце, среднее ингибирование в процентах (относительно обработанного ДМСО контроля) для трехкратно обработанных соединением лунок, при каждой концентрации соединений, определяли и загружали в базу данных анализатора Chalice. Следующую формулу использовали для расчета ингибирования в процентах (1-(значение/среднее значение, день 3, ДМСО))*100. Показатель HSА Excess рассчитывали как описано Lehar и др., 2009.
Затем рассчитывали ингибирование роста. Сначала, «жизнеспособность» базовой линии (день 0) определяли путем подсчитывания жизнеспособности в 189 лунках до обработки. Среднее значение из этих измерений вычитали из измерений в конце эксперимента для дифференцировки между эффектами соединения, которая приводит к «киллингу» или «стазу». Вычитаемые из базовой линии измерения вносили в Chalice для расчета ингибирования роста. Следующую формулу использовали для расчета ингибирования роста: IF-значение < ДМСО, день 0, ((значение - день 0, ДМСО)/день 0, ДМСО)*100. IF-значение > ДМСО, день 0), ((значение - день 0, ДМСО)/(день 3, ДМСО - день 0, ДМСО))*100. Ингибирование роста следует из 0=нет ингибирования роста, 100=стаз и 200=полный киллинг.
Как соединение В, так и соединение С, в качестве одиночных агентов, сильно ингибировали рост всех трех клеточных линий. Значения IC50 соединения В составляли 27,7 нМ, 46,6 нМ и 86 нМ, в случае клеток 449b, 778 и LP6, соответственно. Значения IC50 соединения С составляли 130 нМ, 59,3 нМ и 475 нМ, в случае клеток 449b, 778 и LP6, соответственно.
В комбинации (Фиг. 1-3), обработка соединением В и соединением С вызывала умеренное синергическое ингибирование роста, в случае клеток LP6. Синергизм рассчитывали, используя HSА-модель, в случае которой измеряют воздействие на рост относительно того, что нужно ожидать от очень эффективной дозы одиночного агента. В случае клеток LP6, комбинация соединение В/соединение С вызывала чрезмерное ингибирование, выше наиболее эффективных доз единичных агентов. В случае клеточных линий 449b и 778, этот синергизм не наблюдали.
|
Пояснение к таблице 2: Дополнительные дисплейные данные от анализа путем микроскопии. Антипролиферативную активность соединения В и соединения А оценивали через значения IC50 (перечисленные в нМ). Потенциальное синергическое взаимодействие между соединением В и соединением С оценивали, используя показатель синергизма (Lehar и др., 2009), относительно модели аддитивности Loewe. Расчеты осуществляли, используя программное обеспечение Chalice.
Пример 3: Клиническое исследование с комбинацией соединения В и соединения С
Клиническое исследование можно осуществлять для оценки комбинации соединения В и соединения С в клинике. При этом исследовании, подбор дозы и режимы дозирования двух соединений могут базироваться на пригодной безопасности для человека, эффективности и PK-информации для соединения С и преклинической безопасности, эффективности и PK-информации, для соединения В, также как предопределенной оценке взаимодействия лекарственное средство-лекарственное средство, возможного для этой комбинации.
Исследование может быть запланировано в виде полицентрического, открыто-доступного изучения соединения В в комбинации с соединением С, вводимой перорально, в случае пациентов с липосаркомой, которая прогрессирует во время/или несмотря на предшествующую терапию. Оба соединения можно дозировать один раз в сутки в течение первых двух недель четырехнедельного цикла (2 недели во время лечения, 2 недели без лечения). Могут быть определены цели и связанные с ними конечные моменты, как описано в таблице 3.
|
|