Результат интеллектуальной деятельности: СЕЛЕКТИВНО ЗАМЕЩЕННЫЕ СОЕДИНЕНИЯ ХИНОЛИНА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на патент США № 61/890718, поданной 14 октября 2013 г. Данная заявка включена в настоящий документ в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Область техники
[0003] Варианты осуществления изобретения относятся к селективно замещенным соединениям хинолона и фармацевтическим средствам, содержащим одно или несколько указанных соединений в качестве активного(ых) ингредиента(ов). Более конкретно, варианты осуществления изобретения относятся к соединениям, которые действуют в качестве антагониста или ингибитора для Toll-подобных рецепторов (TLR) 7 и 8, а также к их применению в составе фармацевтической композиции, эффективной для лечения системной красной волчанки (SLE) и волчаночного нефрита.
[0004] Описание предшествующего уровня техники
[0005] Системная красная волчанка (SLE) и волчаночный нефрит представляют собой аутоиммунные заболевания, характеризующиеся воспалением и поражением тканей. Например, SLE может привести к поражению кожи, печени, почек, суставов, легких и центральной нервной системы. Больные SLE могут испытывать общие симптомы, такие как крайняя усталость, боль в суставах и отек суставов, необъяснимая лихорадка, кожная сыпь и нарушение функции почек. Поскольку поражение органов среди пациентов различается, симптомы могут различаться. SLE является заболеванием, поражающим, преимущественно, молодых женщин, с пиком начала в промежутке 15-40 лет, и имеющим приблизительно 10-кратную более высокую распространенность у женщин по сравнению с мужчинами.
[0006] Современные методы лечения SLE обычно включают иммуномодулирующие препараты, такие как белимумаб, гидроксихлорохин, преднизон и циклофосфамид. Каждый из этих препаратов может иметь побочные эффекты, ограничивающие дозу, и многие пациенты по-прежнему плохо контролируют заболевание.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
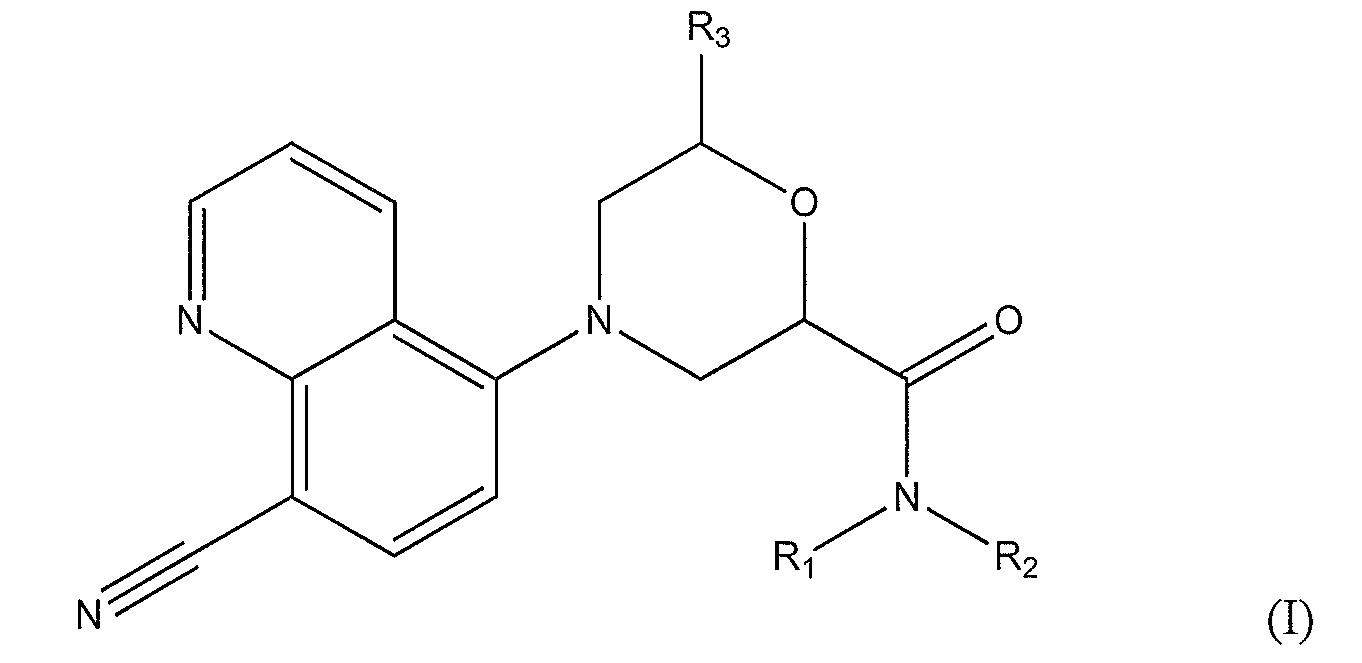
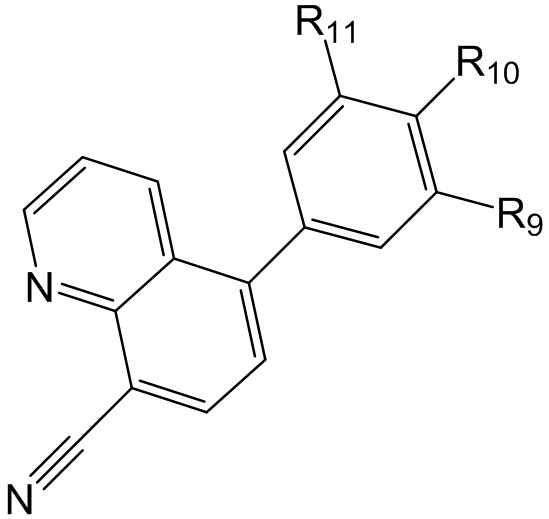
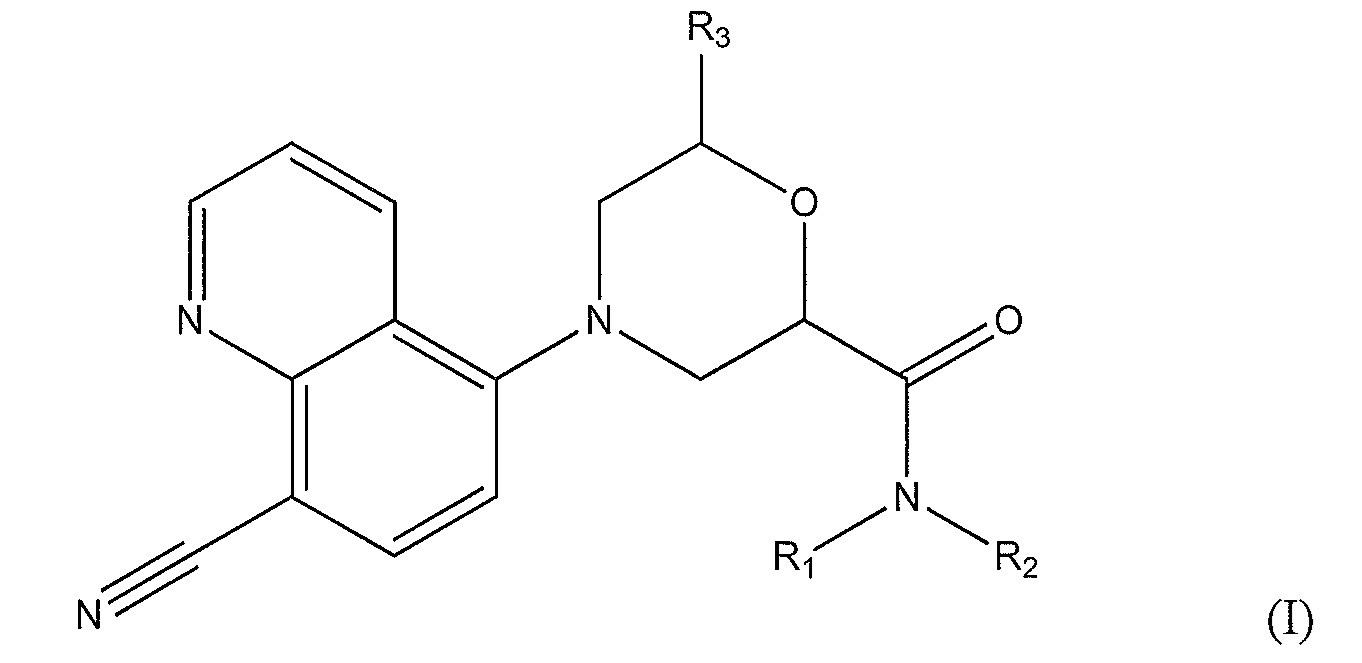
[0007] Варианты осуществления по настоящему изобретению касаются соединений и способов их применения для профилактики или лечения заболеваний или состояний, характеризующихся активацией Toll-подобных рецепторов 7 или 8 у пациентов. В одном из вариантов осуществления предложено соединение формулы (I):
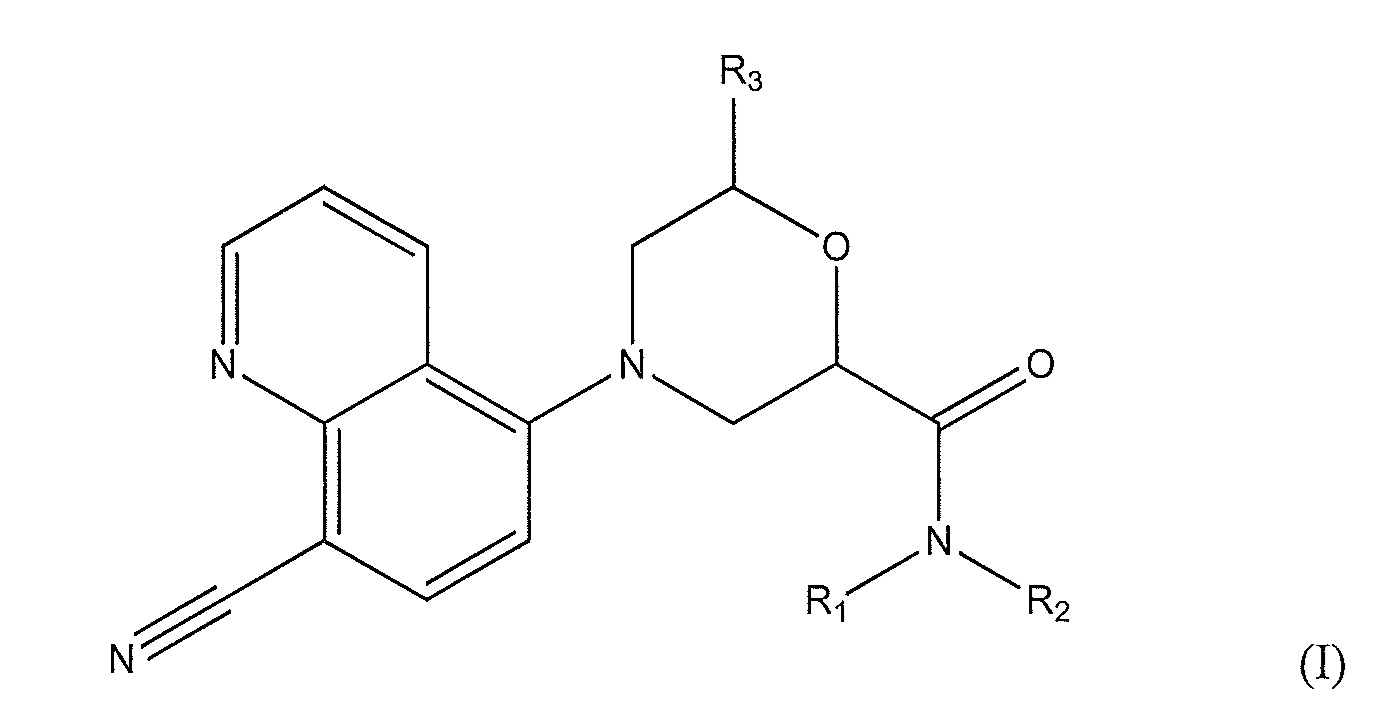
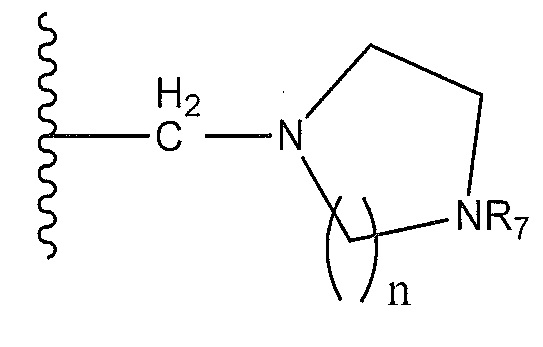
где, по меньшей мере, один из R1 и R2 представляет собой -Н, метил или этил, а другой представляет собой
-Н; или другой представляет собой
C1-С6-алкил, который необязательно замещен:
-OH, метокси, этокси, -OCH(CH3)2, -О(CH2)2CH3, фенилом, фуранилом, -О(CH2)2OH, фенокси, метилтио, -F, -N(СН3)2, циано, пиридинилокси, фторфенокси, изохроманилом, фенолом, бензиламино, -NHCH3, оксо-, амино, карбоксилом, 7-членным спироаминилом, трех-шести-членным циклоалкилом, насыщенным или ненасыщенным и необязательно включающим один или несколько гетероатомов, выбранных из О и N, и необязательно замещенным на одном или нескольких атомах С или N метилом, циано, фтором, метиламино или трифторметилом; или другой представляет собой
C3-C7 циклоалкан, насыщенный или ненасыщенный, необязательно соединенный мостиковой связью, необязательно включающий один или несколько гетероатомов, выбранных из O, S и N, и необязательно замещенный на одном или нескольких атомах С или N метилом, этилом, пиридинилом, азетидинилом, ацетамидилом, карбоксамидилом, циано, фтором, метиламино или трифторметилом; или
R1 и R2, вместе с атомом азота, к которому они присоединены, образуют 8-11-членный спиродиамин, 8-членный бициклодиамин, 7-членный спироксамин, пиперидинил, необязательно замещенный этилом, или четырех-шести членный циклоалкил, необязательно замещенный, по крайней мере, одним карбоксамидилом, аминометилом, метилом, (этиламино)метилом, (диметиламино)метилом, диметиламино, (метиламино)метилом и амино; и где R3 представляет собой -H или метил.
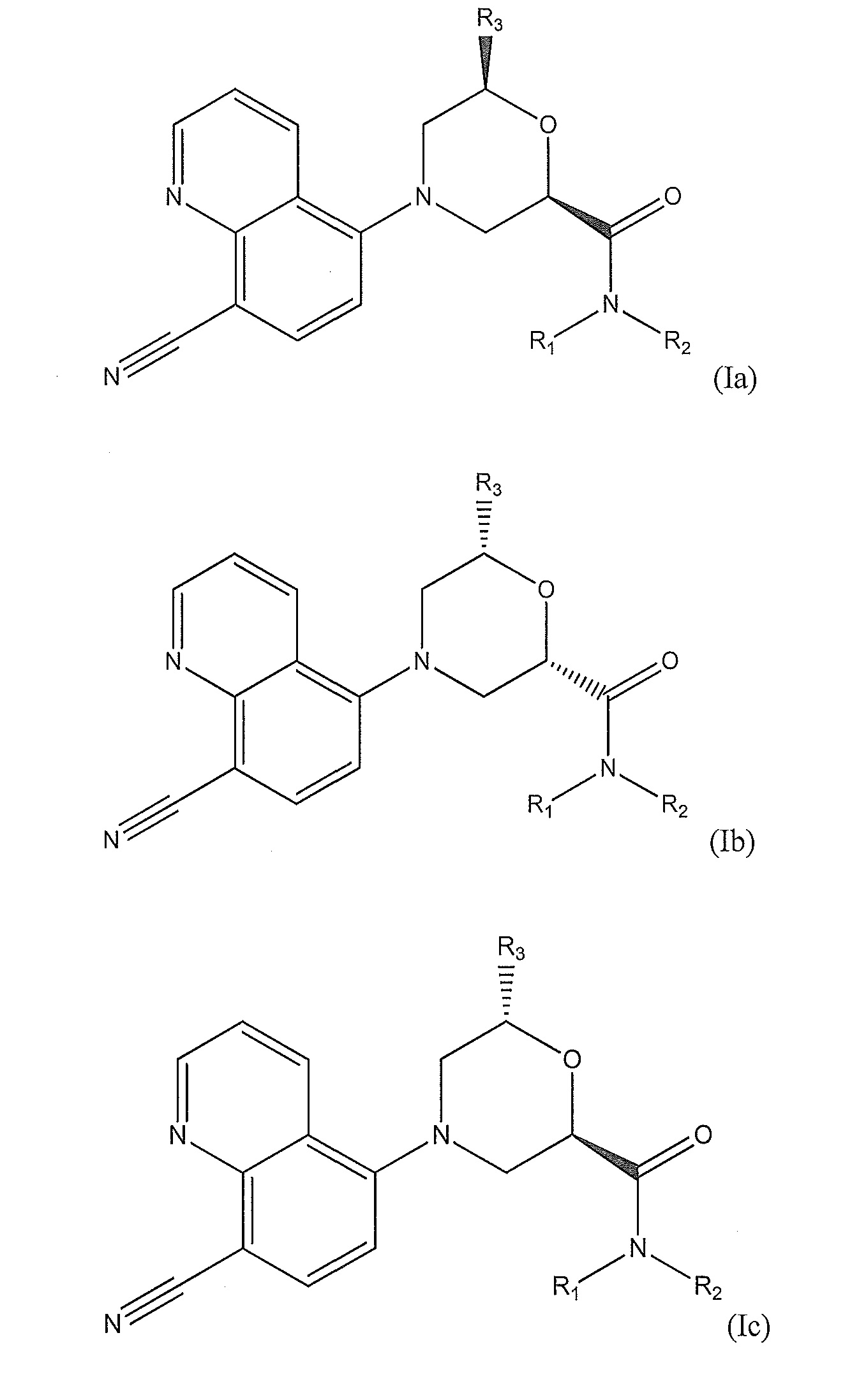
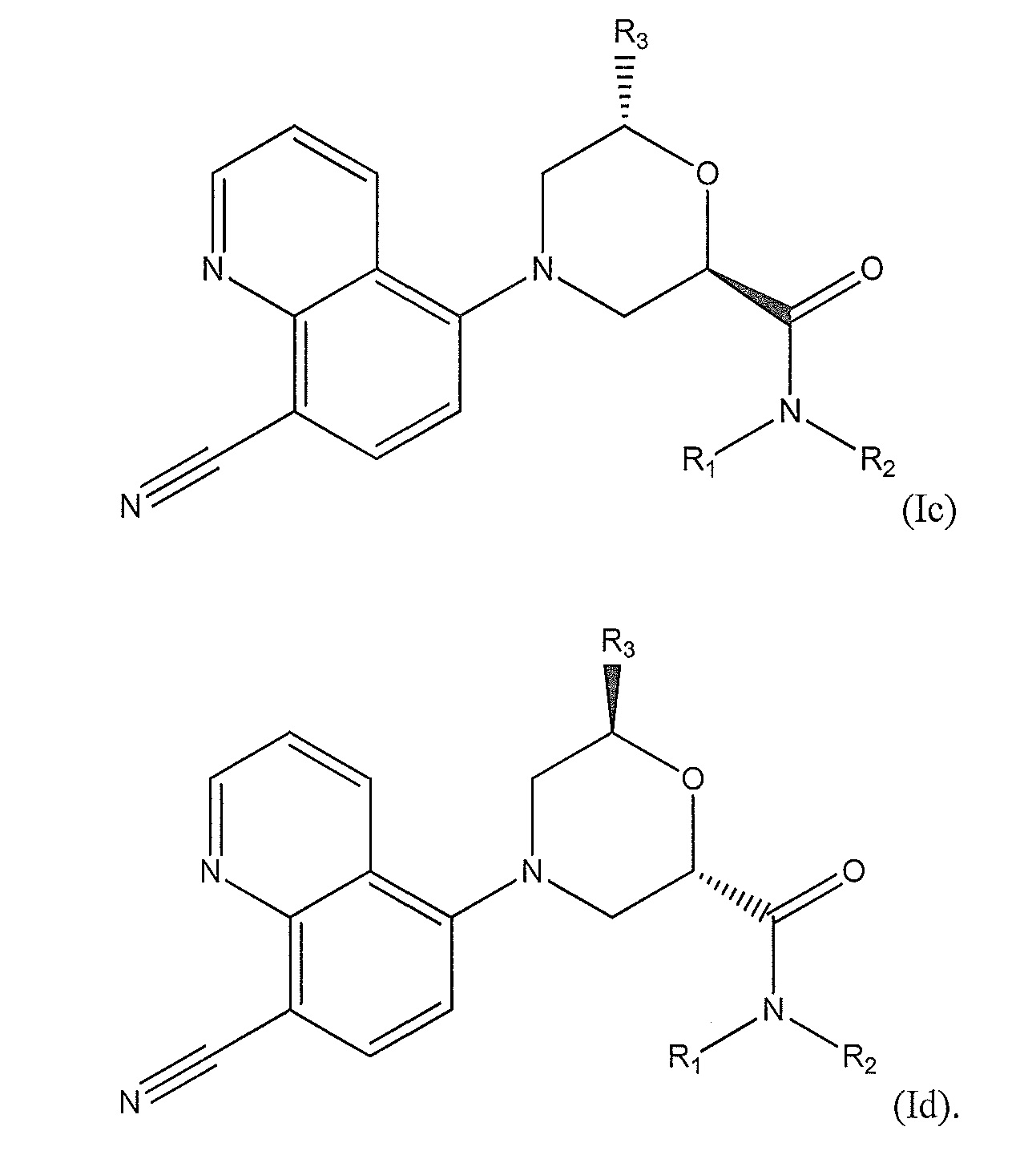
[0008] В другом варианте осуществления изобретения соединение представляет собой соединение формулы (I), имеющее стереохимию, показанную на одном из соединений формулы (Ia), (Ib), (Ic) или (Id), обладающих такими же наборами заместителей, как указано выше для формулы (Iа):
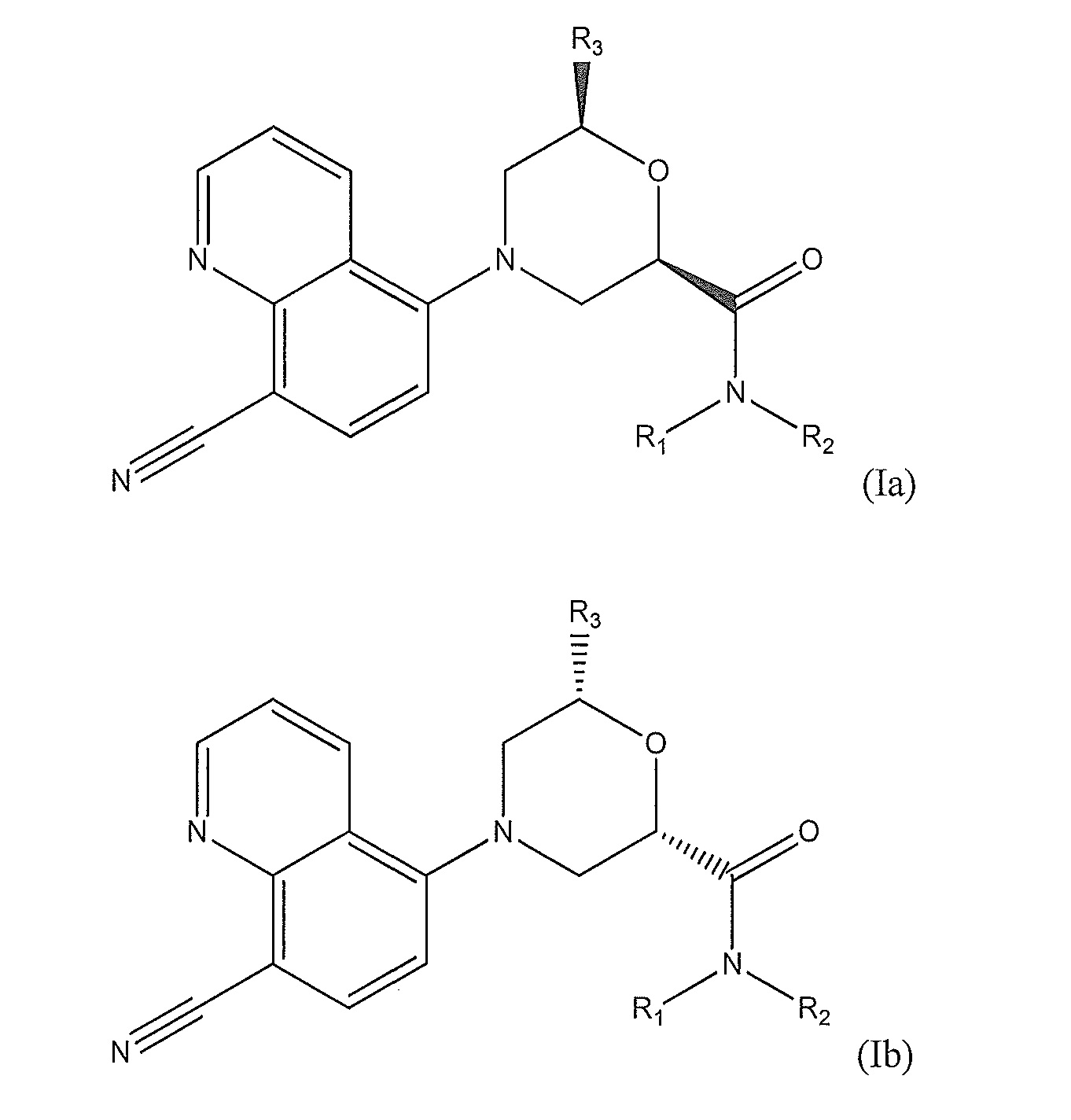
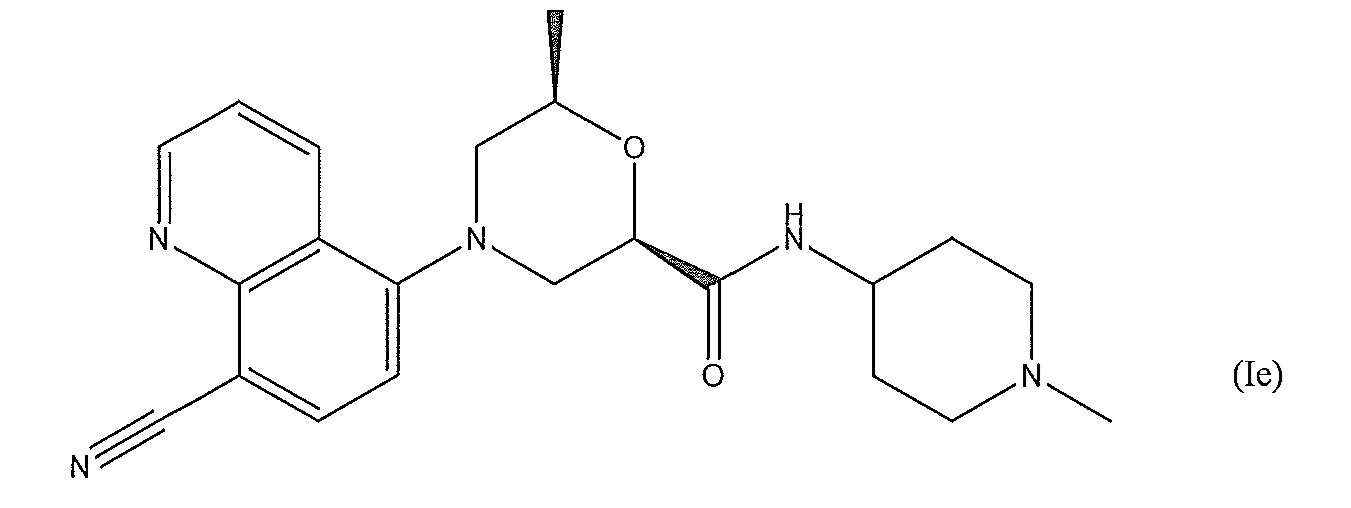
[0009] В еще одном варианте осуществления изобретения предложено соединение формулы (Iе) (показана относительная стереохимия):
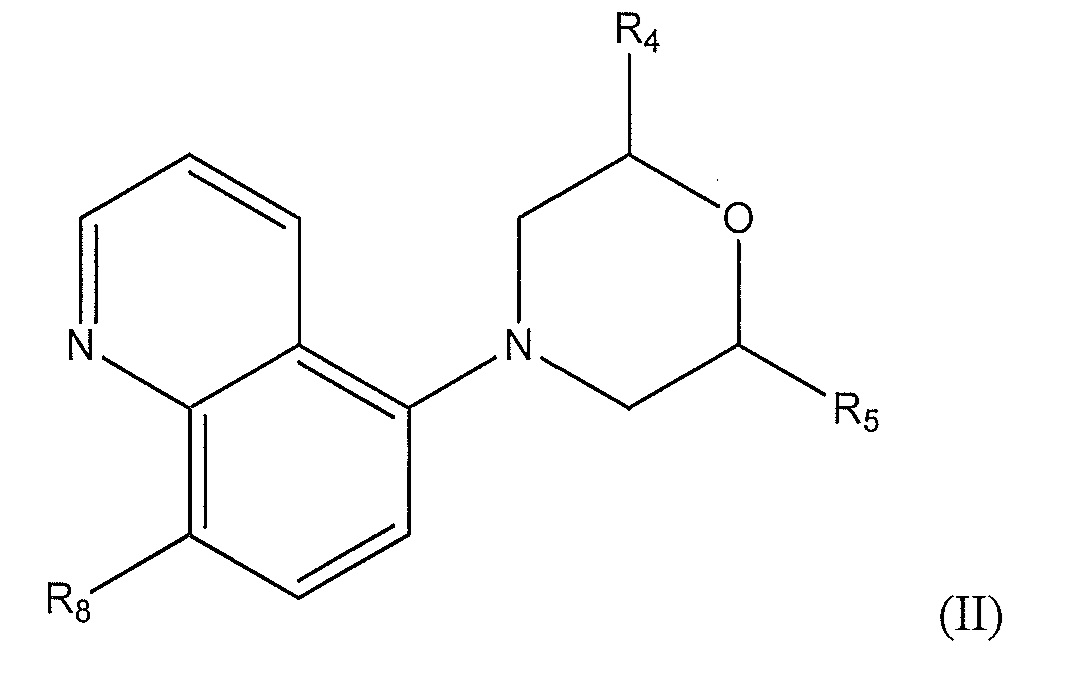
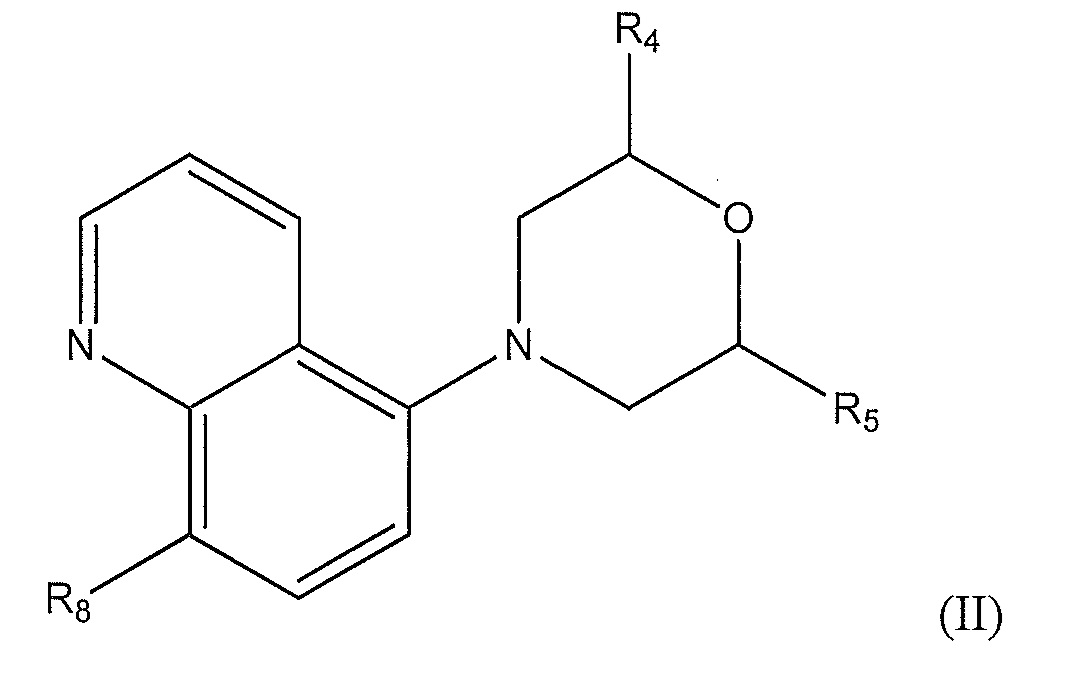
[0010] В другом варианте осуществления изобретения соединение представляет собой соединение формулы (II):
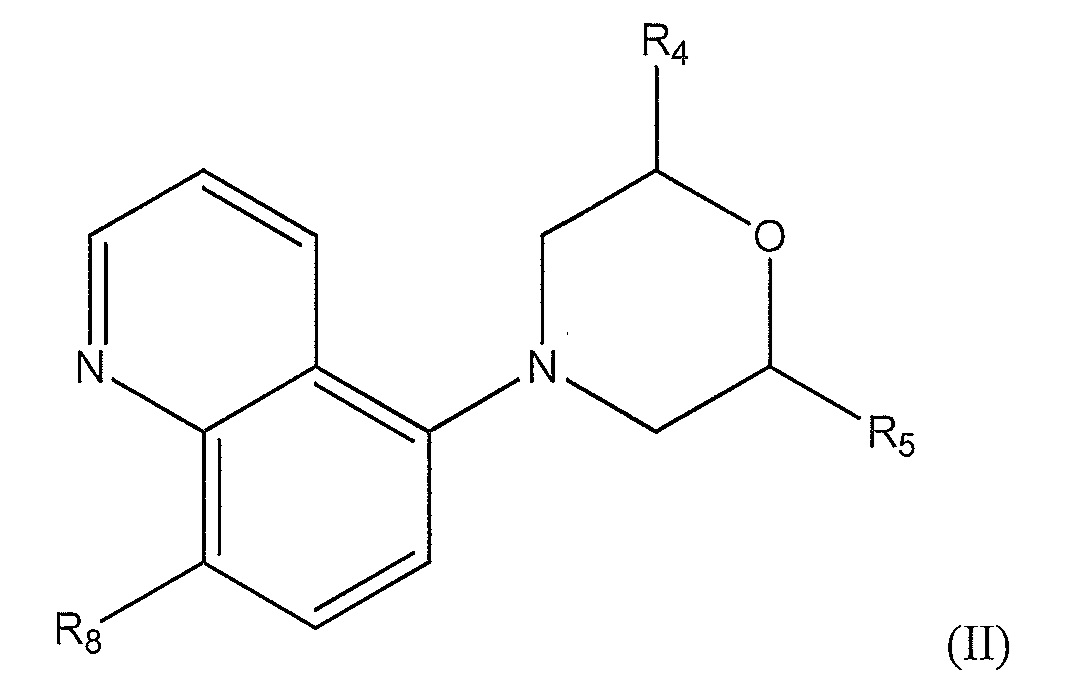
где
R4 представляет собой -H или метил;
R5 представляет собой C1-C5 алкил, который является насыщенным, частично насыщенным или ненасыщенным и который необязательно замещен:
-H, -Cl, -F, -OH, -NH2, оксо-, -N(CH2CH3)2, фенилом, циклогексилом, фенилтриазолилом, циклогексилтриазолилом, пиридинилом, пирролидинилом,
морфолинилом, необязательно замещенным метилом или гидроксиметилом,
-О-, замещенным:
С1-С6 алкилом, метилфенилом, метилциклогексилом, пиридинилом, диазинилом или фенилом, необязательно замещенным -F или метилом,
-NH-, замещенным:
C2-C7 алкилом, который является линейным, разветвленным или циклическим, насыщенным или ненасыщенным, и необязательно замещенным оксо-, фенилом, метилом или -OH,
пиридинилом, необязательно замещенным метилом, метокси, фенилом или амино,
диазинилом, необязательно замещенный этилом,
бензоимидазолилом, метилфенилом, фенилпиразолилом, нафтиридилом,
фенилом, необязательно замещенный -F, метилом, этилом или этокси,
имидазолидинилом, необязательно замещенным метилом,
или R5 представляет собой 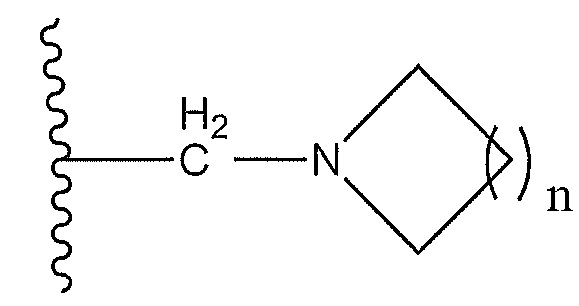 , где n равно 1-3, и где циклический амин необязательно замещен
, где n равно 1-3, и где циклический амин необязательно замещен
C1-C3 алкилом, необязательно замещенным
-OH, -F, фенилом, -NH2, циклогексилом, -N(CH3)2, -C(O)NH2, метилсульфонамидилом, бензолсульфонамидилом, метилбензолсульфонамидилом, или
пирролидинилом, необязательно замещенный метилом или гидроксилом, или
-NHC(O)R6, где R6 представляет собой
C1-C5 алкил, фенил, пиридинил, фторфенил, метилсульфонил, фторбензолсульфонил, диметилпиразолсульфонил или
пиразолил, необязательно замещенный метилом;
пиперидинил, необязательно замещенный -С(O)СН3, -С(O)СН2СН3, метил, оксо-, C(O)Ph, -NH2, -NH-C(O)CH3 или 
пиперазинил, необязательно замещенный -C(O)OC(CH3)3, метилом, -C(O)CH3, -C(O)Ph, C(O)CH(CH3)2, -C(O)CH3 или метилсульфонилом; или
R5 представляет собой 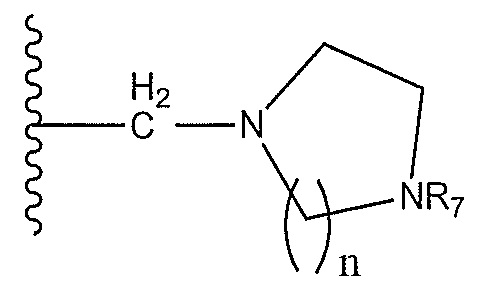 , где n равно 1 или 2, и где циклический диамин, необязательно, замещен, по меньшей мере, на одном атоме углерода
, где n равно 1 или 2, и где циклический диамин, необязательно, замещен, по меньшей мере, на одном атоме углерода
метилом, оксо-, -N(CH3)2, амино, -CH2CH3, или
пиперидинилом, необязательно замещенным метилом, -C(O)CH3, -C(O)CH(CH3)2, -C(O)Ph или -C(O)OC(CH3)3, и
где R7 представляет собой -H, фенил, -C(O)CH3, С1-С3 алкил, -C(O)NH2 или -C(O)Ph; и R8 представляет собой метокси или циано.
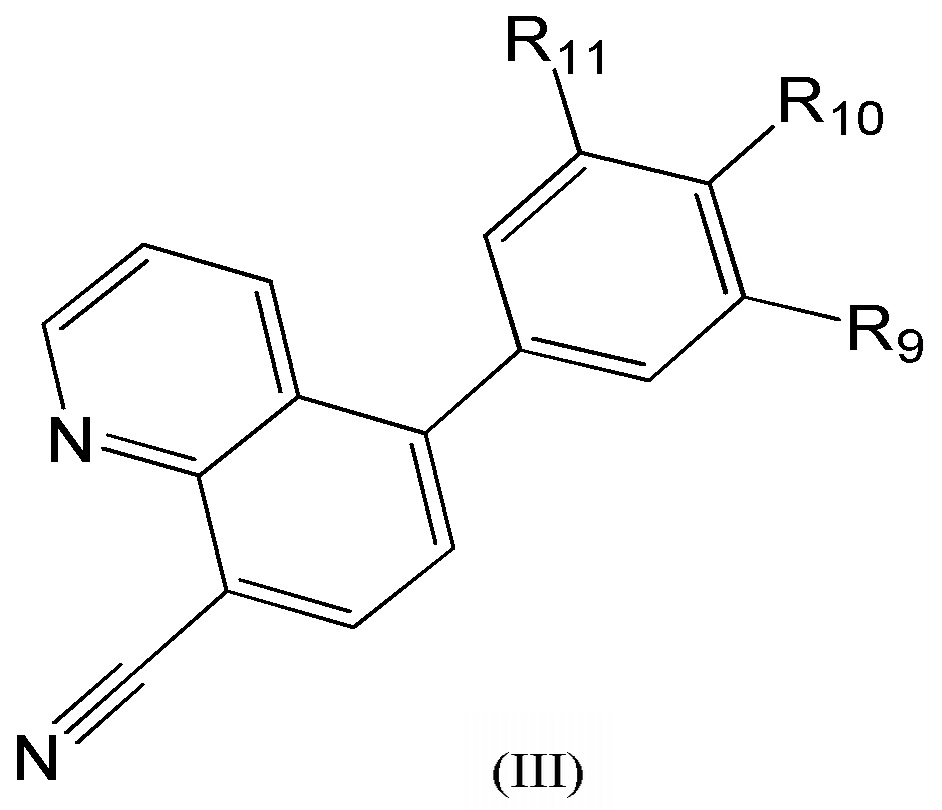
[0011] В еще одном варианте осуществления предложено соединение формулы (III):
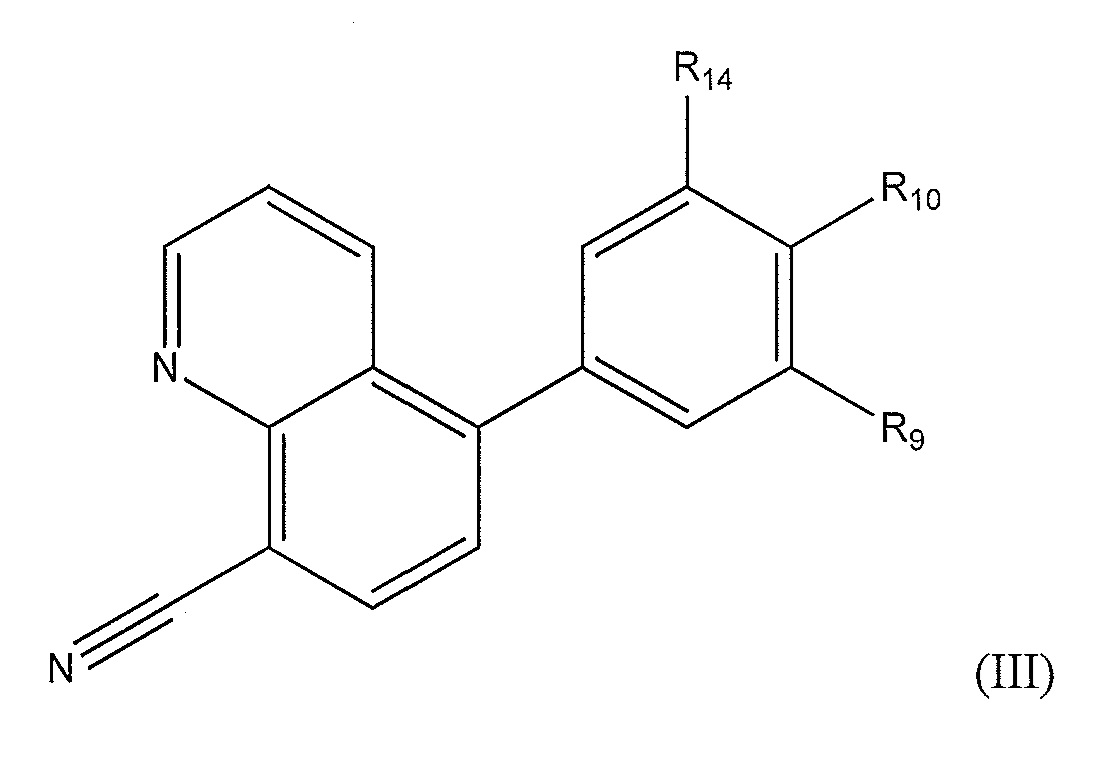
где
R11 представляет собой H или метил;
R10 представляет собой H или, в случае, когда оба, R14 и R9, являются H, представляет собой метил-1,4'-бипиперидинил;
R9 представляет собой -H или представляет собой -CH2-, замещенный 1,4'-бипиперидинилом, оксо-, гидроксилом, метилпиридинилом или пиперидинилом, необязательно замещенным гидроксилом, -N(CH3)2 или пиперидинилом.
[0012] В другом варианте осуществления изобретения соединение выбрано из rel-(2R,6R)-4-(8-цианохинолин-5-ил)-N-((3R,4S)-4-фторпирролидин-3-ил)-6-метилморфолин-2-карбоксамида гидрохлорида, (2R,6R)-4-(8-цианохинолин-5-ил)-6-метил-N-(1-метилпиперидин-4-ил)морфолин-2-карбоксамида, 5-((2S,6R)-2-([1,4'-бипиперидин]-1'-илметил)-6-метилморфолинo)хинолин-8-карбонитрила и 5-((2R,7R)-2-(гидроксиметил)-7-метил-1,4-оксазепан-4-ил)хинолин-8-карбонитрила.
[0013] В другом варианте осуществления изобретения соединение или его фармацевтически эффективная соль, указанные в абзаце выше, имеют значение IC50 меньше или равное 20 нМ против рецепторов TLR7 человека, экспрессированных в клеточной линии НЕК-293. В другом варианте осуществления изобретения соединение или его фармацевтически эффективная соль, указанные в абзаце настоящего описания выше, имеют значение IC50 менее чем или равное 100 нМ против рецепторов TLR7 человека, экспрессированных в клеточной линии НЕК-293. В еще одном варианте осуществления изобретения значение IC50 против рецепторов TLR7 человека, экспрессированных в клеточной линии НЕК-293, определяют посредством (1) культивирования клеток линии НЕК-293, стабильно экспрессирующих TLR7, в модифицированной Дульбекко среде Игла, содержащей 10% фетальной бычьей сыворотки, при плотности 2,22×105 клеток/мл в 384-луночных планшетах, и инкубирования в течение 2-х дней при температуре 37°C, 5% CO2; (2) добавления соединения или его фармацевтически приемлемой соли и инкубирования клеток в течение 30 минут; (3) добавления CL097 (InvivoGen) при 3 мкг/мл и инкубирования клеток в течение примерно 20 часов; и (4) количественной оценки NF-каппаB зависимой репортерной активации путем измерения люминесценции.
[0014] В других вариантах осуществления настоящего изобретения соединения имеют значение IC50 против рецепторов TLR7 человека, экспрессированных в клеточной линии НЕК-293, меньше чем или равный 200 нм, меньше чем или равно 180 нм, меньше чем или равно 160 нм, меньше чем или равно 140 нм, меньше чем или равно 120 нм, меньше чем или равно 100 нм, меньше чем или равно 80 нм, меньше чем или равно 60 нм, меньше чем или равно 40 нм или меньше чем или равно 20 нм. В других вариантах осуществления настоящего изобретения, соединения имеют значение IC50 против рецепторов TLR7 человека, экспрессированных в клеточной линии НЕК-293, составляет от 10 нМ до 30 нМ, от 10 нМ до 50 нМ, от 10 нМ до 100 нМ, от 30 нМ до 50 нМ, от 30 до 100 нМ, или от 50 до 100 нМ. В других вариантах осуществления изобретения IC50 против рецепторов TLR7 человека, экспрессированных в клеточной линии НЕК-293, определяют посредством (1) культивирования клеток клеточной линии НЕК-293, стабильно экспрессирующих TLR7 в модифицированной Дульбекко среде Игла, содержащей 10% фетальную бычью сыворотку при плотности 2,22×105 клеток/мл в 384-луночном планшете, и инкубирования в течение 2 дней при температуре 37°C, 5% CO2; (2) добавления соединения или его фармацевтически приемлемой соли и инкубирования клеток в течение 30 минут; (3) добавления CL097 (InvivoGen) при концентрирования 3 мкг/мл и инкубирования клеток в течение примерно 20 часов; и (4) количественной оценки NF-каппаB зависимой репортерной активации путем измерения люминесценции.
[0015] Согласно другим вариантам осуществления изобретения предложены способы лечения волчанки, включая, но ими не ограничиваясь, лечение системной красной волчанки, кожной волчанки, психоневрологической волчанки, блокады сердца плода и антифосфолипидного синдрома, заключающиеся во введении фармацевтически эффективного количества соединения или его фармацевтически приемлемой соли по изобретению.
[0016] Согласно другим вариантам осуществления изобретения предложены способы антагонизма TLR7, включающие введение фармацевтически эффективного количества соединения или его фармацевтически приемлемой соли по изобретению.
[0017] Согласно другим вариантам осуществления изобретения предложены способы антагонизации TLR8, включающие введение фармацевтически эффективного количества соединения или его фармацевтически приемлемой соли по изобретению.
[0018] Согласно другим вариантам осуществления изобретения предложены фармацевтические композиции, содержащие, по меньшей мере, одно соединение или его фармацевтически приемлемую соль по изобретению, и, по меньшей мере, один фармацевтически приемлемый носитель.
[0019] Согласно другим вариантам осуществления изобретения предложены способы лечения системной красной волчанки или волчанки, включающие введение фармацевтически эффективного количества соединения или его фармацевтически приемлемой соли по изобретению.
[0020] Согласно другим вариантам осуществления изобретения предложены способы антагонизации TLR7, включающие введение фармацевтически эффективного количества соединения или его фармацевтически приемлемой соли по изобретению.
[0021] Согласно другим вариантам осуществления изобретения предложены способы антагонизации TLR8, включающие введение фармацевтически эффективного количества соединения или его фармацевтически приемлемой соли по изобретению.
[0022] Согласно другим вариантам осуществления изобретения предложены фармацевтические композиции, содержащие, по меньшей мере, одно соединение или фармацевтически приемлемую соль по изобретению и, по меньшей мере, один фармацевтически приемлемый носитель.
[0023] Термин «необязательно замещенный», как он используется в настоящем документе, означает, что рассматриваемая структура может включать, но не обязательно включает, один или несколько заместителей, независимо выбранных из низшего алкила, метокси-, -ОН, -NH2, -СН2-NH-CH2, -OCH2CH2CH3, или -ОСН(СН3)2. Если необязательно замещенный фрагмент является циклическим, то необязательное замещение может быть метиловым мостиком между двумя атомами в кольце.
[0024] Символ «C(O)», используемый в настоящем документе, относится к карбонильной группе, имеющей формулу С=О.
[0025] Если не указано иное, указание единственного числа, как использовано в настоящем описании, включая формулу изобретения, означает «один или несколько».
[0026] Как используется в настоящем документе, «низший алкил» относится к прямым, или в случае трех и четырех-углеродных групп, прямым, разветвленным или циклическим, насыщенным углеводородам, содержащим от одного до четырех атомов углерода.
[0027] Как используется в настоящем документе, термин «присоединенный через атом азота» в отношении гетероциклической группы, содержащей азот, означает, что точкой присоединения группы к другой структуре является атом азота, который представляет собой часть гетероцикла.
[0028] Как используется в настоящем документе, термин «TLR7/8» означает «TLR7 и TLR8», или «TLR7 или TLR8», или «TLR7 и/или TLR8.» Конкретное значение может быть понятным специалисту в данной области техники исходя из контекста, в котором встречается «TLR7/8».
[0029] Гетероциклические группы, приведенные в настоящем документе, включают азетидинил, пирролидинил, пиперидинил, метилазетидинил, пиразолил, пиперазинил, морфолинил, тиазолил, пирролопирролил, имидазолидинил и изотиазолил. В случае, когда упоминается гетероциклическая группа, если не указано иное, будет понятно, что гетероциклический(ие) атом(ы) в группе может(могут) быть в любом положении в группе. Следует также понимать, что имидазолил, пиразолил, тиазолил, пирролил и могут быть ненасыщенными или частично ненасыщенным. Один из вариантов осуществления изобретения может включать фармацевтическую композицию, которая содержит одно или несколько соединений по изобретению вместе с фармацевтически приемлемым вспомогательным веществом. Эти фармацевтические композиции могут быть использованы для лечения или профилактики заболевания или состояния, характеризующегося активацией TLR7/8 у пациента, обычно у пациента-человека, который страдает или предрасположен к такому состоянию или заболеванию. Примеры заболеваний или патологических состояний, характеризующихся активацией TLR7/8, включают системную красную волчанку (SLE) и волчаночный нефрит.
[0030] Как используется в настоящем документе, «эффективное количество» соединения по варианту осуществления изобретения соответствует эффективному количеству вышеуказанных соединений, то есть, количеству, достаточному для лечения или профилактики системной красной волчанки и волчаночного нефрита.
[0031] Варианты осуществления изобретения, представленные в настоящем документе, могут включать соединения, имеющие асимметрические или хиральные центры. Варианты осуществления изобретения включают различные стереоизомеры и их смеси. Отдельные стереоизомеры соединений по вариантам осуществления изобретения могут быть получены путем синтеза исходя из коммерчески доступных исходных веществ, которые имеют асимметрические или хиральные центры, или путем получения смесей энантиомеров соединений с последующим разделением этих соединений. Подходящие способы разделения включают присоединение рацемической смеси энантиомеров, обозначаемых (+/-), к хиральному вспомогательному веществу, разделение полученного диастереомера путем хроматографии или перекристаллизации и выделение оптически чистого продукта из вспомогательного вещества; или прямое разделение смеси оптических энантиомеров на хирального исходного вещества, описанный в работе Tsuzuki, et. al., Tetrahedron Asymmetry 2001, 12, 2989 с получением хирального соединения 81 по схеме 20.
[0412] К перемешиваемому раствору (3S,4S)-трет-бутил 3-(бензиламино)-4-гидроксипирролидин-1-карбоксилата 80 (3,091 г, 10,57 ммоль) и имидазола (3,60 г, 52,9 ммоль) в DCM (185 мл) добавляли триэтиламин (4,42 мл, 31,7 ммоль). Полученную смесь охлаждали до 1-2°C, и затем по каплям добавляли раствор тионилхлорида (1,16 мл, 15,9 ммоль) в DCM (46 мл) в течение 30 минут. Смесь перемешивали при 1-2°C в течение 6 часов, нагревали до комнатной температуры и перемешивали в течение ночи, после чего реакционную смесь гасили водой (46 мл). Органический слой разделяли, концентрировали с получением сырого продукта в виде белого цвета твердого вещества/пены, который хроматографировали на колонке с силикагелем (н-гептан/EtOAc 2:1) с получением 2-оксида (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-d][1,2,3]оксатиазол-5(3H)-карбоксилата (2,10 г, 6,21 ммоль, 58,7%-ный выход) в виде твердого вещества белого цвета.
[0413] К перемешиваемому раствору 2-оксида (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-d][1,2,3]оксатиазол-5(3H)-карбоксилата (2,10 г, 6,21 ммоль) в 1,2-дихлорэтане (10 мл), разбавленному ацетонитрилом (10 мл) и водой (10 мл), охлаждаемому до 2-3°C, добавляли гидрат рутений(III) хлорида (14 мг), затем перйодат натрия (1,39 г, 6,50 ммоль). Полученную смесь перемешивали при 2-3°C в течение 1 часа, нагревали при 17-18°C в течение 1 часа и перемешивали при этой температуре в течение 16 часов. Добавляли 20 масс% раствор Na2SO4 (5 г), потом EtOAc (30 мл), после чего полученную смесь интенсивно перемешивали в течение 10 мин и фильтровали через слой из целита (2 г). Органический слой разделяли, промывали 20 масс% раствором сульфитом натрия (5 г), 20 масс% раствором NaCl (5 г) и концентрировали с получением масла светло-сиреневого/серого цвета. Сырое масло пропускали через слой силикагеля (10 г), элюируя EtOAc (120 мл) и концентрировали досуха с получением 2,2-диоксида (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-натрия, лития, калия, кальция, магния и тому подобное, а также нетоксичные катионы аммония, четвертичного аммония и аминов, включая, но ими не ограничиваясь, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и тому подобное.
[0034] Термин «фармацевтически приемлемые сложные эфиры», используемый в настоящем документе, относится к сложным эфирам, которые гидролизуются in vivo, и включают эфиры, которые легко распадаются в человеческом организме с образованием исходного соединения или его соли. Подходящими сложноэфирными группами являются, например, группы, образованные из фармацевтически приемлемых алифатических карбоновых кислот, в частности алкановых, алкеновых, циклоалкановых и алкандионовых кислот, в которых каждая алкильная или алкенильная группа, как правило, содержит не более 6 атомов углерода. Примерами конкретных эфиров являются формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
[0035] В настоящей заявке энантиомеры обозначены символами «R» или «S» или изображаются обычным образом жирной линией, указывающей на расположение заместителя над плоскостью страницы в трехмерном пространстве, и прерывистой или пунктирной линией, указывающей на расположение заместителя под плоскости страницы в трехмерном пространстве. Если стереохимическое обозначение не приведено, то определение структуры включает оба стереохимических варианта. Если структурное или химическое название включает «REL» или «rel», подразумевается, что этой структурой показана относительная стереохимия.
КРАТКОЕ ОПИСАНИЕ ФИГУР
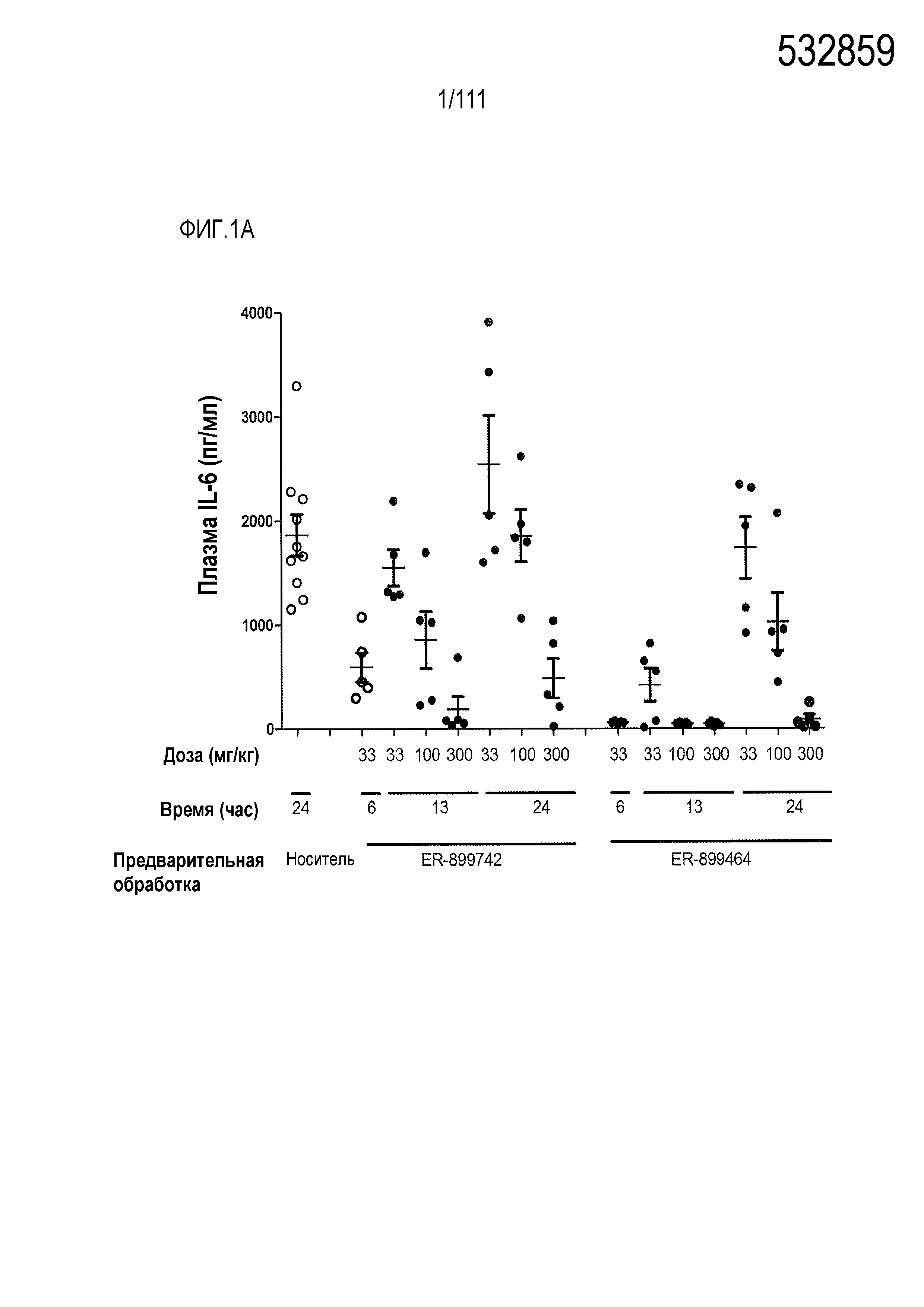
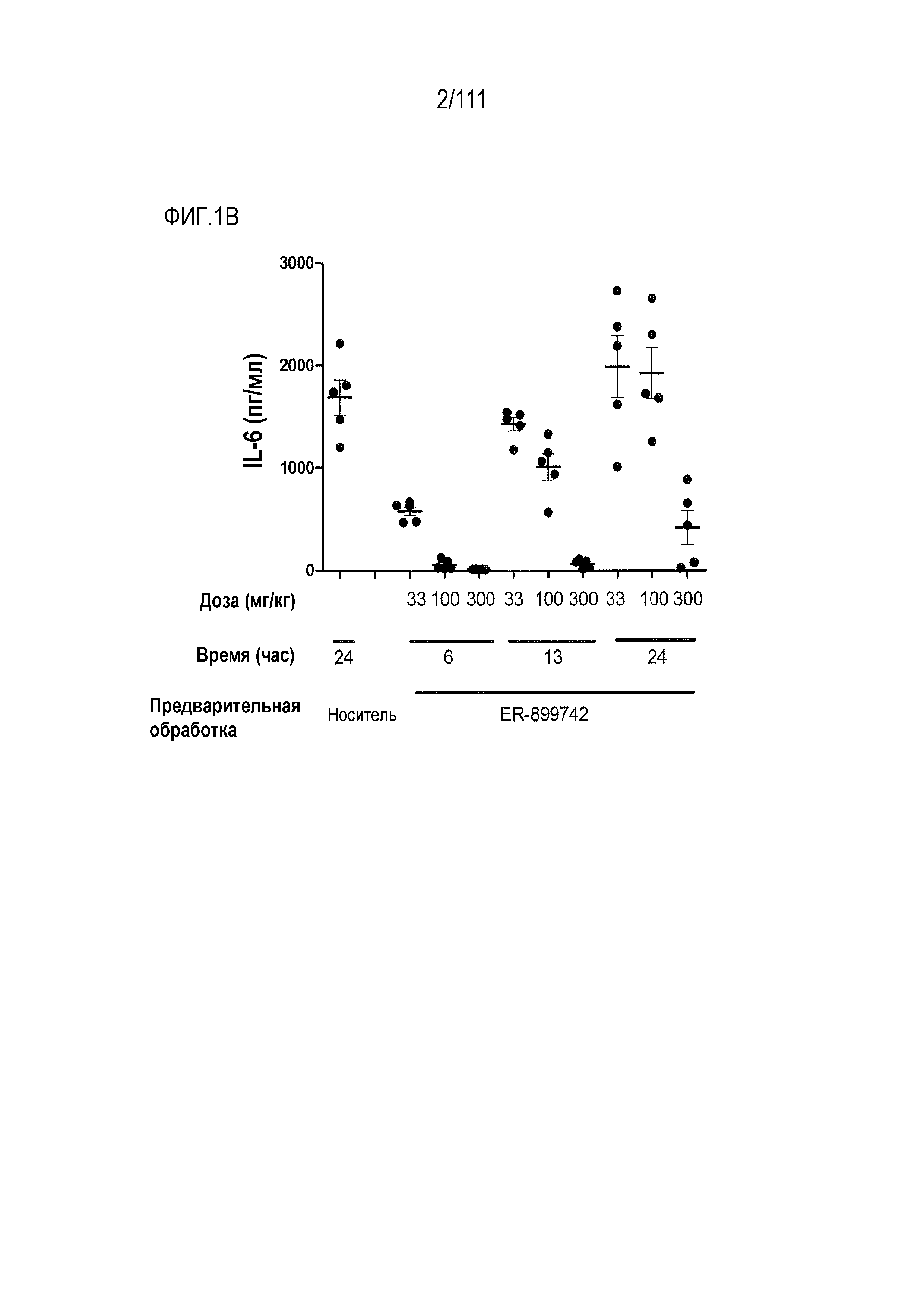
[0036] На фиг.1А и фиг.1В показано непродолжительное in vivo подавление пути TLR7 у мышей с помощью соединений ER-899742 и ER-899464. Описание фигуры: Самкам мышей линии BALB/с вводили перорально через зонд только носитель (0,5%-ный водный раствор метилцеллюлозы), или соединение, объединенное с носителем, в дозе 33 мг/кг, 100 мг/кг или 300 мг/кг. Через 6, 13 или 24 ч после перорального введения мышам вводили подкожно 15 мкг R848 для стимулирования TLR7. Плазму крови собирали пункцией сердца, и затем через 1,5 часа после стимулирования TLR7 оценивали уровень IL-6 посредством стандартной процедуры ELISA (фиг.1А).
ER-899742 и ER-899464 испытывали одновременно в одном эксперименте. (фиг.1В) Повторный эксперимент выполняли с ER-899742, контролируя все три дозы во всех трех временных точках.
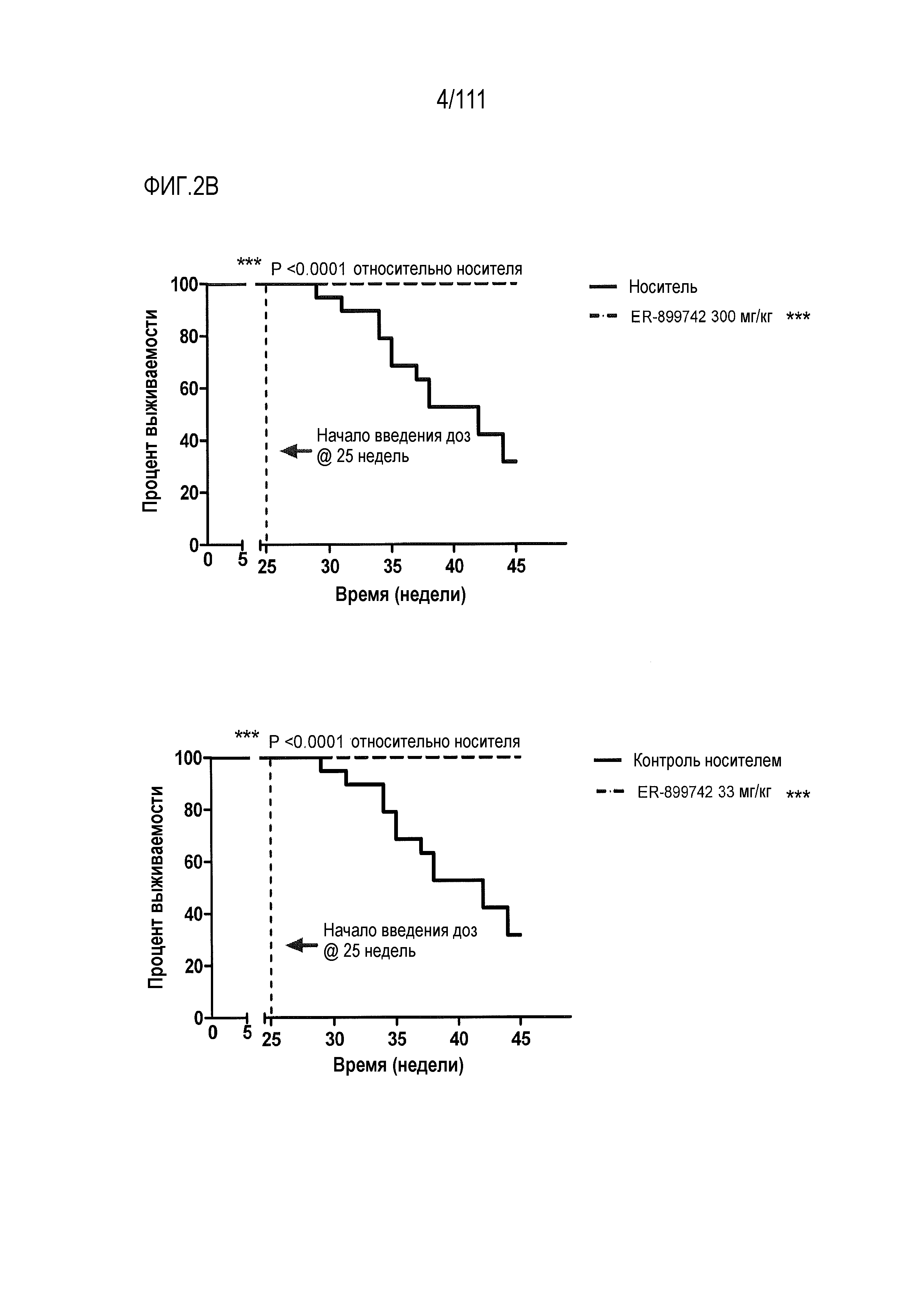
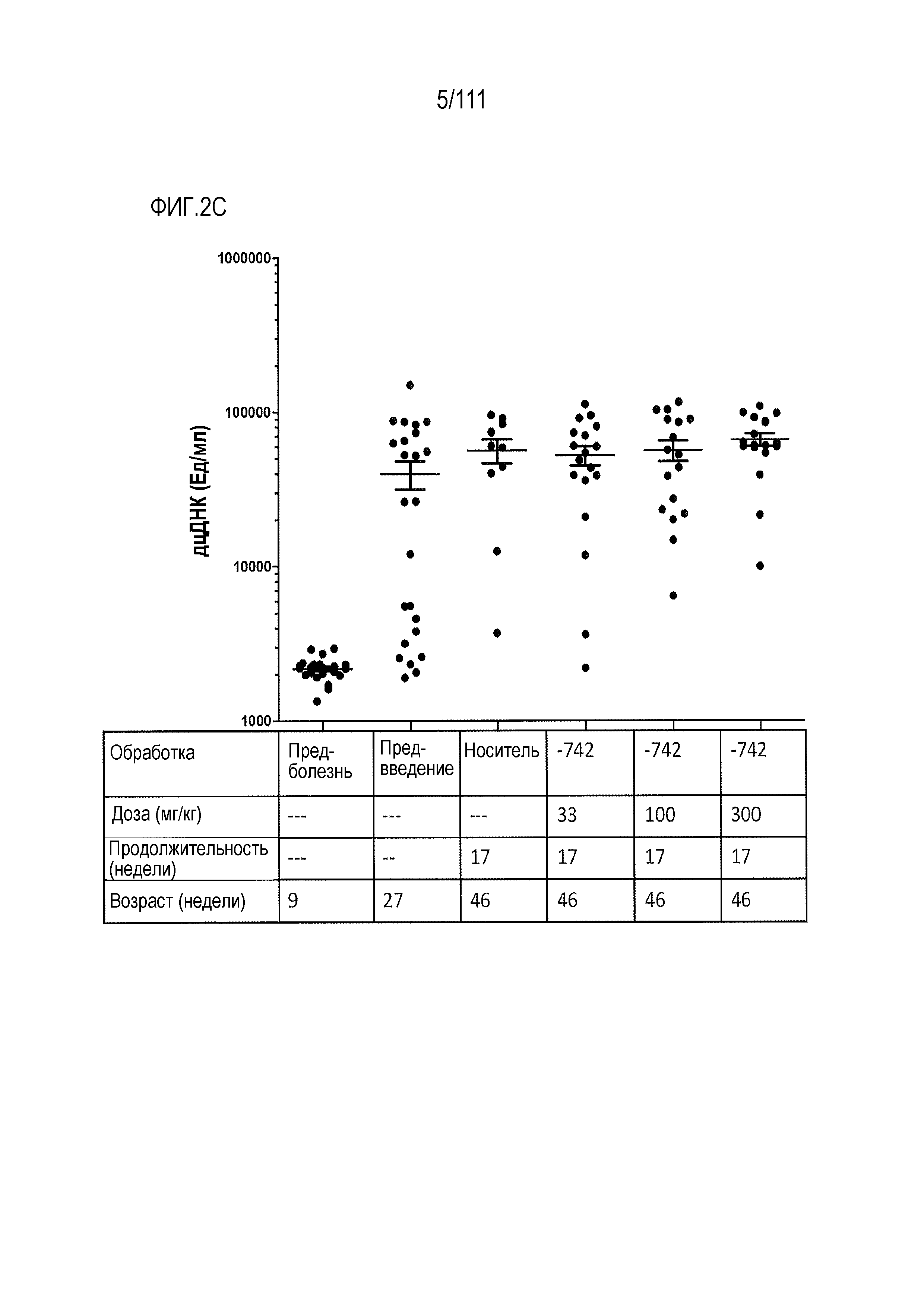
[0037] На фиг.2A-фиг.2C показаны результаты исследования ER-899742 на модели мышей линии NZBxNZW (сокращенно далее как NZBWF1/J или NZB/W) волчанки. Пояснения к фигурам: самок NZBWF1/J мышей получали в возрасте 5 недель, осуществляли начальные отборы крови, и контролировали прогрессирование заболевания у мышей по следующим титрам анти-дцДНК. Мышей 27-недельного возраста разделяли случайным образом на группы с эквивалентными средними титрами анти-дцДНК, и в возрасте 29-ти недель обрабатывали только носителем (Veh, 0,5% метилцеллюлоза) или перорально один раз в день дозой 33, 100 или 300 мг/кг (QD PO). В возрасте 46-ти недель, через 17 недель обработки, у мышей отбирали кровь и исследовали титры анти-дцДНК. Всех мышей 50-недельного возраста умерщвляли (21 неделя обработки соединением). (Фиг.2А) Незадолго до достижения 50-недельного возраста (через 21 недели лечения) у отдельных мышей собирали мочу, и для каждого животного определяли соотношение альбумин/креатинин в моче (UACR, протеинурия) в качестве косвенного показателя функции почек. (Фиг.2B) В этом исследовании наблюдали динамику смертности для групп, обработанных самой высокой и самой низкой дозой. После обработки соединением смертность не наблюдалась. Кроме того, смертность не наблюдалась в группе, обработанной средней дозой (не показано). (Фиг.2С) Влияние обработки на анти-дцДНК титры через 17 недель введения препарата в возрасте 46-ти недель. Не наблюдалось статистически значимого эффекта.
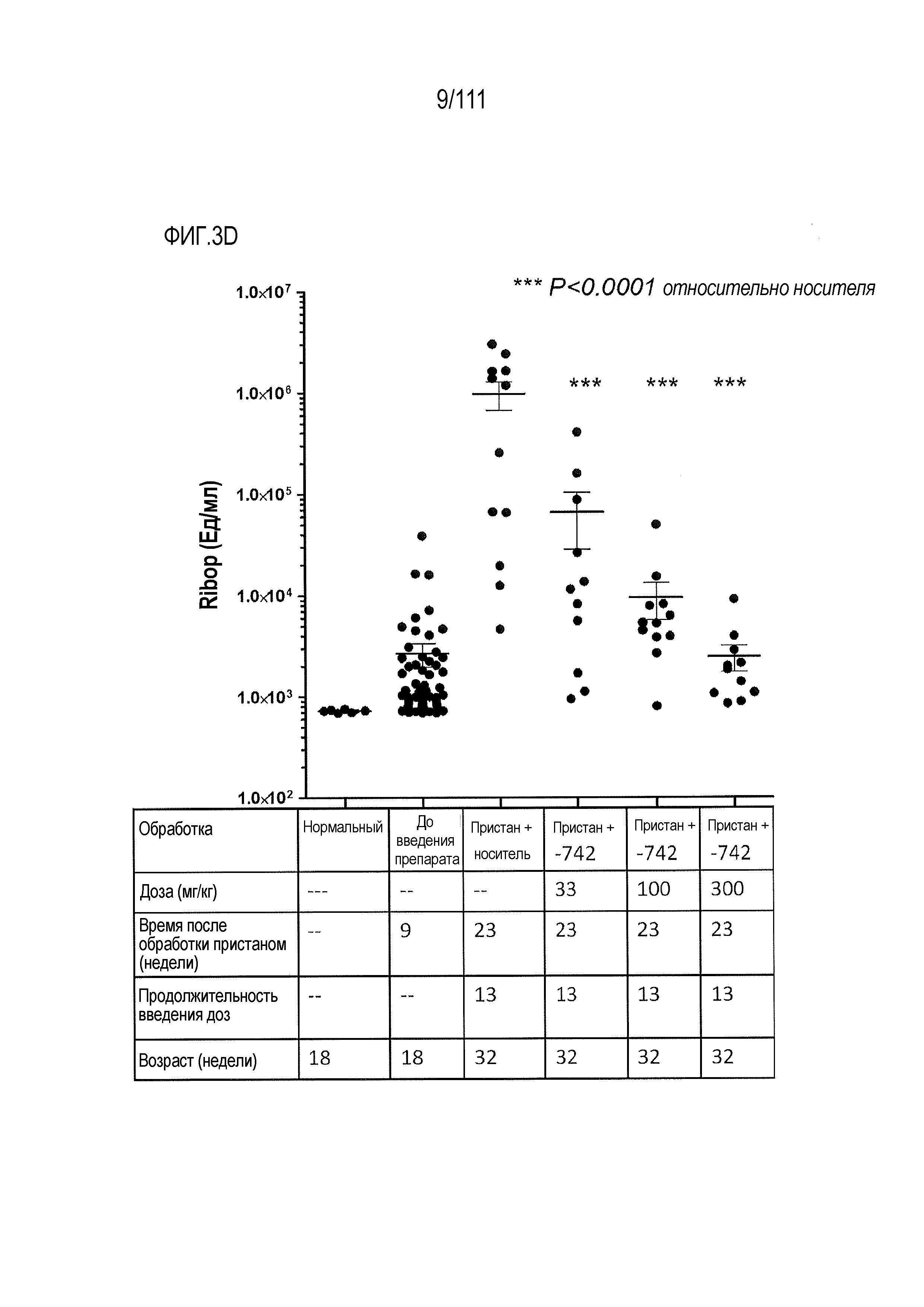
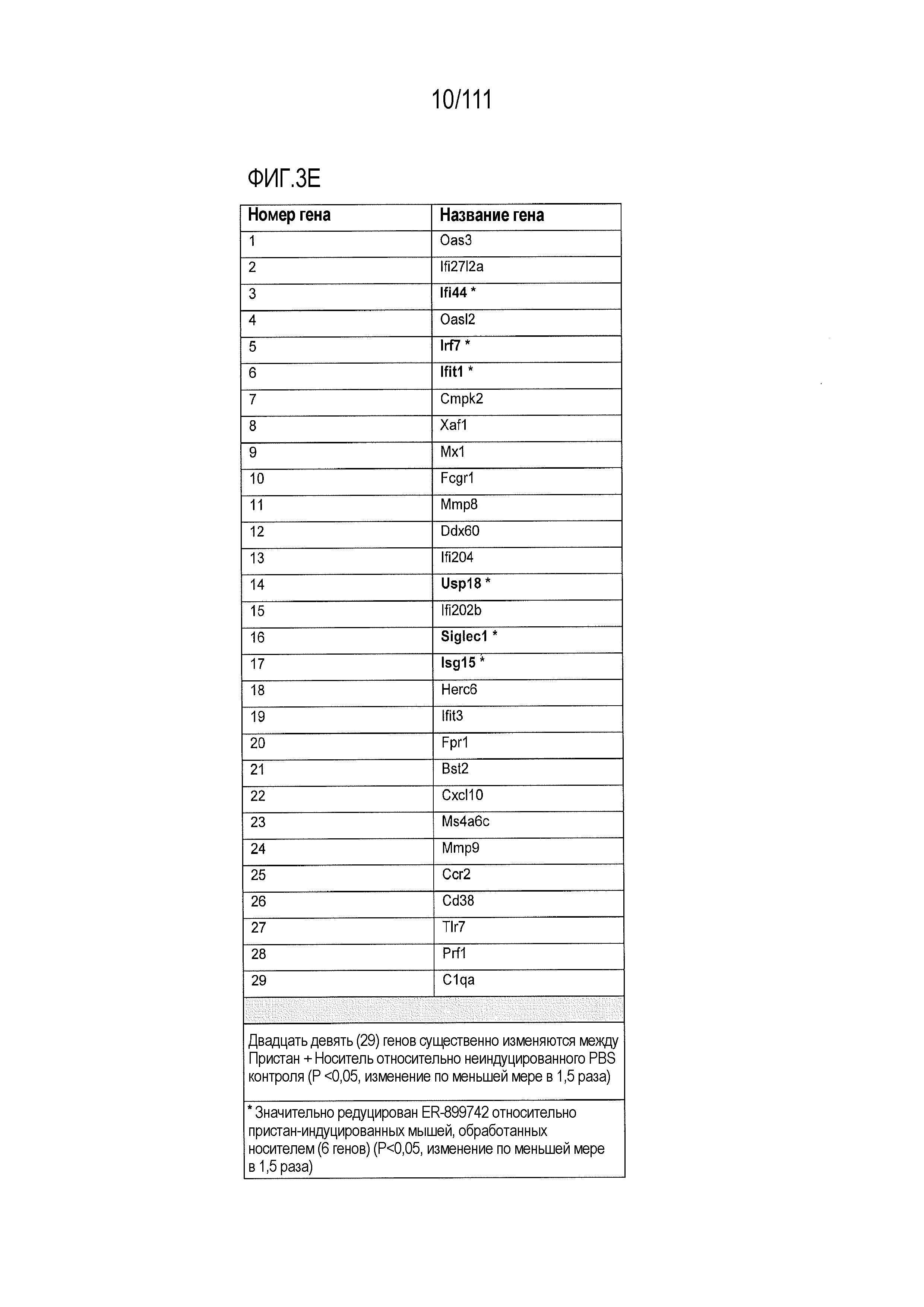
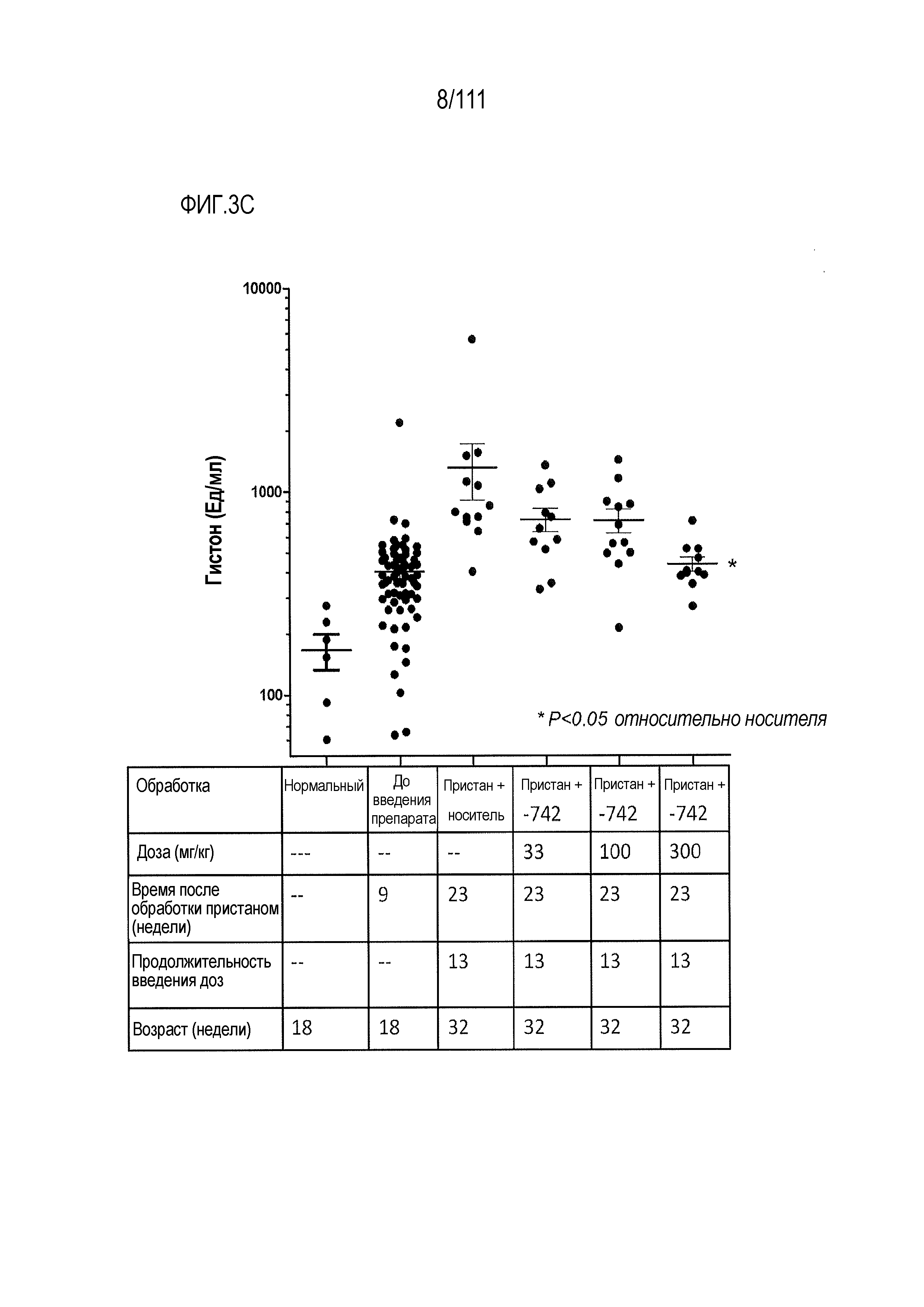
[0038] На фиг.3А-фиг.3E показаны результаты исследования соединения ER-899742 на модели заболевания пристан: DBA/1 штамм волчанки. Пояснения к фигурам: самкам мышей DBA/1 9-недельного возраста внутрибрюшинно инъецировали 0,5 мл пристана или PBS. На 9 неделе после обработки пристаном у животных отбирали кровь для титров аутоантител. Через 10 недель после инъекции пристаном начинали пероральное один раз в день введение носителя (Veh; 0,5% метилцеллюлоза) или ER-899742 в дозе 33 мг/кг, 100 мг/кг или 300 мг/кг и продолжали в течение 13 недель лечения. Через 13 недель обработки соединением мышей умерщвляли, и в образцах плазмы крови измеряли титры анти-дцДНК (фиг.3А), анти-Sm/яРНП (фиг.3B), анти-гистон (фиг.3C) и анти-RiboP (фиг.3D) методом ELISA (статистическая значимость обработки по сравнению с носителем, определяемая методом ANOVA с послетестовым критерием Даннетта). (Фиг.3Е) Через 13 недель обработки ER-899742 в дозе 300 мг/кг измеряли экспрессию IFN-регулируемых генов в цельной крови с помощью набора кПЦР, и вычисляли показатель профиля экспрессии гена IFN (смотри более подробно раздел Фармакологические материалы и способы, относящийся к вычислению показателя IFN). В таблице представлен полный перечень генов, значительно активированных обработкой пристаном по сравнению с контролями PBS. При вычислении показателей интерферона не наблюдали существенных различий между обработанными и обработанными носителем животными. Однако шесть генов были значительно редуцированы при обработке соединением по сравнению с обработкой носителем (t-критерий Стьюдента) и указаны в таблице.
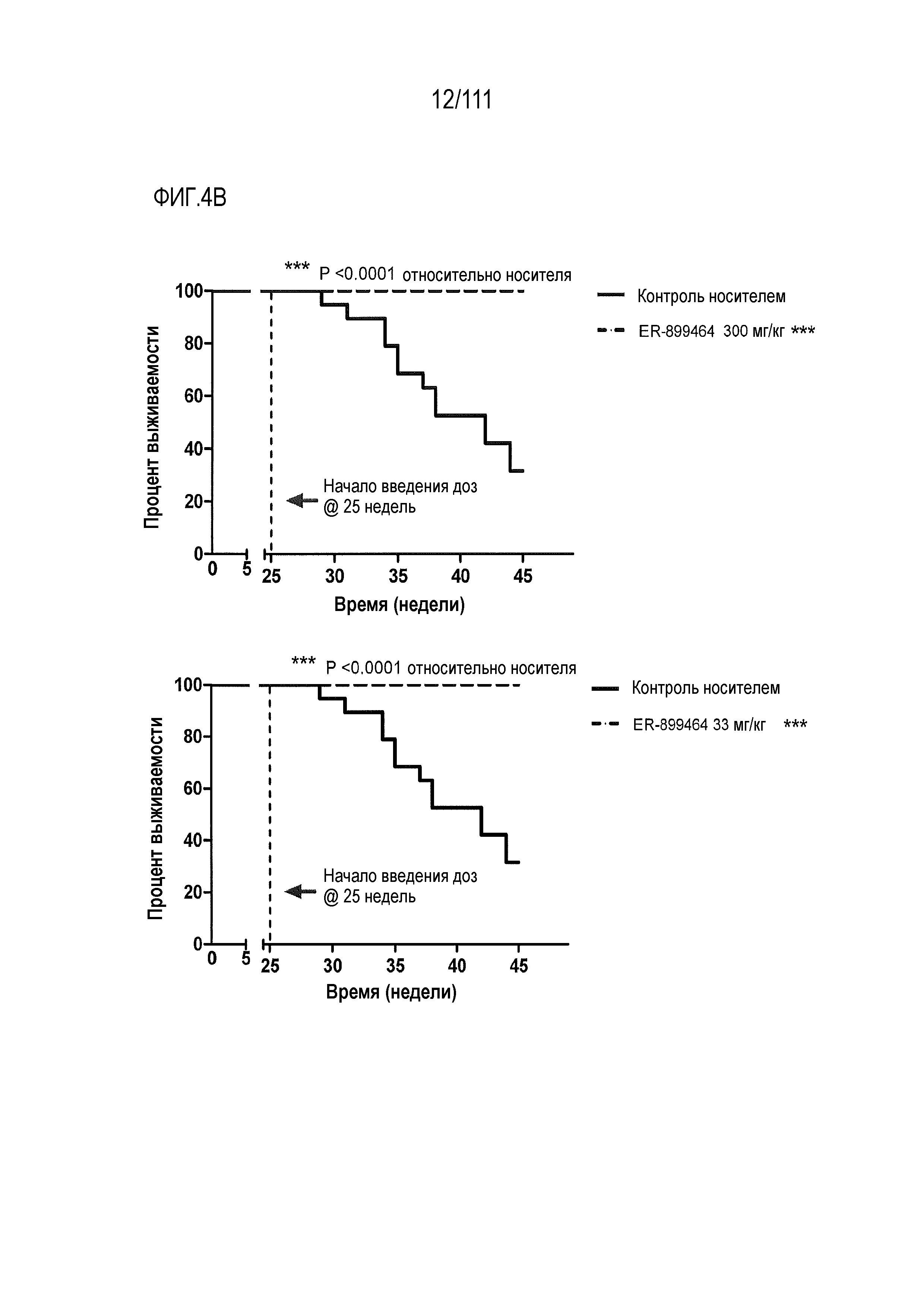
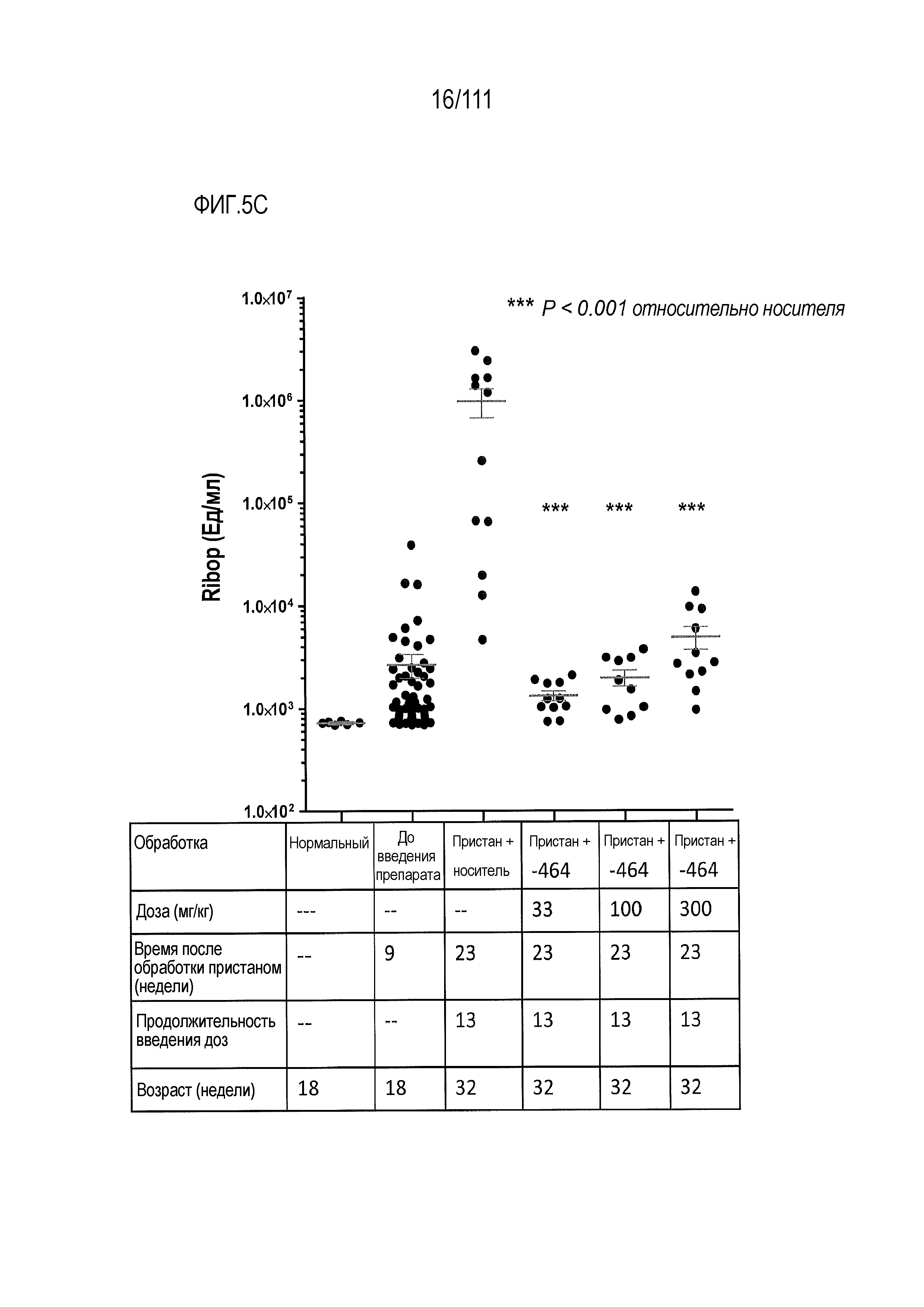
[0039] На фиг.4А-фиг.4C показаны результаты исследования ER-899464 на модели заболевания NZB/W в аналогичном эксперименте, как показано на фиг.2A. Пояснения к фигурам: (Фиг.4A) Незадолго до достижения 50-недельного возраста (через 21 неделю обработки) у отдельных мышей собирали мочу, и для каждого животного определяли соотношение альбумин/креатинин в моче (UACR, протеинурия) в качестве косвенного показателя функции почек. (Фиг.4B) В этом исследовании наблюдали динамику смертности для групп, обработанных самой высокой и самой низкой дозой. В группе, обработанной средней дозой (не показано), смертность не наблюдалась. (Фиг.5С) Влияние обработки на анти-дцДНК титры через 17 недель введения препарата, в возрасте 46-ти недель. Не наблюдался статистически значимый эффект.
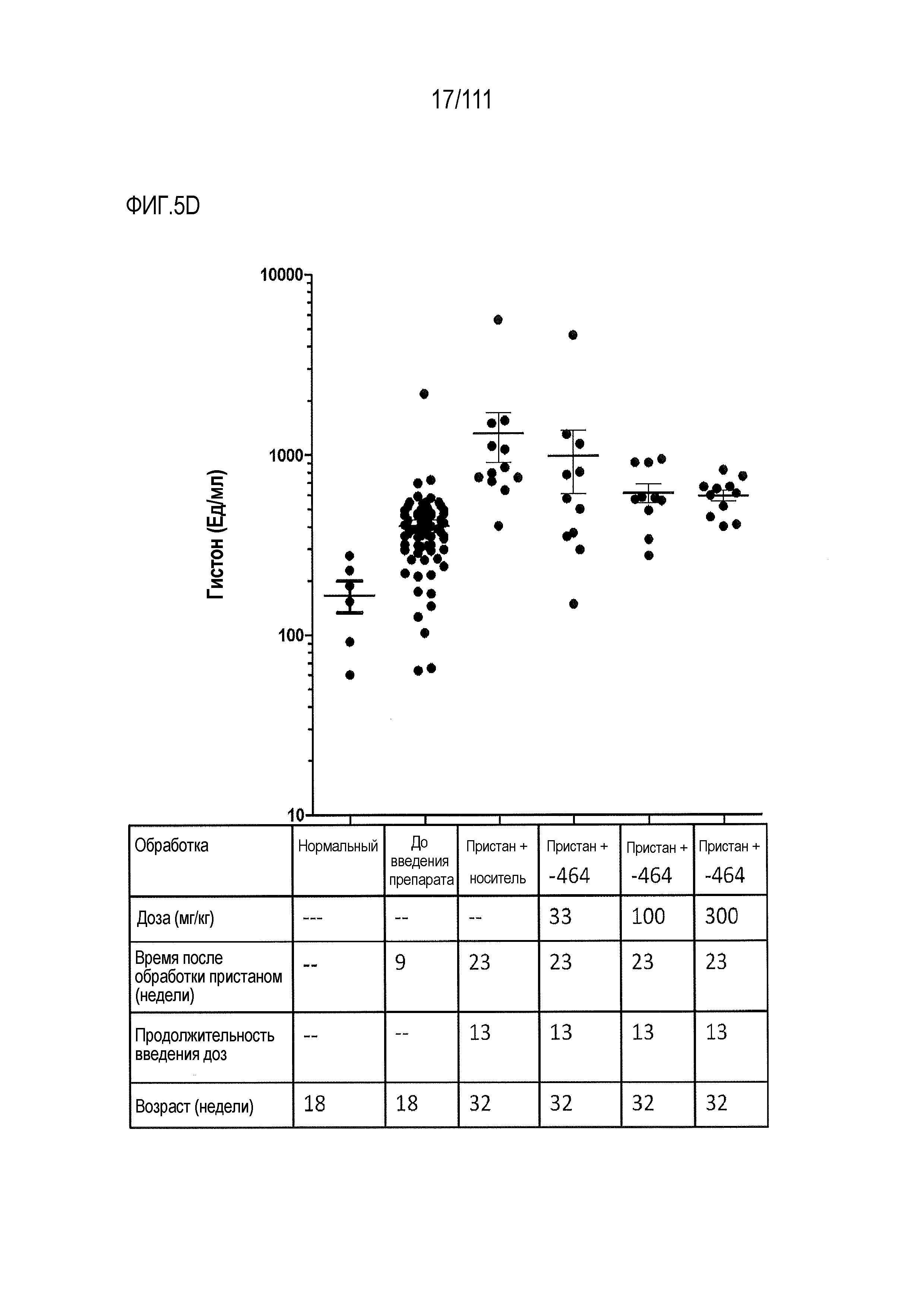
[0040] На фиг.5A-фиг.5D показаны результаты исследования ER-899464 на модели заболевания, вызываемого пристаном, в аналогичном эксперименте, как показано на фиг.3А-фиг.3E. Пояснения к фигурам: Через 13 недель обработки соединением мышей умерщвляли, и в образцах плазмы крови измеряли титры анти-дцДНК (фиг.5А), анти-Sm/яРНП (фиг.5B), анти-гистон (фиг.5C) и анти-RiboP (фиг.5D) методом ELISA (статистическая значимость обработки по сравнению с носителем, определяемая методом ANOVA с послетестовым критерием Даннетта). Как это было выполнено для ER-899742, исследовали интерферон-индуцируемую экспрессию гена, но ни один из активирующих заболевание генов, показанных на фиг.3B, не подвергался воздействию обработкой ER-899464.
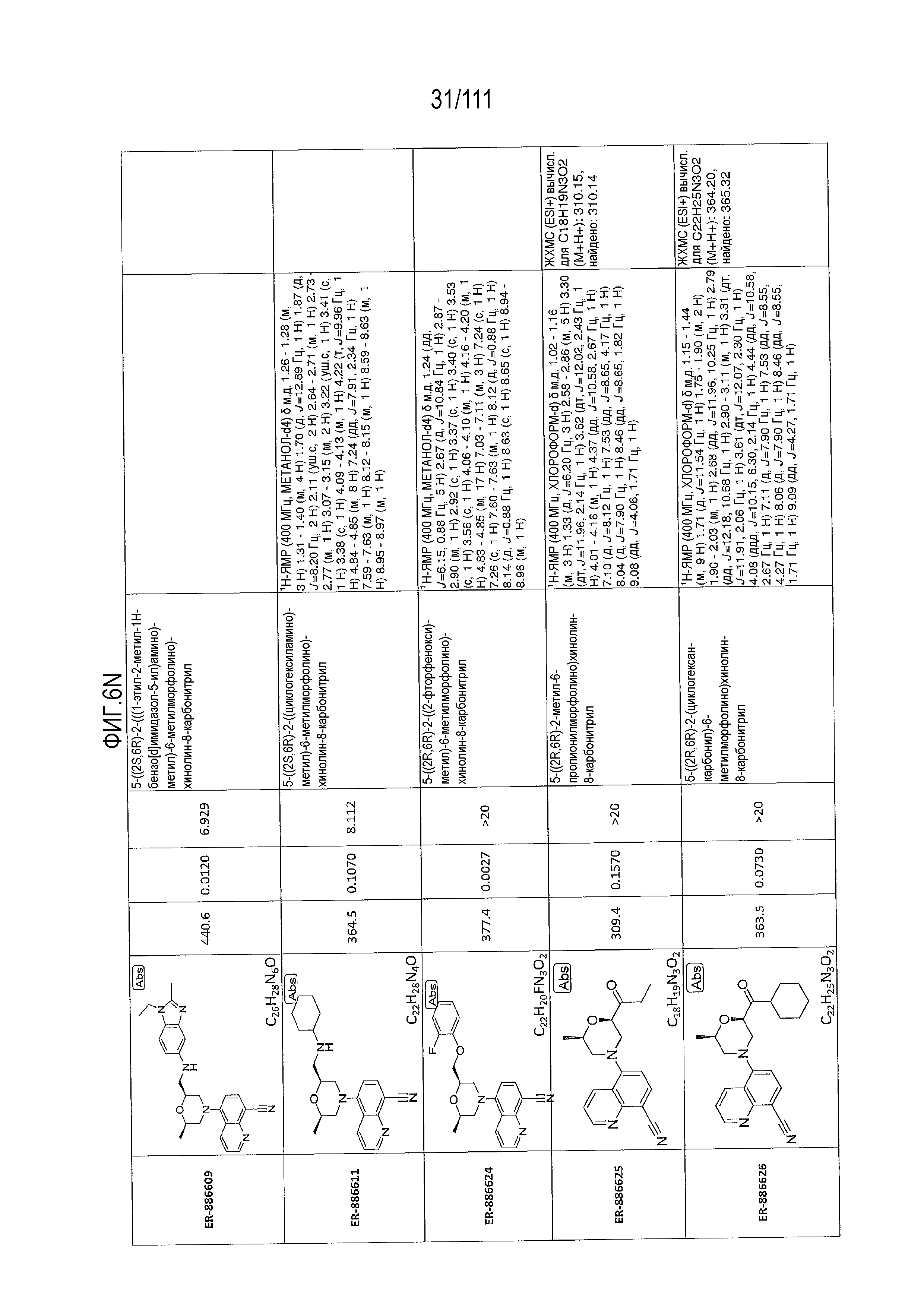
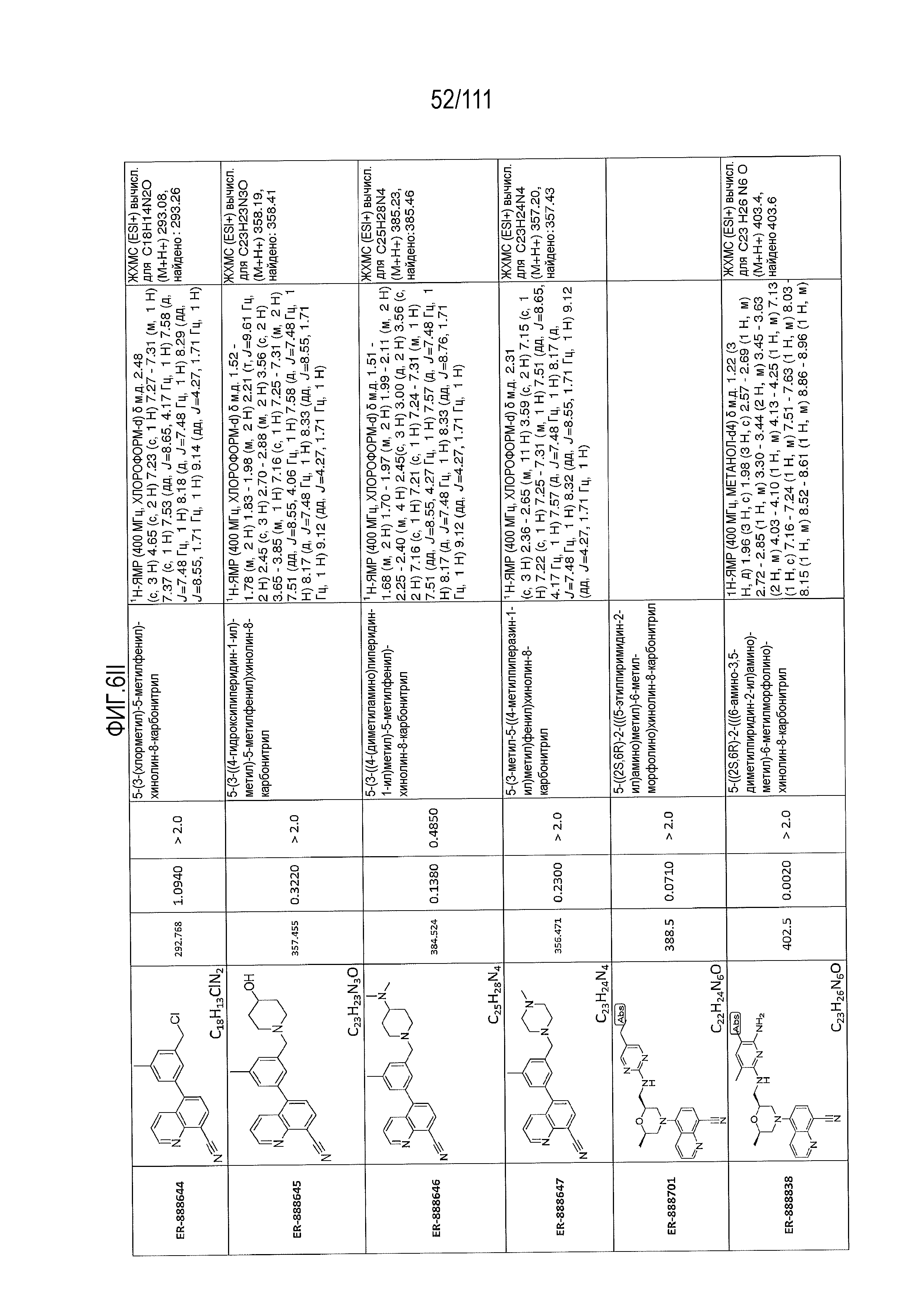
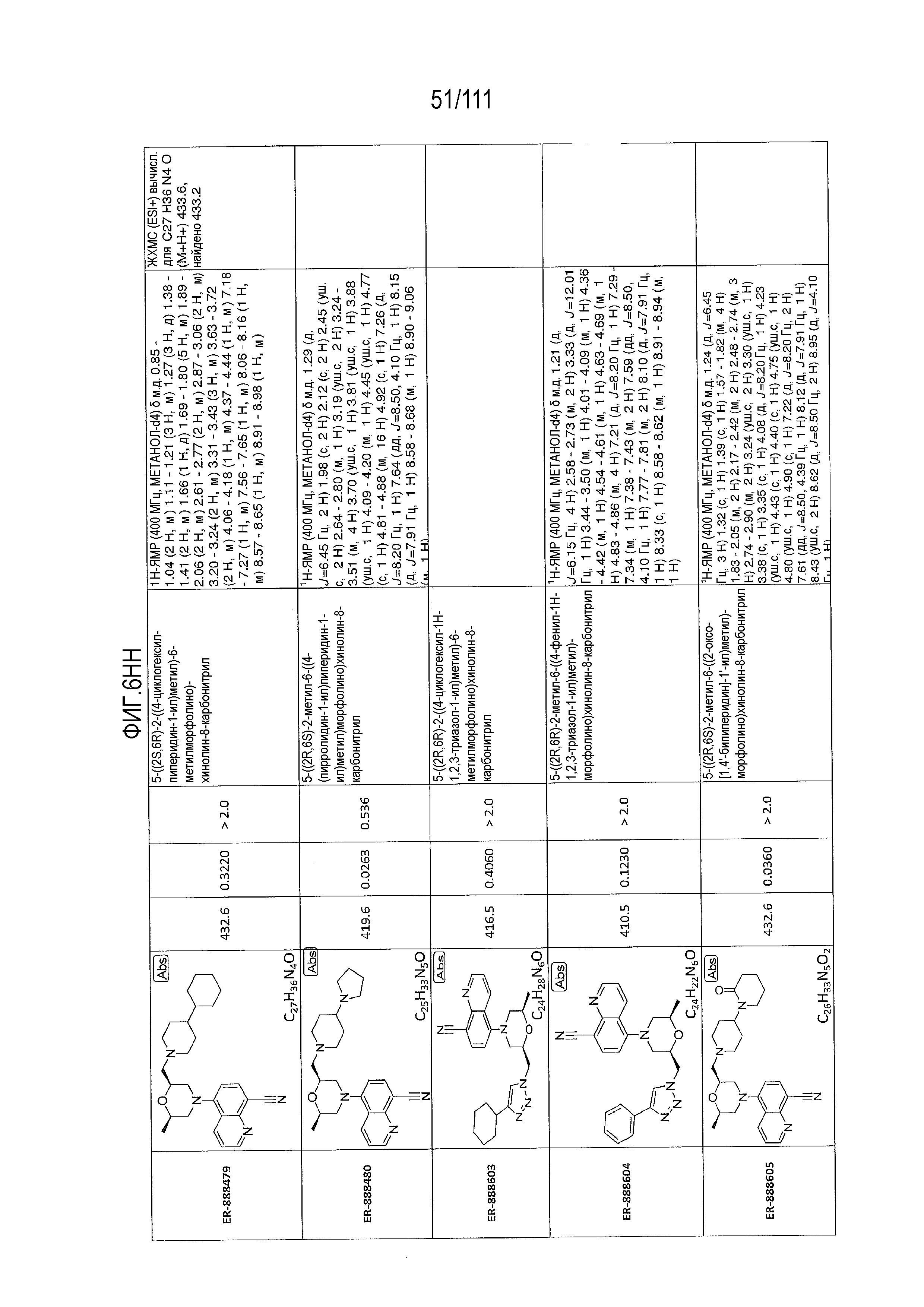
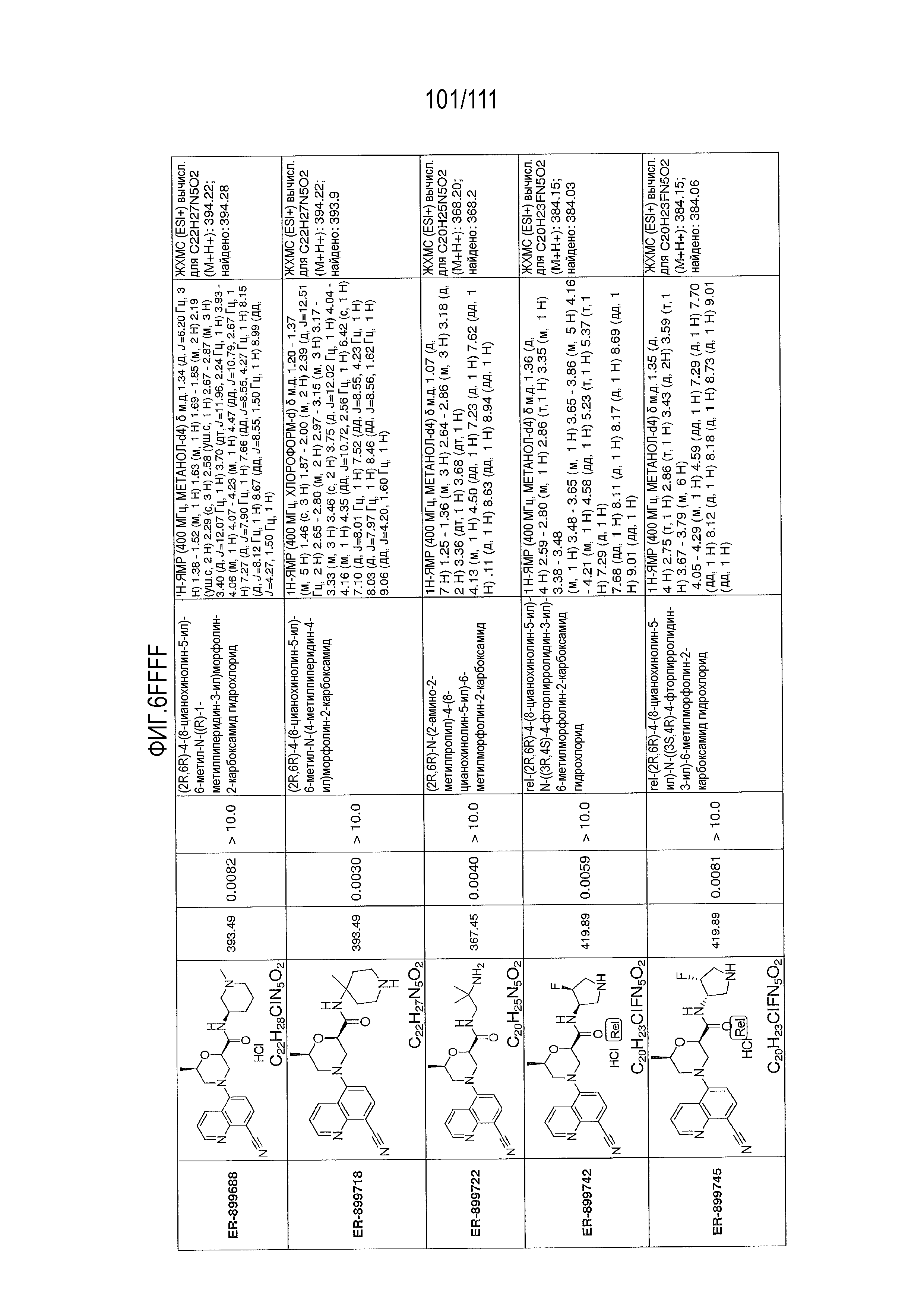
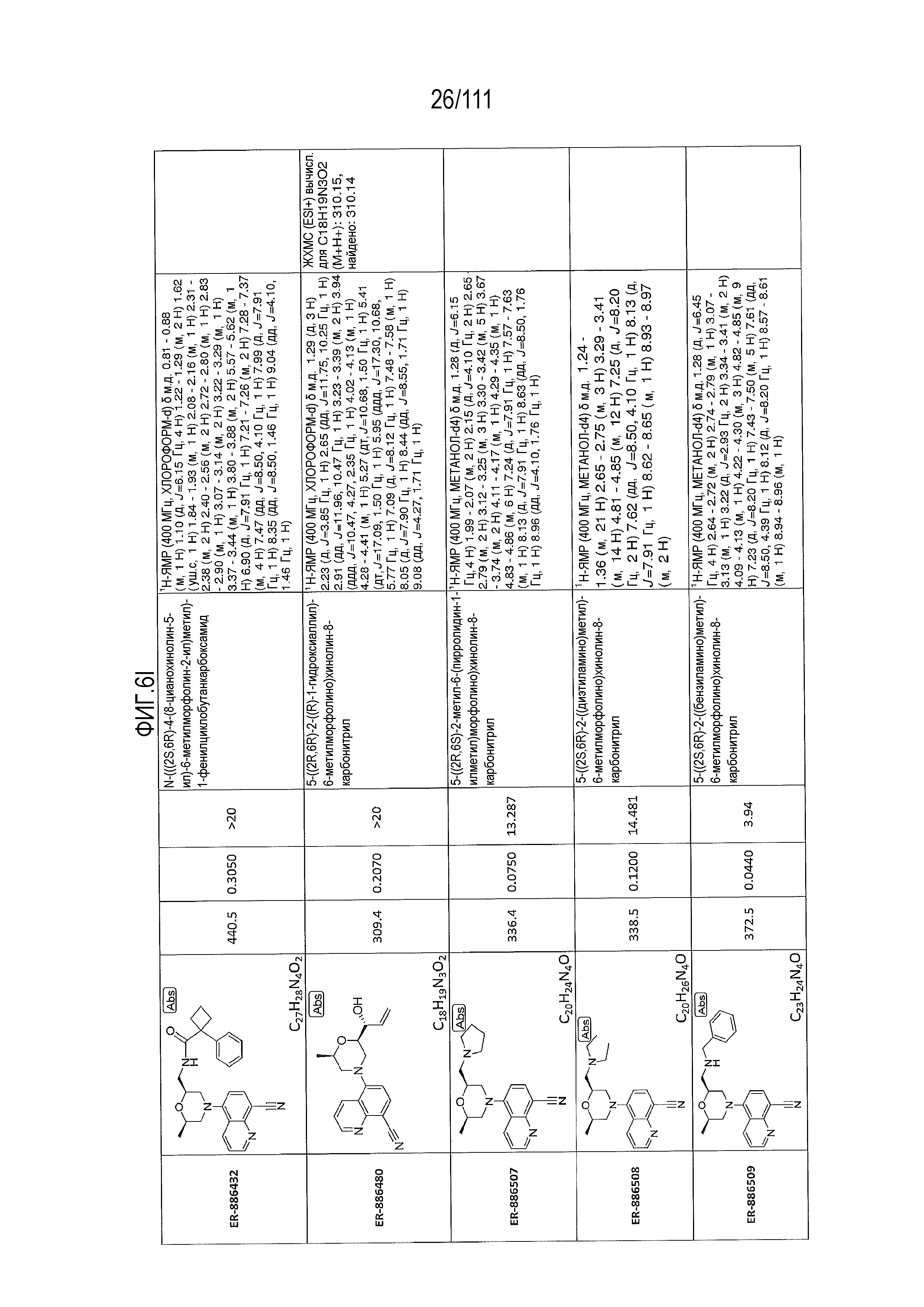
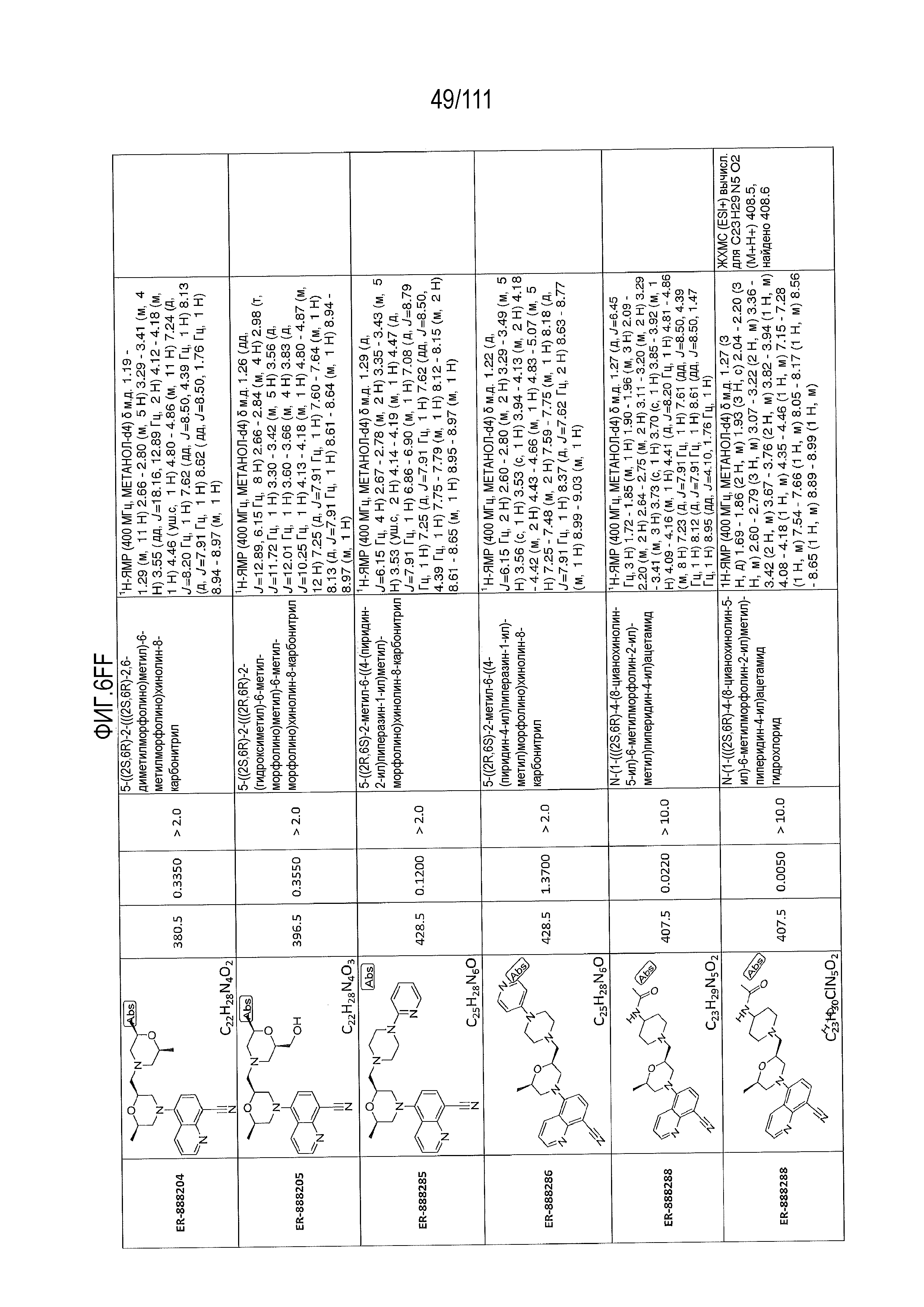
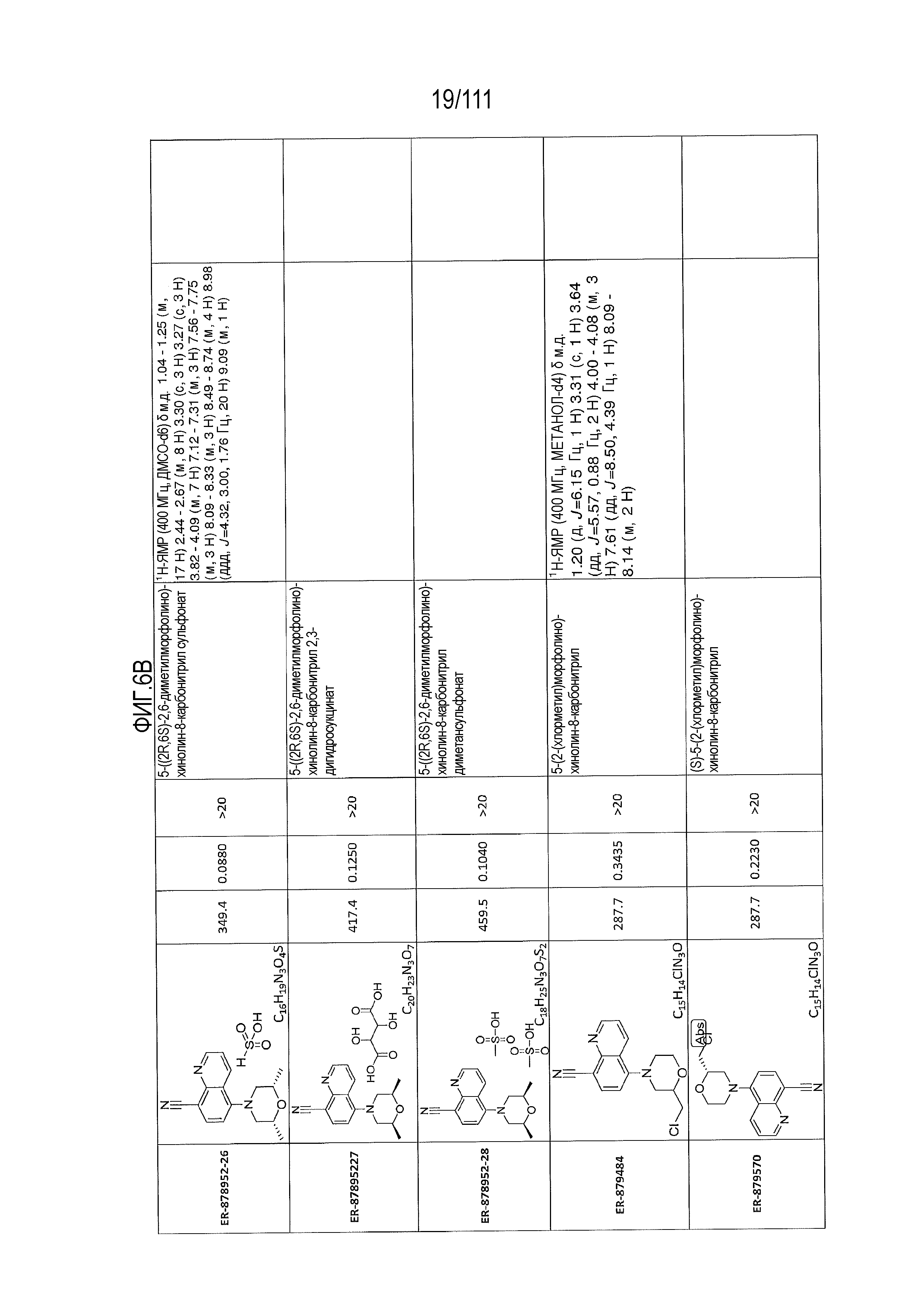
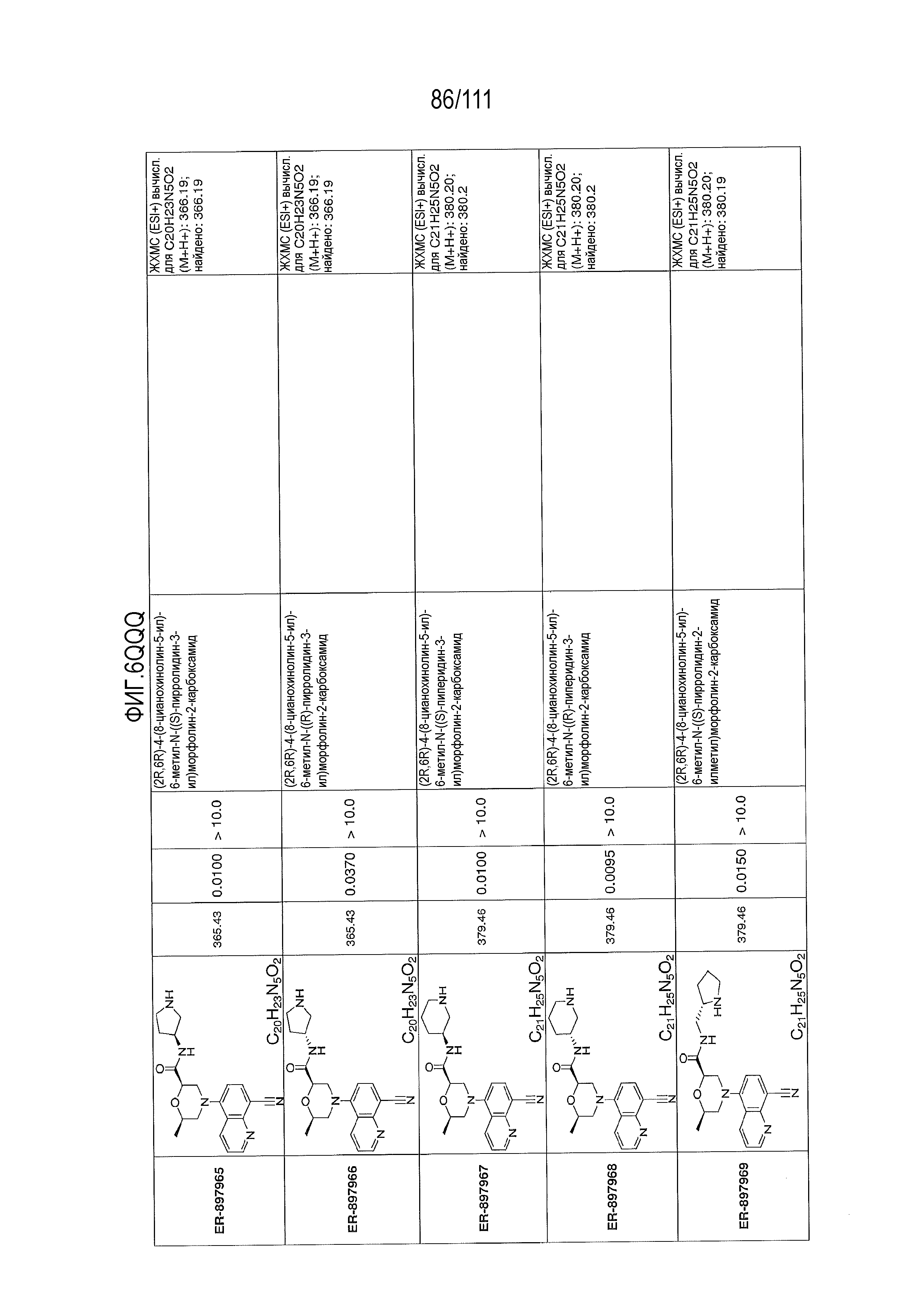
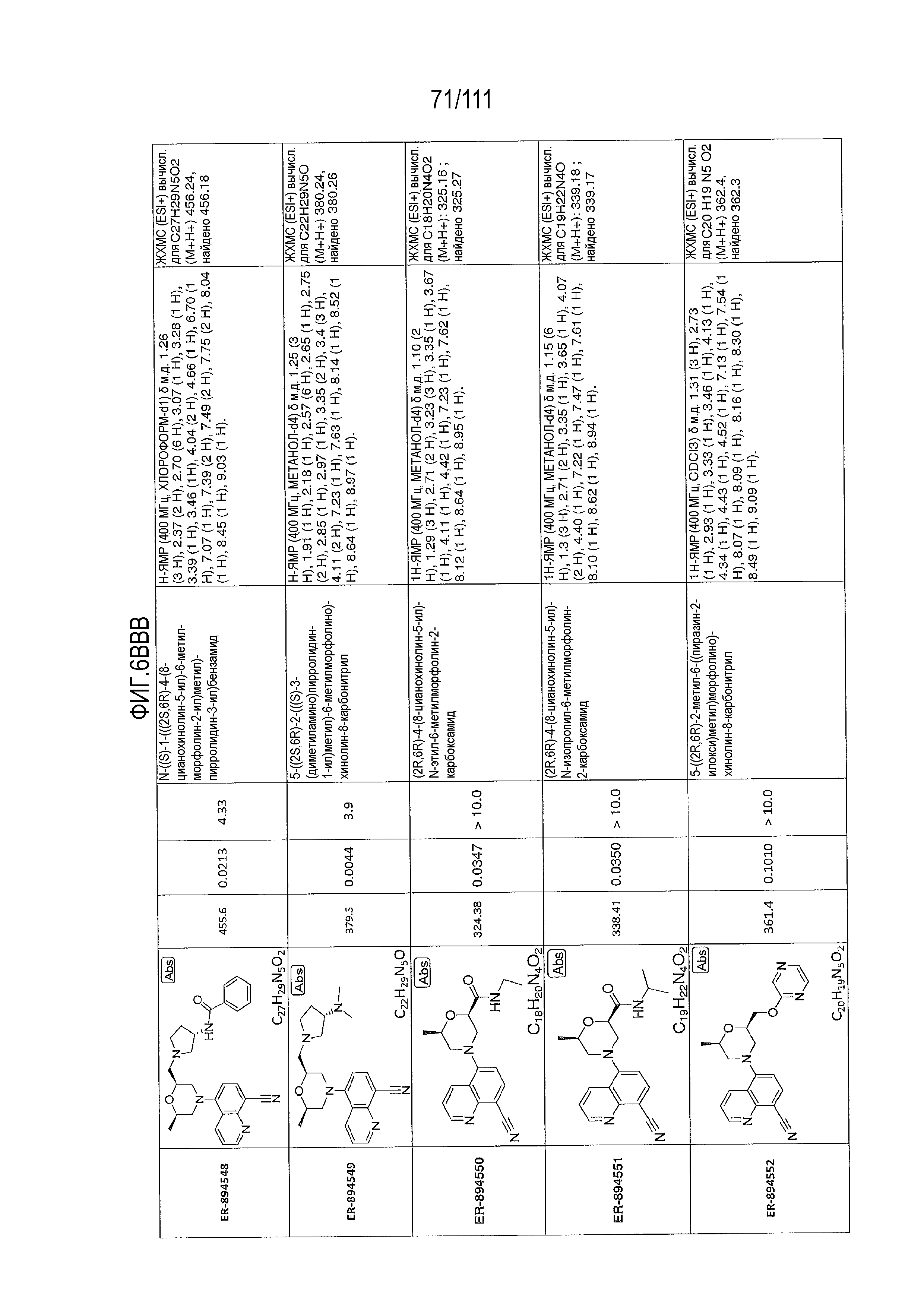
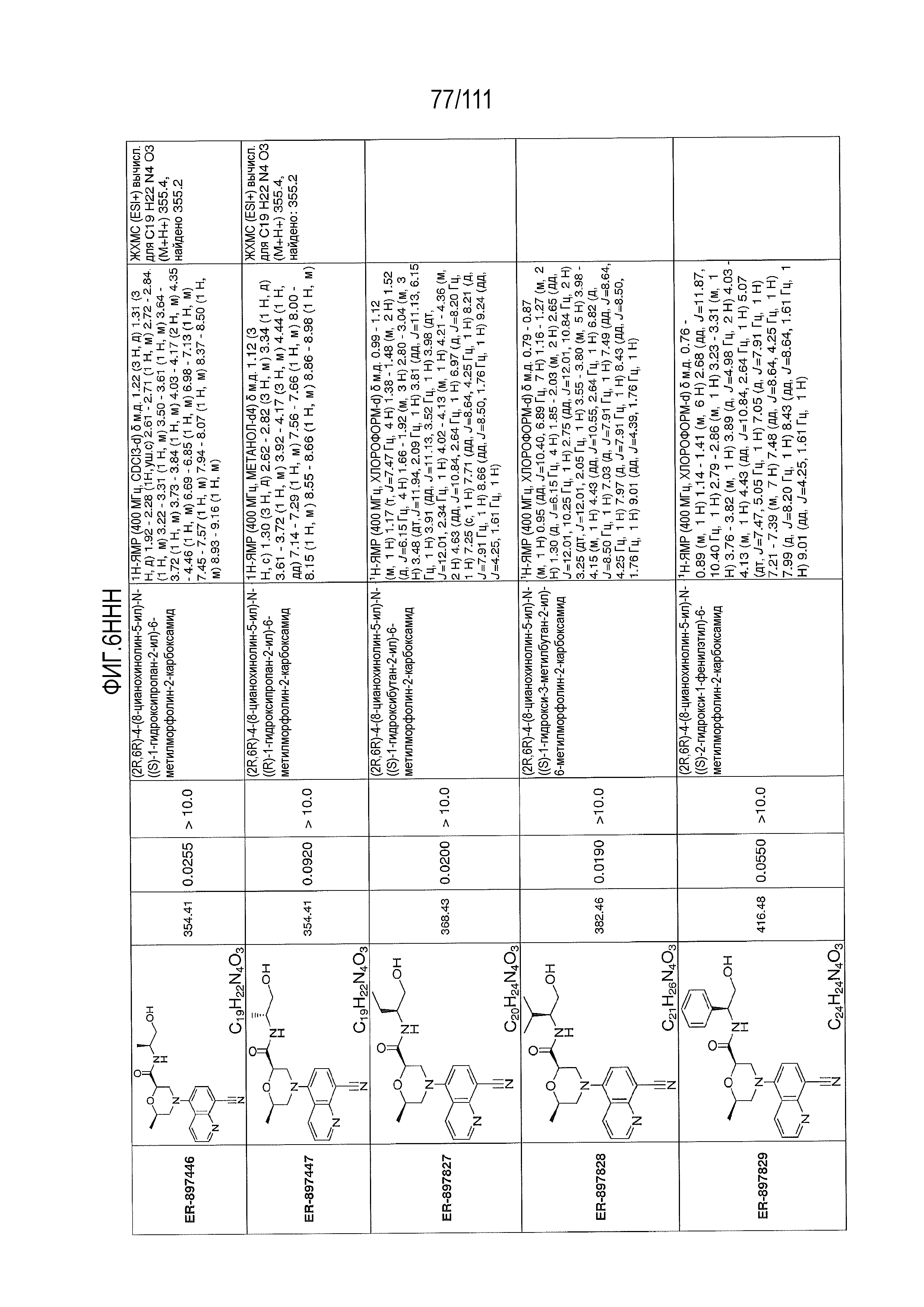
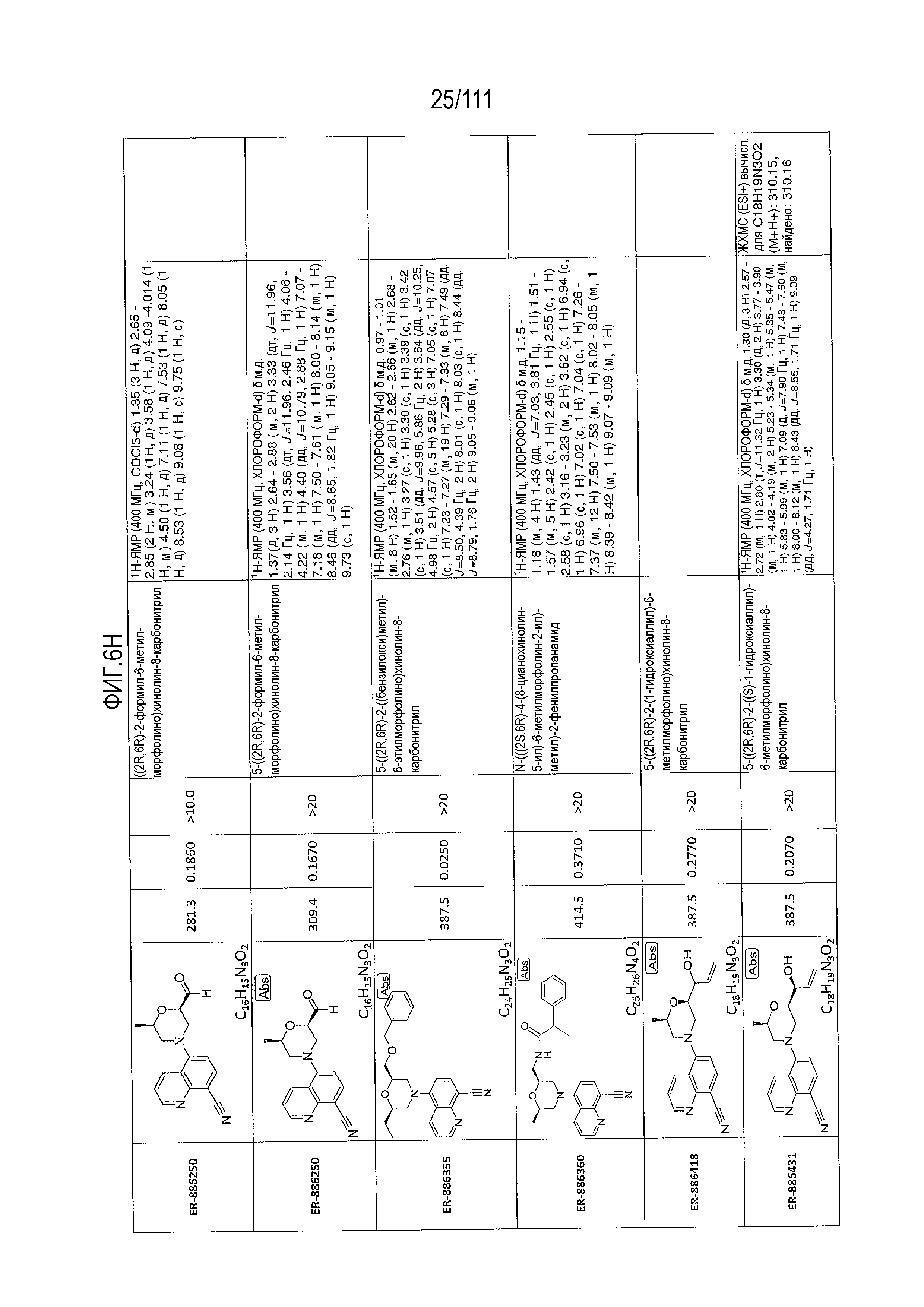
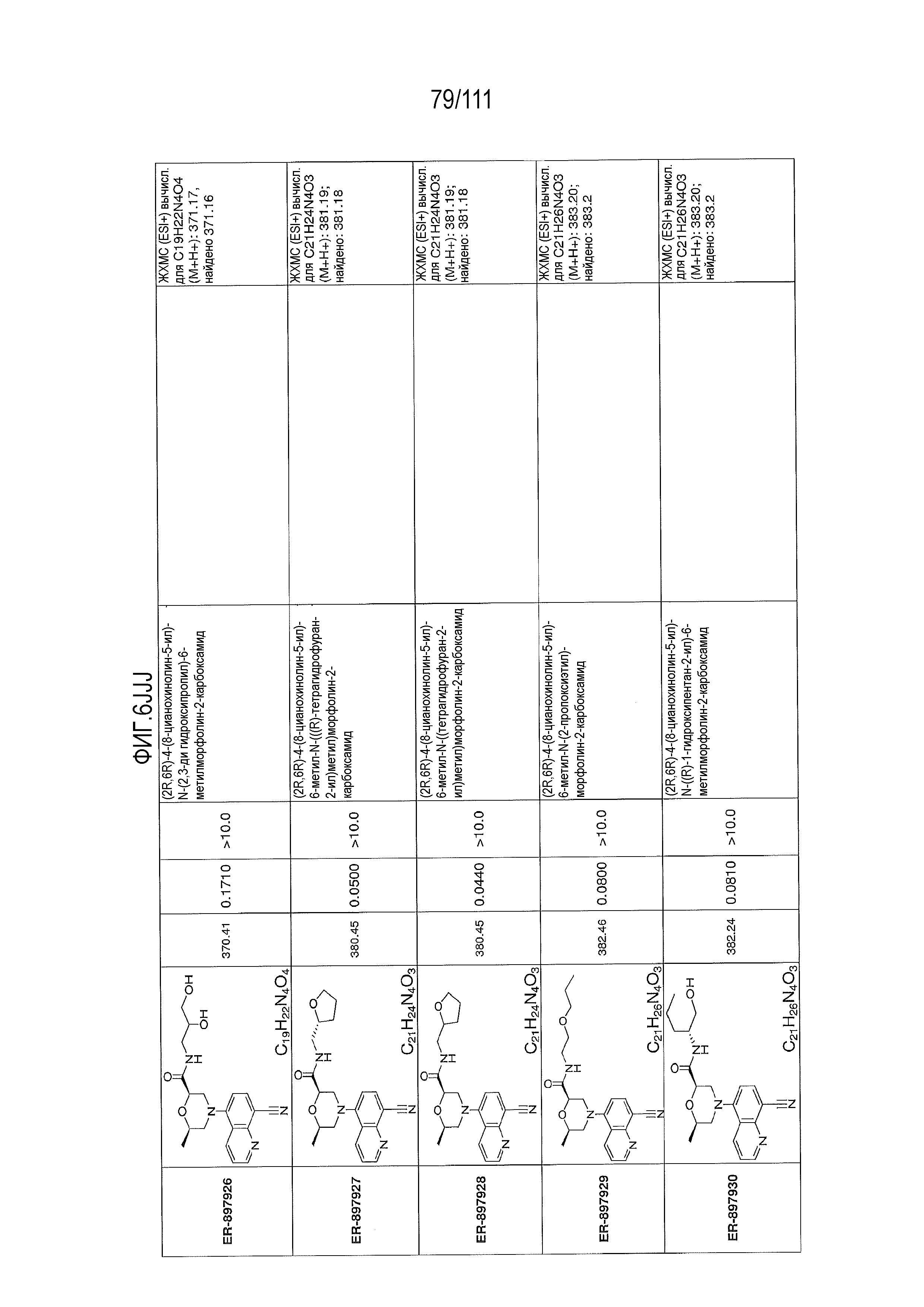
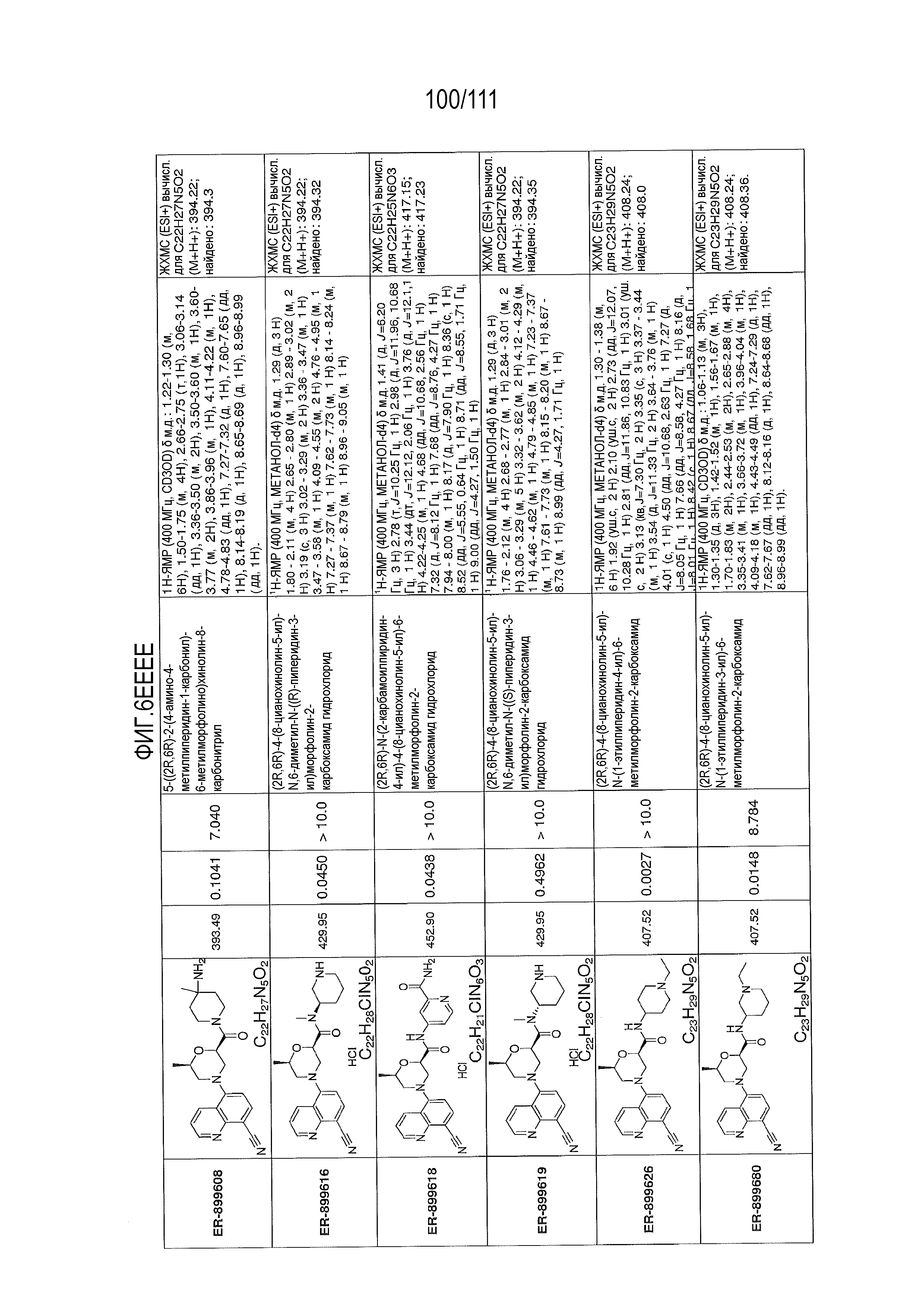
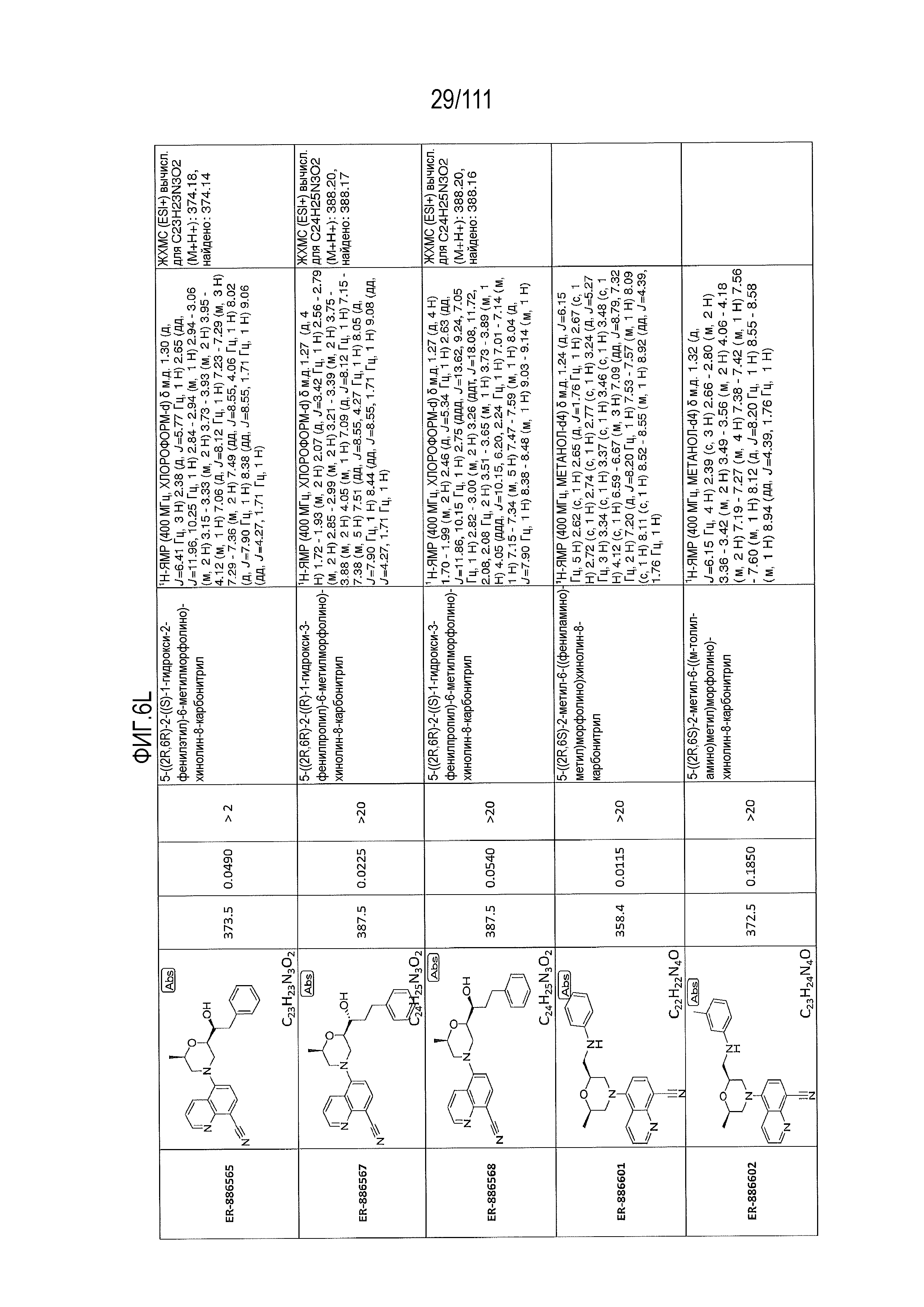
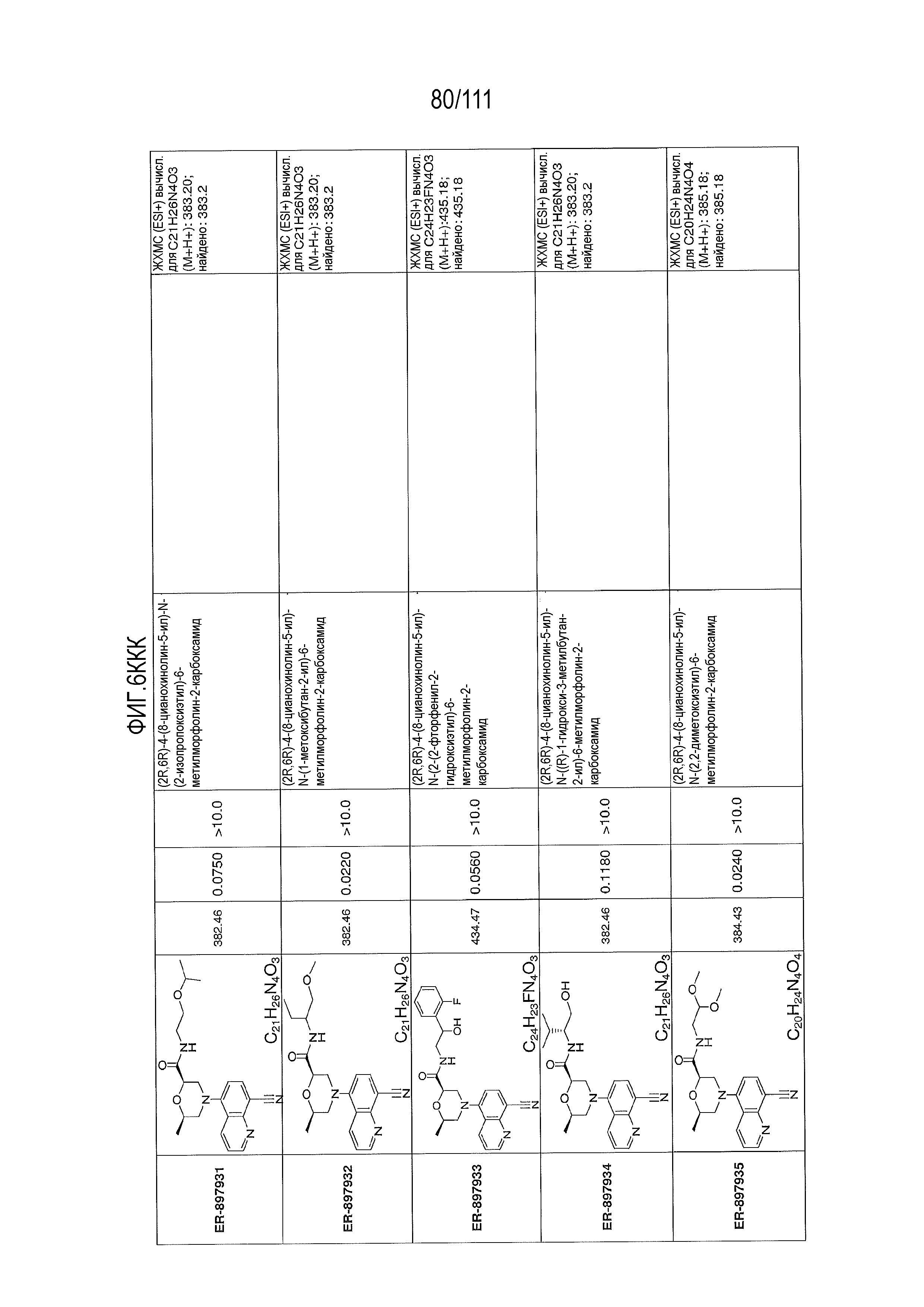
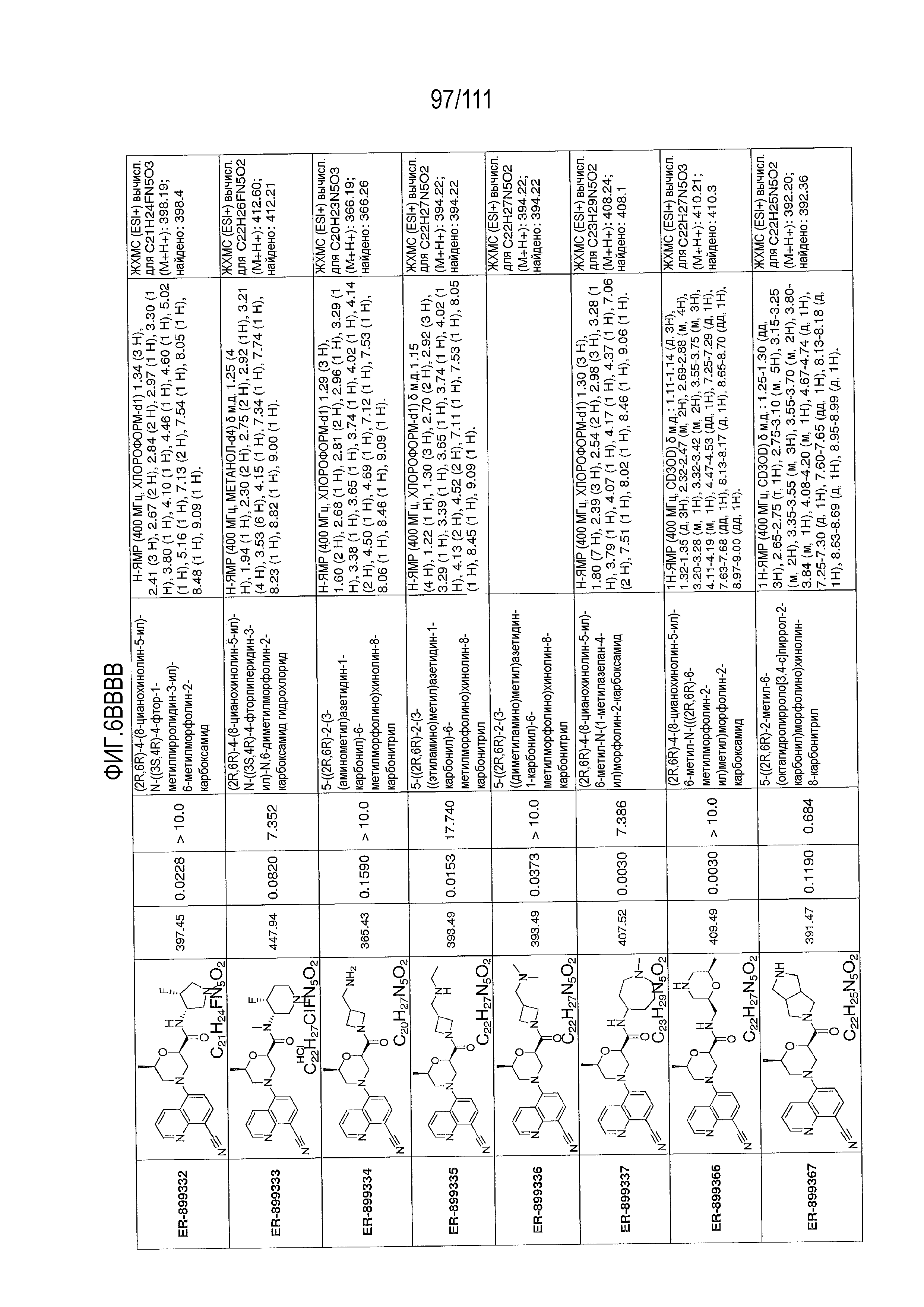
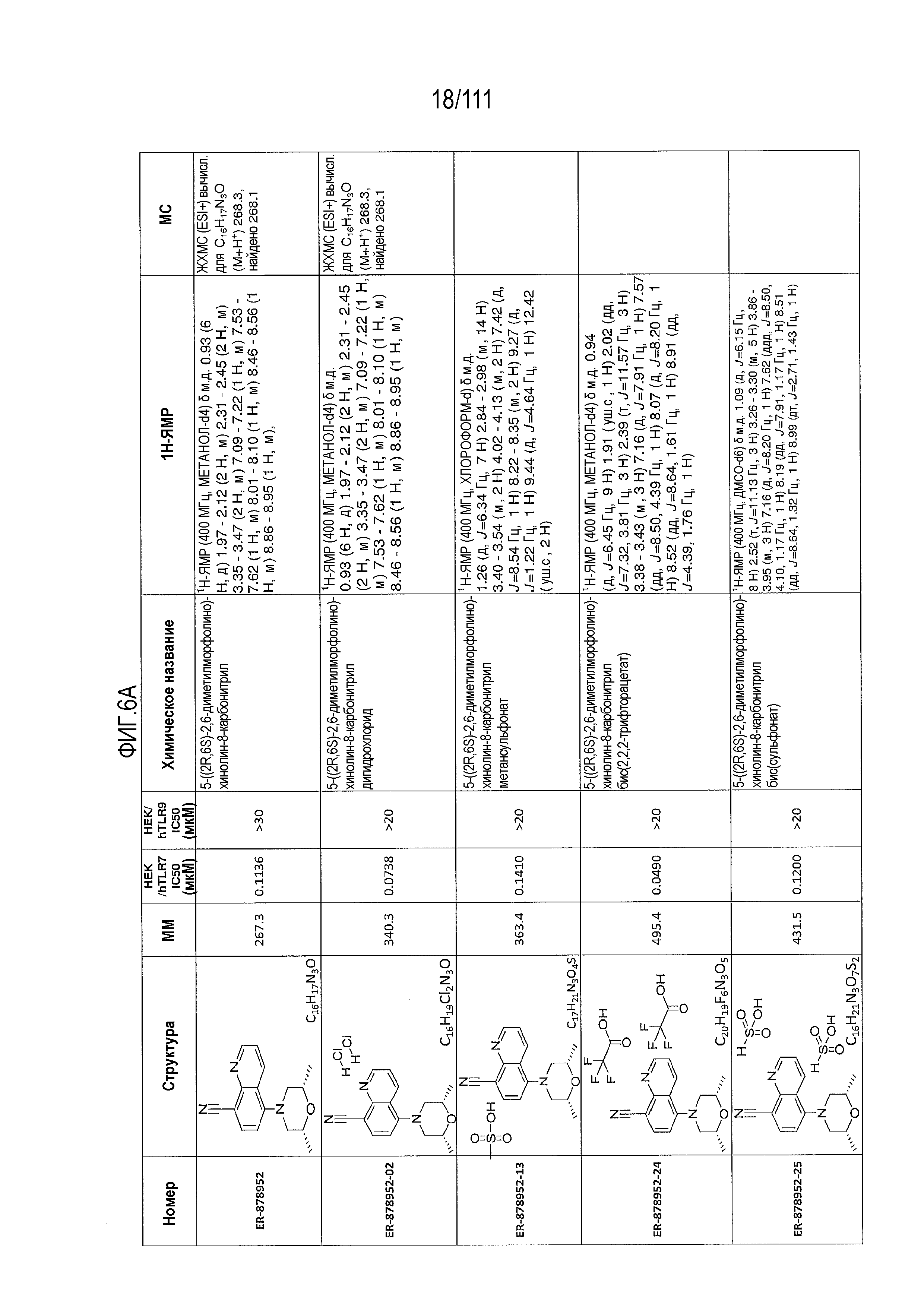
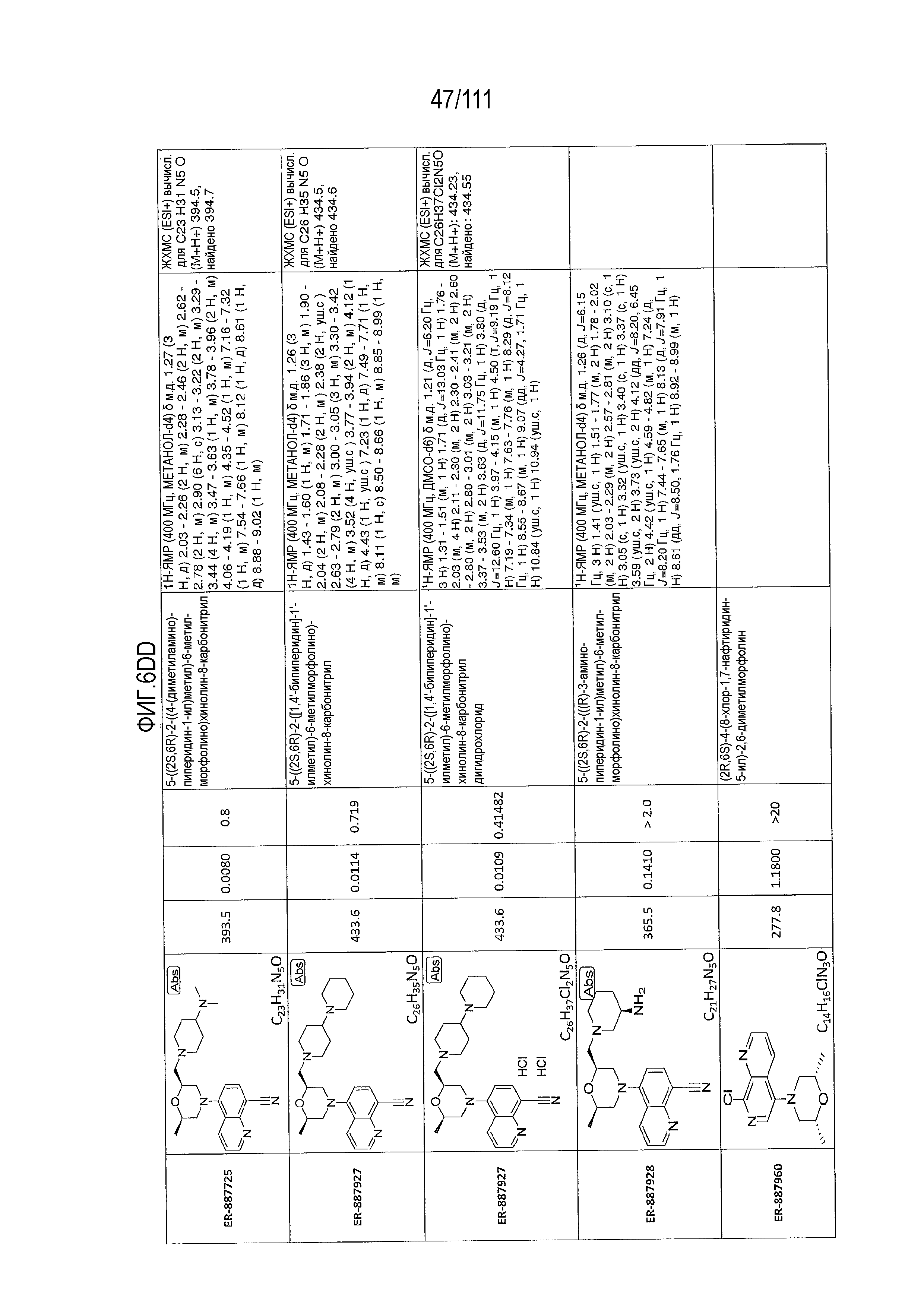
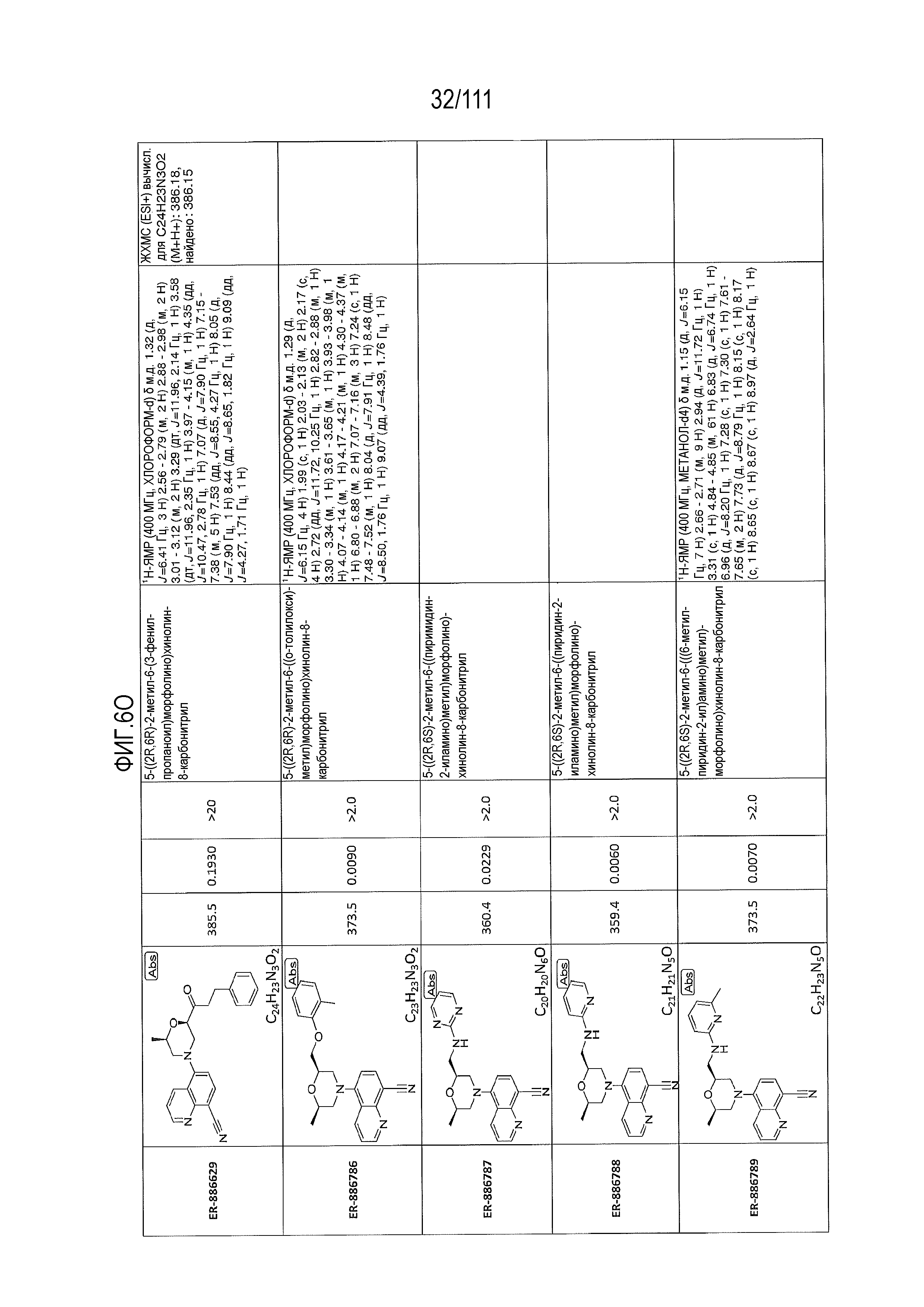
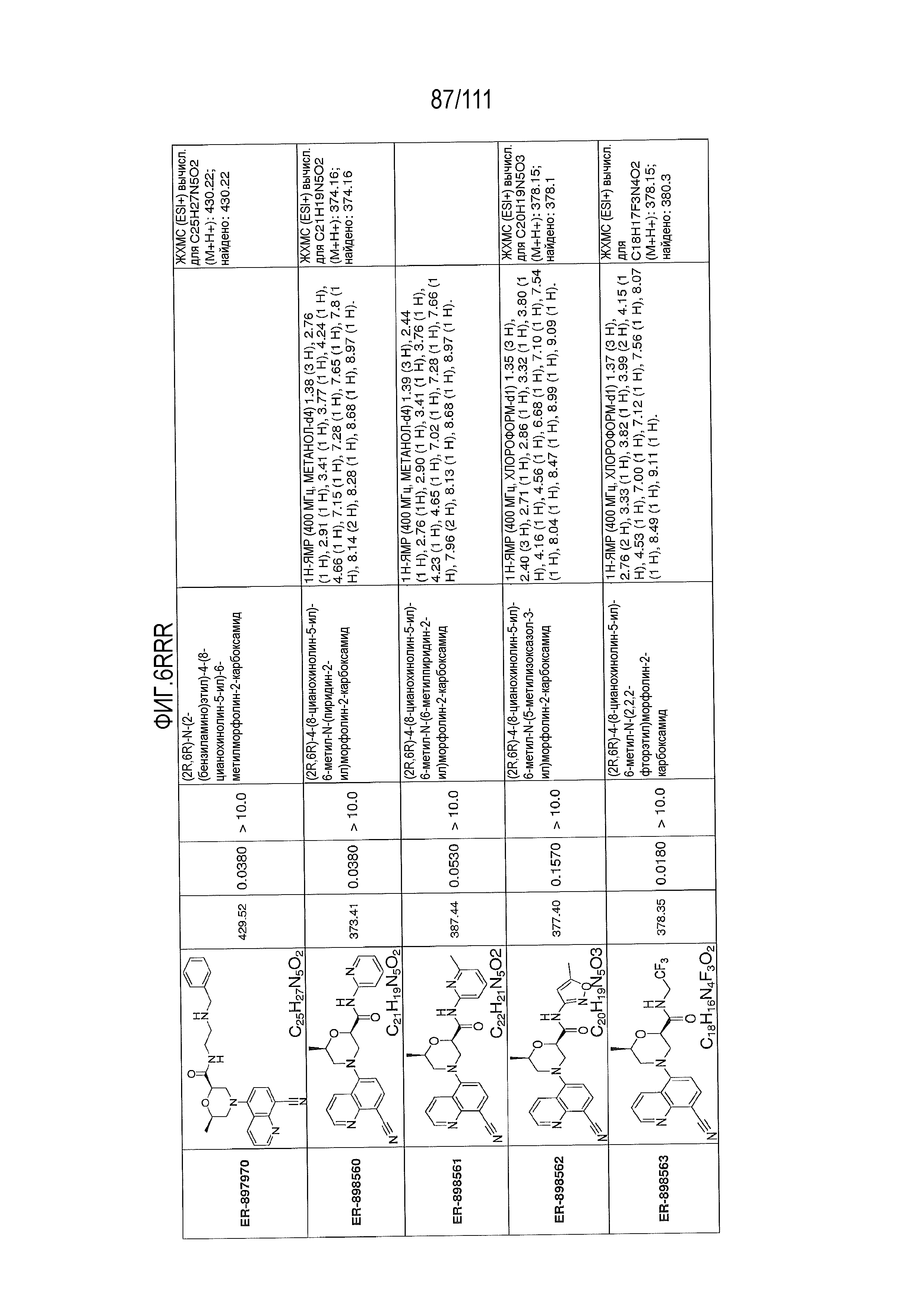
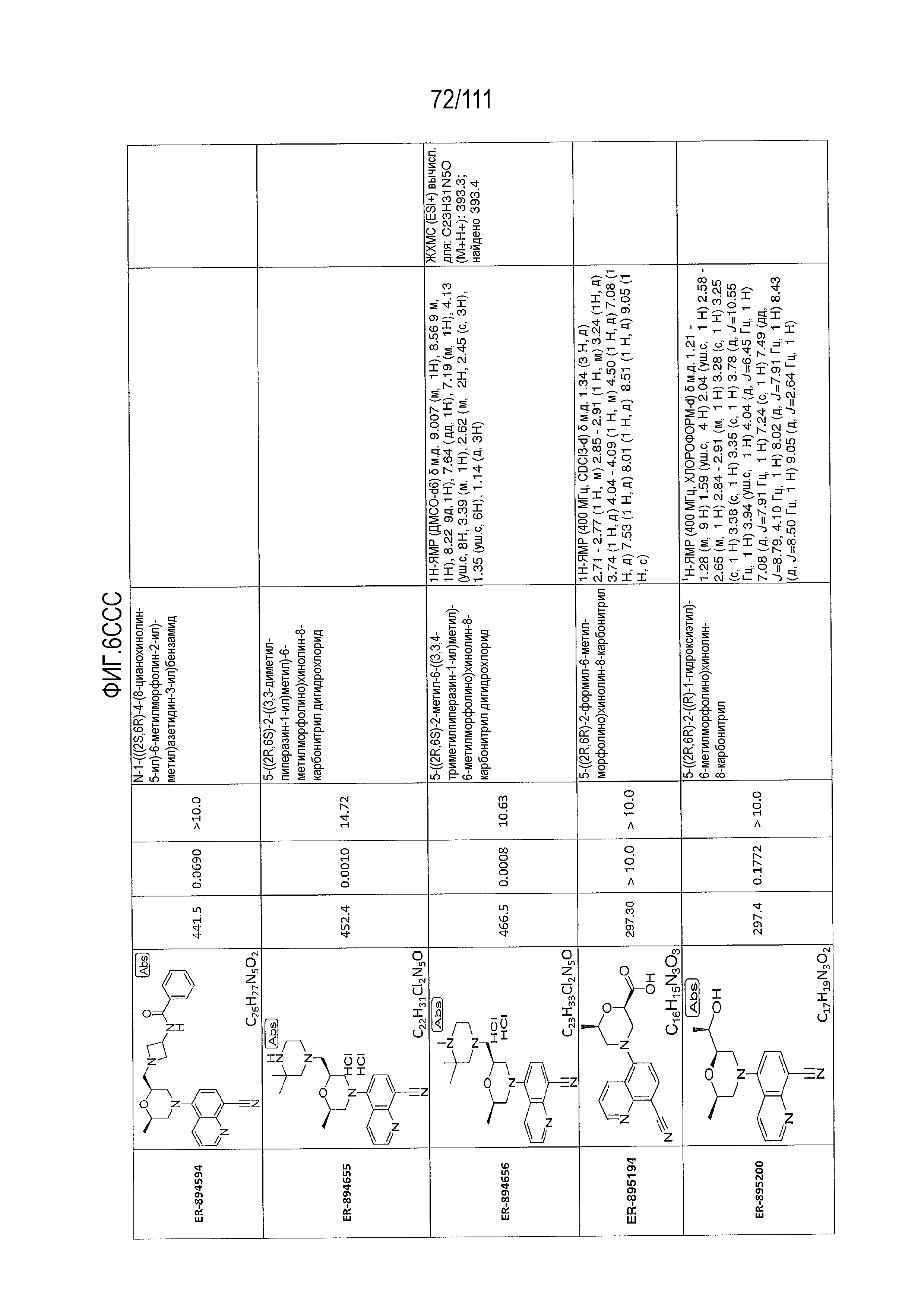
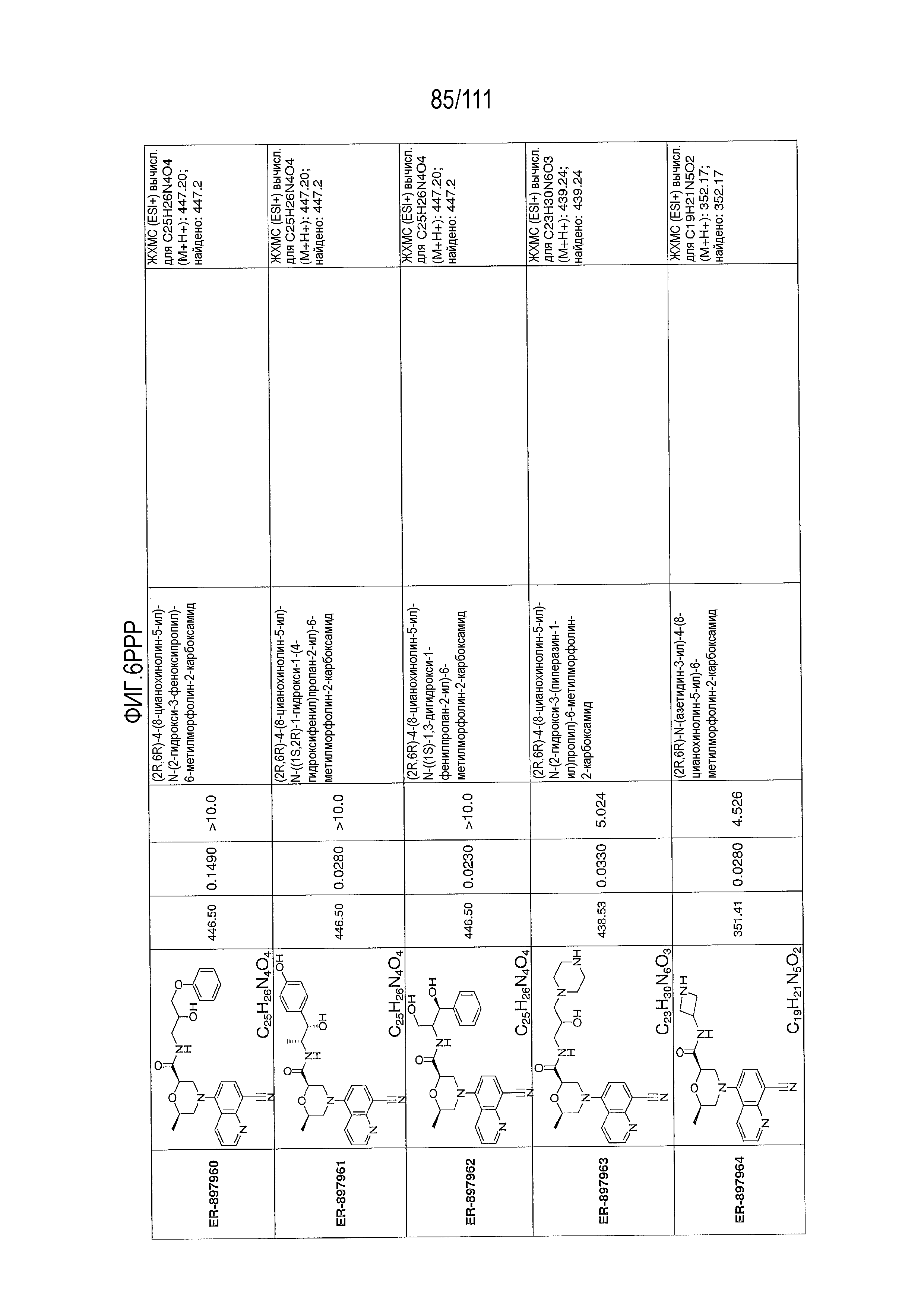
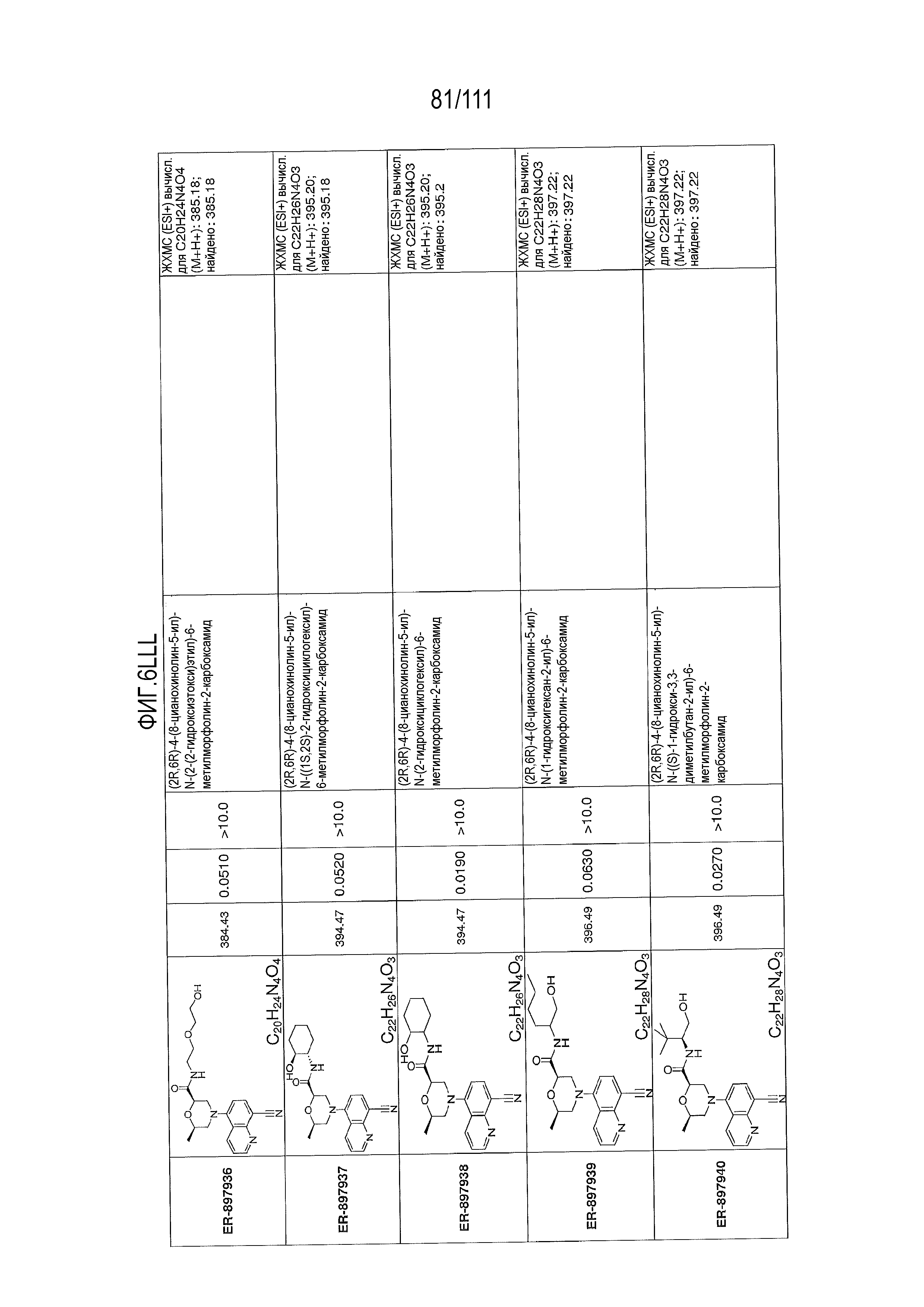
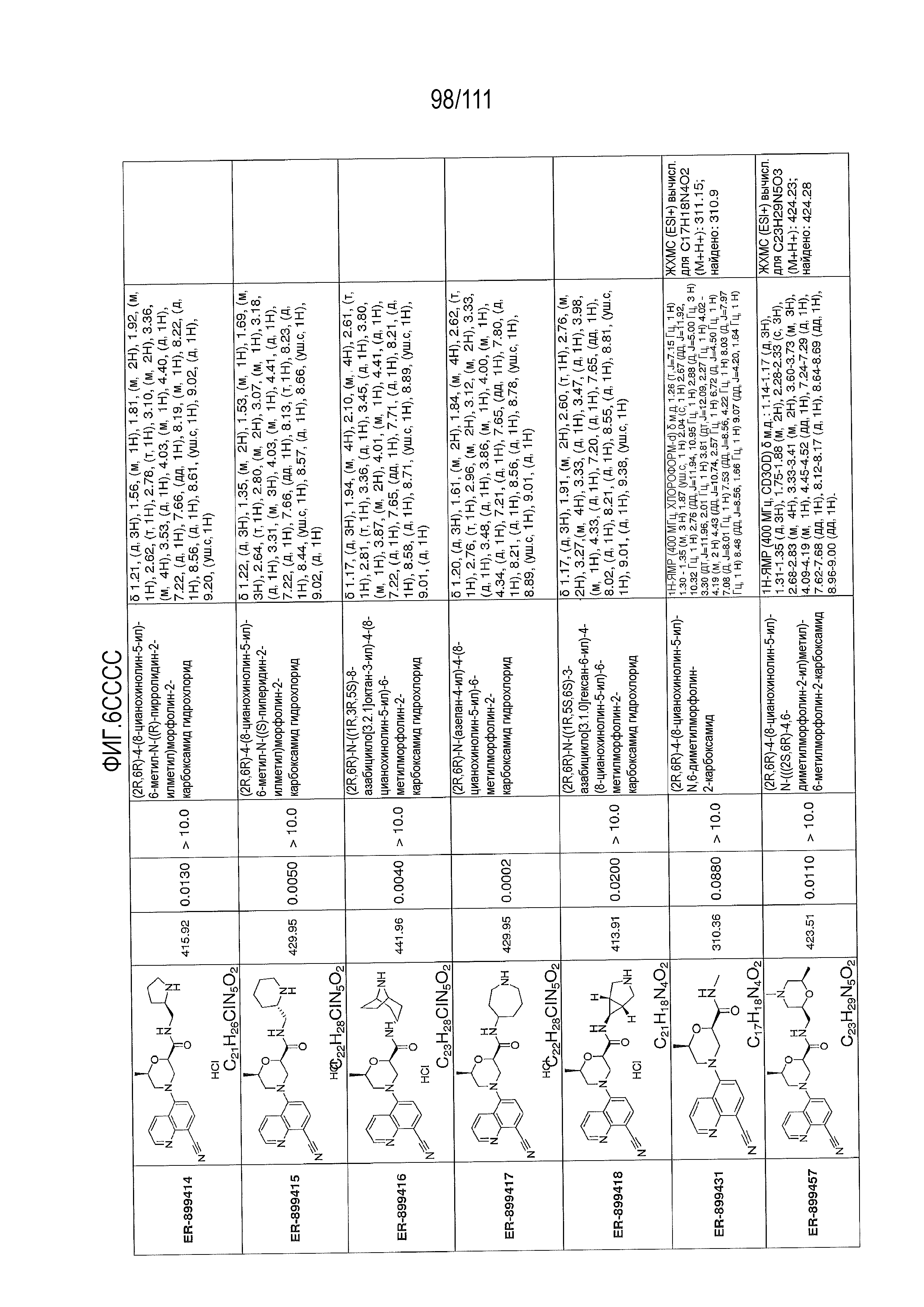
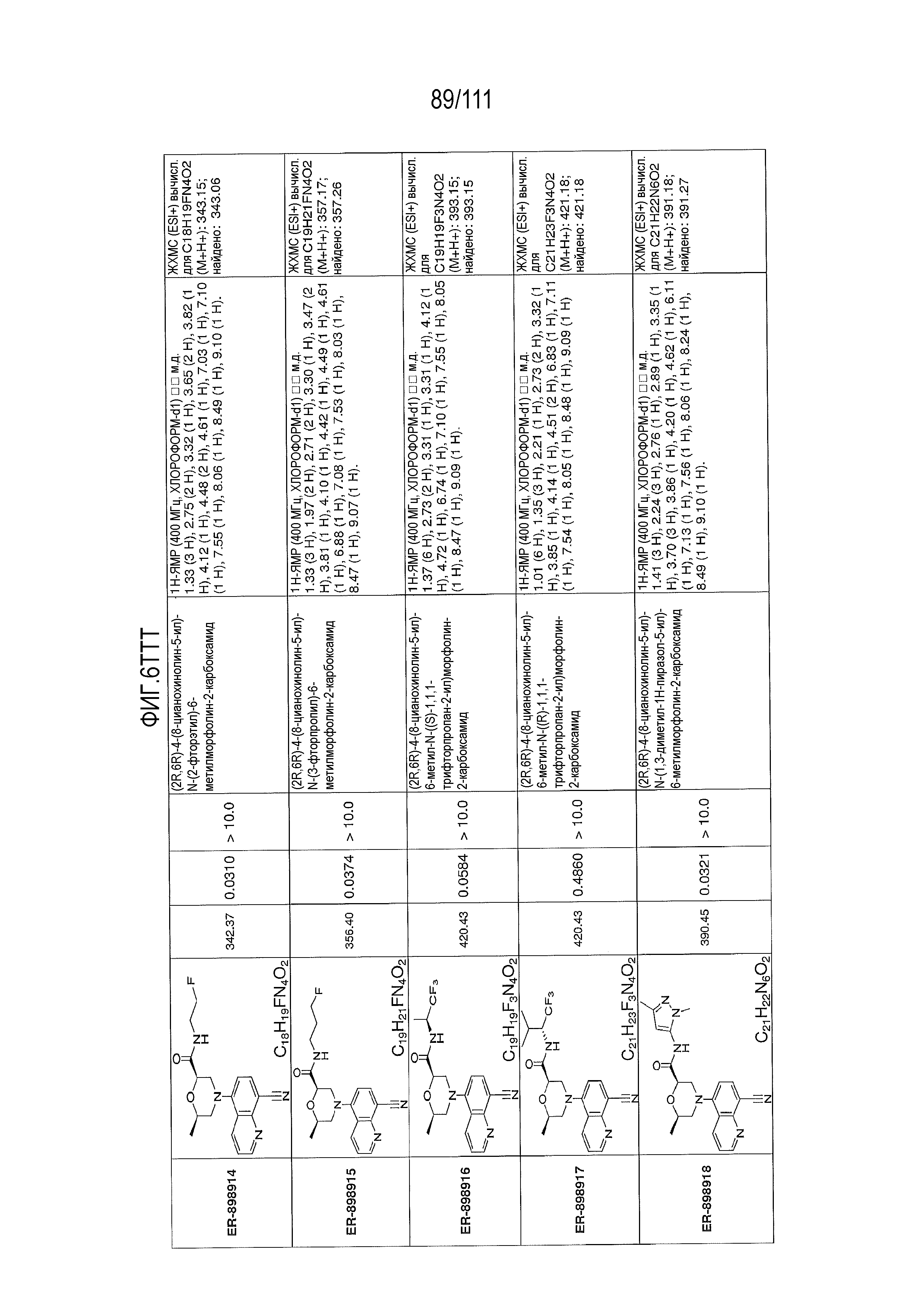
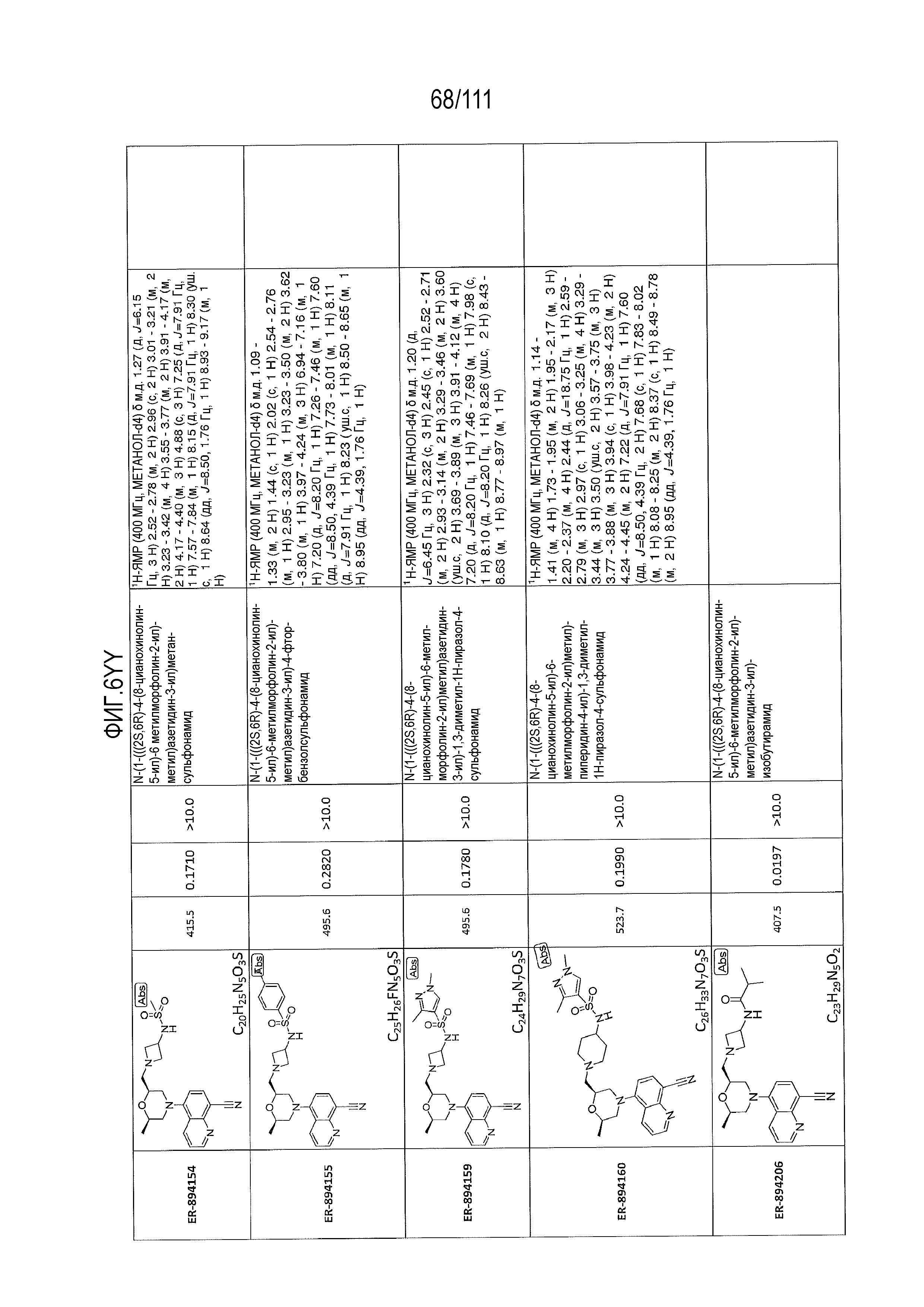
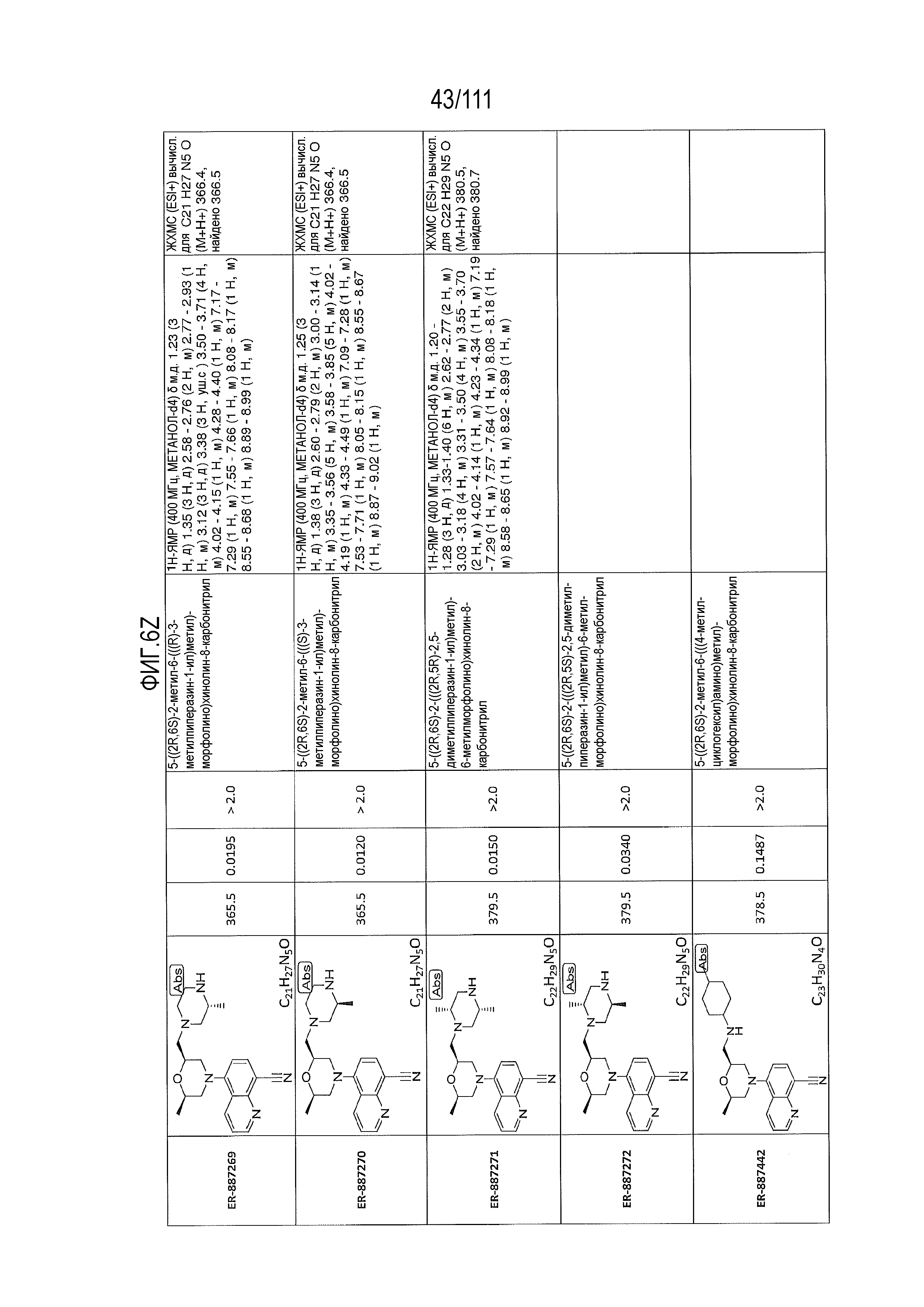
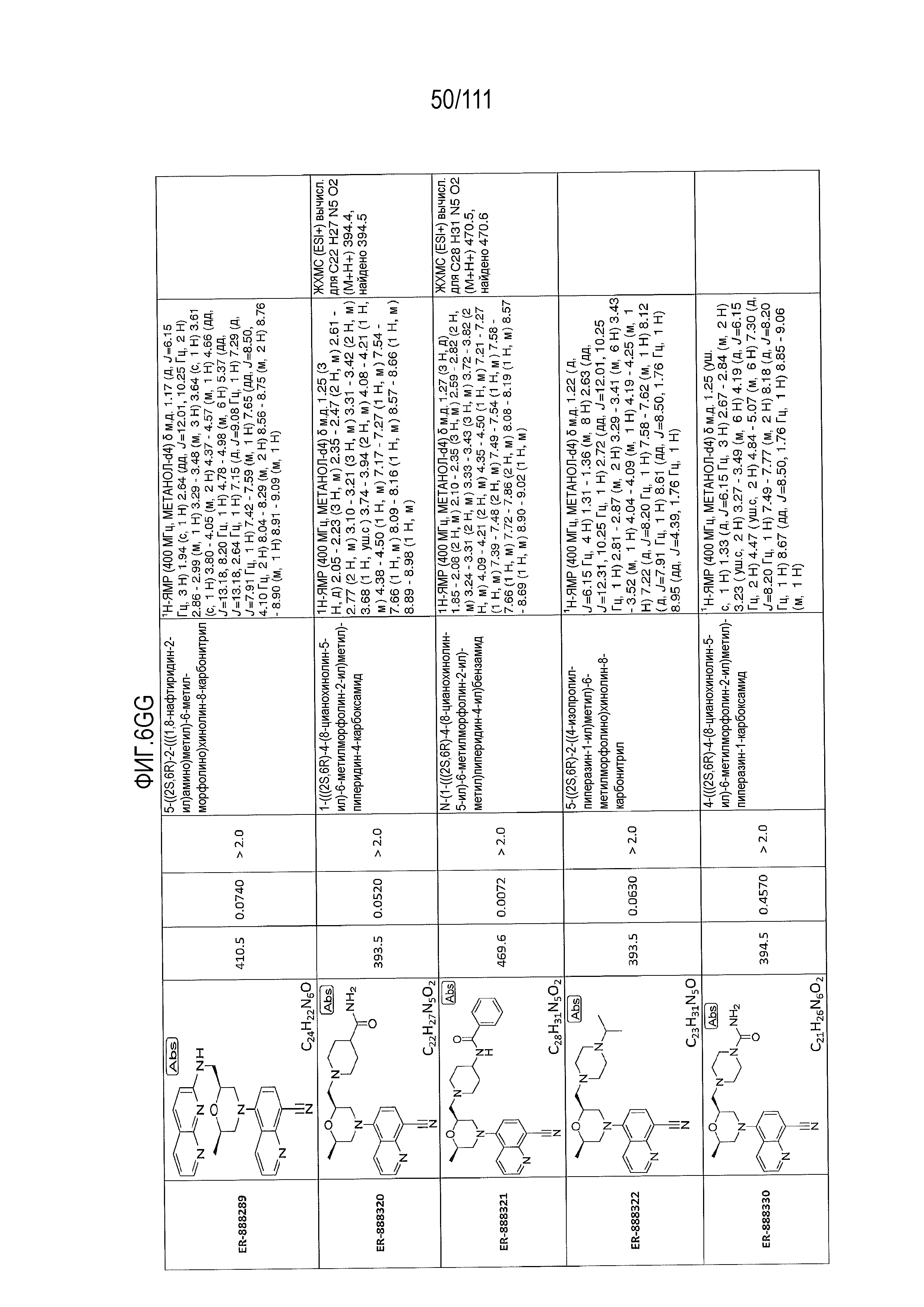
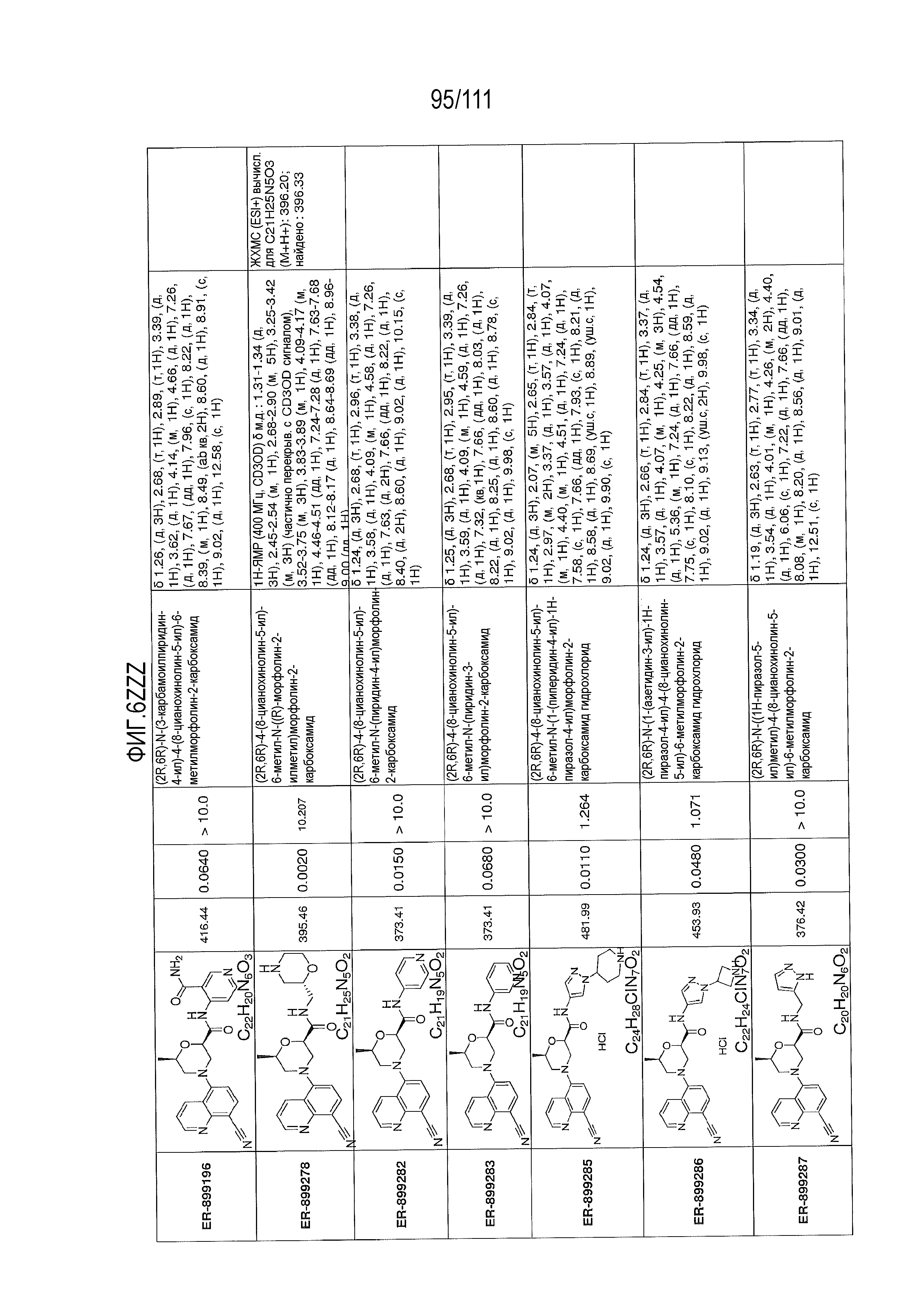
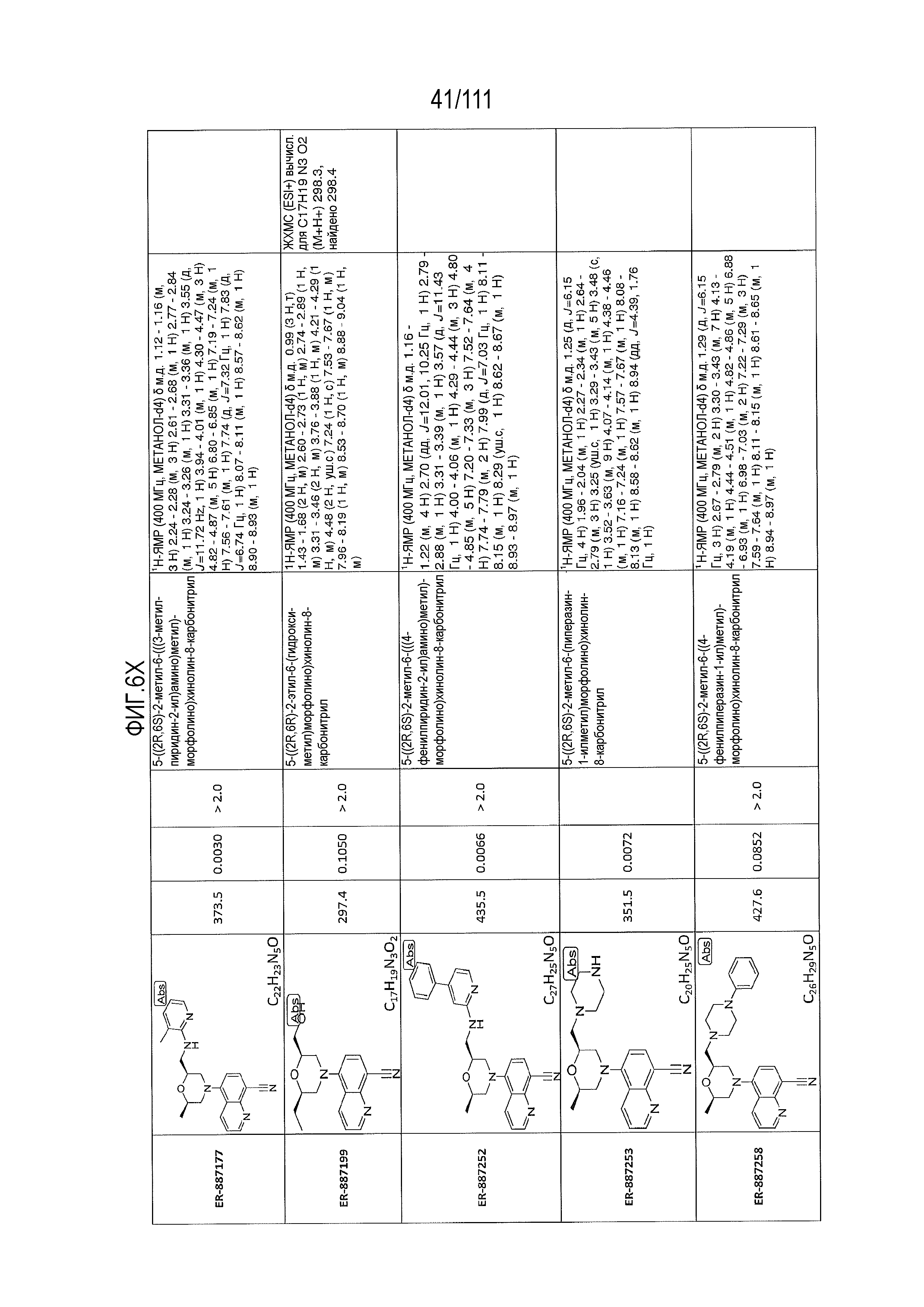
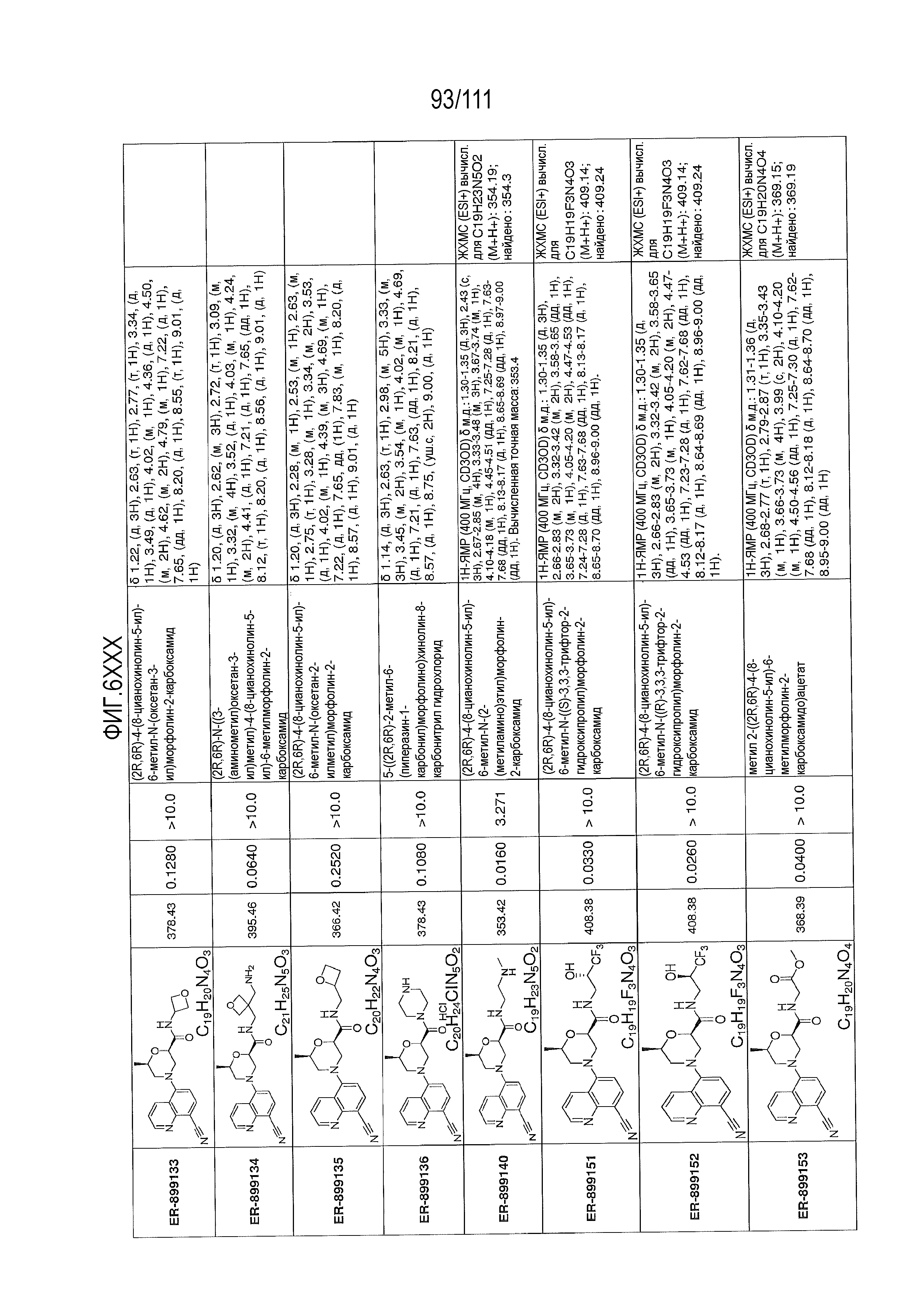
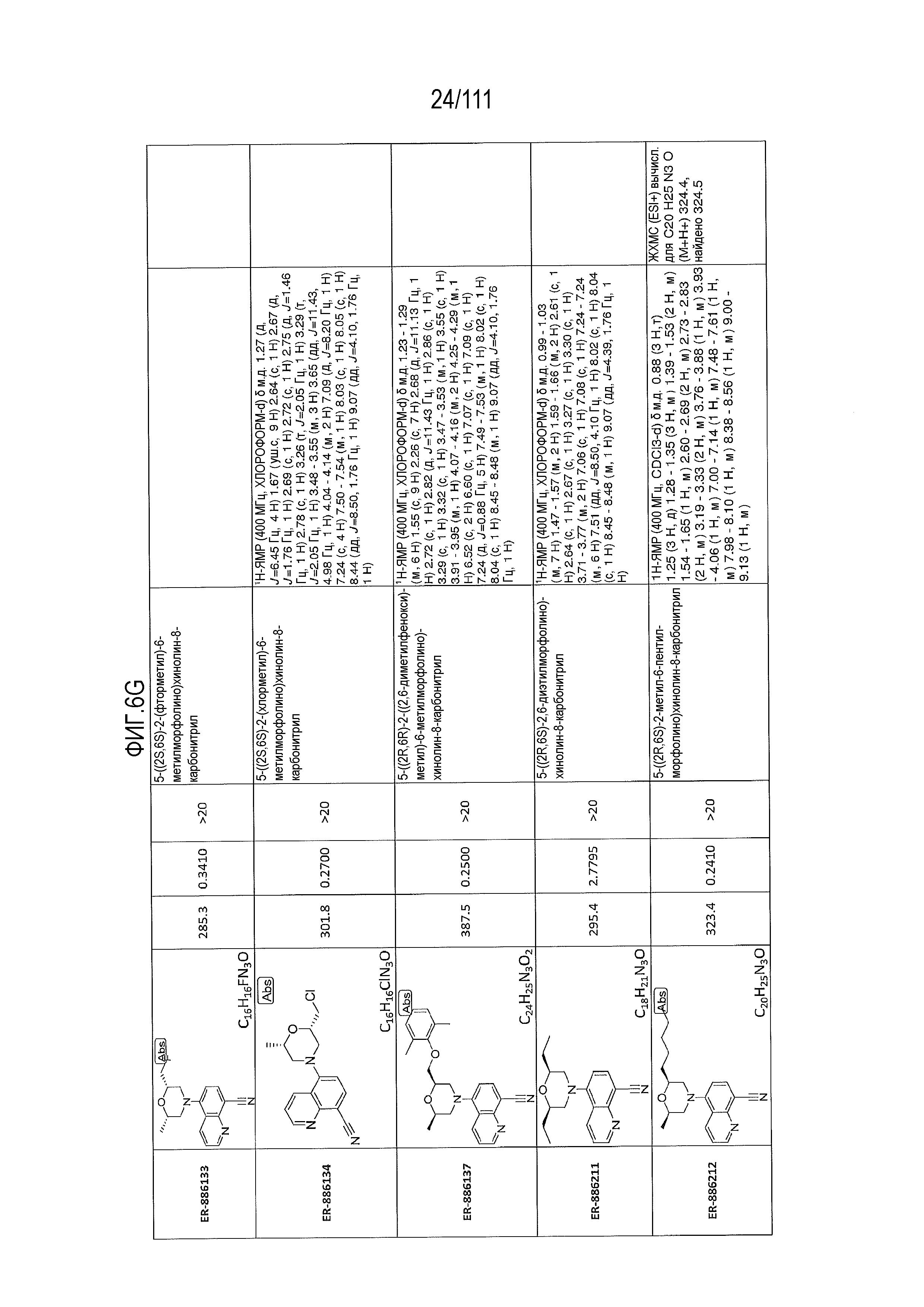
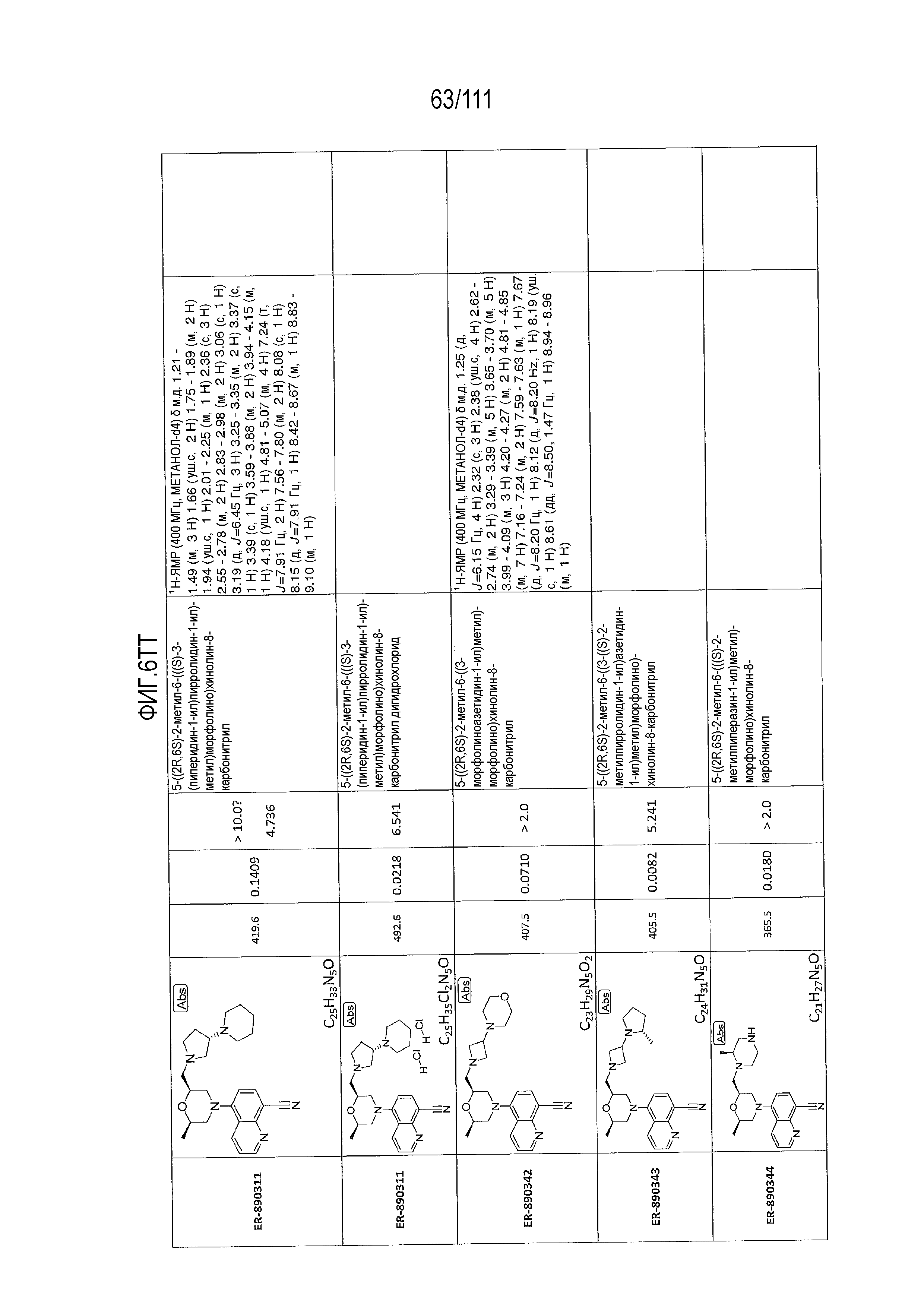
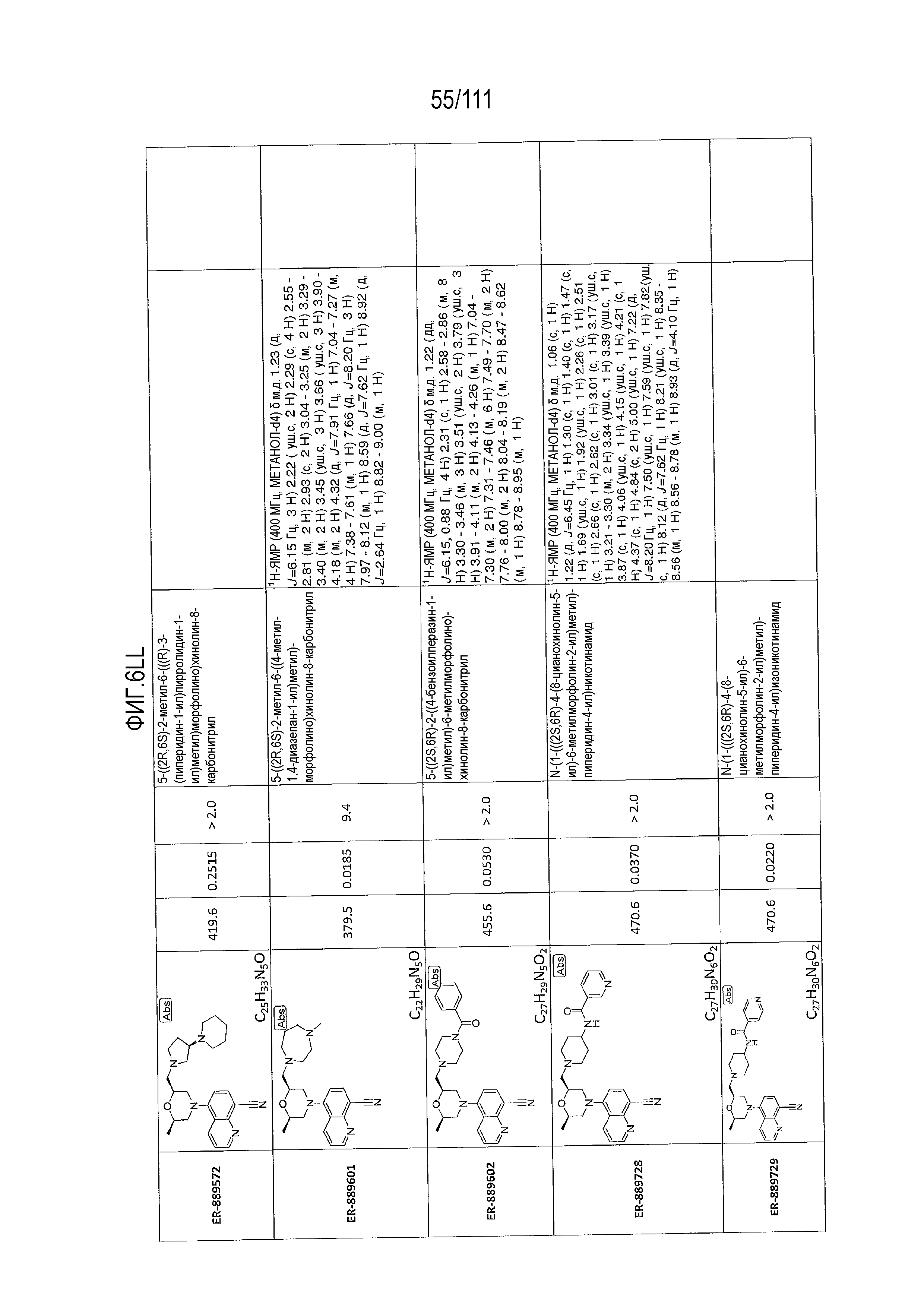
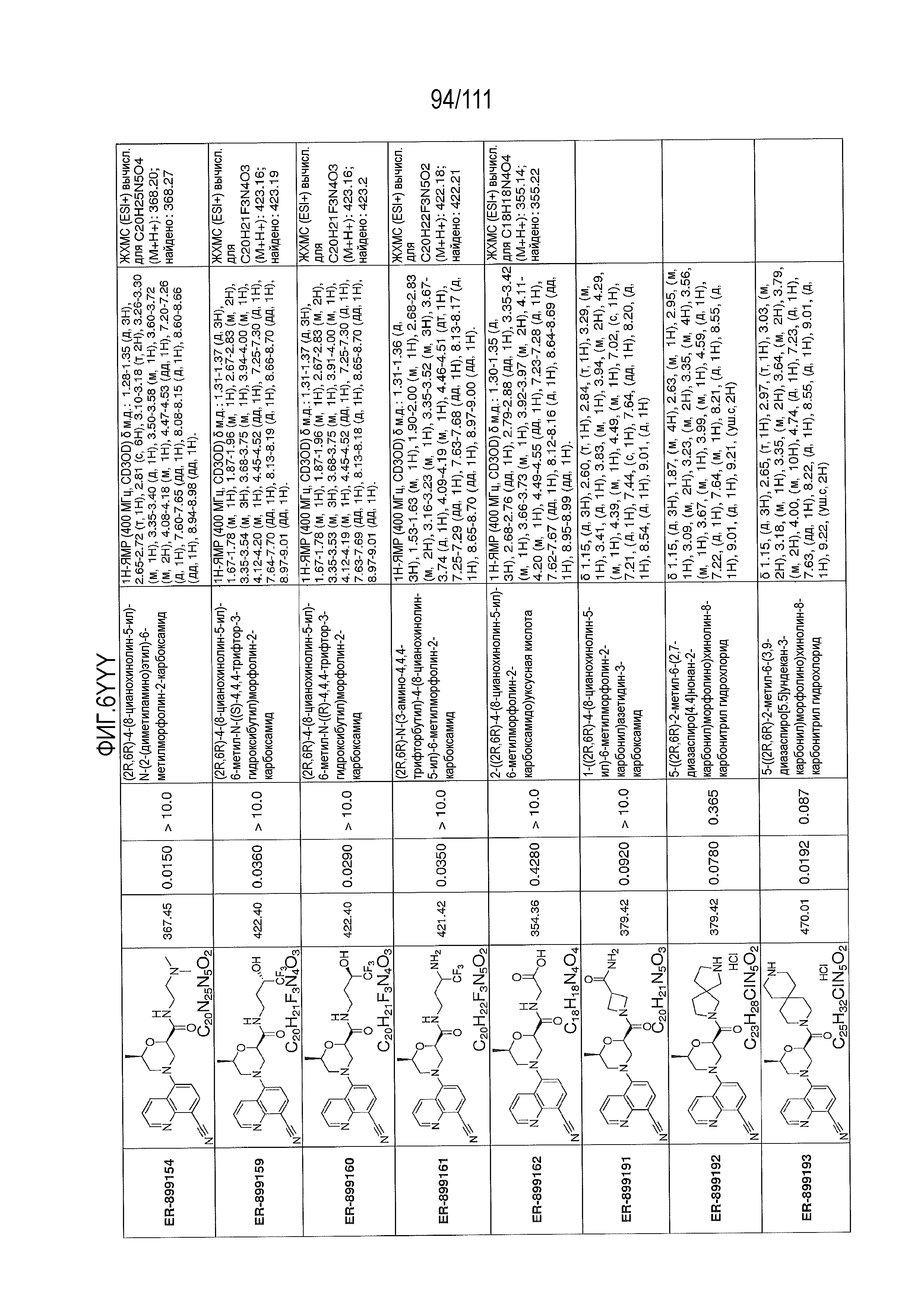
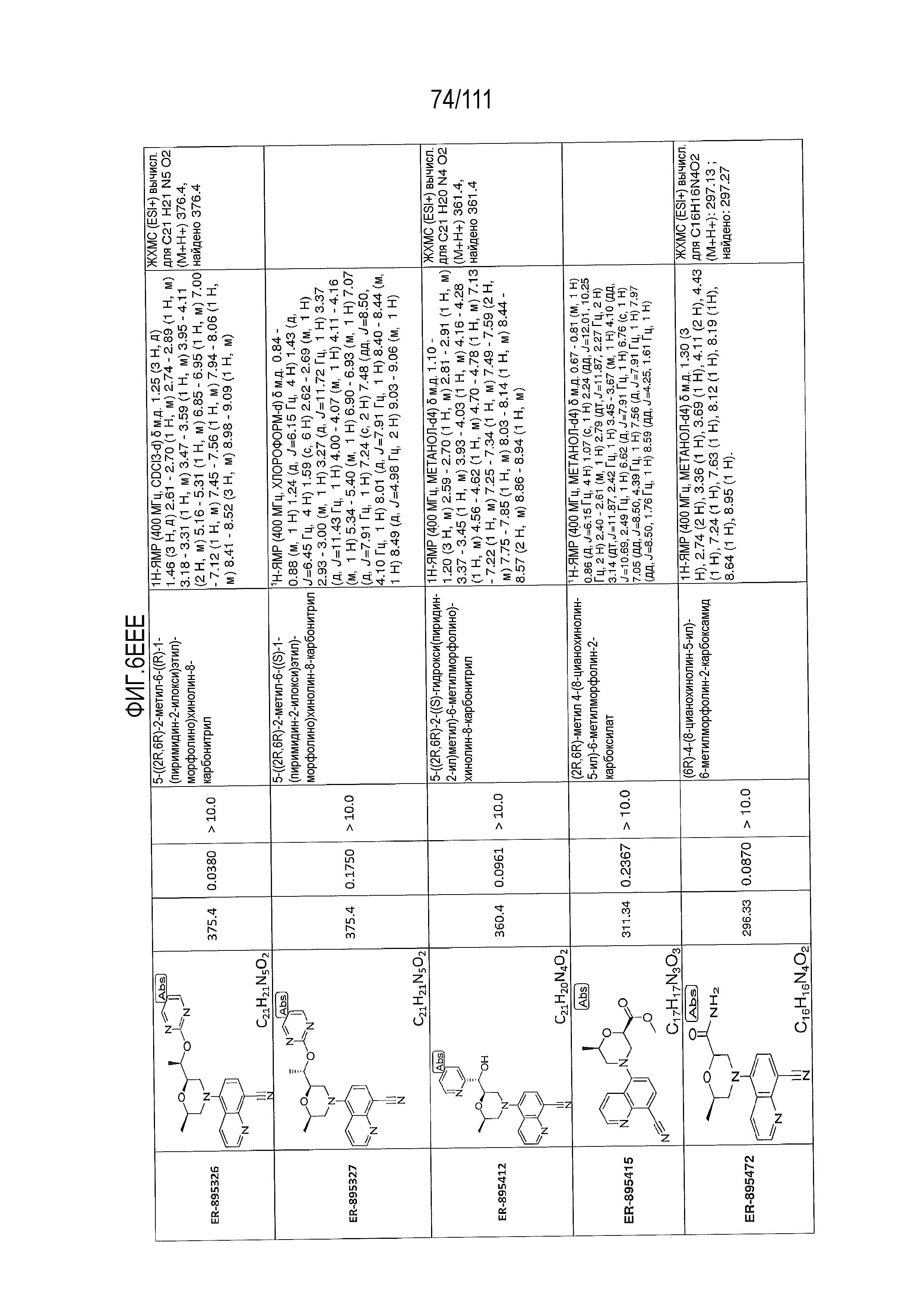
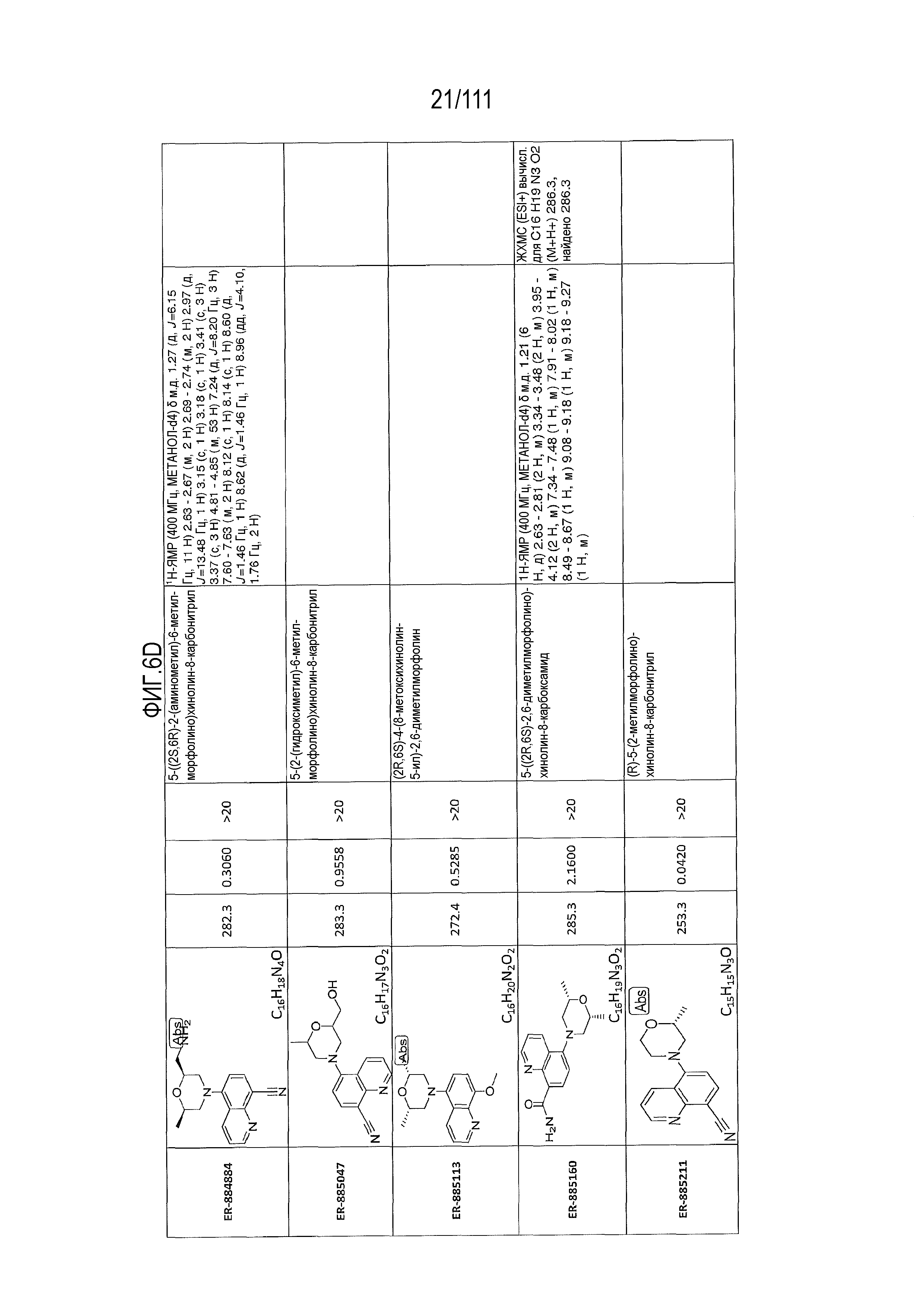
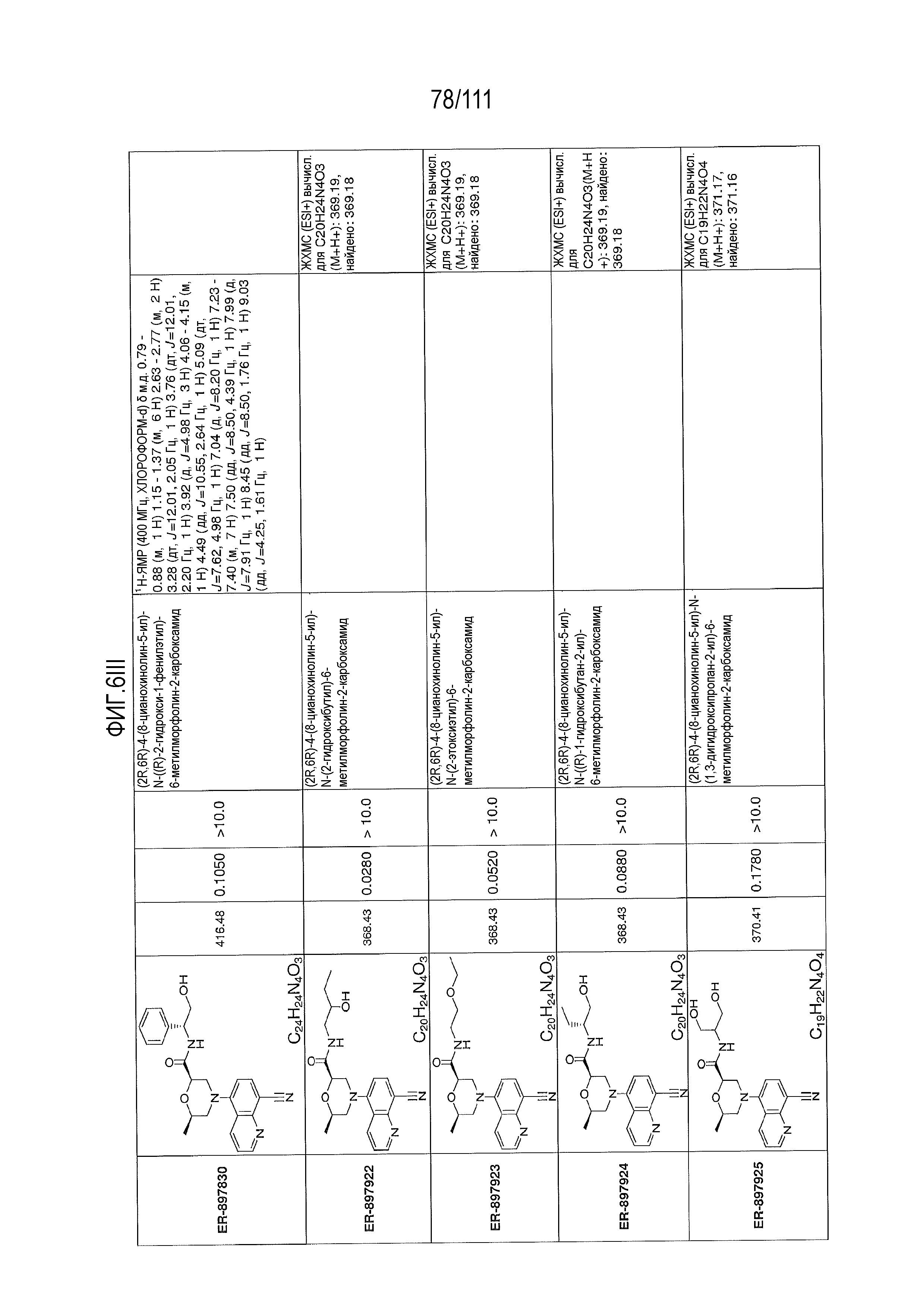
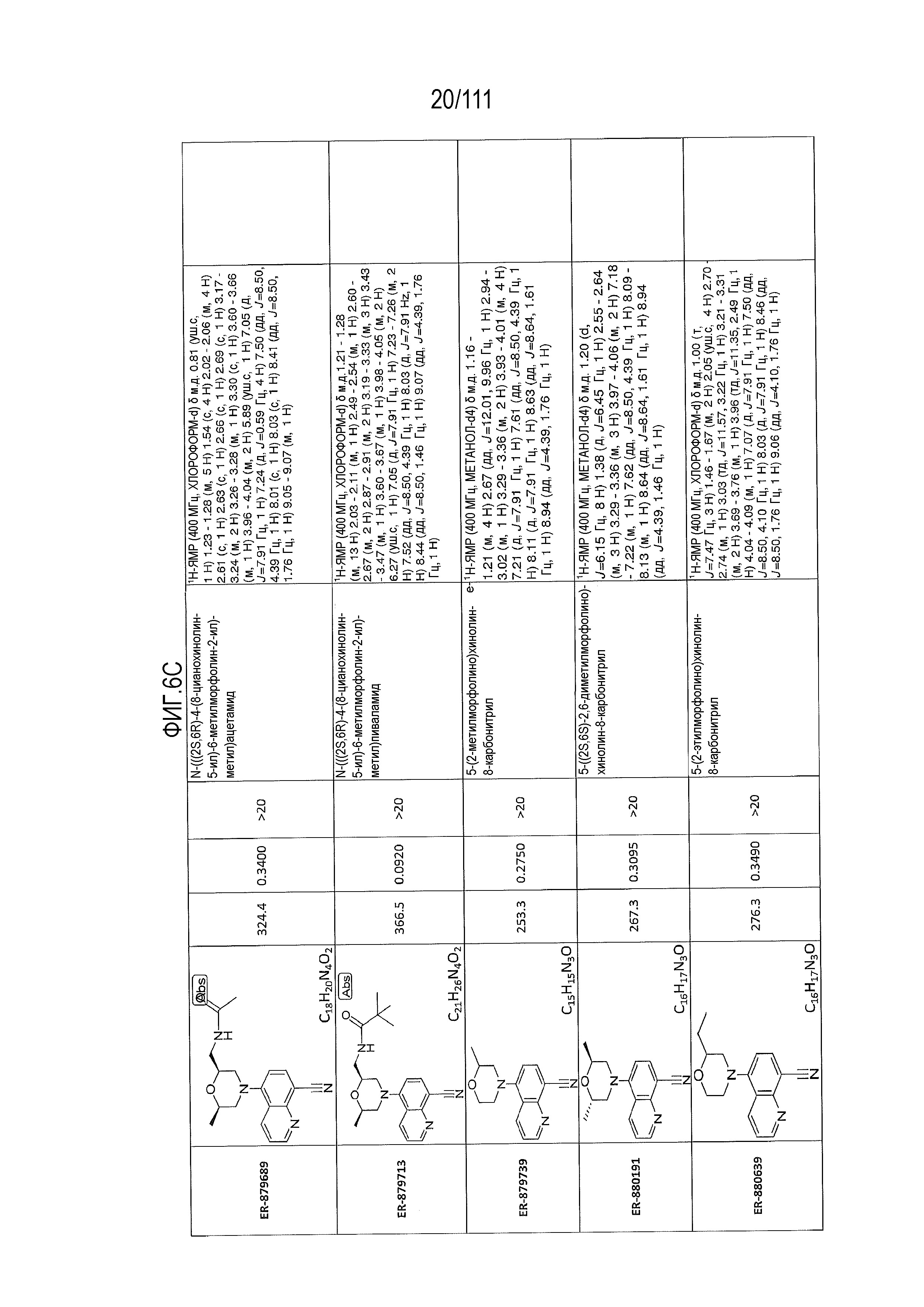
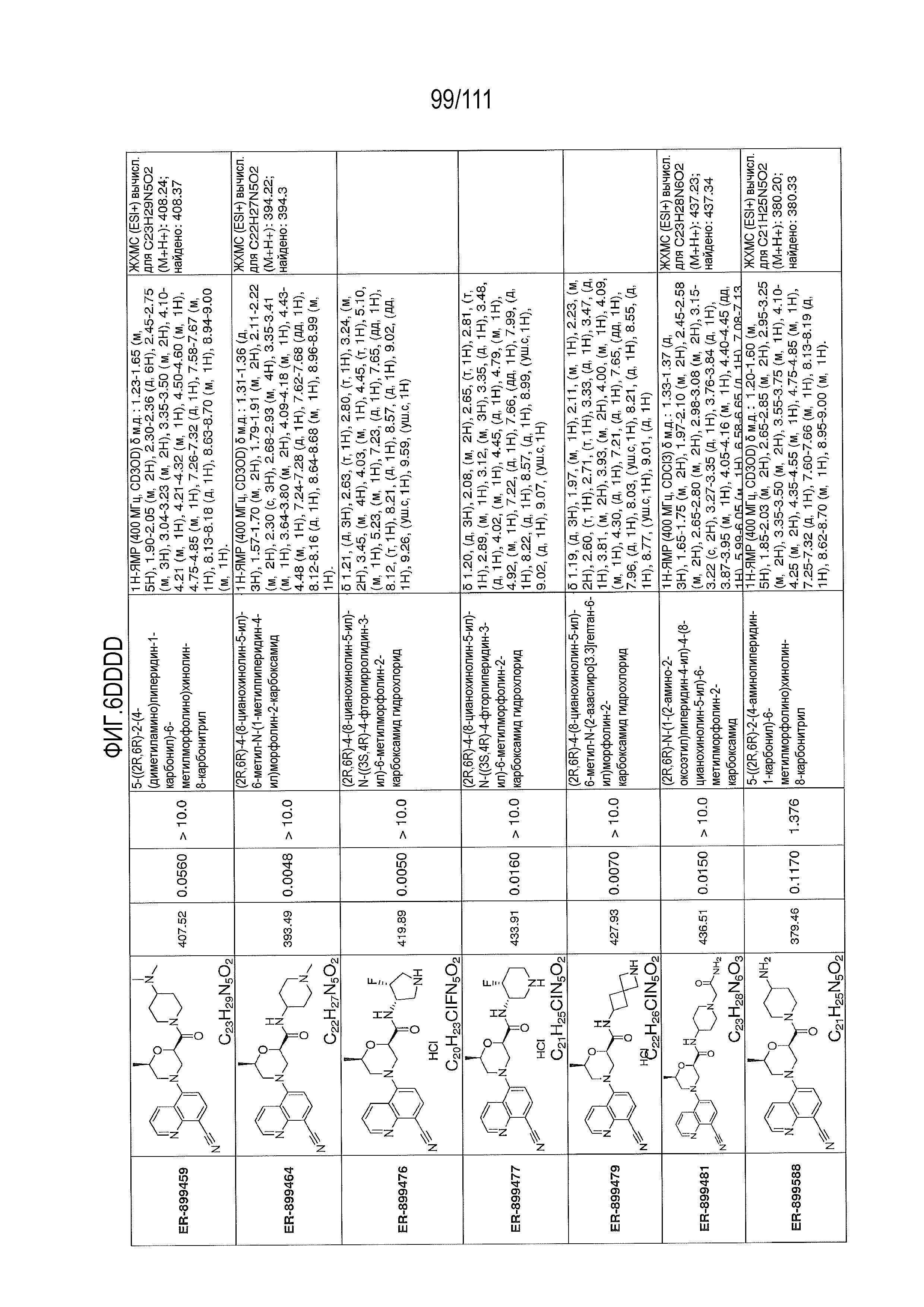
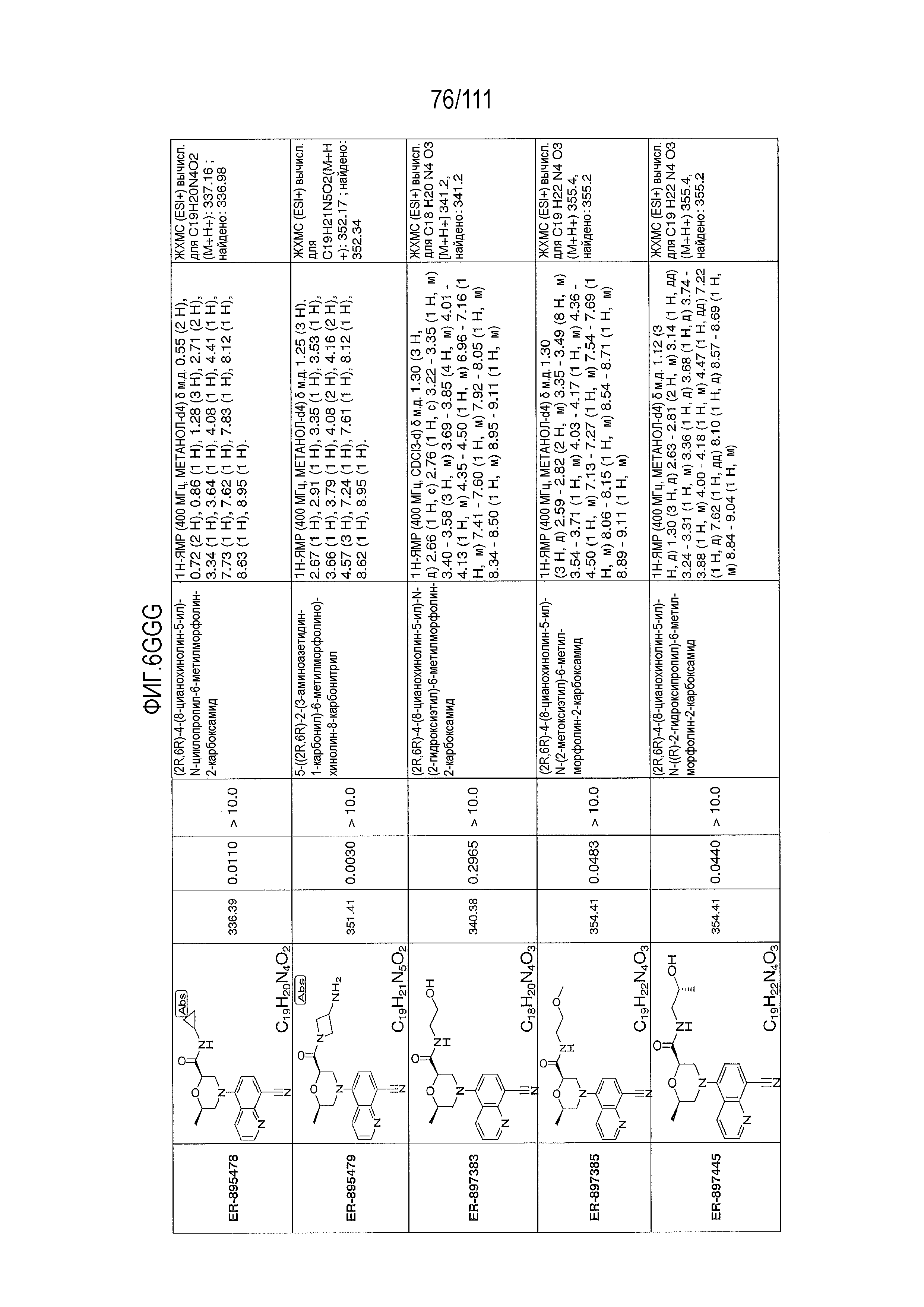
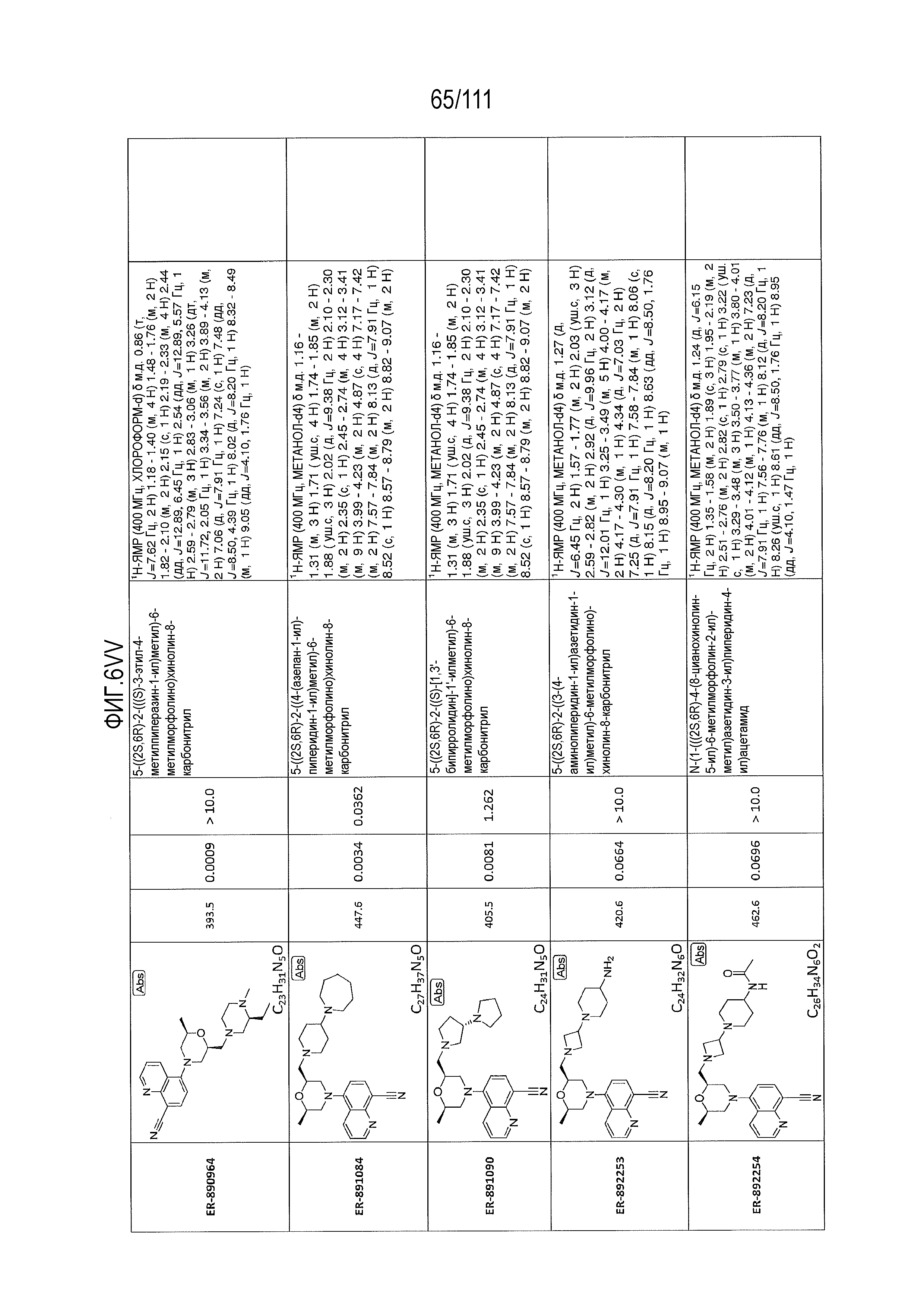
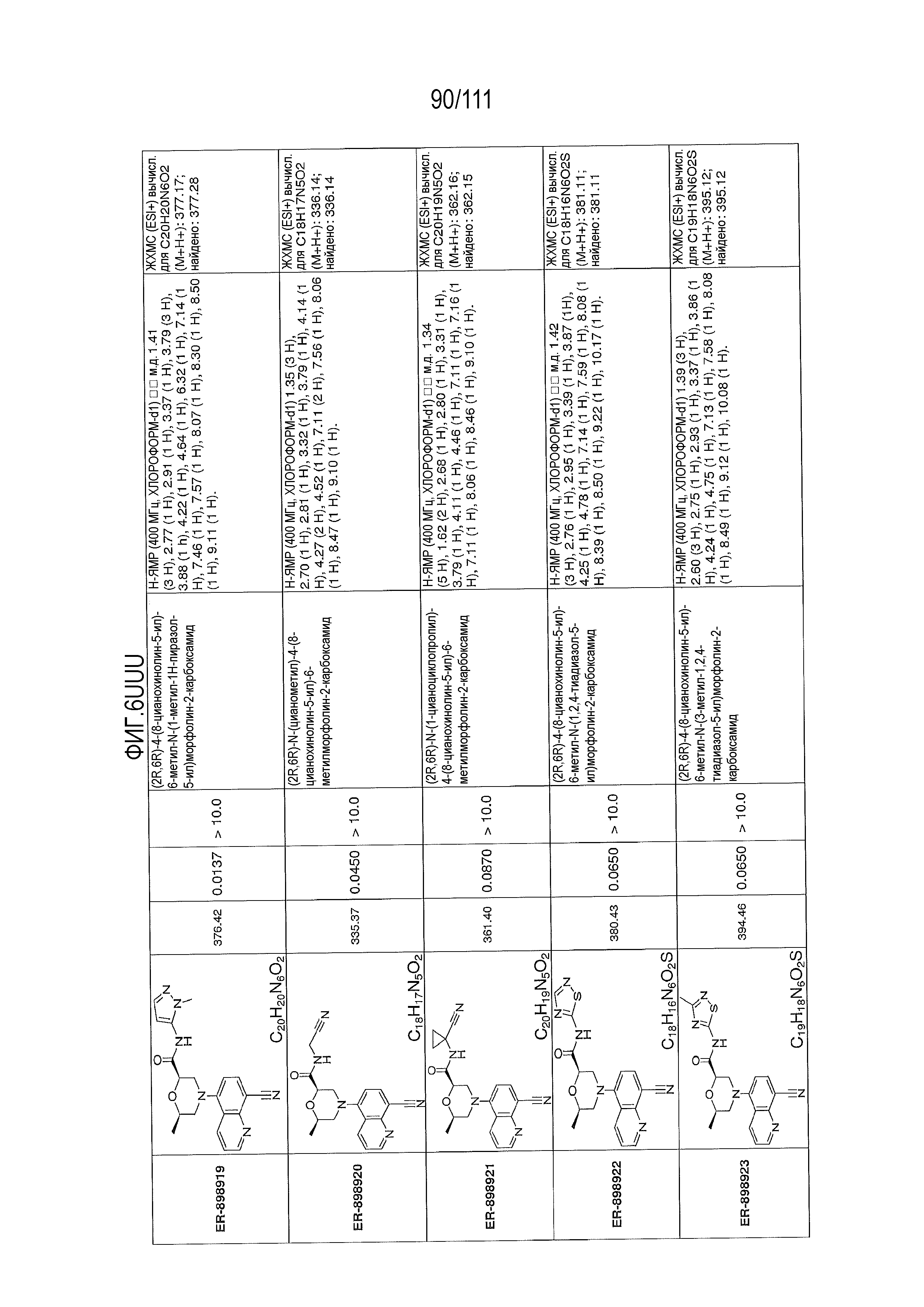
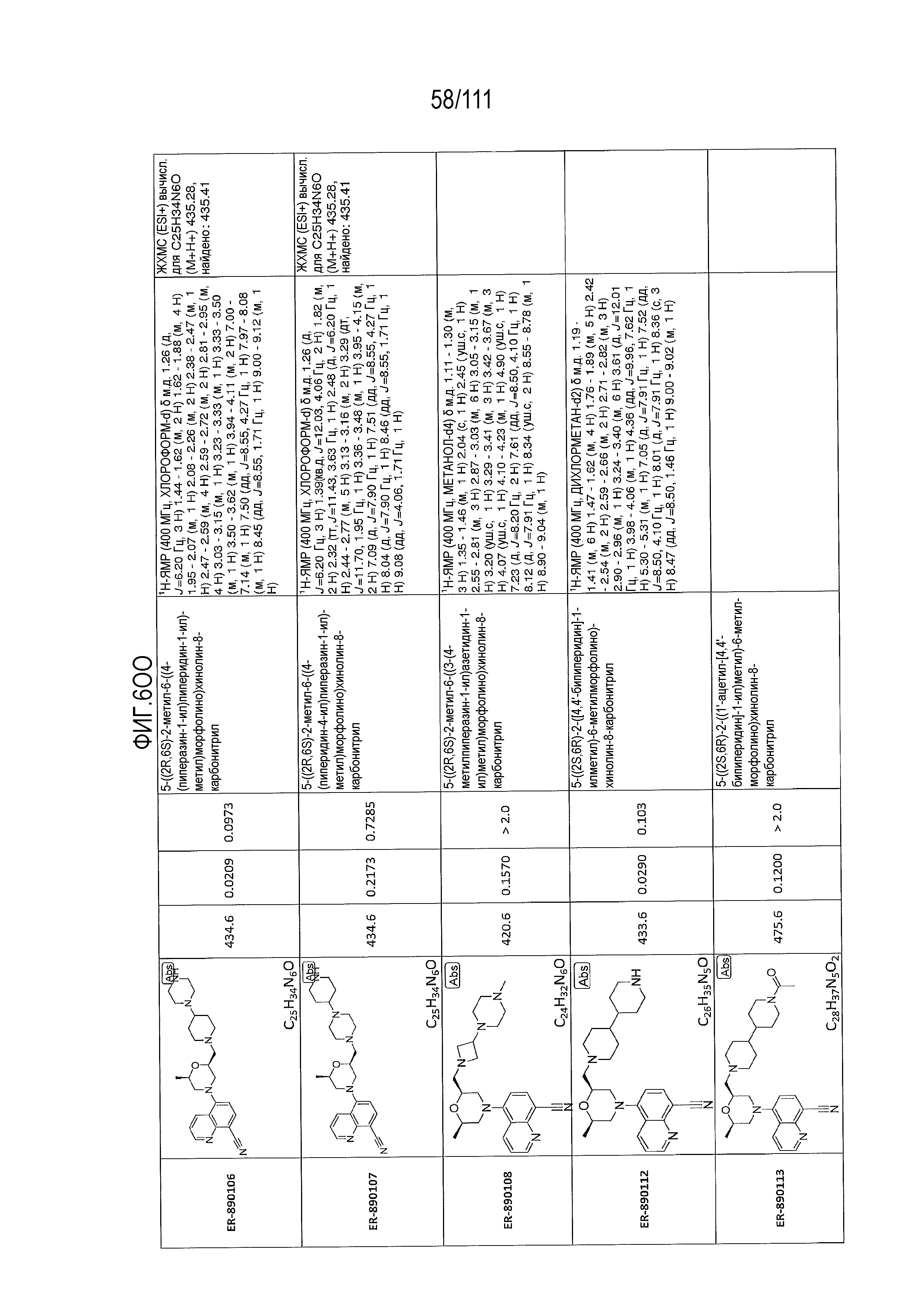
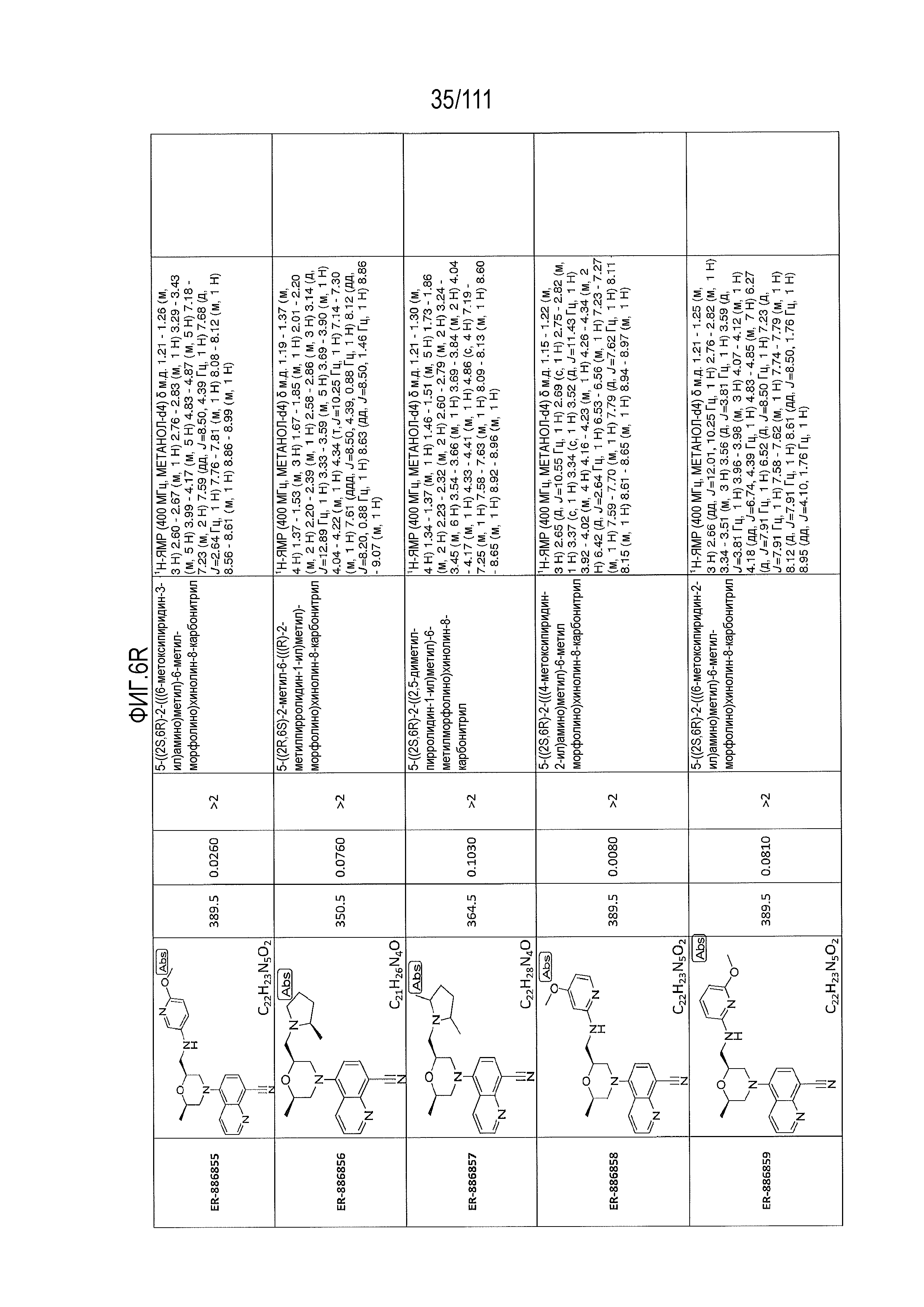
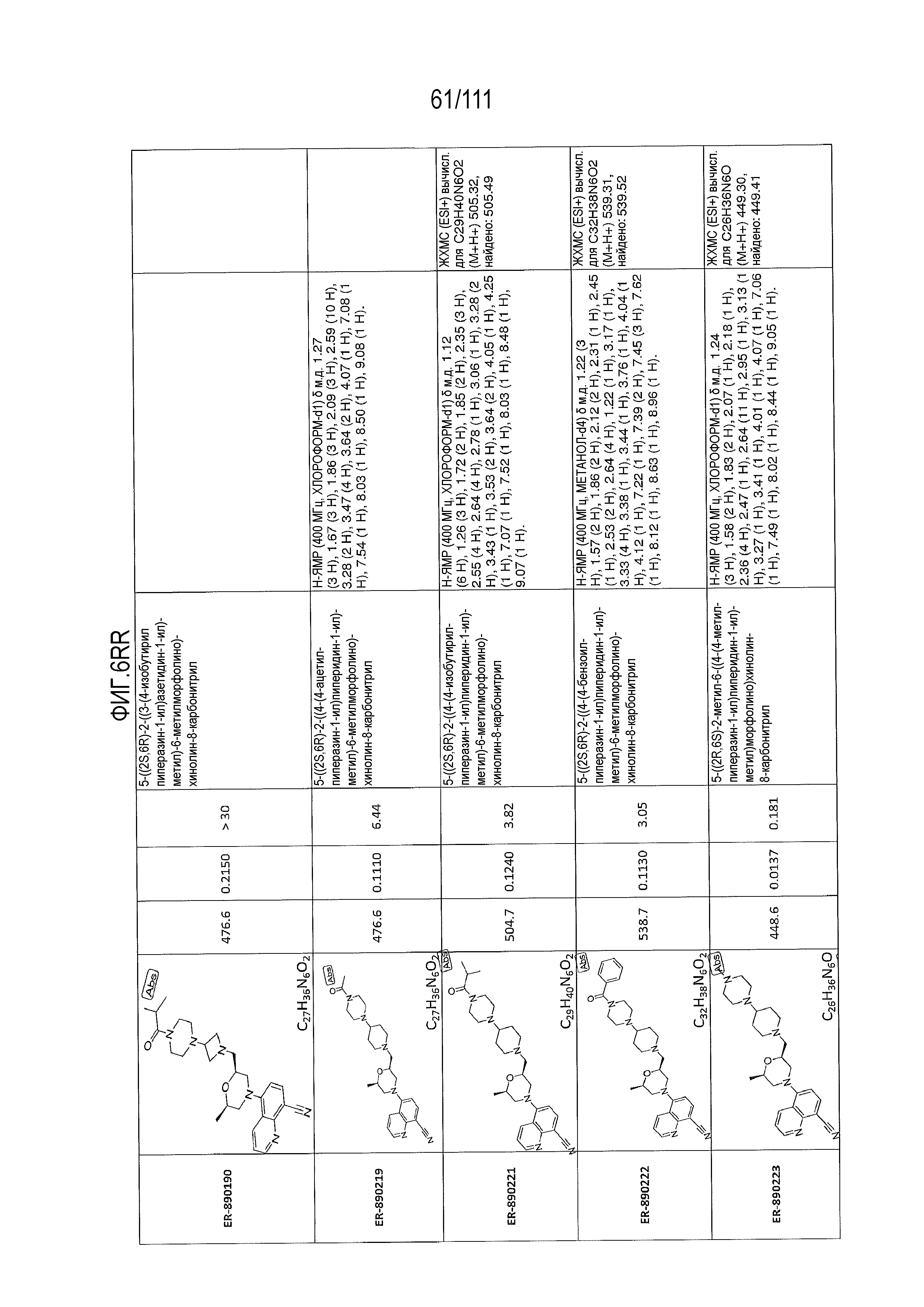
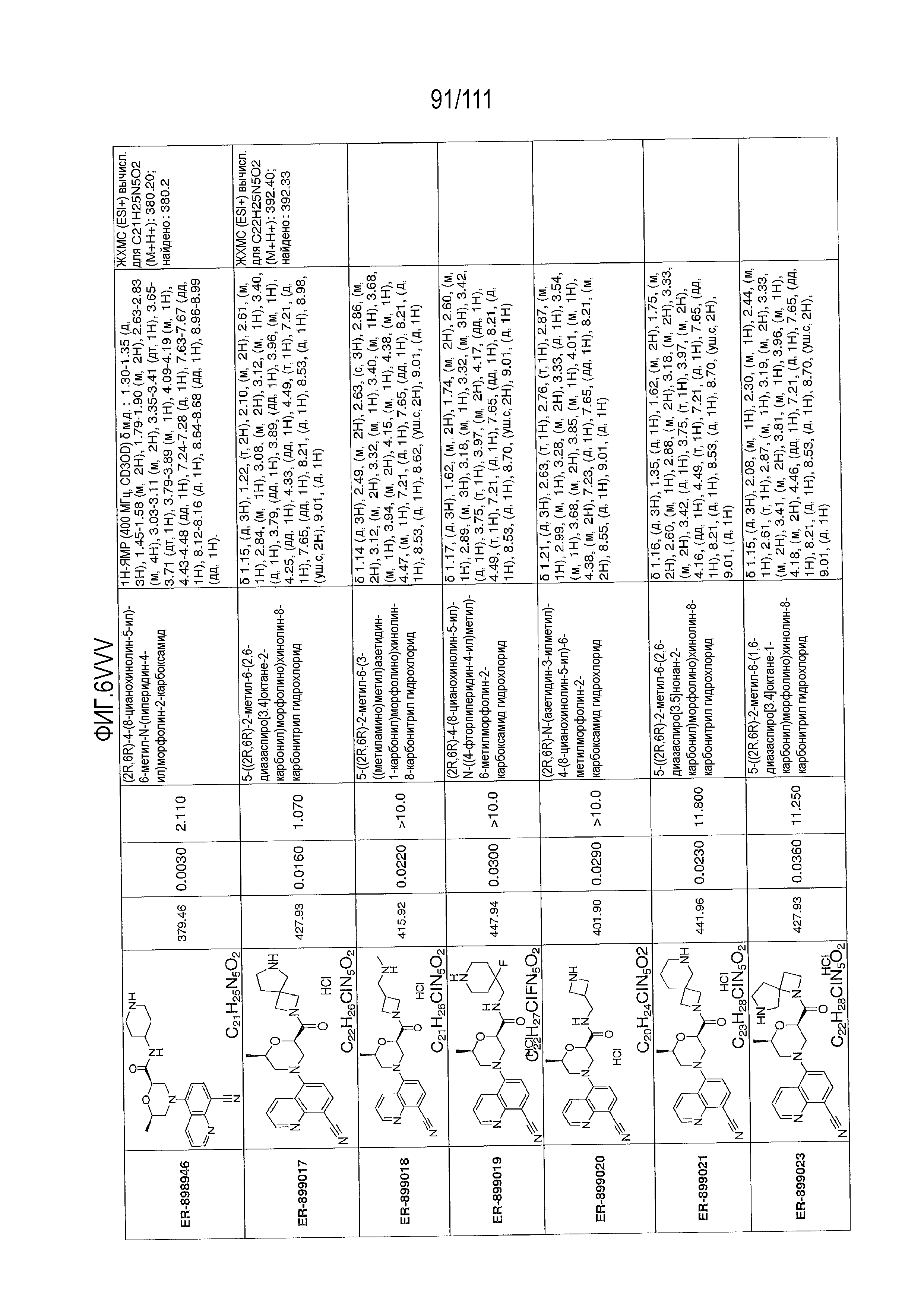
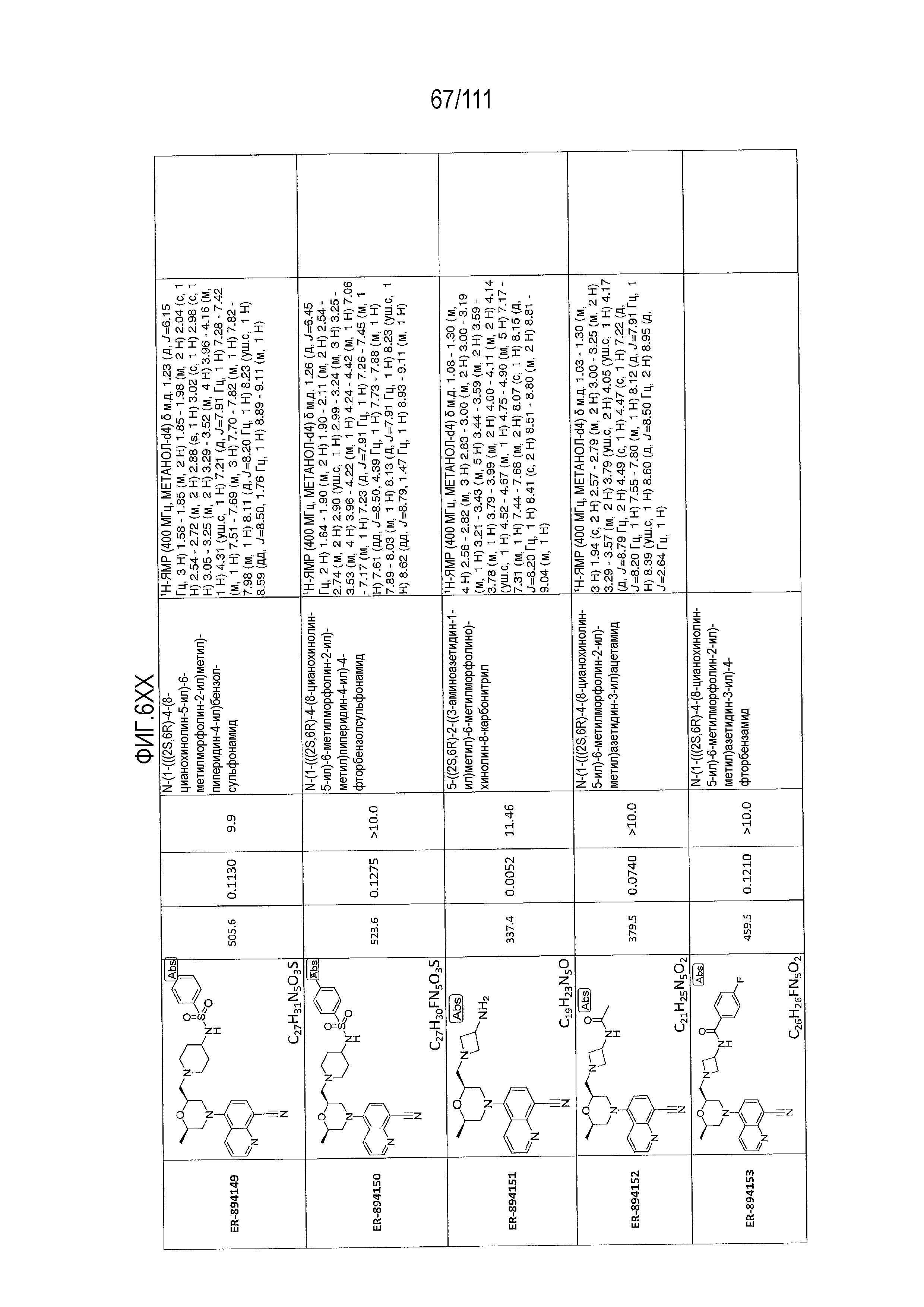
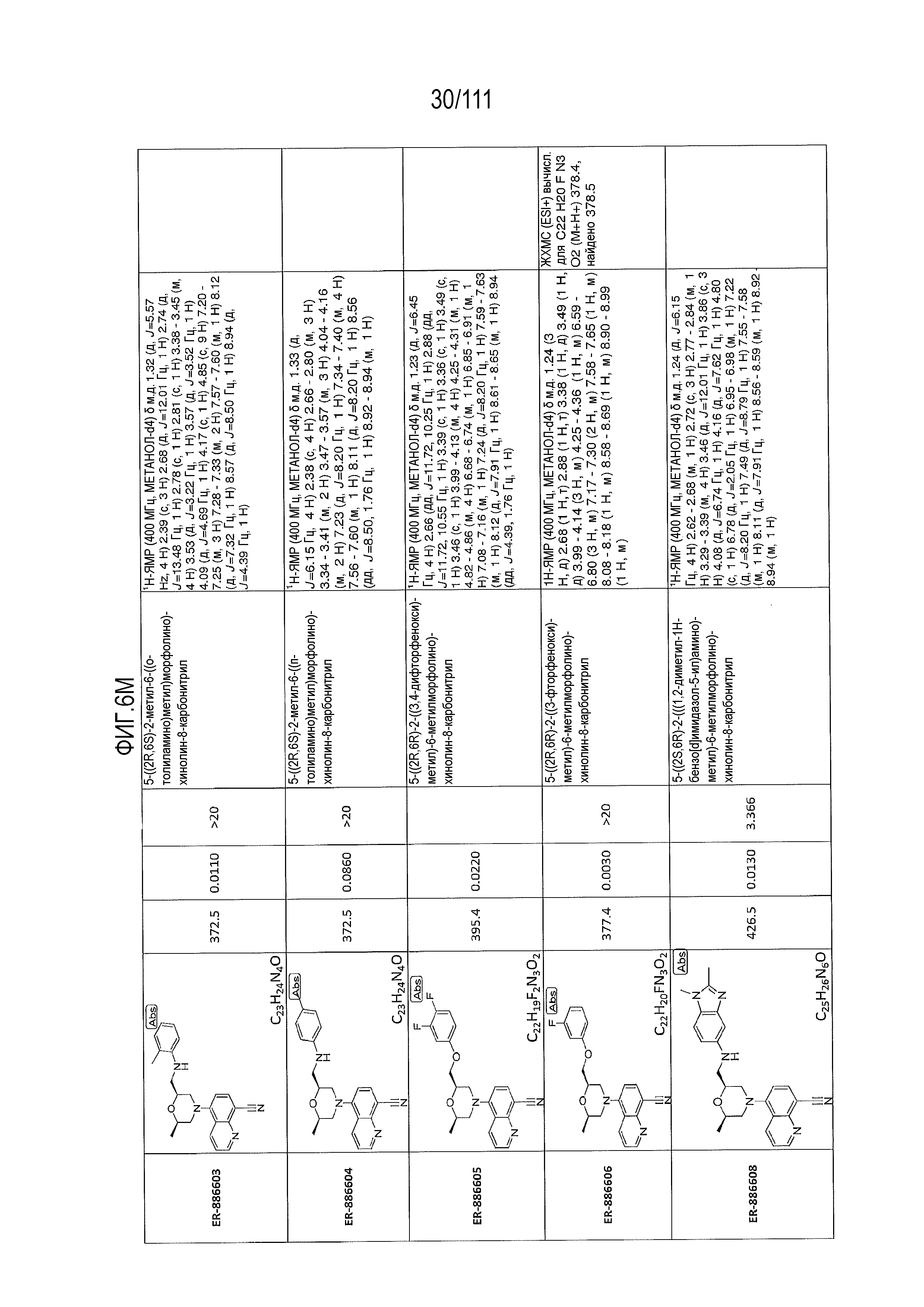
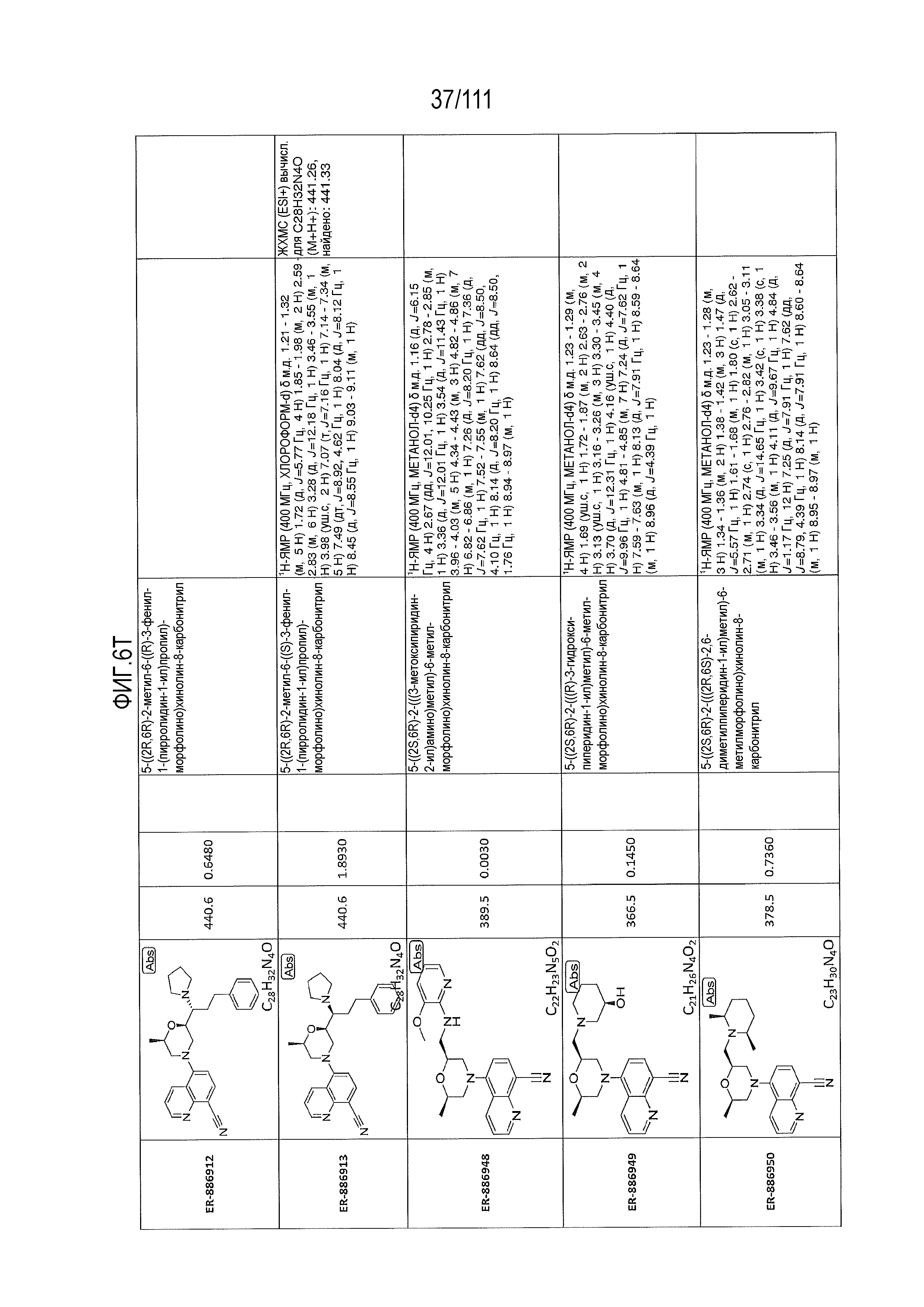
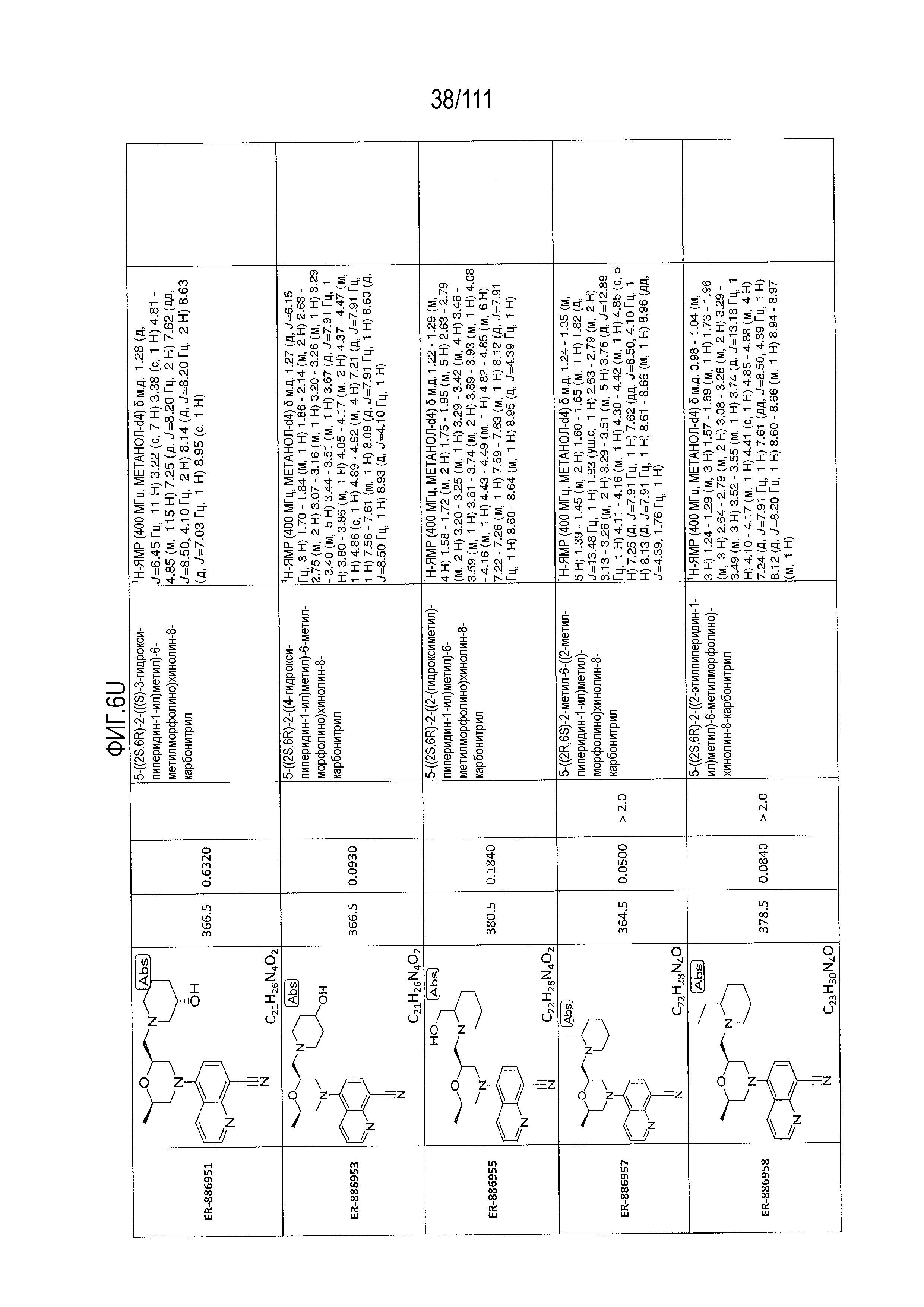
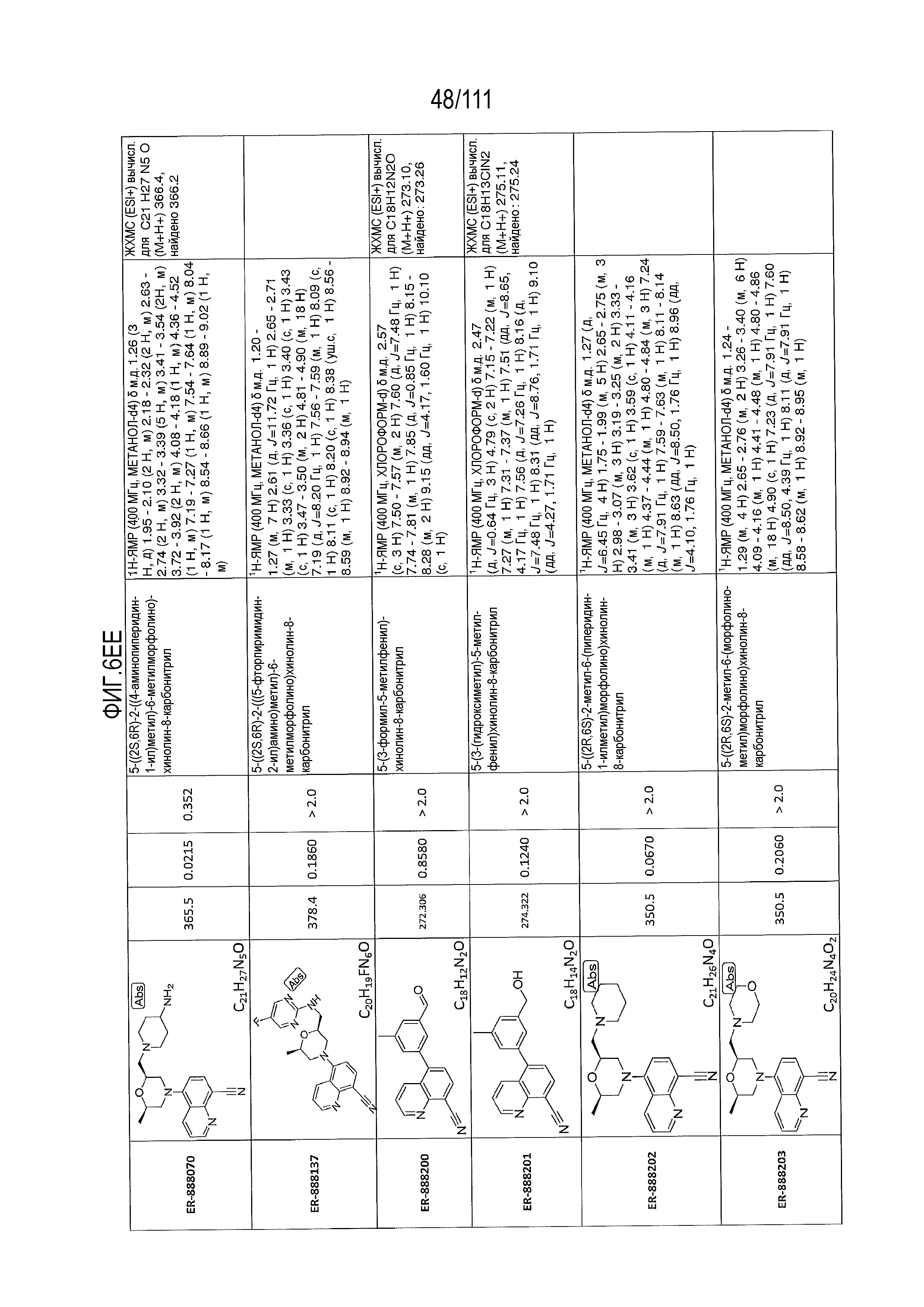
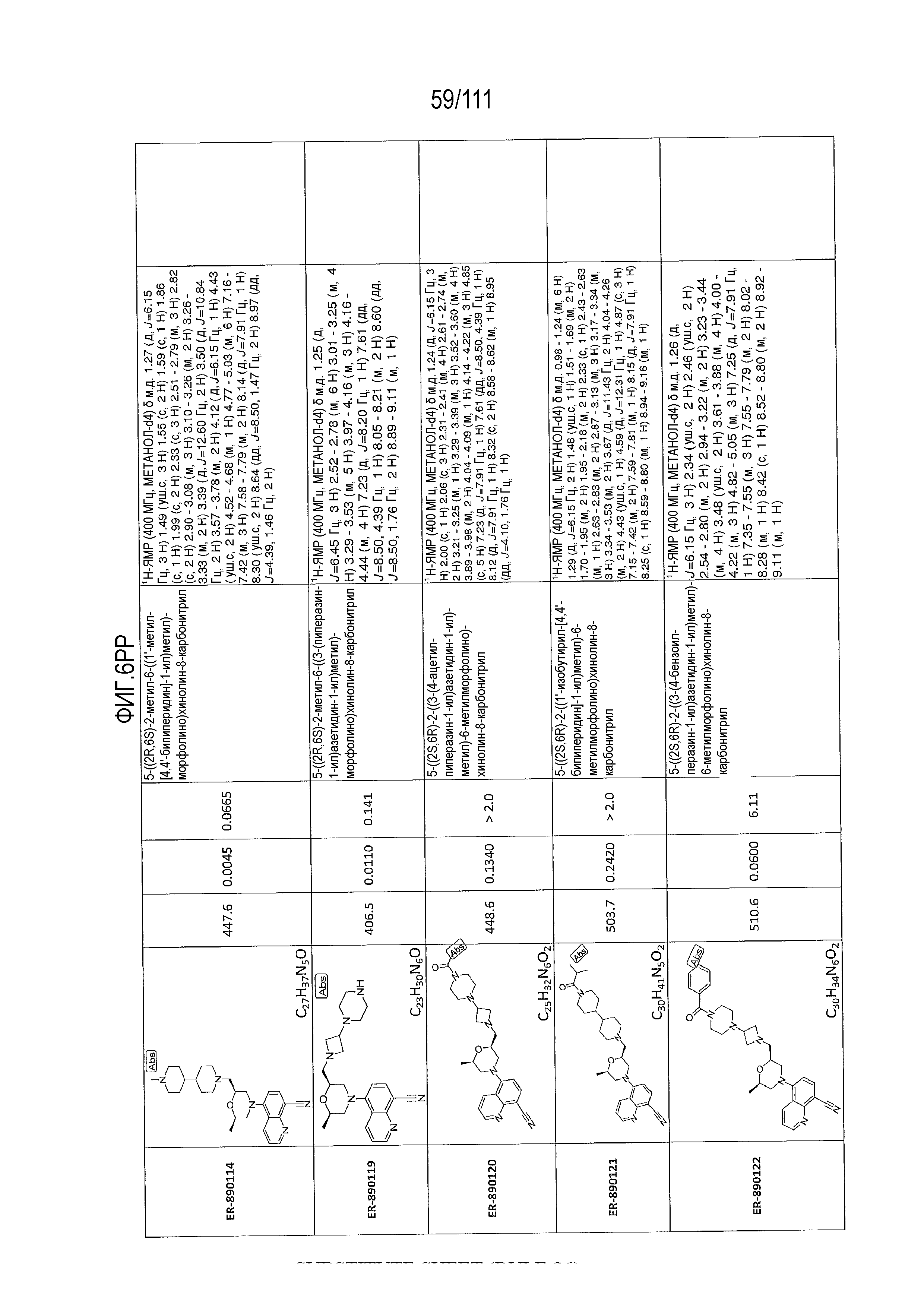
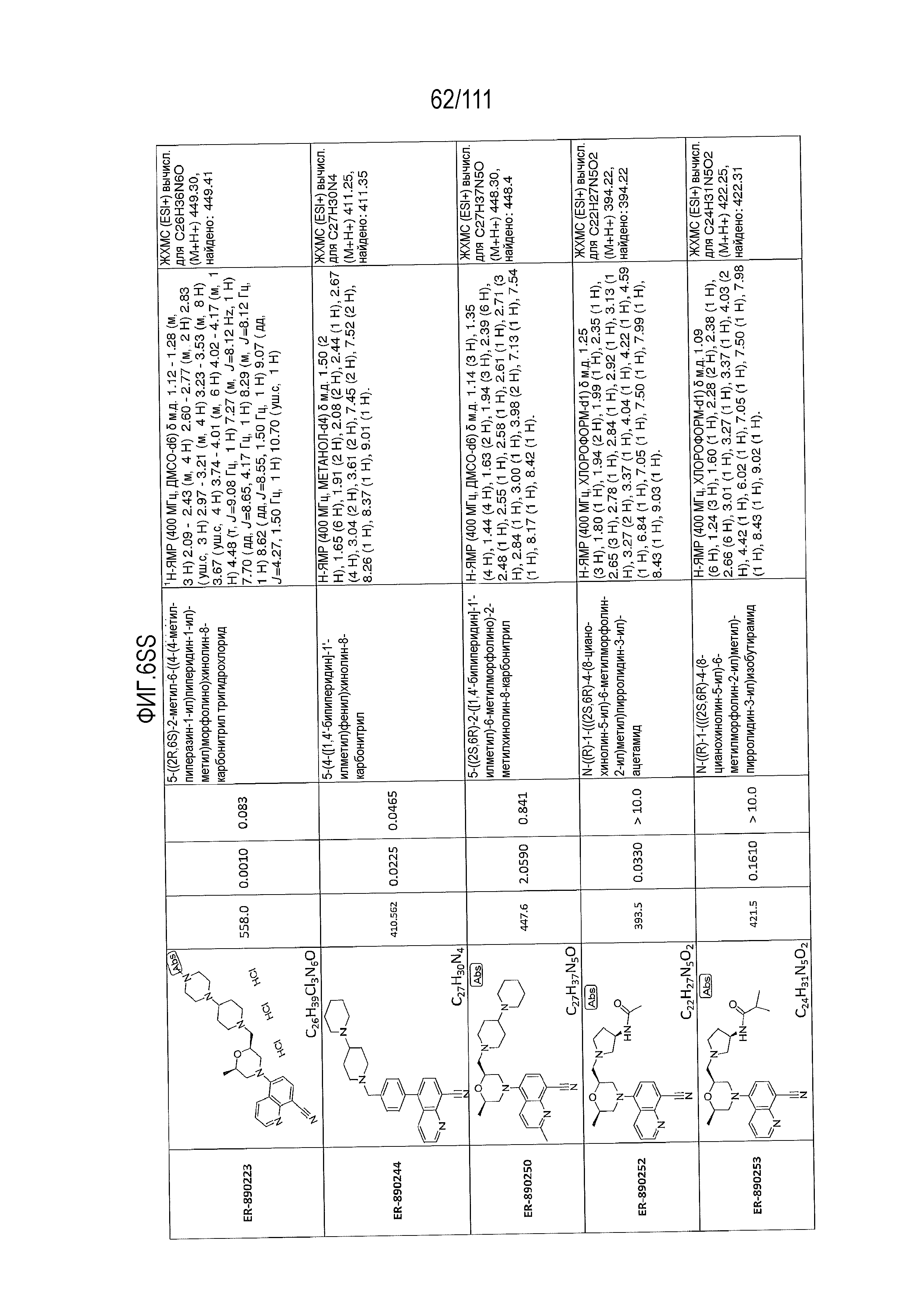
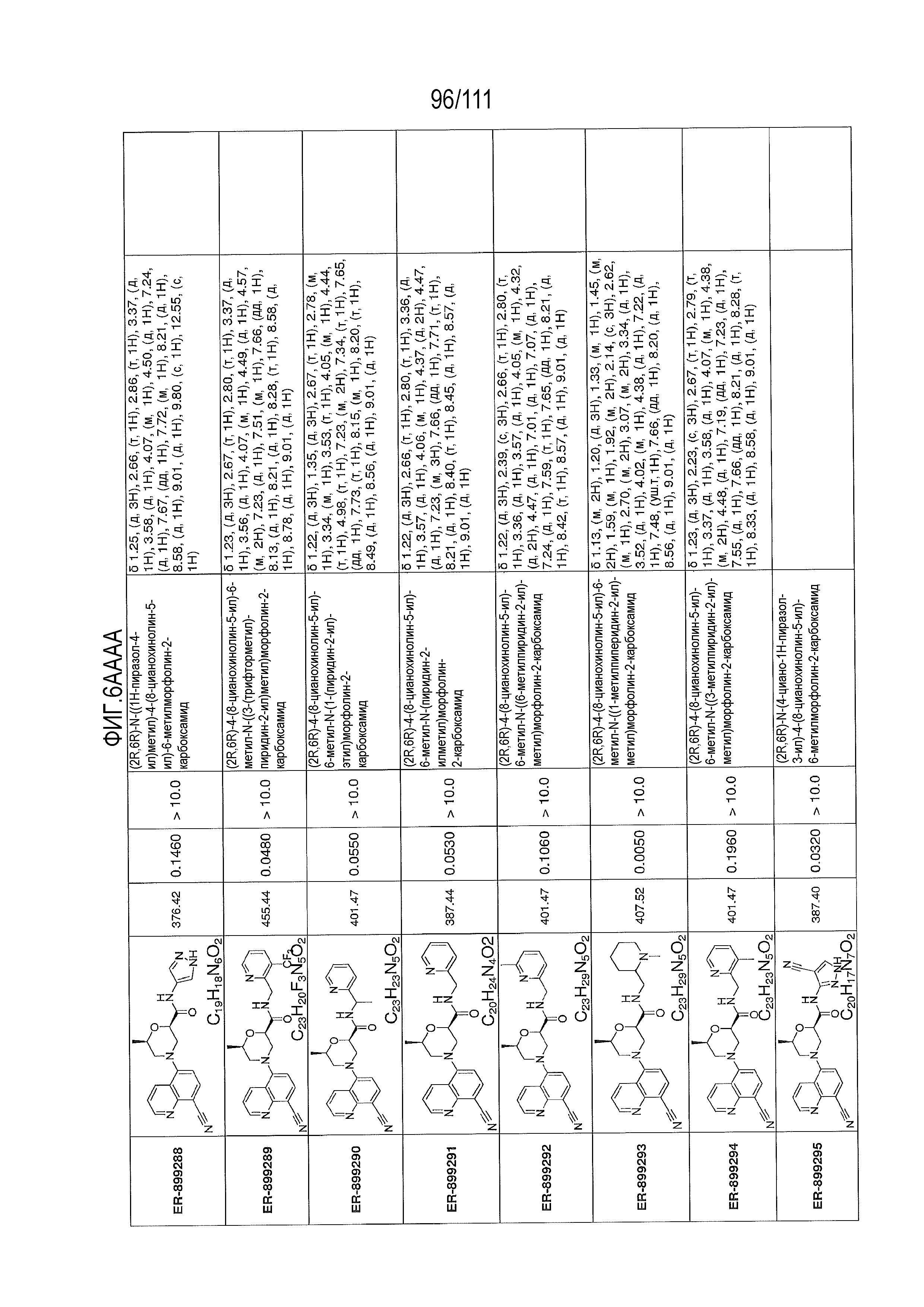
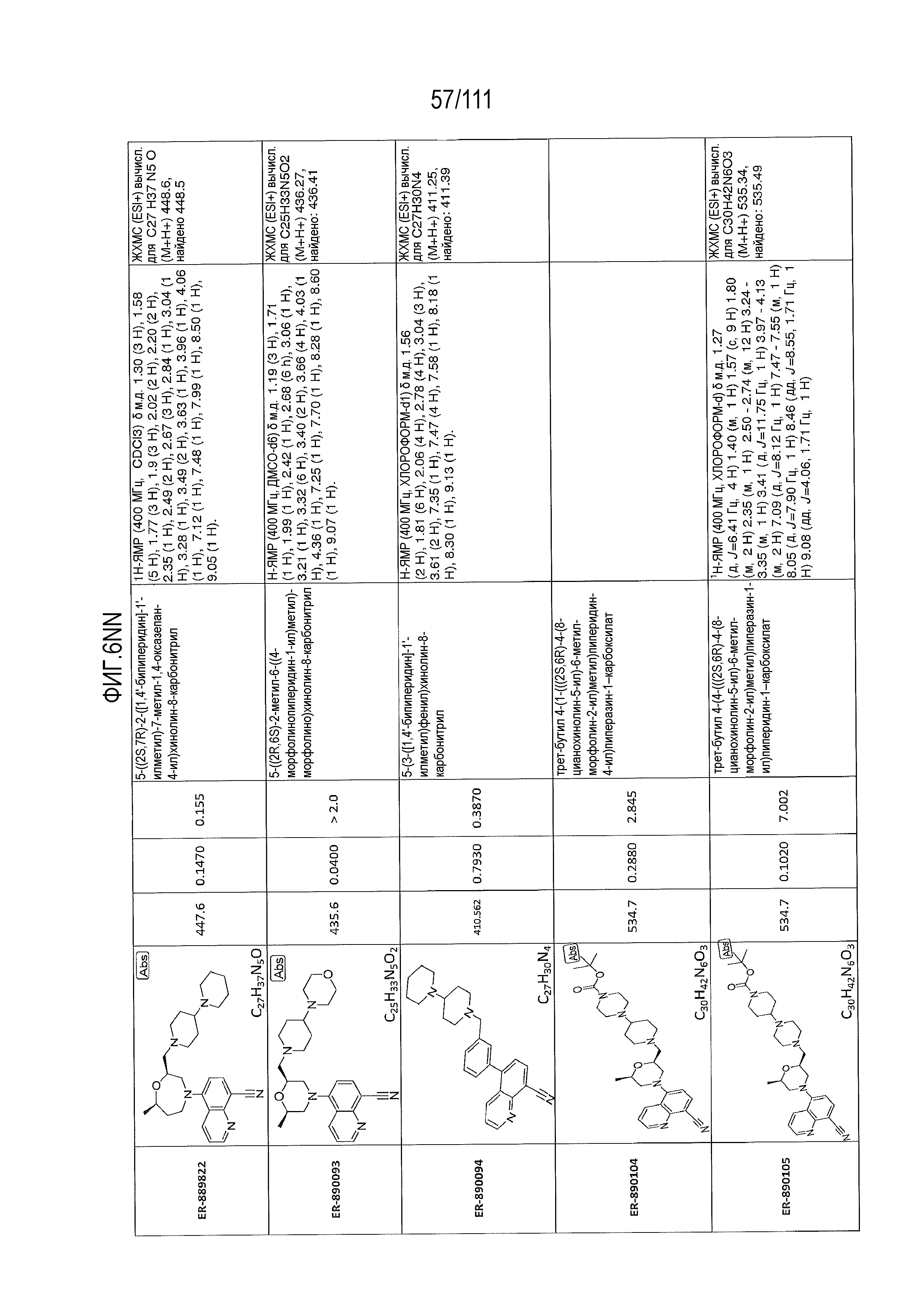
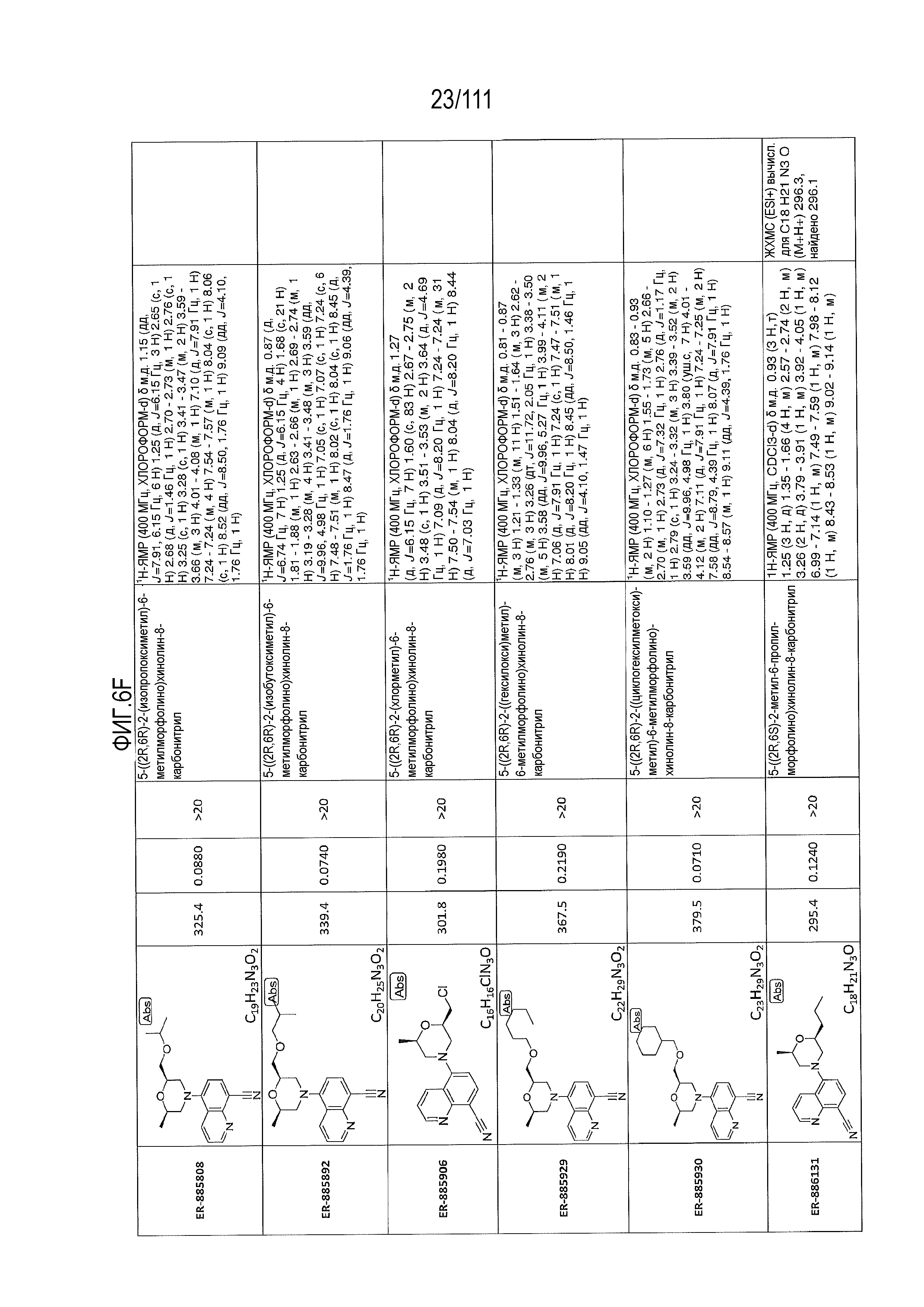
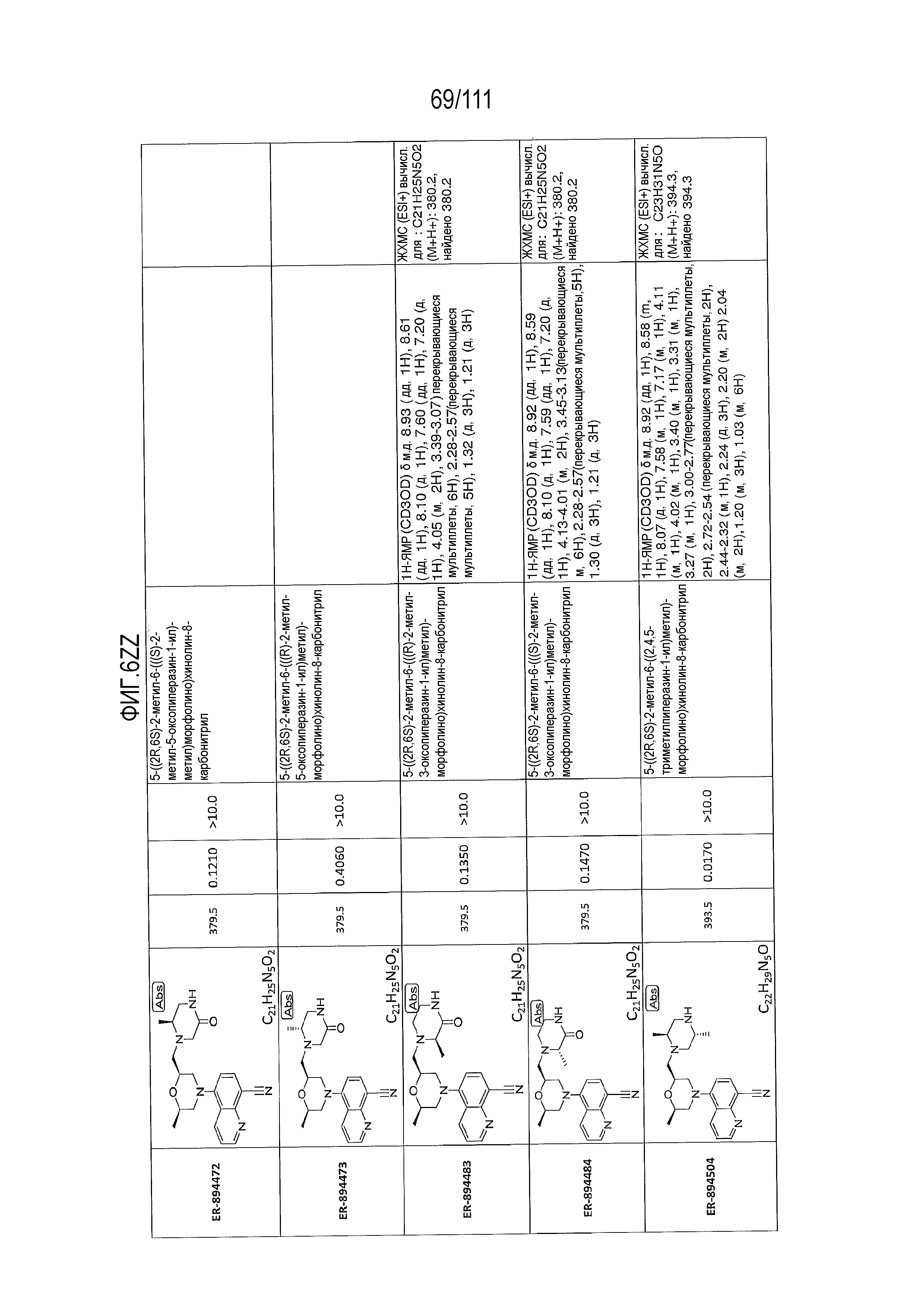
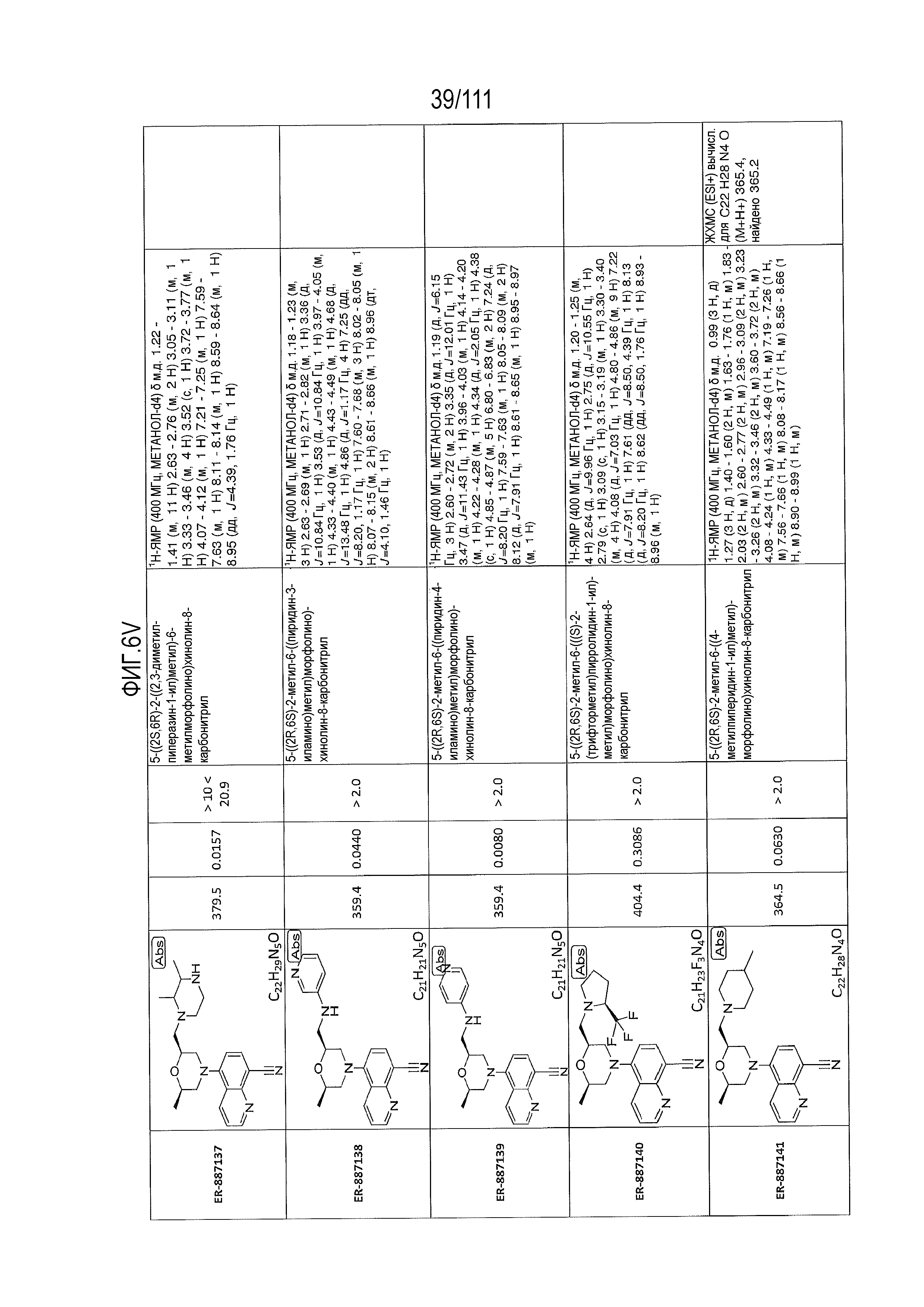
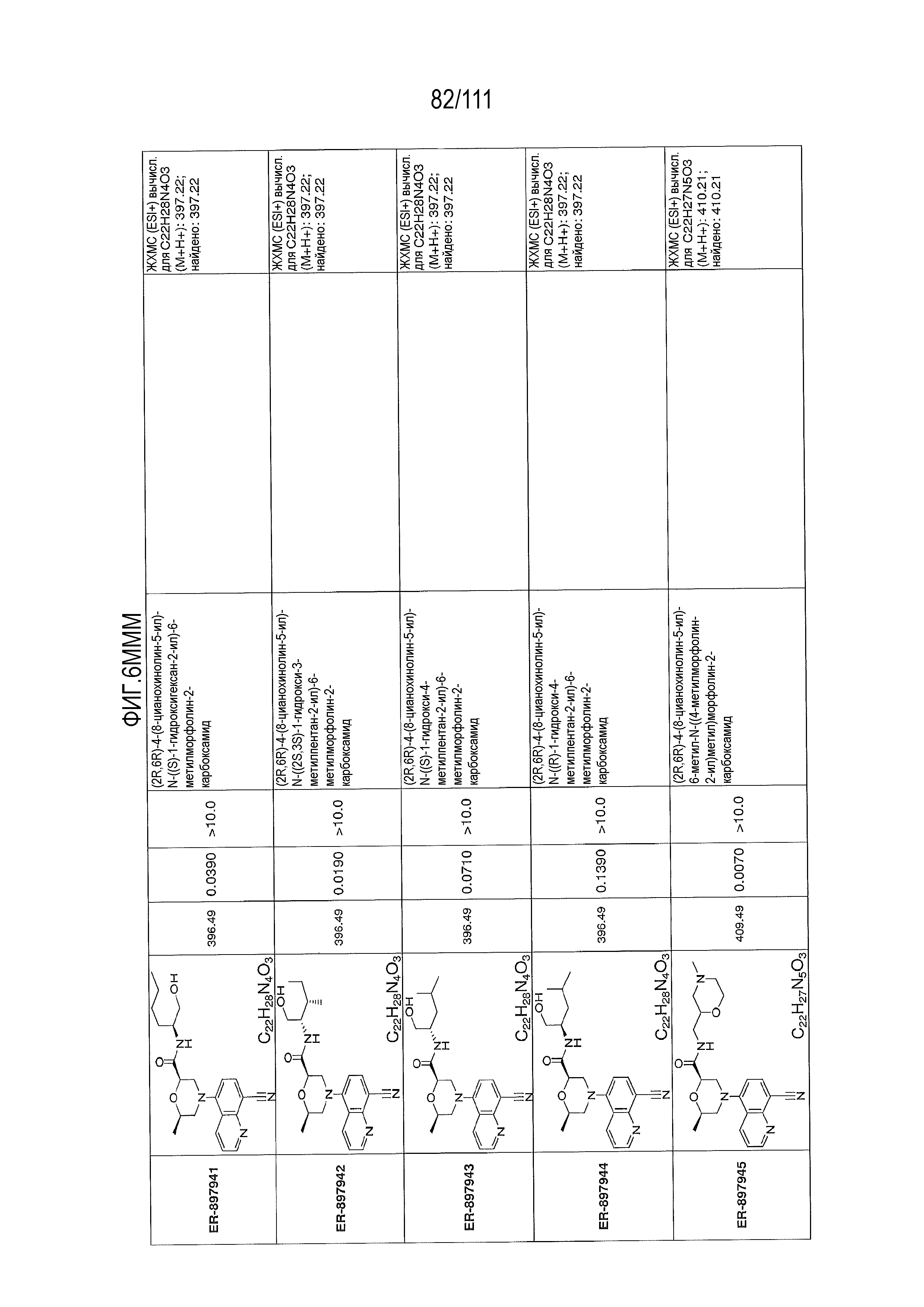
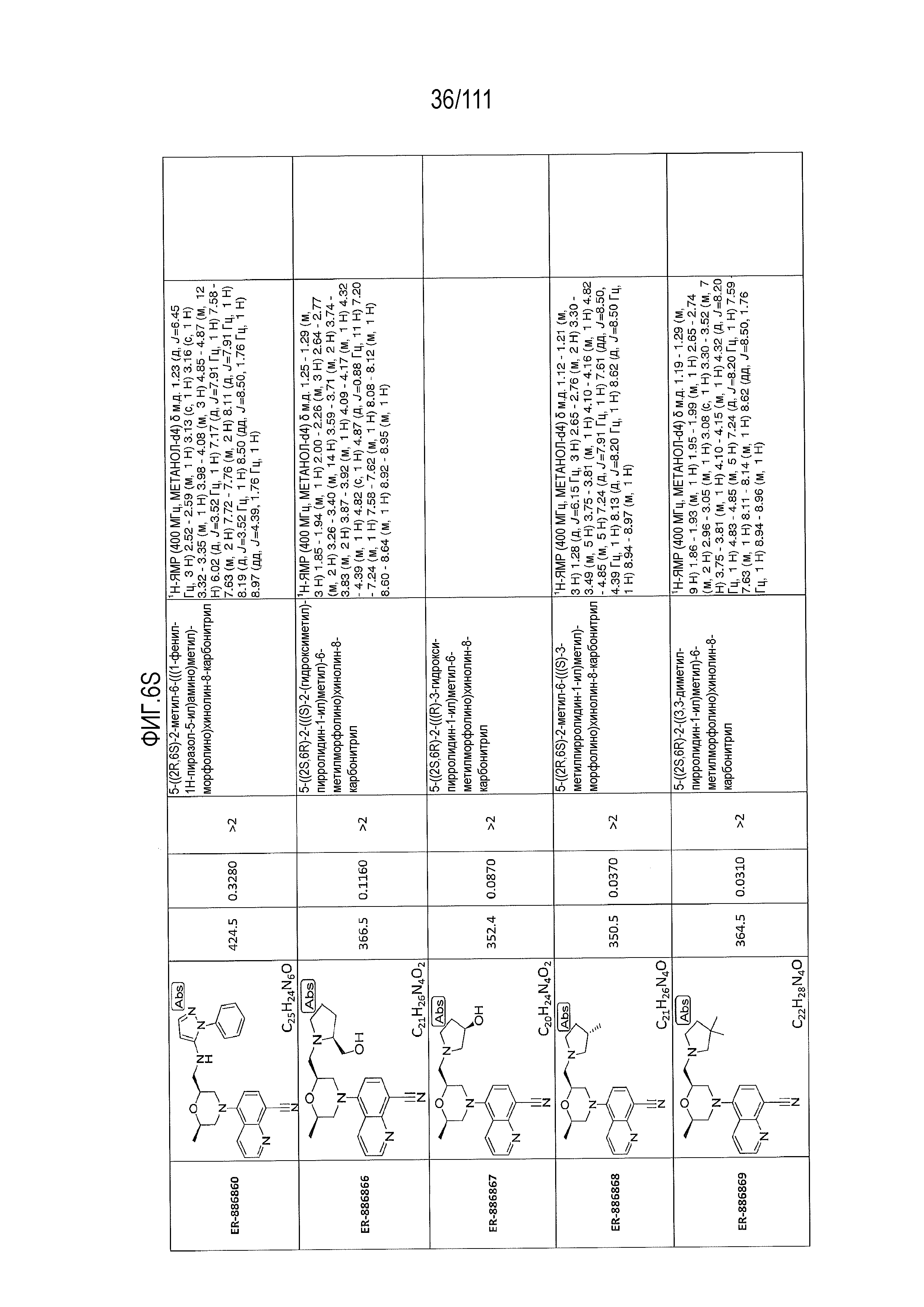
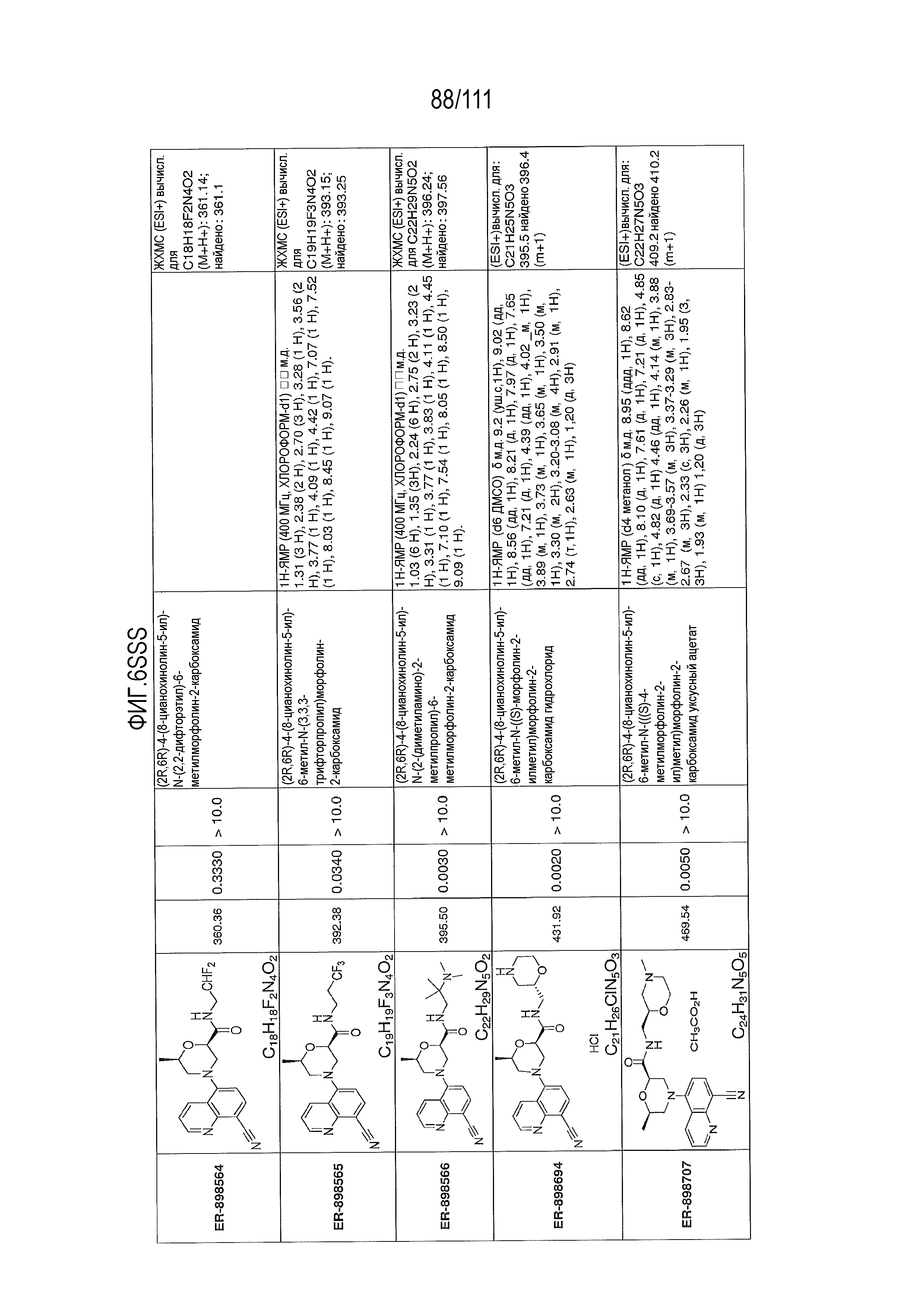
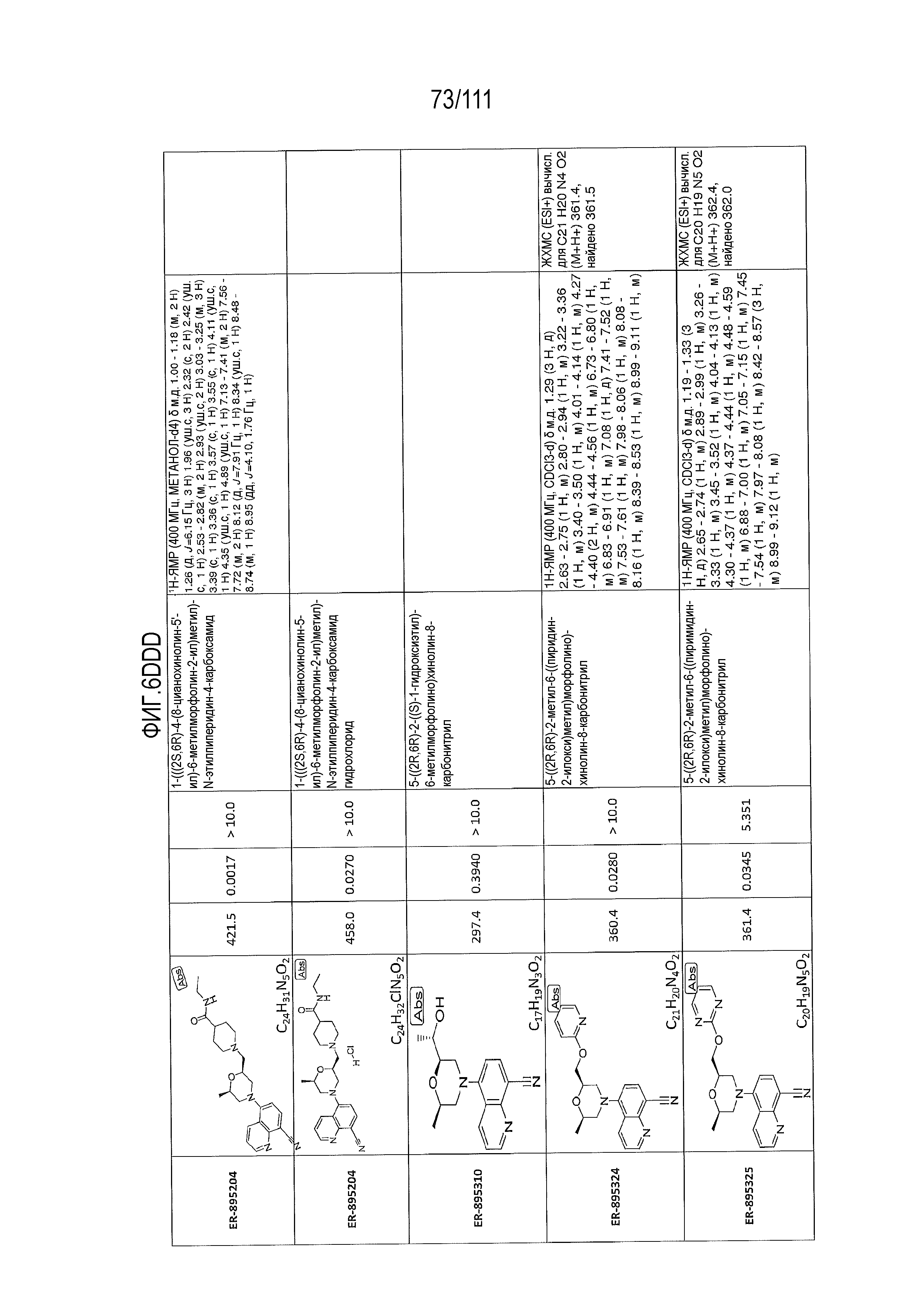
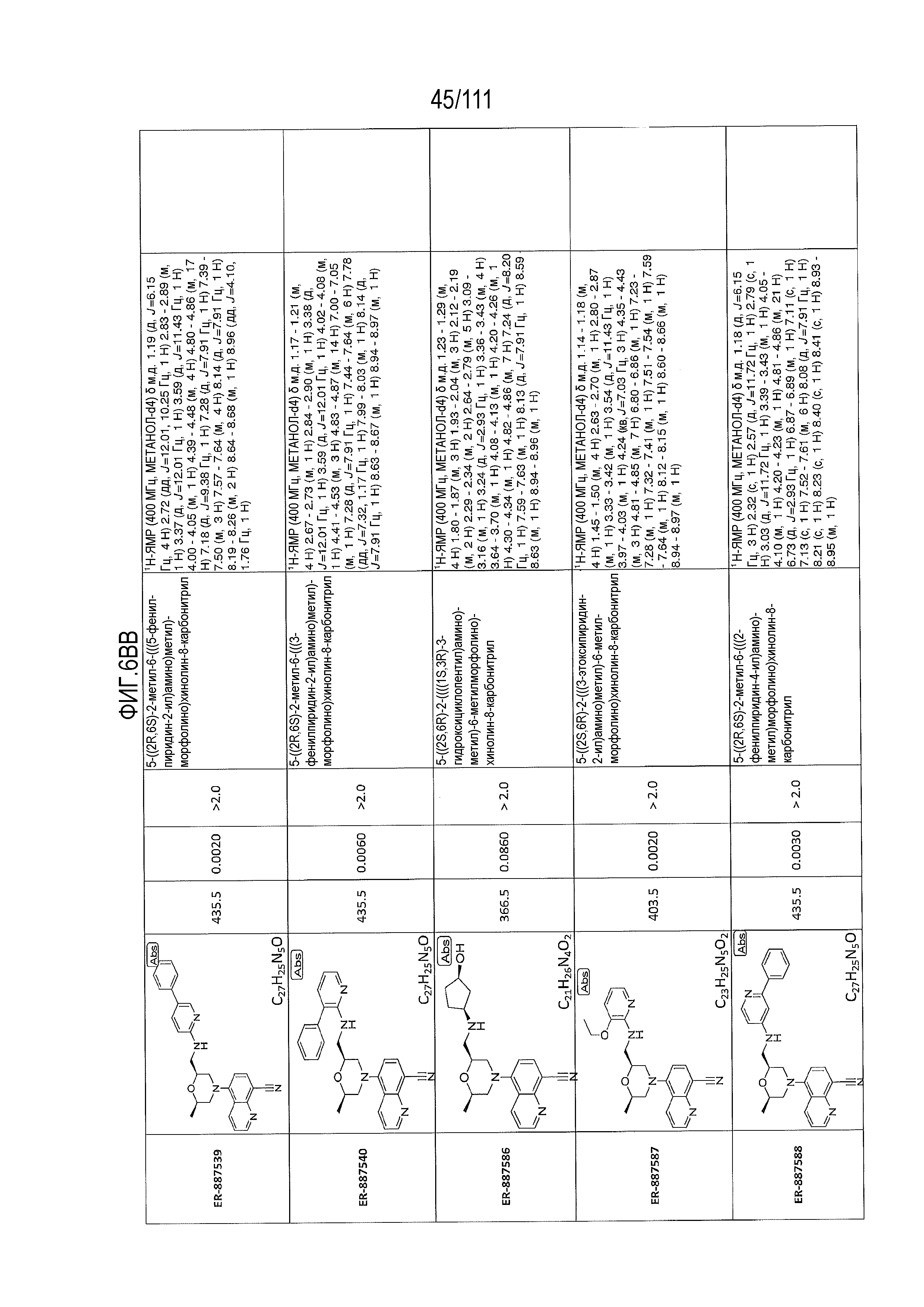
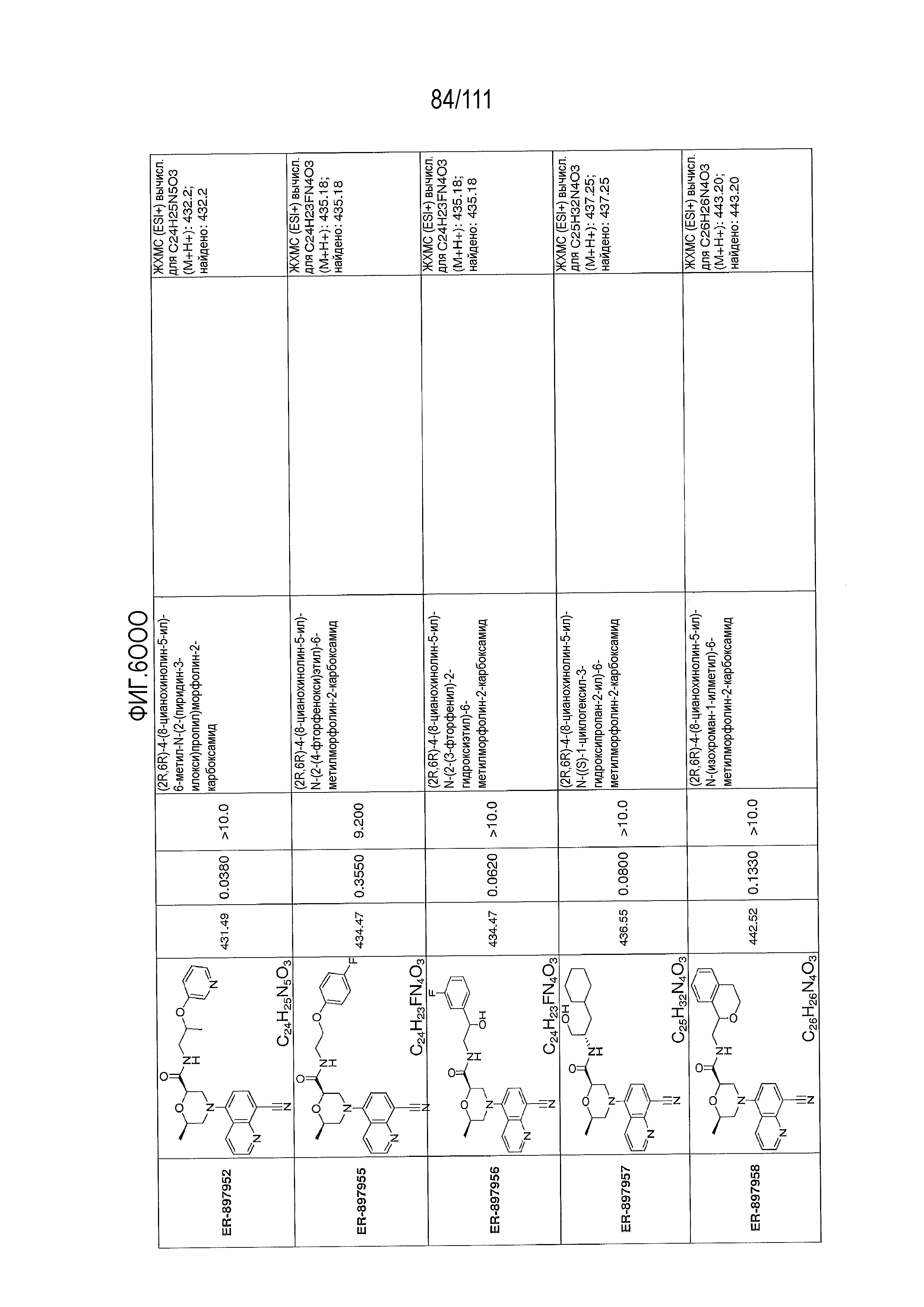
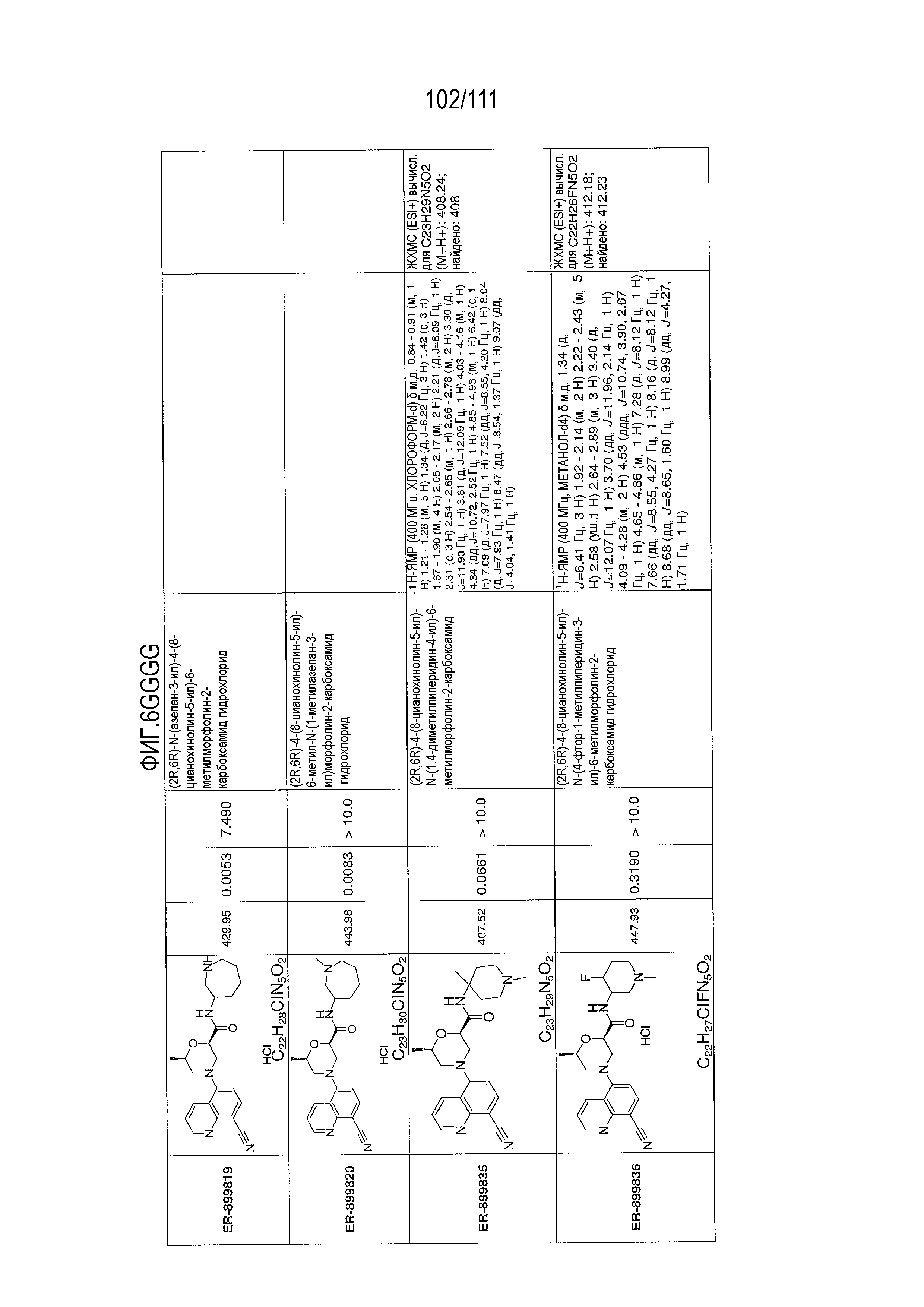
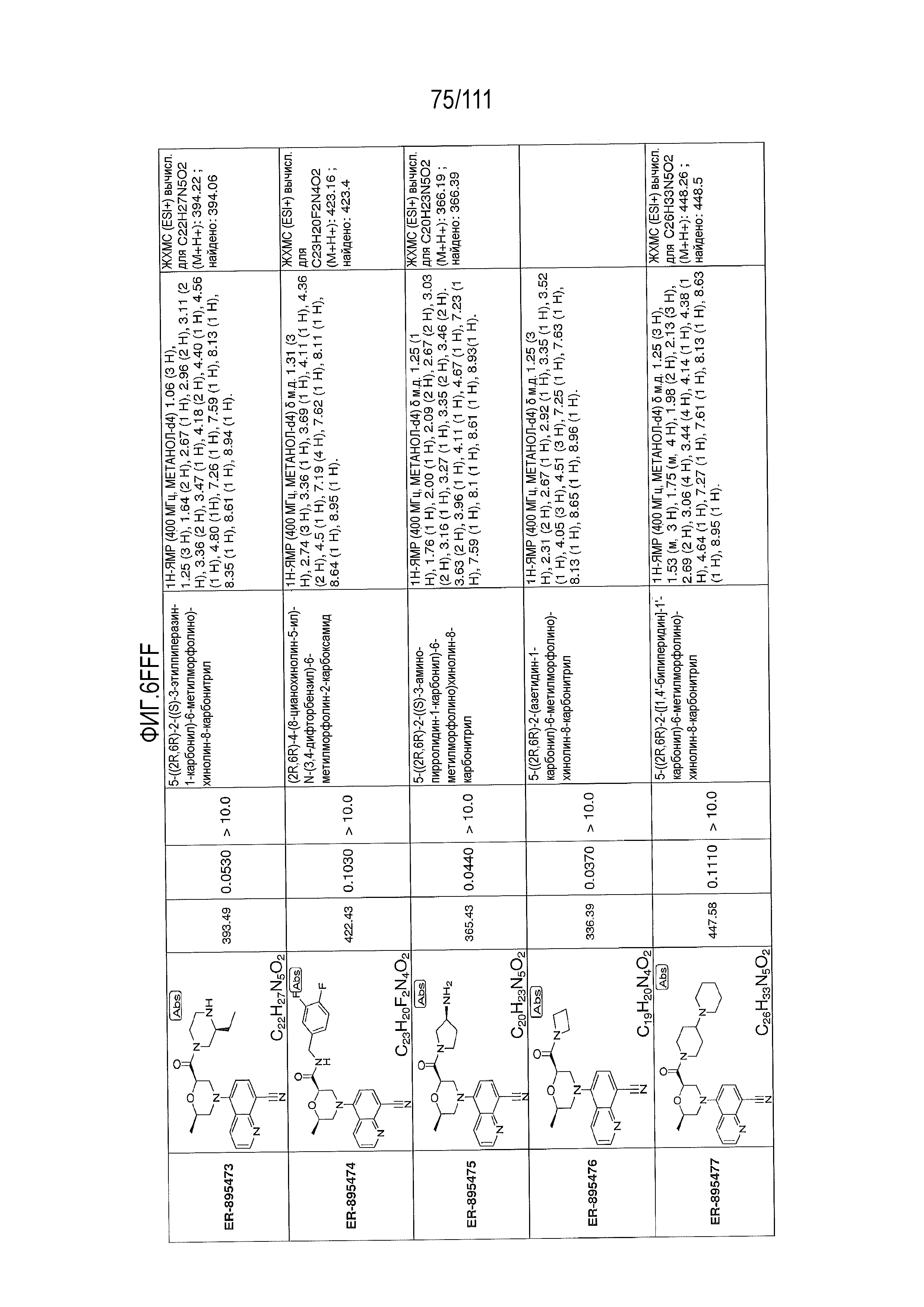
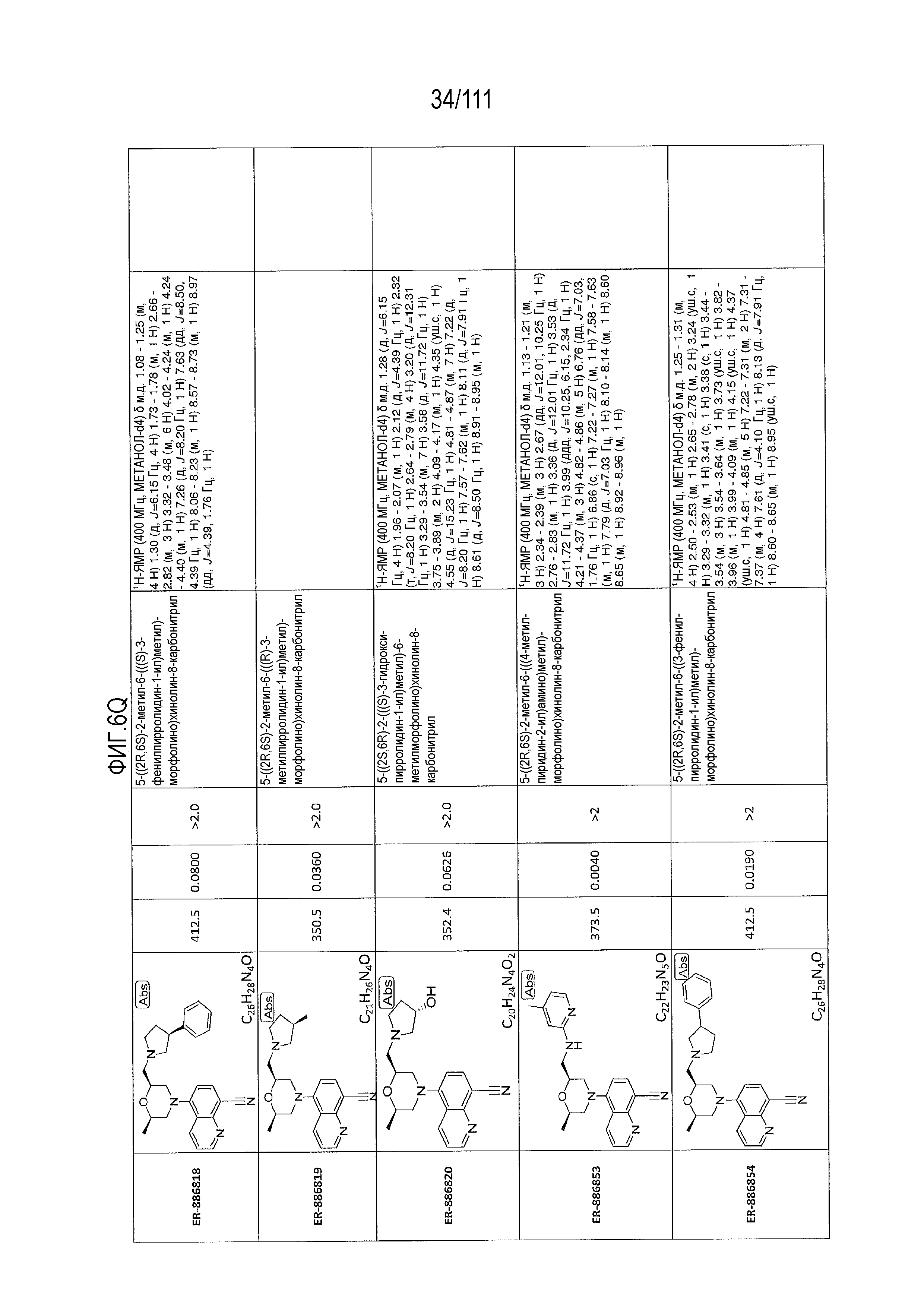
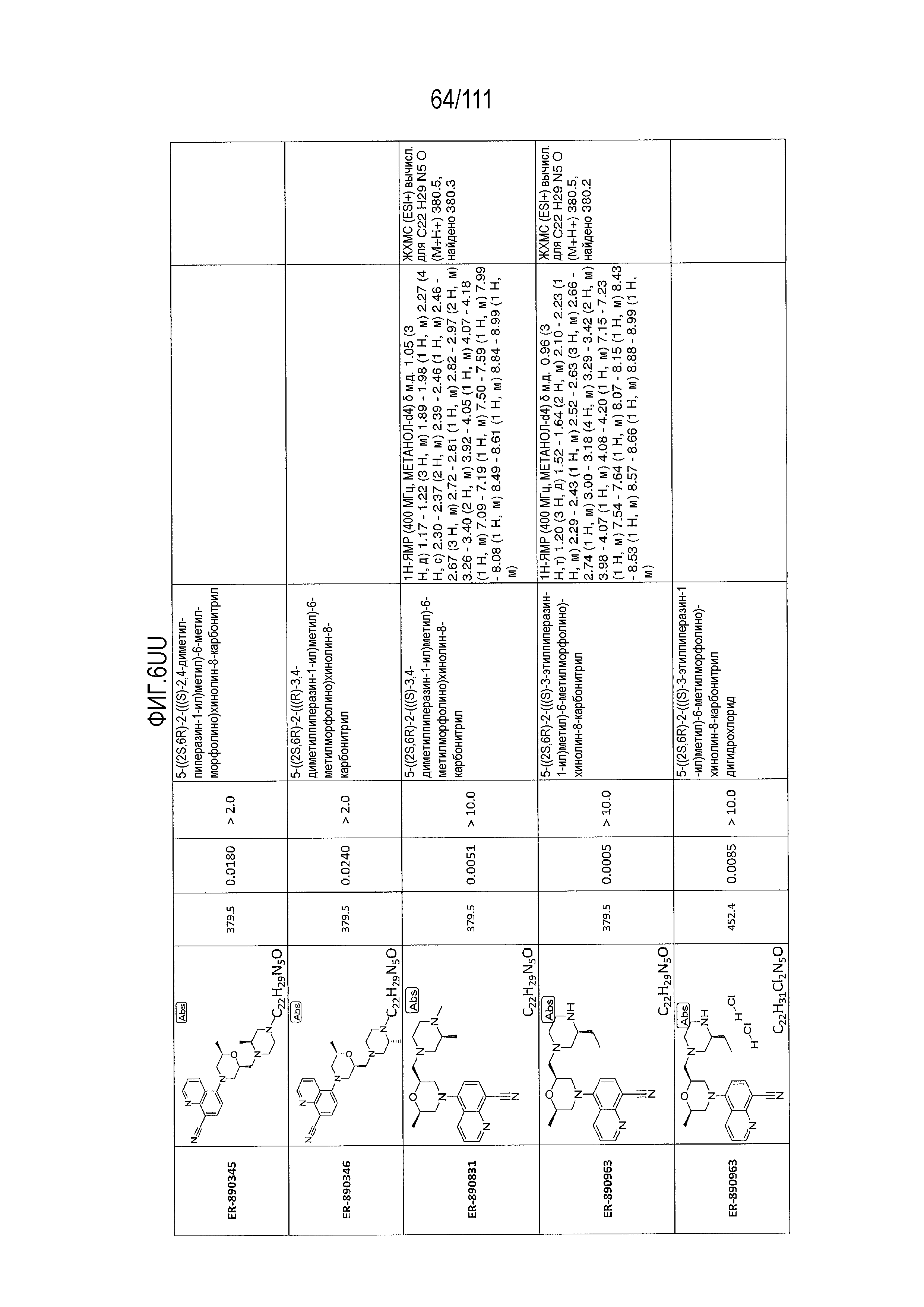
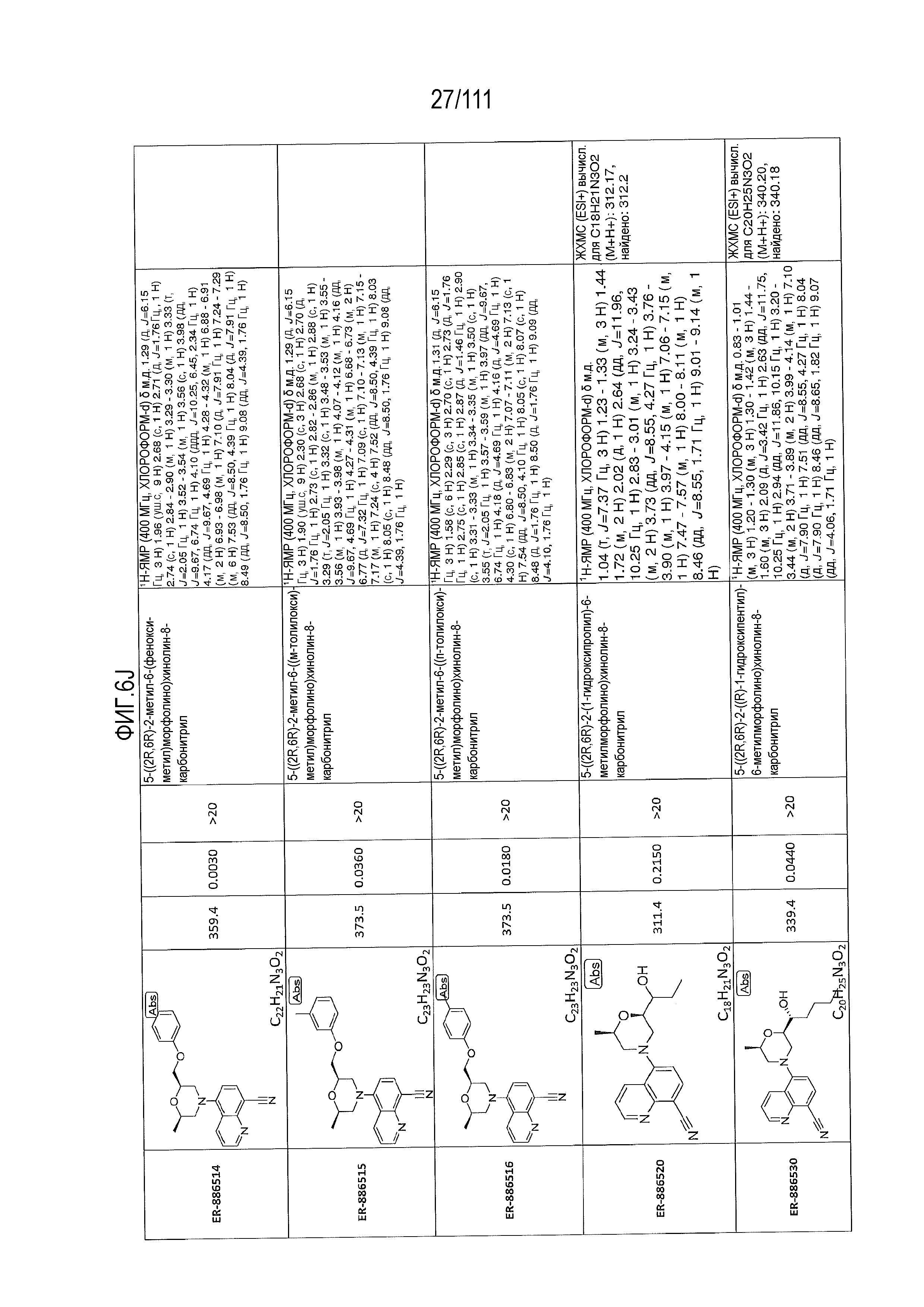
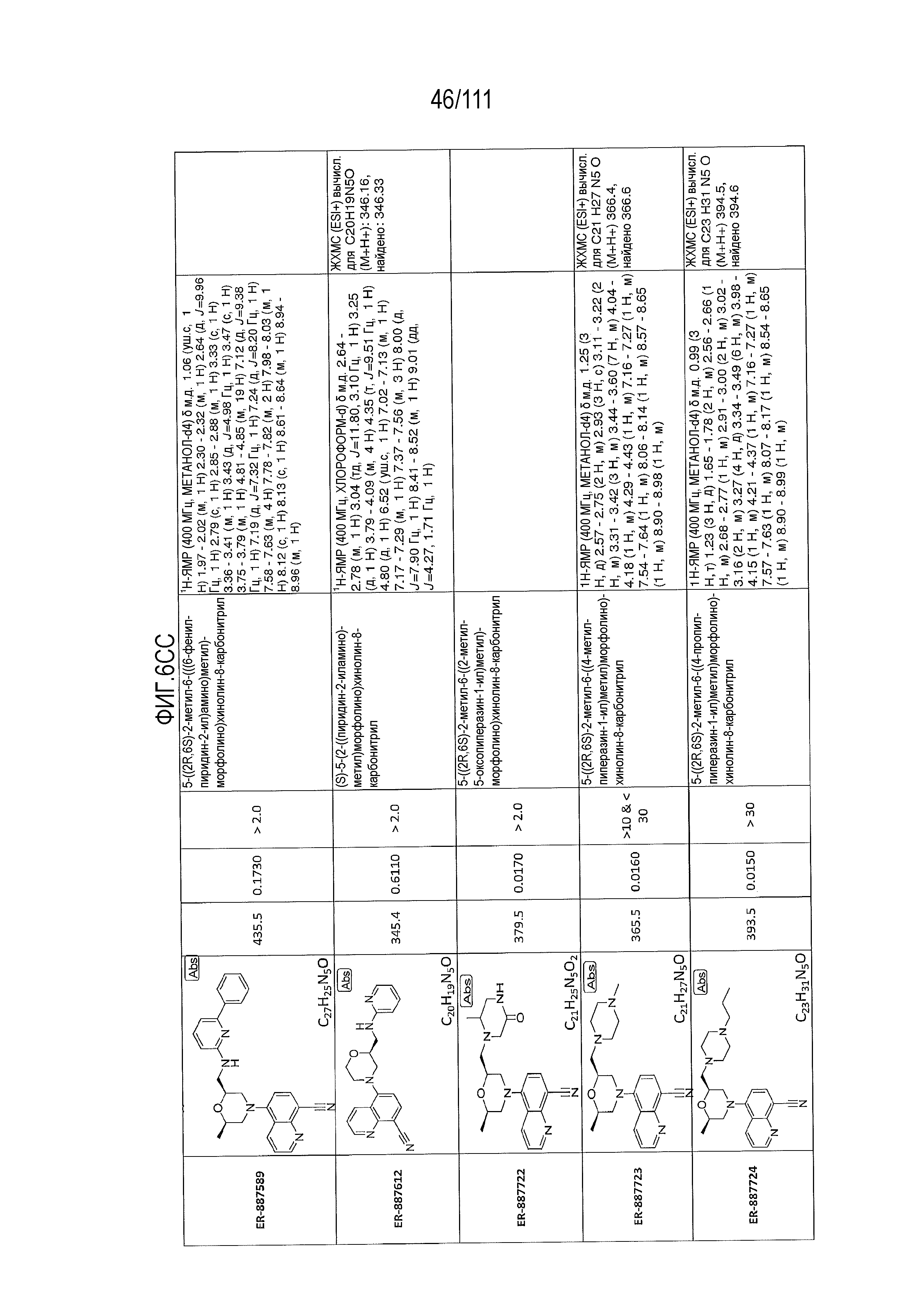
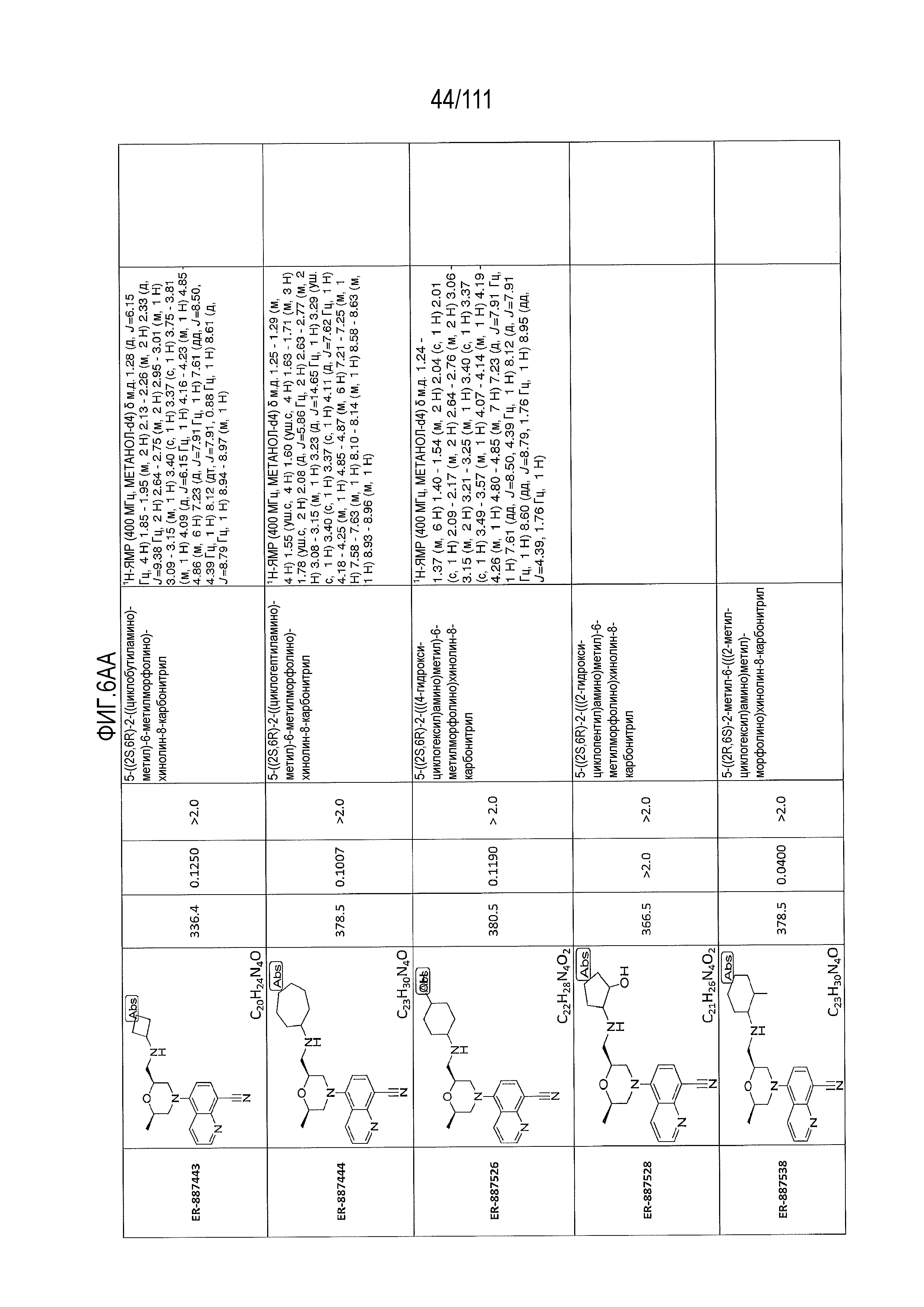
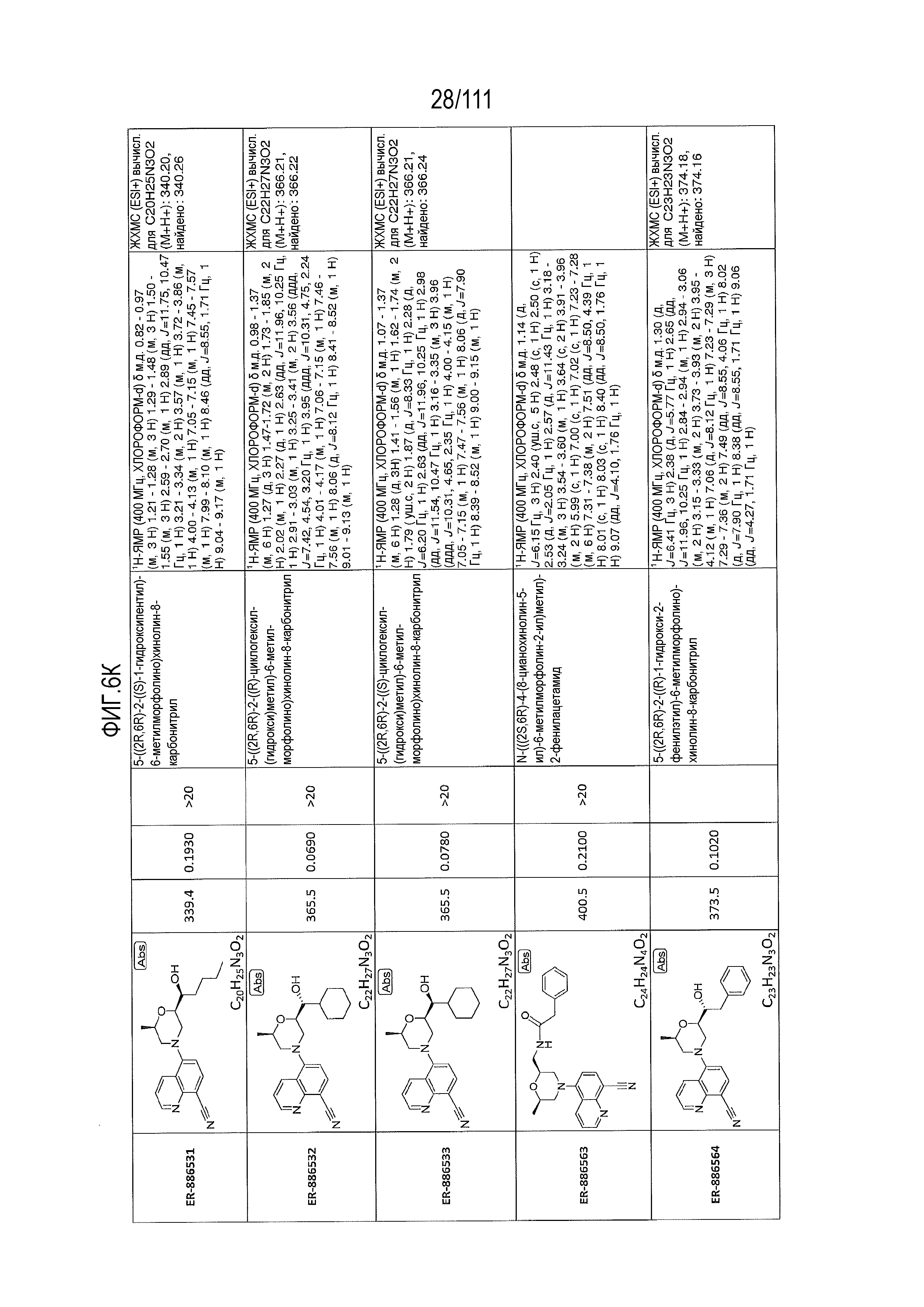
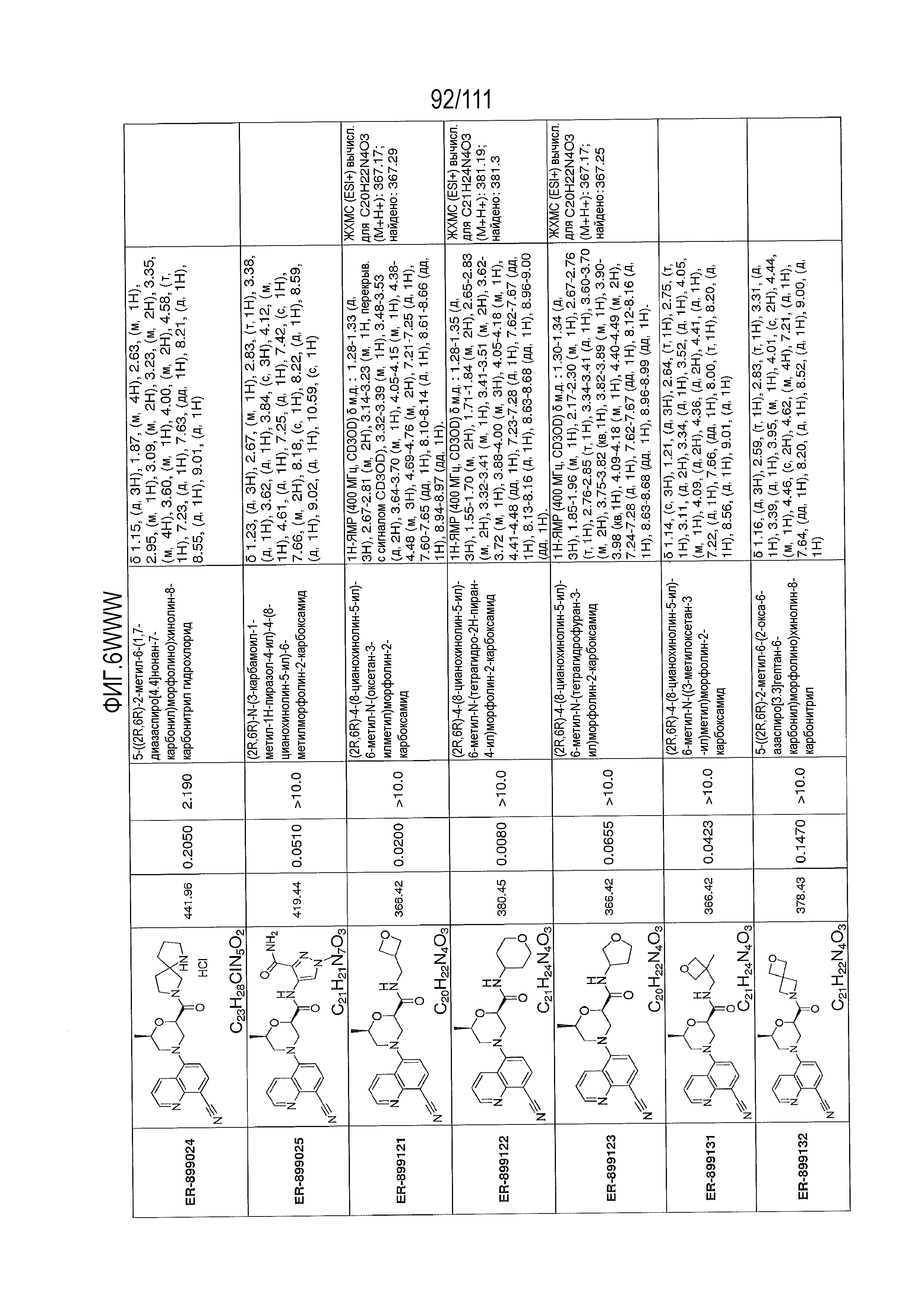
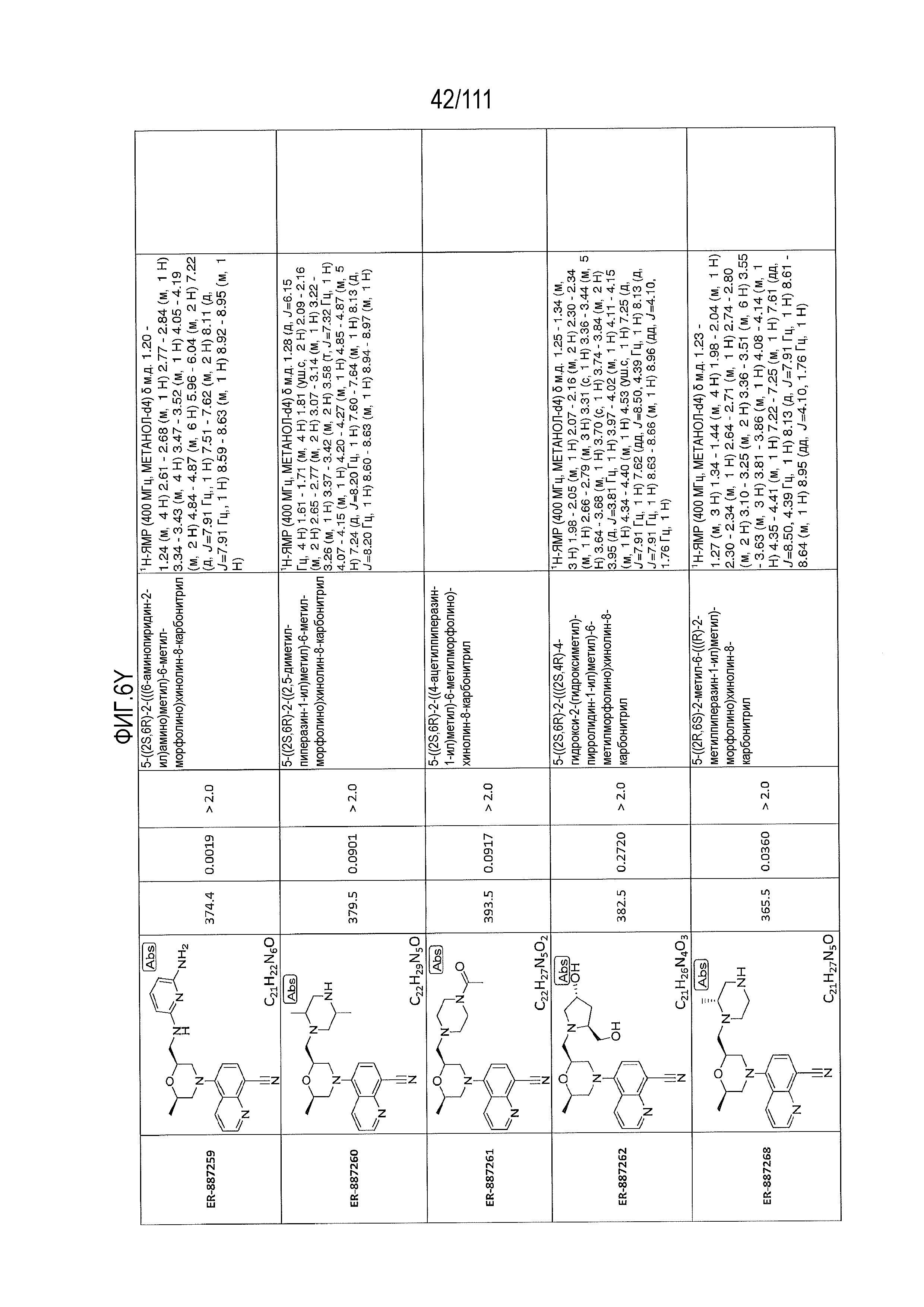
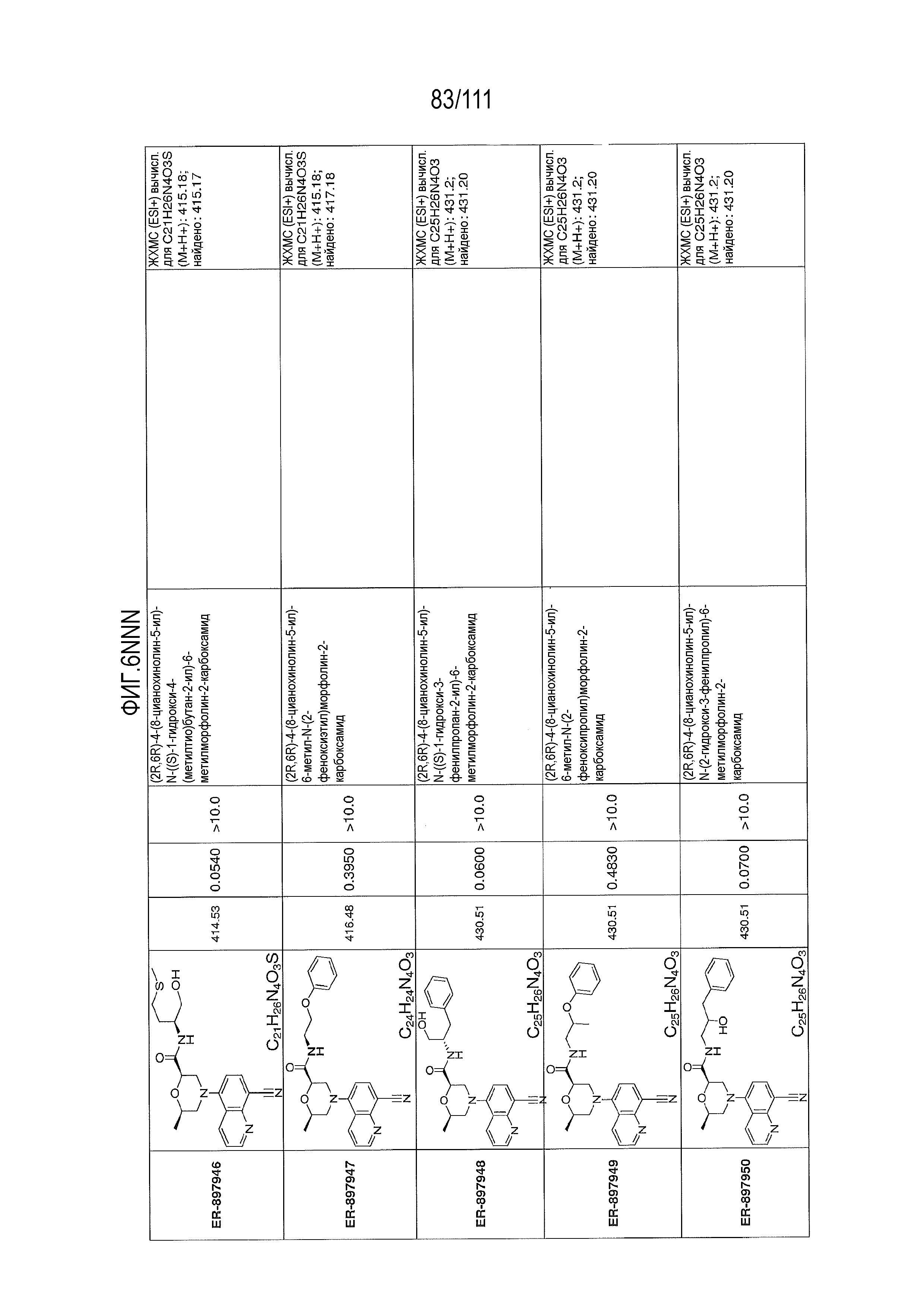
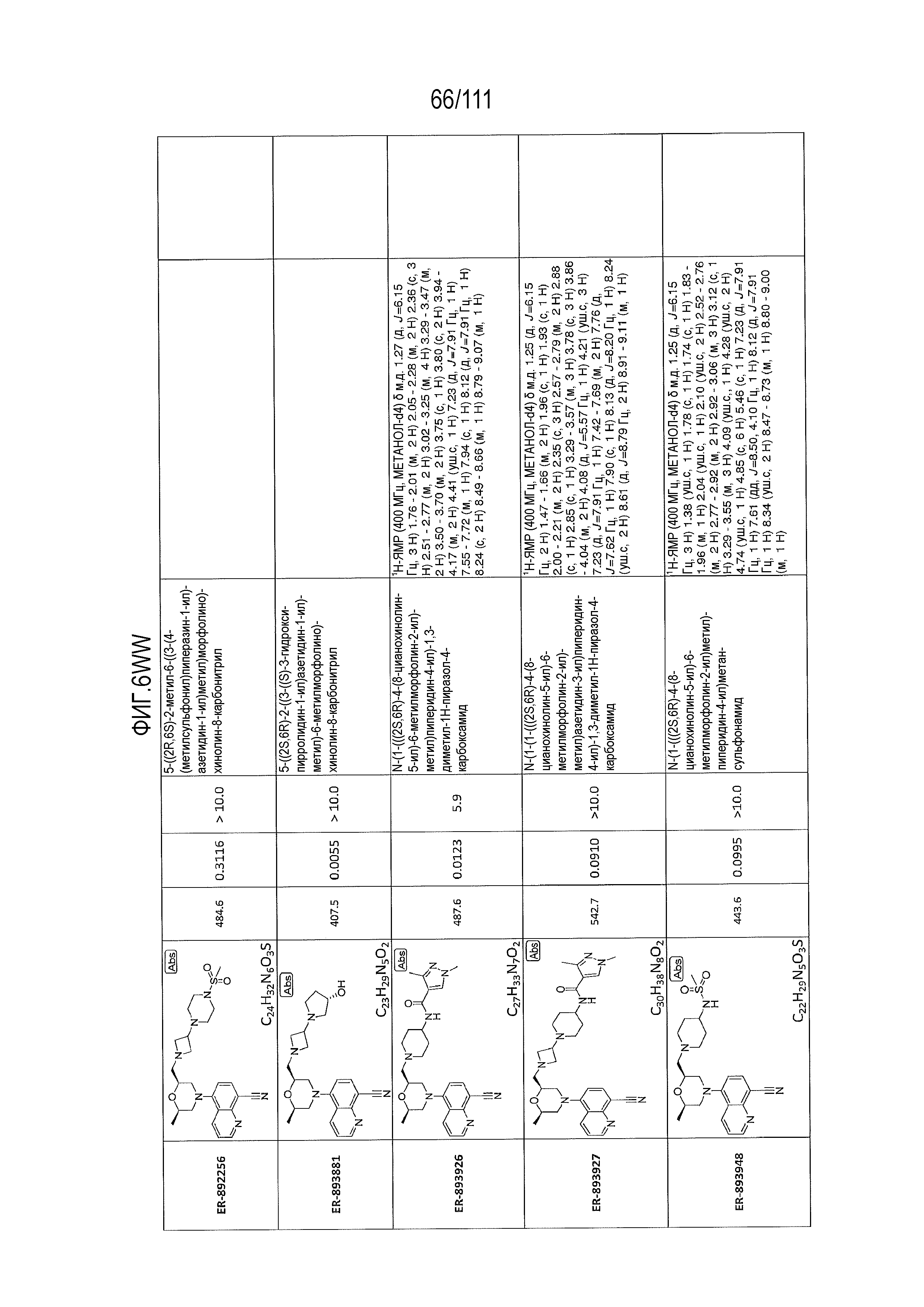
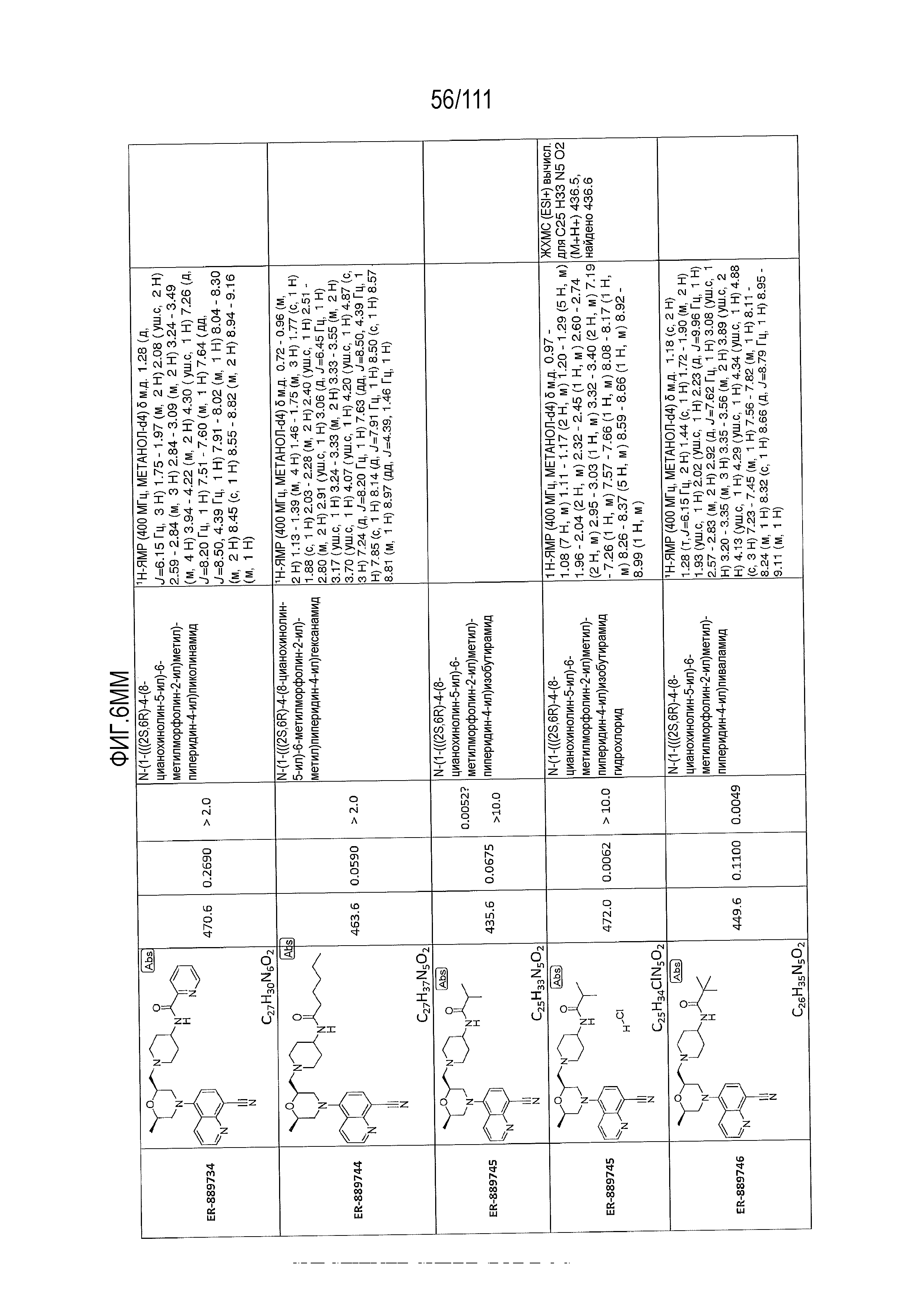
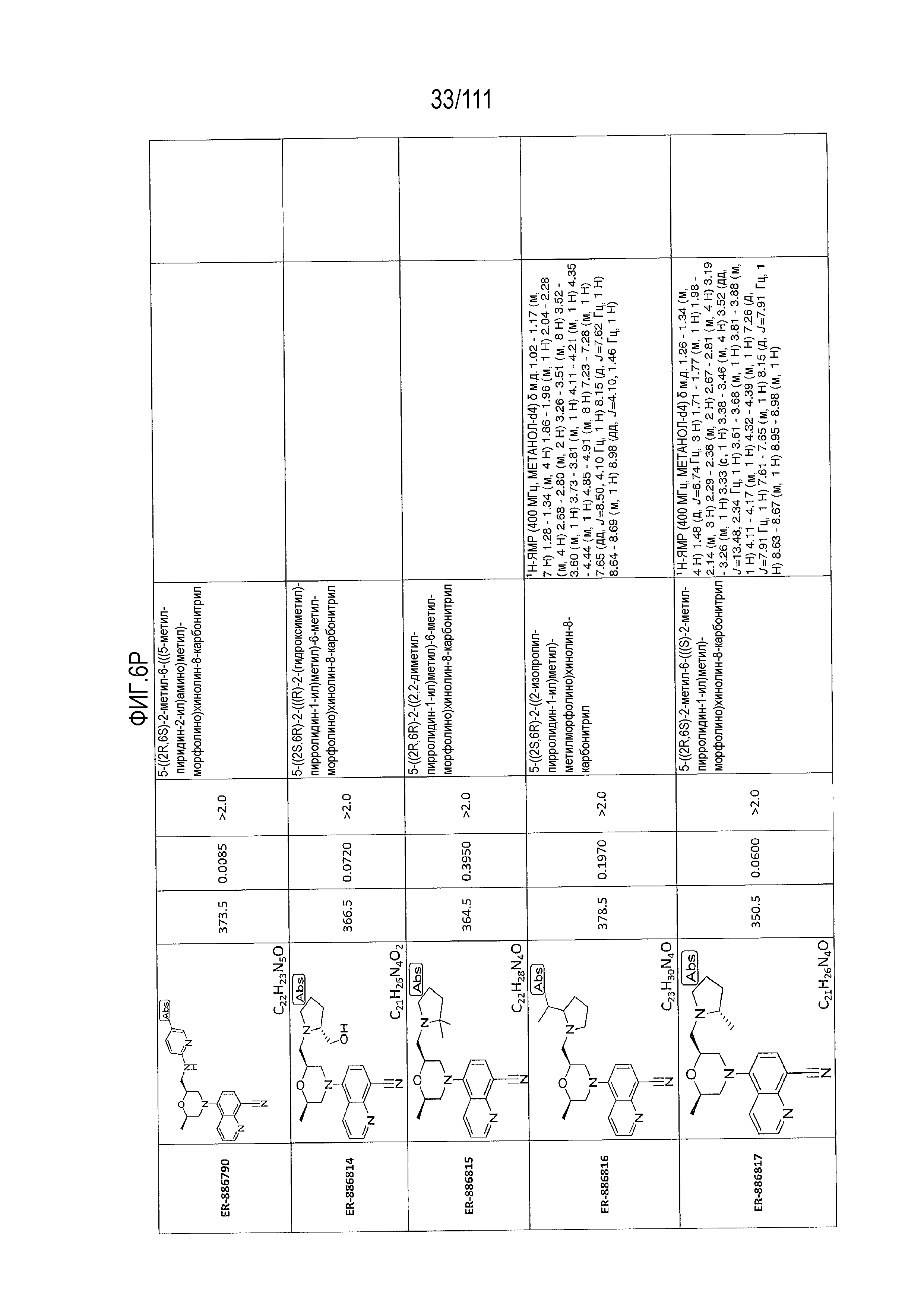
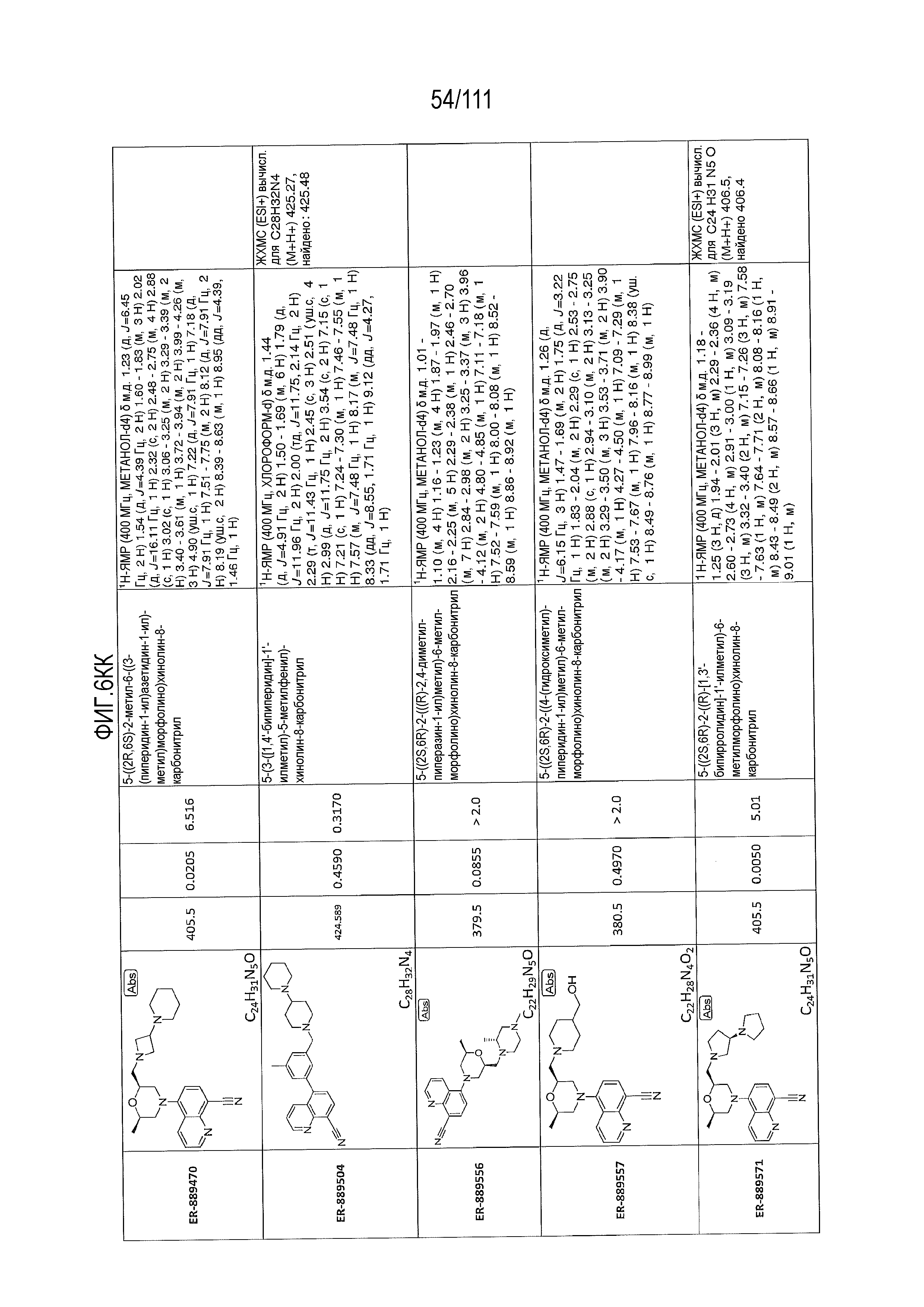
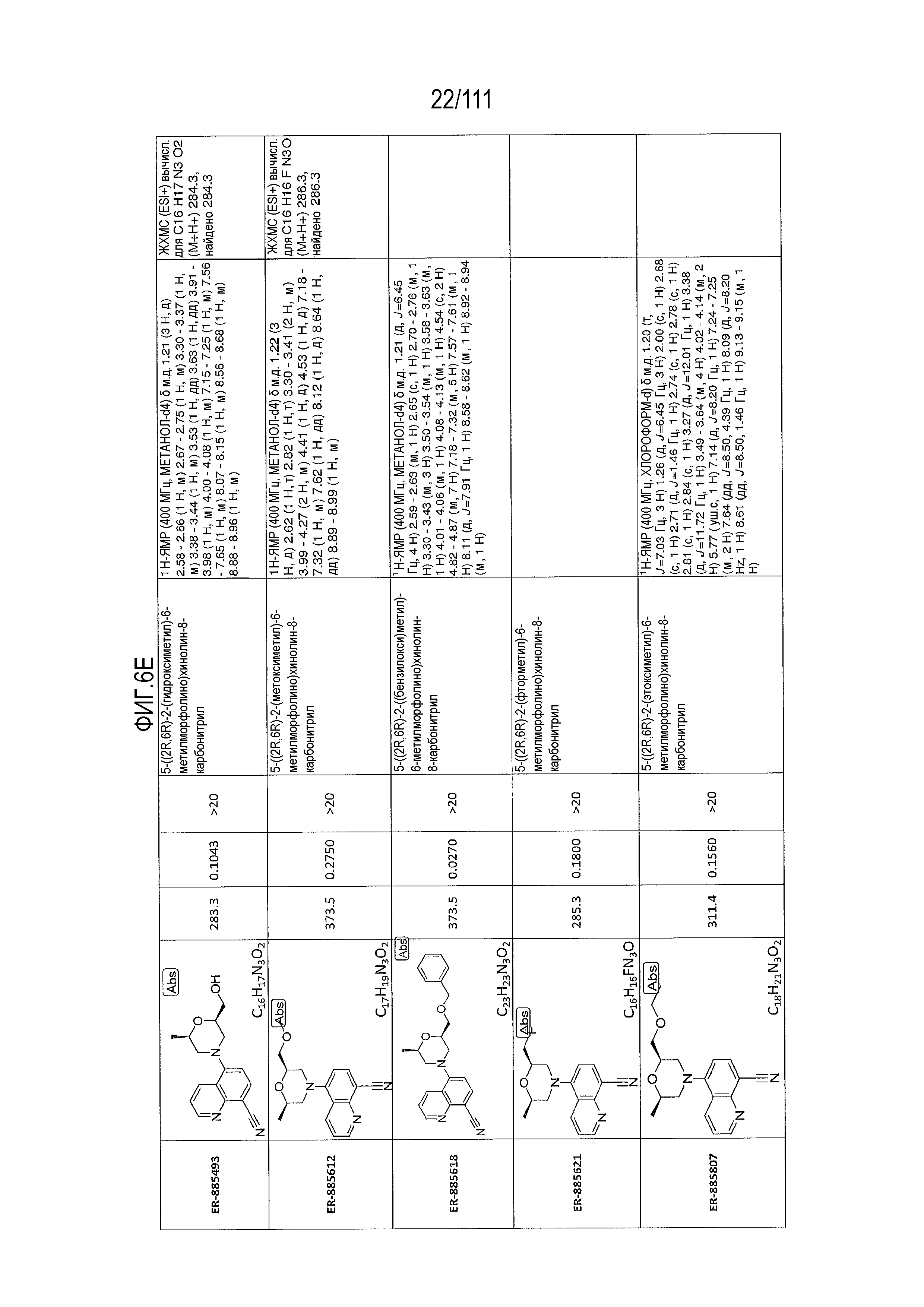
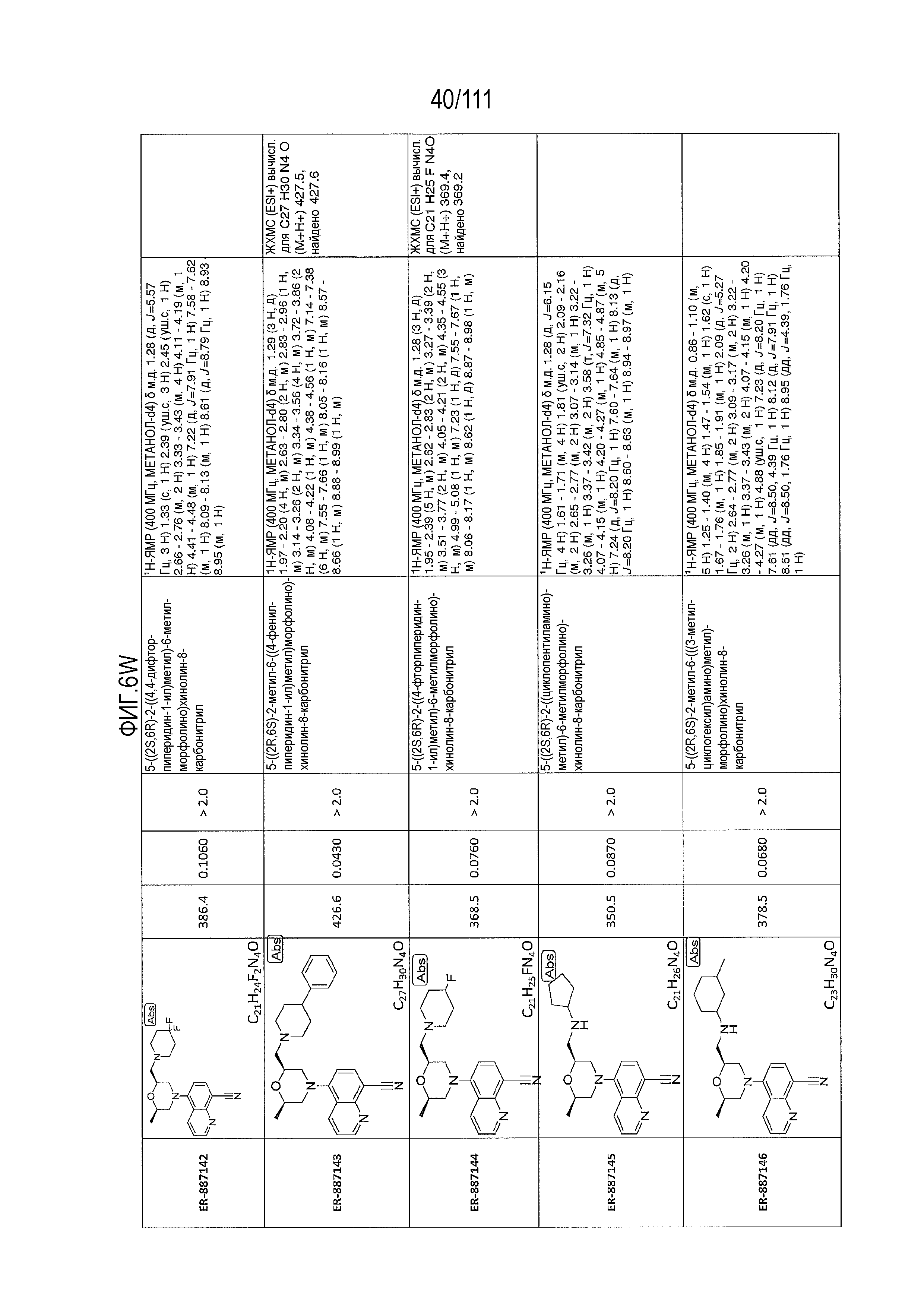
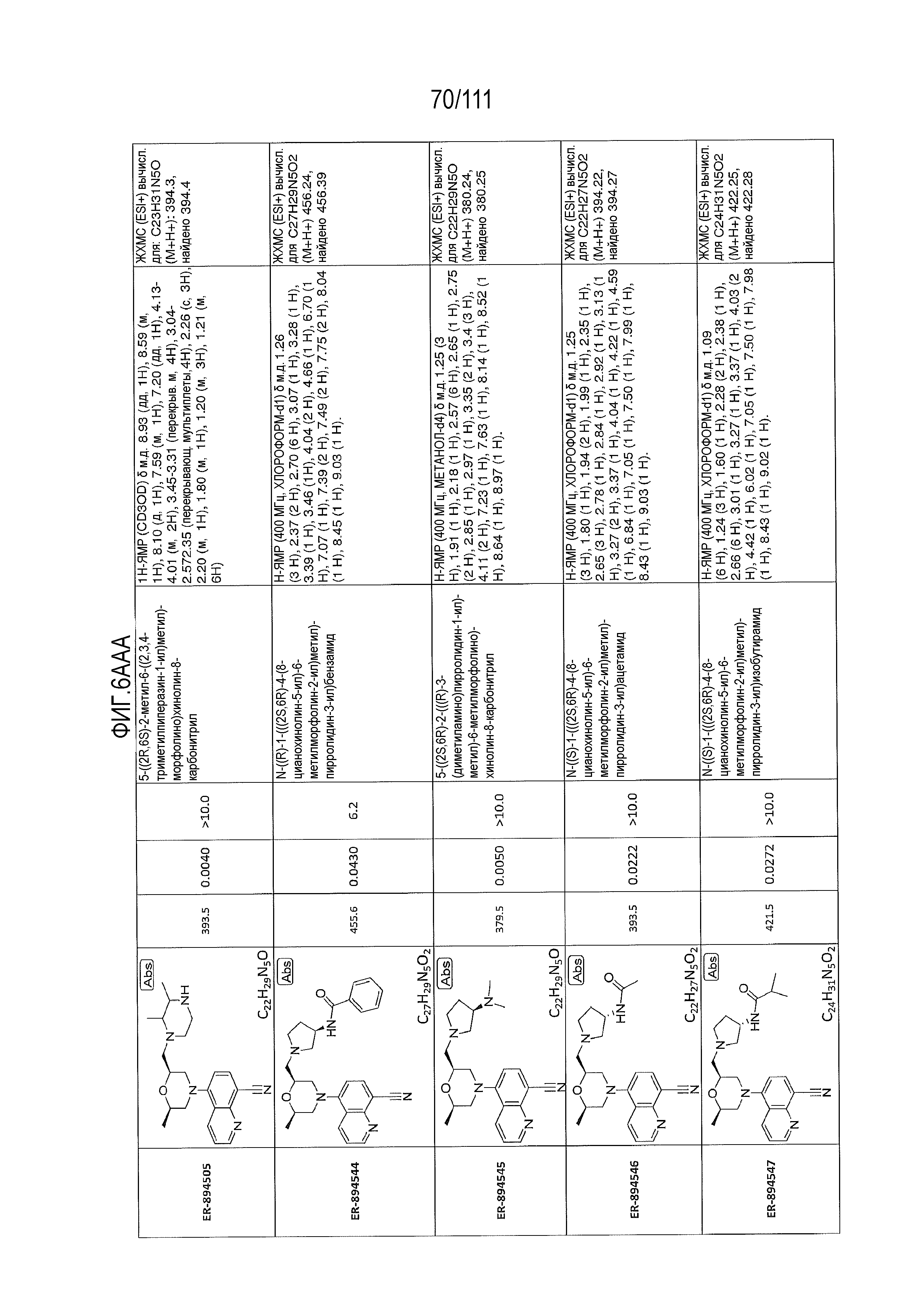
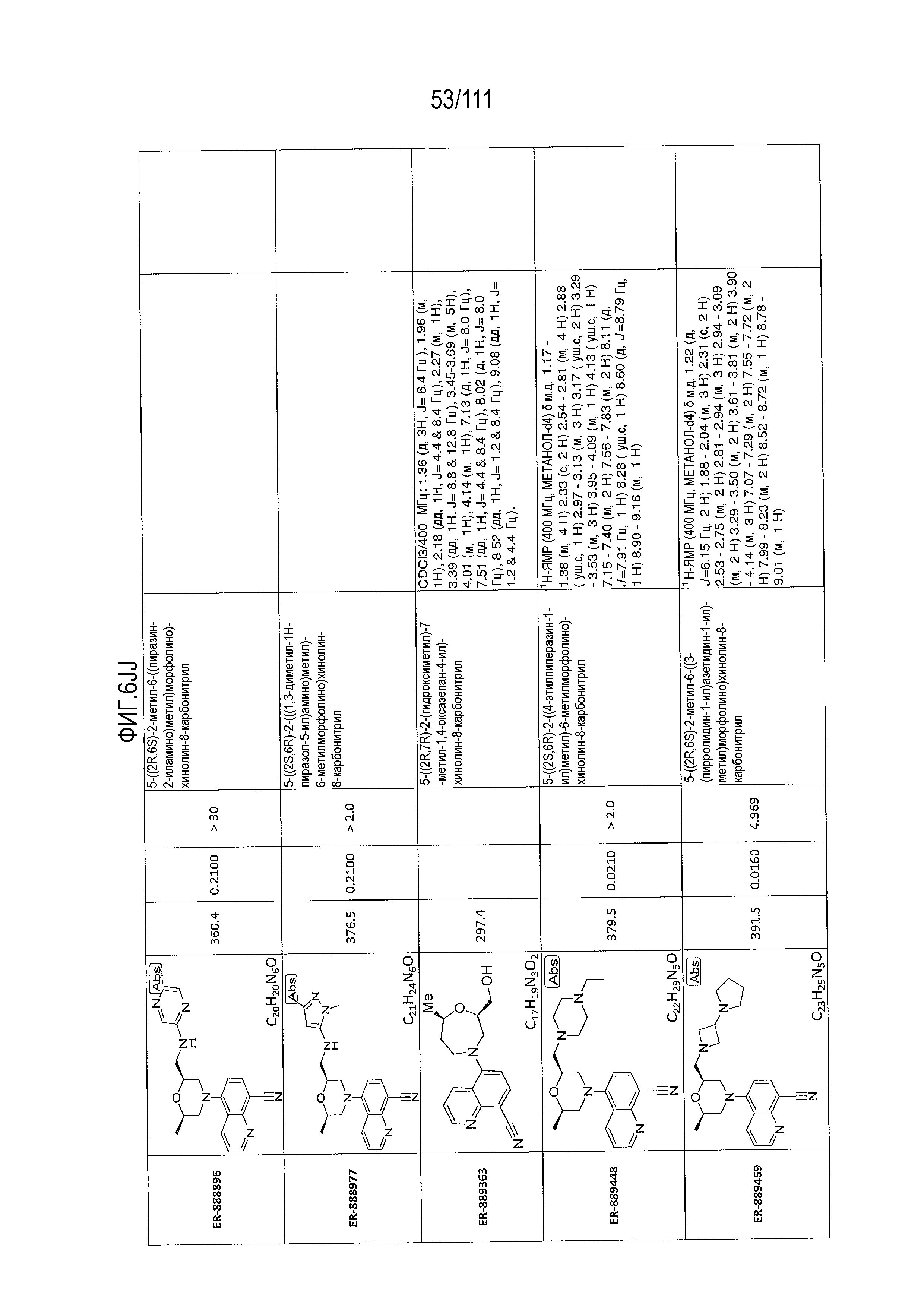
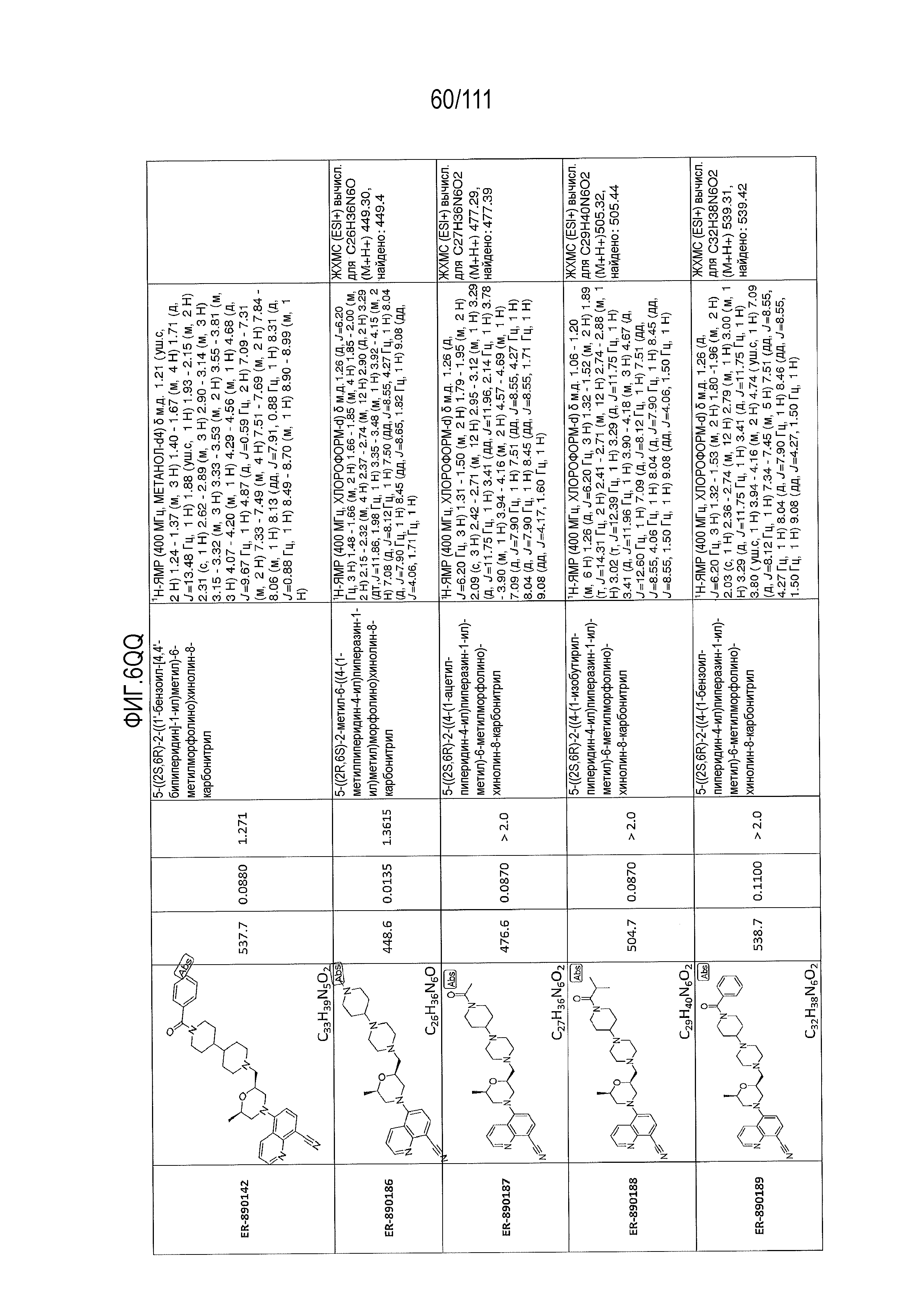
[0041] На фиг.6 показаны структуры и соответствующие химические названия в соответствии с различными вариантами осуществления, представленными в настоящем документе. «ER-номер” является ссылочным номером, присвоенным каждому соединению. Там, где возможно, также включены показатели активности по отношению к клеточной линии НЕК, стабильно экспрессирующей человеческий TLR7, активности по отношению к клеточной линии НЕК, стабильно экспрессирующей человеческий TLR9, данные 1H ЯМР и данные масс-спектрометрии.
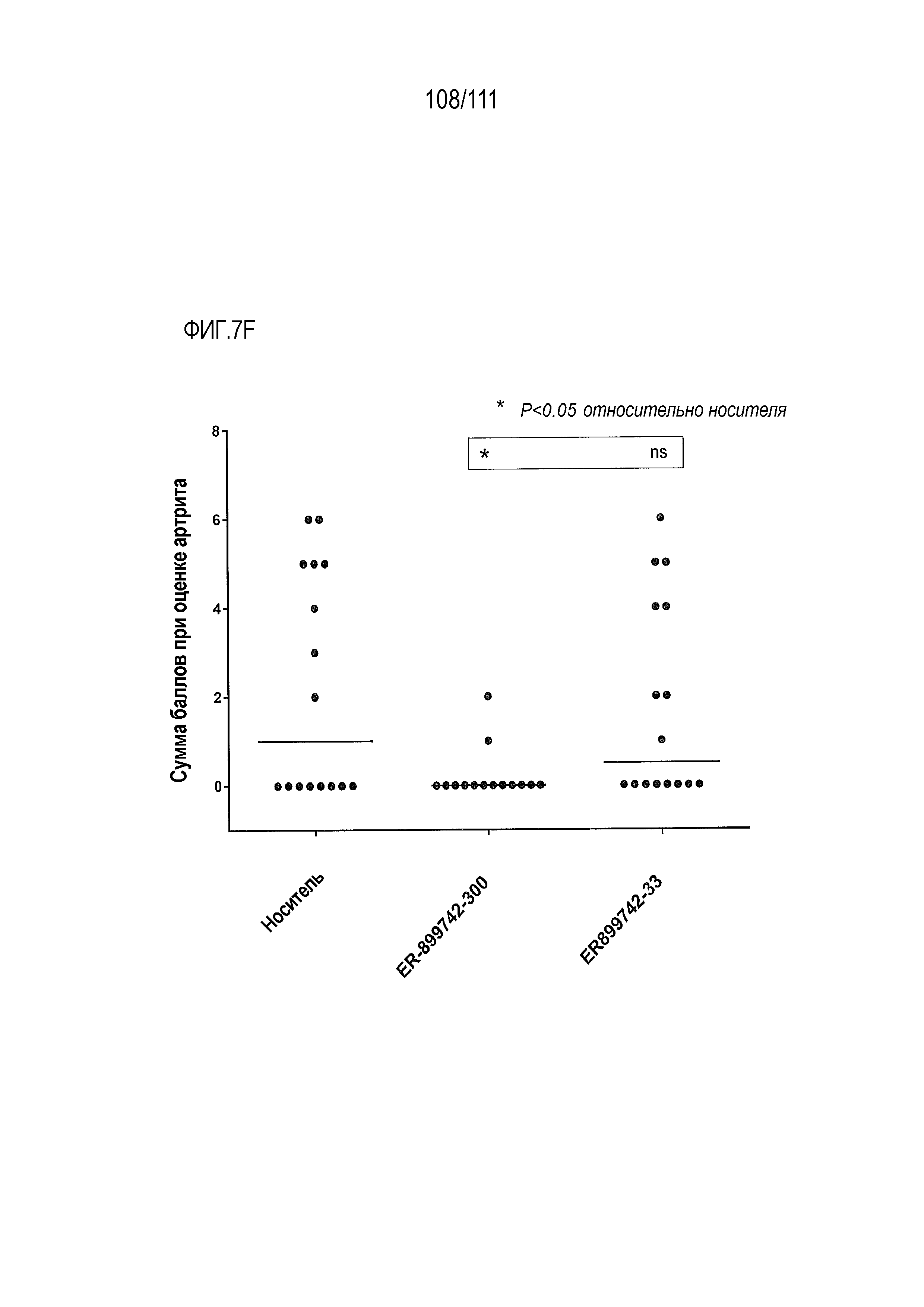
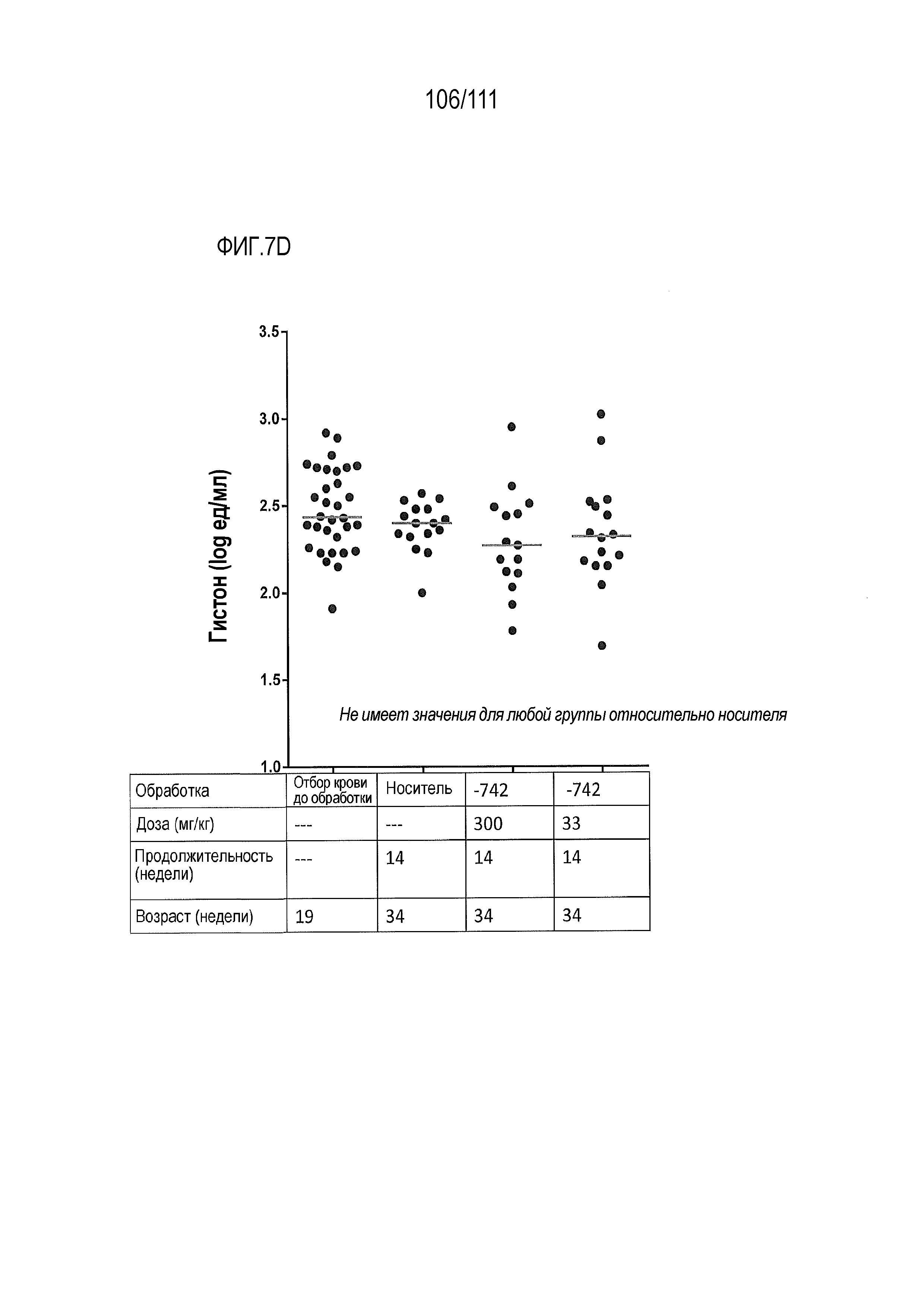
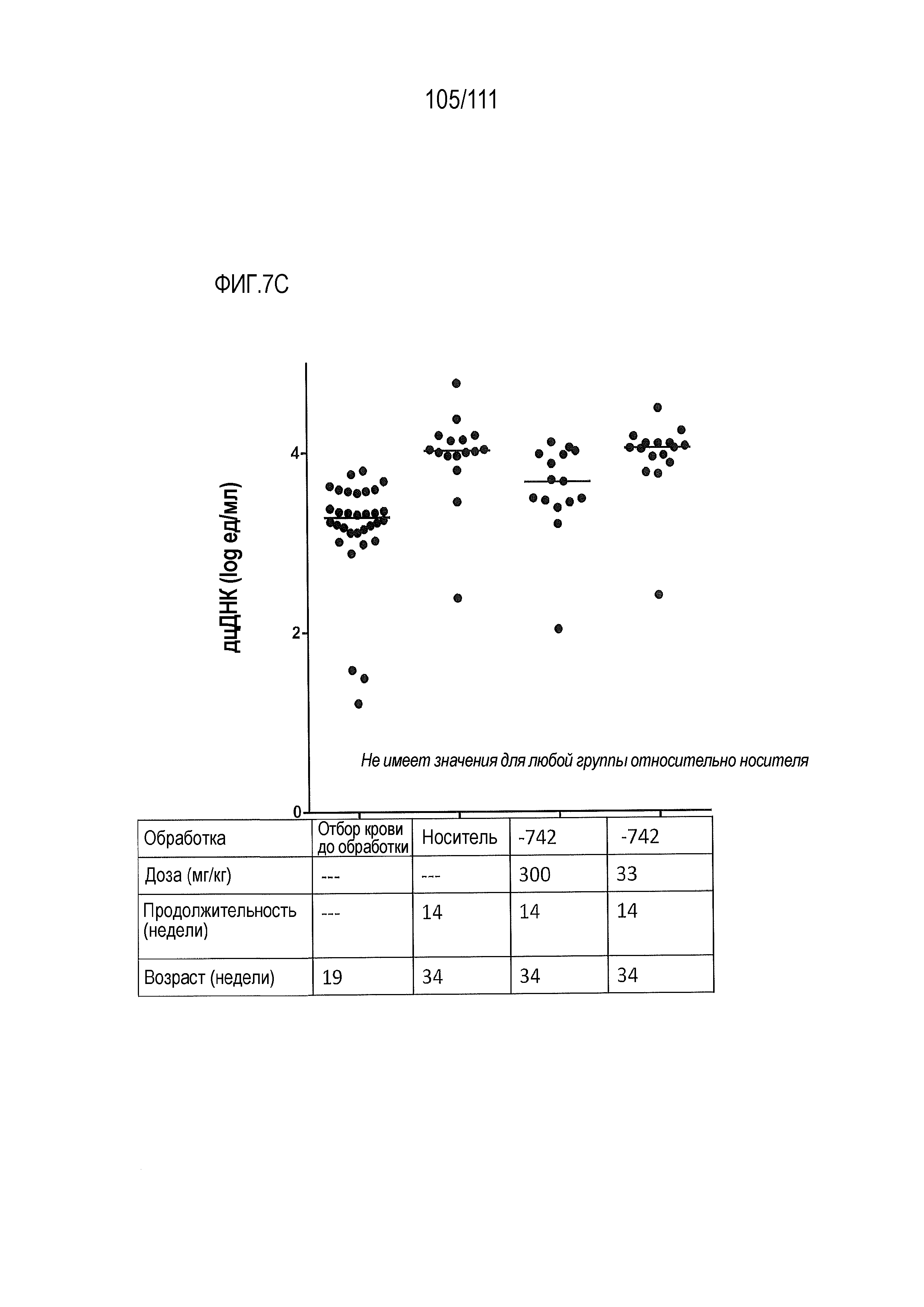
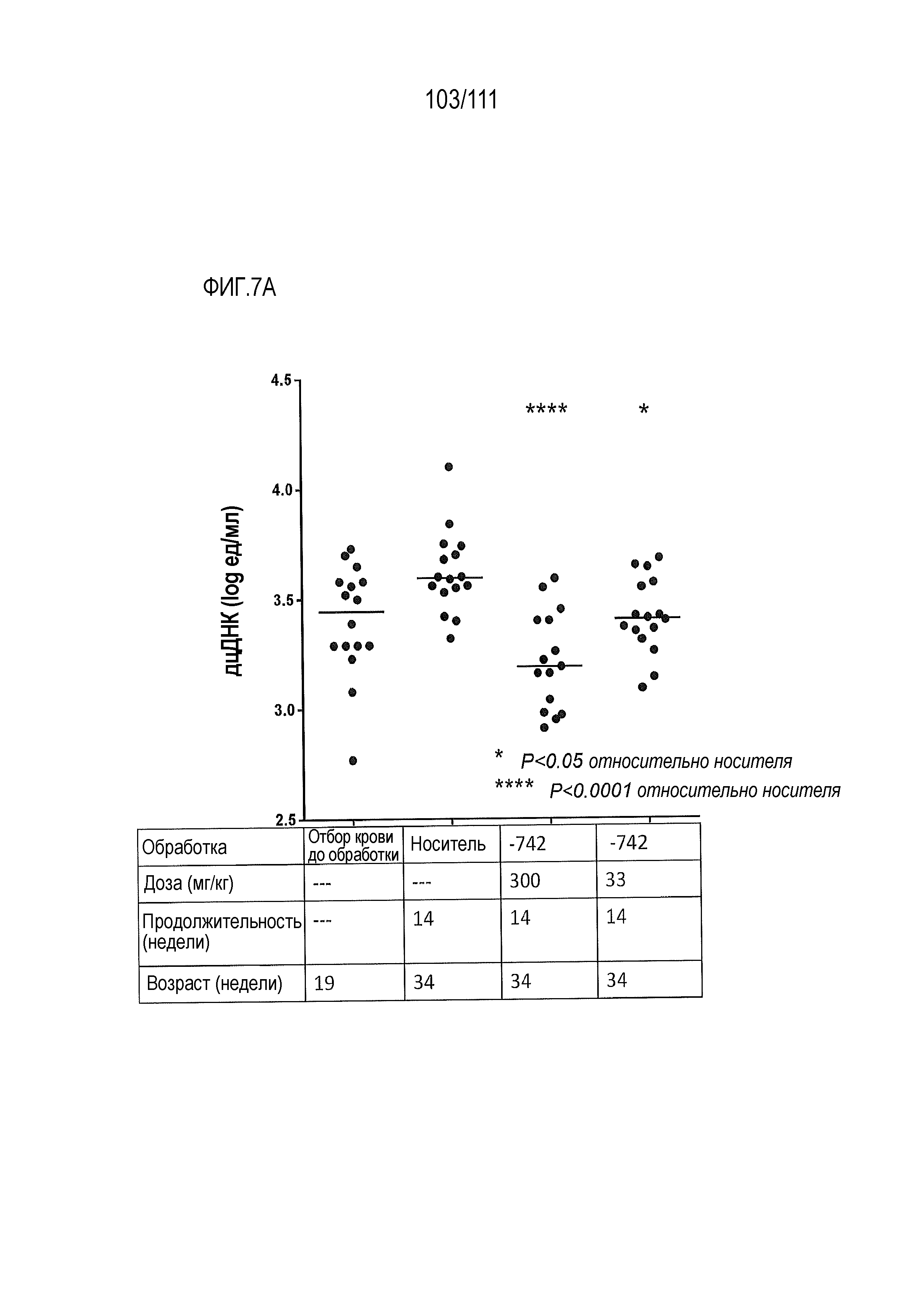
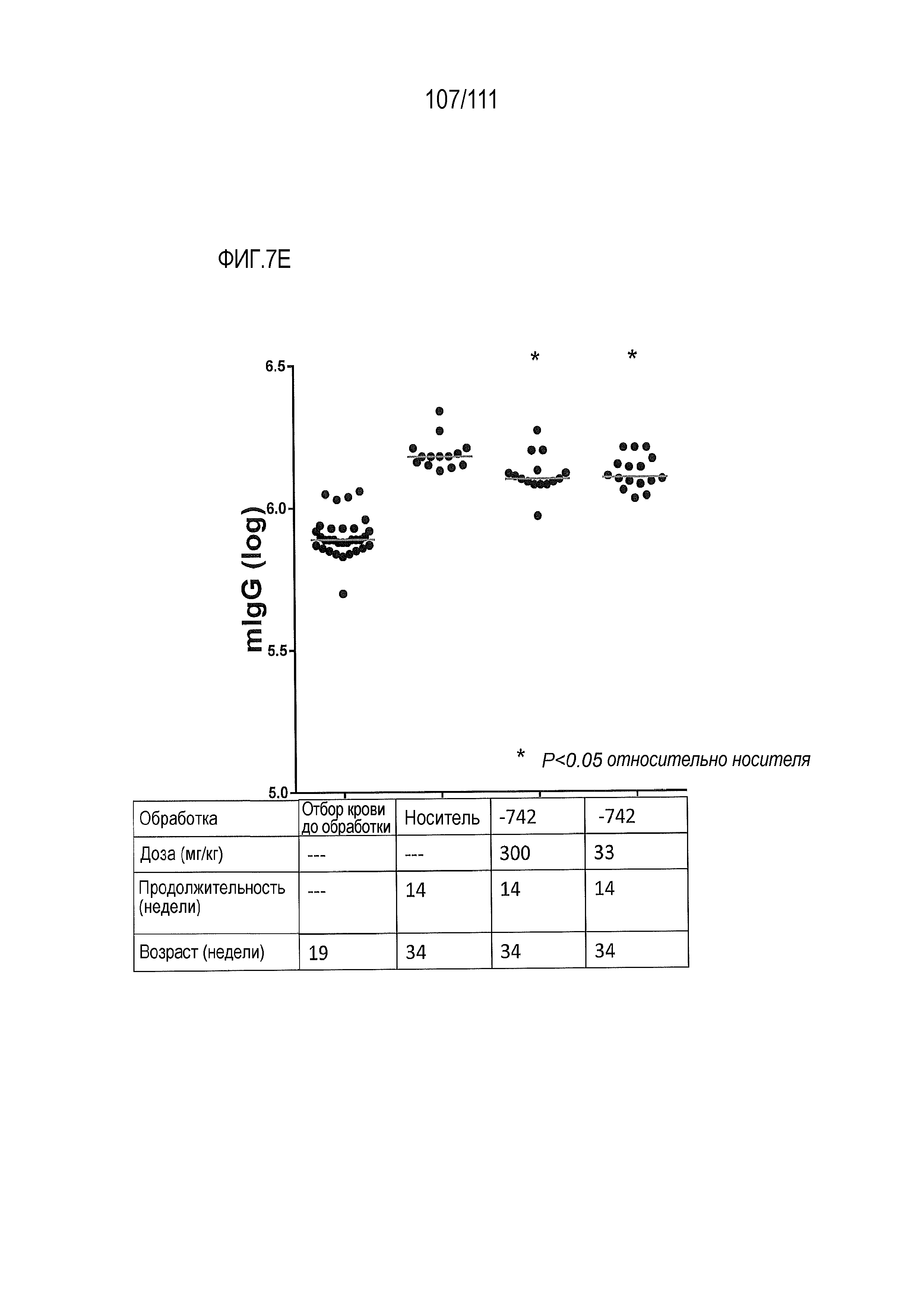
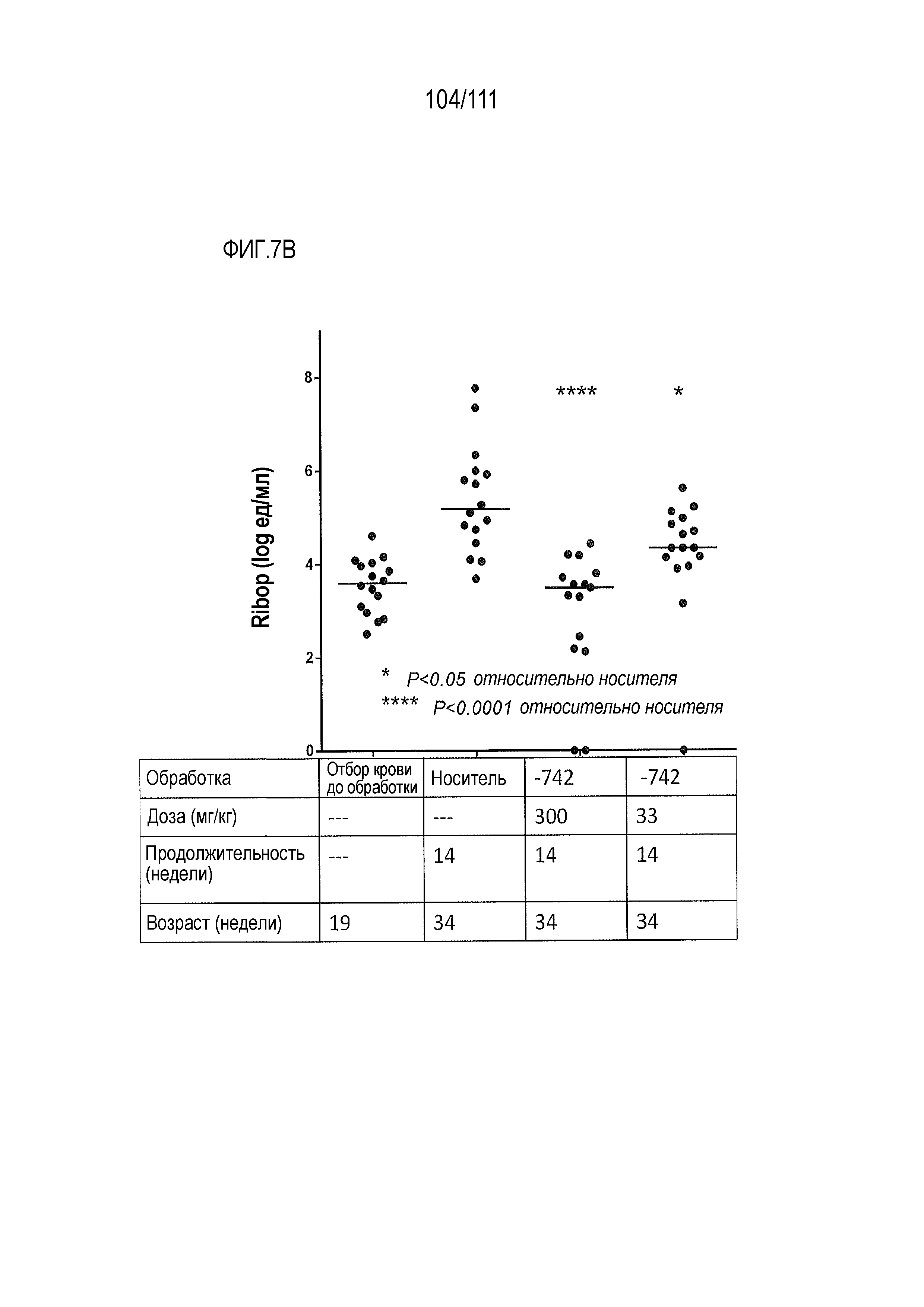
[0042] На фиг.7А-фиг.7G показан эффект от введения доз ER-899742 у мышей DBA/1J с заболеванием, вызванным пристаном. Пояснения к фигурам: Самкам мышей DBA/1 9-недельного возраста внутрибрюшинно инъецировали 0,5 мл пристана или PBS. Через 10 недель после введения пристана у животных отбирали кровь для определения титров аутоантител. Через 11 недель после инъекции пристаном начинали пероральное, один раз в день, введение доз носителя (Veh, 0,5% метил-целлюлоза) или ER-899742 в дозе 33 мг/кг или 300 мг/кг, и продолжали в течение 14 недель обработки. Через 14 недель обработки соединением мышей умерщвляли, и в образцах плазмы крови измеряли титры анти-дцДНК (фиг.7А), анти-RiboP (фиг.7В), анти-Sm/яРНП (фиг.7С), и анти-гистон (фиг.7D) методом ELISA (статистическая значимость обработки по сравнению с носителем, определяемая методом ANOVA с послетестовым критерием Даннетта). Через 14 недель обработки соединением мышей умерщвляли, и измеряли титры анти-дцДНК (фиг.7А), анти-RiboP (фиг.7В), анти-Sm/яРНП (фиг.7С), и анти-гистон (фиг.7D) в образцах плазмы крови методом ИФА (статистическая значимость обработки по сравнению с носителем, определяемая методом ANOVA с послетестовым критерием Даннетта). Для измерения общих титров IgG методом ELISA в конце дозирования (фиг.7E) использовали аналогичную плазму. Наблюдали контроль аутоантител против дцДНК и RiboP при минимальных изменениях общего уровня IgG. У мышей, обработанных пристаном, в настоящем эксперименте развивался артрит, отек суставов задних лап. Артрит оценивали в зависимости от тяжести, каждую лапку оценивали по шкале от 0 до 4 в зависимости от признаков отека и воспаления. Баллы суммировали для двух задних лапок, оцениваемых для каждого животного, и изображали графически на фиг.7F со статистической оценкой относительно вышеуказанных титров ELISA. Наблюдали дозозависимую статистически значимую супрессию. При подсчете баллов интерферона не наблюдали существенных различий между обработанными и обработанными носителем животными. Однако на фиг.7G показана понижающая регуляция пяти из 28-ти связанных с заболеванием интерферон-модулированных генов при обработке ER-899742.
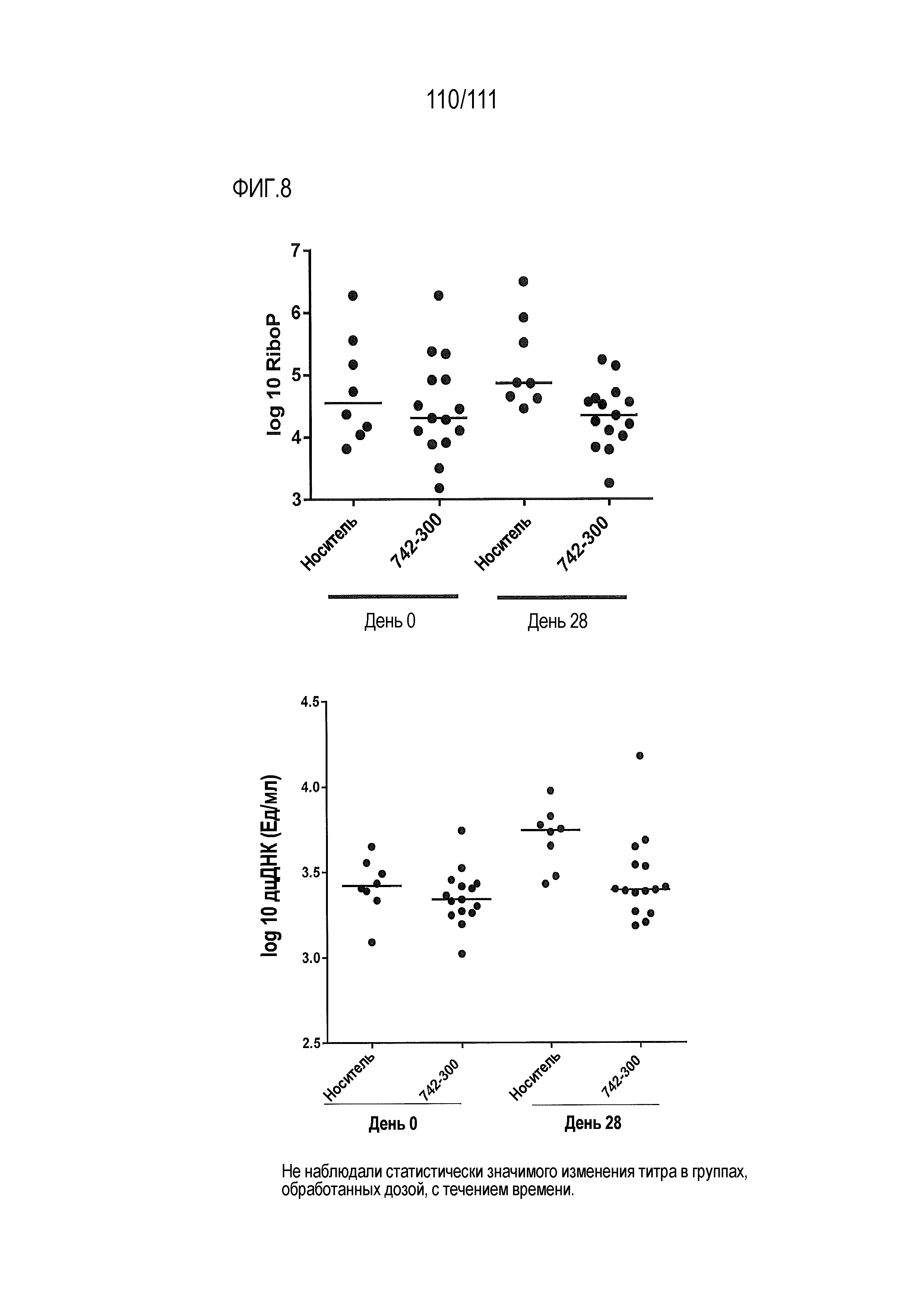
[0043] На фиг.8 представлен результат обработки в течение месяца с помощью ER-899742 мышей линии DBA/1J с заболеванием, вызванным пристаном, на поздней стадии после выработки высоких уровней аутоантител. Пояснения к фигурам: мышам линии DBA/1J в возрасте 10 недель внутрибрюшинно инъецировали пристан. Через три месяца отбирали титры анти-RiboP и анти-дцДНК, и животных распределяли в случайном порядке на группы с соответствующими средними титрами. Через одну, две или четыре недели перорального введения ER-899742 мышей в группах умерщвляли, и измеряли титры RiboP в сыворотке. На фиг.8 не показано статистически значимое изменение титров анти-RiboP или ДНК через 28 дней введения доз, хотя дозирование было связано с отсутствием увеличения титров.
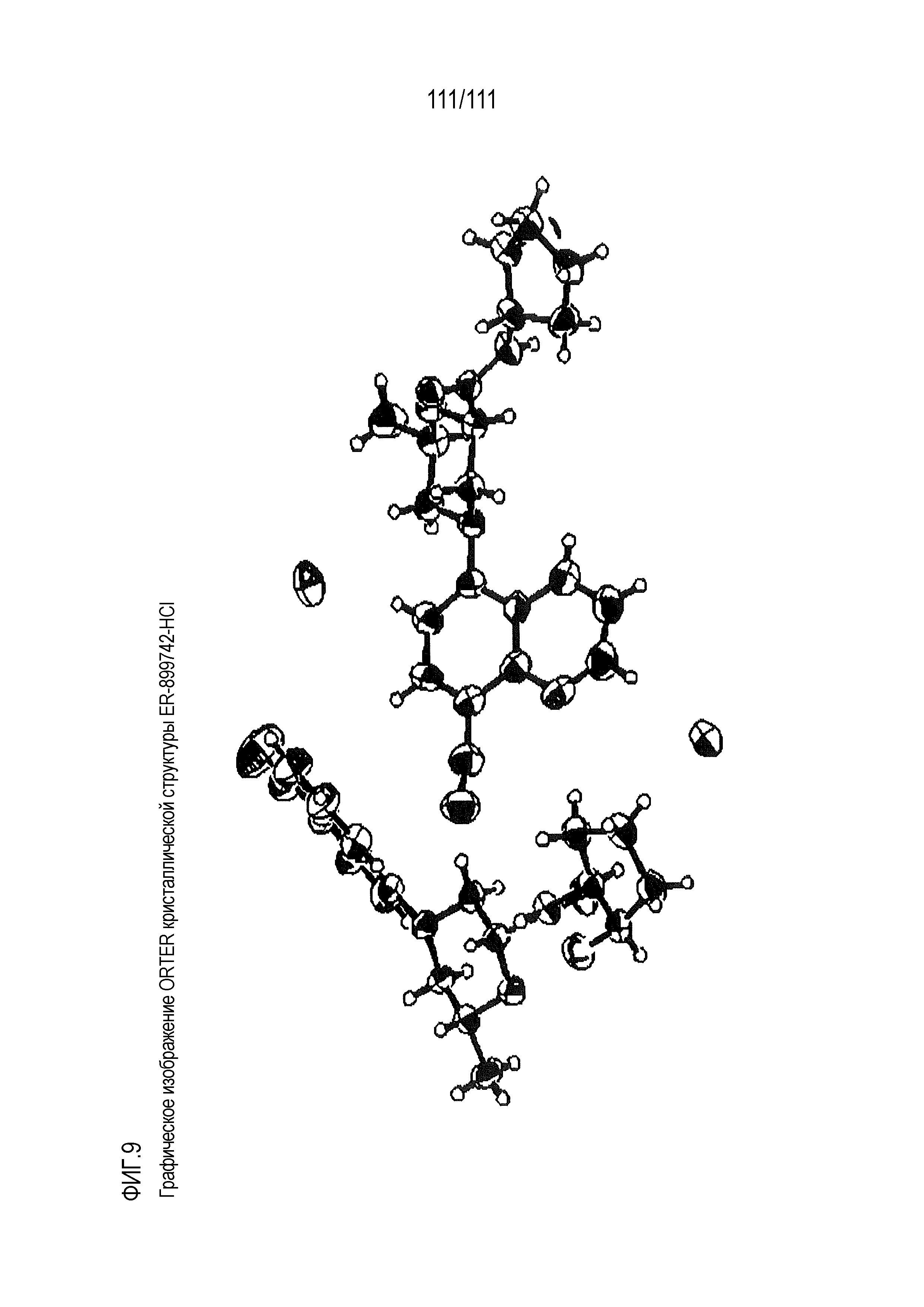
[0044] Фиг.9 представляет собой изображение ORTEP кристаллической структуры ER-899742 в виде соли HCl.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0045] I. TLR и волчанка
[0046] Помимо своей роли в качестве рецепторов врожденного иммунитета, способных обнаруживать экзогенные («не свои») патоген-ассоциированные молекулярные паттерны (PAMP - то есть, обнаружение бактериального LPS с помощью TLR4), Toll-подобные рецепторы (TLR) у млекопитающих также способны распознавать эндогенный стимул (DAMPS), высвобождаемый после повреждения ткани хозяина или стресса, Kono, H. and K.L. Rock, How dying cells alert the immune system to danger. Nat Rev Immunol, 2008. 8(4): p. 279-89. В последние десять лет появилось понимание связи между активацией TLR эндогенными («своими») дистресс-ассоциированными молекулярными паттернами (DAMP) и этиологией аутоиммунных расстройств. В частности, TLR7 могут быть активированы одноцепочечной РНК (оцРНК), полученной как из млекопитающих, так и вирусных источников, в то время как TLR9 могут быть активированы ДНК, полученной из млекопитающих, вирусных и бактериальных источников.
[0047] Волчанка характеризуется аутоантителами, реактивными к самой двухцепочечной ДНК (дцДНК) и связанным белкам (гистонам), а также в отношении широкого спектра РНК-ассоциированных белков, таких как Ro, La, Smith (Sm) и Ul малые ядерный нуклеопротеиды. Kirou, K.A., et al., Activation of the interferon-alpha pathway identifies a subgroup of systemic lupus erythematosus patients with distinct serologic features and active disease. Arthritis Rheum, 2005. 52(5): p. 1491-503. Вторым общим симптом волчанки, который, как было показано, непосредственно коррелирует с тяжестью заболевания, является неуправляемая экспрессия интерферонов типа 1 (IFN), в частности IFNa, и соответствующее повышение большой панели IFNальфа-регулируемых генов в РВМС пациентов с волчанкой (так называемый «профиль экспрессии гена IFN 1-го типа»). Kirou, K.A., et al., см. выше. Основным источником IFN в крови является специализированный иммуноцит, называемый плазмацитоидной дендритной клеткой (pDC), который конститутивно экспрессирует как TLR7, так и TLR9.
[0048] Причинно-следственная связь между этими двумя характеристиками заболевания, уровнями аутоантител и IFN, была установлена, когда ряд исследовательских групп коллективно показали, что комплексы антител, полученных от больных с волчанкой, но не от здоровых доноров, способны контролировать продукцию IFN посредством pDC TLR7/9- и РНК/ДНК-зависимого способа. Means, Т.К., et al., Human lupus autoantibody-DNA complexes activate DCs through cooperation of CD32 and TLR9. J Clin Invest, 2005. 115(2): p. 407-17; Vollmer, J., et al., Immune stimulation mediated by autoantigen binding sites within small nuclear RNAs involves Toll-like receptors 7 and 8. J Exp Med, 2005. 202(11): p. 1575-85; Savarese, E., et al., Ul small nuclear ribonucleoprotein immune complexes induce type I и interferon in plasmacytoid dendritic cells through TLR7. Blood, 2006. 107(8): p. 3229-34. Кроме того, IFN стимулируют повышение экспрессии TLR7/9 в В-клетках, тем самым повышая активацию TLR/BCR (рецептор В-клеток) аутореактивных В-клеток для дифференцировки в продуцирующие антитела плазматические клетки. Banchereau, J. and V. Pascual, Type I interferon in systemic lupus erythematosus and other autoimmune diseases. Immunity, 2006. 25(3): p. 383-92; В этом способе уровни комплексов аутоантител, содержащих лиганды нуклеиновые кислоты TLR7/9, обуславливают прогрессию провоспалительного цикла и волчанки. Авторы настоящего изобретения полагают, как вполне вероятно, что фармакологический антагонизм TLR7/8 будет обеспечивать терапевтические эффекты для пациентов, страдающих волчанкой, нарушая указанный провоспалительный цикл, понижая уровень IFN и сдерживая процесс аутоиммунного заболевания, опосредованный pDC и В-клетками.
[0049] Некоторые другие данные указывают на роль TLR7 в этиологии волчанки человека и подтверждают идею о том, что рецепторы TLR являются важной целью для лечения заболевания. Специфические полиморфизмы в 3'UTR TLR7 были идентифицированы и связаны как с повышенной экспрессией TLR7, так и с усиленным профилем генной экспрессии. Shen, N., et al, Sex-specific association of X-linked Toll-like receptor 7 (TLR7) with male systemic lupus erythematosus. Proc Natl Acad Sci USA, 2010. 107(36): p. 15838-43. Deng, Y. et al, MicroRNA-3148 modulates allelic expression of Toll-like receptor 7 variant associated with systemic lupus erythematosus. PLOS Genetics, 2013. Е1003336. Кроме того, противомалярийные препараты в качестве стандартного лечения волчанки (SOC), такие как хлорохин, нарушают передачу сигнала через эндосомальный TLR7/9 и ингибируют продукцию IFNальфа PBMC и/или pDC, индуцированную оцРНК-рибонуклеопротеидными комплексами или сывороткой пациента с волчанкой. Кроме того, миелоидные DC и моноциты продуцируют IL-12р40, TNF альфа, и IL-6, поддерживая собственную РНК/TLR8 сигнализацию, предполагая дополнительную роль TLR8-зависимых провоспалительных цитокинов в этиологии волчанки человека в дополнение к TLR7-индуцируемому IFN посредством pDC. Vollmer, см. выше; Gorden, K.B., et al., Synthetic TLR agonists reveal functional differences between human TLR7 and TLR8. J Immunol, 2005. 174(3): p. 1259-68.
[0050] Экспериментальные данные на мышиной модели подтверждают роль TLR в волчанке. Опубликованные исследования в совокупности показали, что фармакологическое ингибирование делеции как одного TLR7, так и TLR7/9 гена, или двойного TLR7/9 снижает тяжесть заболевания в четырех различных моделях волчанки. Nickerson, K.M., et al., TLR9 regulates TLR7- and MyD88-dependent autoantibody production and disease in a murine model of lupus, J Immunol, 2010. 184 (4): p. 1840-8; Fairhurst, A.M., et al., Yaa autoimmune phenotypes are conferred by overexpression of TLR7. Eur J Immunol, 2008. 38 (7): p. 1971-8; Deane, J.A., et al., Control of Toll-like receptor 7 expression is essential to restrict autoimmunity and dendritic cell proliferation. Immunity, 2007. 27 (5): p. 801-10; Savarese, E., et al., Requirement of Toll-like receptor 7 for pristane-induced production of autoantibodies and development of murine lupus nephritis. Arthritis Rheum, 2008. 58 (4): p. 1107-15. Отмечая роль TLR7, как одного из важнейших факторов аутоиммунитета, трансгенная сверхэкспрессия TLR7 сама по себе приводит к спонтанной анти-РНК аутореактивности и нефриту в нормально устойчивом к заболеванию штамме C57BL/6. Deane, см. выше.
[0051] С точки зрения безопасности, нет никаких сообщений о том, что мыши, лишенные TLR7, 8 или 9-одного или 7/8- и 7/9-двойного гена, обладают ослабленным иммунитетом, в том смысле, что наблюдается инфекция условно-патогенными микроорганизмами. Аналогично, SOC-антивещества, как полагают, в значительной степени безопасны и эффективны при длительном использовании в организме человека для контролирования внезапного обострения волчанки в дозах, предполагаемых для, по крайней мере, частичного ингибирования передачи сигнала TLR7/9. Lafyatis, R., M. York, and A. Marshak-Rothstein, Antimalarial agents: closing the gate on Toll-like receptor? Arthritis Rheum, 2006. 54(10): p. 3068-70; Costedoat-Chalumeau, N., et al, Low blood concentration of hydroxychloroquine is a marker for and predictor of disease exacerbations inpatients with systemic lupus erythematosus. Arthritis Rheum, 2006. 54(10): p. 3284-90. Фактически, за исключением случаев повышенной восприимчивости к грамположительным бактериальным инфекциям у детей и, в меньшей степени, в зрелом возрасте, люди со значительным дефектом TLR и сигнальных путей IL-1R (MyD88- и IRAK-4-дефицит) являются, тем не менее, здоровыми и поддерживают иммунологические защитные механизмы на достаточном уровне. Casanova, J.L., L. Abel, and L. Quintana-Murci, Human TLRs and IL-IRs in Host Defense: Natural Insights from Evolutionary, Epidemiological, and Clinical Genetics. Annu Rev Immunol, 2010.
[0052] На основе этих и других данных авторы настоящего изобретения полагают, что TLR7, в частности, является хорошо проверенной целью в контексте доклинических мышиных моделей SLE заболевания. Как генетические, так и функциональные исследования человека подтверждают гипотезу о том, что антагонизация путей TLR7 и/или TLR8 будет оказывать терапевтический эффект в отношении пациентов, страдающих волчанкой. Кроме того, оба исследования, делеции мышиного гена TLR и долгосрочного использования антивеществ в организме человека, позволяют предположить, что фармакологическое подавление TLR7, 8 и/или 9 может осуществляться без существенного поражения иммунной защиты организма.
[0053] Поэтому соединение, которое подавляет TLR7, TLR8 или оба, TLR7 и TLR8, как полагают, действует в качестве средства для терапии или профилактики SLE или волчаночного нефрита.
[0054] Авторы настоящего изобретения обнаружили соединения, которые подавляют TLR7 и/или 8, и, соответственно, как ожидается, обладают профилактическим или терапевтическим эффектом в отношении SLE или волчаночного нефрита. Соединения и способы по изобретению описаны в настоящем документе.
[0055] II. Терапевтическое применение
[0056] Уровни доз активных ингредиентов в фармацевтических композициях по изобретению могут быть изменены для того, чтобы получить количество активного(ых) соединения(ий), обеспечивающего(их) достижение желаемого терапевтического эффекта у конкретного пациента для данной композиции и способа введения. Выбранный уровень доз зависит от активности конкретного используемого соединения, способа введения, тяжести состояния, подлежащего лечению, а также состояния и медицинского анамнеза пациента, который проходит лечение. Дозы определяются для каждого конкретного случая с использованием стандартных методов в соответствии с факторами, специфичными для пациента, включая возраст, вес, общее состояние здоровья, а также другие факторы, которые могут оказывать влияние на эффективность соединения(ий) по изобретению. Обычно, в случае перорального введения, соединение в соответствии с настоящим изобретением или его фармацевтически приемлемую соль вводят в дозе приблизительно от 30 мкг до 100 мкг, в дозе от 30 мкг до 500 мкг, в дозе от 30 мкг до 10 г, в дозе от 100 мкг до 5 г или в дозе от 100 мкг до 1 г на взрослого человека в день. В случае введения в виде инъекции, соединение вводят в дозе приблизительно от 30 мкг до 1 г, в дозе от 100 мкг до 500 мг, или в дозе от 100 мкг до 300 мг на взрослого человека в день. В обоих случаях дозу вводят однократно или дозу разделяют на несколько введений. Доза может быть смоделирована, например, с помощью программы Simcyp®.
[0057] Не предполагается, что введение соединения по изобретению млекопитающему, включая человека, будет ограничиваться конкретным способом введения, дозой или частотой введения доз. Настоящее изобретение относится ко всем способам введения, включая пероральное, внутрибрюшинное, внутримышечное, внутривенное, внутрисуставное, внутриочаговое, подкожное введение или любой другой способ, соответствующий обеспечению дозы, адекватной для профилактики или лечения SLE или волчаночного нефрита. Одно или несколько соединений по изобретению можно вводить млекопитающим в виде разовой дозы или нескольких доз. При введении множественных доз, дозы могут быть отделены друг от друга, например, несколькими часами, одним днем, одной неделей, одним месяцем или одним годом. Следует понимать, что для любого конкретного субъекта конкретные режимы дозирования должны быть скорректированы с течением времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, назначающего или наблюдающего за введением фармацевтической композиции, которая содержит соединение по изобретению.
[0058] Для клинического применения соединение по настоящему изобретению обычно можно вводить внутривенно, подкожно, внутримышечно, в толстую кишку, интраназально, внутрибрюшинно, ректально, буккально или перорально. Композиции, содержащие, по меньшей мере, одно соединение по изобретению, пригодные для использования в медицине или ветеринарии, могут быть представлены в формах, обеспечивающих введение подходящим способом. Эти композиции могут быть получены в соответствии с обычными способами, с использованием одного или нескольких фармацевтически приемлемых адъювантов или вспомогательных веществ. Вспомогательные вещества включают, в частности, разбавители, стерильную воду и различные нетоксичные органические растворители. Приемлемые носители или разбавители для терапевтического применения хорошо известны в области фармацевтики и описаны, например, в обзоре Remington: The Science and Practice of Pharmacy (20th ed.), ed. A. R. Gennaro, Lippincott Williams & Wilkins, 2000, Philadelphia, и Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. С Boylan, 1988, 1999, Marcel Dekker, New York. Композиции могут быть представлены в виде таблеток, пилюль, гранул, порошков, водных растворов или суспензий, растворов для инъекций, эликсиров или сиропов, и композиции могут необязательно содержать один или несколько агентов, выбранных из группы, включающей подсластители, вкусовые добавки, красители и стабилизаторы для получения фармацевтически приемлемых препаратов.
[0059] Выбор носителя и содержание активного вещества в носителе обычно определяется в соответствии со свойствами растворимости и химических свойств продукта, конкретного способа введения, а также нормами, которые должны соблюдаться в фармацевтической практике. Например, для изготовления таблеток могут быть использованы вспомогательные вещества, такие как лактоза, цитрат натрия, карбонат кальция и дикальция фосфат и разрыхляющие вещества, такие как крахмал, альгиновые кислоты и некоторые сложные силикаты в сочетании со смазывающими веществами (например, стеарат магния, лаурилсульфат натрия и тальк). Для получения капсулы эффективно использовать лактозу и полиэтиленгликоли с высоким молекулярным весом. При использовании водных суспензий, они могут содержать эмульгирующие вещества, которые способствуют образованию суспензии. Могут быть использованы разбавители, такие как сахароза, этанол, полиэтиленгликоль, пропиленгликоль, глицерин, хлороформ или их смеси.
[0060] Для парентерального введения используются эмульсии, суспензии или растворы композиций по изобретению в растительном масле (например, кунжутное масло, арахисовое масло или оливковое масло), водно-органические растворы (например, вода и пропиленгликоль), инъецируемые органические сложные эфиры (например, этил олеат) или стерильные водные растворы фармацевтически приемлемых солей. Растворы солей композиций по изобретению, в частности, используются для введения путем внутримышечной или подкожной инъекции. Для внутривенного введения могут быть использованы водные растворы, включающие растворы солей в чистой дистиллированной воде, при условии, что (I) их рН отрегулирован соответствующим образом, (II) они соответствующим образом забуферены и сделаны изотоническими с помощью достаточного количества глюкозы или хлорида натрия, и (III) они стерилизованы нагреванием, облучением или микрофильтрацией. Подходящие композиции, содержащие соединение по изобретению, могут быть растворены или суспендированы в подходящем носителе для использования в распылителе или аэрозоле-суспензии или аэрозоле-растворе, или могут быть поглощены или адсорбированы на подходящем твердом носителе для применения в ингаляторе сухого порошка. Твердые композиции для ректального введения включают суппозитории, полученные в соответствии с известными способами и содержащие, по меньшей мере, одно соединение по изобретению.
[0061] Дозированные лекарственные формы по изобретению, которые используются для терапевтического введения, должны быть стерильными. Стерильность легко достигается путем фильтрации через стерильные мембраны (например, мембраны c диаметром ячейки 0,2 мкм) или другими известными способами. Лекарственные формы обычно хранятся в лиофилизированной форме или в виде водного раствора. pН композиций по настоящему описанию в некоторых вариантах осуществления, например, может быть в пределах от 3 до 11, может быть в пределах от 5 до 9, или может быть в пределах от 7 до 8, включительно.
[0062] В то время как одним из способов введения является пероральное введение лекарственных средств, могут быть использованы другие способы введения. Например, композиции можно вводить подкожно, внутривенно, внутримышечно, в толстую кишку, ректально, интраназально или внутрибрюшинно в виде различных лекарственных форм, таких как суппозитории, имплантированные гранулы или небольшие цилиндры, аэрозоли, пероральные дозированные лекарственные формы, а также композиции для местного применения, такие как мази, капли и кожные пластыри. Соединения по вариантам осуществления по изобретению могут быть включены в формованные изделия, такие как имплантаты, в том числе, но ими не ограничиваясь, клапаны, стенты, трубки и протезы, в которых могут применяться инертные материалы, такие как синтетические полимеры или силиконы (например, композиции Silastic®, силиконовый каучук или другие коммерчески доступные полимеры). Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидрокси-пропил-метакриламид-фенол, полигидроксиэтил-аспартамид-фенол или полиэтиленоксид-полилизин, замещенный пальмитоильными остатками. Кроме того, соединение по изобретению может быть связано с классом биодеградируемых полимеров, используемых для достижения контролируемого высвобождения лекарственного средства, например, с полимолочной кислотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно сшитыми или амфипатическими блок-сополимерами гидрогелей.
[0063] Соединение по изобретению также можно вводить в виде липосомальных систем доставки, таких как небольшие однослойные везикулы, большие моноламеллярные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных липидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединение по изобретению также может быть доставлено с помощью антител, фрагментов антител, факторов роста, гормонов или других целевых фрагментов, с которыми соединены молекулы соединения (например, смотри Remington: The Science and Practice of Pharmacy, vide см. выше), включая in vivo конъюгацию соединения варианта осуществления по изобретения с компонентами крови.
[0064] III. Синтез
[0065] Предложены общие и конкретные способы синтеза, которые авторы настоящего изобретения используют для получения примеров осуществления изобретения. Специалистам в данной области техники должно быть понятно, что определенные изменения или модификации этих способов также могут обеспечить синтез соединений в соответствии с изобретением. В некоторых случаях фраза «такие как» используется для перечисления различных альтернатив для более общих соединений или структур. Следует понимать, что фраза «такие как» не должна быть истолкована как ограничивающая, и что ее значение находится в соответствии с «включая, например, но ими не ограничиваясь».
[0066] Определенные условия были общими для конкретных примеров, представленных ниже.
Микроволновый нагрев осуществляли с использованием микроволнового реактора Biotage® Emrys Liberator или Initiator. Колоночную хроматографию осуществляли с использованием системы флэш-хроматографии Biotage® SP4. Удаление растворителя осуществляли с использованием либо роторного испарителя Buchi, либо центробежного испарителя Genevac®. ЯМР-спектры регистрировали при 400 МГц на спектрометре Varian Unity® с использованием дейтерированных растворителей. Химические сдвиги приведены относительно остаточного протонированного растворителя.
[0067] Тонкослойную хроматографию осуществляли на стеклянных планшетах Whatman®, предварительно покрытых 0,25 мм слоем силикагеля, с использованием в различных соотношениях одного или нескольких следующих растворителей: EtOAc, гептан, дихлорметан или метанол.
[0068] Аналитическую ЖХ/МС проводили для многих примеров с помощью системы Waters ACQUITY™ с использованием колонки XBridge™ CI8 1,7 мкм 2,1×50 мм. Растворители А и В представляют собой смеси вода масс/0,1% муравьиная кислота и ацетонитрил масс/0,1% муравьиная кислота, соответственно. Общее время метода 5 минут с градиентом 5% В-99% В в течение 4 мин при скорости потока 0,3 мл/мин. Масс-спектральные данные получали на системе Waters SQD из 100-2000 а.е.м. в режиме положительной электроспрей-ионизации.
[0069] Альтернативно, подтверждение чистоты и массы выполняли на системе Waters Autopurification с использованием колонки XBridge™ C8 3,5 мкм 4,6×50 мм. Растворители А и В представляют собой смесь вода масс/0,1% муравьиная кислота и смесь ацетонитрил масс/0,1% муравьиная кислота, соответственно. Общее время метода 6 минут с градиентом 10% В-95% В в течение 5 мин при скорости потока 2,5 мл/мин. Масс-спектральные данные получали на системе Micromass ZQ ™ из 130-1000 а.е.м. в режиме положительной электроспрей-ионизации.
[0070] Препаративную обращенно-фазовую ЖХ/МС выполняли во многих примерах на системе Waters Autopurification с использованием колонки XBridge™ С8 5 мкм, 19×100 мм. Растворители А и В представляют собой смесь вода масс/0,1% муравьиная кислота и смесь ацетонитрил масс/0,1% муравьиная кислота, соответственно. Общее время метода 12 минут с градиентом 30% В-95% В в течение 10 мин со скоростью потока 20 мл/мин. Масс-спектральные данные получали на системе Micromass ZQ™ из 130-1000 а.е.м. в режиме положительной электроспрей-ионизации.
[0071] Разделение рацемических соединений посредством препаративной ВЭЖХ выполняли во многих примерах, используя одну из следующих хиральных колонок: Chiralpak® IA (5 см×50 см или 2 см×25 см), Chiralpak® AD (2 см×25 см) или Chiralcel® OD (2 см×25 см). Соотношение энантиомеров очищенных соединений определяли с помощью анализа ВЭЖХ на колонке 0,45 см×25 см с аналогичной неподвижной фазой (IA, AD или OD).
[0072] Общие методы и эксперименты для получения соединений по настоящему изобретению приведены ниже. В некоторых случаях, конкретное соединение описано в качестве примера. Тем не менее, следует принимать во внимание, что в каждом случае был получен ряд соединений по настоящему изобретению в соответствии со схемами и данными эксперимента, описанными ниже. Для тех соединений, где предоставлены данные ЯМР и/или масс-спектрометрии, данные представлены на фиг.6.
[0073] В настоящем документе используются следующие сокращения:
Определения: Следующие сокращения имеют указанные значения:
AcOH: уксусная кислота
безвод.: безводный
вод.: водный
Bn: бензил
Boc: трет-бутоксикарбонил
CSA: камфорсульфоновая кислота
д: день(дни)
DAMP: дистресс-ассоциированный молекулярный паттерн
DBU: 1,8-диазобицикло[5,4,0]ундец-7-ен
DCE: 1,2-дихлорэтан
DCM: дихлорметан
DIPEA: N,N-диизопропилэтиламин
DMA: N,N-диметилацетамид
DMAP: 4-диметиламинопиридин
ДМФ: N,N-диметилформамид
ДМСО: диметилсульфоксид
дцДНК: двухцепочечная ДНК
EDC: 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид
э.и.: энантиомерный избыток
EtOAc: этилацетат
EtOH: этанол
ч: час(часы)
HATU: гексафторфосфат N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-ил)урония
HCl: соляная кислота
HCQ: гидроксихлорохин
hep: н-гептан
HEPES: 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота
ВЭЖХ: высокоэффективная жидкостная хроматография
IFN: интерферон
IPA: изопропиловый спирт или изопропанол
K2CO3: карбонат калия
MeOH: метанол
MgSO4 сульфат магния (безводный)
мин: минута (минуты)
MTBE: метил-трет-бутиловый эфир
Na2СО3: карбонат натрия
Na2SO4: сульфат натрия (безводный)
NaBH4: борогидрид натрия
NaCl: хлорид натрия
NaH: 60% гидрид натрия, диспергированный в масле
NaHCO3: бикарбонат натрия
NaOH: гидроксид натрия
NBS: N-бромсукцинимид
NH4Cl: хлорид аммония
NH4OH: гидроксид аммония
NMP: N-метилпирролидон
Ns: нозил или o-нитробензолсульфонил
°C: градусы Цельсия
PAMP: патоген-ассоциированный молекулярный паттерн
PBMC: мононуклеарные клетки периферической крови
PBS: фосфатно-солевой буферный раствор
pDC: плазмацитоидные дендритные клетки
PhNTf2: N-фенилтрифторметансульфонимид
кПЦР qPCR: количественная полимеразная цепная реакция
R848: резиквимод
к.т.: комнатная температура
насыщ.: насыщенный
SNAP: картридж для флеш-хроматографии с товарным знаком BIOTAGE®
SOC: стандарт лечения
оцРНК: одноцепочечная РНК
T3P: ангидрид пропилфосфоновой кислоты
tBuOK: трет-бутилоксид калия
TEA: триэтиламин
TEMPO: 2,2,6,6-тетраметилпиперидин 1-оксил
Tf: трифторметансульфонат
ТФК: трифторуксусная кислота
ТГФ: тетрагидрофуран
TLDA: Taqman® Low Density Array
TLR: Toll-подобный рецептор
TSA: п-толуолсульфоновая кислота
[0074] Общие способы синтеза:
[0075] Соединения получали в соответствии с общими методами синтеза, показанными на схемах 1-31:
[0076] Схема 1
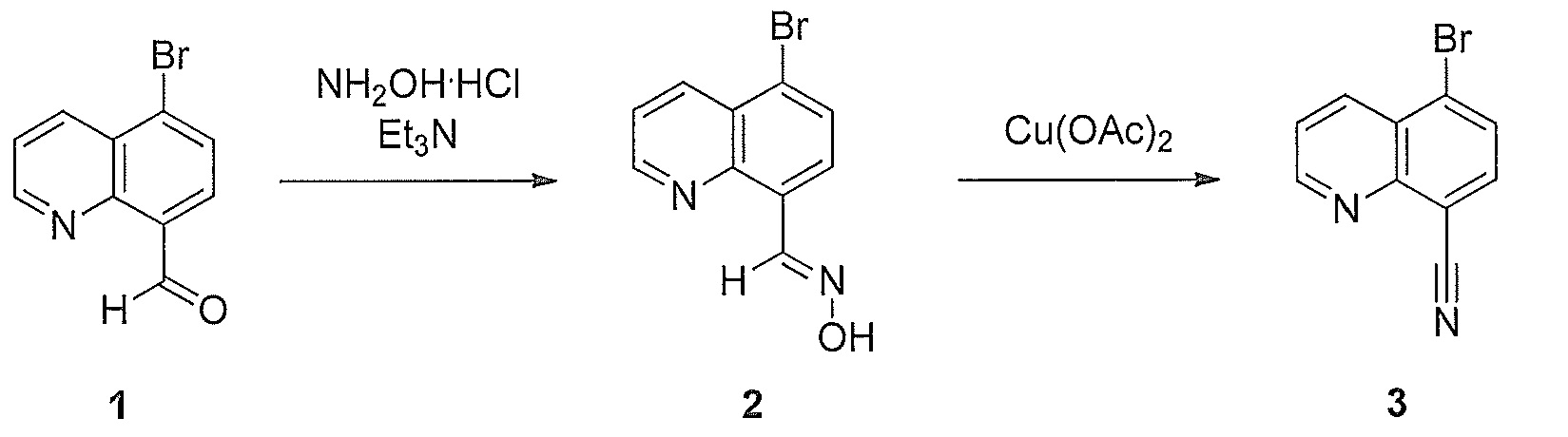
[0077]
[0078] Для получения соединений по некоторым из примеров используют ключевое промежуточное соединение 3, которое может быть получено в соответствии со способом, изображенным на схеме 1. Коммерчески доступный 5-бромхинолин-8-карбальдегид 1 (Frédérieric de Montigny, Gilles Argouarch, Claude Lapinte, «New Route to Unsymmetrical 9,10-Disubstituted Ethynylanthracene Derivatives», Synthesis, 2006, 293-298) обрабатывают гидроксиламин гидрохлоридом с получением оксима 2. Затем соединение 2 превращают в соответствующий нитрил 3 в присутствии каталитического количества ацетата меди с получением одного из ключевых промежуточных соединений, описанных в настоящем документе. Промежуточное соединение 3 используют для синтеза соединений, описанных в настоящем документе, путем замены в 5-м положении 5-бромхинолин-8-карбальдегида соответствующими ароматическими, гетероароматическими и насыщенными гетероциклическими соединениями, такими как пиперидины, пиперазины и морфолины, в соответствующих условиях, описанных подробно ниже.
[0079] Альтернативный способ синтеза ключевого промежуточного соединения 3 показан на схеме 2, где триэтиламин на первой стадии синтеза заменен на ацетат натрия.
[0080] Схема 2
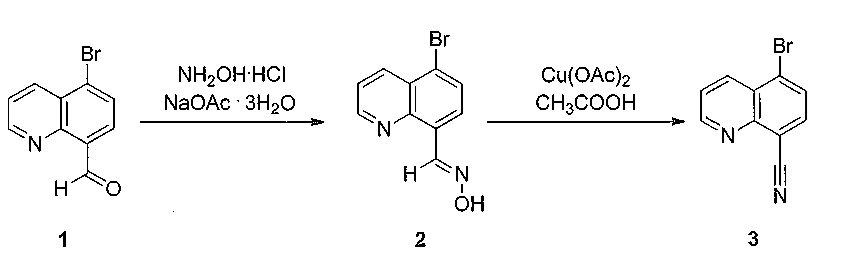
[0081]
[0082] Некоторые соединения по примерам получают путем обычного способа конденсации, как показано на схеме 3, где бромхинолин 3 конденсируют с соответствующим нуклеофилом 4 с образованием соединения 5, которое может представлять собой либо ключевое промежуточное соединение, либо конечное соединение, описанное более подробно ниже.
[0083] Схема 3
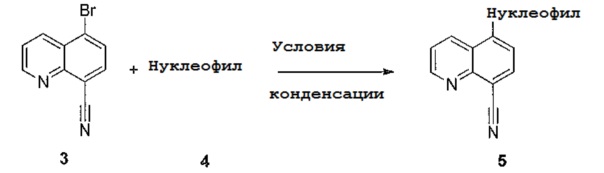
[0084]
[0085] Ряд примеров, представленных соединением 15, получают из дополнительного промежуточного соединения 14, как показано в общем способе, представленном на схеме 4. Соответствующим образом защищенный хиральный эпоксид 6 конденсируются с аллиламином с получением хирального аминоспирта 7. После защиты вторичного амина мезилатом полученное промежуточное соединение 8 межмолекулярно циклизуют с образованием ненасыщенного пирана 9. Восстановление двойной связи энамина для получения соединения 10, с последующим удалением мезильной группы дает соединение 9. Конденсация соединения 11 с бромидом 3 (схема 1 или 2) с использованием или без использования катализатора на основе палладия дает соединение 12, после чего удаление защитной группы у соединения 13 и последующая активация полученного спирта дает ключевое промежуточное соединение 14. Активированное соединение 14 может быть легко преобразовано в ряд соединений по примерам, приведенным ниже, с использованием соответствующим образом замещенных аминов и реагентов конденсации с получением соединений общей структуры 15.
[0086] Схема 4
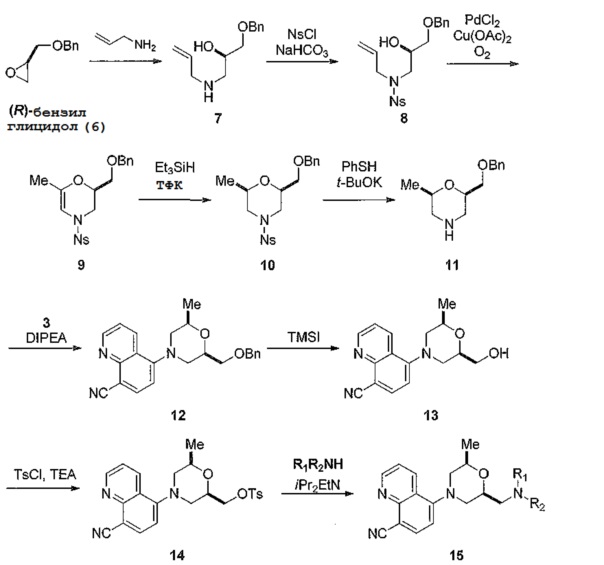
[0087]
[0088] Альтернативный способ получения общей структуры 10 показан на схеме 5. Радикальную циклизацию защищенного спирта 8 можно осуществить путем обработки N-бромсукцинимидом с получением соединения 16. Удаление группы бром с использованием основания дает енол 17, который затем восстанавливают силаном с получением промежуточного соединения 10.
[0089] Схема 5
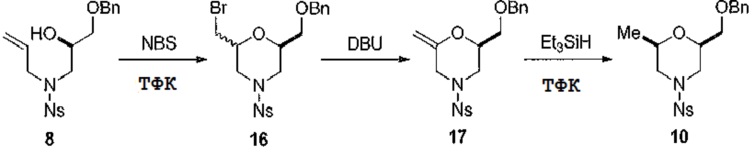
[0090]
[0091] Альтернативный способ получения соединения общей структуры 11 изображен на схеме 6. Начиная с хирального эпокси исходного вещества 6 после защиты вторичного амина Вос-защитной группой получают спирт 18. Образование лактона с использованием растворимого в воде DCC (дикальций цитрата) дает соединение 19, которое затем может быть подвергнуто алкилированию с помощью алкиллития, такого как метиллитий, с образованием смеси кеталей, 20 и 21. Затем смесь кеталей восстанавливают с получением диастереомерной смеси соединений морфолина 22 (являющегося желаемым диастереомеризомером) и соединения 23, которая может быть легко разделена хроматографией на колонке с силикагелем. Было обнаружено, что соотношение метилморфолиновой смеси составляет от 4:1 до 9:1 в сторону соединения структуры 22. Для следующих дополнительных соединений проводили рентгеновское исследование кристаллической структуры для подтверждения абсолютной стереохимии соединения 22. Соединение 22 легко преобразуется в соединение 11 путем удаления защиты с помощью кислоты, такой как ТФК, и последующей нейтрализации основанием.
[0092] Схема 6
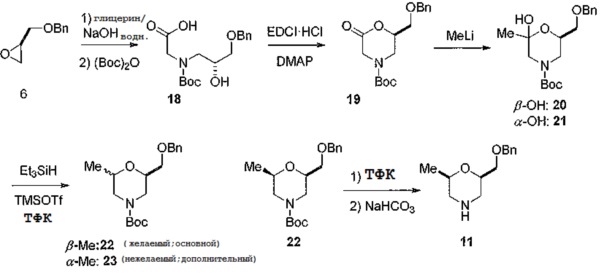
[0093]
[0094] Третий способ получения ключевого промежуточного соединения 11 показан на схеме 7. Коммерчески доступный защищенный эпоксид 6 конденсируют с водным раствором аммиака с получением аминоспирта 23, который в свою очередь конденсируют с хиральным хлорпропинатом 24 с образованием энантиомерно чистого амида 25. Образование эфира с использованием сильного основания, такого как гидрид натрия, дает лактам 26, который может быть превращен в промежуточное соединение 11 посредством восстановления амида в циклический амин.
[0095] Схема 7
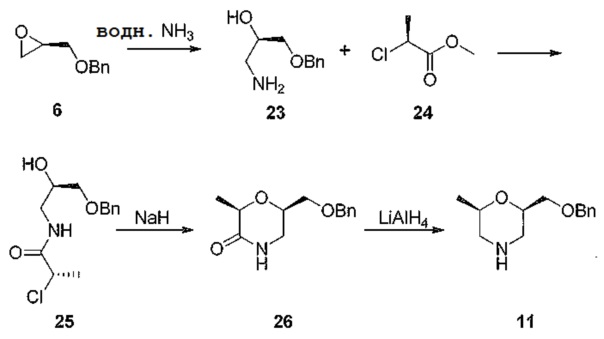
[0096]
[0097] Альтернативный способ получения соединений по примерам, охватываемых общей структурой 5, представленных на схеме 3, и соединения 12 на схеме 4, проиллюстрирован на схеме 8. Исходные вещества 28 и 30, полученные из коммерчески доступных источников (27 и 29), могут легко конденсированы в присутствии неорганического основания с образованием соединения 31. Фенольную защитную группу удаляют путем восстановительного гидролиза с образованием соединения 32, защитную ацетальную группу гидролизуют кислотой с образованием альдегида 33, и затем получают бициклический гетероцикл 34 в условиях конденсации, катализируемой кислотой. Гидроксильная группа фенола соединения 34 затем активируется с образованием соединения 35, которое далее может быть конденсировано с соединением 11 с образованием соединения 12, как показано на схеме 4. Соединение 11 может быть замещено другими нуклеофилами, как показано в приведенных ниже примерах.
[0098] Схема 8
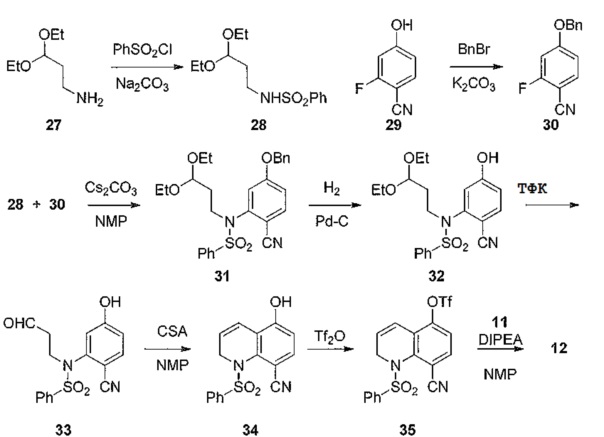
[0099]
[0100] В двух альтернативных способах получения соединений с общей структурой 15 используют процессы, изображенные на схеме 9 и 10. Промежуточное соединение 13 активируется путем образования трифлата 36 с последующим замещением соответствующим амином в присутствии основания, такого как карбонат калия, с образованием желаемого целевого соединения 15, как показано на схеме 9.
[0101] Схема 9
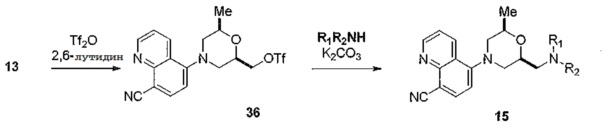
[0102]
[0103] Исходя из Вос-защищенного хирального морфолина 22 на схеме 6, специалист в данной области может предложить дополнительные примеры получения соединений общей структуры 15 путем превращения защищенного спирта в промежуточное соединение азида 37, как показано на схеме 10. 37 легко превращается в первичный амин ER-884884 путем восстановления азида, удаления защитной Вос-группы и конденсации с соединением 3. ER-884884 подобным образом может быть преобразован в дополнительные аналоги, изображенные соединением общей структуры 15, посредством либо процессов алкилирования, либо ацилирования.
[0104] Схема 10
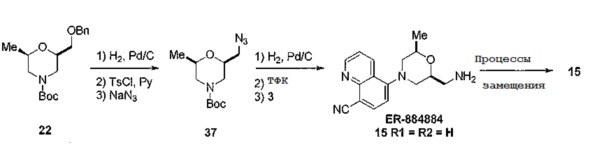
[0105]
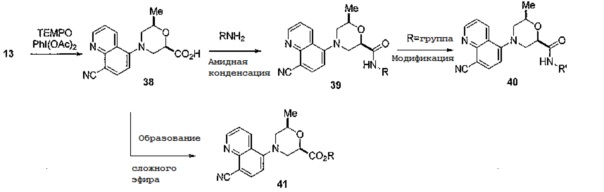
[0106] Осуществление альтернативного ряда примеров соединений проводят путем окисления ключевого промежуточного соединения 13 с получением соединения 38 и последующим получением соединений по примерам в условиях амидной конденсации с образованием соединения 39, как показано на схеме 11. При получении некоторых соединений по примерам, используя указанный общий способ, потребуется одна или две дополнительные стадии с получением желаемых целевых соединений общей структуры 40. Аналогичным образом различные сложные эфиры, представленные общей структурой 41, можно легко получить из соединения 38 с использованием различных способов специалистами в данной области.
[0107] Схема 11
[0108]
[0109] Аналогичным образом, другие соединения по примерам получают двумя возможными способами: (1) замена активированной группы на алкильную, алкенильную или арильную функциональную группу, используя основание и соединение 11 по схеме 4; или с использованием активированного спирта 14 или 36 с фенолами или алкиловыми спиртами в присутствии соответствующего основания. Оба способа получения соединений по примерам с общей химической структурой 42, показаны на схеме 12.
[0110] Схема 12
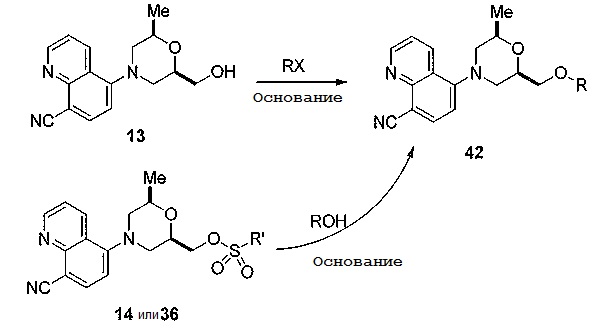
[0111]
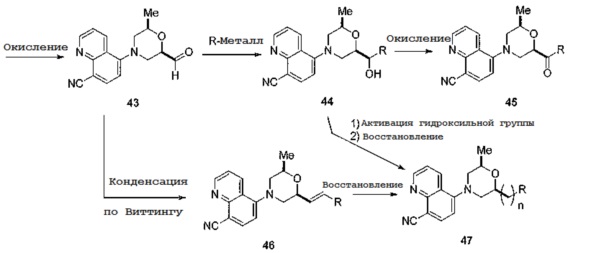
[0112] Ключевое промежуточное соединение 13 также может быть окислено с образованием альдегида 43 с последующей конденсацией с различными алкильными и арильными конденсирующими агентами с получением соединений по примерам 44 или 46, как показано на схеме 13. Затем полученные продукты могут быть преобразованы в дополнительные соединения по примерам либо окислением соединения 44 с получением соединения общей структуры 45, либо восстановлением соединения 46 с получением соединений общей структуры 47, где n=2. Аналогичным образом, специалист в данной области может синтезировать дополнительные соединения по примерам из промежуточного соединения 44 путем активирования гидроксильной группы, например, образованием трифлата с последующим восстановлением с использованием некоторых возможных восстановительных агентов с получением соединений по примерам, которые содержат на одну меньше метиленовых групп или соединения 47, где n=1.
[0113] Схема 13
[0114]
[0115] Окончательный набор соединений по примерам получают путем использования схемы 14. Используя способ синтеза для получения соединения 13, аналогичный представленному на схеме 4, можно получить желаемое семичленное гетероциклическое соединение 68, заменяя алкиламин на 1-амино-3-бутен 62. Затем соединение 68 может быть активировано и далее конденсировано с различными замещенными аминами для синтеза дополнительных аналогов аналогичным образом, как это показано, в частности, на схемах, представленных выше.
[0116] Схема 14
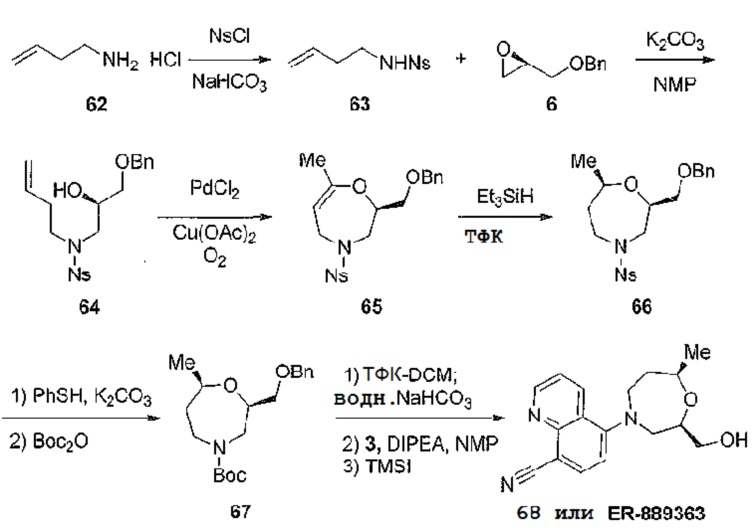
[0117]
[0118] Получение соединений по примерам
[0119] Соединение 3 - Схема 1
[0120] К суспензии 5-бромхинолин-8-карбальдегида 1 (1,00 г, 4,24 ммоль) и гидроксиламингидрохлорида (1,177 г, 16,94 ммоль) в ацетонитриле (110 мл) добавляли TEA (2,362 мл, 16,94 ммоль) с последующим нагреванием c обратным холодильником в течение 3 ч и получением суспензии желтого цвета. После полного завершения реакции реакционную смесь охлаждали до комнатной температуры, осадок отфильтровывали, и осадок на фильтре промывали ацетонитрилом (50 мл). Сырой твердый продукт очищали через небольшой слой силикагеля (10 г), элюируя EtOAc (300 мл) с получением альдоксима 2 в виде твердого вещества желтого цвета.
[0121] Альдоксим 2 (1,001 г, 4,0 ммоль) и моногидрат ацетата меди (II) (84,6 мг, 0,424 ммоль) в безводном ацетонитриле (180 мл) перемешивали при нагревании с обратным холодильником в течение 12 ч. После завершения реакции охлаждали до комнатной температуры, фильтровали, и слой на фильтре промывали H2O, получая твердое вещество коричневого цвета. Сырой твердый продукт очищали через небольшой слой силикагеля (приблизительно 10 г), элюируя (DCM 100 мл) с получением 5-бромхинолин-8-карбонитрила 3 (0,783 г, 3,4 ммоль, 79,3%-ный выход за 2 стадии) после концентрирования и сушки в вакууме элюированного продукта в виде твердого вещества светло-бежевого цвета. Смотри: Frédérieric de Montigny, Gilles Argouarch, Claude Lapinte, Synthesis, 2006, 293.
[0122] Соединение 3 - Схема 2
[0123] К перемешиваемому раствору тригидрата ацетата натрия (31,6 г, 0232 Моль) в этаноле (0498 л) при 15°C 5-добавляли бромхинолин-8-карбальдегид (49,84 г, 0,211 моль), а затем гидрохлорид гидроксиламина (15, 55 г, 0223 моль). Полученную смесь нагревали при 70°C в течение 3 ч, после чего реакционную смесь охлаждали до 35°C и затем разбавляли водой (250 мл). Смесь частично концентрировали до примерно 250 мл, после чего добавляли воду (250 мл), 2-метокси-2-метилпропан (120 мл) и гептан (120 мл), затем повторно концентрировали смесь до приблизительно 250 мл. Полученную взвесь разбавляли водой (250 мл) и охлаждали до 0°C, после чего добавляли 1М раствор NaOH в воде (211 мл), и конечную смесь интенсивно перемешивали в течение 10 мин. Суспензию фильтровали, промывали водой (498 мл), и осадок на фильтре сушили при 30°C в течение 18 часов с получением альдоксима 2 (49,75 г, 0198 моль, 93,9%-ный выход) в виде порошка бежевого цвета.
[0124] К перемешиваемой суспензии соединения 2 (48,21 г, 0,192 моль) в ацетонитриле (386 мл) при 15°C добавляли ацетат меди (II) (0,523 г, 2,9 ммоль), затем уксусную кислоту (13,1 мл, 0229 моль). Полученную смесь нагревали с обратным холодильником в течение 21 ч, затем, после полного завершения реакции, реакционную смесь охлаждали до 50°C. Добавляли воду (0,39 л), и смесь частично концентрировали с последующим разбавлением водой (290 мл) и охлаждали до 5°C. Добавляли 1М раствор NaOH в воде (230 мл) и продолжали интенсивное перемешивание в течение 10 мин. Суспензию фильтровали, осадок на фильтре промывали водой (500 мл) и сушили с получением соединения 3 (42,80 г, 0,183 моль, 95,6%-ный выход) в виде порошка темно-серого цвета.
[0125] Синтез ER-878952 - Схема 3 и 15 (способ 1)
[0126] Схема 15

[0127]
[0128] Соединение 3 (200,2 мг, 0,86 ммоль) в NMP (1 мл) и коммерчески доступный цис-2,6 диметилморфолин 69 (133,4 мг, 1,16 ммоль - в качестве типичного соединения 4 на схеме 3) нагревали в микроволновой печи при 150°C в течение 1 часа. После полного завершения реакции реакционную смесь фильтровали и распределяли в несколько сосудов, разбавляли NMP и очищали с использованием ВЭЖХ (колонка C18, градиент 10/90-95/5 ацетонитрил/вода с 0,1% ТФК, в течение 15 мин, t=8,5-9 мин) с получением после концентрирования и сушки в вакууме желаемых объединенных фракций ER-878952 (180 мг, 0,68 ммоль, 79,1%-ный выход).
[0129] ER-880369 (8,2 мг, 0,031 ммоль, 48,4%-ный выход) получали способом, аналогичным способу получения ER-878952, с использованием соединения 3 (15 мг, 0,064 ммоль) и 2-этилморфолина (22,2 мг, 0,191 ммоль). Разделение энантиомеров не выполняли.
[0130] ER-885618 (385,2 мг, 1,032 ммоль, 60,7%-ный выход) получали способом, аналогичным способу получения ER-878952 с использованием соединения 3 (400 мг, 1,716 ммоль) и 11 (398,1 мг, 1,799 ммоль) из схемы 4.
[0131] Синтез соединения ER-878952 (способ 2, схема 3 и 15)
[0132] К перемешиваемой суспензии соединения 3 (12,00 г, 0,0515 моль) в NMP (30,0 мл) добавляли соединение 69 (14,8 г, 0,129 моль) с последующим нагреванием при 120°C в течение 4 часов. После полного завершения реакции реакционную смесь охлаждали до 50°C, разбавляли IPA (30 мл), гептаном (60 мл) и затем еще охлаждали до 0°C. Через 30 мин осадок собирали фильтрацией, промывали предварительно охлажденной смесью (до 0°C) IPA (18,0 мл)/гептан (36 мл) и сушили в атмосфере N2/вакууме в течение 2 часов с получением ER-878952 (11,00 г) в виде порошка желтого цвета. Фильтрат концентрировали, распределяли между EtOAc (120 мл) и насыщенным водным раствором NaHCO3 (60 мл). Органический слой отделяли, промывали водой (60 мл) и пропускали через предварительно обработанный (гептан-этилацетат 1:1) силикагель, элюируют с помощью EtOAc (120 мл), затем концентрировали. Полученное таким образом твердое вещество коричневого цвета суспендировали в смеси EtOAc (10 мл) и гептана (10 мл) и нагревали до 70°C, затем оставляли охлаждаться до 20°C. Выпавший осадок собирали фильтрацией, промывали смесью EtOAc (5,0 мл) и гептана (5,0 мл), затем сушили в атмосфере N2/вакуум в течение 1 часа с получением дополнительного количества ER-878952 (0,649 г) в виде порошка желтого цвета. В итоге по способу получали ER-878952 (11,64 г, 43,6 ммоль, 89,6%-ный выход).
[0133] ER-879484 (способ 3, схема 3 и 16)
[0134] Схема 16
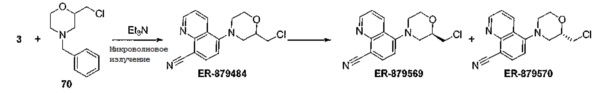
[0135] К перемешиваемому раствору соединения 3 (15 мг, 64,4 ммоль) и 4-бензил-2-(хлорметил)морфолина 70 (43,6 мг (0,193 ммоль) в ДМФ (0,5 мл) добавляли TEA (0,27 мкл, 0,194 ммоль). Реакционную смесь нагревали в микроволновой печи при 160°C в течение 1 часа, затем, после полного завершения реакции, реакционную смесь напрямую очищали на колонке для препаративной ВЭЖХ с обращенной фазой С-18 (колонка Water's X-Bridge C18 19×100 мм; элюируя смесью ацетонитрила в воде с 0,05% ТФК с градиентом 0-40%). Фракции, содержащие целевой продукт, объединяли, концентрировали и сушили в вакууме с получением ER-879484 (4,2 мг, 0,015 ммоль, 22,7%-ный выход). Энантиомеры ER-879484 (3,0 мг, 0,010 ммоль) разделяли, используя препаративную колонку ВЭЖХ с получением после концентрирования желаемых фракций и сушки в вакууме ER-879569 (1,0 мг, 0,004 ммоль) и ER-879570 (1,0 мг, 0,004 ммоль). Абсолютная стереохимия была неизвестной, но устанавливалась произвольным образом.
[0136] ER-879739 (12 мг, 0,047 ммоль, 73,6%-ный выход) получали способом, аналогичным способу получения ER-879484, исходя из соединения 3 (15 мг, 0,064 ммоль) и 2-метилморфолина (19,5 мг, 0,195 ммоль). Разделение энантиомеров не проводили.
[0137] ER-880191 (9,5 мг, 0,036 ммоль, 23,7%-ный выход) получали способом, аналогичным способу получения ER-879484, исходя из соединения 3 (35 мг, 0,150 ммоль) и (2S,6S)-2,6-диметилморфолина (741 мг, 6,434 ммоль). Также выделяли цис-изомер ER-878952 (15,2 мг, 0,057 ммоль, 37,9%-ный выход). В этом получении TEA не использовали.
[0138] Дополнительные соединения по примерам, полученные из ER-878952:
[0139] ER-885160: ER-878952 (85,6 мг, 0,320 ммоль) растворяли в 1,2-этандиоле (1 мл) с последующим добавлением гидроксида калия (60 мг, 1069 ммоль). Реакционную смесь нагревали в микроволновой печи при 120°C в течение 10 часов, после чего фильтровали, потом для очистки напрямую помещали на препаративную ВЭЖХ-колонку C-18 с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм, элюируя 10-100% ацетонитрилом в воде с 0,05% ТФК). Желаемые фракции концентрировали досуха, растворяли в MeOH (3 мл) и элюировали на колонке с силикагелем, пропитанным карбонатом (Biotage Isolute SPE, Si-СО3, 1 г), промывали MeOH (3 мл), концентрировали и сушили в вакууме с получением ER-885160 (56,2 мг, 0,197 ммоль, 61,6%-ный выход).
[0140] Получение соединения ER-890963 в качестве примера соединения 15, схема 4
[0141] Соединение 7: В 22-х литровый реактор помещали (2R)-бензил 2-эпоксипропиловый эфир (0,7692 кг, 4,684 моль) при внутренней температуре 18-19°C. При 18-19°C добавляли аллиламин (3800 мл, 51 моль), и полученную смесь нагревали при 50°C. Через 20 часов смесь концентрировали, отгоняли азеотропно с MTBE (4 л×3) с получением (R)-1-(аллиламино)-3-(бензилокси)пропан-2-ола, 7 (приблизительно 1037 г, 4,684 моль, 100%-ный предполагаемый выход) в виде бесцветного масла.
[0142] Соединение 8: К перемешиваемой суспензии бикарбоната натрия (1180 г, 14,0 моль) в воде (7,2 л) при 10-11°C добавляли раствор о-нитробензолсульфонилхлорида (1038 г, 4684 моль) в DCM (3100 мл) с последующим нагреванием полученной в результате двухфазной смеси до 20°C. Добавляли раствор соединения 7 (приблизительно 1037 г, предположительно 4684 моль) в DCM (4100 мл) в течение 3 ч при поддержании внутренней температуры в диапазоне 20-23°C и продолжали энергичное перемешивание в течение ночи. Смесь при перемешивании разбавляли водой (4100 мл) и после этого слои разделяли. Водный слой экстрагировали МТВЕ (4100 мл). Объединенные органические слои разбавляли н-гептаном (4100 мл), последовательно промывали 1,0М раствором HCl (4700 мл), насыщенным раствором NaHCO3 (2,0 кг), водой (4100 мл), концентрировали и досуха отгоняли азеотропно с MTBE (5200 мл×3) с получением после сушки в течение 3-х дней в вакууме (R)-N-аллил-N-(3-(бензилокси)-2-гидроксипропил)-2-нитробензолсульфонамида 8 (1,855 кг, 4,56 моль, 97%-ный выход) в виде масла коричнево-зеленого цвета.
[0143] Соединение 9: Перемешиваемую суспензию соединения 8 (1,80 кг, 4429 моль) в DMA (5,40 л) нагревали при 40°C до полного растворения, затем охлаждали до 25°C, после чего смесь помещали в отдельный реактор, содержащий ацетат меди (II) (0,145 кг, 0,797 моль), затем промывали первоначальный сосуд DMA (5,40 л). После заменой внутренней атмосферы на кислород (1 бар) добавляли хлорид палладия(II) (0,063 кг, 0,354 моль) и нагревали при 28-32°C в течение 3-х дней. После полного завершения реакции реакционную смесь разделяли на 2 равные части для облегчения обработки. Каждую часть отдельно выливали в смесь 0,1М раствора HCl (23 л) и МТВЕ (9,0 л), поддерживая при этом внутреннюю температуру <25°C. Слои разделяли, и водный слой экстрагировали MTBE (9,0 л и 5,4 л). Все органические слои объединяли, последовательно промывали 0,1М раствором HCl (5,5 л), 8%-ным раствором NaHCO3 (5,9 кг), 29%-ным раствором NaCl (6,3 кг). К органическому слою добавляли Целит 545 (270 г), перемешивали в течение 30 мин, фильтровали, и осадок на фильтре промывали МТВЕ (2,7 л). Все фильтраты объединяли и концентрировали. Масло красноватого оттенка повторно растворяли в DCM (3,6 л) и обрабатывали 1,3,5-триазинан-2,4,6-тритионом (79 г, 0,44 моль) при 25°C в течение 1 часа. Смесь разбавляли MTBE (18 л) и фильтровали через Целит 545 (270 г). Реактор и отфильтрованный осадок промывали МТВЕ (3,6 л), и объединенный фильтрат концентрировали с получением (R)-2-((бензилокси)метил)-6-метил-4-((2-нитрофенил)сульфонил)-3,4-дигидро-2H-1,4-оксазина 9 (1748 г, 4322 моль, 97,6%-ный выход) в виде масла желтого цвета.
[0144] Соединение 10: Перемешиваемую суспензию соединения 9 (1748 г, 4322 моль) в DCM (3,5 л) нагревали при 33-35°C до тех пор, пока не получали свободно текучую суспензию, после чего смесь охлаждали до 18-20°C. В отдельном реакторе ТФК (1,67 л, 21,6 моль) в DCM (2,62 л) охлаждали до 5°C при перемешивании, после чего добавляли триэтилсилан (1,04 л, 6,48 моль), поддерживая температуру в диапазоне 5-6°C, с последующим охлаждением до -5°C. Суспензию соединения 9 в DCM медленно добавляли в основной реактор в течение 1,5 ч, поддерживая температуру в интервале -5 и -3°C и затем продолжали перемешивание в течение 4 ч при температуре от -5 до -3°C. После полного завершения реакции реакционную смесь разбавляли предварительно охлажденным н-гептаном (8,74 л при -10°C), затем выливали в предварительно охлажденный раствор NaOH (NaOH: 890 г, 22,3 моль в воде: 8,7 л при 5°C), поддерживая внутреннюю температуру <15°C (более 1 ч), затем в промывочном реакторе промывали МТВЕ (3,5 л). Смесь разбавляли MTBE (5,2 л) и слои разделяли. Органический слой последовательно промывали водой (8,7 л), 30 масс% NaCl (3,5 кг) в воде, водой (5,2 л), обрабатывали Целит 545 (175 г) и фильтровали. Реакционный сосуд и осадок на фильтре промывали MTBE (1,75 л), и объединенные фильтраты концентрировали в вакууме до прибл. 3,5 л, азеотропно отгоняли с н-гептаном (8,7 л) и концентрировали до прибл. 5 л. Осадок рыжевато-коричневого цвета собирали фильтрацией, промывали н-гептаном (3,5 л) и сушили в атмосфере N2/вакуум в течение 1 часа. Полученные 1,65 кг твердого вещества объединяли с 353 г твердого вещества, полученного отдельной партией, и суспендировали в смеси н-гептан/EtOAc 1:1 (8,0 л). Смесь нагревали при 61-63°C до полного растворения, охлаждали до 23-25°C в течение 1 ч, разбавляли гептаном (4 л) и дополнительно охлаждали до 10-12°C в течение 30 мин. Перемешивание продолжали при этой температуре в течение 30 мин. Осадок светло-бежевого цвета собирали фильтрованием, промывали смесью н-гептан/EtOAc, 6:1 (2 л) и затем н-гептаном (4 л) с последующей сушкой в атмосфере N2/вакуум в течение ночи, а затем сушили в вакуумном печи при 35°C в течение 2 дней с получением (2R,6R)-2-((бензилокси)метил)-6-метил-4-((2-нитрофенил)сульфонил)морфолина 10 (1616 г, 3,98 моль, выход 74% за 2 стадии из соединения 8) в виде твердого вещества рыжевато-коричневого цвета.
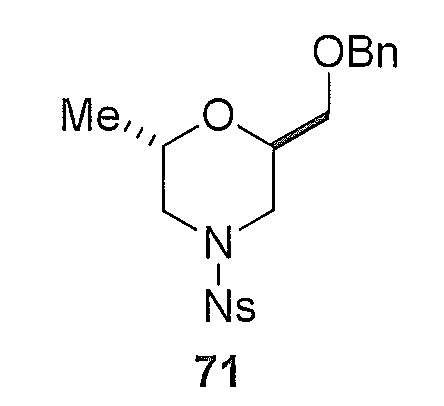
[0145]
[0146] Второстепенный продукт: (2R,6S)-2-((бензилокси)метил)-6-метил-4-((2-нитрофенил)сульфонил)морфолин 71 (диастереоизомер) выделяли путем очистки исходного раствора 10.
[0147] Соединение 11: К перемешиваемому 1,0M раствору t-BuOK (0,650 л, 0,650 моль) в ТГФ (0,310 л), охлажденному до 5°C, добавляли бензолтиол (63,66 мл, 0,620 моль) при поддержании температуры <10°C. Смесь перемешивали при 10°C в течение 30 мин, затем нагревали до 15°C в течение 1 часа, после чего добавляли раствор соединения 10 (240,00 г, 590,5 ммоль) в ТГФ (0,60 л) при поддержании температуры в диапазоне 15-20°C и затем перемешивали в течение 2 часа. После полного завершения реакции реакционную смесь медленно гасили смесью 1,0M раствора HCl (1,30 л) в н-гептане (3,60 л, предварительно охлажденный до 10°C) при поддержании температуры реакционной смеси <15°C. Полученную смесь интенсивно перемешивали в течение 10 мин, затем слои разделяли. Органический слой экстрагировали водой (0,24 л) с промыванием н-гептаном (0,24 л). Все водные слои объединяли и промывали н-гептаном (3,60 л) с последующим добавлением NaCl (240 г) при перемешивании. Водную смесь подщелачивали 5,0М раствором NaOH (165 мл) с последующей экстракцией, два раза, DCM (по 3,60 л и 2,40). Объединенные органические слои промывали 20 масс% NaCl в воде (1400 г), концентрировали, отгоняли азеотропно с MTBE (1400 мл), повторно разбавляли MTBE (960 мл) и фильтровали через стеклянный фильтр. Фильтрат концентрировали с получением (2R,6R)-2-((бензилокси)метил)-6-метилморфолина 11 в виде прозрачного масла коричневатого цвета, которое использовали в последующей реакции без дополнительной очистки.
[0148] Соединение 12: К перемешиваемому раствору соединения 3 (137,6 г, 0,591 моль) в DMA (260 мл) добавляли DIPEA (308 мл, 1,77 моль), затем раствор соединения 11 (130,67 г, 0,5905 моль) в DMA (260 мл), промывая DMA (130 мл). Реакционную смесь нагревали при 125-130°C в течение 2 часов. После полного завершения реакции реакционную смесь охлаждали до 30°C и разбавляли EtOAc (1,96 л) и водой (0,65 л), после чего выливали в воду (2,61 л) при интенсивном перемешивании. Полученную смесь фильтровали через слой из Целита 545 (260 г) и слои разделяли. Водный слой экстрагировали EtOAc (1,31 л) с последующим объединением органических слоев, которые промывали два раза 5%-ным раствором NaCl (1,0 кг, каждый раз) и концентрировали с получением твердого вещества черного цвета. Твердое вещество растворяли в DCM (1 л), разбавляли н-гептаном (520 мл) с последующим добавлением силикагеля (196 г) и MgSO4 (130 г). Полученную взвесь перемешивали при 20°C в течение 30 мин, фильтровали и элюировали изопропилацетатом (2,09 л). Объединенный фильтрат концентрировали, и полученное твердое вещество коричневого цвета суспендировали в смеси EtOAc (196 мл) и н-гептана (523 мл). Смесь нагревали до 70°C, затем охлаждали до комнатной температуры и перемешивали в течение ночи. Осадки собирали фильтрованием, промывали смесью EtOAc/н-гептан 3:8 (220 мл) и сушили в вакууме с получением 5-((2R,6R)-2-((бензилокси)метил)-6-метилморфолино)хинолин-8-карбонитрила 12 (178,44 г, 0,478 моль, 80%-ный выход) в виде порошка бежевого цвета.
[0149] Соединение 13: К перемешиваемой суспензии соединения 12 (167,3 г, 0,45 моль) в ацетонитриле (500 мл) добавляли триметилсилил йодид (82,9 мл, 0,582 моль) при комнатной температуре. Полученную смесь нагревали при 70°C в течение 2 часов, после чего охлаждали до комнатной температуры, медленно гасили водой (167 г) и перемешивали при 25-30°C в течение 1 часа. Реакционную смесь охлаждали до 15°C с последующим добавлением 28% водного раствора гидрохлорида аммония (500 г), после чего реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь частично концентрировали и затем разбавляли водой (0,5 л), MTBE (0,04 л) и н-гептаном (0,3 л) и затем охлаждали до 0-5°C. Осадок собирали фильтрованием и промывали предварительно охлажденной водой (500 мл), затем смесью н-гептан/MTBE 7:1 (400 мл) с последующей сушкой в вакууме (40°C) в течение ночи с получением 5-((2R,6R)-2-(гидроксиметил)-6-метилморфолино)хинолин-8-карбонитрила 13, или ER-885493, (127,2 г, 0,45 моль, 100%-ный выход) в виде порошка бежевого цвета.
[0150] Соединение 14: К перемешиваемому раствору соединения 13 (24,8 г, 0,0875 моль) в DCM (200 мл) добавляли частями п-толуолсульфонил хлорид (17,95 г, 94,17 ммоль), затем TEA (24,60 мл, 0,1765 моль) при комнатной температуре. Реакционную смесь перемешивали в течение 3 часов, затем, после полного завершения реакции, реакционную смесь гасили водой (200 мл). Отделенный органический слой промывали насыщенным солевым раствором (50 мл), сушили над Na2SO4, фильтровали и концентрировали до смолы коричневого цвета. Сырой продукт очищали на силикагеле (SNAP 340×2 г, элюируя смесью гептан/EtOAc=от 5/1 до 3/1, ТСХ гептан/EtOAc=3/1, rf=0,6) с получением после концентрирования целевых фракций и сушки в вакууме ((2R,6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-ил)метил 4-метилбензолсульфоната 14 (34,98 г, 79,95 ммоль, 84,9%-ный выход) в виде порошка желтого цвета.
[0151] Соединение 15 в виде Boc-защищенного ER-890963: К раствору соединения 14 (13,9 г, 31,77 ммоль) и TEA (8,86 мл, 63,541 ммоль) в DMA (89 мл) при комнатной температуре добавляли по каплям коммерчески доступный (S)-трет-бутил 2-этилпиперазин-1-карбоксилат (7,49 г, 34,95 ммоль) в течение 5 мин. Реакционную смесь перемешивали при 110°C в течение 12 час до полного завершения реакции, после чего реакционную смесь охлаждали до комнатной температуры. Реакционную смесь концентрировали для удаления DMA с последующим разбавлением DCM (30 мл). Полученный органический раствор промывали два раза водой (по 30 мл), насыщенным солевым раствором (30 мл) и сушили над MgSO4. Сырой продукт фильтровали, концентрировали в вакууме и очищали на силикагеле (SNAP 340 г, элюируя смесью 10%-30% EtOAc в гептане, ТСХ гептан/EtOAc=3/1, rt=0,6) с получением после концентрирования объединенных желаемых фракций и сушки в вакууме 5-((2S,6R)-2-(((S)-4-(3,3-диметилбутаноил)-3-этилпиперазин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила, или Boc-защищенного ER-890963, (12,27 г, 24,15 ммоль, 76%-ный выход) в виде порошка желтого цвета.
[0152] ER-890963 или соединение 15:
[0153] Boc-защищенный ER-890963 (23,55 г, 49,10 ммоль) растворяли при перемешивании в DCM (50 мл), затем в ТФК (50 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре, затем, после полного завершения реакции, реакционную смесь концентрировали в вакууме. Сырое вещество темно-оранжевого цвета растворяли при перемешивании в DCM (50 мл) и нейтрализовали добавлением насыщ. водного раствора NaHCO3 при 20°C до тех пор, пока значение рН раствора не становилось равным 5-6. Отделенный водный слой экстрагировали два раза DCM (по 50 мл), после чего объединенные органические слои промывали насыщенным солевым раствором (20 мл), сушили над Na2SO4, фильтровали, концентрировали досуха. Сырой остаток перекристаллизовывали из смеси DCM/iPrOH/гептан/Et2O=1/1/1/1 с получением ER-890963 (17,89 г, 47,14 ммоль, 96%) в виде желтого порошка.
[0154] ER-886604 (7,8 мг, 0,021 ммоль, 73%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-4-метилбензола (0,030 мл, 0,290 ммоль), при нагревании в микроволновой печи при 180°C в течение 15 мин. ER-886604 очищали с использованием ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм, элюируя 10% ацетонитрилом в воде, содержащей 0,05% ТФК). Фракции, содержащие продукт, объединяли и концентрировали досуха с последующим разбавлением в MeOH (1 мл), пропускали через основной слой из силикагеля (Biotage SiCO3, 1 г, элюируя MeOH (1 мл)), концентрировали и сушили в вакууме. Удаление защитной группы Boc не требовалось.
[0155] ER-886608 (8,2 мг, 0,019 ммоль, 67%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 5-амино-1,2-диметилбензимидазол дигидрохлорида (30 мг, 0,128 ммоль) вместе с TEA (0,040 мл, 0,290 ммоль).
[0156] ER-886609 (7,4 мг, 0,017 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 5-амино-1-этил-2-метилбензимидазола (30 мг, 0,171 ммоль).
[0157] ER-886611 (9,2 мг, 0,027 ммоль, 88%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-аминоциклогексана (30 мг, 0,171 ммоль).
[0158] ER-886787 (4,5 мг, 0,012 ммоль, 43,9%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-аминопиримидина (24,7 мг, 0,263 ммоль).
[0159] ER-886788 (5,2 мг, 0,014 ммоль, 51%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-аминопиридина (24,4 мг, 0,263 ммоль).
[0160] ER-886789 (4,5 мг, 0,012 ммоль, 42%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-6-метилпиридина (28,1 мг, 0,263 ммоль).
[0161] ER-886790 (4,6 мг, 0,012 ммоль, 43%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-5-метилпиридина (28,1 мг, 0,263 ммоль).
[0162] ER-886814 (4,2 мг, 0,012 ммоль, 40,4%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и D-пролинола (26,2 мг, 0,263 ммоль).
[0163] ER-886815 (4,0 мг, 0,011 ммоль, 38,2%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2,2-диметилпирролидина (14,2 мг, 0,145 ммоль).
[0164] ER-886816 (6,0 мг, 0,016 ммоль, 60%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-изопропилпирролидина (29,4 мг, 0,263 ммоль).
[0165] ER-886817 (4,2 мг, 0,012 ммоль, 62%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (R)-2-метилпирролидина (22,1 мг, 0,263 ммоль).
[0166] ER-886818 (4,2 мг, 0,010 ммоль, 35,2%-ный выход) получали способом, аналогичным способу получения ER-890604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S) 3-фенилпирролидина (38,2 мг, 0,263 ммоль).
[0167] ER-886819 (5,2 мг, 0,015 ммоль, 52%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (R)-3-метилпирролидина (22,1 мг, 0,263 ммоль).
[0168] ER-886820 (6,2 мг, 0,018 ммоль, 62%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S)-3-гидроксипирролидина (22,6 мг, 0,263 ммоль).
[0169] ER-886853 (6,2 мг, 0,017 ммоль, 58%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-4-метилпиридина (28,1 мг, 0,263 ммоль).
[0170] ER-886854 (2,9 мг, 0,007 ммоль, 25%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 3-фенилпирролидина гидрохлорида (47,7 мг, 0,263 ммоль).
[0171] ER-886855 (4,9 мг, 0,013 ммоль, 44%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-5-метоксипиридина (32,2 мг, 0,263 ммоль).
[0172] ER-886856 (7,8 мг, 0,022 ммоль, 78%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S)-2-метилпирролидина (22,1 мг, 0,263 ммоль).
[0173] ER-886857 (5,6 мг, 0,015 ммоль, 54%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2,5-диметилпирролидина (25,7 мг, 0,263 ммоль).
[0174] ER-886858 (3,6 мг, 0,009 ммоль, 32%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-4-метоксипиридина (32,2 мг, 0,263 ммоль).
[0175] ER-886859 (2 мг, 0,005 ммоль, 20%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-6-метоксипиридина (32,2 мг, 0,263 ммоль).
[0176] ER-886860 (2,5 мг, 0,006 ммоль, 21%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 5-амино-1-фенилпиразола (41,3 мг, 0,263 ммоль).
[0177] ER-886866 (8,2 мг, 0,022 ммоль, 78%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и L-пролинола (22,1 мг, 0,263 ммоль).
[0178] ER-886867 (4,5 мг, 0,013 ммоль, 45%-ный выход) получали способом, аналогичным способу получения ER-886604 исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (R)-3-гидроксипирролидина (22,6 мг, 0,263 ммоль).
[0179] ER-886868 (6,5 мг, 0,019 ммоль, 65%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S)-3-метилпирролидина (22,1 мг, 0,263 ммоль).
[0180] ER-886869 (5,3 мг, 0,015 ммоль, 51%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 3,3-диметилпирролидина (25,7 мг, 0,263 ммоль).
[0181] ER-886948 (6,2 мг, 0,016 ммоль, 56%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-3-метоксипиридина (32,2 мг, 0,263 ммоль).
[0182] ER-886949 (4,8 мг, 0,013 ммоль, 46%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (R)-3-гидроксипиперидина (26,2 мг, 0,263 ммоль).
[0183] ER-886950 (5,0 мг, 0,013 ммоль, 46%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (R,S)-2,6-диметилпиперидина (29,4 мг, 0,263 ммоль).
[0184] ER-886951 (3,2 мг, 0,009 ммоль, 31%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S)-3-гидроксипиперидина (26,2 мг, 0,263 ммоль).
[0185] ER-886953 (5,8 мг, 0,016 ммоль, 55%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-гидроксипиперидин (26,2 мг, 0,263 ммоль).
[0186] ER-886955 (7,5 мг, 0,020 ммоль, 69%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-гидроксиметилпиперидина (29,9 мг, 0,263 ммоль).
[0187] ER-887137 (4,5 мг, 0,012 ммоль, 42%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2,3-диметилпиперазина (29,6 мг, 0,263 ммоль).
[0188] ER-887138 (5,9 мг, 0,016 ммоль, 57%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 3-аминопиридина (24,4 мг, 0,263 ммоль).
[0189] ER-887139 (6,5 мг, 0,018 ммоль, 63%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 3-аминопиридина (24,4 мг, 0,263 ммоль).
[0190] ER-887141 (5,2 мг, 0,014 ммоль, 50%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-метилпиперидина (25,7 мг, 0,263 ммоль).
[0191] ER-887142 (4,5 мг, 0,012 ммоль, 41%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4,4-дифторпиперидина (31,4 мг, 0,263 ммоль).
[0192] ER-887143 (4,7 мг, 0,011 ммоль, 38%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-фенилпиперидина (41,8 мг, 0,263 ммоль).
[0193] ER-887144 (6,2 мг, 0,017 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-фторпиперидина (26,8 мг, 0,263 ммоль).
[0194] ER-887145 (6,5 мг, 0,019 ммоль, 65%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-аминоциклопентана (22,1 мг, 0,263 ммоль).
[0195] ER-887146 (7 мг, 0,018 ммоль, 60%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-3-метилциклогексана (29,4 мг, 0,263 ммоль).
[0196] ER-887177 (5,3 мг, 0,014 ммоль, 49%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-3-метилпиридина (20 мг, 0,145 ммоль).
[0197] ER-887253 (10,2 мг, 0,029 ммоль, 60%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (20 мг, 0,046 ммоль) и пиперазина (40 мг, 0,460 ммоль).
[0198] ER-887442 (6,2 мг, 0,016 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,2 мг, 0,028 ммоль) и 1-амино-4-метилциклогексана (30 мг, 0,265 ммоль).
[0199] ER-887443 (4,5 мг, 0,013 ммоль, 47%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-циклобутана (10 мг, 0,141 ммоль).
[0200] ER-887444 (7,7 мг, 0,020 ммоль, 70,7%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-циклогептана (20 мг, 0,177 ммоль).
[0201] ER-887526 (6,2 мг, 0,016 ммоль, 57%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-4-гидроксициклогексана (30 мг, 0,260 ммоль).
[0202] ER-887528 (5,4 мг, 0,015 ммоль, 51,2%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-2-гидроксициклопентана (30 мг, 0,297 ммоль).
[0203] ER-887539 (5,3 мг, 0,014 ммоль, 49%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-2-метилциклогексана (30 мг, 0,265 ммоль).
[0204] ER-887538 (6,5 мг, 0,014 ммоль, 51,8%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-5-фенилпиридина (50 мг, 0,294 ммоль).
[0205] ER-887540 (6,1 мг, 0,014 ммоль, 49%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-3-фенилпиридина (50 мг, 0,294 ммоль).
[0206] ER-887586 (6,2 мг, 0,017 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S,R)-1-амино-2-гидроксипирролидина (10 мг, 0,099 ммоль).
[0207] ER-887587 (7,5 мг, 0,019 ммоль, 65%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-3-этоксилпиридина (40 мг, 0,290 ммоль).
[0208] ER-887588 (5,6 мг, 0,013 ммоль, 45%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-амино-2-фенилпиридина (20 мг, 0,118 ммоль).
[0209] ER-887589 (2,4 мг, 0,006 ммоль, 19%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-6-фенилпиридина (20 мг, 0,118 ммоль).
[0210] ER-887722 (3,5 мг, 0,009 ммоль, 32%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 5-метилпиперазин-2-она (20 мг, 0,175 ммоль).
[0211] ER-887723 (6,2 мг, 0,017 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-N-метилпиперазина (10 мг, 0,100 ммоль).
[0212] ER-887724 (6,2 мг, 0,016 ммоль, 55%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-N-пропилпиперазина (40 мг, 0,138 ммоль).
[0213] ER-887725 (7,2 мг, 0,018 ммоль, 64%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-(диметиламино)-пиперидина (20 мг, 0,156 ммоль).
[0214] ER-887927 (10,2 мг, 0,024 ммоль, 82,3%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1,4'-бипиперидина (20 мг, 0,119 ммоль).
[0215] ER-887928 (3,2 мг, 0,009 ммоль, 31%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (R)-трет-бутил пиперидин-3-илкарбамата (30 мг, 0,150 ммоль).
[0216] ER-888070 (4,5 мг, 0,012 ммоль, 43%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и трет-бутил пиперидин-4-илкарбамата (30 мг, 0,150 ммоль).
[0217] ER-888202 (6,2 мг, 0,018 ммоль, 62%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и пиперидина (0,034 мл, 0,348 ммоль).
[0218] ER-888203 (7,2 мг, 0,020 ммоль, 58%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15,5 мг, 0,035 ммоль) и морфолина (0,030 мл, 0,350 ммоль).
[0219] ER-888204 (6,2 мг, 0,016 ммоль, 57%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (2S,6R)-2,6-диметилморфолина (0,070 мл, 0,580 ммоль).
[0220] ER-888205 (4,6 мг, 0,012 ммоль, 41%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и ((2R,6R)-6-метилморфолин-2-ил)метанола или ER-885491 (40 мг, 0,305 ммоль).
[0221] ER-885491: К перемешиваемой суспензии соединения 11 (890,2 мг, 4,023 ммоль) в MeOH (8 мл) добавляли 5%-ный палладий на угле (270 мг), после чего смесь продували газообразным H2 три раза с вакуумированием между загрузками. Реакционную смесь перемешивали в атмосфере H2 при 40°C в течение 8 час. Неполностью прореагировавшую смесь дегазировали в вакууме с продувкой газообразным N2, а затем добавляли 5%-ный палладий на угле (100 мг) и 2 капли конц. HCl, после чего реакционную смесь помещали в атмосферу H2, как описано выше, в течение 4 ч при 40°C. После полного завершения реакции реакционную смесь продували газообразным N2 с последующим фильтрованием через Целит 545, элюированием MeOH (5 мл), концентрированием и сушкой в вакууме. Сырой продукт ER-885491 (378,2 мг, 2,883 ммоль, 71,7%-ный выход) использовали на последующей стадии без дополнительной очистки.
[0222] ER-888285 (8,6 мг, 0,020 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и N-(2-пиридил)пиперазина (30 мг, 0,184 ммоль).
[0223] ER-888286 (10,2 мг, 0,020 ммоль, 71,3%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (14,6 мг, 0,033 ммоль) и N-(4-пиридил)пиперазина (30 мг, 0,184 ммоль).
[0224] ER-888288 (7,2 мг, 0,016 ммоль, 52%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и N-(пиперидин-4-ил)ацетамид (20 мг, 0,141 ммоль). HCl соль получали способами, описанными выше.
[0225] ER-888289 (16,2 мг, 0,039 ммоль, 21,6%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (80 мг, 0,183 ммоль) и 1,8-нафтиридин-2-амина (100 мг, 0,689 ммоль).
[0226] ER-888320 (5,8 мг, 0,015 ммоль, 42%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15,5 мг, 0,035 ммоль) и пиперидин-4-карбоксамида (20 мг, 0,156 ммоль).
[0227] ER-888321 (6,2 мг, 0,013 ммоль, 37%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15,5 мг, 0,035 ммоль) и N-(пиперидин-4-ил)бензамида (40 мг, 0,196 ммоль).
[0228] ER-888322 (10,5 мг, 0,027 ммоль, 75,3%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15,5 мг, 0,035 ммоль) и 1-изопропилпиперазина (20 мг, 0,156 ммоль).
[0229] ER-888330 (4,2 мг, 0,011 ммоль, 30%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15,5 мг, 0,035 ммоль) и пиперазин-1-карбоксамида (20 мг, 0,155 ммоль).
[0230] ER-888479 (7,6 мг, 0,018 ммоль, 51%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 4-циклогексилпиперидина (30 мг, 0,179 ммоль).
[0231] ER-888480 (8,3 мг, 0,020 ммоль, 58%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 4-(пирролидин-1-ил)пиперидина (30 мг, 0,194 ммоль).
[0232] ER-888838 (6,2 мг, 0,015 ммоль, 45%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 3,5-диметилпиридин-2,6-диамина (20 мг, 0,146 ммоль).
[0233] ER-888977 (1,2 мг, 0,003 ммоль, 11%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1,3-диметил-1H-пиразол-5-амина (28,8 мг, 0,259 ммоль).
[0234] ER-889448 (8,2 мг, 0,022 ммоль, 63%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 1-этилпиперазина (0,020 мл, 0,136 ммоль).
[0235] ER-889469 (6,5 мг, 0,018 ммоль, 52%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 1-(азетидин-3-ил)пирролидина (20 мг, 0,158 ммоль).
[0236] ER-889470 (7,2 мг, 0,017 ммоль, 48%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 1-(азетидин-3-ил)пиперидина (20 мг, 0,158 ммоль).
[0237] ER-889557 (7,7 мг, 0,020 ммоль, 58,6%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и пиперидин-4-илметанола (20 мг, 0,174 ммоль).
[0238] ER-889571 (3,2 мг, 0,008 ммоль, 23%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и (R)-1,3'-бипирролидина (20 мг, 0,143 ммоль).
[0239] ER-889572 (1,1 мг, 0,003 ммоль, 7,7%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и (R)-1-(пирролидин-3-ил)пиперидина (20 мг, 0,130 ммоль).
[0240] ER-889601 (6,7 мг, 0,018 ммоль, 51%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и 1-метил-1,4-диазепана (20 мг, 0,175 ммоль).
[0241] ER-889602 (10,2 мг, 0,022 ммоль, 65,3%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (15 мг, 0,034 ммоль) и фенил(пиперазин-1-ил)метанона (30 мг, 0,158 ммоль).
[0242] ER-891084 (7,2 мг, 0,016 ммоль, 47%-ный выход) получали способом, аналогичным способу получения ER-886608, исходя из соединения 14 (15 мг, 0,034 ммоль) и 1-(пиперидин-4-ил)азепана (30 мг, 0,165 ммоль).
[0243] ER-890108 (15,2 мг, 0,036 ммоль, 58,6%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (27 мг, 0,062 ммоль) и 1-(азетидин-3-ил)-4-метилпиперазина (90,2 мг, 0,581 ммоль). К реакционной смеси также добавляли триэтиламин (0,008 мл, 0,062 ммоль).
[0244] ER-890112 (296,5 мг, 0,683 ммоль, 74,7%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (400,6 мг, 0,916 ммоль) и 4,4'-бипиперидина (290 мг, 1,723 ммоль).
[0245] ER-894472 (53,9 мг, 0,143 ммоль, 25%-ный выход) и ER-894473 (51,2 мг, 0,135 ммоль, 23,6%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (250 мг, 0,571 ммоль) и 5-метилпиперазин-2-она (78,3 мг, 0,686 ммоль). Стереохимию каждой диастереомерной метильной группы устанавливали произвольно.
[0246] ER-886507 (4,2 мг, 0,013 ммоль, 51,9%-ный выход) получали способом, аналогичным способу получения ER-886604, исходя из соединения 14 (10,6 мг, 0,024 ммоль) и пирролидина (0,022 мл, 0,257 ммоль), используя в качестве растворителя вместо DMA толуол (1 мл). Удаление защитной группы Boc не требовалось.
[0247] ER-886508 (3,3 мг, 0,010 ммоль, 38,9%-ный выход) получали способом, аналогичным способу получения ER-890507, исходя из соединения 14 (10,8 мг, 0,025 ммоль) и N,N-диэтиламина (0,027 мл, 0,262 ммоль).
[0248] ER-886509 (4,8 мг, 0,013 ммоль, 44,9%-ный выход) получали способом, аналогичным способу получения ER-890507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и бензиламина (0,028 мл, 0,263 ммоль).
[0249] ER-886601 (6,6 мг, 0,018 ммоль, 64,2%-ный выход) получали способом, аналогичным способу получения ER-890507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и фениламина (0,008 мл, 0,087 ммоль).
[0250] ER-886602 (6,4 мг, 0,017 ммоль, 60,1%-ный выход) получали способом, аналогичным способу получения ER-890507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-3-метилбензола (0,028 мл, 0,263 ммоль).
[0251] ER-887104 (2,1 мг, 0,005 ммоль, 17,9%-ный выход) получали способом, аналогичным способу получения ER-890507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S)-2-(трифторметил)пирролидина (36,1 мг, 0,260 ммоль).
[0252] ER-886603 (7,6 мг, 0,020 ммоль, 71%-ный выход) получали способом, аналогичным способу получения ER-890507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 1-амино-2-метилбензола (0,030 мл, 0,290 ммоль), используя в качестве растворителя вместо толуола NMP (1 мл).
[0253] ER-886957 (4,7 мг, 0,013 ммоль, 45%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-метилпиперидина (25,7 мг, 0,263 ммоль).
[0254] ER-886958 (6,2 мг, 0,016 ммоль, 57%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-этилпиперидина (29,3 мг, 0,263 ммоль).
[0255] ER-887139 (2,1 мг, 0,005 ммоль, 18%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S)-2-трифторметилпирролидина (36,1 мг, 0,263 ммоль).
[0256] ER-887252 (2,6 мг, 0,006 ммоль, 21%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-амино-4-фенилпиридина (20 мг, 0,145 ммоль).
[0257] ER-887258 (4,2 мг, 0,010 ммоль, 34%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и N-фенил пиперазина (0,040 мл, 0,290 ммоль) в толуоле (0,5 мл).
[0258] ER-887259 (3,2 мг, 0,009 ммоль, 30%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2,6-диметилпиридина (30 мг, 0,290 ммоль).
[0259] ER-887260 (3,3 мг, 0,009 ммоль, 30,1%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и (S,S)-2,5-диметилпиперазина (29,6 мг, 0,263 ммоль).
[0260] ER-887261 (4,2 мг, 0,011 ммоль, 39%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12 мг, 0,027 ммоль) и N-ацетил пиперазина (40 мг, 0,274 ммоль).
[0261] ER-887262 (2,4 мг, 0,006 ммоль, 22%-ный выход) получали способом, аналогичным способу получения ER-886507, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 4-(R)-гидрокси-2-(S)-гидроксиметилпирролидина (30,4 мг, 0,263 ммоль).
[0262] ER-887268 (9,3 мг, 0,017 ммоль, 10%-ный выход) получали способом, аналогичным способу получения ER-886608, исходя из соединения 14 (50 мг, 0,114 ммоль) и (R)-трет-бутил 3-метилпиперазин-1-карбоксилата (100 мг, 0,570 ммоль), используя толуол (1 мл). Для Вос-защищенного ER-890963, указанного выше, требовалось удаление защитной группы Вос. ER-887268 очищали с использованием ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм, элюируя смесью 10-40% ацетонитрила в воде с 0,05% ТФК) с последующей нейтрализацией, как описано для ER-886608.
[0263] ER-887269 (6,2 мг, 0,025 ммоль, 21,4%-ный выход) получали способом, аналогичным способу получения ER-887268, исходя из соединения 14 (51,8 мг, 0,118 ммоль) и (R)-трет-бутил 2-метилпиперазин-1-карбоксилата (100 мг, 0,570 ммоль).
[0264] ER-887270 (12,2 мг, 0,033 ммоль, 30%-ный выход) получали способом, аналогичным способу получения ER-887268, исходя из соединения 14 (50 мг, 0,114 ммоль) и (S)-трет-бутил 2-метилпиперазин-1-карбоксилата (200 мг, 1,14 ммоль).
[0265] ER-887271 (2,3 мг, 0,006 ммоль, 5,5%-ный выход) получали способом, аналогичным способу получения ER-887268, исходя из соединения 14 (48,2 мг, 0,110 ммоль) и (R,R)-трет-бутил 2,5-диметилпиперазин-1-карбоксилат гидрохлорида (100 мг, 0,399 ммоль) и DIPEA (0,10 мл, 0,55 ммоль).
[0266] ER-887272 (3,2 мг, 0,008 ммоль, 7,1%-ный выход) получали способом, аналогичным способу получения ER-887268, исходя из соединения 14 (52,7 мг, 0,120 ммоль) и (S,R)-трет-бутил 2,5-диметилпиперазин-1-карбоксилата (100 мг, 0,467 ммоль).
[0267] ER-890119 (256,2 мг, 0,630 ммоль, 58,6%-ный выход) получали способом, аналогичным способу получения ER-890963, исходя из соединения 14 (450 мг, 1,029 ммоль) и трет-бутил 4-(азетидин-3-ил)пиперазин-1-карбоксилата (314,2 мг, 1,302 ммоль). К реакционной смеси также добавляли триэтиламин (0,172 мл, 1,23 ммоль). Вместо DMA использовали диоксан (2 мл). Требовалось удаление защитной группы Вoc с помощью ТФК с последующей нейтрализацией конечного продукта, как описано выше.
[0268] ER-892253 (152,3 мг, 0,362 ммоль, 4,0% полный выход) получали способом, аналогичным способу получения ER-890119, исходя из соединения 14 (4,0 г, 9,1 ммоль) и трет-бутил (1-(азетидин-3-ил)пиперидин-4-ил)карбамата (2,52 г, 9,9 ммоль).
[0269] ER-888605 (7,6 мг, 0,017 ммоль, 5,0%-ный выход) получали способом, аналогичным способу получения ER-890119, исходя из соединения 14 (150 мг, 0,343 ммоль) и [1,4'-бипиперидин]-2-он гидрохлорида (82,5 мг, 0,377 ммоль). Удаление группы Boc не требовалось.
[0270] ER-888605 (7,6 мг, 0,017 ммоль, 5,0%-ный выход) получали способом, аналогичным способу получения ER-890119, исходя из соединения 14 (150 мг, 0,343 ммоль) и [1,4'-бипиперидин]-2-он гидрохлорида (82,5 мг, 0,377 ммоль). Удаление группы Boc не требовалось.
[0271] ER-890093 (15,2 мг, 0,035 ммоль, 45,4%-ный выход) получали способом, аналогичным способу получения ER-890119, исходя из соединения 14 (33,6 мг, 0,077 ммоль) и 4-(пиперидин-4-ил)морфолина (52 мг, 0,305 ммоль). Удаление группы Boc не требовалось.
[0272] ER-890104 (569 мг, 1,06 ммоль, 42,6%-ный выход) получали способом, аналогичным способу получения ER-890119, исходя из соединения 14 (1,08 г, 2,5 ммоль) и трет-бутил 4-(пиперидин-4-ил)пиперазин-1-карбоксилата (1,00 г, 3,7 ммоль). Удаление защитной группы Вос в ER-890104 (21 мг, 0,039 ммоль) выполняли способом, описанным выше, с получением ER-890106 (12,4 мг, 0,029 ммоль, 73,2%-ный выход).
[0273] ER-890105 (65 мг, 0,122 ммоль, 11,3%-ный выход) получали способом, аналогичным способу получения ER-890119, исходя из соединения 14 (1,08 г, 2,5 ммоль) и трет-бутил 4-(пиперидин-4-ил)пиперазин-1-карбоксилата (1,00 г, 3,7 ммоль). К реакционной смеси также добавляли DIPEA (0,65 мл, 3,7 ммоль). Выполняли удаление защитной группы Вос в ER-890105 (60 мг, 0,112 ммоль), как описано выше, с получением ER-890107 (11,3 мг, 0,026 ммоль, 23,2%-ный выход).
[0274] ER-890311 (4,5 мг, 0,011 ммоль, 31%-ный выход) получали способом, аналогичным способу получения ER-886608, исходя из соединения 14 (15 мг, 0,034 ммоль) и (S)-1-(пирролидин-3-ил)пиперидин дигидрохлорида (30 мг, 0,108 ммоль), заменяя DMA на ацетонитрил (1 мл). К реакционной смеси также добавляли триэтиламин (0,014 мл, 0,102 ммоль). Дигидрохлоридную соль продукта получали способами, описанными выше.
[0275] ER-890342 (41,3 мг, 0,101 ммоль, 11%-ный выход) получали способом, аналогичным способу получения ER-890311, исходя из соединения 14 (150,2 мг, 0,916 ммоль) и 4-(азетидин-3-ил)морфолина (221,6 мг, 1,030 ммоль).
[0276] ER-890343 (25,2 мг, 0,062 ммоль, 77,2%-ный выход) получали способом, аналогичным способу получения ER-890311, исходя из соединения 14 (35,2 мг, 0,080 ммоль) и 1-(азетидин-3-ил)-4-метилпиперазина (40,3 мг, 0,0201 ммоль).
[0277] ER-890344 (21,4 мг, 0,059 ммоль, 73,8%) получали способом, аналогичным способу получения ER-890311, исходя из соединения 14 (35,2 мг, 0,080 ммоль) и (S)-трет-бутил 3-метилпиперазин-1-карбоксилата (28,2 мг, 0,201 ммоль). Выполняли удаление защитной группы Boc с помощью ТФК с последующей нейтрализацией.
[0278] ER-890963 (685,2 мг, 1,806 ммоль, 86%) получали способом, аналогичным способу получения ER-890344, исходя из соединения 14 (919 мг, 2,101 ммоль) и (S)-трет-бутил 2-этилпиперазин-1-карбоксилата (500 мг, 2,333 ммоль). Дигидрохлоридную соль продукта получали способами, описанными выше.
[0279] ER-891090 (54,2 мг, 0,133 ммоль, 46,8%-ный выход) получали способом, аналогичным способу получения ER-890311, исходя из соединения 14 (137,5 мг, 0,314 ммоль) и (S)-1,3'-бипирролидина дигидрохлорида (30 мг, 0,165 ммоль). Удаление группы Boc не требовалось.
[0280] ER-895204 (35,2 мг, 0,084 ммоль, 73,1%-ный выход) получали способом, аналогичным способу получения ER-890311, исходя из соединения 14 (50 мг, 0,114 ммоль) и N-этилпиперидин-4-карбоксамида (21,4 мг, 0,137 ммоль). Гидрохлоридную соль продукта получали способами, описанными выше.
[0281] Получение ER-887612 в качестве модифицированного примера получения соединения 15 по схеме 4:
[0282] Смесь соединения 3 (201 мг, 0,862 ммоль) и (R)-2-гидроксиметил морфолина гидрохлорида (132, 0,856 ммоль) в NMP (3 мл) нагревали при 170°C в течение 16 часов. После полного завершения реакции реакционную смесь охлаждали, фильтровали, элюировали MeOH (2 мл), затем очищали непосредственно методом ВЭЖХ с использованием колонки C-18, элюируя смесью 10-100% ацетонитрила в воде с 0,1% ТФК. Желаемый продукт собирали и концентрировали досуха. Полученный продукт растворяли в MeOH (2 мл) и пропускали через основной слой силикагеля (Biotage, 1 г, SiCO3), элюируя MeOH (5 мл) с получением (R)-5-(2-(гидроксиметил)морфолино)хинолин-8-карбонитрила, или ER-886849, (108 мг, 0,401 ммоль, 46,9%-ный выход).
[0283] К перемешиваемому раствору ER-886849 (101 мг, 0,375 ммоль) в DCM (2 мл) добавляли п-толуолсульфонил хлорид (78,5 мг, 0,412 ммоль), затем DIPEA (0,13 мл, 0,746 ммоль) и DMAP (2,3 мг, 0,019 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 час, после чего добавляли дополнительное количество п-толуолсульфонил хлорида (78,7 мг, 0,413 ммоль) с последующим перемешиванием при комнатной температуре в течение 4 часов. К реакционной смеси после полного завершения реакции при перемешивании добавляли воду (1,2 мл) и DCM (5,9 мл) и затем разделяли слои. Органический слой промывали насыщенным солевым раствором (1,2 мл), сушили над MgSO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage SP4, Interchim 25 г, элюируя смесью EtOAc в гептане с градиентом 20-100%), желаемые фракции собирали, концентрировали и сушили в вакууме с получением (R)-(4-(8-цианохинолин-5-ил)морфолин-2-ил)метил 4-метилбензолсульфоната (85 мг, 0,201 ммоль, 53,6%-ный выход).
[0284] Раствор (R)-(4-(8-цианохинолин-5-ил)морфолин-2-ил)метил 4-метилбензол-сульфоната (27 мг, 0,064 ммоль) и 2-аминопиридина (90 мг, 0,956 ммоль) в NMP (1 мл) нагревали в микроволновой печи при 150°C в течение 15 мин. Охлажденную реакционную смесь разбавляли NMP (3 мл) и очищали напрямую методом ВЭЖХ на колонке С-18, элюируя смесью 10-100% ацетонитрила в воде с 0,1% ТФК. Желаемый продукт собирали и концентрировали досуха. Полученный продукт растворяли в MeOH (2 мл) и пропускали через основной слой силикагеля (Biotage, 1 г, SiCO3), элюируя MeOH (5 мл) с получением ER-887612 (16 мг, 0,046 ммоль, 71,9%-ный выход).
[0285] ER-885211 (4 мг, 0,016 ммоль, 24,7%-ный выход) получали способом, аналогичным способу получения ER-886849, исходя из соединения 3 (15 мг, 0,064 ммоль) и (R)-2-метилморфолина (22 мг, 0,160 ммоль). К реакционной смеси добавляли TEA (0,05 мл, 0,359 ммоль).
[0286] Альтернативный синтез соединения 10 - Схема 5
[0287] Соединение 16: К перемешиваемому раствору соединения 8 (2,869 г, 7,06 ммоль) в ацетонитриле (14,4 мл), охлажденному до 5-6°C, добавляли ТФК (0,163 мл, 2,12 ммоль), затем NBS (1,385 г, 7,78 ммоль). Реакционную смесь перемешивали в течение 1 часа, после чего добавляли 9% NaHCO3 (6,6 г, 7,1 ммоль), затем сульфит натрия (Na2SО3; 0,27 г, 2,1 ммоль) и далее перемешивали в течение 5 мин. Смесь разбавляли водой (5,7 мл) и толуолом (29 мл), перемешивали в течение еще 5 мин с последующим разделением слоев. Водный слой экстрагировали толуолом (14,4 мл), после чего объединенные органические слои промывали 20%-ным NaCl (7,20 мл), концентрировали до приблизительно 5 мл, и далее разбавляли MTBE (29 мл). Добавляли 2M раствор NaOH (7,1 мл), и полученную двухфазную смесь интенсивно перемешивали в течение 10 мин. Органический слой разделяли и последовательно промывали два раза 20%-ным NaCl (по 14 мл), водой (5,7 мл), концентрировали до приблизительно 5 мл и разбавляли толуолом (14,4 мл). Полученный раствор, содержащий (2R)-2-((бензилокси)метил)-6-(бромметил)-4-((2-нитрофенил)сульфонил)морфолин 16, использовали непосредственно в следующей реакции.
[0288] Соединение 17: К перемешиваемому раствору в толуоле соединения 16 (приблизительно 3,43 г, 7,06 ммоль, полученного выше) добавляли DBU (2,66 мл, 17,648 ммоль) и затем нагревали при 100°C в течение 4 часов. После полного завершения реакции реакционную смесь охлаждали до 15°C и затем при перемешивании добавляли MTBE (60 мл) и 1M раствор HCl (21,2 мл). Слои разделяли, после чего водный слой экстрагировали MTBE (20 мл). Объединенные органические слои промывали водой (10 мл), 9 масс% раствором NaHCO3 в воде (10 г, 10,713 ммоль), 20 масс% раствором NaCl (10 мл), концентрировали досуха. Данное неочищенное масло желтого цвета с примесями солей разбавляли DCM (10 мл), фильтровали и концентрировали с получением сырого (R)-2-((бензилокси)метил)-6-метилен-4-((2-нитрофенил)сульфонил)-морфолина 17 (3,2 г) в виде масла оранжевого цвета.
[0289] Соединение 10: К перемешиваемому раствору триэтилсилана (1,69 мл, 10,6 ммоль) в DCM (4 мл) при 0°C добавляли ТФК (2,72 мл, 35,3 ммоль) и затем охлаждали до -15°C. Добавляли сырой продукт 17 (приблизительно 2,86 г, 7,06 ммоль) в DCM (4 мл), поддерживая при этом температуру -5°C, и затем добавляли смытые с помощью DCM остатки (4 мл). Полученную смесь перемешивали при температуре в диапазоне от -10 до -5°C в течение 1 часа, затем нагревали при 2-3°C в течение еще 1 часа. После полного завершения реакции реакционную смесь охлаждали до -10°C, выливали в предварительно охлажденный (2°C) 2M раствор NaOH (21,2 мл, 42,4 ммоль), промыв реактор с помощью DCM (2 мл). Конечную смесь экстрагировали MTBE (50 мл), и органический слой промывали водой (10 мл), 20 масс% раствором NaCl (10 мл) и концентрировали с получением масла оранжевого цвета. После объединения и концентрирования нужных фракций с последующей сушкой в вакууме сырой продукт очищали на силикагеле (н-гептан/MTBE 1:2) с получением (2R,6R)-2-((бензилокси)метил)-6-метил-4-((2-нитрофенил)сульфонил)морфолина 10 (1,437 г, 3,54 ммоль, 50%-ный выход за 3 стадии, исходя из соединения 8) в виде твердого вещества светло-желтого цвета.
[0290] Альтернативный синтез соединения 11 - схема 6
[0291] Соединения 18 и 19: К перемешиваемой суспензии глицина (85,86 г, 1,144 моль) в 1,4-диоксане (660 мл) добавляли 1,0M водный раствор NaOH (1144 мл, 1,114 моль) и затем нагревали до 80°C после чего раствор медленно в течение 2 часов добавляли (2R)-бензил 2-эпоксипропиловый эфир 6 (93,90 г, 0,5718 моль) в 1,4-диоксане (94 мл), поддерживая внутреннюю температуру в интервале 77-82°C. После полного завершения реакции реакционную смесь охлаждали до 18°C и затем добавляли ди-трет-бутил дикарбонат (262,1 г, 1,201 моль), поддерживая температуру в диапазоне 18-21°C. Смесь перемешивали при комнатной температуре в течение ночи, после чего полученную смесь промывали два раза гептаном (2000 мл). Водный слой подкисляли с помощью 20 масс% лимонной кислоты (270 г) и экстрагировали три раза EtOAc (2000 мл & 2×1000 мл). Объединенные органические слои промывали дважды 20 масс% раствором NaCl (460 г каждый), концентрировали, растворяли в EtOAc (560 мл), фильтровали, концентрировали и разбавляли DCM (280 мл) с получением (R)-2-((3-(бензилокси)-2-гидроксипропил)(трет-бутоксикарбонил)амино)уксусной кислоты 18 в растворе.
[0292] К перемешиваемому раствору EDC (120,6 г, 0,6290 моль) и DMAP (2,10 г, 0,0172 моль), суспендированному в DCM (380 мл), при 15°C добавляли вышеуказанный раствор соединения 18 в течение 30 минут при поддержании температуры ниже 20°C. Реакционную смесь перемешивали при 18-20°C в течение 3 час, после чего охлаждали до 10°C и затем при перемешивании гасили 20 масс% раствором лимонной кислоты (820 г). Слои разделяли, и водный слой экстрагировали MTBE (1,4 л). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (480 г), 30%-ным раствором NaCl (470 г) и концентрировали. Полученный таким образом сырой продукт очищали на силикагеле (элюируя смесью н-гептан/EtOAc 4:1-3:1) с получением после объединения желаемых фракций, концентрирования и сушки в вакууме (R)-трет-бутил 2-((бензилокси)метил)-6-оксоморфолин-4-карбоксилата 19 (96 г, 0,298 моль, 26,1%-ный выход за две стадии) в виде прозрачного масла желтого цвета.
[0293] Соединения 22 и 23: К перемешиваемому раствору соединения 19 (134,29 г, 0,418 моль) в ТГФ (1100 мл), охлажденному до -75°C, в течение 1 часа добавляли по каплям 1,5M раствор комплекса MeLi-LiBr в диэтиловом эфире (334 мл, 0,501 моль)), поддерживая при этом температуру <-65°C. Смесь охлаждали до -75°C и перемешивали в течение 1,5 час, после чего реакционную смесь медленно гасили в течение 10 мин 20 масс% водным раствором NH4Cl (270 г), поддерживая при этом температуру <-55°C. Смесь нагревали при 0°C в течение 1 часа, распределяли между водой (270 г) и MTBE (1340 мл). Водный слой экстрагировали MTBE (1100 мл) с последующим объединением органических слоев и их промывкой 20 масс% раствором NaCl (270 г) и концентрировали досуха. Остаток растворяли в толуоле (1100 мл), фильтровали, концентрировали, азеотропно отгоняли досуха с толуолом (1100 мл) и затем растворяли в DCM (1200 мл). Смесь охлаждали до -72°C и добавляли триэтилсилан (0,200 л, 1,25 моль), затем триметилсилил трифторметансульфонат (151 мл, 0,836 моль) в течение 45 мин, поддерживая при этом температуру <-68°C. К реакционной смеси после полного завершения реакции в течение 20 мин добавляли ТФК (129 мл, 1,67 моль) в DCM (336 мл, 5,24 моль), поддерживая при этом температуру <-65°C. Смесь нагревали до -10°C и затем при перемешивании добавляли насыщенный водный раствор NaHCO3 (0,70 кг). Слои разделяли, и водный слой экстрагировали два раза DCM (по 940 мл). Объединенные органические слои промывали насыщенным водным раствором NaHCO3 (0,70 кг), концентрировали, растворяли в ацетонитриле (400 мл), обрабатывали ди-трет-бутил дикарбонатом (91,2 г, 0,418 моль) при 20-25°C и перемешивали в течение 1 часа. Реакционную смесь после полного завершения реакции азеотропно отгоняли досуха с толуолом (800 мл) и после объединения желаемых фракций, концентрирования и сушки в вакууме очищали на силикагеле (элюируя смесью н-гептан/EtOAc 9:1-4:1) с получением (2R,6R)-трет-бутил 2-((бензилокси)метил)-6-метилморфолин-4-карбоксилата 22 (61,90 г, 0,193 моль, 46%-ный выход, исходя из соединения 19) в виде твердого вещества белого цвета. Примесный стереоизомер (2R,6S)-трет-бутил 2-((бензилокси)метил)-6-метилморфолин-4-карбоксилат 23 может быть отделен путем колоночной хроматографии на силикагеле.
[0294] Соединение 11: К перемешиваемому раствору соединения 22 (27 мг, 0,084 моль) в DCM (0,60 мл) при комнатной температуре добавляли ТФК (0,30 мл, 0,0039 моль) и затем перемешивали в течение 30 мин. После полного завершения реакции реакционную смесь концентрировали, азеотропно отгоняли досуха с толуолом (1,8 мл×2) и растворяли в DCM (3,0 мл). Органический раствор промывали насыщенным водным раствором NaHCO3 (0,50 г), концентрировали и сушили в вакууме с получением (2R,6R)-2-((бензилокси)метил)-6-метилморфолина 11 (19 мг, 100%-ный выход) в виде бесцветной пленки.
[0295] 2ой альтернативный синтез соединения 11 - схема 7
[0296] Соединение 23: Раствор (2R)-бензил-2-эпоксипропилового эфира 6 (21,0 г, 0,128 моль) в EtOH (100 мл) медленно добавляли к 7,0M раствору аммиака в MeOH (100 мл) и 28%-ного водн. гидрохлорида аммония (210 мл) при комнатной температуре. Реакционный сосуд плотно закрывали и перемешивали при комнатной температуре в течение 23 часов. После полного завершения реакции реакционную смесь концентрировали в вакууме, и сырой продукт азеотропно отгоняли досуха дважды с толуолом (100 мл) с получением (R)-1-амино-3-(бензилокси)пропан-2-ола 23 (23 г) в виде воскообразного твердого вещества, содержащего около 15% димера. Сырой продукт использовали на следующей реакции без дополнительной очистки.
Соединение 25: К раствору 23 (12,0 г, 49,7 ммоль) в EtOH (15 мл) добавляли коммерчески доступный метил (S)-(-)-2-хлорпропионат, 24 (6,69 г, 54,6 моль). Смесь нагревали до 70°C и перемешивали в течение 14 час, затем, после полного завершения реакции, реакционную смесь концентрировали в вакууме. Сырой продукт разбавляли EtOAc (50 мл), промывали 1н раствором HCl (20 мл), насыщенным солевым раствором (20 мл), и затем органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали досуха. После концентрирования и сушки в вакууме желаемых объединенных фракций, очистка на силикагеле (SNAP 10 г, гептан/EtOAc=5/1-1/5, затем только EtOAc, ТСХ гептан/EtOAc=1/3, rf=0,45) давала (S)-N-((R)-3-(бензилокси)-2-гидроксипропил)-2-хлорпропанамид 25 (9,86 г, 36,2 ммоль, 73%-ный выход) виде бесцветного сиропа.
[0297] Соединение 26: К перемешиваемой суспензии 60% гидрида натрия (5,82 г, 0,0728 моль) в ТГФ (440 мл), охлажденной до 0°C, добавляли по каплям в течение 15 мин соединение 25 (9,89 г, 36,4 ммоль) в ТГФ (100 мл). Реакционную смесь перемешивали при 0°C еще 30 мин, после чего оставляли нагреваться до комнатной температуры в течение 1 часа. После полного завершения реакции реакционную смесь охлаждали до 0°C, в процессе чего медленно добавляли изопропиловый спирт (100 мл). Сырой раствор нейтрализовали с помощью Dowex Н+ с последующим отделением смолы фильтрованием, промывкой изопропанолом два раза (по 20 мл) и концентрированием фильтрата досуха. После сбора желаемых объединенных фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (SNAP 100 г, гептан/EtOAc=1/1 - только EtOAc, ТСХ гептан/EtOAc=1/3, rf=0,4)) с получением (2R,6R)-6-((бензилокси)метил)-2-метилморфолин-3-она 26 (6,42 г, 27,3 ммоль, 75%-ный выход).
[0298] Соединение 11:
[0299] В перемешиваемый раствор соединения 26 (6,67 г, 28,3 ммоль) в ТГФ (20 мл) добавляли по каплям при комнатной температуре 1M раствор тетрагидроалюмината лития в ТГФ (40,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до 0°C и затем медленно добавляли по каплям воду (13 мл), затем 1M раствор NaOH в воде (0,8 мл). Гашеную реакционную смесь перемешивали при комнатной температуре до тех пор, пока не образовался сыпучий осадок белого цвета. Осадок отфильтровывали через слой Целита 545 и промывали EtOAc, DCM и Et2O (по 10 мл каждого). Фильтрат концентрировали и очищали на силикагеле (SNAP 100 г, только DCM - DCM/MeOH=97/3, ТСХ CHCl3/MeOH=9/l, rfтранс=0,5, rfцис=0,4). Получали цис/транс диастереоизомерную смесь соединения 11 (4,42 г, 20,0 ммоль, 70,6%-ный выход), из которой выделяли чистое соединение 11 (0,93 г, 4,2 ммоль, 15%-ный выход).
[0300] Альтернативное получение соединения 12 - схема 8
[0301] Соединение 28: К суспензии карбоната натрия (31 г, 0,37 моль) в воде (50 мл) добавляли раствор 1-амино-3,3-диэтоксипропана (10,00 мл, 61,81 ммоль) в DCM (50 мл) и затем охлаждали до 0°C. При интенсивном перемешивании при 0°C добавляли бензолсульфонил хлорид (7,65 мл, 60,0 ммоль) и затем нагревали до 20°C и продолжали перемешивание в течение 2 часов, после чего добавляли MTBE (150 мл). Органический слой отделяли, промывали 1,0M раствором HCl (50 мл), насыщенным NaHCO3 (50 г), водой (50 г), концентрировали и азеотропно отгоняли досуха два раза с MTBE (150 мл × 2) с получением N-(3,3-диэтоксипропил)бензолсульфонамида 28 (17,34 г, 60,34 ммоль, 97%-ный выход) в виде прозрачного масла светло-желтого цвета.
[0302] Соединение 30: К перемешиваемому раствору 2-фтор-4-гидроксибензонитрила 29 (15,00 г, 0,1094 моль) в ДМФ (45,0 мл), охлажденному до 0°C, добавляли карбонат калия (37,8 г, 0,274 моль), затем перемешивали при 0-5°C в течение 30 мин. К реакционной смеси при температуре <5°C добавляли бензилбромид (13,7 мл, 0,115 моль), перемешивали при 5°C в течение 1 часа с последующим нагреванием до 20°C и перемешивали еще в течение 2,5 часов. После полного завершения реакции реакционную смесь распределяли между водой (180 мл) и MTBE (220 мл), и слои разделяли, и органический слой промывали водой (90 мл), концентрировали и азеотропно отгоняли досуха два раза с помощью EtOAc (по 150 мл) с получением 4-(бензилокси)-2-фторбензонитрила, соединение 30 (24,64 г, 0,1084 моль, 99%-ный выход) в виде твердого вещества белого цвета.
[0303] Соединение 32: К перемешиваемому раствору соединения 28 (13,28 г, 46,21 ммоль) в NMP (30,0 мл) при комнатной температуре добавляли соединение 30 (10,00 г, 44,01 ммоль), затем Cs2CO3 (21,5 г, 66,0 ммоль). Полученную смесь нагревали при 110°C в течение 16 часов и затем охлаждали до комнатной температуры. Смесь распределяли между водой (120 г) и MTBE (120 мл), и водный слой экстрагировали MTBE (120 мл). Объединенные органические слои промывали водой (60 г), концентрировали и азеотропно отгоняли досуха два раза с EtOAc (по 100 мл каждый раз) с получением N-(5-(бензилокси)-2-цианофенил)-N-(3,3-диэтоксипропил)бензолсульфонамида 31 в виде масла коричневатого цвета. Сырой продукт в течение 3 час подвергали гидрированию с помощью 10 масс% Pd-C (1,40 г) в EtOAc (100 мл) в атмосфере газообразного водорода (баллон, находящийся под давлением), после чего очищенную реакционную смесь фильтровали через слой из Целита, промывали EtOAc (100 мл) и концентрировали. Полученный таким образом сырой продукт очищали на силикагеле (элюируя смесью н-гептан/MTBE 2:3) с получением N-(2-циано-5-гидроксифенил)-N-(3,3-диэтоксипропил)бензол-сульфонамида 32 (16,38 г, 40,50 ммоль, 92%-ный выход) в виде вязкого масла желтого цвета.
[0304] Соединение 33: К перемешиваемому раствору соединения 32 (5,45 г, 13,5 ммоль) в ТГФ (40 мл), охлажденному до 0°C, добавляли воду (5,4 мл), затем ТФК (11 мл, 0,14 моль). Полученную смесь оставляли нагреваться до 20°C и перемешивали в течение ночи. После полного завершения реакции реакционную смесь азеотропно отгоняли досуха два раза с толуолом (по 54 мл) с получением N-(2-циано-5-гидроксифенил)-N-(3-оксопропил)бензолсульфонамида 33 (4,55 г, 13,8 ммоль, 100%-ный выход) в виде вязкого масла.
[0305] Соединение 34: К перемешиваемой суспензии 33 (1,64 г, 4,96 ммоль) в смеси толуола (29,5 мл) и NMP (1,2 мл), нагреваемой при 70°C, добавляли D-(+)-10-камфорсульфоновую кислоту (1,15 г, 4,96 ммоль) и затем нагревали при 100°C в течение 14 час. После полного завершения реакции реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (60 мл), промывали водой (6,3 мл) и концентрировали с получением масла темно-коричневого цвета. Сырой продукт очищали на силикагеле (элюируя смесью н-гептан/EtOAc 1:1) с получением 5-гидрокси-1-(фенилсульфонил)-1,2-дигидрохинолин-8-карбонитрила 34 (685 мг, 2,19 ммоль, 44%-ный выход) в виде твердого вещества желтого цвета.
[0306] Соединения 35 и 12: К перемешиваемой суспензии соединения 34 (0,393 г, 1,26 ммоль) в DCM (3,0 мл) добавляли 2,6-лутидин (0,437 мл, 3,78 ммоль) и затем охлаждали до 1-2°C. При поддержании температуры ниже 4°C добавляли раствор трифторметансульфонового ангидрида (0,275 мл, 1,64 ммоль) в DCM (1,0 мл). Реакционную смесь перемешивали при 2-3°C в течение 1 часа, выливали в предварительно охлажденную (5°C) смесь MTBE (20 мл) и 1M раствор HCl (6,3 мл). Полученный отделенный органический слой промывали 9 масс% раствором NaHCO3 (3 г), 20 масс% раствором NaCl (5 г), сушили над Na2SO4 (2 г) в течение 1 часа, фильтровали и концентрировали с получением сырого 8-циано-1-(фенилсульфонил)-1,2-дигидрохинолин-5-ил трифторметан-сульфоната 35 в виде масла желтого цвета. Соединение 35 растворяли в NMP (2,5 мл) и DIPEA (1,75 мл, 10,1 ммоль), затем добавляли 11 (0,446 г, 2,02 ммоль), и полученную смесь нагревали при 125°C в течение ночи. После полного завершения реакции реакционную смесь охлаждали до комнатной температуры и распределяли между EtOAc (30 мл) и водой (10 мл). Органический слой промывали водой (10 мл), концентрировали и очищали на колонке с силикагелем (элюируя смесью н-гептан/EtOAc 1:1) с получением 5-((2R,6R)-2-((бензилокси)метил)-6-метилморфолино)хинолин-8-карбонитрила 12 (80,2 мг, 0,215 ммоль, 17%-ный выход) в виде твердого вещества коричневого цвета.
[0307] Синтез соединения 36 - Схема 9: К перемешиваемой суспензии соединения 13 (10,97 г, 38,72 ммоль) в DCM (44 мл) добавляли 2,6-лутидин (5,38 мл, 46,5 ммоль) и затем охлаждали до 0°C. Добавляли раствор ангидрида трифторметансульфоновой кислоты (Tf2O; 6,84 мл, 40,7 ммоль) в DCM (22 мл), поддерживая при этом температуру <5°C и перемешивая в течение 1 часа. После полного завершения реакции реакционную смесь гасили насыщенным раствором бикарбоната натрия (65 г), и смесь нагревали до 15°C. Слои разделяли, и водный слой экстрагировали DCM (55 мл). Объединенные органические слои промывали 20 масс% NaCl (33 г) и перемешивали над флоризилом (11 г) в течение 1,5 час, после чего смесь фильтровали, элюировали MTBE (55 мл) и концентрировали. Твердое вещество коричневого цвета суспендировали в DCM (11 мл), разбавляли н-гептаном (110 мл), фильтровали, промывали смесью н-гептан/DCM 10:1 (121 мл) и сушили в вакууме с получением ((2R,6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-ил)метил трифторметансульфоната 36 (15,20 г, 36,6 ммоль, 94%-ный выход) в виде твердого вещества светло-коричневого цвета.
[0308] Синтез ER-887927 в соответствии со схемами 9 и 17:
[0309] Схема 17
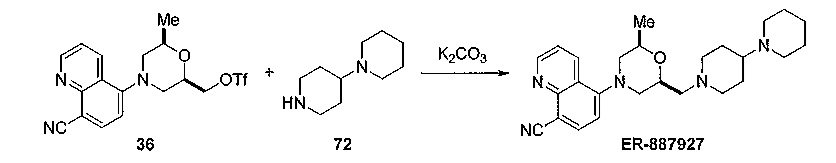
[0310]
[0311] К перемешиваемой суспензии соединения 36 (1,002 г, 2,412 ммоль) в ацетонитриле (6,0 мл) добавляли карбонат калия (1,33 г, 9,65 ммоль), затем коммерчески доступный 1,4'-бипиперидин 72 (609 мг, 3,62 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 5 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры, разбавляли водой (12 мл) и частично концентрировали. Добавляли N-гептан (10 мл) и MTBE (10 мл), и смесь частично концентрировали, в процессе чего полученное таким образом твердое вещество коричневого цвета собирали фильтрованием, промывали: (1) водой (15 мл) и (2) н-гептаном (15 мл) и сушили в вакууме в течение ночи. Высушенное твердое вещество растворяли в н-гептане (10 мл, 0,2 моль), разбавляли ацетонитрилом (5,0 мл, 0,096 моль), затем при комнатной температуре в течение 10 мин обрабатывали флоризилом (0,50 г). Смесь фильтровали, элюировали ацетонитрилом (10 мл) и концентрировали с получением твердого вещества коричневого цвета, которое растирали в смеси MTBE/н-гептан 1:2 (15 мл), фильтровали, промывали смесью MTBE/н-гептан 1:3 (10 мл) и сушили в атмосфере N2/вакуума с получением ER-887927 в виде порошка светло-коричневого цвета (1,001 г, 2,31 ммоль, 95%-ный выход).
[0312] ER-893881 (15,2 мг, 0,037 ммоль, 51,6%-ный выход) получали способом, аналогичным способу получения ER-887927, исходя из соединения 36 (30 мг, 0,072 ммоль) и (S)-1,3'-бипирролидин дигидрохлорида (20,5 мг, 0,144 ммоль), используя вместо K2CO3 TEA (0,020 мл, 0,141 ммоль).
[0313] ER-894483 (30 мг, 0,079 ммоль, 32,8%-ный выход) получали способом, аналогичным способу получения ER-893881, исходя из соединения 36 (100 мг, 0,241 ммоль) и (R)-3-метилпиперазин-2-она (54,9 мг, 0,481 ммоль).
[0314] ER-894484 (30 мг, 0,079 ммоль, 32,8%-ный выход) получали способом, аналогичным способу получения ER-893881, исходя из соединения 36 (100 мг, 0,241 ммоль) и (S)-3-метилпиперазин-2-она (54,9 мг, 0,481 ммоль).
[0315] ER-894504 (30 мг, 0,076 ммоль, 31,5%-ный выход) получали способом, аналогичным способу получения ER-893881, исходя из соединения 36 (100 мг, 0,241 ммоль) и (2S,5R)-2,5-диметилпиперазина (54,9 мг, 0,481 ммоль).
[0316] ER-894505 (30 мг, 0,076 ммоль, 31,5%-ный выход) получали способом, аналогичным способу получения ER-893881, исходя из соединения 36 (100 мг, 0,241 ммоль) и 2,3-диметилпиперазина (54,9 мг, 0,481 ммоль).
[0317] ER-894655 (140 мг, 0,309 ммоль, 64,2%-ный выход) получали способом, аналогичным способу получения ER-893881, исходя из соединения 36 (200 мг, 0,482 ммоль) и трет-бутил 2,2-диметилпиперазин-1-карбоксилата (206 мг, 0,961 ммоль). Защитную группу Вос гидролизовали, используя 4н HCl диоксан с последующим выделением желаемого продукта путем азеотропной отгонки досуха с толуолом и сушки в вакууме.
[0318] ER-894151 (1,066 г, 3,16 ммоль, 65,4%-ный выход) получали способом, аналогичным способу получения ER-893881, исходя из соединения 36 (2,0 г, 4,81 ммоль) и трет-бутил азетидин-3-илкарбамата (0,995 г, 5,78 ммоль). В Boc-защищенном промежуточном соединении удаляли защитную группу с использованием ТФК (3 мл) в DCM (3 мл). Реакционную смесь оставляли перемешиваться в течение 30 мин, после чего реакционную смесь концентрировали досуха путем азеотропной отгонки три раза с толуолом (по 5 мл). Остаток разбавляли DCM (10 мл), промывали два раза насыщ. раствором NaНСО3 (5 мл), водой (5 мл), насыщенным солевым раствором (5 мл), сушили над MgSO4, фильтровали, концентрировали и сушили в вакууме с получением желаемого продукта.
[0319] ER-890250: К охлажденному перемешиваемому раствору соединения ER-887927 (50 мг, 0,115 ммоль) в ТГФ (1 мл) при -78°C добавляли 1,6M комплекса метил литий-литий бромид в этиловом эфире (0,15 мл, 0,24 ммоль), после чего цвет раствора изменялся от светло-желтого до ярко-красного/оранжевого. Реакционную смесь перемешивали в течение 1,5 час при температуре -78°C, после чего гасили водным раствором гидрохлорида аммония (2 мл) с последующим медленным нагреванием до комнатной температуры. Реакционную смесь экстрагировали три раза с помощью DCM (5 мл), и объединенные органические слои сушили, фильтровали и концентрировали досуха.
Сырое промежуточное соединение растворяли в ацетоне (1 мл), затем добавляли раствор нитрата аммония-церия (300 мг, 0,547 ммоль) в воде (1,5 мл). Реакционную смесь перемешивали в течение 30 мин, после чего реакционную смесь концентрировали до сырого твердого вещества. Твердое вещество суспендировали в 5 мл ацетона, перемешивали в течение 5 мин, фильтровали, и твердый слой на фильтре элюировали три раза ацетоном (по 5 мл). Объединенные фильтраты концентрировали, затем очищали методом ВЭЖХ с обращенной фазой (колонка X-Bridge C18 19×100 мм с использованием градиента смеси ацетонитрил/вода с 0,1% муравьиной кислотой). Желаемые фракции объединяли, концентрировали, растворяли в MeOH (2 мл), пропускали через колонку с SiCO3, элюировали два раза MeOH, концентрировали и сушили в вакууме с получением ER-890250 (4,4 мг, 0,010 ммоль, 8,5%-ный выход).
[0320] Синтез ER-884884 в соответствии со схемой 10:
[0321] Соединение 37: К перемешиваемому раствору соединения 22 в соответствии со схемой 6 (1,003 г, 3,121 ммоль) в EtOH (5 мл) добавляли 5% Pd на угле (100 мг) и затем несколько раз заполняли колбу газообразным водородом. Реакционную смесь нагревали до 40°C в атмосфере водорода (баллон, находящийся под давлением) и перемешивали в течение ночи, после чего реакционную смесь продували газообразным азотом несколько раз при вакуумировании системы с помощью вакуумного насоса между очистками. После полного завершения реакции реакционную смесь фильтровали через Целит 545, слой на фильтре промывали два раза EtOH (по 5 мл каждый раз), затем объединенные фильтраты концентрировали и сушили в вакууме. Сырой продукт, (3R,5S)-трет-бутил 3-(гидроксиметил)-5-метилпиперидин-1-карбоксилат (0,720 г, 3,114 ммоль, 99,8%-ный выход) использовали на следующей стадии без дополнительной очистки.
[0322] К перемешиваемому раствору (3R,5S)-трет-бутил 3-(гидроксиметил)-5-метилпиперидин-1-карбоксилата (0,783 г, 3,385 ммоль) в DCM (5 мл) добавляли п-толуолсульфонил хлорид (0,968 г, 5,078 ммоль), затем DMAP (40 мг, 0,33 ммоль) и DIPEA (1,18 мл, 6,77 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем добавляли воду (5 мл) с последующим перемешиванием в течение еще 15 мин. Полученный органический слой промывали 0,1н раствором HCl (5 мл), насыщенным солевым раствором (3 мл), сушили над MgSO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage, элюируя смесью 3:1 гептан:EtOAc) с получением (3S,5R)-трет-бутил 3-метил-5-((тозилокси)метил)пиперидин-1-карбоксилата (0,8602 г, 2,232 ммоль, 65,9%-ный выход).
[0323] К перемешиваемому раствору (3S,5R)-трет-бутил 3-метил-5-((тозилокси)метил)пиперидин-1-карбоксилата (0,860 г, 2,232 ммоль) в ДМФ (7 мл) при комнатной температуре добавляли азид натрия (0,218 г, 3,347 ммоль), после чего реакционную смесь нагревали до 80°C и перемешивали еще 3 часа. После полного завершения реакции реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (25 мл) и промывали три раза водой (по 5 мл). После концентрирования желаемых объединенных фракций и сушки в вакууме полученный органический слой сушили над безводным Na2SO4, фильтровали, концентрировали, после чего сырой продукт очищали на силикагеле (Biotage, элюируя смесью EtOAc в гептане с градиентом 0-15%) с получением (2R,6R)-трет-бутил 2-(азидометил)-6-метилморфолин-4-карбоксилата 37 (0,545 г, 2,126 ммоль, 95,3%-ный выход) в виде бесцветного кристаллического твердого вещества.
[0324] ER-884884: К перемешиваемому раствору соединения 37 (0,545 г, 2,126 ммоль) в MeOH (5 мл) добавляли 5% палладий на активированном угле (250 мг), затем несколько раз сосуд заполняли газообразным водородом. Реакционную смесь выдерживали в атмосфере водорода (баллон, находящийся под давлением) при комнатной температуре и перемешивали в течение 12 часов, после чего реакционную смесь продували газообразным азотом несколько раз при вакуумировании системы с помощью вакуумного насоса между очистками. После полного завершения реакции реакционную смесь фильтровали через Целит 545, слой на фильтре промывали два раза EtOH (по 2 мл), затем объединенные фильтраты концентрировали и сушили в вакууме. Сырой продукт, (2S,6R)-трет-бутил 2-(аминометил)-6-метилморфолин-4-карбоксилат (0,489 г, 2,10 ммоль, 99,9%-ный выход) использовали на следующей стадии без дополнительной очистки.
[0325] К перемешиваемому раствору (2S,6R)-трет-бутил 2-(аминометил)-6-метилморфолин-4-карбоксилата (50,2 мг, 0,218 ммоль) в DCM (0,5 мл) при комнатной температуре добавляли ТФК (0,25 мл, 3,4 ммоль). Реакционную смесь перемешивали в течение 1 часа, после чего концентрировали и азеотропно отгоняли досуха два раза с толуолом (по 2 мл) и сушили в вакууме. Сырой морфолин с удаленной защитной группой растворяли при перемешивании в DMA (1 мл), затем добавляли TEA (2 мл) и соединение 3 (50 мг, 0,214 ммоль). Реакционную смесь нагревали до 140°C и перемешивали в течение 1 часа, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры и после концентрирования желаемых объединенных фракций и сушки в вакууме напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой (после фильтрования) с получением ER-884884 (12,1 мг, 0,043 ммоль, 19,7%-ный выход).
[0326] Замещенное соединение 15, схема 10 или ER-879713: К перемешиваемому раствору ER-884884 (30,2 мг, 0,107 ммоль) в DCM (0,5 мл) добавляли TEA (30 мкл, 0,20 ммоль), затем 2,2-диметилпропаноил хлорид (20 мкл, 0,162 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем, после полного завершения реакции, реакционную смесь концентрировали, фильтровали и после концентрирования желаемых объединенных фракций и сушки в вакууме напрямую очищали посредством препаративной ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм; элюировали градиентом ацетонитрила в воде с 0,05% ТФК) с получением ER-879713 (20,5 мг, 0,056 ммоль, 52,3%-ный выход).
[0327] ER-886432 (10,2 мг, 0,023 ммоль, 52,7%-ный выход) получали способом, аналогичным способу получения ER-879713, исходя из ER-884884 (50 мг, 0,177 ммоль) и 1-фенилциклобутанкарбонил хлорида (8,5 мг, 0,044 ммоль).
[0328] ER-886563 (3,6 мг, 0,023 ммоль, 20,3%-ный выход) получали способом, аналогичным способу получения ER-879713, исходя из ER-884884 (12,4 мг, 0,044 ммоль) и бензолацетил хлорида (0,007 мл, 0,053 ммоль).
[0329] ER-888137: К перемешиваемому раствору ER-884884 (30,2 мг, 0,107 ммоль) в NMP (0,5 мл) добавляли 2-хлор-5-фторпиримидин (140 мг, 1,056 ммоль). Реакционную смесь нагревали в микроволновой печи при 150°C в течение 5 мин, после чего охлажденную реакционную смесь очищали на колонке для препаративной ВЭЖХ с обращенной фазой C-18, элюируя ацетонитрилом в воде с градиентом 10-40%. Желаемые фракции концентрировали и сушили в вакууме с получением ER-888137 (6,5 мг, 0,017 ммоль, 9,7%-ный выход).
[0330] ER-888701 (12,2 мг, 0,031 ммоль, 17,7%-ный выход) получали способом, аналогичным способу получения ER-888137, исходя из ER-884884 (50 мг, 0,177 ммоль) и 2-хлор-5-этилпиримидина (150 мг, 1,052 ммоль).
[0331] ER-888896 (3,0 мг, 0,008 ммоль, 23,1%-ный выход) получали способом, аналогичным способу получения ER-888137, исходя из ER-884884 (10,1 мг, 0,036 ммоль) и 2-хлорпиразина (30 мг, 0,261 ммоль).
[0332] Схема 18: Альтернативный способ получения замещенного соединения 15:
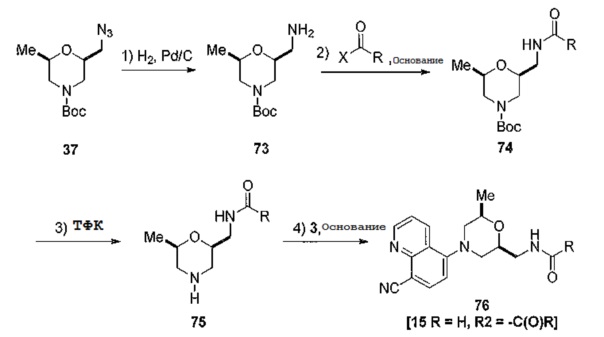
[0333]
[0334] ER-879713 или соединение 76 с использованием схемы 18:
[0335] Соединение 73: К перемешиваемому раствору соединения 37 (0,545 г, 2,126 ммоль) в MeOH (5 мл) добавляли 5%-ный палладий на активированном угле (250 мг), затем несколько раз сосуд заполняли газообразным водородом. Реакционную смесь выдерживали в атмосфере водорода (баллон, находящийся под давлением) при комнатной температуре и перемешивали в течение 12 часов, после чего реакционную смесь продували газообразным азотом несколько раз при вакуумировании системы с помощью вакуумного насоса между очистками. После полного завершения реакции реакционную смесь фильтровали через Целит 545, слой на фильтре промывали два раза EtOH (по 2 мл), затем объединенные фильтраты концентрировали и сушили в вакууме. Сырой продукт, (2S,6R)-трет-бутил 2-(аминометил)-6-метилморфолин-4-карбоксилат 73 (0,489 г, 2,10 ммоль, 99,9%-ный выход) использовали на следующей стадии без дополнительной очистки.
[0336] Соединение 74: К перемешиваемому раствору соединения 73 (50,2 мг, 0,218 ммоль) в DCM (0,5 мл)) добавляли TEA (36,5 мкл, 0,268 ммоль), затем 2,2-диметилпропаноил хлорид (29,5 мкл, 0,235 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем, после полного завершения реакции, реакционную смесь промывали водой, экстрагировали три раза DCM (по 3 мл), и объединенные органические слои сушили над MgSO4, фильтровали, концентрировали и сушили в вакууме с получением сырого (2R,6S)-трет-бутил 2-метил-6-(пиваламидометил)морфолин-4-карбоксилата 74 (R=tBu).
[0337] ER-879713: К перемешиваемому раствору сырого соединения 74 в DCM (5 мл) добавляли ТФК (0,25 мл, 3,4 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. После полного завершения реакции реакционную смесь концентрировали и азеотропно отгоняли два раза с толуолом и затем сушили в вакууме в течение 30 мин, после чего сырое желаемое промежуточное соединение 75 растворяли в DMA (1 мл), затем добавляли TEA (2 мл) и соединение 3 (50 мг, 0,214 ммоль). Реакционную смесь нагревали до 140°C и перемешивали в течение 1 часа, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры и после концентрирования желаемых объединенных фракций и сушки в вакууме напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой (после фильтрования) с получением соединения 76 по примеру или ER-879713 (9,3 мг, 0,025 ммоль, 11,6%-ный выход, R=tBu).
[0338] ER-879689 (4,3 мг, 0,013 ммоль, 6,0%-ный выход, R=Me) получали способом, аналогичным способу получения ER-879713, исходя из соединения 73 (50,2 мг, 0,218 ммоль, R=Me) и соединения 3 (50 мг, 0,215 ммоль).
[0339] ER-886360 (14,3 мг, 0,035 ммоль, 15,8%-ный выход, R=CH(Me)Ph) получали способом, аналогичным способу получения ER-879713, исходя из соединения 73 (50,2 мг, 0,218 ммоль, R=CH(Me)Ph) и соединения 3 (50 мг, 0,215 ммоль).
[0340] Дополнительные примеры замещенного соединения 15:
[0341] ER-888603: К перемешиваемому раствору соединения 37 (58,1 мг, 0,227 ммоль) и циклогексилацетилена (0,026 мл, 0,200 ммоль) в трет-бутиловом спирте (0,08 мл) и воде (0,07 мл) добавляли бикарбонат натрия (2,5 мг, 0,030 ммоль), затем пентагидрат сульфата меди (II) (2,5 мг, 0,010 ммоль) и аскорбат натрия (7,8 мг, 0,039 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 14 часов, после чего добавляли DCM (5 мл) и насыщенный бикарбонат натрия (5 мл) и перемешивали еще 10 мин. Слои разделяли, и водный слой экстрагировали два раза DCM (по 3 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали досуха. Сырое Boc-защищенное промежуточное соединение растворяли при перемешивании в DCM (3 мл), затем добавляли ТФК (0,8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем, после полного завершения реакции, реакционную смесь концентрировали и азеотропно отгоняли досуха с помощью толуола (2 раза по 5 мл). Сырой продукт очищали посредством ВЭЖХ (колонка Water's X-Bridge C18 19×100 мм; элюировали градиентом ацетонитрила в воде с 0,05% ТФК) с получением (2R,6R)-2-((4-циклогексил-1H-1,2,3-триазол-1-ил)метил)-6-метилморфолина (8,9 мг, 0,034 ммоль, 16,8%-ный выход).
[0342] К перемешиваемому раствору (2R,6R)-2-((4-циклогексил-1Н-1,2,3-триазол-1-ил)метил)-6-метилморфолина (8,9 мг, 0,034 ммоль) в DMA (0,3 мл) и TEA (0,005 мл, 0,036 ммоль) добавляли соединение 3 (7,85 мг, 0,034 ммоль). Смесь нагревали в микроволновой печи при 150°C в течение 30 мин, после чего охлажденную реакционную смесь напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой С-18 (колонка Water's X-Bridge C18 19×100 мм; элюируя градиентом 10-40% ацетонитрила в воде с 0,05% ТФК). Желаемые объединенные фракции концентрировали и сушили в вакууме с получением ER-888603 (3,3 мг, 0,008 ммоль, 23,3%-ный выход или 3,9% общий выход).
[0343] ER-888604 (5,2 мг, 0,013 ммоль, 6,5% общий выход) получали способом, аналогичным способу получения ER-888603, исходя из соединения 37 (58,1 мг, 0,227 ммоль), фенилацетилена (0,022 мл, 0,200 ммоль) и соединения 3 (7,85 мг, 0,034 ммоль).
[0344] ER-889556: К перемешиваемой суспензии ER-887268 (140,3 мг, 0,384 ммоль) в воде (1,5 мл) добавляли формальдегид (1 мл) и муравьиную кислоту (0,55 мл), после чего реакционную смесь нагревали в микроволновой печи при 110°C в течение 1,5 часов. После полного завершения реакции реакционную смесь охлаждали и напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой С-18, элюируя градиентом 10-40% ацетонитрила в воде с 0,1% ТФК. Желаемые объединенные фракции концентрировали, растворяли в MeOH (5 мл), пропускали через слой из SiCO3, элюируя MeOH (10 мл), концентрировали и сушили в вакууме с получением ER-889556 (75 мг, 0,197 ммоль, 51,5%-ный выход).
[0345] ER-890114 (75,9 мг, 0,170 ммоль, 40,5%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-890112 (182 мг, 0,420 ммоль).
[0346] ER-890108 (72,1 мг, 0,171 ммоль, 40,7%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-890119 (170,6 мг, 0,420 ммоль).
[0347] ER-890345 (43,5 мг, 0,115 ммоль, 38%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-890344 (110,2 мг, 0,302 ммоль).
[0348] ER-890346 (52,6 мг, 0,139 ммоль, 73,3%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-887269 (69 мг, 0,189 ммоль).
[0349] ER-890831 (85,2 мг, 0,225 ммоль, 74,5%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-887270 (110,2 мг, 0,302 ммоль).
[0350] ER-890964 (506,2 мг, 1,286 ммоль, 71,2%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-890963 (685,2 мг, 1,806 ммоль).
[0351] ER-890186 (10,2 мг, 0,023 ммоль, 20,7%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-890107 (48 мг, 0,111 ммоль).
[0352] ER-890223 (35 мг, 0,078 ммоль, 42,9%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-890106 (100 мг, 0,182 ммоль) в виде ТФК соли.
[0353] ER-894656 (31,7 мг, 0,068 ммоль, 61,5%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из ER-894655 (50 мг, 0,111 ммоль) в виде дигидрохлоридной соли.
[0354] ER-889728: К перемешиваемому раствору ER-888070 (12,5 мг, 0,034 ммоль) в DCM (0,5 мл) добавляли TEA (0,01 мл, 0,072 ммоль), затем никотиноил хлорид (10 мг, 0,071 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа после чего реакционную смесь разбавляли DCM (5 мл), промывали водой (2 мл), насыщенным солевым раствором (2 мл), сушили над MgSО4, фильтровали и концентрировали досуха. Сырой продукт очищали на препаративной колонке с обращенной фазой C-18 ВЭЖХ, элюируя градиентом 10-25% ацетонитрила в воде с 0,1% ТФК. Желаемые объединенные фракции концентрировали, растворяли в MeOH (5 мл), пропускали через слой из SiCО3, элюируя MeOH (10 мл), концентрировали и сушили в вакууме с получением ER-889728 (7,2 мг, 0,015 ммоль, 45%-ный выход).
[0355] ER-889729 (8,2 мг, 0,017 ммоль, 51,3%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (12,5 мг, 0,034 ммоль) и изоникотиноил хлорида (10 мг, 0,071 ммоль).
[0356] ER-889734 (8,6 мг, 0,018 ммоль, 52,9%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (12,5 мг, 0,034 ммоль) и пиколиноил хлорида (10 мг, 0,071 ммоль).
[0357] ER-889744 (12 мг, 0,028 ммоль, 80,8%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (12,5 мг, 0,034 ммоль) и гесаноил хлорида (9 мг, 0,067 ммоль).
[0358] ER-889745 (8 мг, 0,018 ммоль, 54%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (12,5 мг, 0,034 ммоль) и изобутирил хлорида (7 мг, 0,066 ммоль).
[0359] ER-889746 (7,6 мг, 0,017 ммоль, 50%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (12,5 мг, 0,034 ммоль) и 2,2-диметилпропаноил хлорид (8 мг, 0,066 ммоль).
[0360] ER-890113 (25,6 мг, 0,054 ммоль, 66,7%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890112 (35,2 мг, 0,081 ммоль) и уксусного ангидрида (0,093 мл, 0,984 ммоль).
[0361] ER-890120 (20,3 мг, 0,045 ммоль, 54,2%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890119 (33,7 мг, 0,083 ммоль) и уксусного ангидрида (0,012 мл, 0,127 ммоль).
[0362] ER-890122 (35,2 мг, 0,069 ммоль, 43,1%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890119 (65,2 мг, 0,160 ммоль) и бензоилхлорида (0,037 мл, 0,318 ммоль).
[0363] ER-890142 (45,2 мг, 0,084 ммоль, 53,1%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890112 (68,5 мг, 0,158 ммоль) и бензоилхлорида (0,037 мл, 0,318 ммоль).
[0364] ER-890187 (9,4 мг, 0,020 ммоль, 18,0%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890107 (48 мг, 0,111 ммоль) и уксусного ангидрида (0,125 мл, 1,3 ммоль).
[0365] ER-890188 (8,9 мг, 0,018 ммоль, 16,0%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890107 (48 мг, 0,111 ммоль) и изобутирилхлорида (0,051 мл, 0,487 ммоль).
[0366] ER-890189 (10 мг, 0,019 ммоль, 16,7%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890107 (48 мг, 0,111 ммоль) и бензоилхлорида (0,056 мл, 0,482 ммоль).
[0367] ER-890190 (6,5 мг, 0,014 ммоль, 36,8%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890119 (15,6 мг, 0,038 ммоль) и изобутирилхлорида (0,006 мл, 0,058 ммоль).
[0368] ER-890219 (32,0 мг, 0,067 ммоль, 91,8%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890106 (40,2 мг, 0,073 ммоль) в виде ТФК соли, TEA (0,20 мл, 1,43 ммоль) и уксусного ангидрида (0,10 мл, 1,06 ммоль).
[0369] ER-890221 (28,2 мг, 0,056 ммоль, 76,7%-ный выход) получали способом, аналогичным способу получения ER-890219, исходя из ER-890106 (40,2 мг, 0,073 ммоль) в виде ТФК соли и изобутирилхлорида (0,080 мл, 0,764 ммоль).
[0370] АER-890222 (30,1 мг, 0,056 ммоль, 76,7%-ный выход) получали способом, аналогичным способу получения ER-890219, исходя из ER-890106 (40,5 мг, 0,074 ммоль) в виде ТФК соли и бензоилхлорида (0,20 мл, 1,723 ммоль).
[0371] ER-892254 (24,2 мг, 0,0,52 ммоль, 67,5%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-892253 (32,2 мг, 0,077 ммоль) и уксусного ангидрида (0,015 мл, 0,151 ммоль). К реакционной смеси добавляли ацетонитрил (0,5 мл)
[0372] ER-892256 (25,2 мг, 0,052 ммоль, 41,9%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-890119 (50,2 мг, 0,124 ммоль) и метансульфонил хлорида (0,011 мл, 0,142 ммоль).
[0373] ER-893926 (124,2 мг, 0,255 ммоль, 51,7%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (180,2 мг, 0,493 ммоль) и 1,3-диметил-1H-пиразол-4-карбонил хлорида (93,8 мг, 0,592 ммоль).
[0374] ER-893927 (45,2 мг, 0,0,83 ммоль, 57,8%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-892253 (60,5 мг, 0,144 ммоль) и 1,3-диметил-1H-пиразол-4-карбонил хлорида (27,4 мг, 0,173 ммоль).
[0375] ER-893948 (65,3 мг, 0,147 ммоль, 29,9%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (180,2 мг, 0,493 ммоль) и метансульфонил хлорида (68 мг, 0,593 ммоль).
[0376] ER-894149 (67,2 мг, 0,133 ммоль, 80,6%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (60,2 мг, 0,165 ммоль) и бензолсульфонил хлорида (0,023 мл, 0,180 ммоль).
[0377] ER-894150 (58,2 мг, 0,111 ммоль, 69,9%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (58,2 мг, 0,159 ммоль) и 4-фторбензолсульфонил хлорида (0,025 мл, 0,188 ммоль).
[0378] ER-894152 (36,2 мг, 0,095 ммоль, 63,6%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (50,6 мг, 0,150 ммоль) и уксусного ангидрида (0,014 мл, 0,135 ммоль).
[0379] ER-894153 (5,4 мг, 0,012 ммоль, 7,4%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (52,2 мг, 0,155 ммоль) и 4-фторбензоил хлорида (25 мг, 0,158 ммоль).
[0380] ER-894154 (38,5 мг, 0,093 ммоль, 62,4%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (50,4 мг, 0,149 ммоль) и метансульфонил хлорида (0,012 мл, 0,146 ммоль).
[0381] ER-894155 (42,1 мг, 0,085 ммоль, 57,1%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (50,3 мг, 0,149 ммоль) и 4-фторбензолсульфонил хлорида (29 мг, 0,149 ммоль).
[0382] ER-894159 (20,4 мг, 0,041 ммоль, 27,4%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (50,5 мг, 0,150 ммоль) и 1,3-диметил-1H-пиразол-4-сульфонил хлорида (29 мг, 0,149 ммоль).
[0383] ER-894160 (47,2 мг, 0,0,90 ммоль, 65,8%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-888070 (50,1 мг, 0,137 ммоль) и 1,3-диметил-1H-пиразол-4-сульфонил хлорида (27 мг, 0,139 ммоль).
[0384] ER-894206 (11,3 мг, 0,029 ммоль, 19%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (50,6 мг, 0,150 ммоль) и изобутирилхлорида (16 мг, 0,150 ммоль).
[0385] ER-894594 (215 мг, 0,487 ммоль, 46,4%-ный выход) получали способом, аналогичным способу получения ER-889728, исходя из ER-894151 (354 мг, 1,049 ммоль) и бензойного ангидрида (407 мг, 1,81 ммоль). Вместо DCM использовали ацетонитрил (2 мл).
[0386] Получение ER-890252: К перемешиваемому раствору соединения 36 (2,0 г, 4,8 ммоль) в соответствии со схемой 9 в ацетонитриле (15 мл) добавляли (R)-трет-бутил пирролидин-2-илкарбамат (1,10 г, 5,9 ммоль), затем TEA (1,6 мл, 11,5 ммоль). Реакционную смесь перемешивали при 70°C в течение 3 часов, затем, после полного завершения реакции, реакционную смесь концентрировали до сырого сиропа, разбавляли DCM (20 мл), промывали водой (5 мл), сушили, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage SP4, 40+M, элюируя градиентом 5% MeOH в 1:1 EtOAc:DCM - 10% MeOH в 1:1 EtOAc:DCM 10 объемов колонки за цикл. Продукт, содержащий фракции, объединяли, концентрировали и сушили в вакууме с получением трет-бутил ((R)-1-(((2S,6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-ил)метил)пирролидин-3-ил)карбамата (1,35 г, 3,0 ммоль, 62%-ный выход).
[0387] К перемешиваемому раствору трет-бутил ((R)-1-(((2S, 6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-ил)метил)-пирролидин-3-ил)карбамата (1,35 г, 3,0 ммоль) в DCM (10 мл) добавляли ТФК (8,1 мл). Реакционную смесь перемешивали при комнатной температуре, после чего концентрировали и азеотропно отгоняли досуха три раза с толуолом (по 10 мл) и затем сушили в вакууме с получением сырого 5-((2S,6R)-2-(((R)-3-аминопирролидин-1-ил)метил)-6-метилморфолинo)хинолин-8-карбонитрила (1,39 г, 3,0 ммоль, 100%-ный выход) в виде ТФК соли.
[0388] ER-890252 (120,3 мг, 0,306 ммоль, 71,2%-ный выход) получали способом, аналогичным способу получения ER-890222, исходя из 5-((2S,6R)-2-(((R)-3-аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли и уксусного ангидрида (0,80 мл, 8,46 ммоль).
[0389] ER-890253 (146,5 мг, 0,348 ммоль, 80,8%-ный выход) получали способом, аналогичным способу получения ER-890122, исходя из 5-((2S,6R)-2-(((R)-3-аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли и изобутирил хлорида (0,50 мл, 4,77 ммоль).
[0390] ER-894544 (103,6 мг, 0,227 ммоль, 52,9%-ный выход) получали способом, аналогичным способу получения ER-890122, исходя из 5-((2S,6R)-2-(((R)-3-аминопирролидин-1-ил)метил)-6-метилморфолинo)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли и бензоилхлорида (0,50 мл, 4,31 ммоль).
[0391] ER-894546 (96,7 мг, 0,214 ммоль, 49,8%-ный выход) получали способом, аналогичным способу получения ER-890222, исходя из 5-((2S,6R)-2-(((S)-3-аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли и уксусного ангидрида (0,80 мл, 8,46 ммоль). 5-((2S,6R)-2-((((S)-3-Аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрил получали способом, аналогичным способу получения 5-((2S,6R)-2-(((R)-3-аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила, используя (S)-трет-бутил пирролидин-2-илкарбамата в качестве исходного вещества на первой стадии, описанной выше, для получения ER-890252.
[0392] ER-894547 (120,8 мг, 0,287ммоль, 66,7%-ный выход) получали способом, аналогичным способу получения ER-894546, исходя из 5-((2S,6R)-2-(((S)-3-аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли и изомасляного ангидрида (0,70 мл, 4,22 ммоль).
[0393] ER-894548 (110,4 мг, 0,242 ммоль, 56,4%-ный выход) получали способом, аналогичным способу получения ER-894546, исходя из 5-((2S,6R)-2-(((S)-3-аминопирролидин-1-ил)метил)-6-метилморфолино)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли и бензойного ангидрида (0,50 г, 2,21 ммоль).
[0394] ER-894545 (32 мг, 0,084 ммоль, 19,6%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из 5-((2S,6R)-2-(((R)-3-аминопирролидин-1-ил)метил)-6-метилморфолинo)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли.
[0395] ER-894549 (103,8 мг, 0,274 ммоль, 63,6%-ный выход) получали способом, аналогичным способу получения ER-889556, исходя из 5-((2S,6R)-2-(((S)-3-аминопирролидин-1-ил)метил)-6-метилморфолинo)хинолин-8-карбонитрила (200 мг, 0,430 ммоль) в виде ТФК соли.
[0396] Получение 886355, используя модификации для схемы 7 и схемы 4: К перемешиваемому раствору (R)-1-амино-3-(бензилокси)пропан-2-ола, соединение 22 по схеме 7 (8,0 г, 44,1 ммоль), в ДМФ (60 мл) добавляли (S)-2-хлорбутановую кислоту (5,0 г, 40,8 ммоль), затем TEA (10,5 г, 103,8 ммоль), DMAP (0,4 г, 3,3 ммоль) и, наконец, EDC (9,52 г, 49,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 дней, затем, после полного завершения реакции, реакционную смесь концентрировали до сырого сиропа. Очистка на силикагеле (Biotage, элюируя градиентом 20-100% EtOAc в гептане) с последующем сбором желаемых фракций, концентрированием и сушкой в вакууме приводили к получению (S)-N-((R)-3-(бензилокси)-2-гидроксипропил)-2-хлорбутанамида (683,5 мг, 2,392 ммоль, 5,9%-ный выход).
[0397] К перемешиваемой суспензии гидрида натрия (203,1 мг, 5,1 ммоль в виде 60% масляной дисперсии) в ТГФ (18 мл), охлаждаемой до 0°C, добавляли по каплям (S)-N-((R)-3-(бензилокси)-2-гидроксипропил)-2-хлорбутанамид (362,8 мг, 1,270 ммоль) в ТГФ (3,8 мл) в течение 5 мин, после чего реакционную смесь перемешивали при 0°C в течение 30 мин с последующим перемешиванием при комнатной температуре в течение 5 часов. После полного завершения реакции реакционную смесь гасили медленным добавлением IPA (1 мл) с последующим добавлением Dowex 50, H+ форма, до тех пор, пока не достигалось значение рН от нейтрального до кислотного. Конечную суспензию фильтровали, и твердое вещество промывали два раза EtOAc. Объединенный фильтрат концентрировали, и полученный сырой продукт очищали на силикагеле (Biotage, элюируя смесью 1:1 EtOAc:гептан). Желаемые фракции объединяли, концентрировали и сушили в вакууме с получением (2R,6R)-6-((бензилокси)метил)-2-этилморфолин-3-она (314 мг, 1,260 ммоль, 99,2%-ный выход).
[0398] К перемешиваемому раствору (2R,6R)-6-((бензилокси)метил)-2-этилморфолин-3-она (362,2 мг, 1,453 ммоль) в ТГФ (2 мл) в течение 2 минут добавляли по каплям при комнатной температуре 1M раствор тетрагидроалюмината лития в ТГФ (2 мл, 2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 часов, после чего охлаждали до 0°C, затем по каплям добавляли воду (0,6 мл) и потом 1M раствор гидроксида натрия в воде (,04 мл). Гашеную реакционную смесь нагревали до комнатной температуры, перемешивали до образования гранулированного твердого вещества и фильтровали через слой Целита 545, промывая EtOAc (5 мл), DCM (5 мл) и этиловым эфиром (5 мл). Фильтрат концентрировали, и полученный сырой продукт очищали на силикагеле (Biotage, элюируя градиентом 5-10% MeOH в DCM), затем объединяли желаемые фракции, концентрировали и сушили в вакууме с получением (2R,6R)-2-((бензилокси)метил)-6-этилморфолина (50,2 мг, 0,213 ммоль, 14,6%-ный выход).
[0399] К перемешиваемому раствору (2R,6R)-2-((бензилокси)метил)-6-этилморфолина (12,4 мг, 0,053 ммоль) и соединения 3 (10,2 мг, 0,044 ммоль) в DMA (2 мл) добавляли DIPEA (0,015 мл, 0,086 ммоль), и затем нагревали в микроволновой печи при 150°C в течение 7 часов. Охлажденную после полного завершения реакционную смесь напрямую помещали на колонку C-18 для ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18, 19×100 мм, элюируя линейным градиентом 10%-90% ацетонитрила в воде с 0,1% муравьиной кислотой) и концентрировали продукт желаемого пика, затем упаривали досуха в высоком вакууме с получением ER-886355 (6,2 мг, 0,016 ммоль, 36,4%-ный выход).
[0400] Получение ER-887199: Перемешиваемый раствор (2R,6R)-2-((бензилокси)метил)-6-этилморфолина (552,2 мг, 2,347 ммоль) в MeOH (10 мл) прогоняли на колонке 10% Pd(OH)2 в атмосфере H2 при давлении 1 атм в течение 16 часов, используя прибор для гидрирования H-Qube. После полного завершения реакции реакционный раствор концентрировали и сушили в вакууме с получением сырого ((2R,6R)-6-этилморфолин-2-ил)метанола (320 мг, 2,204 ммоль, 93,9%-ный выход), который использовали на следующей стадии без дополнительной очистки.
[0401] ((2R,6R-6-Этилморфолин-2-ил)метанол (145,2 мг, 1,00 ммоль) и соединение 3 (266,4 мг, 1,143 ммоль) в 1-метилпирролидин-2-оне (2 мл) нагревали в микроволновой печи при 180°C в течение 15 минут, после чего охлаждали до комнатной температуры и напрямую помещали на колонку C-18 для ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18, 19×100 мм, элюируя линейным градиентом 10%-90% ацетонитрила в воде с 0,1% муравьиной кислотой) и концентрировали продукт желаемого пика, затем упаривали досуха в высоком вакууме с получением ER-887199 (92,3 мг, 0,313 ммоль, 31,3%-ный выход).
[0402] Получение соединения ER-899742 по примеру, используя схему 11 и 19
[0403] Схема 19
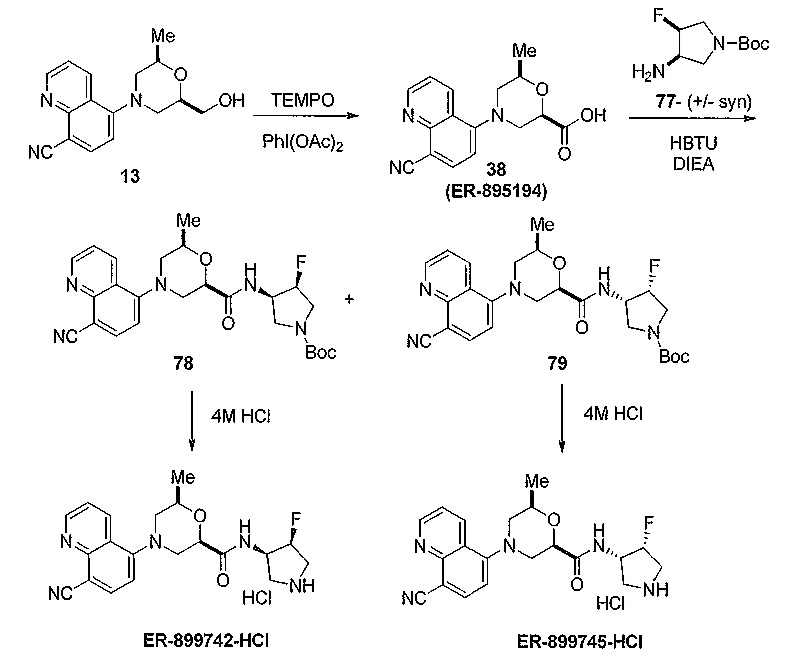
[0404]
[0405] ER-895194 или соединение 38: К перемешиваемому раствору соединения 13 (231,0 г, 815,3 ммоль) в DCM (3,93 л) при 0-5°C добавляли йодбензол диацетат (525 г, 1630,6 ммоль), поддерживая при этом температуру <5°C. Добавляли TEMPO (25,4 г, 162,8 ммоль), затем воду (151 мл), потом полученную реакционную смесь нагревали до 10°C, перемешивали в течение 30 минут и далее оставляли нагреваться до комнатной температуры и перемешивали в течение 15 часов. После полного завершения реакции реакционную смесь охлаждали до <15°C и гасили медленным добавлением 1,34 л 10% (масс/об) раствора тиосульфата натрия в воде при поддержании температуры реакции ≤15°C с последующим дополнительным перемешиванием при комнатной температуре в течение 45 мин. Значение pH гашеной реакционной смеси доводили до 9 медленным добавлением 1M раствора гидроксида натрия в воде при поддержании температуры ≤25°C. Перемешиваемые слои разделяли, и органический слой промывали водой (560 мл). К объединенным водным слоям добавляли 1-бутанол (2,31 л), после чего смесь охлаждали до 10-15°C, затем медленно добавляли 5M раствор серной кислоты (231 мл), поддерживая температуру ≤25°C для доведения значения pH приблизительно до 5. Полученные слои разделяли, и водный слой экстрагировали 3 раза 1-бутанолом (2,31 л) при поддержании значения pH водного слоя равным около 5 между экстракциями. Объединенные водные слои концентрировали при нагревании до 50-55°C, после чего полученную взвесь твердого вещества желтого цвета концентрировали путем азеотропной отгонки три раза с н-гептаном (по 693 мл) до объема, равного 1,5 л, с последующим добавлением DCM (2,31 л). Суспензию твердого вещества желтого цвета перемешивали при комнатной температуре в течение 1 часа, затем фильтровали, промывали слой на фильтре два раза DCM (462 мл). Полученный осадок на фильтре желтого цвета сушили в вакууме в течение ночи при 40°C, затем суспендировали в толуоле (1,16 л) и концентрировали до полного высушивания при 45°C в вакууме с получением соединения 38 или ER-895194 (187 г, 629 ммоль, 77%-ный выход) в виде желтого твердого вещества.
[0406] К перемешиваемому раствору соединения 38 (300 мг, 1,01 ммоль) в DCM (2 мл) добавляли смесь (3S,4R)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата и (3R,4S)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата 77 (205,3 мг, 1,005 ммоль ммоль), HBTU (247 мг, 1,211 ммоль) и DIEA (0,70 мл, 4,04 ммоль), затем перемешивали при комнатной температуре в течение 16 часов. Когда было обнаружено, что реакция полностью завершилась, и смесь концентрировали досуха с последующим растворением в EtOAc (20 мл), промывали 1 раз водой (10 мл), 2н раствором лимонной кислоты в воде (10 мл), насыщенным раствором NaHCO3 (10 мл) и насыщенным солевым раствором (10 мл). Объединенные водные слои экстрагировали 3 раза EtOAc (по 10 мл), затем объединенные органические фракции сушили над MgSO4, фильтровали и концентрировали досуха. Сырой продукт очищали на колонке Biotage с силикагелем (25 г), элюируя 0-10% MeOH в DCM (200 мл всего) с получением диастереомерной смеси соединения 78 и 79.
[0407] Соединения 78 и 79 разделяли на колонке Chiral Technologies' 5 мкМ Chiralpak IA соответствующего размера, элюируя системой растворителей гептан:EtOH:MeOH:DEA (70:15:15:0,1). После концентрирования и сушки до твердого вещества с помощью вакуумного насоса получали: соединение 72 (95 мг, 0,196 ммоль, 19,5%-ный выход) в виде первой элюированной фракции; и соединение 73 (75 мг, 0,155 ммоль, 15,4%-ный выход) в виде второй элюированной фракции.
[0408] Соединение 78 (95 мг, 0,196 ммоль) растворяли при перемешивании в диоксане (17 мкл), затем добавляли по каплям 4н раствор HCl в диоксане (0,49 мл 1,97 ммоль, 10 эквивалентов) в течение 3 минут при комнатной температуре. Реакционную смесь перемешивали в течение еще 4 часов, потом, после полного завершения реакции, реакционную смесь концентрировали и азеотропно отгоняли 3 раза с использованием толуола (по 10 мл) досуха и далее сушили в высоком вакууме с получением ER-899742-HCl (69 мг, 0,164 ммоль, 84%) выход) в виде HCl соли, которая не требовала дополнительной очистки.
[0409] Непрямое определение абсолютной стереохимии ER-899742
[0410] Схема 20
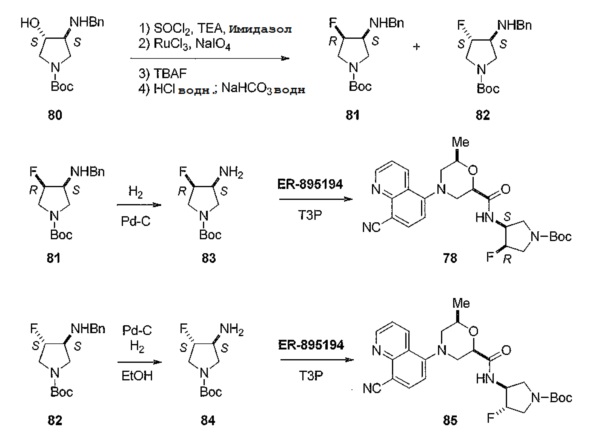
[0411] Для определения абсолютной стереохимии ER-899742 использовали косвенный способ с использованием подтвержденного хирального исходного вещества, описанный в работе Tsuzuki, et. al., Tetrahedron Asymmetry 2001, 12, 29891 с получением хирального соединения 81 по схеме 20.
[0412] К перемешиваемому раствору (3S,4S)-трет-бутил 3-(бензиламино)-4-гидроксипирролидин-1-карбоксилата 80 (3,091 г, 10,57 ммоль) и имидазола (3,60 г, 52,9 ммоль) в DCM (185 мл) добавляли триэтиламин (4,42 мл, 31,7 ммоль). Полученную смесь охлаждали до 1-2°C, и затем по каплям добавляли раствор тионилхлорида (1,16 мл, 15,9 ммоль) в DCM (46 мл) в течение 30 минут. Смесь перемешивали при 1-2°C в течение 6 часов, нагревали до комнатной температуры и перемешивали в течение ночи, после чего реакционную смесь гасили водой (46 мл). Органический слой разделяли, концентрировали с получением сырого продукта в виде белого цвета твердого вещества/пены, который хроматографировали на колонке с силикагелем (н-гептан/EtOAc 2:1) с получением 2-оксида (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-d][1,2,3]оксатиазол-5(3H)-карбоксилата (2,10 г, 6,21 ммоль, 58,7%-ный выход) в виде твердого вещества белого цвета.
[0413] К перемешиваемому раствору 2-оксида (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-d][1,2,3]оксатиазол-5(3H)-карбоксилата (2,10 г, 6,21 ммоль) в 1,2-дихлорэтане (10 мл), разбавленному ацетонитрилом (10 мл) и водой (10 мл), охлаждаемому до 2-3°C, добавляли гидрат рутений(III) хлорида (14 мг), затем перйодат натрия (1,39 г, 6,50 ммоль). Полученную смесь перемешивали при 2-3°C в течение 1 часа, нагревали при 17-18°C в течение 1 часа и перемешивали при этой температуре в течение 16 часов. Добавляли 20 масс% раствор Na2SO4 (5 г), потом EtOAc (30 мл), после чего полученную смесь интенсивно перемешивали в течение 10 мин и фильтровали через слой из целита (2 г). Органический слой разделяли, промывали 20 масс% раствором сульфитом натрия (5 г), 20 масс% раствором NaCl (5 г) и концентрировали с получением масла светло-сиреневого/серого цвета. Сырое масло пропускали через слой силикагеля (10 г), элюируя EtOAc (120 мл) и концентрировали досуха с получением 2,2-диоксида (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-d][1,2,3]оксатиазол-5(3H)-карбоксилата (1,54 г, 4,35 ммоль, 70,0%-ный выход) в виде твердого вещества белого цвета.
[0414] 2,2-Диоксид (3S,6S)-трет-бутил 3-бензилтетрагидропирроло[3,4-d][1,2,3]оксатиазол-5(3H)-карбоксилата (20 мг, 0,056 ммоль) растворяли в TBAF (1M раствор в ТГФ, 1,0 мл) и нагревали с обратным холодильником в течение ночи, после чего реакционную смесь охлаждали до комнатной температуры и подкисляли HCl (1M раствор, 2 мл). Через 2 часа смесь нейтрализовали с помощью NaHCO3 (9% водный раствор, 2,5 г) и экстрагировали EtOAc (10 мл). Органический слой разделяли, концентрировали и объединяли с двумя дополнительными партиями, используя по 100 мг (по 0,282 ммоль) исходного оксатиазола для каждой партии. Объединенные сырые продукты очищали хроматографией на колонке с силикагелем (н-гептан/EtOAc 1:1) с получением (3S,4S)-трет-бутил 3-(бензиламино)-4-фторпирролидин-1-карбоксилата 82 (29 мг, 0,099 ммоль, 15,9%-ный выход), в виде масла светло-коричневого цвета и менее полярного на ТСХ (силикагель), и (3S,4R)-трет-бутил 3-(бензиламино)-4-фторпирролидин-1-карбоксилата 81 (20 мг, 0,068 ммоль, 11,0%-ный выход) в виде масла светло-коричневого цвета и более полярного на ТСХ (силикагель).
[0415] (3S,4R)-трет-Бутил 3-(бензиламино)-4-фторпирролидин-1-карбоксилат 81 (16 мг, 0,054 ммоль) подвергали гидрированию с помощью 10 масс% Pd-C (10 мг) в этаноле (3 мл). После полного завершения реакции реакционную смесь фильтровали, концентрировали и азеотропно отгоняли с CDCl3 с получением (3S,4R)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилатаа 83 (8,3 мг, 0,041 ммоль, 75,9%-ный выход).
[0416] К перемешиваемому раствору (3S,4R)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата и соединения 38 или ER-895194 (15 мг, 0,050 ммоль) в ДМФ (0,2 мл) добавляли пропилфосфоновый ангидрид (0,2 г 50% раствора в EtOAc) при 40°C в течение 2 часов. Реакционную смесь пропускали через слой из силикагеля (3 г, элюируя смесью гептан-EtOAc 1:3), и затем дополнительно очищали с помощью препаративной ТСХ (н-гептан/EtOAc 1:4) с получением соответствующего амида 78 в виде масла желто-зеленого цвета (11,2 мг, 0,023 ммоль, 56%-ный выход за 2 стадии). Данные 1H-ЯМР и ВЭЖХ соответствовали соединению 78, как описано выше, таким образом, абсолютная стереохимия ER-899742 ненапрямую подтверждалась.
[0417] Абсолютную стереохимию HER-899742 также подтверждали с помощью рентгеновской дифракции. Способ кристаллизации: 5,3 мг ER-899742-01 (партия MC2-1130-120-1) растворяли в 0,5 мл IPA и 0,3 мл H2O. Сосуд, содержащий раствор, закрывали крышкой и хранили при комнатной температуре в течение дня. На следующий день крышку снимали, и IPA медленно выпаривали в течение дня при комнатной температуре. На следующий день сосуд закрывали крышкой и флакон хранили при комнатной температуре в течение 2-х недель, после чего появлялись бесцветные игольчатые кристаллы ER-899742-01, из которых отбирали монокристалл для рентгеноструктурного анализа. Рентгеноструктурный анализ: Оборудование: R-AXIS RAPID II (RIGAKU); Источник рентгеновских лучей: CuKa (1=1,54187A); Температура: 297 K (23,85°C); Измерение: Метод колебаний вдоль оси ω. Размер кристаллов: 0,1×0,1×0,4 мм. Кристаллическую структуру растворяли при конечном R-факторе и параметре Flack -0,01. Структуру ER-899742-01 определяли как гидрохлорид (2R,6R)-4-(8-цианохинолин-5-ил)-N-[(3S,4R)-4-фторпирролидин-3-ил]-6-метилморфолин-2-карбоксамид. См. фиг.8 для рисунка ORTEP.
[0418] (3S,4S)-трет-Бутил 3-(бензиламино)-4-фторпирролидин-1-карбоксилат 82 (24 мг, 0,082 ммоль) подвергали гидрированию на 10 масс% Pd-C (10 мг) в этаноле (3 мл). Реакционную смесь фильтровали, концентрировали и азеотропно сушили с CHCl3 с получением (3S,4S)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата (16,6 мг, 0,081 ммоль, 99,2%-ный выход), который использовали на следующей стадии без очистки.
[0419] К перемешиваемому раствору (3S,4S)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата (12,5 мг, 0,061 ммоль) и соединения 38 или ER-895194 (18 мг, 0,061 ммоль) в ДМФ (0,2 мл) обрабатывали ангидридом пропилфосфоновой кислоты (50% раствор в EtOAc; 0,2 г,) при 40°C в течение 2 часов. Реакционную смесь пропускали через слой силикагеля (3 г, элюируя смесью гептан-EtOAc 1:3), и затем дополнительно очищали с помощью препаративной ТСХ (н-гептан/EtOAc 1:4) с получением (3S,4S)-трет-бутил 3-((2R,6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-карбоксамидо)-4-фторпирролидин-1-карбоксилата 85 (14,2 мг, 0,029 ммоль, 47%-ный выход за 2 стадии) в виде масла желто-зеленого цвета.
[0420] ER-899745-HCl (62,3 мг, 0,148 ммоль, 96%-ный выход) был получен с использованием тех же эквивалентов реагентов, что и для ER-899742-HCl, исходя из соединения 79 (75 мг, 0,155 ммоль).
ER-894550 (5,3 мг, 0,016 ммоль, 18,4%-ный выход) получали способом, аналогичным способу получения ER-899742, исходя из соединения 38 (25,9 мг, 0,087 ммоль) и гидрохлорида этиламина (206 мг, 0,962 ммоль). Вместо DCM использовали ДМФ (0,5 мл). ER-894550 очищали методом ВЭЖХ с обращенной фазой (колонка X-Bridge C18 19×100 мм; элюируя градиентом с повышающимся содержанием ацетонитрила c 0,1% муравьиной кислотой), затем объединяли желаемые фракции, концентрировали и сушили в вакууме. Фракции, содержащие продукт, объединяли и концентрировали досуха с последующим разбавлением в MeOH (1 мл), пропускали через основной слой из силикагеля (Biotage SiCO3, 1 г, элюируя MeOH (1 мл)), концентрировали и сушили в вакууме.
[0421] ER-895473 (103 мг, 0,261 ммоль, 27,1%-ный выход) получали способом, аналогичным способу получения ER-899742, исходя из соединения 38 (286 мг, 0,962 ммоль) и (S)-трет-бутил 2-этилпиперазин-1-карбоксилата (206 мг, 0,962 ммоль). Вместо DCM в реакции образования амида использовали ДМФ (3 мл), и в способе удаления Boc-группы использовали 2,0M раствор HCl в этиловом эфире (1,3 мл, 2,6 ммоль) с использованием ацетонитрила (1 мл) в качестве растворителя. ER-895473 очищали с использованием ВЭЖХ с обращенной фазой (колонка X-Bridge C18 19×100 мм; элюируя градиентом с повышающимся содержанием ацетонитрила в воде с 0,1% муравьиной кислотой). Фракции, содержащие продукт, объединяли и концентрировали досуха с последующим разбавлением в MeOH (1 мл), пропускали через основной слой из силикагеля (Biotage SiCO3, 1 г, элюируя MeOH (1 мл)), концентрировали и сушили в вакууме.
[0422] ER-895474 (6,3 мг, 0,015 ммоль, 19,6%-ный выход) получали способом, аналогичным способу получения ER-899742, исходя из соединения 38 (22,5 мг, 0,076 ммоль) и (3,4-дифторфенил)метанамина (10,83 мг, 0,076 ммоль). Удаление защитной группы Boc не требовалось.
[0423] ER-895475 (16,2 мг, 0,044 ммоль, 71,5%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (18,3 мг, 0,062 ммоль) и (R)-трет-бутил пирролидин-3-илкарбамата (11,46 мг, 0,062 ммоль).
[0424] ER-895476 (14,0 мг, 0,042 ммоль, 28,8%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (43,0 мг, 0,145 ммоль) и гидрохлорида азетидина (13,53 мг, 0,145 ммоль).
[0425] ER-895477 (26,1 мг, 0,058 ммоль, 32,1%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (54,0 мг, 0,182 ммоль) и 1,4'-бипиперидина (30,6 мг, 0,182 ммоль).
[0426] ER-895478 (15,9 мг, 0,047 ммоль, 29,0%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (48,4 мг, 0,163 ммоль) и циклопропанамина (11,42 мкл, 0,163 ммоль).
[0427] ER-895479 (14,9 мг, 0,042 ммоль, 23,7%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (53,2 мг, 0,179 ммоль) и трет-бутил азетидин-3-илкарбамата (30,8 мг, 0,179 ммоль).
[0428] ER-897922 (15,1 мг, 0,041 ммоль, 48,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 1-аминобутан-2-ола (13,0 мг, 0,146 ммоль).
[0429] ER-897923 (13,9 мг, 0,038 ммоль, 44,9%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-этоксиэтанамина (13,0 мг, 0,146 ммоль).
[0430] ER-897924 (17,0 мг, 0,046 ммоль, 54,9%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (R)-2-аминобутан-1-ола (14,0 мг, 0,157 ммоль).
[0431] ER-897925 (4,5 мг, 0,012 ммоль, 14,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-аминопропан-1,3-диола (14,0 мг, 0,154 ммоль).
[0432] ER-897926 (7,6 мг, 0,021 ммоль, 24,4%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 3-аминопропан-1,2-диола (15,0 мг, 0,165 ммоль).
[0433] ER-897927 (15,0 мг, 0,039 ммоль, 46,9%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (R)-(тетрагидрофуран-2-ил)метанамина (15,0 мг, 0,148 ммоль).
[0434] ER-897928 (14,9 мг, 0,039 ммоль, 46,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (тетрагидрофуран-2-ил)метанамина (16,0 мг, 0,158 ммоль).
[0435] ER-897929 (10,3 мг, 0,027 ммоль, 32,0%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-пропоксиэтанамина (16,0 мг, 0,155 ммоль).
[0436] ER-897930 (12,8 мг, 0,033 ммоль, 39,8%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (R)-2-аминопентан-1-ола (16,0 мг, 0,155 ммоль).
[0437] ER-897931 (11,1 мг, 0,029 ммоль, 34,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-изопропоксиэтанамина (15,0 мг, 0,145 ммоль).
[0438] ER-897932 (10,0 мг, 0,026 ммоль, 31,1%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 1-метоксибутан-2-амина (0,0160 г, 0,155 ммоль).
[0439] ER-897933 (9,0 мг, 0,021 ммоль, 24,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-амино-1-(2-фторфенил)этанола (23,0 мг, 0,148 ммоль).
[0440] ER-897934 (13,3 мг, 0,035 ммоль, 41,1%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-амино-3-метилбутан-1-ола (15,0 мг, 0,145 ммоль).
[0441] ER-897935 (15,7 мг, 0,041 ммоль, 48,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2,2-диметоксиэтанамина (15,0 мг, 0,143 ммоль).
[0442] ER-897936 (10,4 мг, 0,027 ммоль, 32,2%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-(2-аминоэтокси)этанола (16,0 мг, 0,152 ммоль).
[0443] ER-897937 (12,1 мг, 0,031 ммоль, 36,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (1S,2S)-2-аминоциклогексанола (23,0 мг, 0,200 ммоль).
[0444] ER-897938 (8,5 мг, 0,022 ммоль, 25,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-аминоциклогексанола (17,0 мг, 0,148 ммоль).
[0445] ER-897939 (10,1 мг, 0,025 ммоль, 30,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-аминогексан-1-ола (18,3 мг, 0,156 ммоль).
[0446] ER-897940 (10,3 мг, 0,026 ммоль, 30,9%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-амино-3,3-диметилбутан-1-ола (19,0 мг, 0,162 ммоль).
[0447] ER-897941 (14,0 мг, 0,035 ммоль, 42,0%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-аминогексан-1-ола (19,0 мг, 0,162 ммоль).
[0448] ER-897942 (9,9 мг, 0,025 ммоль, 29,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (2S,3S)-2-амино-3-метилпентан-1-ола (18,0 мг, 0,154 ммоль).
[0449] ER-897943 (11,1 мг, 0,028 ммоль, 33,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-амино-4-метилпентан-1-ола (18,0 мг, 0,154 ммоль).
[0450] ER-897944 (10,9 мг, 0,027 ммоль, 32,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (R)-2-амино-4-метилпентан-1-ола (18,0 мг, 0,154 ммоль).
[0451] ER-897945 (13,2 мг, 0,032 ммоль, 38,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (4-метилморфолин-2-ил)метанамина (20,0 мг, 0,154 ммоль).
[0452] ER-897946 (16,1 мг, 0,035 ммоль, 42,0%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-амино-4-(метилтио)бутан-1-ола (20,0 мг, 0,148 ммоль).
[0453] ER-897947 (12,0 мг, 0,029 ммоль, 34,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-феноксиэтанамина (21,0 мг, 0,153 ммоль).
[0454] ER-897948 (12,0 мг, 0,028 ммоль, 33,1%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-амино-3-фенилпропан-1-ола (24,0 мг, 0,159 ммоль).
[0455] ER-897949 (11,7 мг, 0,027 ммоль, 32,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-феноксипропан-1-амина (29,0 мг, 0,192 ммоль).
[0456] ER-897950 (11,7 мг, 0,027 ммоль, 32,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 1-амино-3-фенилпропан-2-ола (23,0 мг, 0,152 ммоль).
[0457] ER-897952 (14,0 мг, 0,032 ммоль, 38,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-(пиридин-3-илокси)пропан-1-амина (24,0 мг, 0,158 ммоль).
[0458] ER-897955 (8,2 мг, 0,019 ммоль, 22,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-(4-фторфенокси)этанамина (23,0 мг, 0,148 ммоль).
[0459] ER-897956 (11,2 мг, 0,026 ммоль, 26%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 2-амино-1-(3-фторфенил)этанола (24,0 мг, 0,155 ммоль).
[0460] ER-897957 (9,8 мг, 0,022 ммоль, 26,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-2-амино-3-циклогексилпропан-1-ола (30,0 мг, 0,191 ммоль).
[0461] ER-897958 (13,6 мг, 0,031 ммоль, 36,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и изохроман-1-илметанамина (24,0 мг, 0,147 ммоль).
[0462] ER-897960 (13,0 мг, 0,029 ммоль, 34,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 1-амино-3-феноксипропан-2-ола (25,0 мг, 0,150 ммоль).
[0463] ER-897961 (9,7 мг, 0,022 ммоль, 25,8%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и 4-((1S,2R)-2-амино-1-гидроксипропил)фенола (32,0 мг, 0,191 ммоль).
[0464] ER-897962 (17,8 мг, 0,040 ммоль, 47,4%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (25 мг, 0,084 ммоль) и (1S,2S)-2-амино-1-фенилпропан-1,3-диола (26,0 мг, 0,155 ммоль).
[0465] ER-897963 (3,1 мг, 0,007 ммоль, 8,4%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и трет-бутил 4-(3-амино-2-гидроксипропил)пиперазин-1-карбоксилата (40,0 мг, 0,154 ммоль).
[0466] ER-897964 (12,7 мг, 0,036 ммоль, 21,5%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и трет-бутил 3-аминоазетидин-1-карбоксилата (27,0 мг, 0,157 ммоль).
[0467] ER-897965 (0,4 мг, 0,001 ммоль, 1,3%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-трет-бутил 3-аминопирролидин-1-карбоксилата (29,0 мг, 0,156 ммоль).
[0468] ER-897966 (0,4 мг, 0,001 ммоль, 1,3%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и (R)-трет-бутил 3-аминопирролидин-1-карбоксилата (29,0 мг, 0,156 ммоль).
[0469] ER-897967 (0,3 мг, 0,001 ммоль, 0,9%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-трет-бутил 3-аминопиперидин-1-карбоксилата (30,0 мг, 0,150 ммоль).
[0470] ER-897968 (0,4 мг, 0,001 ммоль, 1,3%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и (R)-трет-бутил 3-аминопиперидин-1-карбоксилата (30,0 мг, 0,150 ммоль).
[0471] ER-897969 (0,2 мг, 0,001 ммоль, 0,6%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и (S)-трет-бутил 2-(аминометил)пирролидин-1-карбоксилата (30,0 мг, 0,150 ммоль).
[0472] ER-897970 (3,4 мг, 0,008 ммоль, 9,4%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (25 мг, 0,084 ммоль) и трет-бутил (2-аминоэтил)(бензил)карбамата (38,0 мг, 0,152 ммоль).
[0473] ER-898560 (11,2 мг, 0,030 ммоль, 30,9%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (28,8 мг, 0,097 ммоль) и пиридин-2-амина (9,12 мг, 0,097 ммоль).
[0474] ER-898561 (12,8 мг, 0,033 ммоль, 44,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (22,1 мг, 0,074 ммоль) и 6-метилпиридин-2-амина (8,04 мг, 0,074 ммоль).
[0475] ER-898562 (7,4 мг, 0,020 ммоль, 18,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (31,2 мг, 0,105 ммоль) и 5-метилизоксазол-3-амина (10,30 мг, 0,105 ммоль).
[0476] ER-898563 (6,5 мг, 0,017 ммоль, 16,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30,7 мг, 0,103 ммоль) и гидрохлорида 2,2,2-трифторэтанамина (13,99 мг, 0,103 ммоль).
[0477] ER-898564 (1,4 мг, 0,004 ммоль, 3,8%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и 2,2-дифторэтанамина (8,18 мг, 0,101 ммоль).
[0478] ER-898565 (3,0 мг, 0,008 ммоль, 7,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30,2 мг, 0,102 ммоль) и 3,3,3-трифторпропан-1-амина (11,49 мг, 0,102 ммоль).
[0479] ER-898566 (14,6 мг, 0,037 ммоль, 20,4%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (53,7 мг, 0,181 ммоль) и N2,N2,2-триметилпропан-1,2-диамина (20,99 мг, 0,181 ммоль).
[0480] ER-898914 (31,6 мг, 0,092 ммоль, 28,8%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (95,2 мг, 0,320 ммоль) и гидрохлорида 2-фторэтанамина (31,9 мг, 0,32 ммоль).
[0481] ER-898915 (19,1 мг, 0,054 ммоль, 19,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (82,3 мг, 0,277 ммоль) и гидрохлорида 3-фторпропан-1-амина (31,4 мг, 0,277 ммоль).
[0482] ER-898916 (14,6 мг, 0,037 ммоль, 21,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (51,4 мг, 0,173 ммоль) и (R)-1,1,1-трифторпропан-2-амина (20 мг, 0,177 ммоль).
[0483] ER-898917 (27,6 мг, 0,066 ммоль, 20,4%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (95,7 мг, 0,322 ммоль) и (R)-1,1,1-трифтор-3-метилбутан-2-амина (45,4 мг, 0,322 ммоль).
[0484] ER-898918 (15,0 мг, 0,038 ммоль, 19,3%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (59,2 мг, 0,199 ммоль) и 1,3-диметил-1H-пиразол-5-амина (22,13 мг, 0,199 ммоль).
[0485] ER-898919 (13,1 мг, 0,035 ммоль, 10,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (98,1 мг, 0,33 ммоль) и 1-метил-1H-пиразол-5-амина (32,0 мг, 0,33 ммоль).
[0486] ER-898920 (20,1 мг, 0,060 ммоль, 21,4%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (83,3 мг, 0,280 ммоль) и гидрохлорида 2-аминоацетонитрила (25,9 мг, 0,28 ммоль).
[0487] ER-898921 (11,4 мг, 0,032 ммоль, 12,8%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (73,1 мг, 0,246 ммоль) и гидрохлорида циклопропанкарбонитрила (25,5 мг, 0,246 ммоль).
[0488] ER-898922 (25,4 мг, 0,067 ммоль, 33,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (59,0 мг, 0,198 ммоль) и 1,2,4-тиадиазол-5-амина (20,07 мг, 0,198 ммоль).
[0489] ER-898923 (12,6 мг, 0,032 ммоль, 16,5%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (57,6 мг, 0,194 ммоль) и 3-метил-1,2,4-тиадиазол-5-амина (22,31 мг, 0,194 ммоль).
[0490] ER-899017-HCl (328 мг, 0,769 ммоль, 65,3%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (350 мг, 1,177 ммоль) и трет-бутил 2,6-диазаспиро[3,4]октан-6-карбоксилата (250 мг, 1,177 ммоль).
[0491] ER-899019-HCl (26 мг, 0,059 ммоль, 58,2%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 4-(аминометил)-4-фторпиперидин-1-карбоксилата (23,4 мг, 0,101 ммоль).
[0492] ER-899020-HCl (25 мг, 0,062 ммоль, 61,4%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 3-(аминометил)азетидин-1-карбоксилата (18,8 мг, 0,101 ммоль).
[0493] ER-899023-HCl (25,5 мг, 0,060 ммоль, 59,4%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 1,6-диазаспиро[3,4]октан-6-карбоксилата (21,4 мг, 0,101 ммоль).
[0494] ER-899024-HCl (30,1 мг, 0,068 ммоль, 67,5%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 1,7-диазаспиро[4,4]нонан-1-карбоксилата (22,8 мг, 0,101 ммоль).
[0495] ER-899025-HCl (32,1 мг, 0,077 ммоль, 76%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и 4-амино-1-метил-1H-пиразол-3-карбоксамида (14,1 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0496] ER-899031-HCl (30,1 мг, 0,079 ммоль, 78%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и (3-метилоксетан-3-ил)метанамина (10,2 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0497] ER-899032-HCl (28,7 мг, 0,079 ммоль, 78%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и 2-оксо-6-азаспиро[3,3]гептана (10,0 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0498] ER-899033-HCl (32,8 мг, 0,093 ммоль, 92%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и оксетан-3-амина (7,4 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0499] ER-899034-HCl (26,4 мг, 0,067 ммоль, 66,2%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и дигидрохлорида оксетан-3,3-диилдиметанамина (19,1 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0500] ER-899035-HCl (25,9 мг, 0,071 ммоль, 70,1%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и оксетан-2-илметанамина (8,8 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0501] ER-899036-HCl (33,1 мг, 0,082 ммоль, 82%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил пиперазин-1-карбоксилата (18,8 мг, 0,101 ммоль).
[0502] ER-899191-HCl (30,7 мг, 0,081 ммоль, 80%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и азетидин-3-карбоксамида (10,1 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0503] ER-899192-HCl (34,4 мг, 0,078 ммоль, 77%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 2,7-диазаспиро[4,4]нонан-2-карбоксилата (22,8 мг, 0,101 ммоль).
[0504] ER-899193-HCl (38,1 мг, 0,081 ммоль, 80%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 3,9-диазаспиро[5,5]ундекан-3-карбоксилата (25,7 мг, 0,101 ммоль).
[0505] ER-899196-HCl (23,7 мг, 0,057 ммоль, 56,4%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и 4-аминоникотинамида (13,84 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0506] ER-899282-HCl (29,6 мг, 0,079 ммоль, 79%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и пиридин-4-амина (9,5 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0507] ER-899283-HCl (31,1 мг, 0,083 ммоль, 83%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и пиридин-3-амина (9,5 мг, 0,101 ммоль). Удаление защитной группы Boc не требовалось.
[0508] ER-899285-HCl (28,5 мг, 0,059 ммоль, 58,6%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 4-(4-амино-1H-пиразол-1-ил)пиперидин-1-карбоксилата (26,9 мг, 0,101 ммоль).
[0509] ER-899286-HCl (31,7 мг, 0,070 ммоль, 69,2%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 3-(4-амино-1H-пиразол-1-ил)азетидин-1-карбоксилата (24,0 мг, 0,101 ммоль).
[0510] ER-899287 (29,7 мг, 0,079 ммоль, 78%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и (1H-пиразол-5-ил)метанамина (9,80 мг, 0,101 ммоль).
[0511] ER-899288 (20,7 мг, 0,057 ммоль, 56,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и 1H-пиразол-4-амина (8,38 мг, 0,101 ммоль).
[0512] ER-899289 (35,5 мг, 0,078 ммоль, 77%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и (3-(трифторметил)пиридин-2-ил)метанамина (17,77 мг, 0,101 ммоль).
[0513] ER-899290 (15,0 мг, 0,034 ммоль, 33,9%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и 1-(пиридин-2-ил)этанамина (12,33 мг, 0,101 ммоль).
[0514] ER-899291 (26,1 мг, 0,067 ммоль, 66,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и пиридин-2-илметанамина (10,91 мг, 0,101 ммоль).
[0515] ER-899292 (31,0 мг, 0,077,2 ммоль, 76,4%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и (6-метилпиридин-2-ил)метанамина (12,3 мг, 0,101 ммоль).
[0516] ER-899293 (32,0 мг, 0,079 ммоль, 77,7%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и (1-метилпиперидин-2-ил)метанамина (12,9 мг, 0,101 ммоль).
[0517] ER-899294 (32,2 мг, 0,080 ммоль, 79%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (30 мг, 0,101 ммоль) и (3-метилпиридин-2-ил)метанамина (12,3 мг, 0,101 ммоль).
[0518] ER-899334 (51,3 мг, 0,140 ммоль, 11,7%-ный выход) получали способом, аналогичным способу получения ER-895473, исходя из соединения 38 (357,2 мг, 1,201 ммоль) и (R)-трет-бутил 2-(аминометил)пирролидин-1-карбоксилата (224 мг, 1,201 ммоль).
[0519] ER-899414-HCl (31,1 мг, 0,075 ммоль, 74,1%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и (R)-трет-бутил 2-(аминометил)пирролидин-1-карбоксилата (20,2 мг, 0,101 ммоль).
[0520] ER-899415-HCl (30,5 мг, 0,071 ммоль, 70,3%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и (S)-трет-бутил 2-(аминометил)пиперидин-1-карбоксилата (21,6 мг, 0,101 ммоль).
[0521] ER-899416-HCl (24,2 мг, 0,055 ммоль, 54,3%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 3-амино-8-азабицикло[3.2.1]октан-8-карбоксилата (22,84 мг, 0,101 ммоль).
[0522] ER-899417-HCl (32,8 мг, 0,076 ммоль, 76%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 4-аминоазепан-1-карбоксилата (21,62 мг, 0,101 ммоль).
[0523] ER-899418-HCl (29,6 мг, 0,072 ммоль, 70,9%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и (1R,5S,6S)-трет-бутил 6-амино-3-азабицикло[3,1,0]гексан-3-карбоксилата (20,0 мг, 0,101 ммоль).
[0524] ER-899476-HCl (31,0 мг, 0,068 ммоль, 67,4%-ный выход) или диастереомерную смесь ER-899742 и ER-899745 получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и 1:1 смеси (3R,4S)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата и (3S,4R)-трет-бутил 3-амино-4-фторпирролидин-1-карбоксилата (20,6 мг, 0,101 ммоль).
[0525] ER-899477-HCl (25,5 мг, 0,059 ммоль, 58,2%-ный выход) в виде диастереомерной смеси получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и смеси 1:1 (3R,4S)-трет-бутил 3-амино-4-фторпиперидин-1-карбоксилата и (3S,4R)-трет-бутил 3-амино-4-фторпиперидин-1-карбоксилата (22,02 мг, 0,101 ммоль).
[0526] ER-899479-HCl (30,5 мг, 0,071 ммоль, 70,6%-ный выход) получали способом, аналогичным способу получения ER-899742-HCl, исходя из соединения 38 (30 мг, 0,101 ммоль) и трет-бутил 6-амино-2-азаспиро[3,3]гептан-2-карбоксилата (21,42 мг, 0,101 ммоль).
[0527] ER-897383 (14,2 мг, 0,017 ммоль, 14,1%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (35,2 мг, 0,118 ммоль) и 2-аминоэтанола (10,9 мг, 0,178 ммоль). Вместо DMAC использовали ДМФ (1 мл).
[0528] ER-897385 (14,2 мг, 0,017 ммоль, 14,1%-ный выход) получали способом, аналогичным способу получения ER-897383, исходя из соединения 38 (35 мг, 0,118 ммоль) и 2-метоксиэтанамина (13,7 мг, 0,178 ммоль).
[0529] ER-897445 (87 мг, 0,245 ммоль, 72,9% общий выход) получали способом, аналогичным способу получения ER-897383, исходя из соединения 38 (100 мг, 0,336 ммоль) и (R)-2-((трет-бутилдифенилсилил)окси)пропан-1-амина (158 мг, 0,505 ммоль) с последующим удалением трет-бутилдифенилсилил-защитной группы с использованием 1M раствора TBAF в ТГФ (0,43 мл, 0,43 ммоль) в DCM (1,1 мл), перемешиванием в течение 1 часа при комнатной температуре. Желаемый продукт очищали на силикагеле (элюировали 80-100% EtOAc в гептане).
[0530] ER-897446 (67 мг, 0,189 ммоль, 75% общий выход) получали способом, аналогичным способу получения ER-897445, исходя из соединения 38 (75 мг, 0,252 ммоль) и (S)-1-((трет-бутилдифенилсилил)окси)пропан-2-амина (103 мг, 0,329 ммоль).
[0531] ER-897447 (78 мг, 0,220 ммоль, 65,5% общий выход) получали способом, аналогичным способу получения ER-897445, исходя из соединения 38 (100 мг, 0,336 ммоль) и (R)-1-((трет-бутилдифенилсилил)окси)пропан-2-амина (158 мг, 0,505 ммоль).
[0532] ER-897827 (48,2 мг, 0,131 ммоль, 64,9% общий выход) получали способом, аналогичным способу получения ER-897445, исходя из соединения 38 (60 мг, 0,202 ммоль) и (S)-1-((трет-бутилдифенилсилил)окси)бутан-2-амина (90 мг, 0,303 ммоль).
[0533] ER-897828 (49,4 мг, 0,129 ммоль, 64% общий выход) получали способом, аналогичным способу получения ER-897445, исходя из соединения 38 (60 мг, 0,202 ммоль) и (S)-1-((трет-бутилдифенилсилил)окси)-3-метилбутан-2-амина (103 мг, 0,303 ммоль).
[0534] ER-897829 (65,2 мг, 0,157 ммоль, 77,7% общий выход) получали способом, аналогичным способу получения ER-897445, исходя из соединения 38 (60 мг, 0,202 ммоль) и (S)-2-((трет-бутилдифенилсилил)окси)-1-фенилэтанамина (114 мг, 0,303 ммоль).
[0535] ER-897830 (60,2 мг, 0,145 ммоль, 71,8% общий выход) получали способом, аналогичным способу получения ER-897445, исходя из соединения 38 (60 мг, 0,202 ммоль) и (R)-2-((трет-бутилдифенилсилил)окси)-1-фенилэтанамина (114 мг, 0,303 ммоль).
[0536] ER-899722 (79 мг, 0,215 ммоль, 25,6%-ный выход) получали способом, аналогичным способу получения ER-895474, исходя из соединения 38 (250 мг, 0,841 ммоль) и 2-метилпропан-1,2-диамина (0,09 мл, 0,841 ммоль). Вместо DMAC использовали DCM (2 мл).
[0537] ER-899295 (27,5 мг, 0,0,71 ммоль, 70,4%-ный выход) получали способом, аналогичным способу получения ER-899722, исходя из соединения 38 (30 мг, 0,101 ммоль) и 3-амино-1H-пиразол-4-карбонитрила (10,9 мг, 0,101 ммоль).
[0538] ER-898946: Соединение 38 (50 мг, 0,168 ммоль), HATU (128 мг, 0,336 ммоль) и DIEA (0,176 мл, 1,009 ммоль) растворяли в смеси DCM:ДМФ (5 мл:2 мл), затем добавляли трет-бутил 4-аминопиперидин-1-карбоксилат (67,4 мг, 0,336 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 16 часов, после чего добавляли дополнительное количество HATU (128 мг, 0,336 ммоль) и трет-бутил 4-аминопиперидин-1-карбоксилат (67,4 мг, 0,336 ммоль) с последующим перемешиванием в течение еще 3 часов. После полного завершения реакции реакционную смесь концентрировали досуха, и сырой продукт очищали хроматографией (25 г силикагеля), элюируя 10% ацетонитрилом в DCM с получением чистого Boc-защищенного продукта. Boc-защищенный продукт растворяли в смеси DCM (4 мл)/ТФК (0,5 мл) и перемешивали при комнатной температуре в течение 3 часов, после чего растворитель удаляли при пониженном давлении, остаток растворяли в MeOH (10 мл) и добавляли 0,3 г MP-карбоната (pH>7). Полученную суспензию перемешивали при комнатной температуре в течение 30 мин, после чего полимерные гранулы фильтровали, промывали MeOH (10 мл), и растворитель концентрировали и сушили в высоком вакууме с получением ER-898946 (12 мг, 0,027 ммоль, 16,0%-ный выход).
[0539] ER-898694-2 HCl (67 мг, 0,155 ммоль, 46,1%-ный выход) получали способом, аналогичным способу получения ER-898946, исходя из соединения 38 (100 мг, 0,336 ммоль) и (S)-трет-бутил 2-(аминометил)морфолин-4-карбоксилата (95 мг, 0,437 ммоль) с последующим добавлением 3н раствора HCl в диоксане (31 мкл) с получением после концентрирования и сушки в высоком вакууме дигидрохлоридной соли.
[0540] Альтернативный способ получения ER-899742 и ER-899745: К перемешиваемому раствору соединения 38 (2,91 г, 9,79 ммоль) и TEA (1,706 мл, 12,24 ммоль) в DCM (50,0 мл) добавляли соединение 77 (2,000 г, 9,792 ммоль) и HOBT (2,65 г, 19,59 ммоль). Реакционную смесь охлаждали до 0°C и затем добавляли порциями EDC (3,75 г, 19,59 ммоль), после чего смесь нагревали до 40°C и перемешивали в течение 3 часов. Добавляли DCM (50 мл), и слои разделяли, после чего органический слой промывали насыщенным раствором хлорида аммония (20 мл), насыщенным раствором NaHCO3 (20 мл), насыщенным солевым раствором (20 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage SP4, элюируя смесью 10% MeOH:DCM). Диастереомеры разделяли, как описано выше, с получением соединения 78 (1,65 г, 3,41 ммоль, 34,8%-ный выход) и соединения 79 (1,49 г, 3,08 ммоль, 31,5%-ный выход).
[0541] Соединения 78 (470 мг, 0,97 ммоль) растворяли в перемешиваемом растворе DCM (5,0 мл) и затем добавляли ТФК (2,5 мл, 32,45 ммоль), после чего реакционную смесь нагревали до 49°C и перемешивали в течение 2 часов. После полного завершения реакции реакционную смесь азеотропно отгоняли досуха три раза с толуолом (по 2 мл) и затем сушили в вакууме с получением ER-899742-ТФК (543 мг, 0,97 ммоль, 100%-ный выход продукта, который содержал 1,5 молекулы ТФК на одну молекулу ER-899742 согласно данным масс-спектра) в виде твердого вещества оранжевого цвета.
[0542] Свободное основание ER-899742 может быть получено путем растворения соли ТФК в MeOH и добавления гидроксидной формы Amberlite IRA 400, и либо перемешивая в течение 10 мин, либо сразу достигая нейтрального значения рН. Полученную суспензию фильтровали, промывали МеОН два раза равными объемами, и объединенные фильтраты концентрировали до пастообразного состояния. Пасту азеотропно отгоняли два раза с толуолом с получением ER-899742 в форме свободного основания с количественным выходом. Затем HCl солевая форма может быть синтезирована способом, описанным выше.
[0543] ER-899742-HCl соль может быть получена непосредственно из соединения 78 обработкой 5,5н HCl в изопропаноле с получением желаемого продукта с количественным выходом после перемешивания в течение 2 час при комнатной температуре с последующей азеотропной отгонкой досуха 3 раза с толуолом и сушкой в высоком вакууме в виде 1,5 молекул HCl на одну молекулу ER-899742 согласно данным масс-спектрального анализа.
[0544] ER-899464-HCl: К перемешиваемому раствору соединения 38 (50 г, 168,2 ммоль) в ДМФ (250 мл) добавляли TEA (29,3 мл, 210,2 ммоль), затем 4-амино-1-метилпиперидин (28,8 г, 252,3 ммоль) и HOBT (45,4 г, 336,4 ммоль). Реакционную смесь охлаждали до 0°C, затем частями добавляли EDC (64,5 г, 336,4 ммоль). Реакционную смесь нагревали до 40°C и перемешивали в течение еще 6 часов. После полного завершения реакции реакционную смесь медленно выливали в сосуд, содержащий воду (1,5 л), при перемешивании, после чего добавляли DCM (1,5 л), перемешивали еще 10 мин. Два слоя разделяли, и водный слой экстрагировали три раза DCM (600 мл каждый). Объединенные органические слои концентрировали до раствора в ДМФ, затем концентрировали при 50°C в вакууме. Полученную взвесь желтого цвета разбавляли этиловым эфиром (1 л) и перемешивали в течение 15 мин, после чего твердое вещество собирали фильтрованием, затем слой на фильтре промывали этиловым эфиром (0,5 л) и сушили в вакууме с получением ER-899464 (44,9 г, 114 ммоль, 67,9%-ный выход). HCl соль получали растворением ER-899464 (22,8 г, 57,9 ммоль) в 10 объемах изопропанола и 1 объеме воды с последующим добавлением 1 эквивалента 5,5н раствора HCl в изопропаноле с получением осадка белого цвета. Твердое вещество фильтровали и промывали изопропанолом (2 об.), потом сушили в вакууме с получением ER-899464-HCl (20,3 г, 47,2 ммоль, 81,5%).
[0545] ER-899477 (78 мг, 0,196 ммоль, 58,3%-ный выход) получали способом, аналогичным способу получения ER-899464, исходя из соединения 38 (100 мг, 0,336 ммоль) и (3S,4R)-трет-бутил 3-амино-4-фторпиперидин-1-карбоксилата (220 мг, 1,009 ммоль).
[0546] ER-897968 (475 мг, 1,252 ммоль, 37,2%-ный выход) получали способом, аналогичным способу получения ER-899464, исходя из соединения 38 (1,00 г, 3,364 ммоль) и (R)-трет-бутил 3-аминопиперидин-1-карбоксилата (2,021 г, 10,091 ммоль).
[0547] ER-899018 (370 мг, 0,975 ммоль, 58,0%-ный выход) получали способом, аналогичным способу получения ER-899464, исходя из соединения 38 (500 мг, 1,682 ммоль) и трет-бутил (азетидин-3-илметил)(метил)карбамата (500 мг, 2,497 ммоль).
[0548] ER-899819 (62 мг, 0,158 ммоль, 31,3%-ный выход) получали способом, аналогичным способу получения ER-899464, исходя из соединения 38 (150 мг, 0,505 ммоль) и трет-бутил 3-аминоазепан-1-карбоксилата (324 мг, 1,514 ммоль).
[0549] ER-899416-HCl (53 мг, 0,120 ммоль, 35,7%-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (100 мг, 0,336 ммоль) и (1R,3S,5S)-трет-бутил 3-амино-8-азабицикло[3.2.1]октан-8-карбоксилата (76 мг, 0,336 ммоль).
[0550] ER-899417-HCl (56 мг, 0,130 ммоль, 38,7%-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (100 мг, 0,336 ммоль) и трет-бутил 4-аминоазепан-1-карбоксилата (144 мг, 0,673 ммоль).
[0551] ER-899285-HCl (52 мг, 0,108 ммоль, 32,1%-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (100 мг, 0,336 ммоль) и трет-бутил 4-(4-амино-1H-пиразол-1-ил)пиперидин-1-карбоксилата (179 мг, 0,673 ммоль)
[0552] ER-899021-HCl (62 мг, 0,140 ммоль, 41,7%-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (100 мг, 0,336 ммоль) и трет-бутил 2,6-диазаспиро[3,5]нонан-6-карбоксилата (152 мг, 0,673 ммоль).
[0553] ER-899619-HCl (36 мг, 0,084 ммоль, %-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (100 мг, 0,336 ммоль) и (S)-трет-бутил 3-(метиламино)пиперидин-1-карбоксилата (216 мг, 1,009 ммоль).
[0554] ER-899616-HCl (21 мг, 0,049 ммоль, %-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (100 мг, 0,336 ммоль) и (R)-трет-бутил 3-(метиламино)пиперидин-1-карбоксилата (216 мг, 1,009 ммоль).
[0555] ER-898566-HCl (272 мг, 0,630 ммоль, 37,5%-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (500 мг, 1,682 ммоль) и N2,N2,2-триметилпропан-1,2-диамина (586 мг, 5,045 ммоль).
[0556] ER-899618-HCl (4,8 мг, 0,011 ммоль, 3,2%-ный выход) получали способом, аналогичным способу получения ER-899464-HCl, исходя из соединения 38 (500 мг, 1,682 ммоль) и 4-аминопиколинамида (138 мг, 1,009 ммоль).
[0557] ER-899477 (78 мг, 0,196 ммоль, 58,3%-ный выход в виде диастереомерной смеси) получали способом, аналогичным способу получения ER-899464, исходя из соединения 38 (100 мг, 0,336 ммоль) и рацемической смеси (3S,4R)-трет-бутил 3-амино-4-фторпиперидин-1-карбоксилата и (3R,4S)-трет-бутил 3-амино-4-фторпиперидин-1-карбоксилата (220 мг, 1,009 ммоль).
[0558] ER-895415 в качестве примера соединения 41 по схеме 11: К перемешиваемому раствору соединения 38 (1,10 г, 3,70 ммоль) в DCM (5 мл) при 0°C в течение 2 мин по каплям добавляли оксалил хлорид (1,0 мл, 11,42 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 часа, после чего реакционную смесь концентрировали и сушили в вакууме. Высушенный сироп охлаждали до 0°C, затем медленно добавляли MeOH (5 мл) при перемешивании. После полного завершения реакции реакционную смесь концентрировали досуха, разбавляли DCM (10 мл), промывали насыщенным сульфитом натрия (3 мл), насыщенным солевым раствором (3 мл) и затем сушили над Na2SO4, фильтровали и концентрировали досуха. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (элюирование градиентом 0-50% EtOAc в гептане) с получением ER-895415 (894 мг, 2,81 ммоль, 76%-ный выход).
[0559] Получение примера соединения ER-899332 в соответствии со схемой 21:
[0560] Схема 21
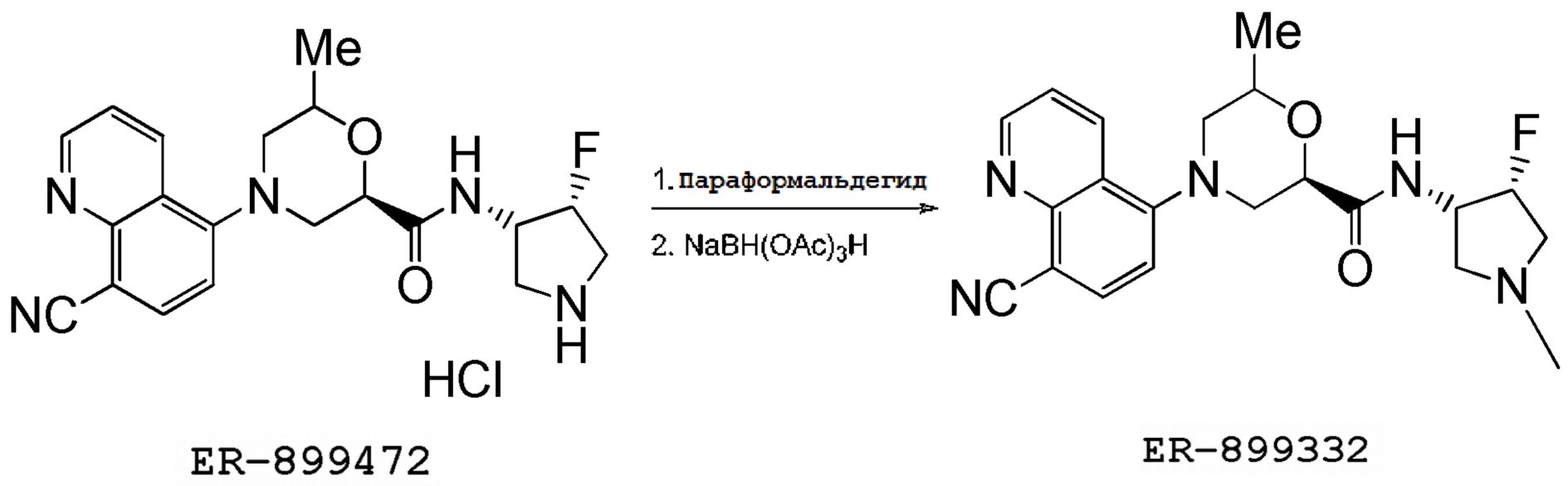
[0561]
[0562] Раствор ER-899472-HCl (49,8 мг, 0,119 ммоль) и параформальдегида (8,90 мг, 0,297 ммоль) в DCM (0,5 мл) перемешивали при комнатной температуре в течение 1 часа. Добавляли триацетоксиборгидрид натрия (62,8 мг, 0,297 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 2 дней. После удаления растворителей, неочищенный продукт хроматографировали на силикагеле (15% MeOH в DCM) с получением ER-899332 (8,16 мг, 0,021 ммоль, 18,3%-ный выход).
[0563] ER-899457 (50 мг, 0,117 ммоль, 97%-ный выход) получали способом, аналогичным способу получения ER-899332, исходя из ER-899336 (50 мг, 0,122 ммоль).
[0564] ER-899836: Перемешиваемый раствор ER-899477 (76 мг, 0,191 ммоль) в 37%-ном растворе формальдегида в воде (0,5 г, 16,652 ммоль) и муравьиной кислоте (0,5 мл, 13,036 ммоль) нагревали при 80°C в течение 3 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры. Смесь азеотропно отгоняли досуха четыре раза с толуолом (по 2 мл каждый раз), и полученный остаток растворяли в MeOH (5 мл) и затем добавляли гидроксидную форму Amberlite IRA400 (2 г) и перемешивали в течение 10 мин. Добавляли дополнительное количество Amberlite IRA400 при перемешивании до тех пор, пока значение pH не становилось нейтральным, после чего суспензию фильтровали, концентрировали и азеотропно отгоняли два раза с толуолом (по 2 мл). Затем сырое вещество очищали на силикагеле (Biotage SNAP Ultra, 25 г, элюируя смесью 1-40% MeOH в DCM) с получением после объединения желаемых фракций, концентрирования и сушки в вакууме ER-899836 (55 мг, 0,134 ммоль, 69,9%-ный выход).
[0565] ER-899836 (50 мг, 0,124 ммоль) растворяли в ацетонитриле (1 мл) с последующим добавлением 2M раствора HCl в диэтиловом эфире (0,062 мл, 0,124 ммоль) и перемешивали при комнатной температуре в течение 30 мин. Полученный раствор оранжевого цвета концентрировали досуха и помещали в высокий вакуум на ночь с получением ER-899836-HCl с количественным выходом.
[0566] ER-899688-HCl (381 мг, 0,886 ммоль, 88,4%-ный выход) получали способом, аналогичным способу получения ER-899836-HCl, исходя из ER-897968 (600 мг, 1,58 ммоль).
[0567] ER-899820-HCl (45 мг, 0,110 ммоль, 69,9%-ный выход) получали способом, аналогичным способу получения ER-899836-HCl, исходя из ER-899819 (62 мг, 0,158 ммоль).
[0568] ER-899337 (35,6 мг, 0,087 ммоль, 24%-ный выход) получали способом, аналогичным способу получения ER-899836, исходя из ER-897968 (142 мг, 0,361 ммоль) в виде свободного основания.
[0569] ER-899835 (29 мг, 0,071 ммоль, 81%-ный выход) получали способом, аналогичным способу получения ER-899836, исходя из ER-899718 (34 мг, 0,086 ммоль) в виде свободного основания.
[0570] ER-899837 (35,6 мг, 0,087 ммоль, 24,2%-ный выход) получали способом, аналогичным способу получения ER-899836, исходя из ER-899417 (142 мг, 0,361 ммоль) в виде свободного основания.
[0571] ER-898707-формиат (17 мг, 0,0,36 ммоль, 78%-ный выход) получали способом, аналогичным способу получения ER-899836, исходя из ER-898694 (20 мг, 0,046 ммоль), сохраняя в виде формиатной соли вместо преобразования в НСl соль, как описано выше.
[0572] Другие примеры получения соединений, изображенные общей структурой 39 или 40 на схеме 11
ER-895472: К охлажденному раствору соединения 38 (22,7 мг, 0,076 ммоль) и TEA (12,8 мкл, 0,092 ммоль) в ТГФ при -15°C добавляли этилхлорформиат (8,1 мкл, 0,084 ммоль). После перемешивания в течение 1,5 часа добавляли гидроксид аммония (6,0 мкл, 0,153 ммоль), затем продолжали перемешивание в течение еще 2 часа при -10°C. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали еще 2 час. После полного завершения реакции реакционную смесь гасили добавлением насыщенного раствора NaHCO3 (5 мл) с последующим экстрагированием водной фазы 3 раза EtOAc (по 5 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали с получением масла светло-желтого цвета. Сырой продукт очищали методом ВЭЖХ с обращенной фазой на колонке C-18 (колонка Water's X-Bridge C18 19×100 мм; использовали градиент смеси ацетонитрил/вода с 0,1% муравьиной кислотой) с получением ER-895472 (6,2 мг, 0,021 ммоль, 27,5%-ный выход).
[0573] ER-899122: К охлажденному раствору соединения 38 (80 мг, 0,24 ммоль) и 4-метилморфолина (32 мкл, 0,288 ммоль) в ТГФ (4 мл) при 0°C добавляли изопропил хлорформиат (38 мкл, 0,084 ммоль). После перемешивания в течение 30 мин добавляли тетрагидропиран-4-иламин (29,1 мг, 0,288 ммоль), после чего продолжали перемешивание в течение еще 2 часа при -10°C. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали еще 16 часов. После полного завершения реакции реакционную смесь гасили добавлением насыщенного раствора NaHCO3 (5 мл), затем водную фазу экстрагировали 3 раза EtOAc (по 5 мл каждый раз). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали с получением масла светло-желтого цвета. После концентрирования желаемых фракций досуха и помещения продукта в высокий вакуум, сырой продукт очищали на силикагеле (25 г), элюируя линейным градиентом 80-100% EtOAc в гептане с получением ER-899122 (40 мг, 0,100 ммоль, 41,7%-ный выход)
[0574] ER-899121 (40 мг, 0,104 ммоль, 43,3%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и 3-аминометил-оксетана (25,06 мг, 0,288 ммоль).
[0575] ER-899123 (40 мг, 0,109 ммоль, 45,5%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и 3-аминотетрагидрофурана (25,06 мг, 0,288 ммоль).
[0576] ER-899140 (20 мг, 0,051 ммоль, 21,3%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и трет-бутил (2-аминоэтил)(метил)карбамата (50,1 мг, 0,288 ммоль), после удаления Вос-группы с использованием ТФК и нейтрализации MP-карбонатом, как описано.
[0577] ER-899151 (15 мг, 0,035 ммоль, 14,6%-ный выход) и ER-899152 (15 мг, 0,035 ммоль, 14,6%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и 3-амино-1,1,1-трифтор-2-пропанола (37,1 мг, 0,288 ммоль) в виде смеси стереоизомеров. Два продукта разделяли методом хроматографии, описанным для ER-899122. Стереоизомерные центры определяли произвольным образом и не были определены однозначно.
[0578] ER-899153 (32 мг, 0,083 ммоль, 34,4%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и гидрохлорида метилового эфира глицина (36,1 мг, 0,288 ммоль).
[0579] ER-899154 (16 мг, 0,041 ммоль, 17,3%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и диметилэтилендиамина (31,6 мкл, 0,288 ммоль).
[0580] ER-899159 (14 мг, 0,033 ммоль, 13,8%-ный выход) и ER-899160 (13 мг, 0,031 ммоль, 12,8%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и гидрохлорида 4-амино-1,1,1-трифторбутан-2-ола (51,6 мг, 0,288 ммоль) в виде смеси стереизомеров. Два продукта разделяли методом хроматографии, описанным для ER-899122. Стереоизомерные центры определяли произвольным образом и не были определены однозначно.
[0581] ER-899161 (13 мг, 0,031 ммоль, 12,9%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,24 ммоль) и дигидрохлорида 4,4,4-трифторбутан-1,3-диамина (61,9 мг, 0,288 ммоль) в виде диастереомерной смеси.
[0582] ER-899152 (9 мг, 0,024 ммоль, 37,0%-ный выход) получали путем растворения ER-899153 (24 мг, 0,65 ммоль) в MeOH (2 мл) и воде (0,5 мл) с последующим добавлением гидроксида лития (3,12 мг, 13,0 ммоль). Реакционную смесь перемешивали в течение 16 часов при комнатной температуре, затем, после полного завершения реакции, реакционную смесь подкисляли 3н раствором HCl до pH 3, потом экстрагировали 3 раза EtOAc (по 10 мл), органические слои объединяли, сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на колонке C-18 для ВЭЖХ с обращенной фазой, элюируя линейным градиентом 10%-90% ацетонитрила в воде с 0,1% муравьиной кислотой, и концентрируя продукт желаемого пика с последующей сушкой в высоком вакууме.
[0583] ER-899278 (20 мг, 0,051 ммоль, 33,8%-ный выход) получали способом, аналогичным способу получения ER-899140, исходя из соединения 38 (50 мг, 0,15 ммоль) и (R)-трет-бутил 2-(аминометил)морфолин-4-карбоксилата (48,6 мг, 0,225 ммоль).
[0584] ER-899366 (70 мг, 0,171 ммоль, 42,4%-ный выход) получали способом, аналогичным способу получения ER-899140, исходя из соединения 38 (120 мг, 0,404 ммоль) и (2S,6R)-трет-бутил 2-(аминометил)-6-метилморфолин-4-карбоксилата (112 мг, 0,484 ммоль).
[0585] ER-899367 (40 мг, 0,102 ммоль, 38%-ный выход) получали способом, аналогичным способу получения ER-899140, исходя из соединения 38 (80 мг, 0,269 ммоль) и трет-бутил гексагидропирроло[3,4-c]пиррол-2(1H)-карбоксилата (68,5 мг, 0,373 ммоль).
[0586] ER-899459 (30 мг, 0,074 ммоль, 31,3%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (70 мг, 0,235 ммоль) и N,N-диметилпиперидин-4-амина (36,2 мг, 0,283 ммоль).
[0587] ER-899464 (20 мг, 0,051 ммоль, 18,9%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (80 мг, 0,269 ммоль) и 1-метилпиперидин-4-амина (36,9 мг, 0,323 ммоль).
[0588] ER-899588 (40 мг, 0,105 ммоль, 44,8%-ный выход) получали способом, аналогичным способу получения ER-899140, исходя из соединения 38 (70 мг, 0,235 ммоль) и трет-бутил пиперидин-4-илкарбамата (56,6 мг, 0,283 ммоль).
[0589] ER-899608 (40 мг, 0,102 ммоль, 37,8%-ный выход) получали способом, аналогичным способу получения ER-899140, исходя из соединения 38 (70 мг, 0,235 ммоль) и трет-бутил (4-метилпиперидин-4-ил)карбамата (63,4 мг, 0,296 ммоль).
[0590] ER-899680 (40 мг, 0,098 ммоль, 19,2%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (100 мг, 0,336 ммоль) и 1-этилпиперидин-3-амина (43,1 мг, 0,336 ммоль).
[0591] ER-899431 (53 мг, 0,103 ммоль, 51,3%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (99 мг, 0,333 ммоль) и метиламина (2M раствор в ТГФ) (1,50 мл, 3,00 ммоль).
[0592] ER-899626 (29 мг, 0,071 ммоль, 35,3%-ный выход) получали способом, аналогичным способу получения ER-899122, исходя из соединения 38 (60 мг, 0,202 ммоль) и 4-амино-1-этил пиперидина (25,9 мг, 0,202 ммоль).
[0593] ER-899718 (32 мг, 0,081 ммоль, 40,1%-ный выход) получали способом, аналогичным способу получения ER-899140, исходя из соединения 38 (60 мг, 0,202 ммоль) и трет-бутил 4-амино-4-метилпиперидин-1-карбоксилата (47,6 мг, 0,222 ммоль).
[0594] Дополнительные соединения по примерам: Модификация общей структуры 39 по схеме 11:
[0595] Схема 22
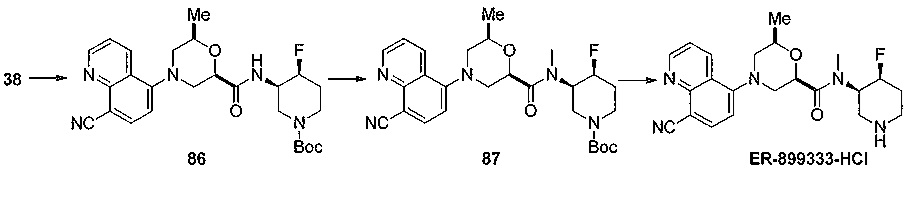
[0596]
[0597] ER-899333-HCl: К перемешиваемому раствору соединения 38 (58,2 мг, 0,196 ммоль) и HBTU (89 мг, 0,235 ммоль) в DCM (1,94 мл) добавляли DIEA (137 мкл, 0,783 ммоль), затем (3R,4S)-трет-бутил 3-амино-4-фторпиперидин-1-карбоксилат (42,7 мг, 0,196 ммоль). Реакционную смесь перемешивали в течение ночи, потом? после полного завершения реакции? реакционную смесь концентрировали и разбавляли EtOAc (10 мл). Органический раствор промывали 2н водным раствором лимонной кислоты, насыщенным раствором NaHCO3, сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (50 г, элюируя смесью 40-100% EtOAc в гептане, 20 объемов колонки) с получением соединения 86 (58,5 мг, 0,118 ммоль, 56,2%-ный выход) в виде твердого вещества светло-желтого цвета.
[0598] К перемешиваемому раствору соединения 86 (58,8 мг, 0,118 ммоль) и метилйодида (7,39 мкл, 0,118 ммоль) в ДМФ (1 мл), охлажденному до 0°C, добавляли NaH (5,20 мг, 0,13 ммоль, дисперсия в масле). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3,5 часов. После полного завершения реакции реакционную смесь охлаждали на бане с ледяной водой и гасили медленным добавлением насыщенного раствора хлорида аммония (5 мл), затем воды (5 мл) и экстрагировали два раза EtOAc (по 10 мл). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (25 г, элюируя 40-100% градиентом EtOAc в гептане, 20 объемов колонки) с получением соединения 87 (42,9 мг, 0,084 ммоль, 71,0%) в виде твердого вещества светло-желтого цвета.
[0599] К перемешиваемому раствору соединения 87 (42,9 мг, 0,084 ммоль) в EtOAc (1 мл) добавляли 4,0 н HCl в 1,4-диоксане (0,419 мл, 1,677 ммоль) и затем перемешивали при комнатной температуре в течение 1 часа, затем, после полного завершения реакции, реакционную смесь концентрировали и сушили в вакууме с получением ER-89933-HCl (23,4 мг, 0,054 ммоль, 62,3%).
[0600] Схема 23
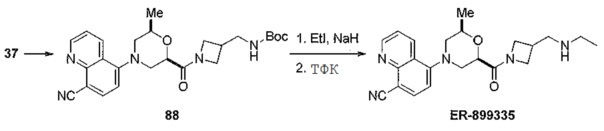
[0601]
[0602] ER-8999335: К перемешиваемому раствору соединения 38 (357,2 мг, 1,201 ммоль) и HBTU (547 мг, 1,442 ммоль) в DCM (10 мл) добавляли DIEA (0,84 мл, 4,806 ммоль) и трет-бутил(азетидин-3-илметил)карбамат (224 мг, 1,201 ммоль). Реакционную смесь перемешивали в течение 3 часов, затем, после полного завершения реакции, реакционную смесь концентрировали, растворяли в EtOAc (25 мл) и промывали 2н водным раствором лимонной кислоты (20 мл), насыщенным раствором NaНСО3 (20 мл) и сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (40 г, элюируя смесью 50-100% EtOAc/гептан, 20 объемов колонки) с получением соединения 88 (181,6 мг, 0,390 ммоль, 32,5%-ный выход) в виде твердого вещества светло-желтого цвета.
[0603] К перемешиваемому раствору соединения 88 (52,6 мг, 0,113 ммоль) и этилйодида (10,50 мкл, 0,13 ммоль) в ДМФ (1,0 мл, 12,915 ммоль) при 0°C добавляли 60%-ный гидрид натрия (5,87 мг, 0,147 ммоль), после чего реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 6 часов. После полного завершения реакции реакционную смесь охлаждали до 0°C и гасили медленным добавлением насыщенного раствора NH4Cl (5 мл), и затем разбавляли водой (5 мл) и экстрагировали два раза EtOAc (по 10 мл). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (25 г, элюируя смесью 70-100% EtOAc в гептане, 20 объемов колонки) с получением Boc-защищенного промежуточного соединения, которое использовали на следующей стадии. Группу Boc удаляли растворением промежуточного соединения в EtOAc (1 мл) и добавлением ТФК (0,5 мл), и затем перемешивали в течение 1 часа. После полного завершения реакции реакционную смесь концентрировали досуха, растворяли в DCM (10 мл), промывали 2 раза насыщенным NaHCO3, сушили над безводным Na2SO4, фильтровали, концентрировали и сушили в высоком вакууме с получением ER-899335 (4,1 мг, 0,010, ммоль, 9,3%) в виде твердого вещества светло-желтого цвета.
[0604] Схема 24
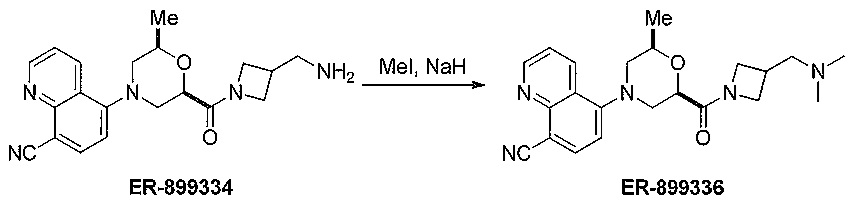
[0605]
[0606] ER-899336: К перемешиваемому раствору ER-899334 (35,4 мг, 0,097 ммоль) и йодметана (0,013 мл, 0,213 ммоль) в ДМФ (1 мл) при 0°C добавляли 60%-ный гидрид натрия (9,69 мг, 0,242 ммоль), после чего реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. После полного завершения реакции реакционную смесь охлаждали до 0°C и гасили медленным добавлением насыщенного раствора NH4Cl (5 мл) и затем разбавляли водой (5 мл) и экстрагировали два раза с помощью EtOAc (по 10 мл). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. После сбора желаемого вещества, концентрирования и сушки в высоком вакууме, сырой продукт очищали на силикагеле (25 г, элюируя смесью 70-100% EtOAc в гептане, 20 объемов колонки) с получением ER-899336 (5,2 мг, 0,013 ммоль, 13,6%-ный выход).
[0607] Схема 25
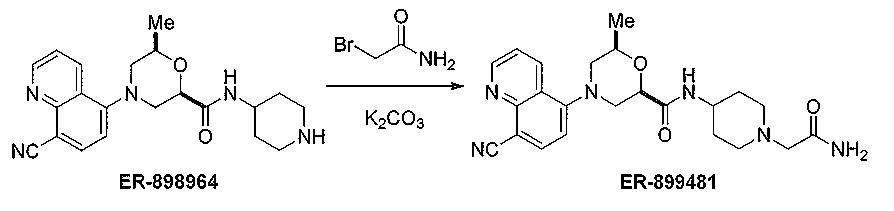
[0608]
[0609] ER-899481: К перемешиваемому раствору ER-898946 (60 мг, 0,158 ммоль) в ацетонитриле (10 мл) добавляли K2CO3 (87 мг, 0,632 ммоль) и 2-бромацетамид (43,6 мг, 0,316 ммоль). Реакционную смесь нагревали до 60°C и перемешивали в течение 16 часов, затем, после полного завершения реакции, реакционную смесь фильтровали. После сбора желаемого вещества, концентрирования и сушки в высоком вакууме, полученный раствор концентрировали, и сырой продукт очищали на ВЭЖХ-колонке C-18 (элюируя 10%-50% ацетонитрилом в воде с 0,1% муравьиной кислотой) с получением ER-899481 (43 мг, 0,099 ммоль, 62,3%-ный выход).
[0610] ER-885612 в качестве примера соединения 42 по схеме 12: К охлажденному перемешиваемому раствору соединения 13 (25 мг, 0,088 ммоль) в ДМФ (0,5 мл) при 0°C добавляли NaH (3,5 мг, 0,088 ммоль, 60%-ная масляная дисперсия), затем метилйодид (16,5 мкл, 0,265 ммоль). Реакционную смесь перемешивали еще 20 мин, после чего медленно добавляли воду (1 мл). Гашеную реакционную смесь экстрагировали два раза DCM (по 2 мл), сушили над MgSO4, фильтровали и концентрировали досуха. После объединения желаемых объединенных фракций, концентрирования и сушки в вакууме, очистка на колонке для препаративной ВЭЖХ с обращенной фазой (колонка X-Bridge C18 19×100 мм; элюируя 0-50% ацетонитрилом в воде с 0,05% ТФК) давала ER-885612 (16,9 мг, 0,057 ммоль, 64,6%-ный выход).
[0611] ER-885807 (15,2 мг, 0,049 ммоль, 55,7%-ный выход) получали способом, аналогичным способу получения ER-885612, исходя из соединения 13 (25 мг, 0,088 ммоль) и йодэтана (20,6 мг, 0,132 ммоль).
[0612] ER-885808 (8,2 мг, 0,025 ммоль, 28,6%-ный выход) получали способом, аналогичным способу получения ER-885612, исходя из соединения 13 (25 мг, 0,088 ммоль) и изопропилйодида (22,5 мг, 0,132 ммоль).
[0613] ER-885892 (3,1 мг, 0,009 ммоль, 10,4%-ный выход) получали способом, аналогичным способу получения ER-885612, исходя из соединения 13 (25 мг, 0,088 ммоль) и 1-йод-2-метилпропана (15,2 мкл, 0,132 ммоль).
[0614] ER-885929 (17,5 мг, 0,048 ммоль, 54,6%-ный выход) получали способом, аналогичным способу получения ER-885612, исходя из соединения 13 (25 мг, 0,088 ммоль) и 1-йодгексана (37,4 мг, 0,176 ммоль).
[0615] ER-885930 (7,9 мг, 0,021 ммоль, 23,7%-ный выход) получали способом, аналогичным способу получения ER-885612, исходя из соединения 13 (25 мг, 0,088 ммоль) и циклогексилметил бромида (31,3 мг, 0,177 ммоль).
[0616] ER-895324 (35,2 мг, 0,098 ммоль, 54,7%-ный выход) получали способом, аналогичным способу получения ER-885612, исходя из соединения 13 (50,6 мг, 0,179 ммоль) и 2-бромпиридина (20,4 мкл, 0,214 ммоль). Вместо ДМФ использовали ТГФ (1 мл).
[0617] ER-895325 (54,2 мг, 0,150 ммоль, 83,8%-ный выход) получали способом, аналогичным способу получения ER-893324, исходя из соединения 13 (50,6 мг, 0,179 ммоль) и 2-бромпиримидина (57 мг, 0,359 ммоль).
[0618] ER-894552 (5 мг, 0,014 ммоль, 19,2%-ный выход) получали способом, аналогичным способу получения ER-893324, исходя из соединения 13 (20,4 мг, 0,072 ммоль) и 2-хлорпиразина (8,3 мг, 0,0,072 ммоль).
[0619] ER-886137: В сухой сосуд для проведения микроволновых реакций добавляли карбонат цезия (172,5 мг, 0,529 ммоль), йодид меди (I) (33,6 мг, 0,176 ммоль), 1,1'-бинафтил-2,2'-диамин (50,2 мг, 0,177 ммоль), 2-йод-1,3-диметилбензол (123 мг, 0,53 ммоль) в ДМСО (0,3 мл), затем соединение 13 (50 мг, 0,177 ммоль). Реакционную смесь нагревали в микроволновой печи при 110°C в течение 12 часов, после чего смесь напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм; используя градиент 0-50% ацетонитрила в воде с 0,05% ТФК) для очистки элюированием с получением сырого продукта. После объединения желаемых объединенных фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage элюируя градиентом 25% EtOAc в гептане - 100% EtOAc) с получением ER-886137 (12,1 мг, 0,031 ммоль, 17,6%-ный выход).
[0620] ER-886514: К перемешиваемой суспензии соединения 14 (10,5 мг, 0,024 ммоль) и карбоната калия (30 мг, 0,217 ммоль) в толуоле (1 мл) добавляли фенол (24,4 мг, 0,259 ммоль). Реакционную смесь нагревали в микроволновой печи при 150°C в течение 5 часов, после чего сырую смесь фильтровали и напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм; используя градиент 0-50% ацетонитрила в воде с 0,05% ТФК) с получением после объединения желаемых объединенных фракций, концентрирования и сушки в вакууме ER-886514 (4,5 мг, 0,013 ммоль, 54,1%-ный выход).
[0621] ER-886515 (3,2 мг, 0,009 ммоль, 37,6%-ный выход) получали способом, аналогичным способу получения ER-886514, исходя из соединения 14 (10,6 мг, 0,024 ммоль) и 3-метилфенола (28,1 мг, 0,260 ммоль).
[0622] ER-886516 (4,7 мг, 0,013 ммоль, 52,4%-ный выход) получали способом, аналогичным способу получения ER-886514, исходя из соединения 14 (10,6 мг, 0,024 ммоль) и 4-метилфенола (28,1 мг, 0,260 ммоль).
[0623] ER-886605 (7,9 мг, 0,020 ммоль, 85,1%-ный выход) получали способом, аналогичным способу получения ER-886514, исходя из соединения 14 (10,3 мг, 0,024 ммоль) и 3,4-дифторфенола (20 мг, 0,154 ммоль). В этом способе получения вместо толуола использовали 1-метилпирролидинон (1 мл).
[0624] ER-886606 (7,2 мг, 0,019 ммоль, 81,2%-ный выход) получали способом, аналогичным способу получения ER-886605, исходя из соединения 14 (10,3 мг, 0,024 ммоль) и 3-фторфенола (13,2 мг, 0,118 ммоль).
[0625] ER-886624 (5,1 мг, 0,014 ммоль, 59%-ный выход) получали способом, аналогичным способу получения ER-886605, исходя из соединения 14 (10 мг, 0,023 ммоль) и 2-фторфенола (10 мг, 0,089 ммоль).
[0626] ER-886786 (8,2 мг, 0,022 ммоль, 76,9%-ный выход) получали способом, аналогичным способу получения ER-886605, исходя из соединения 14 (12,5 мг, 0,029 ммоль) и 2-метилфенола (28,1 мг, 0,260 ммоль).
[0627] Другие примеры использования соединения 13 или ER-885493 в качестве исходного вещества:
[0628] ER-885621: К перемешиваемому раствору бис(2-метоксиэтил)аминосеры трифторида (24,4 мкл, 0,132 ммоль) в DCM (0,1 мл), охлаждаемому до -78°C в атмосфере N2, добавляли соединение 13 (25 мг, 0,088 ммоль) в DCM (0,1 мл). Реакционную смесь оставляли нагреваться до -50°C и перемешивали в течение 0,5 часов, нагревали до 0°C и перемешивали в течение 1,5 час. Реакционную смесь нагревали до 5°C и перемешивали в течение 2 часов, после чего по каплям добавляли насыщенный раствор NaHCO3 в воде до тех пор, пока значение pH не достигало 10. Слои разделяли, и органический слой промывали два раза водой (1 мл), сушили над MgSO4, фильтровали и концентрировали досуха. После объединения желаемых объединенных фракций, концентрирования и сушки в вакууме очистка на колонке для препаративной ВЭЖХ с обращенной фазой, элюируя 0-50% ацетонитрилом в воде, обеспечивала ER-885621 (12,5 мг, 0,044 ммоль, 49,8%-ный выход).
[0629] ER-885906: Перемешиваемый раствор соединения 13 (85,5 мг, 0,302 ммоль) в тионилхлориде (2 мл) нагревали при 85°C в течение 24 часов, после чего удаляли избыточное количество тионилхлорида и сырой продукт очищали на колонке для препаративной ВЭЖХ с обращенной фазой, элюируя 0-50% ацетонитрилом в воде, с получением после объединения желаемых объединенных фракций, концентрирования и сушки в вакууме ER-885906 (4,3 мг, 0,014 ммоль, 4,7%-ный выход).
[0630] Получение ER-886431 и ER-886480 в качестве примеров соединения 44, схема 13
[0631] Соединение 43 или ER-886250: К перемешиваемому раствору соединения 13 (200 мг, 0,706 ммоль) в DCM (5 мл) и пиридина (0,114 мл, 1,4 ммоль) при 0°C в атмосфере азота добавляли перйодинан Десса-Мартина (359 мг, 0,846 ммоль), после чего реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Было обнаружено, что реакция полностью не завершилась, поэтому добавляли дополнительное количество перйодинана Десса-Мартина (359 мг, 0,846 ммоль) и пиридина (0,114 мл, 1,4 ммоль), затем перемешивали в течение еще 30 мин. После полного завершения реакции реакционную смесь промывали насыщенным водным раствором NaHCO3 (4 мл) с 10% водным раствором тиосульфата натрия (2 мл). Смесь перемешивали в течение 30 мин, после чего смесь экстрагировали три раза DCM (по 4 мл каждый раз). Объединенные органические слои промывали насыщенным солевым раствором (4 мл), сушили над Na2SO4, фильтровали и концентрировали. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage SP4, 25 г, элюируя смесью 10-100% EtOAc в гептане) с получением 5-((2R,6R)-2-формил-6-метилморфолинo)хинолин-8-карбонитрила 43 или ER-886250 (110 мг, 0,391 ммоль, 55,4%-ный выход) в виде сиропа желтого цвета.
[0632] К перемешиваемому раствору 43 (25 мг, 0,089 ммоль) в ТГФ (0,5 мл) при 0°C в атмосфере азота добавляли по каплям в течение 2 минут 1M раствор винил магний бромида (0,098 мл, 0,098 ммоль) в ТГФ. Реакционную смесь перемешивали при 0°C в течение 2 часов, после чего медленно добавляли насыщенный раствор хлорида аммония (0,5 мл), затем воду (0,25 мл). Гашеную реакционную смесь нагревали до комнатной температуры, перемешивали в течение еще 10 мин и экстрагировали два раза EtOAc (по 2 мл). Объединенные органические слои промывали насыщенным солевым раствором (1 мл), сушили над Na2SO4, фильтровали и концентрировали. Сырой продукт очищали на пластинах для препаративной ТСХ (пластины Merck Silica Gel 60 F254, 2 20×20 см, элюируя EtOAc) с получением после раздельного элюирования желаемых фракций на силикагеле, концентрирования и сушки в вакууме ER-886431 (3 мг, 0,010 ммоль, 11,2%-ный выход, Rf=0,75, EtOAc) и ER-886480 (3 мг, 0,0,10 ммоль, 11,2%-ный выход, Rf=0,80. EtOAc) в виде сиропа желтого цвета. Для обоих примеров стереохимию свободной спиртовой группы определяли произвольным образом.
[0633] ER-886530 (11 мг, 0,032 ммоль, 36,4%-ный выход, Rf=0,80, EtOAc) и ER-886531 (3 мг, 0,0,10 ммоль, 11,2%-ный выход, Rf=0,75, EtOAc) получали способом, аналогичным способу получения ER-886431 и ER-886480, исходя из соединения 43 (25 мг, 0,089 ммоль) и 2M раствора хлорида бутилмагния в ТГФ (0,131 мл, 0,262 ммоль). Сырой продукт очищали на силикагеле (Biotage SP4, 25 г, элюируя смесью 20-100% EtOAc в гептане. Для обоих примеров стереохимию свободной спиртовой группы определяли произвольным образом.
[0634] ER-886532 (4 мг, 0,011 ммоль, 6,3%-ный выход, Rf=0,80, EtOAc) и ER-886533 (4 мг, 0,011 ммоль, 6,3%-ный выход, Rf=0,75, EtOAc) получали способом, аналогичным способу получения ER-886530 и ER-886531, исходя из соединения 43 (49 мг, 0,174 ммоль) и 1,3M раствора хлорида циклогексилмагния в ТГФ (0,20 мл, 0,260 ммоль). Для обоих примеров стереохимию свободной спиртовой группы определяли произвольным образом.
[0635] ER-886567 (3,6 мг, 0,009 ммоль, 5,3%-ный выход, Rf=0,80, EtOAc) и ER-886568 (8,6 мг, 0,022 ммоль, 12,8%-ный выход, Rf=0,75, EtOAc) получали способом, аналогичным способу получения ER-886530 и ER-886531, исходя из соединения 43 (49 мг, 0,174 ммоль) и 1M раствора хлорида фенетилмагния в ТГФ (0,26 мл, 0,260 ммоль). Для обоих примеров стереохимию свободной спиртовой группы определяли произвольным образом.
[0636] ER-886520 (26 мг, 0,084 ммоль, 49,1%-ный выход, Rf=0,80, EtOAc) получали способом, аналогичным способу получения ER-886530 и ER-886531, исходя из соединения 43 (48 мг, 0,171 ммоль) и 2M раствора хлорида этилмагния в ТГФ (0,128 мл, 0,256 ммоль). Для дополнительных исследований использовали диастереомерную смесь.
[0637] ER-886564 и ER-886565 по схеме 26
[0638] Схема 26
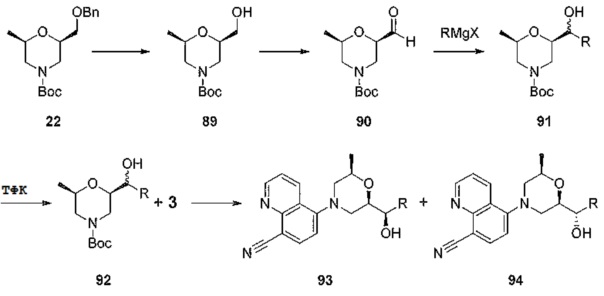
[0639]
[0640] К перемешиваемому раствору соединения 22 (2,51 г, 7,8 ммоль) в EtOH (40 мл) добавляли 10% палладий на активированном угле в 50% воде (1,66 г), затем несколько раз сосуд заполняли газообразным водородом. Реакционную смесь выдерживали в атмосфере водорода (баллон, находящийся под давлением) при 40°C и перемешивали в течение 16 часов, после чего реакционную смесь продували газообразным азотом несколько раз при вакуумировании системы между очистками с помощью вакуумного насоса. После полного завершения реакции реакционную смесь фильтровали через Целит 545, слой на фильтре промывали два раза EtOH (85 мл каждый), затем объединенные фильтраты концентрировали и сушили в вакууме. Сырой продукт, (2R,6R)-трет-бутил 2-(гидроксиметил)-6-метилморфолин-4-карбоксилат 89 (1,56 г, 6,7 ммоль, 86,5%-ный выход), использовали на следующей стадии без дополнительной очистки.
[0641] К перемешиваемому раствору соединения 89 (1,501 г, 6,5 ммоль) в DCM (30 мл) и пиридине (1,05 мл, 13,0 ммоль) при 0°C в атмосфере азота добавляли перйодинан Десса-Мартина (3,3 г, 7,8 ммоль), после чего реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Было обнаружено, что реакция полностью не завершилась, поэтому добавляли дополнительное количество перйодинана Десса-Мартина (1,4 г, 3,3 ммоль) и пиридина (0,52 мл, 6,4 ммоль), и затем перемешивали в течение дополнительных 2 часов. После полного завершения реакции реакционную смесь промывали насыщенным водным раствором NaHCO3 (37 мл) с 10% водным раствором тиосульфата натрия (18 мл). Смесь перемешивали в течение 30 мин, после чего смесь экстрагировали три раза DCM (по 40 мл). Объединенные органические слои промывали насыщенным солевым раствором (37 мл), сушили над Na2SO4, фильтровали и концентрировали. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage 40+S, 40 г, элюируя смесью 10-100% EtOAc в гептане) с получением (2R,6R)-трет-бутил 2-формил-6-метилморфолин-4-карбоксилата 90 (1,285 г, 5,6 ммоль, 86,2%-ный выход) в виде бесцветного сиропа.
[0642] К перемешиваемому раствору соединения 90 (208 мг, 0,907 ммоль) в ТГФ (5 мл) при 0°C в атмосфере азота добавляли по каплям в течение 2 мин 1M раствор бромида бензилмагния (2,3 мл, 2,3 ммоль) в ТГФ. Реакционную смесь перемешивали при 0°C в течение 2,5 часов, после чего медленно добавляли насыщенный раствор хлорида аммония (4,8 мл), затем воду (2,5 мл). Гашеную реакционную смесь нагревали до комнатной температуры, перемешивали в течение еще 10 мин и экстрагировали два раза EtOAc (по 20 мл). Объединенные органические слои промывали насыщенным солевым раствором (9,5 мл), сушили над Na2SO4, фильтровали и концентрировали. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage SP4, 25 г, элюируя смесью 25-100% EtOAc в гептане) с получением (2R,6R)-трет-бутил 2-((R,S)-1-гидрокси-2-фенилэтил)-6-метилморфолин-4-карбоксилата 91 (172 мг, 0,539 ммоль, 59,4%-ный выход, R=-CH2C6H5) в виде бесцветного масла.
[0643] К перемешиваемому раствору соединения 91 (172 мг, 0,539 ммоль) в DCM (1,2 мл) добавляли ТФК (1,2 мл). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре, затем, после полного завершения реакции, реакционную смесь, разбавляли толуолом (4,6 мл), концентрировали и азеотропно отгоняли досуха два раза с толуолом (по 4,6 мл каждый раз) с получением 1-((2R,6R)-6-метилморфолин-2-ил)-2-фенилэтанола 92 (179 мг, 0,534 ммоль, 99,0%-ный выход, R=-CH2C6H5), в виде соли ТФК без дополнительной очистки.
[0644] Сырое соединение 92 (179 мг, 0,534 ммоль) растворяли в N-метилпирролидоне (3 мл), затем добавляли соединение 3 (187 мг, 0,802 ммоль) и DIPEA (0,2 мл, 1,1 ммоль). Смесь нагревали в микроволновой печи при 170°C в течение 5 часов, после чего охлажденную смесь напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой С18, элюируя 10-60% ацетонитрилом в воде с 0,1% ТФК. Две элюированные фракции отдельно концентрировали досуха, азеотропно отгоняли два раза с MeOH (по 5 мл каждый раз). Каждый изомер растворяли в MeOH (2 мл) и пропускали через основной слой силикагеля (силикагель-CO2), элюируя два раза MeOH (по 2 мл) с последующим концентрированием и сушкой в вакууме с получением отдельно соединения 93 или ER-886564 (19 мг, 0,051 ммоль, 9,5%-ный выход, первая фракция, R=-CH2C6H5) и соединения 94 или ER-886565 (23 мг, 0,062 ммоль, 11,5%-ный выход, вторая фракция, R=-CH2C6H5). Стереохимию положения спиртовой группы устанавливали произвольно.
[0645] ER-895200 (22,2 мг, 0,075 ммоль, 32,1%-ный выход, первая фракция) и ER-895310 (15,2 мг, 0,051 ммоль, 21,8%-ный выход, вторая фракция) получали способом, аналогичным способу получения ER-886564 и ER-886564, исходя из соединения 3 (54,6 мг, 0,234 ммоль) и 1-((2R,(5R)-6-метилморфолин-2-ил)этанола (68,2 мг, 0,470 ммоль). Стереохимию положения спиртовой группы устанавливали произвольно.
[0646] ER-895326: К перемешиваемому раствору ER-895200 (17,9 мг, 0,060 ммоль) в ТГФ (0,3 мл) добавляли гидрид натрия (4,8 мг, 0,120 ммоль, 60% дисперсия в масле), затем 2-бромпиримидин (19 мг, 0,120 ммоль). Реакционную смесь нагревали до 60°C и перемешивали в течение 30 мин, после чего охлаждали до комнатной температуры и медленно гасили добавлением по каплям воды (0,5 мл). Смесь экстрагировали три раза DCM (по 3 мл), и объединенные органические слои промывали насыщенным солевым раствором (3 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage, элюируя градиентом 0-10% EtOAc в гептане) с получением после объединения желаемых фракций, концентрирования и сушки в вакууме ER-895326 (20,3 мг, 0,054 ммоль, 90,1%-ный выход).
[0647] ER-895327 (6,4 мг, 0,017 ммоль, 63%-ный выход) получали способом, аналогичным способу получения ER-895326, исходя из ER-895310 (7,9 мг, 0,027 ммоль) и 2-бромпиримидина (8 мг, 0,0,50 ммоль).
[0648] ER-895412: К перемешиваемому 1,6M раствору N-бутил лития в ТГФ (1,36 мл, 2,18 ммоль) при -40°C добавляли по каплям 2-бромпиридин (0,21 мл, 2,20 ммоль) в диэтиловом эфире (2 мл) с последующим перемешиванием в течение 30 мин при -40°C. Добавляли по каплям соединение 90 (500 мг, 2,18 ммоль) в ТГФ (2 мл) в течение 3 минут, после чего реакционную смесь перемешивали при -40°C в течение 2 часов и потом при 0°C в течение 1 часа. После полного завершения реакции реакционную смесь медленно гасили насыщенным раствором хлорида аммония в воде (2 мл), потом нагревали до комнатной температуры, разделяли слои и экстрагировали водный слой два раза EtOAc (по 2 мл). Объединенные органические слои промывали насыщенным солевым раствором (2 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали сначала пропусканием на силикагеле (Biotage, элюируя смесью 30% EtOAc в гептане с последующей кристаллизацией из 3:1 DCM:MeOH с получением, после фильтрования и сушки в вакууме, (2R,6R)-трет-бутил 2-((S)-гидрокси(пиридин-2-ил)метил)-6-метилморфолин-4-карбоксилата (150 мг, 0,486 ммоль, 22,3%-ный выход)
[0649] К перемешиваемому раствору (2R,6R)-трет-бутил 2-((S)-гидрокси(пиридин-2-ил)метил)-6-метилморфолин-4-карбоксилата (150 мг, 0,486 ммоль) в DCM (5 мл) добавляли ТФК (1 мл), затем перемешивали при комнатной температуре в течение 1 часа. После полного завершения реакции реакционную смесь концентрировали и азеотропно отгоняли досуха три раза с толуолом (по 5 мл каждый раз), затем разбавляли DCM (10 мл), промывали два раза насыщенным NaHCO3 в воде (2 мл), насыщенным солевым раствором (2 мл), сушили над MgSO4, фильтровали и концентрировали и сушили в вакууме с получением сырого (S)-((2R,6R)-6-метилморфолин-2-ил)(пиридин-2-ил)метанола (97,8 мг, 0,469, 96,4%-ный выход).
[0650] К перемешиваемому раствору (S)-((2R,6R)-6-метилморфолин-2-ил)(пиридин-2-ил)метанола (97,8 мг, 0,469 ммоль) и соединения 3 (54,6 мг, 0,234 ммоль) в DMAC (1 мл) добавляли TEA (0,132 мл, 0,947 ммоль). Реакционную смесь нагревали в микроволновой печи при 105°C в течение 3 часов, после чего охлажденную реакционную смесь напрямую очищали на колонке для препаративной ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм; используя градиент 0-50% ацетонитрила в воде с 0,1% муравьиная кислота) с получением после объединения желаемых объединенных фракций, концентрирования и сушки в вакууме ER-895296 (15,2 мг, 0,042 ммоль, 18,0%-ный выход, R=2-пиридил).
[0651] Получение ER-886625 в качестве примера соединения 45, схема 13
[0652] К перемешиваемому раствору ER-886520 (19 мг, 0,061 ммоль) в DCM (0,5 мл) и пиридина (0,010 мл, 0124 ммоль) при 0°C в атмосфере азота добавляли перйодинан Десса-Мартина (31,1 мг, 0,073 ммоль), после чего реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 часа. Было обнаружено, что реакция полностью не завершилась, поэтому добавляли дополнительное количество перйодинана Десса-Мартина (31,1 мг, 0,073 ммоль) и добавляли пиридин (0,010 мл, 0124 ммоль) с последующим перемешиванием в течение дополнительных 30 мин. После полного завершения реакции реакционную смесь промывали насыщенным водным раствором NаНСО3 (0,4 мл) c 10% водным раствором тиосульфата натрия (0,2 мл). Смесь перемешивали в течение 30 мин, после чего смесь экстрагировали три раза DCM (0,3 мл каждый). Объединенные органические слои промывали насыщенным солевым раствором (0,35 мл), сушили над Na2SO4, фильтровали и концентрировали. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage SP4, 25 г, элюируя смесью 10-80% EtOAc в гептане) с получением соединения 45 или ER-886625 (7 мг, 0,023 ммоль, 37,1%-ный выход) в виде твердого вещества желтого цвета.
[0653] ER-886626 (10,8 мг, 0,030 ммоль, 90,9%-ный выход) получали способом, аналогичным способу получения ER-886625, исходя из смеси ER-886532 и ER-886533 (12 мг, 0,033 ммоль).
[0654] ER-886629 (6,6 мг, 0,017 ммоль, 81%-ный выход) получали способом, аналогичным способу получения ER-886625, исходя из смеси ER-886567 и ER-886568 (8 мг, 0,021 ммоль).
[0655] Получение ER-886912 и ER-886913:
[0656] К перемешиваемому раствору ER-886568 (124 мг, 0,32 ммоль) в DCM (1,3 мл) при комнатной температуре добавляли метансульфонил хлорид (37 мкл, 0,478 ммоль), затем DMAP (7,8 мг, 0,064 ммоль) и DIPEA (0,17 мл, 0,959 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, затем добавляли воду (1 мл) и DCM (5 мл) с последующим перемешиванием в течение еще 5 мин и разделением слоев. Органический слой промывали насыщенным солевым раствором (1 мл), сушили над Na2SO4, фильтровали и концентрировали. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage SP4, 25 г, элюируя смесью 20-100% EtOAc в гептане) с получением (R)-1-((2R,6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-ил)-3-фенилпропилметан-сульфоната (136 мг, 0,292 ммоль, 93,5%-ный выход) в виде твердого вещества желтого цвета.
[0657] Раствор (R)-1-((2R,6R)-4-(8-цианохинолин-5-ил)-6-метилморфолин-2-ил)-3-фенилпропил метансульфоната (38 мг, 0,082 ммоль) в NMP (2 мл) и пирролидине (0,10 мл, 1,21 ммоль) нагревали в микроволновой печи при 150°C в течение 15 мин, затем охлаждали, фильтровали и напрямую помещали на колонку ВЭЖХ C-18 (колонка Water's X-Bridge C18 19×100 мм; используя градиент 0-50% ацетонитрила в воде с 0,05% ТФК). Фракции ER-886912 и ER-886913 раздельно концентрировали досуха, растворяли в MeOH (3 мл) и элюировали на колонке с силикагелем, пропитанным карбонатом (Biotage Isolute SPE, Si-СО3, 1 г), промывали MeOH (3 мл), концентрировали и сушили в вакууме с получением ER-886912 (1,4 мг, 0,003 ммоль, 3,9%-ный выход) в виде первого элюированного пика и ER-886913 (0,6 мг, 0,001 ммоль, 1,5%-ный выход) в виде второго элюированного пика. Для обоих примеров стереохимию функциональной группы амина определяли произвольным образом.
[0658] Получение ER-886131: Модификация схемы 7 по схеме 27:
[0659] Схема 27
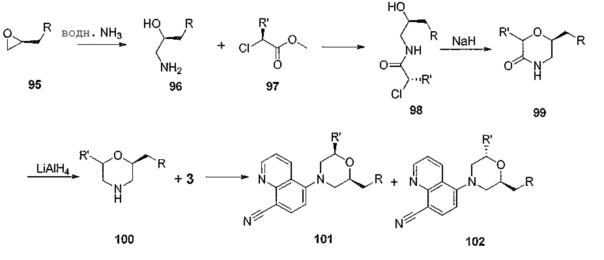
[0660]
[0661] Перемешиваемый раствор коммерчески доступного (S)-2-пропилоксирана 95 (3,0 г, 34,8 ммоль, R=этил) в гидроксиде аммония (100 мл) герметически закрывали и перемешивали в течение 24 час с последующей азеотропной отгонкой досуха три раза с толуолом (100 мл каждый). Сырой бесцветный продукт (S)-1-аминопентан-2-ол 96 (R=этил) использовали в следующей реакции без дополнительной очистки.
[0662] К перемешиваемому раствору сырого соединения 96 (0,987 мг, 9,57 ммоль) в EtOH (20 мл) добавляли (S)-метил 2-хлорпропаноат 97 (1,568 г, 11,5 ммоль, R'=метил) с последующим нагреванием до 70°C и перемешиванием в течение 24 часов. Реакционную смесь после полного завершения реакции охлаждали до комнатной температуры, концентрировали досуха и остаток растворяли в EtOAc (20 мл). Органический раствор промывали три раза 1н водным раствором HCl (по 5 мл каждый раз), насыщенным солевым раствором (5 мл), сушили над MgSO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage, элюировали градиентом 20-100% EtOAc в гептане) с получением (S)-2-хлор-N-((S)-2-гидроксипентил)пропанамида 98 (0,356 г, 1,839 ммоль, 19,2%-ный выход, R=этил; R'=метил).
[0663] К перемешиваемому раствору соединения 98 (0,356 г, 1,839 ммоль) в ТГФ (22 мл) при 0°C добавляли гидрид натрия (294,2 мг, 7,277 ммоль, 60% дисперсия в масле). Реакционную смесь перемешивали при 0°C в течение 30 мин, зетем нагревали до комнатной температуры и перемешивали в течение еще 5 часов. После полного завершения реакции реакционную смесь медленно гасили IPA (1 мл) с последующим добавлением Dowex 50, H+ форма, до тех пор, пока не было установлено нейтральное значение рН. Суспензию фильтровали и промывали два раза IPA (по 5 мл каждый раз). Фильтрат концентрировали, затем очищали на силикагеле (Biotage 25 г, элюируя EtOAc). После объединения желаемых фракций, концентрирования и сушки в вакууме получали смесь (2S,6S)-2-метил-6-пропилморфолин-3-она и (2R,6S)-2-метил-6-пропилморфолин-3-она 99 (168,2 мг, 1,07 ммоль, 58,2%-ный выход, R=этил; R'=метил) при соотношении цис к транс как 2:1.
[0664] К перемешиваемому раствору соединения 99 (168,2 мг, 1,07 ммоль) в ТГФ (0,8 мл) при комнатной температуре добавляли 1M раствор тетрагидроалюминат лития (1 мл, 1 ммоль) по каплям в течение 2 минут. Реакционную смесь перемешивали в течение еще 2,5 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до 0°C с последующим добавлением воды (0,43 мл) и 1M гидроксида натрия в воде (0,03 мл) и потом перемешивали в течение 30 мин. Полученный осадок фильтровали через целит 454 и элюировали EtOAc (2 мл), DCM (2 мл) и диэтиловым эфиром (2 мл). Объединенные фильтраты концентрировали и сушили в вакууме с получением сырого (2R,S;6S)-2-метил-6-пропилморфолина, соединение 100 (R=этил; R'=метил), который используется непосредственно в следующей реакции.
[0665] Сырое соединение 100 растворяли в NMP (5 мл), затем добавляли 3 (150 мг, 0,636 ммоль) и DIPEA (0,2 мл, 1,1 ммоль). Смесь нагревали в микроволновой печи при 145°C в течение 7 часов, после чего охлажденную смесь напрямую помещали на колонку для препаративной ВЭЖХ с обращенной фазой С18, элюируя 10-60% ацетонитрилом в воде с 0,1% ТФК. Две элюированные фракции раздельно концентрировали досуха, азеотропно отгоняли два раза MeOH (по 5 мл каждый раз). Каждый изомер растворяли в MeOH (2 мл) и пропускали через основной слой силикагеля (силикагель-СО2), элюируя два раза MeOH (по 2 мл) с последующим концентрированием и сушкой в вакууме с получением отдельно ER-886131, соединение 101 (64,2 мг, 0,217 ммоль, 34,2%-ный выход, цис-изомер, R=этил; R'=метил), и ER-886132, соединение 102 (25,2 мг, 0,85 ммоль, 13,4%-ный выход, транс-изомер, R=этил; R'=метил).
[0666] ER-886212 (315,2 мг, 0,975 ммоль, 8,5% общий выход) получали способом, аналогичным способу получения ER-886131, исходя из коммерчески доступного (S)-1-аминогептан-2-ола, соединение 90 (3,08 г, 23,5 ммоль, R=н-бутил) и (S)-метил 2-хлорпропаноата, соединение 97 (1,568 г, 11,5 ммоль, R'=метил).
[0667] Альтернативные примеры получения соединения 101 по схеме 28:
[0668] Схема 28
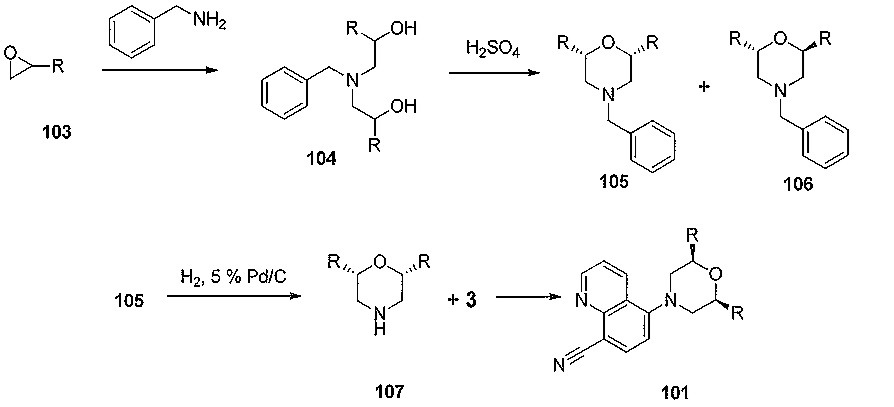
[0669]
[0670] Получение ER-886211:
[0671] К перемешиваемому раствору 2-этилоксиранае 103 (621 мг, 8,61 ммоль, R=этил) в DCM (60 мл) в атмосфере азота добавляли бензиламин (996 мг, 9,30 ммоль), затем трифлат скандия (341 мг, 0,693 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 часов, затем, после полного завершения реакции, реакционную смесь гасили насыщенным NaHCO3 (20 мл), экстрагировали три раза DCM (по 10 мл), и объединенные органические слои сушили над MgSO4, фильтровали и концентрировали досуха. После концентрирования объединенных желаемых фракций и сушки в вакууме сырой продукт очищали на силикагеле (Biotage 25 г, элюируя смесью гептан:EtOAc:TEA при соотношении 10:10:0,1) с получением 1,1-(бензилaзанeдиил)бис(бутан-2-ол) 104 (658 мг, 2,628 ммоль, 30,4%-ный выход, R=этил).
[0672] К перемешиваемому раствору соединения 104 (584 мг, 2,323 ммоль) в воде (0,3 мл) в течение 5 минут медленно добавляли концентрированную серную кислоту (2 мл), после чего реакционную смесь нагревали при 150°C в течение 2 часов. После полного завершения реакции реакционную смесь охлаждали до комнатной температуры и медленно выливали в насыщенный раствор NaHCO3 (20 мл) при перемешивании. Смесь экстрагировали два раза DCM (по 10 мл), и объединенные органические слои промывали водой (5 мл), насыщенным солевым раствором (5 мл), сушили над MgSO4, фильтровали и концентрировали досуха. После концентрации раздельно объединенных желаемых фракций и сушки в вакууме сырой продукт очищали на силикагеле (Biotage 25 г, элюируя смесью гептан:EtOAc при соотношении 2:1) с получением (3S,5R)-1-бензил-3,5-диэтилпиперидина 105 (234,2 мг, 1,003 ммоль, 43,2%-ный выход, R=этил), и (3R,5R)-1-бензил-3,5-диэтилпиперидина 106 (190,2 мг, 0,815 ммоль, 35,1%-ный выход, R=этил).
[0673] К перемешиваемому раствору соединения 105 (107,1 мг, 0,462 ммоль) в MeOH (5 мл) добавляли 5%-ный палладий на активированном угле (250 мг), затем несколько раз сосуд заполняли газообразным водородом. Реакционную смесь выдерживали в атмосфере водорода (баллон, находящийся под давлением) при комнатной температуре и перемешивали в течение 12 часов, после чего реакционную смесь продували газообразным азотом несколько раз при вакуумировании системы с помощью вакуумного насоса между очистками. После полного завершения реакции реакционную смесь фильтровали через Целит 545 слой на фильтре промывали два раза MeOH (по 2 мл), затем объединенные фильтраты концентрировали и сушили в вакууме. Сырой продукт, (3S,5R)-3,5-диэтилпиперидин 107 (0,066 г, 0,462 ммоль, 99,9%-ный выход, R=этил), использовали на следующей стадии без дополнительной очистки.
[0674] К перемешиваемому раствору соединения 107 (0,066 г, 0,462 ммоль, R=этил) в NMP (2 мл) добавляли DIPEA (0,13 мл, 0,728 ммоль) и соединение 3 (86,3 мг, 0,370 ммоль). Реакционную смесь нагревали в микроволновой печи при 150°C в течение 1 часа, после чего напрямую очищали на колонке для препаративной ВЭЖХ с обращенной фазой (колонка Water's X-Bridge C18 19×100 мм; элюируя градиентом 0-50% ацетонитрила в воде с 0,05% ТФК) с получением после объединения желаемых объединенных фракций, концентрирования и сушки в вакууме аналога соединения 101 или ER-886211 (45,2 мг, 0,153 ммоль, 41,4%-ный выход, R=этил).
[0675] Другие примеры:
[0676] ER-885113: К перемешиваемому раствору 2-(ди-трет-бутилфосфино)бифенила (20 мг, 0,067 ммоль) и трис(дибензилиденацетон)дипалладия(0) (20 мг, 0,022 ммоль) в толуоле (0,8 мл) в атмосфере азота при комнатной температуре добавляли коммерчески доступный 5-бром-8-метоксихинолин (201 мг, 0,844 ммоль), трет-бутоксид натрия (122 мг, 1,27 ммоль) и цис-2,6-диметилморфолин (125 мг, 1,085 ммоль), затем толуол (0,8 мл). Реакционную смесь нагревали с обратным холодильником и перемешивали в течение 3 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры, потом добавляли воду (5 мл). Полученную смесь экстрагировали два раза EtOAc (по 5 мл каждый раз), и объединенные органические слои промывали насыщенным солевым раствором (2 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле дважды (Biotage SP4, 25+S, элюируя смесью 12-100% EtOAc в гептане) с получением после объединения желаемых фракций, концентрирования и сушки в вакууме ER-885113 (49 мг, 0,180 ммоль, 21,3%-ный выход).
[0677] ER-887960 (13,7 мг, 0,049 ммоль, 23,5%-ный выход) получали способом, аналогичным способу получения ER-885113, исходя из 5-бром-8-хлор-1,7-нафтиридина (51 мг, 0,210 ммоль) и цис-2,6-диметилморфолина (31,4 мг, 0,273 ммоль)
[0678] ER-886133 и ER-886134: Раствор (S)-2-((бензилокси)метил)оксирана (65 г, 0,396 моль) и 28%-ный NH4OH в воде перемешивали при комнатной температуре в течение 14 часов, затем, после полного завершения реакции, реакционную смесь концентрировали и азеотропно отгоняли два раза с толуолом (150 мл каждый) с получением (S)-1-амино-3-(бензилокси)пропан-2-ола (70,6 г, 0,390 моль, 98%-ный выход) в виде сырого твердого вещества белого цвета.
[0679] К перемешиваемому раствору сырого (S)-1-амино-3-(бензилокси)пропан-2-ола (54,4 г, 0,300 моль) в этаноле (400 мл) добавляли метил (R)-(+)-2-хлорпропионат (40,44 г, 0,330 моль) по каплям в течение 30 минут. Реакционную смесь нагревали до 75°C и перемешивали в течение 16 часов, затем, после полного завершения реакции, реакционную смесь концентрировали досуха. Сырую смесь разбавляли EtOAc (200 мл), промывали 1н водным раствором HCl (100 мл), насыщенным солевым раствором (100 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (Biotage, элюируя линейным градиентом 30-80% EtOAc в гептане) с получением (R)-N-((R)-1-(бензилокси)пропан-2-ил)-2-хлорпропанамида (65,7 г, 0,239 моль, 79,7%-ный выход).
[0680] К перемешиваемому раствору (R)-N-((R)-1-(бензилокси)пропан-2-ил)-2-хлорпропанамида (8,8 г, 0,032 моль) в ТГФ (440 мл) при 0°C добавляли частями NaH (5,181 г, 0,130 моль, в виде 60% масляной дисперсии) в течение 10 минут. Реакционную смесь перемешивали при 0°C, затем оставляли медленно нагреваться до комнатной температуры и перемешивали еще 6 часов. После полного завершения реакции реакционную смесь медленно гасили IPA (20 мл), затем Dowex 50, H+ смола (30 г) с последующим перемешиванием до тех пор, пока не определялось кислотное значение рН. Гашеную суспензию фильтровали, промывали EtOAc (50 мл) и концентрировали досуха. После объединения желаемых фракций, концентрирования и сушки в вакууме сырой продукт очищали на силикагеле (200 г, элюируя 30-50% градиентом EtOAc в гептане) с получением (2S,6S)-6-((бензилокси)метил)-2-метилморфолин-3-она (6,12 г, 0,026 моль, 81,3%-ный выход).
[0681] К перемешиваемому раствору (2S,6S)-6-((бензилокси)метил)-2-метилморфолин-3-она (6,12 г, 0,026 моль) в ТГФ (20 мл) в атмосфере азота при комнатной температуре добавляли по каплям в течение 15 минут 1M раствор тетрагидроалюмината в ТГФ (30 мл, 0,030 моль). Реакционную смесь перемешивали в течение 2,5 часов, после чего охлаждали до 0°C и затем медленно добавляли воду (13 мл) и затем 1н водный раствор NaOH (0,9 мл). Гашеную реакционную смесь перемешивали до тех пор, пока осадок не стал гранулированным, после чего добавляли Целит 545 (10 г), потом фильтровали через слой из целита и промывали три раза DCM (30 мл) и этиловым эфиром (30 мл). Объединенные фильтраты концентрировали и очищали на силикагеле (Biotage, элюируя градиентом 0-5% MeOH в DCM) с получением после объединения желаемых фракций, концентрирования и сушки в вакууме (2S,6S)-2-((бензилокси)метил)-6-метилморфолина (2,7 г, 0,012 моль, 46,2%-ный выход).
[0682] К перемешиваемому раствору (2S,6S)-2-((бензилокси)метил)-6-метилморфолина (2,7 г, 0,012 моль) в DCM (50 мл) добавляли ди-трет-бутилдикарбонат (6,807 г, 0,031 моль), затем TEA (4,35 мл, 0,031 моль) и DMAP (100 мг, 0,82 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, затем, после полного завершения реакции, реакционную смесь промывали 0,1н раствором HCl (50 мл) и насыщенным солевым раствором (50 мл). Органическую фазу концентрировали с последующей очисткой на силикагеле (Biotage, элюируя 10-20% градиентом EtOAc в гептане) с получением после объединения желаемых фракций, концентрирования и сушки в вакууме (2S,6S)-трет-бутил 2-((бензилокси)метил)-6-метилморфолин-4-карбоксилата (3,68 г, 11,4 ммоль, 95,4%-ный выход).
[0683] К перемешиваемому раствору (2S,6S)-трет-бутил 2-((бензилокси)метил)-6-метилморфолин-4-карбоксилата (3,102 г, 9,7 ммоль) в этаноле (15 мл) добавляли 5%-ный Pd на угле (300 мг), затем вакуумировали и заполняли реакционный сосуд три раза газообразным водородом. Реакционную смесь нагревали при 40°C, выдерживая в атмосфере водорода (баллон, находящийся под давлением) и перемешивали в течение ночи, после чего реакционную смесь продували газообразным азотом несколько раз при вакуумировании системы с помощью вакуумного насоса между очистками. После полного завершения реакции реакционную смесь фильтровали через Целит 545, слой на фильтре промывали два раза этанолом (по 10 мл), затем объединенные фильтраты концентрировали и сушили в вакууме. Сырой продукт, (2S,6S)-трет-бутил 2-(гидроксиметил)-6-метилморфолин-4-карбоксилат (2,15 г, 9,3 ммоль, 95,8%-ный выход), использовали на следующей стадии без дополнительной очистки.
[0684] К перемешиваемому раствору (2S,6S)-трет-бутил 2-(гидроксиметил)-6-метилморфолин-4-карбоксилата (200 мг, 0,865 ммоль) в DCM (5 мл) при комнатной температуре добавляли ТФК (0,5 мл, 6,7 ммоль). Реакционную смесь перемешивали в течение 1 часа, после чего концентрировали и азеотропно отгоняли досуха два раза с толуолом (по 5 мл каждый раз) и сушили в вакууме. Сырой морфолин с удаленной защитной группы растворяли при перемешивании в DMAC (1 мл), затем добавляли DIPEA (0,23 мл, 1,3 ммоль) и соединение 3 (152,4 мг, 0,654 ммоль). Реакционную смесь нагревали в микроволновой печи при 140°C и перемешивали в течение 3 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры, концентрировали и очищали на силикагеле (Biotage, элюируя смесью 30-80% EtOAc в гептане) с получением после концентрирования желаемых объединенных фракций и сушки в вакууме 5-((2S,6S)-2-(гидроксиметил)-6-метилморфолино)хинолин-8-карбонитрила или ER-885477 (165,2 мг, 0,583 ммоль, 89,2%-ный выход).
[0685] К охлажденному перемешиваемому раствору бис(2-метоксиэтил)аминосеры трифторида (Deoxo-Fluor®) (0,044 мл, 0,239 ммоль) в DCM (2 мл) в атмосфере азота при -78°C в течение 3 минут добавляли по каплям ER-885477 (50,4 мг, 0,178 ммоль) в DCM (2 мл). Реакционную смесь нагревали до -50°C и перемешивали в течение 30 мин, после чего нагревали до 0°C и перемешивали в течение 1,5 час. После полного завершения реакции реакционную смесь медленно гасили добавлением по каплям насыщенного раствора NaHCO3 до тех пор, пока значение pH не становилось основным (~5 мл). Смесь разбавляли DCM (10 мл), и слои разделяли, после чего органический слой промывали два раза водой (по 5 мл каждый раз), сушили над MgSO4, фильтровали и концентрировали. Сырой продукт очищали на колонке ВЭЖХ с обращенной фазой (колонка X-Bridge C18 19×100 мм; элюируя линейным градиентом 10%-90% ацетонитрила в воде с 0,1% муравьиной кислотой) и концентрировали продукт желаемого пика, затем упаривали досуха в высоком вакууме с получением ER-886133 (35,2 мг, 0,123 ммоль, 69,3%-ный выход).
[0686] К ER-885477 (25,2 мг, 0,089 ммоль) добавляли тионилхлорид (2 мл) с последующим нагреванием до 85°C и перемешиванием в течение 24 часов. После полного завершения реакции реакционную смесь концентрировали досуха путем азеотропной отгонки два раза с толуолом (по 5 мл каждый раз). Сырой продукт очищали на колонке ВЭЖХ с обращенной фазой (колонка X-Bridge C18 19×100 мм; элюируя линейным градиентом 10%-90% ацетонитрила в воде с 0,1% муравьиной кислотой) и концентрировали продукт желаемого пика, затем упаривали досуха в высоком вакууме с получением ER-886134 (2,1 мг 0,007 ммоль, 7,8%-ный выход).
[0687] Получение ER-889363 в соответствии со схемой 14: К перемешиваемой суспензии гидрохлорида 3-бутениламина 62 (5,45 г, 50,6 ммоль) в DCM (33 мл) добавляли NaHCO3 (110 г), затем o-нитробензолсульфонил хлорид (13,5 г, 60,8 ммоль). Полученную смесь интенсивно перемешивали при комнатной температуре в течение 2 часов, после чего добавляли фенилгидразин гидрохлорид (2,9 г, 20 ммоль), и перемешивание продолжали в течение еще 1 часа. После полного завершения реакции реакционную смесь экстрагировали MTBE (70 мл) и затем последовательно промывали 20% водным раствором лимонной кислоты (35 мл), водой (35 мл) и концентрировали. Полученное твердое вещество сиреневого цвета (13,32 г) растворяли в NMP (70 мл) и добавляли карбонат калия (21 г, 0,15 моль), затем (R)-глицидол-бензиловый эфир 6 (9,98 г, 60,8 ммоль). Смесь нагревали до 50°C и перемешивали в течение 22 часов, после чего разбавляли водой (300 мл) и экстрагировали два раза MTBE (200 мл каждый). Все органические слои объединяли и концентрировали с получением масла оранжевого цвета, которое хроматографировали на колонке с силикагелем (н-гептан/MTBE 1:1) с получением соединения 64, (7,90 г, 18,8 ммоль, 37%-ный выход за 2 стадии) в виде масла оранжевого цвета.
[0688] К перемешиваемому раствору соединения 64 (7,90 г, 18,8 ммоль) в DMAC (94,8 мл) при комнатной температуре добавляли ацетат меди (II) (0,853 г, 4,70 ммоль), затем PdCl2 (0,416 г, 2,35 ммоль). Полученную смесь перемешивали в атмосфере O2 (баллон) при комнатной температуре в течение 16 часов, после чего добавляли дополнительное количество PdCb (0,200 г, 1,13 ммоль), и смесь нагревали до 40°C и перемешивали в течение 6 часов. После полного завершения реакции реакционную смесь гасили пиридином (4,5 мл, 56 ммоль), перемешивали в течение 5 мин, затем разбавляли MTBE (400 мл). Смесь промывали водой (250 мл), и органический слой отделяли, концентрировали. Сырое масло желтого цвета очищали хроматографией на колонке с силикагелем (н-гептан/MTBE 1:1) с получением соединения 65 (0,740 г, 1,77 ммоль, 9,4%-ный выход, 31%-ный выход из расчета на выделенный субстрат).
[0689] К охлажденному перемешиваемому раствору соединения 65 (1,480 г, 3,54 ммоль) в DCM (14,8 мл) при 0°C добавляли триэтилсилан (2,96 мл, 18,6 ммоль), затем ТФК (4,44 мл, 57,6 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа, после чего смесь нагревали до комнатной температуры и перемешивали в течение еще 1 часа. После полного завершения реакции реакционную смесь азеотропно отгоняли два раза с толуолом (60 мл каждый) и затем очищали хроматографией на колонке с силикагелем (н-гептан/MTBE 1:1) с получением соединения 66 (1,382 г, 3,29 ммоль, 92%-ный выход) в виде масла желтого цвета.
[0690] К перемешиваемому раствору соединения 66 (1,382 г, 3,29 ммоль) в ДМФ (8,3 мл, 0,11 моль) добавляли карбонат калия (1,45 г, 10,5 ммоль), затем бензолтиол (0,360 мл, 3,50 ммоль). Полученную смесь нагревали при 40°C в течение 2 часов, потом после полного завершения реакции реакционную смесь разбавляли водой (12 мл). Добавляли ди-трет-бутил дикарбонат (0,897 г, 4,11 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. После полного завершения реакции реакционную смесь разбавляли водой (29 мл) и экстрагировали два раза MTBE (по 40 мл), и объединенные органические слои концентрировали с получением масла желтого цвета. Сырой продукт очищали хроматографией на колонке с силикагелем (н-гептан/MTBE 4:1) с получением соединения 67 (847 мг, 2,52 ммоль, 77%-ный выход) в виде бесцветного масла и его стереоизомера (8,3 мг, 0,25 ммоль, 7,5%-ный выход) в виде бесцветного масла.
[0691] К перемешиваемому раствору соединения 67 (0,847 г, 2,52 ммоль) в DCM (4,2 мл) добавляли ТФК (4,2 мл, 0,055 моль) при комнатной температуре и перемешивали в течение 30 мин. После полного завершения реакции реакционную смесь концентрировали, азеотропно отгоняли с толуолом (20 мл) и распределяли между насыщенным NaНСО3 (8,5 мл) и DCM (20 мл). Органический слой разделяли, сушили над MgSO4 (2,0 г), фильтровали и концентрировали досуха. Сырое промежуточное соединение растворяли в NMP (2,12 мл), затем добавляли DIPEA (0,66 мл, 3,8 ммоль) и далее соединение 3 (0,706 г, 3,03 ммоль). Полученную смесь нагревали до 140°C и перемешивали в течение 2 часов, затем, после полного завершения реакции, реакционную смесь охлаждали до комнатной температуры и распределяли между EtOAc (40 мл) и водой (20 мл). Водный слой экстрагировали EtOAc (20 мл), и объединенные органические слои промывали водой (10 мл) и концентрировали с получением сырого продукта в виде твердого вещества/масла коричневого цвета. Сырой продукт очищали на силикагеле (элюируя смесью н-гептан/EtOAc 1:1) с получением смеси 4:1 желаемого промежуточного соединения:соединения 3 (0,684 мг).
Сырую промежуточную смесь (0,684 мг) суспендировали в ацетонитриле (6,0 мл), затем добавляли йодтриметилсилан (0,377 мл, 2,65 ммоль) и затем нагревали до 60°C и перемешиванием в течение 2 часов. После полного завершения реакции реакционную смесь охлаждали до 40°C с последующим добавлением воды (3,0 мл), и реакционную смесь охлаждали до комнатной температуры при перемешивании в течение еще 1 часа. Добавляли 28%-ный водн. раствор гидроксид аммония (1,0 мл), и полученную смесь экстрагировали два раза EtOAc (по 20 мл), после чего объединенные органические слои концентрировали, затем очищали на силикагеле (элюируя 100% EtOAc) с получением соединения 68 или ER-889363 (404 мг, 1,36 ммоль, 53%-ный выход) в виде твердого вещества желтого цвета.
[0692] К перемешиваемому раствору ER-889363 (355 мг, 1,194 ммоль) в DCM (4 мл) добавляли п-толуолсульфонил хлорид (350 мг, 1,836 ммоль), затем DIPEA (0,32 мл, 1,837 ммоль) и DMAP (10 мг, 0,082 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов, потом, после полного завершения реакции, реакционную смесь промывали водой (2 мл) и насыщенным солевым раствором (2 мл) с последующей сушкой над Na2SO4, фильтрованием и концентрированием досуха. Сырой продукт очищали на силикагеле (Biotage, SP4, 25+M, элюируя смесью 10-60% EtOAc в гептане при 20 объемам колонки. Желаемые фракции объединяли, концентрировали и сушили в вакууме с получением ((2R,7R)-4-(8-цианохинолин-5-ил)-7-метил-1,4-оксазепан-2-ил)метил 4-метилбензолсульфоната (476,6 мг, 1,056 ммоль, 88,4%-ный выход)
[0693] ((2R,7R)-4-(8-Цианохинолин-5-ил)-7-метил-1,4-оксазепан-2-ил)метил-4-метил-бензолсульфонат (19,4 мг, 0,043 ммоль) и 1,4'-бипиперидин (30 мг, 0,178 ммоль) растворяли в DMAC (0,5 мл) и потом нагревали в микроволновой печи при 150°C в течение 10 мин. Охлажденную реакционную смесь разбавляли ацетонитрилом (0,5 мл), фильтровали и очищали методом ВЭЖХ с обращенной фазой (колонка Xbridge C18, элюируя градиентом 10-40% ацетонитрила в воде с 0,1% муравьиной кислотой). Объединенные желаемые фракции концентрировали, разбавляли MeOH (1 мл) и пропускали через колонку с основным SiCO3, элюируя MeOH (2 мл), затем концентрировали и сушили в вакууме с получением ER-889822 (11 мг, 0,025 ммоль, 57,2%-ный выход).
[0694] Другие примеры:
[0695] ER-890094: Раствор (3-(бромметил)фенил)борной кислоты (129,5 мг, 0,603 ммоль) и 1,4'-бипиперидина (190 мг, 1,129 ммоль) в DMAC (1 мл) нагревали в микроволновой печи при 150°C в течение 10 мин, после чего реакционную смесь охлаждали и концентрировали досуха для использования на следующей стадии в виде неочищенной (3-([1,4'-бипиперидин]-1'-илметил)фенил)борной кислоты.
[0696] Перемешиваемый раствор, содержащий соединение 3 (44,5 мг, 0,191 ммоль), сырую (3-([1,4'-бипиперидин]-1'-илметил)фенил)борную кислоту (86,5 мг, 0,286 ммоль), ацетат палладия(II) (6 мг, 0,027 ммоль), 2-дициклогексилфосфино-2',6'-диметоксибифенил (12 мг, 0,029 ммоль) и 1M раствор карбоната натрия в воде (0,029 мл, 0,029 ммоль) в EtOH (0,6 мл) и толуоле (0,6 мл) нагревали при 70°C в течение 16 часов. После полного завершения реакции реакционную смесь охлаждали, разбавляли DCM (10 мл), промывали водой (3 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт разбавляли смесью 1:1 ДМСО:ацетонитрил (2 мл) и напрямую очищали методом ВЭЖХ (XBridge C18, элюируя смесью 10-40% ацетонитрила в воде с 0,1% муравьиной кислотой). Желаемый продукт собирали и концентрировали досуха. Полученный продукт растворяли в MeOH (2 мл) и пропускали через слой основного силикагеля (Biotage, 1 г, SiCO3), элюируя MeOH (5 мл) с получением, после концентрирования и сушки в вакууме, ER-890094 (5 мг, 0,012 ммоль, 6,3%-ный выход).
[0697] ER-890244 (63,2 мг, 0,153 ммоль, 27,3% общий выход) получали способом, аналогичным способу получения ER-890094, исходя из (4-(бромметил)фенил)борной кислоты (134,2 мг, 0,625 ммоль) и 1,4'-бипиперидина (125 мг, 0,564 ммоль).
[0698] ER-888200: Перемешиваемый раствор, содержащий соединение 3 (251 мг, 1,077 ммоль), (3-формил-5-метилфенил)борную кислоту (350 мг, 2,135 ммоль), бис(трифенилфосфин)хлорид палладия(II) (150 мг, 0,214 ммоль), хлорид лития (91 мг, 2,147 ммоль), карбонат натрия (230 мг, 2,17 ммоль) и 10%-ный карбонат натрия в воде (2,3 мл) в ДМФ (11 мл) нагревали до 90°C в течение 3 часов. Охлажденную реакционную смесь разбавляли EtOAc (48 мл) и водой (12 мл) при перемешивании с последующим фильтрованием через Целит 545 (1,2 г), элюируя EtOAc (10 мл). Отделенный водный слой экстрагировали два раза с помощью EtOAc (12 мл каждый), и объединенные органические слои промывали водой (24 мл) и насыщенным солевым раствором (24 мл), затем сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage SP4, Interchim 25 г, элюируя смесью 20-100% EtOAc в гептане), после чего фракции желаемого продукта объединяли, концентрировали и сушили в вакууме с получением ER-888200 (163 мг, 0,599 ммоль, 55,6%-ный выход).
[0699] ER-888201: К перемешиваемому раствору ER-888200 (21 мг, 0,077 ммоль) в MeOH (2,1 мл), охлажденному до 0°C, добавляли тетрагидроборат натрия (3,2 мг, 0,085 ммоль). Реакционную смесь перемешивали в течение 1 часа, после чего добавляли воду (2,1 мл), смесь концентрировали до половины объема, затем экстрагировали EtOAc (19 мл). Органический слой промывали насыщенным солевым раствором (3,9 мл), сушили над Na2SO4, фильтровали и концентрировали досуха с получением ER-888201 (17,4 мг, 0,63 ммоль, 82,4%-ный выход).
[0700] ER-888644: К перемешиваемому раствору ER-888201 (91 мг, 0,332 ммоль) в DCM (1,8 мл) добавляли п-толуолсульфонилхлорид (101 мг, 0,530 ммоль), затем добавляли DMAP (2 мг, 0,016 ммоль) и DIPEA (1,8 мл, 1,03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, после чего добавляли дополнительное количество п-толуолсульфонилхлорида (101 мг, 0,530 ммоль) с последующим перемешиванием в течение 2 часов. После полного завершения реакции реакционную смесь разбавляли при перемешивании водой (1 мл) и DCM (5,2 мл). Слои разделяли, и органический слой промывали насыщенным солевым раствором (1 мл), сушили над Na2SO4, фильтровали и концентрировали досуха. Сырой продукт очищали на силикагеле (Biotage SP4, Interchim 25 г, элюируя смесью 20-100% EtOAc в гептане), после чего фракции желаемого продукта объединяли, концентрировали и сушили в вакууме с получением ER-888644 (63 мг, 0,212 ммоль, 65%-ный выход).
[0701] ER-888645: Раствор ER-888644 (20 мг, 0,068 ммоль) и 4-гидроксипиперидина (70 мг, 0,692 ммоль) в N-метилпирролидоне (2 мл) нагревали в микроволновой печи при 150°C в течение 15 мин. Охлажденную реакционную смесь разбавляли NMP (4 мл) и напрямую очищали методом ВЭЖХ на колонке C-18 (Xbridge С18, элюируя 10-40% ацетонитрилом в воде с 0,1% ТФК). Желаемый продукт собирали и концентрировали досуха. Полученный продукт растворяли в MeOH (2 мл) и пропускали через основной слой силикагеля (Biotage, 1 г, SiCO3), элюируя MeOH (5 мл) с получением, после концентрирования и сушки в вакууме, ER-888645 (19,9 мг, 0,056 ммоль, 81,5%-ный выход).
[0702] ER-888646 (17,9 мг, 0,047 ммоль, 68,1%-ный выход) получали способом, аналогичным способу получения ER-888645, исходя из ER-888644 (20 мг, 0,068 ммоль) и 4-диметиламинопиперидина (87,6 мг, 0,683 ммоль).
[0703] ER-888647 (15,3 мг, 0,043 ммоль, 62,8%-ный выход) получали способом, аналогичным способу получения ER-888645, исходя из ER-888644 (20 мг, 0,068 ммоль) и 1-метилпиперазина (68,4 мг, 0,683 ммоль).
[0704] ER-889504 (46 мг, 0,108 ммоль, 62%-ный выход) получали способом, аналогичным способу получения ER-888645, исходя из ER-888644 (51 мг, 0,174 ммоль) и 1,4'-бипиперидина (102 мг, 0,606 ммоль).
[0705] Общее способ скринингового исследования и фармакологическая стратегия.
[0706] Для определения эффективных и селективных TLR7/8 соединений, первоначально аналоги исследовали аналоги по клеточной панели репортерных линий TLR4, TLR7 и TLR9 человека (более подробно см. Фармакологические материалы и способы). Подгруппа соединений, которые были эффективными и селективными в отношении TLR7, также исследовали на предмет активности TLR8 (см. таблицу 3 ниже) и эффективности TLR7/8 в первичном анализе РВМС человека (более подробно см. Фармакологические материалы и способы). Для определения дозазависимой активности и продолжительности действия против TLR7 мыши, некоторые соединения подвергали in vivo (STIV) анализу, (более подробно см. Фармакологические материалы и способы). Затем селективные соединения оценивали по воздействию на одну или несколько следующих мышиных моделей волчанки: BXSB-Yaa, NZB NZW и Пристан DBA/1.
[0707] Многие соединения, описанные в качестве вариантов осуществления по настоящему изобретению, демонстрируют наномолярную активность как против TLR7 человека и мыши, так и TLR8 человека, когда эти рецепторы, экспрессированные либо на клеточных линиях или первичных клетках, стимулируются синтетическими низкомолекулярными (CL097, R848) лигандами или лигандами нуклеиновой кислоты (РНК). С другой стороны, большинство соединений, описанных в настоящем документе в качестве вариантов осуществления, являются неактивными в отношении пути TLR9.
[0708] Современные SOC препараты для лечения волчанки включают противомалярийные средства, такие как хлорохин и гидроксихлорохин (HCQ), которые, как было показано, ингибируют активацию TLR7/9 in vitro. Это может, по крайней мере, частично, объяснить их эффективность в борьбе с развитием волчанки. Варианты осуществления по настоящему изобретению, однако, как было показано, предполагают значительно более эффективное ингибирование. Например, было установлено, что соединение ER-899742 (показано и описано выше) приблизительно в 1000 раз более эффективно против РНК-Ig TLR7/8 стимула, чем HCQ (IC50=0,0009 мкМ, HCQ IC50 ~1,5 мкМ). Это показывает, что ER-899742 будет предлагать гораздо более эффективное ингибирование пути TLR7/8 в сравнении с существующими в настоящее время средствами лечения волчанки. Об этом свидетельствуют результаты, приведенные в таблице 1 ниже.
[0709]
|
[0710] Сравнительную эффективность ER-899742 по сравнению с гидроксихлорохином дополнительно исследовали с использованием клонированного TLR7 и соединения 8 в клеточной линии НЕК 293, как описано ниже в разделе Фармакологические исследования in vitro. Также сравнивали воздействие на TLR7 мышей. Перед считыванием интенсивности люминесценции клетки стимулировали в течение ночи агонистом TLR7/8 против CL097 при заранее определенной ED70-80: 3 мкг/мл для НЕК-hTLR7, 1,5 мкг/мл для НЕК-mTLR7 и 12 мкг/мл для НЕК-hTLR8. Осуществляли три исследования и определяли значение IC50 с использованием программы GraphPad Prism 6 для построения графика нелинейной регрессии. Отдельные результаты исследования и их средние значения приведены в таблице 2. Данные показывают, что в этом анализе ER-899742 имел среднее значение IC50, равное 0,024 мкМ, в клеточной линии НЕК TLR7, и среднее значение IC50, равное 0,0024 мкМ, в клеточной линии НЕК/TLR8.
[0711]
|
[0712] 1mTLR7, мышиный TLR7; hTLR7, человеческий TLR7; hTLR8, человеческий TLR8
[0713]
|
[0714] Экспресс анализ in vivo (STIV): Для оценки эффективности соединений in vivo против мышиного TLR7 использовали in vivo (STIV). Вкратце, мышам перорально вводили соединения и затем в различные моменты времени для стимулирования TLR7 подкожно вводили агонист R848. Потом для оценки эффективности соединения и продолжительности действия соединения после стимуляции R848 измеряли уровень IL-6 в плазме посредством анализа ELISA. Важно отметить, что продукция цитокинов после in vitro или in vivo стимуляции с помощью R848, как показано, была полностью TLR7-зависимой при использовании мышей с дефицитом TLR7. Таким образом, активность соединений в исследовании STIV можно с уверенностью отнести к их модуляции пути TLR7. Однократная пероральная доза ER-899742, составляющая 300 мг/кг, полностью супрессирует путь R848/TLR7/IL-6 in vivo в течение, по крайней мере, 24 часов (см фиг.1А и фиг.1В). Сводные данные активности анализа STIV для группы соединений представлены в таблице 4 ниже.
[0715]
|
|
|
|
|
|
[0716] Мышиные модели волчанки. Для РОС оценки соединений были выбраны две различные модели заболеваний волчанки (NZB/W и пристан), поскольку (1) штамм NZB/W развивает спонтанное заболевание с полигенной этиологией, демонстрируя многие признаки волчанки человека, например, ДНК-ассоциированную аутореактивность, протеинурию и нефрит, опосредованный иммунным комплексом, и (2) положительные результаты целевой оценки TLR7 и/или TLR9 отмечали для обеих моделей заболеваний.
[0717] Основные выводы для ER-899742 в моделях SLE являются следующими (см. фиг.2A-фиг.2C, фиг.3A-3E и фиг.7A-7G, и таблицу 7):
1) ER-899742 в нескольких дозах в диапазоне 33-300 мг/кг обеспечивает выраженное увеличение выживаемости в модели NZB/W, соответствующее существенному снижению протеинурии и гистологических признаков гломерулонефрита.
2) IR-899742 супрессирует различные специфичности аутоантител в модели с пристаном, в частности, сильным воздействием на РНК-связанную реактивность, например, анти-RiboP титры. Снижение экспрессии некоторых IFN-модулированных генов в цельной крови является результатом обработки ER-899742 в этой модели. Также в этой модели наблюдали подавление артрита посредством ER-899742.
[0718] Основные выводы для ER-899464 в моделях SLE являются следующими (см. фигуры 4-5):
1) ER-899464 в нескольких дозах, в диапазоне от 33 до 300 мг/кг, обеспечивает значительное увеличение выживаемости в модели NZB/W, сопровождаемое значительным снижением протеинурии.
2) ER-899464 супрессирует различные специфичности аутоантител в модели с пристаном, в частности, сильным воздействием на РНК-связанную реактивность, например, анти-RiboP титры.
[0719] ФАРМАКОЛОГИЧЕСКИЕ МАТЕРИАЛЫ И СПОСОБЫ:
[0720] Фармакологические данные in vitro:
[0721] Клетки HEK-293 (ATCC) создавали для стабильной экспрессии фактора транскрипции NF-каппаB, индуцируемого Е-селектин (ELAM-1) люциферазным репортером, полученного из плазмиды pGL3 (Promega), содержащей пары оснований, от -224lbp до -254bp, из промотора человеческого гена E-селектина (инвентарный номер NM_000450). Затем эти клетки создавали для стабильной и индивидуальной экспрессии TLR4, TLR7 или TLR9 полноразмерной ORF кДНК человека. Человеческую кДНК TLR4 (инвентарный номер NM_138554) клонировали в вектор экспрессии pcDNA 3.0, (Invitrogen). TLR4 трансфицированные клетки также создавали для экспрессии человеческого MD-2 корецептора [MD-2 кДНК (инвентарный номер NM_015364) клонировали в вектор pEF-BOS] и добавляли 10 нМ растворимого CD14 (R&D Systems) в среде для оптимизации реактивностей LPS. Человеческую TLR9 кДНК (инвентарный номер NM_017442) клонировали в вектор pBluescript II KS (Agilent). Человеческую TLR7 кДНК (инвентарный номер NM_016562) получали из OriGene. Клетки НЕК-293, стабильно экспрессирующие человеческий TLR8 (инвентарный номер NM_138636) или мышиный TLR7 (инвентарный номер NM_133211), приобретали у компании InyivoGen и затем стабильно трансфицировали pNiFty2 (NF-каппаB)-люцифераза репортерной плазмидой (InvivoGen). Каждый тип клеток высевали в модифицированной Дульбекко среде Игла (DMEM), содержащей 10% фетальную бычью сыворотку (FBS), при плотности 2,22×105 клеток/мл в 384-луночный планшет и инкубировали в течение 2-х дней при 37°C, 5% CO2. Затем добавляли различные концентрации соединений антагониста. Потом клетки инкубировали в течение еще 30 минут, перед добавлением соответствующего агониста TLR, в следующем порядке (указаны конечные концентрации): липополисахарид (LPS; Sigma) при 10 мкг/мл для TLR4, CL097 (InvivoGen) при 3 мкг/мл для человеческого TLR7 и TLR8 и мышиного TLR7, и CpG-2006-2A [последовательность: TCGTCGTTAAGTCGTTAAGTCGTT (SEQ ID NO: 1) с фосфоротиоатным остовом, синтезируемый Sigma-Aldrich] в 0,6 мкM для TLR9. Затем клетки инкубировали в течение ночи и количественно определяли активацию NF-каппаB зависимого люциферазного репортера путем измерения люминесценции с помощью реагента SteadyGlo® (Promega) или Steadylite™ (Perkin Elmer) в соответствии с протоколом, предложенным производителем.
[0722] Исследование на основе РВМС человека. Мононуклеарные клетки периферической крови человека (РВМС) выделяли из свежевзятой гепаринизированной (10 USP единиц/мл, Hospira, Lakeforest, IL) цельной крови здорового донора по градиенту плотности (Histopaque® 1077, Sigma, Inc., St. Louis, MO). Вкратце, 25 мл крови с 15 мл PBS (без Ca2+, Mg2+) разбавляли в 50 мл конической пробирке, и добавляли 12 мл Histopaque с помощью спинальной иглы. Пробирки центрифугировали в течение 45 минут при 1200 оборотов в минуту (350×g), и РВМС собирали из лейкоцитарной пленки. Затем клетки дважды промывали в PBS, и красные кровяные клетки лизировали суспензией в 5 мл раствора хлорида аммония (IX Red Blood Cell Lysis Buffer, eBioscience) в течение 5 минут при комнатной температуре. После окончательной промывки в PBS, РВМС повторно суспендировали при конечной концентрации 2×106/мл в среде RPMI-1640 с L-глутамином (Invitrogen) и с добавлением 25 мМ HEPES (Mediatech, Inc, Manassas VA), 10% фетальной бычьей сыворотки (HyClone, Logan, UT) и пенициллин-стрептомицин-глутамина (Mediatech), и высевали при 100 мкл/лунка (2×105 клетки/лунка) в 96-луночные планшеты, обработанные культурой ткани (Falcon).
Соединения антагониста, солюбилизированные и последовательно разведенные в 100% ДМСО, добавляли в трех повторах к клеткам с выходом конечной концентрации 0,1% (ДМСО об/об). Гидроксихлорохин (Acros Organics), растворенный и серийно разведенный в PBS, добавляли в трех повторах к клеткам. РВМС инкубировали с соединениями антагониста или HCQ в течение 30 минут при 37°C, 5% CO2, затем добавляли различные реагенты агонистов TLR в 100 мкл полной среды на лунку в следующей последовательности (указаны конечные концентрации): R848 (Resiquimod; GLSynthesis, Worcester, MA) при 1 мкМ для TLR7 и TLR8, LPS (Sigma) при 10 нг/мл для TLR4, и CpG-2216 (InvivoGen) при 5 мкг/мл для TLR9. Для получения агониста TLR7/8, который имитирует РНК-содержащие иммунные комплексы аутоантител у пациентов с волчанкой, синтезировали 26-мерную РНК с последовательностью, полученной из Ul-мяРНК структуры типа «стебель-петля» IV человека [(последовательность: GGGGGACUGCGU-UCGCGCUUUCCC (SEQ ID NO:2) с фосфоротиоатным остовом] (Dharmacon, Inc., Lafayette, CO), которая, как было показано ранее, является эффективным агонистом TLR7 и TLR8. Эту молекулу РНК разбавляли до 2,5 мкм в бессывороточной среде RPMI и добавляли мышиное моноклонального антитело к человеческой одноцепочечной ДНК (MAB3034, Millipore, Inc., Billerica, MA), которое также дает перекрестную реакцию с РНК при разбавлении 1:25 или при 1 мкг/мл. Перед добавлением к клеткам полученный стимул «РНК-Ig» инкубировали при комнатной температуре в течение 15-30 минут. PBMC инкубировали с различными агонистами TLR в течение 20 часов при 37°C, 5% СО2. Собирали супернатанты клеточных культур, и уровни различных цитокинов человека оценивали, как указано стандартной процедурой ELISA в соответствии с протоколом, рекомендованным производителем (BD Biosciences, Inc., San Diego, CA). Результаты приведены в таблице 5. В последующем исследовании (таблица 6) анализировали способность ER-899742 блокировать стимуляцию нормальных РВМС различными лигандами TLR7/8, но не ДНК-опосредованную активацию TLR9. В этом анализе клетки высевали в 96-луночные планшеты при 1×105 клетки/лунка в 100 мкл.
[0723]
|
[0724]
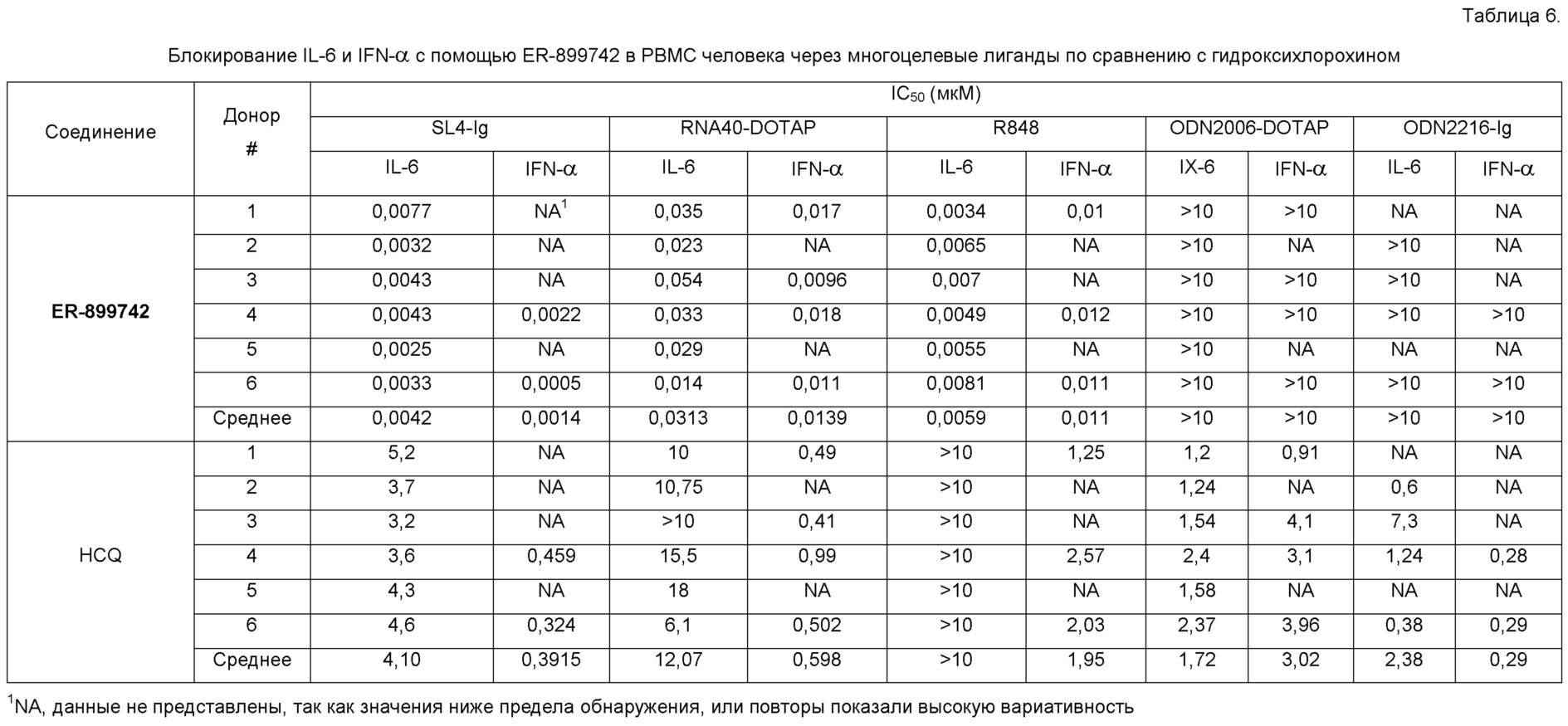
[0725] Клеточное исследование селезенки мыши. У самок мышей BALB/с (Jackson Labs, Bar Harbor, ME), умерщвленных с помощью СО2, изымали селезенки. Моноклеточную суспензию получали путем пропускания селезенок через нейлоновый клеточный фильтр с диаметром ячейки 40 мкм. Клетки дважды промывали по 50 мл PBS (Mediatech, Inc., Manassas, VA), и эритроциты лизировали в 5 мл буфера для лизиса RBC (eBioscience, Inc., San Diego, CA) в течение 5 минут при комнатной температуре. Клетки промывали два раза дополнительно PBS и, наконец, снова суспендировали в дополненном RPMI-1640 при плотности 2,5×106 клеток/мл. Клетки высевали при 100 мкл/лунка (2,5×105 клеток/лунка) в 96-луночных планшетах, обработанных тканевой культурой (Falcon). Серийные разведения соединений, растворенные в 100% ДМСО, добавляли в трех повторах к клеткам с получением конечной концентрации 0,1% ДМСО. Клетки инкубировали с соединением в течение 30 минут при 37°C, 5% CO2, затем добавляли 100 мкл/лунка 740 мкМ R848 (Resiquimod; GLSynthesis, Worcester, MA) в полной среде для конечной концентрации 370 нм R848. Клетки инкубировали в течение 20 часов при 37°C, 5% СО2. Супернатанты культур собирали, и уровни IL-6 оценивали с использованием стандартной процедуры ELISA в соответствии с протоколом, рекомендованным производителем (BD Biosciences, Inc., San Diego, CA). Полученные данные приведены ниже в таблице 7.
|
[0726] Фармакологические исследования in vivo:
[0727] Экспресс анализ in vivo (STIV). Шести-восьми недельным самкам мышей линии BALB/с (Jackson Labs, Bar Harbor, ME) перорально вводили через зонд, в объеме 200 мкл, соединения антагониста, объединенные с 0,5% водным раствором метил-целлюлозы (Sigma, St. Louis, MO). После этого в разные моменты времени для стимулирования TLR7 мышам вводили подкожно, в объеме 100 мкл, 15 мкг R848 (Resiquimod; GLSynthesis, Worcester, MA). Плазму крови собирали пункцией сердца, и определяли уровни IL-6 через 1,5 часа после стимуляции LR7 с использованием стандартной процедуры ELISA в соответствии с протоколом, рекомендованным производителем (R&D Systems).
[0728] Формы мышиной модели волчанки. Мышей самок линии NZB WF1/J приобретали у компании Jackson Labs (Bar Harbor, ME), обе из которых демонстрировали спонтанную волчанку. Самок мышей линии DBA/1 приобретали у компании Harlan Laboratories (Indianapolis, IN) и, в указанном возрасте, внутрибрюшинно инъецировали 0,5 мл пристана (2,6,10,14-тетраметилпентадекан; Sigma, St. Louis, MO) для индуцирования химическим способом волчанки, или 0,5 мл PBS для получения аналогичных по возрасту небольных контрольных мышей.
[0729] Дальнейшее исследование варианта осуществления показано на фиг.2A-фиг.2C, демонстрирующих исследование ER-899742 на модели волчанки у мышей линии NZBxNZW (далее сокращенно NZBWF1/J или NZB/W). Самок мышей линии NZBWF1/J получали в возрасте 5 недель, выполняли начальный отбор крови и контролировали прогрессирование заболевания у мышей по следующим титрам анти-дцДНК. Мышей в возрасте 27 недель распределяли в случайном порядке на группы с эквивалентными средними анти-дцДНК титрами, и в возрасте 29 недель обрабатывали только носителем (Veh; 0,5% метил-целлюлозы) или перорально один раз в день (QD РО) в дозе 33, 100 или 300 мг/кг. Через 17 недель обработки у мышей в возрасте 46 недель отбирали кровь и исследовали титры анти-дцДНК. Всех мышей в возрасте 50 недель умерщвляли (21 неделя обработки соединением). На фиг.2(а) показано, что незадолго до достижения 50-недельного возраста (через 21 неделю обработки) у отдельных мышей собирали мочу, и для каждого животного определяли соотношение альбумин/креатинин в моче (UACR, протеинурия) в качестве косвенного показателя функции почек. На фиг.2(B) показана динамика смертности, наблюдаемая в этом исследовании для групп, обработанной самой высокой и самой низкой дозой. После обработки соединением смертность не наблюдалась. Кроме того, в группе, обработанной средней дозой (не показано), смертность не наблюдалась. На фиг.2(С) показано влияние обработки на анти-дцДНК титры через 17 недель введения препарата, в возрасте 46-ти недель. Не наблюдался статистически значимый эффект.
[0730] В конце эксперимента у подопытных животных отбирали почки, как показано на фиг.2А-2С, фиксировали в 10% формалине в течение 24 часов, заливали в парафин, и Н&Е окрашенные срезы получали для гистопатологической оценки слепым методом (степень 0/1+: от «в пределах нормы» до минимальной; степень 2: умеренная; степень 3: от умеренно выраженной до выраженной; степень 4: тяжелая). Результаты представлены в таблице 8.
[0731]
|
[0732] Оценка титров аутоантител методом ELISA. Титры анти-дсДНК, -Sm/яРНА, -RiboP и -гистона оценивали с использованием стандартного метода ELISA. Вкратце, 96-луночные EIA/RIA ELISA планшеты (Corning) покрывали 100 мкл разбавленного антигена в PBS в течение 90 минут при комнатной температуре в следующей последовательности (указаны конечные концентрации): 10 ед/мл комплекс Sm/яРНП (Immunovision), 10 мкг/мл дцДНК тимуса теленка (Sigma), 5 ед/мл RiboP (Immunovision) и 5 мкг/мл гистон (Immunovision). Планшеты промывали PBS/0,05% Tween 20 (промывочный буфер) и блокировали в течение ночи PBS/1% BSA (блокирующий буфер) при 4°C. Планшеты промывали, образцы плазмы мыши, разведенные в блокирующем буфере (в пределах 1:25-1:10000 в зависимости от модели и антигена), добавляли в лунки в объеме 100 мкл на лунку, и планшеты инкубировали в течение 90 минут при комнатной температуре. Затем планшеты промывали, в каждую лунку добавляли 100 мкл анти-мышиного-IgG-HRPO (Southern Biotech), разбавленного 1:50000 в PBS/1%BSA/0,05%>Tween, и планшеты инкубировали в течение 90 минут при комнатной температуре. Планшеты промывали и в лунки добавляли 100 мкл 1:1 смеси компонентов субстрата из набора субстрата OptEIA ТМВ (BD Biosciences). Планшеты инкубировали при комнатной температуре и, после достаточного формирования цвета, реакцию останавливали добавлением 100 мкл раствора 0,18M серной кислоты. Планшеты считывали спектрофотометрическим методом при длине волны 450 нм.
[0733] Оценка протеинурии. У отдельных мышей отбирали мочу либо вручную, либо путем помещения 1-2 мышей на метаболическую клетку на 18 часов, и для каждого животного определяли соотношение альбумин/креатинин в моче (UACR) в качестве косвенного показателя функции почек. (UACR вычисляли как соотношение альбумина (мг) и креатинина (г) на децилитр мочи). Определяли уровни альбумина в образцах мочи, используя специальный протокол «сэндвич»-метода ELISA с использованием набора мышиных антител к альбумину (Bethyl Labs), который включал покрывающее антитело и вторичное антитело, меченное конъюгатом HRP для обнаружения. Уровни креатинина определяли с использованием коммерческого набора для анализа креатинина (Cayman).
[0734] Гистологическая оценка нефрита. У отдельных мышей изымали почки, фиксировали в 10% формалине в течение 24 часов, заливали в парафин и получали Н&Е окрашенные срезы для патоморфологической оценки слепым способом. Симптомы для оценки нефрита являются следующими: Степень 0 - нормальные пределы; Степень 1 - лентовидное утолщение капиллярных стенок; Степень 2 - повышенное содержание паренхиматозных клеток, сегментирование, образование серповидных тел; Степень 3 - смотри Степень 2, увеличение тяжести и степени (% поражения клубочков) поражения клубочков; Степень 4 - склероз; тяжелая гломерулярная болезнь (нефункциональный орган).
[0735] Оценка экспрессии генов интерферона в цельной крови. Экспрессию IFN-регулируемых генов в цельной крови измеряли с помощью кПЦР. Вкратце, мышей умерщвляли, кровь отбирали через полую вену, и 100 мкл хранили в пробирках, содержащих RNAlater (Ambion, Austin TX). Суммарную РНК выделяли с использованием набора Mouse RiboPure Blood RNA Isolation Kit (Ambion). Концентрации РНК определяли с использованием спектрофотометра NanoDrop ND-1000 (Thermo Scientific, Waltham MA). Синтезировали первую цепь кДНК из 100 нг суммарной РНК с использованием смеси Superscript® Vilo™ Master Mix (Life Technologies, Grand Island, NY). После обратной транскрипции кДНК разбавляли водой без нуклеаз и перемешивали со смесью TaqMan® Fast Advanced Master Mix (Applied Biosystems). Затем смесь наносили на специальный TaqMan® Low Density Array (TLDA), произведенный фирмой Applied Biosystems, и кПЦР выполняли на ABI 7900HT Fast Real-time PCR System (Applied Biosystems). Исходные данные объединяли с помощью RQ-Manager 1.2.1 (Applied Biosystems) и анализировали с использованием программного обеспечения Genedata Analyst 2.2 (Genedata).
[0736] Панель TLDA содержит до 45 генов-мишеней, выбранных из таблицы 9, представленной ниже, и 3 конститутивных гена для нормализации. Конститутивные гены Hprtl выбирали для нормализации на основе коэффициента вариации. Относительные величины определяли для генов-мишеней и использовали для вычисления кратности изменения для каждой пораженной заболеванием мыши относительно контрольной группы, непораженной заболеванием, которой вводили внутрибрюшинно только инъекции PBS. Стандартный t-критерий Стьюдента осуществляли с целью определения того, какие гены-мишени значительно увеличены между группой непораженной заболеванием (обработанной PBS) и группой, пораженной заболеванием и обработанной наполнителем (обработанной пристаном), представляя, таким образом, набор заболевание-регулированных генов. На фиг.7G показана коррекция ложных результатов при множественном сравнении (FDR) с помощью команды p.adjust в пакете «базовый» с опцией по умолчанию. Holm, S. A simple sequentially rejective multiple test procedure. Scandinavian Journal of Statistics, 1979. 6(2): p. 65-70. Впоследствии для каждой мыши вычисляли «показатель IFN» как медианное кратное изменение всех заболевание-регулированных генов, идентифицированных в t-критерии.
|