Результат интеллектуальной деятельности: Способ получения жидкого пробиотического препарата
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к технологии приготовления пробиотических бактериальных препаратов для профилактики болезней, а также повышения продуктивности сельскохозяйственной птицы.
Известен способ получения пробиотика для ветеринарии, предусматривающий выращивание лактобактерий и культивирование на соево-печеночной среде в термостате при температуре 36-38°С, причем дополнительно выращивают чистые культуры Bacillus subtilis, Rhuminococcus albus, из лактобактерий Lactobacillus plantarum, культивирование проводят раздельно в течение 72 часов, после чего полученные культуральные жидкости смешивают в равных количествах (аналог - RU №2084233, дата публикации 20.07.97).
Однако в известном способе в качестве одного из компонентов пробиотического препарата используется Lactobacillus plantarum, который благодаря своим свойствам широко используется в силосовании зеленой массы растений, но мало используется для нормализации работы желудочно-кишечного тракта. Кроме того, в данном способе не указывается источник, из которого выделены используемые в препарате микроорганизмы, что не может обеспечивать высокую эффективность предлагаемого препарата. Следует отметить, что пробиотик, полученный по указанному способу, получится дорогостоящим для применения в животноводстве и птицеводстве, так как каждый вид микроорганизмов культивируется отдельно, что усложняет технологический процесс и требует дополнительного оборудования. Также следует отметить, что такой препарат не может обладать комплексным действием: пробиотическим, антимикробным, иммуномодулирующим и располагать целлюлозолитической активностью.
Известен способ применения молочно-кислой кормовой добавки в кормлении свиней, которая создана на основе лактобактерий (МКД-L), содержит лецитин, органические кислоты, ферменты, микроорганизмы, входящие в состав молочнокислой кормовой добавки, витамины С, А, Д, Е, В 1, 2, 3, 5, 6, 12, аминокислоты, антибиотика подобные вещества. (аналог - статья Молочнокислая кормовая добавка в кормлении свиней, авторы: Ланцева Н.Н., Швыдков А.Н., Барков Д.А., Рябуха Л.А., Чебаков В.П. В сборнике: Пища. Экология. Качество Труды XIII международной научно-практической конференции. - 2016. - С. 131-136).
Недостатком данного способа является кратковременный срок хранения добавки.
Наиболее близким к заявляемому способу является способ получения жидкого пробиотического препарата включающего в себя раздельное выращивание в условиях глубинного культивирования микроорганизмов Lactobacillus, Rhuminococcus albus, Bacillus subtilis до заданного достижения титра каждого микроорганизма и смешивание полученных культуральных жидкостей (прототип RU - №2266126, дата публикации 20.12.2005).
Известный способ не позволяет достичь долгого срока хранения биопрепарата и не защищает его от контаминации условно-патогенной микрофлорой.
Техническим результатом является препятствие контаминации жидкого пробиотического препарата условно патогенной микрофлорой и увеличение срока его хранения за счет консерванта.
Технический результат достигается тем, что в способе получения жидкого пробиотического препарата, включающем выбор культур микроорганизмов Lactobacillus acidophilus Scav. В-4625, Rhuminococcus albus Kr и Bacillus subtilis B-8130, подбор оптимальных питательных сред для их глубинного культивирования, смешивание полученных культуральных жидкостей, согласно изобретению на стадии смешивания в стерильных условиях в смесь культуральных жидкостей для обеспечения срока хранения биопрепарата до 28 суток и снижения контаминации условно-патогенной микрофлорой, добавляют консервант в дозе 0,5-2 г/л, в качестве которого используют нипагин.
Новизна заявляемого способа получения жидкого пробиотического препарата состоит во введении в состав жидкого пробиотического препарата компонента нипагина, сочетающего свойства антисептика и консерванта.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении уровня данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Способ получения жидкого пробиотического препарата применим в лабораториях животноводческих и ветеринарных научно-исследовательских институтов, в биотехнологических лабораториях, на ветеринарных станциях, что соответствует критерию «промышленная применимость».
Способ получения жидкого пробиотического препарата осуществляют следующим образом.
Для получения жидкого пробиотического препарата смешивают между собой культуральные жидкости микроорганизмов Lactobacillus acidophilus Scav. В-4625, Rhuminococcus albus Kr и Bacillus subtilis B-8130. Причем микроорганизмы Lactobacillus acidophilus Scav. B-4625, Rhuminococcus albus Kr выращивают совместно на жидкой питательной среде, состоящей из рубцовой жидкости, шрота подсолнечного, мясопептонного бульона, хлористого натрия, сульфата магния, двузамещенного фосфорнокислого калия, сульфата аммония и карбоната кальция.
Температурой культивирования микроорганизмов Lactobacillus acidophilus Scav. В-4625, Rhuminococcus albus Kr является интервал 37-40°С, а временем 4-6 суток. Если температуру снизить ниже 37°С, рост культуры будет медленный, и она не достигнет необходимого титра за 5 суток. Если температура культивирования окажется выше 40°С, то рост культуры также будет снижаться, а ее дальнейшее повышением может привести к гибели микроорганизмов. Поэтому для достижения необходимого титра культурами оптимальным временем культивирования является 5 суток при температуре 38°С.
Микроорганизмы Bacillus subtilis B-8130, выделенные из слепых отростков кишечника глухаря, выращивают на жидкой питательной среде, состоящей из дрожжей, мелассы, шрота подсолнечникового, глютена, сульфата магния, двузамещенного фосфорнокислого калия и хлористого кальция.
Температурой культивирования микроорганизмов Bacillus subtilis B-8130 является интервал 37-45°С, а временем 4-6 суток. Если температуру снизить ниже 37°С, рост культуры будет медленный, и она не достигнет необходимого титра за 5 суток. Если температура культивирования окажется выше 45°С, то рост культуры также будет снижаться, а ее дальнейшее повышением может привести к гибели микроорганизмов. Поэтому для достижения необходимого титра культурами оптимальным временем культивирования является 5 суток при температуре 41°С.
Полученные таким образом суспензии объединяют.
Для повышения сроков хранения и предотвращения дальнейшей контаминации биопрепарата посторонней микрофлорой, в пробиотик добавляли консервант. В работе использовалось два консерванта: кислота молочная и нипагин. При выборе консерванта количество нипагина изменяли от 0,5 до 5 г/л, а количество кислоты молочной - от 5 до 40 г/л. Для оценки эффективности консервантов использовали методику, описанную в ОФС.1.2.4.0011.15 «Определение эффективности антимикробных консервантов». Согласно требованиям ОФС.1.2.4.0011.15, разрабатываемый биопрепарат относится к категории III - лекарственный препарат для приема внутрь, за исключением антацидов, водорастворимый или приготовленный на водной основе. Проводимые испытания заключаются в искусственной контаминации пробиотика тест штаммами эталонных микроорганизмов - St. Aureus - АТСС 6538, E.coli - АТСС 25922, С.albicans - NCTC 885-653. Согласно требованиям ОФС.1.2.4.0011.15 для лекарственных препаратов III категории после контаминации логарифм числа бактерий в 1 мл, по сравнению с исходным, должен через 14 дней уменьшиться не менее чем на 1, а с 14 до 28 суток не должно быть увеличения логарифма числа бактерий. Логарифм числа грибов через 14 и 28 сутки не должен возрастать, по сравнению с исходным. Готовили серию пробиотика и его готовой к применению формы с различным содержанием нипагина: 0,5, 1, 2 и 5 г/л и молочной кислоты: 5, 10, 20 и 40 г/л. В качестве контроля использовали пробиотики без добавления консервантов. Предварительно были подготовлены образцы тест-штаммов микроорганизмов. Тест-штаммы высевали из ампул в пробирки с питательной средой. Для бактерий использовали Соево-казеиновый бульон, для грибов - среду Сабуро с глюкозой. Пробирки с бактериями инкубировали при 33°С, с Candida albicans - при 22°С в течение 24 часов. Затем делали еще один пассаж на те же среды и через 24-48 часов проводили пересев на чашки Петри для получения изолированных колоний. Бактерии пересевали на Соево-казеиновый агар, Candida albicans пересевали на агар Сабуро с глюкозой. После инкубирования типичные колонии при помощи бактериологической петли пересевали на скошенный агар в пробирки - бактерии на соево-казеиновый агар, грибы - на агар Сабуро с глюкозойи, инкубировали как указано выше. Выросшие культуры смывали 5 мл стерильного фосфатного буферного раствора (pH=7,0). Затем все культуры разводили до содержания 109 КОЕ/мл. Приготовленные инокуляты микроорганизмов использовали для проведения испытания. Для изучения консервирующего действия к 10 мл изучаемых биопрепаратов добавляли по 0,1 мл одного из инокулятов бактерий и грибов. При этом исходная концентрация микроорганизмов составляла 107 КОЕ/мл биопрепарата.
Испытания проводили согласно требованиям Письма от 29 октября 2001 года N 291-22/144 Об Изменении N2 к статье Государственной фармакопеи XI изд. "Методы микробиологического контроля лекарственных средств" с изменениями 1, 2 и 3. Определение количества бактерий и грибов выполняли двухслойным агаровым методом в чашках Петри диаметром 90-100 мм. Для исследования использовали разведения в фосфатном буферном растворе с pH 7,0: 1:10; 1:100; 1:1000; 1:10000. Затем 1 мл каждого разведения биопрепарата вносили в каждую из двух пробирок с 4 мл расплавленной и охлажденной до температуры 45 до 50°С с соево-казеиновым агаром. Быстрым покачиванием чашки Петри равномерно распределяли верхний слой агара. После застывания среды чашки переворачивали и инкубировали при температуре от 30 до 35°С. Через 48 часов и через 7, 14, 28 сутки подсчитывали число бактериальных колоний на двух чашках для каждого разведения, находили среднее значение, умножая его на показатель разведения, вычисляли число бактерий в 1 мл образца.
При определении числа грибов каждое разведение биопрепарата вносили по 1 мл в каждую из двух пробирок с 4 мл расплавленной и охлажденной до температуры 45 до 50°С среды Сабуро. Быстро перемешивали содержимое пробирки и переносили в чашки Петри со средой Сабуро, в которые предварительно добавляли по 0,2 мл взвесь культуры Candida albicans. Быстрым покачиванием чашки Петри равномерно распределяли верхний слой агара, после застывания среды чашки переворачивали. Посевы инкубировали при температуре от 20 до 25°С. Через 48 часов и через 7, 14, 28 сутки проводили наблюдения и подсчитывали общее число колоний грибов на двух чашках для каждого разведения, находили среднее значение, умножали его на показатель разведения и вычисляли число грибов в 1 мл образца. Результаты определения логарифма общего числа условно-патогенных и полезных бактерий, а также грибов приведены в таблице 1 и 2.
Представленные данные этих таблиц свидетельствуют о том, что угнетение роста микроорганизмов и гриба наблюдается в препарате с содержанием нипагина в дозировке 0,5 г/л, а полное уничтожение наблюдается в диапазоне от 1,0 до 5,0 г/л, в то время как молочная кислота в изучаемых дозировках ни в одном из вариантом не проявила полного подавляющего действия. При этом, следует отметить, что титр полезных микроорганизмов с увеличением доз консервантов в течение времени снижается. Минимум данного эффекта наблюдалось при использовании нипагина в дозировке 0,5-1,0 г/л.
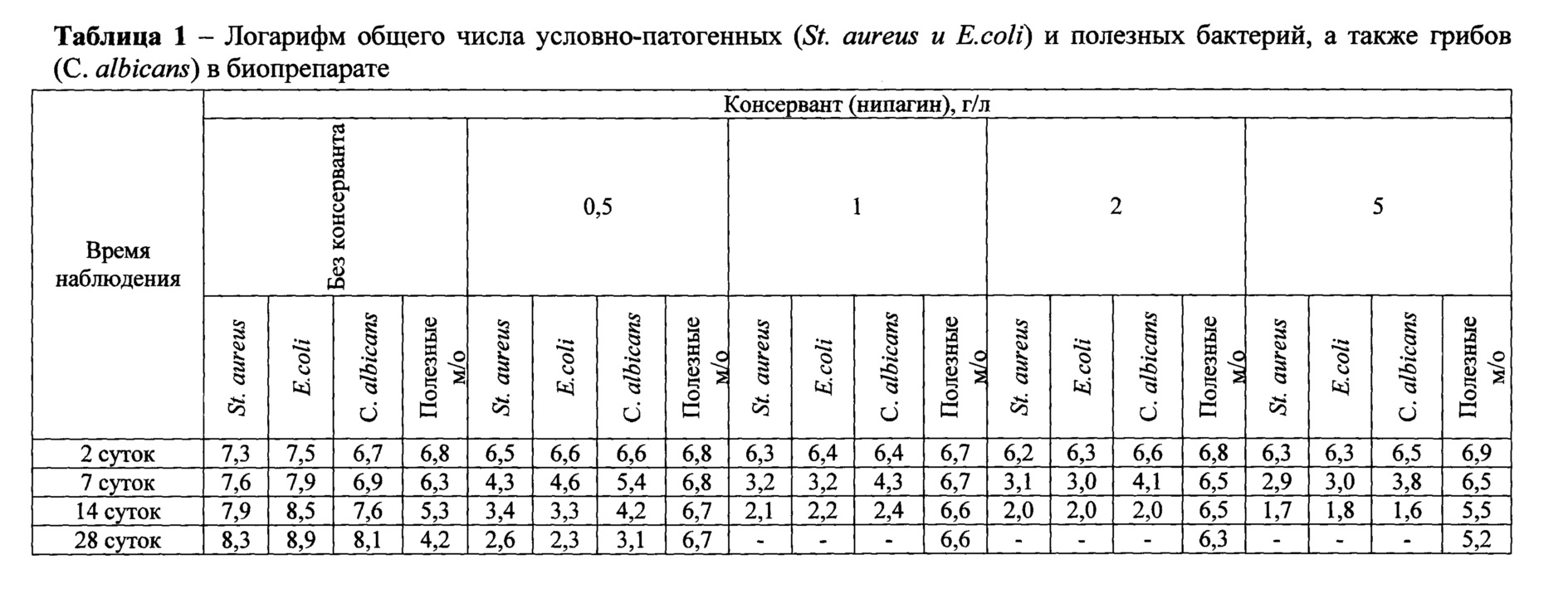
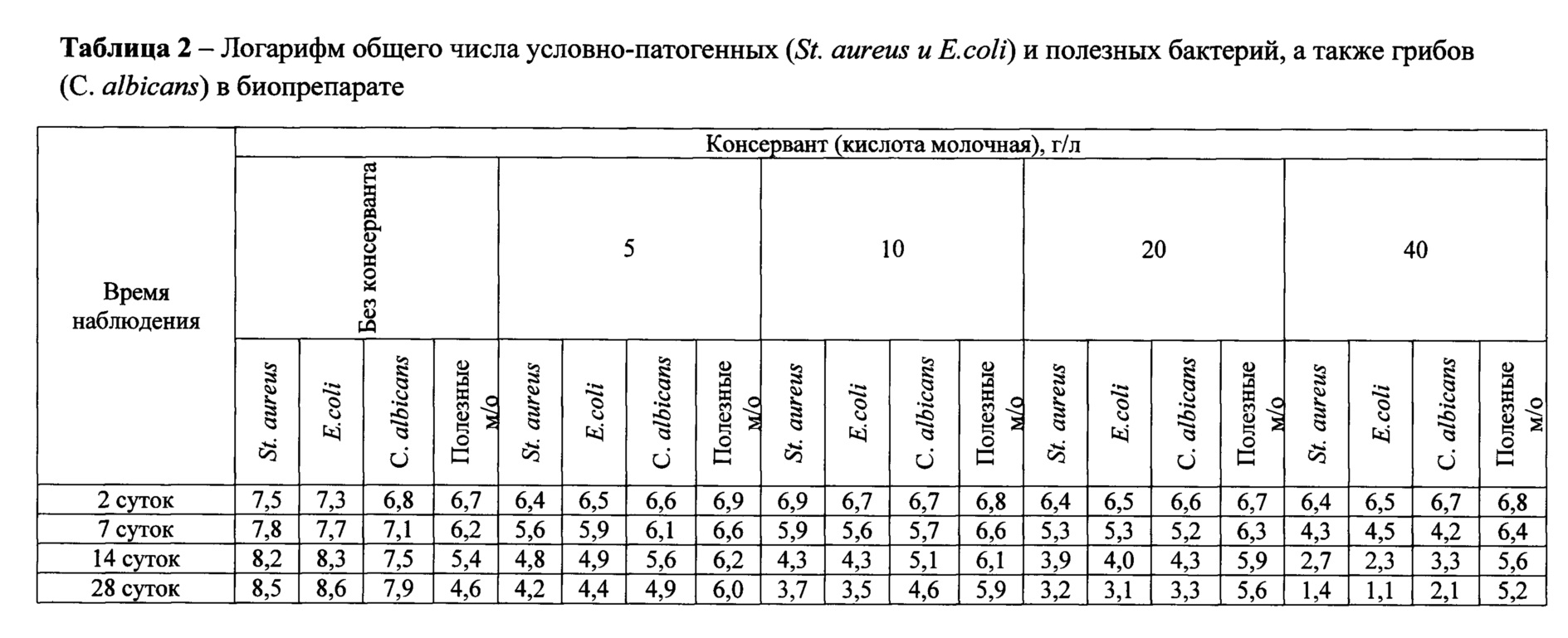
Таким образом, если внести в препарат Lactobacillus acidophilus Scav. В-4625 и Rhuminococcus albus Kr меньше 45%, то пробиотической активности препарата не будет, так как количество бактерий будет недостаточно, и целлюлозолитическая активность препарата не будет регистрироваться ввиду недостаточного количества бактерий для эффективного процесса разрушения клетчатки. Если внести более 55% суспензии бактерий видов Lactobacillus acidophilus Scav. В-4625 и Rhuminococcus albus Kr, то антимикробный эффект не увеличивается, скорость разрушения клетчатки не увеличиться, так как субстрата для их развития будет недостаточно и поэтому нет необходимости вводить больше бактерий. Для того чтобы эффективность препарата была оптимальной, количество молочнокислых бактерий вида Lactobacillus acidophilus Scav. В-4625 и целлюлозолитических бактерий Rhuminococcus albus Kr должно составлять 50% от общего количества микроорганизмов в предлагаемом препарате. Если внести в препарат Bacillus subtilis В-8130 меньше 45%, то антимикробная и иммуностимулирующая активности препарата будут низкие, так как количество бактерий будет недостаточно. Если внести более 55%, то увеличение требуемого эффекта наблюдаться не будет. Для того, чтобы эффективность препарата была оптимальной, количество бацилл вида Bacillus subtilis В-8130 должно составлять 50%. Чтобы предотвратить контаминацию биопрепарата патогенной микрофлорой и продлить его срок хранения, необходимо добавить консервант - нипагин в дозе от 0,5 до 2,0 г/л, так как если использовать его меньше, то угнетение и полное отсутствие посторонней микрофлоры не выявляется, а использование большего количества - нецелесообразно, ввиду того что начинает гибнуть полезная микрофлора, что снижает пробиотическую активность препарата. Оптимальной дозировкой можно считать 1,0 г/л нипагина, так как наблюдается полное отсутствие роста патогенной микрофлоры и минимальное снижение уровня полезной микрофлоры.
Пример конкретного осуществления способа получения жидкого пробиотического препарата.
Выращивание бактериальных культур Lactobacillus acidophilus Scav. В-4625 и Rhuminococcus albus Kr осуществляют на жидкой питательной среде. В качестве питательной среды использовали состав, на который после автоклавирования при 1 атм в течение 1 час, и охлаждения засевали чистую культуру микроорганизмов, методом смыва со кошеного агара.
Выращивание осуществляли в колбах для культивирования микрофлоры объемом 3 литра без встряхивания в течение 5 суток при температуре 37-40°С до получения титра бактериальных клеток 2×108 кл./мл среды.
Одновременно культивируют Bacillus subtilis В-8130 на жидкой питательной среде. В качестве питательной среды использовали состав, на который после автоклавирования при 1 атм в течение 1 час и охлаждения засевали чистую культуру микроорганизмов, методом смыва со кошеного агара.
Выращивание осуществляли в колбах для культивирования микроорганизмов объемом 3 литра без встряхивания в течение 5 суток при температуре 37-45°С до получения титра микрофлоры 1×108 кл/мл среды.
Полученные таким образом культуральные жидкости объединяются стерильно в соотношении 1:1 по объему.
Далее, к полученному пробиотическому препарату в стерильных условиях добавляли консервант - нипагин в дозировке 1,0 г/л, так как данная доза считается оптимальной ввиду того, что обеспечивает полное отсутствие роста патогенной микрофлоры и минимальное снижение уровня полезной микрофлоры.
Испытание эффективности полученного жидкого пробиотического препарата осуществлялся в хозяйстве Республики Адыгея на перепелах японской породы, изучая влияние пробиотика на мясную и яичную продуктивность сельскохозяйственной птицы.
Использовалась технология содержания перепелов, рекомендованная ВНИТИП: с первых суток до 42-х суток птицу содержали вместе без учета половой принадлежности, в 42-суточном возрасте формировали родительские группы и переводили в клетки по 40 голов (из них 6 самцов и 34 самки) для получения яиц. Выбракованных перепелов отправляли на убой для получения тушек и дальнейшей реализации.
В суточном возрасте методом групп-аналогов было сформировано три группы перепелов по 150 голов в каждой. Схема научно-хозяйственного опыта представлена в таблице 3.
В 42-суточном возрасте из контрольной и опытных групп были сформированы одноименные группы в каждой по 40 голов (34 самки и 6 самцов), которых продолжали кормить, как и до 42-х суток. Выбракованную птицу отправляли на убой для изучения мясных качеств сельскохозяйственной птицы. Учет яйценоскости вели с момента формирования родительского стада. Длительность опыта составила 168 дней.

Перепела содержались в специально сконструированных производственных шестиярусных клетках. Каждый ярус состоял из двух секций, рассчитанных на 20 голов. Поение осуществлялось из ниппельных поилок, к которым птица имела постоянный доступ. Раздачу кормов производили вручную. Технологические параметры соответствовали рекомендациям ВНИТИП. Условия содержания и кормления в контрольной и опытных группах были одинаковыми.
Данные хозяйственных показателей по выращиванию перепелов с использованием пробиотической кормовой добавки представлены в таблице 4.
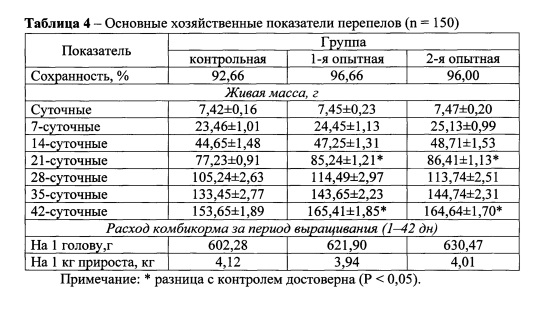
Из таблицы видно, что уже на 7-е сутки живая масса перепелов в 1-й и 2-й опытных группах превысила этот показатель в контрольной на 4,22 и 7,12%. На 21-е сутки живая масса перепелов опытных групп была достоверно (Р < 0,05) выше, чем в контроле на 10,36 и 11,89%. На 28-е сутки наблюдалась тенденция к увеличению живой массы перепелов опытных групп и в среднем составила в 1-й - 114,49 г, во 2-й - 113,74 г, против 105,24 г в контрольной. К 35-суточному возрасту наблюдалось повышение живой массы перепелов в 1-й и 2-й опытных группах по отношению к контрольной на 7,64 и 8,46% соответственно. На 42-е сутки живая масса перепелов опытных групп была выше, чем в контроле на 7,65 и 7,15%, при статистически достоверной (Р < 0,05) разнице.
Не смотря на то, что расход комбикормов в опытных группах был выше, чем в контрольной, его затраты на 1 кг прироста живой массы были ниже в 1-й опытной группе на 4,37%, а во 2-й - на 2,67%.
Сохранность перепелов за период выращивания составила в 1-й опытной группе - 96,66%, во 2-й - 96,00% против 92,66% в контрольной.
Данные влияния жидкого пробиотика на мясную продуктивность и развитие внутренних органов перепелов представлены в таблице 5.
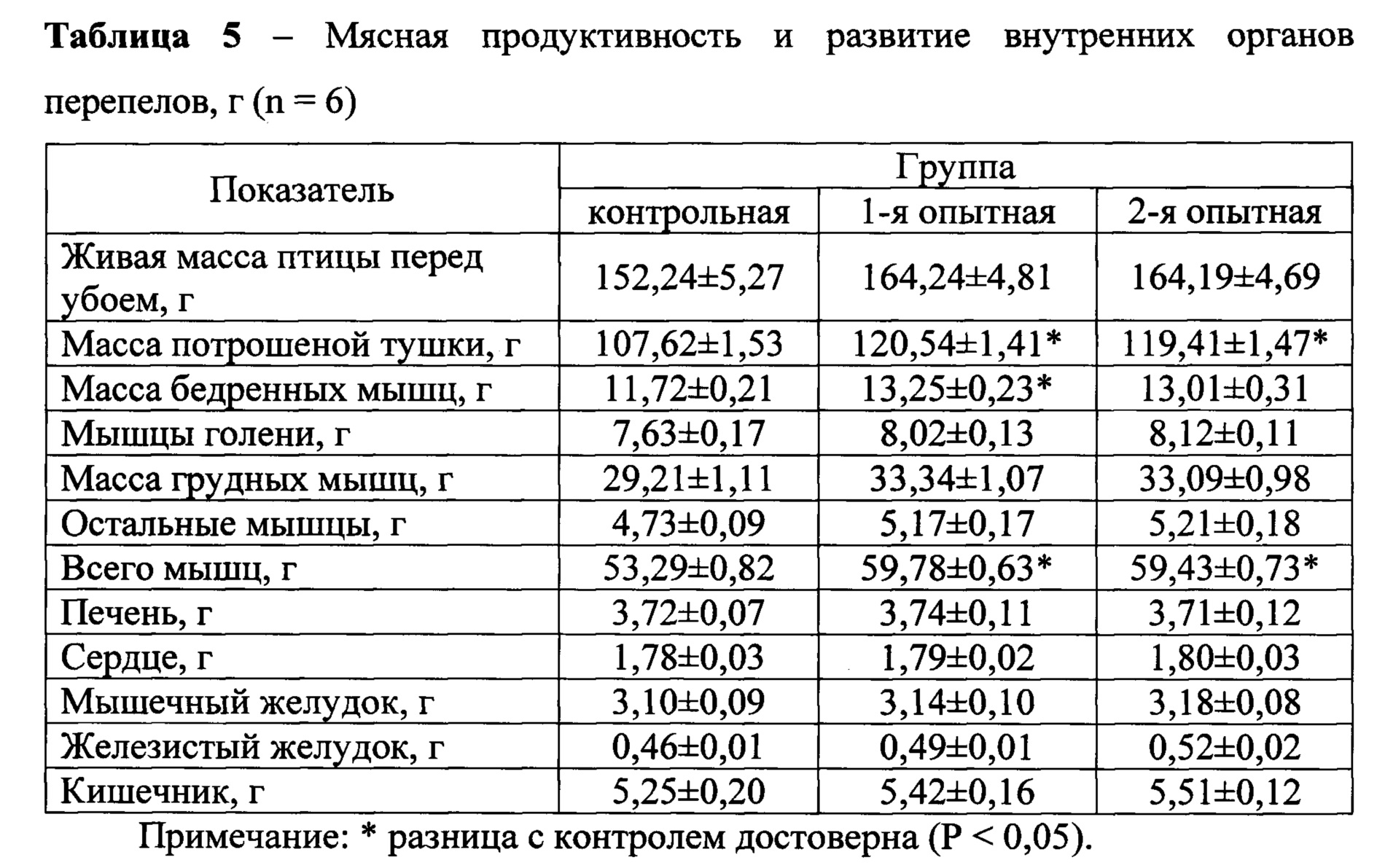
Как видно из данных таблицы, средняя масса потрошеной тушки в 1-й опытной группе составила 120,54 г, во 2-й - 119,41 г, что достоверно (Р<0,05) выше по сравнению с контрольной, на 12,01 и 10,96% соответственно.
Для определения мясных качеств животных и птицы наиболее важно изучение съедобных частей тела. Самыми ценными группами мышц в птичьей тушке являются грудные мышцы, которые в 1-й опытной группе имели массу 33,34 г, или 20,30% от предубойной живой массы, а во 2-й - 33,09 г, или 20,15% от предубойной живой массы, что выше от предубойной живой массы грудных мышц в контрольной группе на 1,11 и 0,96%. Данные массы бедренных мышц показали, что в 1-й опытной группе средняя масса их составила 13,25 г, во 2-й - 13,01 г, что на 0,37 и 0,22% выше от предубойной живой массы бедренных мышц в контроле, соответственно (Р<0,05). Наблюдалось повышение массы мышц голени в 1-й и 2-й опытных группах, которое составило 8,02 и 8,12 г, что выше, чем в контроле на 0,39 и 0,49 г соответственно.
В целом, средняя масса всех мышц в опытных группах перепелов составила, соответственно, 59,78 и 59,43 г, что на 1,40 и 1,20% выше от предубойной живой массой всех мышц в контрольной группе при статистически достоверной (Р<0,05) разнице. Достоверных различий по массе внутренних органов в разрезе групп не наблюдалось.
Таким образом, полученные результаты показывают, что использование жидкой пробиотической кормовой добавки в период развития перепелов положительно сказывается на ростовых и мясных показателях птицы, сохранности поголовья и затратах кормов на прирост живой массы. Наилучшие показатели наблюдались при вводе добавки в дозе 0,2% к массе комбикорма.
Данные влияния добавки на яичную продуктивность перепелов представлены в таблицах 6 и 7. Учет яичной продуктивности перепелок-несушек начали в 42-дневном возрасте, что определено стандартом технологии.
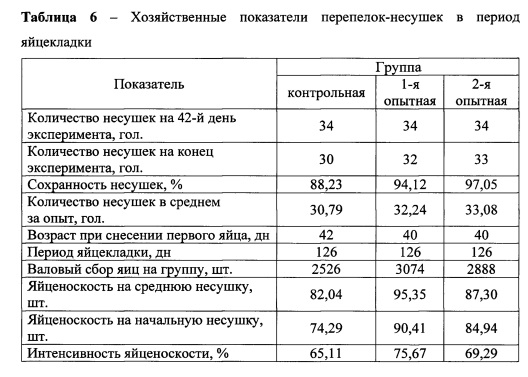
Данные таблицы показывают, что количество несушек на конец опыта в 1-й и 2-й опытных группах составило 32 и 33 голов, что больше по отношению к контрольной на 5,89 и 8,82%. Первое яйцо перепела опытных групп снесли в 40-суточном возрасте, что раньше, чем в контроле на 2 дня. Валовой сбор яиц за весь период учета яйцекладки (126 дней) у перепелов 1-й опытной группы составил 3074 шт., во 2-й - 2888 шт., что больше, чем в контрольной группе на 548 и 362 яйца, или 21,69 и 14,33%. В целом, интенсивность яйценоскости у перепелов опытных групп больше, чем в контроле на 10,56 и 4,18% соответственно.
Рассматривая яичную продуктивность перепелов контрольной и опытных групп по возрастным периодам эксперимента, следует обратить внимание на быстро возрастающую интенсивность яйцекладки.
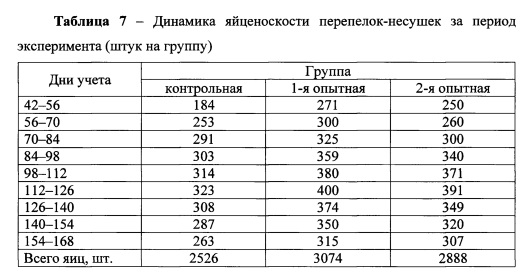
Данные таблицы показывают, что за первые две недели (42-56 дней) количество снесенных яиц перепелами 1-й и 2-й опытных групп было больше, чем в контрольной на 87 и 66 штук. Аналогичная тенденция сохранилась и в другие дни учета яйцекладки. Следует обратить внимание, что в период с 42-х и до 126-суточного возраста яичная продуктивность постепенно возрастала во всех группах перепелов и максимальный пик яйценоскости пришелся на 112-126-е сутки учета. В данный период количество снесенных яиц у перепелов опытных групп составило 400 и 391 штук, в контрольной группе - 323 штук. Затем яйценоскость в группах стала постепенно снижаться, но разница по изучаемому показателю в опытных группах перепелов по сравнению с контрольной сохранилась. Так, в последний учетный период (154-168 суток) количество снесенных яиц перепелами 1-й опытной группы составило 315 штук, во 2-й - 307 штук, что больше по сравнению с контрольной на 19,77 и 16,73%.
Таким образом, исходя из полученных в ходе исследований данных, можно сделать вывод, что добавленный в жидкий пробиотический препарат компонент нипагин эффективно сочетает свойство антисептика, так как подавляет рост условно-патогенной микрофлоры в биопрепарате, и консерванта, так как поддерживает высокий титр полезных микроорганизмов длительное время, а также позволяет улучшить качественные показатели жидкого пробиотического препарата, а в целом биопрепарат способствует увеличению конверсии корма, улучшает интенсивность яйценоскости, а также улучшает мясную продуктивность у сельскохозяйственной птицы.
Способ получения жидкого пробиотического препарата, включающий выбор культур микроорганизмов Lactobacillus acidophilus Scav. В-4625, Rhuminococcus albus Кr и Bacillus subtilis B-8130, подбор оптимальных питательных сред для их глубинного культивирования, смешивание полученных культуральных жидкостей, отличающийся тем, что на стадии смешивания в стерильных условиях в смесь культуральных жидкостей для обеспечения срока хранения биопрепарата до 28 суток и снижения контаминации условно-патогенной микрофлорой добавляют консервант в дозе 0,5 г/л; 1-2 г/л, в качестве которого используют нипагин.
