Результат интеллектуальной деятельности: АДДУКТЫ ТРИАЛЛИЛБОРАНОВ С АММИАКОМ И АМИНАМИ В КАЧЕСТВЕ АЛЛИЛИРУЮЩИХ РЕАГЕНТОВ
Вид РИД
Изобретение
Изобретение относится к химии элементоорганических соединений, а именно к 1:1 аддуктам триаллил-, трикротил-, триметаллил- и трипренилборанов (1-4) с аминосоединениями R1R2NH, где R1=R2=Н; R1=Н, R2=С1-12алкил или СН2С1-11цалкенил; R1=R2=Me, которые могут использоваться в качестве эффективных и удобных аллилирующих реагентов в органическом синтезе, например для трехкомпонентного аминоаллилирования карбонильных соединений с образованием гомоаллиламинов.
Продукты аминоаллилирования карбонильных соединений находят применение в синтезе разнообразных фармацевтических препаратов, природных соединений и пластических масс [Lawrence S.A. Amines: Synthesis, Properties and Applications. Cambridge UK: Cambridge University Press, 2004; Chiral Amine Synthesis: Methods, Developments and Applications /Т.С.Nugent (Ed.). Weinheim: Wiley-VCH, 2010; Puentes CO., Kouznetsov V., J. Heterocycl. Chem., 2002, 39, 595-614; Ramachandran P.V., Burghardt Т.Е., Chem. Eur. J., 2005, 11, 4387-4395; Kuznetsov N.Yu.; Bubnov Yu.N., Russ. Chem. Rev., 2015, 84 (7), 758-785].
Заявляемые аддукты, их способ получения, характеристики и использование в литературе не описаны.
С момента своего открытия аллилборсодержащие соединения в качестве аллилирующих реагентов стали исключительно важным инструментом синтетической химии [Bubnov Yu. N. Allylboranes. - In: Science of Synthesis: Houben-Weyl Methods of Molecular Transformations, Vol. 6 /D.S. Matteson, D. Kaufmann (Eds.). Stutgart (Germany): George Thieme Verlag, 2004, pp. 945-1072; Hall D., Lachance H. Allylboration of Carbonyl Compounds. Hoboken, NJ: Wiley, 2012; Hall D.G. Boronic Acids. Weinheim: Wiley, 2011; Jonnalagadda S.C., Suman P., Patel A., Jampana G., Colfer A. Allylboration. - In: Boron Reagents in Synthesis / А. Coca (Ed.). ACS Symposium Series, 2016, vol. 1236; chapter 3, pp. 67-122; Diner C, Szabo K.J., J. Am. Chem. Soc, 2017,139 (1), 2-14].
Среди множества реакций с участием аллилборанов особое внимание уделяется получению гомоаллиламинов через нуклеофильное аллилирование C=N-связей иминов [Yamamoto Y., Asao N., Chem. Rev., 1993, 93 (6), 2207-2293; Enders D., Reinhold U., Tetrahedron: Asymmetry, 1997, 8 (12), 1895-1946; Bloch R., Chem. Rev., 1998, 98 (4), 1407-1438; Yus M., Gonzalez-Gomez J.C., Foubelo F., Chem. Rev., 2011, 111 (12), 7774-7854; Ramadhar T.R, Batey R.A., Synthesis, 2011, (9), 1321-1346; Yus M.,  J.C., Foubelo F., Chem. Rev., 2013, 113 (7), 5595-5698; Huo H.-X., Duvall J.R., Huanga M.-Y., Hong R., Org. Chem. Front., 2014, 1 (3), 303-320].
J.C., Foubelo F., Chem. Rev., 2013, 113 (7), 5595-5698; Huo H.-X., Duvall J.R., Huanga M.-Y., Hong R., Org. Chem. Front., 2014, 1 (3), 303-320].
Наиболее перспективными аллилборирующими реагентами являются триаллилбораны, поскольку они характеризуются: (а) высокой реакционной способностью, (б) наличием только одного побочного продукта реакции - борной кислоты и (в) высокой атомной эффективностью (содержат три группы аллильного типа, способные к перемещению на субстрат), реализуя один из основных принципов «зеленой» химии - экономию атомов.
Однако высокая активность триаллилборанов определяет и их главные недостатки:
высокую чувствительность к кислороду воздуха (до воспламенения), что требует использования инертной атмосферы;
взрывообразное разложение в воде, спиртах и других протонодонорных соединениях, что требует обезвоживания среды и не позволяет проводить реакции в таких удобных полярных растворителях, как спирты;
затрагивание в процессе аллилирования самых разных функциональных групп, т.е. отсутствие селективности действия, что ограничивает набор субстратов;
протекание реакций при минусовой температуре.
Таким образом, очевидна необходимость в повышении стабильности триаллилборанов для возможности широкого использования их в качестве аллилирующих реагентов. Перспективным при этом может быть связывание триаллилборанов в 1:1 молекулярные аддукты с аминами.
До сих пор не были известны аддукты триаллилборанов с аммиаком, первичными и вторичными аминами. Описаны 1:1 аддукты (СН2=СНСН2)3В (1) с третичными аминами, такими как триметиламин, пиридин, 2- и 3-пиколины [Богданов B.C., Барышникова Т.К., Киселев В.Г., Михайлов Б.М., Ж. общ. хим., 1971, 41 (7), 1533-1540], и аддукты триаллилборанов 1-3 с Et2NCH2CH2NEt2 и пиридином [Schroeder S., Thiele К.Н., Z. Anorg. Allg. Chem., 1977, 428 (1), 225-230], которые получают в инертной атмосфере добавлением к триаллилборанам при охлаждении свежеперегнанных аминов в эквимолярных количествах. Полученные аддукты термически довольно устойчивы, так как выдерживают перегонку в вакууме без разложения, однако легко разлагаются под действием спиртов или воды. В пиридиновых аддуктах при этом происходит внутримолекулярное аллилирование ближайших С=N-связей пиридинового кольца, приводящее к 2,6-диаллилированным тетрагидропиридинам [Bubnov Yu.N., Shagova E.A., Evchenko S.V., Ignatenko A.E, Russ. Chem. Bull, 1994, 43, 645-656; Bubnov Yu.N., Demina E.E., Ignatenko A.V., Russ. Chem. Bull, 1997, 46, 606-607; Bubnov Yu.N., Pure Appl. Chem., 1994, 66, 235-244].
Взаимодействие триаллилборана с NH-содержащими аммиаком и первичными и вторичными аминами, происходящее с сильным разогреванием, приводило к образованию диаллиламиноборанов (CH2=CHCH2)2BNR1R2 и сопровождалось выделением пропилена. Охлаждение до 60°С не изменяло положения. Тем не менее образование аддуктов (CH2=CHCH2)3B⋅NR1R2 постулировалось в качестве первичного акта взаимодействия [Михайлов Б.М., Туторская Ф.Б., Изв. АН СССР, Сер. хим., 1961, (6), 1158-1159].
В литературе нет примеров использования каких-либо аминопроизводных аллилборанов в качестве аллилирующих реагентов.
Задачей заявляемого изобретения является создание новых аддуктов триаллилборанов, применимых в качестве эффективных и удобных в работе аллилирующих реагентов (стабильных на воздухе и устойчивых в спиртовой среде).
Поставленная задача решается 1:1 аддуктами триаллилборанов (R3R4C=CR5CH2)3B с аминосоединениями R1R2NH, где R3=R4=R5=Н; R3=СН3, R4=R5=Н; R3=R4=Н, R5==СН3; R3=R4=СН3, R5=Н, a R1=R2=Н; R1=Н, R2=С1-12алкил, СН2С1-11алкенил; R1=R2=СН3 и применением полученных аддуктов в качестве эффективных и удобных в использовании аллилирующих реагентов, в частности для трехкомпонентного аминоаллилирования карбонильных соединений с образованием гомоаллиаминов.
Заявляемые аддукты получают в отсутствие влаги в инертной атмосфере, в результате добавления избытка аминосоединения к охлаждаемому раствору триаллилборана в легкокипящем инертном растворителе и последующего испарения растворителя и избытка аминосоединения в вакууме (схема 1).
Схема 1
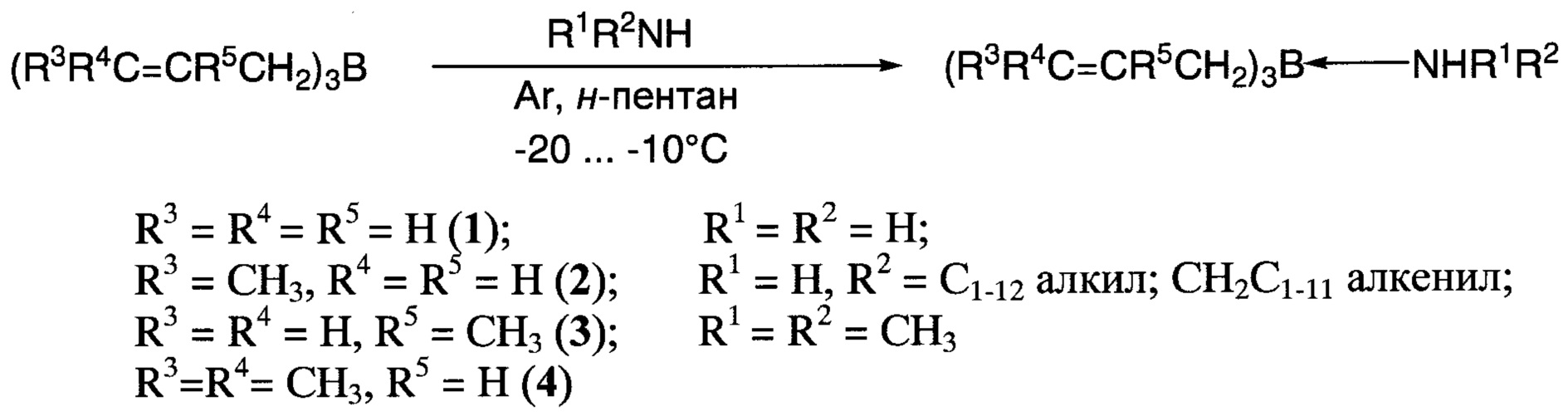
При получении соединений по изобретению аминосоединения добавляют в раствор соответствующего триаллилборана в абсолютированном пентане в атмосфере сухого аргона при температуре -20…-10°С, причем газообразные аммиак и метиламин пропускают через раствор, жидкие амины (например, аллиламин) прибавляют по каплям, газообразный диметиламин вводят в виде раствора в ТГФ; в каждом случае используют избыток аминосоединения (от 1,1 до 10 эквивалентов в зависимости от стоимости и доступности аминосоединения). Выход заявляемых аддуктов составляет 100%.
Условия процесса, особенно температурные, должны четко соблюдаться, так как их изменение может приводить к другим продуктам. Например, при введении сухого аммиака в триаллилборан в течение 30 мин при охлаждении саморазогревающейся реакционной массы до ~60°С получается диаллиламиноборан (CH2=CHCH2)2BNH2 с выходом 49% [Михайлов Б.М., Туторская Ф.Б., Изв. АН СССР, Сер. хим., 1961, (6), 1158-1159], в то время как введение аммиака при 30°С с последующим выдерживанием реакционной смеси при 150-155°С в течение 1 ч приводит к В-триаллилборазолу с выходом 80-86% [Бубнов Ю.Н., Гурский М.Е., Патент РФ №2482121 (2013)]. Прибавление триаллилборана к метанольному раствору аммиака протекает высоко экзотермично и даже при -50°С сопровождается образованием, помимо 1⋅NH3, (CH2=CHCH2)2BOMe⋅NH3 практически в эквимолярном количестве.
Заявляемые аддукты триаллилборанов 1-4 с аммиаком и алифатическими первичными и вторичными аминами представляют собой твердые или маслообразные бесцветные вещества. Их строение подтверждено данными элементного анализа и спектров ЯМР. В спектрах 11В ЯМР аминных комплексов триаллилборанов 1-4 наблюдаются сигналы в области сильного поля, характерные для четырехкоординированного бора, например для 1⋅NH3: при -7.96 м.д. в C6D6-растворе и -8.56 м.д. в CD3OD-растворе, насыщенном аммиаком; при этом последнее значение очень мало зависит от концентрации аммиака.
Комплекс 1⋅NH3 в чистом виде разлагается на воздухе при 60°С на 40% в течение 1 ч и на 54% в течение 4 ч. В 7 М метанольном растворе аммиака разложение замедляется: период полураспада составляет 23 ч при 60°С и 36 сут. при 25°С.Снижение температуры аммиачно-метанольного раствора до -18°С (температуры, стандартной для промышленных холодильников) делает комплекс стабильным вообще неопределенно долго. Остальные аминные аддукты борана 1, а также аддукты боранов 2-4 с R1R2NH имеют другие температурные параметры разложения, но принципиально то, что все они в виде растворов в метаноле, насыщенном аммиаком или соответствующим амином, могут храниться без разложения не менее 2 мес.(Отметим, что незакомплексованные триаллилбораны 1-4 реагируют со спиртами и водой со взрывом даже при сильном охлаждении с образованием алкил(диаллил)боринатов, диалкил(аллил)боронатов, триалкилборатов или соответствующих кислот [Bubnov Yu.N. Allylboranes. - In: Science of Synthesis: Houben-Weyl Methods of Molecular Transformations, Vol. 6 / D.E. Kaufmann and D.S. Matteson (Eds.). Stuttgart, N.-Y.: Thieme, 2004, pp.945-1072; Ramachandran P.V., Gagare P.D., Nicponski D.R. Allylborons. - In: Comprehensive Organic Synthesis II, Vol. 2 / P. Knochel, G.A. Molander (Eds.). Elsevier, 2014, pp. 1-71].)
Таким образом, в отличие от триаллилборанов 1-4, их аддукты c⋅R1R2NH не пирофорны (помещение аддуктов на бумажную салфетку не сопровождается воспламенением, дымлением и обугливанием), т.е. не подвергаются быстрому разложению на воздухе при комнатной температуре, и, как неожиданно оказалось, устойчивы в спиртовой среде. Вследствие этого, соединения по изобретению представляют собой удобные в использовании безопасные аллилирующие реагенты, которые открывают новые возможности для проведения аллилирования без использования сухой инертной атмосферы, при температуре выше 0°С, не только в апротонных (тетрагидрофуран, диоксан и др.), но и в протонных (например, спирты) органических растворителях.
Эффективность аддуктов триаллилборанов 1-4 с R1R2NH в качестве аллилирующих реагентов продемонстрирована на примере реакции аминоаллилирования карбонильных соединений с образованием гомоаллиламинов (схема 2).
Схема 2

Аминоаллилирование проводят в отсутствие инертной атмосферы в метаноле (по аналогии с работами [Sugiura М., Hirano К., Kobayashi S., J. Am. Chem. Soc, 2004, 126 (23), 7182-7183; Thadani A.N., Dhudshia В., Международная заявка PCT/CA 2008/000567], в которых в качестве ал лидирующего реагента используется аллилбороновая кислота или ее эфиры). Сначала перемешивают смесь карбонильного соединения с избытком аммиака или первичного амина в метаноле при 20-25°С от 3 мин до 10 ч. Затем к образовавшемуся имину, не выделяя его, добавляют соответствующий аддукт в чистом виде или в виде раствора в метаноле при 5-25°С и перемешивают при 5-60°С от 30 мин до 16 ч. Оптимальные температурно-временные условия для разных аминирующих реагентов, аллилирующих аддуктов и карбонильных субстратов, естественно, могут несколько различаться, однако любой более или менее опытный химик справится с этой задачей. Например, для аминоаллилирования ароматических альдегидов аммиаком и комплексом 1⋅NH3 оптимально проведение реакции в течение 30 мин, на стадии аллилирования связи C=N - нагревание при 40°С в течение 4 ч. Контроль за ходом реакции легко осуществляется с помощью 11В и 1Н ЯМР-спектрометрии. Так, в спектрах 11В ЯМР наблюдается исчезновение сигнала от ядра четырехкоординированного бора в сильном поле и появление сигнала атома бора производного бороновой, бориновой или борной кислоты в области 1-4 м.д. Целевые гомоаллиламины получают с выходами 73-93%.
Отметим, что в рассматриваемой реакции аминоаллилирования карбонильных соединений:
1. В процессе участвуют все три аллилирующие группы аддуктов 1-4 с R1R2NH, так что реакция протекает при стехиометрическом соотношении аддукт - карбонильное соединение, составляющем 1:3. Для полного завершения реакции необходим лишь 5%-ный избыток аддукта;
2. Амин, используемый для получения имина карбонильного соединения, обычно тождественен амину, образующему аддукт с соответствующим триаллилбораном, однако это в принципе необязательно. В качестве универсальных аллилирующих реагентов можно использовать аддукты триаллилборанов 1-4 с диметиламином (см. примеры 10.30 и 10.31), особенно в случае дорогостоящих аминов в качестве аминирующих реагентов;
3. Аллилирование соединениями по изобретению не затрагивает многие функциональные группы, содержащие кратные связи, такие как С≡С, C≡N, NO2, а также гетероциклические ароматические заместители со связями C=N (пиридинил-, индолил-, пиразолил- и др.);
4. Процесс переноса аллильной группы с атома бора на атом углерода сопровождается ее инверсией (см. примеры 10.28 и 10.29).
Преимуществом заявляемых аддуктов триаллилборанов 1-4 с аммиаком и алифатическими первичными и вторичными аминами как аллилирующих реагентов перед несвязанными триаллилборанами 1-4 является стабильность на воздухе и в спиртовых растворах, позволяющая нарабатывать их в значительных количествах, хранить в течение длительного времени и использовать по мере необходимости в отсутствие инертной атмосферы в различных, в том числе протонных, неабсолютированных растворителях, а также осуществлять реакции с ними в комфортных температурных условиях (выше 0°С) с высокой хемоселективностью.
В некоторых исключительных случаях типичный ход реакции по схеме 2 может нарушаться. Так, при аминоаллилировании 2-этинилбензальдегида образуется транс-2,6-диаллил-1,2,3,4-тетрагидроизохинолин вместо ожидаемого 1-(2-этинилфенил)бут-3-ен-1-амина (схема 3).
Схема 3
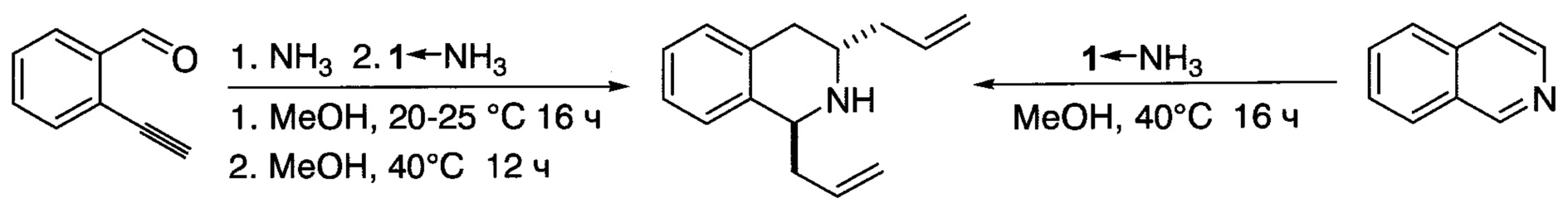
По-видимому, это связано с промежуточным образованием изохинолина из 2-этинилбензальдегида и аммиака [Alfonsi М.,  М., Facoetti D., Arcadi A., Abbiati G., Rossi E., Eur. J. Org. Chem., 2009, (17), 2852-2862], который легко вступает в реакцию восстановительного транс-α,α'-восстановительного диаллилирования под действием триаллилборана [Бубнов Ю.Н., Евченко С.Б., Игнатенко А.В., Изв. АН СССР, Сер. хим., 1993, 1325-1326]. Данное предположение подтверждено получением транс-1,3-диаллилтетрагидроизохинолина при взаимодействии изохинолина с аддуктом 1⋅NH3.
М., Facoetti D., Arcadi A., Abbiati G., Rossi E., Eur. J. Org. Chem., 2009, (17), 2852-2862], который легко вступает в реакцию восстановительного транс-α,α'-восстановительного диаллилирования под действием триаллилборана [Бубнов Ю.Н., Евченко С.Б., Игнатенко А.В., Изв. АН СССР, Сер. хим., 1993, 1325-1326]. Данное предположение подтверждено получением транс-1,3-диаллилтетрагидроизохинолина при взаимодействии изохинолина с аддуктом 1⋅NH3.
Технический результат изобретения состоит в создании новых 1:1 аддуктов триаллилборанов с аминосоединениями, которые являются эффективными и удобными аллилирующими реагентами, используемыми в частности для получения гомоаллиламинов из карбонильных соединений и аминов.
Исходные триаллилбораны 1-4 получают по реакции Барбье-Гриньяра: смесь триалкилбората и соответствующего аллилбромида добавляют в инертной атмосфере к алюминию (активированному HgCl2) или магнию в диэтиловом эфире, перемешивают некоторое время, после чего прямо из реакционной колбы отгоняют растворитель, а затем перегоняют продукты реакции [Захаркин Л.И., Станко В.И., Изв. АН СССР, Сер. хим., 1960, 1896; Топчиев А.В., Прохорова А.А., Паушкин Я.М., Курашев М.В., Изв. АН СССР, Сер. хим., 1958, 370].
Спектры ЯМР сняты на приборе Bruker Avance 400 (для 13С рабочая частота 100 МГц, для 1Н - 400 МГц, для 11В - 128 МГц). В качестве стандартов использованы сигналы растворителей. Масс-спектры сняты на приборе Finnigan Polaris Q Ion Trap (ионизация под действием элетронного удара с энергией 70 эВ).
Изобретение иллюстрируется приведенными ниже конкретными примерами.
Пример 1. Аддукт триаллилборана с аммиаком (1⋅NH3)
В атмосфере аргона в раствор 3.9 мл (3.00 г, 22.4 ммоль) триаллилборана в 30 мл абсолютированного н-пентана при -20°С пропускают сухой аммиак в течение 20 мин, после чего растворитель отгоняют в вакууме. Получают 3.38 г (100%) твердого бесцветного аддукта. Т. пл. 40-44°С.
Вычислено, %: С 71.56; Н 12.01; N 9.27; В 7.16. C9H18BN. Найдено, %: С 71.38; Н 12.16; N 9.10; В 6.97.
1Н ЯМР-спектр (C6D6), δ, м.д.: 6.14-6.03 (м, 3H, СН=), 4.84 (дд, J=10.0 и 2.6 Гц, 3H, СНАНВ=), 4.70 (дм, J=17.0 Гц, 3H, СНАНВ=), 1-54 (уш. с, 3H, NH3), 1.26 (д, J=7.9 Гц, 6Н, СН2). 13С ЯМР-спектр (C6D6), δ, м.д.: 143.71 (3C), 110.05 (3C), 31.08 уш. (3C). 11В ЯМР-спектр, δ, м.д.: -7.95 (C6D6), -8.56 (CD3OD/NH3).
Пример 2. Аддукт трикротилборана с аммиаком (2⋅NH3)
Опыт проводят аналогично примеру 1, используя вместо триаллилборана 3.00 г (17.0 ммоль) трикротилборана в виде смеси транс/цис-пзометров (2.7:1). Получают 3.29 г (100%) аддукта в виде бесцветного масла.
1Н ЯМР-спектр (C6D6), δ, м.д.: 5.67-5.50 (м, 3H, СН=), 5.34-5.19 (м, 0.85Н, СН=), 5.13-4.97 (м, 2.15Н, СН=), 2.30-1.98 (м, 3H, NH3), 1.63 (д, J=6.5 Гц, 6.6Н, СН3), 1.50 (д, J=6.7 Гц, 2.4Н, Me), 1.17-0.87 (м, 6Н, СН2). 13С ЯМР-спектр (C6D6), δ, м.д., 135.67 (2С); (134.56, 134.52, 134.49) (1С); (120.45, 120.30, 120.15) (2С);(119.13, 118.95, 118.79) (1С); 29.27 уш. (2С); 23.57 уш. (1С), 18.38 (2С); 12.87 (1С). 11В ЯМР-спектр, δ, м.д.: -6.83 (C6D6), -7.67 (CD3OD).
Пример 3. Аддукт триметаллилборана с аммиаком (3⋅NH3)
Опыт проводят аналогично примеру 1, используя вместо триаллилборана 3.00 г (17.0 ммоль) триметаллилборана. Получают 3.29 г (100%) аддукта в виде бесцветной подвижной жидкости.
1Н ЯМР-спектр (CD3OD/NH3), δ, м.д.: 4.52-4.49 (м, 3H, СНАНВ=), 4.29 (д, J=2.5 Гц, 3H, СНАНВ=), 1.77 (с, 3H, NH3), 1.73 (с, 9Н, СН3), 1.22 (с, 6Н, СН2).
11В ЯМР-спектр (CD3OD), δ, м.д.: -9.18.
Пример 4. Аддукт трипренилборана с аммиаком (4⋅NH3)
Опыт проводят аналогично примеру 1, используя вместо триаллилборана трипренилборан, и получают аддукт с выходом 100% в виде бесцветного масла.
1Н ЯМР-спектр (C6D6), δ, м.д.: 5.39 (т, J=7.0 Гц, 3H, СН=), 1.92 (уш. с, 3H, NH3), 1.74 (с, 9Н, СН3), 1.54 (с, 9Н, СН3), 1.13 (д, J=7.9 Гц, 6Н, СН2). 13С ЯМР -спектр (C6D6), δ, м.д.: 128.57 (3C), 125.72 (3C), 26.32 (3C), 24.81 уш. (3C), 17.78 (3C). 11В ЯМР-спектр (C6D6), δ, м.д.: -5.30.
Пример 5. Аддукт триаллилборана с метиламином (1⋅MeNH2)
Опыт проводят аналогично примеру 1, используя вместо аммиака газообразный метиламин. Из 3.9 мл (3.00 г, 22.4 ммоль) триаллилборана получают 3.69 г (100%) бесцветного маслообразного аддукта.
1Н ЯМР-спектр (C6D6), δ, м.д.: 6.20-5.96 (м, 3H, СН=), 4.93-4.68 (м, 6Н, СН2=), 2.20 (уш. с, 2Н, NH2), 1.51 (т, J=6.5 Гц, 3H, СН3), 1.23 (д, J=8.2 Гц, 6Н, СН2). 13С ЯМР-спектр (C6D6), δ, м.д.: 143.26 (3C), 110.32 (3C), 29.53 уш. (3C), 25.80 (1С). "В ЯМР-спектр, δ, м.д.: -5.94 (C6D6), -6.77 (CD3OD).
Пример 6. Аддукт триаллилборана с аллиламином (1⋅CH2=CHCH2NH2)
В атмосфере сухого аргона в раствор 3.9 мл (3.00 г, 22.4 ммоль) триаллилборана в 30 мл абсолютированного пентана при перемешивании прибавляют по каплям 5.0 мл (3.83 г, 67.14 ммоль) аллиламина, поддерживая температуру -20°С.Пентан и избыток аллиламина отгоняют в вакууме. Получают 4.28 г (100%) аддукта в виде бесцветного масла.
1Н ЯМР-спектр (C6D6), δ, м.д.: 6.22-6.04 (м, 3H, СН=), 5.09 (ддт, J=16.4, 10.3, 5.9 Гц, 1H, СН=), 4.87 (дд, J=10.1, 2.8 Гц, 3H, СНАНВ=), 4.81 (ддт, J=17.1, 2.9, 1.4 Гц, 3H, СНАНВ=), 4.79 (д, J=10.2 Гц, 1H, СНАНВ=), 4.70 (д, J=17.2 Гц, 1Н, СНАНВ=), 2.78-2.45 (м, 4Н, CH2NH2), 1.32 (д, J=8.2 Гц, 6Н, СН2).
13С ЯМР-спектр (C6D6) δ, м.д.: 143.31 (3C), 132.86 (1С), 118.74 (1С), 110.45 (3C), 42.44 (1С), 29.71 уш. (3C). 11В ЯМР-спектр (C6D6) δ, м.д.: -5.66 (C6D6), -6.43 (CD3OD).
Пример 7. Аддукт триаллилборана с диметиламином (1⋅Me2NH)
В атмосфере сухого аргона к раствору 3.00 г (3.9 мл, 22.4 ммоль) триаллилборана в 14 мл абсолютированного пентана при перемешивании по каплям прибавляют раствор 3.02 г (67.2 ммоль) диметиламина в 33 мл абсолютированного тетрагидрофурана, поддерживая температуру -20°С. После отгонки растворителей в вакууме получают 4.01 г (100%) аддукта в виде бесцветного масла.
1Н ЯМР-спектр (C6D6), δ, м.д.: 6.13 (ддт, J=16.2, 10.9, 8.1 Гц, 3H, СН=), 4.97-4.79 (м, 6Н, СН2=), 2.64 (уш. с, 1Н, NH), 1.71 (д, J=6.1 Гц, 6Н, СН3), 1.31 (д, J=8.1 Гц, 6Н, СН2). 13С ЯМР-спектр (C6D6), δ, м.д.: 143.48 (3C), 110.58 (3C), 37.24 (2С), 29.29 уш. (3C). 11В ЯМР-спектр, δ, м.д.: -3.11 (C6D6), -3.70 (CD3OD).
Пример 8. Аддукт трикротилборана с диметиламином (2⋅Me2NH)
Опыт проводят аналогично примеру 7, используя вместо триаллилборана трикротилборан, и получают аддукт с выходом 100% в виде бесцветного масла.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 5.67-5.48 (м, 3H, СН=), 5.35-5.02 (м, 3H, СН=), 3.23 (уш. с, 1H, NH), 2.52-2.27 (м, 6Н, СН3), 1.73-1.49 (м, 9Н, СН3), 1.24-0.98 (м, 6Н, СН2).
13С ЯМР-спектр (CDCl3), δ, м.д.: (135.14, 135.09, 135.04) (2С); (134.14, 134.07, 134.00) (1С); (120.43, 120.30, 120.17) (2С); (119.18, 118.96, 118.75) (1С); (38.13, 37.91, 37.75, 37.63) (2С); 26.88 уш. (2С); 20.79 уш. (1С); (18.32, 18.29, 18.26) (2С); 12.86 (1С). 11В ЯМР-спектр (CDCl3), δ, м.д.: -2.49.
Пример 9. Аддукт трипренилборана с диметиламином (4⋅Me2NH)
Опыт проводят аналогично примеру 7, используя вместо триаллилборана трипренилборан, и получают аддукт с выходом 100% в виде бесцветного масла.
1Н ЯМР-спектр (C6D6), δ, м.д.: 5.49 (т, J=8.0 Гц, 3H, СН=), 2.50 (уш. м, 1H, NH), 1.77 (с, 9Н, СН3), 1.75 (с, 6Н, СН3), 1.68 (с, 9Н, СН3), 1.20 (д, J=8.1 Гц, 6Н, СН2). 13С ЯМР-спектр-спектр (C6D6), δ, м.д.: 128.69 (3C), 125.47 (3C), 37.55 (2С), 26.63 (3C), 22.76 уш. (3C), 18.07 (3C). 11В ЯМР-спектр (C6D6), δ, м.д.: -1.48.
Пример 10. Общая методика получения гомоаллиламинов
a. К карбонильному соединению (1 ммоль), растворенному в метаноле (0.3 мл), при перемешивании прибавляют по каплям 7 М метанольный раствор аммиака или первичного амина (2-15 ммоль) при температуре 20-25°С и продолжают перемешивание при этой температуре от 3 мин до 10 ч.
b. К полученному раствору иминного интермедиата при перемешивании и температуре 5-25°С прибавляют аминный комплекс соответствующего триаллилборана (0.34-0.36 ммоль) в чистом виде или в виде 2.5 М раствора (0.14 мл) в метаноле, содержащем избыток аммиака или амина. Реакционную смесь перемешивают при 5-60°С в течение 0.5-16 ч. Затем растворитель удаляют в вакууме, остаток промывают 20%-ным раствором NaOH, высушивают над K2CO3 или КОН, растворяют в растворителе, таком как диэтиловый эфир, диоксан, этилацетат, ацетонитрил, метил-трет-бутиловый эфир, и добавляют эквивалентное количество хлористого водорода в диоксане или щавелевой кислоты в метаноле. Выпавшие кристаллы отфильтровывают, промывают подходящим растворителем, сушат в вакууме. В ряде случаев полученный амин выделяют хроматографически, не превращая в соль.
Пример 10.1. 1-Фенилбут-3-ен-1-амин гидрохлорид из бензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 88%. Т. пл. 235-236°С.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 8.76 (уш. с, 3H, NH3), 7.46-7.38 (м, 2Н, Ar), 7.36-7.28 (м, 3H, Ar), 5.53 (ддт, J=14.2, 10.2, 7.0 Гц, 1H, СН=), 5.11-4.95 (м, 2Н, СН2=), 4.23-4.18 (м, 1Н, CHN), 2.86-2.77 (м, 1Н, СНАНВСН=), 2.73-2.64 (м, 1H, СНАНВСН=). 13С ЯМР-спектр (CDCl3), δ, м.д.: 135.63 (1С), 131.40 (1С), 128.94 (3C), 127.40 (2С), 120.10 (1С), 55.77 (1С), 38.75 (1С).
(ЯМР-спектры совпадают с литературными [Ren Н., Wulff W. D., J. Am. Chem. Soc., 2011, 133, 5656-5659].)
Пример 10.2. 1-(3-Толил)бут-3-ен-1-амин гидрохлорид 3-метилбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 92%. Т. пл. 192-193°С. C11H16ClN. Вычислено, %: С 66.83; Н 8.16; N 7.08. Найдено, %: С 66.77; Н 8.30; N 7.33.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 6.80 (уш. с, 3H, NH3), 7.40-7.25 (м, 3H, Ar), 7.17 (д, J=6.4 Гц, 1H, Ar), 5.68-5.50 (м, 1Н, СН=), 5.12-4.93 (м, 2Н, СН2=), 4.22 (дд, J=8.6, 5.9 Гц, 1H, CHN), 2.88-2.71 (м, 1Н, СНАНВСН=), 2.69-2.53 (м, 1Н, СНАНВСН=), 2.31 (с, 3H, СН3). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 137.73, 137.39, 132.86, 129.06, 128.52, 128.18, 124.59, 118.79, 53.93, 38.49, 21.03.
Масс-спектр, m/z (I, %): 162 (5) [М+Н]+, 128 (5), 121 (10), 120 (100), 118 (7), 93 (62), 92 (6), 91 (57), 77 (21).
Пример 10.3. 1-(4-Толил)бут-3-ен-1-амин гидрохлорид из 4-метилбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 91%. Т. пл. 227-228°С. C11H16ClN. Вычислено, %: С 66.83; Н 8.16; N 7.08. Найдено, %: С 66.49; Н 8.13; N 7.30.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.68 (уш. с, 3H, NH3), 7.39 (д, J=8.0 Гц, 2Н, Ar), 7.20 (д, J=7.8 Гц, 2Н, Ar), 5.59 (дддд, J=17.1, 10.2, 7.1, 7.1 Гц, 1H, СН=), 5.10-4.95 (м, 2Н, СН2=), 4.22 (дд, J=9.0, 5.7 Гц, 1Н, CHN), 2.88-2.72 (м, 1H, СНАНВСН=), 2.69-2.55 (м, 1H, СНАНВСН=), 2.30 (с, 3H, СН3). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 137.73, 134.41, 132.91, 129.06 (2С), 127.54 (2С), 118.69, 53.70, 38.45, 20.70.
Пример 10.4. 1-(2-Метоксифенил)бут-3-ен-1-амин гидрохлорид из 2-метоксибензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 92%. Т. пл. 127-128°С. C11H16ClHO. Вычислено, %: С 61.82; Н 7.55; N 6.55. Найдено, %: С 61.70; Н 7.49; N 6.52.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.68 (с, 3H, NH3), 7.55 (д, J=7.6 Гц, 1Н, Ar), 7.34 (t,J=7.8 Гц, 1H, Ar), 7.05 (д, J=8.3 Гц, 1Н, Ar), 6.99 (т, J=7.5 Гц, 1Н, Ar), 5.68-5.51 (м, 1H, СН=), 5.0-4.91 (м, 2Н, СН2=), 4.53 (уш. с, 1Н, CHN), 3.81 (с, 3H, СН3), 2.84-2.72 (м, 1H, СНАНВСН=), 2.70-2.56 (м, 1H, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 156.51, 132.96, 129.77, 127.90, 125.02, 120.53, 118.53, 111.31, 55.67, 47.89, 37.38.
Масс-спектр, m/z (I, %): 178 (6) [М+Н]+, 137 (10), 136 (100), 121 (25), 109 (8), 107 (47), 94 (7), 93 (11), 79 (7), 77 (10), 66 (8).
Пример 10.5. 1-(3-Метоксифенил)бут-3-ен-1-амин гидрохлорид из 3-метоксибензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 74%. Т. пл. 180-181°С. C11H16ClNO. Вычислено, %: С 61.82; Н 7.55; N 6.55. Найдено, %: С 61.68; Н 7.57; N 6.57.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.76 (с, 3H, NH3), 7.30 {с, J=1.9 Гц, 1H, Ar), 7.20 (с, 1H, Ar), 7.06 (с, J=7.5 Гц, 1Н, Ar), 6.91 (дд, J=8.1, 1.9 Гц, 1Н, Ar), 5.60 (дддд, J=13.9, 10.1, 6.9, 6.9 Гц, 1H, СН=), 5.15-4.93 (м, 2Н, СН2=), 4.24 (т, J=6.3 Гц, 1Н, CHN), 3.76 (т, 3H, СН3), 2.88-2.71 (т, 1H, СНАНВСН=), 2.69-2.55 (т, 1H, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 159.39, 139.05, 132.87, 129.67, 119.77, 118.80, 113.87, 113.31, 55.25, 53.93, 38.57.
Масс-спектр, m/z (I, %): 178 (0.5) [М+Н]+, 137 (10), 136 (100), 109 (52), 94 (30), 91 (6), 77 (8), 66 (7). C11H16ClNO. Вычислено, %: С 61.82; Н 7.55; N 6.55. Найдено, %: С 61.68; Н 7.57; N 6.57.
Пример 10.6. 1-(2,3,4-Триметоксифенил)бут-3-ен-1-амин гидрохлорид из 2,3,4-триметоксибензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 81%. Т. пл. 142-143°С. C13H20ClNO2. Вычислено,%: С 57.04; Н 7.36; N 5.12. Найдено, %: С 56.97; Н 7.40; N 5.08.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.60 (уш. с, 3H, NH3), 7.30 (д, J=8.7 Гц, 1Н, Ar), 6.88 (д, J=8.8 Гц, 1Н, Ar), 5.59 (дддд, J=17.1, 10.1, 7.0, 7.0 Гц, 1H, СН=), 5.14-4.90 (м, 2Н, СН2=), 4.41 (дд, J=8.9, 5.8 Гц, 1Н, CHN), 3.83 (с, 3H, СН3), 3.80 (с, 3H, СН3), 3.74 (с, 3H, СН3), 2.81-2.69 (м, 1Н, СНАНВСН=), 2.62-2.52 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 153.53, 151.00, 141.26, 133.02, 122.72, 122.20, 118.69,108.02, 61.14, 60.31, 55.91, 47.72, 38.29.
Пример 10.7. 4-(1-Аминобут-3-ен-1-ил)-N,N-диметиланилин, соль со щавелевой кислотой состава 1:1, из 4-диметиламинобензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 78%. Т. пл. 217°С (разд.). C14H20N2O4. Вычислено, %: С 59.99; Н 7.19; N 9.99. Найдено, %: С 59.85; Н 7.12; N 9.97.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 9.20 (с, 4Н, NH3, ОН), 7.26 (д, J=8.5 Гц, 2Н, Ar), 6.71 (д, J=8.5 Гц, 2Н, Ar), 5.55 (ддт, J=17.1, 10.0, 7.0 Гц, 1H, СН=), 5.03 (д, J=17.2 Гц, 1Н, СНАНВ=), 4.98 (д, J=10.4 Гц, 1Н, СНАНВ=), 4.13 (дд, J=9.2, 5.5 Гц, 1Н, CHN), 2.88 (с, 6Н, 2СН3), 2.75-2.65 (м, 1Н, СНАНВСН=), 2.63-2.53 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 165.38 (2С), 150.80, 133.85, 128.80 (2С), 124.91, 118.83, 112.52 (2С), 54.09, 40.49 (2С), 38.86.
Масс-спектр, m/z (I, %): 174 (22) [М-NH2]+, 173 (100), 172 (97), 170 (10), 158 (19), 157 (78), 156 (22), 149 (28), 130 (6), 129 (39), 128 (41), 127 (8), 122 (9), 115 (13), 107 (6).
Пример 10.8. 1-(2-Фторфенил)бут-3-ен-1-амин гидрохлорид из 2-фторбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 73% Т. пл. 153-154°С. C10H13ClFN. Вычислено, %: С 59.56; Н 6.50; N 6.95. Найдено, %: С 59.31; Н 6.51; N 7.01.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.92 (уш. с, 3H, NH3), 7.80 (т, J=7.0 Гц, 1Н, Ar), 7.42 (дд, J=13.4, 6.1 Гц, 1H, Ar), 7.34-7.18 (м, 2Н, Ar), 5.60 (дддд, J=17.1,10.0, 7.1, 7.1 Гц, 1Н, СН=), 5.13-4.87 (м, 2Н, СН2=), 4.51 (дд, J=9.2, 5.5 Гц, 1Н, CHN), 2.95-2.76 (м, 1H, СНАНВСН=), 2.75-2.56 (м, 1H, СНАНВСН=).
13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 159.61 (д, J=245.8 Гц), 132.31, 130.58 (д,7=8.5 Гц), 128.76, 124.86, 124.37 (д, J=13.4 Гц), 119.14, 115.47 (д, J=21.8 Гц), 46.85, 37.87.
Масс-спектр, m/z (I, %): 166 (12) [М+Н]+, 125 (9), 124 (100), 97 (48), 77 (21), 75 (7).
Пример 10.9. 1-(3-Фторфенил)бут-3-ен-1-амин гидрохлорид из 3-фторбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 89%. Т. пл. 235-236°С. C10H13ClFN. Вычислено, %: С 59.56; Н 6.50; N 6.95. Найдено, %: С 59.43; Н 6.54; N 6.97.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.88 (уш. с, 3H, NH3), 7.57-7.40 (м, 2Н, Ar), 7.37 (д, J=7.5 Гц, 1H, Ar), 7.18 (т, J=7.7 Гц, 1H, Ar), 5.75-5.47 (м, 1Н, СН=), 5.16-4.88 (м, 2Н, СН2=), 4.35 (с, 1Н, CHN), 2.91-2.75 (м, 1Н, СНАНВСН=), 2.70-2.55 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 162.06 (д, J=243.8 Гц), 140.29 (д, J=7.4 Гц), 132.62, 130.60 (д, J=8.5 Гц), 123.98 (д, J=2.5 Гц), 119.00,115.26 (д, J=21.0 Гц), 114.64 (д, J=22.5 Гц), 53.36, 38.46.
Масс-спектр, m/z (I, %): 166 (3) [М+Н]+, 125 (10), 124 (100), 122 (8), 97 (55), 95 (6), 77 (20), 75 (8), 51 (4).
Пример 10.10. 1-(4-Фторфенил)бут-3-ен-1-амин гидрохлорид из 4-фторбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 87%. Т. пл. 240-241°С. C10H13ClFN. Вычислено, %: С 59.56; Н 6.50; N 6.95. Найдено, %: С 59.29; Н 6.39; N 6.78.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д: 8.80 (с, 3H, NH3), 7.61 (с, 2Н, Ar), 7.26 (т, J=8.1 Гц, 2Н, Ar), 5.74-5.46 (м, 1H, СН=), 5.21-4.86 (м, 2Н, СН2=), 4.47-4.23 (м, 1Н, CHN), 2.98-2.73 (м, 1H, СНАНВСН=), 2.73-2.56 (м, 1H, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 161.99 (д, J=244.5 Гц), 133.77 (д, J=2.9 Гц), 132.80, 130.00 (д, J=8.4 Гц, 2С), 118.90, 115.39 (д, J=21.4 Гц, 2С), 53.18, 38.51.
Масс-спектр, m/z (I, %): 166 (19) [М+Н]+, 149 (16), 125 (10), 124 (100), 122 (8), 97 (54), 96 (6), 77 (23), 75 (8).
Пример 10.11. 1-(3-Бромфенил)бут-3-ен-1-амин гидрохлорид из 3-бромбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 93%. Т. пл. 231-233°С. C10H13BrClN. Вычислено, %: С 45.74; Н 4.99; N 5.33. Найдено, %: С 45.52; Н 4.96; N 5.14.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.66 (с, 3H, NH3), 7.77 (с, 1Н, Ar), 7.57 (д, J=7.9 Гц, 1Н, Ar), 7.52 (д, J=7.8 Гц, 1H, Ar), 7.38 (т, J=7.8 Гц, 1Н, Ar), 5.61 (ддт, J=17.0, 10.2, 7.0 Гц, 1H, СН=), 5.05 (д, J=17.8 Гц, 1H, СНАНВ=), 5.04 (м, J=9.7 Гц, 1Н, СНАНВ=), 4.35 (дд, J=8.6, 5.9 Гц, 1Н, CHN), 2.81-2.70 (м, 1Н, СНАНВСН=), 2.66-2.55 (м, 1H, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 140.17, 132.56, 131.33, 130.76, 130.53, 126.85, 121.77, 119.11, 53.19, 38.39.
Масс-спектр, m/z (I, %): 228-226 (7) [М+Н]+, 186-184 (100), 159-157 (19), 104 (7), 78 (12), 77 (19).
Пример 10.12.1-(2-Бром-4-фторфенил)бут-3-ен-1-амин гидрохлорид из 2-бромбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 88%. Т. пл. 210-211°С. C10H12BrClFN. Вычислено, %: С 42.81; Н 4.31; N 4.99. Найдено, %: С 42.69; Н 4.33; N 4.86.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 9.01 (с, 3H, NH3), 7.97 (дд, J=8.6, 6.0 Гц, 1Н, Ar), 7.64 (дд, J=8.5, 2.4 Гц, 1Н, Ar), 7.41 (тд, J=8.5, 2.4 Гц, 1Н, Ar), 5.72-5.53 (м, 1Н, СН=), 5.13-4.91 (м, 2Н, СН2=), 4.61 (с, 1Н, CHN), 2.92-2.73 (м, 1H, СНАНВСН=), 2.72-2.55 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 161.38 (д, J=249.9 Гц), 133.09 (д, J=3.5 Гц), 131.90, 130.17 (д, J=8.8 Гц), 123.86 (д, J=9.7 Гц), 119.77 (д, J=24.7 Гц), 119.45, 115.62 (д, J=21.2 Гц), 52.20, 38.33.
Масс-спектр, m/z (I, %): 246-244 (9) [М+Н]+, 205-203 (9), 204-202 (100), 177-175 (10), 122 (13), 96 (26), 95 (6).
10.13. (4-Этинилфенил)бут-3-ен-1-амин, соль со щавелевой кислотой состава 4:3, из 4-этинилбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 74%. Т. пл. 162-163°С. (4C12H13N+3C2H204). Вычислено, %: С 67.91; Н 6.12; N 5.87. Найдено, %: С 67.83; Н 6.15; N 5.87.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 7.51 (д, J=8.2 Гц, 2Н, Ar), 7.45 (д, J=8.3 Гц, 2Н, Ar), 6.72 (уш.с, 4Н, NH3, ОН), 5.63 (ддт, J=17.2, 10.2, 7.0 Гц, 1Н, СН=), 5.08-4.98 (м, 2Н, СН2=), 4.30-4.19 (м, 1Н, CHN), 4.23 (с, 1H,=СН), 2.66-2.56 (м, 1H, СНАНВСН=), 2.56-2.46 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (CDCl3), δ, м.д.: 165.15 (2С), 140.35, 133.35, 131.78 (2С), 127.72 (2С), 121.35, 118.56, 83.17, 81.14, 53.79, 39.52.
Пример 10.14. 4-(1-Аминобут-3-ен-1-ил)бензонитрил, соль со щавелевой кислотой состава 1:1, из 4-цианобензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 87%. Т. пл. 162-163°С. C13H14N2O4. Вычислено, %: С 59.54; Н 5.38; N 10.68. Найдено, %: С 59.41; Н 5.38; N 10.65.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 7.87 (д, J=8.1 Гц, 2Н, Ar), 7.64 (д, J=8.1 Гц, 2Н, Ar), 6.72 (уш. с, 4Н, NH3, ОН), 5.70-5.55 (м, 1H, СН=), 5.08-4.94 (м, 2Н, СН2=), 4.32 (т, J=6.9 Гц, 1H, CHN), 2.69-2.58 (м, 1H, СНАНВСН=), 2.57-2.45 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (CDCl3), δ, м.д.: 164.89 (2С), 143.23, 132.56 (2С), 132.48,128.70 (2С), 119.28, 118.61, 111.21, 53.39, 38.52.
Пример 10.15. 1-(3-Нитрофенил)бут-3-ен-1-амин гидрохлорид из 3-нитробензалъдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 94%. Т. пл. 220-221°С. C10H13ClN2O2. Вычислено, %: С 52.52; Н 5.73; N 12.25. Найдено, %: С 52.34; Н 5.57; N 12.21.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.88 (с, 3H, NH3), 8.46 (с, 1H, Ar), 8.23 (д, J=7.5 Гц, 1H, Ar), 8.02 (д, J=7.3 Гц, 1Н, Ar), 7.73 (т, J=7.9 Гц, 1Н, Ar), 5.74-.54 (м, 1H, СН=), 5.16-4.89 (м, 2Н, СН2=), 4.58 (с, 1Н, CHN), 2.91-2.75 (м, 1H, СНАНВСН=), 2.75-2.59 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 147.76, 139.68, 134.72, 132.40, 130.20, 123.39, 122.83, 119.35, 52.97, 38.30.
Масс-спектр, m/z (I, %): 193 (8) [М+Н]+, 152 (9), 151 (100), 105 (62), 104 (32), 78 (6), 77 (9).
Пример 10.16. 1-(4-Нитрофенил)бут-3-ен-1-амин гидрохлорид из 4-нитробензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 3 мин; b. 40°С 4 ч. Выход 86%. Т. пл. 224-225°С. C10H13ClN2O2. Вычислено, %: С 52.52; Н 5.73; N 12.25. Найдено, %: С 52.29; Н 5.69; N 12.07.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.83 (с, 3H, NH3), 8.29 (д, J=8.5 Гц, 2Н, Ar), 7.80 (д, J=8.5 Гц, 2Н, Ar), 5.69-5.55 (м, 1Н, СН=), 5.10-4.96 (м, 2Н, СН2=), 4.62-4.48 (м, 1Н, CHN), 2.86-2.74 (м, 1H, CHAHBCH=), 2.69-2.57 (м, 1H, СНАНВСН=). 13C ЯМР-спектр (ДМСО-D6), δ, м.д.: 147.43, 144.90, 132.31, 129.27 (2С), 123.61 (2С), 119.37,53.10, 38.40.
Пример 10.17. 1-([1,1'-Бифенил]-4-ил)бут-3-ен-1-амин гидрохлорид из 4-фенилбензальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 89%. Т. пл. 245-246°С. C16H18ClN. Вычислено, %: С 73.98; Н 6.98; N 5.39. Найдено, %: С 73.98; Н 7.13; N 5.51.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.84 (с, 3H, NH3), 7.69 (т, J=8.5 Гц, 4Н, Ar), 7.63 (д, J=8.0 Гц, 2Н, Ar), 7.47 (т, J=7.4 Гц, 2Н, Ar), 7.37 (т, J=7.2 Гц, 1H, Ar), 5.75-5.55 (м, 1Н, СН=), 5.07 (д, J=17.3 Гц, 1Н, СНАНВ=), 5.02 (д, J=10.3 Гц, 1Н, СНАНВ=), 4.35 (дд, J=8.6, 5.7 Гц, 1H, CHN), 2.93-2.79 (м, 1H, СНАНВСН=), 2.78-2.60 (м, 1H, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 140.20, 139.49, 136.65, 132.91, 129.00 (2С), 128.34 (2С), 127.69, 126.80 (2С), 126.71 (2С), 118.89, 53.65, 38.48.
Масс-спектр, m/z (I, %): 224 (1) [М+Н]+, 183 (16), 182 (100), 156 (6), 155 (48), 154 (9), 153 (19), 152 (10), 77 (5).
Пример 10.18. 1-(4-Метоксинафталин-1-ил)бут-3-ен-1-амин гидрохлорид из 4-метоксинафталин-1-карбальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 76%. Т.пл. 201-202°С. C15H18ClNO. Вычислено, %: С 68.31; Н 6.88; N 5.31. Найдено, %: С 68.38; Н 7.05; N 5.37.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.81 (с, 3H, NH3), 8.25 (д, J=8.3 Гц, 1H, Ar), 8.16 (д, J=8.5 Гц, 1H, Ar), 7.86 (д, J=8.2 Гц, 1H, Ar), 7.64 (т, J=7.6 Гц, 1Н, Ar), 7.56 (т, J=7.6 Гц, 1H, Ar), 7.08 (д, J=8.2 Гц, 1Н, Ar), 5.68 (ддт, J=17.0, 10.2, 7.0 Гц, 1H, СН=), 5.14 (с, 1H, CHN), 5.06 (д, J=17.1 Гц, 1Н, СНАНВ=), 4.96 (д, J=10.2 Гц, 1H, СНАНВ=), 4.00 (с, 3H, СН3), 2.97-2.86 (м, 1H, СНАНВСН=), 2.86-2.74 (м, 1H, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 154.86, 132.87, 131.46, 127.16, 125.40, 125.15, 125.13, 124.78, 122.85, 122.12, 118.89, 103.92, 55.76, 48.45, 38.90.
Масс-спектр, m/z (I, %): 210 (10) [M-NH2]+, 195 (6), 187 (14), 186 (100), 171 (12), 165 (6), 159 (31), 144 (40), 143 (9), 116 (10), 115 (12).
Пример 10.19. 1-(Тиофен-3-ил)бут-3-ен-1-амин гидрохлорид из тиофен-3-карбальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 79%. Т. пл. 216-217°С. C8H12ClNS. Вычислено, %: С 50.65; Н 6.38; N 7.38. Найдено, %: С 50.51; Н 6.33; N 7.27.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.68 (с, 3H, NH3), 7.71-7.62 (м, 1Н, Ar), 7.59 (дд, J=4.9, 3.0 Гц, 1H, Ar), 7.32 (д, J=5.0 Гц, 1H, Ar), 5.62 (ддт, J=17.2, 10.1, 6.9 Гц, 1Н, СН=), 5.08 (дд, J=17.3, 1.4 Гц, 1Н, СНАНВ=), 5.03 (д, J=10.3 Гц, 1H, СНАНВ=), 4.41 (дд, J=8.0, 5.6 Гц, 1Н, CHN), 2.88-2.71 (м, 1Н, СНАНВСН=), 2.71-2.56 (м, 1H, СНАНВСН=).
13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 138.45, 132.90, 126.96, 126.88, 124.33, 118.82, 49.50, 38.15.
Масс-спектр, m/z (I, %): 154 (11) [М+Н]+, 137 (21), 113 (8), 112 (100), 110 (7), 86 (6), 85 (95), 45 (8).
Пример 10.20. 1-(1-Этил-3-метил-1Н-пиразол-4-ил)бут-3-ен-1-амин гидрохлорид из 1-этил-3-метил-1Н-пиразол-4-карбальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 84%. Т.пл. 171-172°С. C10H18ClN3. Вычислено, %: С 55.68; Н 8.41; N 19.48. Найдено, %: С 55.49; Н 8.30; N 19.33.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.47 (с, 3H, NH3), 7.83 (с, 1H, Ar), 5.63 (ддт, J=17.1, 10.2, 6.9 Гц, 1H, СН=), 5.09 (д, J=17.2 Гц, 1H, СНАНВ=), 5.03 (д, J=10.2 Гц, 1H, СНАНВ=), 4.20-4.08 (м, 1H, CHN), 4.02 (кв, J=7.1 Гц, 2Н, СН2СН3), 2.82-2.67 (м, 1Н, СНАНВСН=), 2.65-2.53 (м, 1Н, СНАНВСН=), 2.14 (с, 3H), 1.31 (т, J=7.2 Гц, 3H, СН2СН3).
13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 145.55, 133.28, 129.02, 118.68, 114.95, 46.04, 45.48, 38.24,15.48,11.66.
Пример 10.21. 1-(Пиридин-4-ил)бут-3-ен-1-амин, соль со щавелевой кислотой состава 9:8, из пиридин-4-карбальдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 79%. Т. пл. 160-161°С. (9C9H12N2+8C2H2O4). Вычислено, %: С 56.72; Н 6.08; N 12.27. Найдено, %: С 56.79; Н 6.25; N 12.30.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.59 (д, J=5.9 Гц, 2Н, Ar), 7.50 (с, 4Н, NH3, ОН), 7.46 (д, J=5.8 Гц, 2Н, Ar), 5.71-5.58 (м, 1H, СН=), 5.08-4.98 (м, 2Н, СН2=), 4.31-4.21 (м, 1Н, CHN), 2.69-2.58 (м, 1H, СНАНВСН=), 2.58-2.47 (м, 1Н, СНАНВСН=). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 164.94 (2C), 149.84 (2С), 147.35, 132.68,122.43 (2С), 119.11, 52.91, 38.84.
Пример 10.22. 1-Метил-1-фенилбут-3-ен-1-амин гидрохлорид из ацетофенона, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 45°С 16 ч. Выход 92%. Т. пл. 166-167°С (разл.). C11H16ClH. Вычислено, %: С 66.83; Н 8.16; N 7.08. Найдено, %: С 66.76; Н 8.18; N 7.10.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 9.01 (с, 3H, NH3), 7.53 (д, J=7.5 Гц, 2Н, Ph), 7.40-7.33 (м, 2Н, Ph), 7.33-7.27 (м, 1Н, Ph), 5.49 (ддт, J=17.3, 10.0, 7.2 Гц, 1H, СН=), 5.17 (дд, J=16.9, 1.3 Гц, 1Н, СНАНВ=), 5.10 (дд, J=10.1, 1.6 Гц, 1Н, СНАНВ=), 2.89 (дд, J=14.1, 7.4 Гц, 1H, СНАНВ), 2.81 (дд, J=14.0, 7.1 Гц, 1H, СНАНВ), 1.89-1.76 (м, 3H, СН3).
13С ЯМР-спектр (CDCl3), δ, м.д.: 139.83, 130.71, 128.93 (2С), 128.20, 125.49 (2С), 121.55, (59.71, 59.65), 45.68, 25.27.
Пример 10.23. 1-Аллилциклопентан-1-амин гидрохлорид из циклопентанона, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 45°С 16 ч. Выход 94%. Т. пл. 258°С (разл.). C8H16ClN. Вычислено, %: С 59.43; Н 9.98; N 8.66. Найдено, %: С 56.27; Н 9.79; N 8.55.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 7.69 (с, 3H, NH3), 5.94-5.77 (м, 1Н, СН=), 5.27-5.06 (м, 2Н, СН2=), 2.37 (д, J=7.1 Гц, 2Н, СН2СН=), 1.87-1.35 (м, 8Н, 4СН2). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 132.85, 119.61, 62.55, 42.31, 35.73 (2С), 23.77 (2С).
Пример 10.24. 1-Аллилциклогексан-1-амин гидрохлорид из циклогексанона, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 94%. Т. пл. 277°С (разл.). C9H18ClN. Вычислено, %: С 61.52; Н 10.33; N 7.97. Найдено, %: С 61.27; Н 10.32; N 8.01.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 8.31 (уш. с, 3H, NH3), 6.08-5.77 (м, 1Н, СН=), 5.39-5.10 (м, 2Н, СН2=), 2.52 (д, J=7.4 Гц, 2Н, СН2 аллил), 1.95-1.60 (м, 6Н, 3CH2), 1.55-1.31 (м, 4Н, 2СН2).
13С ЯМР-спектр (CDCI3), δ, м.д.: 130.83, 121.19, 57.32, 41.38, 33.70 (2С), 24.82, 21.18 (2С).
Пример 10.25. 1-Изопропилбут-3-ен-1-амин гидрохлорид из изомасляного альдегида, аммиака и аддукта триаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 45°С 12 ч. Выход 72% (выход по спектрам ЯМР до обработки >98%). Т. пл. 194-195°С. C7H16ClN. Вычислено, %: С 56.18; Н 10.78; N 9.36. Найдено, %: С 56.22; Н 10.75; N 9.31.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 8.10 (уш. с, 3H, NH3), 5.91-5.77 (м, 1Н, СН=), 5.25 (д, J=17.0 Гц, 1Н, СНАНВ=), 5.19 (д, J=10.1 Гц, 1H, СНАНВ=), 3.07 (дд, J=11.5, 6.3 Гц, 1H, CHN), 2.56-2.39 (м, 2Н, СН2), 2.14-2.01 (м, 1Н, СНМе2), 1.06 (дд, J=9.3, 7.0 Гц, 6Н, 2Ме).
13С ЯМР-спектр (CDCl3), δ, м.д.: 132.45, 120.01, 57.43, 34.51, 29.71, 18.68, 17.86.
Пример 10.26. N-Метил-1-фенилбут-3-ен-1-амин из бензальдегида, метиламина и аддукта триаллилборана с метиламином
Стадии: а. 20-25°С 30 мин; b. 55°С 54 ч. Выход 94%. Т. кип. 105°С/15 мм рт.ст.
1Н ЯМР-спектр (CDCl3, δ, м.д.: 7.38-7.29 (м, 4Н, Ph), 7.29-7.23 (м, 1Н, Ph), 5.80-5.67 (м, 1Н, СН=), 5.15-5.03 (м, 2Н, СН2=), 3.54 (дд, J=7.3, 6.3 Гц, 1Н, CHN), 2.49-2.36 (м, 2Н, СН2), 2.29 (с, 3H, СН3), 1.70 (уш. с, 1Н, NH). 13С ЯМР-спектр (CDCl3), δ, м.д.: 143.55, 135.50, 128.42 (2С), 127.26 (2С), 127.10, 117.61, 64.65, 42.85, 34.57. (Спектры ЯМР совпадают с литературными [Shen К.-Н., Yao C.-F., J. Org. Chem., 2006, 71, 3980-3983].)
Пример 10.27. 3-Метил-1-фенилбут-3-ен-1-амин гидрохлорид из бензальдегида, аммиака и аддукта триметаллилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 5°С 1 ч→40°С 4 ч. Выход 87%. Т. пл. 251-252°С. C11H16ClN. Вычислено, %: С 66.83; Н 8.16; N 7.08. Найдено, %: С 66.95; Н 8.07; N 7.03.
1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.72 (с, 3H, NH3), 7.55 (д, J=7.2 Гц, 2Н, Ph), 7.47-7.27 (м, 3H, Ph), 4.69 (с, 1Н, СНАНВ=), 4.61(с, 1H, СНАНВ=), 4.36 (дд, J=8.9, 5.6 Гц, 1H, CHN), 2.78 (дд, J=13.4, 4.9 Гц, 1Н, СНАНВСН=), 2.54 (дд, J=13.4, 10.2 Гц, 1H, СНАНВСН=), 1.61 (с, 3H, СН3). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 139.94,137.64,128.54 (2С), 128.51,127.80 (2С), 114.62, 52.92, 42.46, 22.10.
Пример 10.28. 2-Метил-1-фенилбут-3-ен-1-амин гидрохлорид из бензальдегида, аммиака и аддукта трикротилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 93%. Продукт получается в виде смеси анти/син-диастереомеров состава 2.9:1. C11H16ClN. Вычислено, %: С 66.83; Н 8.16; N 7.08. Найдено, %: С 66.87; Н 8.12; N 7.01.
анти-Изомер: 1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.62 (с, 3H, NH3), 7.55-7.50 (м, 2Н, Ph), 7.47-7.31 (м, 3H, Ph), 5.81 (ддд, J=17.3, 10.2, 8.1 Гц, 1H, СН=), 5.25 (д, J=17.1 Гц, 1Н, СНАНВ=), 5.15 (дд, J=10.2, 1.6 Гц, 1Н, СНАНВ=), 4.12-4.02 (м, 1Н, CHN), 2.84-2.73 (м, 1H, СНСН=), 0.76 (д, J=6.8 Гц, 3H, СН3). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 139.18, 136.71, 128.49 (2С), 128.42, 127.97 (2С), 117.61, 58.43, 41.91,16.14.
син-Изомер: 1Н ЯМР-спектр (ДМСО-D6), δ, м.д.: 8.75 (с, 3H, NH3), 7.47-7.31 (м, 5Н, Ph), 5.57 (ддд, J=16.8, 10.7, 7.8 Гц, 1Н, СН=), 4.95-4.88 (м, 2Н, СН2=), 4.16-4.08 (м, 1Н, CHN), 2.90-2.80 (м, 1Н, СНСН=), 1.07 (д, J=6.8 Гц, 3H, СН3). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 138:27, 136.70, 128.29 (2С), 128.04 (2С), 127.97, 116.71, 58.59, 41.30, 16.92.
Пример 10.29. 2,2-Диметил-1-фенилбут-3-ен-1-амин гидрохлорид из бензальдегида,аммиака и аддукта трипренилборана с аммиаком
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 76%. Т. пл. 250-251°С. C12H18ClN. Вычислено, %: С 68.07; Н 8.57; N 6.62. Найдено, %: С 68.10; Н 8.55; N 6.61.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 8.79 (уш. с, 3H, NH3), 7.30 (дд, J=27.6, 6.9 Гц, 5Н, Ph), 5.79 (дд, J=17.3, 10.7 Гц, 1Н, СН=), 5.13 (д, J=10.7 Гц, 1Н, СНАНВ=), 5.01 (д, J=17.3 Гц, 1Н, СНАНВ=), 3.99-3.95 (м, 1Н, CHN), 1.13 (с, 3H, СН3), 1.01 (с, 3H, СН3). 13С ЯМР-спектр (CDCl3), δ, м.д.: 141.54, 134.13, 128.74 (2С), 128.55, 128.19 (2С), 116.53, 64.65, 40.22, 24.89, 23.80.
Пример 10.30. -Фенилбут-3-ен-1-амин гидрохлорид из бензальдегида, аммиака и аддукта триаллилборана с диметиламином
Стадии: а. 20-25°С 30 мин; b. 40°С 4 ч. Выход 90%. Спектральные характеристики выделенного соединения совпадают со спектральными характеристиками соединения, полученного в примере 10.1.
Пример 10.31. Метиловый эфир 2-[(1-фенилбут-3-енил)амино]уксусной кислоты из бензальдегида, метилового эфира глицина и аддукта триаллилборана с диметиламином
Гидрохлорид метилового эфира глицина (0.15 г, 1.2 ммоль) смешивают с бензальдегидом (0.11 г, 1 ммоль) и Et3N (0.12 г, 1.2 ммоль) в МеОН (1.5 мл), а затем кипятят в течение 2 ч. К полученному in situ имину при температуре 20-25°С добавляют при перемешивании аддукт триаллилборана и диметиламина (64 мг, 0.36 ммоль), после чего нагревают реакционную смесь при перемешивании при 40°С 16 ч. Гомоаллиламин выделяют колоночной хроматографией на силикагеле (элюент - EtOAc:MeOH=10:1) с выходом 91%. C13H17NO2. Вычислено, %: 71.21; Н 7.81; N 6.39. Найдено, %: С 71.18; Н 7.85; N 6.34.
1Н ЯМР-спектр (CDCl3), δ, м.д.: 7.39-7.29 (м, 4Н, Ph), 7.29-7.23 (м, 1H, Ph), 5.77 (дддд, J=16.4, 10.1, 8.1, 6.1 Гц, 1H, СН=), 5.18-5.07 (м, 2Н, СН2=), 3.71 (дд, J=6.0, 4.0 Гц, 1Н, CHN), 3.69 (с, 3H, ОМе), 3.32 (д, J=17.5 Гц, 1H, CHAHBN), 3.19 (д, J=17.6 Гц, 1H, CHAHBN), 2.51-2.45 (м, 2Н, СН2 аллил), 2.12 (уш. с, 1Н, NH). 13С ЯМР-спектр (CDCl3), δ, м.д: 173.11, 142.88, 135.16, 128.53 (2С), 127.39 (3C), 117.93, 61.81, 51.76, 48.49, 43.15.

