Результат интеллектуальной деятельности: Способ лечения радиационных поражений организма
Вид РИД
Изобретение
Изобретение относится к ветеринарии и медицине, в частности, к производству и использованию препаратов, предназначенных для терапии радиационных поражений организма.
Известен способ лечения радиационных поражений организма путем подкожного введения противолучевой сыворотки млекопитающих в дозе 10-12 мг/кг в течение первых 10 сут после облучения (Патент RU №2160572 МПК А61К 35/38 - опубл. 27.06.2001).
Недостатком способа является высокая себестоимость препарата и сложная технология получения противолучевой сыворотки с использованием дорогостоящих сельскохозяйственных животных (лошадей, волов, свиней или овец).
Известны способы лечения и профилактики радиационных поражений путем использования веществ микробного происхождения (цельных микробов кишечно-тифозной группы и их структурных компонентов (белково-полисахаридных комплексов бактериальных экстрактов, экзо-, эндотоксинов) (см. статью В.Н. Андрющенко и др. Противолучевое действие веществ микробного происхождения // Радиац. биол. радиоэкология. - 1996. - Т. 38. - В.З. - С. 416-425).
Известен способ лечения радиационных поражений организма путем перорального введения лактобацилл и бифидобактерий и колибактерина в дозах 5⋅108, 1⋅108 и 1⋅103 КОЕ/мл соответственно при облучении животных в минимальных абсолютно летальных дозах (ЛД80) (см. ст. В.Н. Мальцева и др. Бактериотерапия острой лучевой болезни // Радиобиология. - 1978. - т. 17. - В. 5. - С. 757-760).
Известен способ лечения радиационных поражений организма путем трехкратного внутримышечного применения пробиотического препарата «Биоспорин» облученным в минимальной смертельной дозе (ЛД70/30) лабораторным животным.
К недостаткам данных способов лечения относится низкая радиозащитная эффективность даже при сублетальных (ЛД70-80/30) дозах облучения. При облучении животных в летальных дозах (ЛД90-100/30) эффективность препаратов резко снижается.
Известен также способ лечения острой лучевой болезни путем применения продуктов метаболизма В. subtilis и адсорбента токсинов-цеолита, связывающего и выводящего из организма токсины, тяжелые металлы и радионуклиды (см. статью Е.И. Ткаченко и др. Эридикационная терапия, включающие пробиотики: консенсус эффективности и безопасности // Клиническое питание - 2005. - №1. - С. 14-20).
К недостаткам данного способа относится использование в основе препарата неочищенного цеолита, содержащего значительное количества нерастворимых солей и кварца, не участвующих в процессе адсорбции токсинов и, будучи неактивными компонентами адсорбента, присутствуют в качестве балласта, создавая при этом необоснованную излишнею нагрузку на желудочно-кишечный тракт пациента. При этом следует отметить, что препарат оказывает положительный эффект только при длительном (прием 2 раза в день в течение 2-3 недель) пероральном применении и он предназначен для лечения людей. Применение препарата на животных форме производства - таблетки не предусмотрено и использование его неэкономично и нецелесообразно.
Наиболее близким к предлагаемому способу является лечение радиационных поражений организма путем подкожного введения, облученного в дозе 14 Гр бифидумбактерина, который однократно вводят животным в дозе 1,4⋅106 КОЕ/кг (см. автореф. дисс. А.Ш. Хафизова «Изыскание радиозащитных средств из класса веществ микробного происхождения». - Казань, 2007. - 19 с.).
Хотя данный способ предназначен для лечения радиационных поражений организма, основанный на принципе повышения радиозащитного действия веществ микробного происхождения путем воздействия на микробные клетки ионизирующими излучениями, тогда как в предлагаемым способе радиомодифицирующий агент используют для получения лечебного препарата на основе патогенного микроба - Fusobacterium necrophorum. Выбор тест-микроба обусловлен тем, что, во-первых, данный микроорганизм вырабатывает комплекс весьма сильных токсинов: гемотоксин, термостабильный токсин - лейкоцидин, некротоксин, представляющий собой эндотоксин, тесно связанный с телом клетки и в химическом отношении являющийся липополисахаридом; во вторых, инактивированные токсины (анатоксины) являются весьма эффективными лечебно-профилактическими средствами при поражении организма как агентами биологической (инфекционные агенты), так и неинфекционной (физико-химические, токсические) природы, в частности, при поражении организма ионизирующими излучениями (см. статью В.И. Андрющенко и др. Противолучевое действие веществ микробного происхождения // Радиац. биол. Радиоэкол. - 1996. - Т. 36. - В 2. - С. 195-207).
Следовательно, наличие в микробных клетках F. necrophorum сильных токсинов и липополисахаридов, которые под воздействием ионизирующих излучений переходят в анатоксины, обладающие радиозащитными свойствами, а содержащиеся в эндотоксине липополисахариды, благодаря наличию в их составе хитина и пектинов, взаимно усиливают радиозащитный эффект анатоксинов F. necrophorum.
Обычно токсины переводят в анатоксины путем воздействия формалином и теплом (35-38°С) (см. Патент РФ №2098127, МПК А61К 39/116, опубл. 10.12.1997). Учитывая, что достижение полной безвредности (атоксичности) происходит только через 2-4 недели после термохимической обработки (действия формалина и тепла), были проведены исследования по поиску наиболее эффективных методов обезвреживание токсина. В результате исследований Е. Lowenstein (1909) установлено, что быстрое падение токсичности сильного (столбнячного) токсина наступает под воздействием ультрафиолетовых лучей (УФ-облучение) (см. кн. А.А. Воробьева и др. Анатоксины. - М., 1965).
Поскольку механизм действия ультрафиолетовых лучей и ионизирующих излучений является тождественным, для получения радиозащитного препарата на основе веществ микробного происхождения - F. necrophorum, мы использовали метод радиационной инактивации возбудителя и, соответственно, перевода сильного токсина возбудителя в анатоксин.
Механизм радиозащитного действия анатоксина F. necrophorum обусловлен, во-первых, синтезом антитоксических антител, которые нейтрализуют как специфические, так и неспецифические (радиотоксины) токсины путем реакции флокуляции, во-вторых, анатоксин, являясь сильным антигеном микробного происхождения, после встречи с лимфоцитами и взаимодействия с ними, индуцирует синтез медиаторов иммуногенопоэза - цитокинов, обладающих радиозащитными свойствами, действующих по принципу перехвата и нейтрализации радиотоксинов - основных детерминантов радиационного поражения, обеспечивая тем самым защиту от радиоиндуцированной апоптозной гибели клеток иммуногенопоэза; в третьих - токсины F. necroforum, представленные в химическом отношении липополисахоридом, обладают широким спектором физиологического действия: сорбция радионуклидов, тяжелых металлов, бактерий и бактериальных токсинов, активация функции в кишечнике, нормализация липидного обмена, ингибирование окисления липидов (радиоиндуцированой липопероксидации), регуляция иммунитета (иммуномодулирующее действие полисахаридов), нарушенного вследствие иммунопатологического действия ионизирующей радиации. Содержащиеся в составе липополисахаридов пектины и никротоксины активно и легко связываются с тяжелыми металлами, радиоактивными веществами, экзо- и эндотоксинами, радиотоксинами и т.д.
Таким образом, экзотоксины F. necroforum, представленные в химическом отношении полимером моносахаридов, являются структурными полисахаридами, включающие хитины и пектины, обладающие выраженным радиозащитным свойством (см. статью Ю.П. Фомичева и др. Влияния хитозана на выведение радионуклидов из организма //Новые достижения в исследовании хитина и хитозана. Матер. VI науч. конф. - М.: Изд-во ВНИРО, 2001. - С. 375-376).
Задачей предлагаемого изобретения является повышение эффективности защиты организма от радиационного поражения и расширение области применения радиозащитного препарата.
Технический результат на достижение которого направлено изобретение, заключается в повышении лечебного эффекта и выживаемости облученных животных.
Для достижения названного технического результата, в предлагаемом способе лечения радиационных поражений организма, предусматривающий введение в организм биологического препарата бактериального происхождения, в качестве бактериального препарата используют радиоинактивированную микробную культуру Fusobacterium necrophorum, облученную гамма-лучами 60Со в дозе 25-30 кГр, которую вводят животным однократно подкожно в дозе (1,0-2,0)⋅1010 КОЕ/кг в течение первых трех суток после облучения. Это использования позволяет повысить лечебный эффект до 80%.
Радиозащитный препарат для лечения радиационных поражений получают из культуры вирулентного штамма Fusobacterium necrophorum «8TS630501». Для получения микробной массы, культуру F.necrophorum штамм «8TS630501» культивируют на жидкой питательной среде Китт-Тароцци с добавлением 1,0 мл нормальной сыворотки крупного рогатого скота, выращивают в термостате при температуре 37°С в соответствии с методическими и технологическими требованиями.
Выращенную трехсуточную культуру разливают в стерильные флаконы и осаждают центрифугированием при 3000 об/мин в течение 40 минут. Затем надосадочную жидкость сливают, осадок микробов доводят стерильной дистиллированной водой, согласно эталону стандарту мутности Л.А. Тарасевича до 10 ед. (1 млрд/мл).
Полученную взвесь фасуют во флаконы по 10 мл, закрывают их резиновыми пробками и обкатывают алюминиевыми колпачками. После этого флаконы облучают на гамма-установке «Исследователь», источник - 60Со с мощностью экспозиционной дозы 3,7 кГр/час в дозах 5, 10, 15, 20, 25, 30 кГр.
Степень инактивации гамма-облученных взвесей F. necrophorum определяют путем высева их на среду Китт-Тароцци с последующей выдержкой в термостате в течение 7 сут и регистрацией наличия или отсутствия роста возбудителя.
С выращенных культур делают мазки, окрашивают по Граму, микроскопируют под иммерсией с 90-кратным увеличением.
Культуры, облученные в дозах 5, 10, 15, 20, 25, 30 кГр, высевают в пробирки со средой Китт-Тароцци и добавляют 1,0 мл нормальной сыворотки крупного рогатого скота. После высева пробирки помещают в термостат при температуре 37°С и ведут визуальное наблюдение каждые 24 ч после высева культур в течение семи суток.
Результаты облучения F. necrophorum представлены в таблице 1.
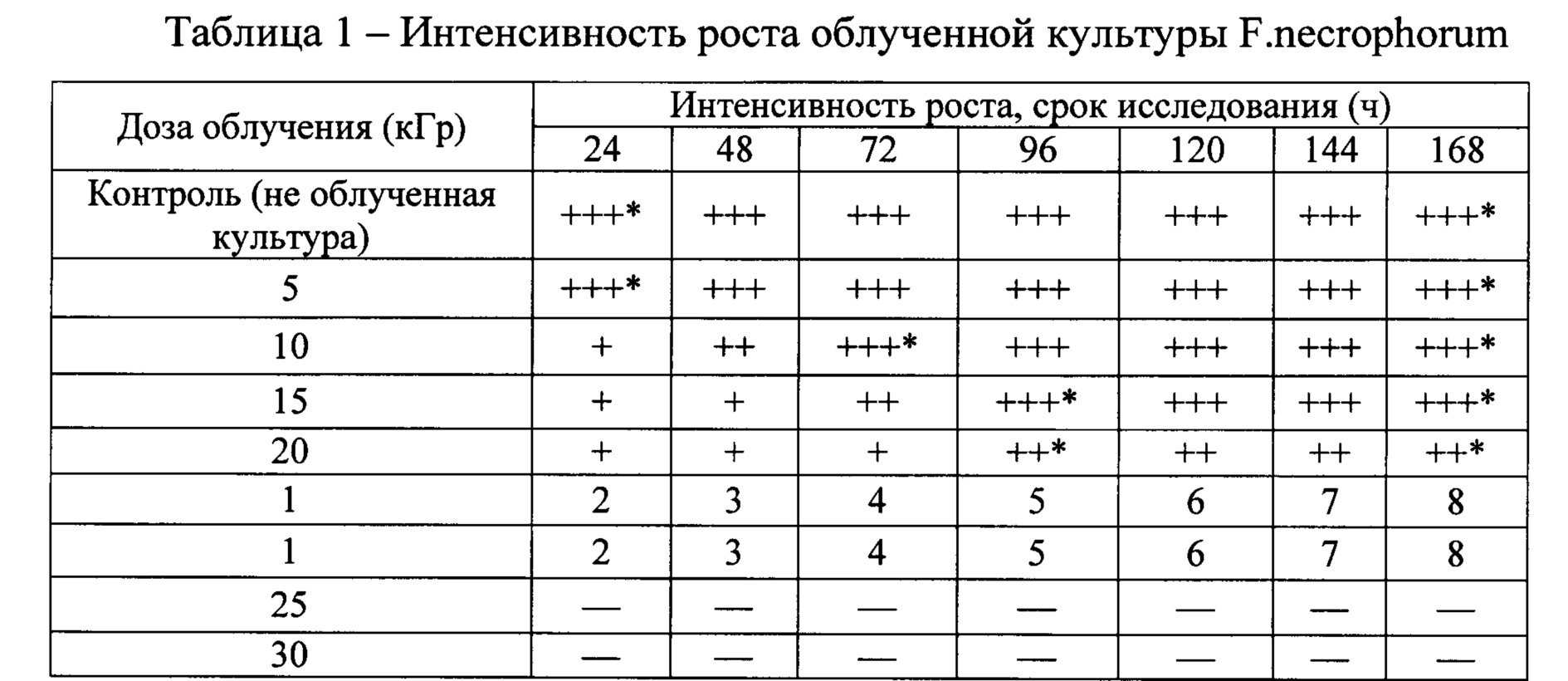
Примечание: (-) - отсутствие роста; (+) - слабый рост; (++) - умеренный рост; (+++) - обильный рост; (+*) - сделан мазок.
Из данных таблицы видно, это полная инактивация культуры F. necrophorum наступает при дозах облучения 25-30 кГр, что подтверждается отсутствием роста микробов за весь период наблюдения.
Облученную (радиоинактивированную) культуру F. necrophorum подвергали исследованиям на аректогенность и безвредность в соответствии с общепринятыми в иммунологии методами (см. кн. Н.П. Бургасова «Руководство по вакцинному и сывороточному делу». - М.: Медицина, 1978. - С. 439).
Для определения аректогенности и безвредности полученного препарата последний в разёличных дозах 1⋅105; 1⋅106; 1⋅107; 1⋅108; 1⋅109; 1⋅1010; 1⋅1011; 1⋅1012 КОЕ/кг внутримышечно, внутрибрюшинно, подкожно, одно-, двух- и трехкратно с интервалом 30, 45, 60, 120 мин вводили белым мышам, используя по 6 животных на каждый вариант опыта, учитывая появление или отсутствие адекватной или неадекватной реакции на препарат. Установлено, что использование препарата при всех вариантах опыта никаких реакций не вызывало: животные были активны, охотно принимали корм и воду, адекватно реагировали на естественные раздражители, что свидетельствует об ареактогенности препарата, и переносимости ими использованных доз, путей и кратности введения.
Полученный по вышеописанному способу препарат на основе радиоинактивированных микробных клеток F. necrophorum используют в качестве радиозащитного (лечебного) средства на облученных животных, а также в качестве профилактического средства против некробактериоза животных.
Радиозащитное действие предлагаемого препарата микробного происхождения осуществляется, во-первых, путем активации процессов регенерации кроветворной ткани в облученном организме. Биологическое действие бактериальных препаратов (в нашем случае - радиоинактиви-рованный некротаксин) на систему кроветворения в облученном организме реализуются через иммунною систему, поскольку предлагаемый препарат, по сути, является иммунотропным (микробный антиген - анатоксин) агентом, оказывающим прямое и непосредственное влияние на систему иммуногемопоэза, в частности, на стволовую кроветворную клетку (СКК), которая определяет выживаемость организма после облучения в определенном (костномозговом) диапазоне доз (СКК - клетки-детерминанты выживаемости на фоне радиогенного стресса); во-вторых, наличие в составе некротоксина (радиоинактивированного некроанатоксина) липополисаха-ридов (имеющие в своем составе хитин - и пектинсодержащие компоненты), определяют антитоксическое действие препарата, которое реализуется путем перехвата и нейтрализации бактериальных экзо- и эндотоксинов, радиотоксинов (супероксидных радикалов, эпоксидов, о-фенолов, о-хинонов, малонового диальдегида, продуктов распада белков и т.д.), пополнение резервов антиоксидантной системы и усиление антиоксидантной активности крови; в-третьих, радиоинактивированные микробные клетки F. necrophorum, представляет собой комплекс антигенов, содержащий соматические антигены и анатоксины, индуцирующие синтез противонекрабоктериозных защитных антител. Следовательно, полученный путем летального облучения возбудителя некробактериоза гамма-лучами препарат, может быть использован не только в качестве лечебного средства при радиационных поражениях, но и по второму назначению - в качестве радиоантигена для профилактики некробактериоза.
Способ лечения радиационных поражений организма иллюстрируется следующими примерами.
Пример 1. Определение радиозащитной активности облученных в различных дозах гамма-лучей препаратов на основе F. necrophorum для белых мышей.
На 5 группах белых мышей изучали противолучевую (лечебную) эффективность различных препаратов на основе F. necrophorum, полученных путем облучения в дозах 15; 20; 25; 30; 35 кГр (по пять животных в каждой группе). Двадцати белым мышам опытных групп (1-4 группы) через 72 часа после облучения в дозе 8,0 Гр (ЛД100/30) вводили подкожно по 0,1 мл радиоинактивированных препаратов на основе F. necrophorum. Облученным животным 5-й и 6-й групп препараты не вводили, они служили контролем облучения и биологическим контролем соответственно. За опытными и контрольными животными вели наблюдения в течение 30 дней после облучения, учитывали количества павших и выживших в каждой группе. Результаты проведенных исследований представлены в таблице 2.
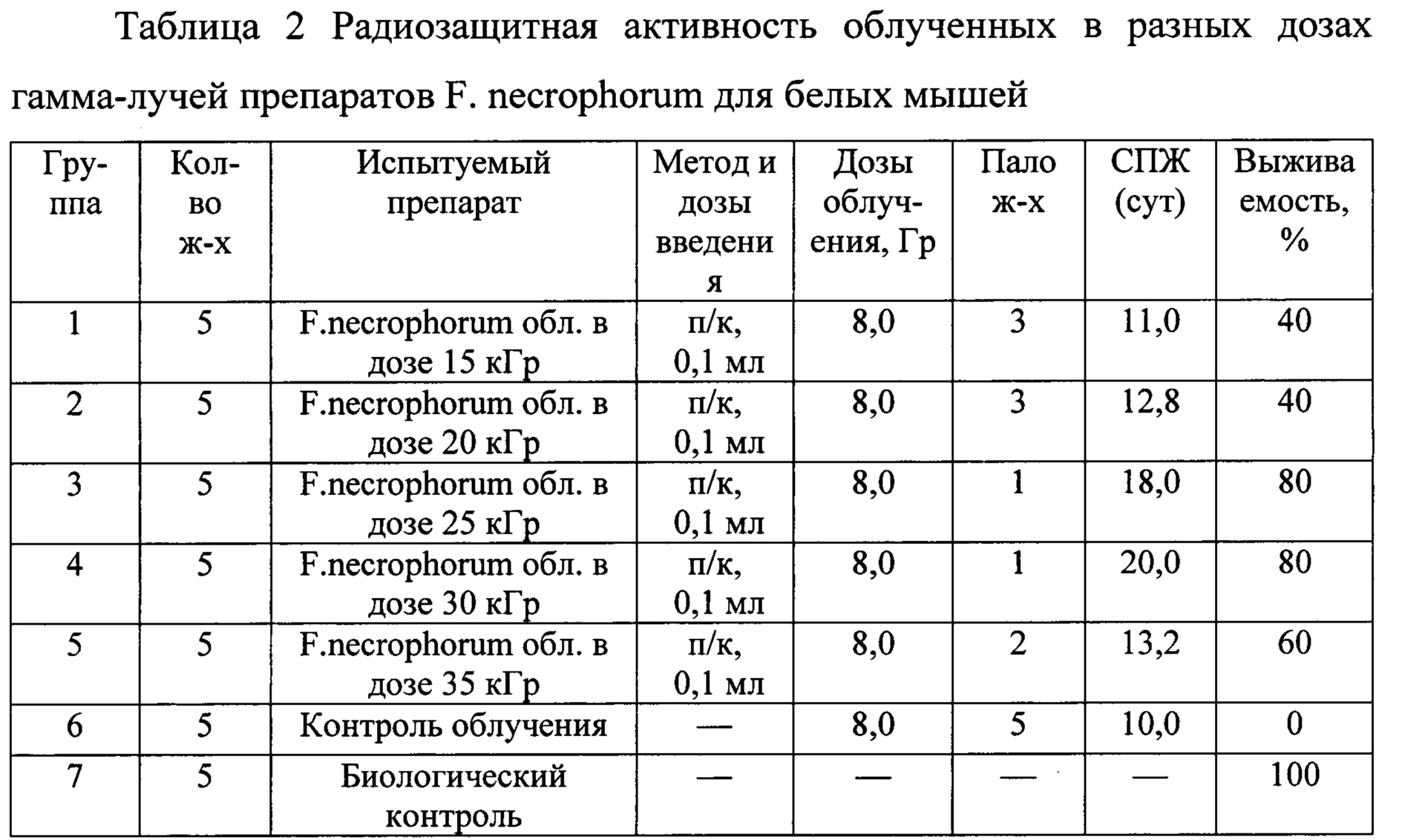
Примечание: п/к - подкожно, СПЖ - средняя продолжительность жизни.
Из приведенной таблицы следует, что препараты F. necrophorum, облученные в дозе 25-30 кГр, обладают максимальным радиозащитным эффектом, обеспечивая 80%-ую выживаемость летально облученных животных.
Пример 2. Определение оптимальных сроков лечебного применения радиоинактивированного штамма F. necrophorum.
Для определения оптимальных сроков лечебного применения радиориактивированного возбудителя некробактериоза, опыты проводили на 60 белых мышах, разделенных на 10 групп по 6 животных в каждой. Облученным в дозе 8,0 Гр животным через 1, 2, 3, 4, 5, 6, 7, 8, 9 и 10 сут после облучения подкожно однократно вводили облученные в дозе 25 кГр F. necrophorum в дозе по 0,1 мл на животное.
Установлено, что выживаемость животных по группам составляла: 1-я - 83,4%; 2-я - 83,4%; 3-я - 83,4%; 4-я - 66,7%; 5-я - 66,7%; 6-я - 50%; 7-я - 33,4%; 8-я - 33,4%; 9-я - 33,4%; 10-я - 33,4%.
Таким образом, однократное подкожное введение,, облученного в дозе 25 кГр F. necrophorum, обеспечивало 83,4% выживаемости летально облученных животных.
Пример 3. Установление оптимальной лечебной дозы препарата.
Для определение оптимальной лечебной дозы препарата, опыты проводили на 50 белых мышах, разделенных на 5 групп по 5 животных в каждой. Животных облучали в дозе 8,0 Гр (ЛД100/30) и через 3 сут после облучения однократно подкожно вводили испытуемый препарат F. necrophorum, облученный в дозе 25 кГр в дозах соответственно 0,1 мл (1-я группа), 0,2 мл (2-я), 0,3 мл (3-я), 0,4 мл (4-я), 0,5 мл (5-я группа). Оценку результатов исследований проводили по примеру 1.
Установлено, что выживаемость летально облученных белых мышей в 1-й группе составляла 70%, во 2-й - 80%), в 3-й - 70%, в 4-й - 60% и в 5-й - 50%.
Таким образом, оптимальной лечебной дозой препарата является 0,2 мл, которая содержит 2⋅810 микробных клеток F. necrophorum. В пересчете на 1 кг живой массы животных получается, что, если живая масса белых мышей в среднем составляет 0,02 кг, то на 1 кг живой массы доза препарата составляет (1-2)⋅1010 КОЕ/кг.
Пример 4. Определение оптимальной кратности применении радионекробактерий.
Для определения эффективности препарата от кратности его применения, опыты проводили на 30 белых мышах, разделенных на 3 группы по 10 животных в каждой. Облученным в дозе 8,0 Гр животным через 3 сут после облучения одно-, двух- и трехкратно подкожно вводили радиоинактивированную в дозе 25 кГр культуру F.necrophorum в оптимальной лечебной дозе (1-2)⋅1010 КОЕ/кг. Оценку эффективности проводили по примеру 1.
Установлено, что увеличение кратности применение до двух и трех раз с интервалом 24 ч между введениями не оказывало существенного влияния на выживаемость животных, что свидетельствует о целесообразности однократного применения препарата.
Пример 5. Изучение формирования радиозащитного эффекта препарата на основе радиоинактивированного штамма F. necrophorum.
Учитывая, что основной мишенью атаки радиотоксинов являются стволовые клетки костного мозга (СКК), которые выступают в качестве детерминантов выживаемости облученного организма, проводили опыты на 30 облученных в летальной дозе (8,0 Гр) белых мышах, разделенных на три группы по 10 животных в каждой. Через 24 ч после облучения животным 1-й группы вводили однократно подкожно радиоинактивированный штамм F. necrophorum в лечебной дозе 2⋅1010 КОЕ/кг. Облученным животным 2-й группы препарат не вводили и они служили контролем облучения. Необлученные и нелеченные животные 3-й группы служили биологическим контролем. Для оценки миелопротекторного действия препарата, животных всех групп убивали, брали пробы костного мозга и определяли клеточность органа.
Формирование радиорезистентности облученного организма под воздействием испытуемого препарата (радиониеробактерий) оценивали по степени ингибирования клеточной гибели миелоцитов, нейтрофилов и лимфоцитов костного мозга на фоне применения испытуемого препарата. Клеточность костного мозга определяли согласно общепринятым в радиационной гематологии методам (см. кн. Е.А. Жербина и А.В. Чухловина «Радиационная гематология». М.: Медицина, 1989 - 175 с).
Результаты исследований представлены в таблице 3.
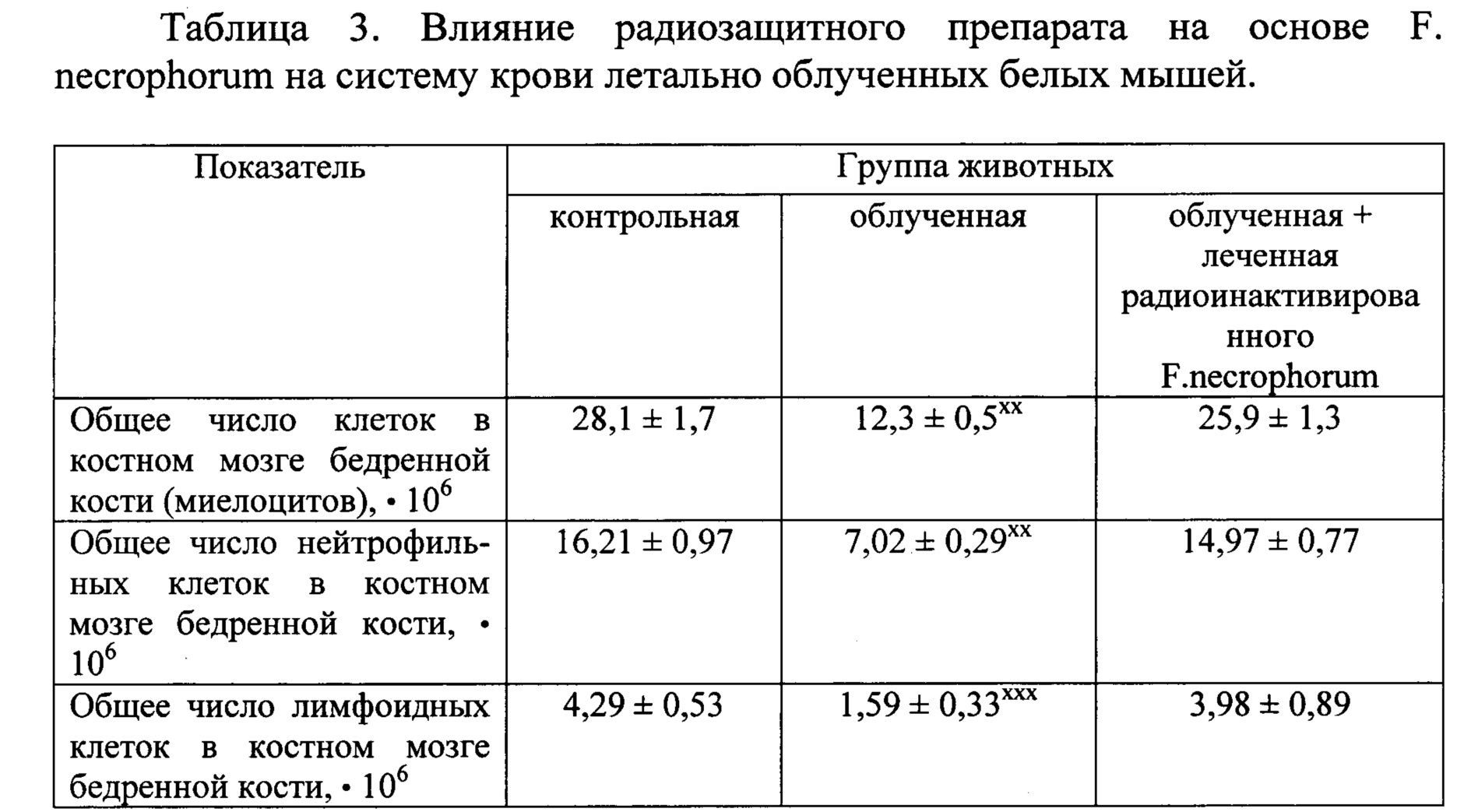
хх-Р<0,01, ххх-Р<0,001.
Как видно из таблицы, летальное облучение животных привело к усилению гибели стволовых клеток костного мозга (миелоцитов) и лимфоцитов на 10-й день опыта, когда число СКК (миелоцитов) снизилось в 2,28 раза, нейтрофильных клеток - в 2,31 раза, и лимфоидных клеток в 2,69 раза. Применение радиоинактивированного F.necrophorum ингибировало катастрофическую гибель миелоцитов и лимфоцитов, когда изучаемые показатели недостоверно отличались от таковых необлученных (контрольных) животных.
Ингибирование радиоиндуцированной гибели миелоцитов и лимфоцитов на фоне применения радионекробактерий обеспечивало сохранность иммунокомпетентных клеток иммуногемопоэза, что отразилось на выживаемости летально облученных клеток, которая составляла 80% выживаемости при 100% гибели облученного контроля.
Пример 6. Изучение влияния радиоинактивированных некробактерий на противонекробактериозную резистентность организма.
Учитывая, что при облучении микробных клеток (вакцинных и вирулентных штаммов различных микроорганизмов) ионизирующими излучениями происходит ослабление вирулентности и токсигенности микробов при сохранение их антигенной структуры (антигенности), обеспечивающий синтез специфических антител, представлял интерес изучение влияния полученного нами радиоиндуцированного варианта некробактерий на противонекробактериозную резистентность организма.
Опыты по изучению возможности формирования противонекробак-териозной резистентности организма на фоне профилактического применения радиоинактивированной культуры F. necrophorum проводили на 70 белых мышах, разделенных по 7 групп по 10 животных в каждой. Животных 1-й, 2-й и 3-й группы за 5 дней до заражения возбудителем некробактериоза иммунизировали формол-эмульсионной вакциной против некробактериоза крупного рогатого скота (ТУ 9384-001-00492374-2008) в дозе 0,1 см. Животных 4-й, 5-й и 6-й групп иммунизировали радиоинактивированной культурой F.necrophorum путем однократного внутрибрюшинного введения препарата за 5, 10 и 20 сут до эксперементального заражения вирулентным штаммом возбудителя F. necrophorum «8TS630501».
Через указанные интервалы времени иммунизированных регламентированной вакциной и испытыемой радиоинактивированной культурой F. necrophorum, а также контрольных (неиммунизированных) животных заражали культурой вирулентного штамма F. necrophorum «8TS630501» в дозе 10 м.к. подкожно в корень хвоста в объеме 0,2 мл.
Результаты изучения противонекробактериозной защиты испытуемых препаратов представлены в таблице 4.
Из данных таблицы видно, что противонекробактериозная защита у иммунизированных регламентированной вакциной наступает только на 20 сут после вакцинации (70%-ная защита против эксперементального заражения). В отличие от известного, использование радиоинактивированной культуры F. necrophorum, уже через 5 дней после иммунизации обеспечивало 50%-ную защиту от возбудителя болезни, а через 20 сут после иммунизации количество защищенных животных составляло 80%.
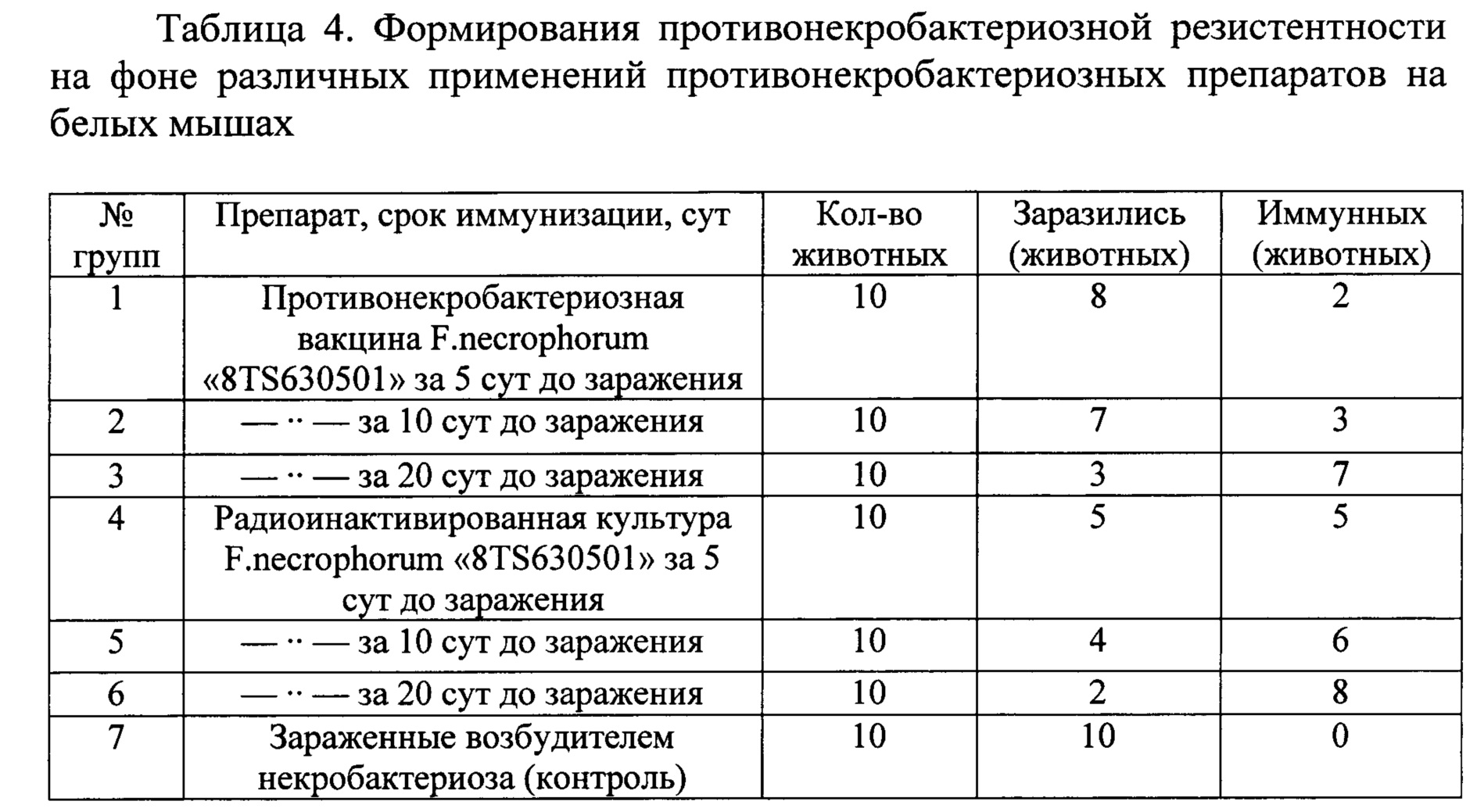
Ускоренное формирование противонекробактериозной защиты иммунитета при применении радиоинактивированной культуры F. necrophorum объясняется особенностью механизма действия радиоинактивированных микробных клеток, который реализуется путем обхода системы генетического контроля радиоинактивированными клетками, которые минуют стадию захвата их макрофагами, переваривания и передача переработанного антигенного материала иммунокомпетентным (антителосинтезирующим) клеткам иммунной системы. В отличие от предлагаемого, иммунный ответ организма на формол-имульсионную вакцину (известную) реализуется по классическому пути: захват чужеродного антигенного материала - комплекса микробных клеток и формалина, который обладает более высокой чувствительностью, чем радиоинактивированны (инертные) клетки убитых микробов, что и обеспечивает включение в иммунный процесс всех механизмов противомикробной защиты (фагоцитов, киллеров, плазматических клеток Т-и В-лимфоцитов).
При использовании радиовакцин участие фагоцитов и хелперов не требуется, что и приводит к ускорению иммунного ответа на использованный антиген.
Таким образом, использование предлагаемого изобретения позволяет снизить степень поражения организма ионизирующими излучениями, повысить лечебный эффект и выживаемость облученных животных на 80%.
Кроме того, предлагаемый способ позволяет применять используемый радиозащитный препарат и в качестве антигена для создания противонекробактериозной резистентности организма.
Способ лечения радиационных поражений организма, предусматривающий введение в организм бактериального препарата, отличающийся тем, что в качестве бактериального препарата используют радиоинактивированную микробную культуру возбудителя некробактериоза F. necrophorum, облученную гамма-лучами Со в дозе 25-30 кГр, которую вводят животным однократно подкожно в дозе (1,0-2,0)⋅10 КОЕ/кг в течение первых трех суток после облучения.
