Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ЦЕЛИАКИИ И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ПОЛУЧЕННОЕ ЭТИМ СПОСОБОМ
Вид РИД
Изобретение
Изобретение относится к фармацевтической промышленности, и может быть использовано для получения средства для лечения целиакии.
Целиакия - аутоиммунное воспаление слизистой оболочки тонкой кишки с ее атрофией у лиц с генетически детерминированной чувствительностью к глютену. [Рекомендации по созданию региональных и общероссийского реестров больных целиакией // Экспериментальная и клиническая гастроэнтерология, Москва-2009 - №10, С. 148-153] []
Целиакия - достаточно распространенное аутоиммунное заболевание, встречающееся примерно у 1% населения в мире. Единственным эффективным спососбом лечения больных, признанным в мире считается пожизненная строгая безглютеновая диета [Сатья Курадаа, Абхиджит Ядава, Дэниэл А. Леффлера «Существующие и новейшие стратегии лечения целиакии» ЭКСПЕРТНАЯ ОЦЕНКА КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ, 2016 http://dx.doi.org/10.1080/17512433.2016.1200463]
Предложены также поддерживающие методы лечения, не устраняющие причину заболевания, но улучшающие состояние больного.
К числу таких способов относится лекарственное средство, содержащее витаминный комплекс, ДНК, РНК, и растительные экстракты [Пат. US 8128971 В1]. Предпочтительной дозой для лечения целиакии является введение 6 капсул препарата пациенту перорально каждый день в течение приблизительно 30 дней. Предполагается, что при использовании данной композиции стимулируется рост кишечных ворсинок, способных более эффективно поглощать питательные вещества.
В Пат. US 8128971 предлагаются к использованию пищеварительные ферменты в композиции включающие амилазы, липазы, протеазы, и любые их комбинации.
В Пат. US 6348495 В1 предлагается использование алканоильных производных L-карнитина (ацетил, пропионил, бутирил, изобутерил, валерил и изовалерил L-карнитина).
В Пат US 8119104 В2 описан способ ингибирования симптомов целиакии, который включает введение моноклонального- или поликлонального-, мономерного, димерного или полимерного препаративного IgA, который накапливается на поверхности слизистой оболочки и способен предотвратить ретро трансцитоз пептидов глиадина, ассоциированных с целиакией и тем самым нарушать процесс заболевания. Вспомогательные вещества, используемые в фармацевтической промышленности смешивают с мономерной, димерной, и полимерной формой IgA с образованием капсулы, таблетки, с последующим покрытием кишечнорастворимыми полимерами или суппозиторий.
Вместе с тем, в ряде патентов приводятся сведения о возможности использования различных соединений белковой природы для создания лекарственных средств, используемых для непосредственно лечения целиакии. Они включают лекарственные формы как для инъекционного введения, так и для перорального приема.
Robert Paul Anderson с группой соавторов в патенте ЕР 2367561 А1 28.09.2011 выявили три доминирующих пептида, которые вместе могут быть использованы в качестве агента в иммунотерапии или в качестве вакцины для модуляции Т-клеточного ответа на три или более видов пептидов глютена и, тем самым, обеспечить толерантность к клейковине, позволяя лечить целиакию. Данное лекарственное средство представлено раствором для инъекционного введения.
В патенте US 7605150 В2 20.10.2009 показана целесообразность введения tTGase, представляющей собой трансглутиминаминазу. Соединение уменьшает токсическое воздействие глютенаолигопептидов, тем самым ослабляя или устраняя воздействие глютена. Лекарственное средство представлено также раствором для инъекционного введения.
В продолжение работ по поиску средств против целиакии в патенте US 7943312 В2 17.05.2011 представлен процесс выделения фермента, принадлежащего к группе по классификации ЕС 3.4.21.26, ЕС 3.4.14.5, или ЕС 3.4.15.1. и предназначенного также для лечения целиакии.
В Пат. ЕР 2736525 А1 приводятся составы пероральных композиций для лечения целиакии и содержащих смесь проферментов или самих ферментов ALV001 и ALV002 или их смеси - ALV003. При этом ALV001 является модифицированной версией профермента форма цистеина endoprotease Б, изоформа 2 (ЕР-В2), ALV002 рекомбинантной версией пролил-эндопептидазы из бактерии Sphingomonas capsulata (СК-ПЭП).
Каждый из этих биологически активных веществ или их смесь в сочетании с маннитолом, ТРИСом, сахарозой, ЭДТА, хлоридом натрия, лимонной кислотой, метабисульфитом натрия, цистеином и монотиоглицерином могут быть заключены в капсулу из гипромеллозы размером 1, 0, или 00, пакетик из фольги, или сформированы в виде таблетки. Суточная доза активной композиции составляет от 100 мг до 3 г. В процессе применения, необходимо растворить препарат в воде или соке и принять во время еды.
Известен «Способ получения белков семейства цистеиновых протеаз пшеницы (Triticum aestivum) и препарат белка тритикаин-альфа, полученный этим способом» [RU №2603504], однако, в нем приводится только способ получения самого белка, но не описан способ получения лекарственного средства, удобного для применения. Рекомбинантный белок тритикаин-α получается в виде волокнистого лиофилизата от белого до серовато-белого цвета, обладающего высокой гигроскопичностью. Он плохо извлекается из флакона, а учитывая, что его доза на прием не превышает 20 мг, это влечет за собой неточность дозирования, большие потери. Кроме того, он обладает неприятными органолептическими характеристиками.
Вместе с там, рекомбинантный белок тритикаин-α устойчив к действию желудочного сока, что позволяет использовать его в составе пероральной лекарственной формы - твердой капсулы из гипромеллозы.
Проблемой, решаемой изобретением, является способ получения и состав лекарственного средства рекомбинантного белка тритикаин-α, используемого для перорального приема.
Технический результат состоит в улучшении технологических свойств тритикаина-α, что позволяет создать лекарственное средство и наиболее подходящую лекарственную форму для его перорального применения.
Поставленная проблема решается способом получения лекарственного средства для лечения целиакии, заключающимся в том, что к белку Тритикаин-α добавляют вспомогательные вещества маннитол и поливинилпирролидон м.м. 12600 (ПВП) при соотношении (вес.ч): 1:0,5-2:0,5-2 соответственно, тщательно перемешивают, замораживают при температуре -70°С не менее 2 ч, лиофилизируют в течение 24 ч при температуре испарителя -50°С и вакууме 0,03-0,04 миллибар, в смеситель помещают МКЦ 102 и Ликатаба-С, взятые в соотношении (вес. ч.): 0,2-1,1:0,2-1,1 соответственно, перемешивают в течение 25 минут до однородной массы, к которой добавляют лиофилизат при соотношении 1:0,15-0,5 (вес. ч.) соответственно, в полученную смесь вводят стеарат магния при соотношении 1:0,007-0,015 соответственно, перемешивают в смесителе в течение 5-15 мин при работающем чоппере при 1000-5000 об/мин, затем скорость вращения чоппера уменьшают до 500 об/мин, перемешивание продолжают в течение 10-30 минут.
Для решения поставленной проблемы предлагается лекарственное средство для лечения целиакии на основе тритикаин-α, отличающееся тем, что оно дополнительно содержит маннитол, ПВП, микрокристаллическую целлюлозу 102, Ликатаб С, стеарат магния при следующем соотношении компонентов в вес. ч.:
|
Проблема решается в два этапа. 1 этап - это получение смеси лиофильновысушенного тритикаина-α со вспомогательными веществами, обладающего удовлетворительными технологическими характеристиками: измельчаемостью, сыпучестью, дозируемостью.
2 этап - получение лекарственной формы тритикаина-α в виде твердых гипромеллозных капсул.
На первом этапе исследована способность к образованию лиофильно высушенных смесей тритикаина-α в сочетании с маннитолом, поливинилпирролидоном М.м. 12600 (ПВП), поливиниловым спиртом (ПВС), введенных как самостоятельно, так и в смеси (таблица 1), пригодных для последующего смешивания со вспомогательными веществами.
Образцы готовили следующим образом. К образцам, сконцентрированным на ячейке Amicon с мембраной РМ-10 (Millipore) с последующим диализом против фосфатно-солевого буфера (PBS, рН 7.4, 4°С, 18 ч), добавляли вспомогательные вещества в соотношениях, указанных в таблице 1, тщательно перемешивали до растворения последних и разливали по приемникам с целью последующей лиофилизации. Сосуд укупоривали крышкой-переходником для крепления к сублимационной сушилке. Далее смесь замораживали при температуре -70°С (не менее 2 ч) в морозильнике Sanyo Ultra Low MDF-U3086S (-70°С) и помещали в установку для лиофилизации (Jouan LP-3, Франция). Процесс лиофилизации проводили в течение 24 ч при температуре испарителя -50°С и вакууме 0,03-0,04 миллибар.
По окончании процесса лиофильного высушивания, флаконы вскрывали, полученный лиофилизат извлекали из флакона, измельчали ударным воздействием (при помощи пестика, диспергатора) избегая растирания, и получали порошкообразную смесь. Было выявлено, что использование в качестве вспомогательного вещества только маннитола приводило к образованию хрупких, пылящих легко электризуемых смесей; введение в состав смеси только поливинилпирролидона (ПВП) или поливинилового спирта (ПВС) не обеспечивало хрупкости полученного лиофилизата. Смеси, состоящая из тритикаина-α с поливинилпирролидоном или из тритикаина-α с поливиниловым спиртом в соотношениях, указанных в таблице 1, после лиофилизации не измельчались, оставались отдельные эластичные волокна, поэтому в дальнейших исследованиях смеси тритикаина-α с этими вспомогательными веществами (тритикаин-α:(ПВП) тритикаин-α:ПВС) использованы не были.

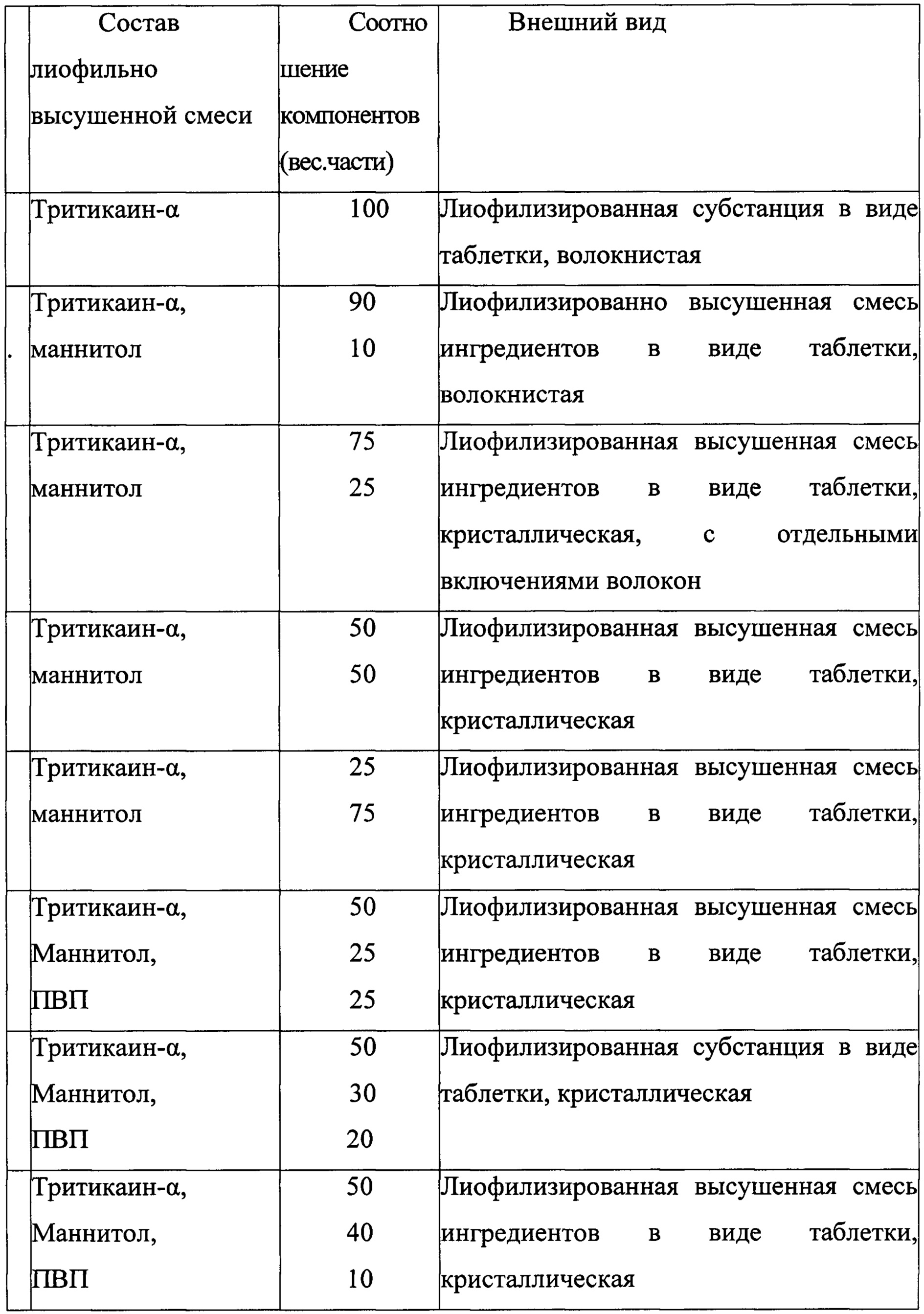
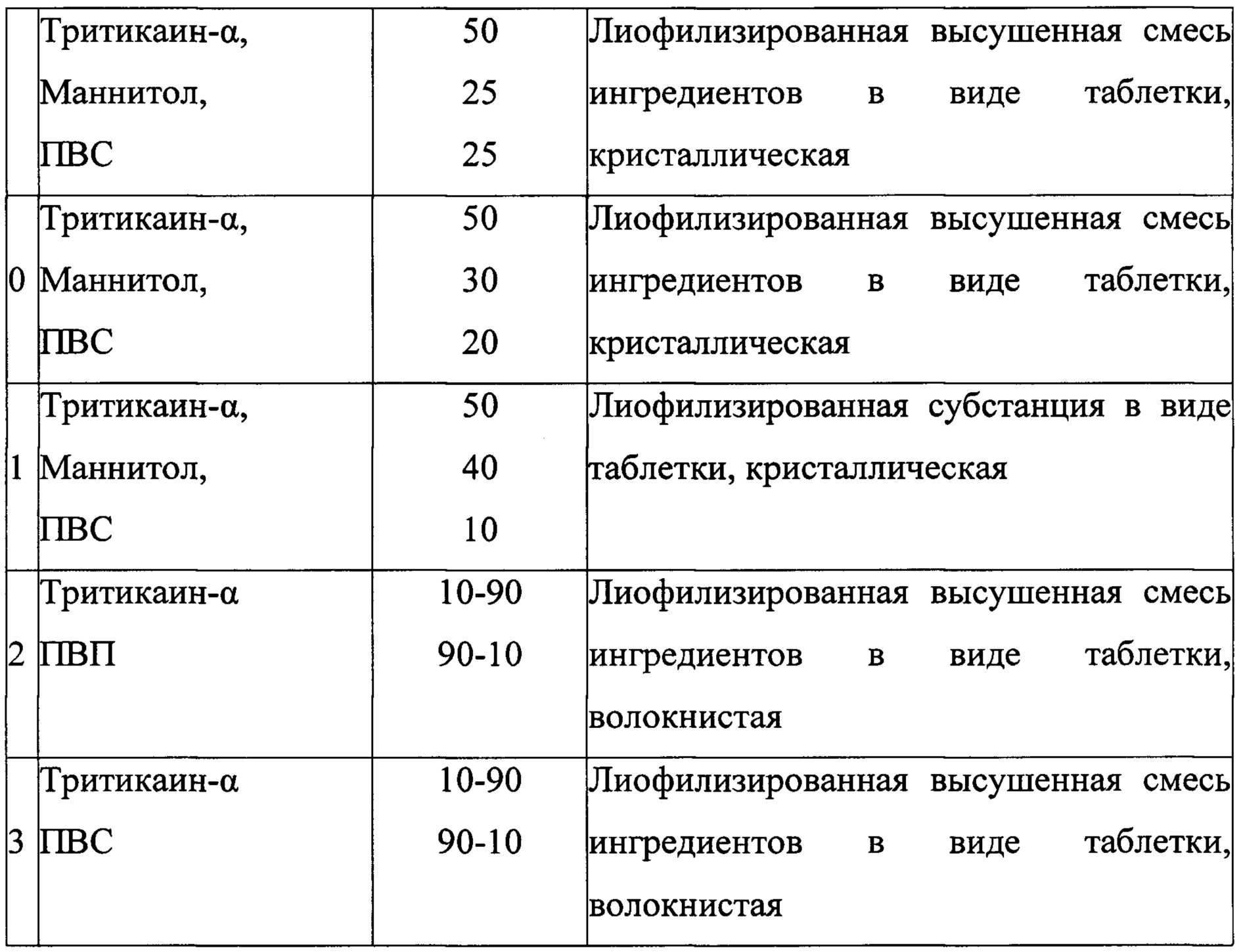
Наиболее оптимальными характеристиками обладали смеси с введением в состав лиофилизата ПВП. Однако, необходимо отметить, что приемлемый диапазон содержания ПВП в смеси узок. Так, при содержании ПВП 75 в.ч в смесях при измельчении отмечалась значительная электризация продукта, а при содержании ПВП в смесях 25 в.ч и ниже - увеличение волокнистости сублимированного продукта, он не разрушался при надавливании. Поскольку в дальнейшем необходим был продукт хрупкий, способный к равномерному разрушению при незначительных воздействиях, содержание ПВП в выбранной смеси находилось в пределах 30-70 в.ч., оптимальным соотношением явилось введение ПВП 25 в.ч.
Смеси тритикаин-α: маннитол: ПВС при испытанных соотношениях компонентов не обеспечивали необходимых качеств продукта (хрупкости, способности к разрушению), и, поэтому в дальнейшем использованы не были.
Отбор вспомогательных веществ для последующего капсулирования проводили на основании технологических параметров как лиофильновысушенной смеси тритикаина с маннитом и ПВП, так и вспомогательных веществ, используемых в фармацевтическом производстве для создания пероральных форм.
Оценку сыпучести проводили в соответствии с ОФС.1.4.1.0010.15 «Порошки» по показателям однородности, сыпучести, насыпной массы, содержания влаги.
Далее проводили исследование качества лиофильно высушенного порошка смеси тритикаина-α с маннитолом, ПВП: однородности, показателей сыпучести, насыпной плотности (свободной и предельной), угла естественного откоса; а также количественного содержания белка, с целью определения приемлемости использования технологической стадии и для выбора ингредиентов, параметров технологической схемы получения смеси для дозирования в капсулы.
Изучены и рассчитаны такие характеристики, как:
Насыпная масса (плотность) - масса единицы объема насыпанного порошкообразного или гранулированного материала.
Свободная насыпная плотность. Показатель определяют путем свободной засыпки порошка в емкость определенного объема (например, мерный цилиндр прибора «ERWEKA» модели SVM 1) с последующим взвешиванием с точностью до 0,01 г.
Предельная насыпная плотность ρн⋅пред - показатель определяют путем измерения объема уплотненной массы порошка на приборе «ERWEKA» модели SVM 1.
Индекс Карра или показатель уплотнения, определяют по разнице в предельной и свободной плотностях, отнесенной к предельной плотности.
Количественное определение белка (тритикаина-α) проводили методом ВЭЖХ, содержание его составило 49,54±0,25%.
Сыпучесть и угол естественного откоса изучаемых порошков определяли в соответствии с ОФС.1.4.2.0016.15.
Полученные результаты по технологическим характеристикам смеси тритикаина-α, маннитола, ПВП и вспомогательных веществ, используемых для капсулирования, представлены в таблице 2.
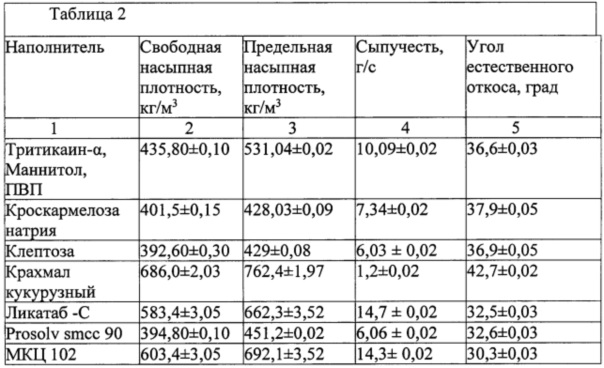
Как следует из данных, приведенных в таблице 2, наиболее близкими по показателю уплотняемости к смеси тритикаина-α, маннитола, ПВП, оказались Ликатаб-С, Prosolv smcc 90, МКЦ-102, и, соответственно, был сделан вывод о наибольшей пригодности данных веществ к созданию порошкообразной смеси, пригодной для капсулирования. По этой причине из дальнейших исследований были исключены кросскармелоза натрия и крахмал кукурузный. Поскольку, по данным литературы, клептоза является веществом, обеспечивающим получение соединений включения, был проведен ряд экспериментов по оценке возможности дальнейшей работы с ней.
При введении в смесь тритикаина-α с ПВП, маннитола клептозы в соотношениях 10:0,5, 10:1, 10:2, рекомендованных для создания соединений включения [Elchman Blouet Нативные и модифицированные циклодекстрины: KLEPTOUSE - многофункциональные вспомогательные вещества для молекулярной инкапсуляции // Фармацевтическая отрасль, 2014 г №5 (46) С. 42-46], было визуально отмечено, что полученная смесь не обладает удовлетворительными показателями сыпучести, и поэтому в дальнейшем также не была использована в исследованиях. В дальнейших исследованиях также не использовали Prosolv smcc 90, поскольку не удавалось получить удовлетворительных визуально смесей при введении его в смесь тритикаина-α, маннитола и ПВП в различных соотношениях ингредиентов.
В дальнейшем исследованы порошкообразные смеси, в которых в качестве вспомогательных веществ были использованы МКЦ-102, Ликатаб-С, как наполнители, диспергаторы.
В результате исследований подобрано соотношение компонентов смеси тритикаина-α, манннитола, ПВП и диспергатора и наполнителя.
Выявлено, что удовлетворительное качество полученной смеси отмечается в следующем диапазоне механических смесей тритикаина-α, манннитола, ПВП со вспомогательными веществами, используемыми для капсулирования:
смесь тритикаина-α с ПВП и маннитолом: 1-10 частей (масс);
микрокристаллическая целлюлоза МКЦ 102: 1-50 частей (масс);
Ликатаб-С - 98-40 частей (масс)
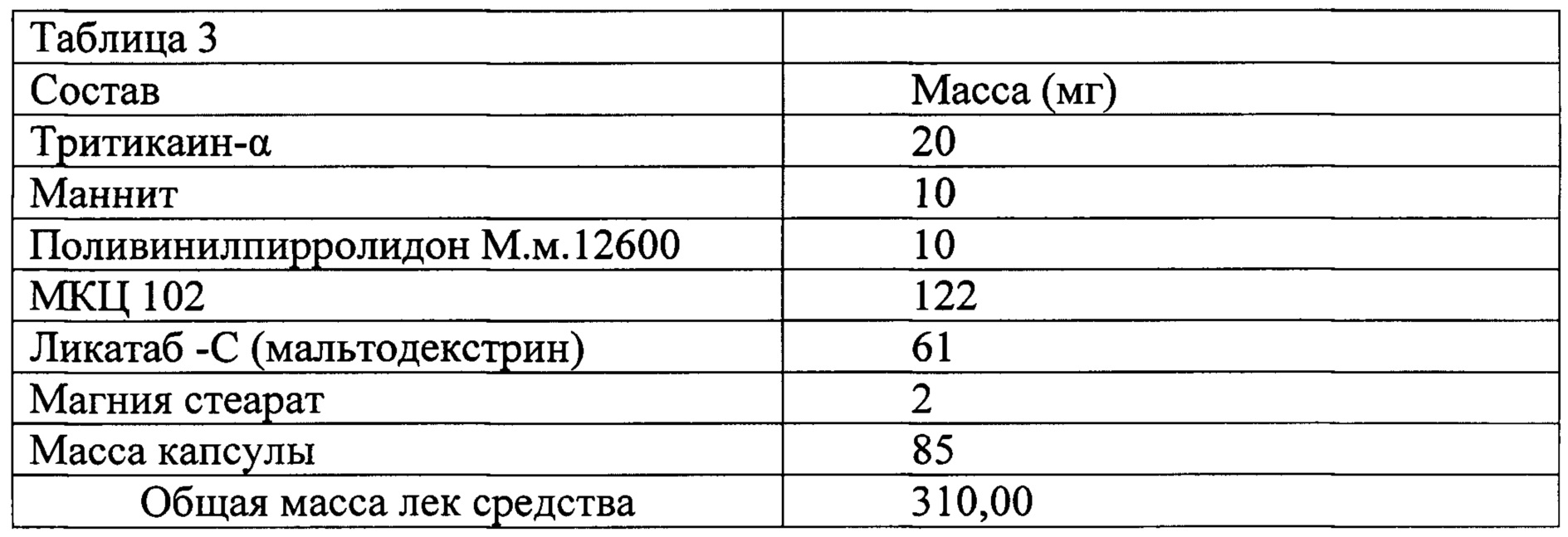
Проанализировав полученные данные, приведенные в таблице 1 и в таблице 2, были выбраны подходящие вспомогательные средства и произведен расчет количества веществ на одну капсулу из гидроксипропилметилцеллюлозы (таблица 3).
Смешение ингредиентов осуществляли в смесителе «Glat» при следующих режимах: скорость вращения мешалки 50-250 об/мин, чоппера 500-1500 об/мин. При указанном диапазоне работы перемешивающих элементов смесителя получали однородную массу. Смешение могло быть произведено на любом другом смесителе, используемом для перемешивания твердых сыпучих веществ.
Для получения однородной смеси в первую очередь получали однородную смесь МКЦ 102 и Ликатаба-С при перемешивании в течение 25 минут. При этом, вначале загружали МКЦ 102, как более кристаллическую смесь, и перемешивали 5-15 минут, затем вводили Ликатаб-С и перемешивали 20-45 минут, добиваясь равномерного распределения. Время перемешивания и качество распределения предварительно оценивали в модельном опыте, при использовании Ликатаба, окрашенного красной меловой аэрозольной краской (производитель: «Dupli-Color»). Оценку проводили визуально.
Затем в смесь, при перемешивании, и увеличенных скоростях вращения: чоппера до 1000-5000 об/мин, а мешалки до 100-1500 об/мин, вводили смесь тритикаина-α с маннитолом и ПВП, которую не подвергали предварительному измельчению и стеарат магния (скользящее вещество). Измельчение смеси и ее распределение осуществлялось в смесителе в течение 5-15 мин, затем скорость вращения чоппера уменьшали до исходной. Перемешивание продолжали в течение 10-30 минут. Температура смеси за указанное время оставалась постоянной - 20°±1°С.
Принимая во внимание природу вспомогательного вещества - белок, отсутствие лабораторных смесителей с охлаждаемой поверхностью, параллельно был проведен эксперимент с использованием охлажденных до -20°±2°С смеси МКЦ 102 и Ликатаба-С. Оценивали возможные продукты разложения методом ВЭЖХ и количественное содержание белка в смеси, полученной при той или иной технологии (фиг. 1, 2).
На фиг. 1 представлены качественные характеристики смеси рекомбинантного белка тритикаина-α, полученные при перемешивании смеси при температуре ингредиентов 20°С.
На фиг. 2 представлены качественные характеристики смеси рекомбинантного белка тритикаина-α, полученные при перемешивании смеси при температуре отдельных ингредиентов - 20°±2°С.
Однородность распределения белка в смеси, определенная методом УФ-спектрофотометрии с раствором бицинхониновой кислоты (ВСА), после отбора пробы порошка из 5 различных мест, последующего их растворения и центрифугирования при 12600 g. Содержание белка в смеси укладывается в 4,54±0,25% во всех точках смеси.
Как следует из данных, приведенных на фиг. 1 и 2, не обнаружено следов разложения тритикаина-α при различных способах получения порошкообразной смеси для капсулирования.
После получения однородной смеси производили дозирование порошка в твердые капсулы Vcaps Plus 0 с использованием настольной капсульной машины ACG - Pam MF 30.
Кроме того проводили оценку качества полученного продукта в соответствии с требованиями ОФС.1.4.1.0010.15 «Порошки» по показателям однородности, сыпучести, насыпной массы, содержания влаги.
Показатели качества полученных смесей приведены ниже.
Сыпучесть порошкообразной массы составила 17,6±0,3 г/сек; свободная насыпная плотность - 588,6±3,05 кг/м3, предельная насыпная плотность- 629,1, угол естественного откоса составил 25,8±0,3, индекс Карра -6,4, содержание влаги - 2,91%.
Приводим конкретный пример осуществления способа.
К 20 г рекомбинантного белка тритикаин-α добавляли 10 г маннитола и 10 г поливинилпирролидона м.м. 12600 (ПВП), тщательно перемешивали до растворения последних и разливали по приемникам с целью последующей лиофилизации. Сосуд укупоривали крышкой-переходником для крепления к сублимационной сушилке. Далее смесь замораживали при температуре -70°С (не менее 2 ч) в морозильнике Sanyo Ultra Low MDF-U3086S (-70°С) и помещали в установку для лиофилизации (Jouan LP-3, Франция). Процесс лиофилизации проводили в течение 24 ч при температуре испарителя -50°С и вакууме 0,03-0,04 миллибар. Для получения однородной смеси в первую очередь получали однородную смесь МКЦ 102 и Ликатаба-С, взятых в количестве 122 г и 61 г соответственно, перемешивали в течение 25 минут смесителе «Glat». При этом, вначале загружали МКЦ 102, как более кристаллическую смесь, и перемешивали 5-15 минут, затем вводили Ликатаб-С и перемешивали 20-45 минут, добиваясь равномерного распределения. Затем в смесь, при перемешивании, и увеличенных скоростях вращения: чоппера до 1000 -5000 об/мин, а мешалки до 100 -1500 об/мин, вводили смесь тритикаина-α с маннитолом и ПВП в количестве 40 г, которую не подвергали предварительному измельчению и 2 г стеарата магния (скользящее вещество). Измельчение смеси и ее распределение осуществлялось в смесителе в течение 5-15 мин, затем скорость вращения чоппера уменьшали до исходной. Перемешивание продолжали в течение 10-30 минут. Температура смеси за указанное время оставалась постоянной - 20°±1°С. Выход продукта 225 г.
Полученная смесь проанализирована по показателям сыпучести, насыпной плотности (свободной и предельной), оценен угол естественного откоса, рассчитан индекс Карра.
Перечисленные показатели составили: сыпучесть 14,6 г/сек; свободная насыпная плотность - 578,3±3,05 кг/м3, предельная насыпная плотность-654,8, угол естественного откоса составил 31,1±0,3, индекс Карра - 11,68. Полученные показатели признаны удовлетворительными для дальнейшей отработки технологии.
Из полученной смеси готовят лекарственное средство в соответствии с изобретением.
После получения однородной смеси производили дозирование порошка в твердые капсулы Vcaps Plus 0 с использованием настольной капсульной машины ACG - Pam MF 30. Получено 1000 капсул следующего состава на одну капсулу:

Способ по изобретению позволяет улучшить технологические свойства тритикаина-α и создать лекарственное средство и наиболее подходящую лекарственную форму для его перорального применения.




