Результат интеллектуальной деятельности: ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ pCXCRs-Fc ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО СЛИТОГО БЕЛКА, ОБЛАДАЮЩЕГО АНТИ-IL-8 АКТИВНОСТЬЮ
Вид РИД
Изобретение
Область техники
Изобретение относится к области биотехнологии, молекулярной генетики, молекулярной биологии, генетической инженерии, а именно - к созданию генно-инженерной генетической конструкции для экспрессии рекомбинантного слитого (химерного) белка CXCRs-Fc, представляющего собой белковую конструкцию из т.н. «рецепторной» и «адапторной» частей. «Рецепторная» часть представляет собой CXCRs-содержащий пептид, специфически связывающийся с интерлейкином-8 (IL-8). «Адапторная» часть представлена Fc-фрагментом иммуноглобулина G человека, который благодаря способности собираться в димерные структуры обеспечивает полимеризацию адресующей (рецепторной) части. Предложенное изобретение может быть использовано для наработки белка, обладающего свойствами блокировать активность интерлейкина-8 (IL-8), обладающего опухоль-стимулирующей активностью. Применение данного химерного белка в качестве основы для лекарственного препарата позволит блокировать рост и пролиферацию опухолевых клеток.
Уровень техники
Известно изобретение WO 2004045526 (А2). Настоящее изобретение представляет средство для ингибирования роста и метастазирование раковых клеток путем введения антител к хемокинам. Необходимо определить конкретные хемокины, которые чрезмерно выражены в опухоли с помощью способов по настоящему изобретению, и вводить антитела против тех хемокинов, у которых имеет место гиперэкспресия. Недостатком данного изобретения является трудоемкость определения мишеней и необходимость последующей наработки антител.
Известен способ лечения различных видов злокачественных опухолей путем введения комбинации антагониста SDF-1, который специфически связывается с человеческим CXCR4, и другого химиотерапевтического агента или лучевой терапии в ходе эмболизации терапии (Патент WO 2015123818). Такие комбинированные препараты предполагают синергетические эффекты по сравнению с использованием каждого препарата в отдельности. Способ лечения предназначен для больных онкологическими заболеваниями, которые имеют низкую толерантность к побочным эффектам, вызванным высокими дозами, которые применяются для лечения химиопрепаратами в отдельности. Недостатком данного изобретения является относительная избирательность активности.
Известно изобретение, относящееся к способу лечения рака молочной железы, характеризующееся активацией гетеродимера HER2/HER3 и включающее стадию введения пациенту терапевтически эффективного количества модулятора интерлейкина-8 (IL-8) и/или его рецепторов хемокинов (СХС-мотив) рецептора 1 (CXCR1) (US2015266961). Недостатком изобретения является узкая направленность лекарственного средства.
Таким образом, на сегодняшний день отсутствует генно-инженерная конструкция, кодирующая слитый белок, состоящий из растворимой части рецептора IL-8 и Fc-фрагмента иммуноглобулина G. Анализ соответствующих информационных источников не обнаружил генетической конструкции, которая могла бы быть прототипом объекта изобретения. В информационных источниках также не обнаружено сведений о том, что где-либо существует целевой продукт указанной генетической конструкции, т.е. слитый белок, состоящий из указанных частей (внеклеточная часть растворимого рецептора к IL-8, слитая с Fc-фрагментом иммуноглобулина G).
С другой стороны, имеется лишь небольшое количество изобретений, которые можно назвать лишь условными аналогами настоящей разработки. Они аналогичны предлагаемому изобретению не по самому объекту изобретения, а лишь по целевому назначению - блокирование интерлейкина-8. Это реализуется либо за счет инактивации самого лиганда, либо за счет блокирования его взаимодействия с рецептором и предотвращению, таким образом, сигнального каскада. Указанные эффекты достигаются в большинстве своем за счет применения антител либо к самому интерлейкину-8, либо к внеклеточной части его рецептора, либо их модуляторов, приводящих к ингибированию опосредованного IL-8 сигнального каскада.
Таким образом, технических решений, совпадающих с совокупностью существенных признаков заявляемого изобретения, из уровня техники не выявлено, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «новизна».
Основание осуществления изобретения
Интерлейкин-8 (IL-8) относится к группе хемокинов, основное назначение которых - обеспечивать хемотаксис в зону воспаления различных типов клеток: нейтрофилов, моноцитов, эозинофилов, Т-клеток. В большинстве злокачественных опухолей, включая рак молочной железы, рак печени, желудка, толстого кишечника и рак предстательной железы, обнаруживается высокий уровень IL-8, этот факт связывают с процессом метастазирования. IL-8 - провоспалительный многофункциональный хемокин, активирующий внутриклеточные сигналы путем связывания с рецепторами на поверхности клеток, - CXCR1 и CXCR2. Указанные рецепторы сопряжены с G-белком и опосредуют множество сигнальных каскадов, в частности PI3K/АКТ, PLC/PKC, Ras/Raf/ERK1/2, FAK, Rho и Rac. Установлено также, что IL-8 способствует самоподдержанию стволовых опухолевых клеток за счет экспрессии последними высокого уровня рецептора CXCR1. В 2013 г. впервые было установлено, что передача CXCR1/2-зависимого сигнала сопровождается трансактивацией молекулы HER2 в стволовых опухолевых клетках, вызывающих рецидивирование опухоли и ее устойчивость к радио- и химиотерапии. В связи с этим в настоящее время именно IL-8 и его рецепторы рассматриваются в качестве одной из ключевых «мишеней», особенно в случае резистентности опухоли к различным видам противоопухолевой терапии.
Задача анти-IL-8 терапии - инактивировать данный ростовой фактор и вывести его из метастатического каскада. Это препятствует пролиферации и миграции эндотелиальных и опухолевых клеток, что, в свою очередь, будет подавлять неоангиогенез и развитие метастазов. Кроме того, такая терапия должна оказывать существенное влияние на устойчивость опухолевых клеток к радио- и химиотерапии, предотвращая возобновление роста опухоли после терапевтического или операционного лечения.
Для решения данной проблемы заявителями разработана генетическая конструкция для получения противоопухолевого рекомбинантного химерного белка, состоящего из растворимой части рецептора IL-8 и Fc-фрагмента иммуноглобулина G. Заявленное средство действует как конкурентный ингибитор IL-8. Рецепторная часть позволяет эффективно связывать IL-8 (биомишень), блокируя его опухоль-индуцирующие свойства, а вторая часть химерного белка обеспечивает удобную очистку его в процессе производства. Кроме того, она способствует усилению биологической активности препарата за счет олигомеризации химерного белка и утилизации комплекса «лиганд-рецептор».
Природные рецепторы интерлейкина-8 (CXCR1 и CXCR2) состоят из семи трансмембранных спиралей и способны связывать хемокин с аффинностью наномолярного порядка [Skelton, 1999]. CXCR1 в отличие от CXCR2 селективен в отношении IL-8. Поэтому растворимая часть рецептора - рекомбинантного CXCR1 - более предпочтительна как потенциальный ингибитор IL-8.
Характер взаимодействия комплекса IL-8 с его рецепторами делает затруднительным получение рекомбинантных ингибиторов IL-8 на основе CXCR1 или CXCR2 из-за недостаточной афинности. Необходимый уровень аффинности, сопоставимый с таковым у природного аналога (Kd 1-5 nM), может быть достигнут только путем искусственной иммобилизации полноразмерного CXCR1 в липидном бислое [Park, 2011]. Однако процесс получения таких структур является достаточно трудоемким и дорогостоящим.
Тем не менее установлено, что конструирование поливалентных структур - это эффективный способ повышения аффинности целевого белка за счет увеличения числа контактов между молекулами; многие естественные процессы, в том числе и взаимодействие антиген-антитело, основаны на этом принципе [Krishnamurthy, 2006]. Эта характеристика очень важна для противоопухолевого препарата, т.к. позволяет снизить дозировку и, следовательно, уменьшить потенциальный токсический эффект на организм. Кроме того, крупные молекулы имеют большее время циркуляции в организме [Kontermarnn, 2011].
Для получения бивалентных молекул использовали Fc-фрагмент иммуноглобулинов G. Известны подходы к получению мультвалентных комплексов путем присоединения к Fc фрагменту дополнительного адаптора (изолейцинового сайта, шарнирной области IgG2, С-концевого фрагмента IgM) [Levin et al., 2015]. Fc фрагмент обладает рядом преимуществ по сравнению с другими олигомеризующими элементами. Присутствие Fc домена заметно увеличивает время полувыведения белка и, следовательно, продлевает терапевтическую активность [Roopenian, 2007], Fc содержащие молекулы могут взаимодействовать с Fc-рецепторами на клетках иммунной системы, что дает им преимущество при использовании в терапии онкологических и инфекционных заболеваний [Nimmerjahn, 2008]. Кроме этого Fc домен сворачивается независимо и может повысить растворимость и стабильность адресующего компонента химерной молекулы. С технологической точки зрения Fc фрагмент удобен, т.к. позволяет очистить целевой белок с помощью аффинной хроматографии на белок A/G носителе.
Исходя из целевого назначения будущего препарата при разработке метода получения рекомбинантного белка CXCRs-Fc следует учитывать необходимость выполнения ряда требований:
а) рецепторная часть рекомбинантного химерного белка должна связывать биомишень IL-8, блокируя его опухоль-индуцирующие свойства;
б) адапторная часть химерного белка должна индуцировать олигомеризацию химерного белка и утилизацию комплекса «лиганд-рецептор».
Для дополнительного повышения авидности рецепторной части в конструкцию был включен адаптер (Fc фрагмент иммуноглобулина G человека), ответственный за олигомеризацию химерного белка. Такая модификация позволит получить димер CXCs-Fc, стабилизированный дисульфидной связью.
Как упоминалось, гибридные белки, содержащие Fc, способны выполнять эффекторные функции иммуноглобулинов in vivo. Финальный продукт, таким образом, будет способен не только связывать IL-8, но участвовать в его утилизации.
Для удобства очистки в структуру химерного белка была добавлена N-концевая сигнальная последовательность CD33. Она обеспечивает транспорт белка в среду культивирования, а наличие Fc-фрагмента позволяет быстро и эффективно очистить белок из среды методом аффинной хроматографии носителе с белком A/G.
Раскрытие изобретения
Задачей изобретения является создание рекомбинантной плазмиды, предназначенной для высокой продукции химерного белка CXCRs-Fc. Рекомбинантные плазмиды обладают биологическими характеристиками, позволяющими использовать данную конструкцию для высокоэффективной продукции химерного белка CXCRs-Fc. Для эффективной наработки белков, слитых с Fc-фрагментом иммуноглобулина G человека, использовали систему экспрессии рекомбинантных белков в клетках млекопитающих. Выбор системы экспрессии опосредован тем, что антиген является гликопротеином. Наработка его в бактериальной или дрожжевой системах повышает риск образования неправильно свернутых форм белка с некорректным профилем гликозилирования или агликозилированных форм. Для наработки белка была выбрана культура клеток почки НЕК. Культура HEK широко используется для наработки белков в научно-исследовательских и промышленных целях. К достоинствам культуры относят высокую скорость пролиферации и высокую степень трансфекции [Backliwal, 2008; Geisse, 2009]. Также культура легко адаптируется к росту в суспензии в широком спектре классических и бессывороточных сред [Brunner, 2010].
Для наработки значительных количеств рекомбинантного рецептора должна быть получена стабильная культура-продуцент. Для этого был сконструирован плазмидный вектор, где нуклеотидная последовательность целевого белка была интегрирована в одну экспрессионную кассету с последовательностью маркера селекции; такая конструкция вектора позволяет отобрать клоны продуцентов с наибольшим уровнем экспрессии белка CXCRs-Fc.
Объектом техники является генетическая конструкция pCXC8R-Fc, кодирующая рекомбинантный слитый белок, состоящий из растворимого рецептора к интерлейкину-8 (IL-8) и Fc-фрагмента иммуноглобулина G. Ниже приводится обоснование для осуществления настоящего изобретения.
Предлагаемая генетическая конструкция pCXC8R-Fc описывается следующими признаками: 5' - P-SP-CXCR-Fc - 3', где:
- Р - промоторная последовательность цитомегаловируса;
- SP - нуклеотидная последовательность, кодирующая сигнальный пептид CD33;
- CXC8R - нуклеотидная последовательность экстраклеточного домена рецептора интерлейкина 8;
- Fc -нуклеотидная последовательность константного домена иммуноглобулина G человека.
Технический результат заключается в том, что получена генетическая конструкция, кодирующая рекомбинантный слитый белок, обладающий анти-IL-8 активностью.
Заявляемые признаки, предопределяющие получение вышеуказанного технического результата, явно не следуют из уровня техники, что позволяет сделать вывод о соответствии заявляемого изобретения такому условию патентоспособности, как «изобретательский уровень».
Условие патентоспособности «промышленная применимость» подтверждено на примерах конкретного применения, которыми заявляемое изобретение проиллюстрировано, но не исчерпано.
Краткое описание чертежей
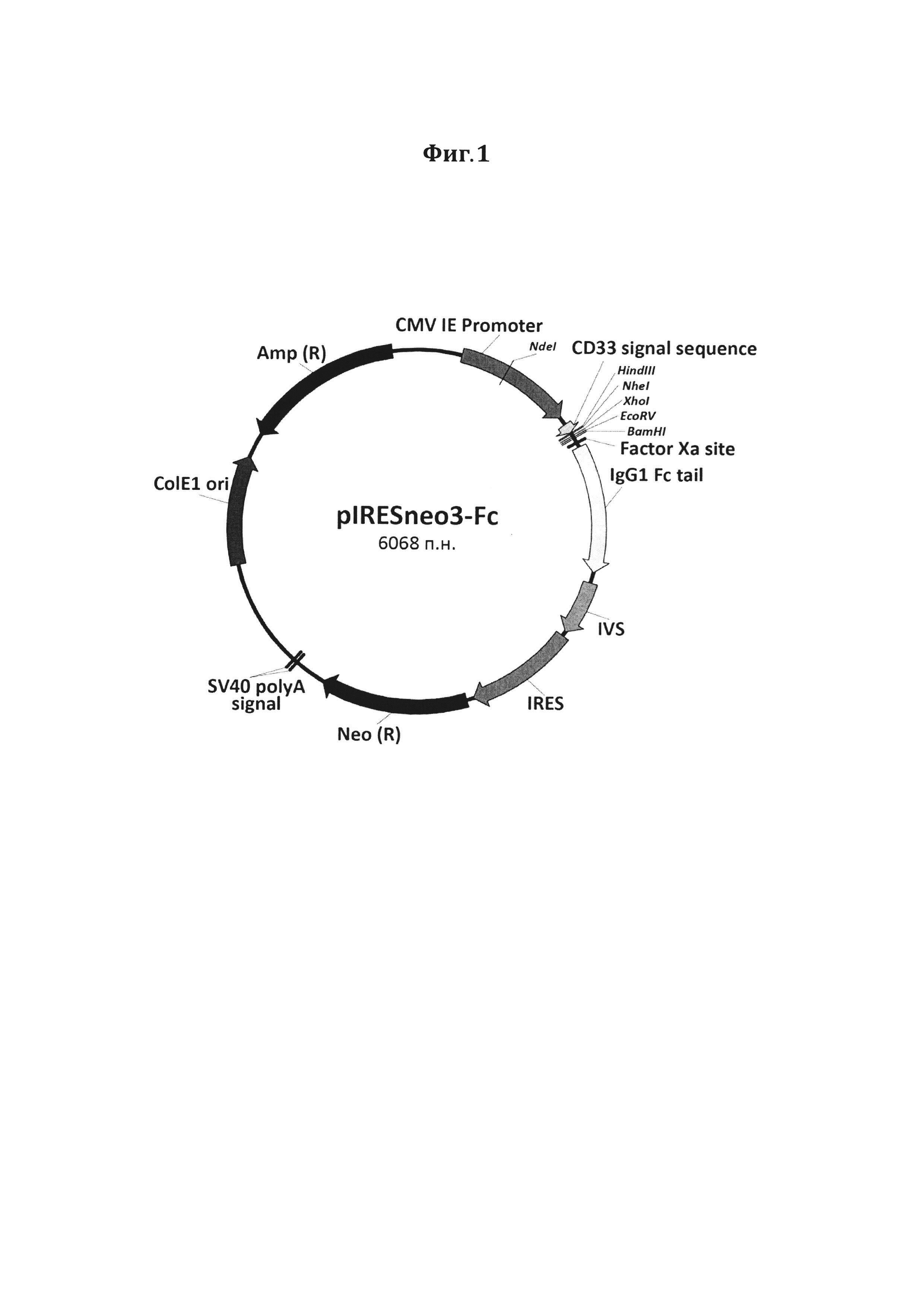
Фигура 1. Схематическое изображение рекомбинантного вектора pIRESneo3-Fc. CMV IE Promoter - ранний промотор цитомегаловируса (CMV) человека (230-862), CD33 signal sequence - лидерная последовательность CD33 (906-959), Factor Ха site - сайт узнавания фактора Ха (1023-1034), IgG1 Fc tail - Fc фрагмент иммуноглобулина G1 человека (1050-1748), IVS - синтетический интрон (1808-2103), IRES - участок внутренней посадки рибосомы вируса энцефаломиокардита (ECMV) (2129-2719), Neo (R) - неомицин-фосфотрансфераза (2755-3555), SV40 polyA signal - сигнальная последовательность полиаденилирования вируса SV40 (3719-3724 и 3748-3753), ColE1 ori - ориджин репликации ColE1 (4345-4944), Amp (R) - β-лактамаза (5071-5933).
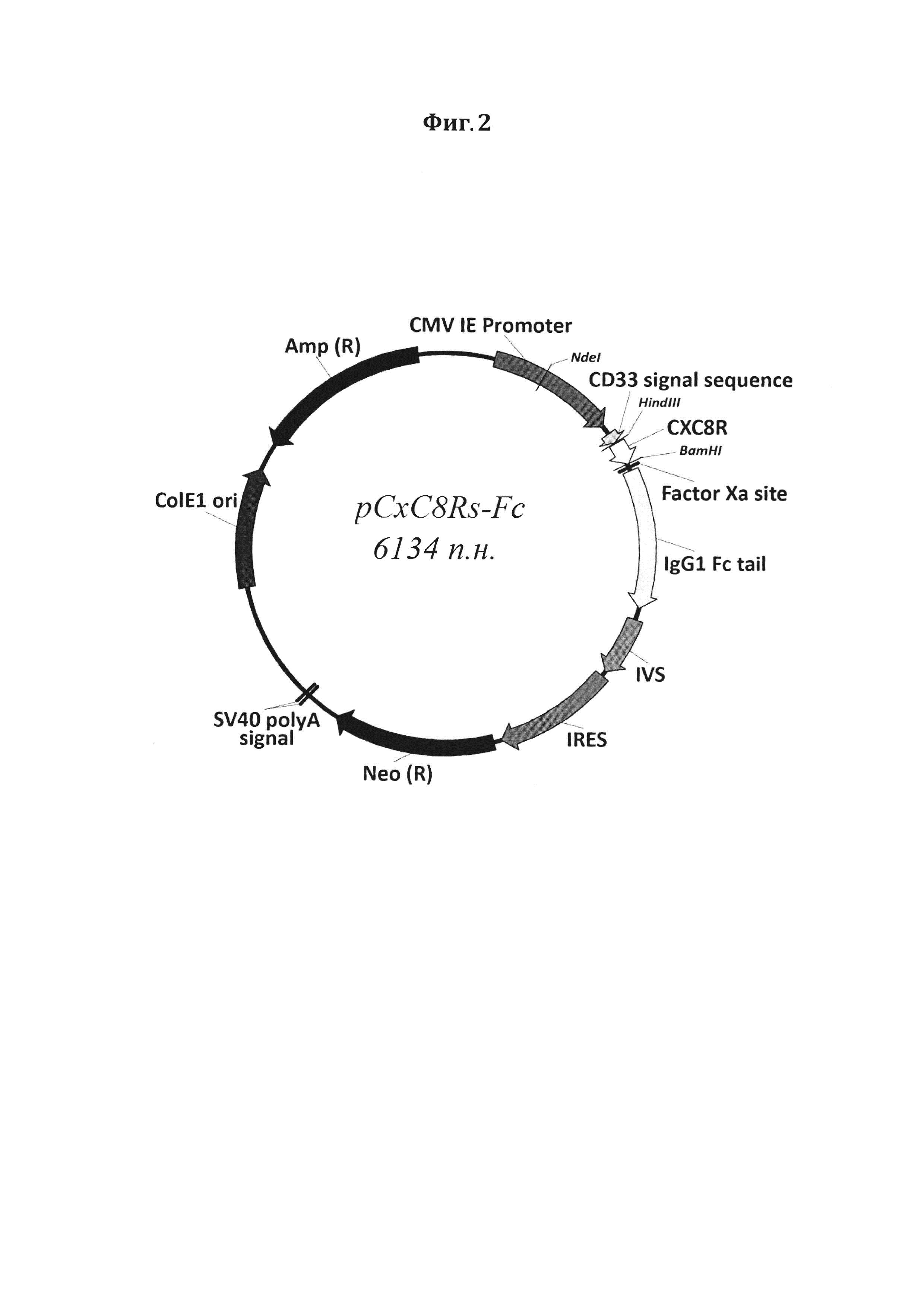
Фигура 2. Схематическое изображение рекомбинантного вектора pCXC8R-Fc. CMV IE Promoter - ранний промотор цитомегаловируса (CMV) человека (230-862), CD33 signal sequence - лидерная последовательность CD33 (906-959), CXC8R - экстраклеточный домен рецептора интерлейкина 8 (966-1082), Factor Ха site - сайт узнавания фактора Ха (1089-1100), IgG1 Fc tail - Fc фрагмент иммуноглобулина G1 человека (1116-1814), IVS -синтетический интрон (1874-2169), IRES - участок внутренней посадки рибосомы вируса энцефаломиокардита (ECMV) (2195-2785), Neo (R) - неомицин-фосфотрансфераза (2821-3621), SV40 polyA signal - сигнальная последовательность полиаденилирования вируса SV40 (3785-3790 и 3814-3819), ColE1 ori - ориджин репликации ColE1 (4411-5010), Amp (R) - β-лактамаза (5137-5999).
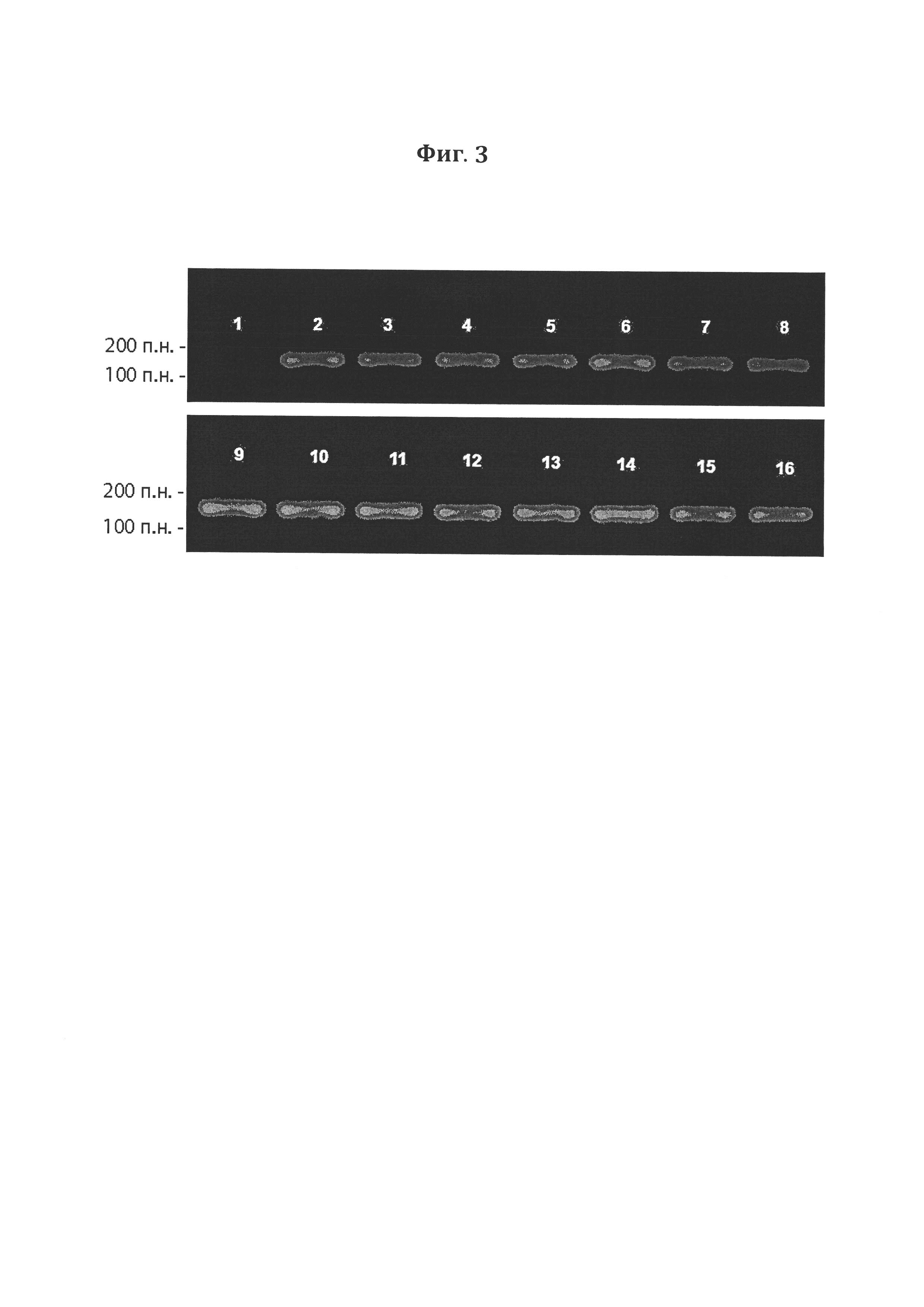
Фигура 3. Электрофорез в 2%-ном агарозном геле ПЦР- продуктов, полученных после амплификации фрагментов ДНК CXCRs-Fc. 16 - положительный контроль, где ПЦР проводили с использованием экспрессионной плазмиды в качестве ДНК-матрицы, 1 - отрицательный контроль, где ПЦР проводили с использованием хромосомной ДНК нетрансфицированной клеточной культуры в качестве ДНК-матрицы.
Фигура 4. Денатурирующий ПААГ-электрофорез очищенного рекомбинантного белка CXCRs-Fc, М - смесь маркерных белков.
Осуществление изобретения
Осуществление изобретения проиллюстрировано, но не ограничено, следующими примерами.
Пример 1. Получение промежуточного вектора pIRESneo3-Fc
На первом этапе получения запланированных генетических конструкций сконструирован новый рекомбинантный промежуточный вектор pIRESneo3-Fc (Фиг. 1). В данном векторе под регуляцией промотора CMV помещены элементы, кодирующие лидерную последовательность CD33 и Fc-фрагмент иммуноглобулина G человека. Присутствие CD33 сигнальной последовательности в составе целевого белка обеспечивает его транспорт в среду культивирования. Такой прием позволяет изолировать белок от внутриклеточных протеаз в процессе наработки, а также облегчает дальнейшую очистку.
Конструкция рекомбинантного слитого белка CXCRs-Fc обеспечивает возможность специфической одноэтапной очистки с помощью аффинной хроматографии. Очистка Fc-содержащих белков методом аффинной хроматографии на носителях с белком А или G обеспечивает довольно высокую чистоту продукта и низкий уровень потерь. Для очистки рекомбинантного белка CXCRs-Fc был выбран метод аффинной хроматографии на Prosep Ultra plus protein A.
Фрагмент ДНК, содержащий данные элементы, амплифицировали методом полимеразной цепной реакции. Полимеразную цепную реакцию проводили с использованием «KOD Hot Start DNA Polymerase» («Merck KGaA») согласно рекомендациям фирмы-производителя. В реакции использовали олигонуклеотиды:
spIg_f(5'-GGAGTATTTACGGTAAACTGCCCACTTG-3')
spIg_r(5'-TTAGGTGATCATATAGAATAGGGCCCTCTAGC-3').
В качестве ДНК-матрицы использовали плазмидную ДНК spIg. Реакционная смесь объемом 25 мкл содержала 1х буфер для «KOD Hot Start DNA Polymerase», по 8 пМ каждого олигонуклеотида, 200 нМ каждого дезоксинуклеозидтрифосфата, 1,5 мМ MgSO4, 1 нг ДНК вектора spIg и 0,5 ед. «KOD Hot Start DNA Polymerase».
Условия амплификации фрагмента ДНК приведены в таблице 1.


Продукты ПЦР длиной 1344 п. н. анализировали электрофорезом в 0,8% агарозном геле. В качестве электрофорезного буфера использовали 1х ТАЕ буфер (40 мМ Трис, 20 мМ уксусная кислота, 1 мМ ЭДТА, рН 8,3). После окончания электрофореза гель окрашивали раствором 5 мкг/мл бромистого этидия. Результаты визуализировали в проходящем ультрафиолетовом свете с помощью трансиллюминатора (Vilber Laurmat). Продукты полимеразной цепной реакции очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific») в соответствии с инструкцией производителя. ПЦР фрагмент элюировали в объеме 25 мкл.
Амплифицированные фрагменты ДНК гидролизовали эндонуклеазами рестрикции NdeI («Thermo Scientific») и BelI («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 2х буфер «Tango», 500 нг продуктов ПЦР и по 10 ед. эндонуклеаз рестрикции NdeI и BelI. Реакционную смесь инкубировали в течение 2 часов при 37°С, ферменты инактивировали прогреванием реакционной смеси при 80°С в течение 20 мин. Векторную ДНК pIRESneo3 гидролизовали эндонуклеазами рестрикции NdeI («Thermo Scientific») и BamHI («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 2х буфер «Tango», 500 нг векторной ДНК и по 10 ед. эндонуклеаз рестрикции NdeI и BamHI. Реакционную смесь инкубировали в течение 2 часов при 37°С, ферменты инактивировали прогреванием реакционной смеси при 80°С в течение 20 мин. Продукты гидролиза очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific») в соответствии с инструкцией производителя. Фрагменты ДНК элюировали в объеме 25 мкл.
Продукты гидролиза (линеаризованный вектор pIRESneo3 и ПЦР-фрагменты) лигировали с использованием Т4 ДНК лигазы («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 1х буфер для Т4 ДНК лигазы, 1 мМ АТФ, 1 ед. Т4 ДНК лигазы и по 100 пмоль продуктов гидролиза. Реакционную смесь инкубировали при 22°С в течение 20 мин.
Продуктами реакции лигирования трансформировали компетентные клетки Е. coli штамма ТОР10. Трансформацию клеток Е. coli проводили химическим методом: реакционную смесь добавляли к компетентным клеткам и инкубировали в течение 60 мин на ледяной бане. Клетки инкубировали на водяной бане при 42°С в течение 90 сек, охлаждали на ледяной бане в течение 15 мин. К клеткам добавляли 1 мл среды LB и инкубировали при 37°С в течение 60 мин. Трансформированные клетки высевали на чашки Петри с агаризованной средой LB, содержащей 100 мкг/мл ампициллина. Клетки инкубировали при 37°С в течение 14-16 часов.
Для анализа колоний клеток Е. coli проводили полимеразную цепную реакцию с использованием Taq ДНК полимеразы («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 25 мкл содержала 1х буфер для Taq ДНК полимеразы, 200 нмоль каждого дизоксинуклеозидтрифосфата, по 10 пмоль олигонуклеотидов spIg_f и IRES_r (5' - ATGCCCGCTTTTGAGAGGGAGTACT-3') и 2,5 ед. Taq ДНК полимеразы. В качестве матричной ДНК использовали суспендированные колонии клеток Е. coli в 5 мкл раствора 1% Тритона Х-100.
Условия амплификации фрагмента ДНК приведены в таблице 2.

Продукты ПЦР анализировали электрофорезом в 0,8% агарозном геле. Из изолированных бактериальных колоний, содержащих рекомбинантные плазмиды, выделяли векторную ДНК, используя набор «GeneJFT™ Plasmid Miniprep Kit» («Thermo Scientific») согласно рекомендациям производителя. Для подтверждения получения запланированного рекомбинантного вектора проводили секвенирование клонированного фрагмента ДНК, используя олигонуклеотиды spIg_f и IRES_r.
Таким образом, на данном этапе был получен вектор pIRESneo3-Fc, схематическое изображение которого представлено на Фигуре 1.
Пример 2. Получение вектора pCXC8R-Fc
Фрагмент ДНК, кодирующий экстраклеточный домен рецептора интерлейкина-8, амплифицировали в два этапа. На первом этапе проводили реакцию обратной транскрипции с использованием RevertAid обратной транскриптазы («Thermo Scientific») согласно рекомендациям фирмы производителя. В качестве матрицы для синтеза кДНК использовали препарат тотальной РНК, выделенной из лейкоцитов периферической крови человека. В качестве праймера использовали олиго-дТ длиной 25 нуклеотидов. Реакционная смесь объемом 20 мкл содержала: 1х буфер для RevertAid обратной транскриптазы, 1 мМ каждого дезоксинуклеозидтрифосфата, 5 мкг тотальной РНК, 20 ед. RiboLock ингибитора РНКаз («Thermo Scientific»), 100 пмоль праймера олиго-дТ и 200 ед. RevertAid обратной транскриптазы. Реакционную смесь инкубировали при 42°С в течение 60 мин. Реакцию останавливали инкубацией реакционной смеси при 70°С в течение 10 мин.
На следующем этапе проводили полимеразную цепную реакцию с использованием «KOD Hot Start DNA Polymerase» («Merck KGaA») согласно рекомендациям фирмы-производителя. В реакции использовали олигонуклеотиды CXCR81-1 (5'-CGGAAGCTTATGTCAAATATTACAGATCCACAGATGTG-3') и CXCR81-2 (5'-TCCGGATCCTTGTTGAGTGTCTCAGTTTCTAGC-3'). В качестве ДНК-матрицы использовали продукты реакции обратной транскриции. Реакционная смесь объемом 25 мкл содержала 1х буфер для «KOD Hot Start DNA Polymerase», по 8 пмоль каждого олигонулеотида, 200 нмоль каждого дезоксинуклеозидтрифосфата, 1,5 мМ MgSO4, 2 мкл продуктов реакции обратной транскрипции и 0,5 ед. «KOD Hot Start DNA Polymerase». Условия амплификации фрагмента ДНК приведены в таблице 3.

Продукты ПЦР длиной 134 п.н. анализировали электрофорезом в 0,8% агарозном геле. Продукты полимеразной цепной реакции очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific») в соответствии с инструкцией производителя. ПЦР фрагмент элюировали в объеме 25 мкл.
Амплифицированные фрагменты ДНК и векторную ДНК pIRESneo3-Fc гидролизовали эндонуклеазами рестрикции BamHI («Thermo Scientific») и HindIII («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 2х буфер «Tango», 500 нг продуктов ПЦР и по 10 ед. эндонуклеаз рестрикции BamHI и HindIII. Реакционную смесь инкубировали в течение 2 часов при 37°С, ферменты инактивировали прогреванием реакционной смеси при 80°С в течение 20 мин. Продукты гидролиза очищали с помощью набора «GeneJET PCR Purification Kit» («Thermo Scientific») в соответствии с инструкцией производителя. Фрагменты ДНК элюировали в объеме 25 мкл.
Продукты гидролиза (линеаризованный вектор pIRESneo3-Fc и ПЦР-фрагменты) лигировали с использованием Т4 ДНК лигазы («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 20 мкл содержала: 1х буфер для Т4 ДНК лигазы, 1 мМ АТФ, 1 ед. Т4 ДНК лигазы, 10 пмоль линеаризованного вектора pIRESneo3-Fc и 100 пмоль ПЦР-фрагментов. Реакционную смесь инкубировали при 22°С в течение 20 мин.
Продуктами реакции лигирования трансформировали компетентные клетки Е. coli штамма ТОР10. Трансформацию клеток Е. coli проводили химическим методом: реакционную смесь добавляли к компетентным клеткам и инкубировали в течение 60 мин на ледяной бане. Клетки инкубировали на водяной бане при 42°С в течение 90 сек, охлаждали на ледяной бане в течение 15 мин. К клеткам добавляли 1 мл среды LB и инкубировали при 37°С в течение 60 мин. Трансформированные клетки высевали на чашки Петри с агаризованной средой LB, содержащей 100 мкг/мл ампициллина. Клетки инкубировали при 37°С в течение 14-16 часов.
Для анализа колоний клеток Е. coli проводили полимеразную цепную реакцию с использованием Taq ДНК полимеразы («Thermo Scientific») согласно рекомендациям фирмы производителя. Реакционная смесь объемом 25 мкл содержала 1х буфер для Taq ДНК полимеразы, 200 нмоль каждого дизоксинуклеозидтрифосфата, по 10 пмоль олигонуклеотидов splg_f и Fc_r (5,-GGGGGAAGAGGAAGACTGACGGT-3') и 2,5 ед. Taq ДНК полимеразы. В качестве матричной ДНК использовали суспендированные колонии клеток Е. coli в 5 мкл раствора 1% Тритона Х-100. Условия амплификации фрагмента ДНК приведены в таблице 4.

Продукты ПЦР анализировали электрофорезом в 0,8% агарозном геле. Из изолированных бактериальных колоний, содержащих рекомбинантные плазмиды, выделяли векторную ДНК, используя набор «GeneJET™ Plasmid Miniprep Kit» («Thermo Scientific») согласно рекомендациям производителя. Для подтверждения получения запланированного рекомбинантного вектора проводили секвенирование клонированного фрагмента ДНК, используя олигонуклеотид spIg_f. Таким образом, на данном этапе был получен вектор pCXC8R-Fc, схематическое изображение которого представлено на Фиг 2.
Нуклеотидная последовательность вектора pCXC8R-Fc и аминокислотная последовательность целевого белка CXCRs-Fc приведены в Перечне последовательностей как SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
Пример 3. Получение штаммов-продуцентов рекомбинантного целевого белка CXCRs-Fc
Вектор pCXC8R-Fc с проверенной нуклеотидной последовательностью рекомбинантного белка CXCRs-Fc использовали для трансфекции культуры HEK293 клеток почки эмбриона человека. В связи с тем, что получение и очистку рекомбинантного белка предполагалось вести из культуральной среды, для повышения продуктивности трансфицированной культуры клеток была выбрана линия клеток НЕК293, адаптированных к росту в суспензии. Штамм характеризуется следующими свойствами:
Морфологические признаки. Под фазовоконтрастным и световым микроскопами культура представлена суспензией округлых клеток.
Культуральные свойства. Штамм HEK293 поддерживается в виде суспензионной культуры на отечественных средах DMEM, DMEM/F-12, IMDM с добавлением 10% эмбриональной телячьей сыворотки при температуре 37°С.
Криоконсервация. Криоконсервацию проводят на среде, содержащей 10% DMEM/F-12, добавлением 80% эмбриональной телячьей сыворотки и 10% диметилсульфоксида в качестве криопротектора. Концентрация клеток (2-4)×106 /мл. Штамм хранится при температуре минус (196±1)°С. Жизнеспособными после восстановления остаются не менее 60% клеток.
Кариологическая характеристика. Кариотип стабилен при исследовании до 30 пассажа, модальное число хромосом - 64, уровень клеток с повышенной плоидностью - 4.2%. Обнаруженные нарушения кариотипа укладываются в требования, предъявляемые к клеточной линии-продуценту согласно РД 42-28-10-89. Кариотип соответствует виду.
Контроль контаминации. Бактерии, грибы, дрожжи, микоплазмы и вирусы методами контроля согласно РД 42 -28-10-89 не обнаружены.
Контроль на туморогенность. На 30 пассаже онкогенных потенций не обнаружено.
Стабильность биологических свойств. Сохраняет стабильность кариотипа, культуральных, морфологических и продуктивных свойств до 30 пассажа (время наблюдения).
Установленный уровень пассажей для использования в производстве - 30.
Пример 4. Исследование устойчивости наследования экспрессионной плазмиды штаммом-продуцентом и ее стабильности
Клетки вышеуказанного штамма HEK293 трансфицировали сконструированной экспрессионной плазмидой, содержащей нуклеотидную последовательность гибридого рекомбинантного белка CXCRs-Fc. Трансфицированные клетки HEK293-CXCRs-Fc культивировали в среде DMEM/F-12, содержащей 400 мкг/мл неомицина, с добавлением 10% эмбриональной телячьей сыворотки при 37°С во влажной атмосфере, содержащей 5% CO2. Через 7 дней среду культивирования меняли на свежую, содержащую 800 мкг/мл неомицина, и инкубировали еще 7 дней при 37°С во влажной атмосфере, содержащей 5% CO2. Выросшие клоны (14 штук) путем «пикирования» пересевали индивидуально на селективную среду вышеуказанного состава. Из клеток, полученных после шестого пассажа, выделяли хромосомную ДНК и подвергали ее ПЦР-анализу на присутствие целевых фрагментов ДНК (последовательности гибридного белка) с использованием специфических олигонуклеотидных праймеров. По данным электрофоретического разделения в агарозном геле, все клоны содержали вставку, несущую кДНК гибридного белка, о чем свидетельствует полоса ДНК-фрагмента размером 150 п. о. (Фигура 3).
После этого амплифицированные фрагменты ДНК клонировали в вектор pUC19 и проводили анализ соответствия структуры клонированного фрагмента ДНК, кодирующего кДНК гибридного рекомбинантного белка CXCRs-Fc, с помощью ДНК-секвенирования. В результате анализа было показано наличие целевого фрагмента ДНК у всех исследованных клонов и отсутствие мутаций, делеций, инсерций, перестроек. Для клеток-продуцентов рекомбинантных белков именно этот показатель - отсутствие перестроек в структуре искусственного гена гибридного белка - является принципиально важным для дальнейшей работы. Следует отметить, что культивирование клеток-продуцентов на среде с неомицином и сохранение целевой встроенной кДНК подтверждает стабильность и наследуемость данных генотипических признаков.
Полученные клоны-продуценты гибридного рекомбинантного белка CXCRs-Fc стабильно наследуют векторную кДНК, а анализ амплифицированных фрагментов ДНК подтвердил наличие целевого фрагмента и отсутствие в его последовательности мутаций, делеций, инсерций и перестроек. Таким образом, выполнено одно из основных условий получения клеток-продуцентов гибридных рекомбинантных белков в части их стабильности и наследуемости генотипических признаков (устойчивость к антибиотику, наличие чужеродного гена).
Пример 5. Оценка биосинтетического потенциала полученных штаммов-продуцентов
Полученные данные позволяли перейти к следующему этапу исследования сконструированных клеток-продуцентов - оценке их биосинтетического потенциала и выбору оптимального клона.
Для этого выращивали по 3×106 клеток каждого из клонов в бессывороточной среде BD Cell™ в течение 4 суток. Морфологический контроль культур проводили каждые 24 часа визуально под микроскопом. По окончании культивирования культуральные жидкости собирали и центрифугировали при 13000 об/мин в течение 5 мин при 4°С. Содержание гибридного рекомбинантного белка CXCRs-Fc в отобранных после центрифугирования супернатантах оценивали с помощью иммунохимического анализа в сэндвич-ELISA постановке. Для этого в лунки 96-луночного планшета вносили рекомбинантный человеческий IL-8 (Sigma-Aldrich, США) в количестве 100 нг/лунку. После блокирования свободной поверхности лунок 1% раствором бычьего сывороточного альбумина в ФСБ добавляли по 100 мкл культуральной среды каждого клона и инкубировали 1 ч при 37°С. После тщательной промывки ФСБ с 0.025% Твин-20 в лунки вносили конъюгат белок А - пероксидаза хрена (Merck Millipore) в разведении 1:5000. Инкубировали 1 ч при 37°С, промывали и проявляли пероксидазную активность в цитратном буфере, рН 4.5, содержащем 1.0 мг/мл o-phenylenediamine и 0.1% urea hydrogen peroxide при 25°C. Наличие комплексов IL-8 - CXCRs определяли спектрометрически с использованием планшетного ридера (Biorad, США). Специфичным сигналом считали значения оптической плотности, в 3 раза превышающие значения отрицательного контроля. Как следует из полученных данных, в супернатантах всех клонов обнаруживался целевой гибридный рекомбинантный белок CXCRs-Fc.
Для более точного количественного определения уровней биосинтеза в различных клонах-продуцентах был проведен дополнительный иммунохимический анализ супернатантов. Для этого предварительно было проведено препаративное выделение рекомбинантного белка CXCRs-Fc из смеси супернатантов различных клонов на микроколонках (5×10 мм), содержащих в качестве аффинного носителя белок А-сефарозу. Смешанные супернатанты клеток-продуцентов наносили на колонку с помощью перистальтического насоса при постоянной скорости 0,5 мл/мин. Операции проводились при 4°С. Связывание белка с носителем на стадиях нанесения белка и промывки носителя контролировали по оптической плотности элюата на длине волны 280 с использованием системы проточного детектора Uvicord.
После связывания целевого белка с аффинным носителем носитель промывали буфером, содержащим 25 мМ трис-HCl, рН 7.1, 25 мМ NaCl г и 5 мМ ЭДТА, для отмывки белков, не связавшихся с белок А-сефарозой, с постоянным контролем по оптической плотности элюата (Uvicord).
Элюцию целевого белка с колонки проводили буфером с низким значением рН (50 мМ Na-ацетат, рН 2.7) в пробирки, содержащие по 0,5 мл 100 мМ раствора трис-HCl, рН 7.9. Скорость нанесения, промывок и элюции составляла не более 0,5 мл/мин.
Качество и количество выделенного рекомбинантного белка CXCRs-Fc определяли электрофоретически (Фигура 4) с последующей денситометрией окрашенного геля. Выделенный рекомбинантный белок CXCRs-Fc с известной концентрацией использовали в качестве положительного контроля и для построения калибровочной кривой.
Для количественной оценки продуктивности различных клонов HEK293-CXCRs-Fc был проведен иммунохимический анализ супернатантов в следующей постановке. В лунки 96-луночного планшета вносили рекомбинантный человеческий IL-8 (Sigma-Aldrich, США) в количестве 100 нг/лунку. После блокирования свободной поверхности лунок 1% раствором бычьего сывороточного альбумина в PBS добавляли по 100 мкл разведенной 1:10, 1:30 и 1:100 культуральной среды каждого клона или выделенный рекомбинантный белок CXCRs-Fc с известной концентрацией (1 мкг/лунку; 0.3 мкг/лунку; 0.1 мкг/лунку и 0.03 мкг/лунку). Инкубировали 1 ч при 37°С. После тщательной промывки PBS с 0.025% Твин-20 в лунки вносили конъюгат белок А - пероксидаза хрена (Merck Millipore) в разведении 1:5000. Инкубировали 1 ч при 37°С, промывали и проявляли пероксидазную активность в цитратном буфере, рН 4.5, содержащем 1.0 мг/мл о-phenylenediamine и 0.1% urea hydrogen peroxide при 25°C. Значения оптической плотности, определенной спектрометрически с использованием планшетного ридера (Biorad, США), сравнивали со значениями OD в лунках с выделенным рекомбинантным белком CXCRs-Fc.
Количественную оценку биосинтетической активности клонов-продуцентов рассчитывали как среднее из трех независимых экспериментов с использованием программы «StatPlus2007» [www.analystsoft.com]. Уровни продукции рекомбинантного белка CXCRs-Fc клетками-продуцентами представлены в таблице 5.


Анализ полученных данных показывает, что биосинтетическая активность полученных штаммов-продуцентов различается менее чем на порядок и максимальная продукция целевого белка наблюдается для клона G2K. Уровень продукции составляет по расчетным данным более 180±16 мг/л. В связи с этим он был выбран как наиболее эффективный продуцент в ряду исследованных клонов HEK293-CXCRs-Fc, и дальнейшая работа проводилась именно с ним.
Пример 6. Выделение и очистка рекомбинантного белка CXCRs-Fc из культуральной жидкости
Для отработки условий выделения и очистки рекомбинантного CXCRs-Fc маточную культуру из матраца вносили в культуральный пакет с 1000 мл среды BD Cell™ MAb. Подготовленный пакет соединяли с модулями подачи воздуха, термостатирования и датчиками рН и DO биореактора BIOSTAT® CultiBag RM и культивировали в течение 7 суток. По окончании культивирования культуральную жидкость переносили в стеклянную емкость и использовали для оптимизации условий очистки.
Основной протокол выделения и очистки целевого белка включает ряд стадий:
1) стадия центрифугирования культуральной жидкости;
2) аффинная хроматография на Prosep Ultra plus protein A;
3) катионообменная хроматография с использованием носителя Poros HS 50;
4) анионообменная хроматография с использованием носителя Q Sepharose FF.
Стадия центрифугирования. В качестве исходного материала для выделения и очистки целевого белка использовали культуральную жидкость клеток-продуцентов рекомбинантного белка - Hek-CXCRs-Fc. По окончании инкубации клеток, культуральную жидкость объединяли (общий объем примерно 500 мл) и отделяли биомассу центрифугированием при 3000 об/мин при +4°С. Полученный супернатант использовали для выделения целевого белка.
Очистка целевого белка методом аффинной хроматографии. Для оптимизации условий аффинной хроматографии сравнивали несколько матриц с иммобилизованными белками А или G: протеин А-агароза (Pierce), протеин G сефароза (GE), ProSepUltra Plus Protein A (Merck KGaA). Сравнительный анализ показал, что ProSepUltra Plus Protein А в отличие от других матриц характеризуется большой емкостью при скорости нагрузки до 10 мл/мин и устойчивостью к износу в процессе использования. Таким образом, для очистки рекомбинантного CXCRs-Fc использовали ProSepUltra Plus Protein А. Для этого культуральную жидкость наносили с помощью перистальтического насоса на колонку (2,5×10,2 см) с ProSepUltra Plus Protein А. После нанесения культуральной жидкости колонку промывали буферным раствором, содержащим 25 мМ Трис-HCl, 25 мМ натрия хлористого, 5 мМ динатриевой соли этилендиаминтетрауксусной кислоты, 0,5 М хлорида тетраметиламмония, рН 7,0, затем аналогичным буфером без хлорида тетраметиламмония. Контроль проводили по оптической плотности элюата на длине волны 280 нм. Промывку проводили до полной отмывки несвязавшихся белков (значение оптической плотности на длине волны 280 нм меньше 0,001). Связавшийся с носителем целевой белок элюировали 100 мМ раствором уксусной кислоты. Скорость посадки, промывок и элюции поддерживали 10 мл/мин. Полученный образец белка хранили при температуре +4°С.
Очистка целевого белка методом катионообменной хроматографии. Для отработки условий катионообменной хроматографии определяли оптимальные условия для нанесения и элюции целевого белка. Образец наносили в буфере с различными концентрациями соли и значениями рН (4,0, 4,5). Было установлено, что оптимальный состав буфера для нанесения образца 20 мМ натрия ацетат, 60 мМ натрий хлористый, рН 4,5. Для определения условий фракционирования образца элюцию белка вели линейным градиентом концентрации натрия хлористого (60-1000 мМ). Определили, что фракция целевого белка элюируется в буфере с 160 мМ концентрацией натрия хлористого. Ниже представлен конечный протокол очистки CXCRs-Fc на стадии катионообменной хроматографии.
Образец белка после аффинной хроматографии титровали 100 мМ раствором едкого натра до рН 4,5 и наносили с помощью перистальтического насоса на колонку (2,5×5,1 см) с носителем - Poros HS 50. После нанесения образца колонку промывали буферным раствором, содержащим 20 мМ натрия ацетат трехводный, 60 мМ натрий хлористый, рН 4,5. Контроль проводили по оптической плотности элюата на длине волны 280 нм. Промывку проводили до полной отмывки несвязавшихся белков (значение оптической плотности на длине волны 280 нм меньше 0,001). Связавшийся с носителем целевой белок элюировали буферным раствором, содержащим 20 мМ натрия ацетат трехводный, 160 мМ натрий хлористый, рН 4,5. Скорость посадки 5 мл/мин, промывок и элюции -10 мл/мин. Полученный образец белка хранили при температуре +4°С.
Очистка целевого белка методом анионообменной хроматографии. Для отработки условий анионообменной хроматографии определяли оптимальные условия для нанесения и элюции целевого белка. Образец наносили в буфере с различными концентрациями соли и значениями рН (7,0, 8,0). Было установлено, что оптимальный состав буфера для нанесения образца 25 мМ Трис-HCl, 50 мМ натрий хлористый, рН 8,0. Для определения условий фракционирования образца элюцию белка вели линейным градиентом концентрации натрия хлористого (50-1000 мМ). Определили, что фракция целевого белка элюируется в буфере с 300 мМ концентрацией натрия хлористого. Ниже представлен конечный протокол очистки CXCRs-Fc на стадии анионообменной хроматографии.
Образец белка после катионообменной хроматографии титровали 1,5 М раствором трис(гидроксиметил)аминометана до рН 8,0 и наносили с помощью перистальтического насоса на колонку (1,2×8,9 см) с носителем Q Sepharose FF. После нанесения образца колонку промывали буферным раствором, содержащим 25 мМ Трис-HCl, 50 мМ натрий хлористый, рН 8,0. Контроль проводили по оптической плотности элюата на длине волны 280 нм. Промывку проводили до полной отмывки несвязавшихся белков (значение оптической плотности на длине волны 280 нм меньше 0,001). Связавшийся с носителем целевой белок элюировали буферным раствором, содержащим 25 мМ Трис-HCl, 300 мМ натрий хлористый, рН 8,0. Скорость посадки 5 мл/мин, промывок и элюции - 10 мл/мин. Полученный образец белка хранили при температуре +4°С.
Пробы полученного рекомбинантного белка анализировали с помощью электрофореза в 12%-ном полиакриламидном геле в денатурирующих условиях. Сканирование высушенных гелей показало, что степень чистоты целевого рекомбинантного белка составляет не менее 96%. Результаты очистки на промежуточных стадиях представлены в таблице 6.

Литературные источники
- Backliwal G. Rational vector design and multi-pathway modulation of HEK 293E cells yield recombinant antibody titers exceeding 1 g/l by transient transfection under serum-free conditions // Nucleic Acids Res. - 2008. - Vol.36. - N 15. - p. 96.
- Barter E.F., Stone, M.J. Synergistic Interactions between Chemokine Receptor Elements in recognition of Interleukin-8 by soluble receptor mimics. // Biochemistry. - 2012. - Vol. 51. - N6. - P. 1322-1331.
- Brunner, D. Serum-free cell culture: the serum-free media interactive online database // ALTEX. - 2010. - Vol. 27. - №1. - p. 53-62.
- Geisse S. Recombinant protein production by transient gene transfer into Mammalian cells // Methods Enzymol. - 2009. - Vol. 463. - p. 223-238.
- Helmer D. Rational design of a peptide capture agent for CXCL8 based on a model of the CXCL8:CXCR1 complex. // RSC Advances. - 2015. - V. 5. - p. 25657-25668.
- Joseph P.R., Solution N.M.R. Characterization of WTCXCL8 monomer and dimer binding to CXCR1 N-terminal domain // Protein Science. - 2015. - V. 24. - p. 81-92.
- Kontermann R.E. Strategies of extended serum half-life of protein terapeutics. // Curr. Opin. Biotechnol. - 2011. - V.22. - p. 868-876.
- Krishnamurthy, V.M. Multivalency in Ligand Design // Fragment-based Approaches in Drug Discovery. - Wiley-VCH Verlag GmbH & Co. KGaA, 2006. - p. 11-53.
- Levin D., Golding В., Strome S.E., Sauna Z.E. Fc fusion as a platform technology: potential for modulating immunogenicity.// Trends in Biotechnology. - 2015. - V. 33. - p. 27-34.
- Park, S.H. Interactions of Interleukin-8 with the Human Chemokine Receptor CXCR1 in Phospholipid Bilayers by NMR Spectroscopy // J Mol Biol. - 2011. - V. 414. - p. 194-203.
- Roopenian D.C., Akilesh S. FcRn: The neonatal Fc receptor comes of age. // Nat. Rev. Immunol. - 2007. - V. 7. - p. 715-725.
- Skelton N.J. Structure of a CXC chemokine-receptor fragment in complex with interleukin-8 // Structure. - 1999. - V. - p. 157-168.
- www.analystsoft.com
Генетическая конструкция pCXC8R-Fc, последовательность которой представлена как SEQ ID NO: 1, кодирующая слитый белок, последовательность которого представлена как SEQ ID NO: 2, состоящий из экстраклеточного домена рецептора интерлейкина 8, CXC8R, и Fc-фрагмента иммуноглобулина G1 человека, обладающий противоопухолевым свойством за счет анти-IL-8 активности, характеризующаяся следующими конструктивными признаками: CMV IE Promoter - ранний промотор цитомегаловируса (CMV) человека (230-862), CD33 signal sequence - лидерная последовательность CD33 (906-959), CXC8R - экстраклеточный домен рецептора интерлейкина 8, последовательность первой части слитого колируемого белка (966-1082), Factor Ха site - сайт узнавания фактора Ха (1089-1100), IgG1 Fc tail - Fc фрагмент иммуноглобулина G1 человека, последовательность второй части слитого кодируемого белка (1116-1814), IVS - синтетический интрон (1874-2169), IRES - участок внутренней посадки рибосомы вируса энцефаломиокардита (ECMV) (2195-2785), Neo (R) - неомицин-фосфотрансфераза (2821-3621), SV40 polyA signal - сигнальная последовательность полиаденилирования вируса SV40 (3785-3790 и 3814-3819), ColE1 ori - ориджин репликации ColE1 (4411-5010), Amp (R) - β-лактамаза (5137-5999).