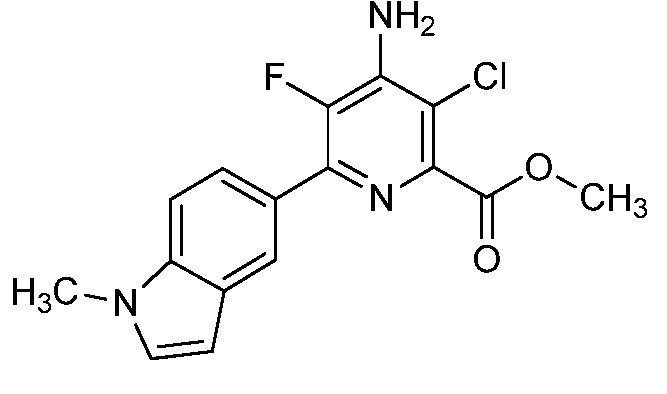
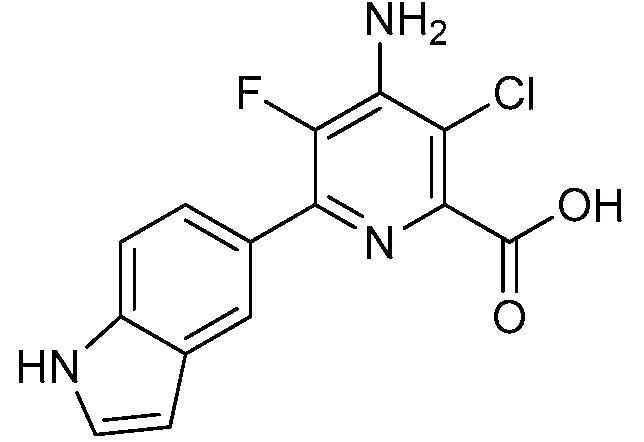
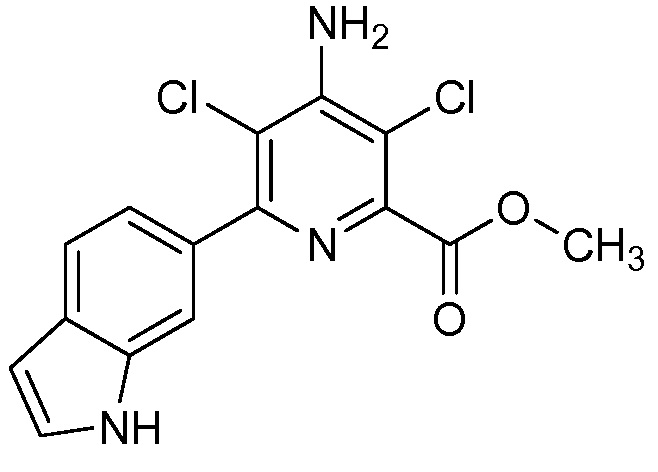
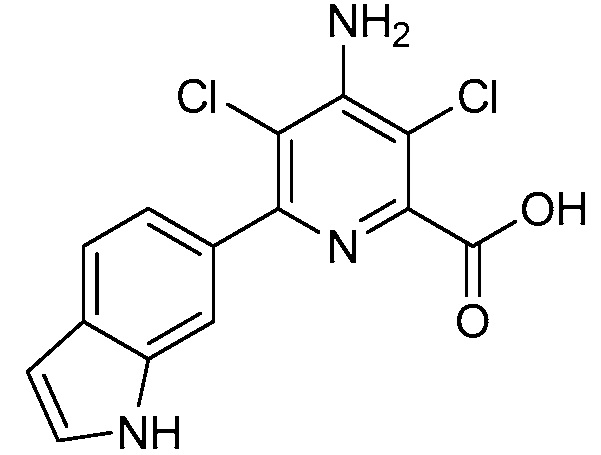
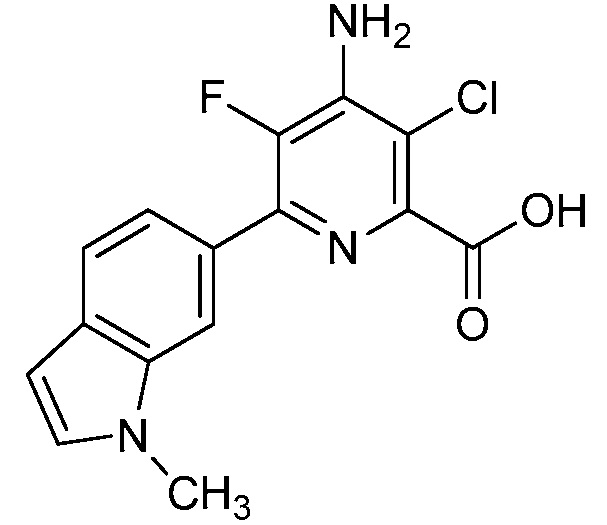
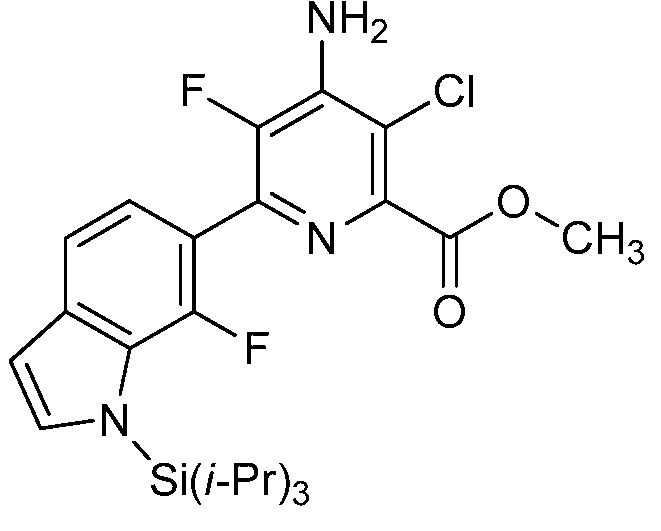
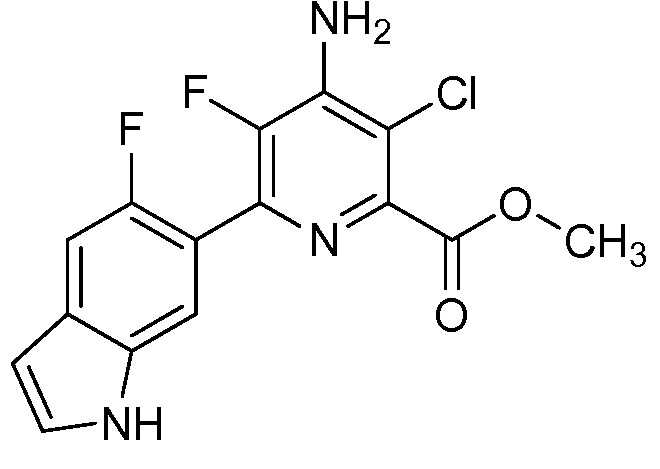
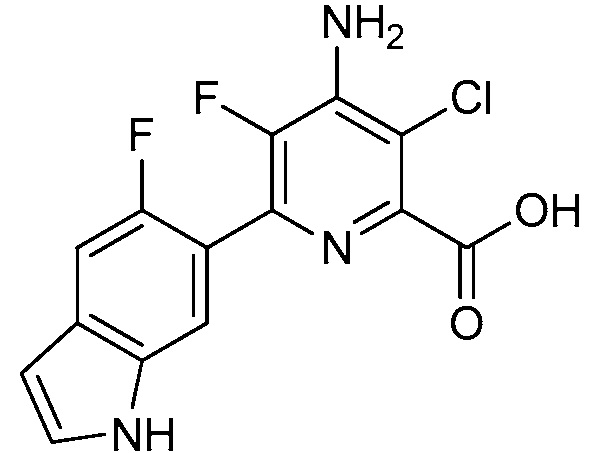
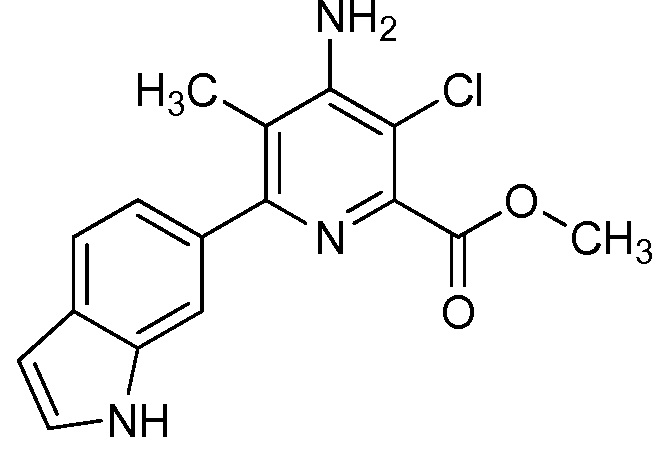
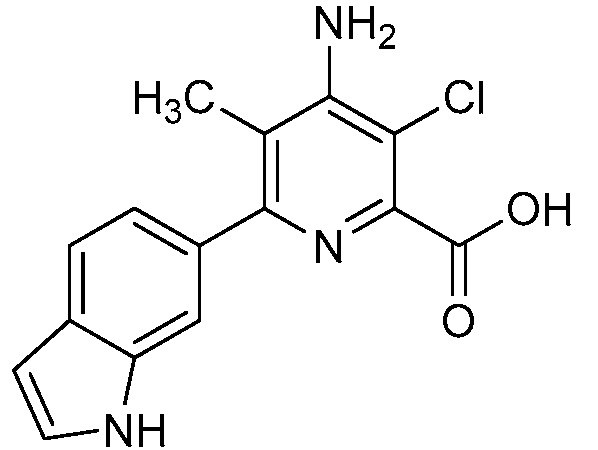
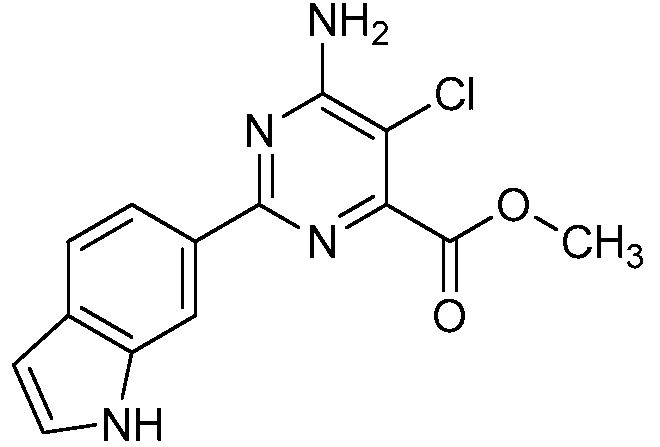
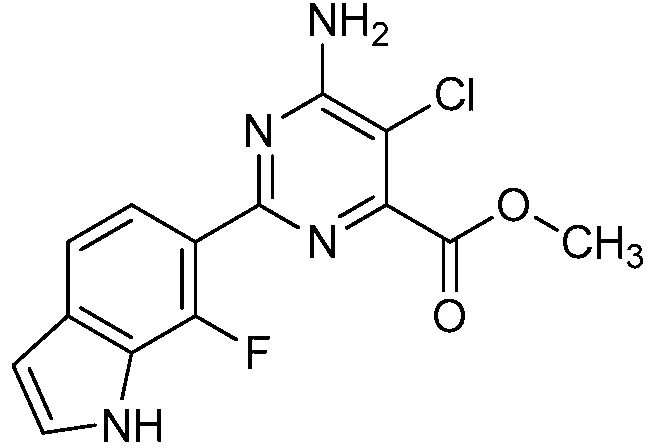
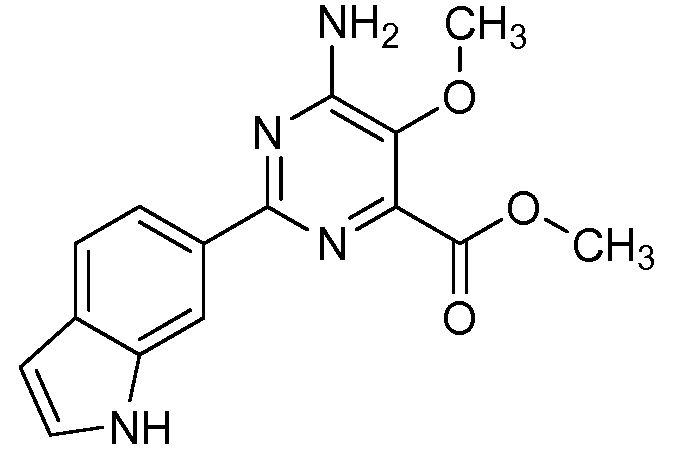
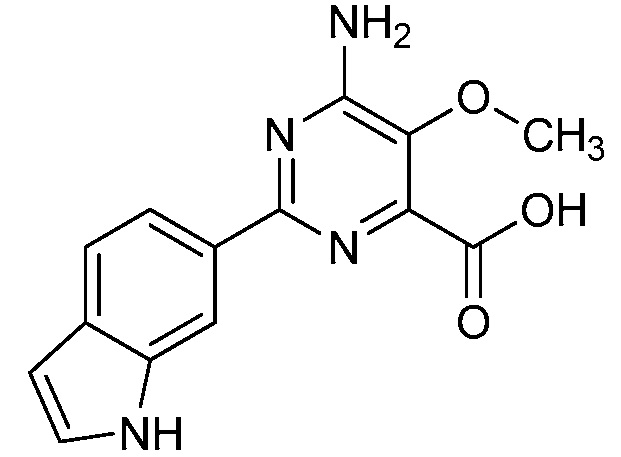
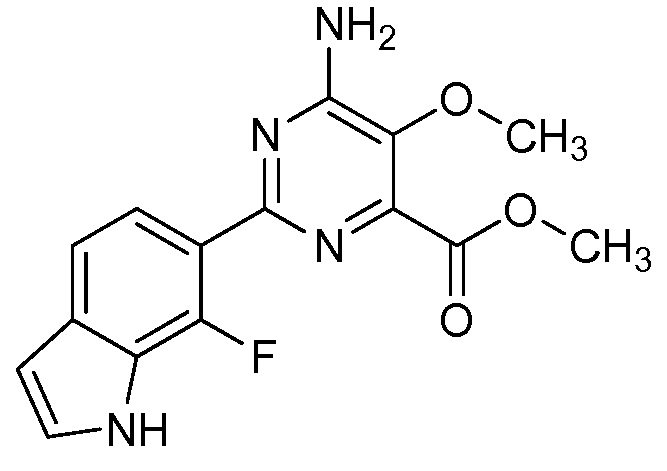
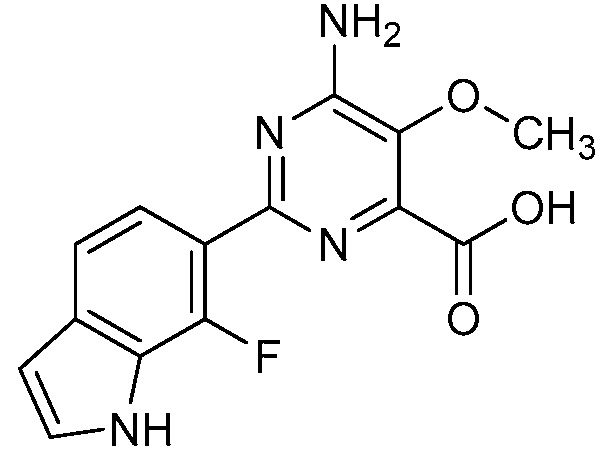
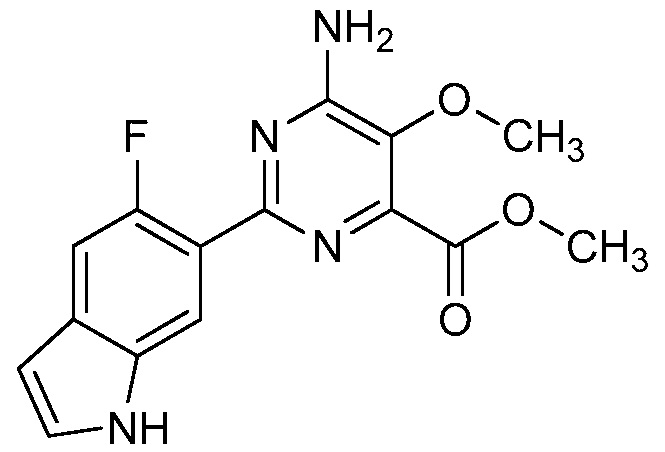
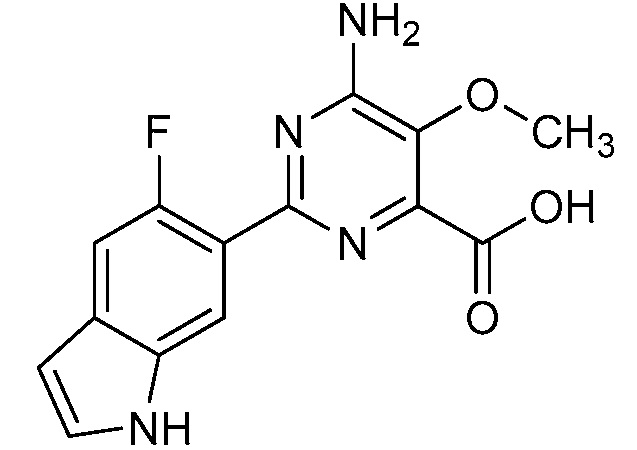
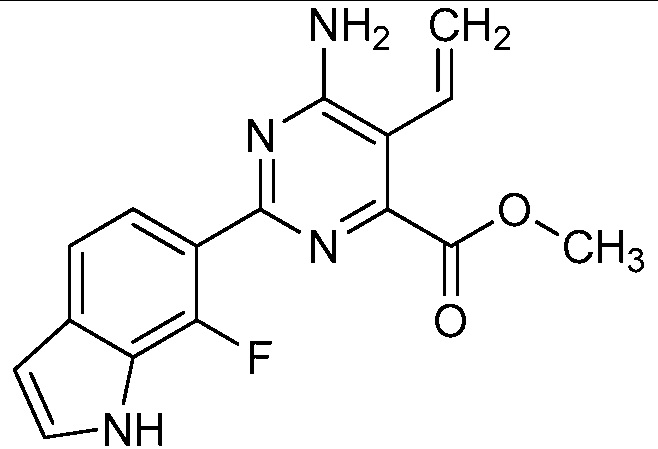
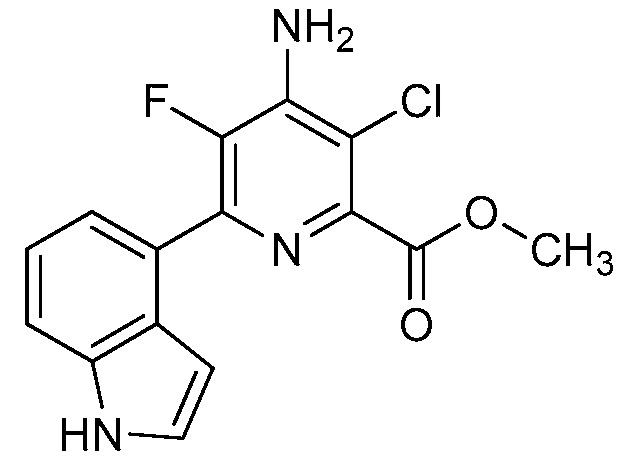
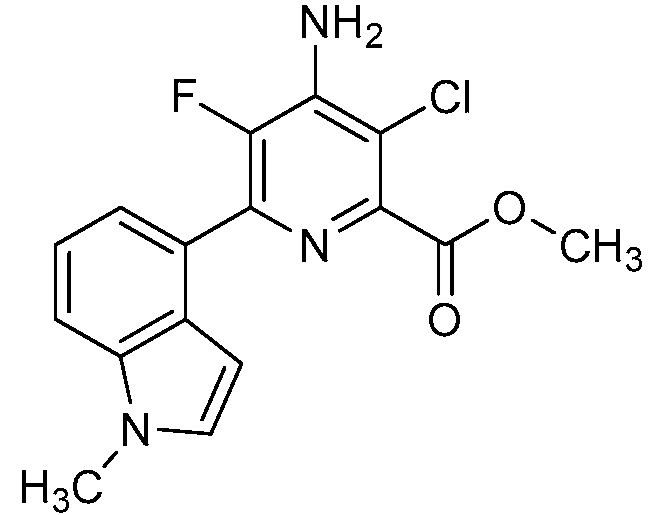
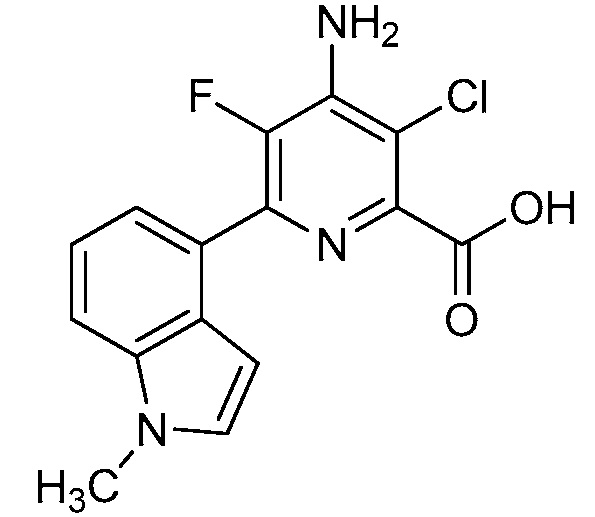
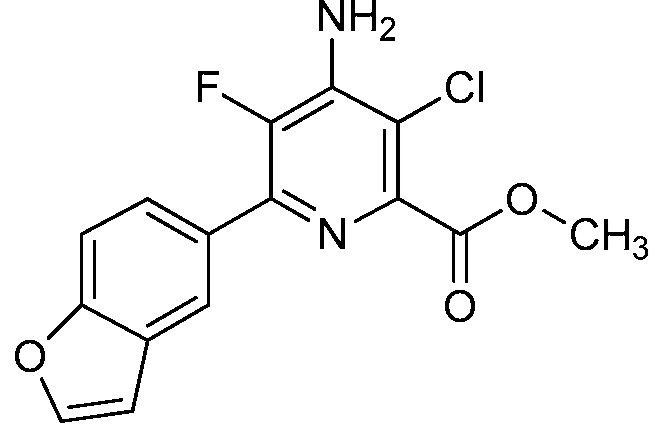
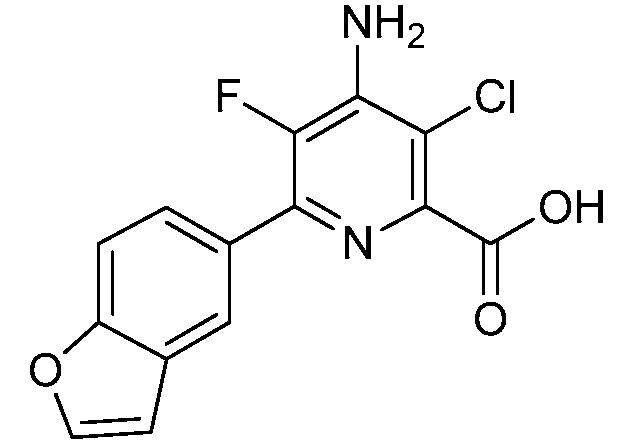
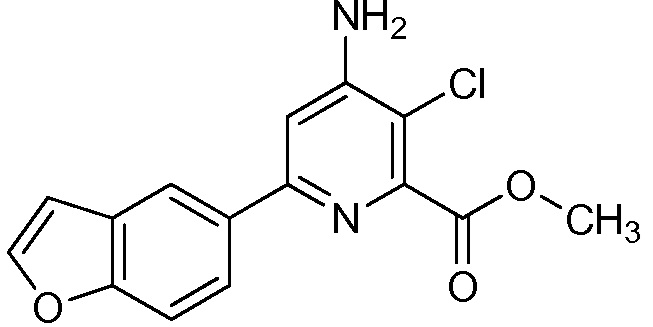
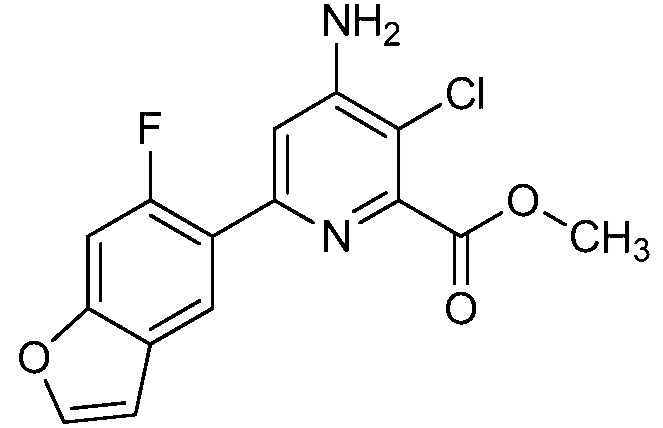
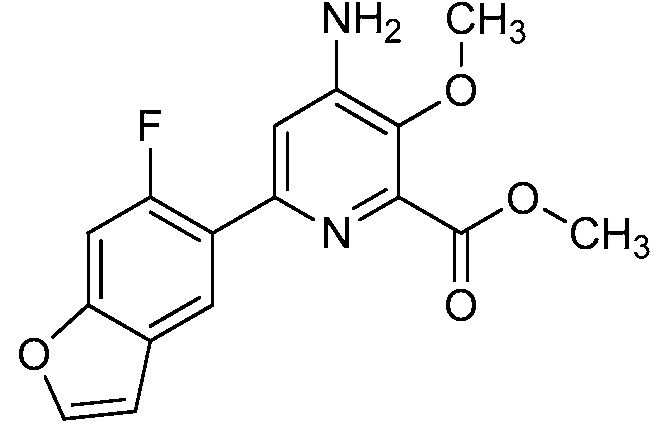
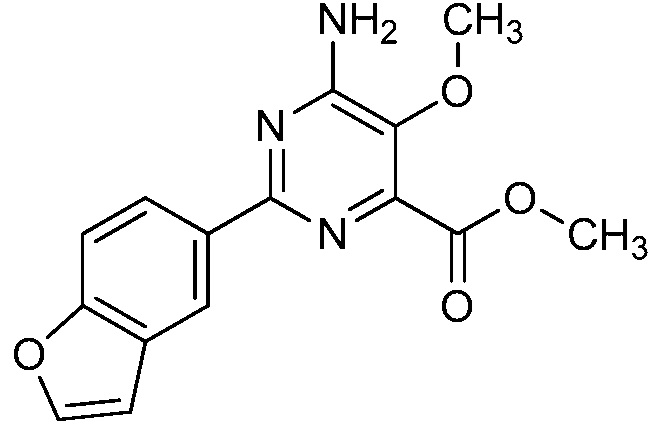
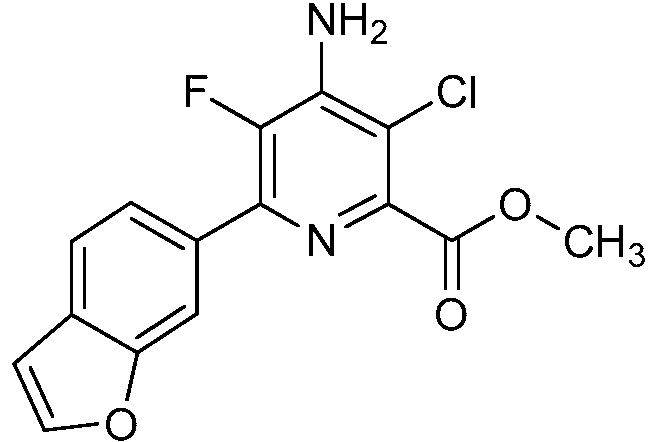
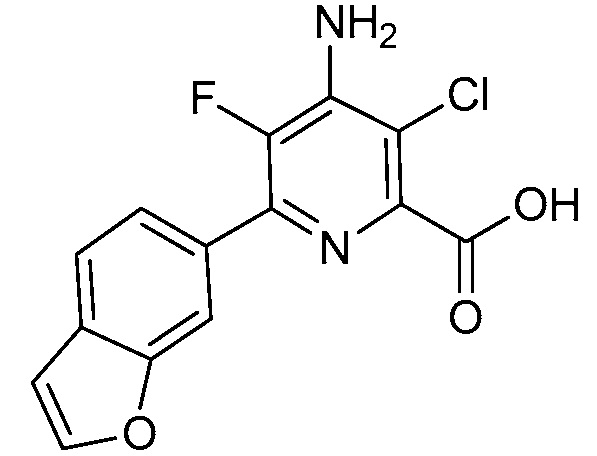
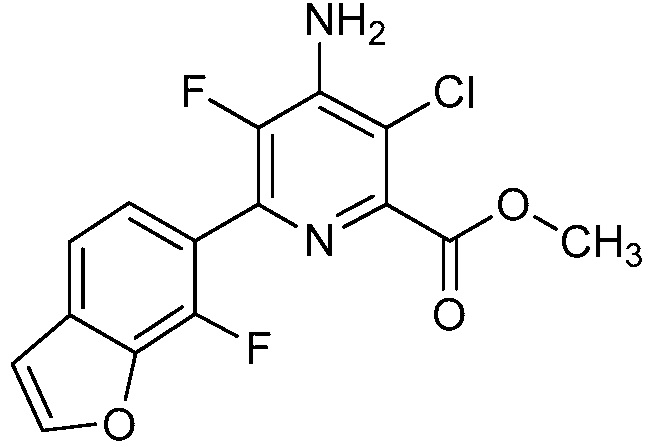
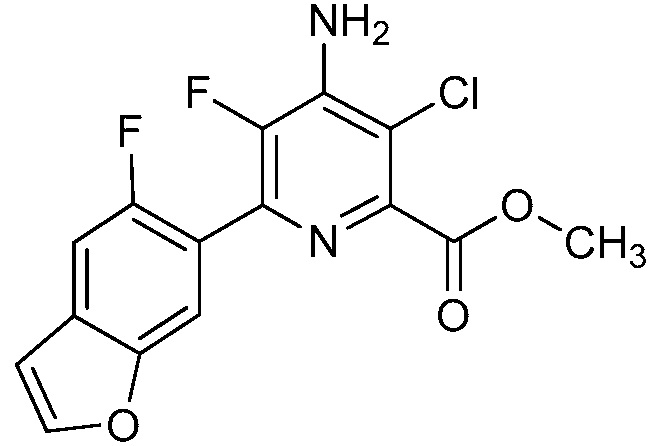
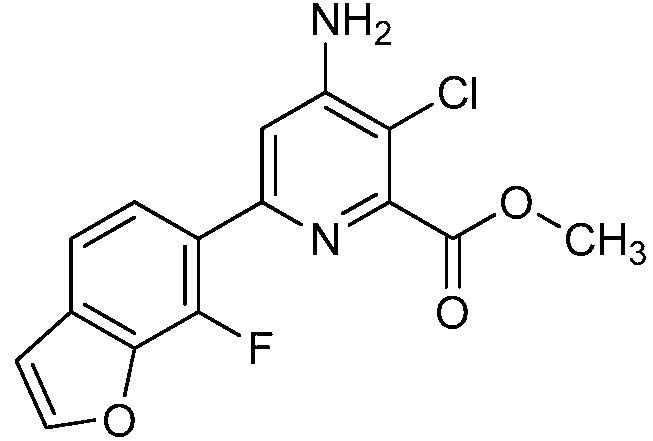
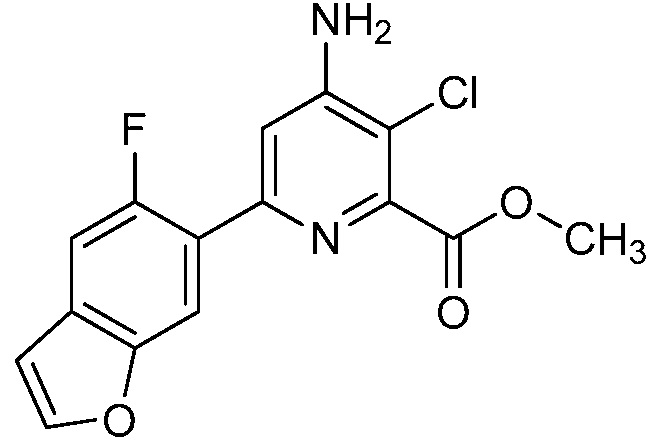
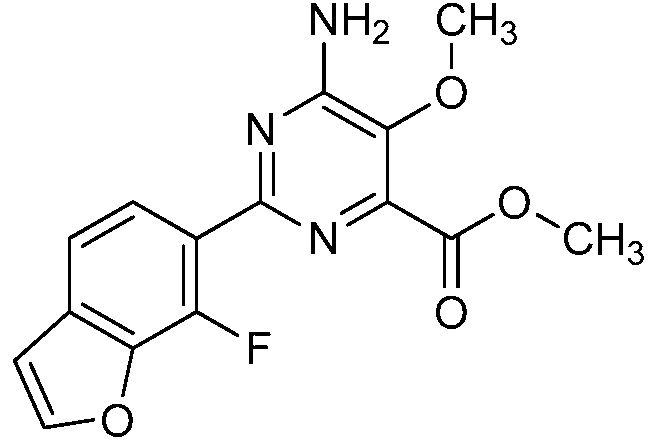
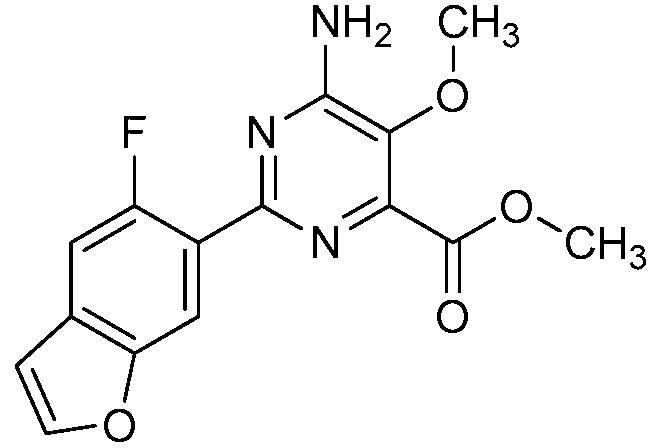
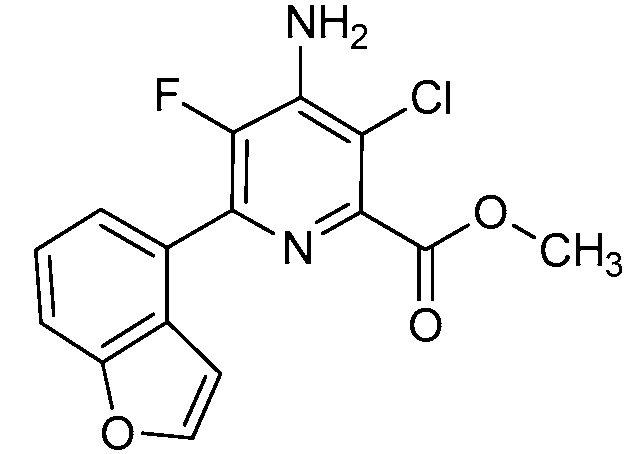
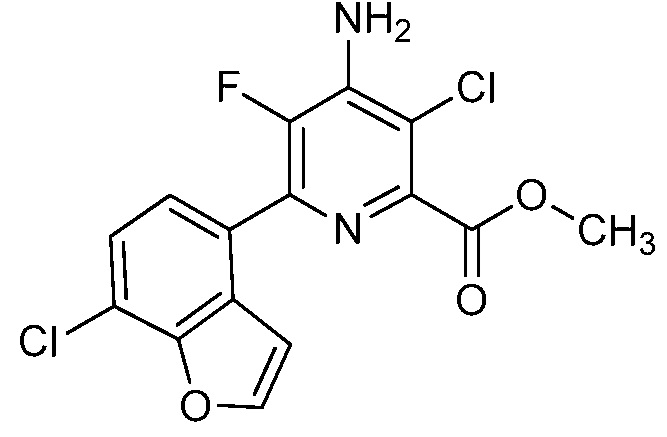
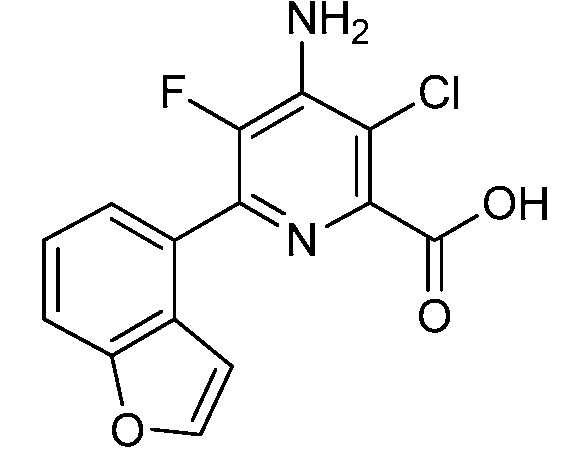
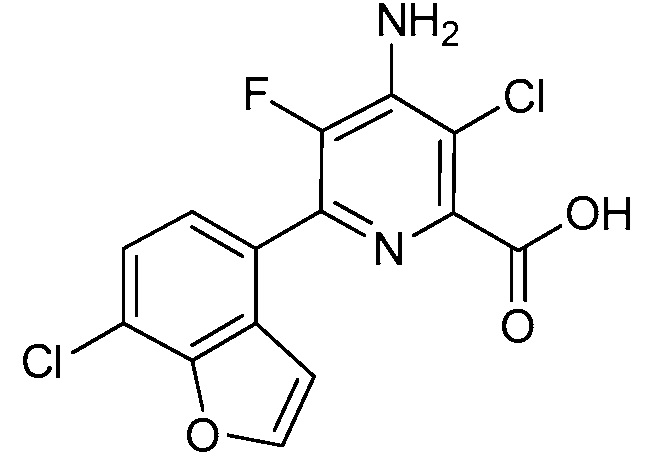
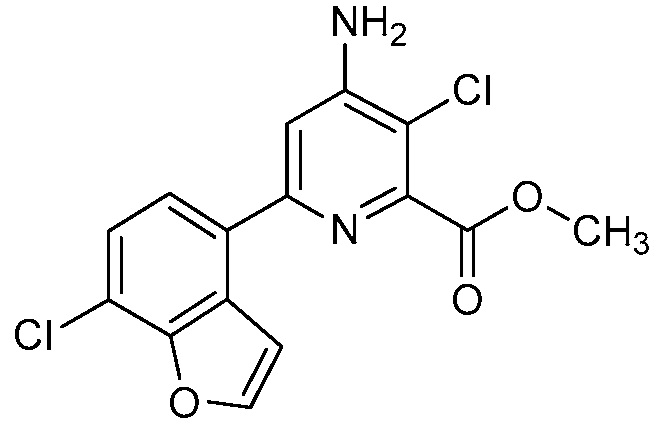
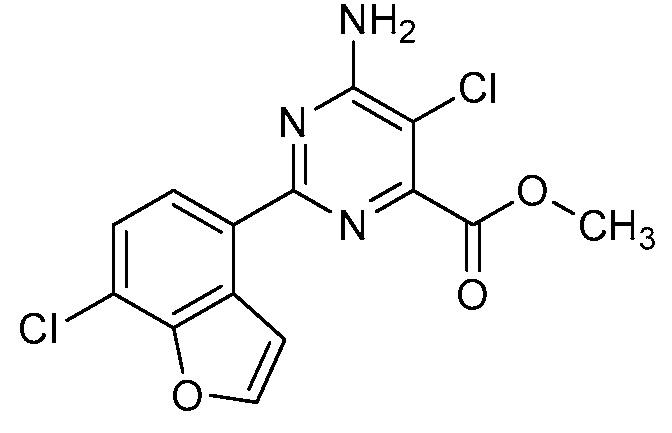
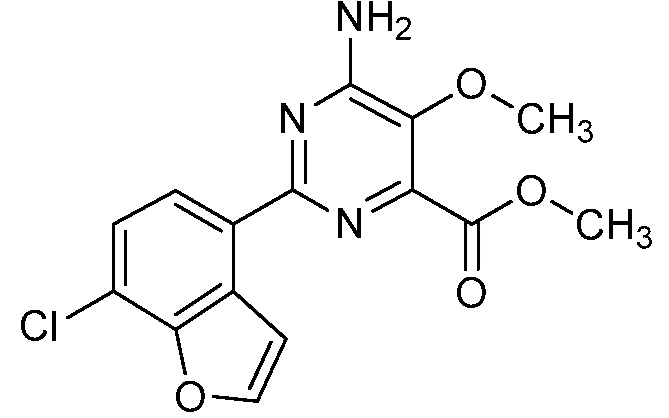
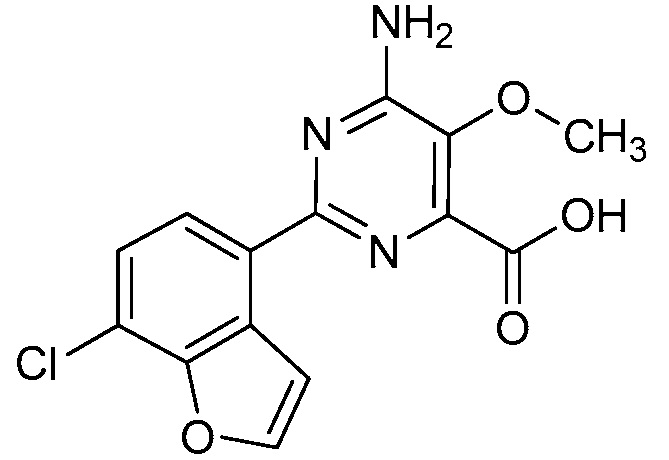
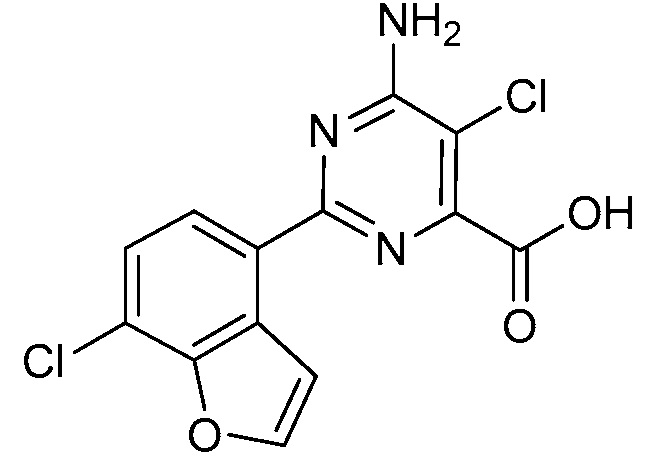
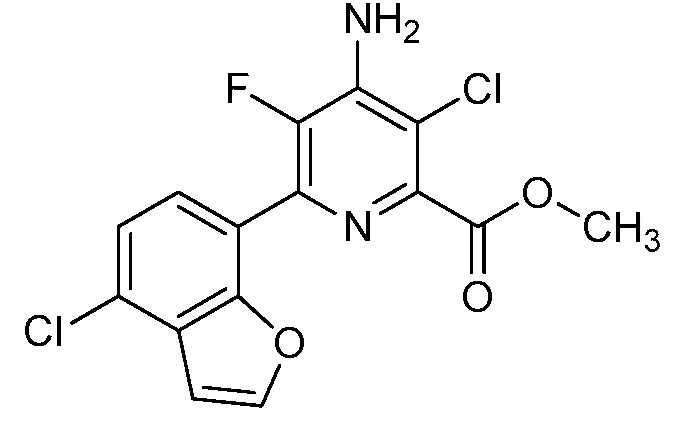
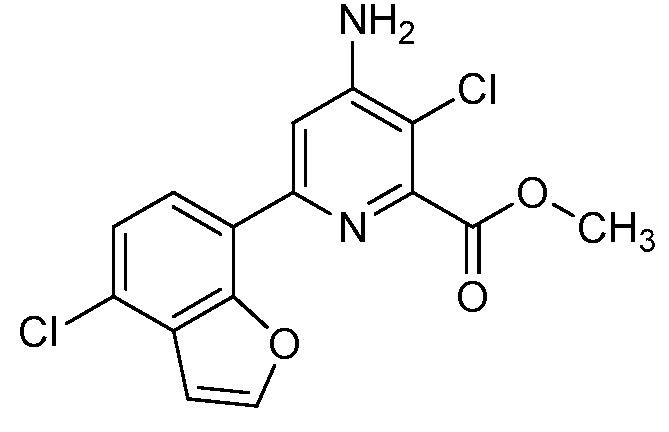
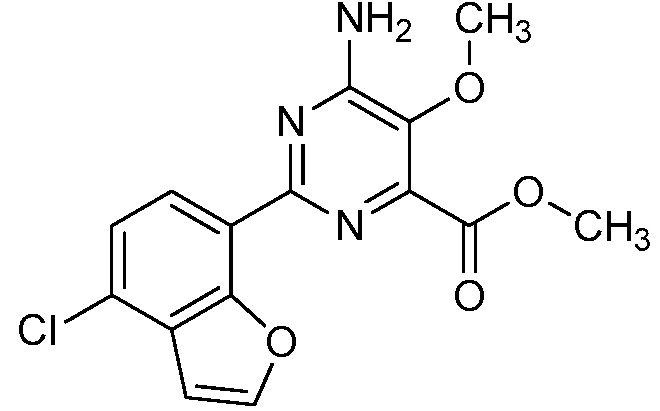
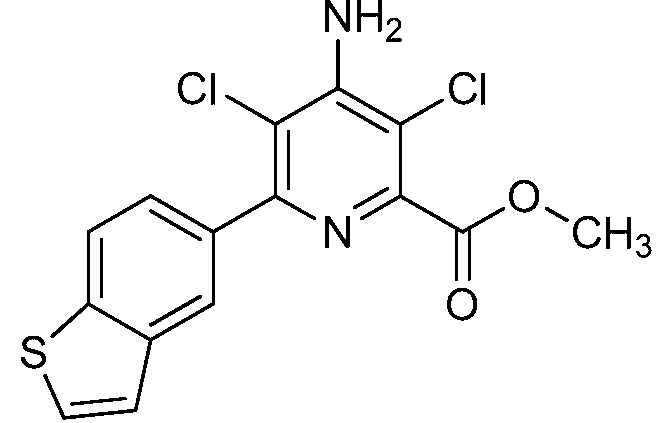
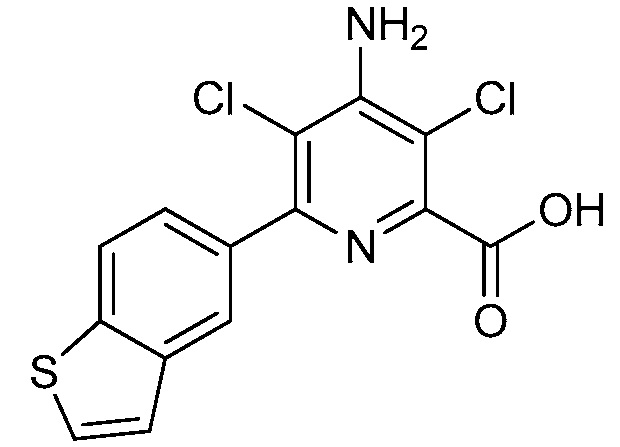
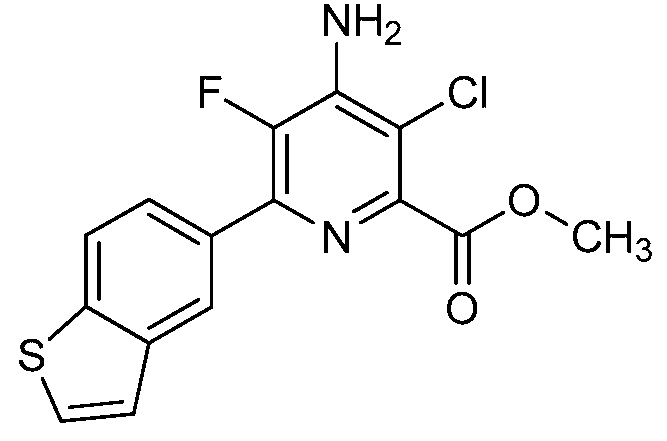
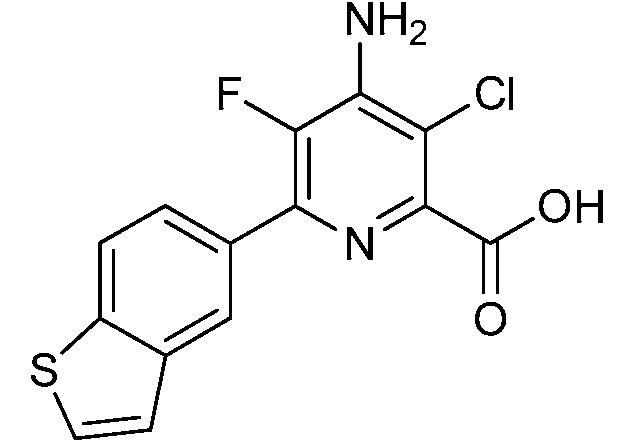
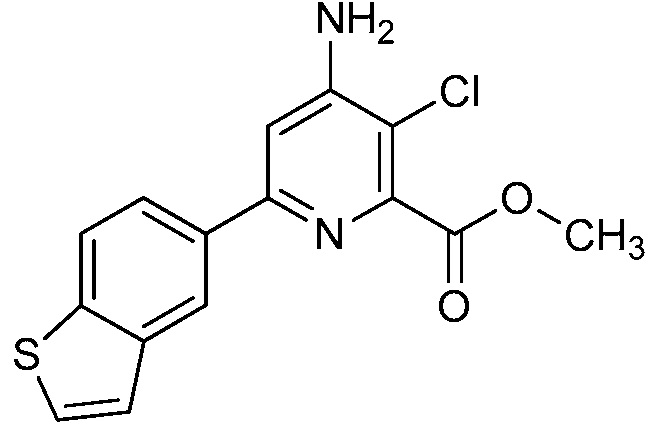
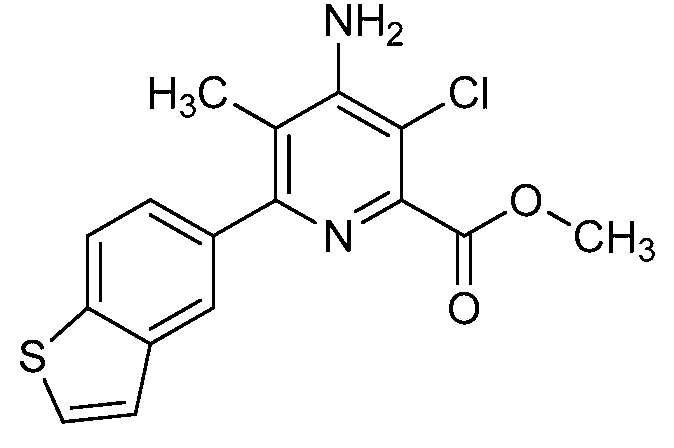
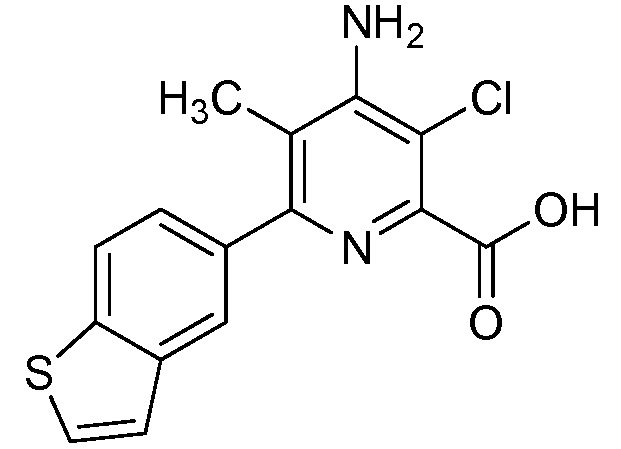
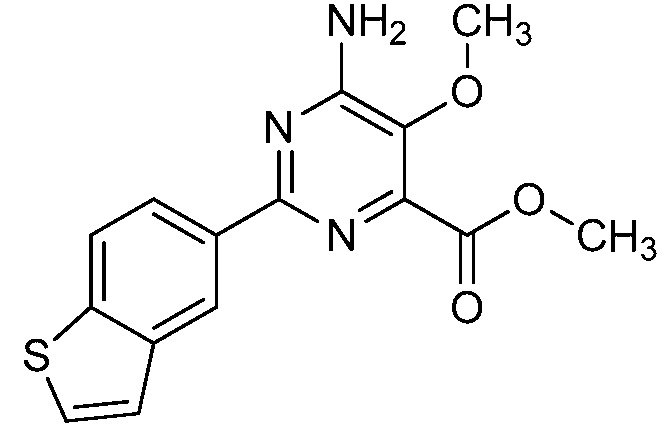
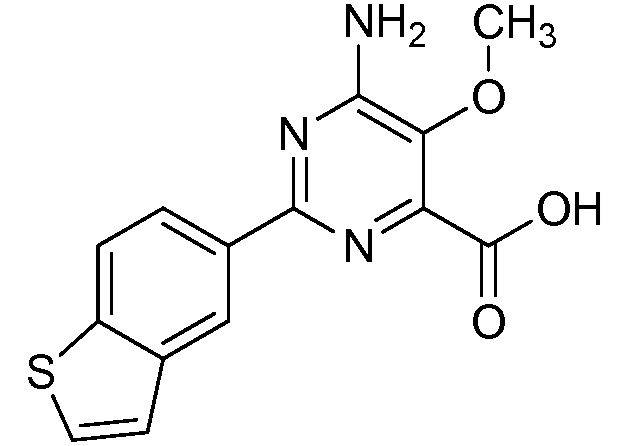
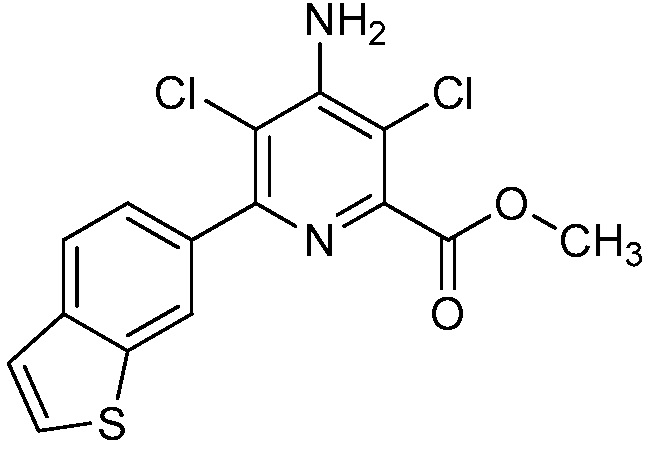
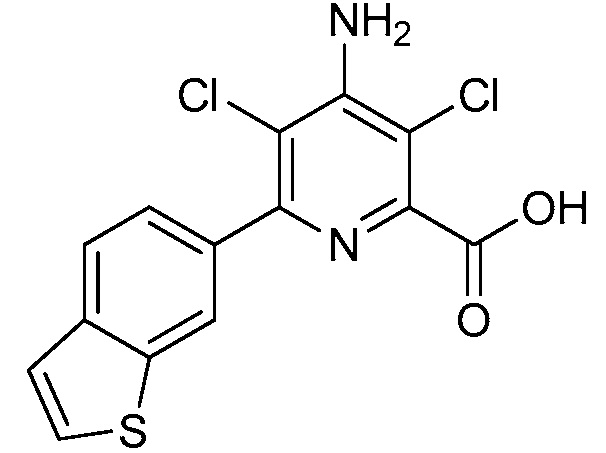
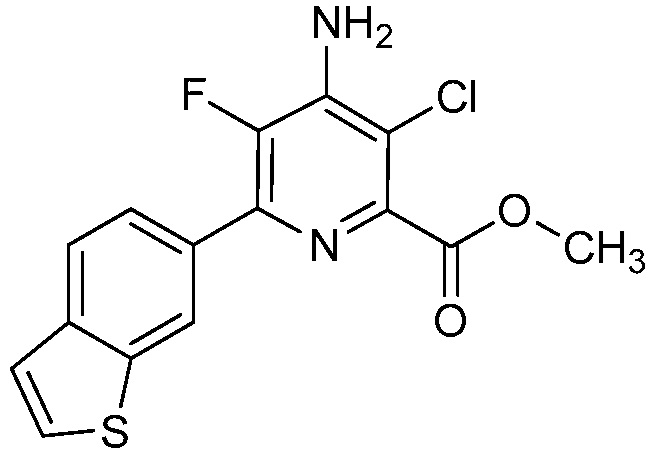
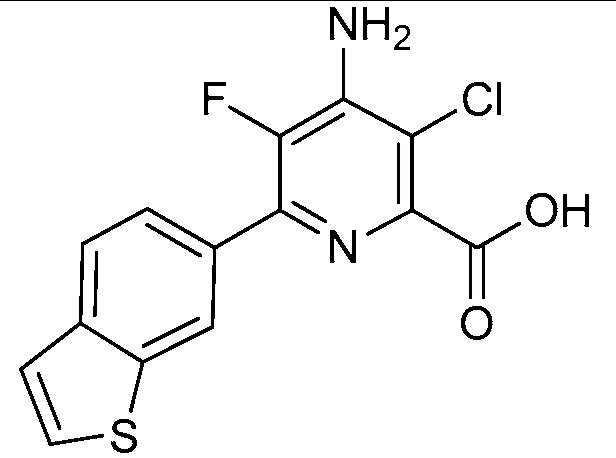
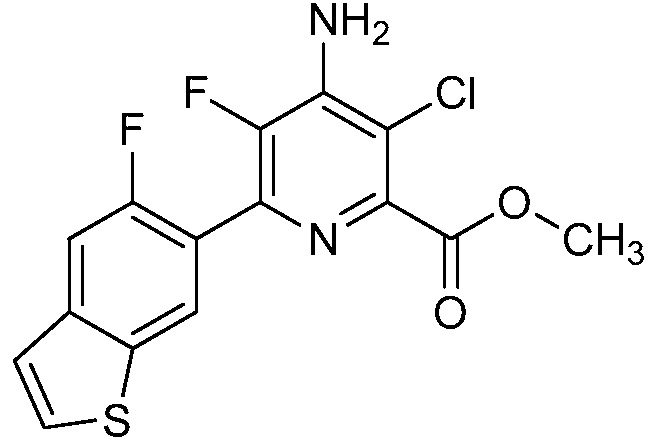
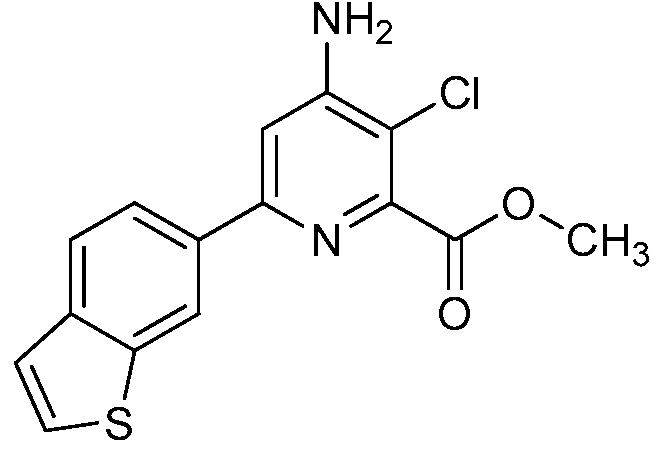
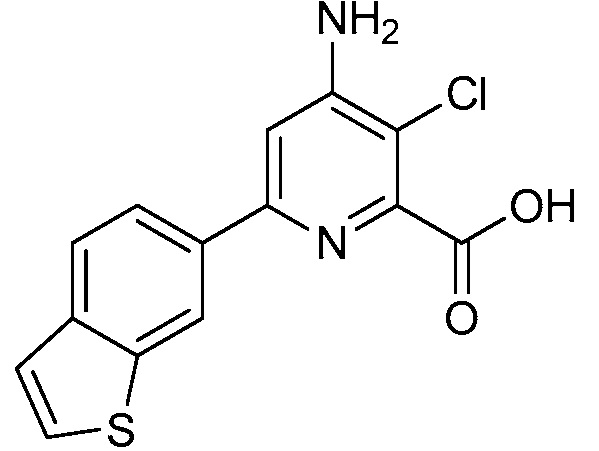
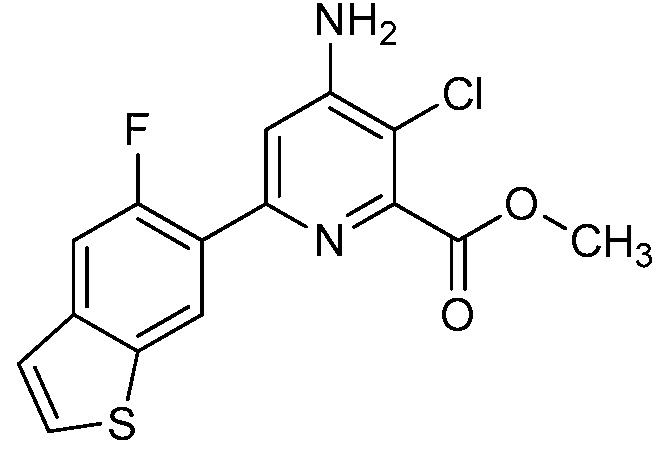
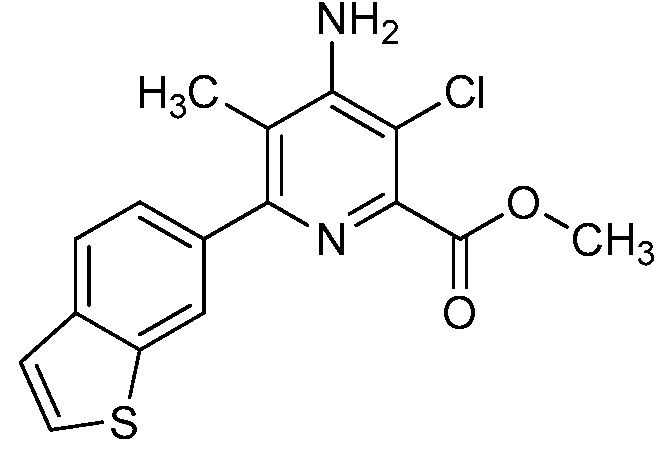
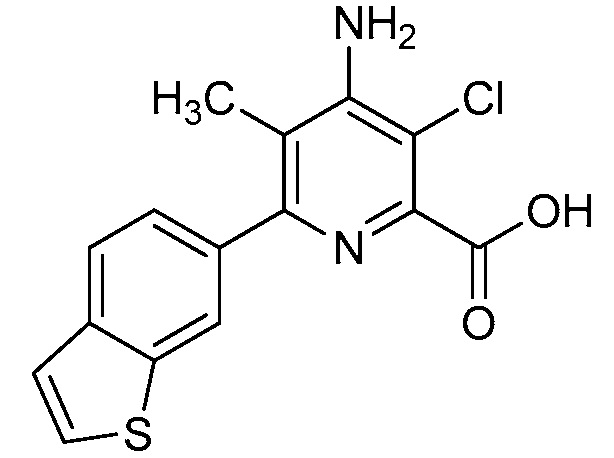
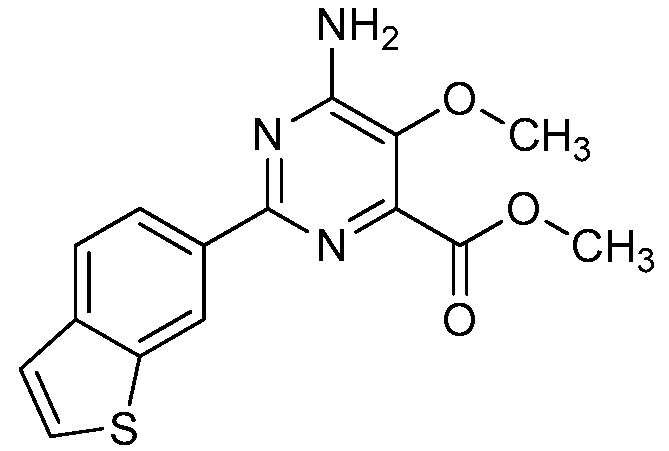
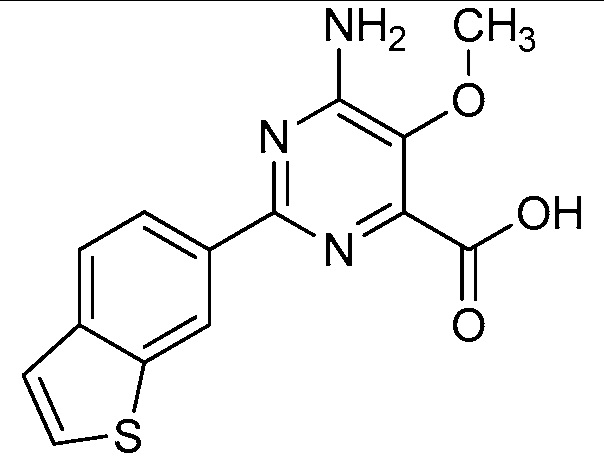
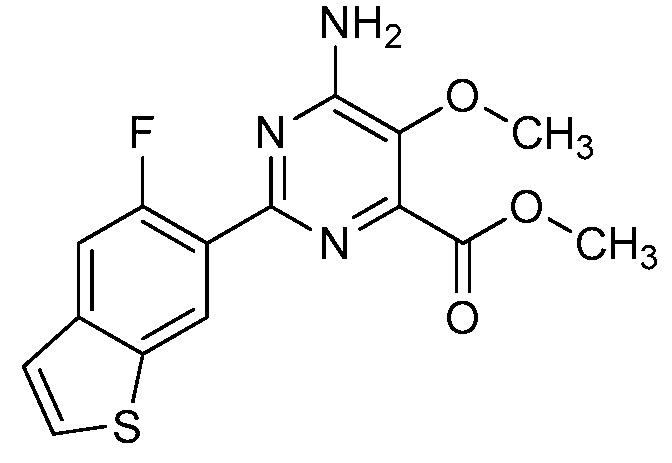
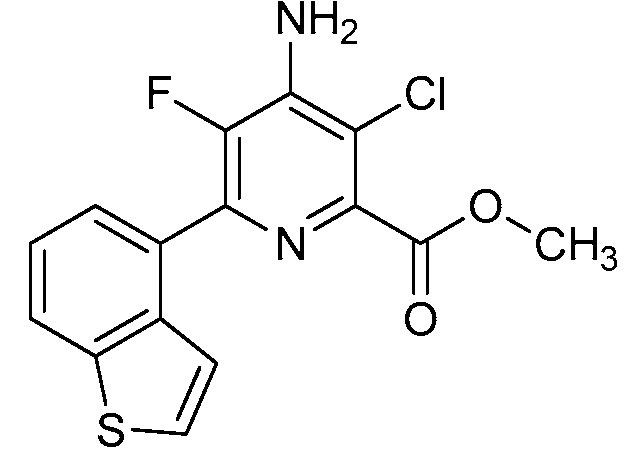
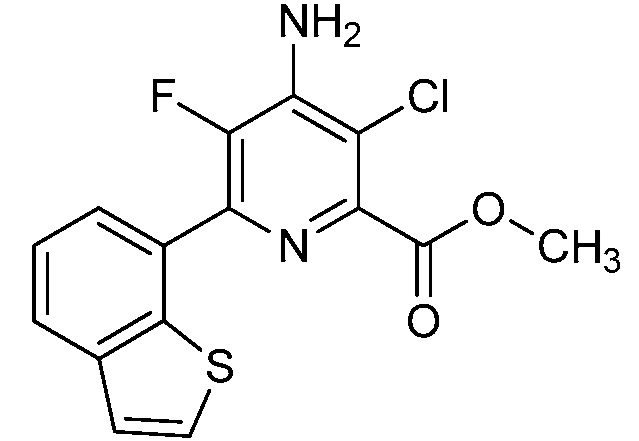
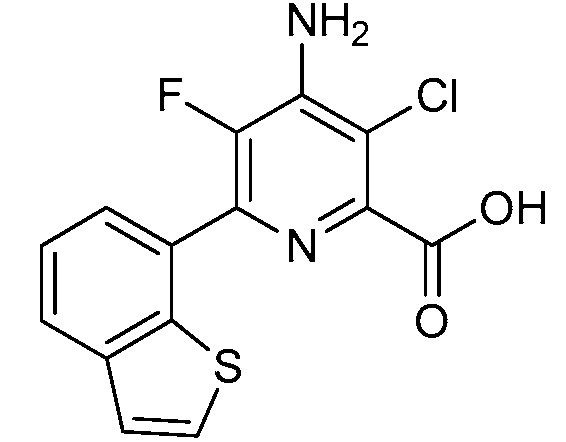
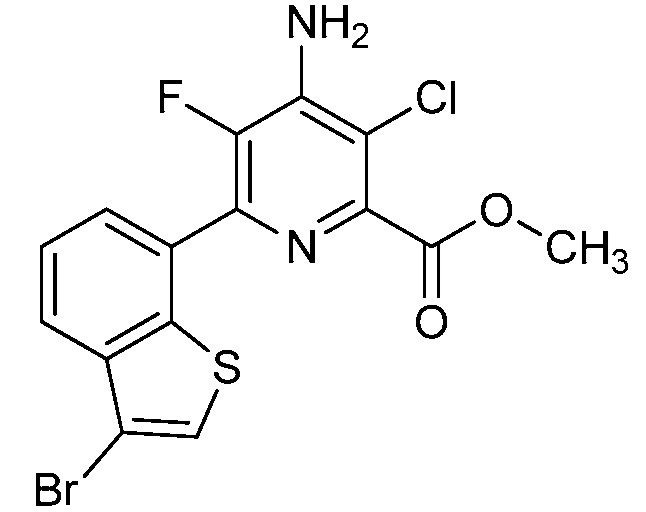
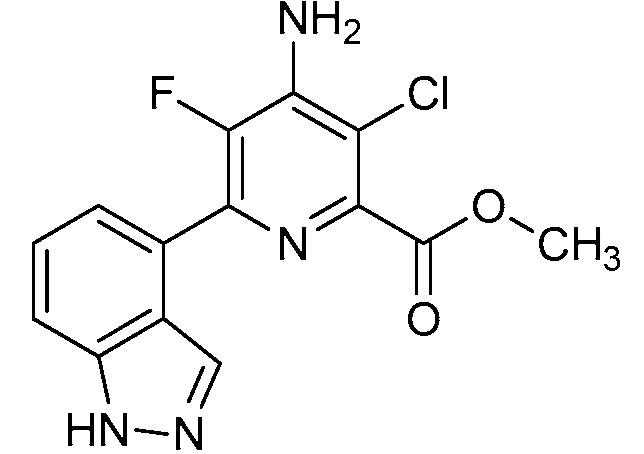
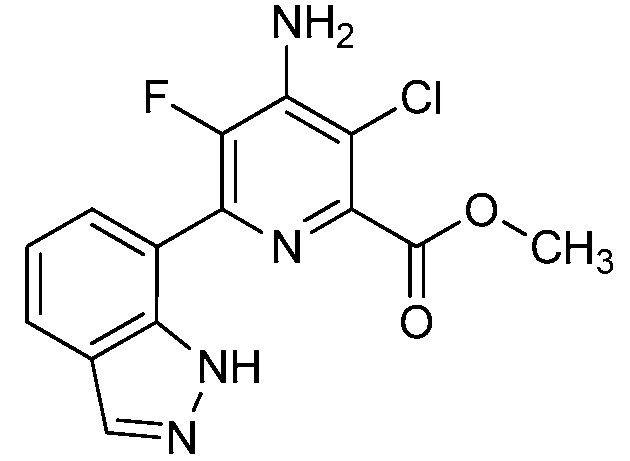
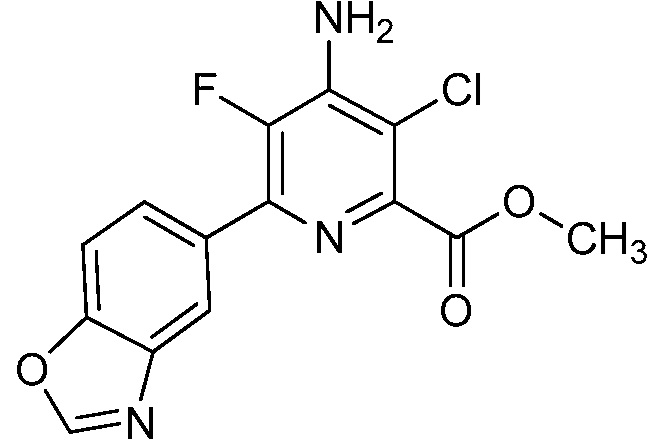
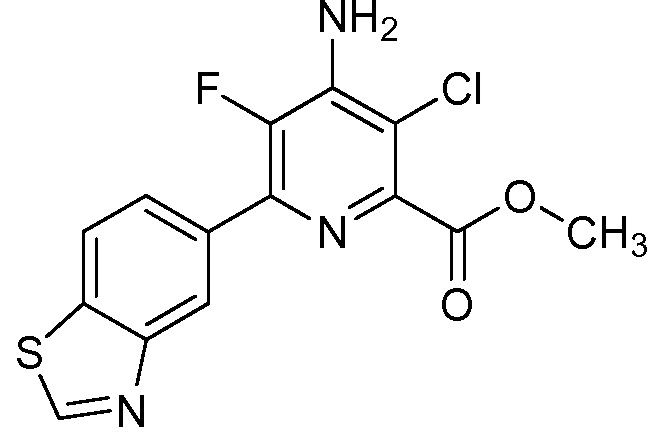
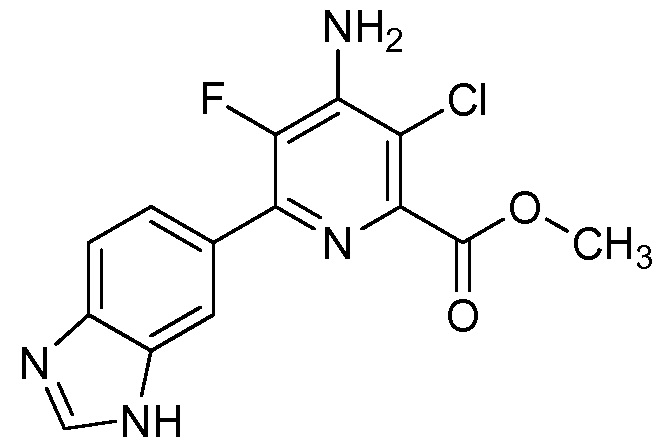
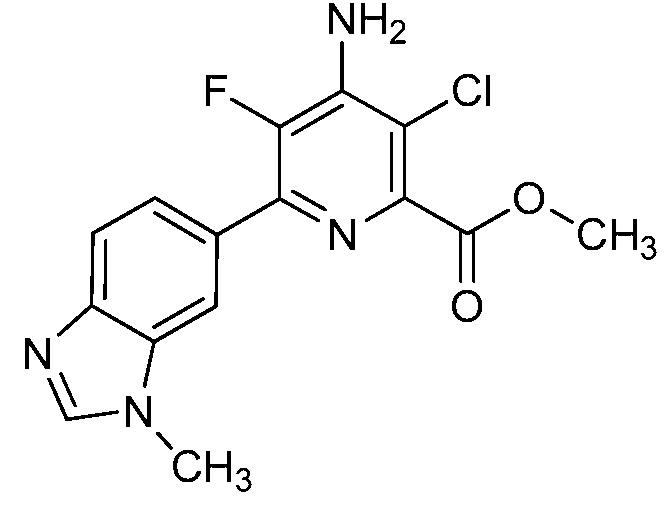
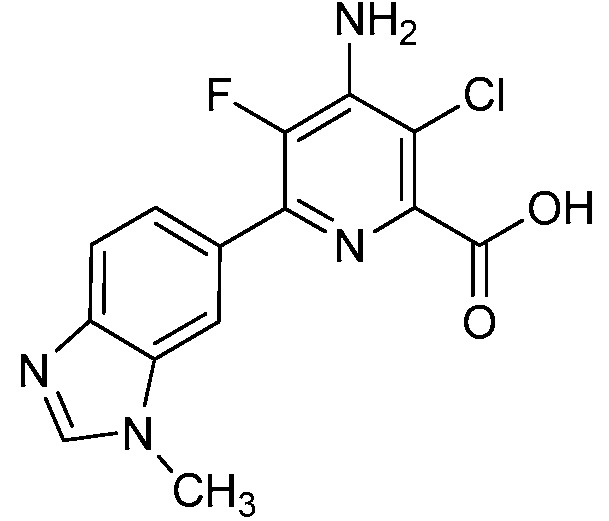
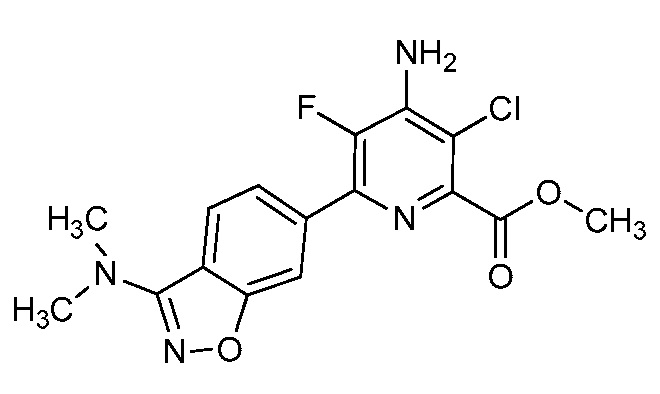
Результат интеллектуальной деятельности: 4-АМИНО-6-(ГЕТЕРОЦИКЛИЧЕСКИЕ)ПИКОЛИНАТЫ И 6-АМИНО-2-(ГЕТЕРОЦИКЛИЧЕСКИЕ)ПИРИМИДИН-4-КАРБОКСИЛАТЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
[0001] По настоящей заявке испрашивается приоритет 15 марта 2013 года на основании заявки США № 13/839000, раскрытие которой явным образом включено настоящую заявку посредством ссылки.
Область, к которой относится изобретение
[0002] Изобретение относится к гербицидным соединениям и композициям и к способам борьбы с нежелательной растительностью.
Предпосылки изобретения
[0003] Появление нежелательной растительности, например, сорняков, является постоянной проблемой, с которой сталкиваются фермеры на участках выращивания сельскохозяйственных культур, пастбищах и в других посевах. Сорняки конкурируют с сельскохозяйственными культурами и отрицательно влияют на урожайность культур. Использование химических гербицидов является важным инструментом в борьбе с нежелательной растительностью.
[0004] В настоящее время сохраняется необходимость в разработке новых химических гербицидов, которые обеспечивают более широкий спектр контроля сорняков, селективности, минимального повреждения культуры, стабильности при хранении, простоты обработки, более высокой активности против сорняков, и/или средств, решающих проблему устойчивость к гербицидам, которая развивается в отношении гербицидов, используемых в настоящее время.
Краткое описание изобретения
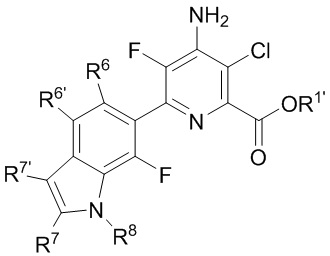
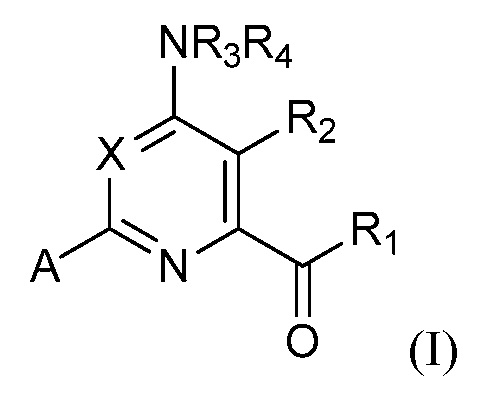
[0005] В настоящей заявке представлены соединения формулы (I):
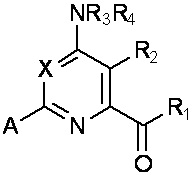
где
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил, или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6галогеналкил, C3-C6 алкенил, C3-C6галогеналкенил, C3-C6алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
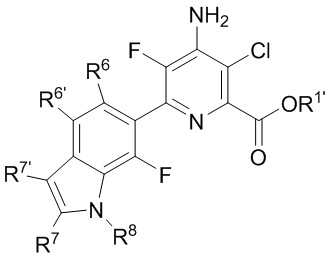
A представляет собой одну из групп A1-A36
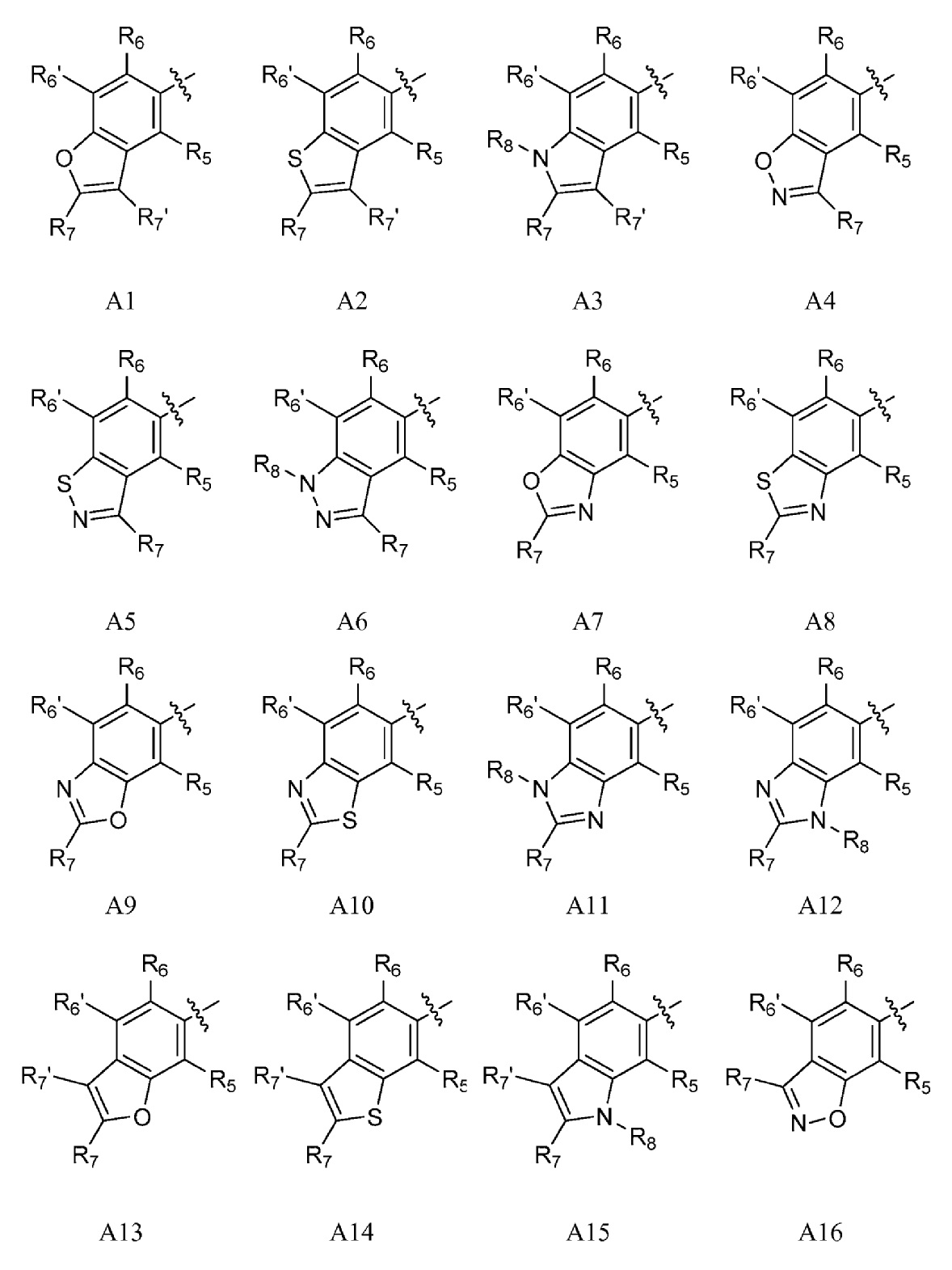
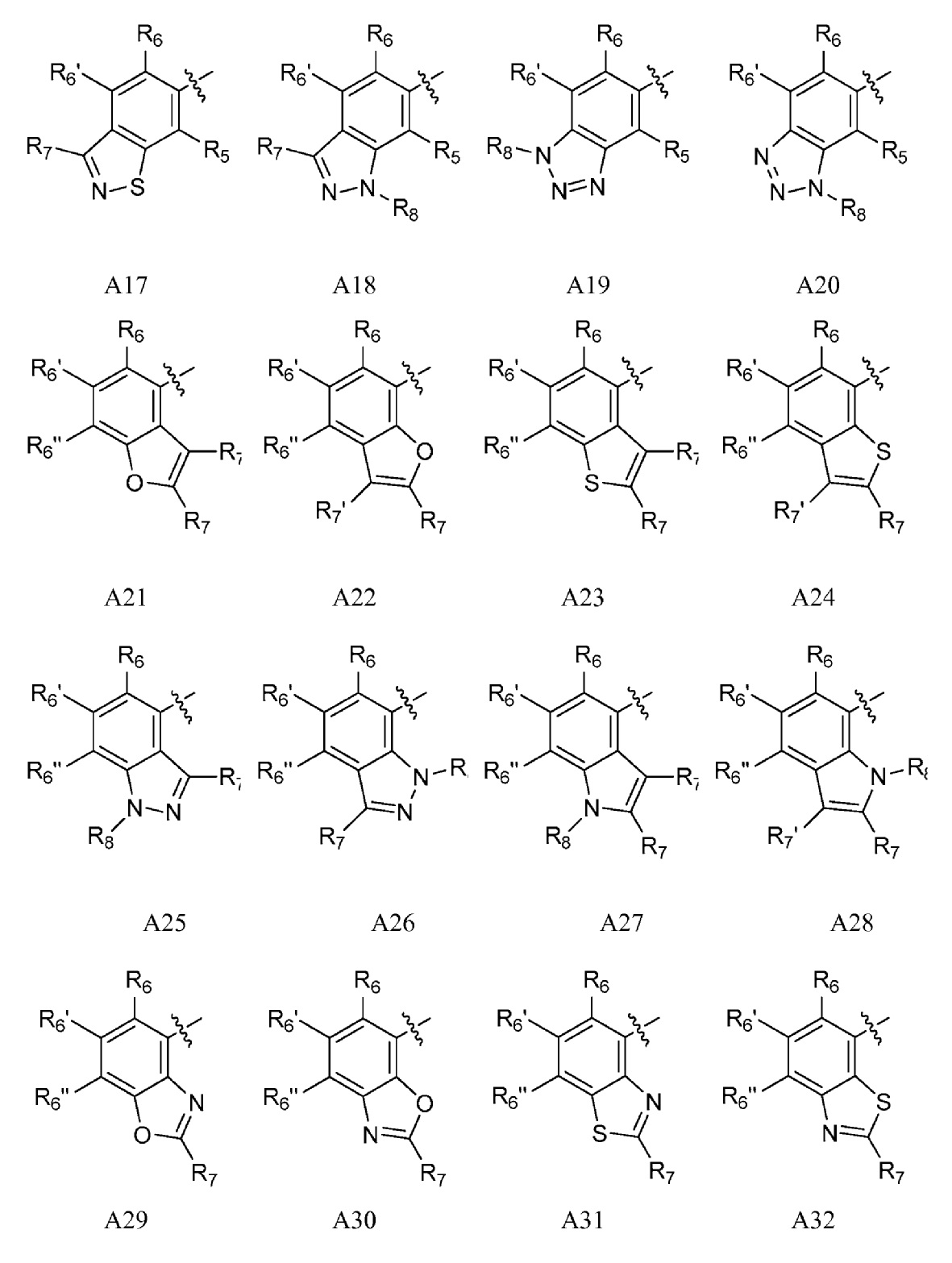
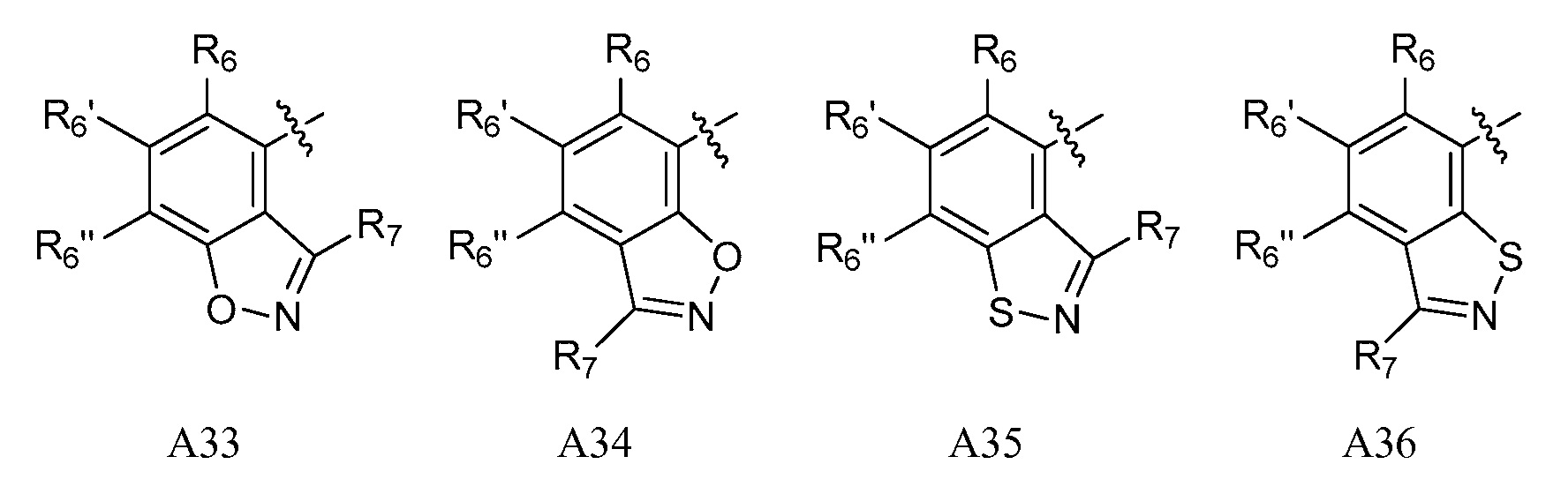
R5, если это применимо к A группе, представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'', если это применимо к A группе, независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3алкилтио, C1-C3 галогеналкилтио, амино, C1-C4алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3галогеналкилтио, амино, C1-C4 алкиламино, C1-C4галогеналкиламино или фенил;
R8 представляет собой водород, C1-C6 алкил, C1-C6галогеналкил, C3-C6 алкенил, C3-C6галогеналкенил, C3-C6алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
или N-оксид или сельскохозяйственно приемлемая соль такого соединения.
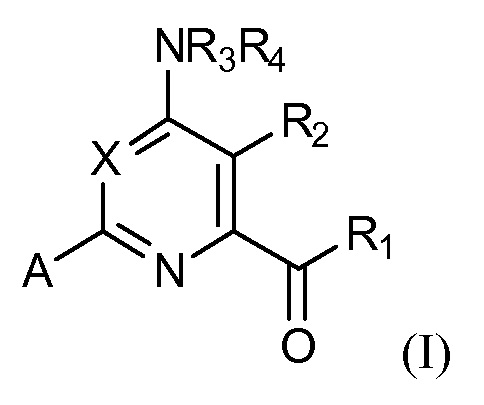
[0006] В некоторых вариантах осуществления, соединение представляет собой соединение формулы (I):
где
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил;
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
или его N-оксид или сельскохозяйственно приемлемую соль,
при условии, что соединение не является соединением формулы (I):
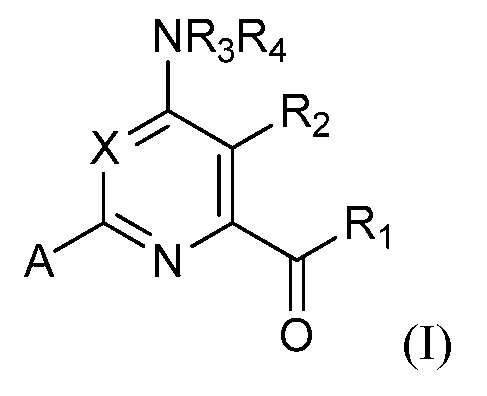
где
X представляет собой N, CH, CF, CCl или CBr;
R1 представляет собой OR1', где R1' представляет собой водород или C1-C4 алкил;
R2 представляет собой хлор;
R3 и R4 представляют собой водород;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19 или A20;
R5 представляет собой водород, галоген, OH, амино, CN, C1-C3 алкил, C1-C3 алкокси, C1-C3 алкиламино или циклопропил;
R6, R6' и R6'' независимо представляют собой водород, галоген, OH, NH2, CN, C1-C3 алкил, C1-C3 алкокси, циклопропил или винил;
R7 и R7' независимо представляют собой водород, галоген, C1-C3 алкил, C1-C3 алкокси, C1-C3 алкилтио, циклопропил или C1-C3 алкиламино или фенил; и
R8 представляет собой водород, C1-C3 алкил, фенил или C1-C3 алкилкарбонил;
или N-оксидом или сельскохозяйственно приемлемой солью такого соединения.
[0007] В некоторых вариантах осуществления, соединение представляет собой соединение формулы (I):
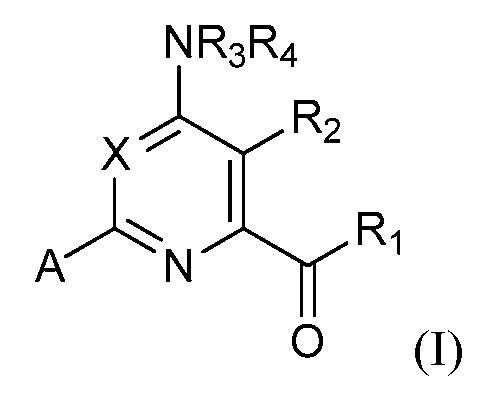
где
X представляет собой CF;
R1 представляет собой OR1', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил;
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
или его N-оксид или сельскохозяйственно приемлемую соль.
[0008] В некоторых вариантах осуществления, R2 представляет собой Cl, метокси, винил или 1-пропенил, и R3 и R4 представляют собой водород. В некоторых вариантах осуществления, R2 представляет собой Cl, и R3 и R4 представляют собой водород.
[0009] В некоторых вариантах осуществления, A представляет собой A15 и/или R5 представляет собой водород или F.
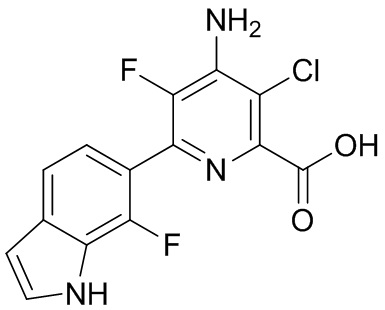
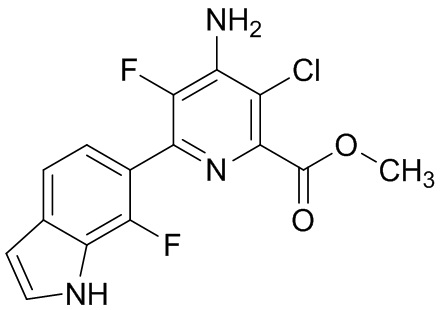
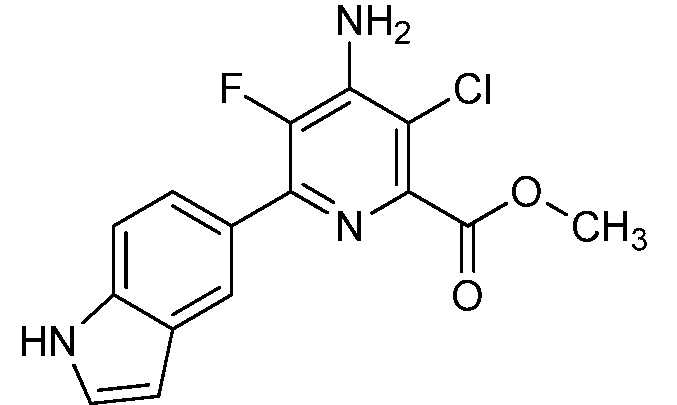
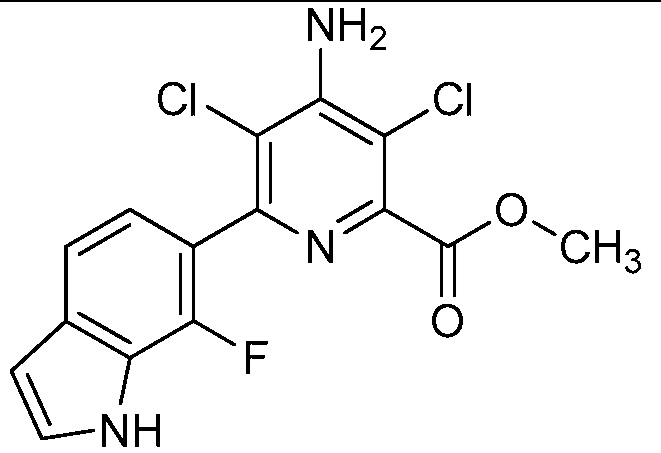
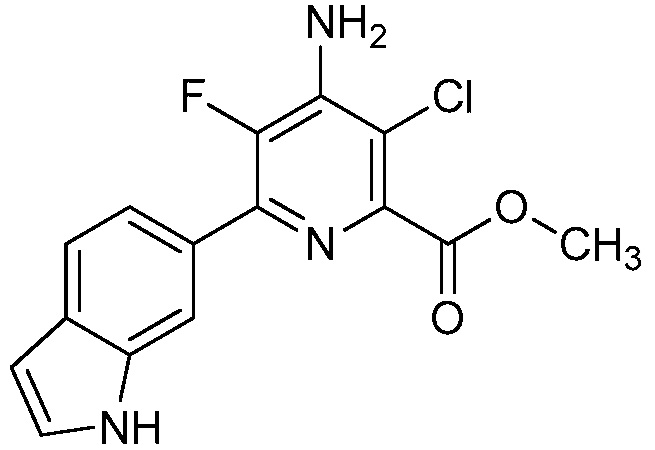
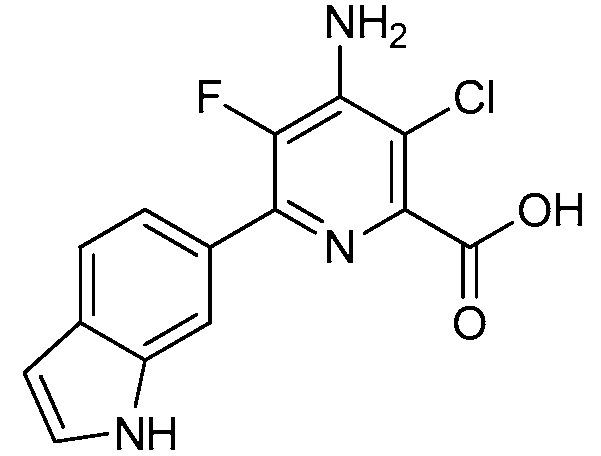
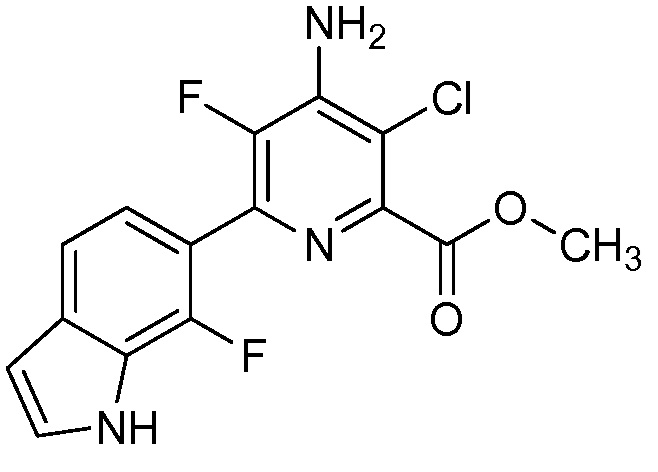
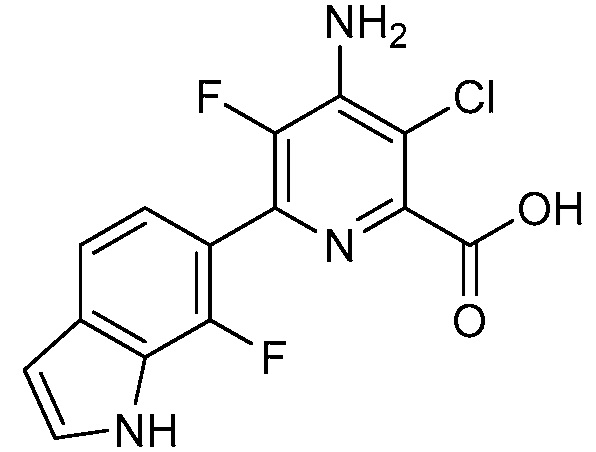
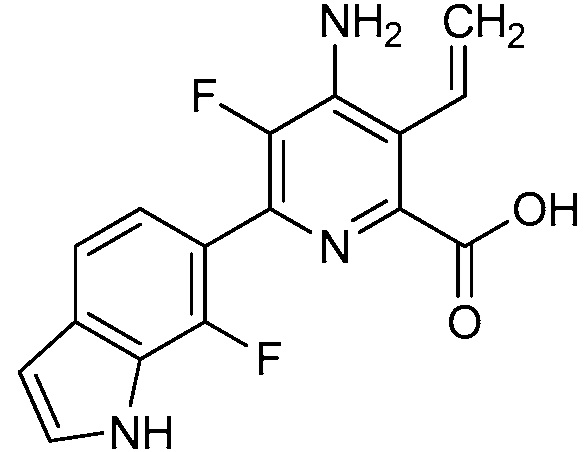
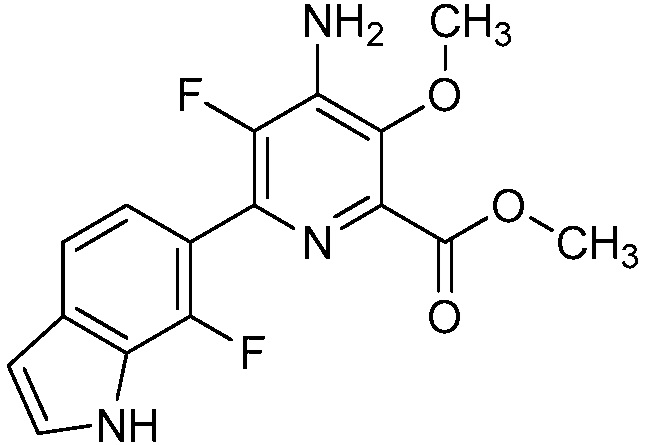
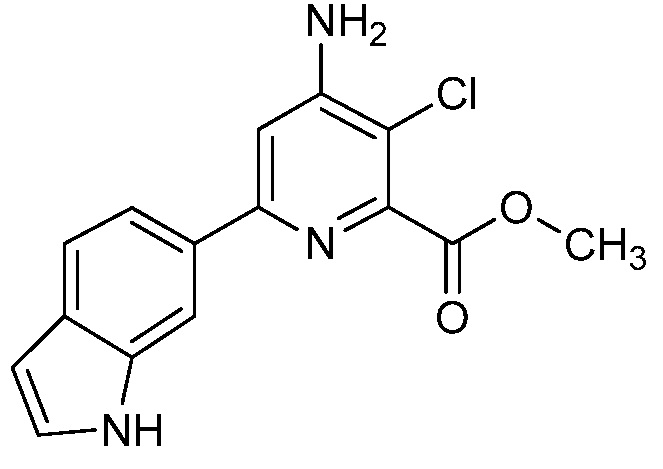
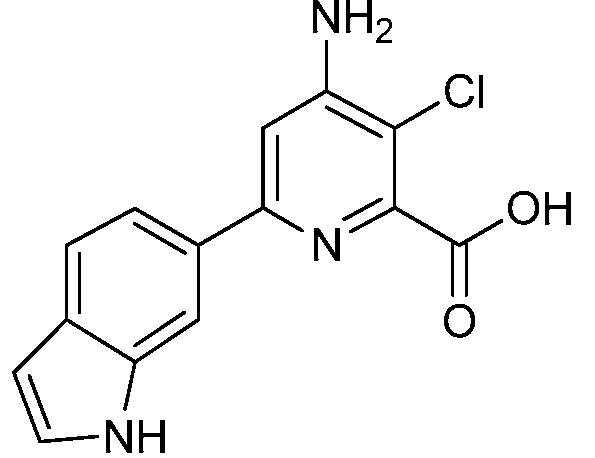
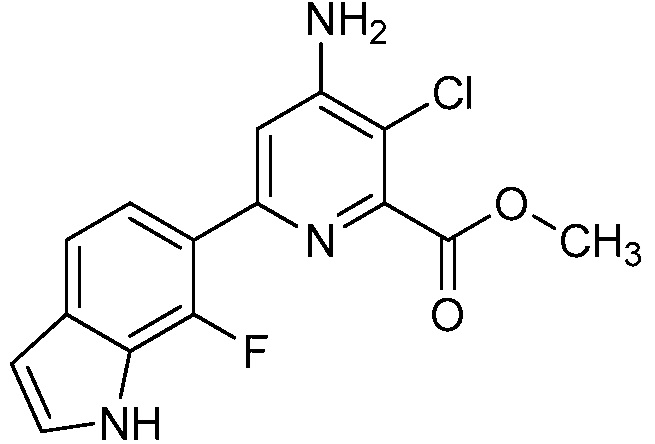
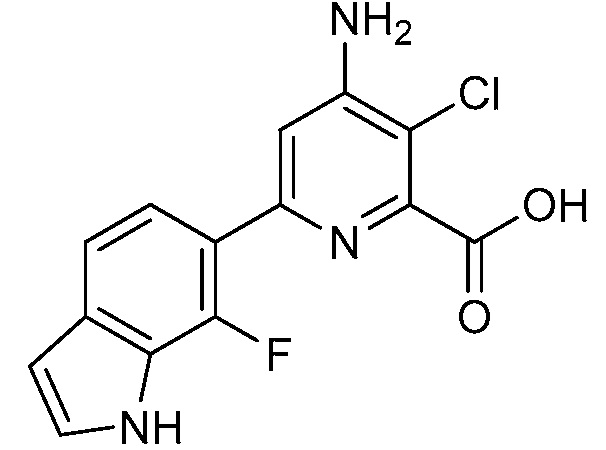
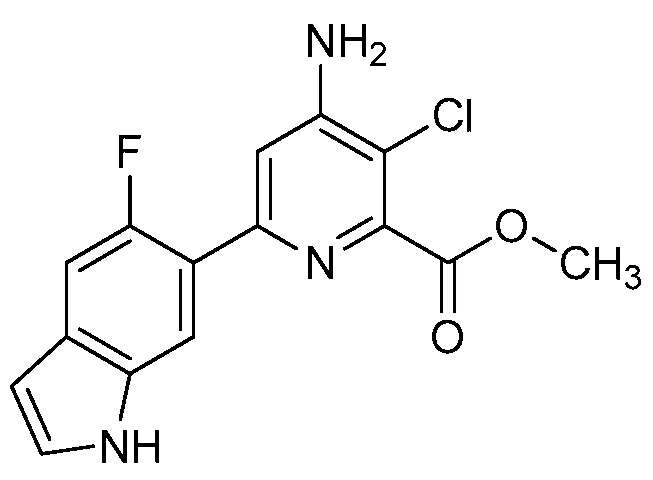
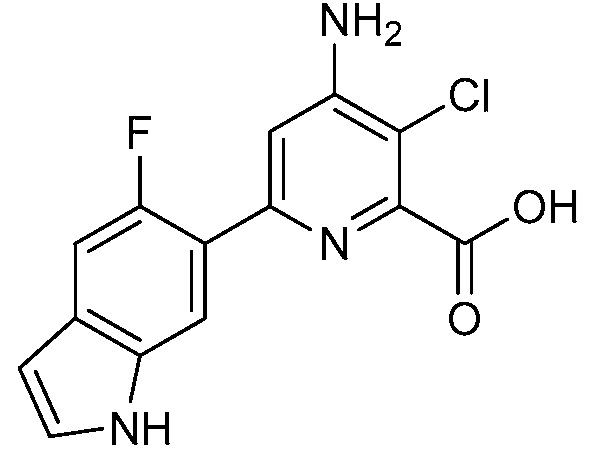
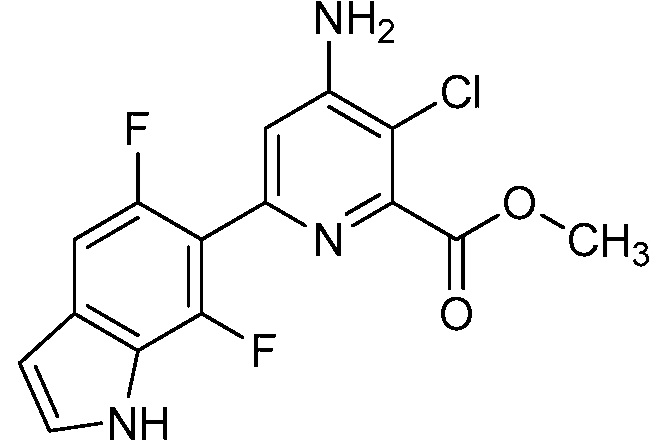
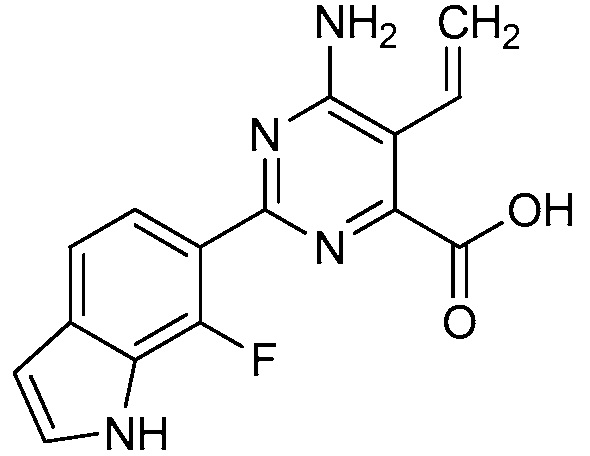
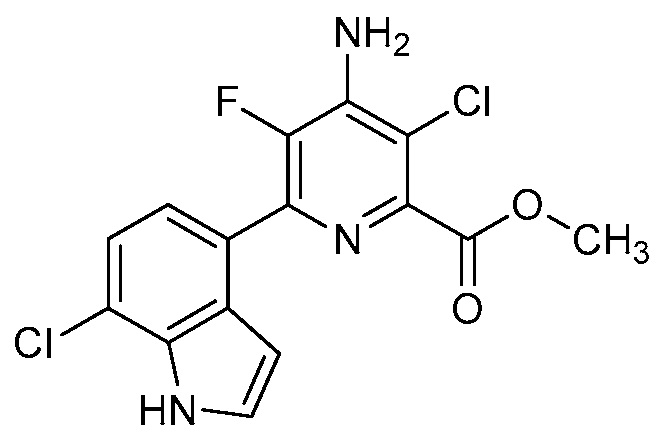
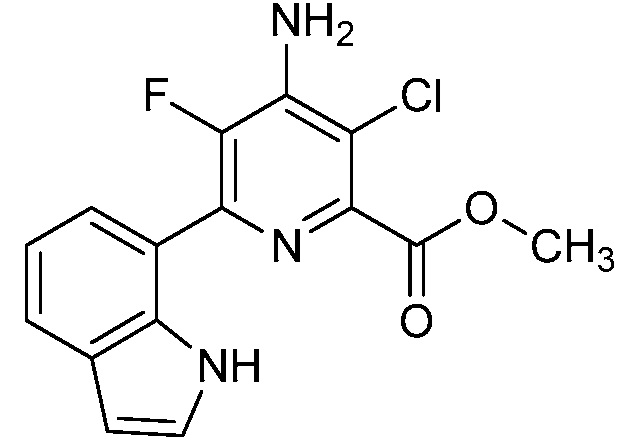
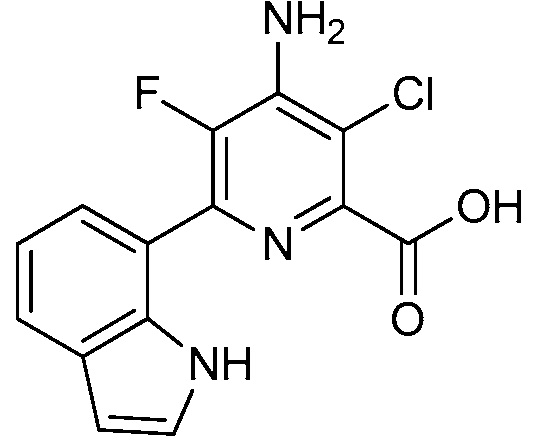
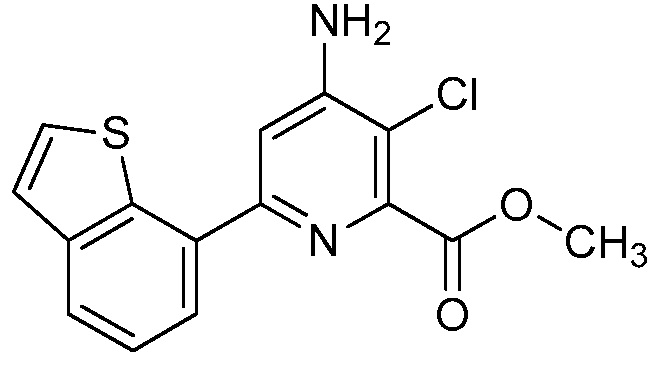
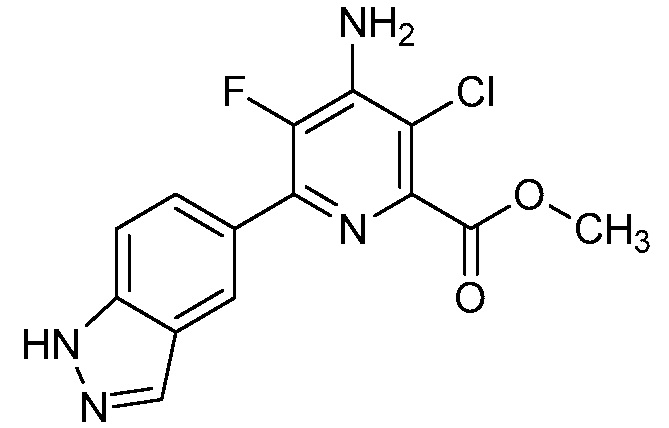
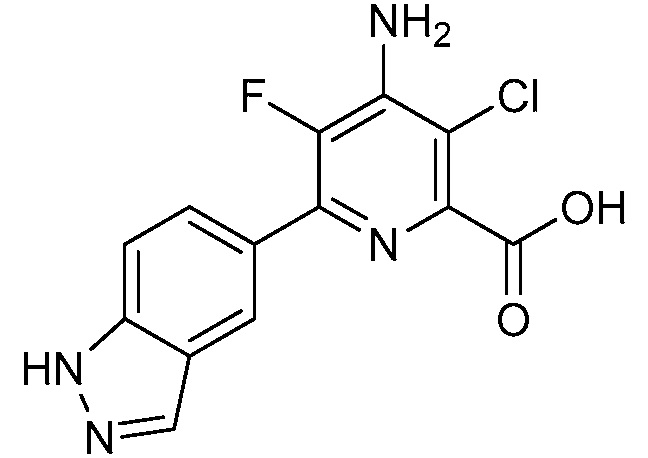
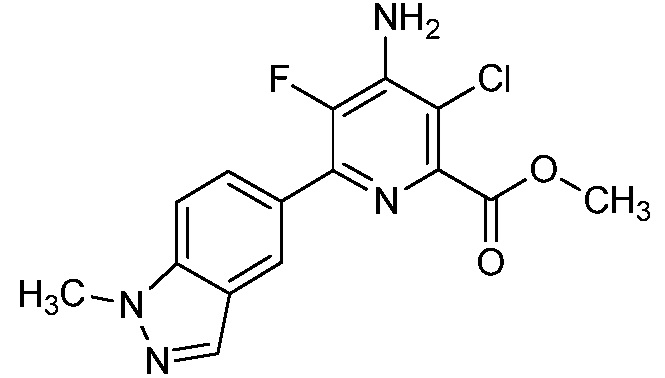
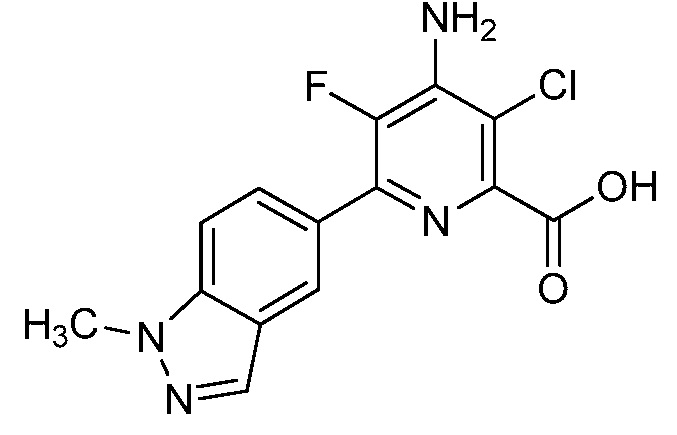
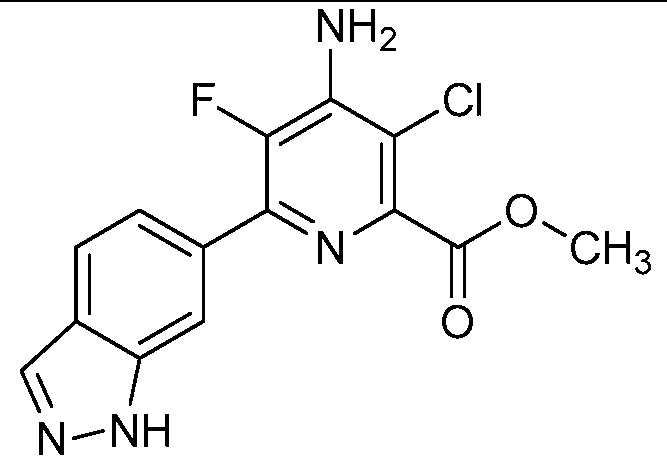
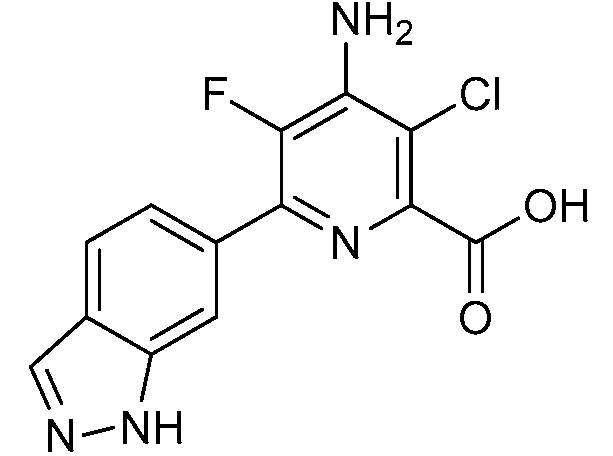
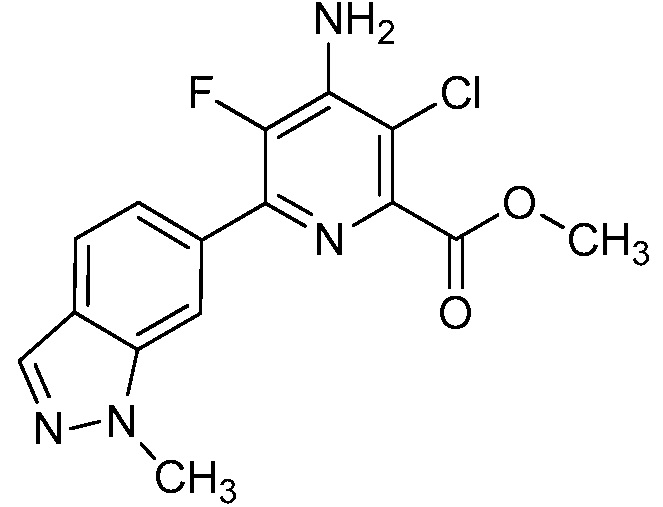
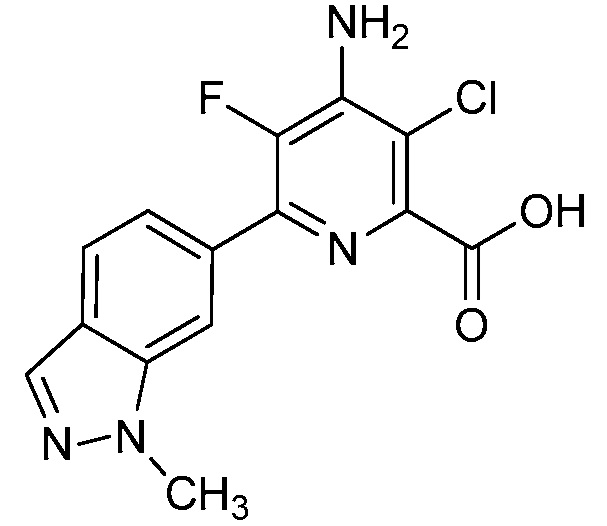
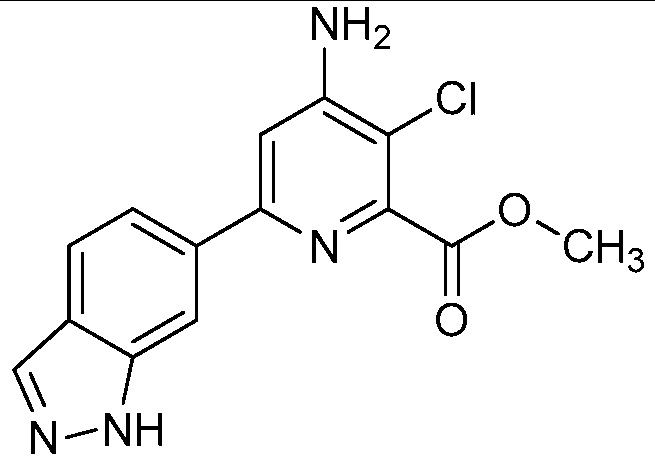
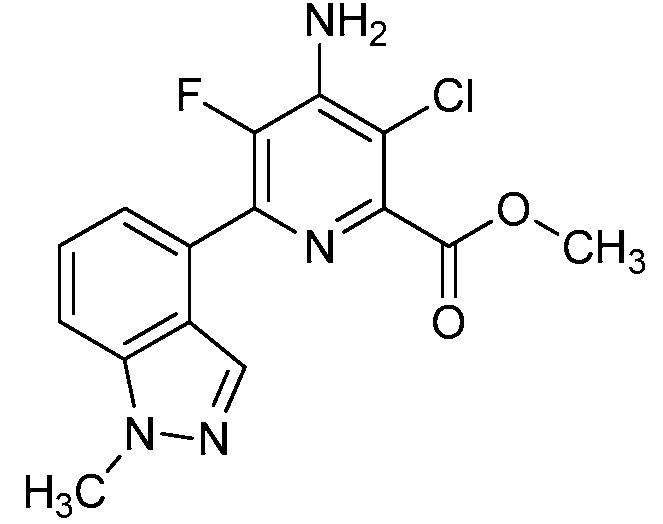
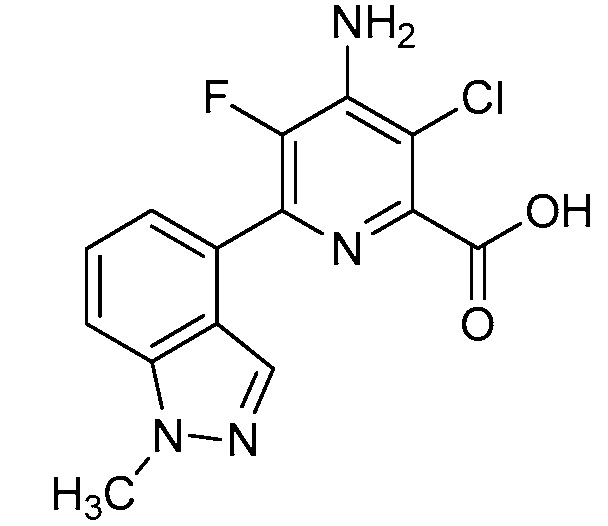
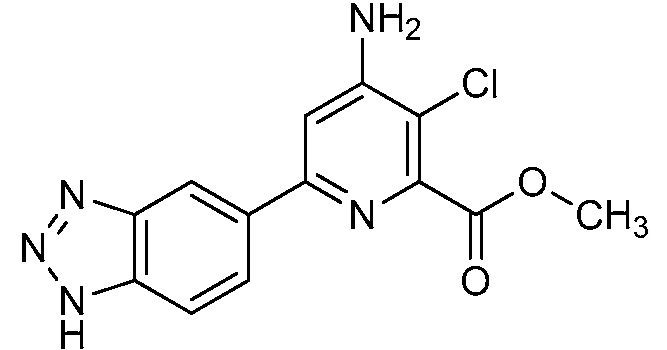
[0010] В одном варианте осуществления, соединение представляет собой 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколиновую кислоту. В одном варианте осуществления, соединение представляет собой метил 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколинат.
[0011] Также представлены способы борьбы с нежелательной растительностью, включающие (a) контактирование с нежелательной растительностью или площадью в непосредственной близости от нежелательной растительности или (b) предвсходовое контактирование с почвой или водой гербицидно эффективного количества по меньшей мере одного соединения формулы (I) или его сельскохозяйственно приемлемого производного.
[0012] Также представлены новые предшественники формулы (II):
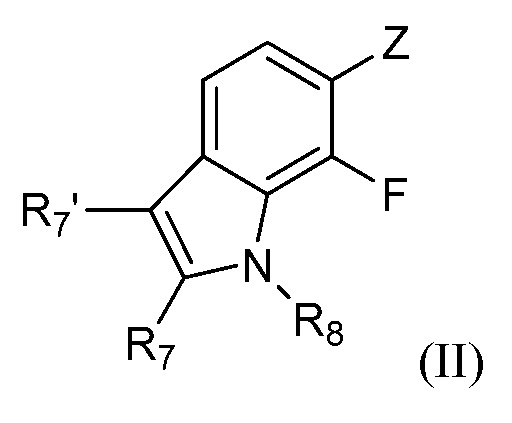
где:
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил;
R8 представляет собой водород, C1-C6 алкил, C1-C6галогеналкил, C3-C6 алкенил, C3-C6галогеналкенил, C3-C6алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
Z представляет собой B(OR22)2, BF3M или Sn(R23)3, где каждый R22 независимо представляет собой водород или C1-C4 алкил, или две OR22 группы взяты вместе с образованием -O-C(CH3)2-C(CH3)2-O- или -O-CH2-C(CH3)2-CH2-O-; M представляет собой металлический катион, например, натрий или калий, и R23 представляет собой C1-C4 алкил;
при условии, что следующее соединение исключается:
Подробное описание изобретения
ОПРЕДЕЛЕНИЯ
[0013] Как используется в настоящей заявке, гербицид и гербицидный активный ингредиент означают соединение, которое контролирует нежелательную растительность при применении в подходящем количестве.
[0014] Как используется в настоящей заявке, контроль или борьба с нежелательной растительностью означает уничтожение или предотвращение разрастания или некоторый другой неблагоприятно модифицирующий эффект на растительность, например, отклонение от естественного роста или развития, регуляция, десикация, торможение и т.п.
[0015] Как используется в настоящей заявке, гербицидно эффективное или контролирующее растительность количество представляет собой такое количество гербицидно активного ингредиента, внесение которого контролирует соответствующую нежелательную растительность.
[0016] Как используется в настоящей заявке, внесение гербицида или гербицидной композиции означает доставку непосредственно к являющейся объектом растительности или в место ее произрастания или на участок, где желателен контроль нежелательной растительности. Способы применения включают, но не ограничиваются этим, предвсходовое контактирование с почвой или водой, послевсходовое контактирование с нежелательной растительностью или площадью в непосредственной близости от нежелательной растительности.
[0017] Как используется в настоящей заявке, растения и растительность включают, но не ограничиваются этим, семена в состоянии покоя, проросшие семена, появляющиеся всходы, растения, появляющиеся из растительных черенков, молодую растительность и установившуюся растительность.
[0018] Как используется в настоящей заявке, сельскохозяйственно приемлемые соли и сложные эфиры относятся к солям и сложным эфирам, которые демонстрируют гербицидную активность, или которые представляют собой или могут быть преобразованы в растениях, воде или почве в указанный гербицид. Примеры сельскохозяйственно приемлемых сложных эфиров включают такие, которые гидролизуются, окисляются, метаболизируются или иным образом преобразуются, или могут гидролизоваться, окисляться, метаболизироваться или иным образом преобразовываться, например, в растениях, воде или почве, в соответствующую карбоновую кислоту, которая, в зависимости от pH, может быть в диссоциированной или недиссоциированной форме.
[0019] Подходящие соли включают соли, образованные из щелочных или щелочно-земельных металлов, и соли, образованные из аммиака и аминов. Предпочтительные катионы включают катионы натрия, калия, магния и аминия формулы:
R13R14R15R16N+
где R13, R14, R15 и R16, каждый независимо, представляет собой водород или C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил, каждый из которых необязательно замещен одним или несколькими гидрокси, C1-C4 алкокси, C1-C4 алкилтио или фенильными группами, при условии, что R13, R14, R15 и R16 являются стерически совместимыми. Кроме того, любые два R13, R14, R15 и R16 вместе могут представлять собой алифатическую дифункциональную группу, содержащую от одного до двенадцати атомов углерода и до двух атомов кислорода или серы. Соли соединений формулы I можно получить путем обработки соединений формулы I гидроксидом металла, таким как гидроксид натрия, амином, таким как аммиак, триметиламин, диэтаноламин, 2-метилтиопропиламин, бисаллиламин, 2-бутоксиэтиламин, морфолин, циклододециламин или бензиламин, или гидроксидом тетраалкиламмония, таким как гидроксид тетраметиламмония или холингидроксид. Соли амина часто являются предпочтительными формами соединений формулы I, поскольку они являются водорастворимыми и могут использоваться для получения желательных гербицидных композиций на водной основе.
[0020] Соединения формулы (I) включают N-оксиды. Пиридин N-оксиды можно получить путем окисления соответствующих пиридинов. Подходящие способы окисления описаны, например, в Houben-Weyl, Methoden der organischen Chemie[Methods in organic chemistry], expanded and subsequent volumes to the 4th edition, volume E 7b, p. 565 f.
[0021] Как используется в настоящей заявке, если не указано иное, ацил относится к формилу, C1-C3 алкилкарбонилу и C1-C3 галогеналкилкарбонилу. C1-C6 ацил относится к формилу, C1-C5 алкилкарбонилу и C1-C5 галогеналкилкарбонилу (группа содержит в целом от 1 до 6 атомов углерода).
[0022] Как используется в настоящей заявке, алкил относится к насыщенным, линейным или разветвленным насыщенным углеводородным группам. Если не указано иное, предполагаются C1-C10 алкильные группы. Примеры включают метил, этил, пропил, 1-метил-этил, бутил, 1-метил-пропил, 2-метил-пропил, 1,1-диметил-этил, пентил, 1-метил-бутил, 2-метил-бутил, 3-метил-бутил, 2,2-диметил-пропил, 1-этил-пропил, гексил, 1,1-диметил-пропил, 1,2-диметил-пропил, 1-метил-пентил, 2-метил-пентил, 3-метил-пентил, 4-метил-пентил, 1,1-диметил-бутил, 1,2-диметил-бутил, 1,3-диметил-бутил, 2,2-диметил-бутил, 2,3-диметил-бутил, 3,3-диметил-бутил, 1-этил-бутил, 2-этил-бутил, 1,1,2-триметил-пропил, 1,2,2-триметил-пропил, 1-этил-1-метил-пропил и 1-этил-2-метил-пропил.
[0023] Как используется в настоящей заявке, «галогеналкил» относится к линейным или разветвленным алкильньным группам, где атомы водорода этих групп могут быть частично или полностью замещены атомами галогенов. Если не указано иное, предполагаются C1-C8 группы. Примеры включают хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-хлорэтил, 1-бромэтил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил и 1,1,1-трифторпроп-2-ил.
[0024] Как используется в настоящей заявке, алкенил относится к ненасыщенным линейным или разветвленным углеводородным группам, содержащим двойную связь. Если не указано иное, предполагается C2-C8 алкенил. Алкенильные группы могут содержать более чем одну ненасыщенную связь. Примеры включают этенил, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил и 1-этил-2-метил-2-пропенил. Винил относится к группе, имеющей структуру -CH=CH2; 1-пропенил относится к группе, имеющей структуру -CH=CH-CH3; и 2-пропенил относится к группе, имеющей структуру -CH2-CH=CH2.
[0025] Как используется в настоящей заявке, алкинил представляет собой линейные или разветвленные углеводородные группы, содержащие тройную связь. Если не указано иное, предполагаются C2-C8 алкинильные группы. Алкинильные группы могут содержать более чем одну ненасыщенную связь. Примеры включают C2-C6-алкинил, такой как этинил, 1-пропинил, 2-пропинил (или пропаргил), 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 3-метил-1-бутинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 3-метил-1-пентинил, 4-метил-1-пентинил, 1-метил-2-пентинил, 4-метил-2-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-4-пентинил, 3-метил-4-пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 3,3-диметил-1-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил и 1-этил-1-метил-2-пропинил.
[0026] Как используется в настоящей заявке, алкокси относится к группе формулы R-O-, где R представляет собой алкил, как он определен выше. Если не указано иное, предполагаются алкокси группы, где R представляет собой C1-C8 алкильную группу. Примеры включают метокси, этокси, пропокси, 1-метил-этокси, бутокси, 1-метил-пропокси, 2-метил-пропокси, 1,1-диметил-этокси, пентокси, 1-метил-бутилокси, 2-метил-бутокси, 3-метил-бутокси, 2,2-ди-метил-пропокси, 1-этил-пропокси, гексокси, 1,1-диметил-пропокси, 1,2-диметил-пропокси, 1-метил-пентокси, 2-метил-пентокси, 3-метил-пентокси, 4-метил-пентокси, 1,1-диметил-бутокси, 1,2-диметил-бутокси, 1,3-диметил-бутокси, 2,2-диметил-бутокси, 2,3-диметил-бутокси, 3,3-диметил-бутокси, 1-этил-бутокси, 2-этилбутокси, 1,1,2-триметил-пропокси, 1,2,2-триметил-пропокси, 1-этил-1-метил-пропокси и 1-этил-2-метил-пропокси.
[0027] Как используется в настоящей заявке, галогеналкокси относится к группе формулы R-O-, где R представляет собой галогеналкил, как он определен выше. Если не указано иное, предполагаются галогеналкокси группы, где R представляет собой C1-C8 алкильную группу. Примеры включают хлорметокси, бромметокси, дихлорметокси, трихлорметокси, фторметокси, дифторметокси, трифторметокси, хлорфторметокси, дихлорфторметокси, хлордифторметокси, 1-хлорэтокси, 1-бромэтокси, 1-фторэтокси, 2-фторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2-фторэтокси, 2-хлор,2-дифторэтокси, 2,2-дихлор-2-фторэтокси, 2,2,2-трихлорэтокси, пентафторэтокси и 1,1,1-трифторпроп-2-окси.
[0028] Как используется в настоящей заявке, алкилтио относится к группе формулы R-S-, где R представляет собой алкил, как он определен выше. Если не указано иное, предполагаются алкилтио группы, где R представляет собой C1-C8 алкильную группу. Примеры включают метилтио, этилтио, пропилтио, 1-метилэтилтио, бутилтио, 1-метил-пропилтио, 2-метилпропилтио, 1,1-диметилэтилтио, пентилтио, 1-метилбутилтио, 2-метилбутилтио, 3-метилбутилтио, 2,2-ди-метилпропилтио, 1-этилпропилтио, гексилтио, 1,1-диметил пропилтио, 1,2-диметил пропилтио, 1-метилпентилтио, 2-метилпентилтио, 3-метил-пентилтио, 4-метил-пентилтио, 1,1-диметил бутилтио, 1,2-диметил-бутилтио, 1,3-диметил-бутилтио, 2,2-диметил бутилтио, 2,3-диметил бутилтио, 3,3-диметилбутилтио, 1-этилбутилтио, 2-этилбутилтио, 1,1,2-триметилпропилтио, 1,2,2-триметилпропилтио, 1-этил-1-метилпропилтио и 1-этил-2-метилпропилтио.
[0029] Как используется в настоящей заявке, галогеналкилтио относится к алкилтио группе, как она определена выше, где атомы углерода частично или полностью замещены атомами галогенов. Если не указано иное, предполагаются галогеналкилтио группы, где R представляет собой C1-C8 алкильную группу. Примеры включают хлорметилтио, бромметилтио, дихлорметилтио, трихлорметилтио, фторметилтио, дифторметилтио, трифторметилтио, хлорфторметилтио, дихлорфтор-метилтио, хлордифторметилтио, 1-хлорэтилтио, 1-бромэтилтио, 1-фторэтилтио, 2-фторэтилтио, 2,2-дифторэтилтио, 2,2,2-трифторэтилтио, 2-хлор-2-фторэтилтио, 2-хлор-2-дифторэтилтио, 2,2-дихлор-2-фторэтилтио, 2,2,2-трихлорэтилтио, пентафторэтилтио и 1,1,1-трифторпроп-2-илтио.
[0030] Как используется в настоящей заявке, арил, а также производные термины, такие как арилокси, относится к фенильной, инданильной или нафтильной группе, при этом фенил является предпочтительным. Термин «гетероарил», а также производные термины, такие как «гетероарилокси», относится к 5- или 6-членному ароматическому кольцу, содержащему один или несколько гетероатомов, таких как N, O или S; эти гетероароматические кольца могут быть конденсированными с другими ароматическими системами. Арильные или гетероарильные заместители могут быть незамещенными или замещенными одним или несколькими заместителями, выбранными из галогена, гидрокси, нитро, циано, формила, C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, C1-C6 алкокси, C1-C6галогеналкила, C1-C6галогеналкокси, C1-C6ацила, C1-C6алкилтио, C1-C6алкилсульфинила, C1-C6алкилсульфонила, C1-C6алкоксикарбонила, C1-C6карбамоила, гидроксикарбонила, C1-C6алкилкарбонила, аминокарбонила, C1-C6алкиламинокарбонила, C1-C6диалкиламинокарбонила, при условии, что заместители являются стерически совместимыми, и соблюдаются правила химического связывания и энергии деформации. Предпочтительные заместители включают галоген, C1-C2 алкил и C1-C2 галогеналкил.
[0031] Как используется в настоящей заявке алкилкарбонил относится к алкильной группе, связанной с карбонильной группой. C1-C3 алкилкарбонил и C1-C3 галогеналкилкарбонил относятся к группам, где C1-C3 алкильная группа связана с карбонильной группой (группа содержит в целом от 2 до 4 атомов углерода).
[0032] Как используется в настоящей заявке, алкоксикарбонил относится к группе формулы 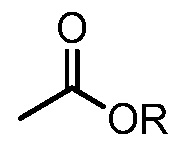 , где R представляет собой алкил.
, где R представляет собой алкил.
[0033] Как используется в настоящей заявке, арилалкил относится к алкильной группе, замещенной арильной группой. C7-C10 арилалкил относится к группе, где общее количество атомов углерода в группе составляет от 7 до 10.
[0034] Как используется в настоящей заявке, алкиламино относится к амино группе, замещенной одной или двумя алкильными группами, которые могут быть одинаковыми или отличными друг от друга.
[0035] Как используется в настоящей заявке галогеналкиламино относится к алкиламино группе, где атомы углерода алкила частично или полностью замещены атомами галогенов.
[0036] Как используется в настоящей заявке, C1-C6 алкиламинокарбонил относится к группе формулы RNHC(O)-, где R представляет собой C1-C6 алкил, и C1-C6 диалкиламинокарбонил относится к группе формулы R2NC(O)-, где каждый R независимо представляет собой C1-C6 алкил.
[0037] Как используется в настоящей заявке, алкилкарбамил относится к карбамильной группе, замещенной по атому азота алкильной группой.
[0038] Как используется в настоящей заявке, алкилсульфонил относится к группе формулы 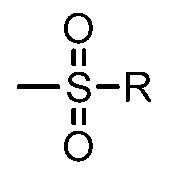 , где R представляет собой алкил.
, где R представляет собой алкил.
[0039] Как используется в настоящей заявке, карбамил (также имеющий название карбамоил и аминокарбонил) относится к группе формулы 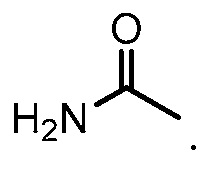
[0040] Как используется в настоящей заявке, диалкилфосфонил относится к группе формулы 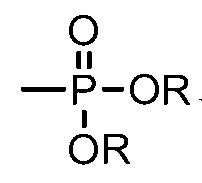 , где R независимо в каждом случае представляет собой алкил.
, где R независимо в каждом случае представляет собой алкил.
[0041] Как используется в настоящей заявке, C1-C6 триалкилсилил относится к группе формулы -SiR3, где каждый R независимо представляет собой C1-C6 алкильную группу (группа содержит в целом от 3 до 18 атомов углерода).
[0042] Как используется в настоящей заявке Me относится к метильной группе; OMe относится к метокси группе; i-Pr относится к изопропильной группе.
[0043] Как используется в настоящей заявке, термин «галоген», включая производные термины, такие как «гало», относится к фтору, хлору, брому и иоду.
[0044] Как используется в настоящей заявке, растения и растительность включают, но не ограничиваются этим, проросшие семена, появляющиеся всходы, растения, появляющиеся из растительных черенков, молодую растительность и установившуюся растительность.
СОЕДИНЕНИЯ ФОРМУЛЫ (I)
[0045] Изобретение обеспечивает соединения формулы (I), определенные выше, и их N-оксиды и сельскохозяйственно приемлемые соли.
[0046] В некоторых вариантах осуществления, соединение представляет собой карбоновую кислоту или сельскохозяйственно приемлемый сложный эфир или соль. В некоторых вариантах осуществления, соединение представляет собой карбоновую кислоту или ее метиловый эфир.
[0047] В некоторых вариантах осуществления:
A представляет собой одну из групп A1-A20;
R1 представляет собой OR1', где R1' представляет собой водород или C1-C4 алкил;
R2 представляет собой хлор;
R3 и R4 представляют собой водород;
X представляет собой N, CH, CF, CCl или CBr;
R5 представляет собой водород, галоген, OH, NH2, CN, C1-C3 алкил, C1-C3 алкокси, C1-C3 алкиламино или циклопропил;
R6, R6' и R6'' независимо представляют собой водород, галоген, OH, NH2, CN, C1-C3 алкил, C1-C3 алкокси, циклопропил или винил;
R7 и R7' независимо представляют собой водород, галоген, C1-C3 алкил, C1-C3 алкокси,C1-C3алкилтио, циклопропил или C1-C3 алкиламино или фенил; и
R8 представляет собой водород, C1-C3 алкил, фенил или C1-C3 алкилкарбонил.
[0048] В некоторых вариантах осуществления R1 представляет собой OR1', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил. В некоторых вариантах осуществления R1' представляет собой водород или C1-C8 алкил. В некоторых вариантах осуществления R1' представляет собой водород.
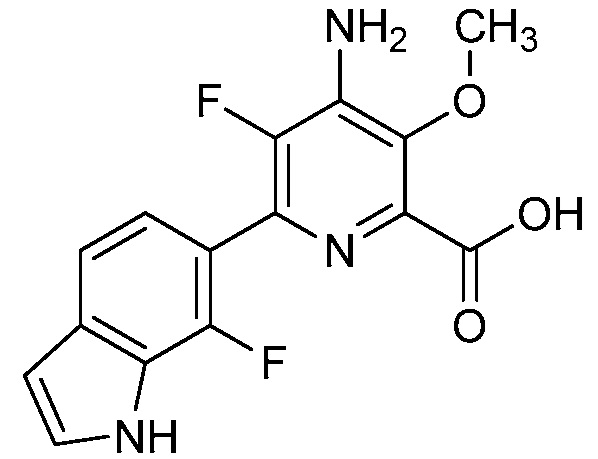
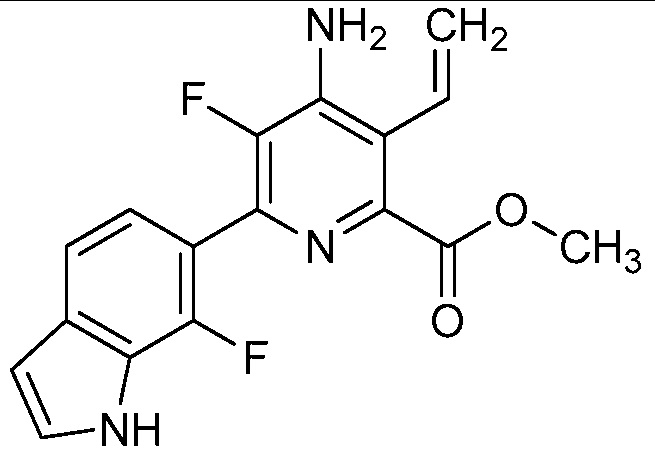
[0049] В некоторых вариантах осуществления R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкинил, C2-C4-алкенил, C2-C4 галогеналкенил или C1-C4-алкокси или C1-C4 галогеналкокси. В некоторых вариантах осуществления R2 представляет собой галоген, C2-C4-алкенил, C2-C4 галогеналкенил или C1-C4-алкокси. В некоторых вариантах осуществления R2 представляет собой галоген. В некоторых вариантах осуществления R2 представляет собой C2-C4-алкенил или C2-C4 галогеналкенил. В некоторых вариантах осуществления R2 представляет собой C1-C4 алкокси. В некоторых вариантах осуществления R2 представляет собой Cl, OMe, винил или 1-пропенил. В некоторых вариантах осуществления R2 представляет собой Cl. В некоторых вариантах осуществления R2 представляет собой OMe. В некоторых вариантах осуществления R2 представляет собой винил или 1-пропенил.
[0050] В некоторых вариантах осуществления R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6галогеналкил, C3-C6 алкенил, C3-C6галогеналкенил, C3-C6алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6алкинил, C1-C6 алкокси или C1-C6 алкиламино. В некоторых вариантах осуществления R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6галогеналкил, C3-C6 алкенил, C3-C6галогеналкенил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C1-C6 алкокси или C1-C6 алкиламино. В некоторых вариантах осуществления R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6галогеналкил, C3-C6 алкенил, C3-C6галогеналкенил, формил, C1-C3 алкилкарбонил или C1-C3 галогеналкилкарбонил. В некоторых вариантах осуществления, меньшей мере один из R3 и R4 представляет собой водород. В некоторых вариантах осуществления R3 и R4 оба представляют собой водород.
[0051] В некоторых вариантах осуществления X представляет собой N, CH или CF. В некоторых вариантах осуществления X представляет собой N. В некоторых вариантах осуществления X представляет собой CH. В некоторых вариантах осуществления X представляет собой CF.
[0052] В некоторых вариантах осуществления A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19 или A20.
[0053] В некоторых вариантах осуществления A представляет собой одну из групп A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 и A36.
[0054] В некоторых вариантах осуществления A представляет собой одну из групп A1, A2, A3, A7, A8, A9, A10, A13, A14 и A15. В некоторых вариантах осуществления A представляет собой одну из групп A1, A2, A3, A13, A14 и A15. В некоторых вариантах осуществления A представляет собой одну из групп A13, A14 и A15. В некоторых вариантах осуществления A представляет собой A15.
[0055] В некоторых вариантах осуществления R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио или амино. В некоторых вариантах осуществления R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси или амино. В некоторых вариантах осуществления R5 представляет собой водород, галоген, C1-C4 алкил или C1-C4 алкокси. В некоторых вариантах осуществления R5 представляет собой водород или F. В некоторых вариантах осуществления R5 представляет собой водород.
В других вариантах осуществления R5 представляет собой F.
[0056] В некоторых вариантах осуществления R6 представляет собой водород, галоген, C1-C4 алкил, C1-C4галогеналкил, C1-C3алкокси или C1-C3галогеналкокси. В некоторых вариантах осуществления R6 представляет собой водород или фтор. В некоторых вариантах осуществления R6 представляет собой водород. В некоторых вариантах осуществления R6 представляет собой фтор.
[0057] В некоторых вариантах осуществления R6' представляет собой водород или галоген. В некоторых вариантах осуществления R6' представляет собой водород, F или Cl. В некоторых вариантах осуществления R6' представляет собой водород или F. В некоторых вариантах осуществления R6' представляет собой водород.
[0058] В некоторых вариантах осуществления R6'' представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, C2-C4 алкинил, CN или NO2. В некоторых вариантах осуществления R6'' представляет собой водород. В некоторых вариантах осуществления R6'' представляет собой галоген. В некоторых вариантах осуществления R6'' представляет собой C1-C4 алкил. В некоторых вариантах осуществления R6'' представляет собой C1-C4 галогеналкил. В некоторых вариантах осуществления R6'' представляет собой циклопропил. В некоторых вариантах осуществления R6'' представляет собой C2-C4 алкинил. В некоторых вариантах осуществления R6'' представляет собой CN. В некоторых вариантах осуществления R6'' представляет собой NO2.
[0059] В некоторых вариантах осуществления:
R2 представляет собой галоген, C2-C4-алкенил, C2-C4 галогеналкенил или C1-C4-алкокси;
R3 и R4 оба представляют собой водород; и
X представляет собой N, CH или CF.
[0060] В некоторых вариантах осуществления:
R2 представляет собой галоген;
R3 и R4 оба представляют собой водород; и
X представляет собой N, CH или CF.
[0061] В некоторых вариантах осуществления:
R2 представляет собой C2-C4-алкенил или C2-C4 галогеналкенил;
R3 и R4 оба представляют собой водород; и
X представляет собой N, CH или CF.
[0062] В некоторых вариантах осуществления:
R2 представляет собой C1-C4-алкокси;
R3 и R4 оба представляют собой водород; и
X представляет собой N, CH или CF.
[0063] В некоторых вариантах осуществления:
R2 представляет собой галоген, C2-C4-алкенил, C2-C4 галогеналкенил или C1-C4-алкокси;
R3 и R4 оба представляют собой водород;
X представляет собой N, CH или CF;
R5 представляет собой водород или F;
R6 представляет собой водород или F;
R6' представляет собой водород;
R6'', если это применимо к соответствующей A группе, представляет собой водород или галоген; и
R7 и R7', если это применимо к соответствующей A группе, независимо представляют собой водород или галоген.
[0064] В некоторых вариантах осуществления:
R2 представляет собой галоген, C1-C4-алкокси или C2-C4-алкенил ;
R3 и R4 представляют собой водород;
X представляет собой N, CH или CF; и
A представляет собой одну из групп A1-A20;
[0065] В некоторых вариантах осуществления:
R2 представляет собой хлор;
R3 и R4 представляют собой водород;
X представляет собой N, CH или CF;
A представляет собой одну из групп A1-A20;
R5 представляет собой водород или F;
R6 и R6'независимо представляют собой водород или F; и
R7 и R7', если это применимо к соответствующей A группе, независимо представляют собой водород, галоген, C1-C4 алкил или C1-C4 галогеналкил.
[0066] В некоторых вариантах осуществления:
R2 представляет собой хлор, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород; и
X представляет собой N, CH или CF.
[0067] В некоторых вариантах осуществления:
R2 представляет собой хлор;
R3 и R4 представляют собой водород; и
X представляет собой N, CH или CF.
[0068] В некоторых вариантах осуществления:
R2 представляет собой винил или 1-пропенил;
R3 и R4 представляют собой водород; и
X представляет собой N, CH или CF.
[0069] В некоторых вариантах осуществления:
R2 представляет собой метокси;
R3 и R4 представляют собой водород; и
X представляет собой N, CH или CF.
[0070] В некоторых вариантах осуществления:
R2 представляет собой хлор;
R3 и R4 представляют собой водород; и
X представляет собой N.
[0071] В некоторых вариантах осуществления:
R2 представляет собой хлор;
R3 и R4 представляют собой водород; и
X представляет собой CH.
[0072] В некоторых вариантах осуществления:
R2 представляет собой хлор;
R3 и R4 представляют собой водород; и
X представляет собой CF.
[0073] В некоторых вариантах осуществления:
R2 представляет собой хлор;
R3 и R4 представляют собой водород;
X представляет собой CF;
A представляет собой одну из групп A1, A2, A3, A7, A8, A9, A10, A13, A14 или A15;
R5 представляет собой F; и
R6 представляет собой H.
[0074] В некоторых вариантах осуществления:
R2 представляет собой хлор, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород;
X представляет собой N, CH или CF; и
A представляет собой одну из групп A21-A36.
[0075] В некоторых вариантах осуществления:
R2 представляет собой хлор, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород;
X представляет собой CF; и
A представляет собой одну из групп
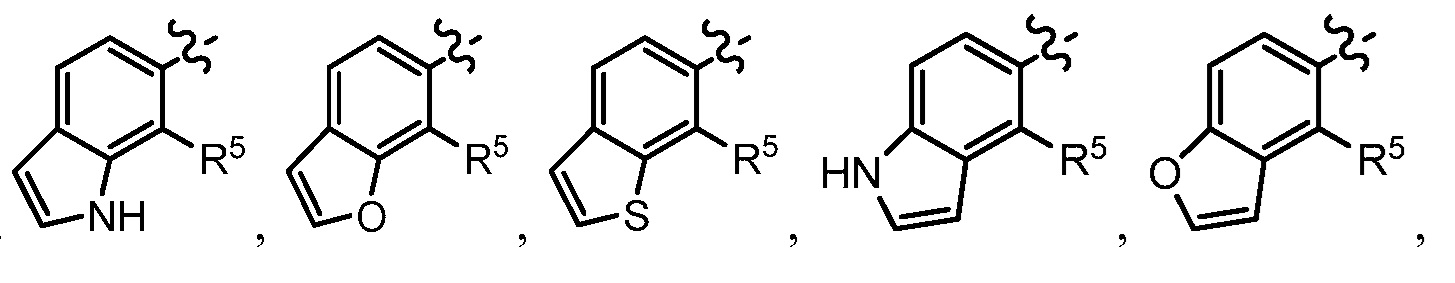
где R5 представляет собой водород или F.
[0076] В некоторых вариантах осуществления:
R2 представляет собой хлор, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород;
X представляет собой N, CH или CF; и
A представляет собой
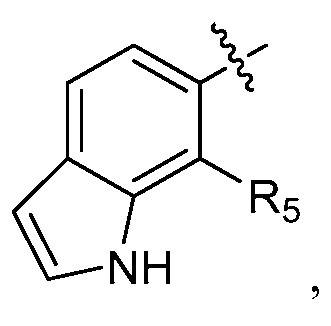
где R5 представляет собой водород или F.
[0077] В некоторых вариантах осуществления:
R2 представляет собой хлор, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород;
X представляет собой N, CH или CF; и
A представляет собой
[0078] В некоторых вариантах осуществления:
R2 представляет собой хлор, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород;
X представляет собой CF; и
A представляет собой
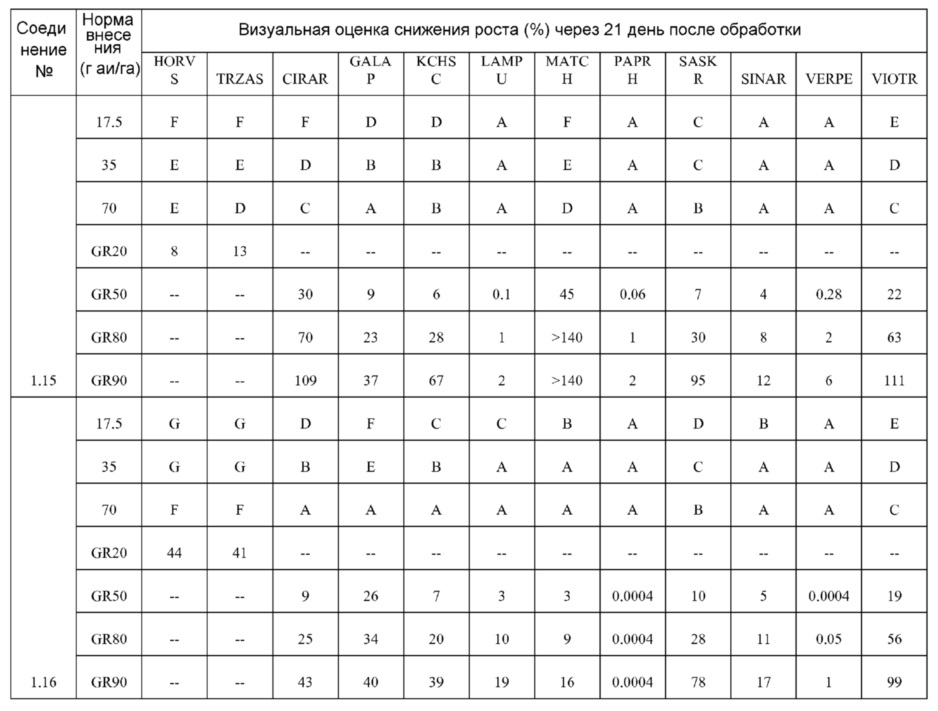
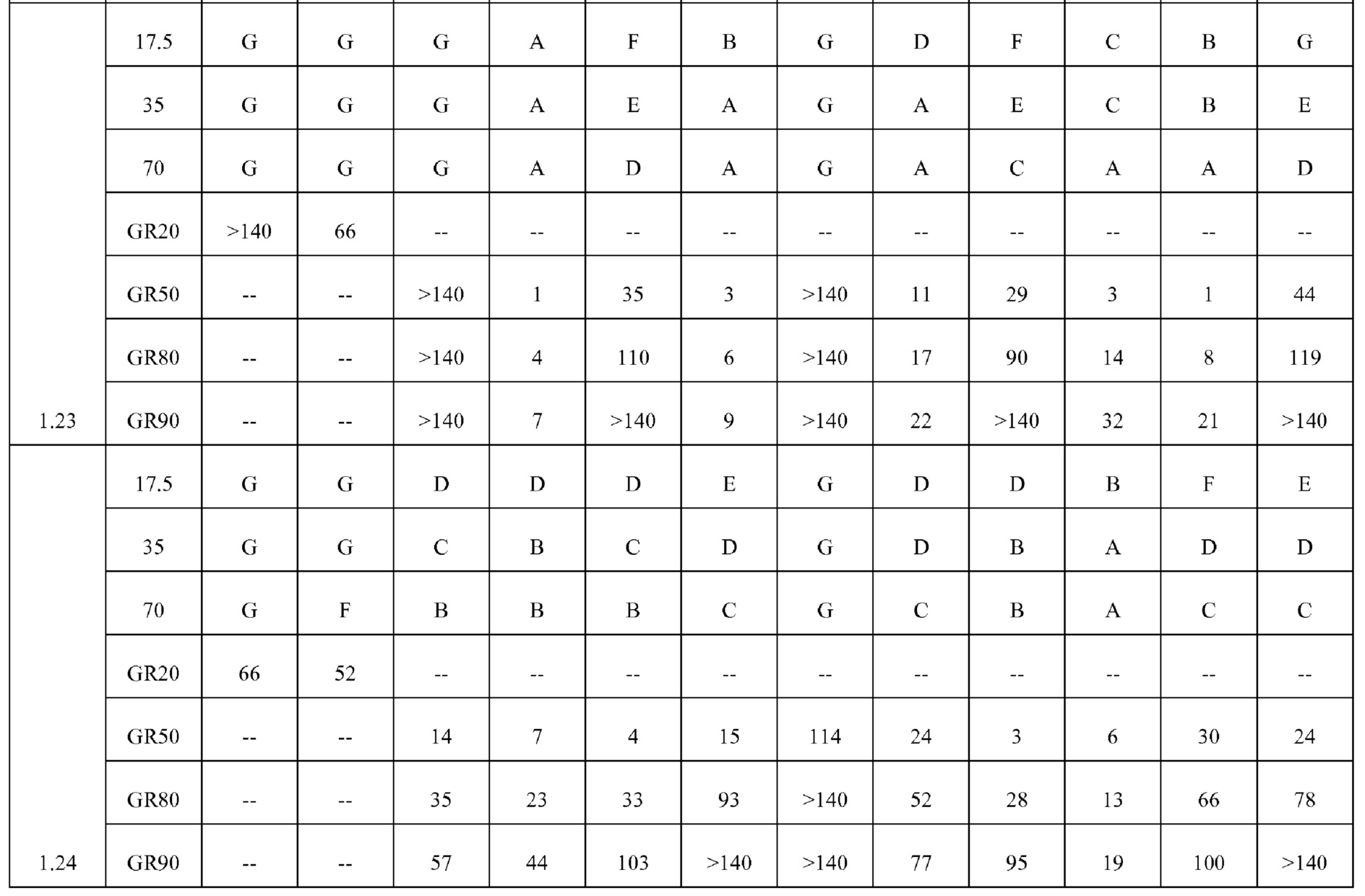
[0079] Особенно следует отметить, что соединения формулы (I) где A представляет собой, например, A15, демонстрируют a существенное повышение активности, когда X представляет собой CF. Это продемонстрировано путем сравнения активности соединений 1.21 и 1.22 (где X представляет собой CH) с активностью соединений 1.08 и 1.09 (где X представляет собой CF). Это также продемонстрировано путем сравнения активности соединений 1.23 и 1.24 (где X представляет собой CH) с активностью соединений 1.15 и 1.16 (где X представляет собой CF). Повышенная активность еще более повышается, когда R5 представляет собой F.
[0080] В некоторых вариантах осуществления, соединение представляет собой соединение формулы (I):
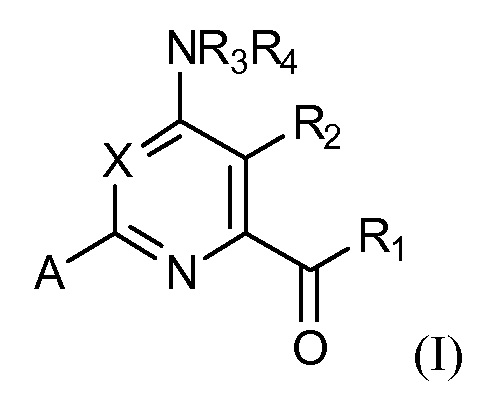
где
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
или N-оксид или сельскохозяйственно приемлемую соль такого соединения,
при условии, что соединение не является соединением формулы (I):
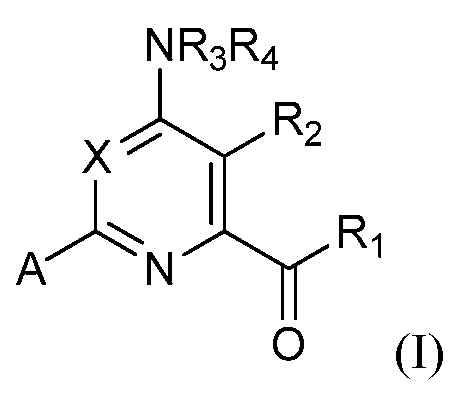
где
X представляет собой N, CH, CF, CCl или CBr;
R1 представляет собой OR1', где R1' представляет собой водород или C1-C4 алкил;
R2 представляет собой хлор;
R3 и R4 представляют собой водород;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19 или A20;
R5 представляет собой водород, галоген, OH, амино, CN, C1-C3 алкил, C1-C3 алкокси, C1-C3 алкиламино или циклопропил;
R6, R6' и R6'' независимо представляют собой водород, галоген, OH, NH2, CN, C1-C3 алкил, C1-C3 алкокси, циклопропил или винил;
R7 и R7' независимо представляют собой водород, галоген, C1-C3 алкил, C1-C3 алкокси, C1-C3 алкилтио, циклопропил или C1-C3 алкиламино или фенил; и
R8 представляет собой водород, C1-C3 алкил, фенил или C1-C3 алкилкарбонил;
или N-оксидом или сельскохозяйственно приемлемой солью такого соединения.
[0081] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления, A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0082] В некоторых вариантах осуществления:
X представляет собой CY, где Y представляет собой C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил.
[0083] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0084] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой C5-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил;
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
[0085] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0086] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой F, Br, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил.
[0087] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0088] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил.
[0089] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления, A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0090] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил.
[0091] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0092] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19 или A20;
R5 представляет собой C4 алкил, C1-C4 галогеналкил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, C4 алкиламино или C2-C4 галогеналкиламино;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил.
[0093] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления, A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0094] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19 или A20;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой C4 алкил, C1-C4 галогеналкил, галогенциклопропил, C3-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, C1-C4 алкиламино или C2-C4 галогеналкиламино или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил.
[0095] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления, A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0096] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17 или A18;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой C4 алкил, C1-C4 галогеналкил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 галогеналкокси, C1-C3 галогеналкилтио, амино, C4 алкиламино или C2-C4 галогеналкиламино; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил
[0097] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления, A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[0098] В некоторых вариантах осуществления:
X представляет собой N или CY, где Y представляет собой водород, галоген, C1-C3 алкил, C1-C3 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкокси, C1-C3 алкилтио или C1-C3 галогеналкилтио;
R1 представляет собой OR1' или NR1''R1''', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил, и R1'' и R1''' независимо представляют собой водород, C1-C12 алкил, C3-C12 алкенил или C3-C12 алкинил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A3, A6, A11, A12, A15, A18, A19 или A20;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой C3-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил или C1-C6 триалкилсилил.
[0099] В некоторых из этих вариантов осуществления R1 представляет собой OR1. В некоторых из этих вариантов осуществления X представляет собой CF. В некоторых из этих вариантов осуществления A представляет собой A15. В некоторых из этих вариантов осуществления R5 представляет собой F.
[00100] В некоторых вариантах осуществления, соединение представляет собой соединение формулы (I):
где
X представляет собой CF;
R1 представляет собой OR1', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4 алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио, C1-C4 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, циано или группу формулы -CR17=CR18-SiR19R20R21, где R17 представляет собой водород, F или Cl; R18 представляет собой водород, F, Cl, C1-C4 алкил или C1-C4 галогеналкил; и R19, R20 и R21 независимо представляют собой C1-C10 алкил, C3-C6 циклоалкил, фенил, замещенный фенил, C1-C10 алкокси или OH;
R3 и R4 независимо представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил, C1-C6 диалкилфосфонил, или R3 и R4, взятые вместе с N, представляют собой 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино, или R3' и R4', взятые вместе с =C, представляют собой 5- или 6-членное насыщенное кольцо;
A представляет собой A1, A2, A3, A4, A5, A6, A7, A8, A9, A10, A11, A12, A13, A14, A15, A16, A17, A18, A19, A20, A21, A22, A23, A24, A25, A26, A27, A28, A29, A30, A31, A32, A33, A34, A35 или A36;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино, OH или CN;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино, OH, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси,C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино, C2-C4 галогеналкиламино или фенил; и
R8 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил, C1-C6 алкилкарбамил, C1-C6 алкилсульфонил, C1-C6 триалкилсилил или фенил;
или N-оксид или сельскохозяйственно приемлемую соль такого соединения.
[00101] В некоторых вариантах осуществления:
R1 представляет собой OR1', где R1' представляет собой водород, C1-C8 алкил или C7-C10 арилалкил;
R2 представляет собой галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4-алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C4-алкокси, C1-C4 галогеналкокси, C1-C4 алкилтио или C1-C4 галогеналкилтио.
R3 и R4 представляют собой водород, C1-C6 алкил, C1-C6 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, C3-C6 алкинил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, или R3 и R4, взятые вместе, представляют собой =CR3'(R4'), где R3' и R4' независимо представляют собой водород, C1-C6 алкил, C3-C6 алкенил, C3-C6 алкинил, C1-C6 алкокси или C1-C6 алкиламино;
A представляет собой A1, A2, A3, A7, A8, A9, A10, A11, A12, A13, A14, A15, A21, A22, A23, A24, A27, A28, A29, A30, A31 или A32;
R5 представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, C1-C3 галогеналкилтио, амино, C1-C4 алкиламино или C2-C4 галогеналкиламино;
R6, R6' и R6'' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, галогенциклопропил, C2-C4 алкенил, C2-C4 галогеналкенил, C2-C4 алкинил, C1-C3 алкокси, C1-C3 галогеналкокси, CN или NO2;
R7 и R7' независимо представляют собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, C1-C3 алкокси, C1-C3 галогеналкокси, C1-C3 алкилтио, циклопропил, амино или C1-C4 алкиламино; и
R8 представляет собой водород, C1-C6 алкил, C1-C4 галогеналкил, C3-C6 алкенил, C3-C6 галогеналкенил, формил, C1-C3 алкилкарбонил, C1-C3 галогеналкилкарбонил, C1-C6 алкоксикарбонил или C1-C6 алкилкарбамил.
[00102] В некоторых вариантах осуществления R2 представляет собой галоген, C2-C4-алкенил, C2-C4 галогеналкенил или C1-C4-алкокси. В некоторых вариантах осуществления R2 представляет собой Cl, метокси, винил или 1-пропенил. В некоторых вариантах осуществления R3 и R4 представляют собой водород.
[00103] В некоторых вариантах осуществления, A представляет собой A1, A2, A3, A7, A8, A9, A10, A13, A14 или A15. В некоторых вариантах осуществления A представляет собой A1, A2, A3, A13, A14 или A15. В некоторых вариантах осуществления A представляет собой A15.
[00104] В некоторых вариантах осуществления R5 представляет собой водород или F. В некоторых вариантах осуществления R5 представляет собой F. В некоторых вариантах осуществления R5 представляет собой H.
[00105] В некоторых вариантах осуществления R6 представляет собой водород или F. В некоторых вариантах осуществления R6 представляет собой F. В некоторых вариантах осуществления R6 представляет собой H. В некоторых вариантах осуществления R6'' представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, C2-C4 алкинил, CN или NO2. В некоторых вариантах осуществления R6, R6' и R6'' все представляют собой водород.
[00106] В некоторых вариантах осуществления:
R2 представляет собой Cl, метокси, винил или 1-пропенил;
R3 и R4 представляют собой водород;
A представляет собой A15;
R5 представляет собой водород или F; и
R6 представляет собой водород или F; и
R6'' представляет собой водород, галоген, C1-C4 алкил, C1-C4 галогеналкил, циклопропил, C2-C4 алкинил, CN или NO2.
[00107] В одном варианте осуществления, соединение представляет собой 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколиновую кислоту. В одном варианте осуществления, соединение представляет собой метил 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколинат.
ИЛЛЮСТРАТИВНЫЕ СОЕДИНЕНИЯ
[00108] Следующие далее Таблицы 1-9 описывают примеры соединений формулы (I')
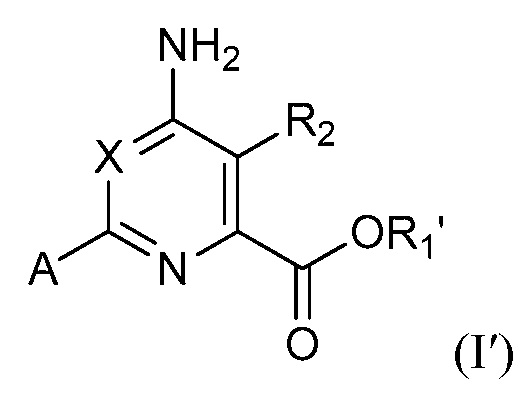
Таблица 10 представляет структуру, внешний вид, способ получения и предшественника(предшественников), используемого в синтезе иллюстративных соединений. Таблица 11 представляет физические данные для каждого из иллюстративных соединений.
[00109] Пустые места в представляющих соединения таблицах, означают водород или, что для A группы, указанной в данной конкретном ряду, графа, в которой имеется пустое место, не является актуальной.
Таблица 1
Соединения формулы (I') с индолильными концевыми группами
A представляет собой A3, A15, A27 или A28:
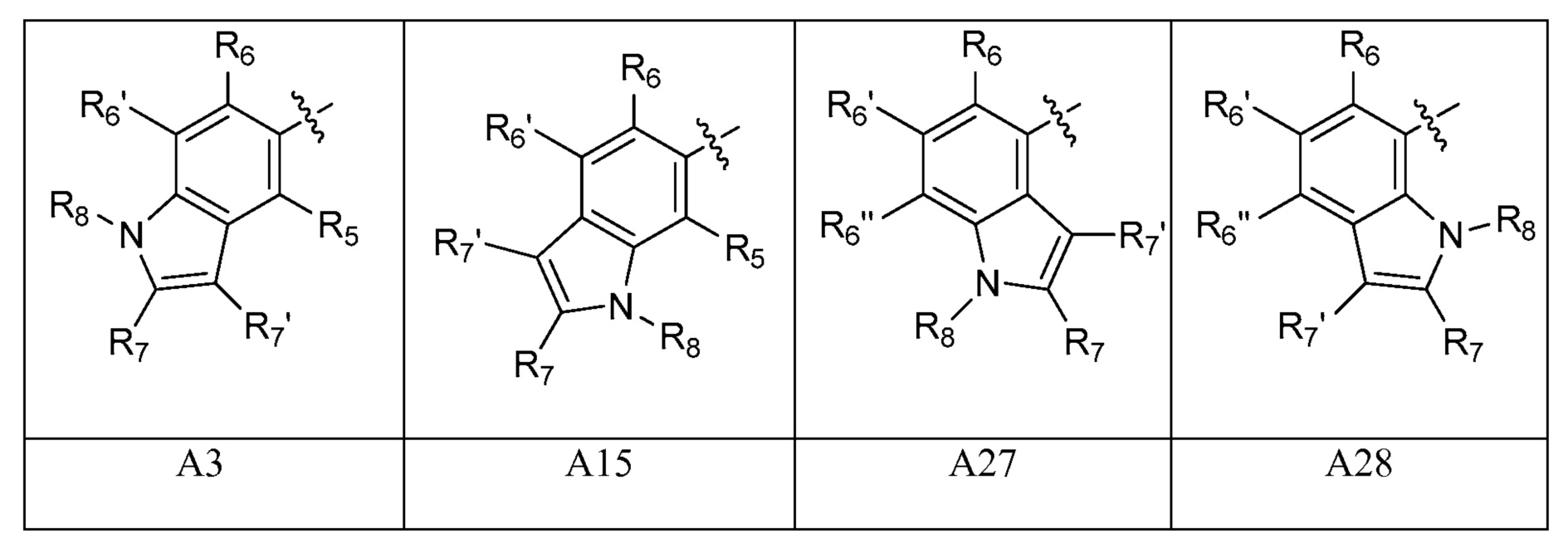
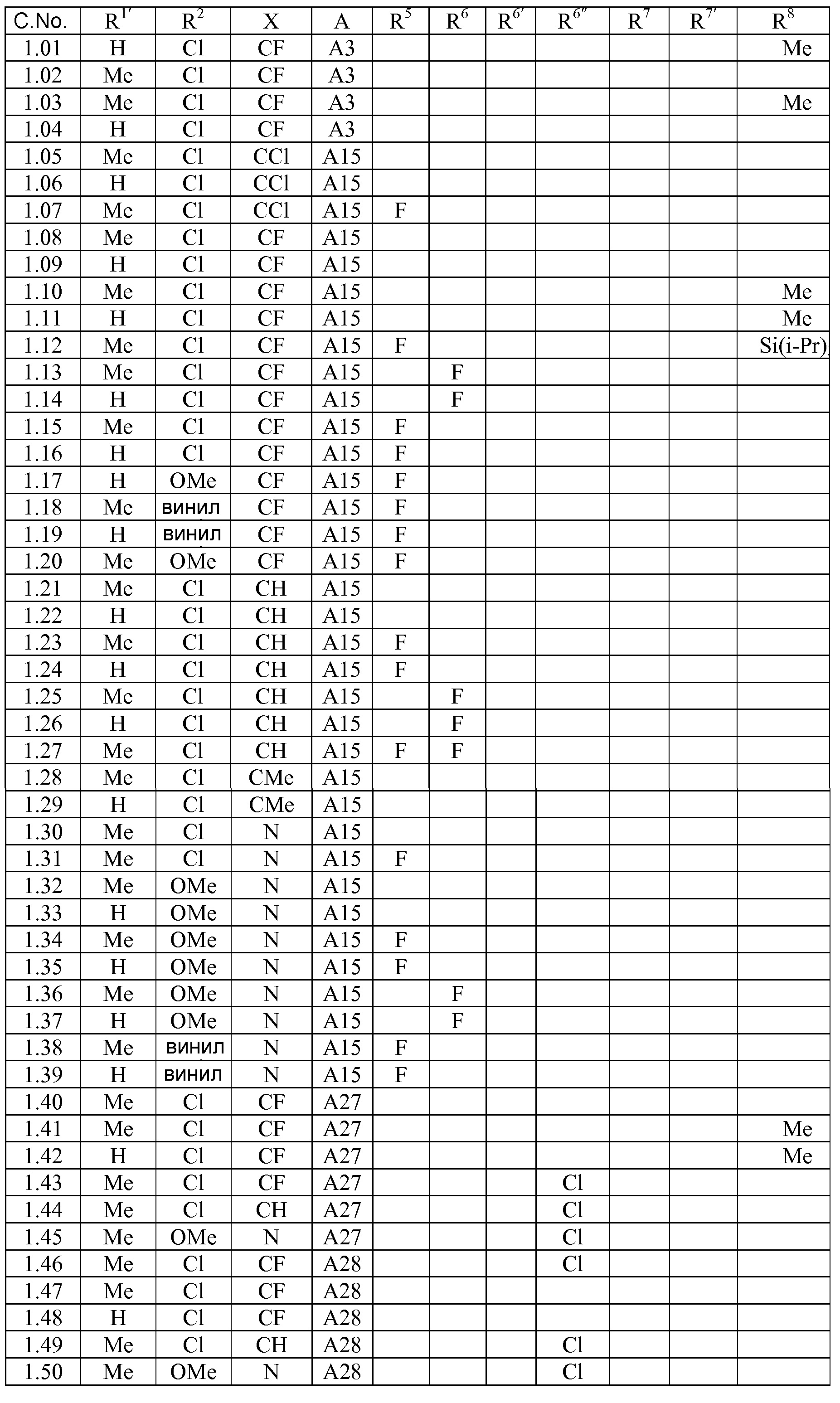
Таблица 2
Соединения формулы (I') с бензофуранильными концевыми группами
A представляет собой A1, A13, A21 или A22:
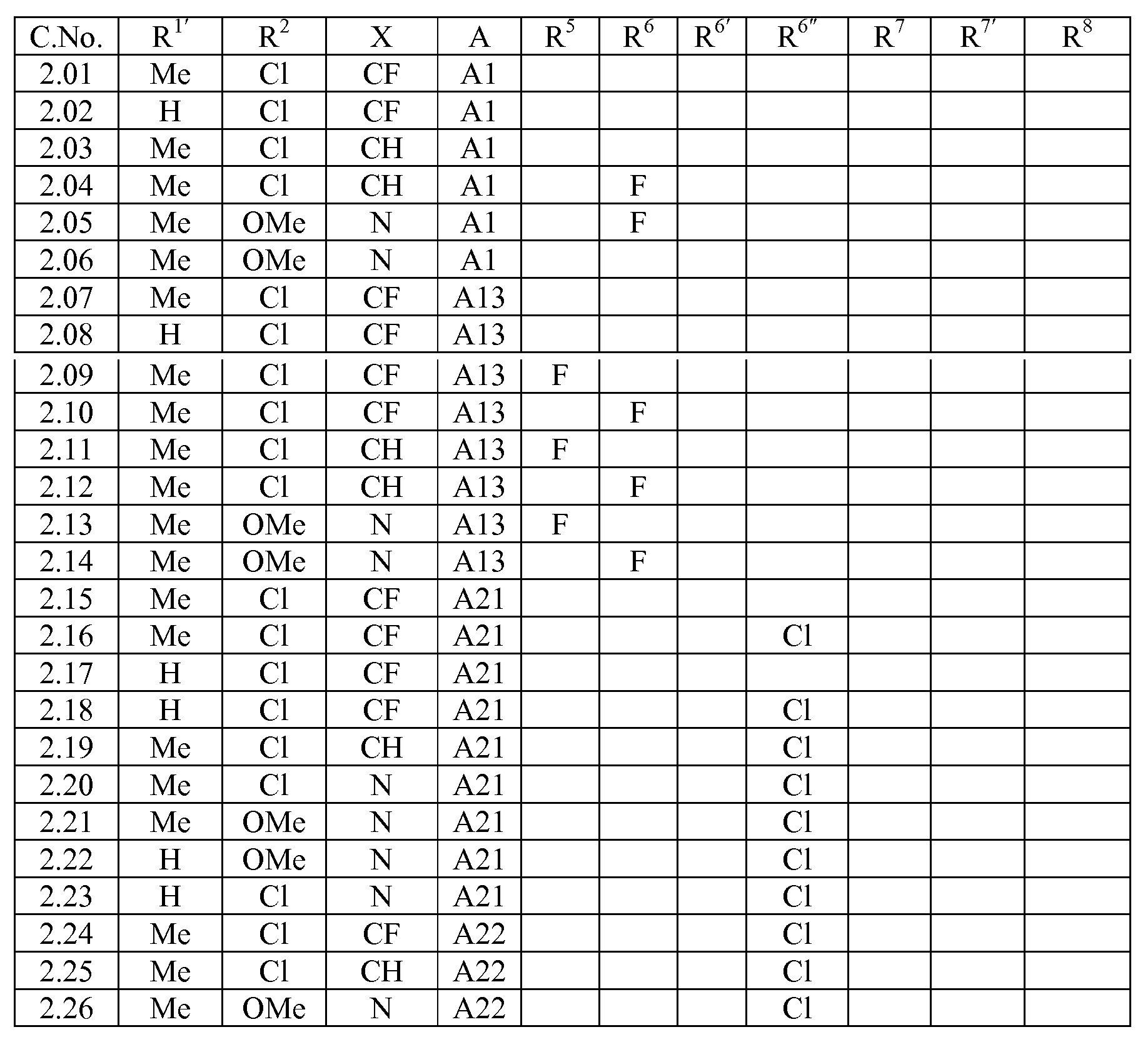
Таблица 3
Соединения формулы (I') с бензотиофуранильными концевыми группами
A представляет собой A2, A14, A23 или A24:
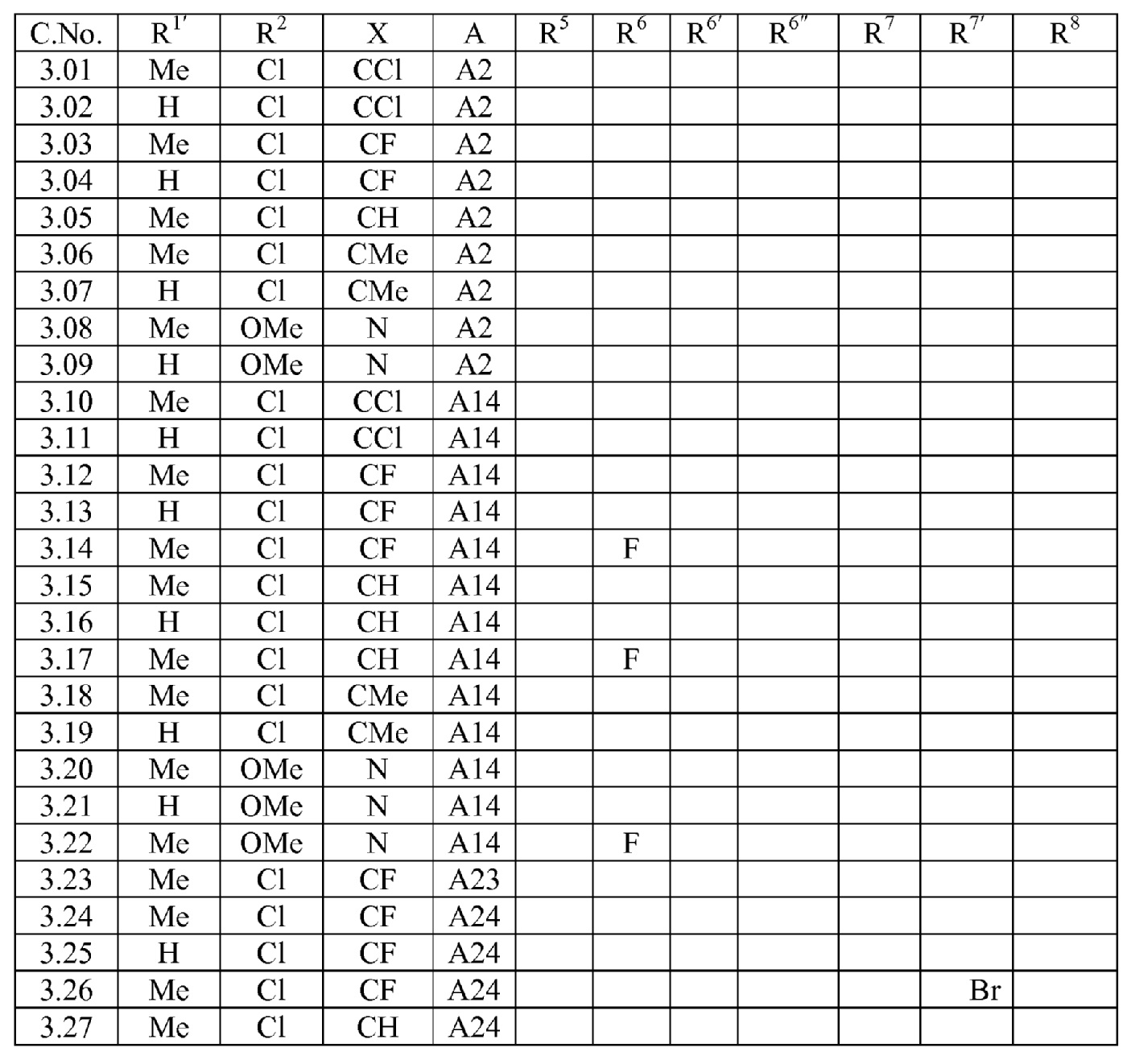
Таблица 4
Соединения формулы (I') с 1H-индазолильными концевыми группами
A представляет собой одну из групп A6, A18, A25 и A26:
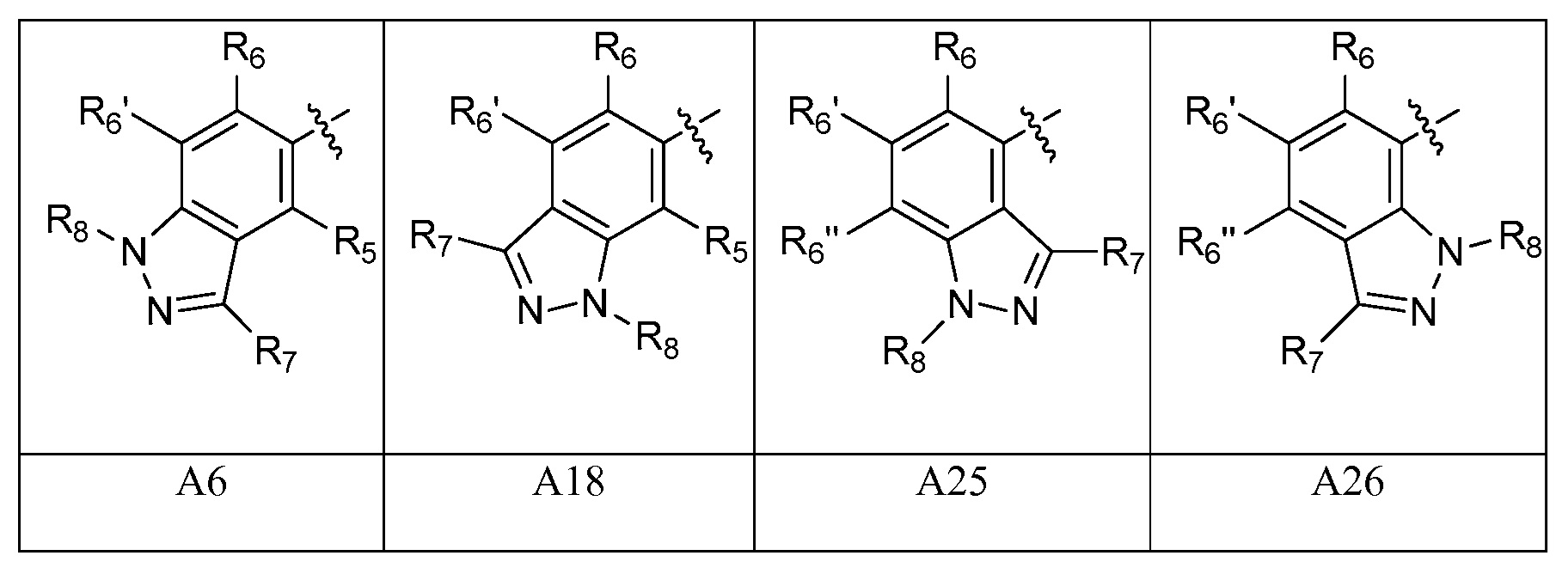
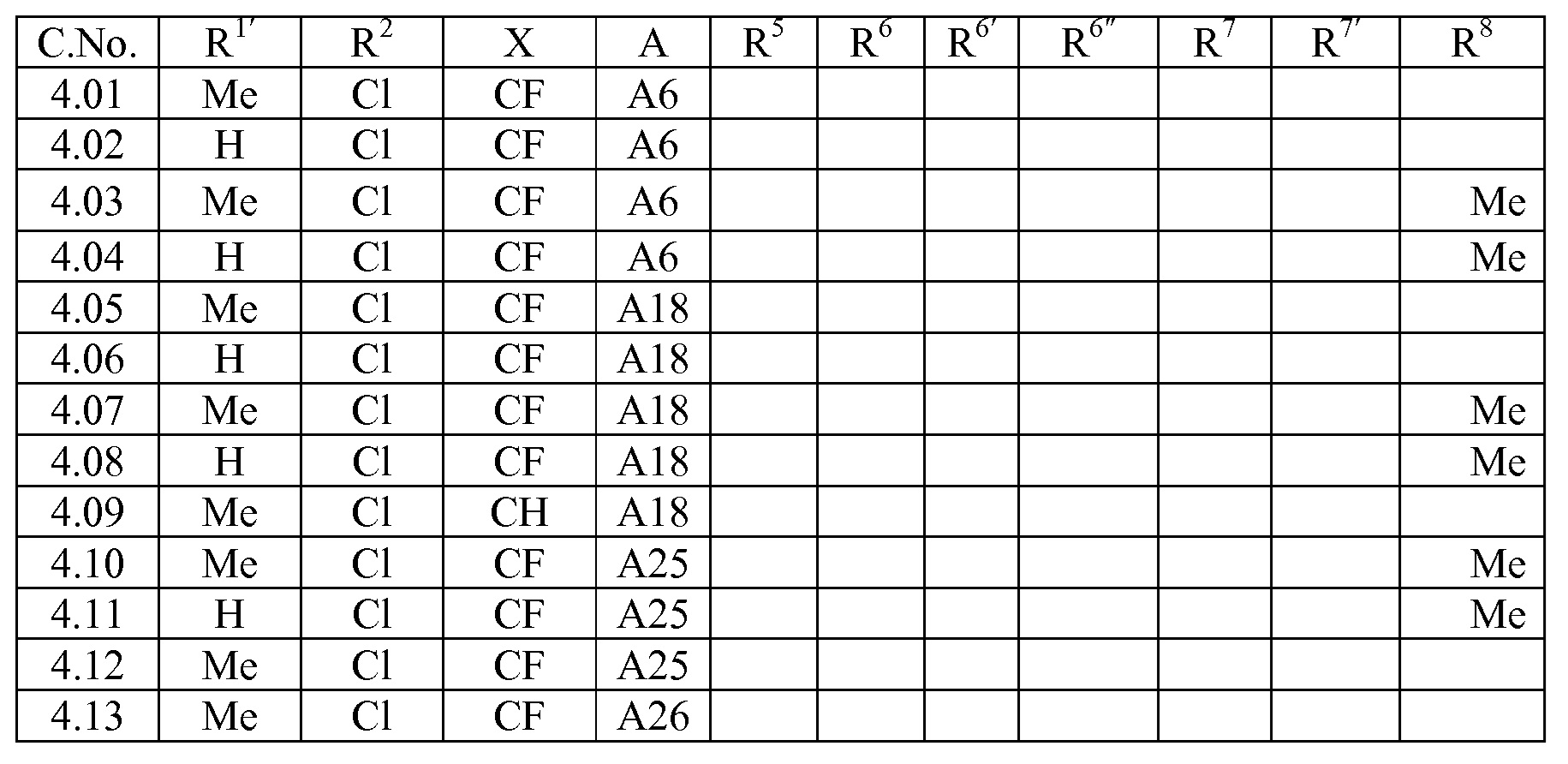
Таблица 5
Соединения формулы (I') с бензоксазолильными концевыми группами
A представляет собой A7, A9, A29 или A30:
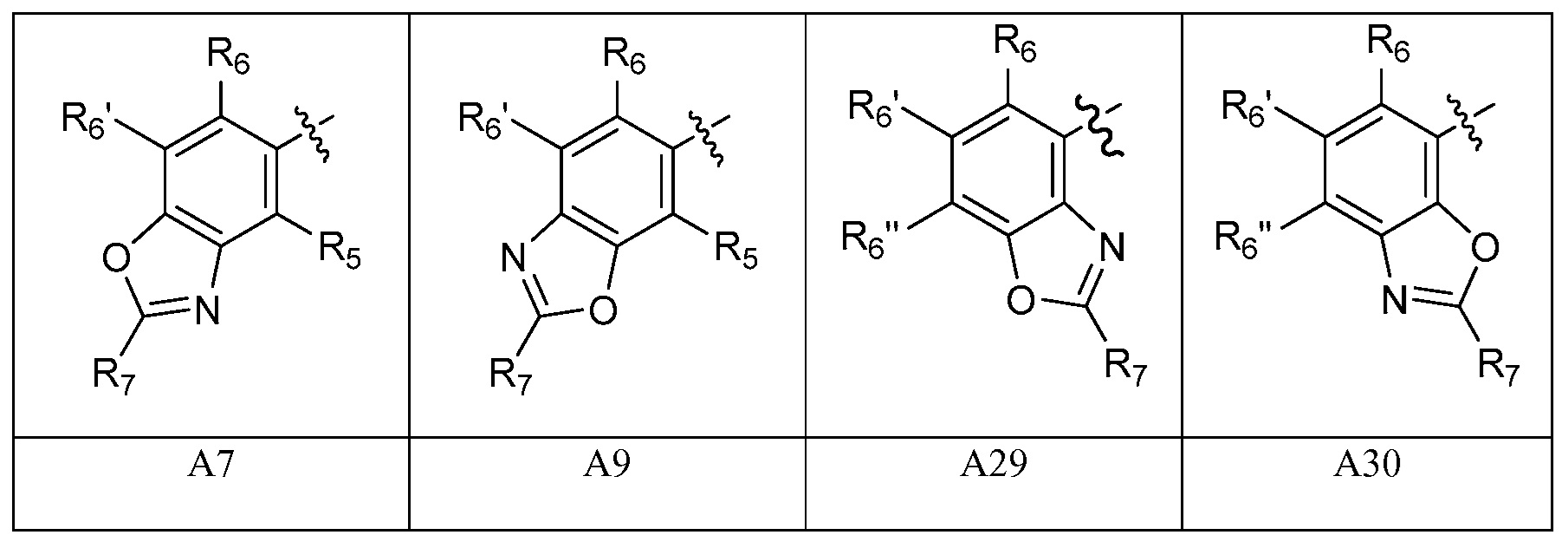

Таблица 6
Соединения формулы (I') с бензотиазолильными концевыми группами
A представляет собой A8, A10, A31 или A32:
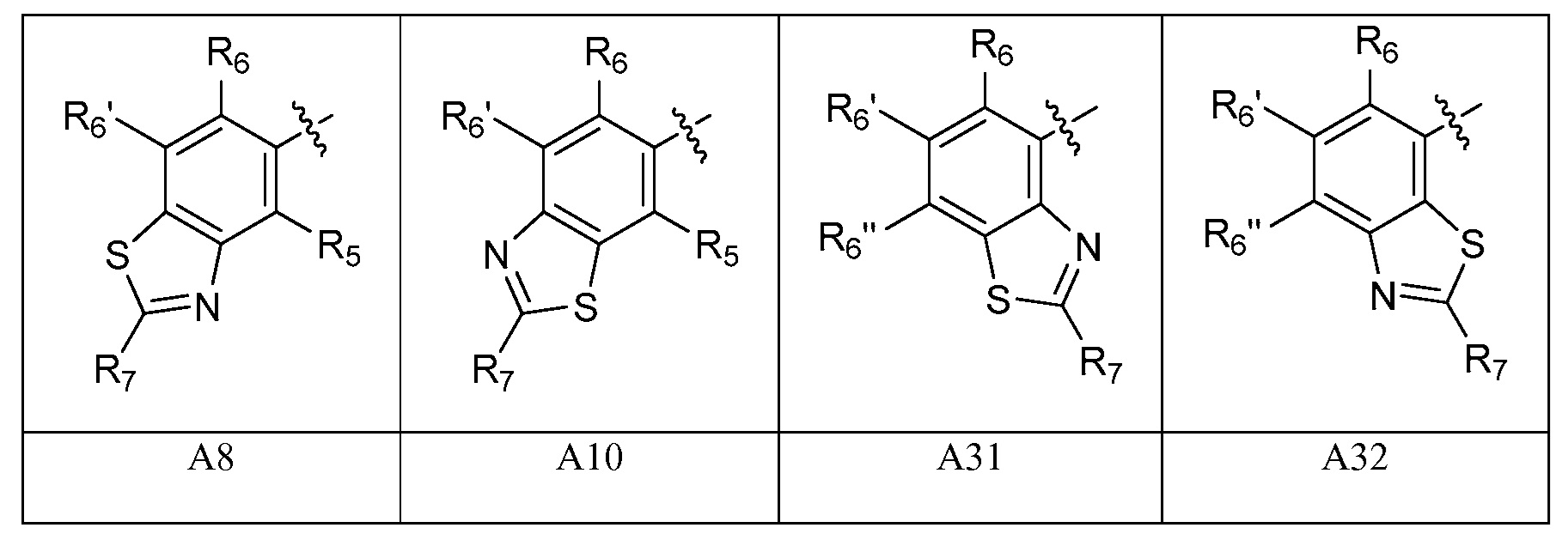
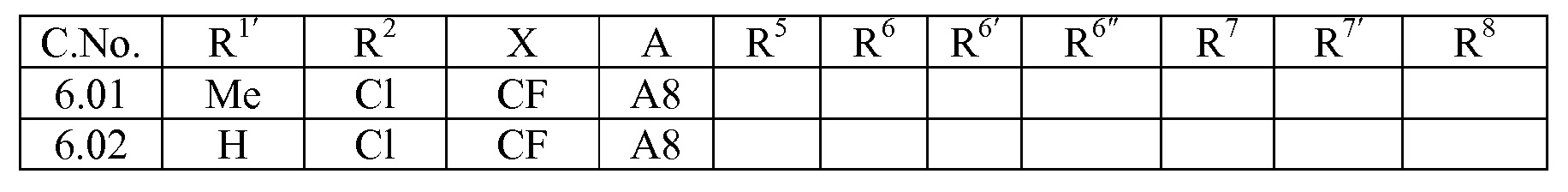
Таблица 7
Соединения формулы (I') с 1H-бензимидазолильными концевыми группами
A представляет собой одну из групп A11 и A12:
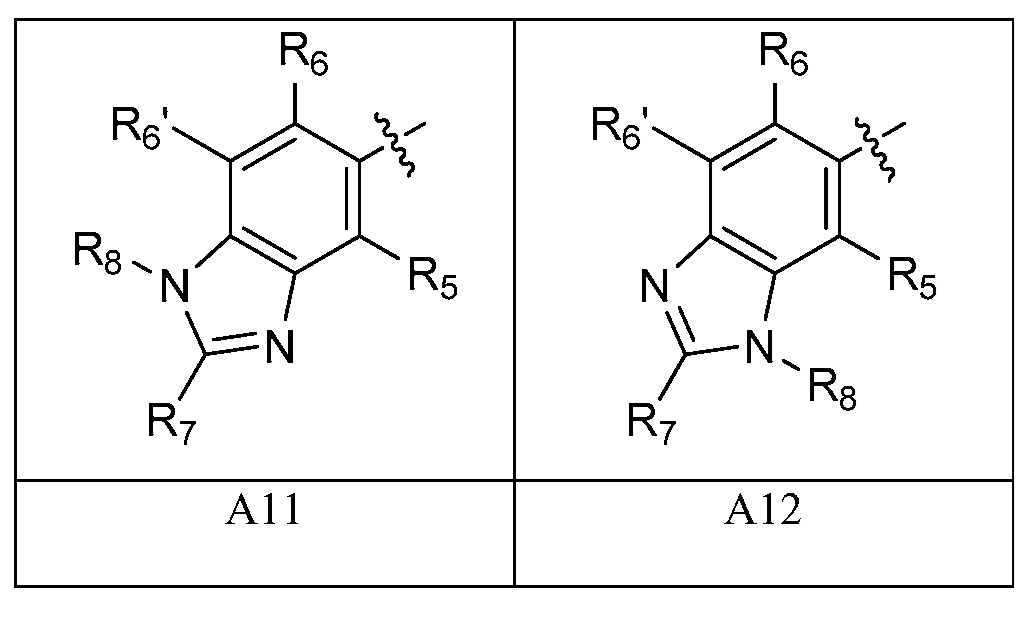
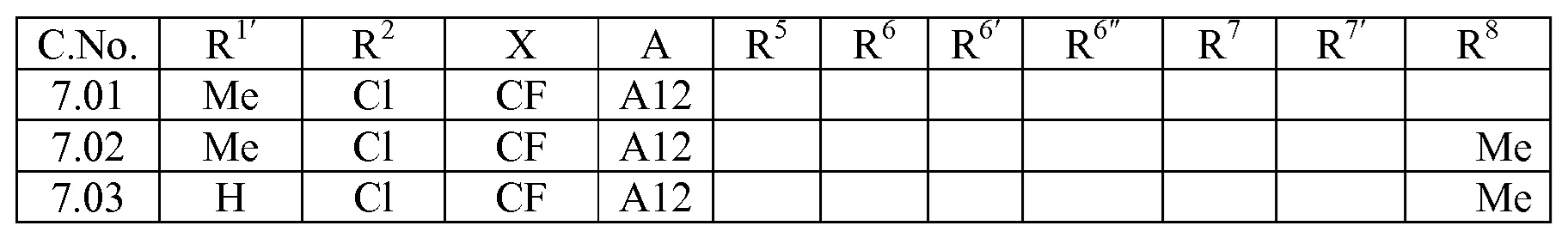
Таблица 8
Соединения формулы (I') с индоксазинильными концевыми группами
A представляет собой A4, A16, A33 или A34:
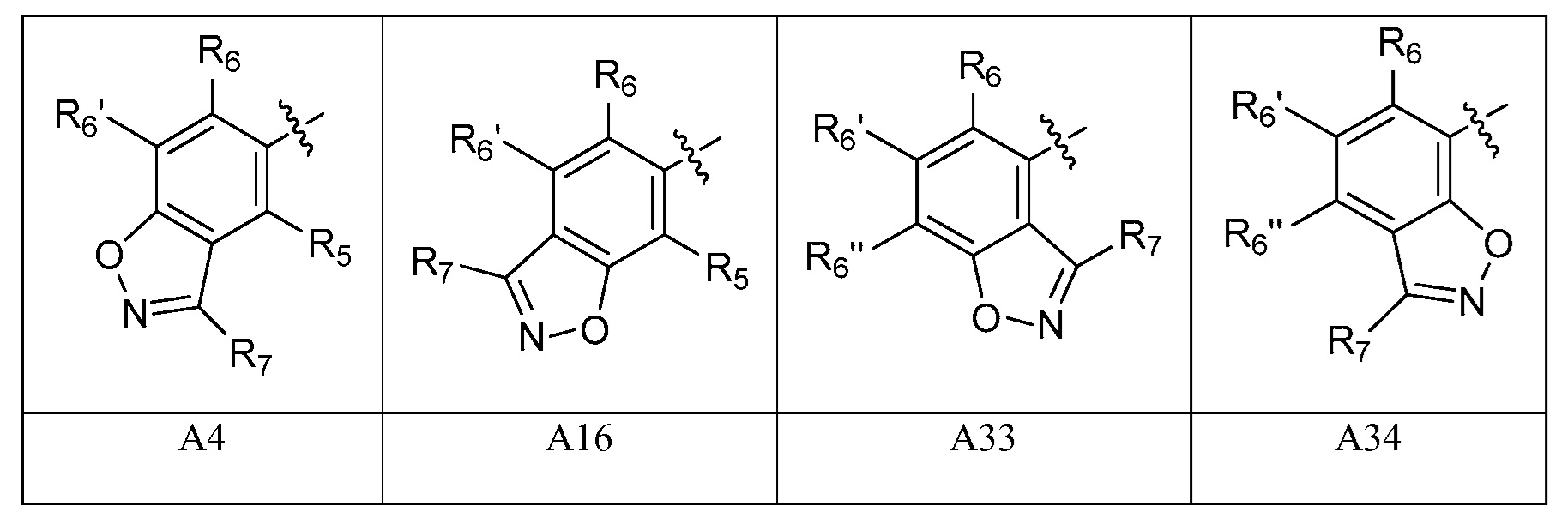

Таблица 9
Соединения формулы (I') с 1H-бензотриазолильными концевыми группами
A представляет собой A19 или A20:
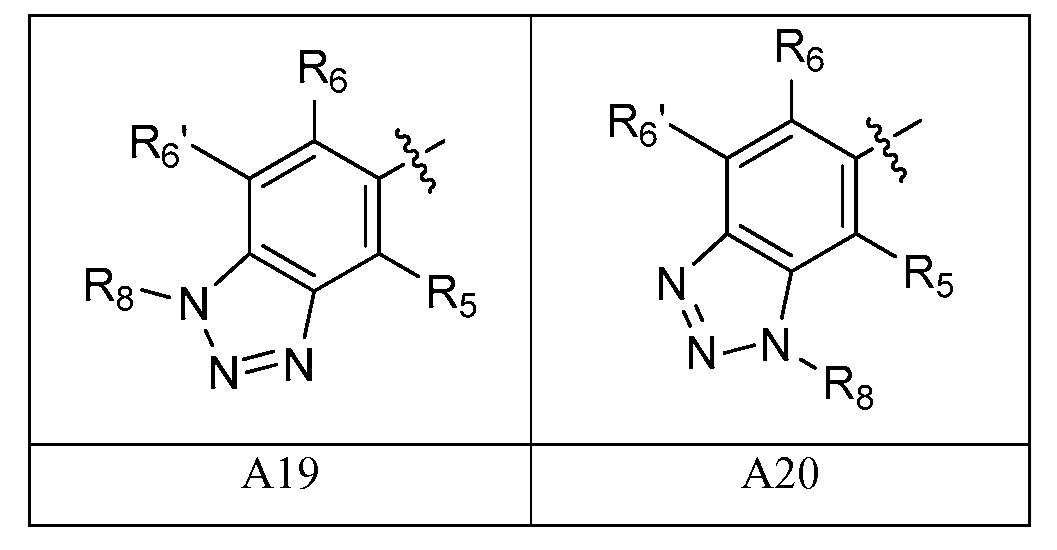

СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ
[00110] Примеры процедур для синтеза соединений формулы (I) представлены ниже.
[00111] 4-Амино-6-(гетероциклические)пиколиновые кислоты формулы (I) можно получить различными путями. Как показано на Схеме I, 4-амино-6-хлорпиколинаты формулы (II) могут быть преобразованы в 4-амино-6-замещенные-пиколинаты формулы (III), где Ar имеет значение, определенное выше, через реакцию сочетания Сузуки с бороновой кислотой или сложным эфиром, в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярных протонных растворителей, такой как ацетонитрил-вода, при температуре, такой как 110°C, например, в микроволновом реакторе (реакция a1). 4-Амино-6-замещенные-пиколинаты формулы (III) можно преобразовать в 5-иод-4-амино-6-замещенные-пиколинаты формулы (IV) через взаимодействие с иодирующими реагентами, такими как периодная кислота и иод, в полярном протонном растворителе, таком как метиловый спирт (реакция b1). Реакция сочетания по методу Стилле 5-иод-4-амино-6-замещенные-пиколинатов формулы (IV) со станнаном, таким как тетраметилолово, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как 120-130°C, например, в микроволновом реакторе, обеспечивает 5-(замещенные)-4-амино-6-замещенные-пиколинаты формулы (I-A), где Z1 представляет собой алкил, алкенил, алкинил, галогеналкенил и алкилтио (реакция c1).
[00112] Альтернативно, 4-амино-6-хлорпиколинаты формулы (II) можно преобразовать в 5-иод-4-амино-6-хлорпиколинаты формулы (V) через взаимодействие с иодирующими реагентами, такими как периодная кислота и иод, в полярном протонном растворителе, таком как метиловый спирт (реакция b2). Реакция сочетания по методу Стилле 5-иод-4-амино-6-хлорпиколинатов формулы (V) со станнаном, таким как тетраметилолово, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как 120-130°C, например, в микроволновом реакторе, обеспечивает 5-(замещенные)-4-амино-6-хлорпиколинаты формулы (VI), где Z1 представляет собой алкил, алкенил, алкинил, галогеналкенил и алкилтио (реакция c2). 5-замещенные-4-амино-6-хлорпиколинаты формулы (VI) могут быть преобразованы в 5-замещенные-4-амино-6-замещенные-пиколинаты формулы (I-A), где Ar имеет значение, определенное выше, через реакцию сочетания Сузуки с бороновой кислотой или сложным эфиром, в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярных протонных растворителей, такой как ацетонитрил-вода, при температуре, такой как 110°C, например, в микроволновом реакторе (реакция a2).
Схема I
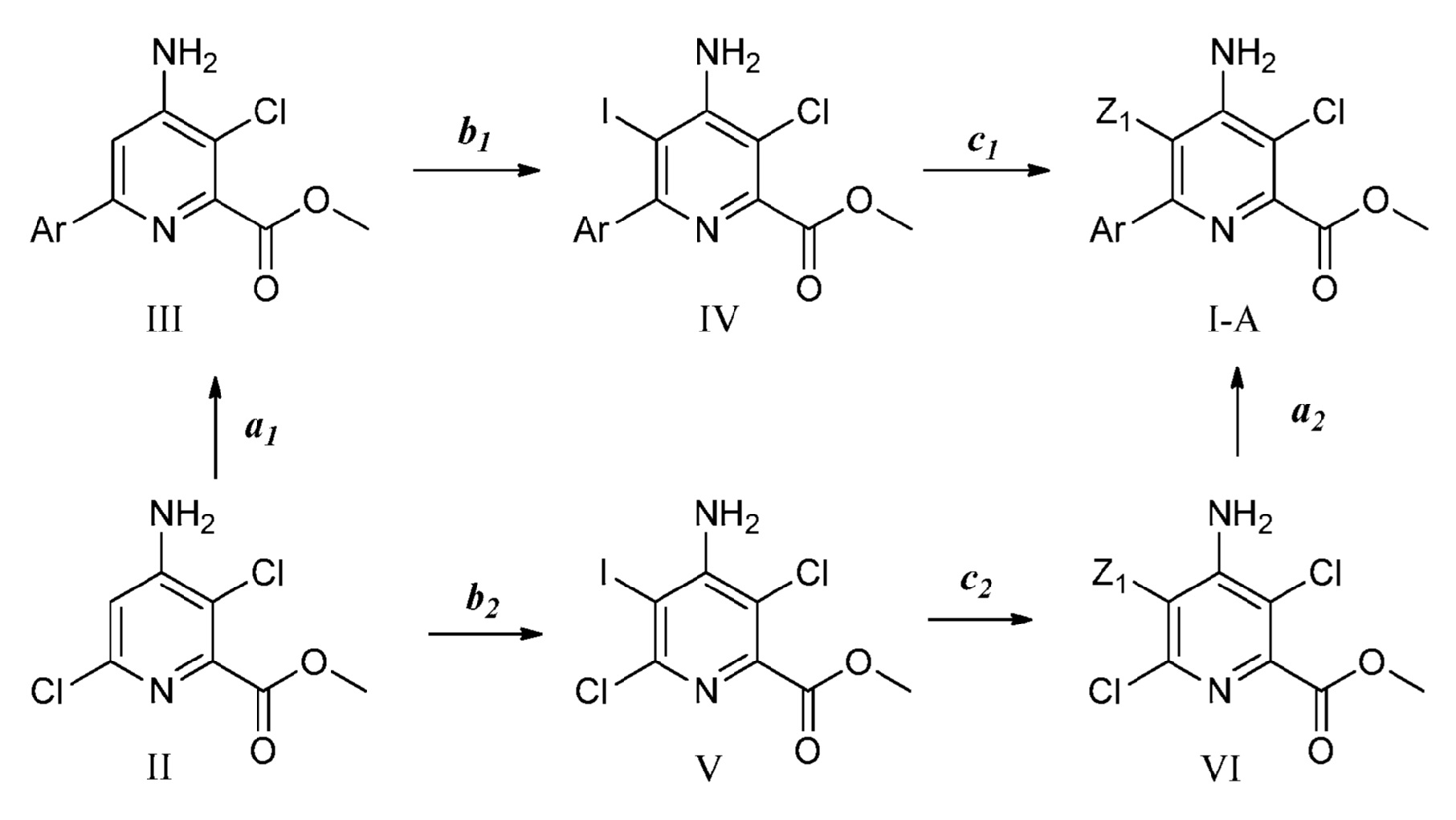
[00113] Как показано в Схеме II, 4,5,6-трихлорпиколинат формулы (VII) может быть преобразован в соответствующий изопропиловый эфир формулы (VIII), через взаимодействие с изопропиловым спиртом и концентрированной серной кислотой, например, при температуре кипения с обратным холодильником с использованием ловушки Дина-Старка (реакция d). Изопропиловый эфир формулы (VIII) можно подвергнуть взаимодействию с источником фторидного иона, такие как фторид цезия, в полярном апротонном растворителе, таком как диметилсульфоксид (DMSO), при температуре, такой как 80°C, с использованием ловушки Дина-Старка, с получением изопропил 4,5,6-трифторпиколината формулы (IX) (реакция e). Изопропил 4,5,6-трифторпиколинат формулы (IX) можно подвергнуть аминированию с использованием источника азота, такого как аммиак, в полярном апротонном растворителе, таком как DMSO, с получением 4-амино-5,6-дифторпиколината формулы (X) (реакция f). Фтор-заместитель в 6-положении 4-амино-5,6-дифторпиколината формулы (X) может быть обменен на хлор-заместитель путем обработки хлоридным источником, таким как хлористый водород, например, в диоксане, в реакторе Парра, при температуре, такой как 100°C, с получением 4-амино-5-фтор-6-хлор-пиколината формулы (XI) (реакция g). 4-Амино-5-фтор-6-хлорпиколинат формулы (XI) можно подвергнуть реакции переэтерификации с получением соответствующего метилового эфира формулы (XII) путем взаимодействия с изопропоксидом титана(IV) в метиловом спирте при температуре кипения с обратным холодильником (реакция h).
Схема II
[00114] Как показано на Схеме III, 4-амино-5-фтор-6-хлорпиколинат формулы (XII) можно преобразовать в 3-иод-4-амино-5-фтор-6-хлорпиколинат формулы (XIII) через взаимодействие с иодирующими реагентами, такими как периодная кислота и иод, в полярном протонном растворителе, таком как метиловый спирт (реакция b3). Реакция сочетания по методу Стилле 3-иод-4-амино-5-фтор-6-хлорпиколинатов формулы (XIII) со станнаном, таким как трибутил(винил)станнан, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как 120-130°C, например, в микроволновом реакторе, обеспечивает 3-(замещенные)-4-амино-5-фтор-6-хлорпиколинаты формулы (XIV), где R2 представляет собой алкил, алкенил, алкинил, галогеналкенил и алкилтио (реакция c3). Альтернативно, 3-иод-4-амино-5-фтор-6-хлорпиколинаты формулы (XIII) можно обработать карбонатом цезия и каталитическим количеством иодида меди(I) и 1,10-фенантролина в присутствии полярного протонного растворителя, такого как метиловый спирт, при температуре, такой как 65°C, с получением 3-(замещенных)-4-амино-5-фтор-6-хлорпиколиновых кислот формулы (XIV), где R2 представляет собой алкокси или галогеналкокси (реакция i1), которые можно подвергнуть этерификации, с получением метиловых сложных эфиров, например, путем обработки хлористым водородом (газ) и метиловым спиртом при 50°C (реакция j1). 3-(Замещенные)-4-амино-5-фтор-6-хлорпиколинаты формулы (XIV) могут быть преобразованы в 4-амино-6-замещенные-пиколинаты формулы (I-B), где Ar имеет значение, определенное выше, через реакцию сочетания Сузуки с бороновой кислотой или сложным эфиром, в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярных протонных растворителей, такой как ацетонитрил-вода, при температуре, такой как 110°C, например, в микроволновом реакторе (реакция a3).
[00115] Альтернативно, 4-амино-5-фтор-6-хлорпиколинаты формулы (XII) могут быть преобразованы в 4-амино-5-фтор-6-замещенные-пиколинаты формулы (XV), где Ar имеет значение, определенное выше, через реакцию сочетания Сузуки с бороновой кислотой или сложным эфиром, в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярных протонных растворителей, такой как ацетонитрил-вода, при температуре, такой как 110°C, например, в микроволновом реакторе (реакция a4). 4-Амино-5-фтор-6-замещенные-пиколинаты формулы (XV) можно преобразовать в 3-иод-4-амино-5-фтор-6-замещенные-пиколинаты формулы (XVI) через взаимодействие с иодирующими реагентами, такими как периодная кислота и иод, в полярном протонном растворителе, таком как метиловый спирт (реакция b4). Реакция сочетания по методу Стилле 3-иод-4-амино-5-фтор-6-замещенных-пиколинатов формулы (XVI) со станнаном, таким как трибутил(винил)станнан, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как 120-130°C, например, в микроволновом реакторе, обеспечивает 3-(замещенные)-4-амино-5-фтор-6-замещенные-пиколинаты формулы (I-B), где R2 представляет собой алкил, алкенил, алкинил, галогеналкенил и алкилтио (реакция c4). Альтернативно, 3-иод-4-амино-5-фтор-6-замещенные-пиколинаты формулы (XVI) можно обработать карбонатом цезия и каталитическим количеством иодида меди(I) и 1,10-фенантролина в присутствии полярного протонного растворителя, такого как метиловый спирт, при температуре, такой как 65°C, с получением 3-(замещенных)-4-амино-5-фтор-6-замещенных-пиколиновых кислот формулы (I-B), где R2 представляет собой алкокси или галогеналкокси (реакция i2), которые можно подвергнуть этерификации, с получением метиловых сложных эфиров, например, путем обработки хлористым водородом (газ) и метиловым спиртом при температуре, такой как 50°C (реакция j2).
Схема III
[00116] Как показано в Схема IV, 4-ацетамидо-6-(триметилстаннил)пиколинаты формулы (XVII) могут быть преобразованы в 4-ацетамидо-6-замещенные-пиколинаты формулы (XVIII), где Ar имеет значение, определенное выше, через реакцию сочетания по методу Стилле с арилбромидом или арилиодидом в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в растворителе, таком как 1,2-дихлорэтан, например, при температуре кипения с обратным холодильником (реакция k). 4-Амино-6-замещенные-пиколинаты формулы (I-C), где Ar имеет значение, определенное выше, можно синтезировать из 4-ацетамидо-6-замещенных-пиколинатов формулы (XVIII) с использованием стандартных способов удаления защиты, например, с использованием газообразного хлористого водорода в метаноле (реакция л).
Схема IV
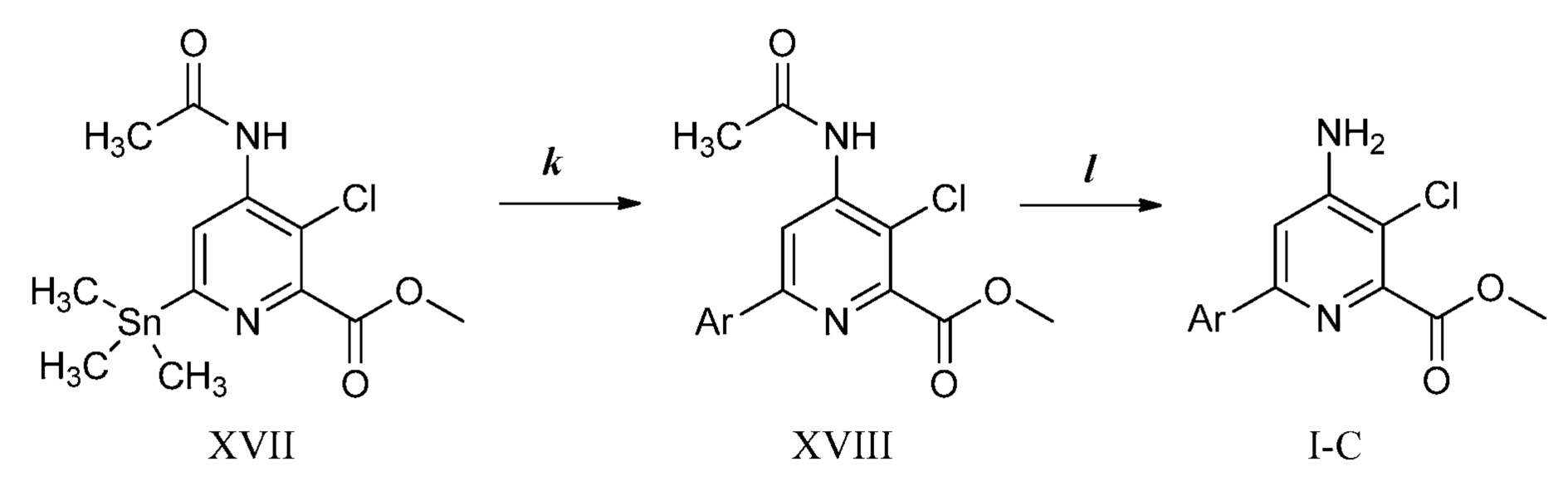
[00117] Как показано на Схеме V, 2,4-дихлор-5-метоксипиримидин (XIX) можно преобразовать в 2,4-дихлор-5-метокси-6-винилпиримидин (XX) через взаимодействие с винилмагнийбромидом в полярном апротонном растворителе, таком как тетрагидрофуран (реакция m). 2,4-Дихлор-5-метокси-6-винилпиримидин (XX) можно преобразовать в 2,6-дихлор-5-метоксипиримидин-4-карбоксальдегид (XXI) путем обработки озоном, например, в смеси растворителей дихлорметан:метанол (реакция n). 2,6-Дихлор-5-метоксипиримидин-4-карбоксальдегид (XXI) можно преобразовать в метил 2,6-дихлор-5-метоксипиримидин-4-карбоксилат (XXII) путем обработки бромом, например, в смеси растворителей метанол:вода (реакция o). Метил 2,6-дихлор-5-метоксипиримидин-4-карбоксилат (XXII) можно преобразовать в метил 6-амино-2-хлор-5-метоксипиримидин-4-карбоксилат (XXIII) путем обработки аммиаком (например, 2 эквивалентов) в растворителе, таком как DMSO (реакция p). Наконец, 6-амино-2-замещенные-5-метоксипиримидин-4-карбоксилаты формулы (I-D), где Ar имеет значение, определенное выше, можно получить через реакцию сочетания Сузуки с бороновой кислотой или сложным эфиром, с 6-амино-2-хлор-5-метоксипиримидин-4-карбоксилатом (XXIII), в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярных протонных растворителей, такой как ацетонитрил-вода, при температуре, такой как 110°C, например, в микроволновом реакторе (реакция a5).
Схема V
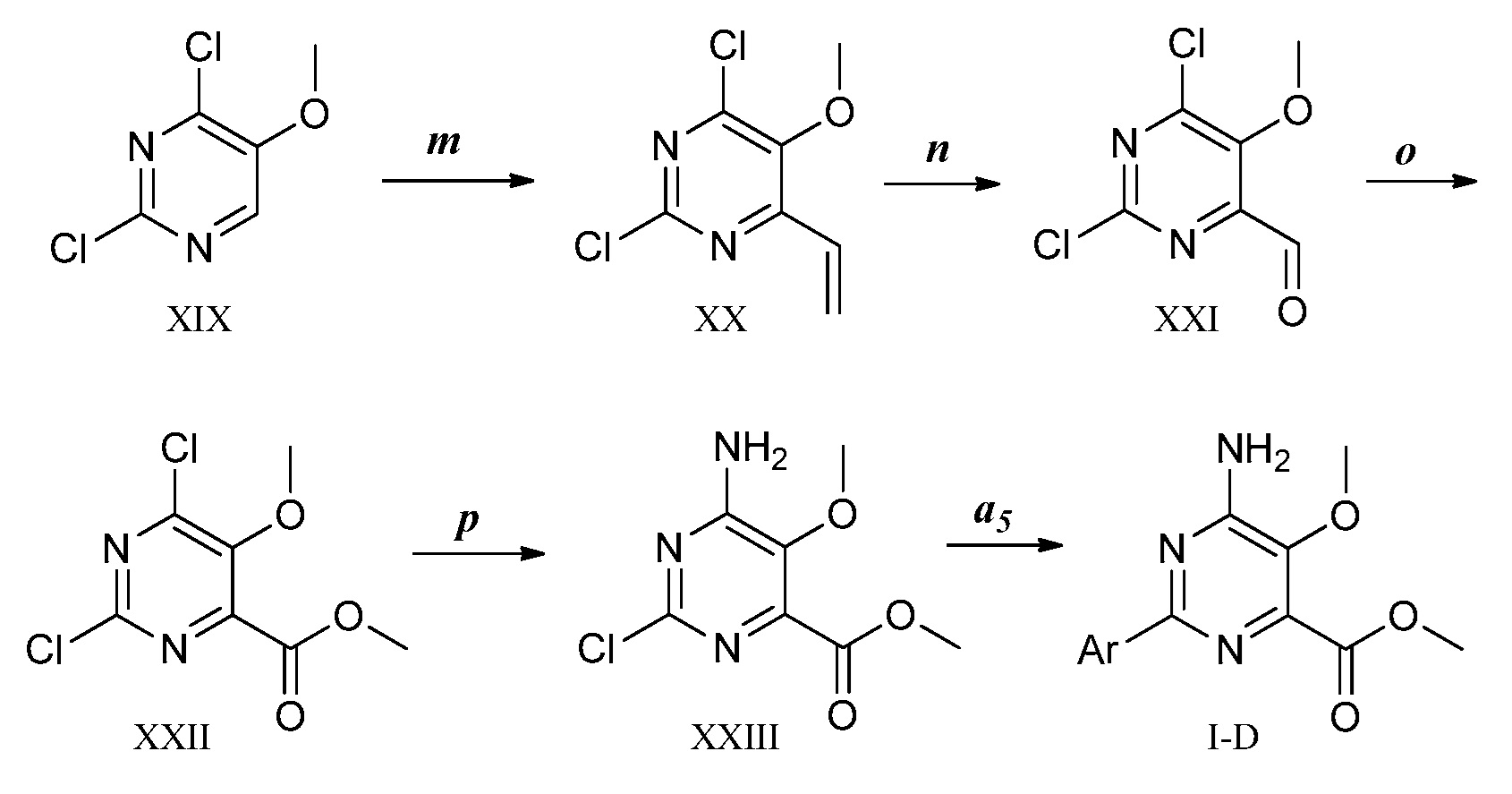
[00118] Соединения формулe I-A, I-B, I-C и I-D, полученные любым из этих способов, могут быть выделены обычными способами и очищены с использованием стандартных процедур, например, при помощи перекристаллизации или хроматографии. Соединения формулы (I) можно получить из соединений формул I-A, I-B, I-C и I-D с использованием стандартных способов, хорошо известных в данной области.
КОМПОЗИЦИИ И СПОСОБЫ
[00119] В некоторых вариантах осуществления, соединения, представленные настоящей заявке, используют в смесях, содержащих гербицидно эффективное количество соединения вместе с по меньшей мере одним сельскохозяйственно приемлемым адъювантом или носителем. Подходящие адъюванты или носители включают такие, которые не являются фитотоксичными или существенно фитотоксичными для полезных сельскохозяйственных культур, например, при концентрациях, используемых для внесения композиций для селективного контроля сорняков в присутствии сельскохозяйственных культур, и/или не взаимодействуют или существенно не взаимодействуют химически с соединениями, представленными настоящей заявке, или другими ингредиентами композиции. Такие смеси могут быть предназначены для непосредственного нанесения на сорняки или место их произрастания, или могут представлять собой концентраты или составы, которые разбавляют дополнительными носителями и адъювантами перед применением. Они могут представлять собой твердые вещества, такие как, например, дусты, гранулы, вододиспергируемые гранулы или смачиваемые порошки, или жидкости, такие как, например, эмульгируемые концентраты, растворы, эмульсии или суспензии. Они также могут быть представлены в виде премикса или баковой смеси.
[00120] Подходящие сельскохозяйственные адъюванты и носители, которые являются полезными для получения гербицидных смесей в соответствии с настоящим изобретением, хорошо известны специалистам в данной области. Некоторые из этих адъювантов включают, но не ограничиваются этим, маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом(минеральное масло (85%) + эмульгатор (15%)); нонилфенол этоксилат; бензилкокоалкилдиметил четвертичная аммониевая соль; смесь нефтяного углеводорода, алкиловых сложных эфиров, органической кислоты и анионного поверхностно-активного вещества; C9-C11 алкилполигликозид; фосфатированный этоксилированный спирт; натуральный первичный спирт (C12-C16) этоксилат; ди-втор-бутилфенол EO-PO блок-сополимер; полисилоксан с концевыми метильными блокирующими группами; нонилфенолэтоксилат + аммиакат мочевины и аммиачной селитры; эмульгированное метилированное масло из семян растений; тридециловый спирт (синтетический) этоксилат (8EO); таллоуаминэтоксилат (15 EO); ПЭГ(400) диолеат-99.
[00121] Жидкие носители, которые можно использовать, включают воду и органические растворители. Органические растворители включают, но не ограничиваются этим, нефтяные фракции или углеводороды, такие как минеральное масло, ароматические растворители, парафиновые масла и т.п.; растительные масла, такие как соевое масло, рапсовое масло, оливковое масло, касторовое масло, подсолнечное масло, кокосовое масло, кукурузное масло, масло семян хлопчатника, льняное масло, пальмовое масло, арахисовое масло, сафлоровое масло, кунжутное масло, тунговое масло и т.п.; сложные эфиры указанных выше растительных масел; сложные эфиры одноатомных спиртов или двухатомных, трехатомных или других низших полиспиртов (4-6 гидрокси-содержащие), такие как 2-этилгексилстеарат, н-бутилолеат, изопропилмиристат, пропиленгликольдиолеат, ди-октилсукцинат, ди-бутиладипат, ди-октилфталат и т.п.; сложные эфиры моно-, ди- и поликарбоновых кислот и т.п. Конкретные органические растворители включают толуол, ксилол, лигроин, растительное масло, ацетон, метилэтилкетон, циклогексанон, трихлорэтилен, перхлорэтилен, этилацетат, амилацетат, бутилацетат, монометиловый эфир пропиленгликоля и монометиловый эфир диэтиленгликоля, метиловый спирт, этиловый спирт, изопропиловый спирт, амиловый спирт, этиленгликоль, пропиленгликоль, глицерин, N-метил-2-пирролидинон, N,N-диметилалкиламиды, диметилсульфоксид, жидкие удобрения и т.п. В некоторых вариантах осуществления носитель для разбавления концентратов представляет собой воду.
[00122] Подходящие твердые носители включают тальк, пирофиллитовую глину, диоксид кремния, аттапульгитовую глину, каолиновую глину, кизельгур, мел, диатомовую землю, известь, карбонат кальция, бентонитовую глину, фуллерову землю, оболочки семян хлопчатника, пшеничную муку, соевую муку, пемзу, древесную муку, муку из ореховой скорлупы, лигнин, целлюлозу и т.п.
[00123] В некоторых вариантах осуществления в композиции, описанные в настоящей заявке, включают одно или несколько поверхностно-активных веществ. В некоторых вариантах осуществления такие поверхностно-активные вещества используют как в твердых, так и жидких композициях, например, в таких, которые необходимо разбавлять носителем перед применением. Поверхностно-активные вещества могут быть анионного, катионного или неионного типа, и их можно использовать в качестве эмульгаторов, смачивающих веществ, суспендирующих веществ или для других целей. Поверхностно-активные вещества, которые также можно использовать в композициях по настоящему изобретению, описаны, inter alia, в «McCutcheon's Detergents and Emulsifiers Annual», MC Publishing Corp., Ridgewood, New Jersey, 1998, и в «Encyclopedia of Surfactants», Vol. I-III, Chemical Publishing Co., New York, 1980-81. Типичные поверхностно-активные вещества включают соли алкилсульфатов, такие как лаурилсульфат диэтанол-аммония; алкиларилсульфонатные соли, такие как додецил-бензол-сульфонат кальция; продукты присоединения алкилфенола-алкиленоксида, такие как нонилфенол-C18 этоксилат; продукты присоединения спирта-алкиленоксида, такие как тридециловый спирт-C16 этоксилат; мыла, такие как стеарат натрия; алкил-нафталин-сульфонатные соли, такие как дибутил-нафталинсульфонат натрия; диалкиловые эфиры сульфосукцинатных солей, такие как ди(2-этилгексил)сульфосукцинат натрия; сложные эфиры сорбита, такие как сорбитололеат; четвертичные амины, такие как лаурилтриметил-аммонийхлорид; полиэтиленгликолевые сложные эфиры жирных кислот, такие как полиэтиленгликольстеарат; блок-сополимеры этиленоксида и пропиленоксида; соли моно- и диалкилфосфатных сложных эфиров; растительные или семечковые масла, такие как соевое масло, рапсовое/каноловое масло, оливковое масло, касторовое масло, подсолнечное масло, кокосовое масло, кукурузное масло, масло семян хлопчатника, льняное масло, пальмовое масло, арахисовое масло, сафлоровое масло, кунжутное масло, тунговое масло и т.п.; и сложные эфиры указанных выше растительных масел, например, метиловые сложные эфиры.
[00124] Во многих случаях некоторые из этих веществ, такие как растительные или семечковые масла и их сложные эфиры, можно использовать взаимозаменяемо в качестве сельскохозяйственного адъюванта, в качестве жидкого носителя или в качестве поверхностно-активного вещества.
[00125] Другие адъюванты, традиционно используемые в сельскохозяйственных композициях, включают агенты совместимости, противовспенивающие добавки, комплексообразующие соединения, нейтрализующие вещества и буферы, ингибиторы коррозии, красители, отдушки, агенты рассеяния, вспомогательные вещества для улучшения пенетрации, агенты прилипания, диспергирующие вещества, загустители, вещества, понижающие температуру замерзания, противомикробные средства и т.п. Композиции также могут содержать другие совместимые компоненты, например, другие гербициды, регуляторы роста растений, фунгициды, инсектициды и т.п., и могут быть сформулированы с жидкими удобрениями или твердыми мелкими частицами удобрений в качестве носителя, такими как нитрат аммония, мочевина и т.п.
[00126] Концентрация активных ингредиентов в гербицидных композициях, описанных в настоящей заявке, как правило, составляет от около 0,001 до около 98 массовых процентов. Часто используют концентрацию от около 0,01 до около 90 массовых процентов. В композициях, предназначенных для использования в виде концентратов, активный ингредиент, как правило, присутствует в концентрации от около 5 до около 98 массовых процентов, предпочтительно от около 10 до около 90 массовых процентов. Такие композиции обычно разбавляют инертным носителем, таким как вода, перед применением. Разбавленные композиции, которые обычно наносят на сорняки или на участок, где растут сорняки, как правило, содержат, от около 0,0001 до около 1 массовых процентов активного ингредиента, предпочтительно содержат от около 0,001 до около 0,05 массовых процентов.
[00127] Композиции, описанные в настоящей заявке, можно наносить на сорняки или на участок, где растут сорняки, с использованием традиционных дустов для внесения в почву или опылений с воздуха, разбрызгивателей и машин для внесения гранулированных удобрений, путем добавления к воде для орошения или добавления в воду на рисовой плантации и другими традиционными способами, известными специалистам в данной области.
[00128] В некоторых вариантах осуществления, соединения и композиции, описанные в настоящей заявке, применяют в виде послевсходового нанесения, предвсходового нанесения или водного нанесения на заводненный рис-падди или внесения в водоемы (например, пруды, озера и течения) или путем контактного нанесения.
[00129] В некоторых вариантах осуществления, соединения и композиции, представленные в настоящей заявке, используют для борьбы с сорняками в сельскохозяйственных культурах, включая, но не ограничиваясь этим, цитрусовые, яблоневые, каучуковые деревья, масличные культуры, пальмы, лесные участки, посеянный семенами, посеянный в воду и пересаженный рис, пшеницу, ячмень, овес, рожь, сорго, кукурузу/маис, подножный корм, сенокосные земли, пастбищные угодья, землю под паром, дерн, фруктовые сады и виноградники, водные растения или пропашные культуры, а также несельскохозяйственные посадки, например, промышленное озеленение (IVM) и полосы отвода. В некоторых вариантах осуществления, соединения и композиции используют для борьбы с древесными растениями, широколистными и злаковыми сорняками или осокой.
[00130] В некоторых вариантах осуществления соединения и композиции, представленные в настоящей заявке, используют для борьбы с нежелательной растительностью в рисе. В некоторых вариантах осуществления нежелательная растительность представляет собой Brachiaria platyphylla (Groseb.) Nash (ветвянка широколистная, BRAPP), Digitaria sanguinalis (L.) Scop. (ползучий сорняк, DIGSA), Echin°Chloa crus-galli (L.) P. Beauv. (ежовник обыкновенный, ECHCG), Echin°Chloa colonum (L.) LINK (ежовник крестьянский, ECHCO), Echin°Chloa oryzoides (Ard.) Fritsch (горчица полевая ранняя, ECHOR), Echin°Chloa oryzicola (Vasinger) Vasinger (горчица полевая поздняя, ECHPH), Ischaemum rugosum Salisb. (saramollagrass, ISCRU), Lept°Chloa chinensis (L.) Nees (лептохлоя китайская, LEFCH), Lept°Chloa fascicularis (Lam.) Gray (лептохлоя бородатая, LEFFA), Lept°Chloa panicoides (Presl.) Hitchc. (лептохлоя амазонская, LEFPA), Panicum dichotomiflorum (L.) Michx. (просо осеннее, PANDI), Paspalum dilatatum Poir. (паспалум расширенный, PASDI), Cyperus difformis L. (сыть вееровидная мелкоцветная, CYPDI), Cyperus esculentus L. (сыть съедобная, земляной миндаль, CYPES), Cyperus iria L. (сыть вееровидная рисовая, CYPIR), Cyperus rotundus L. (сыть круглая, CYPRO), вид Ele°Charis (ELOSS), Fimbristylis miliacea (L.) Vahl (полынь холодная, FIMMI), Schoenoplectus juncoides Roxb. (камыш озерный японский, SCPJU), Schoenoplectus maritimus L. (камыш исполинский, SCPMA), Schoenoplectus mucronatus L. (камыш озерный, растущий на рисовом поле, SCPMU), вид Aeschynomene, (вика, AESSS), Alternanthera philoxeroides (Mart.) Griseb. (очереднопыльник филоксеровый, ALRPH), Alisma plantago-aquatica L. (частуха подорожниковая обыкновенная, ALSPA), вид Amaranthus, (растения семейства маревых и амарантовых, AMASS), Ammannia c°Ccinea Rottb. (аистник цикутовый, AMMCO), Eclipta alba (L.) Hassk. (нивяник обыкновенный, ECLAL), Heteranthera limosa (SW.) Willd./Vahl (ряска, HETLI), Heteranthera reniformis R. & P. (подорожник большой, HETRE), Ipomoea hederacea (L.) Jacq. (вьюнок пурпурный плющевидный, IPOHE), Lindernia dubia (L.) Pennell (бедренец малый ложный, LIDDU), Mon°Choria korsakowii Regel & Maack (одноцветные, MOOKA), Mon°Choria vaginalis (Burm. F.) C. Presl ex Kuhth, (одноцветные, MOOVA), Murdannia nudiflora (L.) Brenan (просянка, MUDNU), Polygonum pensylvanicum L., (горец перечный пенсильванский, POLPY), Polygonum persicaria L. (горец почечуйный, POLPE), Polygonum hydropiperoides Michx. (горец перечный, POLHP), Rotala indica (Willd.) Koehne (ротала индийская, ROTIN), вид Sagittaria, (стрелолист, SAGSS), Sesbania exaltata (Raf.) Cory/Rydb. Ex Hill (сесбания рослая, SEBEX) или Sphen°Clea zeylanica Gaertn. (сфеноклея цейлонская, SPDZE).
[00131] В некоторых вариантах осуществления, соединения и композиции, представленные в настоящей заявке, используют для борьбы с нежелательной растительностью в зерновых культурах. В некоторых вариантах осуществления нежелательная растительность представляет собой Alopecurus myosuroides Huds. (лисохвост мышехвостиковидный, ALOMY), Apera spica-venti (L.) Beauv. (метлица обыкновенная, APESV), Avena fatua L. (овсюг, AVEFA), Bromus tectorum L. (костер кровельный, BROTE), Lolium multiflorum Lam. (плевел многоцветковый, LOLMU), Phalaris minor Retz. (канареечник канарский малый, PHAMI), Poa annua L. (мятлик однолетний, POAAN), Setaria pumila (Poir.) Roemer & J.A. Schultes (лисохвост желтый, SETLU), Setaria viridis (L.) Beauv. (лисохвост зеленый, SETVI), Cirsium arvense (L.) Scop. (бодяк полевой, CIRAR), Galium aparine L. (подмаренник цепкий, GALAP), K°Chia scoparia (L.) Schrad. (кохия, KCHSC), Lamium purpureum L. (яснотка пурпурная, LAMPU), Matricaria recutita L. (ромашка лекарственная, MATCH), Matricaria matricarioides (Less.) Porter (ромашка непахучая, MATMT), Papaver rhoeas L. (мак обыкновенный, PAPRH), Polygonum convolvulus L. (горец вьющийся, POLCO), Salsola tragus L. (солянка русская, SASKR), Stellaria media (L.) Vill. (звездчатка средняя, STEME), Veronica persica Poir. (вероника персидская, VERPE), Viola arvensis Murr. (фиалка полевая, VIOAR) или Viola tricolor L. (фиалка лесная, VIOTR).
[00132] В некоторых вариантах осуществления соединения и композиции, представленные в настоящей заявке, используют для борьбы с нежелательной растительностью на выгонах и пастбищах. В некоторых вариантах осуществления нежелательная растительность представляет собой Ambrosia artemisiifolia L. (амброзия обыкновенная, AMBEL), Cassia obtusifolia (резуха канадская, CASOB), Centaurea maculosa auct. non Lam. (василек пятнистый, CENMA), Cirsium arvense (L.) Scop. (бодяк полевой, CIRAR), Convolvulus arvensis L. (вьюнок полевой, CONAR), Euphorbia esula L. (молочай острый, EPHES), Lactuca serriola L./Torn. (латук компасный, LACSE), Plantago lanceolata L. (подорожник, PLALA), Rumex obtusifolius L. (щавель туполистный, RUMOB), Sida spinosa L. (сида колючая, SIDSP), Sinapis arvensis L. (горчица полевая, SINAR), Sonchus arvensis L. (осот многолетний, SONAR), вид Solidago (золотарник, SOOSS), Taraxacum officinale G.H. Weber ex Wiggers (одуванчик, TAROF), Trifolium repens L. (клевер ползучий, TRFRE) или Urtica dioica L. (крапива обыкновенная двудомная, URTDI).
[00133] В некоторых вариантах осуществления соединения и композиции, представленные в настоящей заявке, используют для борьбы с нежелательной растительностью, присутствующей в пропашных сельскохозяйственных культурах. В некоторых вариантах осуществления нежелательная растительность представляет собой Alopecurus myosuroides Huds. (лисохвост мышехвостиковидный, ALOMY), Avena fatua L. (овсюг, AVEFA), Brachiaria platyphylla (Groseb.) Nash (ветвянка широколистная, BRAPP), Digitaria sanguinalis (L.) Scop. (ползучий сорняк, DIGSA), Echin°Chloa crus-galli (L.) P. Beauv. (ежовник обыкновенный, ECHCG), Echin°Chloa colonum (L.) Link (ежовник крестьянский, ECHCO), Lolium multiflorum Lam. (плевел многоцветковый, LOLMU), Panicum dichotomiflorum Michx. (просо осеннее, PANDI), Panicum miliaceum L. (дикое просо, PANMI), Setaria faberi Herrm. (лисохвост гигантский, SETFA), Setaria viridis (L.) Beauv. (лисохвост зеленый, SETVI), Sorghum halepense (L.) Pers. (джонсова трава, SORHA), Sorghum bicolor (L.) Moench ssp. Arundinaceum (арундинария, SORVU), Cyperus esculentus L. (сыть съедобная, земляной миндаль, CYPES), Cyperus rotundus L. (сыть круглая, CYPRO), Abutilon theophrasti Medik. (канатник Теофраста, ABUTH), вид Amaranthus (растения семейства маревых и амарантовых, AMASS), Ambrosia artemisiifolia L. (амброзия обыкновенная, AMBEL), Ambrosia psilostachya DC. (амброзия западная, AMBPS), Ambrosia trifida L. (амброзия гигантская, AMBTR), Asclepias syriaca L. (ваточник сирийский, ASCSY), Chenopodium album L. марь белая, CHEAL), Cirsium arvense (L.) Scop. (бодяк полевой, CIRAR), Commelina benghalensis L. (коммелина бенгальская, COMBE), Datura stramonium L. (дурман обыкновенный, DATST), Daucus carota L. (дикая морковь, DAUCA), Euphorbia heterophylla L. (пуансеттия дикая, EPHHL), Erigeron canadensis L. (мелколепестник канадский, ERICA), Helianthus annuus L. (подсолнечник обыкновенный, HELAN), Jacquemontia tamnifolia (L.) Griseb. (вьюнок мелкоцветный, IAQTA), Ipomoea hederacea (L.) Jacq. (вьюнок плющевидный, IPOHE), Ipomoea lacunosa L. (вьюнок белый, IPOLA), Lactuca serriola L./Torn. (латук компасный, LACSE), Portulaca oleracea L. (портулак огородный, POROL), Sida spinosa L. (сида колючая, SIDSP), Sinapis arvensis L. (горчица полевая, SINAR), Solanum ptychanthum Dunal (паслен черный восточный, SOLPT) или Xanthium strumarium L. (дурнишник обыкновенный, XANST).
[00134] В некоторых вариантах осуществления, нормы нанесения от около 1 до около 4000 грамм/гектар (г/га) используют в послевсходовых обработках. В некоторых вариантах осуществления нормы нанесения от около 1 до около 4000 г/га используют в предвсходовых обработках.
[00135] В некоторых вариантах осуществления, соединения, композиции и способы, представленные в настоящей заявке, используют в сочетании с одним или несколькими другими гербицидами для борьбы с более широким рядом нежелательной растительности. Для использования в сочетании с другими гербицидами, соединения по настоящему изобретению можно сформулировать с другим гербицидом или гербицидами, приготовить в виде баковой смеси с другим гербицидом или гербицидами или применять последовательно с другим гербицидом или гербицидами. Некоторые из гербицидов, которые можно использовать в сочетании с соединениями, описанными в настоящей заявке, включают, но не ограничиваются этим: 4-CPA, 4-CPB, 4-CPP, 2,4-D, 2,4-D соль холина, 2,4-D сложные эфиры и амины, 2,4-DB, 3,4-DA, 3,4-DB, 2,4-DEB, 2,4-DEP, 3,4-DP, 2,3,6-TBA, 2,4,5-T, 2,4,5-TB, ацетохлор, ацифлуорфен, аклонифен, акролеин, алахлор, аллидохлор, аллоксидим, аллиловый спирт, алорак, аметридион, аметрин, амибузин, амикарбазон, амидосульфурон, аминоциклопирахлор, аминопиралид, амипрофос-метил, амитрол, аммония сульфамат, анилофос, анисурон, асулам, атратон, атразин, азафенидин, азимсульфурон, азипротрин, барбан, BCPC, бефлубутамид, беназолин, бенкарбазон, бенфлуралин, бенфуресат, бенсульфурон-метил, бенсулид, бентиокарб, бентазон-натрий, бензадокс, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофлуор, бензоилпроп, бензтиазурон, бициклопирон, бифенокс, биланафос, биспирибак-натрий, боракс, бромацил, бромбонил, бромбутид, бромфеноксим, бромоксинил, бромпиразон, бутахлор, бутафенацил, бутамифос, бутенахлор, бутидазол, бутиурон, бутралин, бутроксидим, бутурон, бутилат, какодиловая кислота, кафенстрол, хлорат кальция, цианамид кальция, камбендихлор, карбасулам, карбетамид, карбоксазол, хлорпрокарб, карфентразон-этил, CDEA, CEPC, хлометоксифен, хлорамбен, хлоранокрил, хлоразифоп, хлоразин, хлорбромурон, хлорбуфам, хлоретурон, хлорфенac, хлорфенпроп, хлорфлуразол, хлорфлуренол, хлоридазон, хлоримурон, хлорнитрофен, хлоропон, хлоротолурон, хлороксурон, хлороксинил, хлорпрофам, хлорсульфурон, хлортал, хлортиамид, цинидон-этил, цинметилин, циносульфурон, цисанилид, клетодим, клиодинат, клодинафоп-пропаргил, клофоп, кломепроп, клопроп, клопроксидим, клопиралид, клорансулам-метил, смA, сульфат меди, CPMF, CPPC, кредазин, крезол, кумилурон, цианатрин, цианазин, циклоат, циклосульфамурон, циклоксидим, циклурон, цигалофоп-бутил, циперкват, ципразин, ципразол, ципромид, диамурон, далапон, дазомет, делахлор, десмедифам, десметрин, ди-аллат, дикамба, дихлобенил, дихлоралмочевина, дихлормат, дихлорпроп, дихлорпроп-P, диклофоп, диклосулам, диэтамкват, диэтанил, дифенопентен, дифеноксурон, дифензокват, дифлуфеникан, дифлуфензопир, димефурон, димепиперат, диметахлор, диметаметрин, диметенамид, диметенамид-P, димексано, димидазон, динитрамин, динофенат, динопроп, диносам, диносеб, дитотерб, дифенамид, дипропeтрин, дикват, дисул, дитиопир, диурон, DMPA, DN°C, DSMA, EBEP, эглиназин, эндотал, эпроназ, EPTC, эрбон, эспрокарб, эталфлуралин, этбензамид, этаметсульфурон, этидимурон, этиолат, этобензамид, этобензамид, этофумесат, этоксифен, этоксисульфурон, этинофен, этнипромид, этобензанид, EXD, фенасулам, фенoпроп, феноксапроп, феноксапроп-P-этил, феноксапроп-P-этил + изоксадифен-этил, феноксасульфон, фентеракол, фентиапроп, фентразамид, фенурон, сульфат железа, флампроп, флампроп-M, флазасульфурон, флорасулам, флуазифоп, флуазифоп-P-бутил, флуазолат, флукарбазон, флуцетосульфурон, флухлоралин, флуфенацет, флуфеникан, флуфенпир-этил, флуметсулам, флумезин, флумиклорак-пентил, флумиоксазин, флумипропин, флуoметурон, флуородифен, флуорогликофен, флуоромидин, флуоронитрофен, флуoтиурон, флуpоксам, флупропацил, флупропанат, флупирсульфурон, флуридон, флурoхлоридон, флуроксипир, флуртамон, флутиацет, фомесафен, форамсульфурон, фосамин, фурилоксифен, глюфосинат, глюфосинат-аммоний, глифосат, галосафен, галосульфурон-метил, галоксидин, галоксифоп-метил, галоксифоп-P-метил, гексахлорацетон, гексафлурат, гексазинон, имазаметабенз, имазамокс, имазапик, имазапир, имазаквин, имазосульфурон, инданофан, индазифлам, иодобонил, иодметан, иодсульфурон, иофенсульфурон, иоксинил, ипазин, ипфенкарбазон, ипримидам, изокарбамид, изоцил, изометиозин, изонорурон, изополинат, изопропалин, изопротурон, изоурон, изоксабен, изоксахлортол, изоксафлутол, изоксапирифоп, карбутилат, кетоспирадокс, лактофен, ленацил, линурон, MAA, MAMA, MCPA сложные эфиры и амины, MCPA-тиоэтил, MCPB, мекопроп, мекопроп-P, медитотерб, мефенацет, мефлуидид, мезопразин, мезосульфурон, мезотрион, метам, метамифоп, метамитрон, метазахлор, метазосульфурон, метфлуразон, метабензтиазурон, металпропалин, метазол, метиобенкарб, метиозолин, метиурон, метометон, метопротрин, метилбромид, метилизотиоцианат, метилдимрон, метобензурон, метобромурон, метолахлор, метосулам, метоксурон, метрибузин, метсульфурон, молинат, моналид, монисоурон, монохлоруксусная кислота, монолинурон, монурон, морфамкват, MSMA, напроанилид, напропамид, напропамид-M, напталам, небурон, никосульфурон, нипирaклофен, нитралин, нитрофен, нитрофлуорфен, норфлуразон, норурон, °CH, орбенкарб, орто-дихлорбензол, ортосульфамурон, оризалин, оксадиаргил, оксадиазон, оксапиразон, оксасульфурон, оксазикломефон, оксифлуорфен, парафлуфен-этил, парафлурон, паракват, пебулат, пеларгоновая кислота, peндиметалин, пеноксулам, пентахлорфенол, пентанохлор, пентоксазон, перфлуидон, петоксамид, фенизофам, фенмедифам, фенмедифам-этил, фенoбензурон, ацетат фенилртути, пиклопам, пиколинaфен, пиноксаден, пиперофос, арсенит калия, азид калия, цианат калия, претилaхлор, примисульфурон-метил, проциазин, продиамин, профлуазол, профлуралин, профоксидим, проглиназин, прогексадион-кальций, прометон, прометрин, пропaхлор, пропанил, пропaквизафоп, пропазин, профам, пропизохлор, пропоксикарбазон, пропирисульфурон, пропизамид, просульфалин, просульфокарб, просульфурон, проксан, принахлор, пинадон, пираклонил, пирафлуфен, пирасульфотол, пиразогил, пиразолинат, пиразосульфурон-этил, пиразоксифен, пирибензоксим, пирибутикарб, пириклор, пиридафол, пиридат, пирифталид, пириминобак, пиримисульфан, пиритиобак-метил, пироксасульфон, пирокссулам, хинклорак, хинмерак, хинокламин, хинонамид, хизалофоп, хизалофоп-P-этил, родетанил, римсульфурон, сафлуфенацил, S-метолахлор, себутилазин, секбуметон, сетоксидим, сидурон, симазин, симетон, симетрин, SMA, арсенит натрия, азид натрия, хлорат натрия, сулкотрион, сульфаллат, сулфентразон, сульфометурон, сульфосат, сульфосульфурон, серная кислота, сулгликапин, свеп, TCA, тебутам, тебутиурон, тефурилтрион, темботрион, тепралоксидим, тербацил, тербукарб, тербухлор, тербуметон, тербутилазин, тербутрин, тетрафлурон, тенилхлор, тиазафлурон, тиазопир, тидиазимин, тидиазурон, тиенкарбазон-метил, тифенсульфурон, тиобенкарб, тиокарбазил, тиоклопим, топрамезон, тралкоксидим, триафамон, три-аллат, триaсульфурон, триазифлам, трибенурон, трикамба, сложные эфиры и амины триклопира, тридифан, триетазин, трифлоксисульфурон, трифлуралин, трифлусульфурон, трифоп, трифопсим, тригидрокситриазин, триметурон, трипропиндан, тритак, тритосульфурон, вернолат и ксилахлор.
[00136] Соединения и композиции, описанные в настоящей заявке, обычно можно использовать в комбинации с известными антидотами для гербицидов, такими как беноксакор, бентиокарб, брассинолид, клоквинтоцет (мексил), циометринил, даимурон, дихлормид, дициклонон, димепиперат, дисульфотон, фенхлоразол-этил, фенклопим, флуразол, флуксофеним, фурилазол, белки гарпинса, изоксадифен-этил, мефенпир-диэтил, MG 191, MON 4660, нафталевый ангидрид (NA), оксабетринил, R29148 и амиды N-фенил-сульфонилбензойной кислоты, для усиления их селективности.
[00137] Соединения, композиции и способы, описанные в настоящей заявке, можно использовать для борьбы с нежелательной растительностью в глифосат-устойчивых-, глюфосинат-устойчивых-, дикамба-устойчивых-, феноксиауксин-устойчивых-, пиридилоксиауксин-устойчивых-, арилоксифеноксипропионат-устойчивых-, ингибитор ацетил CoA карбоксилазы (ACCазы)-устойчивых-, имидазолинон-устойчивых-, ингибитор ацетолактатсинтазы (ALS)-устойчивых-, ингибитор 4-гидроксифенил-пируватдиоксигеназа (HPPD)-устойчивых-, ингибитор протопорфириногеноксидазы (PPO)-устойчивых-, триазин-устойчивых- и бромоксинил-устойчивых- сельскохозяйственных культурах (таких как, но не ограничиваясь этим, соя, хлопчатник, канола/рапс, рис, зерновые, кукуруза, дерн и т.п.), например, вместе с глифосатом, глюфосинатом, дикамба, феноксиауксинами, пиридилоксиауксинами, арилоксифеноксипропионатами, ингибиторами ACCазы, имидазолинонами, ингибиторами ALS, ингибиторами HPPD, ингибиторами PPO, триазинами и бромоксинилом. Композиции и способы можно использовать для борьбы с нежелательной растительностью в сельскохозяйственных культурах, обладающих множественными или суммарными характеристиками, сообщающими устойчивость к различным химикатам и/или ингибиторам с различными способами действия.
[00138] Соединения и композиции, описанные в настоящей заявке, также можно использовать для борьбы с гербицид- резистентными или устойчивыми сорняками. Примеры резистентных или устойчивых сорняков включают, но не ограничиваются этим, биотипы, резистентные или устойчивые к ингибиторам ацетолактатсинтазы (ALS), ингибиторам фотосистемы II, ингибиторам ацетил CoA карбоксилазы (ACCase), синтетическим ауксинам, ингибиторам фотосистемы I, ингибиторам 5-енолпирувилшикимат-3-фосфат (EPSP) синтазы, ингибиторам сборки микротрубочек, ингибиторам синтеза липидов, ингибиторам протопорфириногеноксидазы (PPO), ингибиторам биосинтеза каротеноидов, ингибиторам жирных кислот с очень длинной цепью (VLCFA), ингибиторам фитоендесатуразы (PDS), ингибиторам глутаминсинтетазы, ингибиторам 4-гидроксифенил-пируват-диоксигеназы (HPPD), ингибиторам митоза, ингибиторам биосинтеза целлюлозы, гербицидам с различными способами действия, такими как хинклорак, и неклассифицированными гербицидами, такими как ариламинопропионовые кислоты, дифензокват, эндотал и органическими соединениями мышьяка. Примеры резистентных или устойчивых сорняков включают, но не ограничиваются этим, биотипы с резистентностью или устойчивостью к нескольким гербицидам, нескольким химическим классам и нескольким гербицидным способам действия.
[00139] Описанные варианты осуществления и следующие далее примеры представлены для иллюстративных целей и не предназначены для ограничения объема притязаний. Средним специалистам в данной области будут очевидны другие модификации, применения или комбинации, касающиеся композиций, описанных в настоящей заявке, без отступления от сути и объема заявленного изобретения.
СИНТЕЗ ПРЕДШЕСТВЕННИКОВ
Получение 1: Метил 4-амино-3,6-дихлорпиколинат (Головная группа A)
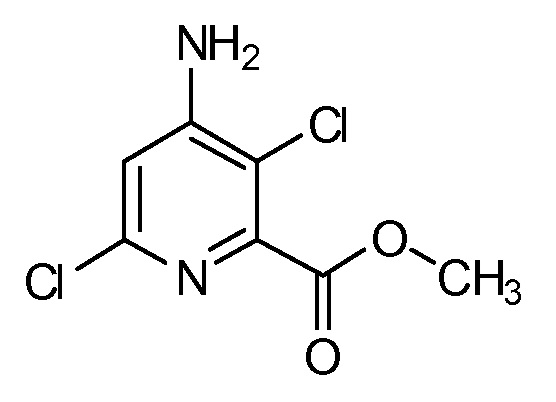
[00140] Получали, как описано в Fields et al., WO 2001051468 A1.
Получение 2: Метил 4-амино-3,6-дихлор-5-фторпиколинат (Головная группа B)
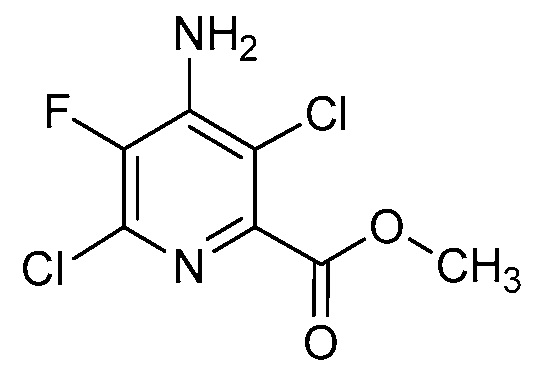
[00141] Получали, как описано в Fields et al., Tetrahedron Letters 2010, 511, 79-81.
Получение 3: 2,6-Дихлор-5-метокси-4-винилпиримидин
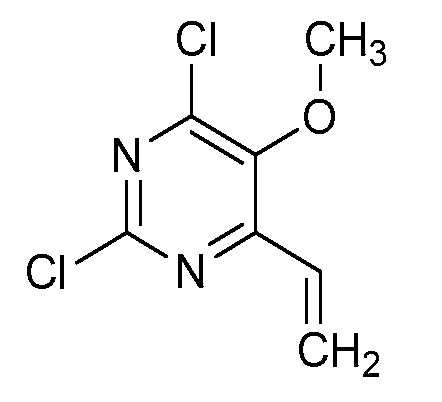
[00142] К раствору коммерчески доступного 2,6-дихлор-5-метоксипиримидина (100 грамм (г), 0,55 моль (моль)) в безводном тетрагидрофуране (ТГФ) добавляли по каплям 1 молярный (M) раствор винилмагнийбромида в тетрагидрофуране (124 г, 0,94 моль) в течение одного часа (ч) при комнатной температуре. Смесь затем перемешивали в течение 4 часов при комнатной температуре. Избыток реагента Гриньяра гасили путем добавления ацетона (200 миллилитров (мл)), при этом температуру смеси поддерживали при температуре ниже 20°C. Затем сразу же добавляли 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ; 151 г, 0,67 моль) и перемешивали в течение ночи. Происходило образование желтого твердого осадка. Твердое вещество фильтровали и промывали этилацетатом (500 мл). Фильтрат концентрировали при пониженном давлении и полученное неочищенное соединение разбавляли этилацетатом (2 литра (л)). Полученное нерастворившееся темное полутвердое вещество выделяли путем фильтрования с использованием этилацетата. Это вещество далее концентрировали при пониженном давлении с получением неочищенного соединения, которое очищали колоночной хроматографией. Соединение элюировали смесью 5-10% этилацетата в гексане с получением указанного в заголовке соединения (70 г, 60%): т.пл. 60-61°C; 1H ЯМР (CDCl3) δ 3,99 (с, 3H), 5,85 (д, 1H), 6,75 (д, 1H), 6,95 (дд, 1H).
Получение 4: 2,6-Дихлор-5-метокси-пиримидин-4-карбальдегид
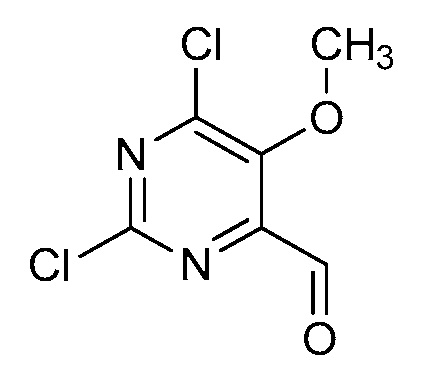
[00143] Раствор 2,6-дихлор-5-метокси-4-винилпиримидина (50 г, 0,24 моль) в дихлорметане:метаноле (4:1, 2 л) охлаждали до -78°C. Осуществляли барботирование смеси газообразным озоном в течение 5 часов. Реакцию гасили диметилсульфидом (50 мл). Смесь медленно нагревали до комнатной температуры и концентрировали при пониженном давлении при 40°C с получением указанного в заголовке соединения (50,5 г, 100%); высокоэффективная жидкостная хроматография (ВЭЖХ; 85% ацетонитрила, забуференного при помощи 0,1% объем на объем (об/об) уксусной кислоты).
Получение 5: Метил 2,6-дихлор-5-метокси-пиримидин-4-карбоксилат
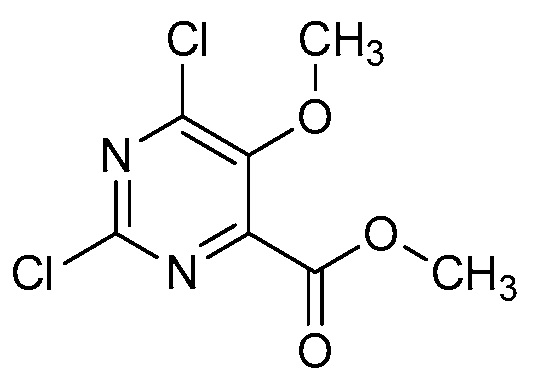
[00144] Получали раствор 2,6-дихлор-5-метокси-пиримидин-4-карбальдегида (50 г, 0,24 моль) в метаноле (1 л) и воде (60 мл). К раствору добавляли бикарбонат натрия (400 г). 2 M раствор брома (192 г, 1,2 моль) в метаноле/воде (600 мл, 9:1) добавляли по каплям к раствору пиримидина в течение 45 минут (мин) при 0°C при перемешивании смеси. Перемешивание продолжали при этой же температуре в течение 1 часа. Затем смесь перемешивали при комнатной температуре в течение 4 часов. При перемешивании, реакционную смесь затем выливали на смесь измельченного льда (2 л), бисульфита натрия (50 г) и хлорида натрия (200 г). Продукт экстрагировали этилацетатом (1л x 2) и объединенный органический слой сушили над сульфатом натрия и фильтровали. Выпаривание растворителя при пониженном давлении давало вязкое вещество, которое отверждалось при длительном выстаивании, с получением указанного в заголовке соединения (50,8 г, 87%); ESIMS m/z238 ([M+H]+).
Получение 6: Метил 6-амино-2-хлор-5-метокси-пиримидин-4-карбоксилат (Головная группа C)
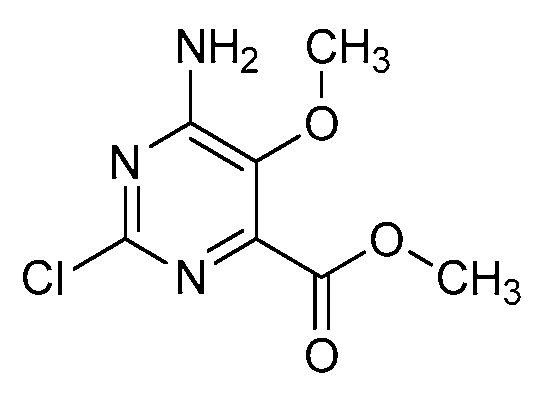
[00145] Получали раствор метил 2,6-дихлор-5-метокси-пиримидин-4-карбоксилата (25 г, 0,1 моль) и диметилсульфоксида (DMSO). К этому раствору добавляли при 0-5°C раствор аммиака (2 экв.) в DMSO. Эту смесь перемешивали при этой же 0-5°C температуре в течение 10-15 минут. Затем смесь разбавляли этилацетатом и полученное твердое вещество отфильтровывали. Этилацетатный фильтрат промывали насыщенным солевым раствором и сушили над сульфатом натрия. В результате концентрирования получали неочищенный продукт. Неочищенный продукт перемешивали в минимальном количестве этилацетата и фильтровали с получением чистого соединения. Дополнительное чистое соединение получали из фильтрата, который после концентрирования очищали флэш-хроматографией. Это давало указанное в заголовке соединение (11 г, 50%): т.пл. 158°C; 1H ЯМР (DMSO-d6) δ 3,71 (с, 3H), 3,86 (с, 3H), 7,65 (шир.с, 1H), 8,01 (шир.с, 1H).
Получение 7: Метил 4-амино-3,6-дихлор-5-иодпиколинат
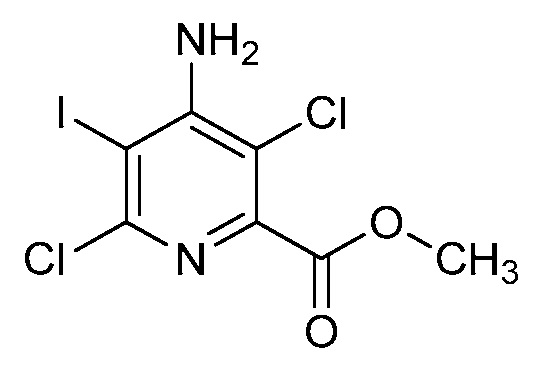
[00146] Метил 4-амино-3,6-дихлорпиколинат (10,0 г, 45,2 ммоль), периодную кислоту (3,93 г, 17,2 миллимоль (ммоль)) и иод (11,44 г, 45,1 ммоль) растворяли в метаноле (30 мл) и перемешивали при температуре кипения с обратным холодильником при 60°C в течение 27 часов. Реакционную смесь концентрировали, разбавляли диэтиловым эфиром и промывали два раза насыщенным водным раствором бисульфита натрия. Водные слои экстрагировали один раз диэтиловым эфиром и объединенные органические слои сушили над безводным сульфатом натрия. Продукт концентрировали и очищали флэш-хроматографией (силикагель, 0-50% этилацетат/гексан) с получением указанного в заголовке соединения в качестве бледно-желтого твердого вещества (12,44 г, 35,9 ммоль, 79%): т.пл. 130,0-131,5°C; 1H ЯМР (400 МГц, CDCl3) δ 5,56 (с, 2H), 3,97 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 163,80, 153,00, 152,75, 145,63, 112,12, 83,91, 53,21; EIMS m/z 346.
Получение 8: Метил 4-амино-3,6-дихлор-5-метилпиколинат (Головная группа D)
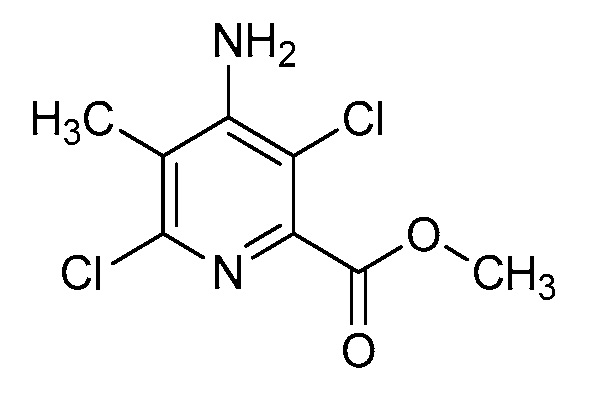
[00147] Смесь метил 4-амино-3,6-дихлор-5-иодпиколината (8,1 г, 23,4 ммоль), тетраметилстаннана (8,35 г, 46,7 ммоль) и бис(трифенилфосфин)палладий(II) хлорида (2,5 г, 3,5 ммоль) в 1,2-дихлорэтане (40 мл) подвергали облучению в микроволновом устройстве Biotage Initiator при 120°C в течение 30 минут, осуществляя контроль температуры при помощи внешнего датчика инфракрасного (ИК) излучения. Реакционную смесь нагружали непосредственно на картридж с силикагелем и очищали флэш-хроматографией (силикагель, 0-50% этилацетат/гексан) с получением указанного в заголовке соединения в виде оранжевого твердого вещества (4,53 г, 83 %): т.пл. 133-136°C; 1H ЯМР (400 МГц, CDCl3) δ 4,92 (с, 2H), 3,96 (с, 3H), 2,29 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 164,34, 150,24, 148,69, 143,94, 117,01, 114,60, 53,02, 14,40; ESIMS m/z 236 ([M+H]+), 234 ([M-H]-).
Получение 9: Метил 6-амино-2,5-дихлорпиримидин-4-карбоксилат (Головная группа E)
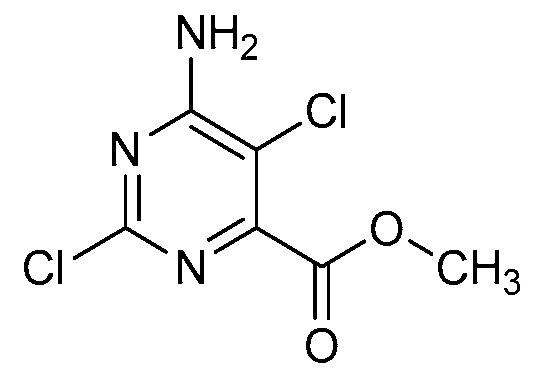
[00148] Получали, как описано в Epp et al., WO 2007082076 A1.
Получение 10: Метил 4-амино-6-хлор-5-фтор-3-метоксипиколинат (Головная группа F)
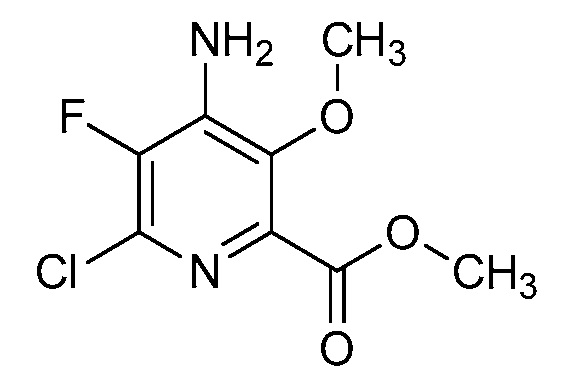
Получали, как описано в Epp et al., WO 2013003740 A1.
Получение 11: Метил 4-амино-6-хлор-5-фтор-3-винилпиколинат (Головная группа G)
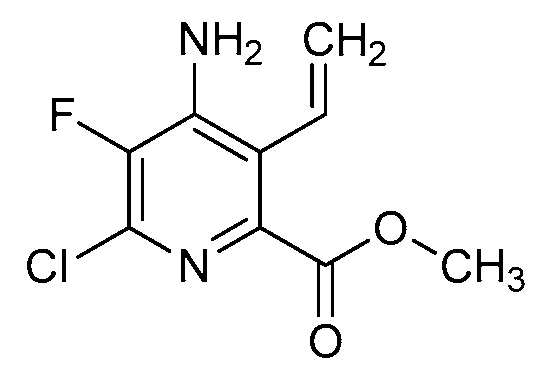
[00149] Метил 4-амино-6-хлор-5-фтор-3-иодпиколинат (7,05 г, 21,33 ммоль, получали, как описано в Epp et al., WO 2013003740 A1) и винилтри-н-бутилолово (7,52 мл, 25,6 ммоль) суспендировали в дихлорэтане (71,1 мл) и смесь дегазировали аргоном в течение 10 минут. Затем добавляли бис(трифенилфосфин)палладий(II) хлорид (1,497 г, 2,133 ммоль) и реакционную смесь перемешивали при 70°C в течение ночи (прозрачный оранжевый раствор). Реакцию отслеживали методом газовой хроматографии-масс-спектрометрии (ГХ-МС). Через 20 часов реакционную смесь концентрировали, адсорбировали на Целит и очищали колоночной хроматографией (силикагель (SiO2), градиент гексан/этилацетат) с получением указанного в заголовке соединения (3,23 г, 65,7%) в виде светло-коричневого твердого вещества: т.пл. 99-100°C; 1H ЯМР (400 МГц, CDCl3) δ 6,87 (дд, J=18,1, 11,6 Гц, 1H), 5,72 (дд, J=11,5, 1,3 Гц, 1H), 5,52 (дд, J=18,2, 1,3 Гц, 1H), 4,79 (с, 2H), 3,91 (с, 3H); 19F ЯМР (376 МГц, CDCl3) δ -138,79 (с); EIMS m/z230.
Получение 12: Метил 4-амино-3,5,6-трихлорпиколинат (Головная группа H)
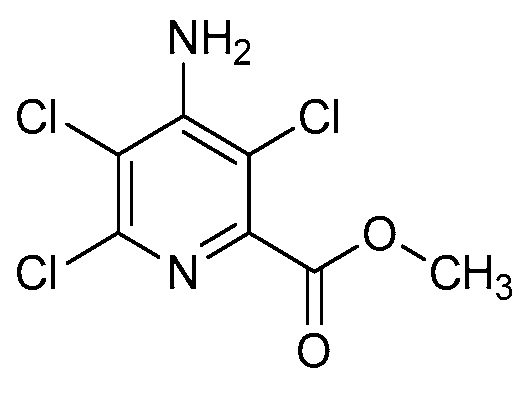
[00150] Получали, как описано в Finkelstein et al., WO 2006062979 A1.
Получение 13: Метил 4-амино-6-бром-3-хлор-5-фторпиколинат (Головная группа I)
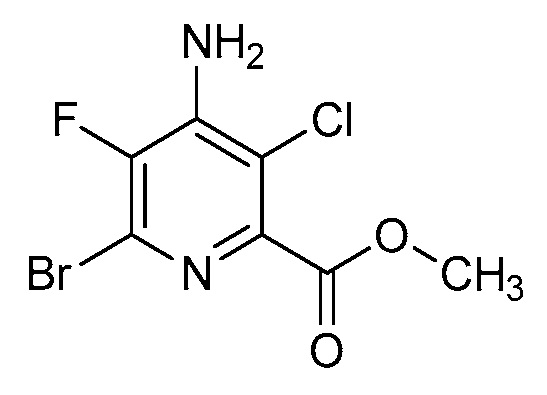
[00151] Получали, как описано в Arndt et al., US 20120190857 A1.
Получение 14: Метил 4-амино-3-хлор-5-фтор-6-(триметилстаннил)пиколинат (Головная группа J)
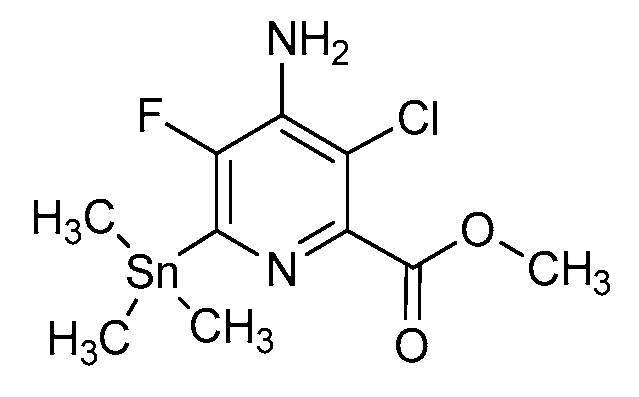
[00152] Метил 4-амино-6-бром-3-хлор-5-фторпиколинат (500 мг, 1,8 ммоль), 1,1,1,2,2,2-гексаметилдистаннан (580 мг, 1,8 ммоль) и бис(трифенилфосфин)-палладий(II) хлорид (120 мг, 0,18 ммоль) объединяли в безводном диоксане (6 мл), барботировали потоком азота в течение 10 минут и затем нагревали до 80ºC в течение 2 часов. Охлажденную смесь перемешивали с этилацетатом (25 мл) и насыщенным раствором NaCl (25 мл) в течение 15 минут. Органическую фазу отделяли, фильтровали через диатомовую землю, сушили (Na2SO4) и упаривали. Остаток поглощали в этилацетат (4 мл), перемешивали и обрабатывали по порциям гексаном (15 мл). Молочно-белый раствор декантировали для отделения от каких-либо образовавшихся твердых веществ, фильтровали через стекловату и упаривали с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (660 мг, 100%): 1H ЯМР (400 МГц, CDCl3) δ 4,63 (д, J=29,1 Гц, 1H), 3,97 (с, 2H), 0,39 (с, 4H); 19F ЯМР (376 МГц, CDCl3) δ -130,28; EIMS m/z 366.
Получение 15: Метил 4-ацетамидо-3-хлор-6-(триметилстаннил)-пиколинат (Головная группа K)
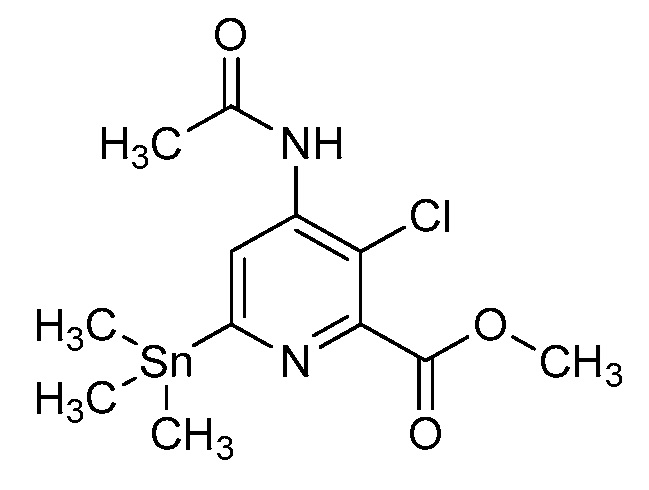
[00153] Получали, как описано в Balko et al., WO 2003011853 A1.
Получение 16: Метил 4-ацетамидо-3,6-дихлорпиколинат (Головная группа L)
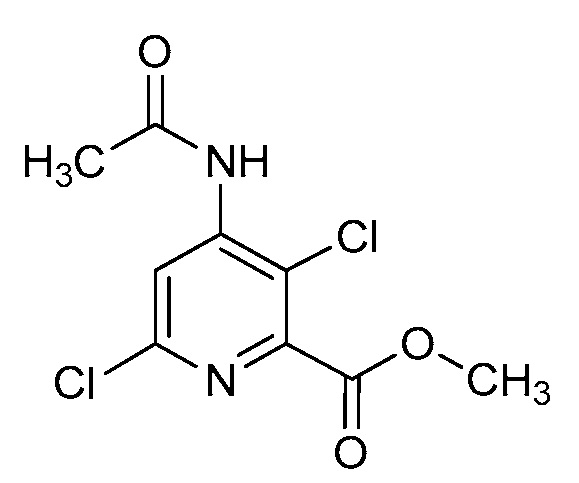
[00154] Получали, как описано в Fields et al., WO 2001051468 A1.
Получение 17: Метил 4-амино-3-хлор-6-иодпиколинат (Головная группа M)
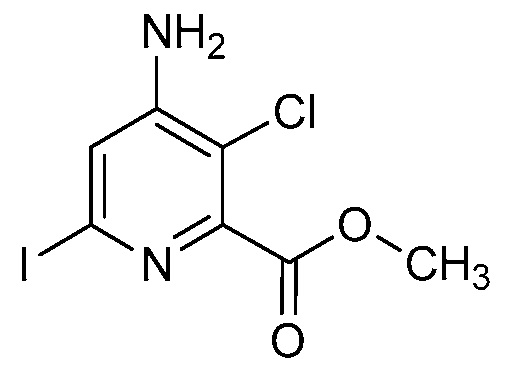
[00155] Получали, как описано в Balko et al., WO 2007082098 A2.
Получение 18: Метил 4-ацетамидо-3-хлор-6-иодпиколинат (Головная группа N)
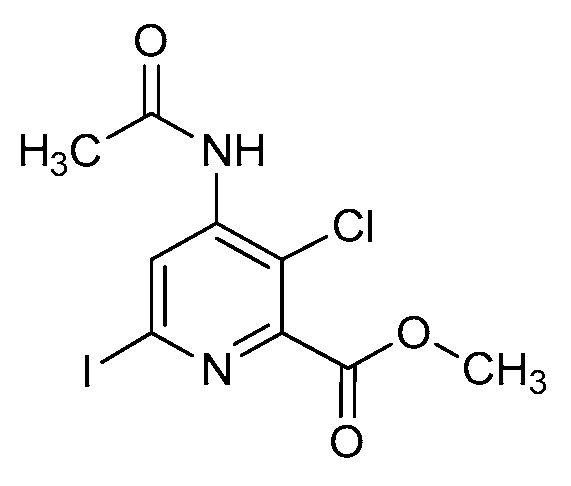
[00156] Получали, как описано в Balko et al., WO 2007082098 A2.
Получение 19: Метил 4-амино-6-бром-3,5-дифторпиколинат (Головная группа O)
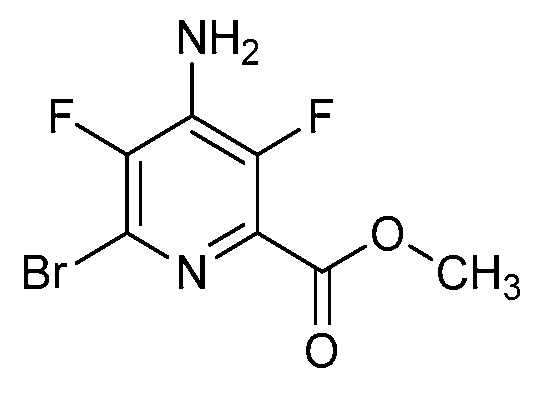
[00157] Получали, как описано в Fields et al., WO 2001051468 A1.
Получение 20: Метил 6-амино-2-хлор-5-винилпиримидин-4-карбоксилат (Головная группа P)
[00158] Получали, как описано в Epp et al., US20090088322.
Получение 21: 1-Бром-4-(2,2-диэтоксиэтокси)-2-фторбензол
[00159] 4-Бром-3-фторфенол (7 г, 0,03665 моль) и карбонат калия (7,6 г, 0,055 моль) растворяли в N,N-диметилформамиде (9 мл). Добавляли 2-бром-1,1-диэтоксиэтан (8,5 мл, 0,055 моль) и реакционную смесь перемешивали и нагревали до 135°C в течение 7 часов. Растворитель удаляли после завершения реакции. Остаток растворяли в этилацетате и промывали раствором 2M NaOH. Органическую фазу сушили над Na2SO4. Растворитель выпаривали с получением 1-бром-4-(2,2-диэтоксиэтокси)-2-фторбензола в виде масла (11,4 г, 100%).
Получение 22: 1-Бром-3-(2,2-диэтоксиэтокси)-2-фторбензол
[00160] 1-Бром-3-(2,2-диэтоксиэтокси)-2-фторбензол получали из 3-бром-2-фторфенола, как описано в Получении 21.
Получение 23: 2-Бром-4-(2,2-диэтоксиэтокси)-1-фторбензол
[00161] 2-Бром-4-(2,2-диэтоксиэтокси)-1-фторбензол получали из 3-бром-4-фторфенола, как описано в Получении 21.
Получение 24: 1-Бром-4-хлор-2-(2,2-диэтоксиэтокси)бензол
[00162] 1-Бром-4-хлор-2-(2,2-диэтоксиэтокси)бензол получали из 2-бром-5-хлорфенола, как описано в Получении 21.
Получение 25: (4-Бром-3-фторфенил)(2,2-диэтоксиэтил)сульфан
[00163] (4-Бром-3-фторфенил)(2,2-диэтоксиэтил)сульфан получали из 4-бром-3-фторбензолтиола, как описано в Получении 21.
Получение 26: 4-Бром-7-хлорбензофуран
[00164] К 80 мл бензола добавляли полифосфорную кислоту (3,47 г, 36,9 ммоль) и коммерчески доступный 2-(5-бром-2-хлорфенокси)ацетальдегид (9,2 г, 36,9 ммоль) и распределяли в восемь 20-мл сосудов, содержащих равные количества. Сосуды нагревали до внешней температуры 90°C в течение 4 дней. После охлаждения реакционной смеси бензол удаляли путем декантирования. К органическому раствору добавляли Целит (50 г) и растворитель удаляли с использованием роторного испарителя. Пропитанный Целит загружали в систему очистки Teledyne-Isco и очищали хроматографией на силикагеле с использованием 0-30% этилацетата:гексан, с получением 4-бром-7-хлорбензофурана в виде белого твердого вещества (2,7 г, 32%): 1H ЯМР (400 МГц, CDCl3) δ 7,73 (д, J=2,2 Гц, 1H), 7,33 (д, J=8,3 Гц, 1H), 7,18 (д, J=8,3 Гц, 1H), 6,85 (д, J=2,2 Гц, 1H); 13C ЯМР (101 МГц, CDCl3) δ 150,38 (с), 146,14 (с), 130,27 (с), 126,56 (с), 125,32 (с), 116,44 (с), 112,49 (с), 107,71 (с); ESIMS m/z 232 ([M+H]+), 230 ([M-H]-).
Получение 27: 6-Бромбензофуран и 4-бромбензофуран
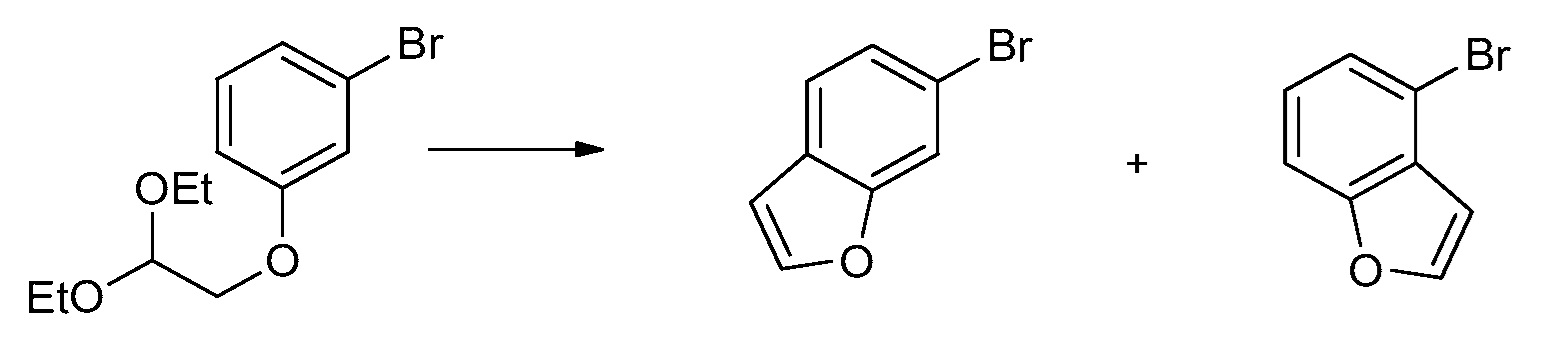
[00165] 6-Бромбензофуран и 4-бромбензофуран получали, как описано в US20040147559, из 1-бром-3-(2,2-диэтоксиэтокси)бензола.
Получение 28: 5-Бром-6-фторбензофуран и 5-бром-4-фторбензофуран
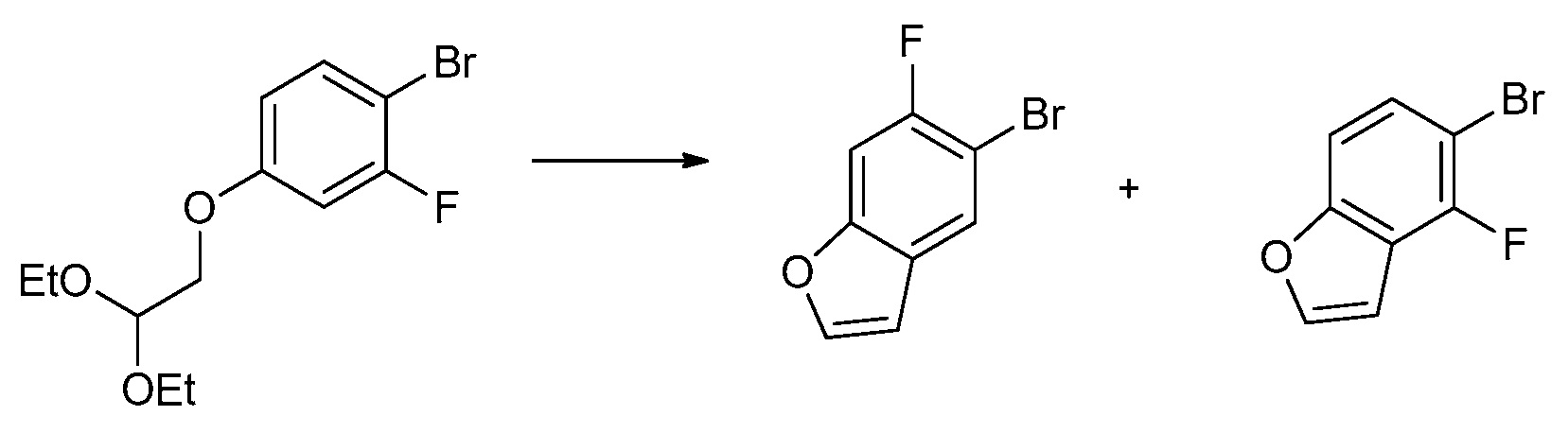
[00166] 1-Бром-4-(2,2-диэтоксиэтокси)-2-фторбензол (11,4 г, 0,037 моль) растворяли в толуоле (78 мл). Добавляли полифосфорную кислоту (11,9 г) и смесь нагревали до температуры кипения с обратным холодильником в течение 5 часов. Растворитель удаляли и остаток разбавляли водой и этилацетатом. Органическую фазу промывали раствором 2M NaOH и затем сушили над Na2SO4. Смесь 5-бром-6-фторбензофурана и 5-бром-4-фторбензофурана (4,8 г, 60,3%) получали в виде смеси после очистки колоночной хроматографией.
Получение 29: 6-Бром-7-фторбензофуран
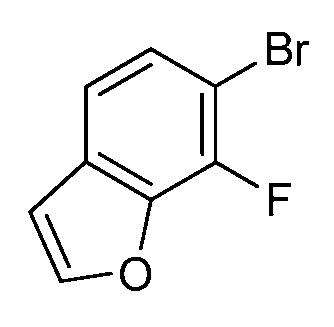
[00167] 6-Бром-7-фторбензофуран получали из 1-бром-3-(2,2-диэтоксиэтокси)-2-фторбензола, как описано в Получении 28: ESIMS m/z 216 ([M+H]+).
Получение 30: 6-Бром-5-фторбензофуран
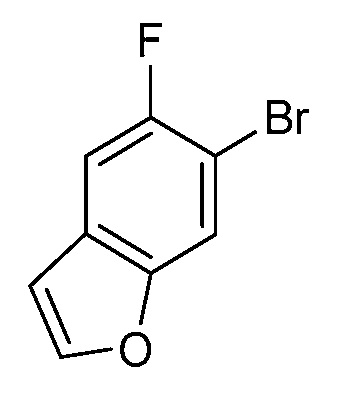
[00168] 6-Бром-5-фторбензофуран получали из 2-бром-4-(2,2-диэтоксиэтокси)-1-фторбензол, как описано в Получении 28: ESIMS m/z 216 ([M+H]+).
Получение 31: 7-Бром-4-хлорбензофуран
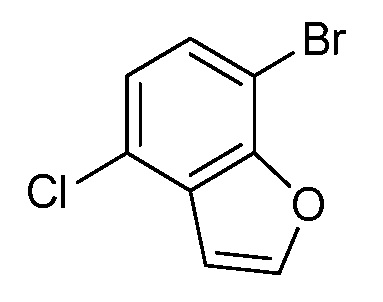
[00169] 7-Бром-4-хлорбензофуран получали из 1-бром-4-хлор-2-(2,2-диэтоксиэтокси)бензола, как описано в Получении 28: ESIMS m/z 232 ([M+H]+).
Получение 32: 5-Бром-4-фторбензо[b]тиофен и 5-бром-6-фторбензо[b]тиофен
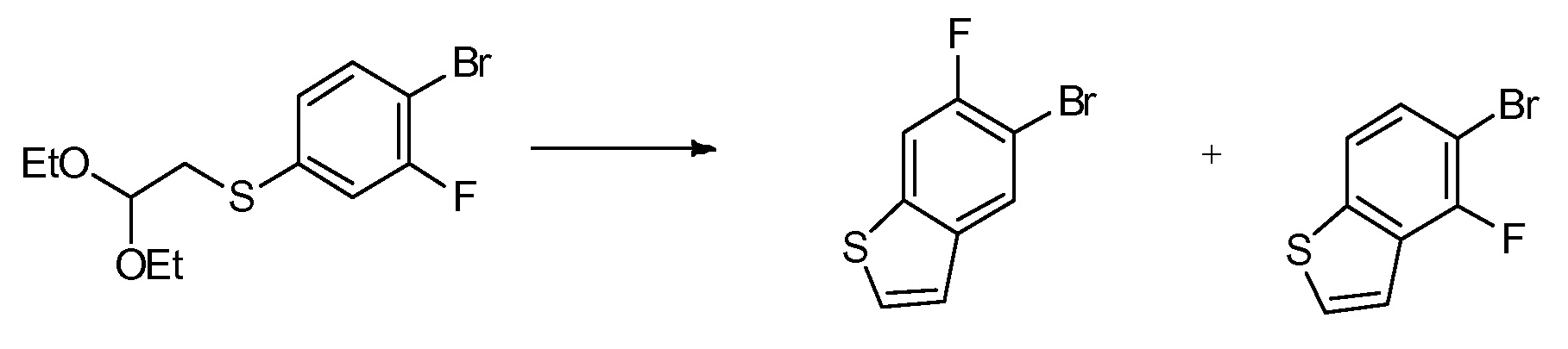
[00170] Полифосфорную кислоту (13,9 г) перемешивали в хлорбензоле (50 мл) при 130°C. Добавляли (4-бром-3-фторфенил)(2,2-диэтоксиэтил)сульфан (7,7 г, 0,0238 моль) в хлорбензоле (15,4 мл) по каплям при 130°C. Смесь затем перемешивали при 130°C в течение 10 часов. Растворитель удаляли и остаток экстрагировали толуолом, гексаном и затем водой. Органическую фазу объединяли и промывали насыщенным раствором бикарбоната натрия (NaHCO3) и насыщенным солевым раствором и затем сушили над Na2SO4. Продукты 5-бром-4-фторбензо[b]тиофен и 5-бром-6-фторбензо[b]тиофен получали после очистки колоночной хроматографией (3,6 г, 65,5%).
Получение 33: 6-Бром-5-фторбензо[b]тиофен и 4-бром-5-фторбензо[b]тиофен
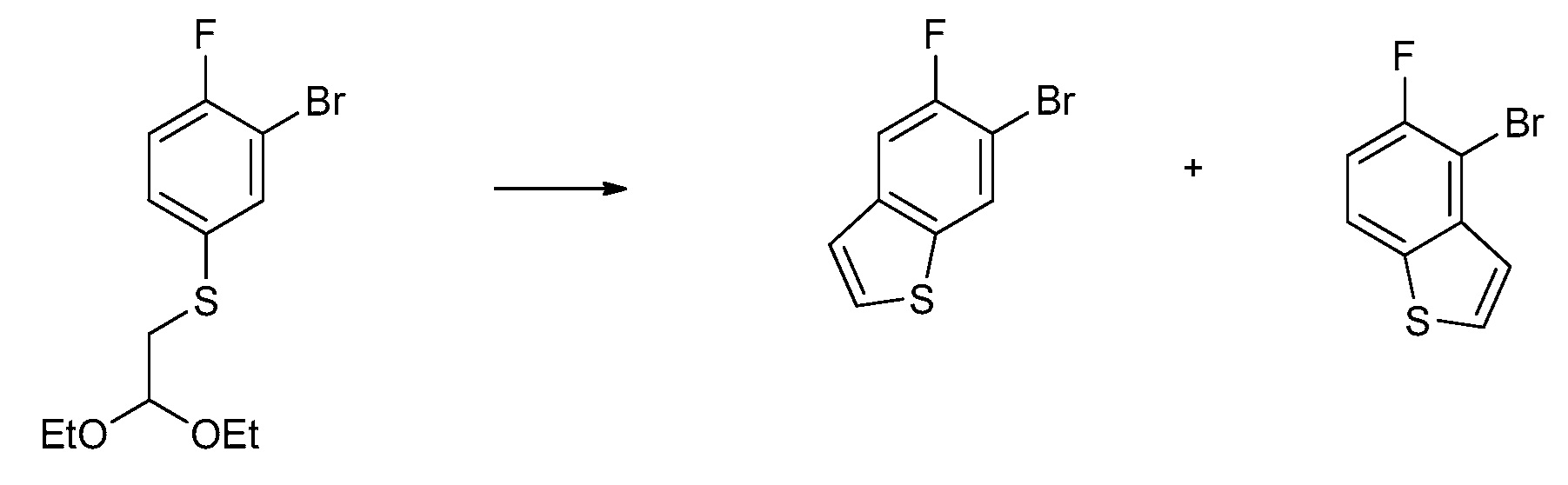
[00171] 6-Бром-5-фторбензо[b]тиофен и 4-бром-5-фторбензо[b]тиофен получали из (3-бром-4-фторфенил)(2,2-диэтоксиэтил)сульфана, как описано в Получении 32:ESIMS m/z 232 ([M+H]+).
Получение 34: 2-(7-Хлорбензофуран-4-ил)-5,5-диметил-1,3,2-диоксаборинан
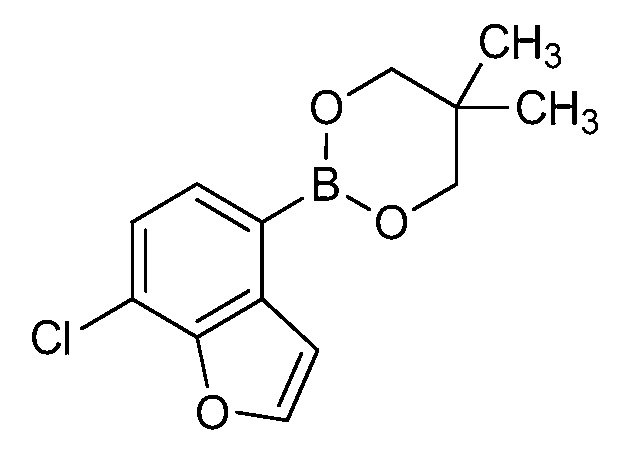
[00172] 2-(7-Хлорбензофуран-4-ил)-5,5-диметил-1,3,2-диоксаборинан получали, как описано в Получении 55, из 4-бром-7-хлорбензофурана (получен, как описано в WO2005056015) с получением белого твердого вещества (66%): ИК (см-1) 669,18,701,26, 741,33, 792,08, 773,25, 842,53, 811,66, 863,44, 876,27, 884,51, 953,31, 993,58, 1027,34, 1132,28, 1059,34, 1157,92, 1217,21, 1207,86, 1253,95, 1238,65, 1302,38, 1266,72, 1359,16, 1335,94, 1370,05, 1422,73, 1438,38, 1480,37, 1577,30, 1602,05, 2903,59, 2871,91, 2940,30, 2955,31, 3140,15, 3161,21; 1H ЯМР (400 МГц, CDCl3) δ 7,69 (д, J=2,1 Гц, 1H), 7,63 (д, J=7,8 Гц, 1H), 7,28 (дд, J=6,7, 2,6 Гц, 1H), 7,27 (д, J=2,2 Гц, 1H), 3,82 (с, 4H), 1,05 (с, 6H); ESIMS m/z 265 ([M+H]+), 263([M-H]-).
Получение 35: 2-(Бензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(бензофуран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
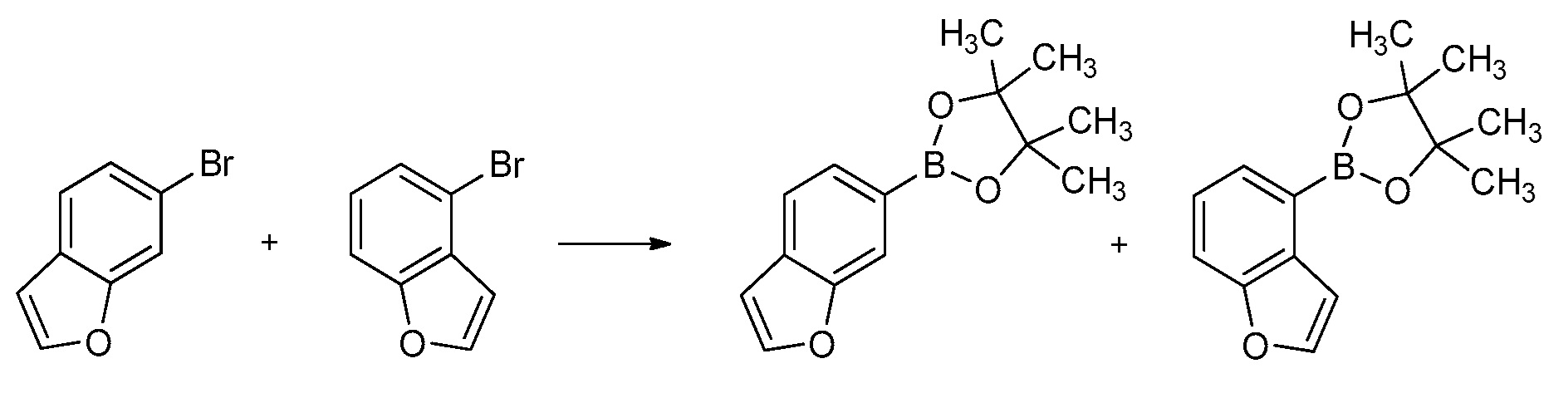
[00173] 2-(Бензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(бензофуран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан получали, как описано в Получении 55, из 4-бромбензофурана и 6-бромбензофурана, с получением смеси в виде прозрачного масла (48%): 1H ЯМР (400 МГц, CDCl3) δ 7,97 (с, 1H), 7,72 - 7,68 (м, 1H), 7,66 (дд, J=4,9, 2,6 Гц, 2H), 7,60 (дд, J=8,0, 5,2 Гц, 2H), 7,30 (дд, J=7,1, 6,2 Гц, 1H), 7,28 - 7,21 (м, 2H), 6,77 (дд, J=2,1, 0,8 Гц, 1H), 1,37 (д, J=6,2 Гц, 22H), 1,29 - 1,22 (м, 8H); 13C ЯМР (101 МГц, CDCl3) δ 146,01, 145,21, 130,19, 130,11, 128,76, 123,56, 120,60, 117,60, 114,05, 108,45, 106,63, 83,82, 83,69, 83,50, 25,02, 24,98, 24,88; ESIMS m/z 245 ([M+H]+), 243([M-H]-).
Получение 36: 2-(6-Фторбензофуран-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(4-фторбензофуран-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
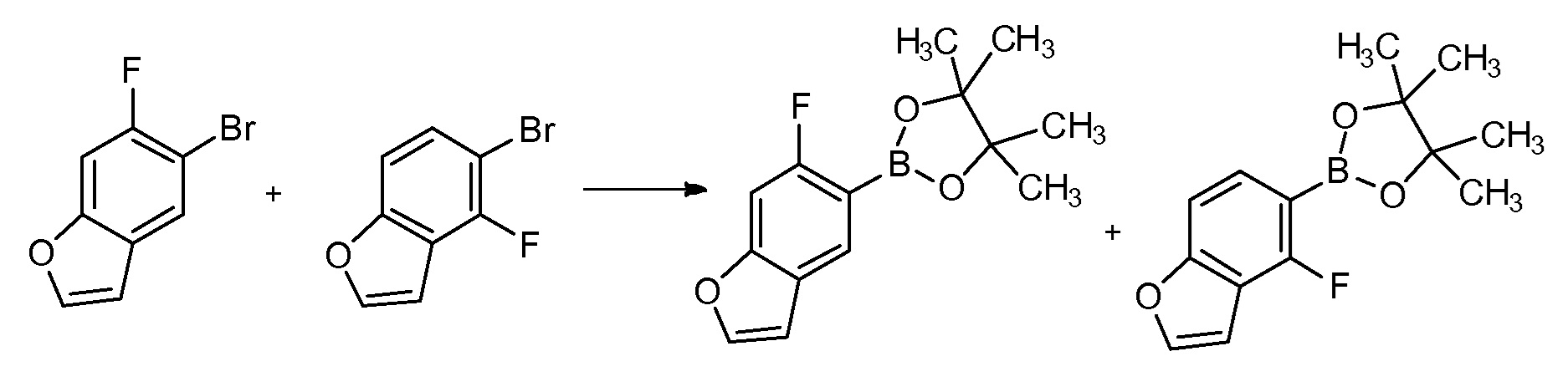
[00174] Смесь 5-бром-6-фторбензофурана и 5-бром-4-фторбензофурана (1 объединенный эквивалент), ацетата калия (KOAc; 3 экв.) и бис(пинаколато)дибора (1,2 экв.) перемешивали в диоксане (0,1M в расчете на смесь 5-бром-6-фторбензофурана и 5-бром-4-фторбензофурана) под потоком азота в течение 30 минут. Добавляли катализатор [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (PdCl2(dppf); 0,15 экв.) и поток азота поддерживали в течение 10 минут. Реакционную смесь нагревали до 85°C в течение ночи. Растворитель удаляли, остаток растворяли в метиленхлориде и твердое вещество фильтровали. Фильтрат концентрировали и очищали через колонку, с получением смеси 2-(6-фторбензофуран-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана и 2-(4-фторбензофуран-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (63%): 1H ЯМР (400 МГц, CDCl3) δ 7,98 (д, J=5,7 Гц, 1H), 7,59 (д, J=2,1 Гц, 1H), 7,18 (д, J=9,4 Гц, 1H), 6,73 (д, J=1,3 Гц, 1H), 1,38 (с, 12H); 1H ЯМР (400 МГц, CDCl3) δ 7,81 (д, J=7,0 Гц, 1H), 7,37 (т, J=7,4 Гц, 1H), 7,30 (д, J=8,4 Гц, 1H), 6,87 (с, 1H), 1,38 (с, 12H); 19F ЯМР (376 МГц, CDCl3) δ -107,80, -107,81, -107,82, -107,84, -108,47, -108,48; ESIMS m/z 262 ([M+H]+).
Получение 37: 2-(4-Хлорбензофуран-7-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
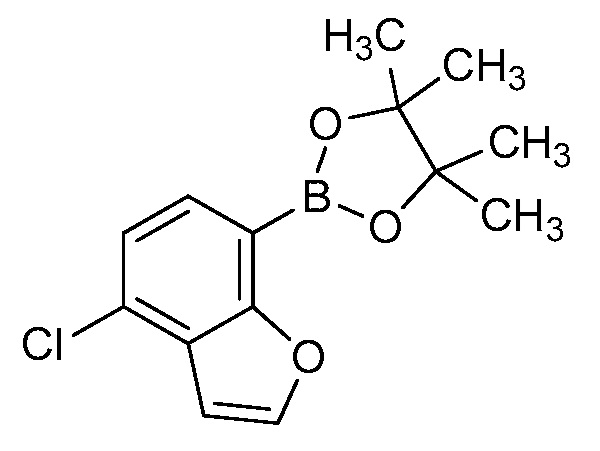
[00175] 2-(4-Хлорбензофуран-7-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан получали, как описано в Получении 36, из 7-бром-4-хлорбензофурана: 1H ЯМР (400 МГц, CDCl3) δ 7,75 (д, J=2,2 Гц, 1H), 7,67 (д, J=7,8 Гц, 1H), 7,24 (д, J=7,8 Гц, 1H), 6,86 (д, J=2,2 Гц, 1H), 1,41 (с, 12H); ESIMS m/z 278 ([M+H]+).
Получение 38: 2-(5-Фторбензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
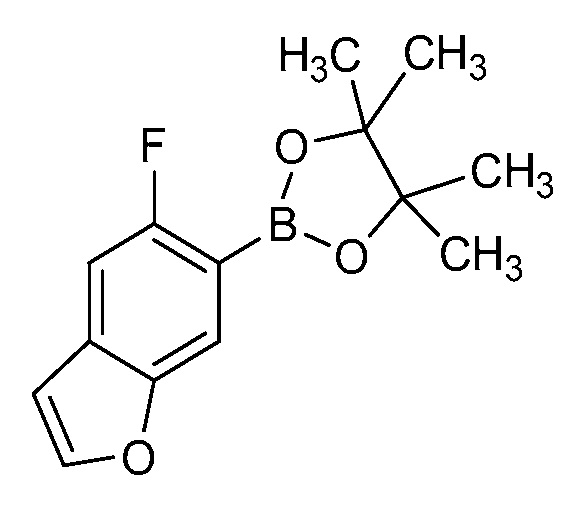
[00176] 2-(5-Фторбензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан получали, как описано в Получении 36, из 6-бром-5-фторбензофурана: 1H ЯМР (400 МГц, CDCl3) δ 7,85 (д, J=4,3 Гц, 1H), 7,68 (д, J=2,2 Гц, 1H), 7,24 - 7,20 (м, 1H), 6,75 - 6,70 (м, 1H), 1,38 (с, 12H); 19F ЯМР (376 МГц, CDCl3) δ -110,23 (дд, J=9,6, 4,1 Гц); ESIMS m/z 262 ([M+H]+).
Получение 39: 2-(7-Фторбензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
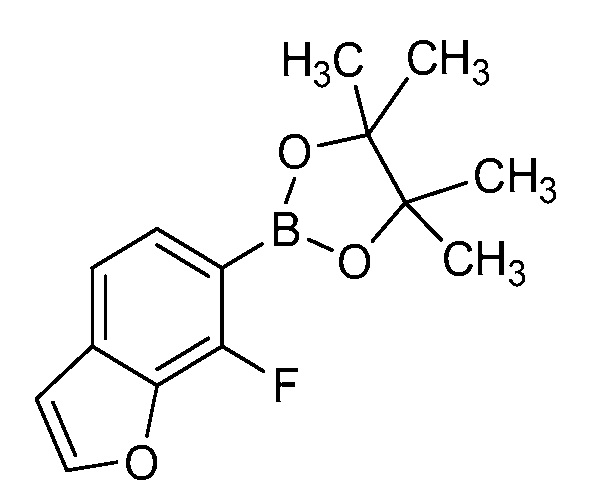
[00177] 2-(7-Фторбензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан получали, как описано в Получении 36, из 6-бром-7-фторбензофурана: 1H ЯМР (400 МГц, CDCl3) δ 7,68 (т, J=3,1 Гц, 1H), 7,55 (дд, J=7,8, 4,5 Гц, 1H), 7,34 (т, J=6,5 Гц, 1H), 6,80 (дд, J=2,9, 2,2 Гц, 1H), 1,38 (с, 12H); 19F ЯМР (376 МГц, CDCl3) δ -127,62 (дд, J=4,2, 3,1 Гц); ESIMS m/z 262 ([M+H]+).
Получение 40: 2-(6-Фторбензо[b]тиофен-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(4-фторбензо[b]тиофен-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан

[00178] 2-(6-Фторбензо[b]тиофен-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(4-фторбензо[b]тиофен-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан получали, как описано в Получении 36, из 5-бром-4-фторбензо[b]тиофена и 5-бром-6-фторбензо[b]тиофена: 1H ЯМР (400 МГц, CDCl3) δ 8,20 (д, J=5,5 Гц, 1H), 7,53 (д, J=9,3 Гц, 1H), 7,35 (д, J=5,5 Гц, 1H), 7,30 (д, J=5,5 Гц, 1H), 1,39 (с, 12H); 1H ЯМР (400 МГц, CDCl3) δ 7,69 - 7,61 (м, 2H), 7,47 (д, J=5,6 Гц, 1H), 7,39 (д, J=5,6 Гц, 1H), 1,39 (с, 12H); 19F ЯМР (376 МГц, CDCl3) δ -107,24, -109,56; ESIMS m/z 278 ([M+H]+).
Получение 41: 2-(5-Фторбензо[b]тиофен-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(5-фторбензо[b]тиофен-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
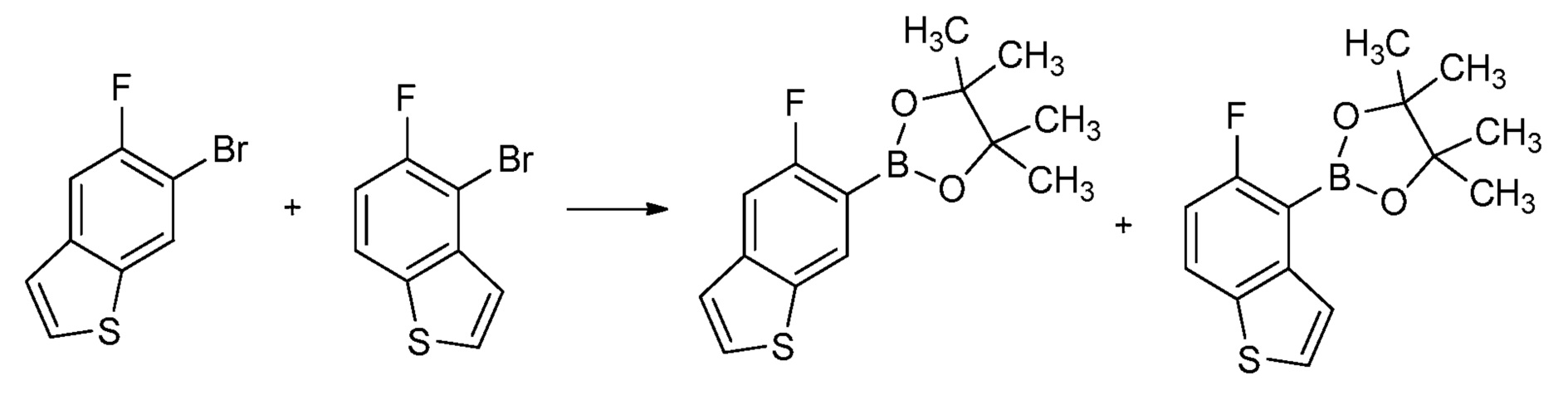
[00179] 2-(5-Фторбензо[b]тиофен-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан и 2-(5-фторбензо[b]тиофен-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан получали, как описано в Получении 36, из 6-бром-5-фторбензо[b]тиофена и 4-бром-5-фторбензо[b]тиофена: 1H ЯМР (400 МГц, CDCl3) δ 8,26 (д, J=5,1 Гц, 1H), 7,59 (д, J=5,4 Гц, 1H), 7,45 (д, J=9,9 Гц, 1H), 7,28 (д, J=5,4 Гц, 1H), 1,39 (с, 12H); 1H ЯМР (400 МГц, CDCl3) δ 7,92 (д, J=5,5 Гц, 1H), 7,88 (дд, J=8,8, 4,9 Гц, 1H), 7,55 (д, J=5,5 Гц, 1H), 7,07 (т, J=9,1 Гц, 1H), 1,42 (с, 12H); 19F ЯМР (376 МГц, CDCl3) δ -107,32, -107,34, -107,35, -107,36, -111,00, -111,02, -111,02, -111,03, -111,04, -111,04; ESIMS m/z 278 ([M+H]+).
Получение 42: 2-(Бензо[b]тиофен-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
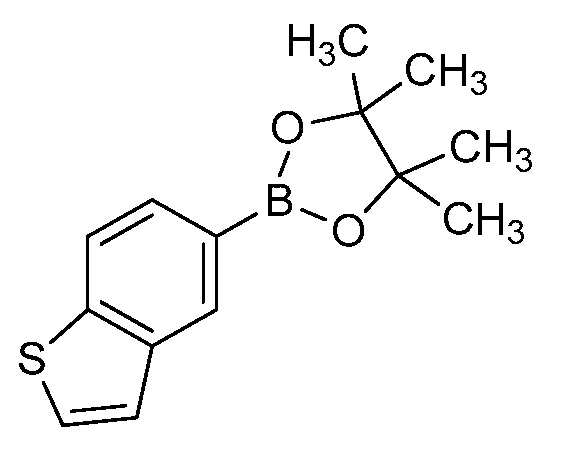
[00180] 6-Бромбензо[b]тиофен (3,09 г, 14,5 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (4,42 г, 17,4 ммоль), PdCl2(dppf)(0,54 г, 0,74 ммоль) и KOAc (2,89 г, 29,4 ммоль) в безводном диоксане (48 мл) перемешивали при температуре кипения с обратным холодильником при 80°C в течение 4 часов. Реакционную смесь охлаждали и разбавляли этилацетатом, фильтровали через слой Целита и промывали насыщенным солевым раствором. Водный слой экстрагировали этилацетатом. Органические слои сушили, фильтровали и адсорбировали на силикагель. Очистка флэш-хроматографией (0 - 30% этилацетата/гексан) давала 2-(бензо[b]тиофен-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (3,266 г, 87%) в виде желтого маслянистого твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 8,38 (д, J=0,7 Гц, 1H), 7,79 (ддд, J=20,2, 8,0, 0,8 Гц, 2H), 7,51 (д, J=5,5 Гц, 1H), 7,34 (дд, J=5,4, 0,7 Гц, 1H), 1,37 (с, 12H); 13C ЯМР (101 МГц, CDCl3) δ 141,78, 129,75, 129,58, 128,18, 123,87, 122,94, 83,89, 24,92; EIMS m/z 260.
Получение 43: 5-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
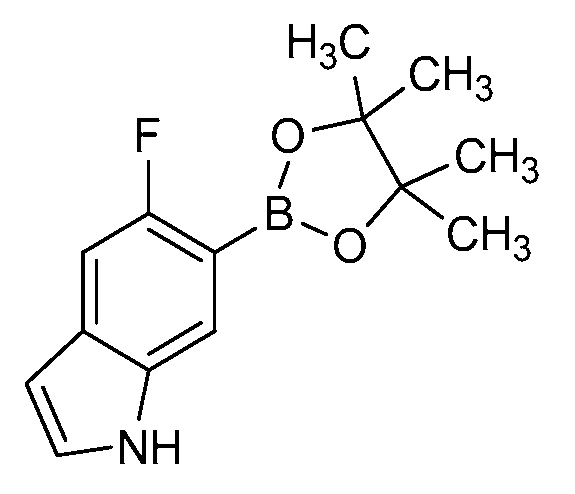
[00181] В круглодонную колбу загружали 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (1,424 г, 5,61 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (0,342 г, 0,467 ммоль) и ацетат калия (0,917 г, 9,34 ммоль) в виде твердых веществ. Колбу герметично закрывали и откачивали и продували (3x) инертным газом. Затем добавляли 6-бром-5-фтор-1H-индол (1,0 г, 4,67 ммоль) в диоксане (15,57 мл). Реакционную смесь перемешивали и нагревали до внутренней температуры 85°C. Через 18 часов реакционную смесь охлаждали и фильтровали через слой Целита, промывая избыточным количеством этилацетата. Фильтрат разбавляли водой и разделяли. Водный слой экстрагировали этилацетатом (3 × 15 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с использованием системы очистки Teledyne ISCO с системой градиентного элюирования с использованием этилацетата и гексана, с получением указанного в заголовке соединения в виде твердого вещества персикового цвета (656 мг, 54%): 1H ЯМР (400 МГц, DMSO-d6) δ 1,31 (с, 12H), 6,42 (ддд, J=2,9, 1,9, 0,9 Гц, 1H), 7,22 (д, J=10,5 Гц, 1H), 7,52 (т, J=2,8 Гц, 1H), 7,69 (д, J=4,8 Гц, 1H), 11,24 (с, 1H); 19F ЯМР (376 МГц, DMSO-d6) δ -116,07; ESIMS m/z 262,0 ([M+H]+), 260,0 ([M-H]-).
Получение 44: 7-Бром-4-хлор-1H-индол
[00182] К раствору 1-бром-4-хлор-2-нитробензола (932 мг, 3,95 ммоль) в тетрагидрофуране (10 мл) добавляли по каплям винилмагнийбромид (0,7 M в тетрагидрофуране; 12 ммоль) в тетрагидрофуране (15 мл) при -40°C. Через 1 час реакционную смесь выливали в насыщенный раствор хлорида аммония (NH4Cl). Полученный органический слой концентрировали. Полученный остаток очищали с использованием Teledyne ISCO системы хроматографии с системой градиентного элюирования, включающей 2% этилацетата в гексане, с получением указанного в заголовке соединения (400 мг, 44%): 1H ЯМР (300 МГц, CDCl3) δ 6,73 (т, J=2,8 Гц, 1H), 7,02 (д, J=8,1 Гц, 1H), 7,19 - 7,39 (м, 2H), 8,43 (с, 1H).
Получение 45: 4-Бром-7-хлор-1H-индол
[00183] 4-Бром-7-хлор-1H-индол получали из 4-бром-1-хлор-2-нитробензола, как описано в Получении 44: 1H ЯМР (300 МГц, CDCl3) δ 6,49 - 6,74 (м, 1H), 7,07 (д, J=8,1 Гц, 1H), 7,15 - 7,42 (м, 2H), 8,49 (с, 1H).
Получение 46: 6-Бром-7-фтор-1H-индол
[00184] 6-Бром-7-фтор-1H-индол получали из 1-бром-2-фтор-3-нитробензола, как описано в Получении 44 (250 мг, 25,2%): 1H ЯМР (300 МГц, CDCl3) δ 6,52 - 6,62 (м, 1H), 7,13 - 7,34 (м, 3H), 8,38 (с, 1H); ESIMS m/z 215,0 ([M+H]+).
Получение 47 (Пример предшественника 1): 4-Хлор-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
[00185] К раствору 7-бром-4-хлор-1H-индола (8 г, 0,03 моль) в диоксане добавляли KOAc (9,8 г, 0,1 моль), дихлор[1,1'-бис(дифенилфосфино)ферроцен]-палладий(II) (2,19 г, 0,003 моль) и 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (13,2 г, 0,052 моль) в виде твердых веществ. Реакционную смесь помещали в инертную атмосферу и колбу герметично закрывали. Реакционную смесь нагревали до 100°C в течение 16 часов. Реакционную смесь затем обрабатывали при помощи H2O и экстрагировали этилацетатом. Органический слой отделяли и концентрировали. Полученный остаток очищали с использованием Teledyne ISCO системы хроматографии с системой градиентного элюирования, включающей этилацетат в гексане, с получением указанного в заголовке соединения (1,3 г, 15,6%): 1H ЯМР (300 МГц, CDCl3) δ 1,40 (с, 12H), 6,58 - 6,73 (м, 1H), 7,14 (д, J=7,6 Гц, 1H), 7,28 - 7,36 (м, 1H), 7,56 (д, J=7,6 Гц, 1H), 9,34 (с, 1H).
Получение 48: 7-Хлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
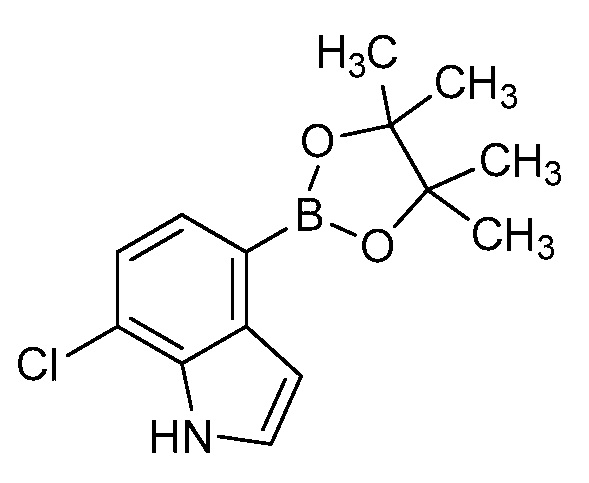
[00186] 7-Хлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол получали, как описано в Получении 47, из 4-бром-7-хлор-1H-индола (4,2 г, 43,7%): 1H ЯМР (300 МГц, CDCl3) δ 1,38 (с, 26H), 7,08 (дд, J=3,2, 2,2 Гц, 1H), 7,20 (д, J=7,6 Гц, 1H), 7,30 (т, J=2,8 Гц, 1H), 7,56 (д, J=7,6 Гц, 1H), 8,40 (с, 1H).
Получение 49 (Пример предшественника 2): 7-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
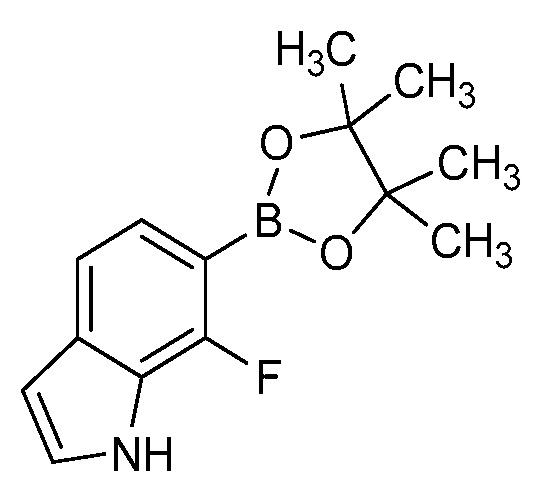
[00187] 7-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол получали, как описано в Получении 47, из 6-бром-7-фтор-1H-индола (150 мг, 45,5%): 1H ЯМР (300 МГц, CDCl3) δ 1,26 (с, 25H), 1,39 (с, 24H), 7,27 (д, J=4,5 Гц, 2H), 7,40 (д, J=2,6 Гц, 2H), 8,43 (с, 1H); 19F ЯМР (282 МГц, CDCl3) δ -124,52; 13C ЯМР (101 МГц, CDCl3) δ 24,87 (д, J=15,9 Гц), 77,30, 83,49 (д, J=6,9 Гц), 103,25, 115,98 (д, J=3,3 Гц), 126,08 (д, J=7,7 Гц).
Получение 50 (Пример предшественника 3): 7-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-(триизопропилсилил)-1H-индол
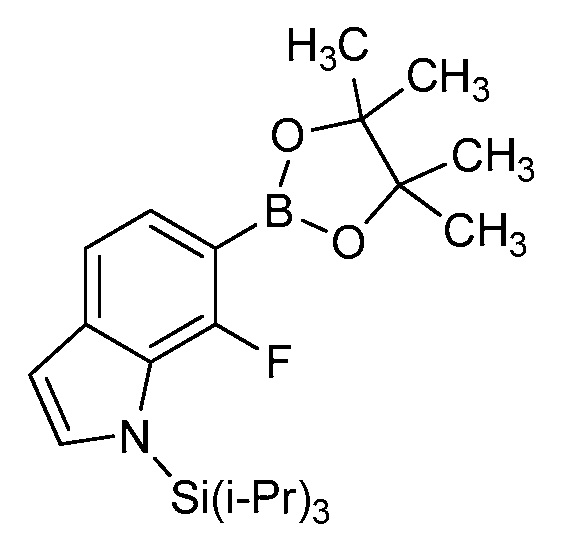
[00188] 7-Фтор-1-(триизопропилсилил)-1H-индол (4,0 г, 14 ммоль) (получен в соответствии с M. Schlosser, et al.,Eur. J. Org. Chem. 2006, 2956-2969) растворяли в 30 мл безводного ТГФ, охлаждали до -75°C, обрабатывали по порциям втор-бутиллитием (10 мл, 1,4 M, 14 ммоль) и перемешивали в течение 2 часов при -75°C. Добавляли по порциям 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (3,0 мл, 2,7 г, 14 ммоль) и смесь перемешивали в течение 1 часа при -75°C. Охлаждающую баню удаляли и температуре allowed повыситься до 5°C в течение 30 минут. Реакцию гасили путем добавления 5 мл насыщенного раствора NH4Cl и смесь распределяли между этилацетатом и водой. Органическую фазу промывали насыщенным раствором хлорида натрия (NaCl), сушили (Na2SO4), упаривали на силикагеле и очищали флэш-хроматографией (SiO2; элюировали гексаном), с получением указанного в заголовке соединения в виде вязкого масла (4,2 г, 73%): 1H ЯМР (400 МГц, CDCl3) δ 7,43 (дд, J=7,9, 4,6 Гц, 1H), 7,38 (м, 2H), 1,75 (м, 3H), 1,38 (с, 12H), 1,13 (д, J=7,6 Гц, 18H);19F ЯМР (376 МГц, CDCl3) δ -113,07; EIMS m/z 417.
Получение 51: 2-Этинил-4,6-дифторанилин
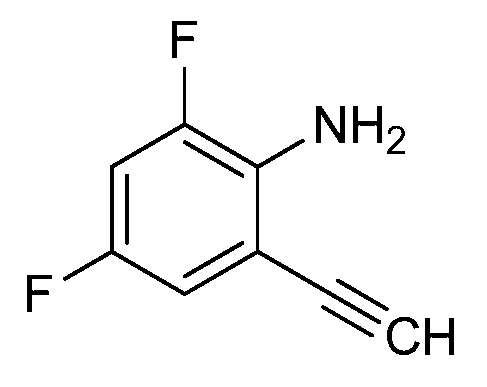
[00189] Стадия 1: 2-Бром-4,6-дифторанилин (10 г, 48 ммоль), иодид меди (I) (CuI; 180 мг, 0,96 ммоль), бис(трифенилфосфин)палладий(II) хлорид (680 мг, 0,96 ммоль) и этинилтриметилсилан (7,1 г, 72 ммоль) объединяли с 10 мл безводного DMF и нагревали до 50°C в течение 18 часов. Добавляли дополнительные 2 мл этинилтриметилсилана, 200 мг бис(трифенилфосфин)палладий(II) хлорида и 60 мг CuI и нагревание продолжали в течение 4 часов. После охлаждения смесь разбавляли этилацетатом и перемешивали с 1 н раствором хлористоводородной кислоты (HCl). Темную смесь фильтровали через Целит для удаления мелких твердых частиц. Органическую фазу промывали водой, насыщенным раствором NaCl, сушили и концентрировали. Очистка флэш-хроматографией (SiO2, элюировали смесью 0-20% EtOAc в гексане) давала 9 г вещества, которое состояло при соотношении 70/30 из TMS алкинового производного и исходного бромида.
[00190] Стадия 2: Смесь подвергали десилилированию без дополнительной очистки. TMS производное растворяли в метаноле (500 мл) и обрабатывали при помощи 8,5 г KF. Образовывался прозрачный раствор, который перемешивали в течение ночи при комнатной температуре (RT). Основную часть летучих веществ удаляли в вакууме, остаток поглощали в этилацетат и промывали водой и насыщенным раствором NaCl. Раствор сушили, упаривали и очищали флэш-хроматографией (SiO2, элюировали смесью 0-10% этилацетата в гексане) с получением указанного в заголовке соединения (4,2 г, чистота 70% по данным газовой хроматографии с использованием пламенно-ионизационного детектора (FID-GC)): 1H ЯМР (400 МГц, CDCl3) δ 6,83 (м, 1H), 4,13 (м, 1H), 3,46 (с, 1H);19F ЯМР (376 МГц, CDCl3) δ -124,04, -124,88, -126,94, -130,08; EIMS m/z 153. Это вещество использовали на стадии циклизации без дополнительной очистки.
Получение 52: 5,7-Дифтор-1H-индол
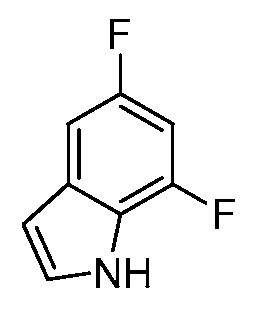
[00191] Неочищенный 2-этинил-4,6-дифторанилин (4,2 г, 19 ммоль) из предыдущего Получения растворяли в этаноле (75 мл), обрабатывали натрий-золото(III) хлоридом дигидратом (310 мг, 0,77 ммоль) и перемешивали в течение 3 часов в атмосфере азота. Смесь концентрировали, поглощали в этилацетат, промывали водой, промывали насыщенным раствором NaCl, сушили над сульфатом натрия (Na2SO4) и упаривали. Очистка флэш-хроматографией (SiO2, 100-200 меш; элюировали смесью 0-15% EtOAc в гексане, содержащей 2% уксусной кислоты) давала указанный в заголовке продукт (2,0 г, чистота ~ 85%): 1H ЯМР (400 МГц, CDCl3) δ 8,32 (с, 1H), 7,26 (дд, J=4,8, 2,0 Гц, 1H), 7,09 (дд, J=9,1, 2,2 Гц, 1H), 6,74 (ддд, J=11,2, 9,3, 2,0 Гц, 1H), 6,55 (тд, J=3,3, 2,2 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -122,11, -131,96; EIMS m/z 153.
Получение 53: 5,7-Дифтор-1-(триизопропилсилил)-1H-индол
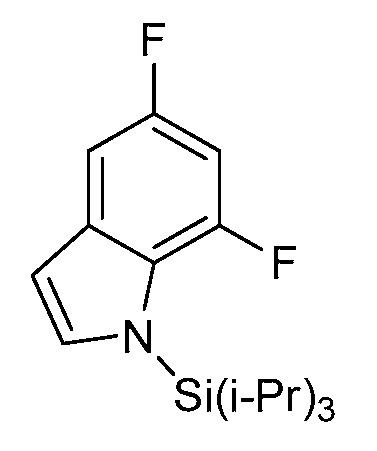
[00192] N-Бутиллитий (2,7 мл, 2,5 M, 6,9 ммоль) добавляли к 10 мл безводного ТГФ при -70°C. К раствору добавляли по порциям 5,7-дифтор-1H-индол (1,0 г, 6,5 ммоль) в 5 мл ТГФ и смесь перемешивали в течение 30 минут при -75°C. Добавляли триизопропилхлорсилан (1,5 мл, 1,3 г, 6,9 ммоль), перемешивание продолжали в течение 1 часа при -75°C и затем смеси давали нагреться до -5°C в течение 2 часов. После обработки при помощи 5 мл насыщенного раствора NH4Cl смесь смешивали с 30 мл диэтилового эфира и органическую фазу промывали при помощи 5 мл насыщенного раствора NaCl, сушили (Na2SO4) и упаривали. Продукт очищали флэш-хроматографией (SiO2; гексан) с получением указанного в заголовке соединения в виде прозрачного масла (1,5 г; 74%): 1H ЯМР (400 МГц, CDCl3) δ 7,35 (д, J=3,1 Гц, 1H), 7,07 (дд, J=8,7, 2,3 Гц, 1H), 6,69 (м, 1H), 6,59(т, J=3,1 Гц, 1H), 1,67 (м, 3H), 1,13 (д, J=7,6 Гц, 18H); 19F ЯМР (376 МГц, CDCl3) δ -120,64, -120,65, -122,49, -122,49; EIMS m/z 309.
Получение 54: 5,7-Дифтор-6-иод-1-(триизопропилсилил)-1H-индол
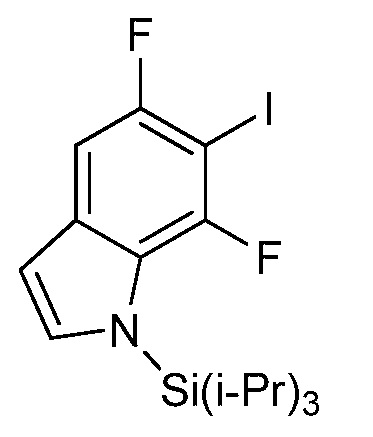
[00193] 5,7-Дифтор-1-(триизопропилсилил)-1H-индол (1,4 г, 4,5 ммоль) и пентаметилдиэтилен-триамин( 830 мг, 4,8 ммоль) объединяли в 10 мл безводного ТГФ, охлаждали до -70°C и обрабатывали по порциям втор-бутиллитием (3,4 мл, 1,4 M, 4,8 ммоль) и перемешивали в течение 3 часов при этой температуре. Добавляли иод (1,3 г, 5,0 ммоль) в 5 мл ТГФ, смесь перемешивали в течение 50 минут, гасили путем добавления 3 мл насыщенного раствора NH4Cl и распределяли между диэтиловым эфиром и водой. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4), упаривали и очищали флэш-хроматографией (SiO2; гексан) с получением указанного в заголовке соединения в виде прозрачного масла, которое отверждалось при выстаивании (1,9 г, 90%): т.пл. 74-76°C; 1H ЯМР (400 МГц, CDCl3) δ 7,34 (д, J=3,1 Гц, 1H), 7,14 (дд, J=7,7, 0,9 Гц, 1H), 6,60 (т, J=3,1 Гц, 1H), 1,67 (м, 3H), 1,13 (д, J=7,6 Гц, 18H); 19F ЯМР (376 МГц, CDCl3) δ -101,37, -105,33.
Получение 55: 2-(2,2-диметилбензо[d][1,3]диоксол-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
[00194] К DMSO (10 мл) добавляли ацетат калия (1,671 г, 17,03 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (1,729 г, 6,81 ммоль), 5-бром-2,2-диметилбензо[d][1,3]диоксол (1,3 г, 5,68 ммоль) и PdCl2(dppf) (0,415 г, 0,568 ммоль). Реакционную смесь нагревали до внешней температуры 80°C в течение 18 часов. После охлаждения реакционную смесь выливали в 50 мл ледяной воды. Смесь в ледяной воде переносили в делительную воронку и два раза экстрагировали при помощи EtOAc (50 мл). Органические слои объединяли, сушили над Na2SO4 и фильтровали. Раствор концентрировали на 5г целита с использованием EtOAc в качестве растворителя. Пропитанный целит загружали в систему очистки Teledyne Isco и очищали хроматографией на силикагеле с использованием 0-30% EtOAc:гексан, с получением 2-(2,2-диметилбензо[d][1,3]диоксол-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (767мг, 49%) в виде красного полутвердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 7,31 (дт, J=6,6, 3,3 Гц, 1H), 7,15 (с, 1H), 6,74 (д, J=7,7 Гц, 1H), 1,66 (с, 6H), 1,32 (с, 12H); 13C ЯМР (101 МГц, CDCl3) δ 129,21 (с), 113,78 (с), 108,15 (с), 83,59 (с), 25,86 (с), 24,82 (с); ESIMS m/z 277 ([M+H]+), 275 ([M-H]-).
ПРИМЕРЫ СИНТЕЗА СОЕДИНЕНИЙ ФОРМУЛЫ (I)
Пример 1. Метил 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколинат (Соединение № 1.14)
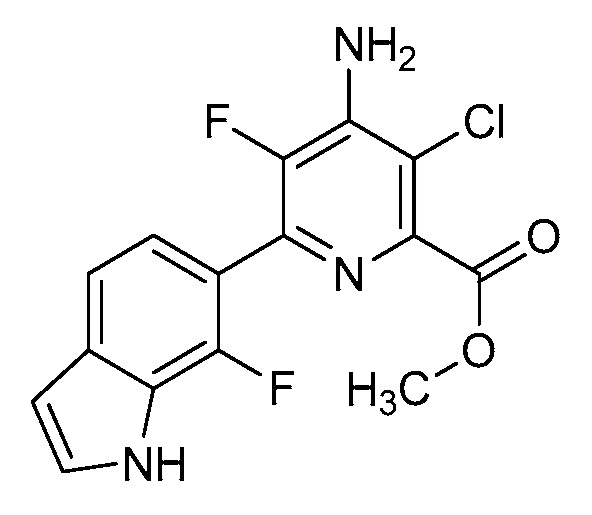
[00195] Метил 4-амино-3,6-дихлор-5-фторпиколинат (0,650 г, 2,72 ммоль), 7-фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол (0,817 г, 3,13 ммоль), бис(трифенилфосфин)палладий(II) хлорид (0,191 г, 0,272 ммоль) и фторид цезия (0,826 г, 5,44 ммоль) объединяли в ацетонитриле (4,53 мл) и воде (4,53 мл). Реакционную смесь подвергали облучению в микроволновом устройстве Biotage Initiator при 110°C в герметично закрытом сосуде в течение 30 минут. Охлаждали реакционную смесь распределяли между этилацетатом и водой. Органическую фазу сушили и концентрировали. Продукт очищали флэш-хроматографией (SiO2; элюировали смесью 5-40% этилацетата в гексане) с получением указанного в заголовке соединения в виде белого твердого вещества (0,517 г, 52,4% выход). Примечание: В некоторых примерах, в которых имеются ссылки на этот конкретный пример, фторид цезия заменяли фторидом калия.
[00196] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 1».
Пример 2: Метил 4-амино-3-хлор-5-фтор-6-(1H-индол-5-ил)пиколинат (Соединение № 1.2)
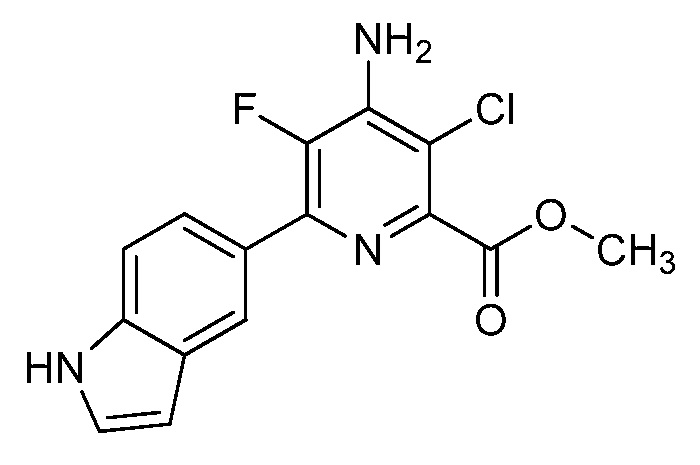
[00197] 1H-Индол-5-илбороновую кислоту (220 мг, 1,4 ммоль, 1,1 экв.) и метил 4-амино-3,6-дихлор-5-фторпиколинат (300 мг, 1,3 ммоль, 1,0 экв.) последовательно добавляли в 5-мл Biotage микроволновой сосуд, с последующим добавлением фторида цезия (380 мг, 2,5 ммоль, 2,0 экв.), палладий(II) ацетат (14 мг, 0,063 ммоль, 0,05 экв.) и 3,3',3''-фосфинтриилтрибензолсульфоната натрия (71 мг, 0,13 ммоль, 0,10 экв.). Добавляли 3:1 смесь вода:ацетонитрил (2,5 мл) и полученн темно-коричневую смесь помещали в Biotage микроволновой сосуд и нагревали до 150°C в течение 5 минут, с внешним ИК-сенсорным температурным контролем со стороны сосуда. Охлажденную реакционную смесь разбавляли водой (50 мл) и экстрагировали дихлорметаном (15 × 30 мл). Объединенные органические слои сушили (сульфат натрия), подвергали гравитационному фильтрованию и концентрировали на роторном испарителе. Остаток очищали обращенно-фазовой колоночной хроматографией (градиент 5% ацетонитрила до 100% ацетонитрила) с получением указанного в заголовке соединения в виде желто-коричневого порошка (290 мг, 73%).
[00198] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 2».
Пример 3: Метил 4-амино-6-(бензо[d]тиазол-5-ил)-3-хлор-5-фторпиколинат (Соединение № 6.1)

[00199] В 5-мл микроволновой сосуд сосуд добавляли метил 4-амино-6-бром-3-хлор-5-фторпиколинат (200 мг, 1,0 ммоль), бензо[d]тиазол-5-илбороновую кислоту (237 мг, 1,35 ммоль), фторид калия (KF; 122 мг, 2,12 ммоль), TPPTS-Na (трис-(3-сульфонатнофенил)-фосфин 4-гидрат натриевая соль, 67 мг, 0,106 ммоль) и Pd(OAc)2 (11 мг, 0,053 ммоль). Затем добавляли CH3CN (1,0 мл) и H2O (3,0 мл) и реакционный сосуд герметично закрывали и нагревали в микроволновом устройстве Biotage при 150°C в течение 5 минут, с внешним ИК-сенсорным температурным контролем со стороны сосуда. Реакционную смесь охлаждали до комнатной температуры и разбавляли дихлорметаном и промывали водой. Органические экстракты объединяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали путем растирания в порошок с диэтиловым эфиром (Et2O) с получением указанного в заголовке соединения в виде коричневого твердого вещества (172 мг, 51%).
[00200] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 3».
Пример 4: Метил 4-амино-6-(бензо[b]тиофенил-5-ил)-3,5-дихлорпиколинат (Соединение № 3.1)
[00201] В 5-мл микроволновой сосуд добавляли метил 4-амино-3,5,6-трихлорпиколинат (0,232 г, 0,909 ммоль), 2-(бензо[b]тиофен-5-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,260 г, 0,999 ммоль), фторид цезия (0,276 г, 1,817 ммоль) и (PPh3)2PdCl2 (0,064 г, 0,091 ммоль). Реакционный сосуд затем герметично закрывали и помещали в инертную атмосферу. Затем добавляли диоксан (4,0 мл) и H2O (1,0 мл) и реакционную смесь нагревали в Biotage микроволновом сосуде при 120°C в течение 60 минут, с внешним ИК-сенсорным температурным контролем со стороны сосуда. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом (5 мл) и выливали в насыщенный солевой раствор. Слои разделяли и водную фазу экстрагировали этилацетатом (3 × 10 мл). Органические экстракты объединяли, сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с использованием системы очистки Teledyne ISCO с системой градиентного элюирования, включающей этилацетат и гексан. Дополнительную очистку осуществляли, при необходимости, с использованием систем Teledyne ISCO с обращенной фазой с системой градиентного элюирования, включающей ацетонитрил и H2O, с получением указанного в заголовке соединения в виде белого твердого вещества.
[00202] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 4».
Пример 5: Метил 4-амино-3-хлор-6-(7-хлорбензофуран-4-ил)-5-фторпиколинат (Соединение № 2.16)
[00203] Фторид калия (0,365 г, 6,28 ммоль), палладий диацетат (0,047 г, 0,209 ммоль), 2-(7-хлорбензофуран-4-ил)-5,5-диметил-1,3,2-диоксаборинан (0,609 г, 2,301 ммоль), 3,3',3''-фосфинтриилтрибензолсульфонат натрия тетрагидрат (0,134 г, 0,209 ммоль) и метил 4-амино-3,6-дихлор-5-фторпиколинат (0,5 г, 2,092 ммоль) объединяли в микроволновом реакционном сосуде. К смеси добавляли воду (3 мл) и ацетонитрил (1 мл). Реакционную смесь нагревали при 150°C в микроволновом реакторе в течение 6 минут. Охлажденную реакционную смесь разбавляли этилацетатом и водой и фильтровали через ватный тампон. Органическую фазу сушили (Na2SO4) и концентрировали в вакууме. Очистка методом обращенно-фазовой хроматографии давала указанное в заголовке соединение в виде белого твердого вещества (127 мг, 12,5% выход).
[00204] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 5».
Пример 6 Метил 4-амино-3-хлор-6-(7-фтор-1H-индол-6-ил)пиколинат (Соединение № 1.22)
[00205] Метил 4-ацетамидо-3,6-дихлорпиколинат (400 мг, 1,520 ммоль), 7-фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол (437 мг, 1,673 ммоль), фторид цезия (462 мг, 3,04 ммоль) и (PPh3)2PdCl2 (107 мг, 0,152 ммоль) загружали в виде твердых веществ в микроволновой реакционный сосуд и добавляли диоксан (4 мл) и воду (1 мл). Реакционный сосуд герметично закрывали и подвергали облучению в микроволновом устройстве Biotage Initiator при 110°C в течение 2 часов, с внешним ИК-сенсорным температурным контролем со стороны. Реакционную смесь распределяли между этилацетатом и водой. Органическую фазу фильтровали и концентрировали. Промежуточный продукт очищали флэш-хроматографией (ISCO диоксид кремния 40 г 10-75% EtOAc: Гексан 16 CV). Фракции, содержащие продукт, объединяли и концентрировали с получением 524 мг белого твердого промежуточного продукта метил 4-ацетамидо-3-хлор-6-(7-фтор-1H-индол-6-ил)пиколината (0,524 г, 1,448 ммоль), который затем разбавляли метанолом (10,0 мл). Затем добавляли ацетилхлорид (0,725 мл, 10,20 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали досуха. Полученный остаток растворяли в этилацетате и выливали в насыщенный раствор NaHCO3. Слои разделяли и водный слой экстрагировали этилацетатом (3 × 15 мл). Органические экстракты объединяли, промывали насыщенным раствором NaCl, сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с использованием системы очистки Teledyne ISCO с системой градиентного элюирования, включающей этилацетат и гексан, с получением указанного в заголовке соединения в виде белого твердого вещества (365 мг, 79%).
[00206] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 6».
Пример 7: Метил 4-амино-3-хлор-6-(5,7-дифтор-1H-индол-6-ил)пиколинат (Соединение № 1.26)
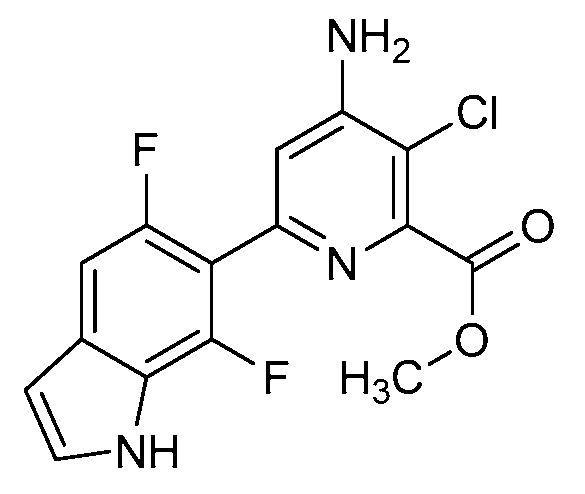
[00207] 5,7-Дифтор-6-иод-1-(триизопропилсилил)-1H-индол (450 мг, 1,0 ммоль), метил 4-ацетамидо-3-хлор-6-(триметилстаннил)пиколинат (450 мг, 1,1 ммоль) объединяли в 7 мл безводного DMF, удаляли воздух при помощи потока азота в течение 15 минут, обрабатывали бис(трифенилфосфин)палладий(II) хлоридом (72 мг, 0,10 ммоль) и иодидом меди (I) и нагревали до 60°C в течение 2 часов. Смесь распределяли между этилацетатом и водой. Органическую фазу промывали водой, промывали насыщенным раствором NaCl, сушили (Na2SO4) и упаривали. Очистка флэш-хроматографией (SiO2, 100-200 меш; элюировали смесью 0-30% EtOAc в гексане) давала 200 мг силилированного N-ацетамидного продукта. Это вещество суспендировали в метаноле (15 мл), обрабатывали при помощи 2 мл ацетилхлорида и нагревали при температуре кипения с обратным холодильником в течение 2 часов. Летучие вещества удаляли в вакууме и остаток очищали флэш-хроматографией (SiO2; 0-40% этилацетата в гексане) с получением 30 мг указанного в заголовке соединения плюс 60 мг указанного в заголовке соединения, которое все еще было защищено TIPS группой по азоту индола. TIPS производное растворяли в 5 мл безводного ТГФ, обрабатывали гидратом тетрабутиламмонийфторида (140 мг, 0,5 ммоль) и перемешивали в течение 1 часа при 20°C. Смесь распределяли между 20 мл этилацетата и насыщенным раствором NaCl. Органическую фазу сушили (Na2SO4) и упаривали. Очистка флэш-хроматографией (SiO2; 0-50% этилацетата в гексане) давала еще 30 мг указанного в заголовке соединения в виде белого твердого вещества (60 мг, 16%).
[00208] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 7».
Пример 8: Метил 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколинат (Соединение № 1.14)
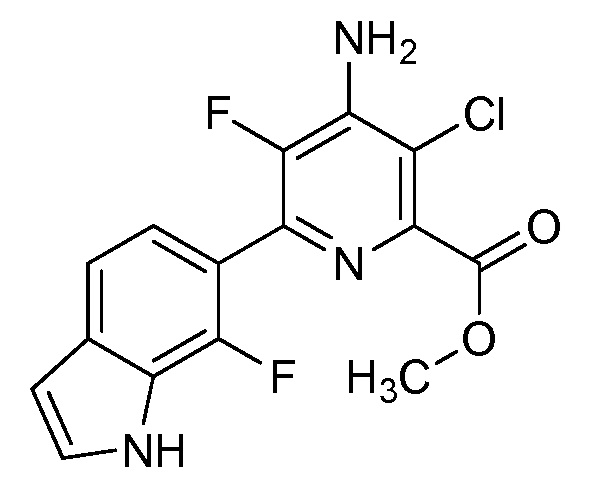
[00209] 7-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-(триизопропилсилил)-1H-индол (500 мг, 1,2 ммоль), метил 4-амино-3,6-дихлор-5-фторпиколинат (290 мг, 1,2 ммоль), фторид цезия (360 мг, 2,4 ммоль) и бис(трифенилфосфин)палладий(II) хлорид (84 мг, 0,12 ммоль) объединяли в 4 мл 1:1 об/об смеси ацетонитрил-вода и нагревали при 115°C в течение 25 минут в микроволновом реакторе Biotage Initiator. Смесь распределяли между этилацетатом и насыщенным раствором NaCl и органическую фазу сушили и упаривали. Очистка флэш-хроматографией (SiO2; элюировали смесью 0-20% этилацетата в дихлорметане) давала содержащий примеси продукт. Это вещество снова очищали флэш-хроматографией (SiO2; элюировали смесью 0-30% этилацетата в гексане) с получением указанного в заголовке соединения в виде белого твердого вещества (220 мг, 52%).
[00210] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 8».
Пример 9: Метил 4-амино-5-фтор-6-(7-фтор-1H-индол-6-ил)-3-винилпиколинат (Соединение № 1.17)
[00211] 7-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-(триизопропилсилил)-1H-индол (320 мг, 0,77 ммоль), метил 4-амино-6-хлор-5-фтор-3-винилпиколинат (190 мг,0,84 ммоль), карбонат натрия (81 мг, 0,77 ммоль) и бис(трифенилфосфин)палладий(II) хлорид (54 мг, 0,08 ммоль) объединяли в 4 мл 1:1 об/об смеси ацетонитрил-вода и нагревали до 115°C в течение 30 минут в микроволновом реакторе Biotage Initiator. Смесь распределяли между этилацетатом и водой. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и упаривали. Очистка флэш-хроматографией(SiO2; элюировали смесью 0-20% этилацетата в гексане) давала 220 мг TIPS-защищенного продукта. Это вещество растворяли в 10 мл ТГФ, обрабатывали гидратом тетрабутиламмонийфторида (260 мг, 1,0 ммоль) и перемешивали в течение 1 часа. Смесь распределяли между насыщенным раствором NaCl и этилацетатом. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и упаривали. Очистка флэш-хроматографией (SiO2; элюировали смесью 0-20% этилацетата в гексане) давала указанное в заголовке соединение в виде белого твердого вещества (100 мг, 37%).
[00212] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 9».
Пример 10: Получение метил 4-амино-3-хлор-5-фтор-6-(7-фтор-1-(триизопропилсилил)-1H-индол-6-ил)пиколината (Соединение 1.12)
[00213] 7-Фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-(триизопропилсилил)-1H-индол (1,0 г, 2,4 ммоль), метил 4-амино-3,6-дихлор-5-фторпиколинат (630 мг, 2,6 ммоль), карбонат натрия (250 мг, 2,4 ммоль) и бис(трифенилфосфин)палладий(II) хлорид (170 мг, 0,24 ммоль) объединяли в 10 мл 1:1 об/об смеси ацетонитрил-вода и нагревали при 110°C в течение 30 минут в микроволновом реакторе Biotage Initiator. Смесь перемешивали с 30 мл этилацетата и 20 мл воды и фильтровали через стекловату для удаления темных твердых веществ. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и упаривали. Очистка флэш-хроматографией (SiO2; элюировали смесью 0-30% этилацетата в гексане) давала указанное в заголовке соединение в виде белого твердого вещества (520 мг; 42%).
[00214] Способ получения, используемый в этом примере, указан в Таблице 10 как «Сочетание 10».
Пример 11: Метил 4-амино-6-(3-бромбензо[b]тиофен-7-ил)-3-хлор-5-фторпиколинат (Соединение № 3.26)
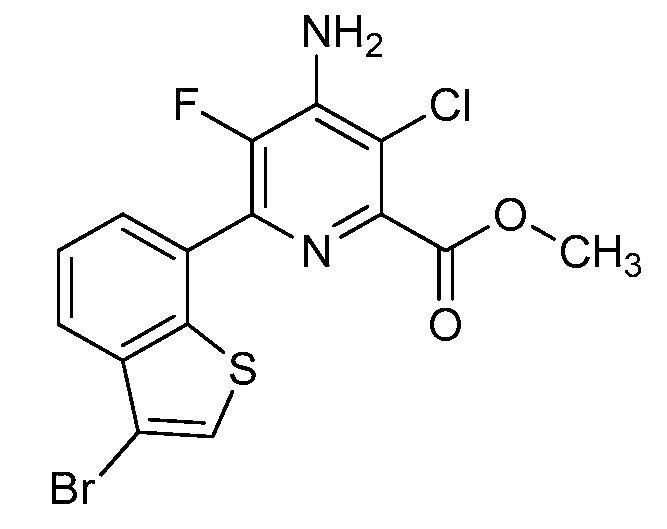
[00215] Метил 4-амино-6-(бензо[b]тиофен-7-ил)-3-хлор-5-фторпиколинат (0,500 г, 1,485 ммоль) растворяли в дихлорметане (9,90 мл) и охлаждали до -5°C на бане с ацетоном, к которому добавляли несколько кусочков сухого льда. Бром (114 мкл, 2,227 ммоль) растворяли в дихлорметане (9,90 мл) и добавляли по каплям. Реакционную смесь перемешивали в течение ночи и затем распределяли между этилацетатом и водой. Органическую фазу сушили и концентрировали и продукт очищали флэш-хроматографией (SiO2; градиент 5-40% этилацетата/гексан) с последующей второй очисткой методом обращенно-фазовой хроматографии, с получением указанного в заголовке соединения в виде серого твердого вещества (0,278 г, 45%).
Пример 12: 4-Амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколиновая кислота(Соединение 1.38)
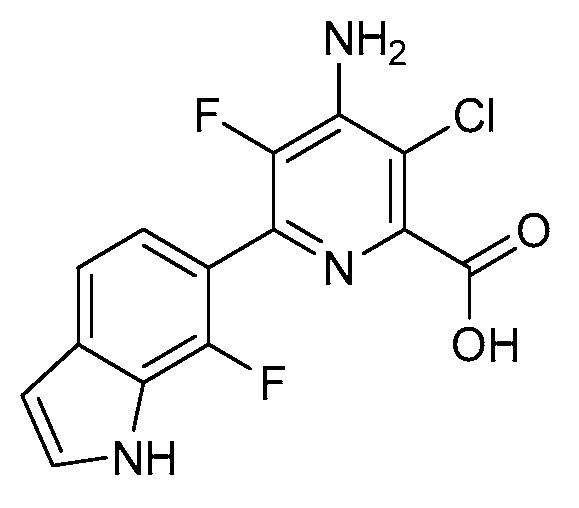
[00216] В реакционный сосуд, содержащий метил 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколинат (0,500 г, 1,481 ммоль), добавляли метанол (14,81 мл) и гидроксид натрия (2,96 мл, 5,92 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, затем подкисляли путем добавления небольшого избытка 2н раствора HCl. Смесь концентрировали и образовавшийся осадой промывали водой и сушили в вакууме с получением 4-амино-3-хлор-5-фтор-6-(7-фтор-1H-индол-6-ил)пиколиновой кислоты (0,400 г, 79% выход) в виде не совсем белого твердого вещества.
[00217] Способ получения, используемый в этом примере, указан в Таблице 10 как «Гидролиз 1:.
Пример 13: 4-Амино-6-(бензо[b]тиофен-5-ил)-3,5-дихлорпиколиновая кислота (Соединение 3.2)
[00218] В 100-мл круглодонной колбе метил 4-амино-6-(бензо[b]тиофен-5-ил)-3,5-дихлорпиколинат (210 мг, 0,595 ммоль) растворяли в метаноле (2,3 мл), тетрагидрофуране (2,3 мл) и H2O (1,2 мл). Добавляли гидроксид лития гидрат (74,8 мг, 1,784 ммоль) в виде твердого вещества. Реакционную смесь перемешивали при комнатной температуре до завершения реакции. Реакционную смесь концентрировали досуха. Полученный остаток растворяли в H2O (2,0 мл) и использовали 1 н раствор HCl для доведения pH до 3,0, что вызывало образование осадка. Эту суспензию экстрагировали этилацетатом (3 × 15 мл). Органические экстракты объединяли, промывали насыщенным раствором NaCl, сушили (MgSO4), фильтровали и концентрировали. При необходимости осуществляли дополнительную очистку полученного твердого вещества с использованием Teledyne ISCO обращено-фазовой системы с системой градиентного элюирования, включающей ацетонитрил и H2O, с получением указанного в заголовке соединения в виде белого твердого вещества (110 мг, 55%).
[00219] Способ получения, используемый в этом примере, указан в Таблице 10 как «Гидролиз 2».
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример A. Оценка послевсходовой гербицидной активности
[00220] Послевсходовое испытание I. Семена испытываемых видов получали от коммерческих поставщиков и высевали в круглый горшок диаметром 5 дюймов(12,7 см), содержащий почвозаменяющую смешанную среду (Metro-Mix 360®, Sun Gro Horticulture). Растения для послевсходовой обработки высевали за 8-12 дней (д) до нанесения средства и культивировали в теплице, оборудованной дополнительными источниками света для обеспечения 16-часового светового периода при 24-29°C. Все горшки поверхностно орошали.
[00221] Приблизительно 10 миллиграмм (мг) каждого соединения растворяли в 1,3 мл ацетон-DMSO (97:3, об/об) и разбавляли с использованием 4,1 мл смеси вода-изопропанол-маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом (78:20:2, об/об/об), содержащей 0,02% Triton X-155. Обработки подвергали серийному разведению с использованием указанной выше композиции растворителя с получением 1,85, 0,926, 0,462 и 0,231 мг/мл испытываемого соединения, вносимого в количестве 2,7 мл/горшок (примерно эквивалентно 4,0, 2,0, 1,0 и 0,5 килограмм на гектар (кг/га), соответственно).
[00222] Сформулированные соединения наносили с использованием DeVilbiss® пневматического опрыскивателя при давлении 2-4 фунта на квадратный дюйм (ф/дюйм2)(0,14-0,28 кг/см2). После обработки горшки возвращали в теплицу на время осуществления эксперимента. Все горшки дополнительно обрабатывали путем подповерхностного орошения, при необходимости, для обеспечения оптимальных условий выращивания. Во все горшки вносили удобрение один раз в неделю путем подповерхностного орошения удобрением Peters Peat-Lite Special® (20-10-20).
[00223] Оценку фитотоксичности осуществляли через 10 дней после обработки в послевсходовый период. Все оценки осуществляли визуально по шкале от 0 до 100, где 0 означает отсутствие активности, и 100 означает полную гибель растения.
[00224] Некоторые из испытываемых соединений, используемые нормы внесения, испытываемые виды растений и результаты представлены в Таблице 13.
|
Пример B. Оценка предвсходовой гербицидной активности
[00225] Предвсходовое Испытание I. Семена испытываемых видов высевали в круглые пластиковые горшки (диаметром 5 дюймов ((12,7 см)), содержащие суглинистую почву. После посадки осуществляли подповерхностное орошение всех горшков за 16 часов до внесения соединения.
[00226] Соединения растворяли в 97:3 об/об (объем/объем) смеси ацетона и DMSO и разбавляли до подходящей концентрации в конечном растворе для нанесения, содержащем воду, ацетон, изопропанол, DMSO и Agri-dex (маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом) в соотношении 59:23:15:1,0:1,5 об/об и 0,02% масс/об (масса/объем) Triton X-155 для получения разбрызгиваемого раствора, содержащего наивысшую норму внесения препарата. Эту высокую концентрацию использовали для серийного разведения указанным выше раствором для обеспечения доставки соединения в количествах 1/2X, 1/4X и 1/8X от наивысшей концентрации (эквивалентно 4,0, 2,0, 1,0 и 0,5 кг/га, соответственно).
[00227] Сформулированное соединение (2,7 мл) наносили/капали через пипетку равномерно по всей поверхности почвы с последующим смешиванием с водой (15 мл). После обработки горшки возвращали в теплицу на время осуществления эксперимента. Теплица имела запрограммированный режим приблизительно 15 часов светового периода, при поддержании температуры при около 23-29°C в течение дня и 22-28°C в течение ночи. Питательные вещества и воду добавляли регулярно путем поверхностного орошения и обеспечивали дополнительное освещение при помощи расположенных сверху металло-галогеновых 1000 Ватт ламп, при необходимости.
[00228] Оценки гербицидного эффекта осуществляли через 14 дней после обработки. Все оценки осуществляли относительно соответствующих контролей по шкале от 0 до 100, где 0 означает отсутствие гербицидного эффекта, и 100 означает гибель растения или отсутствие всходов из почвы. Некоторые из испытываемых соединений, используемые нормы внесения, испытываемые виды растений и результаты представлены в Таблице 14.
|
Пример C. Оценка послевсходовой гербицидной активности
[00229] Послевсходовое испытание II: Семена или орешки желаемого испытываемого вида растений высевали в Sun Gro Metro-Mix® 360 смесь для посадки, которая типично имеет pH от 6,0 до 6,8 и содержание органических веществ около 30 процентов, в пластиковые горшки с площадью поверхности 64 квадратных сантиметров (см2). Когда необходимо было обеспечить хорошую всхожесть и здоровые растения, осуществляли обработку фунгицидом и/или другую химическую или физическую обработку. Растения выращивали в течение 7-21 дней в теплице с приблизительно 15-часовым световым периодом с поддержанием температуры при около 23-29°C в течение дня и 22-28°C в течение ночи. Питательные вещества и воду добавляли регулярно и обеспечивали дополнительное освещение при помощи расположенных сверху металло-галогеновых 1000-Ватт ламп, при необходимости. Растения использовали для испытания, когда они достигали стадии первого или второго настоящего листа.
[00230] Отвешенное количество, определяемое на основании наивысшей испытываемой нормы внесения, каждого испытываемого соединения помещали в 25-мл стеклянный сосуд и растворяли в 4 мл 97:3 об/об смеси ацетона и DMSO с получением концентрированных исходных растворов. Если испытываемое соединение быстро не растворялось, смесь нагревали и/или обрабатывали ультразвуком. Полученные концентрированные исходные растворы разбавляли 20 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, DMSO, Atplus 411F маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом, и Triton® X-155 поверхностно-активное вещество в соотношении 48,5:39:10:1,5:1,0:0,02 об/об для обеспечения растворов для опрыскивания, содержащих самые большие нормы внесения препарата. Дополнительные нормы внесения получали путем серийного разведения 12 мл высококонцентрированного раствора в растворе, содержащем 2 мл 97:3 об/об смеси ацетона и DMSO и 10 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, DMSO, Atplus 411F маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом, и Triton X-155 поверхностно-активное вещество, в соотношении 48,5:39:10:1,5:1,0:0,02 об/об с получением 1/2X, 1/4X, 1/8X и 1/16X разведений высококонцентрированного раствора. Количество соединения определяли из расчета 12 мл объема нанесения при норме 187 литров на гектар (л/га). Сформулированные соединения наносили на растительный материал с использованием машины для разбрызгивания химикатов Mandel, оборудованной 8002E выпускными отверстиями, откалиброванными для распределения 187 л/га на обрабатываемой площади 0,503 квадратных метров при при разбрызгивании на высоте 18 дюймов (43 см) выше средней высоты кроны растения. Контрольные растения опрыскивали таким же способом с использованием холостого растворителя.
[00231] Обрабатываемые растения и контрольные растения помещали в теплицу, как описано выше, и поливали путем подповерхностного орошения для предотвращения вымывания испытываемых соединений. Через 14 дней состояние испытываемых растений по сравнению с необработанными растениями определяли визуально и оценивали по шкале от 0 до 100 процентов, где 0 соответствует отсутствию поражений, и 100 соответствует полному уничтожению. Некоторые из соединений, которые были испытаны, используемые нормы внесения препарата, испытываемые виды растений и результаты представлены в Таблицах 15 и 16.
Таблица 15
Послевсходовое испытание II. Гербицидная активность в отношении ключевых широколиственных сорняков и вида сельскохозяйственной культуры
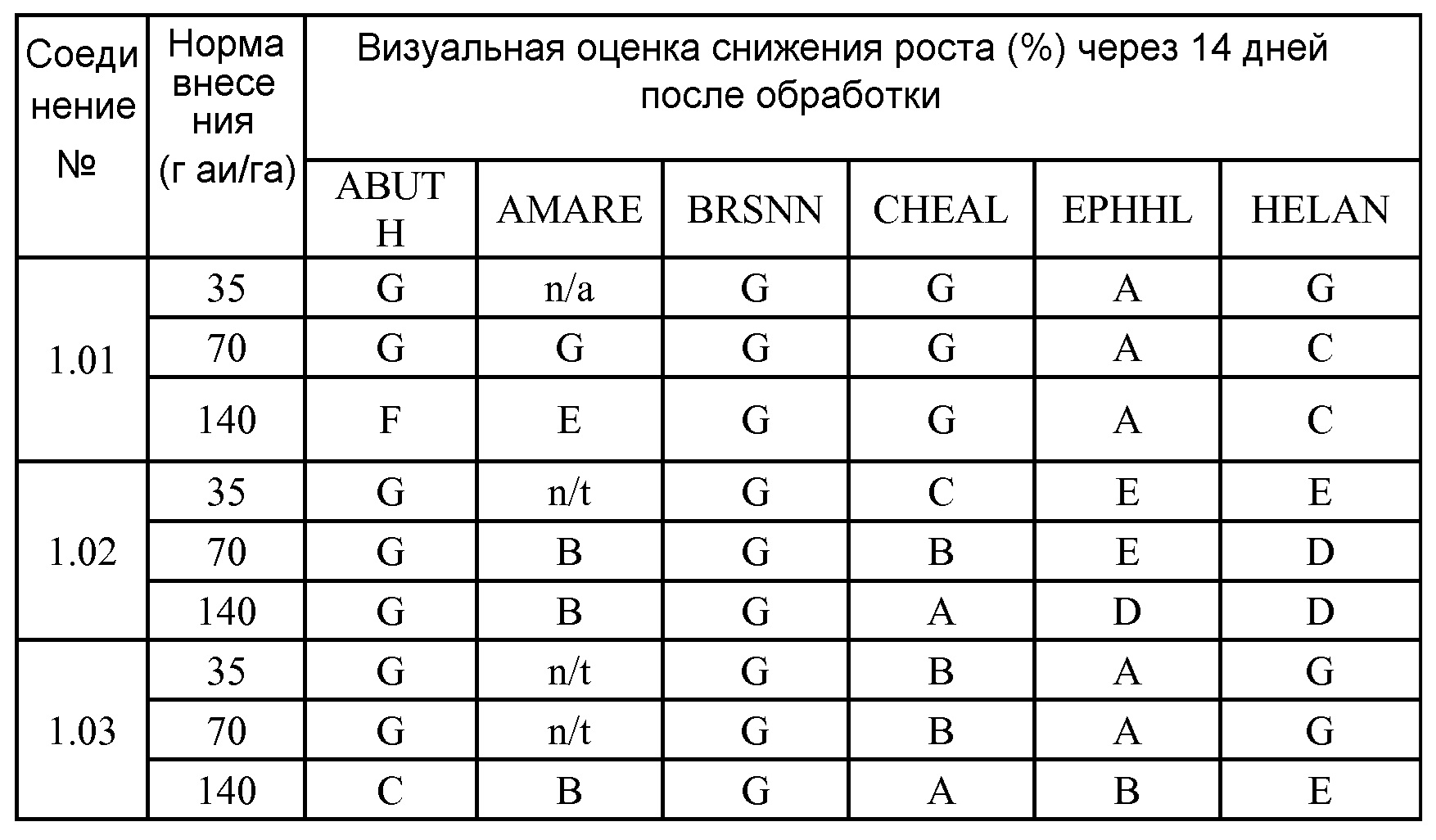
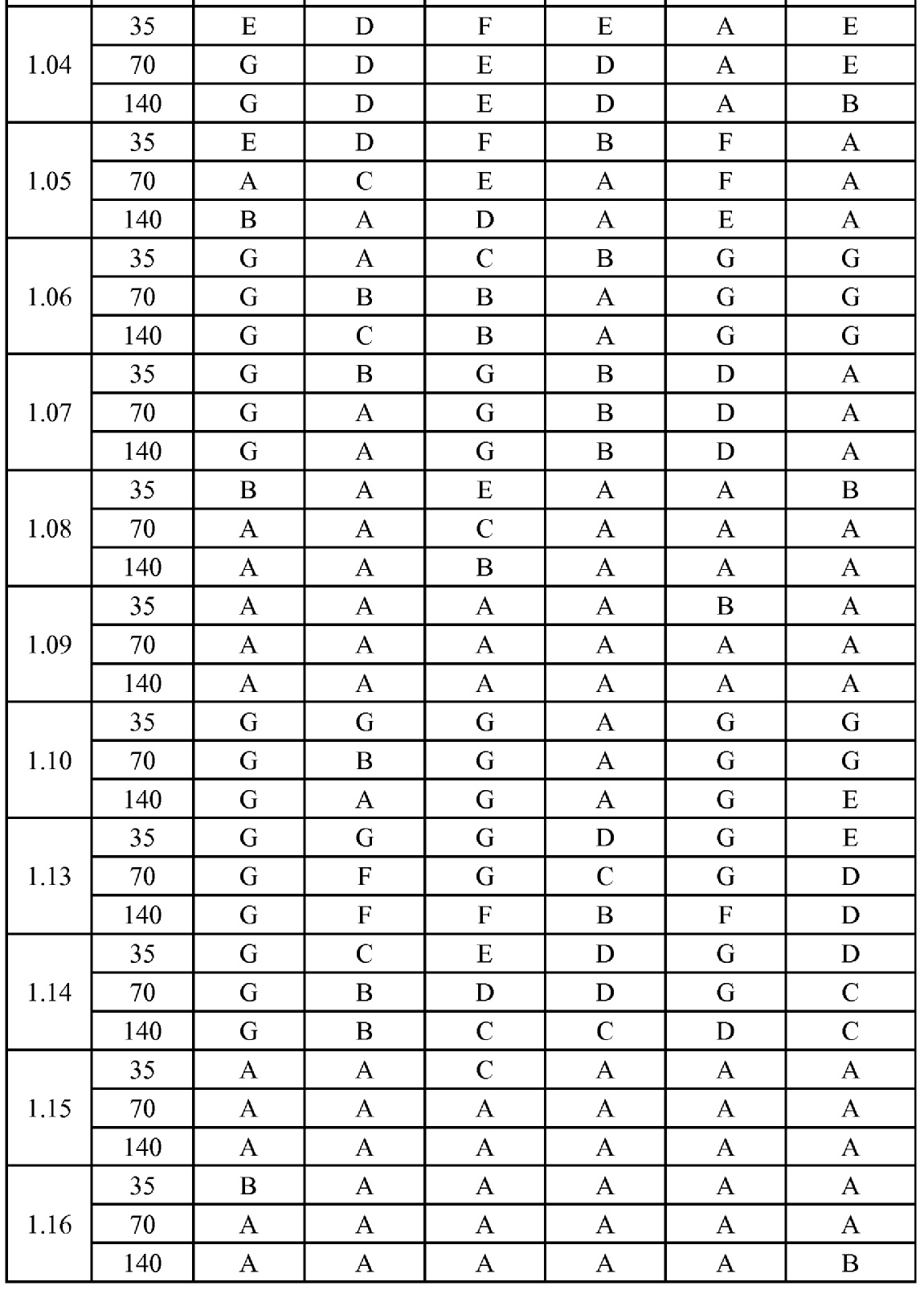
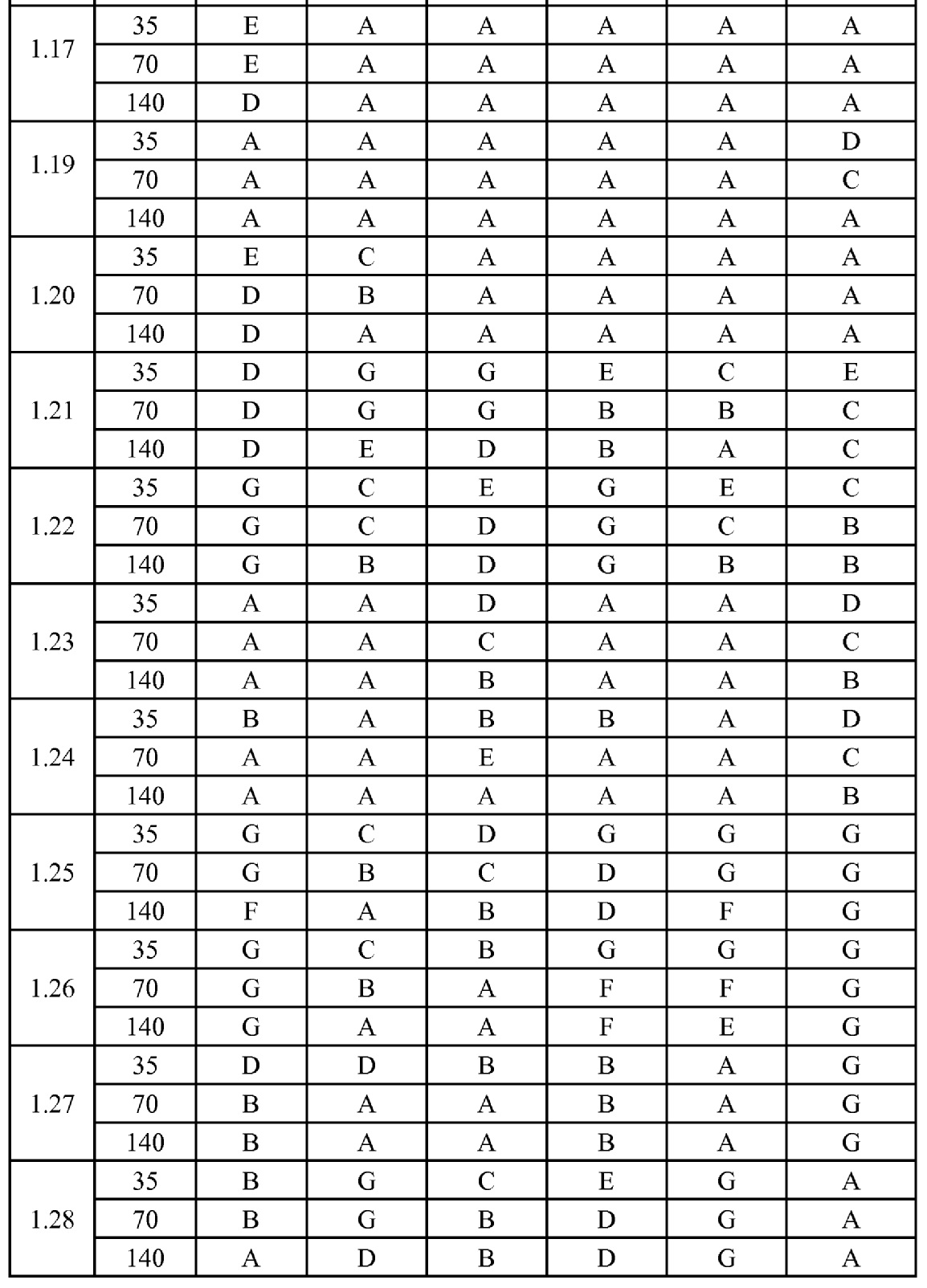
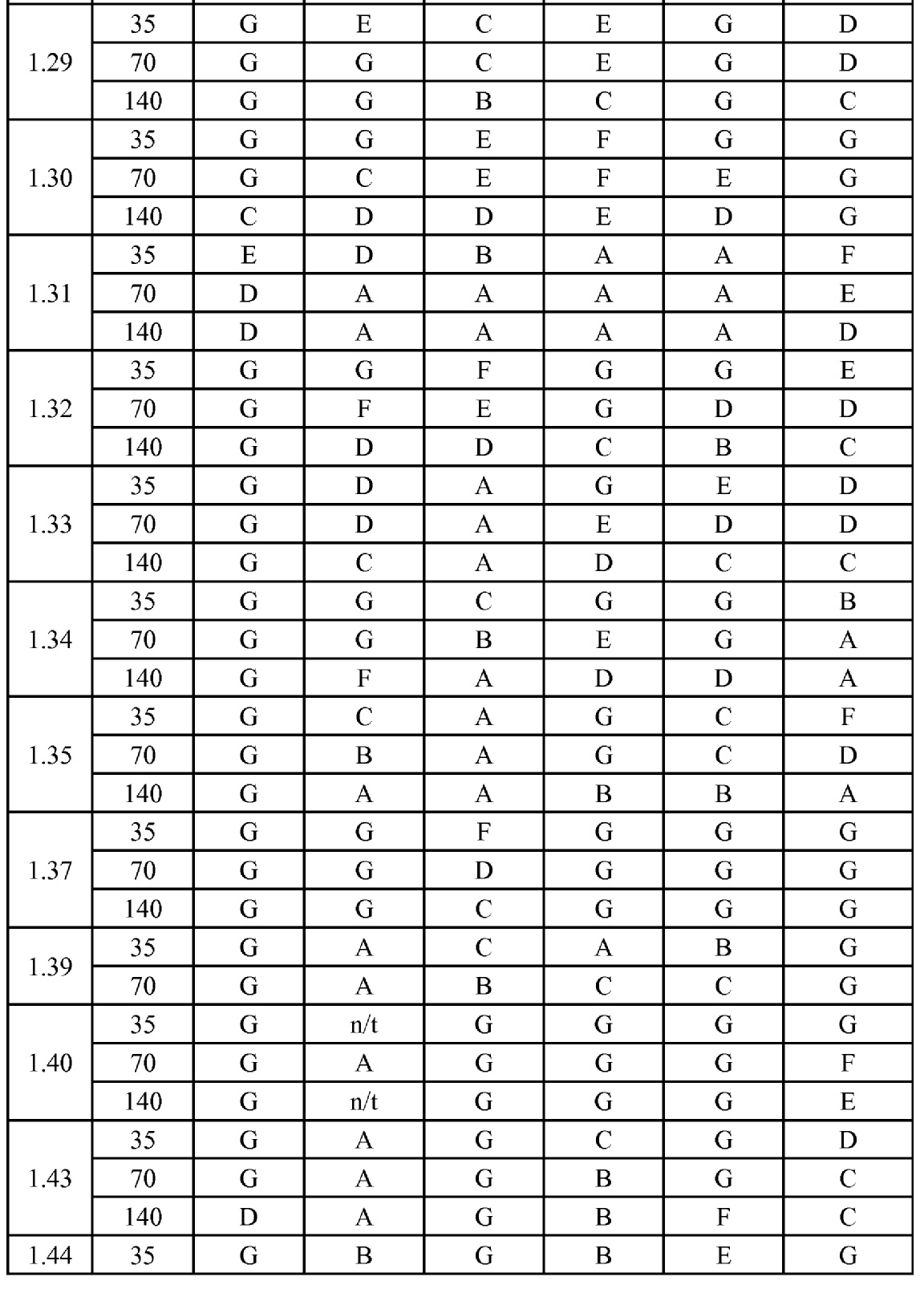
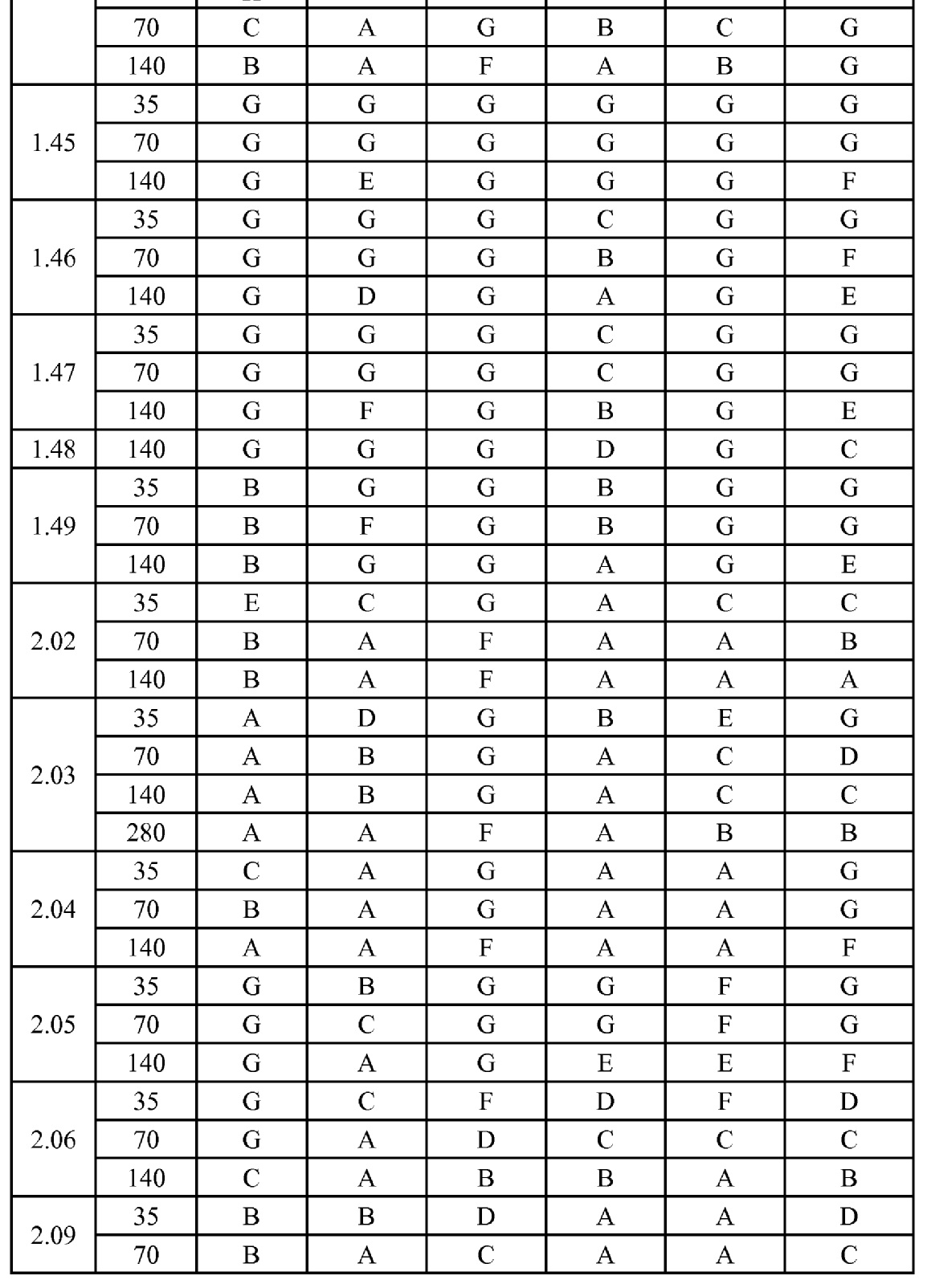
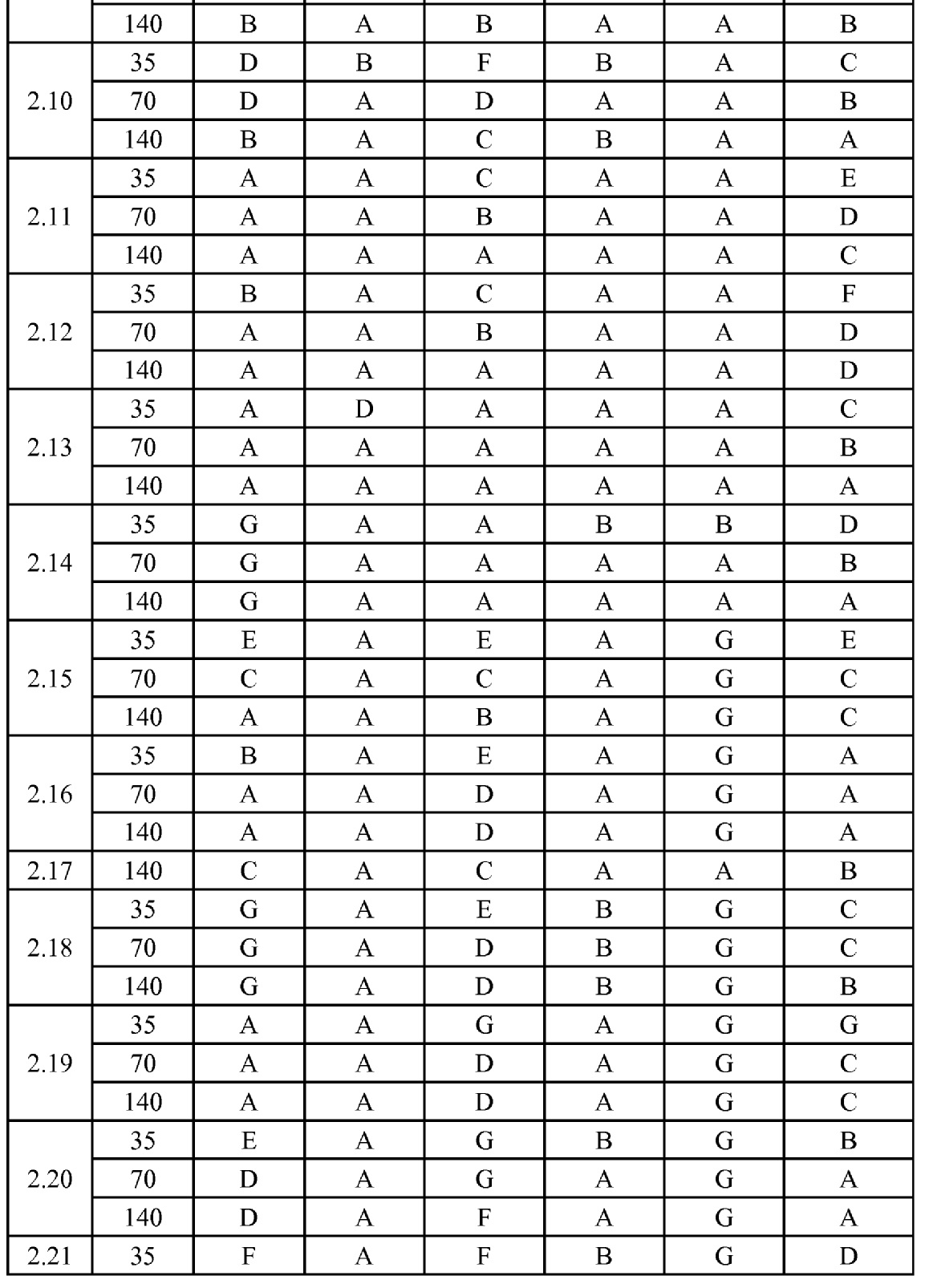
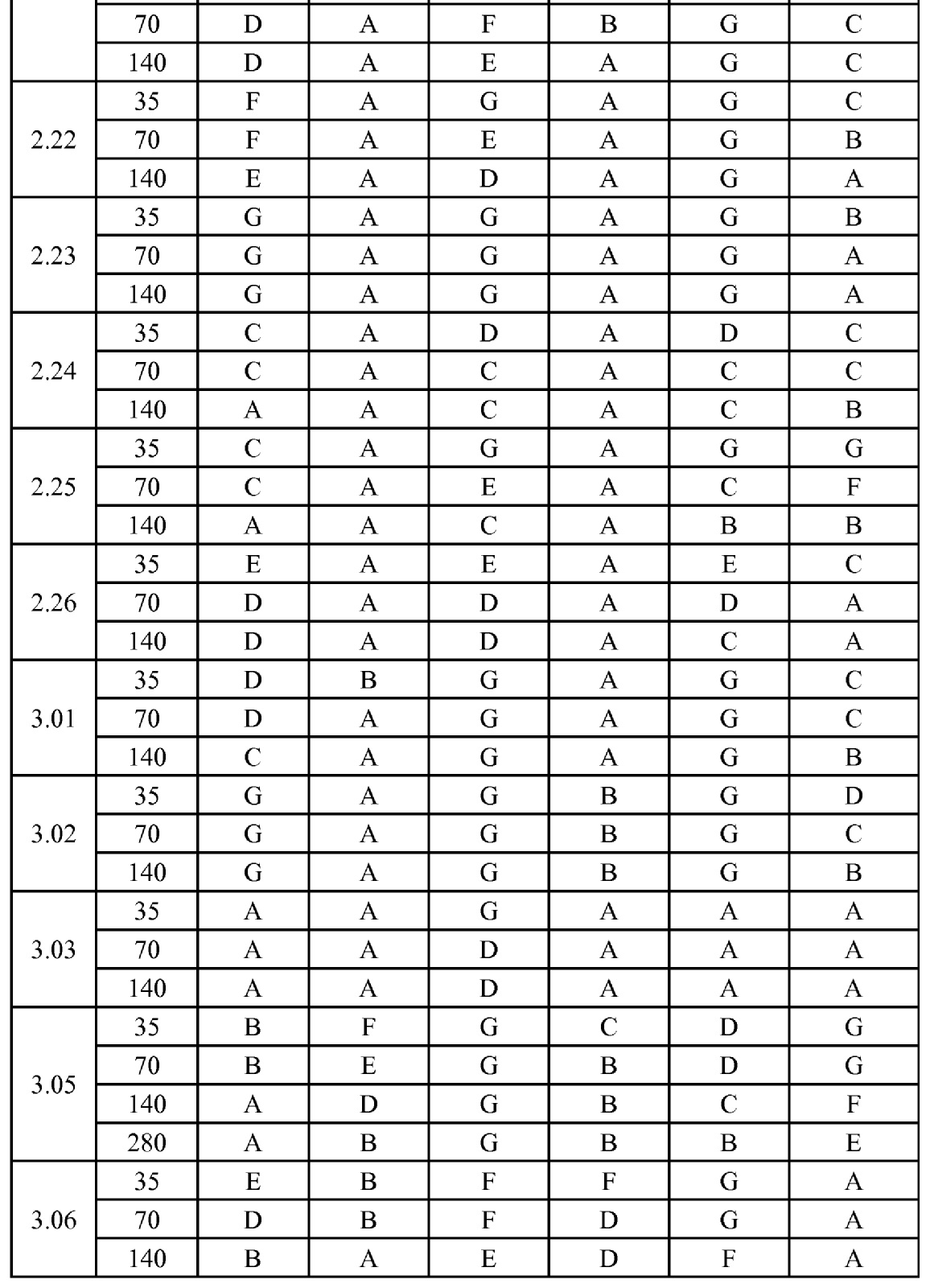
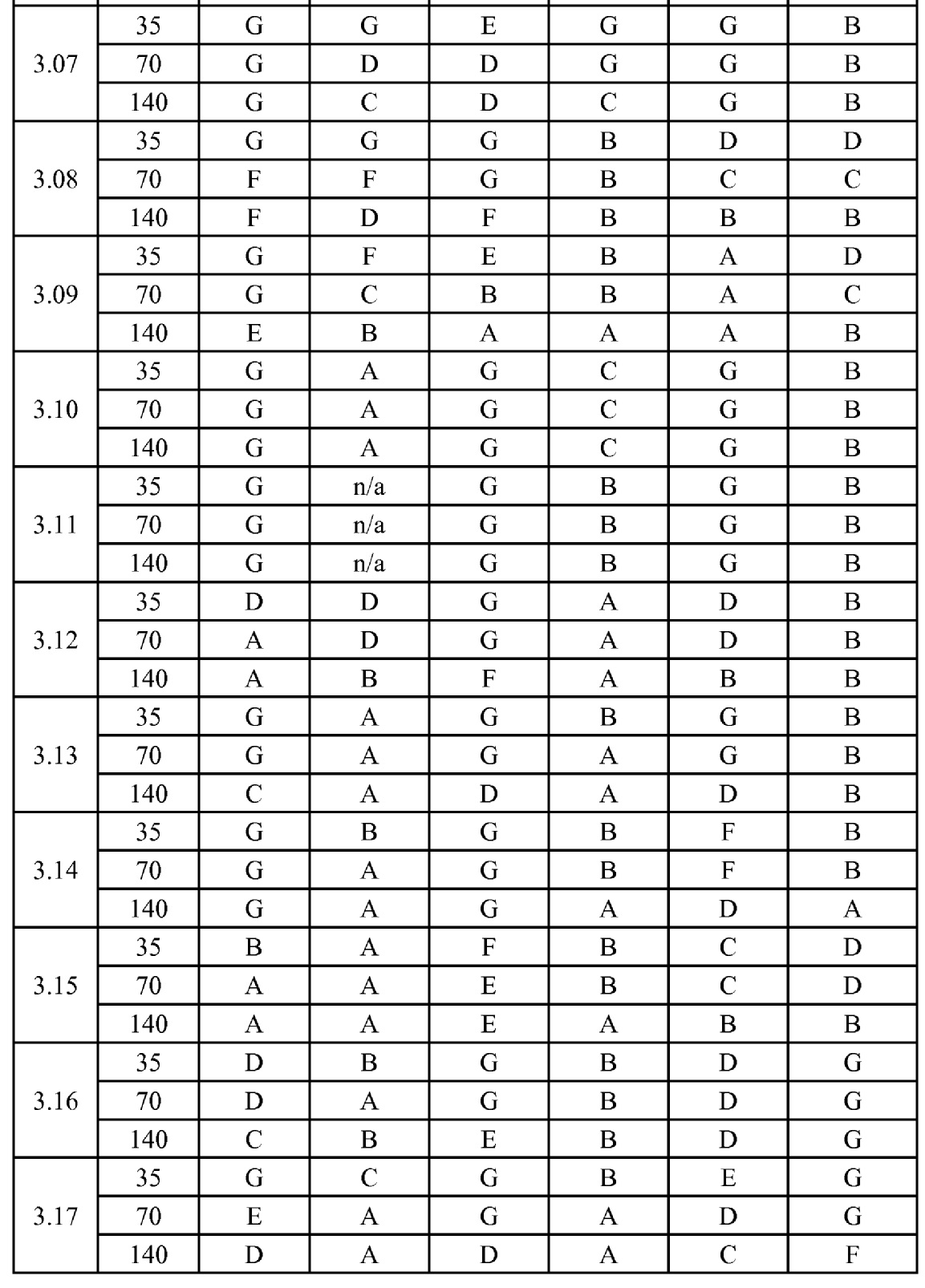
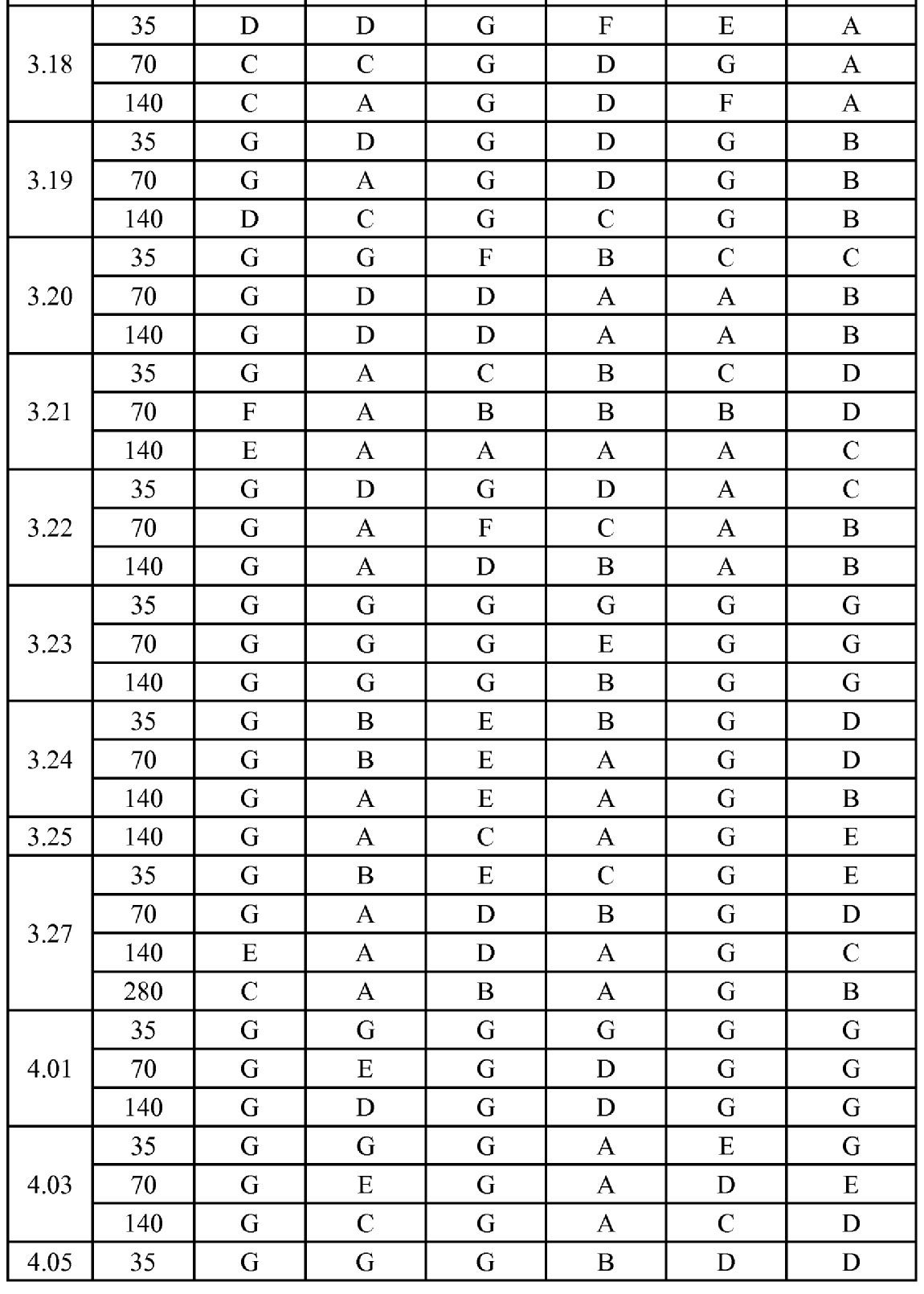
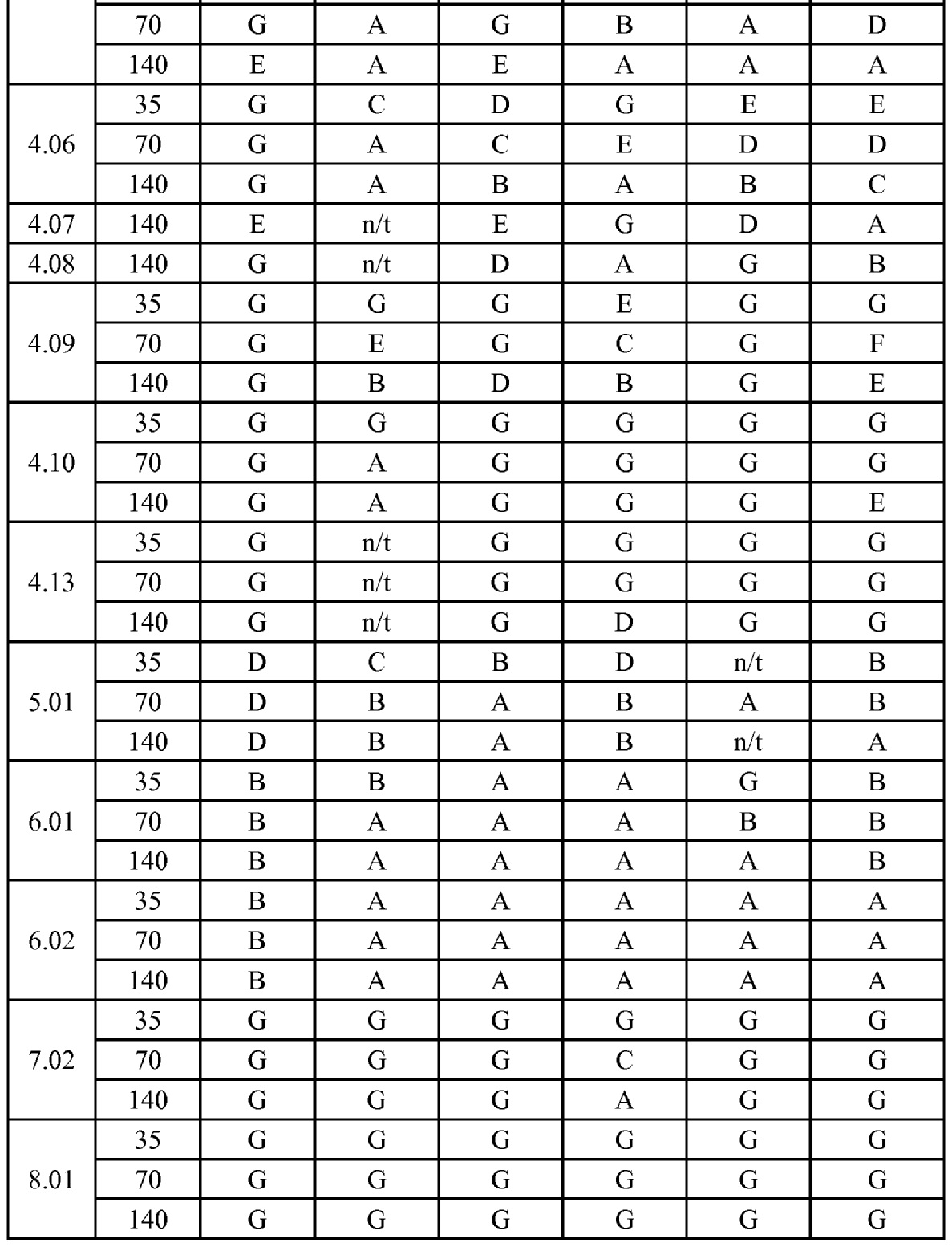
ABUTH: канатник Теофраста (Abutilon theophrasti)
AMARE: щирица колосистая (Amaranthus retroflexus)
BRSNN: масличный рапс, канола (Brassica napus)
CHEAL: марь белая, (Chenopodium album)
EPHHL: пуансеттия дикая (Euphorbia heterophylla)
HELAN: подсолнечник (Helianthus annuus)
г аи/га: грамм активного ингредиента на гектар
n/t: не испытывали
Таблица 16
Послевсходовое испытание II. Гербицидная активность в отношении ключевых злаковых сорняков и осоки, а также дернообразующих трав
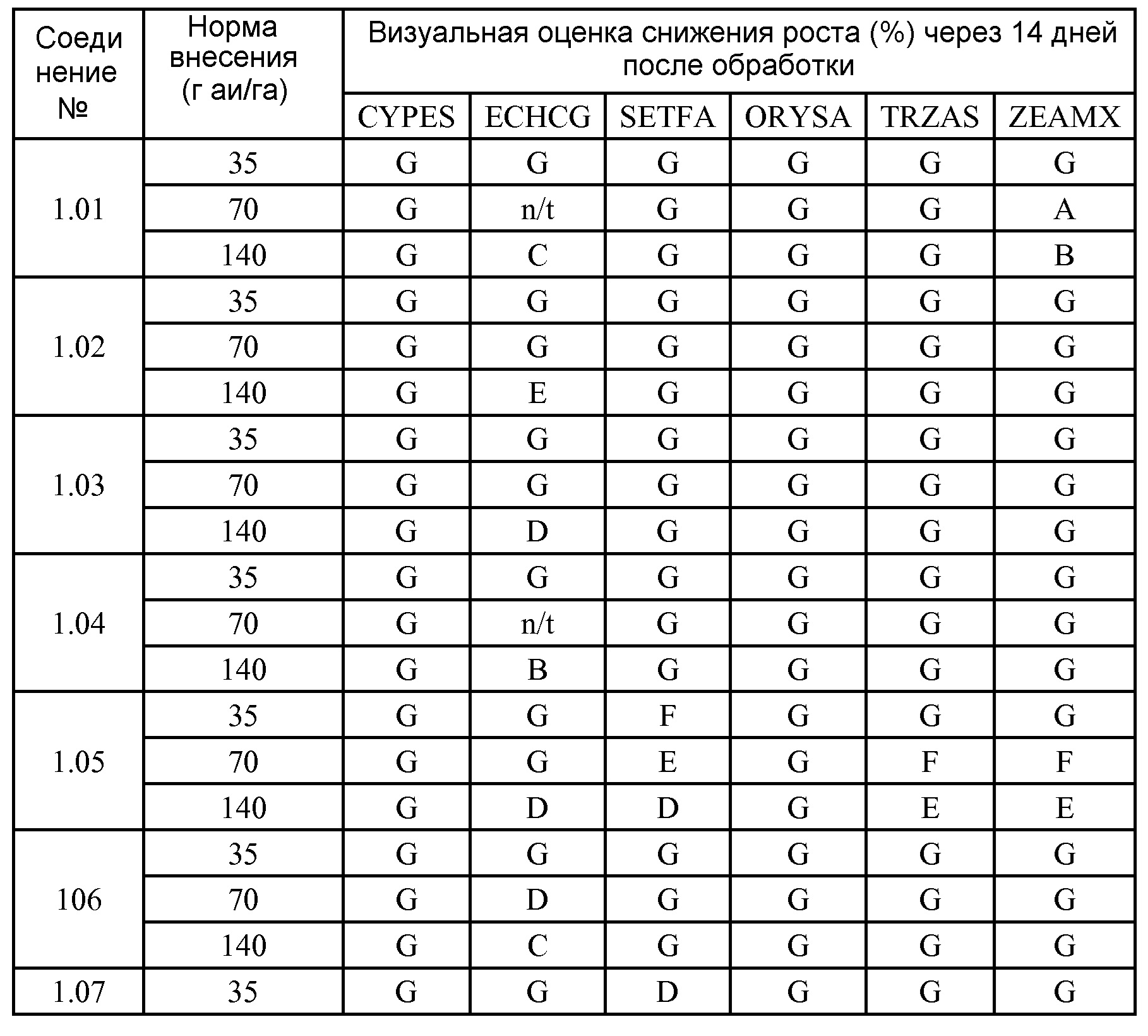
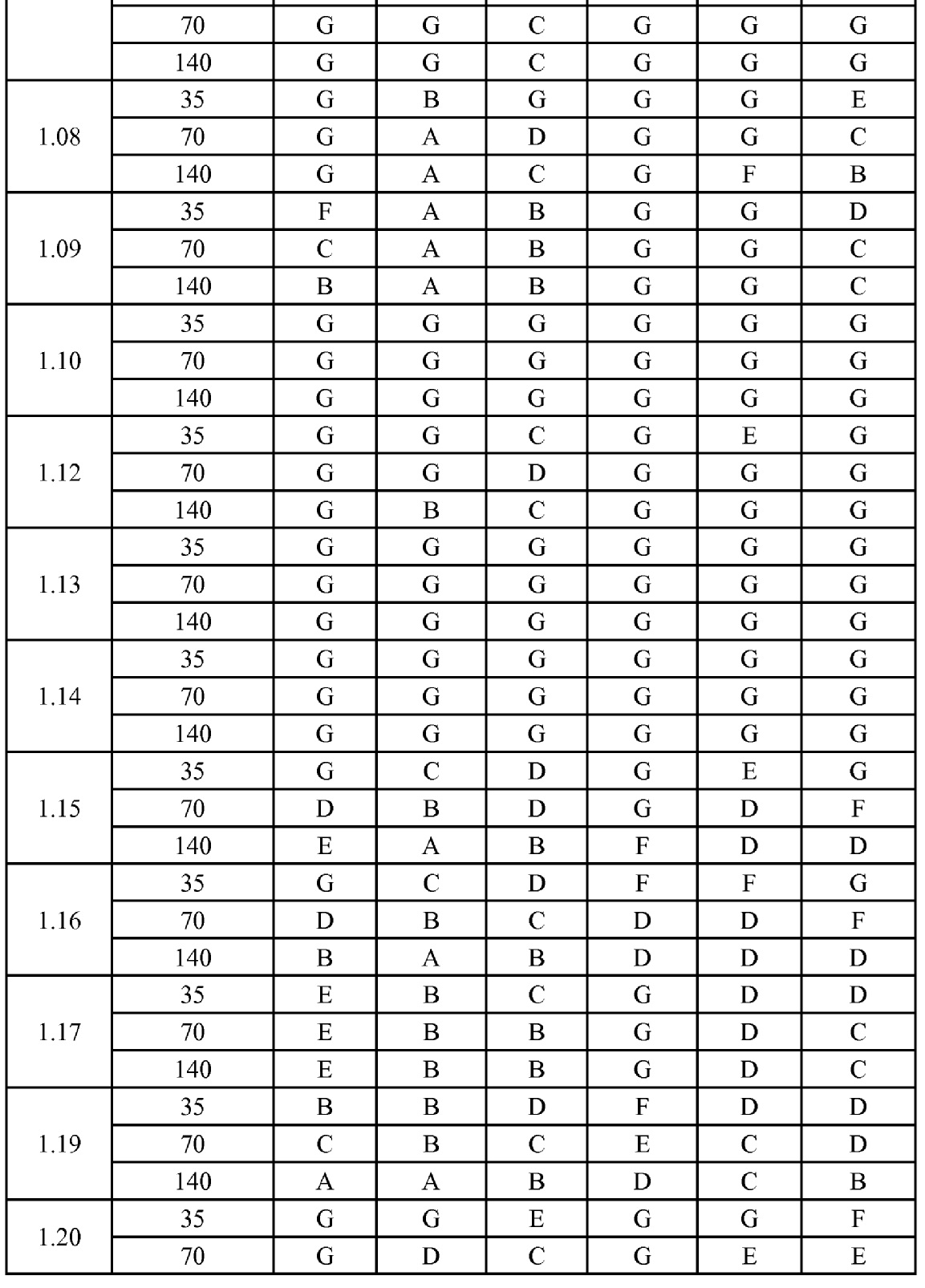
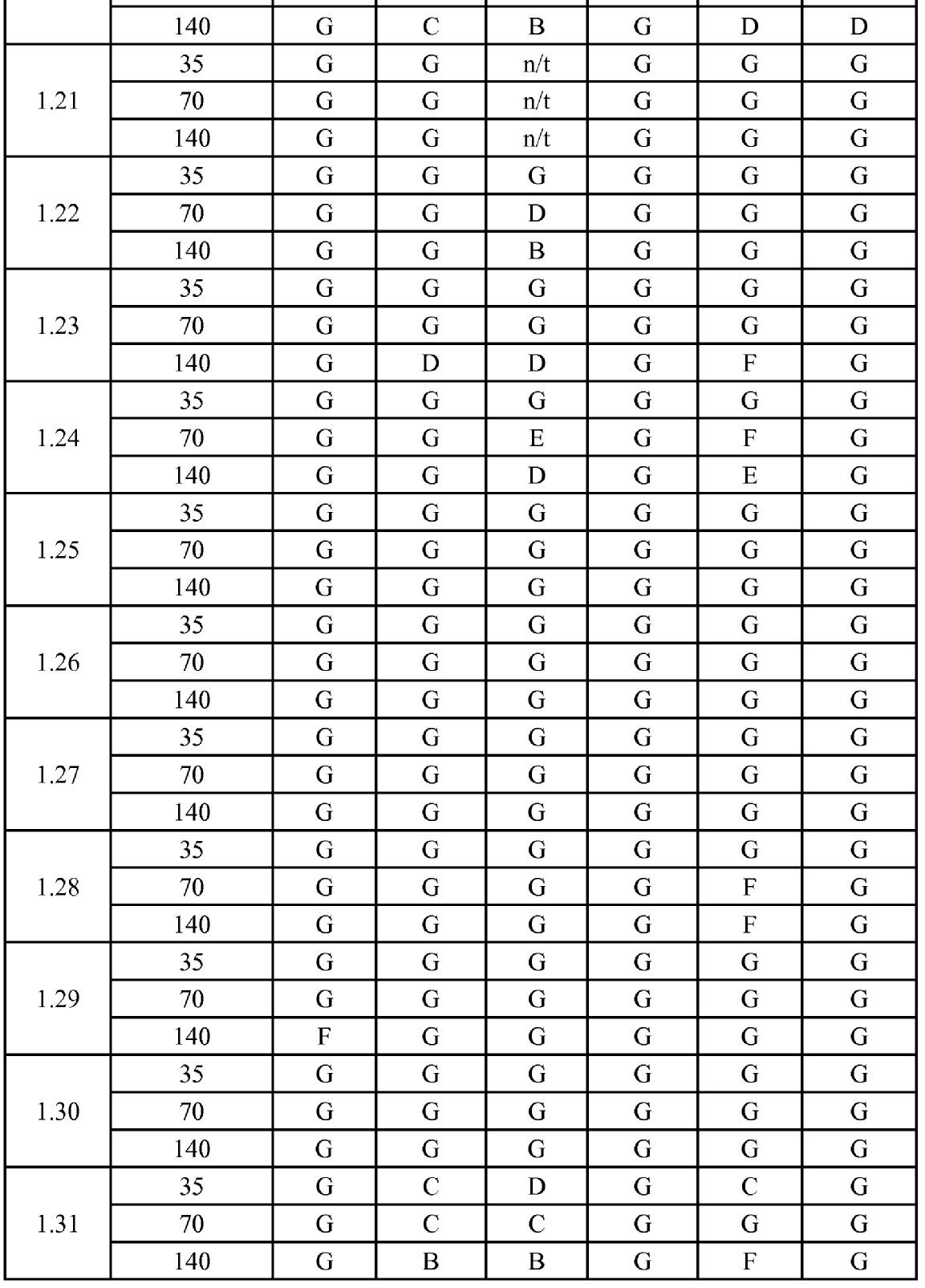
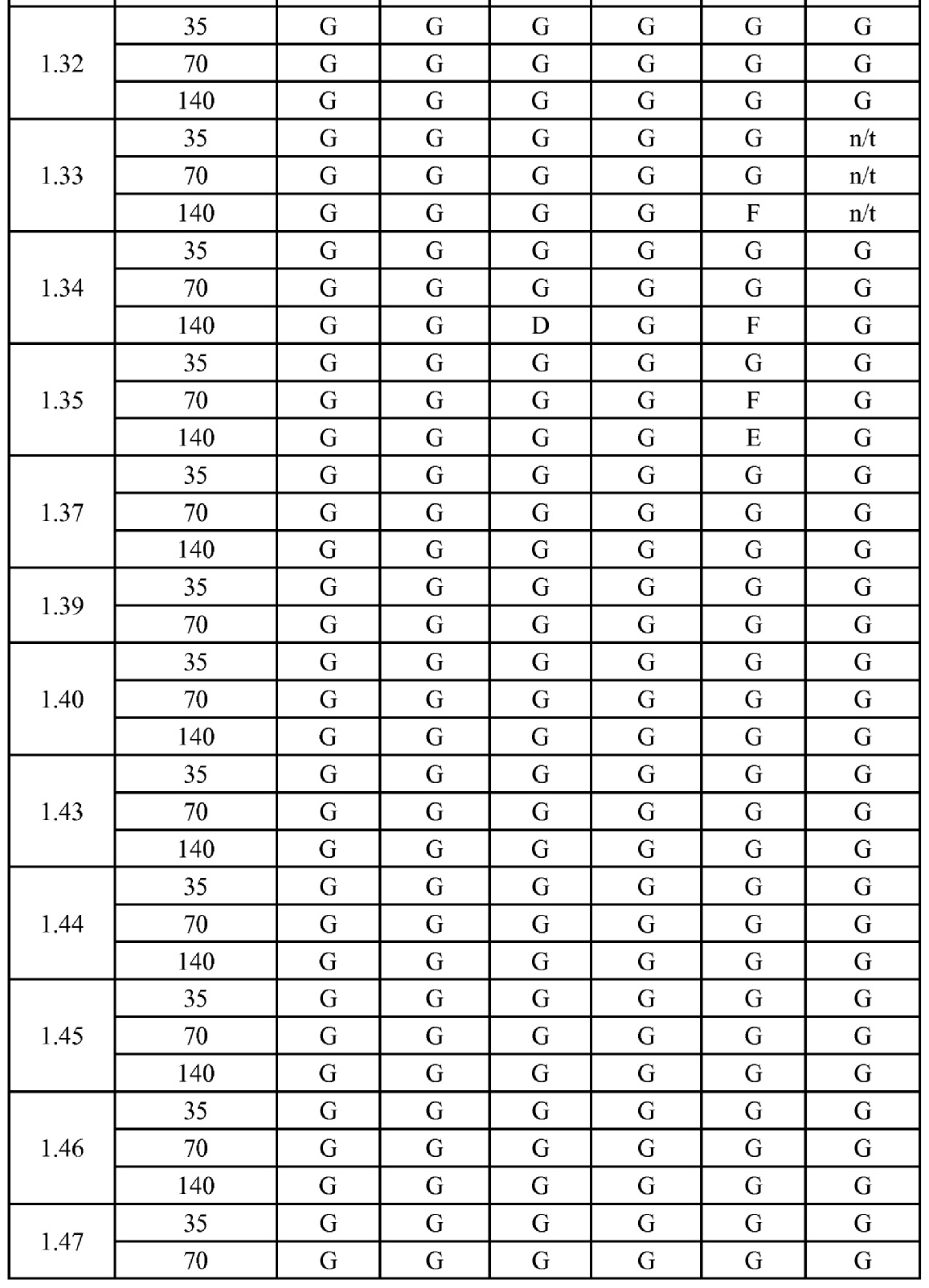
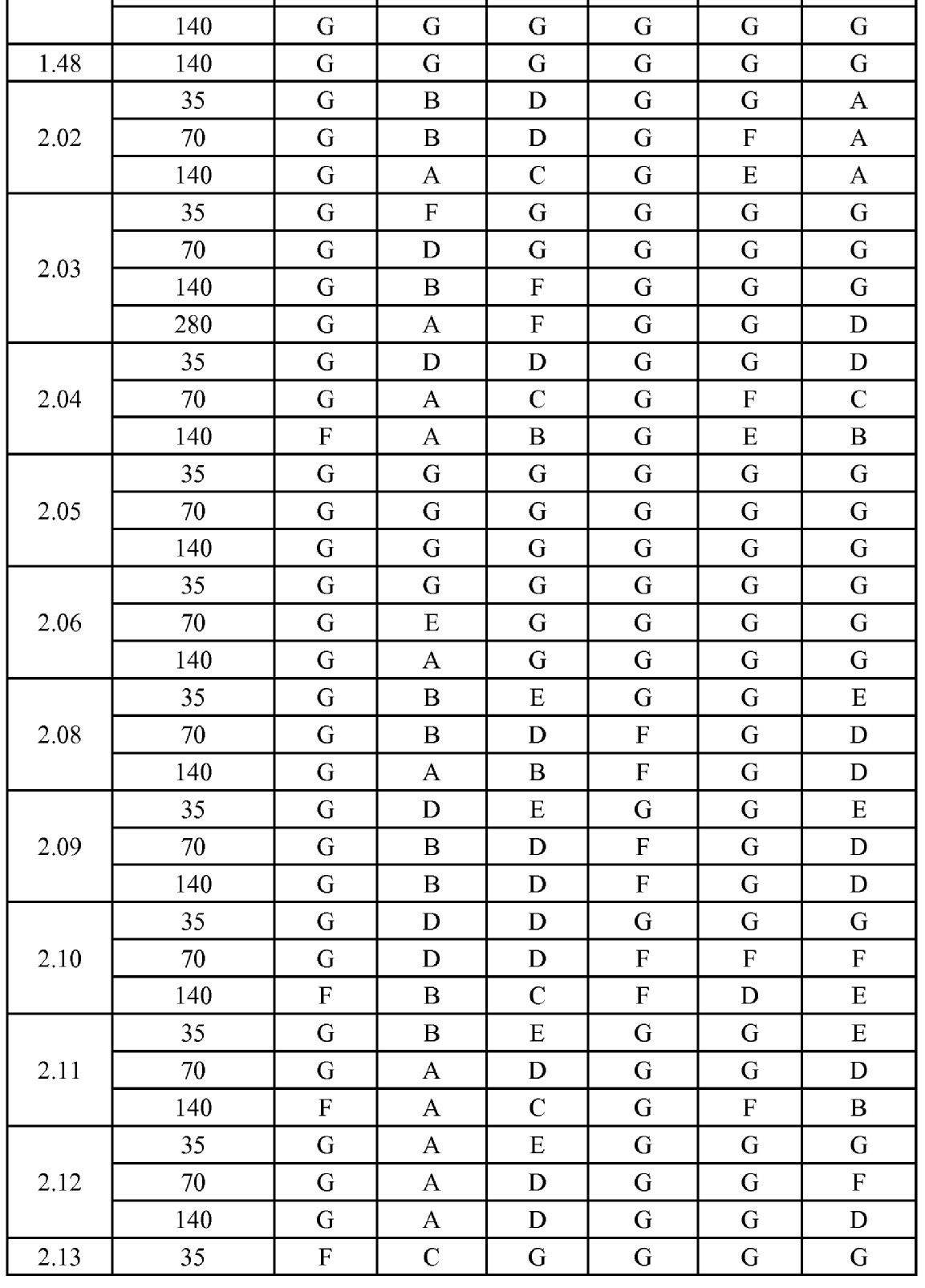
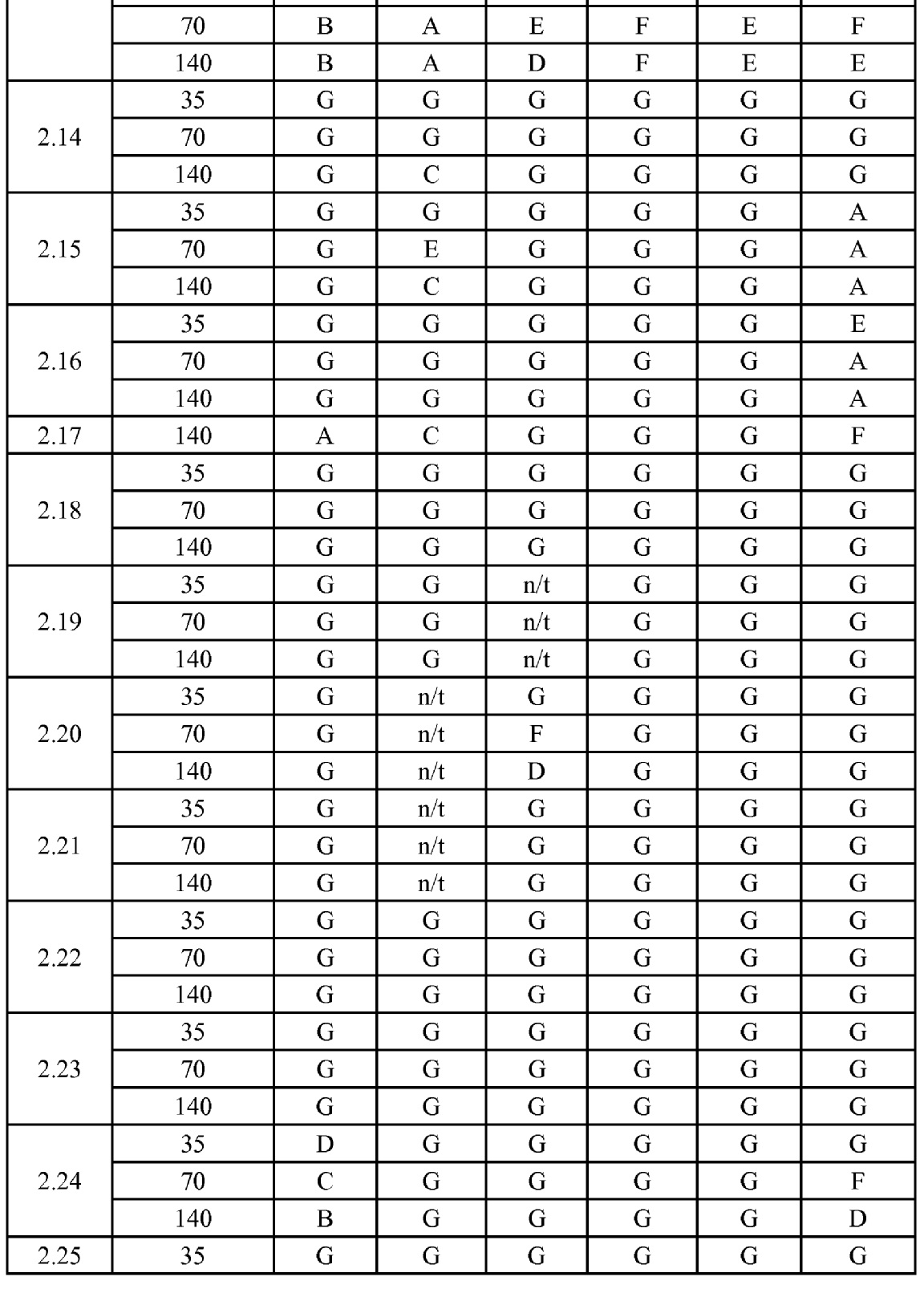
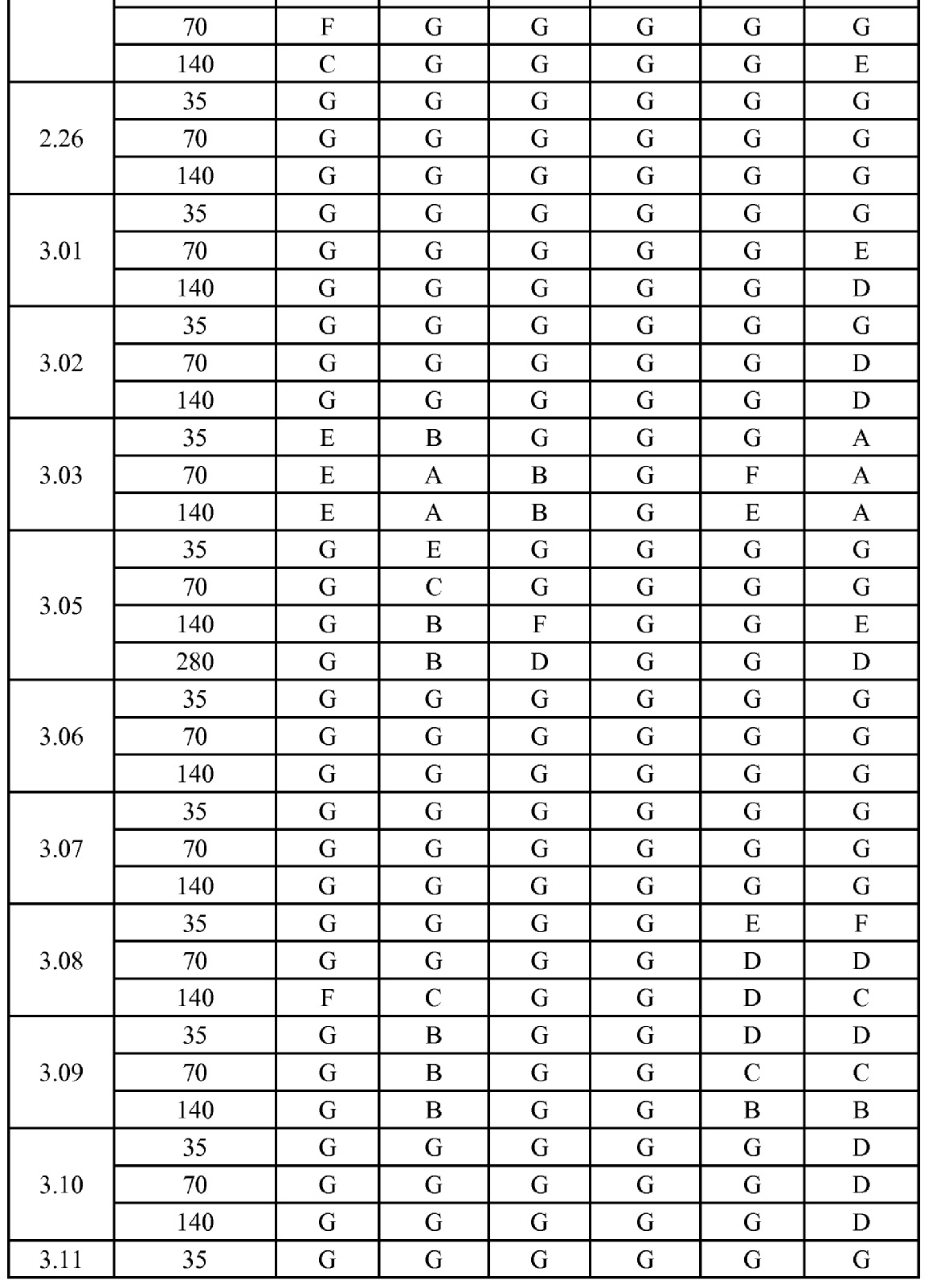
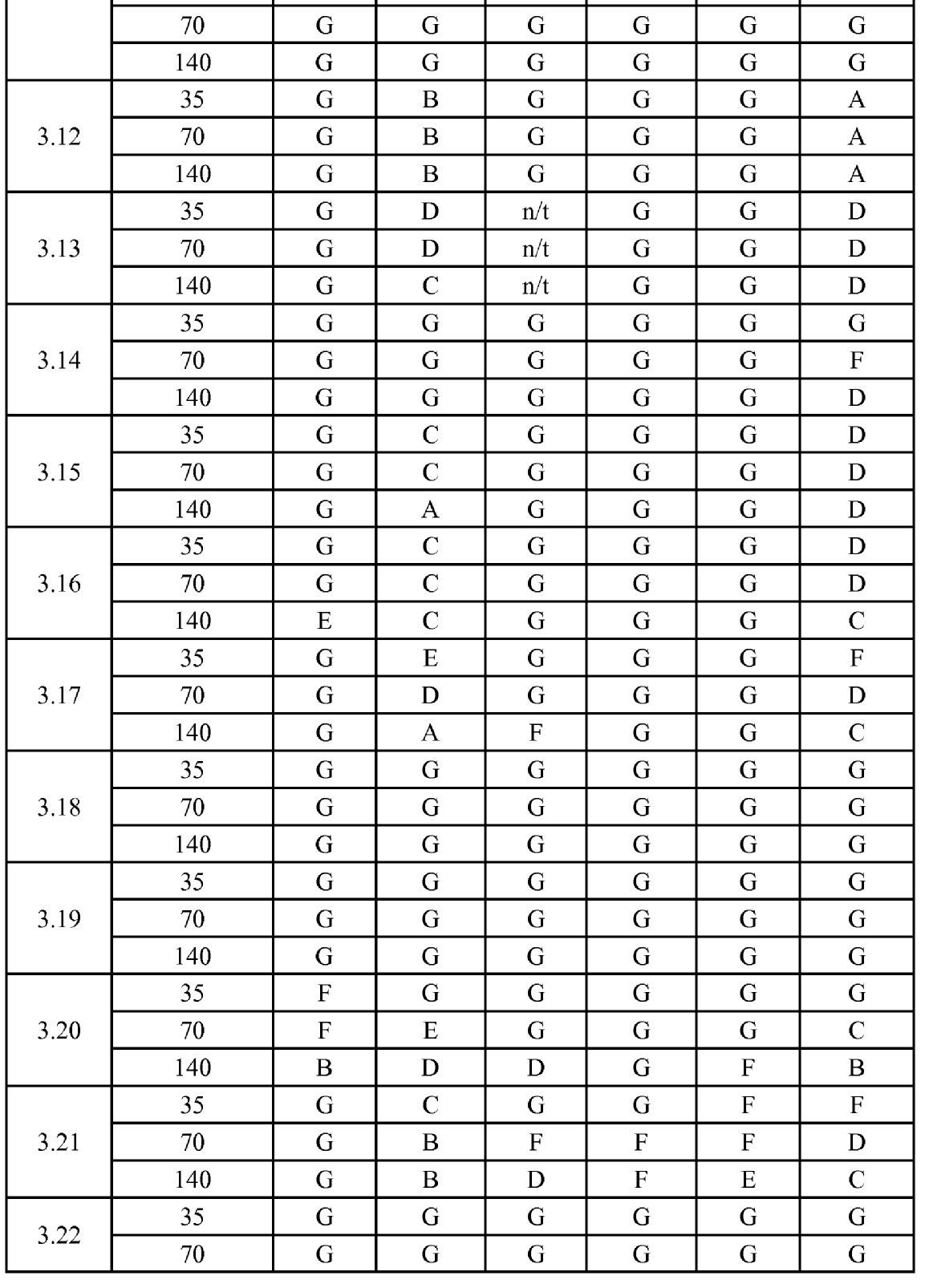
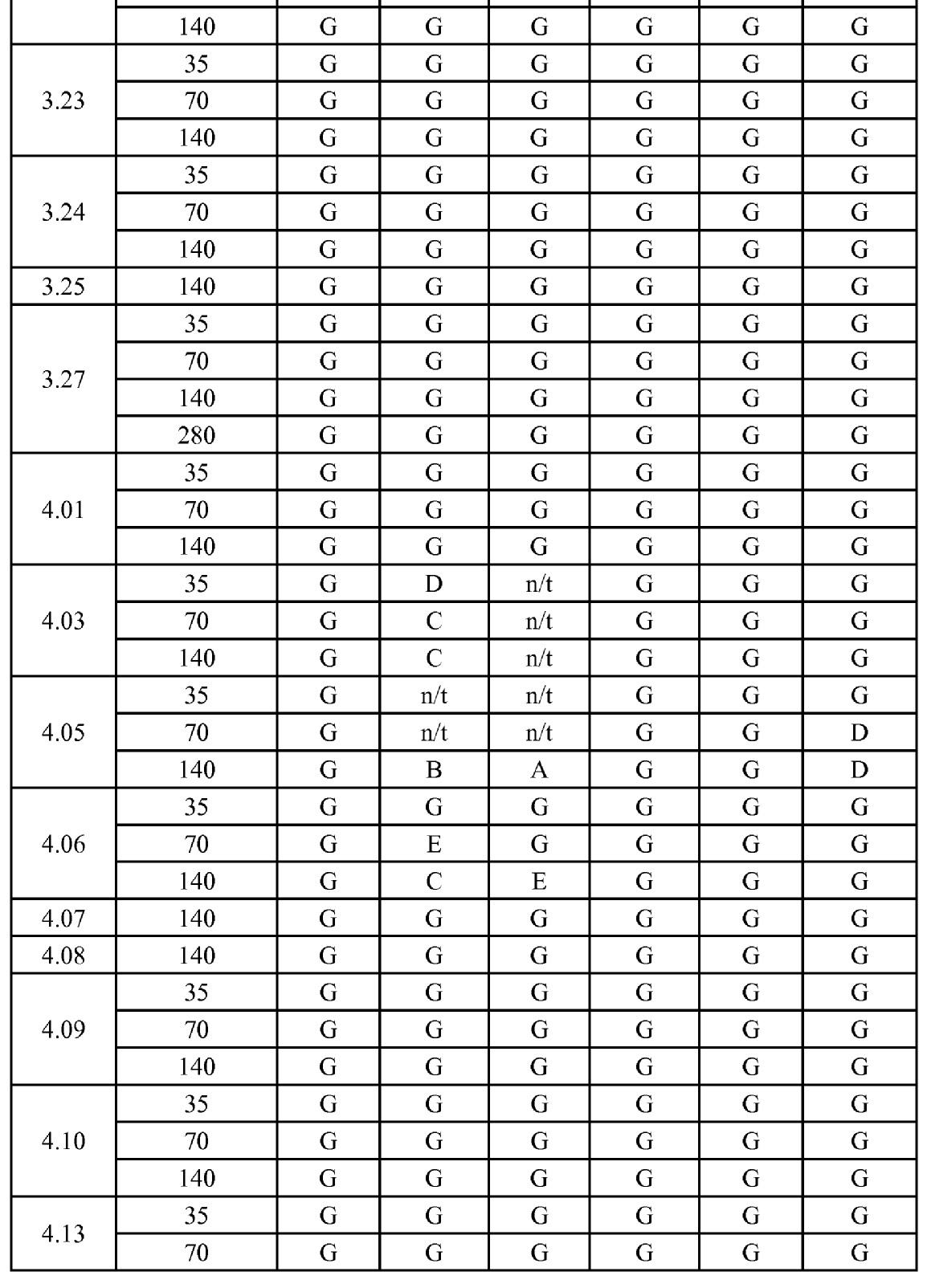
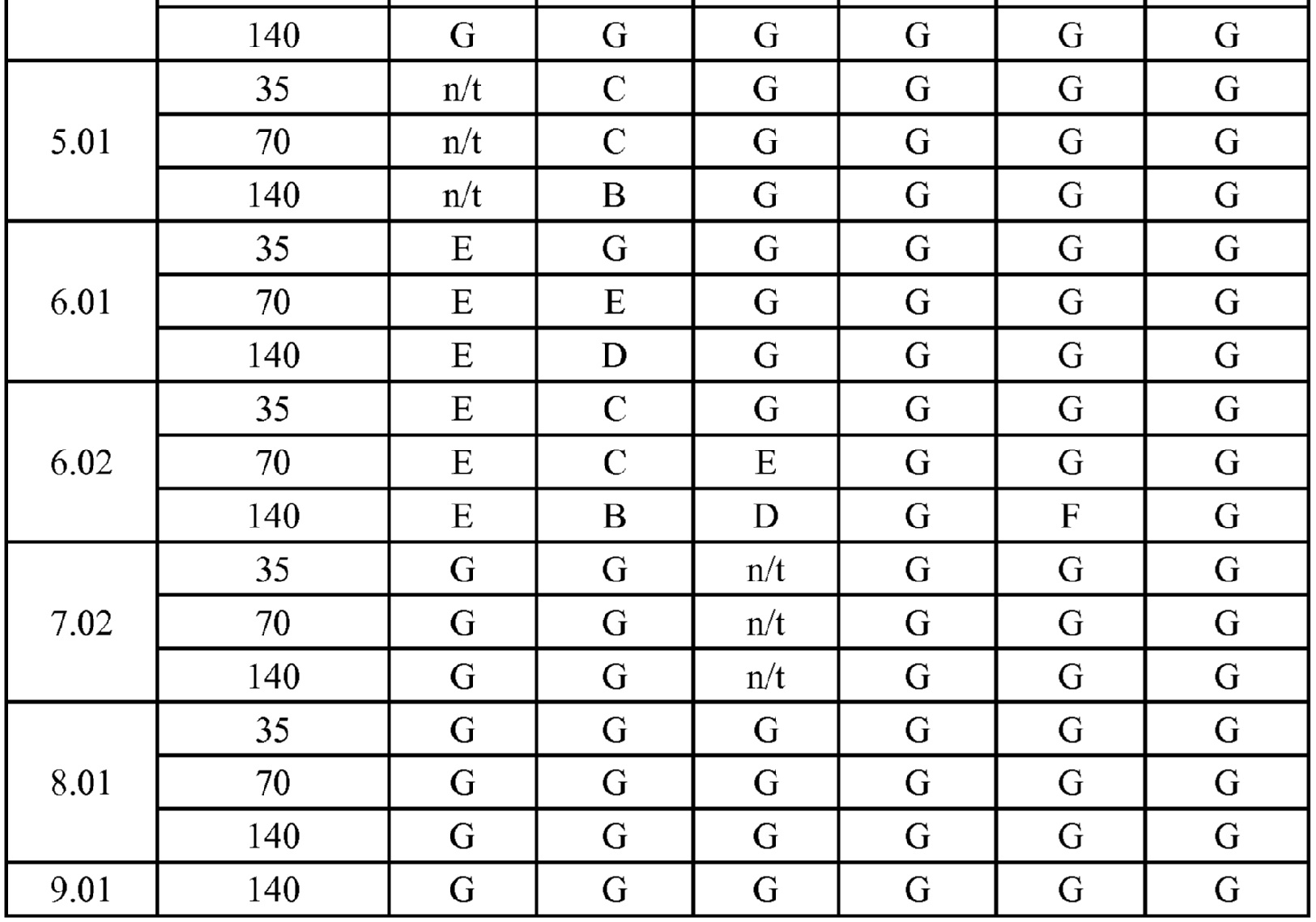
ECHCG: ежовник обыкновенный (Echin°Chloa crus-galli)
CYPES: сыть съедобная (Cyperus esculentus)
ORYSA: рис (Oryza sativa)
SETFA: лисохвост гигантский (Setaria faberi)
TRZAS: пшеница, ранняя (Triticum aestivum)
ZEAMX: маис, кукуруза (Zea mays)
г аи/га: грамм активного ингредиента на гектар
n/t: не испытывали
Пример D. Оценка послевсходовой гербицидной активности в пшенице и ячмене
[00232] Послевсходовое испытание III. Семена желаемого испытываемого вида растения высевали в Sun Gro MetroMix® 306 смесь для посадки, которая обычно имеет pH 6,0-6,8 и содержание органических веществ около 30 процентов, в пластиковые горшки с площадью поверхности 103,2 квадратных сантиметров (см2). Когда необходимо было обеспечить хорошую всхожесть и здоровые растения, осуществляли обработку фунгицидом и/или другую химическую или физическую обработку. Растения выращивали в течение 7-36 дней (д) в теплице с приблизительно 14-часовым (ч) световым периодом, в которой поддерживали температуру при около 18°C в течение дня и 17°C в течение ночи. Питательные вещества и воду добавляли регулярно и обеспечивали дополнительное освещение при помощи расположенных сверху металло-галогеновых 1000 ватт ламп, при необходимости. Растения использовали для испытания, когда они достигали стадии второго или третьего настоящего листа.
[00233] Отвешенное количество, определяемое на основании наивысшей испытываемой нормы внесения, каждого испытываемого соединения помещали в 25-мл стеклянный сосуд и растворяли в 4 мл 97:3 об/об смеси ацетона и DMSO с получением концентрированных исходных растворов. Если испытываемое соединение быстро не растворялось, смесь нагревали и/или обрабатывали ультразвуком. Полученные концентрированные исходные растворы разбавляли с использованием 20 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, DMSO, Agri-Dex маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом, и X-77 поверхностно-активное вещество в соотношении 48:39:10:1,5:1,5:0,02 об/об для обеспечения растворов для опрыскивания, содержащих самые большие нормы внесения. Дополнительный нормы внесения получали путем серийного разведения 12 мл высококонцентрированного раствора в растворе, содержащем 2 мл 97:3 об/об смеси ацетона и DMSO, и 10 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, DMSO, Agri-Dex маслянистый концентрат, который снижает повреждение целевых культур при обработке гербицидом, и X-77 поверхностно-активное вещество в соотношении 48:39:10:1,5:1,5:0,02 об/об, для обеспечения 1/2X, 1/4X, 1/8X и 1/16X разведений высококонцентрированного раствора. Количество соединения определяли из расчета 12 мл объема нанесения при норме 187 литров на гектар (л/га). Сформулированные соединения наносили на растительный материал с использованием машины для разбрызгивания химикатов Mandel, оборудованной 8002E выпускными отверстиями, откалиброванными для распределения 187 л/га на обрабатываемой площади 0,503 квадратных метров при разбрызгивании на высоте 18 дюймов (43 см) выше средней высоты кроны растения. Контрольные растения опрыскивали таким же способом с использованием холостого растворителя.
[00234] Обрабатываемые растения и контрольные растения помещали в теплицу, как описано выше, и поливали путем подповерхностного орошения для предотвращения вымывания испытываемых соединений. Через 21 день состояние испытываемых растений по сравнению с необработанными растениями определяли визуально и оценивали по шкале от 0 до 100 процентов, где 0 соответствует отсутствию поражений, и 100 соответствует полному уничтожению.
[00235] Путем использования общепринятого пробит-анализа, описанного J. Berkson в Journal of the American Statistical Society, 48, 565 (1953) и D. Finney в «Probit Analysis» Cambridge University Press (1952), представленные выше данные можно использовать для расчета GR20, GR50, GR80 и GR90 значений, которые определяют как показатели снижения роста, которые соответствуют эффективной дозе гербицида, необходимой для уничтожения или контроля 20 процентов, 50 процентов, 80 процентов или 90 процентов, соответственно, целевого растения.
[00236] Некоторые из соединений, которые были испытаны, используемые нормы внесения препарата, испытываемые виды растений и результаты представлены в Таблице 17.
Таблица 17
Активность гербицидных соединений в пшенице и ячмене