Результат интеллектуальной деятельности: Способ получения микроволокнистого материала, высвобождающего лекарственные средства
Вид РИД
Изобретение
Изобретение относится к области медицины, более конкретно, к области медицинских материалов и может быть использовано для изготовления сосудистых протезов, покрытий для эндоваскулярных стентов и противоспаечных мембран.
В настоящее время материалы и покрытия, высвобождающие лекарственные средства, находят широкое применение для локальной доставки лекарств. Локальная доставка лекарственных препаратов позволяет повысить требуемый эффект от действия лекарства, уменьшить его дозу и элиминировать побочные эффекты, возникающие при системном использовании лекарственных препаратов.
Лекарственные средства, как правило, вносят в смеси с биоразлагаемыми полимерами, такими как полимолочная кислота или более медленно деградирующий тирозинполикарбонат (S. Nishio, K. Kosuga, K. Igaki, М. Okada et al, Circulation, 2012, V. 125, P. 2343-2353). Эти полимеры несколько замедляют кинетику высвобождения лекарств, однако, как правило, основная часть препаратов высвобождается в первые несколько дней (Zeller, Т., Rastan, A., Rothenpieler, U. and 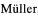 , С., Cathet. Cardiovasc. Intervent., 2006, V. 68, P. 125-130). Невысокая эффективность таких покрытий показана в ряде рандомизованных исследований (G. Nakazawa, F. Otsuka, М. Nakano, et al. Journal of the American College of Cardiology, 2011, V. 57, N. 11, P. 1314-1322).
, С., Cathet. Cardiovasc. Intervent., 2006, V. 68, P. 125-130). Невысокая эффективность таких покрытий показана в ряде рандомизованных исследований (G. Nakazawa, F. Otsuka, М. Nakano, et al. Journal of the American College of Cardiology, 2011, V. 57, N. 11, P. 1314-1322).
В настоящее время интенсивно разрабатываются микроволокнистые материалы, которые могут быть изготовлены методом электроспиннига (Н. Pant, P. Pokharel, М.К. Joshi, et al, Chemical Engineering Journal, 2015, V. 270, P. 336-342; P. Boodagh, D. Guo, N. Nagiah, W. Tan, Journal of Biomaterials Science, Polymer Edition, 2015, V. 27, N. 11, P. 1086-1099).
Принцип метода электроспиннинга заключается в образовании волокон в сильном электрическом поле, образованном между двумя электродами противоположной полярности. При этом раствор или расплав полимерного материала подается из электрода-фильеры с заданной скоростью. Раствор полимера при выходе из шприца растягивается в электрическом поле и превращается в полимерные нити (растворитель испаряется), которые собираются на вращающийся металлический коллектор (электрод-коллектор), являющийся вторым электродом, образуя пористый материал (Н. Wu, et al. J Mater Sci: Mater Med, 2010, V. 21, P. 3207-3215).
Известен способ получения микроволокнистого материала на основе поликапролактона (ПКЛ), высвобождающего паклитаксел (ГОСТ), который наносят методом электроспиннинга на стент (Y. Zhu, С. Hu, В. Li, Н. Yang, Y. Cheng, W. Cui, Acta Biomaterialia, 2013, V. 9, N. 9, P. 8328-8336). Основным недостатком микроволокнистого материала из ПКЛ, высвобождающего ПКТ, является быстрое (в течение нескольких дней) высвобождение лекарственного средства.
Известен способ получения двухслойного материала, выполненного в виде полимерного покрытия, с разной скоростью высвобождающего паклитаксель. Первый слой материала (покрытия) состоит из смеси двух полимеров: полилактида и полиэтиленоксида (PLA-PEO), являющихся быстро разрушающимися гидрофильными материалами. Второй слой состоит из смеси полилактида и поликапролактона, представляющей медленно разрушающийся гидрофобный материал, а в качестве активного вещества применяют таксол (паклитаксел), подавляющий развитие рестеноза после пластических операций на сосудах (Патент US 6258121 В1, опубл. 10.07.2001).
Известные микроволокнистые материалы имеют склонность к разрушению при деформации. Кроме того, плотная полимерная структура материалов не может обеспечить равномерной скорости деградации материала-основы и равномерного выхода лекарственного вещества наружу.
Известен способ изготовления биорезорбируемого микроволокнистого материала, включающий приготовление полимерной композиции путем смешивания в хлороформе полигидроксибутирата (ПГБВ) с включением оксивалериата от 8.5% до 37% и эпсилонполикапролактона (ПКЛ) и проведение двухстадийного электроспиннинга, при этом соотношение полимеров в сухой смеси композиции ПГБВ : ПКЛ составляет 23.1-36.4:76.9-63.6, при этом на первом этапе электроспиннинга к раствору полимера добавляют коллаген IV типа в концентрации 100 мкг на 1 мл раствора и человеческий фибронектин в концентрации 10 мкг на 1 мл композиции, а на втором этапе электроспиннинга осуществляют с использованием полимерной композиции, дополненной фактором роста фибробластов в концентрации 0.01 мкг на 1 мл раствора (патент RU 2504406 C1, оп. 20.01.2014).
Недостатками способа являются его сложность и длительность, а также недостаточная эластичность получаемого материала.
Наиболее близким к заявленному способу - прототипом, является способ получения микроволокнистого материала методом двухфазного электроспиннинга, предназначенного для изготовления сосудистого графта. Способ включает растворение исходного синтетического полимера поликапролактона (ПКЛ) в растворителе, смешивание раствора полимера с раствором биологических веществ в фосфатно-солевом буфере в соотношении 20:1 с последующим проведением электроспиннинга путем нанесения на электрод-коллектор полученной смеси. В качестве биологических веществ используют эндотелиальный фактор роста (VEGF), фактор стромальных клеток (SDF-1a), фактор роста фибробластов (b-FGF) а также гепарин. Предлагаемый сосудистый графт может иметь в своем составе одно вещество или их комбинацию (патент 2496526 С1, опубл. 27.10.2013).
Недостатками известного способа являются низкое качество целевого продукта, сложность способа из-за необходимости добавления факторов роста в процессе электроспиннинга, трудность в изготовлении однородного полимерного раствора, поскольку используется двухфазный электроспиннинг. Получаемый известным способом микроволокнистый материал обладает недостаточной эластичностью, неравномерной скоростью высвобождения биологических веществ и недостаточной биологической активностью, поскольку в процессе изготовления материала белковые молекулы получаются «запаянными» в полимерное волокно и не имеют контакта с внешней средой.
Задачей изобретения является разработка способа получения эластичного микроволокнистого материала, способного высвобождать лекарственное средство в течение длительного времени.
Технический результат: повышение эластичности микроволокнистого материала, увеличение длительности высвобождения лекарственного средства из состава материала.
Поставленная задача решается предлагаемым способом, заключающимся в следующем:
Микроволокнистый материал изготавливают методом электроспиннинга со следующими параметрами: напряжение - 20 кВ, скорость подачи раствора полимеров - 1,5 мл/час, расстояние между иглой и коллектором - 20 см, скорость вращения коллектора - 300 об/мин.
Предварительно готовят полимерную композицию для электроспиннинга, состоящую из смеси растворов полимера и белка, растворенных в гексафторизопропаноле (ГФИП), и лекарственного средства, растворенного в диметилсульфоксиде (ДМСО). В качестве полимера используют поликапролактон (ПКЛ), в качестве белка используют человеческий сывороточный альбумин (ЧСА), а лекарственное средство выбирают из группы цитостатиков, преимущественно паклитаксел или сиролимус или из группы нестероидных противовоспалительных средств, преимущественно диклофенак.
Полимерную композицию готовят путем последовательного смешивания между собой растворов ЧСА в ГФИП и лекарственного средства в ДМСО, после чего полученный раствор смешивают с раствором ПКЛ в ГФИП. При этом, ПКЛ растворяют в ГФИП до конечной концентрации 9,0%, а ЧСА до конечной концентрации 1,0%. Лекарственное средство (ЛС) растворяют в ДМСО, при этом объемная доля ДМСО в конечном полимерном растворе составляет 0,5-10,0%. Для приготовления полимерной композиции подготовленные растворы смешивают в объемном соотношении ПКЛ : ЧСА : ЛС равном 1:1:(0,01-0,2). Оптимальная концентрация в готовом полимерном растворе для паклитакселя составляет 0,001% (весовые соотношения ПКЛ : ЧСА : паклитаксел 9:1:0,002), для сиролимуса - 0,01% (весовые соотношения ПКЛ : ЧСА : сиролимус 9:1:0,02), для диклофенака - 0,15% (весовые соотношения ПКЛ : ЧСА : диклофенак 9:1:0,3).
В процессе электроспиннинга на электрод-коллектор выбранного диаметра, покрытый слоем алюминиевой фольги, наносят требуемый объем раствора полимерной композиции. По завершению электроспиннинга микроволокнистый материал снимают с поверхности фольги в сухом виде.
В результате получают микроволокнистый материал с диаметром волокон 0,5-1,0 мкм, обладающий высокой эластичностью, способный к удлинению при растяжении на 300%, содержащий в своем составе лекарственные средства, и высвобождающий эти лекарственные средства во внешнюю среду в терапевтической концентрации в течение длительного времени.
Определяющими отличительными признаками по сравнению с прототипом являются:
1. Для изготовления микроволокнистого материала используют метод однофазного электроспиннинга, что позволяет упростить способ и обеспечить получение однородной полимерной композиции.
2. Полимерную композицию готовят путем последовательного смешивания между собой раствора ЧСА в ГФИП и лекарственного средства в ДМСО, после чего полученный раствор смешивают с раствором ПКЛ в ГФИП, при этом весовое соотношение ПКЛ : ЧСА составляет 9:1, что позволяет повысить эластичность микроволокнистого материала.
3. В состав полимерной композиции для электроспиннинга вводят высококипящий растворитель ДМСО в диапазоне 0,5-10,0% от объема полимерного раствора, что позволяет снизить скорость высвобождения лекарственного вещества из состава материала и обеспечить его длительное высвобождение в течение не менее месяца.
3. Низкомолекулярные лекарственные вещества (ЛВ), растворенные в ДМСО вводят в исходный полимерный раствор в экспериментально подобранном оптимальном количестве, конечная концентрация в готовом полимерном растворе для паклитакселя 0,001%, для сиролимуса - 0,01%, для диклофенака - 0,15%, при этом объемное соотношение растворов ПКЛ : ЧСА : ЛС составляет 1:1:(0,01-0,2), что обеспечивает простоту и воспроизводство процесса изготовления микроволокнистого материала.
Предлагаемый способ позволяет получать эластичные микроволокнистые материалы, длительно высвобождающие лекарственные средства, способные ингибировать пролиферативную активность клеток подстилающей ткани или микроорганизмов, снизить воспалительную реакцию в месте имплантации материала.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1.
Для получения микроволокнистого материала использовали полимерный раствор ПКЛ, ЧСА в 1,1,1,3,3,3-гексафоризопропаноле (ГФИП) и паклитакселя в ДМСО. Для этого отдельно 0,09 г ПКЛ растворяли в 1 мл ГФИП, 0,01 г ЧСА растворяли в 1 мл ГФИП, 20 мкг паклитакселя растворяли в 10 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 0,5%, весовое соотношение ПКЛ : ЧСА : паклитаксел составляло 9:1:0,002). Затем поочередно смешивали растворы паклитакселя и ЧСА, после чего добавляли раствор ПКЛ до получения 2 мл раствора. Стерильный шприц заполняли 2 мл полученной полимерной композиции и проводили электроспиннинг раствора в следующем режиме: напряжение - 20 кВ, скорость подачи полимерной композиции - 1,5 мл/час, скорость вращения электрода-коллектора - 300 об/мин. Полученный микроволокнистый материал формировали на поверхности барабанного электрода - коллектора диаметром 2 см и длиной 4 см. После формирования материал снимали с поверхности коллектора в сухом состоянии.
Пример 2.
Способ осуществляли согласно примеру 1, за исключением того, что 20 мкг паклитакселя растворяли в 120 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 6,0%, а весовое соотношение ПКЛ : ЧСА : паклитаксел составляло 9:1:0,002).
Пример 3.
Способ осуществляли согласно примеру 1, за исключением того, что 20 мкг паклитакселя растворяли в 200 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 10,0%, а весовое соотношение ПКЛ : ЧСА : паклитаксел составляло 9:1:0,002).
Пример 4.
Способ осуществляли согласно примеру 1, за исключением того, что вместо раствора паклитакселя использовали раствор 200 мкг сиролимуса в 10 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 0,5%, а весовое соотношение ПКЛ : ЧСА : сиролимус составляло 9:1:0,02).
Пример 5.
Способ осуществляли согласно примеру 3, за исключением того, что вместо раствора паклитакселя использовали раствор 200 мкг сиролимуса в 120 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 6,0%, а весовое соотношение ПКЛ : ЧСА : сиролимус составляло 9:1:0,02).
Пример 6.
Способ осуществляли согласно примеру 2, за исключением того, что вместо раствора паклитакселя использовали раствор 200 мкг сиролимуса в 200 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 10,0%, а весовое соотношение ПКЛ : ЧСА : сиролимус составляло 9:1:0,02).
Пример 7.
Способ осуществляли согласно примеру 1, за исключением того, что вместо раствора паклитакселя использовали раствор 3 мг диклофенака в 10 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 0,5%, а весовое соотношение ПКЛ : ЧСА : диклофенак составляло 9:1:0,3).
Пример 8.
Способ осуществляли согласно примеру 3 за исключением того, что вместо раствора паклитакселя использовали раствор, содержащий 3 мг диклофенака в 120 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 6,0%, а весовое соотношение ПКЛ : ЧСА : диклофенак составляло 9:1:0,3.
Пример 9.
Способ осуществляли согласно примеру 2 за исключением того, что вместо раствора паклитакселя использовали раствор, содержащий 3 мг диклофенака в 200 мкл ДМСО (объемная доля ДМСО в полимерном растворе составляла 10,0%, а весовое соотношение ПКЛ : ЧСА : диклофенак составляло 9:1:0,3).
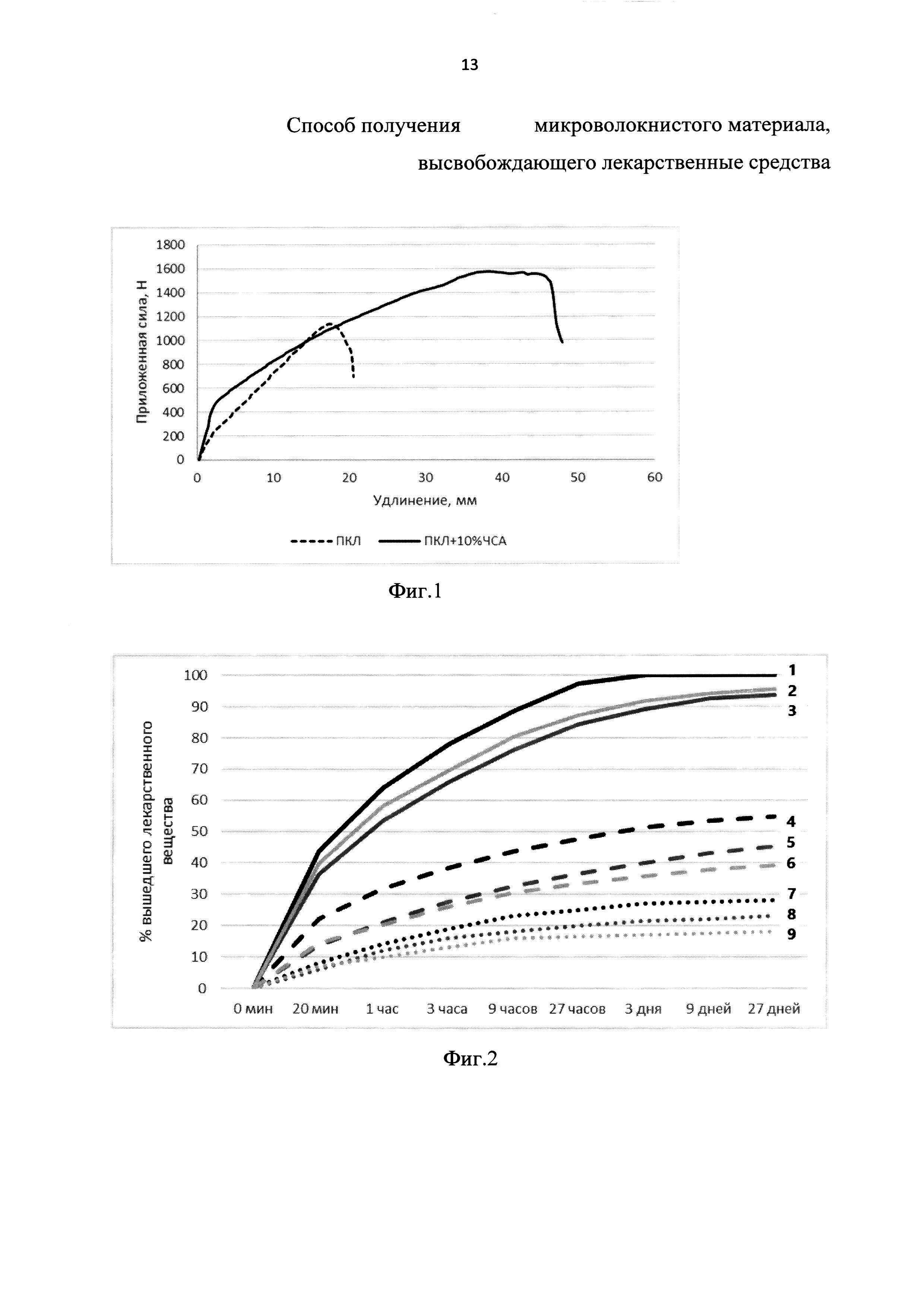
Механические свойства микроволокнистых материалов, полученных по примерам 1-9 изучали согласно ГОСТ 51556-2000, с использованием универсальной разрывной машины для испытания материалов Zwick/Roell Z100 (Германия) при постоянной скорости приложения силы 10 мм/мин. результаты с разрывной машины чистый ПКЛ и ПКЛ с ЧСА. На фиг. 1 представлена диаграмма растяжения микроволокнистых материалов, изготовленных из чистого ПКЛ и ПКЛ с добавлением 10% ЧСА. Показано, что введение 10% ЧСА в состав полимерных волокон материала значительно увеличивают эластичность последнего по сравнению с чистым поликапролактоном.
Для исследования скорости высвобождения лекарственных веществ из материалов, полученных по примерам 1-9, в состав полимерной композиции вводили лекарственное вещество, меченое тритием по методу обмена термоактивированного трития (Патент №1823961 A3), с концентрацией метки 106 срм на 2 мл полимерного раствора.
Из полученных микроволокнистых материалов высекали диски диаметром 1 см и раскладывали в лунки 48 луночного планшета. В каждую лунку вносили по 250 мкл раствора, после чего начинали отсчет времени инкубации. Планшет заклеивали герметичной липкой пленкой для предотвращения высыхания раствора в лунках.
Для инкубации были выбраны следующие временные промежутки: 20 мин, 60 мин, 3 часа, 9 часов, 27 часов, 3 дня, 9 дней, 27 дней. Кинетику высвобождения веществ из состава материала оценивали путем последовательной инкубации одного и того же образца со сменой раствора через заданные временные промежутки.
При инкубации из лунок отбирали по 200 мкл, переносили в пробирку на 1,5 мл для измерения радиоактивности. Отмывали лунки с матриксами 200 мкл раствора и вносили свежие 200 мкл раствора. Образцы материала инкубировали до следующей временной точки и повторяли процедуру отбора образцов и отмывания материалов.
Счет радиоактивности проводили на стинтиляционном анализаторе "Tri - Carb 2800 TR" фирмы PerkinElmer. Кинетика высвобождения лекарственных препаратов из состава микроволокнистых материалов при инкубации в плазме крови представлена на фиг. 2, где
1 - ПКЛ + 10,0% ЧСА + Паклитаксел + 0,5% ДМСО;
2 - ПКЛ + 10,0% ЧСА + Диклофенак + 0,5% ДМСО;
3 - ПКЛ + 10,0% ЧСА + Сиролимус + 0,5% ДМСО;
4 - ПКЛ + 10,0% ЧСА + Паклитаксел + 6,0% ДМСО;
5 - ПКЛ + 10,0% ЧСА + Диклофенак + 6,0% ДМСО;
6 - ПКЛ + 10,0% ЧСА + Сиролимус + 6,0% ДМСО.
7 - ПКЛ + 10,0% ЧСА + Паклитаксел + 10,0% ДМСО;
8 - ПКЛ + 10,0% ЧСА + Диклофенак + 10,0% ДМСО;
9 - ПКЛ + 10,0% ЧСА + Сиролимус + 10,0% ДМСО.
Показано, что в первые 20 минут из волокон материала высвобождается 35-40% лекарственных веществ (от общего количества введенного вещества) а затем в течение месяца до 90-100% (при добавлении 0,5% ДМСО в состав полимерной композиции), с 15-25% в течение первых 20 минут до 40-55% в течение месяца при добавлении 6,0% ДМСО и с 8-10% в течение первых 20 минут до 19-30% в течение месяца при добавлении 10,0% ДМСО в состав полимерной композиции для электроспиннинга.
Показано, что увеличение концентрации ДМСО в составе полимерной композиции с 0,5 до 10,0% позволяет снизить скорость высвобождения лекарственного вещества из состава материала и обеспечить его длительное высвобождение в течение не менее месяца.
Таким образом, использование предлагаемого способа позволит получать микроволокнистые материалы, которые обладают высокой эластичностью, способны в течение не менее месяца выделять лекарственные препараты в терапевтической концентрации для использования в медицинской практике. Процедура изготовления отличается простотой, воспроизводимостью и технологичностью.