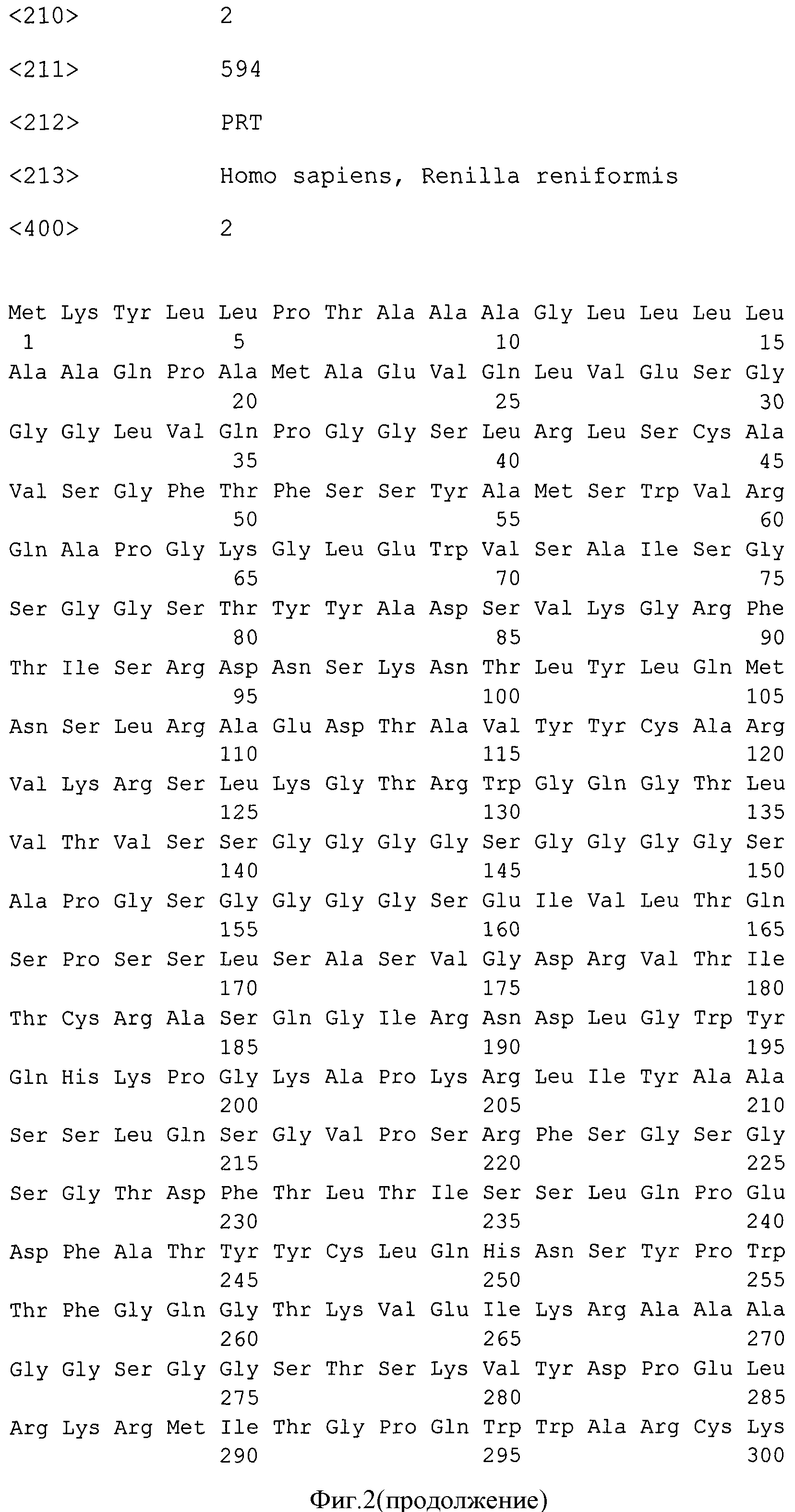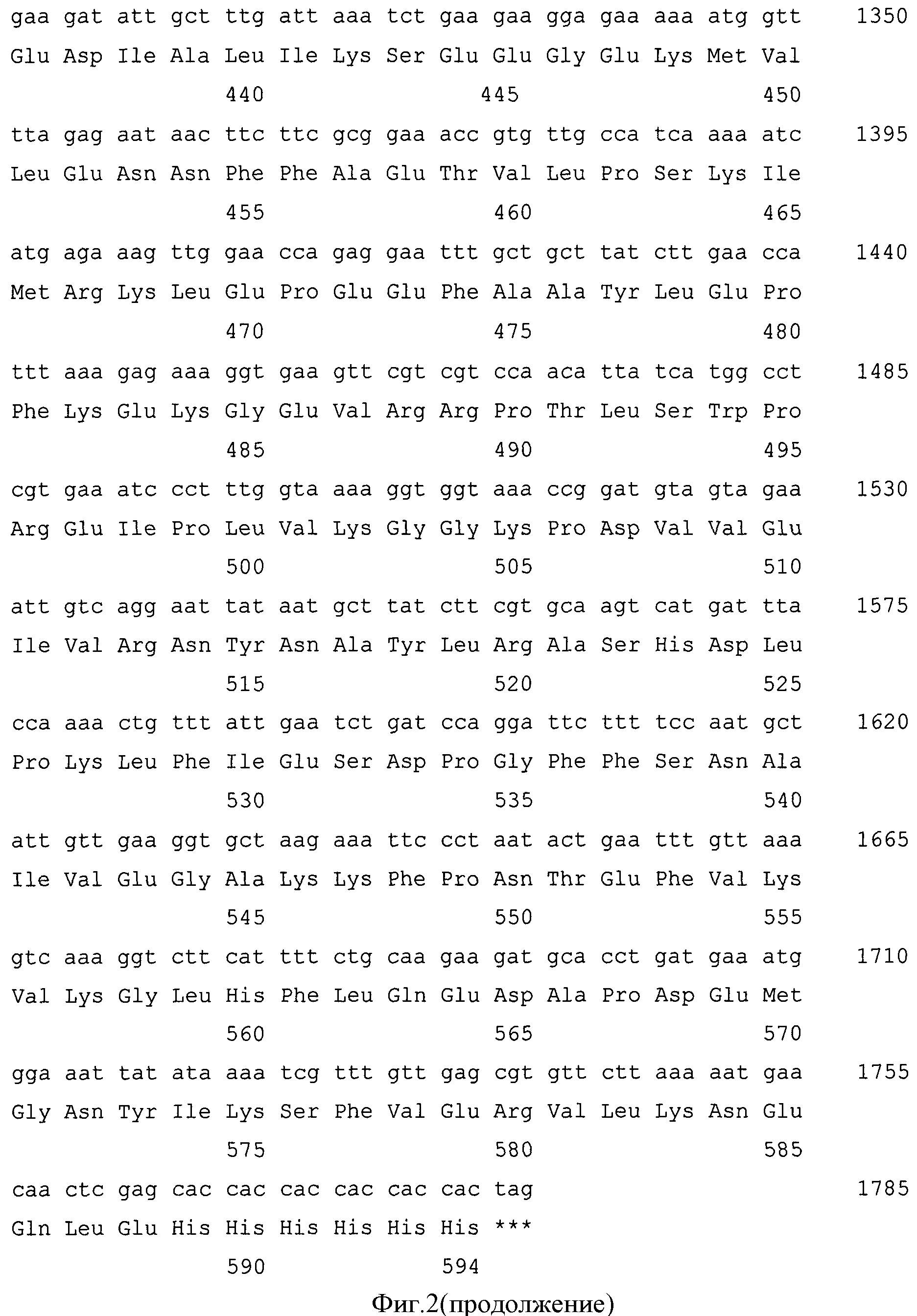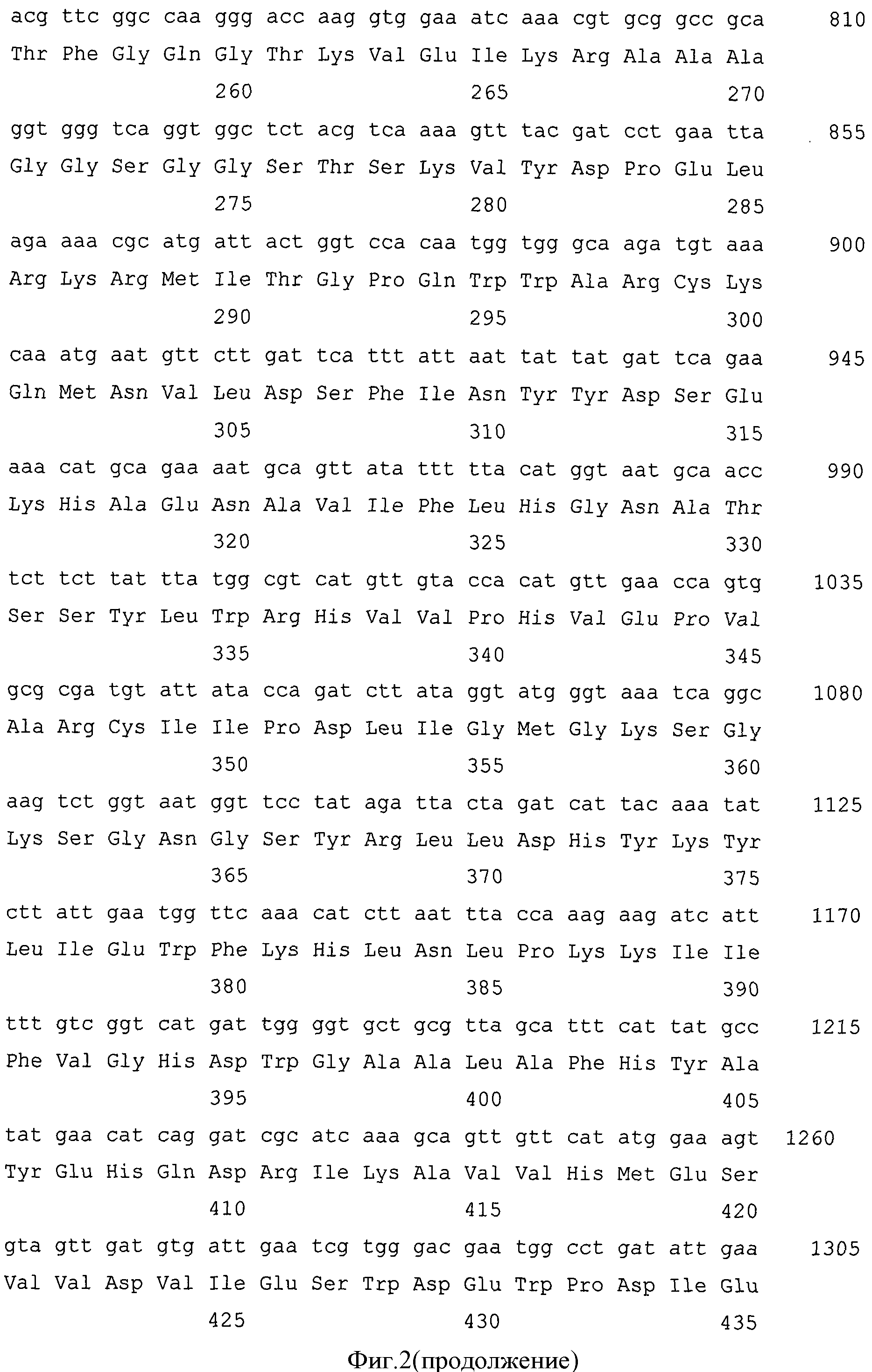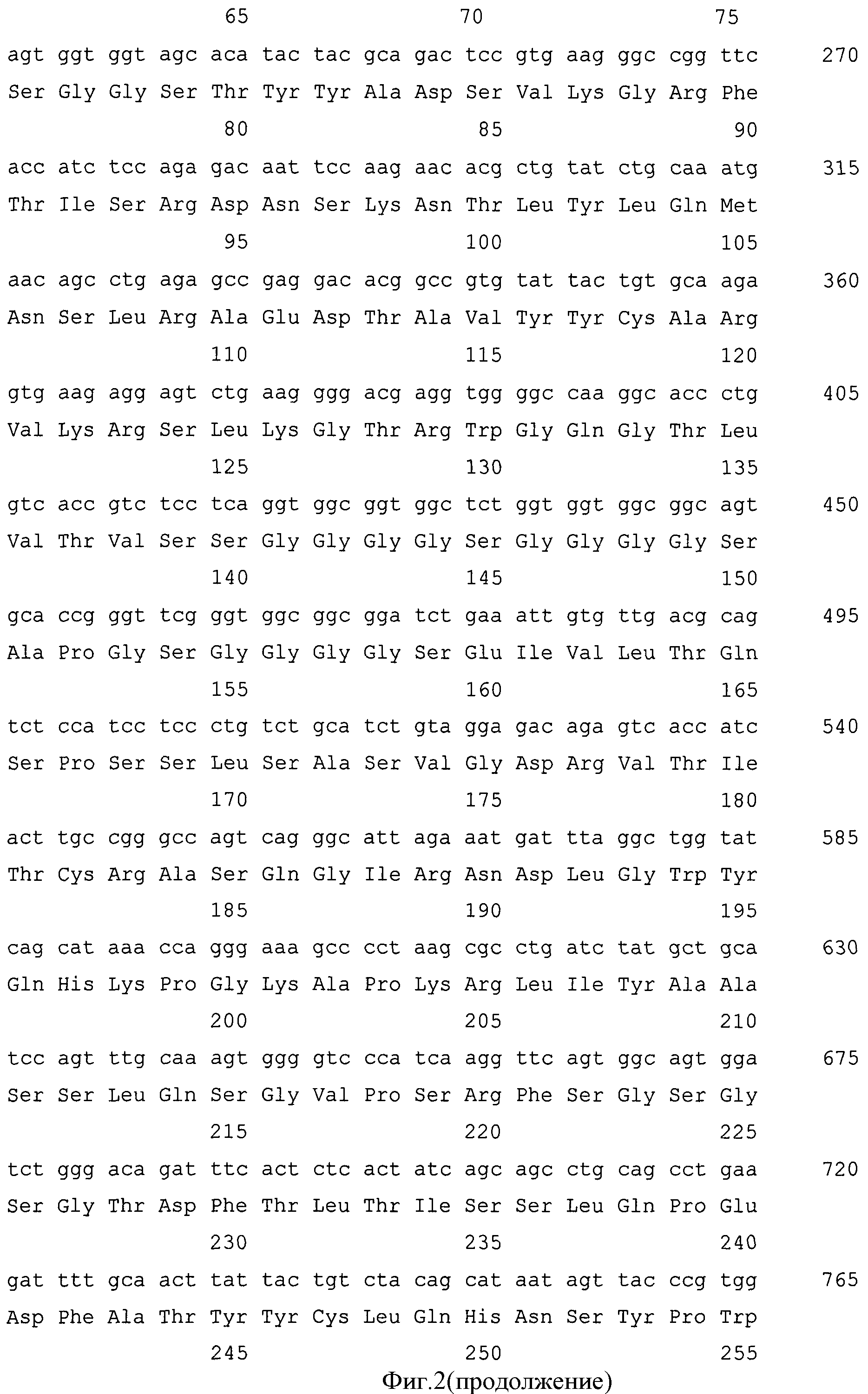Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pG1-Rm7, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА G1-Rm7, И ГИБРИДНЫЙ БЕЛОК, СВЯЗЫВАЮЩИЙ ФАКТОР НЕКРОЗА ОПУХОЛЕЙ И ОБЛАДАЮЩИЙ БИОЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Группа изобретений относится к биотехнологии, генной и белковой инженерии и предназначена для получения генетически слитого бифункционального гибридного белка, состоящего из одноцепочечного антитела человека против фактора некроза опухолей альфа человека и модифицированного светоизлучающего белка целентеразин-зависимой люциферазы Renilla muelleri.
Фактор некроза опухолей альфа (ФНО) является главным медиатором острого воспалительного ответа на грамотрицательные бактерии и другие инфекционные агенты. Основным источником ФНО являются активированные мононуклеарные фагоциты, хотя стимулированные Т-клетки, натуральные киллеры и тучные клетки также могут секретировать этот белок [1]. Главным стимулятором запуска продукции ФНО макрофагами является бактериальный липополисахарид (ЛПС) или грамотрицательные бактерии, высвобождающие ЛПС [1]. Интерферон-гамма, продуцируемый Т-клетками и NK-клетками, усиливает продукцию этого цитокина ЛПС-активированными макрофагами [2].
ФНО ответственен за многие системные осложнения, возникающие при тяжелых инфекционных процессах, при этом ФНО, продуцируемый в большом количестве, может вызывать системные клинические и патологические проявления. Воздействуя на гипоталамус, он индуцирует лихорадку и поэтому называется естественным эндогенным пирогеном. В результате возникающей лихорадки увеличивается синтез простагландинов цитокин-стимулированными клетками гипоталамуса [3]. Кроме того, ФНО оказывает воздействие на печень, увеличивая, в частности, синтез гепатоцитами сывороточного амилоидного белка А и фибриногена - сывороточных воспалительных белков. Пролонгированная продукция ФНО вызывает и метаболические повреждения, такие как кахексия: он ингибирует синтез липопротеинлипазы - фермента, необходимого для высвобождения жирных кислот из циркулирующих липопротеиновых комплексов. Когда концентрация ФНО в сыворотке достигает больших значений, превышая 10-7 М, это вызывает снижение сосудистого тонуса и сократимости миокарда, что, в конечном счете, приводит к резкому падению кровяного давления и шоку [4]. Кроме того, ФНО вносит ощутимый вклад в развитие локальных воспалительных реакций, в частности, при аутоиммунных заболеваниях [5]. Поэтому высокочувствительное количественное определение уровня ФНО в организме необходимо для своевременной диагностики ряда патологических состояний.
Люцифераза мягкого коралла Renilla muelleri представляет собой сравнительно небольшой, 36 кДа, одноцепочечный полипептид. Фермент катализирует окисление субстрата - целентеразина, молекулярным кислородом с образованием CO2 и молекулы целентерамида в возбужденном состоянии. Переход этого соединения в основное состояние сопровождается выделением света в видимой области спектра (λmax=482 нм). Ген, кодирующий этот белок, был клонирован, получен и изучен рекомбинантный белок дикого типа, а также методом сайт-направленного мутагенеза получен термостабильный вариант этого белка Rm7 [6, 7].
Известны ген и рекомбинантная целентеразин-зависимая люцифераза коралла Renilla reniformis, а также улучшенные производные этого белка. В литературе описаны бифункциональные гибридные белки на основе этой люциферазы, слитой с другими белками, например зеленым флуоресцентным белком (GFP) [8, 9], рецептором [10] и пр., которые используются для in vivo имиджинга, исследований на основе явления BRET и др.
Наиболее близким аналогом - прототипом к заявляемой группе изобретений является рекомбинантная плазмидная ДНК, полученная на базе бактериальной экспрессирующей плазмиды pKKtac вставкой последовательно гена Т84.66 anti-CEA, кодирующего антитело к карциноэмбриональному антигену, и гена модифицированной люциферазы Renilla reniformis, соединенных олигонуклеотидом, кодирующим 18-членный пептид-линкер. Плазмида кодирует синтез гибридного белка anti-CEA diabody-Renilla luciferase (Db-18-RLuc8), обладающего аффинностью к карциноэмбриональному антигену и биолюминесцентной активностью люциферазы, который может быть использован для визуализации опухоли в живом организме [11].
Конструирование, получение и использование для иммуноанализа фактора некроза опухолей гибридных белков с использованием люциферазы Renilla reniformis или ее аналогов в качестве репортеров в литературе не описано. Также не описано получение каких-либо гибридных белков с люциферазой мягкого коралла Renilla muelleri или ее генетически измененных вариантов.
Технической результатом группы изобретений является получение бифункционального гибридного белка, обладающего способностью связывать ФНО человека и одновременно биолюминесцентной активностью, как потенциально пригодного высокочувствительного репортера для выявления фактора некроза опухолей методом биолюминесцентного иммуноанализа.
Указанный результат достигается путем конструирования рекомбинантной плазмидной ДНК pG1-Rm7, содержащей уникальный ген одноцепочечного антитела человека, направленного против ФНО, и ген модифицированной люциферазы Renilla muelleri; экспрессией целевого гибридного белка в трансформированных упомянутой плазмидной ДНК клетках Escherichia coli HB2151 с последующими выделением из периплазматической фракции и очисткой металл-хелатной хроматографией гибридного белка G1-Rm7, который обладает способностью связывать ФНО человека и одновременно биолюминесцентной активностью. Сущность группы изобретений заключается в следующем.
Генно-инженерными методами получают плазмиду pG1-Rm7, несущую уникальный ген одноцепочечного антитела человека, направленного против ФНО, и ген модифицированной люциферазы Renilla muelleri. Клетки E. coli HB2151, трансформированные сконструированной плазмидой, способны продуцировать гибридный белок G1-Rm7, состоящий из одноцепочечного антитела человека, направленного против ФНО, и модифицированной люциферазы Renilla muelleri, катализирующей реакцию окисления целентеразина с излучением света в видимой области спектра.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pG1-Rm7 являются:
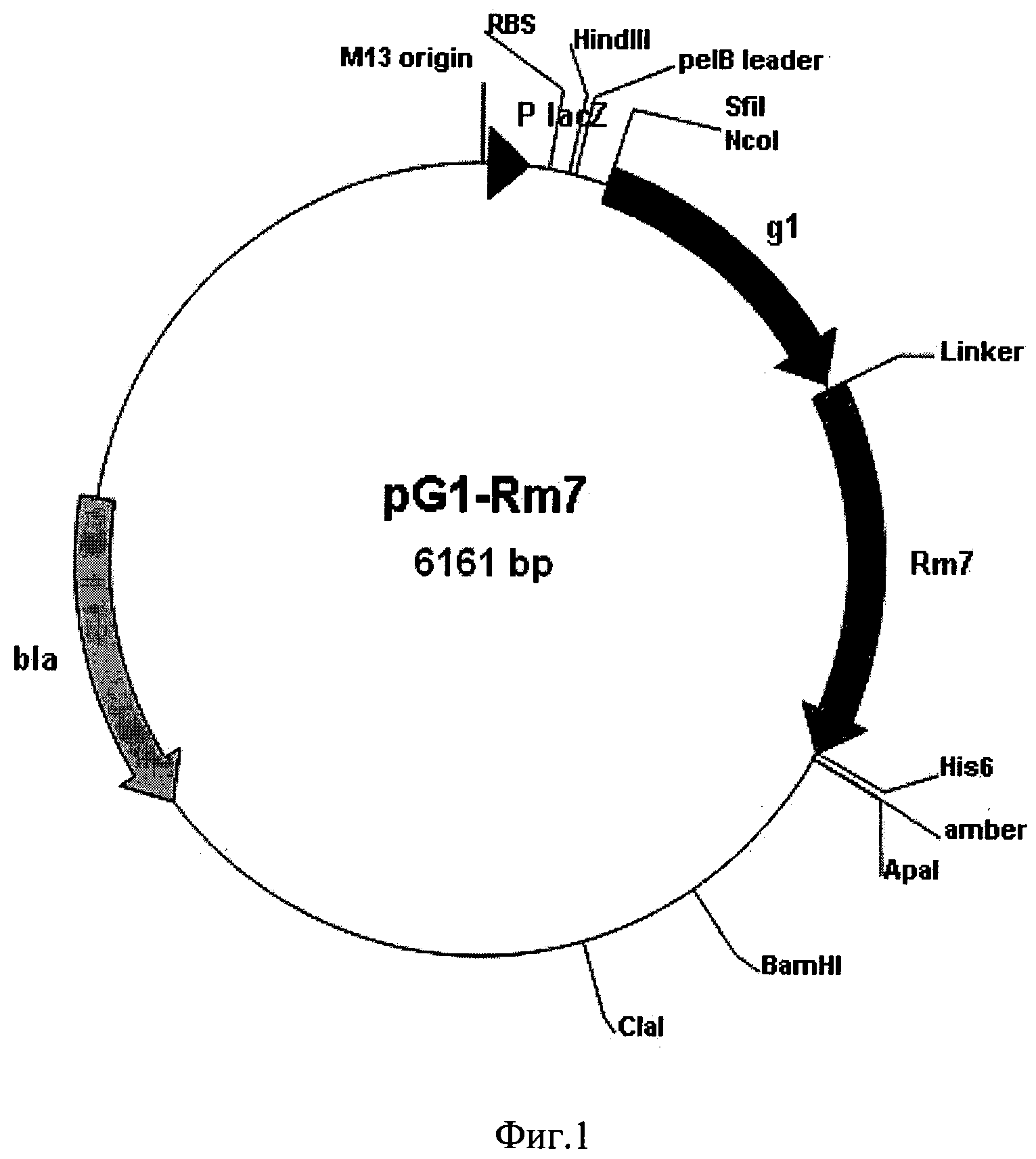
а) модифицированный плазмидный вектор pHEN2-g1 [12], содержащий ген вариабельных доменов тяжелой и легкой цепей моноклонального антитела gl против фактора некроза опухоли человека, представляющий собой два фрагмента размером 360 п.о. и 333 п.о. соответственно, между которыми находится коннектор размером 57 п.о., кодирующий линкерный пептид (Gly4Ser)2(AlaProGlySer)(Gly4Ser), гидролизованный по NotI и ApaI-сайтам и содержащий сайт инициации репликации фага М13, промотор lacZ и уникальные сайты рестрикции HindIII (235), SfiI (328), NcoI (332), AvaI (2939), PstI (986), NotI (1076), BamHI (1737), ClaI (2045);
б) ДНК-последовательность, кодирующая пептид GGSGGS и модифицированную люциферазу Renilla muelleri [6, 7], встроенную по сайтам эндонуклеаз рестрикции NotI и ApaI.
Полученная в результате плазмида pG1-Rm7 характеризуется следующими признаками:
- имеет молекулярную 3.69 МДа и размер 6161 п.о.;
- содержит NotI-ApaI-фрагмент размером 954 п.о., представляющий собой последовательность, кодирующую пептид GGSGGS и модифицированную целентеразин-зависимую люциферазу из мягкого коралла Renilla muelleri;
- содержит генетические маркеры: bla - ген ампициллин резистентности (ген (3-лактамазы), определяющий устойчивость к ампициллину при трансформации Escherichia coli.
Экспрессию гибридного белка осуществляют в бактериальных клетках Escherichia coli HB2151, трансформированных ДНК плазмиды pG1-Rm7, обеспечивающих индуцируемый изопропилтиогалактозидом (ИПТГ) синтез гибридного белка G1-Rm7.
Индикацию экспрессии осуществляют с помощью гель-электрофореза в денатурирующих условиях (SDS-PAGE). Уровень экспрессии определяют с помощью денситометрии полиакриламидного геля, окрашенного Кумасси-К250 с использованием программного обеспечения Image Lab Ver. 3.0, поставляемого с прибором GelDocXR+(Bio-Rad). Уровень экспрессии составляет около 2% суммарного клеточного белка.
Целевой белок выделяют из периплазматической фракции и очищают с помощью металл-хелатной хроматографии. Степень очистки определяют сканированием геля на денситометре GelDocXR+(Bio-Rad). Концентрацию очищенного гибридного белка G1-Rm7 определяют спектрофотометрически с помощью набора DC Protein Assay (Bio-Rad), no протоколу производителя.
Полученный гибридный белок обладает биолюминесцентной активностью, которую определяют с помощью кюветного люминометра (модель БЛМ 8802, СКБ Наука, Красноярск) в буфере следующего состава 50 мМ Трис-HCl рН 7.0, 25 мМ NaCl, 1 мМ ЭДТА сразу после внесения целентеразина (10-5 М раствор в метаноле). При проведении биолюминесцентного иммуноанализа измерения проводили с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия). Биолюминесценцию инициировали внесением свежеприготовленного раствора целентеразина в 50 мМ Трис-HCl рН 7.0, 25 мМ NaCl, 1 мМ ЭДТА.
Полученный гибридный белок обладает способностью связывать ФНО человека, которая была показана с помощью прямого биолюминесцентного твердофазного иммуноанализа. При этом ФНО обнаруживается в растворе с концентрацией до 1,6 нг/мл (9,4 10-11 М).
Таким образом, впервые получена плазмидная ДНК pG1-Rm7, содержащая в одной рамке считывания ген одноцепочечного антитела человека, способного связывать фактор некроза опухолей, последовательность, кодирующую пептид GGSGGS, и ген модифицированной люциферазы Renilla muelleri; получен гибридный белок - одноцепочечное антитело-люцифераза (G1-Rm7), связывающий фактор некроза опухолей и обладающий биолюминесцентной активностью, который обеспечивает выявление фактора некроза опухолей биолюминесцентным иммуноанализом.
Изобретение иллюстрируется следующими фигурами:
Фиг.1. Общая схема структурной организации плазмиды pG1-Rm7. Обозначения: g1 - ген, кодирующий одноцепочечное антитело человека, способное связывать фактор некроза опухолей; Rm7 - ген, кодирующий модифицированную люциферазу Renilla muelleri; Linker - последовательность, кодирующая пептид GGSGGS; His6 - последовательность, кодирующая пептид НННННН; bla - ген устойчивости к ампициллину; указаны некоторые сайты рестрикции.
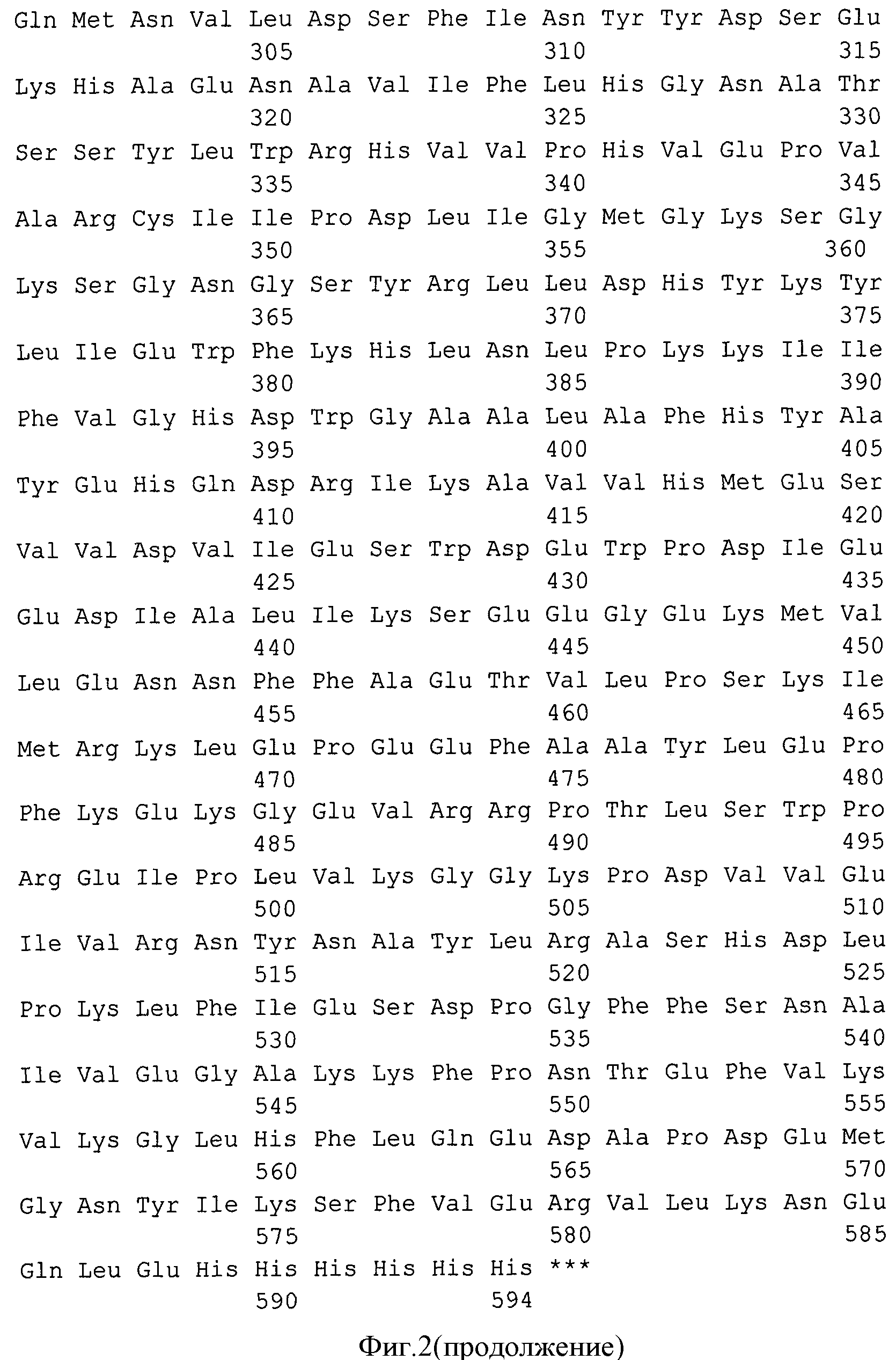
Фиг.2. Нуклеотидная и кодируемая ею аминокислотная последовательности гибридного белка G1-Rm7.
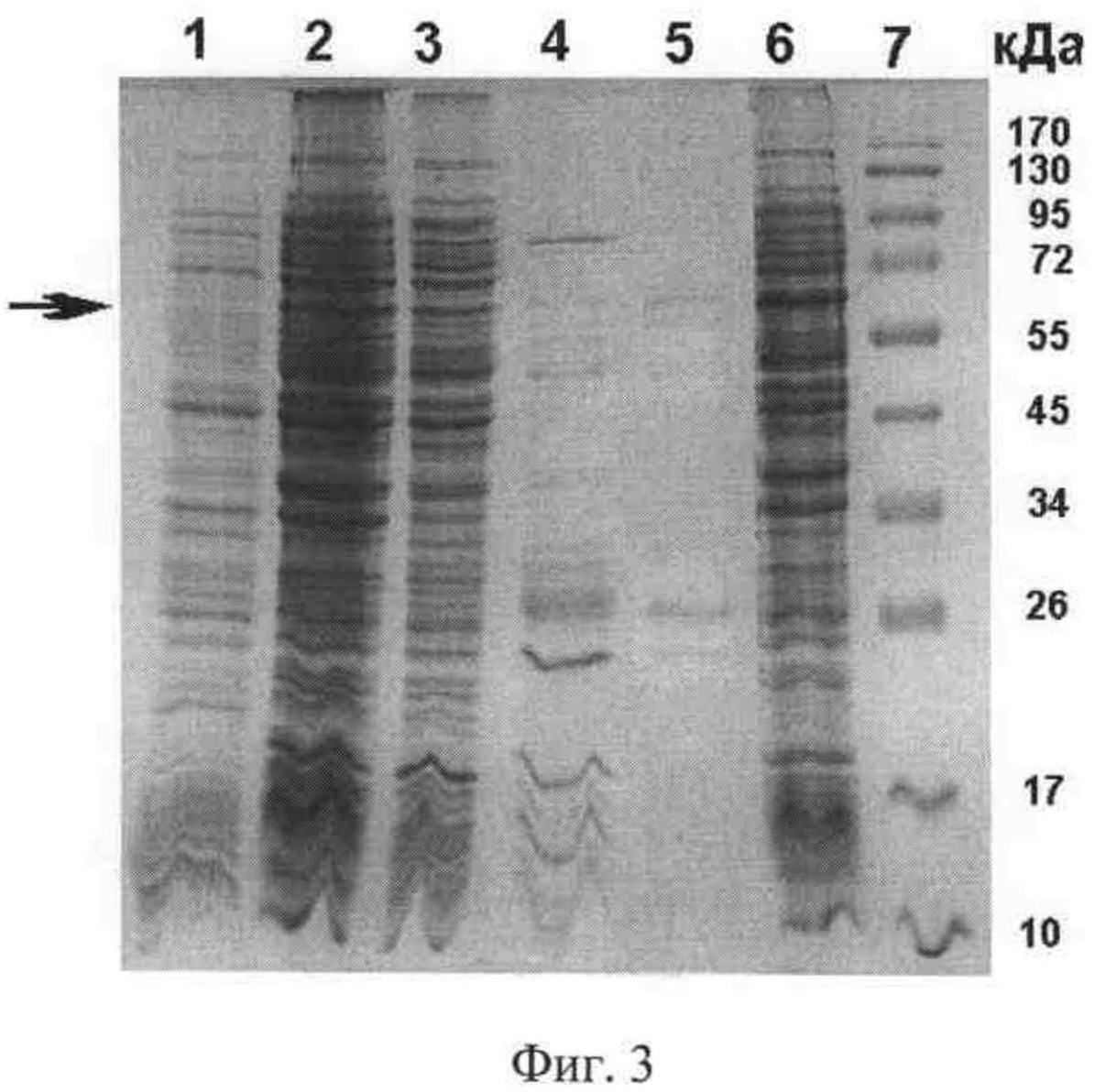
Фиг.3. 12% SDS-гель электрофорез фракций при выделении гибридного белка G1-Rm7. Дорожки: 1, 2 - лизат клеток НВ2151/pG1-Rm7 до и после индукции ИПТГ, соответственно; 3 - цитоплазматическая фракция, 4, 5 - периплазматическая фракция до и после очистки металл-хелатной хроматографией, 6 - фракция телец включения, 7 - маркеры молекулярных масс. Стрелкой показаны полосы, соответствующие целевому гибридному белку.
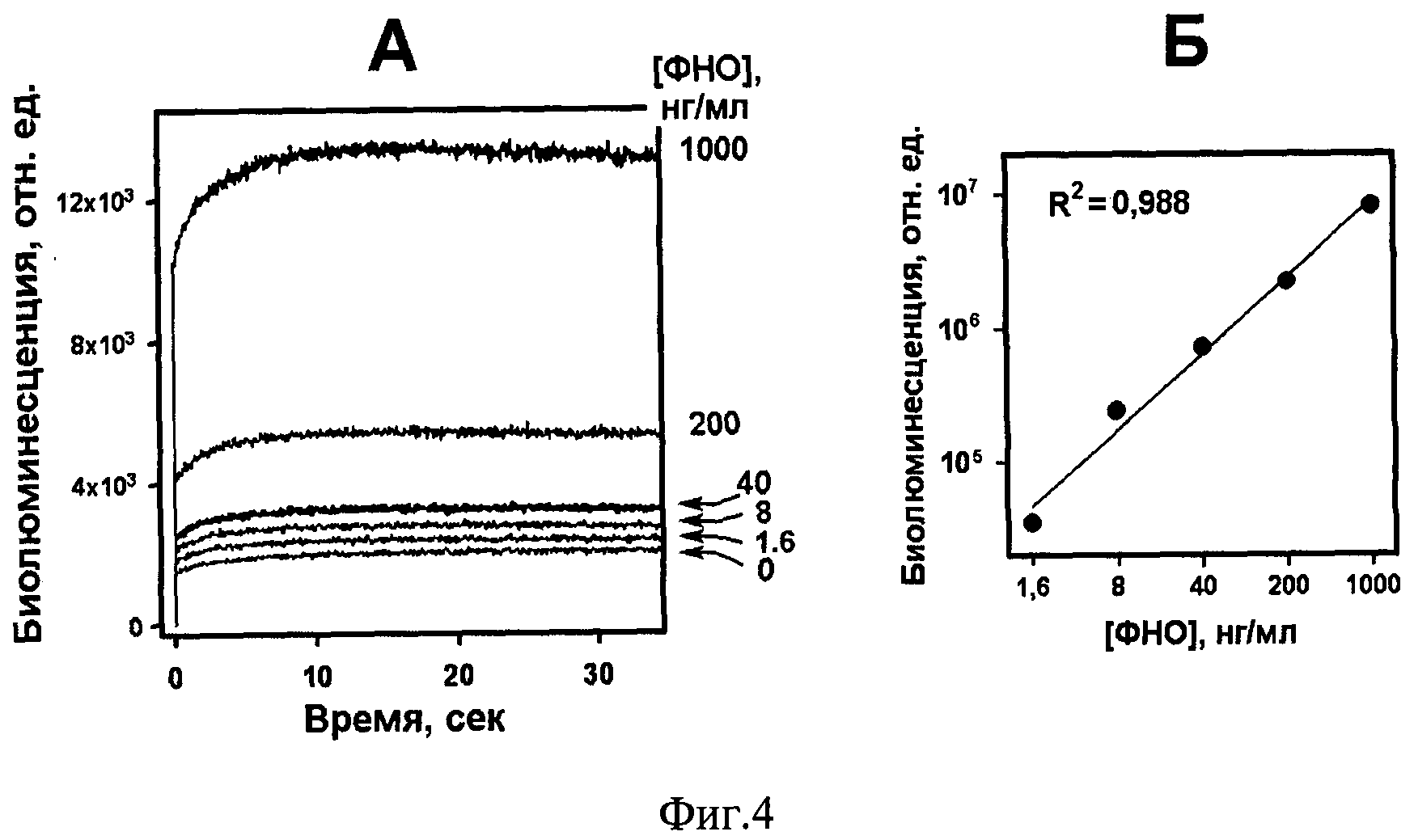
Фиг.4 (А-Б). Твердофазный иммуноанализ ФНО с использованием гибридного белка G1-Rm7.
Для лучшего понимания сущности предлагаемых изобретений, они иллюстрируются следующими примерами осуществления.
Пример 1. Конструирование плазмиды pG1-Rm7.
Предварительно проводят конструирование гена, кодирующего рекомбинантную люциферазу из мягкого коралла Remlla muelleri.
Амплификацию гена, кодирующего люциферазу, проводят методом ПЦР с использованием Pfu-ДНК-полимеразы (СибЭнзим, Новосибирск). Для синтеза фрагмента ДНК, кодирующего люциферазу, в реакционную смесь добавляют прайме? 92Rm7No5 5'-CAGGCTGCGGCCGCAGGTGGGTCAGGTGGCTCTACGTCAAAAG, кодирующий гибкий пептидный линкер (Gly2Sei)2 и содержащий сайт рестрикции для NotI. В качестве обратного используют праймер 115Rm7Ap3 5'-GTTAGCAGCGGGCCCTCAGTGGTG, содержащий сайт рестрикции для ApaI. Продукт амплификации, кодирующий пептид (Gly2Ser)2 и рекомбинантную люциферазу Remlla muelleri, подвергают очистке с помощью QIAquick PCR Purification Kit (Qiagen, USA) и расщепляют рестриктазами NotI и ApaI в реакционной смеси, содержащей 10 mM TpиcHCl, рН 7.6; 10 mM MgCl2; 50 тМ NaCl, 1 mM DTT и по 20 ед. активности соответствующих ферментов. Реакцию ведут 2 часа при 37°С. После этого фрагмент длиной 990 п.о. очищают методом электрофореза в агарозном геле с последующей очисткой с помощью QIAquick Gel Extraction Kit (Qiagen, USA).
Плазмидную ДНК pHEN2-g1, содержащую ген одноцепочечного антитела g1 с лидерным пептидом pelB, обрабатывают эндонуклеазами рестрикции NotI и Apal в стандартном буфере при 37°С в течение 2 часов. Затем проводят дефосфорилирование в течение 1 часа с 20 ед. CIP в том же буфере. Ферменты инактивируют прогреванием при 65°С 20 мин. После этого ДНК плазмиды очищают методом электрофореза в 1% агарозном геле с последующей очисткой с помощью QIAquick Gel Extraction Kit (Qiagen, USA).
Линеаризованную плазмиду лигируют с фрагментом ДНК, кодирующим пептид (Gly2Ser)2 и рекомбинантную люциферазу Renilla muelleri, обработанным теми же эндонуклеазами рестрикции. Лигирование проводят в стандартном буфере. Полученной лигазной смесью трансформируют клетки E. coli XL1Blue. С помощью рестрикционного анализа отбирают клоны, содержащие плазмидную ДНК со вставкой нужного размера. Полученную таким образом целевую плазмиду обозначают как pG1-Rm7. Схема плазмидной ДНК pG1-Rm7 представлена на фиг.1.
Правильность конструирования подтверждают секвенированием. Результат представлен на фиг.2.
Пример 2. Получение гибридного белка G1-Rm7.
Клетки Е. coli HB2151 трансформируют ДНК плазмиды pG1-Rm7, инкубируют в YTx2 среде с добавлением 0,1% глюкозы и 100 мМ ампициллина при 37°С до оптической плотности ОД600=0,4-0,5. Затем клеточную суспензию охлаждают и экспрессию гибридного белка G1-Rm7 индуцируют добавлением 0,5 мМ ИПТГ. Далее клетки инкубируют при 28°С в течение ночи и осаждают центрифугированием. Гибридный белок G1-Rm7 выделяют из периплазматической фракции и очищают с помощью металл-хелатной хроматографии на сорбенте Talon (Clontech) по протоколу производителя. Результаты выделения и очистки представлены на фиг.3. На фигуре 3 видно (дорожки 1, 2), что после индукции в клетках появляется новый белок, молекулярная масса которого 64,5 кДа близка расчетной массе гибридного белка G1-Rm7 (показано стрелкой). Белок обнаружен в цитоплазматической и периплазматической фракциях (дорожки 3, 4), а также в тельцах включения (дорожка 6). После очистки периплазматической фракции металл-хелатной хроматографией получен препарат, в котором гибридный белок составляет 15,5% (дорожка 5). На дорожке 7 приведены маркеры молекулярных масс.
Пример 3. Применение гибридного белка G1-Rm7 для биолюминесцентного твердофазного иммуноанализа ФНО.
В лунки непрозрачного иммунологического планшета (Costar, США) вносят по 100 мкл раствора рекомбинантного фактора некроза опухолей [13] в различных концентрациях (1000, 200, 40, 8, 1.6, 0 нг/мл) в 50 мМ K-Na фосфатном буфере рН 7,0 с 0,15 М NaCl (PBS) и инкубируют при 37°С в течение часа. После промывки (PBS, содержащий 0,1% Tween-20 и 5 мМ ЭДТА) в лунки вносят по 100 мкл 2% раствора обезжиренного молочного порошка в PBS и инкубируют при 37°С, 1 час. После промывки (PBS, содержащий 0,1% Tween-20 и 5 мМ ЭДТА) в лунки вносят раствор полученного гибридного белка, инкубируют при 23°С 1 час при перемешивании. После промывки (PBS, содержащий 0,1% Tween-20 и 5 мМ ЭДТА) вносят в лунки по 100 мкл раствора целентеразина (2×10-6 М в 50 мМ Трис-HCl рН 7.0, 25 мМ NaCl, 1 мМ ЭДТА) с одновременным измерением биолюминесцентного сигнала связавшегося гибридного белка с помощью планшетного люминометра Mithras LB 940 (Berthold, Германия). Сигнал интегрируют в течение 30-40 с. Полученный результат приведен на Фиг.4(А-Б). На Фиг.4А показаны биолюминесцентные сигналы гибридного белка от лунок, на поверхность которых сорбировали разное количество ФНО. На Фиг.4Б приведена зависимость интегрированного в течение 40 секунд биолюминесцентного сигнала (среднее значение от двух повторов, с вычетом усредненного сигнала от контрольных лунок с нулевым содержанием ФНО) от концентрации растворов ФНО, взятых для сорбции на поверхности лунок (логарифмические координаты). Зависимость биолюминесцентного сигнала от концентрации фактора некроза опухолей в диапазоне от 1,6 нг/мл до 1 мг/мл близка линейной (R2=0,988). Это означает возможность построения калибровочной кривой для количественного иммуноанализа фактора некроза опухолей с использованием полученного гибридного белка в качестве репортера.
Таким образом, впервые получена плазмидная ДНК pG1-Rm7, содержащая в одной рамке считывания ген одноцепочечного антитела человека, способного связывать фактор некроза опухолей, и ген модифицированной люциферазы Renilla muelleri. Получен рекомбинантный гибридный белок - одноцепочечное антитело-люцифераза (G1-Rm7), связывающий фактор некроза опухолей и обладающий биолюминесцентной активностью, что делает возможным его применение в качестве высокочувствительного репортера для количественного иммуноанализа фактора некроза опухолей.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Abbas, A.K., Lightman, A.H., Pober, J.S. Cellular and Molecular Immunology. Fourth Edition, 553. - 2000. P.240-242, 244-246.
2. Konur A., Schuiz U., Eissner G., Andreesen R., Holler E. Interferon (IFN)-gamma is a main mediator ofkeratinocyte (HaCaT) apoptosis and contributes to autocrine IFN-gamma and tumour necrosis factor-alpha production. Br. J. Dennatol. - 2005. - Vol.152(6). - P.1134-42.
3. Zailae MZ. Decreased proinflammatory cytokine production by peripheral blood mononuclear cells from vitiligo patients following aspirin treatment. Saudi Med J. - 2005. - Vol.26(5). - P.799-805.
4. Carlson DL., Willis MS., White DJ., et al., Tumor necrosis factor-alpha-induced caspase activation mediates endotoxin-related cardiac dysfunction. Crit Care Med. - 2005. - May; 33(5). - P.1021-8.
5. Feldmann M. and Maini R.N. Lasker Clinical Medical Research Award. TNF defined as a therapeutic target for rheumatoid arthritis and other autoimmune diseases. Nat. Med. - 2003 - Vol.9. - P.1245-1250.
6. M.S.Titushin, S.V.Markova, L.A.Frank, N.P.Malikova, G.A.Stepanyuk, J.Lee, E.S.Vysotski. Coelenterazine-binding protein ofRenilla muelleri: cDNA cloning, overexpression, and characterization as a substrate of luciferase. // Photochem. Photobiol. Sci. - 2008. - Vol.. - P.189-196.
7. G.A.Stepanyuk, J.Unch, N.P.Malikova, S.V.Markova, J.Lee, E.S.Vysotski. Coelenterazine-v ligated to Ca2+-triggered coelenterazine-binding protein is a stable and efficient substrate of the red-shifted mutant of Renilla muelleri luciferase. Anal. Bioanal. Chem. - 2010 - Vol.398 - P.1809-1817
8. Wang Y., Yu Y.A., Shabahang S., Wang G., Szalay A.A. Renilla luciferase-Aequorea GFP (Ruc-GFP) fusion protein, a novel dual reporter for real-time imaging of gene expression in cell cultures and in live animals. Mol. Genet. Genomics. - 2002 - Vol.268. - P.160-168
9. J.Liu, Y.Wang, A.A.Szalay, A.Escher. Visualizing and quantifying protein secretion using a Renilla luciferase-GFP fusion protein. Luminescence - 2000 - Vol.15. - P.45-49
10. Zeng F.-Y., Mclean A.J., G. Milligan, Lemer M., Chalmers D.T., Behan D.P. Ligand specific up-regulation of a Renilla reniformis luciferase-tagged, structurally unstable muscarinic M3chimeric G protein-coupled receptor. Mol. Pharmacol. - 2003. - Vol.64. - P.1474-1484
11. Venisnik K.M., Olafsen Т., Loening A.M., Iyer M., Gambhir S.S., Wu A.M. Bifunctional antibody-Renilla luciferase fusion protein for in vivo optical detection of tumors. Prot. Eng. Des. Sel. - 2006. - Vol.19. - P.453-460.
12. Вихрова М.А., Батанова Т.А., Лебедев Л.Р., Шингарова Л.Н., Франк Л.А., Кирпичников М.П., Тикунова Н.В. Одноцепочечные антитела человека, направленные к фактору некроза опухолей. Биоорг. химия. - 2011. - Т.37. - С.334-343.
13. Шингарова Л.Н., Сагайдак Л.Н., Турецкая Р.Л., Недоспасов С.А., Есипов Д.С., Коробко В.Г. Мутанты фактора некроза опухолей человека: получение и некоторые свойства. - 1996. - Т.22. - С.243-251.