Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и представляет собой способ получения рекомбинантного антиангиогенного пептида Пигастина (PGS), представляющего собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro. Проявляемые им антиангиогенные свойства определяют возможность его использования в качестве препарата для терапии заболеваний, ассоциированных с офтальмоангиопатиями.
Ангиогенез - процесс образования новых кровеносных сосудов в органе или ткани (Battegay E.J. J. Mol. Med. 1995. V. 73. №7. 333-346). Различают 2 вида ангиогенеза: физиологический и патологический. Физиологический ангиогенез является неотъемлемой частью физиологических и репаративных процессов. Патологический ангиогенез развивается как при избытке его стимуляторов и/или дефиците ингибиторов, так и при дефиците стимуляторов и/или избытке ингибиторов (Gao G., Ma J. Drug Discov. Today. 2002. V. 7. №3. 171-172). Неоангиогенез (неоваскуляризация) имеет место при ряде заболеваний глаз, таких как: диабетическая ретинопатия, возрастная макулярная дегенерация, тромбоз центральной вены сетчатки, неоваскулярная глаукома, опухоли хориоидеи и сетчатки. Сложный механизм ангиогенеза предоставляет много возможностей для терапевтического вмешательства. Основной мишенью антиангиогенной терапии является проангиогенный сосудистый эндотелиальный фактор роста VEGF. Однако развитие неоангиогенеза зависит от множества других проангиогенных белков и их функций.
В тканях и жидкостях глаза основной ангиоингибирующей молекулой, уравновешивающей проангиогенное действие VEGF является фактора роста пигментного эпителия человека (PEDF), секретируемый гликопротеин размером 50 кДа, относящийся к классу серпинов (Becerra S., Sagasti A., Spinella, Notario V. J. Biol. Chem. 1995. V. 270. №43. P. 25992-25999; Ohno-Matsui K., Morita I., Tombran-Tink J., Mrazek D., Onodera M, Uetama Т., Hayano M., Murota S.I., Mochizuki M. J Cell Physiol 2001. V. 189. №3. 323-333). PEDF был впервые идентифицирован в культуре клеток пигментного эпителия эмбриональной сетчатки человека как нейротрофный фактор (Tombran-Tink J., Johnson L.V. Ophthalmol. Vis. Sci. 1989. V. 30. №8. 1700-1707). PEDF выполняет роль сильнейшего эндогенного ингибитора ангиогенеза, действие которого опосредовано через блокирование пролиферациии миграции эндотелиальных клеток, активированных различными проангиогенными факторами, такими как PDGF, VEGF, IL-8, aFGF (Dawson D.W., Volpert О.V., Gillis, Crawford S.E., Xu H., Benedict W., Bouck N. Science. 1999. V. 285. №5425. P. 245-248). Помимо антиангиогенной функции PEDF оказывает нейропротекторное действие на нейроны головного и спинного мозга, а также на фоторецепторы сетчатки при воздействии различных повреждающих факторов, таких как ишемия, аксотомия, окислительный стресс и др. (Cao W., Tombran-Tink J., Chen W., Mrazek D., Elias R., McGinnis J.F. J. Neurosci. Res. 1999. V. 57. №6. 789-800; DeCoster M.A., Schabelman E., Tombran-Tink J., Bazan N.G. J. Neurosci. Res. 1999. V. 56. №6. 604-610; Houenou L.J., D'Costa A., Li L., Turgeon V.L., Enyadike C., Alberdi E., Becerra S. J. Com Neurol. 1999. V. 412. №3. 506-514; Bilak M.M., Corse A.M., Bilak S.R., Lehar M., Tombran-Tink J., Kuncl R.W. J. Neuropathol. Ex Neurol. 1999. V. 58. №7. 719-728). На уровне белковых взаимодействий существует несколько механизмов, с помощью которых PEDF блокирует действие VEGF. PEDF ингибирует патологический ангиогенез, подавляя фосфорилирование рецептора VEGFR-1, а также активируя γ-секретазу, которая расщепляет VEGFR-1 и VEGFR-2 (Cai J., Jiang W.G., Grant M.B., Boulton M. J. Biol. Chem. 2006. V. 281. №6. 3604-3613; Ablonczy Z., Prakasam A., Fant J., Fauq A., Crosson C, Sambamurti, K. J. Biol. Chem. 2009.V. 284. №44. 30177-30186). Также показано, что апоптоз эндотелиальных клеток, вызываемый PEDF, промотируется р38 MAP киназ-зависимым расщеплением каспаз 3, 8 и 9 (Chen L., Zhang S.S., Barnstable C.J., Tombran-Tink J. Biochem. Biophys. Res. Commun. 2006 V. 348. №4. 1288-1295). Кроме того, PEDF ингибирует активацию фактора NFAT (nuclear factor of activated T cells), необходимого для VEGF-индуцированного трубочкообразования и неоваскуляризации (Zaichuk Т.А., Shroff Е.Н., Emmanuel R., Filleur S., Nelius Т., Volpert O.V. J. Ex Med. 2004. V. 199, №11. 1513-1522). В настоящий момент PEDF проходит вторую фазу клинических испытаний в качестве препарата против возрастной макулярной дегенерации (Campochiaro A., Nguyen Q.D., Shah S.M., Klein М.l., Holz E., Frank R.N., Saperstein D.A., Gupta A, Stout J.T., Macko J., DiBartolomeo R., Wei L.L. Hum. Gene Ther. 2006. V. 17. №2. 167-176).
Совмещение в одной молекуле PEDF двух таких различных функций как нейропротекторная и антиангиогенная указывает на наличие двух отдельных функциональных эпитопов на поверхности молекулы. На основании трехмерной структуры комплекса PEDF/рецептор были выявлены несколько участков и проведено исследование их биологических эффектов (Filleur S., Volz K., Nelius Т., Mirochnik Y., Huang H., Zaichuk T.A., Aymerich M.S., Becerra S., Yap R., Veliceasa D., Shroff E.H., Volpert O.V. Cancer Res. 2005. V. 65. №12. P. 5144-5152). В результате установлено, что N-концевые фрагменты [36-46] и [44-77] обладают апоптотическим и антипролиферативным действием в отношении эндотелиальных клеток, способны блокировать их миграцию и патологическую неоваскуляризацию роговицы и сосудистой оболочки глаза. В то же время более дистальный фрагмент [78-121] лишен этих свойств, но при этом является индуктором нейрональной диффернцировки ретинобластомы (Alberdi Е., Aymerich M.S., Becerra S. J. Biol. Chem. 1999. V. 274. №44. 31605-31612). Примечательно, что короткий фрагмент в его составе [88-114] обладает как нейротрофной, так и антиангиогенной активностью.
Наиболее близкий к заявленному для патентования способу получения рекомбинантного фрагмента [44-77] фактора роста пигментного эпителия человека описан в публикации (Gong Q, Yang X, Cai W, Gao G, Yang Z. Protein J. 2010. V. 29. №3. P. 167-173). Для экспрессии в бактериальных клетках Escherichia coli был сконструирован рекомбинантный плазмидный вектор, кодирующий гибридный белок из N-концевой глутатион-S-трансферазы и С-концевого фрагмента [44-77] PEDF, разделенных сайтом протеолиза тромбином. Гибридный белок после разрушения клеточной биомассы отделялся в растворимой фракции и был очищен из клеточного супернатанта с помощью аффинной хроматографии. После расщепления гибридного белка тромбином целевой пептид очищали с помощью ультрафильтрации. Предложенная методика с выходом 10 мг пептида с 1 л культуральной среды предполагает использование дорогостоящего протеолитического фермента, в чем и заключается ее основной недостаток. Кроме того, в связи с небольшим размером и отсутствием организованной структуры полученный авторами фрагмент [44-77] PEDF заведомо обладает крайне низким временем полужизни в организме.
Изобретение решает задачу получения высокопродуктивного бактериального штамма-продуцента, позволяющего получать с высоким выходом и по упрощенной технологии рекомбинантный антиангиогенный пептид PGS, представляющий собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro, увеличивающей устойчивость пептидов к действию протеолитических ферментов, а, следовательно, стабильность in vivo (Walker J.R., Altman R.K., Warren J.W, Altman E. J. Peptide. Res. 2003. V. 62. P. 214-226).
Поставленная задача решается за счет того, что:
1. Конструируют экспрессионную плазмидную ДНК pERIG-PGS путем клонирования синтетического гена, кодирующего антиангиогенный пептид PGS, представляющий собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro, в плазмидный вектор pERIG;
2. Путем трансформации плазмидной ДНК pERIG-PGS клеток штамма Escherichia coli BL21(DE3) получают штамм-продуцент гибридного белка GyrA-PGS, состоящего из мини-интеина Мхе GyrA и антиангиогенного пептида PGS, накапливающегося во время культивирования в виде тел включения;
3. После разрушения клеточной биомассы в буферном растворе при рН 7.6-8.0 в присутствии ингибитора протеаз гибридный белок GyrA-PGS в виде тел включения отделяют центрифугированием. Солюбилизацию гибридного белка из тел включения проводят при рН 8 в буферном растворе, содержащем 4-8 М мочевину. Ренатурацию гибридного белка осуществляют путем разбавления полученного белкового раствора ренатурирующим буферным раствором с рН 7.6-8.0. Автокаталитическое расщепление индуцируют снижением рН до 6.0-6.8 и проводят в течение 16 часов при комнатной температуре. После окончании инкубации белковый раствор при рН 4.0 наносят на колонну с катионообменным сорбентом. В ходе элюции при рН 7.5 в линейном градиенте от 0 до 250 мМ NaCl собирают фракцию, содержащую пептид PGS. Дальнейшую очистку целевого продукта проводят с помощью обращенно-фазовой высокоэффективной жидкостной и гель-фильтрационной хроматографий. Идентичность полученного пептида PGS подтверждают с помощью масс-спектрометрии.
Технический результат
Техническим результатом изобретения является получение антиангиогенного пептида Пигастина, представляющего собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro, в результате автокаталитического расщепления интеин-содержащего гибридного белка.
Для получения антиангиогенного пептида PGS (SEQ ID NO 1) конструируют гибридный белок, содержащий на N-конце модифицированный мини-интеин GyrA из Mycobacterium xenopi, связанный с аффинной меткой, а на С-конце целевой пептид, и способный к контролируемому автокаталитическому расщеплению в интервале рН от 6.0 до 7.0. С этой целью используют рекомбинантную плазмидную ДНК pERIG, содержащую гибридный ген, состоящий из слитых в рамке нуклеотидных последовательностей хитин-связывающего домена, модифицированного мини-интеина Мхе GyrA и фрагмента MCS, содержащего уникальные сайты узнавания рестриктаз (Esipov R.S., Kostromina М.А. Comparative analysis of the effectiveness of C-terminal cleavage intein-based constructs in producing a recombinant analog of anophelin, an anticoagulant from Anopheles albimanus. Appl Biochem Biotechnol. 2015. V175 №52468-88). Для того чтобы получить экспрессионный вектор pERIG-PGS, химико-ферментативным синтезом получают нуклеотидную последовательность, кодирующую антиангиогенный пептид PGS (SEQ ID NO 2), и несущую на 5' и 3'-концах сайты узнавания рестриктаз SapI и BamHI и клонируют в плазмидный вектор pERIG по сайтам этих рестриктаз. Полученную в результате экспрессионную плазмидную ДНК pERIG-PGS, физическая карта которой представлена на Фиг. 1, трансформируют в штамм Е.coli BL21(DE3) (New England Biolabs, www.neb.com/products/c2527-bl21de3-competent-e-coli). Полученный штамм Е.coli BL21(DE3)/pERIG-PGS является продуцентом гибридного белка GyrA-PGS (SEQ ID NO 13), состоящего из мини-интеина Мхе GyrA с аффинной меткой и антиангиогенного пептида PGS и способного к контролируемому автокаталитическому расщеплению. Выделение антиангиогенного пептида PGS, представляющего собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro, включает выделение и расщепление гибридного белка и последующую хроматографическую очистку целевого продукта.
В предлагаемом техническом решении используют штамм-продуцент Е.coli BL21(DE3)/pERIG-PGS, содержащий плазмидную ДНК pERIG-PGS для суперпродукции гибридного белка GyrA-PGS, состоящего из N-концевого белка-носителя из модифицированного мини-интеина Мхе GyrA с аффинной меткой и С-концевого отщепляемого антиангиогенного пептида PGS, представляющего собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro.
Используют рекомбинантную плазмидную ДНК pERIG-PGS
- имеющую длину 6805 п.о.;
- кодирующую гибридный белок GyrA-PGS, содержащий N-концевой белок-носитель из мини-интеина Мхе GyrA с аффинной меткой и С-концевой антиангиогенный пептид PGS;
- состоящую из NdeI/BamHI-фрагмента ДНК плазмиды pERIG, содержащего участки инициации репликации плазмидного вектора (Ori) и фага М13 (М13 ori), ген репрессора лактозного оперона (lacI), промотор и терминатор транскрипции РНК-полимеразы бактериофага Т7, ген РНК-организующего белка (Rop), ген β-лактамазы (Ар), детерминирующий устойчивость трансформированных плазмидой pERIG-PGS клеток Е.coli к пенициллиновым антибиотикам, и NdeI/BamHI-фрагмента ДНК, содержащего гибридный ген CBDGyrA-PGS, состоящий из слитых в рамке 5'-концевой последовательности, кодирующей N-концевой белок-носитель из модифицированного мини-интеина Мхе GyrA, связанный с аффинной меткой, и 3'-концевой последовательности с оптимизированными для экспрессии в Е.coli кодонами, кодирующей С-концевой отщепляемый антиангиогенный пептид PGS, представляющий собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro;
- содержащая уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии от сайта BamHI: SeaI - 583 п.о., PvuI - 695 п.о., EcoRV - 3789 п.о., XbaI - 5820 п.о., NdeI - 5860 п.о.
С помощью сконстурированной рекомбинантной плазмидной ДНК pERIG-PEDF при культивировании штамма-продуцента достигается высокий уровень экспрессии гибридного гена CBDGyrA-PEDF, состоящего из 5'-концевой последовательности, кодирующей мини-интеина Мхе GyrA, связанный с хитин-связывающим доменом, и 3'-концевой последовательности, кодирующей антиангиогенный пептид PEDF. Для конструирования плазмидной ДНК используют химико-ферментативный подход, позволяющий использовать для экспрессии клонированного структурного гена оптимальные регуляторные элементы, контролирующие его экспрессию.
Штамм Е.coli BL21(DE3)/pERIG-PGS, продуцирующий гибридный полипептид GyrA-PGS, содержащий мини-интеин Мхе GyrA с аффинной меткой и антиангиогенный пептид PGS, получают путем трансформации клеток штамма Escherichia coli BL21(DE3) рекомбинантной плазмидной ДНК pERIG-PGS.
Предлагаемый штамм-продуцент Е.coli BL21(DE3)/pERIG-PGS характеризуется следующими признаками:
Морфологические признаки.
Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки.
Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или среде Лурье-Бертрана) образуют интенсивную ровную муть.
Физико-биологические признаки.
Клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы. Устойчивость к антибиотикам.
Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент Е.coli BL21(DE3)/pERIG-PGS отличается от штамма-реципиента Е.coli BL21(DE3) наличием рекомбинантной плазмидной ДНК pERIG-PGS, которая и придает ему устойчивость к пенициллиновым антибиотикам.
Генетические особенности штамма.
Генотип штамма - F- ompT gal dcm lon hsdSB(rB- mB-) λ(DE3 [lacI lacUV5-T7 gene 1 ind1 sam7 nin5]).
Осуществление изобретения
Плазмидный вектор pERIG-PGS получают следующим образом.
С помощью химико-ферментативного синтеза конструируют ген, кодирующий антиангиогенный пептид PGS, представляющий собой фрагмент [44-77] фактора роста пигментного эпителия человека с присоединенной к С-концу последовательностью Pro-Gly-Pro и содержащий на 5' и 3'-концах сайты узнавания рестриктаз SapI и BamHI.
Полученную нуклеотидную последовательность клонируют в плазмидный вектор pERIG по этим же сайтам. Полученную в результате экспрессионную плазмидную ДНК pERIG-PGS верифицируют посредством секвенирования.
Штамм-продуцент получают путем трансформации компетентных клеток Е.coli BL21(DE3) рекомбинантной плазмидной ДНК pERIG-PGS. Созданный штамм Е.coli BL21(DE3)/pERIG-PGS является суперпродуцентом гибридного белка GyrA-PGS, который накапливается в клетках в виде тел включения.
Культивирование штамма-продуцента проводят в богатой культуральной среде (среда Лурье-Бертрана) при 37°С. Индукцию белкового биосинтеза вызывают путем добавления в культуральную среду индуктора изопропилтио-β-D-галактозида (ИПТГ). Выращивание проводят до достижения наибольшего содержания гибридного белка относительного суммарного белка клетки (4 часа при 37°С после внесения ИПТГ).
Выделение антиангионного пептида PGS осуществляют в несколько этапов. Клеточную биомассу разрушают с помощью ультразвукового дезинтегратора в буферном растворе при рН 7.6-8.0 в присутствии ингибитора протеаз. Гибридный белок отделяют в виде тел включения путем центрифугирования суспензии клеточной биомассы и проводят солюбилизацию при рН 8 в буферном растворе, содержащем 4-8 М мочевину. Ренатурацию гибридного белка осуществляют путем разбавления полученного белкового раствора ренатурирующим буферным раствором с рН 7.6-8.0. Автокаталитическое расщепление индуцируют снижением рН до 6.0-6.8 и проводят в течение 16 часов при комнатной температуре. После окончании инкубации белковый раствор при рН 4.0 наносят на колонну с катионообменным сорбентом. В ходе элюции при рН 7.5 в линейном градиенте от 0 до 250 мМ NaCl собирают фракцию, содержащую пептид PGS. Дальнейшую очистку целевого продукта проводят с помощью обращенно-фазовой высокоэффективной жидкостной и гель-фильтрационной хроматографий. Идентичность полученного антиангиогенного пептида PGS подтверждают с помощью масс-спектрометрии.
Перечень последовательностей, представленных в описании изобретения.
На SEQ ID NO 1 приведена аминокислотная последовательность рекомбинантного антиангиогенного пептида PGS
На SEQ ID NO 2 приведена нуклеотидная последовательность гена, содержащего кодирующую антиангиогенный пептид PGS последовательность
Ha SEQ ID NO 3 - SEQ ID NO 11 приведены последовательности олинонуклеотидов, использованных при конструировании гена, кодирующего антиангиогенный пептид PGS
На SEQ ID NO 12 приведена нуклеотидная последовательность гибридного гена CBDGyrA-PGS и аминокислотная последовательность кодируемого им гибридного белка GyrA-PGS
На SEQ ID NO 13 приведена аминокислотная последовательность гибридного белка GyrA-PGS
Краткое описание фигур
Изобретение иллюстрируют следующие графические материалы:
На Фиг. 1 показана физическая карта рекомбинантной плазмиды pERIG-PGS. Указаны уникальные сайты эндокуклеаз рестрикции. Ori - участок инициации репликации плазмидного вектора, M13 ori - участок инициации репликации фага М13, AmpR - ген устойчивости к ампицилину, lacI - ген репрессора лактозного оперона, Rop - ген РНК-организующего белка, CBDGyrA-PGS- ген гибридного белка GyrA-PGS, состоящего из интеина Мхе GyrA с аффинной меткой и антиангиогенного пептида PGS
На Фиг. 2 представлена электрофореграмма накопления гибридного белка GyrA-PGS в ходе выращивания клеточной культуры штамма-продуцента Е.coli BL21(DE3)/pERIG-PGS. М - стандарт молекулярных масс; 1 - тотальный клеточный лизат после 2 часов выращивания после внесения ИПТГ; 2 - тотальный клеточный лизат после 3 часов выращивания после внесения ИПТГ; 3 - тотальный клеточный лизат после 4 часов выращивания после внесения ИПТГ; А - гибридный белок GyrA-PGS, содержащий антиангиогенный пептид PGS; Б - остаточный белок CBDGyrA
На Фиг. 3 представлена электрофореграмма выделения и протеолитического расщепления гибридного белка GyrA-PGS. М - стандарт молекулярных масс; 1 - тотальный клеточный лизат; 2 - осветленный клеточный супернатант; 3 - осадок тел включений; 4 - гибридный белок GyrA-PGS после ренатурации; 5 - продукты автокаталитического расщепления гибридного белка GyrA-PGS после инкубации в течение 16 часов при рН 6.5 и комнатной температуре
На Фиг. 4 показан хроматографический профиль анализа продуктов автокаталитического расщепления гибридного белка GyrA-PGS с помощью аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии
На Фиг. 5 показан результат масс-спектрометрического анализа рекомбинантного антиангиогенного пептида PGS
Изобретение иллюстрируют нижеследующие примеры.
Пример 1.
Конструирование рекомбинантной плазмиды pERIG-PGS
На основании известной аминокислотной последовательности фрагмента [44-77] фактора роста пигментного эпителия человека (SEQ ID NO 1) создана нуклеотидная последовательность, оптимизированная по кодонам для экспрессии в Е.coli. Помимо последовательности, кодирующей фрагмент [44-77] PGS, полученная нуклеотидная последовательность (SEQ ID NO 2) содержит на 3'-конце фрагмент, кодирующий трипептид Pro-Gly-Pro, увеличивающий стабильность пептида in vivo.
Проводят химико-ферментативный синтез гена PGS с использованием олигонуклеотидов PGS-1 - PGS-7, PGS-Forward и PGS-Reverse, приведенных в SEQ ID NO 3 - SEQ ID NO 11. Для этого проводят ферментативное фосфорилирование олигонуклеотидов с помощью полинуклеотидкиназы фага Т4 в соответствии с протоколом фирмы-производителя. После инкубации при 37°С в течение 1.5 часов реакционные смеси прогревают 5 мин при 70°С. Фосфорилированные и нефосфорилированные олигонуклеотиды смешивают в эквимолярном соотношении (по 600 пмоль), высаживают смесью 4М LiClO4 с ацетоном, перерастворяют в 20 мкл воды milliQ, прогревают при 95°С и медленном охлаждают до 25°С. Далее олигонуклеотиды лигируют с помощью ДНК-лигазы фага Т4 в соответствии с протоколом фирмы-производителя. После чего амплифицируют ДНК-фрагмент PGS с помощью ПЦР. В качестве матрицы используют лигазную смесь олигонуклеотидов, а в качестве праймеров - синтетические праймеры PGS-Forward и PGS-Reverse (SEQ ID NO 3, SEQ ID NO 11). В 50 мкл приготовленной реакционной смеси для ПЦР содержатся по 80 пмоль каждого праймера, 1х буферного раствора для Pfu ДНК-полимеразы, 1.25 ед. Pfu ДНК-полимеразы, 2 мкл лигазной смеси олигонуклеотидов, 0.2 мМ dNTP. Полимеразную цепную реакцию проводят в ДНК-амплификаторе по следующей программе: 1) денатурация 2 мин при 92°С; 2) денатурация 30 сек при 92°С, отжиг 30 сек при 58°С, элонгация 1 мин при 72°С (5 циклов); 3) денатурация 30 сек при 92°С, отжиг 1 мин при 60°С, элонгация 30 сек при 72°С (25 циклов); 4) элонгация 5 мин при 72°С.
Для получения экспрессионного вектора pERIG-PGS ПЦР-фрагмент (2 мкг), содержащий последовательность PGS, и вектор pERIG (1 мкг), последовательно обрабатывают эндонуклеазами рестрикции SapI и BamHI в соответствии с протоколом фирмы-производителя. По окончании инкубации при 37°С реакционную смесь анализируют с помощью электрофореза в 1- и 2%-ном агарозном геле. Полученные ДНК фрагменты выделяют из агарозного геля и лигируют в соотношении 3:1 с помощью ДНК-лигазы фага Т4 в соответствии с протоколом фирмы-производителя. Реакционную смесь инкубируют в течение 16 часов при 4°С, после чего прогревают 5 мин при 70°С для ингибирования ДНК-лигазы фага Т4. 10 мкл полученной лигазной смеси трансформируют в клетки штамма E.coli ER2566. Колонии, полученные при высевании трансформированных клеток на агаризованную среду LB с добавлением 100 мкг/мл ампициллина, переносят в культуральные пробирки с 5 мл среды LB с добавлением 100 мкг/мл ампициллина и выращивают 8 часов при 37°С на термостатируемом шейкере. После чего добавляют ИПТГ до конечной концентрации 0.4 мМ, выращивают в течение 3 часов при 37°С и центрифугируют по 1 мл. Отбор рекомбинантов осуществляют по результатам белкового электрофореза в денатурирующих условиях по наличию белковой полосы, соответствующей по размеру гибридному белку GyrA-PGS (SEQ ID NO 13), а также с помощью ПЦР с праймерами Т7 Universal Primer и PGS-Reverse. Правильность последовательности полученной рекомбинантной плазмидной ДНК pERIG-PGS верифицируют с помощью секвенирования.
Физическая карта плазмиды pERIG-PGS представлена на Фиг. 1. Ori - участок инициации репликации плазмидного вектора, Ml3 ori - участок инициации репликации фага М13, AmpR - ген устойчивости к ампицилину, lacI - ген репрессора лактозного оперона, Rop - ген РНК-организующего белка, CBDGyrA-PGS- ген, кодирующий гибридный белок GyrA-PGS, состоящий из интеина Мхе GyrA с аффинной меткой и антиангиогенного пептида PGS.
Пример 2.
Получение штамма-продуцента Е.coli BL21(DE3)/pERIG-PGS и определение его продуктивности
Штамм-продуцент Е.coli BL21(DE3)/pERIG-PGS получают трансформацией компетентных клеток Е.coli BL21(DE3) с генотипом [F- ompT hsdSB (r-m-) gal dcm (DE3)] рекомбинантной плазмидой pERIG-PGS, создание которой описано в примере 1. Клетки штамма Е.coli BL21(DE3)/pERIG-PGS являются продуцентом гибридного белка GyrA-PGS, состоящего из интеина Мхе GyrA с аффинной меткой и антиангиогенного пептида PGS. (SEQ ID NO 12, SEQ ID NO 13).
Трансформированные клетки высевают на агаризованную среду LB, содержащую ампициллин (100 мкг/мл), и выращивают в течении 14 часов при 37°С для получения отдельных колоний. После чего несколько колоний переносят в 100 мл среды LB, содержащую 2% глюкозу и ампициллином (100 мкг/мл), и выращивают 10 ч при 37°С на шейкере при перемешивании со скоростью 180 об/мин для получения культуры с ОД600=3.5. Полученной ночной культурой (процент засева составляет 2%) засевают требуемый объем среды LB, содержащую 0.2% глюкозу и ампициллин (100 мкг/мл), и выращивают при 37°С при перемешивании со скоростью 200 об/мин. При плотности клеточной культуры ОД600=0.8 вносят ИПТГ до концентрации 0.4 мМ и выращивают при 37°С в течение 4 часов. Каждый час после добавления ИПТГ отбирают аликвоты для последующего электрофоретического анализа. На Фиг. 2 представлена электрофореграмма накопления гибридного белка GyrA-PGS в ходе выращивания клеточной культуры штамма-продуцента Е.coli BL21(DE3)/pERIG-PGS. М - стандарт молекулярных масс; 1 - тотальный клеточный лизат после 2 часов выращивания после внесения ИПТГ; 2 - тотальный клеточный лизат после 3 часов выращивания после внесения ИПТГ; 3 - тотальный клеточный лизат после 4 часов выращивания после внесения ИПТГ; А - гибридный белок GyrA-PGS, содержащий антиангиогенный пептид PGS
Пример 3.
Получение гибридного белка GyrA-PGS, его автокаталитическое расщепление и выделение рекомбинантного PGS
По окончании культивирования, описанного в примере 2, клеточную биомассу штамма Е.coli BL21(DE3)/pERIG-PGS отделяют центрифугированием в течение 30 мин при 10°С и 7500 об/мин. Разрушение клеточной биомассы проводят в буферном растворе при рН 7.6-8.0 в присутствии ингибитора протеаз с помощью УЗ-дезинтегратора при 10°С. Осадок тел включения отделяют центрифугированием в течение 60 мин при 10°С и 7500 об/мин. Полученный осадок тел включения дважды промывают в буферном растворе с рН 7.6. Солюбилизацию гибридного белка GyrA-PGS из отмытых тел включения осуществляют в буферном растворе с рН 8, содержащем 8М мочевину. После центрифугирования (30 мин при 15°С и 9000 об/мин) полученный белковый раствор разбавляют в буферном растворе с рН 8.0, титруют до рН 6.5 и инкубируют в течение 16 часов при 23°С.
После окончания инкубации белковый раствор титруют до рН 4.0 и наносят на хроматографическую колонку, содержащую катионообменный сорбент Macro-Prep High S (Bio-Rad). Элюцию целевого пептида PGS проводят при 7.5 в линейном градиенте от 0 до 250 мМ NaCl. Последующую очистку пептида PGS осуществляют с помощью ОФ ВЭЖХ на хроматографической колонне PerfectSil300 С18 (MZ-Analysentechnik GmbH) в линейном градиенте от 0 до 28% ацетонитрила (0.1% ТФУ). Окончательную очистку рекомбинантного PGS осуществляют с помощью гель-фильтрационной хроматографии на колонне, содержащей сорбент Bio-Gel Р-2 Gel (Bio-Rad) в буферном растворе 5 мМ уксусной кислоты. Полученный пептид PGS лиофильно высушивают.
Идентификацию образующегося рекомбинантного антиангиогенного пептида PGS проводят с помощью масс-спектрометрического анализа. Молекулярная масса продукта составляет 4044.00 Да, что соответствует теоретически рассчитанному значению 4043.59 Да.
На Фиг. 3 представлена электрофореграмма выделения и протеолитического расщепления гибридного белка GyrA-PGS. М - стандарт молекулярных масс; 1 - тотальный клеточный лизат; 2 - осветленный клеточный супернатант; 3 - осадок тел включений; 4 - гибридный белок GyrA-PGS после ренатурации; 5 - продукты автокаталитического расщепления гибридного белка GyrA-PGS после инкубации в течение 48 часов при рН 6.5 и 23°С; А - гибридный белок GyrA-PGS, содержащий антиангиогенный пептид PGS; Б - остаточный белок CBDGyrA
На Фиг. 4 показан профиль анализа продуктов автокаталитического расщепления гибридного белка GyrA-PGS с помощью аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии; 1 - антиангиогенный пептид PGS; 2 -остаточный белок CBDGyrA
На Фиг. 5 показан результат масс-спектрометрического анализа рекомбинантного антиангиогенного пептида PGS
Пример 4.
Оценка антиангиогенной активности рекомбинантного пептида Пигастина in vitro Для подтверждения антиангиогенной активности Пигастина проводят стандартный комплекс тестов, позволяющий оценить действие на ранних этапах ангиогенеза (пролиферация эндотелиальных клеток и образование капилляроподобных структур).
Антиантиогенные свойства Пигастина изучают в диапазоне концентраций от 0.1 нМ до 20 нМ (Мирошников А.И., Лихванцева В.Г., Степанова Е.В., Арутюнян Е.В., Осипов Р.А., Бейрахова К.А., Степаненко В.Н., Белоус О.В. Офтальмохирургия. 2011. №1. Р. 76-82). В работе используют иммортализованную культуру эндотелиальных клеток мыши SVEC-4-10 (O'Connel K., Edidin М. 1990. V. 144. №2. Р. 521-525).
С помощью стандартного МТТ-теста по выживаемости эндотелиальных клеток мыши SVEC4-10 оценивают цитотоксичность пептида PGS. К эндотелиальным клеткам (6×104 в мл) после 24-ти часовой инкубации в среде DMEM, содержащей 0.1% эмбриональной сыворотки и 2 мМ глутамина, добавляют рекомбинантный пептид PGS в концентрациях от 0.1 до 20 нМ и инкубируют 2 дня. После чего вносят МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид) в конечной концентрации 0.5 мг/мл и инкубируют 4 часа. По окончании инкубации среду сливают, клетки растворяют в ДМСО. Оптическую плотность оценивают с помощью планшетного спектрофотометра при длине волны 540 нм. Выживаемость клеток в присутствии исследуемого пептида PGS носит дозозависимый характер и составляет 84±3% при концентрации 20 нМ и достигает 93±3% при концентрации 1-0,1 нМ.
С помощью модифицированного митогенного теста исследуют ингибирование bFGF-стимулированной пролиферации иммортализованной культуры эндотелиальных клеток мыши SVEC-4-10. К эндотелиальным клеткам (15×103 в мл) после 24-ти часовой инкубации в среде DMEM, содержащей 0.1% эмбриональной сыворотки, 2 мМ глутамина и 20 нг/мл основного фактора роста фибробластов (bFGF), добавляют рекомбинантный пептид PGS в концентрациях от 0.1 до 20 нМ и инкубируют в течение 6 дней (среду и исследуемый пептид меняют каждые 3 дня), после чего клетки окрашивают красителем Crystal Violet. Оптическую плотность оценивают с помощью планшетного спектрофотометра при длине волны 540 нм. Максимальное ингибирование (ИК50) пролиферации клеток наблюдается при концентрации пептида 1 нМ (47% от контроля). При более высоких концентрациях пептида антипролиферативный эффект менее выражен.
Для определения ингибирующего действия пептида PGS на образование трубочко-подобных структур эндотелиальные клетки (4×105 в мл) инкубируют вместе с исследуемым пептидом PGS в нецитотоксичных концентрациях 0.1 и 10 нМ в среде DMEM, содержащей 0.1% эмбриональной сыворотки, 2 мМ глутамина, в течение 20 минут при 37°С. Аликвоту клеток (500 мкл) вносят в лунки, покрытые Матригелем и инкубируют в СО2-инкубаторе в течение 4-5 часов. Оценивают длину трубочек и количество контактов между трубочками. Пептид PGS при концентрациях 0.1 и 10 нМ вызывает 50 и 40% ингибирование образования трубочко-подобных структур, соответственно, в течение 24 часов после инкубации.
Перечень последовательностей, представленных в описании изобретения

Аминокислотная последовательность антиангиогенного пептида PGS

Нуклеотидная последовательность сконструированного гена, содержащая кодирующую антиангиогенный пептид PGS последовательность (выделена прописными буквами) Подчеркиванием обозначены сайты узнавания рестриктаз SapI и BamHI.

Олигонуклеотидные праймеры, использующиеся для конструирования гена PGS. Подчеркиванием обозначены сайты узнавания рестриктаз SapI и BamHI, жирным шрифтом выделен стоп-кодон

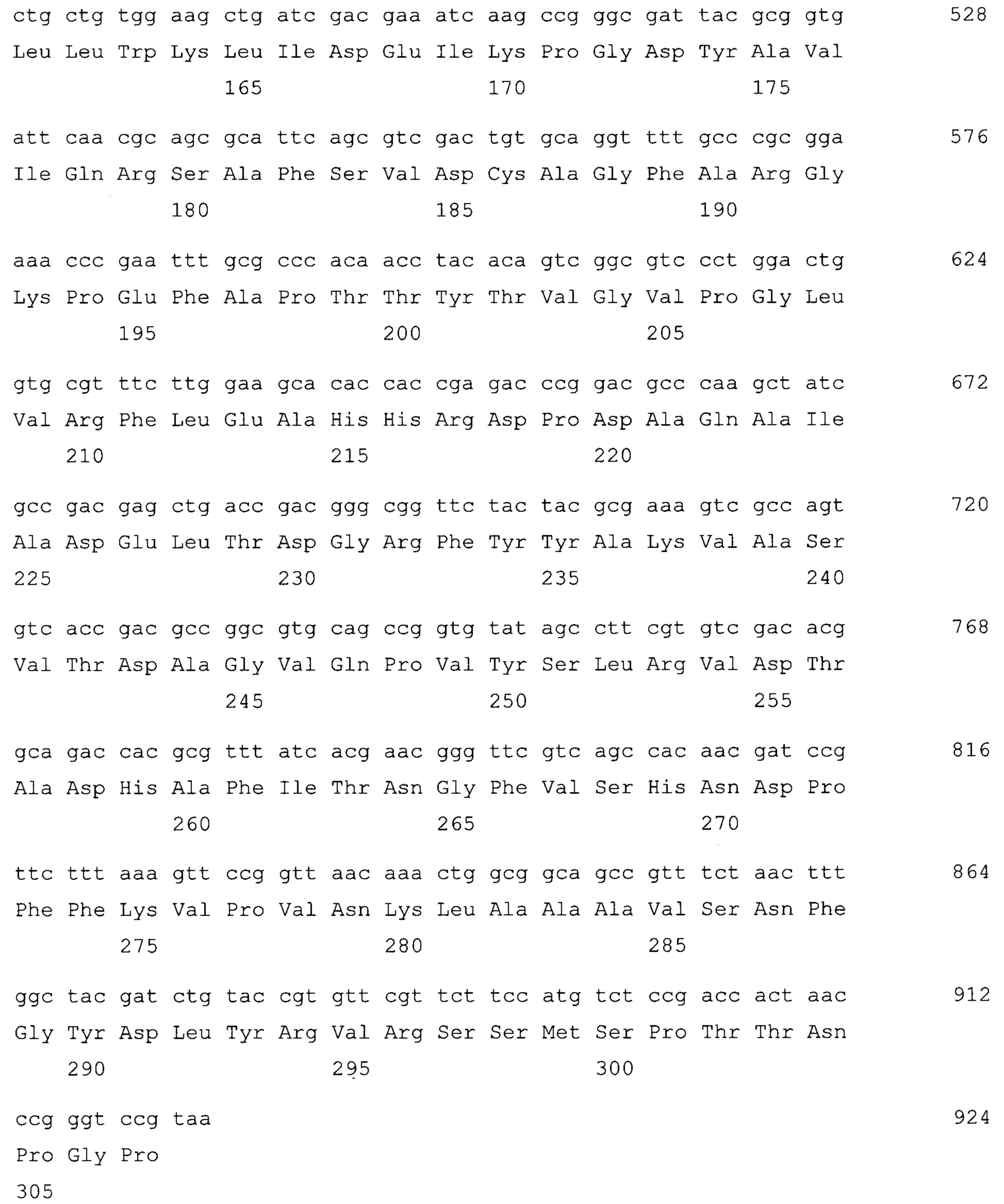
Нуклеотидная последовательность гибридного гена CBDGyrA-PGS и аминокислотная последовательность кодируемого им гибридного белка GyrA-PGS



Аминокислотная последовательность гибридного белка GyrA-PGS
Перечень последовательностей
<110> Патентообладатель (ли) Федеральное государственное
бюджетное учреждение науки Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук (ИБХ РАН)
<120> РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pERIG-PGS, КОДИРУЮЩАЯ
ГИБРИДНЫЙ БЕЛОК, СПОСОБНЫЙ К АВТОКАТАЛИТИЧЕСКОМУ
РАСЩЕПЛЕНИЮ С ОБРАЗОВАНИЕМ АНТИАНГИОГЕННОГО ПЕПТИДА
ПИГАСТИНА - ПРОИЗВОДНОГО ФРАГМЕНТА [44-77] ФАКТОРА РОСТА
ПИГМЕНТНОГО ЭПИТЕЛИЯ ЧЕЛОВЕКА, ШТАММ Escherichia coli
BL21(DE3)/pERIG-PGS - ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА, И
СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИАНГИОГЕННОГО
ПЕПТИДА
<130> Пигастин патент
<160> 13
<170> PatentIn version 3.5
<210> 1
<211> 37
<212> PRT
<213> Artificial Sequence
<220>
<223> PGS, Пигастин, Фрагмент [44-77] фактора роста пигментного
эпителия человека c присоединенной к С-концу
последовательностью Pro-Gly-Pro
<220>
<221> mat_peptide
<222> (1)..(37)
<400> 1
Asp Pro Phe Phe Lys Val Pro Val Asn Lys Leu Ala Ala Ala Val Ser
1 5 10 15
Asn Phe Gly Tyr Asp Leu Tyr Arg Val Arg Ser Ser Met Ser Pro Thr
20 25 30
Thr Asn Pro Gly Pro
35
<210> 2
<211> 163
<212> DNA
<213> Artificial Sequence
<220>
<223> Ген, кодирующий PGS, Пигастин, Фрагмент [44-77] фактора
роста пигментного эпителия человека c присоединенной к
С-концу последовательностью Pro-Gly-Pro
<220>
<221> gene
<222> (18)..(148)
<400> 2
10 20 30 40 50
GGTGGTGCTC TTCCAACGAT CCGTTCTTTA AAGTTCCGGT TAACAAACTG 50
60 70 80 90 100
GCGGCAGCCG TTTCTAACTT TGGCTACGAT CTGTACCGTG TTCGTTCTTC 100
110 120 130 140 150
CATGTCTCCG ACCACTAACC CGGGTCCGTA ACCACTAACC CGGGTCCGTA 150
160
AGGATCCACC ACC 163
<210> 3
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотидный праймер PGS-Forward
<400> 3
ggtggttgct cttcaacgat ccgttc 26
<210> 4
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-1
<400> 4
tttaaagttc cggttaacaa actggcggca g 31
<210> 5
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-2
<400> 5
ccgtttctaa ctttggctac gatctgtacc gtgttc 36
<210> 6
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-3
<400> 6
gttcttccat gtctccgacc actaacccgg gtcc 34
<210> 7
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-4
<400> 7
ggtggtggat ccttacggac ccgggttagt g 31
<210> 8
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-5
<400> 8
gtcggagaca tggaagaacg aacacggtac agatcg 36
<210> 9
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-6
<400> 9
tagccaaagt tagaaacggc tgccgccagt ttg 33
<210> 10
<211> 31
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотид PGS-7
<400> 10
ttaaccggaa ctttaaagaa cggatcgttg g 31
<210> 11
<211> 29
<212> DNA
<213> Artificial Sequence
<220>
<223> Олигонуклеотидный праймер PGS-Reverse
<400> 11
ggtggtggat ccttacggac ccgggttag 29
<210> 12
<211> 792
<212> DNA
<213> Artificial Sequence
<220>
<223> Гибридный ген CBDGyrA-PGS, кодирующий гибридный белок
GyrA-PGS
<220>
<221> CDS
<222> (1)..(924)
<400> 12
atg aaa atc gaa gaa ggt aaa ctg aca aat cct ggt gta tcc gct tgg 48
Met Lys Ile Glu Glu Gly Lys Leu Thr Asn Pro Gly Val Ser Ala Trp
1 5 10 15
cag gtc aac aca gct tat act gcg gga caa ttg gtc aca tat aac ggc 96
Gln Val Asn Thr Ala Tyr Thr Ala Gly Gln Leu Val Thr Tyr Asn Gly
20 25 30
aag acg tat aaa tgt ttg cag ccc cac acc tcc ttg gca gga tgg gaa 144
Lys Thr Tyr Lys Cys Leu Gln Pro His Thr Ser Leu Ala Gly Trp Glu
35 40 45
cca tcc aac gtt cct gcc ttg tgg cag ctt caa aac aac ggt aac aac 192
Pro Ser Asn Val Pro Ala Leu Trp Gln Leu Gln Asn Asn Gly Asn Asn
50 55 60
ggt ctc gaa ctg cgc gag tcc gga gct atc acg gga gat gca cta gtt 240
Gly Leu Glu Leu Arg Glu Ser Gly Ala Ile Thr Gly Asp Ala Leu Val
65 70 75 80
gcc cta ccc gag ggc gag tcg gta cgc atc gcc gac atc gtg ccg ggt 288
Ala Leu Pro Glu Gly Glu Ser Val Arg Ile Ala Asp Ile Val Pro Gly
85 90 95
gcg cgg ccc aac agt gac aac gcc atc gac ctg aaa gtc ctt gac cgg 336
Ala Arg Pro Asn Ser Asp Asn Ala Ile Asp Leu Lys Val Leu Asp Arg
100 105 110
cat ggc aat ccc gtg ctc gcc gac cgg ctg ttc cac tcc ggc gag cat 384
His Gly Asn Pro Val Leu Ala Asp Arg Leu Phe His Ser Gly Glu His
115 120 125
ccg gtg tac acg gtg cgt acg gtc gaa ggt ctg cgt gtg acg ggc acc 432
Pro Val Tyr Thr Val Arg Thr Val Glu Gly Leu Arg Val Thr Gly Thr
130 135 140
gcg aac cac ccg ttg ttg tgt ttg gtc gac gtc gcc ggg gtg ccg acc 480
Ala Asn His Pro Leu Leu Cys Leu Val Asp Val Ala Gly Val Pro Thr
145 150 155 160
ctg ctg tgg aag ctg atc gac gaa atc aag ccg ggc gat tac gcg gtg 528
Leu Leu Trp Lys Leu Ile Asp Glu Ile Lys Pro Gly Asp Tyr Ala Val
165 170 175
att caa cgc agc gca ttc agc gtc gac tgt gca ggt ttt gcc cgc gga 576
Ile Gln Arg Ser Ala Phe Ser Val Asp Cys Ala Gly Phe Ala Arg Gly
180 185 190
aaa ccc gaa ttt gcg ccc aca acc tac aca gtc ggc gtc cct gga ctg 624
Lys Pro Glu Phe Ala Pro Thr Thr Tyr Thr Val Gly Val Pro Gly Leu
195 200 205
gtg cgt ttc ttg gaa gca cac cac cga gac ccg gac gcc caa gct atc 672
Val Arg Phe Leu Glu Ala His His Arg Asp Pro Asp Ala Gln Ala Ile
210 215 220
gcc gac gag ctg acc gac ggg cgg ttc tac tac gcg aaa gtc gcc agt 720
Ala Asp Glu Leu Thr Asp Gly Arg Phe Tyr Tyr Ala Lys Val Ala Ser
225 230 235 240
gtc acc gac gcc ggc gtg cag ccg gtg tat agc ctt cgt gtc gac acg 768
Val Thr Asp Ala Gly Val Gln Pro Val Tyr Ser Leu Arg Val Asp Thr
245 250 255
gca gac cac gcg ttt atc acg aac ggg ttc gtc agc cac aac gat ccg 816
Ala Asp His Ala Phe Ile Thr Asn Gly Phe Val Ser His Asn Asp Pro
260 265 270
ttc ttt aaa gtt ccg gtt aac aaa ctg gcg gca gcc gtt tct aac ttt 864
Phe Phe Lys Val Pro Val Asn Lys Leu Ala Ala Ala Val Ser Asn Phe
275 280 285
ggc tac gat ctg tac cgt gtt cgt tct tcc atg tct ccg acc act aac 912
Gly Tyr Asp Leu Tyr Arg Val Arg Ser Ser Met Ser Pro Thr Thr Asn
290 295 300
ccg ggt ccg taa 924
Pro Gly Pro
305
<210> 13
<211> 307
<212> PRT
<213> Artificial Sequence
<220>
<223> Гибридный белок GyrA-PGS
<400> 13
Met Lys Ile Glu Glu Gly Lys Leu Thr Asn Pro Gly Val Ser Ala Trp
1 5 10 15
Gln Val Asn Thr Ala Tyr Thr Ala Gly Gln Leu Val Thr Tyr Asn Gly
20 25 30
Lys Thr Tyr Lys Cys Leu Gln Pro His Thr Ser Leu Ala Gly Trp Glu
35 40 45
Pro Ser Asn Val Pro Ala Leu Trp Gln Leu Gln Asn Asn Gly Asn Asn
50 55 60
Gly Leu Glu Leu Arg Glu Ser Gly Ala Ile Thr Gly Asp Ala Leu Val
65 70 75 80
Ala Leu Pro Glu Gly Glu Ser Val Arg Ile Ala Asp Ile Val Pro Gly
85 90 95
Ala Arg Pro Asn Ser Asp Asn Ala Ile Asp Leu Lys Val Leu Asp Arg
100 105 110
His Gly Asn Pro Val Leu Ala Asp Arg Leu Phe His Ser Gly Glu His
115 120 125
Pro Val Tyr Thr Val Arg Thr Val Glu Gly Leu Arg Val Thr Gly Thr
130 135 140
Ala Asn His Pro Leu Leu Cys Leu Val Asp Val Ala Gly Val Pro Thr
145 150 155 160
Leu Leu Trp Lys Leu Ile Asp Glu Ile Lys Pro Gly Asp Tyr Ala Val
165 170 175
Ile Gln Arg Ser Ala Phe Ser Val Asp Cys Ala Gly Phe Ala Arg Gly
180 185 190
Lys Pro Glu Phe Ala Pro Thr Thr Tyr Thr Val Gly Val Pro Gly Leu
195 200 205
Val Arg Phe Leu Glu Ala His His Arg Asp Pro Asp Ala Gln Ala Ile
210 215 220
Ala Asp Glu Leu Thr Asp Gly Arg Phe Tyr Tyr Ala Lys Val Ala Ser
225 230 235 240
Val Thr Asp Ala Gly Val Gln Pro Val Tyr Ser Leu Arg Val Asp Thr
245 250 255
Ala Asp His Ala Phe Ile Thr Asn Gly Phe Val Ser His Asn Asp Pro
260 265 270
Phe Phe Lys Val Pro Val Asn Lys Leu Ala Ala Ala Val Ser Asn Phe
275 280 285
Gly Tyr Asp Leu Tyr Arg Val Arg Ser Ser Met Ser Pro Thr Thr Asn
290 295 300
Pro Gly Pro
305
![Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида](https://fips.edrid.ru/images/rid/84/0c/2e/5c11d1059ae36e315c1a541053bb5192.jpg)
![Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида](https://fips.edrid.ru/images/rid/84/0c/2e/acfab22bcd9932072cb2bdcdfb2f90f2.jpg)

