Результат интеллектуальной деятельности: КОМБИНАЦИЯ АНАЛОГОВ СОМАТОСТАТИНА С ИНГИБИТОРАМИ 11β- ГИДРОКСИЛАЗЫ
Вид РИД
Изобретение
Настоящее изобретение относится к комбинации, которая включает (а) аналог соматостатина и (b) ингибитор 11β-гидроксилазы; каждый из которых находится в свободной форме или в форме фармацевтически приемлемой соли; к применению такой комбинации для получения лекарственного средства для лечения заболеваний, связанных с повышенным уровнем гормонов стресса; к продажной упаковке или продукту, включающему такую комбинацию; и к способу лечения теплокровных животных, в частности, человека.
Уровень техники, к которой относится изобретение
Класс соматостатинов известен как класс маленьких пептидов, включающих соматостатин-14 естественного происхождения и аналоги, имеющие близкую к соматостатину активность, например, как описал A.S. Dutta в Small Peptides, Vol. 19, Elsevier (1993). Под «аналогом соматостатина», как применяют здесь, имеют в виду любой полипептид с прямой цепью или циклический полипептид, имеющий структуру, основанную на структуре природного соматостатина-14, где одна аминокислотная единица или более удалена и/или замещена на одну аминогруппу или более, и/или где одна функциональная группа или более замещена одной другой или несколькими функциональными группами, и/или одна группа или более замещена одной или несколькими другими изостерическими группами. В целом, термин включает все модифицированные производные природного соматостатина-14, которые обладают близкой к соматостатину активностью, например, они связываются с по меньшей мере одним из пяти рецепторов соматостатина (SSTR), предпочтительно в наномолярном диапазоне. Хорошо известными аналогами соматостатина являются октреотид, вапреотид, ланреотид, паcиреотид.
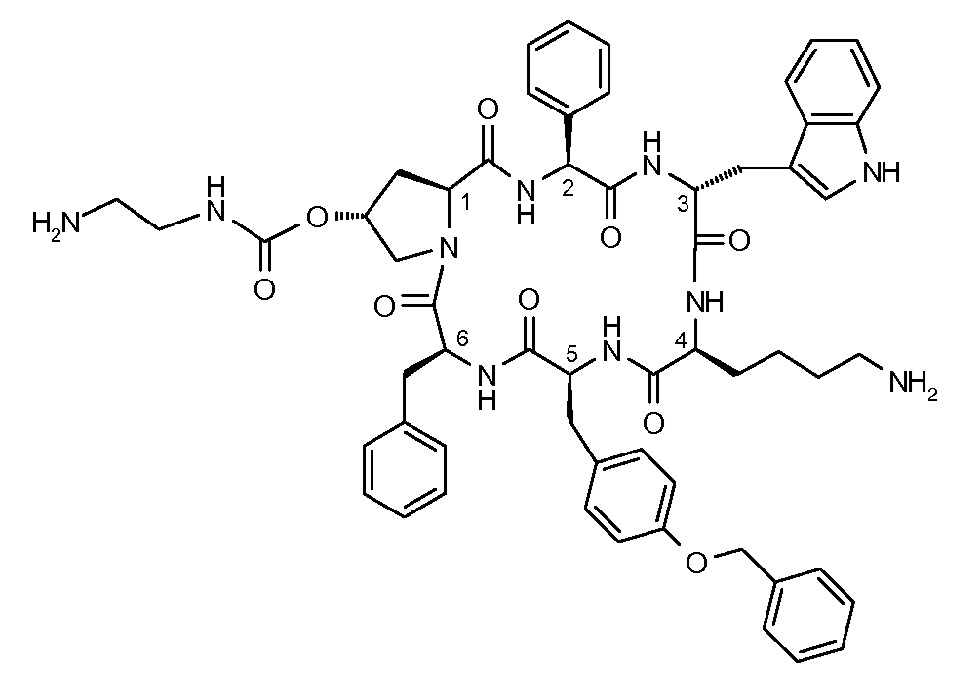
Пасиреотид имеет химическую структуру, как показано ниже:
 .
.
Пасиреотидом называют цикло[{4-(NH2-C2H4-NH-CO-O-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe], в котором Phg означает -HN-CH(C6H5)-CO- и Bzl означает бензил, в свободной форме, в форме соли, в форме комплекса или в защищенной форме.
Синдром Кушинга представляет собой гормональное расстройство, вызываемое высокими уровнями кортизола в крови. Это может быть вызвано приемом глюкокортикоидов или опухолями, которые продуцируют кортизол или адренокортикотропный гормон (ACTH, АКТГ) или кортиколиберин (CRH). Болезнь Кушинга предполагает одну конкретную причину развития синдрома: опухоль (аденома) гипофиза, которая продуцирует большое количество АКТГ, который вызывает подъем уровня кортизола. Это является наиболее распространенной причиной синдрома Кушинга, ответственной за 70% случаев за исключением случаев, связанных с глюкокортикоидами. Значительное снижение уровней кортизола у пациентов с болезнью Кушинга на пасиреотиде поддерживает его потенциальное применение в качестве целенаправленного лечения болезни Кушинга (Colao с соавт. Т Engl J Med 2012; 366: 32-42).
Соединение А представляет собой эффективный ингибитор фермента, ограничивающего скорость 11-β-гидроксилазы, последней стадии синтеза кортизола. WO 2011/088188 предлагает возможное применение соединения А в лечении заболевания или расстройства, характеризующегося повышенными уровнями гормонов стресса и/или сниженными уровнями андрогенов, включая возможное применение соединения А в лечении сердечной недостаточности, кахексии, острого коронарного синдрома, синдрома хронического стресса, синдрома Кушинга или метаболического синдрома.
Соединение А, также называемое (R)-4-(6,7-дигидро-5Н-пирроло[1,2-c]имидазол-5-ил)-3-фторбензонитрил, имеет формулу (II)
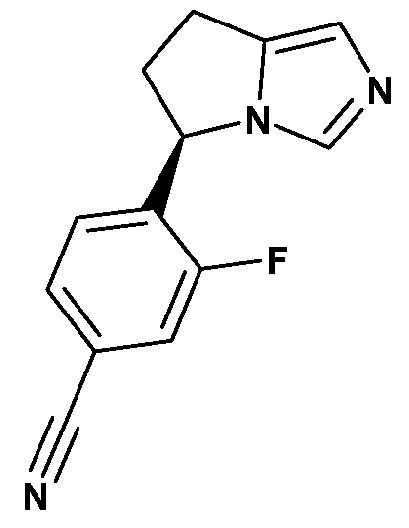 .
.
Соединение А можно синтезировать или производить и анализировать при помощи методов, описанных в WO 2007/024945.
Сущность изобретения
Настоящее изобретение является в том числе основанным на данных 10-недельного клинического исследования для подтверждения концепции, демонстрирующего эффективность соединения А с удовлетворительным профилем безопасности у пациентов с болезнью Кушинга. Соединение А значительно снижает свободный кортизол мочи (UFC) у всех пациентов, для большинства пациентов до нормального диапазона UFC. Тем не менее, для некоторых пациентов исследования уровень UFC возвращается к превышающему верхнюю границу нормы (ULN) через две недели после прекращения приема лекарства. Более того, уровень АКТГ становится вдвое выше у половины пациентов. Таким образом, целью настоящего изобретения является поддержание и улучшение влияния соединения А, в частности, на снижение уровня кортизола в целом, и в частности, на эффективность соединения А в лечении или улучшении течения заболевания или расстройства, характеризующегося повышением уровней гормонов стресса, в частности, повышением уровня кортизола, включая потенциальное применение соединения А в лечении сердечной недостаточности, кахексии, острого коронарного синдрома, синдрома хронического стресса, синдрома Кушинга или метаболического синдрома.
Таким образом, первый аспект настоящего изобретения предоставляет комбинацию (будет называться комбинацией изобретения в рамках этой заявки) (a) соединения А (R)-4-(6,7-дигидро-5Н-пирроло[1,2-c]имидазол-5-ил)-3-фторбензонитрила; и (b) аналога соматостатина, где (а) и (b) присутствуют в каждом случае в свободной форме, в форме комплекса или в форме фармацевтически приемлемой соли.
В одном предпочтительном варианте осуществления аналогом соматостатина является октреотид, вапреотид, ланреотид или пасиреотид. В одном предпочтительном варианте осуществления аналогом соматостатина является пасиреотид или любая из его фармацевтически приемлемых солей. Предпочтительными солями являются лактат, аспартат, бензоат, сукцинат и памоат, включая моно- и дисоли, более предпочтительно дисоль аспартат и моносоль памоат. Конкретные соли пасиреотида образуют гель в водной среде, такие как соль аспартата, например, моно- или диаспартат, глутамат, например, моно- или диглутамат, или сукцинат, например, моно- или дисукцинат, лактат, ацетат или цитрат. В одном предпочтительном варианте изобретения фармацевтически приемлемой солью пасиреотида является соль памоат.
Предпочтительной солью соединения А является фосфатная или азотная соль. Более предпочтительно ею является дигидрогенфосфат. Термин “фосфатная соль”, как применяют в настоящей заявке, относится к кислотно-аддитивной соли соединения А с фосфорной кислотой. Более конкретно, он относится к дигидрогенфосфату однократно протонированного соединения А, иначе говоря, соединение А однократно протонировано и, таким образом, каждая молекула несет единичный положительный заряд, в то время как противоион представляет собой H2PO4-.
Удивительно то, что такая комбинация поддерживает кортизол-снижающий эффект соединения А. Более того, аналог соматостатина и соединение А потенциируют эффект друг друга, что приводит к большей эффективности, снижению необходимой эффективной дозы.
Настоящее изобретение также относится к комбинации для одновременного, раздельного или последовательного применения, такой как фиксированная комбинация, включая нефиксированную комбинацию или фармацевтическую фиксированную комбинацию. Фиксированная комбинация относится к обоим активным ингредиентам, присутствующим в одной лекарственной форме, например, в одной таблетке или в одной капсуле. Таким образом, фармацевтическая фиксированная комбинация настоящего изобретения включает (а) аналог соматостатина и (b) соединение А, в котором в каждом случае присутствуют (а) и (b) в свободной форме, в форме комплекса или в форме фармацевтически приемлемой соли, и необязательно по меньшей мере один фармацевтически приемлемый носитель. Предпочтительно аналогом соматостатина является пасиреотид.
Фармацевтически приемлемый носитель включает любые растворители, дисперсионные среды, покрытия, сурфактанты, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства), изотонические средства, средства, замедляющие абсорбцию, соли, консерванты, лекарства, стабилизаторы лекарств, связывающие вещества, эксципиенты, дезинтегрирующие средства, лубриканты, подсластители, ароматизирующие вещества, красители, им подобные материалы и комбинации вышеупомянутых веществ, как известно среднему специалисту в данной области техники.
Термин “нефиксированная комбинация”, как применяется здесь, определяет, что сочетание ингредиентов (а) и (b), как определено здесь, можно дозировать независимо друг от друга с различными количествами сочетаемых ингредиентов (а) и (b), т.е. одновременно или в разные периоды времени. Термин “нефиксированная комбинация” включает “набор частей”. Части набора частей можно затем, например, вводить одновременно или в хронологическом порядке, то есть в разные периоды времени и с одинаковыми или разными интервалами для любых частей комплекта деталей.
Предпочтительно, временные интервалы выбирают таким образом, что эффект на пролечиваемое заболевание при комбинированном применении (а) и (b) больше, чем эффект, получаемый при применении только одного из ингредиентов комбинации (а) и (b). Соотношение общего количества ингредиента комбинации (а) к ингредиенту комбинации (b) для введения в фиксированную комбинацию может варьироваться, например, с целью соответствия нуждам подгруппы пролечиваемых пациентов или нуждам одного пациента, чьи нужды могут отличаться от других пациентов из-за возраста, пола, веса тела и т.д. Предпочтительно имеет место по меньшей мере один положительных эффект, например, взаимное усиление влияния ингредиентов комбинации (а) и (b), в частности, синергизм, например, сверх аддитивный эффект, дополнительные положительные эффекты, меньшие побочные эффекты, комбинированный терапевтический эффект при неэффективной дозировке одного или обоих ингредиентов комбинации (а) и (b) и очень предпочтительно сильный синергизм ингредиентов комбинации (а) и (b).
В одном аспекте настоящее изобретение предоставляет Комбинацию Изобретения для применения в лечении болезненных состояний, характеризующихся повышением уровней гормонов стресса. Термин “гормон стресса”, как применяют здесь, относится к гормону, который секретируется в ответ на необычное жизненное воздействие. Ответ на стресс вовлекает активацию как симпатической адреномедуллярной системы с секрецией эпинефрина и норэпинефрина, так и гипоталамо-гипофизарно-надпочечниковой (HPA) системы с секрецией кортизола. В предпочтительном варианте осуществления гормонами стресса являются альдостерон или кортизол, предпочтительно кортизол.
В одном предпочтительном варианте осуществления настоящее изобретения предоставляет комбинацию изобретения для применения в лечении заболевания, характеризующегося повышенным уровнем кортизола. Термин “повышенный уровень кортизола”, как применяют здесь, относится к уровню кортизола, превышающему нормальный диапазон кортизола индивидуума. Нормальный уровень UFC для популяции составляет 10-100 мкг на 24 часа (мкг/24 ч или мкг/24 ч). Таким образом, термин “повышенный уровень кортизола” можно дополнительно определить как превышающий 30 мкг/24 ч, превышающий 50 мкг/24 ч, превышающий 70 мкг/24 ч, превышающий 85 мкг/24 ч или превышающий 100 мкг/24 ч. Термин “повышенный уровень кортизола” можно дополнительно определить как превышающий 125 мкг/24 ч, превышающий 125 мкг/24 ч или превышающий 200 мкг/24 ч. Свободный кортизол мочи (UFC) измеряют как среднее значение свободного кортизола в моче за 24 часа, высчитывая его из четырех 24-часовых образцов, собираемых в течение 2 недель. Предпочтительно термин “повышенный уровень кортизола” относится к уровню, превышающему 80 мкг/24 ч, превышающему 100 мкг/24 ч или превышающему 120 мкг/24 ч или превышающему 150 мкг/24 ч.
Заболевания, характеризующиеся повышенным уровнем кортизола, включают, но не ограничиваются хронической сердечной недостаточностью, хронической сердечной недостаточностью со снижением толерантности к нагрузкам, хронической сердечной недостаточностью с мышечной слабостью, сердечной кахексией, кахексией, вызванной ХНЗЛ, кахексией, вызванной циррозом, кахексией, вызванной опухолью, кахексией, вызванной ВИЧ, острой сердечной недостаточностью, острой декомпенсированной сердечной недостаточностью, острым коронарным синдромом, синдромом хронического стресса, синдромом Кушинга, метаболическим синдромом и повышенным содержанием кортизола в крови.
Состояния хронической сердечной недостаточности, как и хронической сердечной недостаточности со сниженной толерантностью к нагрузкам и мышечной слабостью, характеризуются повышением уровней альдостерона плазмы, как показал Bolger с соавт. в Circulation 2002; 106:92-99, повышенным уровнем дегидроэпиандростерона плазмы, как показал Anker с соавт. в European Heart Journal 1999; 20: 683-693, и снижением уровней андрогена, как показал Jankowaska с соавт. в Circulation 2006; 114: 1829-1837.
Сердечная кахексия представляет собой серьезное осложнение хронической сердечной недостаточности, поскольку пациенты страдают общей потерей жировой ткани, мышечной ткани и костной ткани. При сердечной кахексии у пациентов наблюдаются повышенные уровни альдостерона и кортизола в плазме, а также пониженные уровни дегидроэпиандростерона, как описал Anker с соавт. в Circulation 1997; 96: 526-534.
Кахексия, вызванная ХНЗЛ, кахексия, вызванная циррозом, кахексия, вызванная опухолью и кахексия, вызванная ВИЧ, характеризуются повышенными уровнями альдостерона плазмы, как отмечено в WO 2000/21509 или US 2009/0023639, и лечатся анаболическим андрогеном или производными андрогена, как сообщает Yeh с соавт, в Chest 2002; 122: 421-428 и Cuerda с соавт. в Nutrition Clinical Practice 2005 20; 93-97.
Инфаркт миокарда вызывает подъем уровней кортизола, что влияет на ремоделирование сердца, как отмечает Mihailidu с соавт. в Hypertension 2009 в печати. Масштаб кортизолового ответа связан с размером произошедшего инфаркта, как показал Bain с соавт. в International Journal of Cardiology 1992; 27: 145-150.
Хронические стрессовые расстройства с их физическими и физиологическими последствиями связаны с чрезмерными уровнями альдостерона и кортизола в соответствии с Kubzansky и Adler, Neuroscience and Biobehavioral Reviews, 2009; 5: 1-7. В частности, чрезмерная и сохраняющаяся секреция кортизола может привести к депрессии, гипергликемии и супрессии иммунной системы.
Синдром Кушинга описывает состояние хронического чрезмерного высвобождения кортизола. Повышение уровня кортизола может быть прямым следствием наличия опухоли надпочечников или вторичным от опухоли гипофиза (болезнь Кушинга) или эктопической опухоли, которая выделяет адренокортикотропин, как показал Boscaro и Arnaldi в Journal of Clinical Endocrinology and Metabolism 2009; 94: 3121-3131.
Метаболический синдром определяет состояние метаболической дисрегуляции, характеризующееся инсулинорезистентностью и предрасположенностью к сахарному диабету 2 типа, центральному и висцеральному ожирению, гипертензии и дислипидемии. Метаболическая дисрегуляция может быть вызвана лежащим в основе эндокринным дисбалансом, регулируемым стероидами надпочечников - альдостероном и кортизолом, как сообщает Kidamby с соавт. в Hypertension 2007; 49: 704-711.
Гиперкортизолемия относится к состоянию, которое характеризуется высокими уровнями циркулирующего кортизола. Высокие уровни кортизола плазмы могут прямо указывать на патологическое состояние, представляя собой признак патологического состояния, или иметь непатологическую природу.
В одном предпочтительном варианте осуществления настоящее изобретение предоставляет комбинацию изобретения для применения в лечении синдрома Кушинга. Комбинация изобретения поддерживает кортизол-снижающий эффект соединения А. Не будучи связанными или ограниченными теорией, следует понимать, что аналог соматостатина, в частности пасиреотид, улучшает или поддерживает эффект соединения А, адресно воздействуя на АКТГ. Таким образом, в одном предпочтительном варианте осуществления синдром Кушинга представляет собой АКТГ-зависимый синдром Кушинга, предпочтительно болезнь Кушинга.
В добавление к повышенному уровню АКТГ из-за секретирующей АКТГ опухоли гипофиза, другие ткани, например, опухоли вне нормальной гипофизарно-надпочечниковой системы, такие как мелкоклеточный рак легкого, могут вырабатывать АКТГ, что влияет на надпочечники. Таким образом, в одном варианте осуществления у пациента с синдромом Кушинга имелся повышенный уровень АКТГ негипофизарной природы.
С другой стороны настоящее изобретение также рассматривает улучшенное лечение синдрома Кушинга, в котором повышенный уровень кортизола является независимым от АКТГ. Не будучи связанным или не ограничиваясь теорией, пасиреотид снижает уровень АКТГ, повышение которого может быть потенциально вызвано из-за введения соединения А.
В одном аспекте настоящее изобретение предоставляет соединение А для применения в комбинации с аналогом соматостатина, предпочтительно пасиреотида, для лечения синдрома Кушинга.
В одном аспекте настоящее изобретение предоставляет способ лечения синдрома Кушинга, включающий введение (1) соединения А и (2) аналога соматостатина пациенту одновременно, раздельно или последовательно.
В одном аспекте настоящее изобретение предоставляет применение комбинации изобретения для получения лекарственного средства для лечения синдрома Кушинга.
В одном аспекте настоящее изобретение предоставляет применение соединения А в свободной форме, форме комплекса или в форме фармацевтически приемлемой соли для получения лекарственного средства для применения в комбинации с аналогом соматостатина.
В одном аспекте настоящее изобретение предоставляет продажную упаковку, включающую комбинацию изобретения вместе с инструкциями для одновременного, раздельного или последовательного его применения для лечения синдрома Кушинга.
Предпочтительно указанным аналогом соматостатина является пасиреотид.
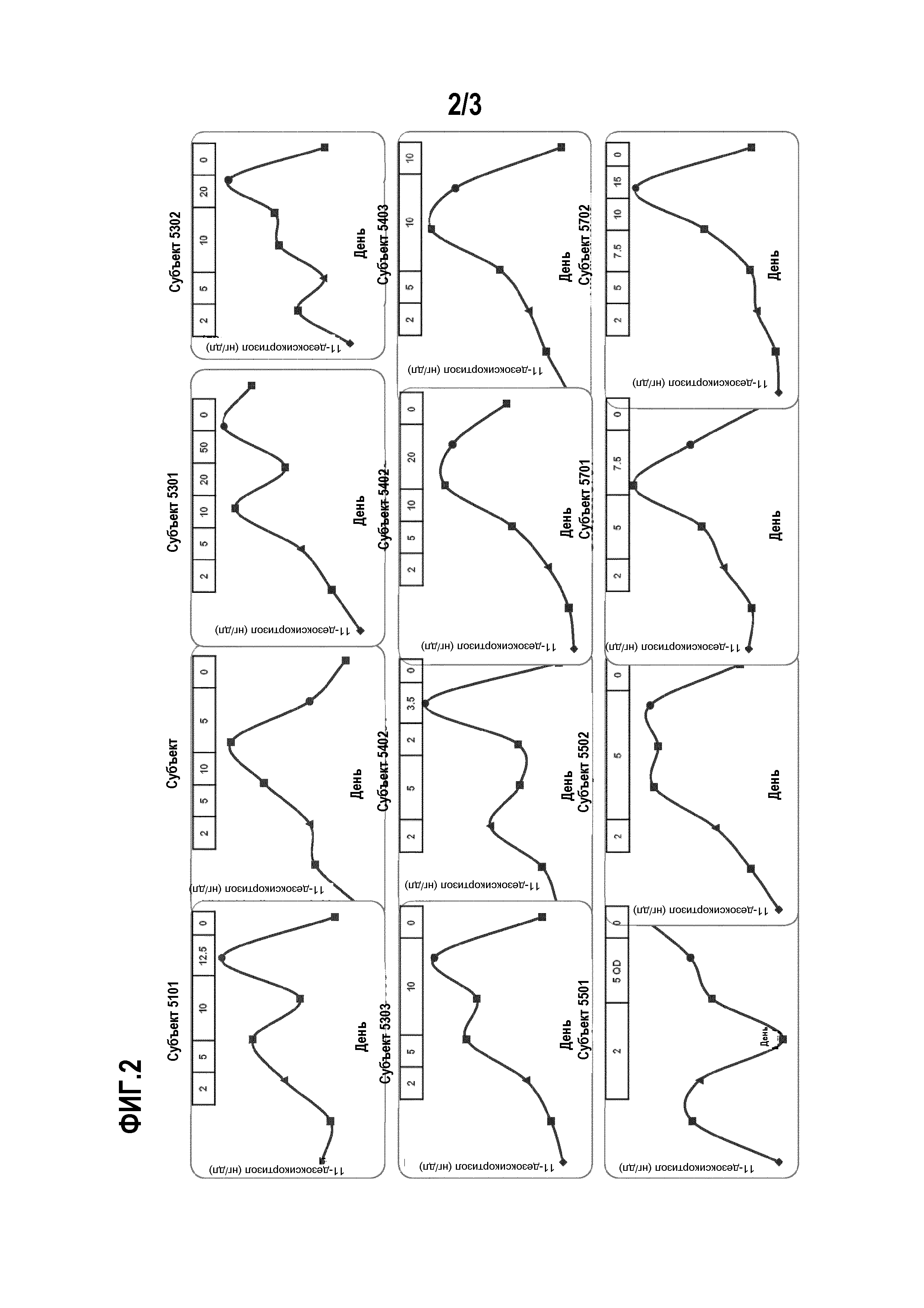
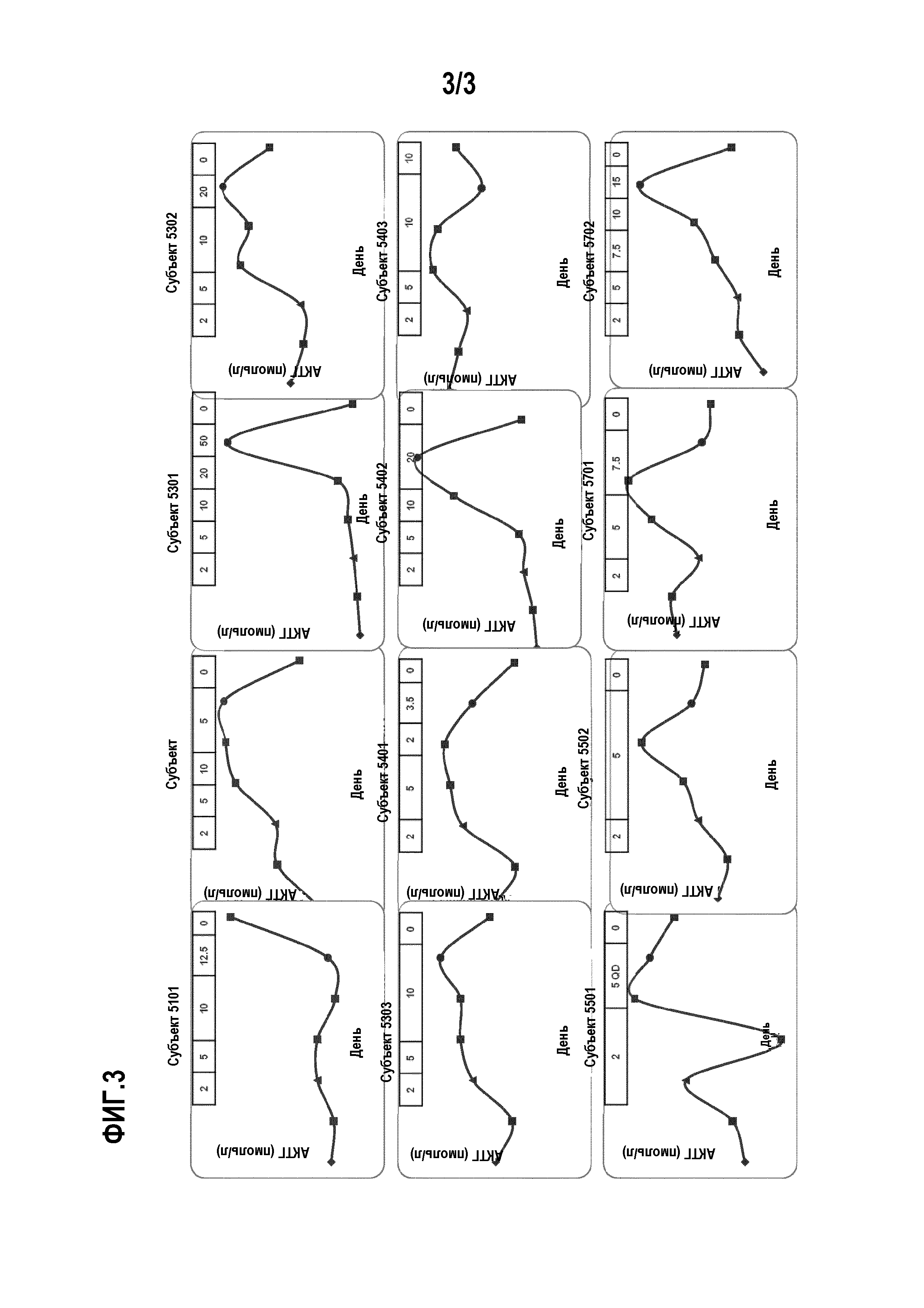
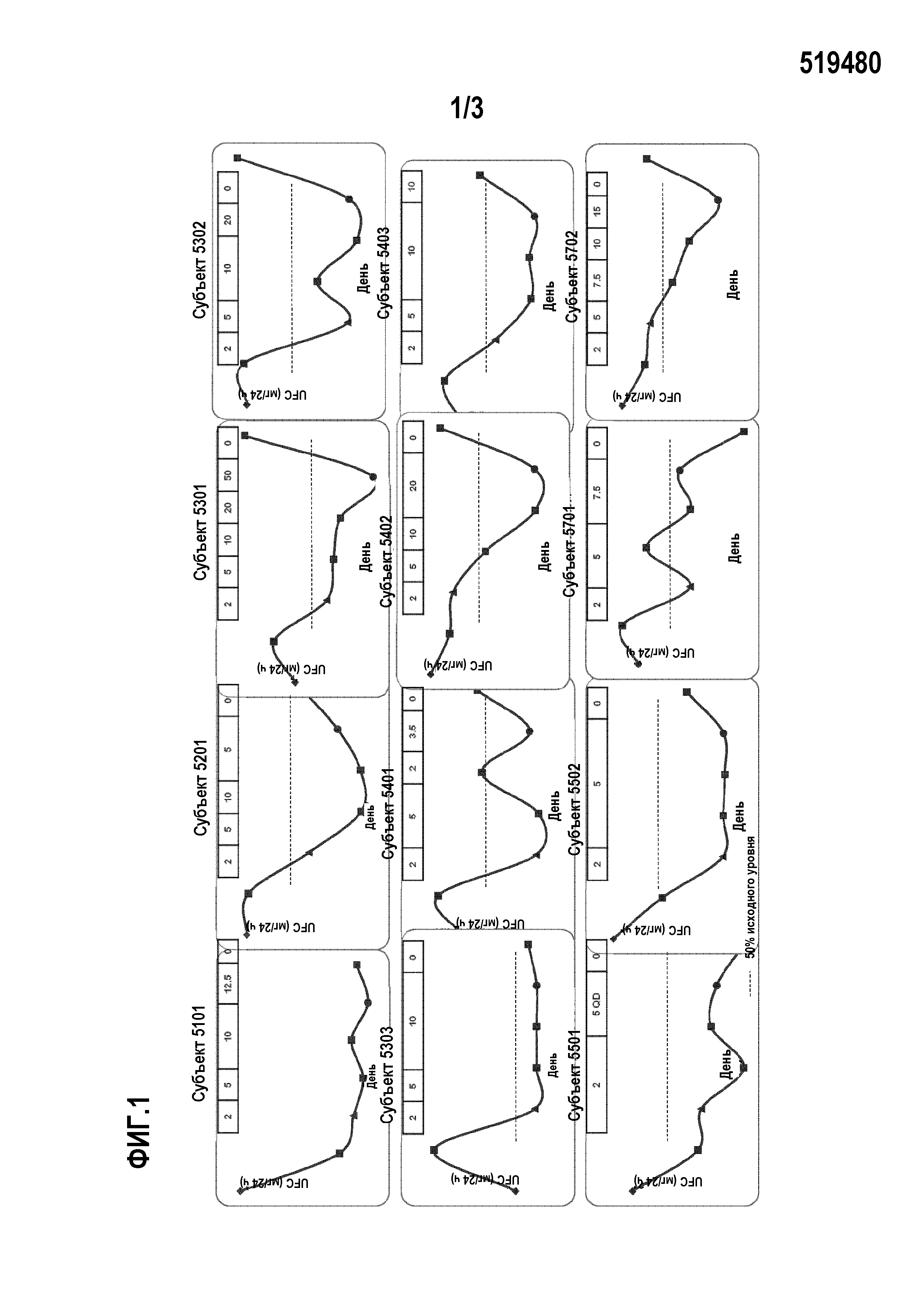
Способ поясняется фиг. 1-3.
ПРИМЕРЫ
Следующие примеры иллюстрируют изобретение, описанное выше, но, тем не менее, не намерены каким-либо образом ограничивать объем изобретения. Другие тестовые модели, известные специалистам в области техники, также могут определить положительные эффекты изобретения.
Пример 1
Фосфатная соль 4-(R)-6,7-дигидро-5Н-пирроло[1,2-c]имидазол-5-ил-3-фторбензонитрила (Форма А)
2 г свободного основания растворяют в 40 мл этанола и добавляют 1 эквивалент фосфорной кислоты в течение нескольких минут. После добавления, сухие вещества собирают при помощи фильтрации. Сухие вещества высушивают при 22°C под потоком азота. Собирают приблизительно 1,8 г.
Молярное соотношение фосфата к 4-(R)-6,7-дигидро-5Н-пирроло[1,2-c]имидазол-5-ил-3-фторбензонитрилу в полученной соли составляет 1:1.
В воде соль фосфата является растворимой при 0,1% целевой концентрации и стабильной в течение двухдневного периода при 50°C. Свободное основание остается в значительно мере нерастворимым. Оно превращается из свободного плавающего сухого вещества в маслянистый материал за короткий период времени после контакта с водой и остается таковым в течение двухдневного периода при 50°C.
Гидрофильность
Изотермы сорбции/десорбции измеряют при помощи VTI 100 микробаланса влажности (VTI Corporation, Hialeah, FL, USA). Измерения проводят при 25°C. Образцы высушивают под потоком N2 при 25°C.
Гидрофильность фосфатной соли оказывается равной 0% водопоглощения при 5% относительной влажности (RH) и 0,9% водопоглощения при 75% относительной влажности.
Излишки сухих веществ приводят в равновесие в каждом растворителе в течение более 24 часов при 25°C±0,1. Концентрацию в надосадочной жидкости измеряют при помощи гравиметрии для органических растворителей и при помощи ВЭЖХ (высокоэффективной жидкостной хроматографии, HPLC) для водных растворителей и пропиленгликоля.
Следующие результаты получены для фосфатной соли в сравнении со свободным основанием:
|
Это показывает, что растворимость фосфатной соли является сравнительно низкой в неводных растворах, которые, таким образом, являются для соли антирастворителями, таким образом, делая возможным достижение хорошей преципитации и, следовательно, хорошего выхода продукта и хорошей чистоты. С другой стороны, растворимость в воде лучше для свободного основания, что является преимущественным для предоставления пероральных или парентеральных форм.
Точку плавления определяют при помощи TG/DTA, как описано выше, и определяют равной 210,2°C.
Пример 2
Пациенты с болезнью Кушинга достигают нормального кортизола мочи при помощи соединения А, сильного ингибитора 11β-гидроксилазы: предварительные результаты многоцентрового клинического исследования для подтверждения концепции.
Введение: Клинические признаки и осложнения синдрома Кушинга исходят из хронического избытка циркулирующего кортизола, обычно измеряемого в виде 24-часового свободного кортизола мочи (UFC). Соединение А является сильным ингибитором 11β-гидроксилазы. Поскольку 11β-гидроксилаза катализирует финальную стадию синтеза кортизола, соединение А является потенциально новым лечением для всех форм синдрома Кушинга.
Методы: Взрослые пациенты с умеренным-тяжелым течением болезни Кушинга (UFC>1,5x верхняя граница нормы [ULN], в среднем три сбора за 14 дней) получают перорально соединение А в течение 10 недель в открытом исследовании. Соединение А начинают применять в виде 2 мг 2 р/д. Увеличение дозы планируется каждые 2 недели до 5, 10, 20 и 50 мг 2 р/д до нормализации UFC, в случае которой дозу поддерживают до 70 дня, когда лечение прекращают. Снижение дозы для переносимости запрещается. UFC оценивают в предпоследний день каждого двухнедельного периода. Пациентов наблюдают до 84 дня. Начальная конечная точка составляет UFC≤ULN или ≥50% снижение от исходной отметки на 70 день с применением среднего значения 3 образцов UFC, собираемых в течение недели перед 70 днем.
Результаты: двенадцать пациентов (в возрасте 25-55 лет; 4 мужчин) включены в исследование и 9 завершают исследование к дате. Их уровни UFC, дезоксикортизола и АКТГ индивидуально показаны на фигурах. Девяти пациентам предварительно проводится оперативное вмешательство. Исходный диапазон UFC равен 1,6-17,0×ULN (среднее UFC±SD, мкг/24 ч, 346±385; диапазон 115-153). Уровни UFC нормальны по меньшей мере в одном измерении у 11 из 11 пациентов во время исследования. Начальная конечная точка достигнута всеми 9 пациентами, которые завершили фазу активного лечения, у 8 из которых наблюдаются нормальные уровни UFC на 70 день. После окончания лечения UFC превышает ULN у 6 пациентов с измерениями на 84 день. Средняя дозировка соединения А, связанная с нормализацией UFC, находится между 5 и 10 мг 2 р/д. На 70 день среднее SBP (систолическое артериальное давление) снижается на 13,1 мм рт.ст. от исходной величины. Соединение А в целом хорошо переносится; наиболее частыми сообщаемыми побочными эффектами являются слабость (7/12), тошнота (4/12) и головная боль (3/12). У пяти пациентов уровни АКТГ в 2 раза превышают исходные. У четырех пациентов развивается зависимая от исследуемого лекарственного средства гипокалиемия (К+<3,5 ммоль/л; мин 3,1 ммоль/л). Не наблюдаются серьезные побочные эффекты (AE), заподозренные в связи с лекарственным средством.
Вывод: Соединение А демонстрирует эффективность с удовлетворительным профилем безопасности в этом клиническом исследовании для подтверждения концепции у пациентов с болезнью Кушинга.
Пример 3
Исследование комбинации соединения А и пасиреотида на крысах
Целью этого неклинического исследования является определение токсичности соединения А и SOM230 в комбинации. Сочетанная терапия включает ежедневное пероральное введение крысам соединения А и однократную ежедневную подкожную инъекцию SOM230. В дополнение, определяют токсикокинетические характеристики соединения А/SOM230.
Соединение А, произведенное в ультрачистой воде, вводят перорально через зонд (5 мл/кг) отдельно или в комбинации с SOM230, произведенным с буферным раствором ацетата с pH 4,5 для инъекции USP, и вводят при помощи подкожной инъекции (в межлопаточное пространство, 1 мл/кг) 5 группам (10/пол/группа) крыс Wistar Hannover с ежедневной дозировкой соединения А/SOM230 1,5/0,03, 5/0,1, 20/0,3, 20/ и /0,3 мг/кг/день. Другая группа крыс (10/пол) получают ежедневные дозировки ультрачистой воды, вводимые перорально через зонд, и буферный раствор ацетата с pH 4,5, для инъекции USP при помощи подкожной инъекции, выступающие в роли контроля. На время начальной дозировки возраст животных составляет приблизительно 7-8 недель, особи мужского пола весят от 176 до 216 г, а особи женского пола от 123 до 165 г.
Мероприятия исследования включают клинические обследования, включающие дважды в день обследование на летальность и признаки заболевания или реакцию на лечение, ежедневные наблюдения в клетке перед введением дозировки и через 1 час после введения, еженедельные тщательные обследования, взвешивание тела и потребление еды, два офтальмологических обследования (перед лечением и на 13 неделе), лабораторную диагностику (анализ крови, коагулограмму и биохимический анализ крови, анализ мочи) и иммунологическое обследование в конце дозировок (адренокортикотропный гормон, кортикостерон, гормон роста, инсулиноподобный фактор роста и анализ мочи на кортикостерон). Токсикокинетическая оценка производится на 1 день и в течение 11 недели (через 0,5, 1, 3, 7 и 24 часа после введения дозировки) в группах, получающих комбинацию соединение А/SOM230. Посмертные анализы включают макроскопические наблюдения, оценку веса органа (абсолютного и относительно тела) и микроскопические исследования.
Прижизненные наблюдения: не наблюдаются смерти, клинические признаки токсичности, побочные эффекты на потребление еды или глазные изменения связанные с соединением А/SOM230, во время проведения этого исследования.
Эффекты на кортикостерон сыворотки (маркер PD): соединение А или SOM230 по отдельности вызывают снижение сывороточного кортикостерона только у женских особей. Введение соединения А/SOM230 в комбинации вызывает умеренное снижение кортикостерона сыворотки у особей мужского и женского пола во всех уровнях тестируемых дозировок (таблица 1). Эти данные предполагают, что комбинация соединения А и SOM230 обеспечивает лучшую эффективность по сравнению с каждым средством по отдельности.
|
Эффекты на надпочечники (потенциальный орган адресного воздействия токсичности): лечение соединением А связано с увеличенным весом надпочечников (больше выражено у женского пола), совместное лечение с применением SOM230 предотвращает увеличение веса надпочечников под действием соединения А (таблица 2). В дополнение, лечение соединением А вызывает гипертрофию надпочечников у крыс женского пола, и совместное лечение с применением SOM230 предотвращает гипертрофию надпочечников под действием соединения А у крыс женского пола. Эти данные предполагают, что такое совместное лечение с SOM230 может предотвратить побочные эффекты на надпочечники, вызванные соединением А.
|
В заключение, введение соединения A/SOM230 в комбинации путем ежедневного перорального введения через зонд/подкожную инъекцию крысам в течение 13 недель хорошо переносится в течение жизни и не усугубляет токсичность органов адресного воздействия по сравнению с SOM230 и соединением А по отдельности. Более того, совместное лечение, кажется, обеспечивает лучшую эффективность, как показывает стабильное снижение уровня сывороточного кортикостерона, и лучшую безопасность, как показывает снижение побочных эффектов на надпочечники.
Пример 4
Сочетанное исследование соединения А и пасиреотида в отношении синдрома Кушинга
Дизайн клинического исследования
Исследование состоит из периода отбора 60 дней, 10-14 дневного расчетного периода и 10-недельного (70 дней) периода лечения с последующим увеличением дозировки с последующим 12-недельной фазой лечения соединением А 2 р/д, где пациенты продолжают получать соединение А в максимально переносимой дозировке с возможностью вхождения в спасательную фазу SOM230 при необходимости. На 22 неделе производится оценка пациентов для определения вхождения в одну из двух групп на 4 недели: (1) соединение А 2 р/д плюс пасиреотид или (2) соединение А в дозировке один раз в день. Добавление пасиреотида п/к может иметь место раньше (между 10 неделей и 22 неделей), если будет необходимо в качестве резервного лечения. В конце 26 недели пациенты, принимающие соединение А в ежедневной дозировке, смогут вступить в фазу дополнительного лечения на 12 месяцев.
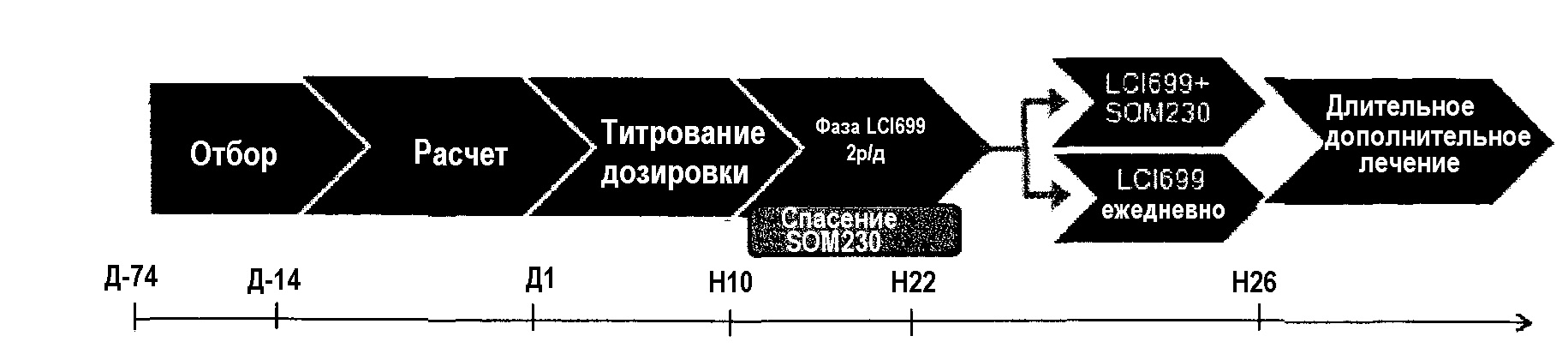
* Заметка: пациенты с исходным UFC>3×ULN начинают с 5 мг 2 р/д (вместо 2 мг 2 р/д).
Популяция:
В популяцию исследования включены пациенты мужского и женского пола с эндогенным повышением уровня кортизола из-за надпочечникового синдрома Кушинга (АКТГ-независимого) или из-за повышенной выработки АКТГ гипофизом (болезнь Кушинга) или эктопического происхождения (эктопический АКТГ). Пациенты должны либо пройти неудачную терапию (включая хирургическое лечение), либо это могут быть первичные пациенты, для которых оперативное лечение не является возможным.
Критерии включения/исключения:
Включение:
1. Пациенты мужского или женского пола в возрасте 18-75 лет.
2. Диагноз синдрома Кушинга:
Как видно из следующих критериев:
а. Болезнь Кушинга:
- UFC>1,5×ULN (средняя величина трех 24-часовых образцов мочи, собранных в течение 14 дней).
- Утренняя плазма.
- Подтверждение гипофизарного происхождения избытка АКТГ, по меньшей мере одно из трех следующих:
- МРТ подтверждение аденомы гипофиза в анамнезе (большей или равной 6 мм) с положительным динамическим тестом (например, CRH или тест подавления высокими дозами дексаметазона) или
- Градиент нижнего каменистого синуса в анамнезе >3 после стимуляции CRH или
- Предшествующее оперативное вмешательство на гипофизе с гистопатологическим исследованием, подтверждающим АКТГ-окрашиванием аденому.
b. Надпочечниковый синдром Кушинга:
- UFC>1,5×ULN (средняя величина трех 24-часовых образцов мочи, собранных в течение 14 дней).
- АКТГ утренней плазмы < нижней границы нормы, не реагирует на CRH.
- Подтверждение надпочечникового источника избыточного содержания кортизола, по меньшей мере одно из следующих:
- Очевидное отображение повреждений надпочечников сравнимых с АКТГ-независимым синдромом Кушинга или
- Предшествующее оперативное вмешательство в анамнезе с гистопатологическим исследованием, подтверждающим продуцирующую аденому или карциному.
c. Эктопический АКТГ-синдром Кушинга:
- UFC>1,5×ULN (средняя величина трех 24-часовых образцов мочи, собранных в течение 14 дней).
- АКТГ утренней плазмы ≥ нижней границы нормы, не реагирует на CRH.
- Подтверждение вненадпочечникового источника избыточного содержания АКТГ, по меньшей мере одно из трех следующих:
* Отсутствующий гипофиз на МРТ-изображении и отрицательный CRH-тест вместе с:
- Очевидным негипофизарным источником АКТГ (опухоль грудной клетки на КТ и/или октреоскане (Octreoscan), клинически подтвержденной опухолью любой локализации или
- Градиентом нижнего каменистого синуса ≤3 после CRH-стимуляции или
- Предшествующим оперативным вмешательством с гистопатологическим исследованием, подтверждающим АКТГ окрашиванием аденому/карциному.
3. Для пациентов на следующем лекарственном лечении периоды отмывки должны завершиться до проведения оценки исходной эффективности, как описано ниже:
- Ингибиторы стероидогенеза (кетоконазол, метирапон): 1 неделя.
- Агонисты допамина (бромокриптин, каберголин), агонисты PPAR (рецептора, активируемого пролифератором пероксисом)-гамма (росиглитазон или пиоглитазон): 4 недели.
- Октреотид LAR, пасиреотид LAR и лантреотид автогель: 8 недель.
- Мифепристон, ланреотид SR: 4 недели.
- Октреотид и пасиреотид (препарат с немедленным высвобождением): 1 неделя.
- Другие экспериментальные терапии, по меньшей мере 5 периодов полувыведения.
Исключение:
1. Применение исследуемых лекарственных средств во время включения в исследование.
2. Гиперчувствительность к любому из лекарственных средств исследования или к лекарственным средствам сходных химических классов в анамнезе.
3. Озлокачествление любой системы органов в анамнезе (отличное от локализованной базальноклеточной карциномы кожи и отличное от связанными с синдромом Кушинга, например, карциномы надпочечников или карциноида/карциномы, секретирующей АКТГ), пролеченные или нелеченные, в течение 5 последних лет, независимо от наличия признаков местного рецидива или метастазов.
4. Беременность или кормление (лактация) для женщин.
5. Женщины, способные к деторождению.
6. Фертильные мужчины, кроме тех случаев, когда субъект соглашается с двумя эффективными методами контрацепции на всем протяжении исследования.
7. Пациенты, которые получали лечение митотаном в течение последних 6 месяцев до 1 Визита.
8. Пациенты с компрессией зрительного перекреста, с целью исключения пациентов с опухолью, вызывающей компрессию, требующей оперативного вмешательства.
9. Пациенты с псевдо-синдромом Кушинга [для пациентов со средним UFC<3×ULN требуется дополнительное тестирование для выявления этого состояния, кроме тех случаев, когда болезнь Кушинга или эктопический или надпочечниковый источник подтверждается гистопатологически]. По меньшей мере 2 из 3 тестов должны быть не в норме с целью исключения псевдо-синдрома Кушинга: супрессионный тест низкими дозами дексаметазона, дексаметазон-CRH тест или поздний ночной слюнной или сывороточный кортизол.
10. Пациенты с нарушением работы почек (установленный клиренс креатинина <60 мл/мин по формуле MDRD), сывороточным креатинином >2,0×ULN.
11. Пациенты, которые не имеют биохимически нормальную функцию щитовидной железы.
12. Пациенты, которым проводилась крупное оперативное вмешательство за последний месяц до периода отбора.
13. Пациенты-диабетики с плохо контролируемым диабетом, что подтверждает HbA1C>9%.
14. Пациенты, которые имеют застойную сердечную недостаточность (NYHA класс III или IV), нестабильную стенокардию, постоянную форму желудочковой тахикардии, клинически значимую брадикардию, прогрессирующую блокаду сердца, острый инфаркт миокарда в анамнезе менее, чем за год до вхождения в исследование или клинически значимое нарушение сердечно-сосудистой функции.
15. Пациенты с заболеванием печени, таким как цирроз, хронический активный гепатит или хронический персистирующий гепатит, или пациенты с АЛТ/АСТ, превышающим 3×ULN, сывороточным билирубином >2,0×ULN.
Если встречаются любые из следующих исключений для пасиреотида, пациент не может принимать пасиреотид.
1. Пациенты с диабетом с плохо контролируемым уровнем глюкозы, что подтверждает HbA1с>8%.
2. Пациенты с факторами риска для желудочковой тахикардии типа “пируэт”, т.е. пациенты с QTcF>470 мс, гипокалиемией, гипомагниемией, неконтролируемым гипотиреозом, семейным анамнезом синдрома удлинения интервала QT.
3. Пациенты с заболеванием печени в анамнезе, таким как цирроз, хронический активный гепатит В и С, или пациенты с АЛТ или АСТ>2×ULN или общим билирубином >1,5×ULN.
4. Присутствие поверхностного антигена Гепатита В (HbsAg).
5. Присутствие антител в Гепатите С (anti-HCV).
6. Известные заболевания желчного пузыря или желчевыводящих путей, острый или хронический панкреатит.
7. Пациенты с надпочечниковым синдромом Кушинга или эктопическими АКТГ-синдромом Кушинга.
Исследуемый препарат и препарат сравнения: Исследование начинается с новыми взятыми в исследование пациентами как с 2 мг 2 р/д соединения А, если исходный mUFC≤3×ULN, или 5 мг 2 р/д, если исходный mUFC>3×ULN, и дозировки увеличиваются каждые 2 недели до 10 недели. Все пациенты продолжают принимать соединение А 2 р/д в качестве монотерапии с недели до 22 недели. 300 мг пасиреотида 2 р/д п/к будет потенциально вводиться в качестве дополнительной терапии (недели 22-26) или при необходимости раньше (недели 10-22) в качестве резервного лечения. Пациентам, которые не получают пасиреотид на 22 неделе или раньше, можно потенциально вводить соединение А в однократной дневной дозировке (1 р/д) вместо 2 р/д в течение 4 недель.
Оценка эффективности/фармакодинамическая оценка: Оценка эффективности включает свободный кортизол мочи, АКТГ плазмы, кортизол, 11-дезоксикортизол и ренин, дезоксикортикостерон плазмы и мочи, альдостерон плазмы и мочи, натрий и калий в плазме и моче, кортизол и альдостерон в слюне, тестостерон и эстрадиол, ЛГ, ФСГ, ИФР-1, ТТГ, свободный Т4, HbA1c и инсулин плазмы.
Анализ данных: Основную переменную определяют как пропорцию ответивших на лечение соединением А. Пациент считается ответившим на лечение, если средний уровень UFC с 10 недели в 24-часовых образцах мочи ≤ULN или представляет ≥50% снижение от исходного уровня. Пациенты, которые прекращают прием лекарственного средства из-за причин, связанных с заболеванием или лечением (например, из-за смерти, побочных эффектов, клинического прогрессирования заболевания и т.д.), или у которых средние уровни UFC на 10 неделе в 24-часовых образцах выше, чем граница нормы, и чье снижение UFC<50%, считаются не ответившими на лечение. Пациентов, которые имеют 24-часовое измерение UFC<2 исходных или пост-исходных, не включаются в первичный анализ.
Пропорцию ответивших на лечение и связанный 95% доверительный интервал определяют при помощи Точного Биномиального Теста.
Основной показатель эффективности определяют как пропорцию ответивших на монотерапию соединением А на 22 неделе. Пациент, нуждающийся в резервном лечении до 22 недели, также классифицируется как не ответивший на лечение.
Ответивших на лечение классифицируют дополнительно в пациентов с контролируемым UFC и частично контролируемым UFC.