Результат интеллектуальной деятельности: СПОСОБ СОЗДАНИЯ И СЕЛЕКЦИИ БИБЛИОТЕКИ МОДИФИЦИРОВАННЫХ АПТАМЕРОВ
Вид РИД
Изобретение
Изобретение относится к области биохимии и биотехнологии, в частности к способу создания и селекции библиотеки модифицированных аптамеров для различных мишеней, в частности к человеческому клеточному рецептору CD47 или CD44.
В последнее время большое внимание исследователей привлекают новые технологии, позволяющие селективно воздействовать на определенные структуры живой клетки с целью диагностировать заболевание или вылечить его. Так, например, антитела, изначально являющиеся молекулами, вырабатываемыми организмом для мечения и уничтожения чужеродных антигенов, стали использоваться для диагностики многих патологий и для лечения таких сложных заболеваний, как онкология и аутоиммунные нарушения. В этом направлении применение моноклональных антител успело зарекомендовать себя как простой и достаточно эффективный способ диагностики и терапии. К сожалению, помимо очевидных достоинств применения поликлональных или моноклональных антител, существует и ряд достаточно серьезных недостатков:
- Процесс получения антител начинается в организме животного, следовательно, возникают трудности с получением антител к молекулам, которые животные плохо переносят, например к токсинам. Также затруднительно или невозможно получать антитела к слабоиммуногенным молекулам.
- Технология получения гибридом фактически ограничена иммунизацией мышей и крыс, существенно, в свою очередь, ограничивая и затрудняя терапевтическое применение, имеются ограничения и для диагностического применения таких антител, например наличие гетерофильных антител, аутоантител и ревматоидных факторов у человека.
- Идентификация клонов и продукция моноклональных антител требует огромных затрат труда и средств, особенно при поиске редких антител, требующих скрининга большого числа клонов.
- Продукция антител имеет свои трудности - замороженные культуры клеток, продуцирующих антитела, необходимо хранить в нескольких различных хранилищах для предотвращения случайной потери трудновосполнимых продуцентов в результате гибели клеток, не все гибридомы хорошо растут в полости кишечника животных (асцитной жидкости), что ограничивает доступность антител и приводит к их удорожанию.
- Одни и те же антитела различаются от одного выделения к другому, что требует реоптимизации иммунных тестов с каждой новой партией выделенных антител.
- Идентификация антител ограничена параметрами, существующими in vivo. Это делает трудным или невозможным получение антител в условиях, отличных от физиологических.
- Кинетические параметры взаимодействия антитела с его мишенью не могут быть предсказуемым образом изменены.
- Антитела чувствительны к температуре и ряду других параметров, могут претерпевать необратимую денатурацию, срок их хранения ограничен.
- Антитела имеют большую молекулярную массу и, как правило, неспособны проникать внутрь клеток, что ограничивает ряд применений, кроме того, они могут быть иммуногенными при терапевтическом применении.
С другой стороны, в последнее десятилетие набирает популярность методика создания специфичных к определенным мишеням молекул, которые называются аптамерами.
Аптамеры представляют собой однонитевые молекулы дезоксирибонуклеиновой (ДНК) или рибонуклеиновой кислоты (РНК), формирующие самые разнообразные трехмерные структуры, что позволяет им специфически распознавать молекулярные структуры и даже осуществлять катализ реакций. В качестве наиболее известных можно назвать такие молекулы, как транспортная РНК или рибосомальные РНК, которые играют огромную роль в процессах белкового синтеза, а также можно вспомнить теорию «РНК мира». В процессе развития ДНК технологий стало очевидно, что огромное разнообразие нуклеиновых кислот и их способность формировать самые разнообразные вторичные и третичные структуры делают возможным направленный поиск вариантов нуклеиновых кислот, обладающих заданными свойствами. Все это привело к созданию методов эволюции нуклеиновых кислот in vitro, позволяющих получать молекулы оцДНК или РНК, способных распознать практически любую мишень. Такая технология позволяет нивелировать недостатки, присущие антителам. Так, аптамеры имеют следующие преимущества:
- Аптамеры идентифицируются целиком in vitro, процесс не зависит от использования животных, клеток или даже условий in vivo, свойства аптамеров можно модифицировать в зависимости от применения.
- Условия селекции аптамеров могут меняться в широком диапазоне, необходимом как для диагностических применений (не физиологические солевые и кислотные условия, температуры), так и для терапии (кинетические свойства взаимодействия с мишенью).
- Поскольку иммунизация животных не является ограничивающим фактором в селекции аптамеров, мишень может быть любой, в том числе неиммуногенной, токсической или низкомолекулярной.
- Аптамеры получают химическим синтезом, что обеспечивает высокий уровень чистоты и воспроизводимости. Соответственно, практически не бывает вариабельности свойств от партии к партии синтезированного вещества.
- Аптамеры могут быть легко и специфически модифицированы разнообразными функциональными группами (флуоресцентными, аффинными, и т.д.) и дериватизированы для иммобилизации или конъюгации с другими молекулами.
- Аптамеры могут быть денатурированы, что разрушает их специфическое взаимодействие с мишенью, но этот процесс обратим и аптамер может быть ренатурирован в течение нескольких минут. Аптамеры стабильны при долговременном хранении и могут транспортироваться без специального охлаждения.
Мишень-специфичные аптамеры получают последовательным, направленным отбором из комбинаторных библиотек in vitro. Метод отбора получил название SELEX (от англ. Systematic evolution of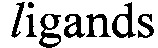 by exponential enrichment). Зачастую для увеличения разнообразия библиотеки, т.е. увеличения количества возможных вариантов молекул, производят внедрение модифицированных нуклеотидов в состав исходных олигонуклеотидов на этапе синтеза библиотеки. Такие аптамеры называют модифицированными. Модифицированные аптамеры используются как с целью повышения их устойчивости к нуклеазам, так и для повышения потенциала связывания с мишенью, часть которой может представлять собой труднодоступную для взаимодействия с ДНК или РНК-аптамерами поверхность.
by exponential enrichment). Зачастую для увеличения разнообразия библиотеки, т.е. увеличения количества возможных вариантов молекул, производят внедрение модифицированных нуклеотидов в состав исходных олигонуклеотидов на этапе синтеза библиотеки. Такие аптамеры называют модифицированными. Модифицированные аптамеры используются как с целью повышения их устойчивости к нуклеазам, так и для повышения потенциала связывания с мишенью, часть которой может представлять собой труднодоступную для взаимодействия с ДНК или РНК-аптамерами поверхность.
Известен способ скрининга библиотеки аптамеров для идентификации связующих агентов с мишенью, представляющей интерес, который основывается на известной методике "Систематическое выделение лигандов экспоненциальным обогащением" (SELEX), применяемом для проведения селекции на микровезикулах. Недостатком этого способа является ограниченность использования исключительно с природными нуклеотидами (патентная заявка US 20160003835, опубл. 2016-01-07).
Также известен другой способ выделения аптамеров с использованием методики SELEX. Для выделения высокоаффинных лигандов нуклеиновых кислот исходная библиотека аптамеров инкубируется с представляющим интерес белком. Молекулы нуклеиновых кислот, которые связываются с определенным белком, отделяют от других последовательностей в библиотеке, связанные последовательности удаляют и амплифицируют методом обратной транскрипции и ПЦР для создания библиотеки, обогащенной последовательностями, которые связываются с белком-мишенью (патентная заявка US 20100240732, опубл. 2010-09-23).
Также известны методы селекции аптамеров, специфичных для целевого интереса из числа библиотеки потенциальных последовательностей аптамеров. Аптамеры могут быть использованы для обнаружения поверхностных антигенов, используемых для диагностики различных заболеваний, включая различные типы рака. Эти методы также включают в себя использование лишь таких нуклеозидтрифосфатов, которые могут непосредственно служить субстратами для термостабильных ДНК-полимераз либо РНК-полимераз (международная заявка WO 2014100434 (А1), опубл. 2014-06-26).
Также известен ряд публикаций, свидетельствующих об определенных успехах в создании модифицированных библиотек аптамеров для специальных применений (Chushak, Y.G., et al., Computational design of RNA libraries for in vitro selection of aptamers. Methods Mol Biol, 2014. 1111: p. 1-15; Kim, N., et al., Computational generation and screening of RNA motifs in large nucleotide sequence pools. Nucleic Acids Res, 2010. 38(13): p. e139; Luo, X., et al., Computational approaches toward the design of pools for the in vitro selection of complex aptamers. RNA, 2010. 16(11): p. 2252-62; Ruff, K.M., T.M. Snyder, and D.R. Liu, Enhanced functional potential of nucleic acid aptamer libraries patterned to increase secondary structure. J Am Chem Soc, 2010. 132(27): p. 9453-64). Однако успех селекции в большинстве случаев зависит от протоколов селекции в большей степени, чем от дизайна библиотеки (Ahmad, K.М., Y. Xiao, and Н.Т. Soh, Selection is more intelligent than design: improving the affinity of a bivalent ligand through directed evolution. Nucleic Acids Res, 2012. 40(22): p. 11777-83).
Стандартная методика SELEX, направленная на отбор модифицированных аптамеров, включает следующие этапы:
1. Синтез комбинаторной библиотеки олигонуклеотидов, которые содержат центральный район со случайной последовательностью, окруженный двумя районами с фиксированными последовательностями. Случайная последовательность обеспечивает формирование специфичной пространственной структуры молекулы аптамера, в свою очередь фиксированные районы необходимы для амплификации библиотеки при проведении отбора и внесения различных молекулярных меток и маркеров. оцДНК библиотеку получают стандартными методами синтеза олигонуклеотидов, однако при синтезе вариабельного, случайного района в реакцию добавляют смесь всех четырех нуклеотидов. Если это модифицированная библиотека, то в последовательность вводятся модифицированные нуклеотиды.
2. После синтеза олигонуклеотиды комбинаторной библиотеки инкубируют с белком-мишенью, которой был предварительно сорбирован на каком-либо аффином сорбенте.
3. В дальнейшем, несвязавшиеся молекулы олигонуклеотидов удаляют промывкой буферным раствором, а связавшиеся элюируют и используют для дальнейшего отбора.
4. Элюированные олигонукеотиды амплифицируют и проводят аналогичную стадию сорбции с белком-мишенью. В среднем для получения мишень-специфичных аптамеров достаточно провести 5-20 подобных раундов отбора.
5. На последнем этапе, когда афинность олигонуклеотидов перестает увеличиваться, обогащенную библиотеку клонируют в плазмидные векторы и проводят определение индивидуальных аптамеров.
Важным этапом при селекции библиотеки модифицированных олигонуклеотидов является проведение реакции амплификации после раунда отбора связавшихся с белком-мишенью вариантов аптамеров. В первую очередь это связано со сложностью чтения и включения модифицированных нуклеотидов ДНК-зависимыми ДНК-полимеразами. При использовании стандартной методики отбора специфичных аптамеров полимеразный комплекс должен прочитать модифицированные основания, что уже вызывает некоторые ограничения при выборе сложных модификаций с высокомолекулярными группировками. Однако основное ограничение связано со встраиванием модифицированных дезоксирибонуклеотидов в строящуюся цепь олигонуклеотида, т.к. каталитический центр ДНК-полимеразы оказывается более восприимчив к неканоническим основаниям. В связи с этим возникает потребность рационализации методики отбора модифицированных аптамерных молекул.
Задачей изобретения является создание нового способа, направленного на быстрый отбор сложномодифицированных аптамеров к различным мишеням с повышенным потенциалом связывания.
Минимально-модифицированными нуклеотидами обозначены нуклеотиды, содержащие алкиновый линкер, присоединенный к азотистому основанию, по которому проводится дальнейшее присоединение функциональной группировки. Минимально-модифицированные нуклеотиды способны эффективно встраиваться в цепь ДНК при помощи известных термостабильных ДНК-полимераз. Сложномодифицированным нуклеотидом обозначен модифицированный нуклеотид, содержащий присоединенную к азотистому основанию функциональную группировку, которая присоединена либо методом азид-алкинового присоединения к минимально-модифицированному нуклеотиду, либо иным способом, при этом сложномодифицированный нуклеотид может не обладать способностью эффективно встраиваться в цепь ДНК при помощи известных термостабильных ДНК-полимераз. Минимально- и сложномодифицированными аптамерами обозначены аптамеры, содержащие в своем составет минимально- или сложномодифицированные нуклеотиды соответственно.
Задача решается за счет способа, включающего в себя следующие этапы:
1. Синтез комбинаторной библиотеки олигонуклеотидов с использованием одного из модифицированных оснований. Олигонуклеотиды имеют стандартную структуру и состоят из константных участков, необходимых для амплификации фрагментов библиотеки в процессе отбора, и вариабельного участка, включающего модифицированные нуклеотиды. Модифицированные нуклеотиды представляют собой коммерчески доступные неканонические нуклеотиды, такие как 5'-замещенные дезоксиуридины, содержащие алкиновый линкер, присоединенный к азотистому основанию:
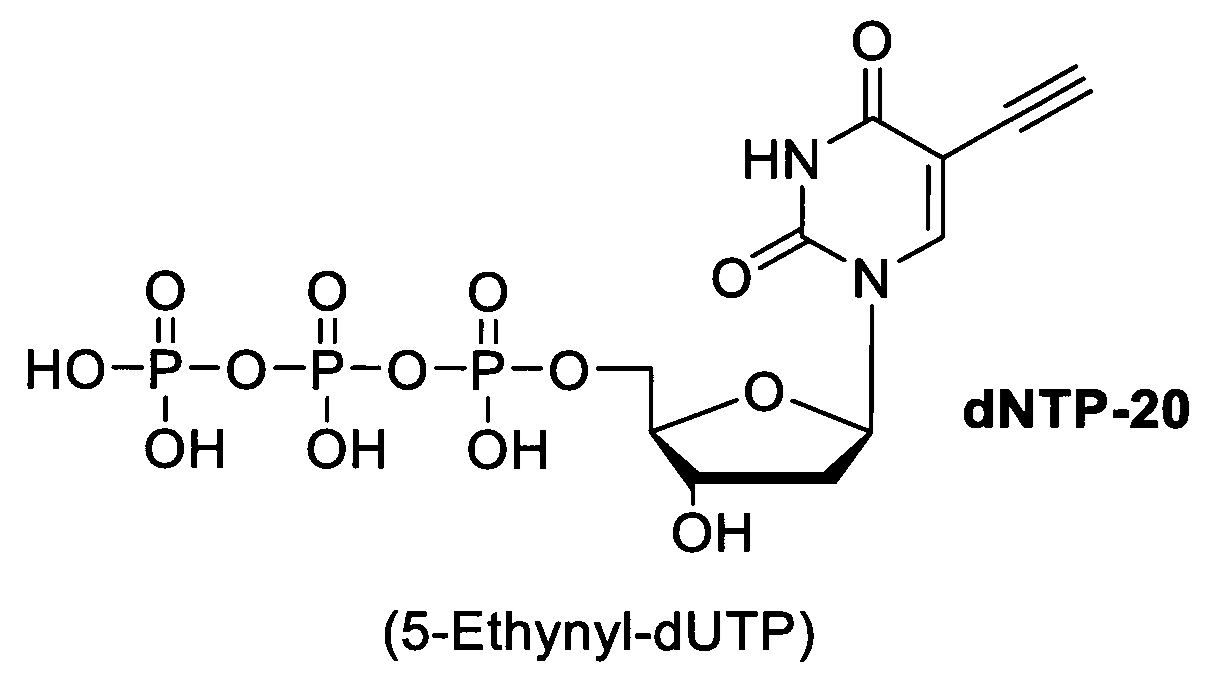
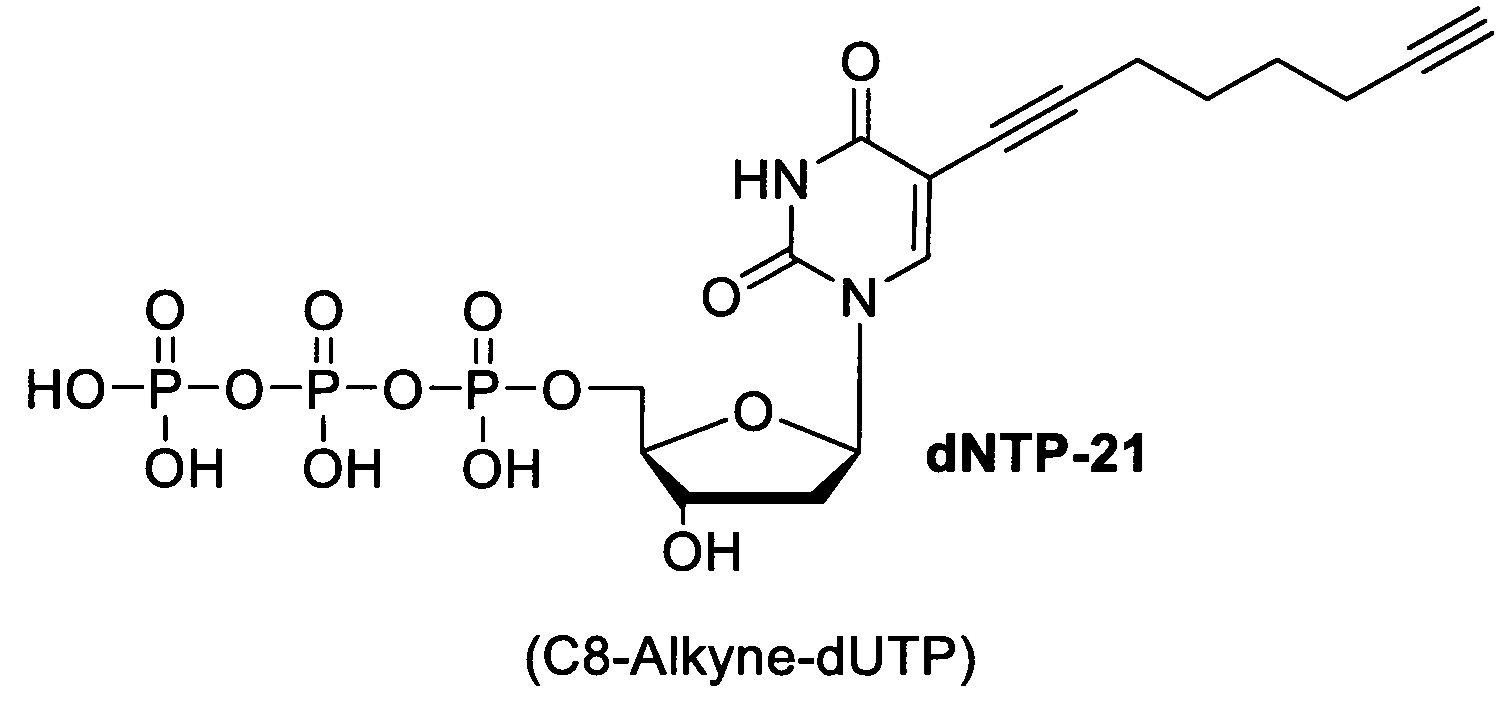
dNTP20 - 5'-(этинил)2'дезоксиуридинтрифосфат, dNTP21 - 5-(окта-1,7-диинил)-2'-дезоксиуридинтрифосфат
В дальнейшем синтезированная библиотека, содержащая в своем составе подобные неканонические нуклеотиды, может быть подвергнута обработке различными химическими реагентами, содержащими реактивный азид, например азидными производными фенилбороновой кислоты, такими как 2-азид-4-аминофенилбороновая кислота
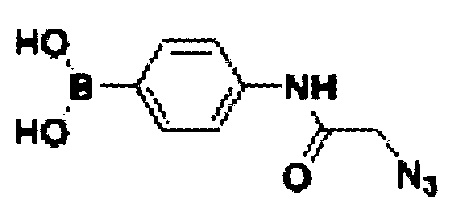
В результате реакции азид-алкинового присоединения образуются конечные сложномодифицированные олигонуклеотиды. Для проведения реакции водный раствор исходного нуклеозидтрифосфата смешивают с раствором 2-азид-4-аминофенилбороновой кислоты и после прибавляют раствор бромида меди (I), содержащий также вспомогательный лиганд ТВТА (трис[(1-бензил-1Н-1,2,3-триазол-4-ил)метил]амин). После выдержки в течение 2-5 часов (контроль по ВЭЖХ) продукты выделяют с помощью препаративной обращенно-фазовой ВЭЖХ.
2. После этого модифицированную подобным образом библиотеку инкубируют с белком-мишенью и отбирают аффинные варианты аптамеров.
3. После этого проводят амплификацию уже обогащенной библиотеки с использованием неканонических минимально-модифицированных нуклеотидов.
В данном случае полимераза использует и встраивает минимально-модифицированные основания, что не приводит к блокировке синтеза дочерней цепи, как это возникает при использовании сложномодифицированных нуклеотидов с громоздкими радикальными группировками. В качестве предпочтительной используется термостабильная высокоточная ДНК-зависимая ДНК полимераза DeepVent.
4. После амплификации проводят новый этап химической модификации минимально-модифицированных аптамеров и дальнейший отбор аффинных мишень-специфичных молекул.
Важным моментом данной технологии является использование коммерчески доступных нуклеотидов и химических реагентов, позволяющих создать достаточно сложные модификации без значительных потерь на этапе амплификации обогащенной библиотеки. Также такой способ позволяет проводить сложные химические модификации в короткий срок и персоналу, незнакомому с методиками химического синтеза модифицированных азотистых оснований.
Методика химической модификации уже созданной библиотеки олигонуклеотидов позволяет создать практически неограниченное количество возможных вариантов аптамеров и подобрать наиболее подходящие модификации с учетом химической структуры и свойств молекулы-мишени.
Техническим результатом осуществления изобретения является библиотека модифицированных с возможностью дальнейшей селекции из нее вариантов аптамеров к различным мишеням, представляющих собой клеточные рецепторы. Так, например, при осуществлении изобретения был получен модифицированный аптамер к клеточному рецептору CD 47.
Исходную библиотеку одноцепочечных ДНК-аптамеров составили последовательности длиной в 40 нуклеотидов каждая, дополнительно несущие с 5' и 3' концов последовательности, комплементарные прямому и обратному праймерам (5'-ATACCAGCTTATTCAATT-N40-AGATAGTAAGTGCAATCT-3'). N представляет собой случайный набор нуклеотидов А, Г, С8У, Ц, где С8У - минимально-модифицированный дезоксиуридин (С8-алкин-дУТФ). Для ПЦР-амплификации ДНК-библиотек и разделения одноцепочечных ДНК с помощью биотин-стрептавидиновой системы были использованы следующие праймеры: прямой праймер 1 - (5'-ATACCAGCTTATTCAATT-3') и обратный биотин-модифицированный праймер 2 - (5'-AGATTGCACTTACTATCT-3'). Прямой праймер 1 был модифицирован амидитом флуоресцеина (Fluorescein amidite, FAM) для последующего мониторинга процесса селекции с помощью проточного цитометра. Далее исходная синтезированная библиотека была подвергнута модификации с помощью реакции азид-алкинового присоединения, после чего инкубировалась с белком-мишенью CD47 с целью отбора наиболее аффинных вариантов аптамеров. Далее обогащенная библиотека была амплифицирована с использованием А, Г, С8У, Ц, после чего был осуществлен новый раунд модификации и селекции. Для отбора конечного аптамера было осуществлено 9 раундов селекции.
Пул одноцепочечных ДНК-аптамеров после девяти раундов селекции был амплифицирован с помощью ПНР для получения двухцепочечных последовательностей с применением праймеров, которые не были модифицированы, после чего данные фрагменты были клонированы в вектор методом ТА-клонирования (pAL-TA, Evrogen). Рекомбинантные плазмиды затем были трансформированы в Е. coli DH5α. Среди колоний, полученных с помощью сине-белой селекции, были случайным образом отобраны 50 колоний, которые были секвенированы. Для анализа последовательностей и их сравнения было использовано программное обеспечение DNAMAN 6.0 (Lynnon Biosoft, СА, USA). Для оценки вторичных структур секвенированных аптамеров использовалось он-лайн программное обеспечение МЕМЕ 4.10.2.
Синтезированные аптамеры были проанализированы с помощью иммунологического анализа в отношении селективности к лизату линии клеток U937. Для сорбции в лунки 96-луночного планшета вносилось по 100 мкл раствора, содержащего клеточный лизат, инкубация проводилась в термостатируемом шейкере для планшета при температуре 37°С в течение 3 часов с вибрацией 200 об/мин, после чего раствор удалялся из лунок, лунки подвергались промыванию и обработке в течение двух часов 4% раствором BSA в PBS.
Для проведения тестирования в каждую лунку вносилось равное количество тестируемого аптамера в PBS, концентрация аптамера составляла 1 нг/мкл, объем раствора 100 мкл (использовались варианты идентифицированных аптамеров, синтезированные с введением молекулы биотина на 5'-конце). После инкубации в течение 2-х часов в термостатируемом шейкере лунки подвергались троекратной отмывке для удаления несвязавшихся аптамеров, после чего к ним был добавлен раствор пероксидазы хрена (HRP), коньюгированной с авидином в растворе PBS, и проведена инкубация в течение 40 минут. Далее в лунки вносился реагент для детекции активности HRP на основе непреципитирующего раствора тетраметилбензидина. Через 5 минут после внесения реагента реакция останавливалась добавлением раствора серной кислоты, и показатели оптической плотности раствора определялись на планшетном спектрофотометре в оптическом канале 405 нм.
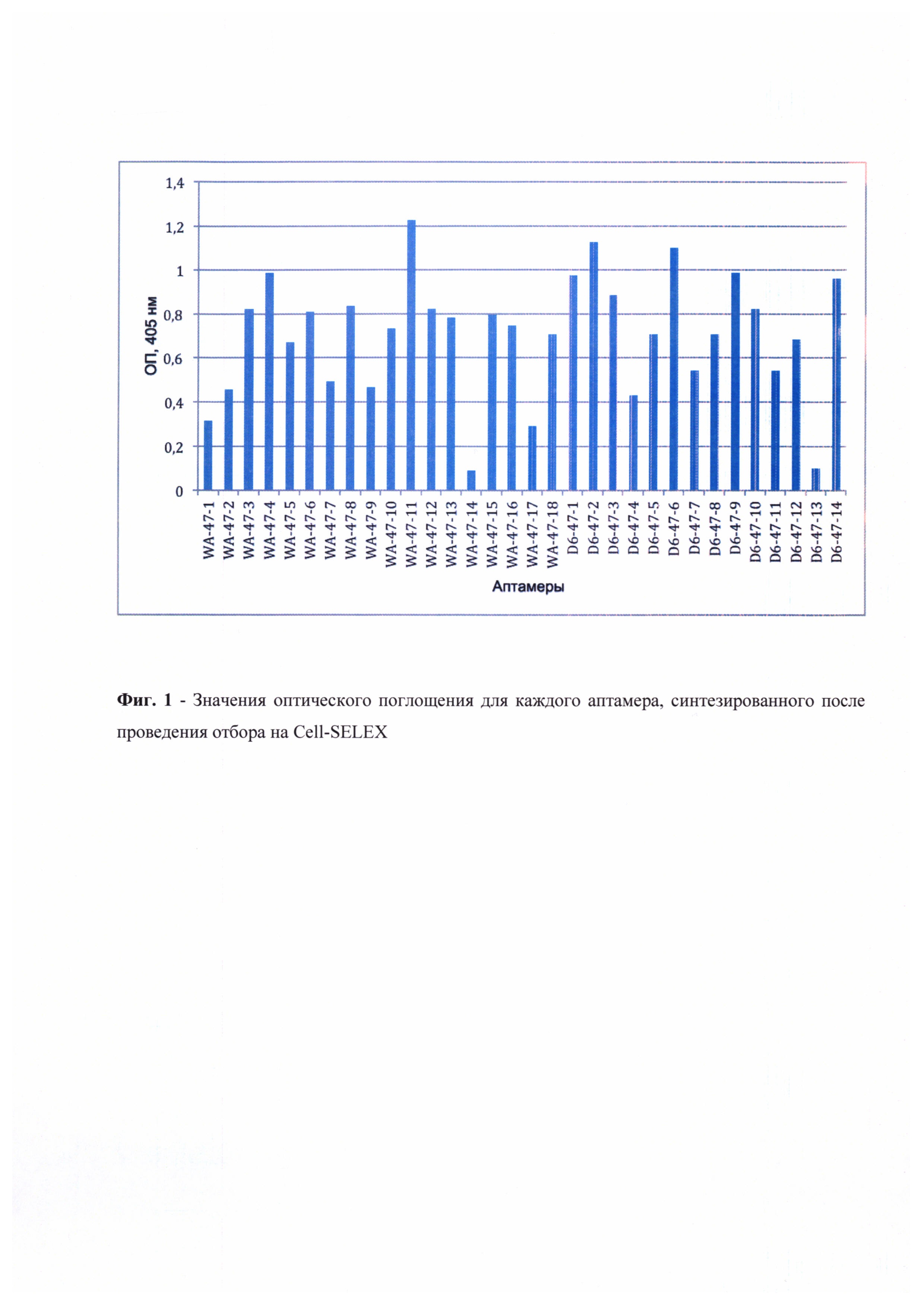
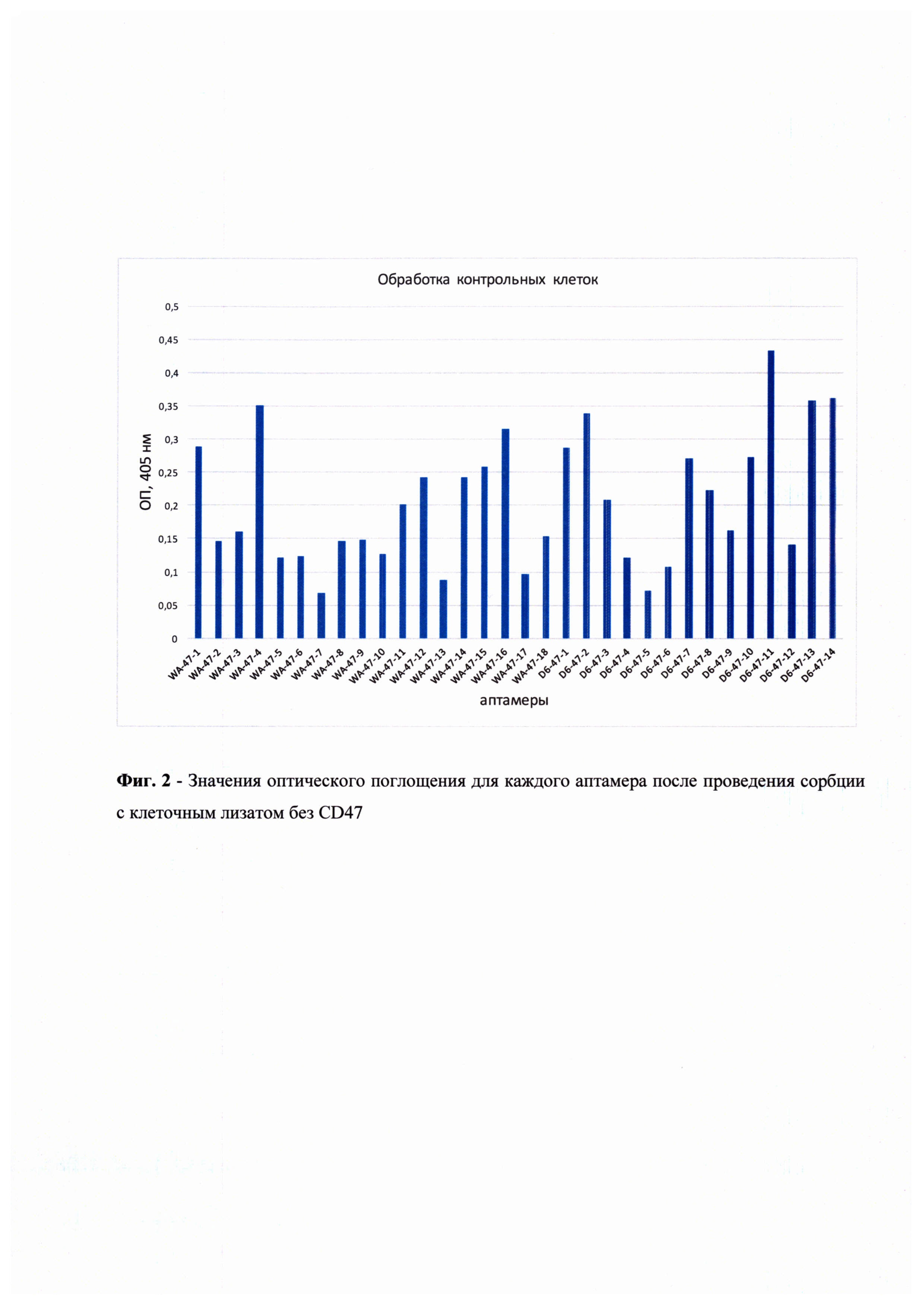
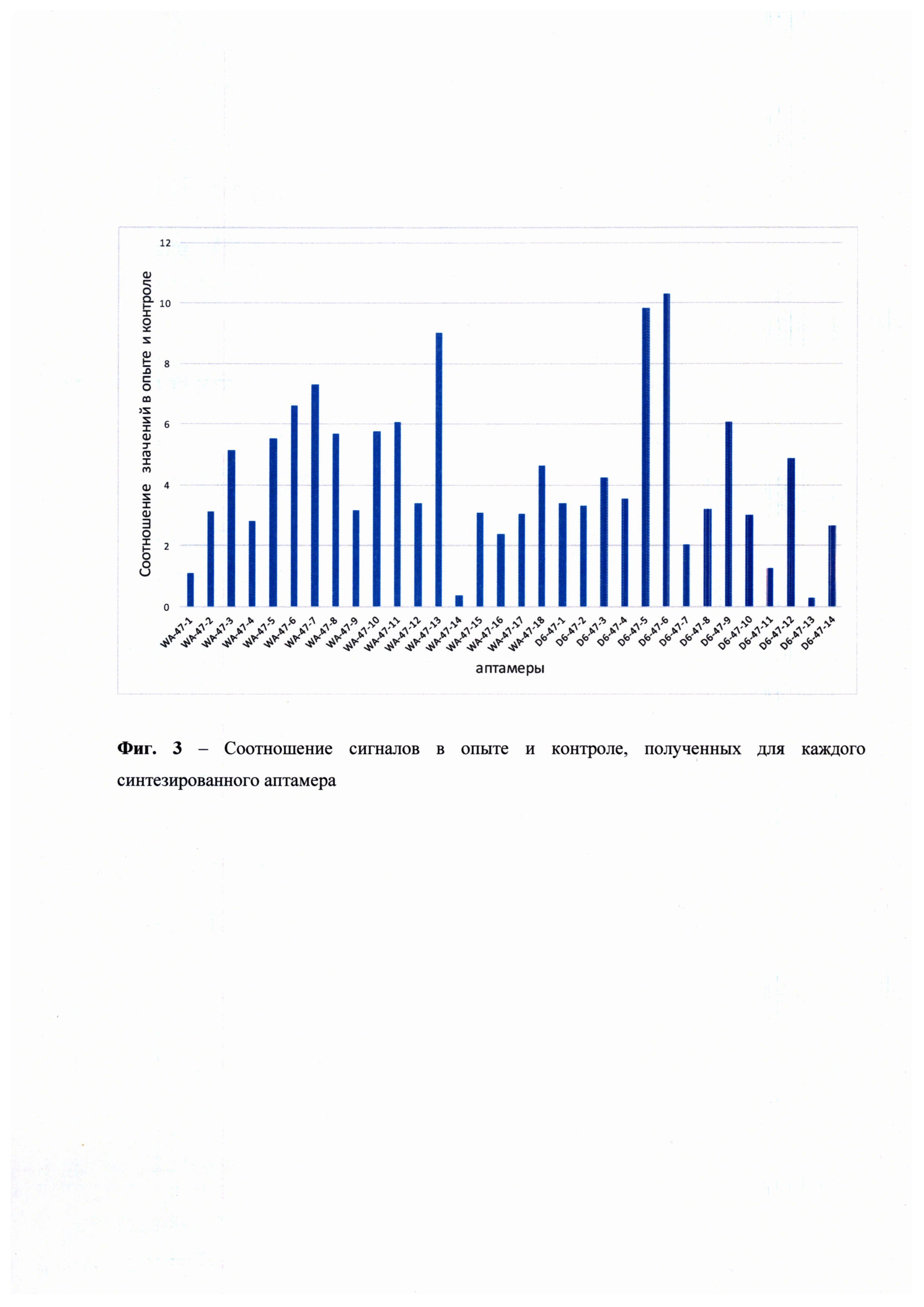
На основании полученных данных были построены графики, иллюстрирующие значения оптического поглощения связавшихся аптамеров от концентрации CD47 в условиях наличия в лунке посторонних белков клеточного лизата, а также в контрольных условиях, когда в лунках находился только чистый CD47 (Фиг. 1). В качестве отрицательного контроля для проверки специфичности действия тестируемых аптамеров аналогичный эксперимент был поставлен с использованием лизатов линии клеток, не экспрессировавшей CD47 (U937sh47) (Фиг. 2). Для определения наиболее эффективного и специфичного аптамера из числа протестированных было проведено сравнение сигналов в опытной и контрольной постановках (Фиг. 3) Исходя из полученных данных видно, что чувствительность аптамеров достаточно высока в отношении взаимодействия с рецептором CD47 на поверхности клеток U937. Итоговым аптамером-кандидатом выбран модифицированный аптамер D6-47-6 как продемонстрировавший максимальное соотношение уровней сигнала в опыте и контроле. Константа диссоциации отобранного аптамера, измеренная методом поверхностного плазмонного резонанса, составила 319 пмоль, что говорит о его высокой афинности к молекуле-мишени CD47. Тестирование ДНК-аптамера к CD47 на мышиной модели in vivo также показало его высокую эффективность действия.