Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ М-ХОЛИНОРЕАКТИВНОСТИ ЭРИТРОЦИТОВ
Вид РИД
Изобретение
Способ определения M-холинореактивности эритроцитов относится к экспериментальной биологии и медицине, к лабораторным способам исследования в физиологии и гематологии. Заключается в биохимическом определении реактивности эритроцитов к холинергическим веществам на основе торможения осмотического гемолиза в присутствии блокатора M-холинорецепторов атропина. Способ может быть использован в экспериментальных исследованиях и лабораторной диагностике.
Холинергические механизмы, наряду с адренергическими, занимают значительное место в регуляции функций организма. В многочисленных работах показано наличие различных подтипов M-холинорецепторов на мембранах кардиомиоцитов, гладких мышечных клеток и других [12, 13, 14], в том числе на мембранах форменных элементов крови [5, 8, 11, 16, 17].
Одним из общеизвестных способов определения холинореактивности организма является метод атропиновой пробы. Суть метода заключается в определении степени изменения ЧСС и артериального давления при введении в организм атропина. Реактивность оценивается по отклонению показателей от исходных значений, измеренных в покое [4]. Главными недостатками данного способа является наличие ряда побочных эффектов при введении препарата в организм: значительная и продолжительная тахикардия, расширение зрачка и нарушение аккомодации, атония кишечника и др.
Известен способ оценки M-холинореактивности по изменению амплитуды и скорости сокращения изолированных полосок тканей и органов (миокарда, матки, аорты) при воздействии ацетилхолина. Регистрация сокращений производится с помощью миоцитографа с проточной камерой [6, 7]. Недостатками работы с изолированными органами является потребность в дорогостоящем оборудовании, необходимости оперативного вмешательства в организм, ограниченность сроков работы с препаратом, невозможность отследить изменение изучаемого свойства у одного и того же организма в разных функциональных состояниях.
Существует способ определения M-холинореактивности эритроцитов, заключающийся в определении скорости агглютинации эритроцитов человека в присутствии ацетилхолина и атропина [5]. Способ основан на данных о наличии в мембранах эритроцитов M-холинорецепторов [16, 17] и заключается в проведении реакции агглютинации эритроцитов в стандартной сыворотке группы 0αβ (I) в отсутствии ацетилхолина (контроль) и при его присутствии в среде инкубации в концентрациях 5,5×10-10 - 5,5×10-6 M. Недостатком способа является необходимость использования гемагглютинирующих сывороток, что возможно при работе с кровью человека, но неприменимо в работе с кровью лабораторных животных из-за видовой специфичности факторов агглютинации. Приобретение видоспецифичных сывороток для лабораторных животных является дорогостоящим.
Задачей предлагаемого изобретения является создание способа оценки M-холинореактивности эритроцитов крови, который удобен и прост в реализации, может применяться для работы с кровью человека, а также лабораторных животных при различных функциональных состояниях организма и в условиях разнообразных экспериментальных моделей, позволит оперативно получать достоверные результаты.
Поставленная задача решается с помощью предлагаемого способа определения M-холинореактивности эритроцитов, состоящего в модификации метода оценки β-адренореактивности мембран эритроцитов авторов Стрюк Р.И. и Длусской И.Г. (2003) [2].
В основе метода-прототипа [2] лежит определение степени торможения гипоосмотического гемолиза в присутствии β-адреноблокатора. Для этого определяют оптическую плотность надосадочной жидкости контрольной (гипотонический раствор 0,4% NaCl) и опытной проб (гипотонический раствор 0,4% NaCl совместно с β-адреноблокатором). β-Адренореактивность оценивается по проценту оптической плотности опытных проб относительно контрольных проб. Высокие значения β-адренореактивности мембран означают низкую чувствительность адренорецепторов мембран, а низкие значения β-адренореактивности мембран - высокую чувствительность адренорецепторов. Способ рекомендован для изучения природы артериальной гипертензии. Недостатками способа [2] являются: отсутствие возможности оценки реактивности к другим регуляторным факторам, в частности холинергической природы; анализ результатов на основе обратных зависимостей между снижением гемолиза, адренореактивностью и чувствительностью рецепторов клеточных мембран.
Для определения M-холинореактивности предлагается использовать вместо β-адреноблокатора блокатор M-холинорецепторов - атропин. Обоснованием для такого подхода являются данные о присутствии M-холинорецепторов на мембранах форменных элементов крови человека и животных [5, 9, 11, 16, 17], а также тот факт, что M-холинорецепторы в различных органах и тканях человека и животных имеют сходную структуру [12]. Доказана способность ацетилхолина через M-холинорецепторы активизировать сигнальные каскады, приводящие к активации инозиол-3-фосфат-зависимых Ca2+-каналов, что повышает вход Ca2+ в эритроциты и выход из них K+ [14]. Входящий в эритроцит Ca2+ активирует протеинкиназу C, которая фосфорилирует белки полос 4.1 и 4.9, что повышает микровязкость мембраны эритроцита [10, 15]. Рост микровязкости мембраны происходит также за счет деструкции липидного бислоя и уменьшения белково-липидных контактов под влиянием комплекса «Ca2+-кальмодулин» и Ca2+-кальмодулинзависимой протеинкиназы [4]. Эти изменения свойств мембраны способны снизить устойчивость эритроцитов к гемолизу. Таким образом, атропин как блокатор M-холинорецепторов, способен повлиять на устойчивость эритроцитов к гемолизу в сторону ее повышения.
Суть модификации метода Стрюк Р.И. и Длусской И.Г. [2] заключается в том, что вместо адренореактивного вещества (пропранолола) в опытную пробу вносится 0,1 мл раствора M-холиноблокатора атропина в концентрации 0,4 мг/мл для получения конечной концентрации в среде инкубации эритроцитов - 15×10-6 мг/мл. При выборе концентрации учитывались данные литературы [5, 8]. M-холинореактивность эритроцитов рассчитывается как степень снижения осмотического гемолиза в присутствии атропина на основе разницы оптических плотностей надосадочной жидкости контрольной (инкубация без атропина) и опытной (инкубация с атропином) проб.
Предлагаемый способ даст возможность определять M-холинореактивность эритроцитов на основе торможения атропином осмотического гемолиза в среде инкубации, что позволит объективно оценивать свойство холинореактивности без побочных эффектов от введения атропина в организм, без оперативного вмешательства и иссечения органов для подготовки изолированных тканей, не требует дорогостоящего, технически сложного оборудования и специфических гемагглютинирующих сывороток в случае проведения исследований на лабораторных животных. Использование небольшого объема крови (200 мкл на анализ) дает возможность проводить определение показателя у одного и того же организма многократно при различных функциональных состояниях и в условиях разнообразных экспериментальных моделей.
Отличительными признаками заявленного способа по сравнению с другими способами оценки холинореактивности [4, 5, 6, 7] и метода-прототипа [2] являются: возможность определения M-холинореактивность эритроцитов крови человека и животных биохимическим путем, что придает способу универсальность, а его использование наряду с определением β-адренореактивности мембран эритроцитов, расширяет лабораторную базу исследования регуляторных процессов и свойств эритроцитов; определение M-холинореактивности эритроцитов в среде инкубации, что исключает введение в организм препаратов (атропина, ацетилхолин), способных вызвать побочные эффекты; возможность забора небольшого количества крови (200 мкл на одно исследование) позволяет проводить наблюдение за динамикой показателя у одного и того же организма в разных функциональных состояниях и экспериментальных условиях, дает возможность повторить исследование и уточнить результат при необходимости; отсутствие потребности в предварительной подготовке, в технически сложном и дорогостоящем оборудовании и реактивах, что делает способ легко реализуемым и экономически выгодным.
Техническим результатом от реализации заявляемого способа является упрощение оценки M-холинореактивности эритроцитов крови человека и животных в различных функциональных состояниях при повышении достоверности результатов.
Предлагаемый способ реализуется следующим образом. Готовятся реактивы:
1. Фосфатный буфер: для приготовления  концентрированного фосфатного буфера необходимо взять
концентрированного фосфатного буфера необходимо взять 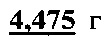 натрий фосфорнокислый двузамещенный 12-водный (Na2HPO4*12H2O),
натрий фосфорнокислый двузамещенный 12-водный (Na2HPO4*12H2O), 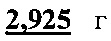 натрий фосфорнокислый однозамещенный 2-водный (NaH2PO4*2H2O) и
натрий фосфорнокислый однозамещенный 2-водный (NaH2PO4*2H2O) и 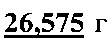 натрий хлористый (NaCl) и растворить в
натрий хлористый (NaCl) и растворить в 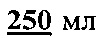 дистиллированной воды. Полученный раствор концентрата буфера можно хранить при температуре не выше 15°С в течение 1 месяца. Для определения взять 10 мл концентрата буфера и довести до
дистиллированной воды. Полученный раствор концентрата буфера можно хранить при температуре не выше 15°С в течение 1 месяца. Для определения взять 10 мл концентрата буфера и довести до 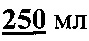 дистиллированной водой;
дистиллированной водой;
2. Раствор атропина (0,4 мг/мл): Для приготовления раствора атропина необходимо взять 2 мл раствора атропина сульфата ((C17H23NO3)2⋅H2SO4) с концентрацией 1 мг/мл и довести его объем до 5 мл дистиллированной водой. Из этого раствора для определения брать 0,1 мл;
3. Антикоагулянт: гепарин натрия (5000 ЕД/мл) - 0,02 мл.
Ход работы:
Для исследования необходимо получить 0,2 мл цельной крови. У лабораторных крыс кровь забирают из хвостовой вены по общепринятой методике [1]. У человека набирают необходимое количество крови из пальца традиционным способом [3]. 0,2 мл цельной крови вносят в пробирку с 0,2 мл физиологического раствора и 0,02 мл гепарина, аккуратно перемешивают. Приготовленный таким образом образец крови годится для дальнейшей обработки в течение 3-х часов при комнатной температуре.
Из каждого анализируемого образца крови готовится 4 пробы: две контрольные и две опытные. Для этого необходимо взять 4 чистые центрифужные пробирки и внести в них реактивы и анализируемую кровь по схеме
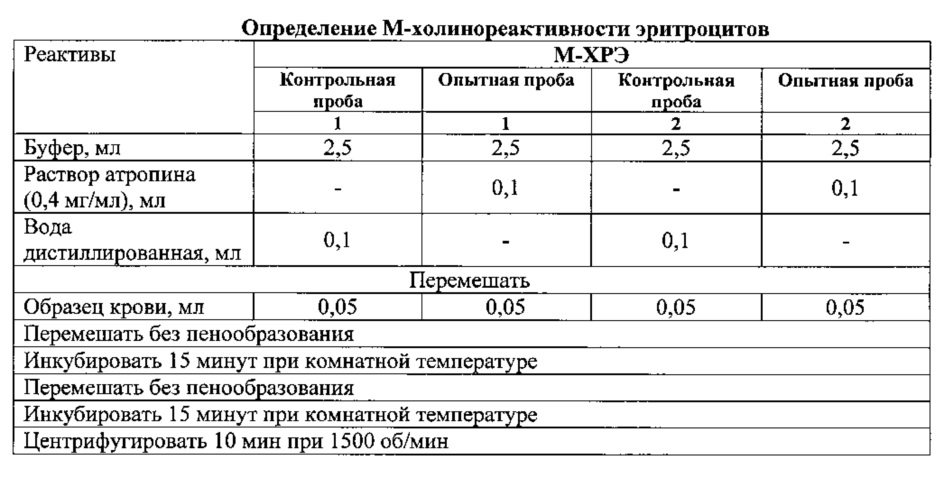
После центрифугирования определяется оптическая плотность надосадочной жидкости всех проб при длине волны 540 нм.
Величину показателя M-холинореактивности эритроцитов (М-ХРЭ) предлагается рассчитывать по формуле
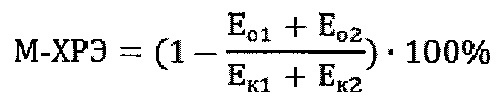
где М-ХРЭ - величина показателя M-холинореактивности эритроцитов, отн. ед.; Eo1 и Eo2 - оптические плотности опытных проб, ед. опт. плотн.; Eк1 и Ек2 - оптические плотности контрольных проб, ед. опт. плотн.
Согласно данной формуле М-ХРЭ определяется как процент, на который гемолиз в опытных пробах ниже, чем в контрольных. Это позволяет определить именно реактивность гемолиза на присутствующий в среде атропин и, в отличие от способа-прототипа [2], перейти от анализа обратных зависимостей к анализу прямых зависимостей между величиной М-ХРЭ и чувствительностью M-холинорецепторов. То есть расценивать высокие значения М-ХРЭ как показатель высокой чувствительности M-холинорецепторов, низкие значения М-ХРЭ - как показатель низкой чувствительности M-холинорецепторов.
С помощью предлагаемого способа проведены обследования 117 самцов нелинейных крыс, у которых была взята кровь на определение фоновой или исходной М-ХРЭ для выявления фактических значений показателя, сопоставления их со значениями β-АРЭ, определенного по способу-прототипу [2], анализа динамики показателя М-ХРЭ в условиях изменения функционального состояния организма и его регуляторного аппарата.
Пример 1.
Анализ фоновых значений М-ХРЭ, степени их варьирования в выборке нелинейных крыс.
Забор крови проводился из хвостовой вены животных по общепринятой методике [1]. 0,2 мл цельной крови вносили в пробирку с 0,2 мл физиологического раствора и 0,02 мл гепарина, аккуратно перемешивали. Из приготовленного образца крови готовили 2 контрольных и 2 опытных пробы. Все пробы готовились на фосфатном буфере (2,5 мл). В контрольные пробы добавляли 0,1 мл дистиллированной воды и 0,05 мл анализируемой крови. В опытные пробы - 0,1 мл раствора атропина (0,4 мг/мл) и 0,05 мл анализируемой крови. Пробы аккуратно перемешивали и инкубировали при комнатной температуре 30 минут. Затем пробы центрифугировали 10 минут при 1500 об/мин. Отбирали надосадочную жидкость и измеряли ее оптическую плотность на спектрофотометре APEL DD-303UV. М-ХРЭ рассчитывается как степень снижения осмотического гемолиза в присутствии атропина на основе разницы оптических плотностей надосадочной жидкости контрольных и опытных проб.
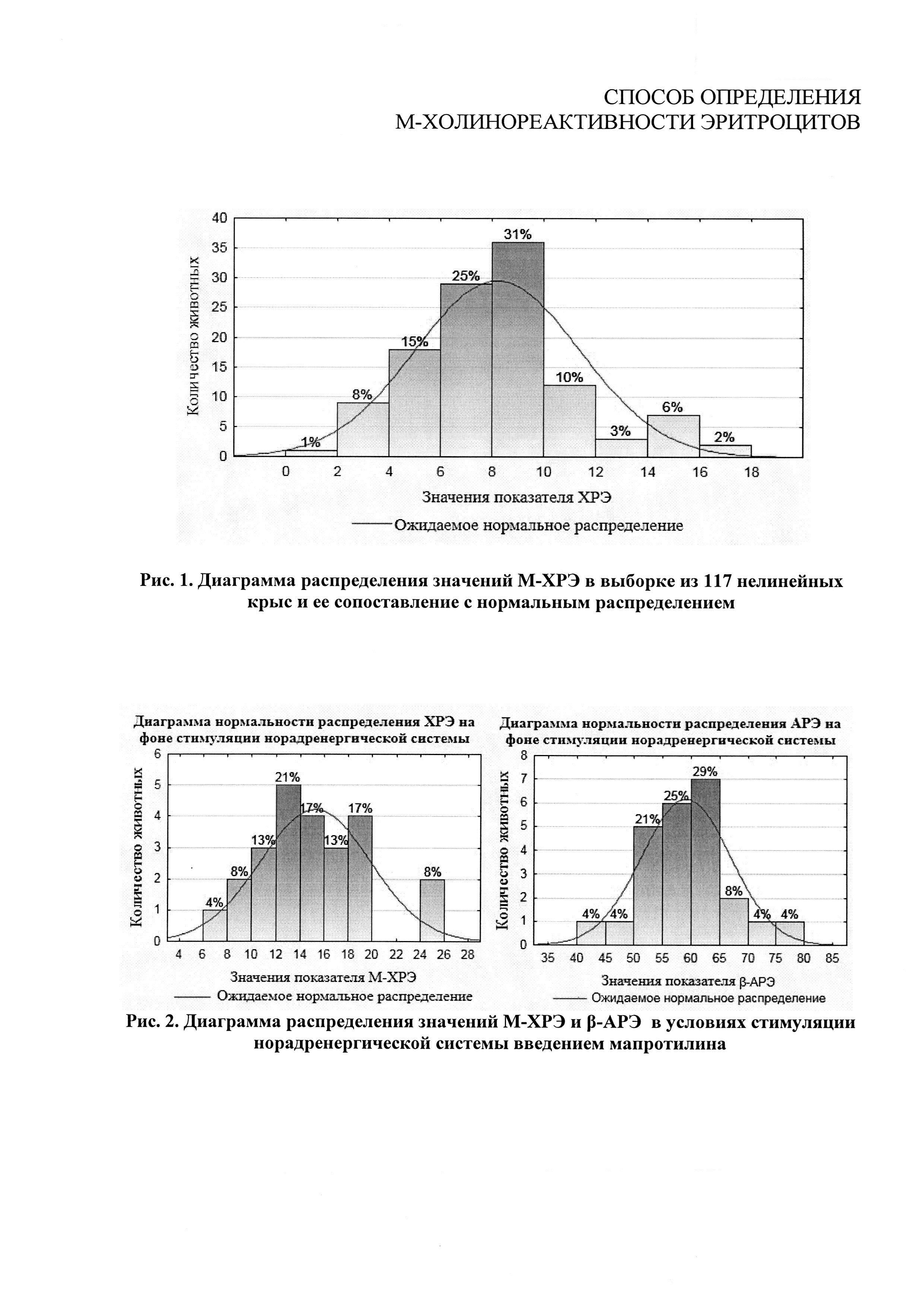
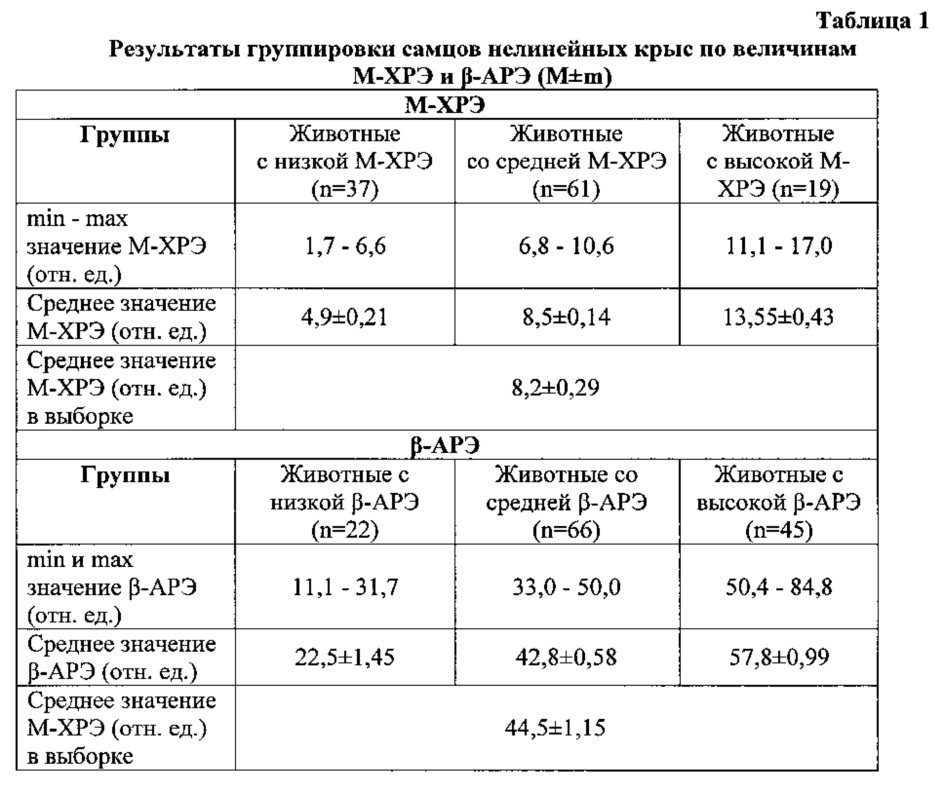
В результате определения М-ХРЭ таким способом получены фактические значения показателя, на основе которых построен вариационный ряд (рис. 1). Как видно из диаграммы, минимальное и максимальное значения составляют 1,7 и 17,0 отн. ед. соответственно. Вариационный ряд в диапазоне от минимальной до максимальной величины соответствует нормальному распределению. Центром вариационного ряда являются два четко выраженных пика, на которые приходится 25% и 31% всех значений М-ХРЭ выборки. Границе этих классов соответствует среднее значение М-ХРЭ - 8,2±0,29 отн. ед.
В результате проведенного кластерного анализа методом k-средних была осуществлена группировка особей по величине М-ХРЭ. К группе со средней М-ХРЭ отнесены животные с величинами показателя от 6,8 до 10,6 отн. ед. В группу с низкой М-ХРЭ вошли особи со значениями от 1,7 до 6,6 отн. ед., а в группу с высокой М-ХРЭ - животные с величинами М-ХРЭ между 11,1 и 17,0 отн. ед. Средние значения для групп с низкой, средней и высокой М-ХРЭ равны 4,9±0,21, 8,5±0,14 и 13,55±0,43 отн. ед. соответственно (табл. 1). Группа-кластер со средней М-ХРЭ является самой многочисленной (61 шт.), самой малочисленной (19 шт.) - группа с высокими значениями М-ХРЭ. Это говорит о том, что среди самцов нелинейных крыс в 52% случаев встречаются животные со средней М-ХРЭ, и лишь в 16% случаев особи с высокой М-ХРЭ. Около 84% значений М-ХРЭ находится в пределах средних и низких величин (от 1,7 до 10,6 отн. ед.).
При сопоставлении фоновых значений М-ХРЭ со значениями β-АРЭ, определенными у тех же животных методом Стрюк Р.И. и Длусской И.Г. (2003) [2] установлено, что величины М-ХРЭ крыс в среднем в 5 раз ниже, а разброс их значений уже, чем значений β-АРЭ. Также у большинства животных определяются средние и высокие значения β-АРЭ. Таким образом, показатели М-ХРЭ и β-АРЭ, определенные у одних и тех же животных и одних и тех же образцах крови, существенно отличаются по абсолютным величинам, характеру варьирования в выборке и могут рассматриваться как два самостоятельных показателя.
Пример 2.
Исследование М-ХРЭ при введении в организм атропина.
Задача состояла в том, чтобы определить, изменяется ли М-ХРЭ при введении в организм животных атропина в дозе 1 мг/кг м.т. У 12 самцов крыс определили фоновую М-ХРЭ - 11,4±2,25 отн. ед. После введения атропина М-ХРЭ в среднем по группе снизилась до 6,3 7±1,17 отн. ед. (p<0,0607), что указывает на снижение чувствительности M-холинорецепторов, так как значительная часть из тех, что присутствуют на мембранах, блокируются введенным атропином. То есть введение блокатора M-холинорецепторов в организм снижает M-холинореактивность эритроцитов.
Пример 3.
Исследование М-ХРЭ и β-АРЭ в условиях острого стресса.
Задача заключалась в оценке изменений М-ХРЭ, а также для сравнения β-АРЭ, в условиях острого стресса. Показатели определяли в состоянии спокойного бодрствования до начала стрессирования. Затем животных подвергали острому эмоционально-болевому стрессу, который вызывали путем иммобилизации животных в пеналах из плексигласа в течение 1 ч в сочетании с электрокожным раздражением хвоста по стохастической схеме пороговыми значениями переменного тока. Из данных табл.2 следует, что острый стресс вызывает снижение М-ХРЭ в 2 раза (p<0,01), в то время как β-АРЭ снижается на 31,2% от уровня в покое (p<0,05). Следовательно, показатели изменяются однонаправлено, но в разной степени, что подтверждает их самостоятельную значимость и изменчивость при изменении функционального состояния организма.

Пример 4.
Исследование М-ХРЭ и β-АРЭ при стимуляции норадренергической системы.
Задача состояла в выяснении того, в каком направлении и в какой мере М-ХРЭ, а также β-АРЭ, изменяются при повышении активности норадренергической нейромедиаторной системы организма. У 24 самцов крыс определили фоновую (исходную) М-ХРЭ - 8,3±0,46 отн. ед., а также для сравнения β-АРЭ - 48,4±1,56 отн. ед. Стимуляцию норадренергической системы осуществляли четырехкратным введением мапротилина (10 мг/кг м.т. внутрибрюшинно). Из табл. 3 и рис. 2 видно, на фоне активации норадренергической системы отмечался рост обоих показателей, в выборке животных увеличивается доля особей с высокими значениями обоих показателей. Так, М-ХРЭ выросла на 83% (p<0,001), а β-АРЭ на 22% (p<0,001) по сравнению с исходным состоянием. Как видно из результатов, стимуляция норадренергической системы сопровождается почти двукратное увеличением М-ХРЭ, в отличии от β-АРЭ. Следовательно, М-ХРЭ изменяется в экспериментальных условиях независимо от β-АРЭ и несет свою информационную нагрузку, а повышение значение показателя свидетельствует о росте чувствительности M-холинорецепторов в условиях примененного экспериментального воздействия.

Предлагаемый способ определения M-холинореактивности эритроцитов универсален, технически прост, легко воспроизводим, позволяет проводить измерения у одного и того же организма в динамике функциональных состояний и в условиях разнообразных экспериментальных моделей, дает возможность оперативно получить достоверные результаты. Способ дополняет и расширяет методическую базу экспериментальных исследований регуляторных процессов и свойств эритроцитов, при дополнительных уточнениях может быть применим к человеческой крови и использоваться в диагностических целях как самостоятельный показатель или в комплексе с определением бета-адренореактивности мембран.
Используемая литература
1. Большой практикум по физиологии человека и животных: учеб. пособие для студ. вузов в 2 т. / Под ред. А.Д. Ноздрачева. - М.: Издательский центр «Академия», 2007. - 608 с.
2. Длусская И.Г., Стрюк Р.И. Способ определения гипераденерической формы гипертонической болезни. Патент РФ №2026552. БИ, 1995, №1.
3. Медицинские лабораторные технологии: руководство по клинической лабораторной диагностике: в 2 т. / Под ред. А.И. Карпищенко. - 3-е изд., перераб. и доп. - Т. 2. - М.: ГЭОТАР-Медиа, 2013. - 792 с.
4. Соловьева А.Д., Данилов А.Б., Хаспекова Н.Б. Методы исследования вегетативной нервной системы // В кн.: Вегетативные расстройства: Клиника, диагностика, лечение. Под ред. A.M. Вейна. - М.: ООО «МИА», 2003. - С. 44-108.
5. Стрельникова А.И., Циркин В.И., Крысова А.В., Хлыбова С.В., Дмитриева С.Л. M-холинореактивность эритроцитов небеременных и беременных женщин, определяемая по изменению скорости агглютинации эритроцитов под влиянием ацетилхолина // Бюллетень экспериментальной биологии и медицины. - 2012. - №8. - С. 140-143.
6. Торопов А.Л., Коротаева К.Н. Самоделкина Е.О., Циркин В.И., Вязников В.А. Влияние лизофосфатидилхолина на адрено- и м-холинореактивность гладких мышц и миокарда // Вестник НГУ. Серия: Биология, клиническая медицина. - 2010. - Т. 8. Вып. 3. - С. 18-26
7. Чулкина Е.А., Циркин В.И. Роль эндотелия коронарной артерии свиньи в реализации сократительных эффектов ацетилхолина // Вестник Северного (Арктического) федерального университета. Серия: Естественные науки. - 2013. - №1. - С. 94-101.
8. Carvalho F.A., Mesquita R., Martins-Silva J., Saldanha С Acetylcholine and choline effects on erythrocyte nitrite and nitrate levels // J Appl. Toxicol. - 2004. - Vol. 24, N 6. - P. 419-27.
9. Dalefield R.R, Oehme F.W. The presence of a muscarinic receptor on canine erythrocyte membranes // General Pharmacology: The Vascular System. - 1999. - Vol. 32, Is. 3. - P. 341-344.
10. Faquin W.C., Chahwala S.B., Cantley L.C, Branton D. Protein kinase С of human erythrocytes phosphorylates bands 4.1 and 4.9. Biochim. Biophysica Acta. - 1986. - Vol. 887, N. 2. - P. 142-149.
11. Guschin G.V., Jakovleva E.E., Kataeva G.V., Korneva E.A., M. Gajewski. Muscarinic cholinergic receptors of rat lymphocytes: effect of antigen stimulation and local brain lesion // Neuroimmunomodulation. - 1994. - Vol. 1, N. 4. - P. 259-264.
12. Klapproth H., Reinheimer Т., Metzen J., Munch M., Bittinger F., Kirkpatrick C.J., Hohle K.D., Schemann M., Racke K., Wessler I. Nonneuronal acetylcholine, a signaling molecule synthezised by surface cells of rat and man // Naunyn Schmiedebergs Arch. Pharmacol. - 1997. Vol. 355. - P. 515-523.
13. Levey A.I. Immunological localization of m1-m5 muscarinic acetylcholine receptors in peripheral tissues and brain // Life Sci. - 1993. - Vol. 52 N. 5-6. - P. 441-448.
14. Nathanson N.M. Muscarinic Acetylcholine Receptors // Encyclopedia of Biological Chemistry. - 2013. - P. 215-217.
15. Postnov Y.V., Kravtsov G.M., Orlov S.N., Pokudin N.I. Effect of protein kinase С activation on cytoskeleton and cation transport in human erythrocytes. Reproduction of some membrane abnormalities revealed in essential hypertension. Hypertension. - 1988. - Vol. 12. P. 267-273.
16. Tang L.C. Human erythrocyte as a model for investigating muscarinic agonists and antagonists // Gen. Pharmacol. - 1991. - Vol. 22, N. 3. P. 485-490.
17. Tang L.C. Identification and characterization of human erythrocyte muscarinic receptors // General Pharmacology: The Vascular System. - 1986. - Vol. 17, Is. 3. - P. 281-285.
Способ определения М-холинореактивности эритроцитов крови на основе снижения гипоосмотического гемолиза эритроцитов в присутствии атропина, включающий забор крови (0,2 мл) у человека или животных для анализа, подготовку раствора атропина с концентрацией 0,4 мг/мл, инкубацию образца крови в гипоосмотической среде в отсутствии (контрольная проба) и присутствии атропина в конечной концентрации 15×10 мг/мл (опытная проба) с последующим определением оптической плотности надосадочной жидкости проб и расчетом значения М-холинореактивности эритроцитов как процента, на который гемолиз в опытных пробах ниже, чем в контрольных, отличающийся тем, что М-холинореактивность эритроцитов определяется биохимическим методом при инкубации образцов крови в присутствии атропина и за величину М-холинореактивности эритроцитов принимается процент, на который гемолиз в опытных пробах ниже, чем в контрольных.