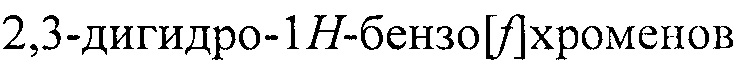Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХРОМАН-2-АМИНОВ
Вид РИД
Изобретение
Изобретение относится к способу получения хроман-2-аминов, содержащих во втором положении дигидропиранового цикла остаток вторичного амина. Интерес к разработке новых эффективных методов синтеза N,O-ацеталей гетероциклического ряда, в частности хроман-2-аминов, обусловлен широким спектром биологического действия подобного типа соединений. Среди хроман-2-аминов и их арено- и гетероконденсированных аналогов выявлены соединения, обладающие антитромботической [1, 2], противораковой активностью (например, 2-морфолино-8-фенилхроман-4-он (LY294002)) [3, 4], а также являющиеся нестероидными антагонистами глюкокортикоидного рецептора (например, 4-[9-(2-метил-1H-индол-3-ил)-7-нитро-1,2,3,4,9,9а-гексагидро-4aH-ксантен-4а-ил]морфолин (NC3327)) [5]. Кроме того, подобного типа соединения являются эффективными предшественниками 2-(3-аминопропил)фенолов, которые могут быть получены при гидрировании хроман-2-аминов [6]. Данный подход был использован при синтезе лекарственного препарата толтеродин и его аналогов, являющихся антагонистами мускариновых рецепторов и использующихся при лечении урологических заболеваний [7, 8].
Данным изобретением решена задача разработки нового высокоэффективного способа получения хроман-2-аминов, содержащих остаток вторичного амина гетероциклического ряда в α-положении к атому кислорода дигидропиранового цикла.
Формула изобретения - способ получения 3-аминозамещенных 2,3-дигидро-1H-бензо[ƒ]хроменов и 2-аминозамещенных хроманов конденсацией трифторацетилхроменов и вторичных циклических аминов в мольном соотношении 1:2 в метанольном растворе при комнатной температуре.
В литературе представлено ограниченное число способов получения хроман-2-аминов: взаимодействие хроман-2-олов со вторичными аминами [1, 2, 7-9], трехкомпонентная конденсация 2-нафтола, 3-гидрокси-2,2-диалкилпропаналя и вторичных аминов в присутствии n-толуолсульфокислоты [10], взаимодействие предшественников о-хинонметидов с замещенными енаминами в условиях реакции Дильса-Альдера [3, 5, 11-16], а также реакция енаминов с о-гидрокси-ω-нитростиролами [17] или 2-гидроксибензальдегидами [18]. Следует отметить, что указанные методы имеют ряд ограничений. Исходные соединения часто труднодоступны и их синтез в ряде случаев представляет самостоятельную синтетическую задачу. При этом полученные хроман-2-амины и их конденсированные аналоги, как правило, содержат различные заместители в 3-ем и/или 4-ом положениях дигидропиранового цикла, вследствие чего незамещенные по этим положениям хроман-2-амины остаются труднодоступными соединениями. Одним из очевидных подходов к их получению могло бы быть [4+2]-циклоприсоединение между N-виниламинами и предшественниками о-хинонметидов. Однако большинство N-виниламинов коммерчески не доступны, их синтез сопряжен с рядом трудностей [19, 20], либо они не известны. Кроме того, енамины подобного типа часто термически неустойчивы и подвергаются полимеризации [20].
Наиболее близким по конечному результату к заявляемому способу является трехкомпонентная конденсация фенолов, коричного альдегида и вторичных аминов, в том числе гетероциклического ряда [21]. В качестве примера можно привести взаимодействие n-крезола, коричного альдегида и пиперазина. Способ заключается в том, что смесь 1 экв. n-крезола и 0.6 экв. пиперазина нагревают в толуоле при кипении в течение 30 мин с насадкой Дина-Старка с азеотропной отгонкой воды. Далее прибавляют 1.5 экв. коричного альдегида и смесь продолжают кипятить с насадкой Дина-Старка еще в течение 4 ч. Полученный раствор охлаждают до комнатной температуры и выпавший осадок фильтруют [7].
Указанный способ обладает рядом существенных недостатков:
1. Данный способ позволяет получать только хроман-2-амины, содержащие в 4-ом положении арильный заместитель.
2. В реакцию вводились исключительно фенолы, содержащие электронодонорные заместители в бензольном ядре.
3. Необходимость азеотропной отгонки воды для смещения равновесия и использования огнеопасного толуола.
4. Продукты часто образуются в виде трудноразделимой смеси стереоизомеров.
Полученный нами технический результат - принципиально иной способ синтеза 3-аминозамещенных 2,3-дигидро-1H-бензо[ƒ]хроменов, не содержащих заместителей в 1-ом и 2-ом положениях, общей формулы I и 2-аминозамещенных хроманов общей формулы II:
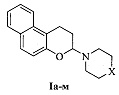
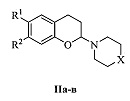
где X: О (Ia), CH2 (Iб), CHPh (Iв), CHCH2Ph (Iг), СНОН (Iд), C(OH)Ph (Ie), (СН2)2 (Iж), NCH3 (Iз), NPh (Iи), N-(2-CH3C6H4) (Iк), N-(2-CH3OC6H4) (Iл), N-(2-пиримидил) (Iм); R1, R2, X: Cl, Н, О (IIa), СН3, СН3, О (IIб), СН3, СН3, N-(4-FC6H4) (IIв).
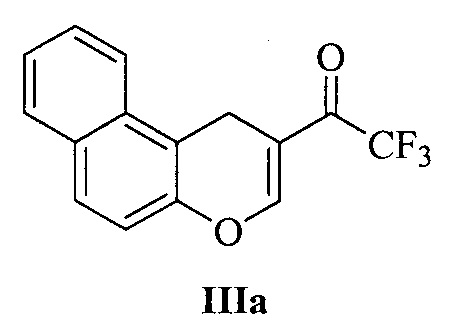
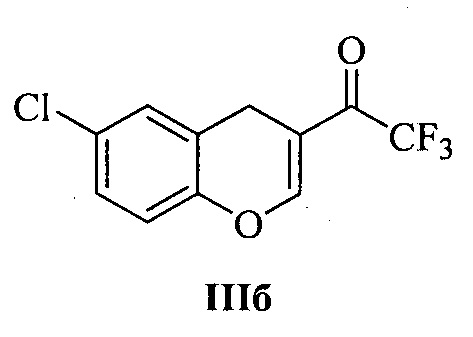
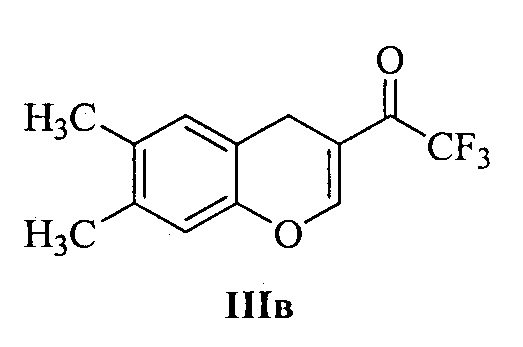
Технический результат достигается тем, что при получении 3-аминозамещенных 2,3-дигидро-1H-бензо[ƒ]хроменов Ia-м и 2-аминозамещенных хроманов IIа-в в качестве исходных соединений используются 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтан-1-он IIIа (для соединений Ia-м) и 1-(6-хлор-4H-хромен-3-ил)-2,2,2-трифторэтан-1-он IIIб или 1-(6,7-диметил-4H-хромен-3-ил)-2,2,2-трифторэтан-1-он IIIв (для соединений IIа и IIб, в, соответственно):
и циклические вторичные амины (морфолин, гомопиперидин, производные пиперидина и пиперазина) общей формулы IV:
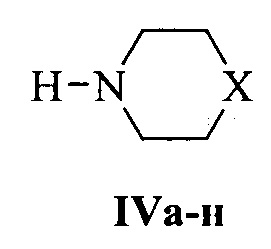
где X: О (IVa), СН2 (IVб), CHPh (IVb), CHCH2Ph (IVг), СНОН (IVд), C(OH)Ph (IVe), (CH2)2 (IVж), NCH3 (IVз), NPh (IVи), N-(2-CH3C6H4) (IVк), N-(2-CH3OC6H4) (IVл), N-(2-пиримидил) (IVм), N-(4-FC6H4) (IVн).
Отличительные признаки:
1. Использование трифторацетилхроменов, содержащих как донорные, так и акцепторные группы в ароматическом фрагменте.
2. Исходные трифторацетилхромены и вторичные циклические амины вводятся в реакцию в мольном соотношении 1:2 в соответствии со следующей стехиометрией реакции:
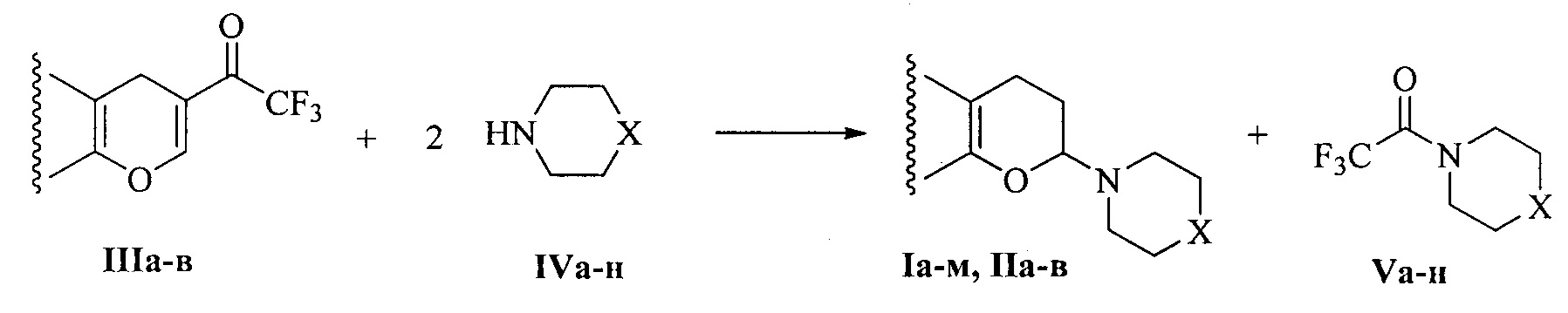
3. В качестве второго продукта реакции образуются N-трифторацетиламины Va-н.
4. Использование в качестве растворителя метанола, который при необходимости может быть заменен на менее токсичный этанол.
Заявляемое изобретение имеет следующие преимущества:
1. Метод позволяет получать хроман-2-амины, не содержащие заместителей в положениях 3 и 4 дигидропиранового цикла.
2. Более высокие выходы конечных продуктов (в среднем 73%).
3. Целевые продукты выпадают непосредственно из реакционной массы и, как правило, не требуют дополнительной очистки.
4. Синтез легко масштабируется.
5. Реакция проводится при комнатной температуре, нет необходимости в создании инертной атмосферы и использовании безводных растворителей, что существенно упрощает схему реактора, и не требует применения сложного и дорогостоящего оборудования.
Исходные трифторацетилхромены IIIа-в получены по методу, описанному в работе [22].
Примеры выполнения способа
ИК спектры записаны на спектрометре Shimadzu FTIR-8400S в таблетках KBr. Спектры ЯМР 1Н и 13С (400 и 100 МГц соответственно), а также DEPT зарегистрированы на спектрометре JEOL JNM-ECX400 в CDCl3. Измерения проводили без использования дополнительных эталонов с привязкой частоты к сигналу дейтерированного растворителя. Элементный анализ выполнен на автоматическом CHNS-анализаторе Euro Vector ЕА-3000. Температуры плавления определены капиллярным методом на приборе SRS OptiMelt МРА 100.
Пример 1.
4-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)морфолин (Ia). К раствору 0.16 г (1.8 ммоль) морфолина IVa в 5 мл метанола прибавляют 0.25 г (0.9 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.19 г (79%). Бесцветные кристаллы; т. пл. 151-152°С. ИК νмакс.: 2957, 2911, 2889, 2849, 1618, 1595, 1512, 1468, 1435, 1406, 1391, 1377, 1296, 1265, 1240, 1207, 1186, 1159, 1115, 1066, 1037, 1022, 970, 920, 887, 841, 814, 802, 772, 754. 1Н ЯМР (CDCl3) δ: 2.14-2.25 (м, 2Н, СН2), 2.80-2.84 (м, 2Н, СН2), 3.05-3.13 (м, 3Н, СН2), 3.19-3.25 (м, 1Н, СН2), 3.73-3.82 (м, 4Н, СН2), 4.65 (дд, 1H, J=8.9, 3.2 Гц, CHN), 7.06 (д, 1Н, J=8.9 Гц, Ar), 7.34 (т, 1Н, J=8.0 Гц, Ar), 7.48 (т, 1H, J=8.0, Ar), 7.62 (д, 1Н, J=8.9 Гц, Ar), 7.74-7.79 (м, 2Н, Ar). 13С ЯМР (CDCl3) δ: 22.6 (СН2), 25.0 (СН2), 47.9 (2CH2N), 67.3 (2CH2O), 92.0 (CHN), 113.4 (С), 119.2 (СН), 122.0 (СН), 123.3 (СН), 126.4 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 132.9 (С), 152.7 (С-O). Вычислено для C17H19NO2, %: С 75.81; Н 7.11; N 5.20. Найдено, %: С 75.90; Н 7.04; N 5.09.
Пример 2.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)пиперидин (Iб). К раствору 0.15 г (1.8 ммоль) пиперидина IVб в 5 мл метанола прибавляют 0.25 г (0.9 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.19 г (79%). Бесцветные кристаллы; т. пл. 113-114°С. ИК νмакс.: 2936, 2824, 1622, 1599, 1514, 1466, 1410, 1381, 1350, 1306, 1231, 1206, 1196, 1177, 1113, 1076, 1057, 1036, 1013, 970, 959, 910, 851, 804, 739. 1H ЯМР (CDCl3) δ: 1.52-1.72 (м, 6Н, СН2), 2.14-2.29 (м, 2Н, СН2), 2.74-2.80 (м, 2Н, СН2), 3.02-3.12 (м, 3Н, СН2), 3.21 (ддд, 1Н, J=16.5, 5.5, 2.0 Гц, СН2), 4.69 (дд, 1H, J=10.1, 1.8 Гц, СН-О), 7.05 (д, 1Н, J=8.9 Гц, Ar), 7.32 (т, 1H, J=7.8 Гц, Ar), 7.47 (т, 1Н, J=7.8 Гц, Ar), 7.61 (д, 1Н, 7=8.7 Гц, Ar), 7.73-7.79 (м, 2Н, Ar). 13С ЯМР (CDCl3) δ: 23.1 (СН2), 24.8 (СН2), 25.5 (СН2), 26.4 (2СН2), 48.6 (2CH2N), 93.1 (CHN), 113.5 (С), 119.3 (СН), 122.0 (СН), 123.1 (СН), 126.4 (СН), 127.8 (СН), 128.5 (СН), 128.8 (С), 133.0 (С), 153.2 (С-О). Вычислено для C18H21NO, %: С 80.86; Н 7.92; N 5.24. Найдено, %: С 80.78; Н 7.99; N 5.17.
Пример 3.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)-4-фенилпиперидин (Iв). К раствору 0.23 г (1.44 ммоль) 4-фенилпиперидина IVb в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.2 г (81%). Бесцветные кристаллы; т. пл. 170-172°С. ИК νмакс.: 2936, 2824, 1624, 1597, 1514, 1493, 1410, 1379, 1261, 1232, 1205, 1180, 1151, 1140, 1067, 1036, 1009, 968, 959, 849, 808, 756, 741, 698. 1Н ЯМР (CDCl3) δ: 1.73-1.99 (м, 4Н), 2.18-2.33 (м, 2Н), 2.64 (тт, 1Н, J=12.1, 3.7 Гц, Ar), 2.77 (тд, 1H, J=12.1. 1.8 Гц), 3.07-3.18 (м, 3Н), 3.23-3.32 (м, 2Н), 4.78 (дд, 1Н, J=9.8, 1.6 Гц, CHN), 7.08 (д, 1Н, J=8.7 Гц, Ar), 7.20-7.35 (м, 6Н, Ar), 7.46-7.50 (м, 1Н, Ar), 7.63 (д, 1H, J=8.9 Гц, Ar), 7.76 (д, 1Н, J=8.0 Гц, Ar), 7.79 (д, 1H, J=8.5 Гц, Ar). 13С ЯМР (CDCl3) δ: 23.1 (СН2), 25.6 (СН2), 33.8 (СН2), 33.9 (СН2), 43.0 (CHPh), 45.2 (СН2), 51.6 (СН2), 92.7 (CHN), 113.5 (С), 119.3 (СН), 122.0 (СН), 123.2 (СН), 126.3 (СН), 126.4 (СН), 127.0 (2СН), 127.9 (СН), 128.49 (СН), 128.54 (2СН), 128.9 (С), 133.0 (С), 146.5 (С), 153.1 (С). Вычислено для C24H25NO, %: С 83.93; Н 7.34; N 4.08. Найдено, %: С 84.05; Н7.30; N 3.94.
Пример 4.
4-Бензил-1-(2,3-дигидро-1H-бензо[ƒ]хромен-3-ил)пиперидин (Iг). К раствору 0.25 г (1.44 ммоль) 4-бензилпиперидина IVг в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.2 г (80%). Бесцветные кристаллы; т. пл. 135-137°С. ИК νмакс.: 1624, 1595, 1514, 1495, 1466, 1447, 1410, 1387, 1261, 1232, 1209, 1174, 1153, 1138, 1070, 1039, 1028, 1022, 970, 943, 845, 808, 791, 762, 746, 700. 1Н ЯМР (CDCl3) δ: 1.25-1.41 (м, 2Н, СН2), 1.60-1.78 (м, 3Н, СН2), 2.13-2.28 (м, 2Н, СН2), 2.53-2.62 (м, 3Н, СН2), 2.90-3.00 (м, 2Н, СН2), 3.03-3.25 (м, 3Н, СН2), 4.71 (дд, 1Н, J=10.1, 2.0 Гц, CHN), 7.02 (д, 1Н, J=9.0 Гц, Ar), 7.16-7.22 (м, 3Н, Ar), 7.27-7.34 (м, 3Н, Ar), 7.46 (ддд, 1Н, J=8.2, 6.8, 1.4 Гц, Ar), 7.60 (д, 1Н, J=9.0 Гц, Ar), 7.74 (д, 1Н, J=8.0 Гц, Ar), 7.76 (д, 1H, J=8.5 Гц, Ar). 13С ЯМР (CDCl3) δ: 23.0 (СН2), 25.5 (СН2), 32.5 (СН2), 32.7 (СН2), 38.2 (СН3), 43.4 (СН2), 44.9 (СН2), 50.9 (СН2), 92.7 (СН), 113.4 (С), 119.3 (СН), 122.0 (СН), 123.1 (СН), 125.9 (СН), 126.4 (СН), 127.8 (СН), 128.3 (2СН), 128.5 (СН), 128.8 (С), 129.3 (2СН), 133.0 (С), 140.8 (С), 153.1 (С). Вычислено для C25H27NO, %: С 83.99; Н 7.61; N 3.92. Найдено, %: С 84.11; Н 7.55; N 3.99.
Пример 5.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)пиперидин-4-ол (Iд). К раствору 0.18 г (1.8 ммоль) пиперидин-4-ола IVд в 5 мл метанола прибавляют 0.25 г (0.9 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.15 г (59%). Бесцветные кристаллы; т. пл. 180-181°С. ИК νмакс.: 3450-3300, 2943. 2830, 1624, 1599, 1514, 1466, 1406, 1368, 1231, 1219, 1206, 1180, 1136, 1096, 1063, 1036, 1020, 988, 968, 932, 849, 804, 724. 1Н ЯМР (CDCl3) δ: 1.55-1.68 (м, 2Н, СН2), 1.79 (уш. с, 1Н, ОН), 1.94-2.02 (м, 2Н, СН2), 2.14-2.26 (м, 2Н, СН2), 2.63-2.70 (м, 1H, СН2), 2.98-3.01 (м, 2Н, СН2), 3.04-3.13 (м, 1H, СН2), 3.17-3.26 (м, 2Н, СН2), 3.75-3.82 (м, 1H, СН2), 4.72 (дд, 1H, J=9.6, 2.5 Гц, CHN), 7.03 (д, 1Н, J=8.9 Гц, Ar), 7.32 (ддд, 1Н, J=8.0, 6.9, 0.9 Гц, Ar), 7.47 (ддд, 1Н, J=8.2, 6.9, 1.2 Гц, Ar), 7.60 (д, 1H, J=8.9 Гц, Ar), 7.73-7.78 (м, 2Н, Ar). 13С ЯМР (CDCl3) δ: 23.0 (СН2), 25.7 (СН2), 34.8 (СН2), 35.1 (СН2), 43.4 (СН2), 47.2 (СН2), 68.5 (СН-ОН), 92.3 (CHN), 113.4 (С), 119.2 (СН), 122.0 (СН), 123.2 (СН), 126.4 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 133.0 (С), 153.0 (С). Вычислено для C18H21NO2, %: С 76.30; Н 7.47; N 4.94. Найдено, %: С 76.22; Н 7.40; N 5.09.
Пример 6.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)-4-фенилпиперидин-4-ол (Iе). К раствору 0.2 г (1.44 ммоль) 4-фенилпиперидин-4-ола IVe в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°C до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.18 г (70%). Бесцветные кристаллы; т.пл. 176-177°С. ИК νмакс.: 3300-3100, 2959, 2934, 2885, 1622, 1595, 1514, 1500, 1491, 1464, 1448, 1435, 1402, 1387, 1306, 1261, 1267, 1205, 1176, 1151, 1126, 1065, 1043, 1012, 978, 966, 943, 862, 814, 760, 745, 696. 1Н ЯМР (CDCl3) δ: 1.77 (уш. с, 1H, ОН), 1.84 (д, 2Н, J=13.1 Гц, СН2), 2.15-2.34 (м, 4Н, СН2), 2.91-2.96 (м, 1H, СН2), 3.06-3.16 (м, 3Н, СН2), 3.22-3.28 (м, 1Н, СН2), 3.46 (тд, 1Н, J=12.4, 2.5 Гц, СН2), 4.77 (дд, 1H, J=10.1, 2.1 Гц, CHN), 7.10 (д, 1Н, J=8.7 Гц, Ar), 7.27-7.41 (м, 4Н, Ar), 7.48 (ддд, 1H, 7=8.2, 6.9, 1.4 Гц, Ar), 7.54-7.58 (м, 2Н, Ar), 7.63 (д, 1Н, J=9.0 Гц, Ar), 7.76 (д, 1Н, J=7.8 Гц, Ar), 7.79 (д, 1Н, J=8.5 Гц, Ar). 13С ЯМР (CDCl3) δ: 22.9 (СН2), 25.4 (СН2), 38.8 (СН2), 38.9 (СН2), 41.3 (СН2), 46.5 (СН2), 71.8 (С-ОН), 92.5 (CHN), 113.4 (С), 119.4 (СН), 122.0 (СН), 123.2 (СН), 124.7 (2CHPh), 126.4 (СН), 127.1 (СН), 127.9 (СН), 128.5 (2CHPh, СН), 128.9 (С), 133.0 (С), 148.5 (С), 153.0 (С). Вычислено для C24H25NO2, %: С 80.19; Н 7.01; N 3.90. Найдено, %: С 80.27; Н6.94; N 3.72.
Пример 7.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)азепан (Iж). К раствору 0.14 г (1.44 ммоль) гомопиперидина IVж в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.14 г (69%). Бесцветные кристаллы; т. пл. 78-79°С. ИК νмакс.: 2926, 2847, 1622, 1597, 1514, 1468, 1449, 1431, 1416, 1383, 1229, 1207, 1186, 1163, 1140, 968, 947, 818, 745. 1Н ЯМР (CDCl3) δ: 1.63-1.75 (м, 8Н, СН2), 2.17-2.23 (м, 2Н, СН2), 2.90-2.97 (м, 2Н, СН2), 3.04-3.23 (м, 4Н, СН2), 4.80-4.83 (м, 1Н, CHN), 7.05 (д, 1Н, J=8.9 Гц, Ar), 7.32 (ддд, 1H, J=8.0, 6.8, 1.1 Гц, Ar), 7.47 (ддд, 1Н, J=8.2, 6.8, 1.4 Гц, Ar), 7.60 (д, 1Н, J=9.0 Гц, Ar), 7.74 (д, 1Н,.7=8.5 Гц, Ar), 7.77 (д, 1H, J=8.5 Гц, Ar). 13С ЯМР (CDCl3) δ: 23.4 (СН2), 26.7 (СН2), 27.5 (2СН2), 29.9 (2СН2), 50.2 (2CH2N), 94.4 (CHN), 113.2 (С), 119.6 (СН), 122.0 (СН), 123.0 (СН), 126.3 (СН), 127.7 (СН), 128.4 (СН), 128.8 (С), 133.1 (С), 153.7 (С). Вычислено для C19H23NO, %: С 81.10; Н 8.24; N 4.98. Найдено, %: С 81.19; Н 8.17; N 5.11.
Пример 8.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)-4-метилпиперазин (Iз). К раствору 0.14 г (1.44 ммоль) 1-метилпиперазина IVз в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.12 г (59%). Бесцветные кристаллы; т.пл. 138-140°С. ИК νмакс.: 1620, 1595, 1514, 1470, 1445, 1433, 1410, 1391, 1373, 1360, 1290, 1260, 1236, 1211, 1200, 1182, 1169, 1144, 1134, 1080, 1063, 1032, 1013, 970, 932, 847, 826, 810, 745. 1Н ЯМР (CDCl3) δ: 2.14-2.21 (м, 2Н, СН2), 2.36 (с, 3Н, СН3), 2.54 (уш. с, 4Н, СН2), 2.85-2.90 (м, 2Н, СН2), 3.02-3.23 (м, 4Н, СН2), 4.69 (дд, 1H, J=8.9, 3.4 Гц, CHN), 7.02 (д, 1Н, J=8.9 Гц, Ar), 7.32 (ддд, 1H, J=8.0, 6.9, 1.1 Гц, Ar), 7.46 (ддд, 1H, J=8.2, 6.9, 1.4 Гц, Ar), 7.59 (д, 1H, J=8.9 Гц, Ar), 7.73-7.77 (м, 2Н, Ar). 13С ЯМР (CDCl3) δ: 22.7 (СН2), 25.2 (СН2), 46.2 (СН3), 47.3 (уш. с, 2CH2N), 55.4 (2CH2N), 91.8 (CHN), 113.3 (С), 119.3 (СН), 122.0 (СН), 123.2 (СН), 126.4 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 132.9 (С), 152.8 (С). Вычислено для C18H22N2O, %: С 76.56; Н 7.85; N 9.92. Найдено, %: С 76.55; Н 7.78; N 9.81.
Пример 9.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)-4-фенилпиперазин (Iи). К раствору 0.23 г (1.44 ммоль) 1-фенилпиперазина IVи в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.18 г (75%). Бесцветные кристаллы; т.пл. 212-213°С. ИК νмакс.: 2882, 2833, 1620, 1593, 1503, 1466, 1449, 1408, 1387, 1323, 1313, 1279, 1263, 1230, 1209, 1190, 1146, 1072, 1038, 1020, 959, 922, 845, 812, 748, 685. 1Н ЯМР (CDCl3) δ: 2.21-2.31 (м, 2Н, СН2), 2.96-3.03 (м, 2Н, СН2), 3.07-3.17 (м, 1Н, СН2), 3.22-3.32 (м, 7Н, СН2), 4.77 (дд, 1H, J=9.2, 3.0 Гц, CHN), 6.89 (т, 1H, J=7.4 Гц, Ar), 6.98 (д, 2Н, J=8.0 Гц, Ar), 7.05 (д, 1H, J=8.9 Гц, Ar), 7.27-7.36 (м, 3Н, Ar), 7.46-7.51 (м, 1H, Ar), 7.63 (д, 1H, J=8.9 Гц, Ar), 7.76 (д, 1H, J=8.0 Гц, Ar), 7.79 (д, 1Н, J=8.5 Гц, Ar). 13С ЯМР (CDCl3) δ: 22.7 (СН2), 25.3 (СН2), 47.5 (2CH2N), 49.7 (2CH2N), 91.9 (CHN), 113.4 (С), 116.4 (2СН), 119.2 (СН), 119.9 (СН), 122.0 (СН), 123.2 (СН), 126.4 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 129.2 (2СН), 133.0 (С), 151.6 (С), 152.8 (С). Вычислено для C23H24N2O, %: С 80.20; Н 7.02; N 8.13. Найдено, %: С 80.08; Н 6.89; N 8.05.
Пример 10.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)-4-(о-толил)пиперазин (Iк). К раствору 0.25 г (1.44 ммоль) 1-(о-толил)пиперазина IVк в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.2 г (80%). Бесцветные кристаллы; т.пл. 175-176°С. ИК νмакс.:1620, 1595, 1574, 1512, 1463, 1464, 1445, 1408, 1393, 1375, 1306, 1263, 1227, 1206, 1184, 1159, 1140, 1020, 976, 949, 932, 845, 816, 806, 764, 745, 721. 1Н ЯМР (CDCl3) δ: 2.20-2.33 (м, 2Н, СН2), 2.37 (с, 3Н, СН3), 2.97-3.30 (м, 10Н, СН2), 4.78 (дд, 1H, J=8.9, 3.0 Гц, CHN), 7.00 (тд, 1H, J=7.5, 1.2 Гц, Ar), 7.06 (д, 1H, J=7.8 Гц, Ar), 7.10 (д, 1H, J=8.9 Гц, Ar), 7.17-7.21 (м, 2Н, Ar), 7.34 (ддд, 1H, J=8.0, 6.9, 0.9 Гц, Ar), 7.48 (ддд, 1H, J=8.2, 6.8, 1.4 Гц, Ar), 7.63 (д, 1Н, J=8.9 Гц, Ar), 7.76 (д, 1Н, J=7.8 Гц, Ar), 7.79 (д, 1H, J=8.5 Гц, Ar). 13С ЯМР (CDCl3) δ: 18.0 (СН3), 22.9 (СН2), 25.4 (СН2), 47.9 (уш. с, 2CH2N), 52.1 (2CH2N), 92.1 (CHN), 113.4 (С), 119.1 (СН), 119.3 (СН), 122.0 (СН), 123.22 (СН), 123.24 (СН), 126.4 (СН), 126.7 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 131.2 (СН), 132.8 (С), 133.0 (С), 151.7 (С), 152.9 (С). Вычислено для C24H26N2O, %: С 80.41; Н 7.31; N 7.81. Найдено, %: С 80.30; Н 7.25; N 7.95.
Пример 11.
1-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)-4-(2-метоксифенил)пиперазин (Iл). К раствору 0.28 г (1.44 ммоль) 1-(о-метокси)пиперазина IVл в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIа. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.21 г (78%). Бесцветные кристаллы; т.пл. 172-173°С. ИК νмакс.: 1620, 1595, 1503, 1466, 1445, 1412, 1391, 1379, 1335, 1317, 1306, 1250, 1207, 1190, 1140, 1119, 1070, 1059, 1020, 974, 953, 924, 845, 822, 806, 752, 739. 1Н ЯМР (CDCl3) δ: 2.22-2.32 (м, 2Н, СН2), 3.00-3.36 (м, 10H, СН2), 3.90 (с, 3Н, CH3O), 4.77 (дд, 1H, J=8.4, 3.7 Гц, CHN), 6.89 (д, 1H, J=8.0 Гц, Ar), 6.93-7.08 (м, 4Н, Ar), 7.32-7.36 (м, 1H, Ar), 7.48 (ддд, 1H, J=8.0, 6.6, 1.2 Гц, Ar), 7.62 (д, 1H, J=8.9 Гц, Ar), 7.76 (д, 1Н, J=8.2 Гц, Ar), 7.79 (д, 1H, J=8.7 Гц, Ar). 13С ЯМР (CDCl3) δ: 22.7 (СН2), 25.2 (СН2), 47.7 (2CH2N), 51.0 (2CH2N), 55.5 (СН30), 92.0 (CHN), 111.3 (СН), 113.3 (С), 118.4 (СН), 119.3 (СН), 121.1 (СН), 122.0 (СН), 123.1 (СН), 123.2 (СН), 126.4 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 133.0 (С), 141.5 (С), 152.4 (С), 152.9 (С). Вычислено для C24H26N2O2, %: С 76.98; Н 7.00; N 7.48. Найдено, %: С 77.12; Н 6.94; N 7.39.
Пример 12.
2-[4-(2,3-Дигидро-1H-бензо[ƒ]хромен-3-ил)пиперазин-1-ил]пиримидин (Iм). К раствору 0.24 г (1.44 ммоль) 2-(пиперазин-1-ил)пиримидина IVм в 5 мл метанола прибавляют 0.2 г (0.72 ммоль) 1-(1H-бензо[ƒ]хромен-2-ил)-2,2,2-трифторэтанона IIIa. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIа и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.21 г (85%). Бесцветные кристаллы; т.пл. 142-143°С. ИК νмакс.: 1622, 1585, 1545, 1514, 1466, 1449, 1408, 1389, 1362, 1310, 1260, 1231, 1207, 1192, 1179, 1153, 1138, 1020, 980, 970, 955, 939, 837, 814, 783, 768, 743. 1Н ЯМР (CDCl3) δ: 2.19-2.31 (м, 2Н, CH2), 2.85-2.92 (м, 2Н, СН2), 3.06-3.17 (м, 3Н, СН2), 3.20-3.27 (м, 2Н, СН2), 3.86-3.96 (м, 4Н, СН2), 4.76 (дд, 1H, J=9.2, 3.0 Гц, CHN), 6.49 (т, 1Н, J=4.8 Гц, Нпиримидин-5), 7.01 (д, 1H, J=8.9 Гц, Ar), 7.33 (т, 1Н, J=8.0 Гц, Ar), 7.47 (ддд, 1Н, J=8.3, 7.1, 1.4 Гц, Ar), 7.60 (д, 1H, J=8.7 Гц, Ar), 7.74 (д, 1H, J=8.0 Гц, Ar), 7.78 (д, 1Н, J=8.4 Гц, Ar), 8.32 (д, 2Н, J=4.8 Гц, Нпиримидин-4,6). 13С ЯМР (CDCl3) δ: 22.8 (СН2), 25.3 (СН2), 44.0 (2СН2 пиперазин), 47.5 (2СН2 пиперазин), 92.1 (CHN), 109.9 (СН), 113.4 (С), 119.2 (СН), 122.0 (СН), 123.2 (СН), 126.4 (СН), 127.9 (СН), 128.5 (СН), 128.9 (С), 132.9 (С), 152.7 (С), 157.8 (2СНпиримидин-4,6), 161.8 (Спиримидин-2). Вычислено для C21H22N4O, %: С 72.81; Н 6.40; N 16.17. Найдено, %: С 72.71; Н 6.50; N 16.11.
Пример 13.
4-(6-Хлорхроман-2-ил)морфолин (IIа). К раствору 0.13 г (1.52 ммоль) морфолина IVa в 5 мл метанола прибавляют 0.2 г (0.76 ммоль) 1-(6-хлор-4H-хромен-3-ил)-2,2,2-трифторэтанона IIIб. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIб и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.13 г (69%). Бесцветные кристаллы; т.пл. 100-101°С. ИК νмакс.: 2940, 2864, 2843, 1574, 1479, 1449, 1408, 1263, 1238, 1213, 1190, 1177, 1115, 1082, 1072, 1015, 968, 920, 914, 872, 831, 820, 797, 770, 642. 1Н ЯМР (CDCl3) δ: 1.93-2.09 (м, 2Н, СН2), 2.70-2.79 (м, 3Н, СН2), 2.84-2.92 (м, 1H, СН2), 2.95-3.01 (м, 2Н, СН2), 3.68-3.77 (м, 4Н, СН2), 4.57 (дд, 1H, J=9.8, 2.3 Гц, CHN), 6.71 (д, 1H, J=8.5 Гц, Н-8), 6.99 (д, 1Н, J=2.5 Гц, Н-5), 7.01 (дд, 1Н, J=8.5, 2.5 Гц, Н-7). 13С ЯМР (CDCl3) δ: 24.8 (CH2), 25.6 (CH2), 47.8 (2CH2N), 67.2 (2CH2O), 92.3 (CHN), 118.1 (CH), 123.4 (C), 124.7 (C), 127.3 (CH), 128.7 (CH), 153.8 (С). Вычислено для C13H16ClNO2, %: С 61.54; H 6.36; N 5.52. Найдено, %: С 61.62; Н 6.41; N 5.41.
Пример 14.
4-(6,7-Диметилхроман-2-ил)морфолин (IIб). К раствору 0.135 г (1.56 ммоль) морфолина IVa в 5 мл метанола прибавляют 0.2 г (0.78 ммоль) 1-(6,7-диметил-4H-хромен-3-ил)-2,2,2-трифторэтанона IIIв. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIв и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.14 г (73%). Бесцветные кристаллы; т.пл. 94-95°С. ИК νмакс.: 2967, 2930, 2866, 2828, 1622, 1572, 1503, 1454, 1402, 1294, 1273, 1260, 1218, 1200, 1165, 1111, 1092, 1069, 1043, 1020, 1006, 957, 918, 908, 885, 853, 785. 1Н ЯМР (CDCl3) δ: 1.92-2.09 (м, 2Н, СН2), 2.15 (с, 3Н, СН3), 2.18 (с, 3Н, СН3), 2.70-2.77 (м, 3Н, СН2), 2.81-2.90 (м, 1H, СН2), 2.96-3.02 (м, 2Н, СН2), 3.69-3.78 (м, 4Н, СН2), 4.54 (дд, 1H, J=10.1, 2.0 Гц, CHN), 6.62 (с, 1H, Ar), 6.79 (с, 1H, Ar). 13С ЯМР (CDCl3) δ: 18.8 (СН3), 19.5 (СН3), 25.3 (СН2), 25.4 (СН2), 47.8 (2CH2N). 67.3 (2CH2O), 92.0 (CHN), 117.6 (СН), 118.9 (С), 128.1 (С), 130.0 (СН), 135.7 (С), 153.0 (С-О). Вычислено для C15H21NO2, %: С 72.84; Н 8.56; N 5.66. Найдено, %: С 72.75; Н 8.52; N 5.77.
Пример 15.
1-(6,7-Диметилхроман-2-ил)-4-(4-фторфенил)пиперазин (IIв). К раствору 0.28 г (1.56 ммоль) 1-(4-фторфенил)пиперазина IVн в 5 мл метанола прибавляют 0.2 г (0.78 ммоль) 1-(6,7-диметил-4H-хромен-3-ил)-2,2,2-трифторэтанона IIIв. Полученную смесь нагревают 1-2 минуты при 40°С до полного растворения IIIв и затем выдерживают при комнатной температуре в течение 24 ч без перемешивания. Выпавший осадок отфильтровывают, промывают 1 мл ледяного метанола и сушат на воздухе при комнатной температуре. Выход 0.15 г (59%). Бесцветные кристаллы; т.пл. 147-148°С. ИК νмакс.: 2853, 1622, 1574, 1518, 1501, 1449, 1406, 1387, 1310, 1294, 1263, 1246, 1233, 1202, 1165, 1142, 1078, 1045, 1007, 951, 920, 868, 860, 818, 787, 750, 716, 702. 1H ЯМР (CDCl3) δ: 1.97-2.13 (м, 2Н, СН2), 2.17 (с, 3Н, СН3), 2.19 (с, 3Н, СН3), 2.73-2.79 (м, 1Н, СН2), 2.85-2.97 (м, 3Н, СН2), 3.12-3.20 (м, 6Н, СН2), 4.65 (д, 1H, J=9.2 Гц, CHN), 6.63 (с, 1H, Ar), 6.82 (с, 1Н, Ar), 6.88-6.92 (м, 2Н, Ar), 6.95-7.00 (м, 2Н, Ar). 13С ЯМР (CDCl3) δ: 18.9 (СН3), 19.6 (СН3), 25.5 (СН2), 25.7 (СН2), 47.4 (2CH2N), 50.6 (2CH2N), 91.9 (CHN), 115.6 (д, 2J=21.9 Гц, 2CHo-F), 117.7 (СН), 118.0 (д, 3J=7.6 Гц, 2CHм-F), 118.9 (С), 128.1 (С), 130.0 (СН), 135.8 (С), 148.3 (С), 153.1 (С), 157.3 (д, 1J=237.4 Гц, C-F). Вычислено для C21H25FN2O, %: С 74.09; Н 7.40; N 8.23. Найдено, %: С 73.92; Н 7.33; N 8.32.
Литература:
[1] Bruno О., Brullo С., Ranise A., Schenone S., Bondavalli F., Barocelli E., Ballabeni V., Chiavarini M., Tognolini M., Impicciatore M. Synthesis and pharmacological evaluation of 2,5-cycloamino-5H-[1]benzopyrano[4,3-d]pyrimidines endowed with in vitro antiplatelet activity // Bioorg. Med. Chem. Lett., 2001, V. 11, pp. 1397-1400.
[2] Bruno O., Schenone S., Ranise A., Bondavalli F., Barocelli E., Ballabeni V., Chiavarini M., Bertoni S., Tognolini M., Impicciatore M. New polycyclic pyrimidine derivatives with antiplatelet in vitro activity: synthesis and pharmacological screening // Bioorg. Med. Chem. Lett., 2001, V. 9, pp. 629-636.
[3] Jurd L. New anti-tumor agents. 2. Benzopyranylamine compounds // J. Heterocyclic Chem., 1996, V. 33, pp. 1919-1925.
[4] Jiang N., Wang X., Yang Y., Dai W. Advances in mitotic inhibitors for cancer treatment // Mini. Rev. Med. Chem., 2006, V. 6, pp. 885-895.
[5] Li Q.-Y., Zhang M., Hallis Т.M., DeRosier T.A., Yue J.-M., Ye Y., Mais D.E., Wang M.-W. Characterization of a novel non-steroidal glucocorticoid receptor antagonist // Biochem. Biophys. Res. Commun., 2010, V. 391, pp. 1531-1536.
[6] Page P.С.В., Heaney H., Rassias G.A., Reignier S., Sampler E.P., Talib S. The reductive cleavage of cyclic aminol ethers to N,N-dialkylamino-derivatives: modifications to the Eschweiler-Clarke procedure // Synlett, 2000, pp. 104-106.
[7] Ahman J.В., Dillon B.R., Pettman A.J. Process for the production of benzopyran-2-ol derivatives // Patent WO 2007/138440 A1 (2007).
[8] Ciambecchini U., Turchetta S., de Ferra L., Zenoni M. Process for the preparation of 2-hydroxy-4-phenyl-3,4-dihydro-2H-chromen-6-y1-methanol and (R)-feso-deacyl // Patent WO 2011/154854 A1 (2011)
[9] Liu Y.-K., Li Z.-L., Li J.-Y., Feng H.-X., Tong Z.-P. Open-close: an alternative strategy to α-functionalization of lactone via enamine catalysis in one pot under mild conditions // Org. Lett., 2015, V. 17, pp. 2022-2025.
[10] Huang P., Cameron Т., Jha A. Novel synthesis of 2,2-dialkyl-3-dialkylamino-2,3-dihydro-1H-naphtho[2,1-b]pyrans // Tetrahedron Lett., 2009, V. 50, pp. 51-54.
[11] Jurd L. New anti-tumor agents. 3. Phenolic benzopyran lactone and amine derivatives // J. Heterocyclic Chem., 1997, V. 34, pp. 601-604.
[12] Jurd L. Bioactive heterocyclic analogs of the antitumor drug, podophyllotoxin // J. Heterocyclic Chem., 1988, V. 25, pp. 89-96.
[13] Benameur L., Bouaziz Z., Nebois P., Bartoll M.-H., Boitard M., Fillion H. Synthesis of furonaphth[1,3]oxazine and furo[1,3]oxazinoquinoline derivatives as precursors for an o-quinonemethide structure and potential antitumor agents // Chem. Pharm. Bull., 1996, V. 44, pp. 605-608.
[14] von Strandtmann M., Cohen M.P., Shavel J. Jr. Carbon-carbon alkylation of enamines with mannich bases. II. A new synthesis of pyran containing fused ring systems // Tetrahedron Lett., 1965, V. 6, pp. 3103-3106.
[15] von Strandtmann M., Cohen M. P., Shavel J. Jr. Reaction of phenolic mannich bases with enamines. General synthesis of pyran-containing fused ring systems // J. Heterocyclic Chem., 1970, V. 7, pp. 1311-1319.
[16] Mahajan J.R., Araujo H.C. Synthesis of medium and macrocyclic benzo- and naphthoketolactones. Oxidation of 2,3-polymethylenebenzo- and naphthopyrans // Synthesis, 1976, pp. 111-112.
[17] Klutchko S., Sonntag A.C, von Strandtmann M., Shavel J. Jr. The reaction of enamines with o-hydroxy-ω-nitrostyrenes. Preparation of benzodihydropyrans and hexahydroxanthenes and their rearrangement to pyrroline 1-oxides and hexahydroindole 1-oxides // J. Org. Chem., 1973, V. 38, pp. 3049-3051.
[18] Paquette L.A. The self-trapping of enamine-aldehyde condensation products: a new xanthone synthesis // Tetrahedron Lett., 1965, V. 6, pp. 1291-1294.
[19] Katritzky A.R., Long Q.-H., Lue P., Jozwiak A. Benzotriazole-assisted synthesis of enamines // Tetrahedron, 1990, V. 46, pp. 8153-8160.
[20] Blumenkopf N., Hecht O.F. Process of making N-vinyl morpholine // Patent US 3179661 (1965).
[21] Jurd L. Synthesis of 4-phenyl-2H-1-benzopyrans // J. Heterocyclic Chem., 1991, V. 28, pp. 983-986.
[22] Лукашенко А.В., Осянин В.А., Осипов Д.В., Климочкин Ю.Н. Комплементарное сочетание о-хинонметидов и 3-(N,N-диэтиламино)акролеина - синтез 1H-бензо[ƒ]хромен-2-карбальдегидов // Химия гетероцикл. соед., 2016, Т. 52, С. 711-715 [Chem. Heterocycl. Compd., 2016, V. 52, pp. 711-715.].
Способ получения 3-аминозамещенных и 2-аминозамещенных хроманов конденсацией трифторацетилхроменов и вторичных циклических аминов в мольном соотношении 1:2 в метанольном растворе при комнатной температуре.