Результат интеллектуальной деятельности: ВАРИАНТЫ СУБТИЛАЗ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым вариантам субтилаз, демонстрирующим изменение одного или нескольких свойств, включающих моющую эффективность, термическую устойчивость, устойчивость при хранении или каталитическую активность, по сравнению с исходной субтилазой. Варианты по настоящему изобретению подходят для применения, например, в чистящих или моющих композициях, таких как стиральные порошки и составы для мытья посуды, включая составы для автоматического мытья посуды. Кроме того, настоящее изобретение относится к выделенным последовательностям ДНК, кодирующим варианты субтилаз, векторам экспрессии, клеткам-хозяевам, а также к способам получения и применения вариантов по настоящему изобретению. Помимо этого, настоящее изобретение относится к чистящим и моющим композициям, содержащим варианты по настоящему изобретению.
Предпосылки создания изобретения
В индустрии моющих средств уже в течение 30 лет практикуется включение ферментов в моющие композиции. Ферменты, применяемые в таких композициях, включают протеазы, липазы, амилазы, целлюлазы, маннозидазы, а также другие ферменты или их смеси. Наиболее важными с коммерческой точки зрения ферментами являются протеазы.
Все больше число протеаз, находящих коммерческое применение, представляет собой специально разработанные варианты природных протеаз дикого типа, например, DURAZIM(R), RELASE®, ALCALASE®, SAVINASE®, PRIMASE®, DURALASE®, ESPERASE®, OVOZYME®, RELASE(R) и KANNASE® (Novozymes A/S), AXAPEM(R) (Gist-Brocades N.V.), PURAFECT(R) (Genencor International, Inc.), MAXATASETM, MAXACALTM, MAXAPEMTM, PROPERASETM, PURAFECTTM, PURAFECT OxPTM, FN2TM, FN3TM и FN4TM (Genencor International, Inc.).
Далее, в данной области описан ряд вариантов, например, в WO 04/041979 (NOVOZYMES A/S) описаны варианты субтилазы, демонстрирующие измененные свойства, по сравнению с исходной субтилазой, например, моющую эффективность, термическую устойчивость, устойчивость при хранении или каталитическую активность. Эти варианты подходят для применения, например, в чистящих или моющих композициях.
Был описан ряд подходящих для применения вариантов протеаз, многие из которых обладают улучшенной активностью, стабильностью и растворимостью в различных моющих средствах. Однако разнообразные факторы делают желательным дальнейшее улучшение протеаз. Условия удаления загрязнений продолжают меняться, например, что касается температуры и pH, и многие загрязнения по-прежнему трудно удалить полностью в стандартных условиях. Таким образом, несмотря на интенсивные исследования по разработке протеаз, сохраняется потребность в новых улучшенных протеазах.
В силу этого, задача настоящего изобретения заключалась в разработке вариантов субтилизина с улучшенными свойствами по сравнению с исходным ферментом.
Сущность изобретения
Настоящее изобретение относится к вариантам исходных субтилизинов, которые могут представлять собой, например, субтилизин, такой как показано в SEQ ID NO:1.
В одном из аспектов варианты по настоящему изобретению имеют, по меньшей мере, одно улучшенное свойство по сравнению с исходным субтилизином, например, представленным в SEQ ID NO:1, где указанные улучшенные свойства могут представлять собой, например, улучшенную моющую эффективность, например, улучшенную способность удаления пятен, улучшенную моющую эффективность при мойке твердых поверхностей, например, улучшенную эффективность мытья посуды, улучшенную стабильность, например, устойчивость при хранении или термическую устойчивость, или улучшенную каталитическую активность. В одном из аспектов настоящего изобретения варианты субтилизина обладают улучшенной способностью удалять остатки яиц, например, улучшенной способностью удалять вареные яичные желтки с твердых поверхностей.
Так, например, один из аспектов настоящего изобретения относится к варианту исходного субтилизина, включающему замены 9{R,K,H}, 15{G,A,S,T,M}, 68{G,A,S,T,M}, 218{D,S,G,V} и 245{R,K,H}, где данный вариант дополнительно включает, по меньшей мере, одну из следующих модификаций: 61{D,E}, 62{D,E}, 76{D,E}, *97aG, 98{G,S}, 99G, 101G, 120{V,Q,D}, 131{T,S}, 137H, 194P, 228V, 230V, 261D, где указанные положения соответствуют положениям в последовательности зрелого полипептида SEQ ID NO:2 [BPN’].
В одном из аспектов вариант по настоящему изобретению дополнительно включает замену G61E.
В одном из аспектов вариант по настоящему изобретению дополнительно включает замену A98S.
В одном из аспектов вариант по настоящему изобретению дополнительно включает замену S99G.
В одном из аспектов вариант по настоящему изобретению включает следующие замены S9R, A15T, G61E, V68A, A98S, S99G, N218D и Q245R.
В одном из аспектов исходный субтилизин является полипептидом, включающим аминокислотную последовательность, имеющую, по меньшей мере, 80% идентичность с последовательностью SEQ ID NO:1.
В другом аспекте вариант по настоящему изобретению имеет одно или несколько улучшенных свойств по сравнению с исходным субтилизином, где улучшенные свойства включают моющую способность, стабильность, каталитическую активность и эффективность мытья посуды.
В следующем аспекте улучшенные свойства включают улучшенную моющую способность, например, улучшенную способность к удалению загрязнений, улучшенную эффективность при мытье твердых поверхностей, например, мытье посуды, улучшенную стабильность, например, устойчивость при хранении или термическую устойчивость, или улучшенную каталитическую активность. В одном из аспектов настоящего изобретения варианты имеют улучшенную способность к удалению остатков яиц, например, улучшенную способность к удалению остатков вареных яичных желтков с твердых поверхностей.
Другие аспекты изобретения относятся к способу получения варианта путем введения в исходный субтилизин следующих замен:
i. замену остатка в положении 9 остатками {R, K, H};
ii. замену остатка в положении 15 остатками {G, A, S, T, M};
iii. замену остатка в положении 68 остатками {G, A, S, T, M};
iv. замену остатка в положении 245 остатками {R, K, H}; и
v. замену остатка в положении 218 остатками {D, S, G или V},
и одной или нескольких из следующих модификаций: замену остатка в положении 61 остатками {D, E}, замену остатка в положении 62 остатками {D, E}, замену остатка в положении 76 остатками {D, E}, вставку остатка G в положение 97, замену остатка в положении 98 остатками {G, S}, замену остатка в положении 99 остатком G, замену остатка в положении 101 остатком G, замену остатка в положении 120 остатками {V, Q, D}, замену остатка в положении 131 остатками {T, S}, замену остатка в положении 137 остатком H, замену остатка в положении 194 остатком P, замену остатка в положении 228 остатком V, замену остатка в положении 230 остатком V, замену остатка в положении 261 остатком D, где указанные положения соответствуют положениям в последовательности зрелого полипептида SEQ ID NO:2 [BPN’].
Другой аспект настоящего изобретения относится к выделенным полинуклеотидам, кодирующим варианты субтилизинов, а также конструктам нуклеиновых кислот, векторам и клеткам-хозяевам, включающим эти полинуклеотиды.
Еще один аспект настоящего изобретения относится к чистящим или моющим композициям, предпочтительно композициям для стирки или мытья посуды, включающим варианты по настоящему изобретению. Один из аспектов настоящего изобретения относится к применению данных вариантов в моющих средствах, например, для стирки или мытья посуды.
Подробное описание изобретения
Определения
Протеолитическая активность. Данный термин определяется в настоящем описании, как способность расщеплять протеины (белки) в ходе протеолиза, который представляет собой катаболизм белков, происходящий в результате гидролиза пептидных связей, соединяющих аминокислотные остатки друг с другом в полипептидную цепь с образованием белка. Таким образом, под действием протеаз, обладающих протеолитической активностью, белки расщепляются на аминокислоты. Термины «протеазная активность» или «протеолитическая активность» являются взаимозаменяемыми. См. также приведенное ниже по тексту определение «протеаз».
Вариант. Термин «вариант» определяется в настоящем описании, как полипептид, включающий изменение или модификацию(и), например, замену, вставку и/или делецию одного или более (нескольких) аминокислотных остатков в одном или более (нескольких) конкретных положениях. Измененные полинуклеотиды получают в результате вмешательства человека путем изменения полинуклеотидной последовательности. Эти варианты могут представлять собой вариант субтилизина, т.е. вариант субтилизина, имеющего, например, полинуклеотидную последовательность, описанную в SEQ ID NO:1, или гомологичную ей последовательность. Термины «вариант протеазы» или «вариант субтилизина» являются взаимозаменяемыми. Варианты по настоящему изобретению предпочтительно обладают протеазной активностью или протеолитической активностью. Термины «один или более», «один или несколько» и «по меньшей мере, один» являются взаимозаменяемыми.
Модификация(и). Считается, что термин «модификация(и)» в настоящем описании включает химическую модификацию субтилазы, а также генетические операции с ДНК, кодирующей исходную протеазу. Модификация(и) может представлять собой замену(ы) боковой аминокислотной цепи(ей), замену(ы), делецию(и) и/или вставку(и) в представляющем интерес положении(ях) аминокислотной последовательности.
Фермент дикого типа. Термин вариант протеазы «дикого типа» означает вариант протеазы, экспрессируемой встречающимся в природе микроорганизмом, например, встречающимися в природе бактериями, дрожжами или мицеллярными грибами, т.е. полинуклеотид, кодирующий данный вариант протеазы, не был получен в результате человеческого вмешательства путем изменения полинуклеотидной последовательности.
Исходный фермент. Термин «исходный» вариант протеазы, например, «исходный» вариант субтилизина, в настоящем описании означает протеазу, например, субтилизин, в которой осуществляется модификация, например, замена(ы), вставка(и), делеция(и) и/или усечение(я), для получения вариантов фермента по настоящему изобретению. Данный термин относится также к полипептиду, с которым сравнивают или совмещают его вариант. Исходный вариант может быть природным полипептидом (дикого типа) или вариантом. Например, исходный полипептид может являться вариантом природного полипептида, аминокислотная последовательность которого подверглась модификации или изменению. Исходный полипептид может также являться аллельным вариантом, который представляет собой полипептид, закодированный любой из двух или нескольких альтернативных форм гена, занимающих один и тот же локус на хромосоме.
Выделенный вариант или полипептид. Термины «выделенный вариант» или «выделенный полипептид» в настоящем описании относятся к варианту или полипептиду, который выделен из своего источника. В одном из аспектов данный вариант или полипептид имеет, по меньшей мере, 1% чистоту, предпочтительно, по меньшей мере, 5% чистоту, более предпочтительно, по меньшей мере, 10% чистоту, более предпочтительно, по меньшей мере, 20% чистоту, более предпочтительно, по меньшей мере, 40% чистоту, более предпочтительно, по меньшей мере, 60% чистоту, еще более предпочтительно, по меньшей мере, 80% чистоту и, наиболее предпочтительно, по меньшей мере, 90% чистоту по данным SDS-PAGE.
По существу чистый вариант или полипептид. Термин «по существу чистый вариант» или «по существу чистый полипептид» в настоящем описании означают полипептидный препарат, который содержит не более 10%, предпочтительно не более 8%, более предпочтительно, не более 6%, более предпочтительно, не более 5%, более предпочтительно, не более 4%, более предпочтительно, не более 3%, еще более предпочтительно не более 2%, наиболее предпочтительно, не более 1%, и еще более предпочтительно, не более 0,5% по массе других полипептидных материалов, с которыми он связан нативно или рекомбинантно. Следовательно, предпочтительно, чтобы по существу чистый вариант или полипептид имел чистоту не менее 92%, предпочтительно, не менее 94%, более предпочтительно, не менее 95%, более предпочтительно, не менее 96%, более предпочтительно, не менее 97%, более предпочтительно, не менее 98%, еще более предпочтительно, не менее 99%, наиболее предпочтительно не менее 99,5% и еще более предпочтительно, не менее 100% по массе от общей массы полипептидного материала, присутствующего в препарате. Варианты и полипептиды по настоящему изобретению предпочтительно находятся по существу в чистой форме. Этого можно добиться, например, получая вариант или полипептид с помощью хорошо известных рекомбинантных методик или классическими способами очистки.
Зрелый полипептид. Термин «зрелый полипептид» определяется в настоящем описании, как полипептид, обладающий активностью варианта протеазы, которая имеется у его конечной формы, после трансляции или любых посттрансляционных модификаций, например, N-концевого процессинга, C-концевого укорачивания, гликозилирования, фосфорилирования и т.д. В одном из аспектов зрелый полипептид представляет собой полипептид, соответствующий SEQ ID NO:3 или SEQ ID NO:4. Для предсказания зрелого полипептида можно применять программу SignallP3.0.
Последовательность, кодирующая зрелый полипептид. Термин «последовательность, кодирующая зрелый полипептид» определяется в настоящем описании, как нуклеотидная последовательность, которая кодирует зрелый полипептид, обладающий активностью варианта протеазы. В одном из аспектов последовательность, кодирующая зрелый полипептид, представляет собой нуклеотиды, кодирующие SEQ ID NO:3 или SEQ ID NO:4.
Идентичность. Сходство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром «идентичность».
Для целей настоящего изобретения, степень идентичности между двумя аминокислотными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends in Genetics 16:276-277; http://emboss.org), предпочтительно версии 3.0.0 или более поздней. Используют следующие значения необязательных параметров: “gap open penalty” (штраф за делецию) устанавливают равным 10, “gap extension penalty” (штраф за продолжение делеции) устанавливают равным 0,5, и используют матрицу замен EBLOSUM62 (EMBOSS версия BLOSUM62). Результат работы программы Needle, именуемый “longest identity” («идентичность наибольшей протяженности») (полученный при включенной опции “Nobrief”), используют для определения идентичности в процентах, и вычисляют по следующей формуле:
(число идентичных остатков×100)/(длина выравнивания-общее количество делеций в выравнивании)
Для целей настоящего изобретения, степень идентичности между двумя дезоксирибонуклеотидными последовательностями определяют с использованием алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, см. выше), реализованного в программе Needle пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, см. выше; http://emboss.org), предпочтительно версии 3.0.0 или более поздней. Используют следующие значения необязательных параметров: “gap open penalty” (штраф за делецию) устанавливают равным 10, “gap extension penalty” (штраф за продолжение делеции) устанавливают на 0,5, и используют матрицу замен EDNAFULL (EMBOSS версия NCBI NUC4.4). Результат работы программы Needle, именуемый “longest identity” («идентичность наибольшей протяженности») (полученный при включенной опции “nobrief”), используют для определения идентичности в процентах, и вычисляют по следующей формуле:
(число идентичных дезоксирибонуклеотидов×100)/(длина выравнивания-общее количество делеций в выравнивании)
Гомологичная последовательность. Термин «гомологичная последовательность» определяется в настоящем описании, как ожидаемый полипептид, который имеет значение E (или величину “expectancy score” (математического ожидания)) менее 0,001 в поисковой программе tfasty (Pearson, W.R., 1999 in Bioinformatics Methods and Protocols, S. Misener and S.A. Krawetz, ed., pp.185-219) при сравнении с вариантом протеазы CBS 100236 Micrododhium nivale.
Полипептидный фрагмент. Термин «полипептидный фрагмент» определяется в настоящем описании, как полипептид, включающий один или более (несколько) аминокислотных остатков, удаленных с амино- и/или карбокси-конца зрелого полипептида; или гомологичная ему последовательность; где указанный фрагмент обладает активностью варианта протеазы.
Подпоследовательность. Термин «подпоследовательность» в настоящем описании определяется, как полинуклеотидная последовательность, включающая один или более (несколько) нуклеотидов, удаленных с 5’- и/или 3’-конца последовательности, кодирующей зрелый полипептид; или последовательность, гомологичную ей; где указанная последовательность кодирует полипептидный фрагмент, обладающий активностью варианта протеазы.
Аллельный вариант. Термин «аллельный вариант» в настоящем описании означает любую из двух или нескольких альтернативных форм гена, занимающих один и тот же локус на хромосоме. Аллельные варианты возникают естественным путем в результате мутаций и могут приводить к полиморфизму в популяциях. Мутации генов могут быть «молчащими» (не приводить к изменениям в кодируемом полипептиде), или они могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида представляет собой полипептид, закодированный аллельным вариантом гена.
Выделенный полинуклеотид. Термин «выделенный полинуклеотид» в настоящем описании относится к полинуклеотиду, который выделен из своего источника. В одном из аспектов выделенный полинуклеотид имеет, по меньшей мере, 1% чистоту, предпочтительно, по меньшей мере, 5% чистоту, более предпочтительно, по меньшей мере, 10% чистоту, более предпочтительно, по меньшей мере, 20% чистоту, более предпочтительно, по меньшей мере, 40% чистоту, более предпочтительно, по меньшей мере, 60% чистоту, еще более предпочтительно, по меньшей мере, 80% чистоту, наиболее предпочтительно, по меньшей мере, 90% чистоту, и даже еще более предпочтительно, 95% чистоту по данным электрофореза в агарозном геле.
По существу чистый полинуклеотид. Термин «по существу чистый полинуклеотид» в настоящем описании относится к полинуклеотидному препарату, свободному от других посторонних или нежелательных нуклеотидов, и находящемуся в форме, подходящей для применения в генно-инженерных системах выработки полипептидов. Так, например, по существу чистый полинуклеотид содержит не более 10%, предпочтительно не более 8%, более предпочтительно, не более 6%, более предпочтительно, не более 5%, более предпочтительно, не более 4%, более предпочтительно, не более 3%, еще более предпочтительно не более 2%, наиболее предпочтительно, не более 1%, и еще более предпочтительно, не более 0,5% по массе других полинуклеотидных материалов, с которыми он связан нативно или рекомбинантно. Тем не менее, по существу чистый нуклеотид может включать встречающиеся в природном продукте нетранслируемые 5’- и 3’-области, такие как промоторы и терминаторы. Предпочтительно, чтобы по существу чистый полинуклеотид имел чистоту по массе не менее 90%, предпочтительно, не менее 92%, более предпочтительно, не менее 94%, более предпочтительно, не менее 95%, более предпочтительно, не менее 96%, более предпочтительно, не менее 97%, еще более предпочтительно, не менее 98%, наиболее предпочтительно, не менее 99%, и даже еще более предпочтительно не менее 99,5%. Полинуклеотиды по настоящему изобретению предпочтительно находятся по существу в чистой форме, т.е. полинуклеотидный препарат в основном свободен от других полинуклеотидных материалов, с которыми он связан нативно или рекомбинантно. Полинуклеотиды могут иметь геномное, кДНК, РНК, полусинтетическое, синтетическое или комбинированное происхождение.
Кодирующая последовательность. В настоящем описании термин «кодирующая последовательность» означает полинуклеотид, который непосредственно определяет аминокислотную последовательность полипептидного продукта. Границы кодирующей последовательности, как правило, определяются открытой рамкой считывания, которая обычно начинается инициирующим кодоном ATG или альтернативными инициирующими кодонами, например, GTG и TTG, и заканчивается терминирующим кодонами, например, TAA, TAG и TGA. Указанная кодирующая последовательность может представлять собой ДНК, кДНК, синтетический или рекомбинантный полинуклеотид.
кДНК. Термин «кДНК» в настоящем описании означает молекулу ДНК, которую можно получить обратной транскрипцией из зрелой, сплайсированной молекулы мРНК, полученной из эукариотической клетки. кДНК не содержат интронных последовательностей, которые обычно присутствуют в соответствующей геномной ДНК. Исходный первичный транскрипт РНК является предшественником мРНК и в результате ряда промежуточных стадий превращается в зрелую сплайсированную мРНК. Эти стадии включают удаление интронных последовательностей в ходе процесса, называемого сплайсингом. Поэтому кДНК, образующаяся из мРНК, не содержит каких-либо интронных последовательностей.
Конструкт нуклеиновой кислоты. Термин «конструкт нуклеиновой кислоты» в настоящем описании относится к одно- или двухцепочечной молекуле нуклеиновой кислоты, которая выделена из природного гена или подверглась такой модификации, что она содержит фрагменты нуклеиновых кислот, расположенные в таком порядке, который, в ином случае, не мог бы существовать в природе, или является синтетическим. Термин «конструкт нуклеиновой кислоты» является синонимом термину «кассета экспрессии», если конструкт нуклеиновой кислоты содержит управляющие последовательности, необходимые для экспрессии кодирующей последовательности по настоящему изобретению.
Управляющие последовательности. Термин «управляющие последовательности» в настоящем описании включает все компоненты, необходимые для экспрессии полинуклеотида, кодирующего полипептид по настоящему изобретению. Каждая из управляющих последовательностей может являться нативной или чужеродной по отношению к нуклеотиду, кодирующему полипептид, кроме того они могут быть нативными или чужеродными по отношению друг к другу. Указанные управляющие последовательности включают, но, не ограничиваясь ими, лидерную последовательность, последовательность полиаденилирования, пропептидную последовательность, промотор, последовательность сигнального пептида и терминатор транскрипции. В минимальном варианте управляющие последовательности включают промотор и сигналы остановки транскрипции и трансляции. Управляющие последовательности могут быть снабжены линкерами, облегчающими сшивание управляющих последовательностей с кодирующими участками полинуклеотида, кодирующего полипептид, с целью введения определенных сайтов рестрикции.
Функционально связанный. Термин «функционально связанный» в настоящем описании означает конфигурацию, в которой управляющая последовательность находится в надлежащем положении по отношению к кодирующей последовательности полинуклеотидной последовательности, так что управляющая последовательность управляет экспрессией кодирующей последовательности полипептида.
Экспрессия. Термин «экспрессия» включает любые стадии, вовлеченные в выработку полипептида, включающие, но, не ограничиваясь ими, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Вектор экспрессии. Термин «вектор экспрессии» в настоящем описании относится к линейной или кольцевой молекуле ДНК, которая включает полинуклеотид, кодирующий полипептид по настоящему изобретению, и функционально связана с дополнительными нуклеотидами, которые обеспечивают экспрессию кодирующего полинуклеотида.
Клетка-хозяин. Термин «клетка-хозяин» в настоящем описании включает любые типы клеток, которые восприимчивы к трансформации, трансфекции, трансдукции и т.п. конструктом нуклеиновой кислоты или вектором экспрессии, включающим полинуклеотид по настоящему изобретению. Термин «клетка-хозяин» охватывает любое потомство родительской клетки, которое не идентично родительской клетке вследствие мутаций, происходивших при репликации.
Улучшенное свойство. Термин «улучшенное свойство» определяется в настоящем описании, как характеристика, относящаяся к варианту по настоящему изобретению, которая улучшена по сравнению с соответствующей характеристикой исходного варианта протеазы. Такие улучшенные свойства включают, но, не ограничиваясь перечисленным, моющую эффективность, например, эффективность в отношении загрязнений, например, загрязнений, содержащих белок, эффективность удаления загрязнений, например, удаления остатков яиц, устойчивость, например, термическую устойчивость, устойчивость в кислой или щелочной среде, или устойчивость в порошке, жидких или гелевых моющих композициях или композициях для мытья посуды, измененный профиль зависимости активности от температуры, зависимости активности от pH, специфичности к субстратам, специфичности к продуктам, и химическую стабильность. В одном из вариантов осуществления улучшенные свойства включают улучшенную эффективность стирки или мытья посуды, например, удаления белковых загрязнений, таких как остатки яиц.
Моющая эффективность. В контексте настоящего описания термин «моющая эффективность» используется в отношении способности фермента удалять белковые или органические загрязнения, присутствующие на объекте, который предполагается очистить во время, например, мытья или чистки твердой поверхности. Улучшение моющей эффективности может быть количественно охарактеризовано путем вычисления величины, так называемой интенсивности (Int), определенной в примере 3 настоящего описания. См. также тест на моющую эффективность в примере 3 настоящего описания.
Улучшенная моющая эффективность. Термин «улучшенная моющая эффективность» в настоящем описании относится к варианту фермента, демонстрирующему изменение моющей эффективности варианта протеазы по отношению к моющей эффективности исходного варианта протеазы, например, за счет увеличения эффективности удаления загрязнений. Термин «моющая эффективность» включает моющую эффективность при стирке, а также, например, при мытье посуды.
Очистка твердых поверхностей. Данный термин включает «мытье посуды» и относится к очистке твердых объектов, например, обычных объектов мытья посуды, которые включают, но, не ограничиваясь ими, тарелки, чашки, стаканы, миски и столовые приборы, например, ложки, ножи, вилки, сервировочный инвентарь, керамическую посуду, пластиковую посуду, металлическую посуду, фарфоровые изделия, стеклянную посуду и акриловые изделия.
Композиция для мытья посуды. Термин «композиция для мытья посуды» относится ко всем формам композиций для очистки твердых поверхностей. Настоящее изобретение не ограничено каким-либо конкретным типом композиции для мытья посуды или каким-либо конкретным моющим компонентом.
Протеазы
Ферменты, расщепляющие амидные связи в белковых субстратах, относят к протеазам или (что имеет эквивалентное значение) к пептидазам (см. Walsh, 1979, Enzymatic Reaction Mechanisms. W.H. Freeman and Company, San Francisco, Chapter 3).
Нумерация положений аминокислот/остатков
Если не имеется каких-либо других указаний, нумерация аминокислотных остатков, используемая в настоящем описании, соответствует нумерации последовательности субтилазы BPN’ (BASBPN). Для более подробного ознакомления с последовательностью BPN’, см. SEQ ID NO:2 или Siezen et al., Protein Engng. 4 (1991) 719-737.
Сериновые протеазы
Сериновая протеаза представляет собой фермент, катализирующий гидролиз пептидных связей, в котором ключевую роль в активном центре играют остатки серина (White, Handler and Smith, 1973 “Principles of Biochemistry”, Fifth Edition, McGraw-Hill Book Company, NY, pp.271-272).
Бактериальные сериновые протеазы имеют молекулярные массы в диапазоне от 20000 до 45000 Дальтон. Их активность ингибируется диизопропилфторфосфатом. Они гидролизуют простые концевые сложноэфирные группы и похожи по своей активности на химотрипсин эукариотов, который также является сериновой протеазой. Более узкий термин, а именно, «щелочная протеаза», который охватывает подгруппу сериновых протеаз, отражает высокие оптимальные значения pH для некоторых сериновых протеаз, а именно от 9,0 до 11,0, (для ознакомления с обзором, см. Priest (1977) Bacteriological Rev. 41711-753).
Субтилазы
Подгруппа сериновых протеаз, условно называемых субтилазами, была предложена в работах Siezen et al., Protein Engng. 4 (1991) 719-737 и Siezen et al., Protein Science 6 (1997) 501-523. Они определены с помощью гомологического анализа более 170 аминокислотных последовательностей сериновых протеаз, называвшихся ранее субтилизин-подобными протеазами. Ранее субтилизин часто определяли, как сериновую протеазу, вырабатываемую грамположительными бактериями или грибками, и, согласно Siezen и соавторам, сейчас его относят к подгруппе субтилаз. Был идентифицирован широкий круг субтилаз, и для ряда субтилаз были определены аминокислотные последовательности. С более подробным описанием таких субтилаз и их аминокислотных последовательностей можно ознакомиться в приведенной работе Siezen et al. (1997).
Одна подгруппа субтилаз, а именно I-S1 или «настоящие» субтилизины, включает «классические» субтилизины, например, субтилизин 168 (BSS168), субтилизин BPN’, субтилизин Carlsberg (ALCALASE®, NOVOZYMES A/S) и субтилизин DY (BSSDY).
Еще одна подгруппа субтилаз, а именно I-S2 или высокощелочные субтилизины, выявлена Siezen и соавторами (см. выше). Протеазы подгруппы I-S2 описаны как высокощелочные субтилизины и включают такие ферменты, как субтилизин PB92 (BAALKP) (MAXACAL®, Genencor International Inc.), субтилизин 309 (SAVINASE®, NOVOZYMES A/S), субтилизин 147 (BLS147) (ESPERASE®, NOVOZYMES A/S) и щелочную эластазу YaB (BSEYAB).
“SAVINASE®”
SAVINASE® поставляется на рынок NOVOZYMES A/S. Этот продукт представляет собой субтилизин 309 из B. Lentus, и отличается от BAALKP только в одном положении (N87S). SAVINASE® имеет аминокислотную последовательность SEQ ID NO:1.
Исходная субтилаза
Термин «исходная субтилаза» описывает субтилазу, определенную в соответствии с работами Siezen и соавторов (1991 и 1997). Для ознакомления с дополнительными подробностями см. описание «субтилаз» выше по тексту. Исходная субтилаза может также являться субтилазой, выделенной из природного источника, где при сохранении характеристик субтилазы осуществлялись последующие модификации. Кроме того, исходная субтилаза может являться субтилазой, которая получена по методике перестановок в ДНК, например, описанной J.E.Ness et al., Nature Biotechnology, 17, 893-896 (1999).
Альтернативно, термин «исходная субтилаза» может быть заменен термином «субтилаза дикого типа».
Для справки ниже приведена таблица акронимов различных субтилаз, указанных в настоящем описании, и для ознакомления с другими акронимами, см. Siezen et al., Protein Engng.4 (1991) 719-737 и Siezen et al., Protein Science 6 (1997) 501-523.
|
Модификация(и) субтилазы
Имеется в виду, что термин «модификация(и)» включает химическую модификацию субтилазы, а также генетические операции с ДНК, кодирующей субтилазу. Модификация(и) может представлять собой замену(ы) аминокислотной боковой цепи(ей), замену(ы), делецию(и) и/или вставку(и) в и/или по представляющему интерес аминокислотному остатку(ам).
Вариант субтилазы
Термин «вариант» и термин «вариант субтилазы» определены выше.
Гомологичные последовательности субтилаз
Гомология между двумя аминокислотными последовательностями в данном контексте для целей настоящего изобретения описывается параметром «идентичность», где степень идентичности между двумя аминокислотными последовательностями определяется с применением алгоритма Нидлмана-Вунша, как описано выше. Результатом применения данного алгоритма, помимо выравнивания аминокислотных последовательностей, является вычисление «идентичности в процентах» между двумя последовательностями.
Выявление подходящих гомологичных субтилаз, которые можно модифицировать согласно настоящему изобретению, является стандартной операцией для специалиста в данной области техники на основании настоящего описания.
В одном из аспектов исходная протеаза включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:1 предпочтительно не менее 80%, более предпочтительно, не менее 81%, более предпочтительно, не менее 82%, более предпочтительно не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, еще более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно не менее 95%, и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:1.
По существу гомологичные варианты исходной протеазы могут иметь одну или более (несколько) замен, делеций и/или вставок аминокислотных остатков, где в контексте настоящего описания термин «одна или более» является взаимозаменяемым с термином «несколько». Эти изменения предпочтительно носят несущественный характер, т.е. представляют собой консервативные замены аминокислотных остатков, как описано выше, и другие замены, которые не оказывают существенного влияния на укладку трехмерной структуры или активность белка или полипептида; небольшие делеции, как правило, от одного до примерно 30 аминокислотных остатков; и небольшие удлинения амино- и карбокси-концов, например, введение амино-концевого метионинового остатка, небольшого линкерного пептида длиной примерно до 20-25 остатков, или небольшого удлинения, облегчающего очистку (аффинной метки), например, полигистидинового фрагмента или белка A (Nilsson et al., 1985, EMBO J. 4:1075; Nilsson et al., 1991, Methods Enzymol. 198:3. См. также, для общей информации, Ford et al., 1991, Protein Expression and Purification 2:95-107).
Хотя описанные выше изменения предпочтительно носят несущественный характер, эти изменения могут также носить и существенный характер, например, включать встраивание крупных полипептидов размером до 300 аминокислотных остатков или более в качестве амино- или карбокси-концевых удлинений.
Исходная протеаза может включать или состоять из аминокислотных последовательностей SEQ ID NO:1 или ее аллельных вариантов; или их фрагментов, имеющих протеолитическую активность. В одном из аспектов исходная протеаза включает или состоит из аминокислотной последовательности SEQ ID NO:1.
Варианты субтилаз
Настоящее изобретение относится к новым вариантам субтилаз, демонстрирующим изменения одного или нескольких свойств по сравнению с исходной субтилазой, а именно: моющей эффективности, например, демонстрирующим улучшенную способность удаления загрязнений, моющей эффективности при очистке твердых поверхностей, например, при мытье посуды, устойчивости, например, при хранении или термической устойчивости, а также каталитической активности. В одном из аспектов настоящего изобретения приведенные варианты обладают улучшенной способностью удаления остатков яичных желтков, например, улучшенной эффективностью удаления желтка вареных яиц с твердых поверхностей.
Эффективность моющих составов вариантов субтилазы по настоящему изобретению можно установить в экспериментах по определению моющей способности. Варианты фермента можно тестировать с использованием автоматического анализа механического усилия (AMSA), который подробно описан в примере 3.
Каталитическую активность вариантов по настоящему изобретению можно определить с использованием анализа «кинетика гидролиза модельного субстрата Suc AAPF-pNA», который подробно описан в примерах.
В одном из вариантов осуществления вариант субтилазы, считающийся частью настоящего изобретения, является таким вариантом, в котором, по сравнению с исходной субтилазой, был заменен, исключен или включен один или несколько аминокислотных остатков, где указанный вариант включает вариант исходного субтилизина, содержащий замены 9{R,K,H}, 15{G,A,S,T,M}, 68{G,A,S,T,M}, 218{D,S,G,V} и 245{R,K,H}, причем указанный вариант дополнительно включает, по меньшей мере, одну из следующих модификаций: 61{D,E}, 62{D,E}, 76{D,E}, *97aG, 98{G,S}, 99G, 101G, 120{V,Q,D}, 131{T,S}, 137H, 194P, 228V, 230V, 261D, где указанные положения соответствуют положениям в зрелом полипептиде SEQ ID NO:2 [BPN’].
В одном из вариантов осуществления настоящего изобретения указанный вариант дополнительно включает, по меньшей мере, одно из следующих изменений G61E, A98S или S99G.
В конкретном варианте осуществления настоящего изобретения указанный вариант включает замены S9R, A15T, G61E, V68A, A98S, S99G, N218D и Q245R.
Как для природных ферментов, так и для ферментов искусственного происхождения, а также для разработки и получения вариантов исходной субтилазы, предпочтительно, чтобы исходная субтилаза принадлежала к подгруппам I-S1 или I-S2, в особенности подгруппе I-S2.
Что касается вариантов из подгруппы I-S1, предпочтительно выбирать исходную субтилазу из группы, состоящей из BSS168 (BSSAS, BSAPRJ, BSAPRN, BMSAMP), BASBPN, BSSDY, BLSCAR (BLKERA, BLSCA1, BLSCA2, BLSCA3), BSSPRC (сериновой протеазы C) и BSSPRD (сериновой протеазы D) или их функциональных вариантов, у которых сохраняются характеристики подгруппы I-S1.
Что касается вариантов из подгруппы I-S2, предпочтительно выбирать исходную субтилазу из группы, состоящей из BSAPRQ, BLS147 (BSAPRM, BAH101), BLSAVI (BSKSMK, BAALKP, BLSUBL), BYSYAB, BAPB92, TVTHER и BSAPRS или их функциональных вариантов, у которых сохраняются характеристики подгруппы I-S2.
В частности, исходная субтилаза представляет собой BLSAVI (Savinase®, NOVOZYMES A/S) и, соответственно, предпочтительный вариант субтилазы по настоящему изобретению представляет собой вариант Savinase® (SEQ ID NO:1).
Условные обозначения для описания вариантов
Для целей настоящего изобретения, аминокислотная последовательность BPN’, представленная SEQ ID NO:2, используется для определения соответствующего аминокислотного остатка в другой протеазе или варианте протеазы. Аминокислотные последовательности другой протеазы или варианта протеазы выравнивают с аминокислотной последовательностью протеазы, представленной SEQ ID NO:2, и на основании данного выравнивания можно определить номер положения, соответствующий любому аминокислотному остатку аминокислотной последовательности варианта протеазы, представленного SEQ ID NO:2.
Выравнивание полипептидных последовательностей можно осуществлять, например, используя “ClustalW” (Thompson, J.D., Higgins, D.G. and Gibson, T.J., 1994, CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice, Nucleic Acids Research 22: 4673-4680). Выравнивание последовательностей ДНК можно осуществить, используя выравнивание полипептидных последовательностей в качестве шаблона, и заменяя аминокислоты соответствующими кодонами из последовательности ДНК.
Широко распространенные алгоритмы попарного сравнения последовательностей подходят для выявления подобия между полипептидными последовательностями, отличия которых друг от друга не выходят за рамки примерно 20-30% идентичности последовательностей (Doolittle, 1992, Protein Sci. 1:191-200; Brenner et al., 1998, Proc. Natl. Acad. Sci. USA 95, 6073-6078). Однако реально гомологичные полипептиды с одной и той же укладкой и аналогичными биологическими функциями часто различаются до такой степени, что традиционное сравнение последовательностей не способно установить взаимосвязь между ними (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615). Более высокой чувствительности в поиске подобия последовательностей можно добиться, используя поисковые программы, которые используют вероятностные представления семейств полипептидов (профилей) для поисков в базах данных. Например, программа PSI-BLAST генерирует профили с помощью итерационного поиска в базе данных, и способна обнаруживать отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большей чувствительности можно добиться, если семейство или суперсемейство представляющего интерес полипептида имеет один или более (несколько) представителей в базах данных структуры белков. Такие программы, как GenTHREADER (Jones 1999, J. Mol. Biol. 287:797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881) используют информацию из различных источников (PSI-BLAST, предсказания вторичной структуры, профили выравнивания структур и потенциалы сольватации) в качестве исходных данных для нейронной сети, которая предсказывает структурную укладку для запрашиваемой последовательности. Аналогично, можно применять методику Gough et al., 2000, J. Mol. Biol. 313:903-919 для соотнесения последовательности неизвестной структуры с моделями суперсемейств, имеющихся в базе данных SCOP. Такие соотнесения в свою очередь можно использовать для моделей гомологии для представляющего интерес полипептида, и точность таких моделей можно оценить, применяя ряд средств, разработанных для этой цели.
Для белков известной структуры доступно несколько средств и ресурсов для нахождения и генерирования структурных соответствий. Например, были структурно выровнены суперсемейства белков SCOP, и эти выравнивания доступны и могут быть загружены из сети интернет. Структуры двух или нескольких белков могут быть сопоставлены с использованием ряда алгоритмов, например, матрицы дистанционного выравнивания (Holm and Sander, 1998, Proteins 33:88-96) или комбинаторного удлинения (Shindyalov and Bourne, 1998, Protein Eng. 11:739-747), и эти алгоритмы могут найти дополнительное применение для направления запроса относительно представляющей интерес структуры базе структурных данных с целью обнаружения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16:566-567). Эти структурные сопоставления могут использоваться для предсказания структурно и функционально соответствующих аминокислотных остатков в белках в рамках одного и того же структурного суперсемейства. Эта информация, наряду с информацией, полученной из моделирования гомологии и профильного поиска, может использоваться для предсказания того, какие остатки необходимо изменить при перемещении представляющей интерес мутации из одного белка в его близкий или отдаленный гомолог.
При описании различных вариантов протеаз по настоящему изобретению, для облегчения изложения, принимается описанная ниже номенклатура. Во всех случаях для аминокислот применяются принятые IUPAC однобуквенные или трехбуквенные сокращения.
При описании различных вариантов фермента субтилазы, полученных или рассматриваемых в настоящем изобретении, для облегчения изложения принималась приведенная ниже номенклатура и условные обозначения:
Во-первых определяли пределы соответствия, выравнивая последовательность выделенного или исходного фермента с последовательностью субтилизина BNP’ (BASBPN) SEQ ID NO:2, как описано выше.
Варианты исходной протеазы
Замены. Для замены аминокислотных остатков используется следующая номенклатура: исходная аминокислота, положение, замещающая аминокислота. Соответственно, замена треонина аланином в положении 226 обозначается как “Thr226Ala” или “T226A”. Множественные замены можно разделять символом сложения (знаком «+»), например, “Gly205Arg+Ser411Phe” или “G205R+S411F” означает мутации в положениях 205 и 411, представляющие собой замену глицина (G) аргинином (R) и серина (S) фенилаланином (F), соответственно. Альтернативно, множественные мутации можно разделять пробелом, например, G205R S411F, или запятой (,), например, G205R, S411F.
Делеции. Для делеций аминокислотных остатков используется следующая номенклатура: исходная аминокислота, положение*. Соответственно, делецию глицина в положении 195 обозначают как “Gly195*” или “G195*”. Множественные делеции можно разделять, как описано выше для замен, например, запятой (,) “Gly195*, Ser411*” или “G195*, S411*”.
Вставки. Для вставок аминокислотных остатков используется следующая номенклатура: исходная аминокислота, положение, исходная аминокислота, вновь введенная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначается “Gly195GlyLys” или “G195GK” или “*195aK”. Множественные вставки аминокислотных остатков обозначаются [исходная аминокислота, положение, исходная аминокислота, вновь введенная аминокислота №1, вновь введенная аминокислота №2; и т.д.]. Например, вставка лизина и аланина после глицина в положении 195 обозначается как “Gly195GlyLysAla” или “G195GKA”.
В этих случаях введенный аминокислотный остаток(ки) нумеруется путем добавления строчной буквы к номеру положения аминокислотного остатка, предшествующего введенному аминокислотному остатку(ам).
Таким образом, в приведенном выше примере последовательность могла бы выглядеть таким образом:
|
Вариант исходной протеазы можно получать из любых подходящих источников, таких как микроорганизмы, например, грибы, например, мицеллярные грибы или дрожжи, или они могут представлять собой искусственные последовательности, полученные из известных нуклеиновых кислот или на основе информации об аминокислотной последовательности.
Штаммы указанных микроорганизмов легко доступны неограниченному кругу пользователей из коллекций культур, например, American Type Culture Collection (ATCC, Американской коллекции типовых культур), Deutsche Sammlung von Mikroorganismen und Zelikulturen GmbH (DSM, Германской коллекции микроорганизмов и культур клеток) и Centraalbureau Voor Schimmelcultures (CBS, Центрального бюро грибковых культур, Нидерланды).
В одном из аспектов настоящего изобретения исходный субтилизин является полипептидом, включающим аминокислотную последовательность, которая, по меньшей мере, на 80% идентична SEQ ID NO:1.
В одном из аспектов настоящего изобретения исходная протеаза включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:1 предпочтительно не менее 80%, более предпочтительно, не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95%, и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:1.
В другом аспекте исходная протеаза включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:1 предпочтительно не менее 80%, более предпочтительно, не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95%, и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:1, где указанная последовательность обладает протеолитической активностью.
В одном из аспектов настоящего изобретения варианты имеют аминокислотную последовательность, которая отличается от SEQ ID NO:1 тридцатью аминокислотными остатками, двадцатью девятью аминокислотными остатками, двадцатью восемью аминокислотными остатками, двадцатью семью аминокислотными остатками, двадцатью шестью аминокислотными остатками, двадцатью пятью аминокислотными остатками, двадцатью четырьмя аминокислотными остатками, двадцатью тремя аминокислотными остатками, двадцатью двумя аминокислотными остатками, двадцатью одним аминокислотными остатками, двадцатью аминокислотными остатками, девятнадцатью аминокислотными остатками, восемнадцатью аминокислотными остатками, семнадцатью аминокислотными остатками, шестнадцатью аминокислотными остатками, пятнадцатью аминокислотными остатками, четырнадцатью аминокислотными остатками, тринадцатью аминокислотными остатками, двенадцатью аминокислотными остатками, одиннадцатью аминокислотными остатками, десятью аминокислотными остатками, девятью аминокислотными остатками, восемью аминокислотными остатками, семью аминокислотными остатками, шестью аминокислотными остатками, пятью аминокислотными остатками, четырьмя аминокислотными остатками, тремя аминокислотными остатками, двумя аминокислотными остатками или одним аминокислотным остатком.
В конкретном аспекте настоящего изобретения варианты по настоящему изобретению имеют аминокислотную последовательность, которая отличается от SEQ ID NO:1 двенадцатью аминокислотными остатками, более предпочтительно, одиннадцатью аминокислотными остатками, более предпочтительно, десятью аминокислотными остатками, еще более предпочтительно, девятью аминокислотными остатками и даже еще более предпочтительно, восемью аминокислотными остатками.
В одном из аспектов количество изменений аминокислотных остатков в вариантах по настоящему изобретению по сравнению с исходным (например, исходным вариантом протеазы, имеющим аминокислотную последовательность, показанную в SEQ ID NO:1) включает или состоит из 20 изменений, 19 изменений, 18 изменений, 17 изменений, 16 изменений, 15 изменений, 14 изменений, 13 изменений, 12 изменений, 11 изменений, 10 изменений, 9 изменений, 8 изменений, 7 изменений, 6 изменений, 5 изменений, 4 изменений, более предпочтительно 3 изменений, еще более предпочтительно 2 изменений и наиболее предпочтительно 1 изменения. В другом аспекте число изменений аминокислотных остатков в вариантах по настоящему изобретению состоит из предпочтительно 20 изменений, 19 изменений, 18 изменений, 17 изменений, 16 изменений, 15 изменений, 14 изменений, 13 изменений, 12 изменений, 11 изменений, 10 изменений, 9 изменений, 8 изменений, 7 изменений, 6 изменений, 5 изменений, 4 изменений, 3 изменений, 2 изменений или 1 изменения.
В одном из аспектов количество изменений аминокислотных остатков в вариантах по настоящему изобретению по сравнению с исходным (например, исходным вариантом протеазы, имеющим аминокислотную последовательность, показанную SEQ ID NO:1) включает или состоит из 20 замен, 19 замен, 18 замен, 17 замен, 16 замен, 15 замен, 14 замен, 13 замен, 12 замен, 11 замен, 10 замен, 9 замен, 8 замен, 7 замен, 6 замен, 5 замен, 4 замен, более предпочтительно 3 замен, еще более предпочтительно 2 замен и наиболее предпочтительно 1 замены. В другом аспекте число замен аминокислотных остатков в вариантах по настоящему изобретению состоит из предпочтительно 20 замен, 19 замен, 18 замен, 17 замен, 16 замен, 15 замен, 14 замен, 13 замен, 12 замен, 11 замен, 10 замен, 9 замен, 8 замен, 7 замен, 6 замен, 5 замен, 4 замен, 3 замен, 2 замен или 1 замены.
В одном из аспектов вариант включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:1 предпочтительно не менее 80%, более предпочтительно не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95%, и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:1.
В одном из аспектов вариант включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:1 предпочтительно не менее 80%, более предпочтительно, не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95% и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:1, где указанный вариант обладает протеолитической активностью.
В одном из аспектов настоящее изобретение относится к применению варианта, который может включать или состоять из аминокислотной последовательности SEQ ID NO:3 или ее аллельного варианта; или ее фрагмента, имеющего активность варианта протеазы. В одном из аспектов данный вариант включает или состоит из аминокислотной последовательности SEQ ID NO:3. В другом аспекте настоящее изобретение относится к применению варианта, который может включать или состоять из аминокислотной последовательности SEQ ID NO:3 или ее аллельного варианта, в очистке твердых поверхностей. Кроме того, настоящее изобретение относится к способу удаления белковых загрязнений, особенно остатков вареных яиц, с твердых поверхностей или с белья, где указанный способ включает приведение в контакт твердой поверхности с остатками яиц или текстильного белья с пятнами от яиц, с чистящей или моющей композицией, предпочтительно, композиций для стирки текстильного белья или для мытья посуды, содержащей вариант субтилизина, который может включать или состоять из аминокислотной последовательности SEQ ID NO:3 или ее аллельного варианта. В одном из аспектов данный вариант включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:3 предпочтительно не менее 80%, более предпочтительно не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95% и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:3.
В одном из аспектов вариант включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:3 предпочтительно не менее 80%, более предпочтительно, не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95% и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:3, где указанный вариант обладает протеолитической активностью.
В одном из аспектов настоящего изобретения, варианты имеют аминокислотную последовательность, которая отличается от SEQ ID NO:3 тридцатью аминокислотными остатками, двадцатью девятью аминокислотными остатками, двадцатью восемью аминокислотными остатками, двадцатью семью аминокислотными остатками, двадцатью шестью аминокислотными остатками, двадцатью пятью аминокислотными остатками, двадцатью четырьмя аминокислотными остатками, двадцатью тремя аминокислотными остатками, двадцатью двумя аминокислотными остатками, двадцатью одним аминокислотными остатками, двадцатью аминокислотными остатками, девятнадцатью аминокислотными остатками, восемнадцатью аминокислотными остатками, семнадцатью аминокислотными остатками, шестнадцатью аминокислотными остатками, пятнадцатью аминокислотными остатками, четырнадцатью аминокислотными остатками, тринадцатью аминокислотными остатками, двенадцатью аминокислотными остатками, одиннадцатью аминокислотными остатками, десятью аминокислотными остатками, девятью аминокислотными остатками, восемью аминокислотными остатками, семью аминокислотными остатками, шестью аминокислотными остатками, пятью аминокислотными остатками, четырьмя аминокислотными остатками, тремя аминокислотными остатками, двумя аминокислотными остатками или одним аминокислотным остатком.
В одном из аспектов настоящее изобретение относится к применению варианта, который может включать или состоять из аминокислотной последовательности SEQ ID NO:4 или ее аллельного варианта; или ее фрагмента, имеющего активность варианта протеазы. В одном из аспектов данный вариант включает или состоит из аминокислотной последовательности SEQ ID NO:4. В другом аспекте настоящее изобретение относится к применению варианта, который может включать или состоять из аминокислотной последовательности SEQ ID NO:4 или ее аллельного варианта, в очистке твердых поверхностей. Кроме того, настоящее изобретение относится к способу удаления белковых загрязнений, особенно остатков вареных яиц, с твердых поверхностей или с текстильного белья, где указанный способ включает приведение в контакт твердой поверхности с остатками яиц или текстильного белья с пятнами от яиц, с чистящей или моющей композицией, предпочтительно, композиций для стирки текстильного белья или для мытья посуды, содержащей вариант субтилизина, который может включать или состоять из аминокислотной последовательности SEQ ID NO:4 или ее аллельного варианта.
В одном из аспектов данный вариант включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:4 предпочтительно не менее 80%, более предпочтительно не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95%, и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:4.
В одном из аспектов вариант включает аминокислотную последовательность, имеющую степень идентичности с SEQ ID NO:4 предпочтительно не менее 80%, более предпочтительно, не менее 81%, более предпочтительно, не менее 82%, более предпочтительно, не менее 83%, более предпочтительно, не менее 84%, более предпочтительно, не менее 85%, более предпочтительно, не менее 86%, более предпочтительно, не менее 87%, более предпочтительно, не менее 88%, более предпочтительно, не менее 89%, более предпочтительно, не менее 90%, более предпочтительно, не менее 91%, более предпочтительно, не менее 92%, более предпочтительно, не менее 93%, более предпочтительно, не менее 94%, наиболее предпочтительно, не менее 95%, и еще более предпочтительно не менее 96%, не менее 97%, не менее 98% или не менее 99%, или даже 100% идентичность с SEQ ID NO:4, где указанный вариант обладает протеолитической активностью.
В одном из аспектов настоящего изобретения, варианты имеют аминокислотную последовательность, которая отличается от SEQ ID NO:4 тридцатью аминокислотными остатками, двадцатью девятью аминокислотными остатками, двадцатью восемью аминокислотными остатками, двадцатью семью аминокислотными остатками, двадцатью шестью аминокислотными остатками, двадцатью пятью аминокислотными остатками, двадцатью четырьмя аминокислотными остатками, двадцатью тремя аминокислотными остатками, двадцатью двумя аминокислотными остатками, двадцатью одним аминокислотными остатками, двадцатью аминокислотными остатками, девятнадцатью аминокислотными остатками, восемнадцатью аминокислотными остатками, семнадцатью аминокислотными остатками, шестнадцатью аминокислотными остатками, пятнадцатью аминокислотными остатками, четырнадцатью аминокислотными остатками, тринадцатью аминокислотными остатками, двенадцатью аминокислотными остатками, одиннадцатью аминокислотными остатками, десятью аминокислотными остатками, девятью аминокислотными остатками, восемью аминокислотными остатками, семью аминокислотными остатками, шестью аминокислотными остатками, пятью аминокислотными остатками, четырьмя аминокислотными остатками, тремя аминокислотными остатками, двумя аминокислотными остатками или одним аминокислотным остатком.
По существу гомологичные варианты могут иметь одну или несколько замен, делеций и/или вставок аминокислотных остатков. Эти изменения предпочтительно имеют несущественный характер, т.е. представляют собой консервативные замены аминокислотных остатков, как описано выше, и другие замены, которые не оказывают значительное влияние на трехмерную укладку или активность белка или полипептида; небольшие делеции, как правило, от одного до примерно 30 аминокислотных остатков; а также небольшие удлинения амино- или карбокси-концов, например, введение амино-концевого остатка метионина, небольшого линкерного пептида длиной примерно до 20-25 остатков или небольшого удлинения, которое облегчает очистку (аффинной метки), например, полигистидинового фрагмента или белка A (Nilsson et al., 1985, EMBO J. 4:1075; Nilsson et al., 1991, Methods Enzymol.198:3. См. также, для общей информации, Ford et al., 1991, Protein Expression and Purification 2:95-107).
Хотя описанные выше изменения предпочтительно носят несущественный характер, эти изменения могут также носить и существенный характер, например, включать встраивание крупных полипептидов размером до 300 аминокислотных остатков или более, в качестве амино- или карбокси-концевых удлинений.
Получение вариантов
Варианты исходной протеазы можно получать с применением любой методики мутагенеза, известной в данной области, например, сайт-направленного мутагенеза, синтетического конструирования генов, полусинтетического конструирования генов, случайного мутагенеза, перестановок и т.д.
Сайт-направленный мутагенез представляет собой методику, в которой одна или несколько мутаций создаются на определенном участке молекулы полинуклеотида, кодирующей исходный вариант протеазы. Эту методику можно применять in vitro или in vivo.
Синтетическое конструирование генов включает in vitro синтез сконструированной полинуклеотидной молекулы, кодирующей представляющую интерес полипептидную молекулу. Синтез генов можно осуществлять с применением ряда методик, например, мультиплексной технологии на основе микрочипов, описанной Tian, et al., (Tian, et al., Nature 432: 1050-1054) и подобных методик, где олигонуклеотиды синтезируют и собирают на фото-программируемых микроструйных чипах.
Сайт-направленный мутагенез можно осуществлять in vitro с помощью PCR, включающей применение олигонуклеотидных праймеров, содержащих желаемую мутацию. Сайт-направленный мутагенез можно также осуществлять in vitro путем кассетного мутагенеза, включающего расщепление под действием рестриктазы на участке плазмиды, включающем полинуклеотид, кодирующий исходный вариант протеазы, и последующее лигирование олигонуклеотида, содержащего мутацию, в полинуклеотид. Как правило, плазмиду и олигонуклеотид расщепляют одной и той же рестриктазой, позволяющей получить «липкие» концы плазмиды и вставку для связывания одного фрагмента с другим. См., например, Scherer and Davis, 1979, Proc. Natl. Acad. Sci. USA 76: 4949-4955; и Barton et al., Nucleic Acids Research 18: 7349-4966.
Сайт-направленный мутагенез можно осуществлять in vivo по известным в данной области методикам. См., например, опубликованную патентную заявку США 2004/0171154; Storici et al., 2001, Nature Biotechnology 19: 773-776; Kren et al., 1998, Nat.Med.4: 285-290; и Calissano and Macino, 1996, Fungal Genet. Newslett. 43:15-16.
В настоящем изобретении может применяться любая методика сайт-направленного мутагенеза. В продаже имеется много коммерческих наборов, которые можно применять для получения вариантов исходной протеазы.
Единичные или множественные замены, делеции и/или вставки аминокислотных остатков можно осуществлять и тестировать с использованием известных методик мутагенеза, рекомбинации и/или перестановок, с последующим осуществлением соответствующей процедуры скрининга, например, как раскрыто у Reidhaar-Olson and Sauer, 1988, в Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413; или WO 95/22625. Другие методики, которые могут найти применение в настоящем изобретении, включают PCR пониженной точности, фаговый дисплей (например, Lowmann et al., 1991, Biochem.30:10832-10837; патент США № 5223409; WO 92/06204) и сайт-направленный мутагенез (Derbyshire et al., 1986, Gene 46:145; Ner et al., 1988, DNA 7:127).
Методики мутагенеза/перестановок могут быть скомбинированы с высокопроизводительными автоматизированными методами скрининга, для определения активности клонированных подвергнутых мутагенезу полипептидов, экспрессируемых клетками-хозяевами. Подвергнутые мутагенезу молекулы ДНК, которые кодируют активные полипептиды, можно выделить из клеток-хозяев и быстро секвенировать, используя известные в данной области стандартные методы. Эти методы дают возможность быстро определять значимость индивидуальных аминокислотных остатков в представляющем интерес полипептиде.
Полусинтетическое конструирование генов осуществляют, комбинируя некоторые аспекты синтетического конструирования генов и/или сайт-направленного мутагенеза, и/или случайного мутагенеза, и/или перестановок. Конкретным примером полусинтетического конструирования является способ, в котором используются синтетические полинуклеотидные фрагменты, в комбинации с методикой PCR. Так, например, определенные области генов могут быть синтезированы из простейших компонентов, тогда как другие области могут быть амплифицированы с использованием сайт-специфичных мутагенных праймеров, причем некоторые другие области можно подвергнуть амплификации с помощью PCR пониженной точности или обычной PCR. После этого можно осуществить перестановку полинуклеотидных фрагментов.
Другой аспект настоящего изобретения относится к способу получения варианта путем введения в исходный субтилизин следующих замен:
i. замены остатка в положении 9 остатками {R, K, H};
ii. замены остатка в положении 15 остатками {G, A, S, T, M};
iii. замены остатка в положении 68 остатками {G, A, S, T, M};
iv. замены остатка в положении 245 остатками {R, K, H}; и
v. замены остатка в положении 218 остатками {D, S, G или V}
и одной или нескольких из следующих модификаций: замены остатка в положении 61 остатками {D, E}, замены остатка в положении 62 остатками {D, E}, замены остатка в положении 76 остатками {D, E}, вставки остатка G в положение 97, замены остатка в положении 98 остатками {G, S}, замены остатка в положении 99 остатком G, замены остатка в положении 101 остатком G, замены остатка в положении 120 остатками {V, Q, D}, замены остатка в положении 131 остатками {T, S}, замены остатка в положении 137 остатком H, замены остатка в положении 194 остатком P, замены остатка в положении 228 остатком V, замены остатка в положении 230 остатком V, замены остатка в положении 261 остатком D, где указанные положения соответствуют положениям в последовательности зрелого полипептида SEQ ID NO:2 [BPN’].
В одном из аспектов указанный способ включает замену в положении, соответствующем положению 9, 15, 68, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 68, 218 и 245 остатком R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, A, D и R в положениях, соответствующих положениям 9, 15, 68, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, V68A, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
В одном из аспектов указанный способ включает замену в положении, соответствующем положению 9, 15, 68, 120, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 68, 218 и 245 остатком R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, A, V, D и R в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, V68A, H120V, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
В одном из аспектов способ включает замену в положении, соответствующем положению 9, 15, 68, 120, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 68, 120, 218 и 245 остатком Q, R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, A, Q, D и R в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, V68A, H120Q, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
В одном из аспектов способ включает замену в положении, соответствующем положению 9, 15, 68, 76, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 68, 76, 218 и 245 остатком R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, A, D, D и R в положениях, соответствующих положениям 9, 15, 68, 76, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, V68A, N76D, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
В одном из аспектов способ включает замену в положении, соответствующем положению 9, 15, 61, 68, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 61, 68, 218 и 245 остатком R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, E, A, D и R в положениях, соответствующих положениям 9, 15, 61, 68, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, G61E, V68A, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
В одном из аспектов способ включает замену в положении, соответствующем положению 9, 15, 61, 68, 98, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 61, 68, 98, 218 и 245 остатком R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, E, A, S, D и R в положениях, соответствующих положениям 9, 15, 61, 68, 98, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, G61E, V68A, A98S, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
В одном из аспектов способ включает замену в положении, соответствующем положению 9, 15, 61, 68, 98, 99, 218 и 245. В другом аспекте этот способ включает замену в положении, соответствующем положению 9, 15, 61, 68, 98, 99, 218 и 245 остатком R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте этот способ включает замену остатками R, T, E, A, S, G, D и R в положениях, соответствующих положениям 9, 15, 61, 68, 98, 99, 218 и 245, соответственно. В другом аспекте этот способ включает замены S9R, A15T, G61E, V68A, A98S, S99G, N218D и Q245R в зрелом полипептиде, имеющем последовательность SEQ ID NO:1.
Один из конкретных аспектов относится к способу, в котором в исходный субтилизин вводят следующие замены:
i. замену остатка S в положении 9 остатком R;
ii. замену остатка A в положении 15 остатком T;
iii. замену остатка V в положении 68 остатком A;
iv. замену остатка Q в положении 245 остатком R;
v. замену остатка N в положении 218 остатками D, S, G или V,
а также одну или несколько из следующих модификаций: замену остатка G в положении 61 остатком E, замену остатка N в положении 62 остатком D, замену остатка N в положении 76 остатком D, вставку остатка G в положение 97, замену остатка A в положении 98 остатком S, замену остатка S в положении 99 остатком G, замену остатка S в положении 101 остатком G, замену остатка H в положении 120 остатками D, V или Q, замену остатка P в положении 131 остатком T, замену остатка Q в положении 137 остатком H, замену остатка A в положении 194 остатком P, замену остатка A в положении 228 остатком V, замену остатка A в положении 230 остатком V, замену остатка N в положении 261 остатком D.
Варианты
В одном из аспектов настоящее изобретение относится к варианту исходного субтилизина, включающему замены 9{R,K,H}, 15{G,A,S,T,M}, 68{G,A,S,T,M}, 218{D,S,G,V} и 245{R,K,H}, где данный вариант дополнительно включает, по меньшей мере, одну из следующих модификаций: 61{D,E}, 62{D,E}, 76{D,E}, *97aG, 98{G,S}, 99G, 101G, 120{V,Q,D}, 131{T,S}, 137H, 194P, 228V, 230V, 261D, где указанные положения соответствуют положениям в последовательности зрелого полипептида SEQ ID NO:2 [BPN’].
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 9. В другом аспекте данный вариант включает замену в положении, соответствующем положению 9, остатками R, K или H. В другом аспекте данный вариант включает остаток R в качестве замены остатка в положении, соответствующем положению 9. В другом аспекте данный вариант включает замену S9R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 15. В другом аспекте вариант включает замену в положении, соответствующем положению 15, остатками G, A, S, T или M. В другом аспекте данный вариант включает остаток T в качестве замены в положении, соответствующем положению 15. В другом аспекте данный вариант включает замену A15T в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 61. В другом аспекте данный вариант включает замену в положении, соответствующем положению 61, остатками E или D. В другом аспекте данный вариант включает остаток E в качестве замены в положении, соответствующем положению 61. В еще одном аспекте данный вариант включает замену G61E в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 62. В другом аспекте данный вариант включает замену в положении, соответствующем положению 62, остатками E или D. В другом аспекте данный вариант включает остаток D в качестве замены в положении, соответствующем положению 62. В еще одном аспекте данный вариант включает замену N62D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 68. В другом аспекте данный вариант включает замену в положении, соответствующем положению 68, остатками G, A, S, T или M. В другом аспекте данный вариант включает остаток A в качестве замены в положении, соответствующем положению 68. В еще одном аспекте данный вариант включает замену V68A в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 76. В другом аспекте данный вариант включает замену в положении, соответствующем положению 76, остатками E или D. В другом аспекте данный вариант включает остаток D в качестве замены в положении, соответствующем положению 76. В еще одном аспекте данный вариант включает замену N76D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает вставку в положении, соответствующем положению 97. В другом аспекте вариант включает вставку остатка G в положении, соответствующем положению 97. В еще одном аспекте данный вариант включает вставку *97aG в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 98. В другом аспекте данный вариант включает замену в положении, соответствующем положению 98, остатками G, A, S, T или M. В другом аспекте данный вариант включает остаток S в качестве замены в положении, соответствующем положению 98. В еще одном аспекте данный вариант включает замену A98S в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 99. В другом аспекте данный вариант включает замену в положении, соответствующем положению 99, остатками G, A, S, T или M. В другом аспекте данный вариант включает замену в положении, соответствующем положению 99, остатком G. В еще одном аспекте данный вариант включает замену S99G в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 101. В другом аспекте данный вариант включает замену в положении, соответствующем положению 101, остатками G, A, S, T или M. В другом аспекте данный вариант включает замену в положении, соответствующем положению 101, остатком G. В еще одном аспекте данный вариант включает замену S101G в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 120. В другом аспекте данный вариант включает замену в положении, соответствующем положению 120, остатками Q, V, N, E или D. В другом аспекте данный вариант включает остаток D в качестве замены в положении, соответствующем положению 120. В еще одном аспекте данный вариант включает замену H120D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 120. В другом аспекте данный вариант включает замену в положении, соответствующем положению 120, остатками Q, V, N, E или D. В другом аспекте данный вариант включает остаток N в качестве замены в положении, соответствующем положению 120. В еще одном аспекте данный вариант включает замену H120N в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 120. В другом аспекте данный вариант включает замену в положении, соответствующем положению 120, остатками Q, V, N, E или D. В другом аспекте данный вариант включает остаток V в качестве замены в положении, соответствующем положению 120. В еще одном аспекте данный вариант включает замену H120V в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 120. В другом аспекте данный вариант включает замену в положении, соответствующем положению 120, остатками Q, V, N, E или D. В другом аспекте данный вариант включает остаток Q в качестве замены в положении, соответствующем положению 120. В еще одном аспекте данный вариант включает замену H120Q в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 131. В другом аспекте данный вариант включает замену в положении, соответствующем положению 131, остатками T или S. В другом аспекте данный вариант включает остаток S в качестве замены в положении, соответствующем положению 131. В еще одном аспекте данный вариант включает замену P131S в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 137. В другом аспекте данный вариант включает замену в положении, соответствующем положению 137, остатками R, K или H. В другом аспекте данный вариант включает остаток H в качестве замены в положении, соответствующем положению 137. В еще одном аспекте данный вариант включает замену Q137H в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 194. В другом аспекте данный вариант включает замену в положении, соответствующем положению 194, остатком P. В еще одном аспекте данный вариант включает замену A194P в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 218. В другом аспекте данный вариант включает замену в положении, соответствующем положению 218, остатками E, D, L, I, V, G, A, S, T или M. В другом аспекте данный вариант включает остаток V в качестве замены в положении, соответствующем положению 218. В еще одном аспекте данный вариант включает замену N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 228. В другом аспекте данный вариант включает замену в положении, соответствующем положению 228, остатками L, I или V. В другом аспекте данный вариант включает остаток V в качестве замены в положении, соответствующем положению 228. В еще одном аспекте данный вариант включает замену A228V в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 230. В другом аспекте данный вариант включает замену в положении, соответствующем положению 230, остатками L, I или V. В другом аспекте данный вариант включает остаток V в качестве замены в положении, соответствующем положению 230. В еще одном аспекте данный вариант включает замену A230V в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 245. В другом аспекте данный вариант включает замену в положении, соответствующем положению 245, остатками R, K или H. В другом аспекте данный вариант включает остаток R в качестве замены в положении, соответствующем положению 245. В еще одном аспекте данный вариант включает замену Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положении, соответствующем положению 261. В другом аспекте данный вариант включает замену в положении, соответствующем положению 261, остатками E или D. В другом аспекте данный вариант включает остаток D в качестве замены в положении, соответствующем положению 261. В еще одном аспекте данный вариант включает замену N261D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9 и 15. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9 и 15, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R и T в качестве замен в положениях, соответствующих положениям 9 и 15, соответственно. В еще одном аспекте данный вариант включает замены S9R и A15T в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9 и 68. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9 и 68, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R и A в качестве замен в положениях, соответствующих положениям 9 и 68, соответственно. В еще одном аспекте данный вариант включает замены S9R и V68A в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9 и 218. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9 и 218, остатками R, K, H, E, D, L, I, V, G, A, S, T или M. В другом аспекте данный вариант включает остатки R и D в качестве замен в положениях, соответствующих положениям 9 и 218, соответственно. В еще одном аспекте данный вариант включает замены S9R и N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9 и 245, остатками R, K или H. В другом аспекте данный вариант включает остаток R в качестве замены в положениях, соответствующих положениям 9 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 15 и 68. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 15 и 68, остатками G, A, S, T или M. В другом аспекте данный вариант включает остатки T и A в качестве замен в положениях, соответствующих положениям 15 и 68, соответственно. В еще одном аспекте данный вариант включает замены A15T и V68A в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 15 и 218. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 15 и 218, остатками E, D, L, I, V, G, A, S, T или M. В другом аспекте данный вариант включает остатки T и D в качестве замен в положениях, соответствующих положениям 15 и 218, соответственно. В еще одном аспекте данный вариант включает замены A15T и N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 15 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 15 и 245, остатками G, A, S, T, R, K или H. В другом аспекте данный вариант включает остатки T и R в качестве замен в положениях, соответствующих положениям 15 и 245, соответственно. В еще одном аспекте данный вариант включает замены A15T и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 68 и 218. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 68 и 218, остатками E, D, L, I, V, G, A, S, T или M. В другом аспекте данный вариант включает остатки A и D в качестве замен в положениях, соответствующих положениям 68 и 218, соответственно. В еще одном аспекте данный вариант включает замены V68A и N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 68 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 68 и 245, остатками G, A, S, T, R, K или H. В другом аспекте данный вариант включает остатки A и R в качестве замен в положениях, соответствующих положениям 68 и 245, соответственно. В еще одном аспекте данный вариант включает замены V68A и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 218 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 218 и 245, остатками E, D, R, K, H. В другом аспекте данный вариант включает остатки D и R в качестве замен в положениях, соответствующих положениям 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 61. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 61, остатками R, K, H, G, A, S, T, M, D или E. В другом аспекте данный вариант включает остатки R, T и E в качестве замен в положениях, соответствующих положениям 9, 15 и 61, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и G61E в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 62. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 62, остатками R, K, H, G, A, S, T, M, D или E. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 62, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и N62D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 68. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 68, остатками R,K,H,G,A,S,T или M. В другом аспекте данный вариант включает остатки R,T и A в качестве замен в положениях, соответствующих положениям 9, 15 и 68, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и V68A в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 76. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 76, остатками R, K, H, G, A, S, T, M, D или E. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 76, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и N76D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает модификации в положениях, соответствующих положениям 9, 15 и 97. В другом аспекте данный вариант включает замены в положениях, соответствующих положениям 9 и 15, остатками R, K, H, G, A, S, T или M, и вставку в положении, соответствующем положению 97. В другом аспекте данный вариант включает остатки R и T в качестве замен в положениях, соответствующих положениям 9 и 15, соответственно, и вставку остатка G в положение 97. В еще одном аспекте данный вариант включает модификации S9R, A15T и *97aG в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 98. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 98, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T и S в качестве замен в положениях, соответствующих положениям 9, 15 и 98, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и A98S в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 99. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 99, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T и G в качестве замен в положениях, соответствующих положениям 9, 15 и 99, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и S99G в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120, остатками R, K, H, G, A, S, T, N, Q, V, D, E или M. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 120, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и H120D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120, остатками R, K, H, G, A, S, T, N, Q, V, D, E или M. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 120, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и H120N в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120, остатками R, K, H, G, A, S, T, N, Q, V, D, E или M. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 120, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и H120Q в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 120, остатками R, K, H, G, A, S, T, N, Q, V, D, E или M. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 120, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и H120V в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 131. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 131, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T и {S, T} в качестве замен в положениях, соответствующих положениям 9, 15 и 131, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и P131{S,T} в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 137. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 137, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T и H в качестве замен в положениях, соответствующих положениям 9, 15 и 137, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и Q137H в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 194. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 194, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T и P в качестве замен в положениях, соответствующих положениям 9, 15 и 194, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и A194P в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 218. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 218, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 218, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 228. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 228, остатками R, K, H, G, A, S, T, L, I, V или M. В другом аспекте данный вариант включает остатки R, T и V в качестве замен в положениях, соответствующих положениям 9, 15 и 228, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и A228V в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 230. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 230, остатками R, K, H, G, A, S, T, L, I, V или M. В другом аспекте данный вариант включает остатки R, T и V в качестве замен в положениях, соответствующих положениям 9, 15 и 230, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и A230V в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 245, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T и R в качестве замен в положениях, соответствующих положениям 9, 15 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 261. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15 и 261, остатками R, K, H, G, A, S, T, D, E или M. В другом аспекте данный вариант включает остатки R, T и D в качестве замен в положениях, соответствующих положениям 9, 15 и 261, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T и N261D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 15, 68 и 218. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 15, 68 и 218, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки T, A и D в качестве замен в положениях, соответствующих положениям 15, 68 и 218, соответственно. В еще одном аспекте данный вариант включает замены A15T, V68A и N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 15, 68 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 15, 68 и 245, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки T, A и R в качестве замен в положениях, соответствующих положениям 15, 68 и 245, соответственно. В еще одном аспекте данный вариант включает замены A15T, V68A и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 68, 218 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 68, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки A, D и R в качестве замен в положениях, соответствующих положениям 68, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены V68A, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68 и 218. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68 и 218, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T, A и D в качестве замен в положениях, соответствующих положениям 9, 15, 68 и 218, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, V68A и N218D в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68 и 245, остатками R, K, H, G, A, S, T или M. В другом аспекте данный вариант включает остатки R, T, A и R в качестве замен в положениях, соответствующих положениям 9, 15, 68 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, V68A и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замену в положениях, соответствующих положениям 15, 68, 218 и 245. В другом аспекте данный вариант включает замены в положениях, соответствующих положениям 15, 68, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки T, A, D и R в качестве замен в положениях, соответствующих положениям 15, 68, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены A15T, V68A, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 68, 218 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T, A, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 68, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, V68A, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, Q, E или D. В другом аспекте данный вариант включает остатки R, T, A, Q, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, V68A, H120Q, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, Q, E или D. В другом аспекте данный вариант включает остатки R, T, A, V, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 68, 120, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, V68A, H120V, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 68, 76, 218 и 245. В другом аспекте данный вариант включает замену в положениях, соответствующих положениям 9, 15, 68, 76, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T, A, D, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 68, 76, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, V68A, H76D, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 61, 68, 218 и 245. В другом аспекте данный вариант включает замены в положениях, соответствующих положениям 9, 15, 61, 68, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T, E, A, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 61, 68, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, G61E, V68A, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 61, 68, 98, 218 и 245. В другом аспекте данный вариант включает замены в положениях, соответствующих положениям 9, 15, 61, 68, 98, 218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T, E, A, S, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 61, 68, 98, 218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, G61E, V68A, A98S, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В одном из аспектов данный вариант включает замены в положениях, соответствующих положениям 9, 15, 61, 68,98,99,218 и 245. В другом аспекте данный вариант включает замены в положениях, соответствующих положениям 9, 15, 61, 68,98,99,218 и 245, остатками R, K, H, G, A, S, T, M, L, I, V, E или D. В другом аспекте данный вариант включает остатки R, T, E, A, S, G, D и R в качестве замен в положениях, соответствующих положениям 9, 15, 61, 68,98,99,218 и 245, соответственно. В еще одном аспекте данный вариант включает замены S9R, A15T, G61E, V68A, A98S, S99G, N218D и Q245R в последовательности зрелого полипептида SEQ ID NO:1.
В других вариантах осуществления, описанный в настоящем описании вариант субтилазы может быть успешно скомбинирован с одной или несколькими модификациями в любом из следующих положений:
27, 36, 56, 87, 95, 96, 100, 102, 103, 104. 123, 159, 167, 170, 206, 222, 224, 232, 235, 236, 245, 248, 252 и 274.
Конкретно, подходящими для комбинации считаются следующие модификации BLSAVI, BLSUBL, BSKSMK и BAALKP:
K27R, *36D, S56P, S87N, S103A, V104A, V104I, V104N, V104Y, S106A, N123S, G159D, Y167A, R170S, R170L, N204D, V205I, Q206E, L217D, M222S, M222A, T224S, A232V, K235L, Q236H, N248D, N252K и T274A.
Кроме того, улучшенные свойства демонстрируют варианты, включающие любую из модификаций S101G+V104N, S87N+S101G+V104N,
K27R+V104Y+N123S+T274A, N76D+S103A+V104I,
S99D+S101R+S103A+V104I+G160S,
S3T+V4I+S99D+S101R+S103A+V104I+G160S+V199M+V205I+L217D,
S3T+V4I+S99D+S101R+S103A+V104I+G160S+A194P+V199M+V205I+L217D,
S3T+V4I+S99D+S101R+S103A+V104I+G160S+V205I или N76D+V104A
или другие комбинации модификаций K27R, *36D, S56P, S87N, G97N, S99SE, S101G, S103A, V104A, V104I, V104N, V104Y, S106A, N123S, G159D, Y167A, R170S, R170L, N204D, V205I, Q206E, L217D, M222S, M222A, T224S, A232V, K235L, Q236H, N248D, N252K и T274A в сочетании с одной или несколькими из указанных выше модификаций.
В определенном аспекте приведенный вариант включает модификацию в положении, соответствующем одном или нескольким из положений 61{E,D}, 62{D,E}, 76{D,E}, *97aG, 98{G,S}, 99G, 101G, 120{N,V,Q,D}, 131{T,S}, 137H, 194P, 228V, 230V, 261D последовательности зрелого полипептида SEQ ID NO:3.
В определенном аспекте приведенный вариант включает модификацию в положении, соответствующем одном или нескольким из положений 61{E,D}, 62{D,E}, 76{D,E}, *97aG, 98{G,S}, 99G, 101G, 120{N,V,Q,D}, 131{T,S}, 137H, 194P, 228V, 230V, 261D последовательности зрелого полипептида SEQ ID NO:4.
Кроме того, варианты субтилазы по основному аспекту(ам) настоящего изобретения, предпочтительно скомбинированы с одной или несколькими модификациями в любом из положений 61, 62, 76, 97, 98, 99, 101, 120, 131, 137, 194, 228, 230 и 261, предпочтительно, модификациями 61{D,E}, 62{D,E}, 76{D,E}, *97aG, 98{G,S}, 99G, 101G, 120{V,Q,N,D}, 131{T,S}, 137H, 194P, 228V, 230V, 261D. Еще более предпочтительно, модификациями 61E, 62D, 76D, *97aG, 98S, 99G, 101G, 120D, 131T, 137H, 194P, 228V, 230V, 261D. Ожидается, что любые из этих модификаций обеспечат более высокий уровень экспрессии варианта субтилазы при получении этого варианта.
Особенно интересным вариантом является вариант, который, помимо модификаций по настоящему изобретению, содержит следующие замены:
S9R, A15T, G61E, V68A, A98S, S99G, N218D и Q245R.
Варианты, представляющие конкретный интерес, включают следующие модификации:
|
Моющую эффективность выбранного варианта по настоящему изобретению можно протестировать в тесте на моющую эффективность, раскрытом в примере 3 настоящего описания. Тест на моющую эффективность может применяться для оценки способности того или иного варианта, при его включении в стандартную или коммерческую моющую композицию, удалять белковые загрязнения со стандартных образцов тканей, по сравнению с эталонной системой, а именно, исходной субтилазой или подобной субтилазой, демонстрирующей еще лучшую моющую эффективность (включенной в ту же самую моющую систему и протестированной в идентичных условиях). Варианты фермента по настоящему изобретению тестировали с использованием автоматического анализа механического усилия (AMSA). С помощью теста AMSA можно быстро определить моющую эффективность большого числа моющих композиций с ферментами, взятых в малых объемах. Используя этот тест, можно провести первоначальное исследование моющей эффективности выбранного варианта, причем целесообразность такого способа тестирования заключается в том, что если выбранный вариант не демонстрирует значительного улучшения в данном тесте по сравнению с исходной субтилазой, обычно нет смысла осуществлять дальнейшее тестирование.
Поэтому варианты, которые особенно представляют интерес для целей настоящего изобретения, являются такими вариантами, которые при тестировании в коммерческой моющей композиции, например, композиции для мытья посуды европейского типа, композиции для стирки азиатского типа, композиции для стирки европейского типа или композиции для стирки латиноамериканского типа, некоторые примеры которых описаны в тесте на моющую эффективность (пример 3), демонстрируют улучшенную моющую эффективность, по сравнению с исходной субтилазой, протестированной в идентичных условиях.
Очевидно, предпочтительно, чтобы вариант по настоящему изобретению удовлетворял приведенному выше критерию, по меньшей мере, на указанном низшем уровне, более предпочтительно, на указанном высшем уровне.
Конструкты нуклеиновой кислоты
Настоящее изобретение относится также к конструктам нуклеиновой кислоты, включающим полинуклеотид, кодирующий вариант протеазы по настоящему изобретению, функционально связанный с одной или несколькими управляющими последовательностями, которые направляют экспрессию кодирующей последовательности в подходящей клетке-хозяине в условиях, совместимых с управляющей последовательностью.
С выделенным полинуклеотидом, кодирующим вариант протеазы по настоящему изобретению, можно осуществлять целый ряд операций для обеспечения экспрессии данного варианта. Проведение таких операций с полинуклеотидом перед его включением в вектор может быть желательным или необходимым в зависимости от вектора экспрессии. Способы модификации полинуклеотидов с использованием методик рекомбинантных ДНК хорошо известны в данной области.
Управляющая последовательность может представлять собой подходящую промоторную последовательность, которая распознается клеткой-хозяином, для экспрессии полинуклеотида. Промоторная последовательность содержит последовательности, управляющие транскрипцией, которые опосредуют экспрессию варианта протеазы. Промотор может быть любой последовательностью нуклеиновых кислот, которая демонстрирует транскрипционную активность в выбранной клетке-хозяине, включая мутантные, укороченные и гибридные промоторы, и его можно получать из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные или гетерологичные клетке-хозяину.
Примерами подходящих промоторов для управления транскрипцией конструктов нуклеиновых кислот по настоящему изобретению, в частности, в бактериальных клетках-хозяевах, являются промоторы, полученные из оперона lac E.coli, гена агаразы Streptomyces coelicolor (dagA), гена левансахарозы Bacillus subtilis (sacB), гена альфа-амилазы Bacillus licheniformis (amyL), гена мальтогенной амилазы Bacillus stearothermophilus (amyM), гена альфа-амилазы Bacillus amyloliquefaciens (amyQ), гена пенициллиназы Bacillus licheniformis (penP), генов xylA и xylB Bacillus subtilis и гена прокариотической бета-лактамазы (Villa-Kamaroff et al., 1978, Proceedings of the National Academy of Sciences USA 75: 3727-3731), а также промотор tac (DeBoer et al., 1983, Proceedings of the National Academy of Sciences USA 80: 21-25). Другие промоторы описаны в “Useful proteins from recombinant bacteria” в Scientific American, 1980, 242: 74-94; и в Sambrook et al., 1989, см. выше.
Примерами подходящих промоторов для управления транскрипцией конструктов нуклеиновых кислот по настоящему изобретению в клетках-хозяевах из числа мицеллярных грибов являются промоторы, полученные из генов TAKA амилазы Aspergillus oryzae, аспарагиновой протеиназы Rhizomucor miehei, нейтральной альфа-амилазы Aspergillus niger, устойчивой к кислотам альфа-амилазы Aspergillus niger, глюкоамилазы Aspergillus niger или Aspergillus awamori (glaA), липазы Rhizomucor miehei, щелочной протеазы Aspergillus oryzae, триозафосфат изомеразы Aspergillus oryzae, ацетамидазы Aspergillus nidulans, амилоглюкозидазы Fusarium venenatum (WO 00/56900), Fusarium venenatum Daria (WO 00/56900), Fusarium venenatum Quinn (WO 00/56900), трипсин-подобной протеазы Fusarium oxysporum (WO 96/00787), бета-глюкозидазы Trichoderma reesei, целлобиогидролазы I Trichoderma reesei, целлобиогидролазы II Trichoderma reesei, эндоглюканазы I Trichoderma reesei, эндоглюканазы II Trichoderma reesei, эндоглюканазы III Trichoderma reesei, эндоглюканазы IV Trichoderma reesei, эндоглюканазы V Trichoderma reesei, ксиланазы I Trichoderma reesei, ксиланазы II Trichoderma reesei, бета-ксилозидазы Trichoderma reesei, а также промотор NA2-tpi (гибрид промоторов из генов нейтральной альфа-амилазы Aspergillus niger и триозафосфат изомеразы Aspergillus oryzae, а также полученные из них мутантные, укороченные и гибридные промоторы.
В клетках-хозяевах из числа дрожжей, подходящие промоторы получают из генов енолазы Saccharomyces cerevisiae (ENO-1), галактокиназы Saccharomyces cerevisiae (GAL1), алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae (ADH1, ADH2/GAP), триозафосфата изомеразы Saccharomyces cerevisiae (TPI), металлотионеина Saccharomyces cerevisiae (CUP1) и 3-фосфоглицераткиназы Saccharomyces cerevisiae. Другие подходящие промоторы для клеток-хозяев из числа дрожжей описаны Romanos et al., 1992, в Yeast 8:423-488.
Управляющая последовательность может являться также подходящей последовательностью, терминирующей транскрипцию, которая распознается клеткой-хозяином и вызывает прекращение транскрипции. Эта терминирующая последовательность функционально связана с 3’-концом полинуклеотида, кодирующего вариант протеазы. В настоящем изобретении может применяться любая терминирующая последовательность, которая проявляет эту функцию в выбранной клетке-хозяине.
Предпочтительные терминаторы для клеток-хозяев из числа мицеллярных грибов получают из генов амилазы TAKA Aspergillus oryzae, глюкоамилазы Aspergillus niger, антранилатсинтазы Aspergillus nidulans, альфа-глюкозидазы Aspergillus niger и трипсин-подобной протеазы Fusarium oxysporum.
Предпочтительные терминаторы для клеток-хозяев из числа дрожжей получают из генов енолазы Saccharomyces cerevisiae, цитохрома C Saccharomyces cerevisiae (CYC1) и глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae. Другие подходящие терминаторы для клеток-хозяев из числа дрожжей описаны Romanos et al., 1992, см. выше.
Управляющая последовательность также может являться подходящей лидерной последовательностью, т.е. не транслируемой областью мРНК, которая имеет значение для трансляции клеткой-хозяином. Лидерная последовательность функционально связана с 5’-концом полинуклеотида, кодирующего вариант протеазы. В настоящем изобретении может применяться любая лидерная последовательность, которая проявляет эту функцию в выбранной клетке-хозяине.
Предпочтительные лидерные последовательности для клеток-хозяев из числа мицеллярных грибов получают из генов амилазы TAKA Aspergillus oryzae, и триоза-фосфат-изомеразы Aspergillus nidulans.
Подходящие лидерные последовательности для клеток-хозяев из числа дрожжей получают из генов енолазы Saccharomyces cerevisiae (ENO-1), 3-фосфоглицераткиназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae, и алкоголидегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы (ADH2/GAP) Saccharomyces cerevisiae.
Управляющая последовательность может являться также последовательностью полиаденилирования, т.е. последовательностью функционально связанной с 3’-концом полипептид-кодирующей последовательности, и после транскрипции распознаваемой клеткой-хозяином, как сигнал к присоединению полиаденозиновых остатков к транскрибируемой мРНК. В настоящем изобретении может применяться любая последовательность полиаденилирования, которая проявляет такую функцию в выбранной клетке-хозяине.
Предпочтительные последовательности полиаденилирования для клеток-хозяев из числа мицеллярных грибов получают из генов амилазы TAKA Aspergillus oryzae, глюкоамилазы Aspergillus niger, антранилатсинтазы Aspergillus nidulans, трипсин-подобной протеазы Fusarium oxysporum и альфа-глюкозидазы Aspergillus niger.
Подходящие последовательности полиаденилирования для клеток-хозяев из числа дрожжей описаны Guo и Sherman, 1995, Molecular Cellular Biology 15: 5983-5990.
Управляющая последовательность также может являться областью, кодирующей сигнальный пептид, которая кодирует аминокислотную последовательность, связанную с амино-концом варианта протеазы, и направляющую закодированный полипептид на путь клеточной секреции. 5’-конец кодирующей последовательности полинуклеотида может содержать собственную область, кодирующую сигнальный пептид, естественным образом связанную в трансляционной рамке считывания с сегментом кодирующей области, который кодирует секретируемый вариант варианта протеазы. Альтернативно, 5’-конец кодирующей последовательности может содержать область, кодирующую сигнальный пептид, которая является чужеродной по отношению к кодирующей последовательности. Чужеродная область, кодирующая сигнальный пептид, может потребоваться в том случае, если кодирующая последовательность в ее естественном виде не содержит области, кодирующей сигнальный пептид. Альтернативно, чужеродная область, кодирующая сигнальный пептид, может просто заменять собой естественную область, кодирующую сигнальный пептид, для улучшения секреции варианта протеазы. Однако любая область, кодирующая сигнальный пептид, которая направляет экспрессированный полипептид на секреторный путь выбранной клетки-хозяина, может найти применение в настоящем изобретении.
Эффективные последовательности, кодирующие сигнальный пептид, для клеток-хозяев из числа мицеллярных грибов, представляют собой последовательности, кодирующие сигнальный пептид, полученные из генов амилазы TAKA Aspergillus oryzae, нейтральной амилазы Aspergillus niger, глюкоамилазы Aspergillus niger, аспарагиновой протеиназы Rhizomucor miehei, целлюлазы Humicola insolens, эндоглюканазы V Humicola insolens и липазы Humicola lanuginosa.
Подходящие последовательности, кодирующие сигнальный пептид, для клеток-хозяев из числа дрожжей получают из генов альфа-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие подходящие последовательности, кодирующие сигнальный пептид, описаны Romanos et al., 1992, см. выше.
Управляющая последовательность также может представлять собой область, кодирующую пропептид, которая кодирует аминокислотную последовательность, расположенную на амино-конце варианта протеазы. Образующийся полипептид известен как профермент или прополипептид (или, в некоторых случаях, как зимоген). Прополипептид, как правило, является неактивным и может быть превращен в зрелый активный полипептид в результате каталитического или автокаталитического отщепления пропептида от прополипептида. Область, кодирующую пропептид, можно получить из генов альфа-фактора Saccharomyces cerevisiae, аспарагиновой протеиназы Rhizomucor miehei и лакказы Myceliophthora thermophila (WO 95/33836).
Если на амино-конце полипептида присутствуют области как сигнального пептида, так и пропептида, область пропептида расположена после амино-конца полипептида, и область сигнального пептида расположена после амино-конца области пропептида.
Кроме того, может оказаться желательным добавление регулирующих последовательностей, которые позволят регулировать экспрессию варианта протеазы в зависимости от роста клетки-хозяина. Примерами регулирующих систем являются такие системы, которые вызывают запуск или остановку экспрессии гена в ответ на химические или физические стимулы, включающие присутствие регулирующего соединения. Регулирующие системы в прокариотических клетках включают системы операторов lac, tac и trp. В случае дрожжей можно использовать систему ADH2 или систему GAL1. В мицеллярных грибах в качестве регулирующих последовательностей могут применяться промотор TAKA альфа-амилазы, промотор глюкоамилазы Aspergillus niger и промотор глюкоамилазы Aspergillus oryzae. Другими примерами регулирующих последовательностей являются такие последовательности, которые делают возможной амплификацию гена. В эукариотических системах эти регулирующие последовательности включают ген дигидрофолат редуктазы, который амплифицируется в присутствии метотрексата, и гены металлотионеина, которые амплифицируются тяжелыми металлами. В этих случаях, полинуклеотид, кодирующий вариант протеазы, может быть функционально связан с регулирующей последовательностью.
Векторы экспрессии
Настоящее изобретение относится также к рекомбинантным векторам экспрессии, включающим полинуклеотид, кодирующий вариант протеазы по настоящему изобретению, промотор, а также сигналы прекращения транскрипции и трансляции. Различные нуклеотиды и контрольные последовательности, описанные выше, могут быть соединены друг с другом для получения рекомбинантного вектора экспрессии, который может включать один или более (несколько) сайтов рестрикции, чтобы обеспечить возможность вставок или замен по этим сайтам в полинуклеотиде, кодирующем приведенный вариант. Альтернативно, полинуклеотид можно подвергнуть экспрессии путем включения полинуклеотида или конструкта нуклеиновой кислоты, включающего этот полинуклеотид, в подходящий вектор для экспрессии. При создании вектора экспрессии, кодирующую последовательность размещают в векторе таким образом, чтобы кодирующая последовательность была функционально связана с соответствующими управляющими последовательностями для экспрессии.
Рекомбинантный вектор экспрессии может являться любым вектором (например, плазмидой или вирусом), который можно легко обрабатывать с помощью методик создания рекомбинантной ДНК, и который может вызывать экспрессию полинуклеотида. Выбор вектора, как правило, будет зависеть от совместимости вектора с клеткой-хозяином, в которую предполагается ввести указанный вектор. Векторы могут быть линейными или замкнутыми кольцевыми плазмидами.
Вектор может являться автономно реплицирующимся вектором, т.е. вектором, который существует в виде внехромосомного объекта, репликация которого независима от репликации хромосом, например, плазмиды, внехромосомного элемента, минихромосомы или искусственной хромосомы. Вектор может включать любые средства для обеспечения саморепликации. Альтернативно, вектор может представлять собой такой вектор, который при введении в клетку-хозяина, интегрируется в геном и реплицируется совместно с хромосомой(ами), в которую он интегрировался. Кроме того, можно применять одиночный вектор или плазмиду, или два или несколько векторов или плазмид, которые совместно содержат полную ДНК, которую предполагается ввести в геном клетки-хозяина, или транспозон.
Векторы по настоящему изобретению предпочтительно содержат один или более (несколько) селектируемых маркеров, которые допускают несложный выбор трансформируемых, трансфецируемых, трансдуцируемых или подобных клеток. Селектируемый маркер представляет собой ген, продукт которого обеспечивает биоцидную или вирусную устойчивость, устойчивость к тяжелым металлам, прототрофию ауксотрофам и т.п.
Подходящими маркерами для клеток-хозяев из числа дрожжей являются ADE2, HIS3, LEU2, LYS2, MET3, TRP1 и URA3. Селектируемые маркеры для применения в клетках-хозяевах из числа мицеллярных грибов включают, но, не ограничиваясь ими, amdS (ацетамидазу), argB (орнитин карбамоилтрансферазу), bar (фосфинотрицин ацетилтрансферазу), hph (гигромицин фосфотрансферазу), niaD (нитрат редуктазу), pyrG (оротидин-5’-фосфат декарбоксилазу), sC (сульфат аденилтрансферазу) и trpC (антранилатсинтазу), а также их эквиваленты. Предпочтительными для применения в клетках Aspergillus являются гены amdS и pyrG видов Aspergillus nidulans или Aspergillus oryzae, а также гены bar вида Streptomyces hygroscopicus.
Векторы по настоящему изобретению предпочтительно включают элемент(ы), который дает возможность интеграции вектора в геном клетки-хозяина или автономной репликации вектора в клетке, независимо от генома.
Для интеграции в геном клетки-хозяина, вектор может включать полинуклеотидную последовательность, кодирующую полипептид, или любой другой элемент вектора для интеграции в геном путем гомологичной или не гомологичной рекомбинации. Альтернативно, вектор может содержать дополнительные нуклеотидные последовательности для управления интеграцией за счет гомологичной рекомбинации в геном клетки-хозяина в определенное положение(я) на хромосоме(ах). Для увеличения вероятности интеграции в определенное положение, интеграционные элементы предпочтительно должны содержать достаточное количество нуклеиновых кислот, например, от 100 до 10000 пар оснований, предпочтительно от 400 до 10000 пар оснований и, наиболее предпочтительно, от 800 до 10000 пар оснований, которые имеют высокую степень идентичности соответствующей целевой последовательности, для увеличения вероятности гомологичной рекомбинации. Эти интеграционные элементы могут являться любой последовательностью, которая гомологична целевой последовательности в геноме клетки-хозяина. Кроме того, интеграционные элементы могут быть некодирующими или кодирующими нуклеотидными последовательностями. С другой стороны, вектор может быть интегрирован в геном клетки-хозяина путем негомологичной рекомбинации.
Для автономной репликации, вектор может дополнительно включать точку начала репликации, позволяющую автономно реплицироваться в выбранной клетке-хозяине. Точка начала репликации может представлять собой репликатор любой плазмиды, опосредующий автономную репликацию, который функционирует в клетке. Термины «точка начала репликации» или «репликатор плазмиды» определяются в настоящем описании, как нуклеотидная последовательность, которая дает возможность плазмиде или вектору реплицироваться in vivo.
Примерами точек начала репликации, подходящих для применения в клетках-хозяевах из числа дрожжей, являются точка начала репликации 2 микрон, ARS1, ARS4, комбинация ARS1 и CEN3 и комбинация ARS4 и CEN6.
Примерами точек начала репликации, применимых в клетках мицеллярных грибов, являются AMA1 и ANS1 (Gems et al., 1991, Gene 98: 61-67; Cullen et al., 1987, Nucleic Acids Research 15:9163-9175; WO 00/24883). Изоляцию гена AMA1 и конструирование плазмид или векторов, включающих этот ген, можно осуществлять по методикам, раскрытым в WO 00/24883.
Для увеличения выработки варианта протеазы в клетку-хозяина можно ввести более одной копии полинуклеотида по настоящему изобретению. Увеличение числа копий полинуклеотида может быть достигнуто за счет интеграции в геном клетки-хозяина, по меньшей мере, одной дополнительной копии последовательности или за счет включения в полинуклеотид гена амплифицируемого селектируемого маркера, где клетки содержат амплифицируемые копии гена селектируемого маркера, и за счет этого дополнительные копии полинуклеотида могут быть выбраны при культивировании клеток в присутствии подходящего селектируемого агента.
Методики, применяемые для лигирования описанных выше элементов с целью конструирования рекомбинантных векторов экспрессии по настоящему изобретению, хорошо известны специалисту в данной области техники (см., например, Sambrook et al., 1989, выше), и они позволяют получать по существу чистые варианты протеазы.
Клетки-хозяева
Помимо этого, настоящее изобретение относится к рекомбинантным клеткам-хозяевам, включающим полинуклеотид, кодирующий вариант протеазы по настоящему изобретению, которые преимущественно применяются при рекомбинантном получении указанного варианта. Вектор, включающий полинуклеотид по настоящему изобретению, вводят в клетку-хозяина таким образом, чтобы он сохранялся в виде составной части хромосомы или в виде самореплицирующегося внехромосомного вектора, который описан выше. Выбор клетки-хозяина в значительной степени будет зависеть от гена, кодирующего полипептид, и от его источника.
Клетка-хозяин может являться любой клеткой, применимой в рекомбинантном получении варианта протеазы. Клетка-хозяин может также быть эукариотической, например, клеткой млекопитающих, насекомых, растений или грибов.
В одном из аспектов клетка-хозяин является клеткой грибов. Термин «грибы» в настоящем описании включает филумы (таксонометрические типы) Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota (согласно определению Hawksworth et al., In, Anisworth and Bisby’s Dictionary of the Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK), а также Oomycota (как указано в Hawksworth et al., 1995, выше, стр. 171) и все митоспоровые грибы (Hawksworth et al., 1995, выше).
В другом аспекте грибковая клетка-хозяин представляет собой клетку дрожжей. «Дрожжи» в настоящем описании включают аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, относящиеся к несовершенным грибам (Blastomycetes). Поскольку классификация дрожжей в будущем может измениться, для целей настоящего изобретения дрожжи следует определять, как описано в Biology and Activities of Yeast (Skinner, F.A., Passmore, S.M., and Davenport, R.R., eds, Soc. App. Bacteriol. Symposium Series NO.9, 1980).
В другом аспекте дрожжевая клетка-хозяин представляет собой клетку Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia.
В следующем аспекте дрожжевая клетка-хозяин представляет собой клетку Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis. В другом аспекте дрожжевая клетка-хозяин представляет собой клетку Kluyveromyces lactis. В еще одном аспекте дрожжевая клетка-хозяин представляет собой клетку Yarrowia lipolytica.
В следующем аспекте клетка-хозяин, относящаяся к грибам, представляет собой клетку мицеллярных грибов. «Мицеллярные грибы» включают все мицеллярные формы подгрупп Eumycota и Oomycota (согласно определению Hawksworth et al., 1995, выше). Мицеллярные грибы, как правило, характеризуются стенкой мицелия, состоящей из хитина, целлюлозы, глюкана, хитозана, маннана и других сложных полисахаридов. Вегетативный рост происходит посредством удлинения гифа, и катаболизм углерода является облигатно аэробным. В противоположность этому, вегетативный рост дрожжей, таких как Saccharomyces cerevisiae происходит посредством почкования одноклеточного таллома, и катаболизм углерода может быть ферментативным.
В другом аспекте клетка-хозяин, относящаяся к мицеллярным грибам, представляет собой клетку Acremonium, Aspergillus, Aureobasidium, Bjerkandera, Ceriporiopsis, Chrysosporium, Coprinus, Coriolus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Phlebia, Piromyces, Pleurotus, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes или Trichoderma.
В следующем аспекте клетка-хозяин, относящаяся к мицеллярным грибам, представляет собой клетку Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger или Aspergillus oryzae. В другом аспекте клетка-хозяин, относящаяся к мицеллярным грибам, представляет собой клетку Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides или Fusarium venenatum. В еще одном аспекте клетка-хозяин, относящаяся к мицеллярным грибам, представляет собой клетку Bjerkandera adusta, Ceriporiopsis aneirina, Ceriporiopsis aneirina, Ceriporiopsis caregiea, Ceriporiopsis gilvescens, Ceriporiopsis pannocinta, Ceriporiopsis rivulosa, Ceriporiopsis subrufa, Ceriporiopsis subvermispora, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium tropicum, Chrysosporium merdarium, Chrysosporium inops, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium zonatum, Coprinus cinereus, Coriolus hirsutus, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Phlebia radiata, Pleurotus eryngii, Thielavia terrestris, Trametes villosa, Trametes versicolor, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
Клетки грибов можно трансформировать по методике, включающей формирование протопластов, трансформацию протопластов и регенерацию клеточной стенки способом, известным по существу. Подходящие методики трансформации клеток-хозяев Aspergillus и Trichoderma описаны в EP 238023 и Yelton et al., 1984, Proceedings of the National Academy of Sciences USA 81: 1470-1474. Подходящие методики трансформации грибов видов Fusarium описаны Malardier et al, 1989, Gene 78: 147-156, и в WO 96/00787. Дрожжи можно трансформировать с использованием методик, описанных Becker and Guarente, In Abelson, J.N. and Simon, M.I., editors, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp 182-187, Academic Press, Inc., New York; Ito et al, 1983, Journal of Bacteriology 153: 163; и Hinnen et al., 1978, Proceedings of the National Academy of Sciences USA 75: 1920.
Способ получения варианта субтилазы
Настоящее изобретение относится к способу получения выделенного фермента по настоящему изобретению, где подходящую клетку-хозяина, которая была трансформирована последовательностью ДНК, кодирующей этот фермент, культивируют в условиях, допускающих выработку фермента, и полученный фермент выделяют из культуры.
Если вектор экспрессии, включающий последовательность ДНК, кодирующую приведенный фермент, трансформирован в гетерологичную клетку-хозяина, появляется возможность гетерологичной рекомбинантной выработки фермента по настоящему изобретению. За счет этого можно получить композицию субтилазы высокой степени чистоты, которая характеризуется отсутствием гомологичных примесей.
Среда, применяемая для культивирования трансформированной клетки-хозяина, может быть любой традиционной средой, подходящей для выращивания выбранной клетки-хозяина. Экспрессированная субтилаза обычно может быть секретирована в культуральную среду и может быть выделена из нее с применением хорошо известных методик, включающих выделение клеток из среды с помощью центрифугирования или фильтрования, осаждение белковых компонентов среды с помощью солей, например, сульфата аммония, с последующим хроматографическим разделением, например, ионообменной хроматографией, аффинной хроматографией и т.п.
Чистящие и моющие композиции
Фермент по настоящему изобретению можно добавлять в моющие композиции, в результате чего фермент становится компонентом моющей композиции. Чистящие и моющие композиции в целом хорошо описаны в данной области, и для дальнейшего описания подходящих чистящих и моющих композиций делается ссылка на заявки WO 96/34946; WO 97/07202; WO 95/30011.
Моющая композиция по настоящему изобретению может, например, иметь форму моющей композиции для ручной или машинной стирки, включая вспомогательную композицию для стирки, которая предназначена для предварительной обработки загрязненных тканей или является ополаскивателем, добавляемым для смягчения ткани, или иметь форму моющей композиции для чистки различных твердых поверхностей в домашнем хозяйстве, или же форму композиции для ручного или машинного мытья посуды.
В отдельном аспекте изобретение относится к моющей добавке, содержащей фермент по настоящему изобретению. Данная моющая добавка, так же, как и моющая композиция, может содержать один или несколько других ферментов, например, протеазу, липазу, кутиназу, амилазу, карбогидразу, целлюлазу, пектиназу, маннаназу, арабиназу, галактаназу, ксиланазу, оксидазу, например, лакказу и/или пероксидазу.
Свойства выбранного фермента(ов), как правило, должны быть совестимы со свойствами выбранного детергента (т.е. оптимальное значение pH, совместимость с другими ферментными и неферментными ингредиентами, и т.д.), и данный фермент(ы) должен присутствовать в эффективных количествах.
Протеазы. Подходящие протеазы включают ферменты животного, растительного или микробного происхождения. Предпочтительным является микробное происхождение. В число подходящих протеаз входят химически модифицированные ферменты или продукты направленной мутации белка. Протеаза может представлять собой сериновую протеазу или металлопротеазу, предпочтительно, щелочную микробную протеазу или трипсин-подобную протеазу. Примерами щелочных протеаз являются субтилизины, в частности, полученные из бактерий рода Bacillus, например, субтилизин novo, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168 (описанный в WO 89/06279). Примерами трипсин-подобных протеаз являются трипсин (например, полученный из свиней или коров) и протеаза Fusarium, описанная в WO 89/06270 и WO 94/25583.
Примерами применимых протеаз являются варианты, описанные в WO 92/19729, WO 98/20115, WO 98/20116 и WO 98/34946, в частности, варианты с заменами в одном или нескольких из следующих положений: 27, 36, 57, 76, 87, 97, 101, 104, 120, 123, 167, 170, 194, 206, 218, 222, 224, 235 и 274.
Предпочтительные коммерчески доступные ферменты из числа протеаз включают Durazym®, Relase®, Alcalase®, Savinase®, Primase®, Duralase®, Esperase®, Ovozyme® и Kannase® (Novozymes A/S), MaxataseTM, MaxacalTM, MaxapemTM, ProperaseTM, PurafectTM, Purafect OxPTM, FN2TM, FN3TM и FN4TM (Genencor International, Inc.).
Липазы. Подходящие липазы включают ферменты, полученные из бактерий или грибов. В число подходящих липаз входят химически модифицированные ферменты или продукты направленной мутации белка. Примеры подходящих липаз включают липазы из грибов рода Humicola (синоним Thermomyces), например, из H.lanuginosa (T.lanuginosus), как описано в EP 258068 и EP 305216, или из H.insolens, как описано в WO 96/13580, липазу из бактерий рода Pseudomonas, например, из P. alcaligenes или P. pseudoalcaligenes (EP 218272), P. cepacia (EP 331376), P. stutzeri (GB 1372034), P. fluorescens, штамма вида Pseudomonas SD 705 (WO 95/06720 и WO 96/27002), P. wisconsinensis (WO 96/12012), липазу из бактерий рода Bacillus, например из B. subtilis (Dartois et al., (1993), Biochemica et Biophysica Acta, 1131, 253-360), B. stearothermophilus (JP 64/744992) или B. pumilus (WO 91/16422).
Другими примерами являются варианты липаз, описанные, например, в WO 92/05249, WO 94/01541, EP 407225, EP 260105, WO 95/35381, WO 96/00292, WO 95/30744, WO 94/25578, WO 95/14783, WO 95/22615, WO 97/04079 и WO 97/07202.
Предпочтительные коммерчески доступные ферменты из числа липаз включают Lipex®, Lipolase® и Lipolase Ultra® (Novozymes A/S).
Амилазы. Подходящие амилазы (α и/или β) включают амилазы, полученные из бактерий или грибов. В число подходящих амилаз входят химически модифицированные ферменты или продукты направленной мутации белка. Амилазы включают, например, α-амилазы, полученные из бактерий рода Bacillus, например, специального штамма B. licheniformis, более подробно описанного в GB 1296839.
Примерами применимых амилаз являются варианты, описанные в WO 94/02597, WO 94/18314, WO96/23873 и WO 97/43424, в частности варианты с заменами в одном или нескольких из следующих положений: 15, 23, 105, 106, 124, 128, 133, 154, 156, 181, 188, 190, 197, 202, 208, 209, 243, 264, 304, 305, 391, 408 и 444.
Коммерчески доступными амилазами являются Duramyl®, Termamyl®, Fungamyl® и BAN® (Novozymes A/S), RapidaseTM и PurastarTM (компании Genencor International Inc.).
Целлюлазы. Подходящие целлюлазы включают ферменты, полученные из бактерий или грибов. В число подходящих целлюлаз входят химически модифицированные ферменты или продукты направленной мутации белка. Подходящие целлюлазы включают целлюлазы родов Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, например, целлюлазы грибов, продуцируемые Humicola insolens, Myceliophthora thermophila и Fusarium oxysporum, раскрытые в патентах США 4435307, 5648263, 5691178, 5776757 и заявке WO 89/09259.
Особенно предпочтительными целлюлазами являются щелочные или нейтральные целлюлазы, преимущество которых заключается в отсутствии вредного влияния на цвет тканей. Примерами таких целлюлаз являются целлюлазы, описанные в EP 0495257, EP 0531372, WO 96/11262, WO 96/29397, WO 98/08940. Другими примерами служат варианты целлюлаз, например, описанные в WO 94/07998, EP 0531315, US 5457046, US 5686593, US 5763254, WO 95/24471, WO 98/12307 и PCT/DK98/00299.
Коммерчески доступные целлюлазы включат Celluzyme® и Carezyme® (Novozymes A/S), ClazinaseTM и Puradax HATM (Genencor International Inc.), и KAC-500(B)TM (Kao Corporation).
Пероксидазы/оксидазы. Подходящие пероксидазы/оксидазы включают ферменты, вырабатываемые растениями, бактериями или грибами. Кроме того, в число подходящих пероксидаз/оксидаз входят химически модифицированные ферменты или продукты направленной мутации белка. Примеры применимых пероксидаз включают пероксидазы грибов рода Coprinus, например, C. cinereus и их варианты, например, описанные в WO 93/24618, WO 95/10602 и WO 98/15257. Коммерчески доступные пероксидазы включают Guardzyme® (Novozymes A/S).
Детергентный фермент(ы) может быть включен в моющую композицию путем введения отдельной добавки, содержащей один или несколько ферментов, или путем введения комбинированной добавки, содержащей все указанные ферменты. Детергентная добавка по настоящему изобретению, т.е. содержащая отдельный фермент(ы) или комбинированная добавка, может иметь форму, например, гранулированного материала, жидкости, суспензии и т.д. Предпочтительными формами детергентных добавок являются гранулированные материалы, в частности, не образующие пыли, жидкие составы, в частности, стабилизированные жидкости, или суспензии.
Непылящие грануляты можно получать, например, как описано в патентах США 4106991 и 4661452, и их можно необязательно снабжать покрытием с помощью известных в данной области способов. Примерами воскообразных покрывающих материалов являются продукты поли(этиленоксида) (полиэтиленгликоль, ПЭГ) со средними молекулярными массами от 1000 до 20000; этоксилированные нонилфенолы, включающие от 16 до 50 этиленоксидных фрагментов; этоксилированные жирные спирты, в которых спирт содержит от 12 до 20 атомов углерода и которые включают от 15 до 80 этиленоксидных фрагментов; жирные спирты; жирные кислоты; а также моно-, ди- или триглицериды жирных кислот. Примеры пленкообразующих покрывающих материалов, которые подходят для нанесения по способу кипящего слоя, приведены в GB 1483591. Жидкие препараты ферментов можно, например, стабилизировать добавлением полиола, такого как пропиленгликоль, сахара или сахарного спирта, молочной кислоты или борной кислоты по известным методикам. Защищенные ферменты можно получать по способу, раскрытому в EP 238216.
Моющие композиции по настоящему изобретению могут иметь любую удобную форму, например, плиток, таблеток, порошков, гранул, пасты, жидкости, универсального моющего средства или средства для удаления сильных загрязнений в гранулированной или порошковой форме, в частности, в форме стирального порошка; универсального моющего средства в форме жидкости, геля или пасты, в частности, жидкости для удаления сильных загрязнений; жидкого моющего средства для тонких легких тканей; средства для ручного мытья посуды или для мытья слабо загрязненной посуды, в частности с высоким пенообразованием; средства для машинной мойки посуды, включая различные таблетки, гранулированные, жидкие композиции и ополаскиватели для применения в домашнем хозяйстве и заведениях общественного питания. Композиции по настоящему изобретению могут также находиться в упаковках, содержащих определенную разовую дозу, включая известные в данной области, и являться растворимыми в воде, нерастворимыми в воде и/или проницаемыми для воды. Жидкие моющие композиции могут быть водными, как правило, содержащими до 70% воды и 0-30% органического растворителя, или неводными.
Кроме того, моющая композиция по настоящему изобретению может включать ПАВ, моющие компоненты, отбеливатели, активаторы отбеливания, катализаторы отбеливания, красители, усилители отбеливания, хелатообразующие агенты, средства, препятствующие переносу красителей, средства, содействующие растворению осадков, диспергирующие средства, дополнительные ферменты и стабилизаторы ферментов, каталитические материалы, активаторы отбеливания, пероксид водорода, источники пероксида водорода, оптические усилители яркости, фотоактиваторы, флуоресцирующие вещества, кондиционирующие средства для тканей, заранее полученные перкислоты, полимерные диспергирующие средства, средства для удаления/предотвращения повторного осаждения глины и почвы, солевые наполнители, гидротропные вещества, усилители яркости, пеногасители, средства для усиления эластичности, умягчители тканей, гидролизуемые ПАВ, консерванты, антиоксиданты, средства против усадки ткани, гермициды (бактерициды), фунгициды, средства от потускнения, антикоррозионные средства, источники щелочности, солюбилизирующие агенты, носители, технологические добавки, пигменты, красители, отдушки, средства для регулирования pH, другие ферменты и системы стабилизации ферментов.
Так, например, моющая композиция содержит одно или несколько ПАВ, которые могут быть неионными, включая семиполярные, и/или анионными, и/или катионными, и/или цвиттерионными, и/или амфолитными, и/или семиполярными неионными, и/или смесями ПАВ перечисленных типов. Как правило, ПАВ присутствуют в количестве от 0,1% до 60% по массе, в то время как в альтернативных вариантах осуществления, их содержание составляет примерно от 1 процента до примерно 50 процентов, и в еще одной группе вариантов осуществления, их содержание составляет примерно от 5 процентов до примерно 40 процентов по массе от массы моющей композиции.
Если в моющую композицию входят анионные ПАВ, а именно линейные алкилбензолсульфонаты, альфа-олефинсульфонаты, алкилсульфаты (сульфаты жирных спиртов), этоксисульфаты спиртов, втор-алкансульфонаты, метиловые эфиры альфа-сульфожирных кислот, алкил- или алкенилянтарные кислоты или мыла, их содержание составляет примерно от 1% до примерно 40%.
Другие подходящие анионные ПАВ являются мылами, а также мылами, содержащими сульфатные или сульфонатные группы. ПАВ сульфонатного типа, которые рассматриваются в настоящем изобретении, представляют собой (C9-C13-алкил)бензолсульфонаты и олефинсульфонаты, причем имеется в виду, что последние представляют собой смеси алкенсульфонатов и гидроксиалкансульфонатов и -дисульфонатов, полученные, например, сульфонированием C12-C18 моноолефинов с концевой или внутренней двойной связью. Кроме того, могут применяться (C12-C18)алкансульфонаты и эфиры альфа-сульфожирных кислот (эфирсульфонаты), например, альфа-сульфонированные метиловые эфиры гидрированных жирных кислот из кокосового масла, пальмоядрового масла или животного жира, альфа-сульфокарбоксилированных кислот, полученные при омылении MES.
Другими подходящими анионными ПАВ являются эфиры глицерина и сульфонированных жирных кислот, включая моно-, ди- и три-замещенные эфиры и их смеси.
Предпочтительными алк(ен)ил сульфатами являются соли щелочных металлов и натриевые соли моноэфиров серной кислоты и C12-C18 жирных спиртов, например, жирных спиртов, полученных из кокосового масла, жирных спиртов, полученных из животного жира, лаурилового, миристилового, цетилового или стеарилового спирта, или C10-C20 оксоспиртов, а также моноэфиров серной кислоты и вторичных спиртов, имеющих указанную длину цепи. С точки зрения технологии удаления загрязнений, особое предпочтение отдается C12-C16 алкилсульфатам и C12-C15 алкилсульфатам, а также C14-C15 алкилсульфатам. Подходящими анионными ПАВ являются также алкан-2,3-диилбис(сульфаты), которые получают, например, в соответствии с US 3234258 или US 5075041.
Кроме того, подходят моноэфиры серной кислоты и линейных или разветвленных спиртов C7-C21, этоксилированные 1-6 молями этиленоксида, такие как, 2-метил-разветвленные спирты C9-C11, этоксилированные в среднем 3,5 молями этиленоксида (EO), или C12-C18 жирные спирты, этоксилированные 1-4 молями EO. Вследствие высокого пенообразования, их обычно применяют в моющих и чистящих композициях лишь в относительно низкой концентрации, например, от 1% до 5% по массе.
Анионные ПАВ могут также включать диэфиры и/или соли моноэфиров сульфоянтарной кислоты с жирными спиртами C8-C18 или их смеси. Особенно предпочтительными являются сульфосукцинаты с узким распределением длин цепей остатков жирных спиртов. Аналогично, можно применять алк(ен)илсульфосукцинаты, алк(ен)ильная цепь которых предпочтительно включает от 8 до 18 атомов C, или их соли.
Другими анионными ПАВ, которые рассматриваются в настоящем изобретении, являются производные жирных кислот и аминокислот, например, метилтаурина (тауриды) и/или метилглицина (саркозиды). Еще одним типом анионных ПАВ, рассматриваемых в настоящем изобретении, являются мыла. Могут применяться мыла, являющиеся производными насыщенных жирных кислот, например, солями лауриновой кислоты, миристиновой кислоты, пальмитиновой кислоты, стеариновой кислоты, гидрированной эруковой кислоты и бегеновой кислоты, а также мыльные смеси, полученные из природных жирных кислот, например, жирных кислот из кокосового масла, пальмоядрового масла или животного жира. Анионные ПАВ, включая мыла, могут присутствовать в форме их натриевых, калиевых или аммониевых солей, а также в форме растворимых солей органических оснований, например, моно-, ди- и триэтаноламина. Анионные ПАВ могут присутствовать в форме их натриевых или калиевых солей.
В качестве неионных ПАВ предпочтительно применяются алкоксилированные, преимущественно этоксилированные и/или пропоксилированные, в особенности, первичные спирты, включающие от 8 до 18 атомов углерода, и, в среднем, от 1 до 12 молей этиленоксида(EO) и/или от 1 до 10 молей пропиленоксида (PO) на моль спирта. Особенно предпочтительными являются алкоксилаты спиртов C8-C16, преимущественно этоксилированные и/или пропоксилированные алкоксилаты спиртов C10-C15, в особенности алкоксилаты спиртов C12-C14, имеющие степень этоксилирования от 2 до 10 или от 3 до 8, и/или степень пропоксилирования от 1 до 6, или от 1,5 до 5. Спиртовые остатки предпочтительно могут быть линейными или, особенно в положении 2, метил-разветвленными, или могут включать смесь линейных и метил-разветвленных цепей, что обычно имеет место в оксо-спиртах. Однако особенно предпочтительными являются этоксилаты спиртов, полученные из линейных спиртов природного происхождения, которые содержат от 12 до 18 атомов углерода, например, жирных спиртов из кокосового масла, пальмового масла или животного жира, или олеилового спирта, и в среднем 2-8 молей EO на моль спирта. Этоксилированные спирты включают, например, спирты C12-C14 с 3 EO или 4EO, спирты C9-C11 с 7 EO, спирты C13-C15 с 3EO, 5EO, 7EO или 8EO, спирты C12-C18 с 3 EO, 5 EO или 7EO, их смеси, например, смеси спирта C12-C14 с 3 EO и спирта C12-C18 с 5EO. Приведенные степени этоксилирования и пропоксилирования представляют собой статистически средние значения, которые, для конкретного продукта, могут являться целыми или дробными числами. Предпочтительные этоксилаты и пропоксилаты спиртов имеют узкое распределение гомологов (узкий диапазон этоксилатов/пропоксилатов, NRE/NRP). Помимо описанных неионных ПАВ могут применяться также этоксилаты жирных спиртов, включающие более 12 EO. Их примерами являются этоксилаты жирных спиртов из животного жира с 14 EO, 25 EO, 30 EO или 40 EO.
Также подходящими являются алкоксилированные амины, которые являются этоксилированными и/или пропоксилированными, в особенности первичные и вторичные амины, в алкильных цепях которых содержится от 1 до 18 атомов углерода, алкоксилированные в среднем от 1 до 12 молей этиленоксида (EO) и/или от 1 до 10 молей пропиленоксида (PO) на моль амина.
Помимо этого, в качестве еще одной группы неионных ПАВ также могут применяться алкилполигликозиды общей формулы R1O(G)x, где R1 означает первичную алкильную группу с линейной цепью или метил-разветвленную алкильную группу (в особенности метил-разветвленную группу в положении 2), включающую от 8 до 22, предпочтительно от 12 до 18 атомов углерода, и символ G означает фрагмент гликозы (моносахарида), включающий 5 или 6 атомов углерода; предпочтительно G представляет собой глюкозу. Степень олигомеризации x, которая показывает среднее число фрагментов гликозы, как правило, находится в пределах от 1 до 10; предпочтительно, x равен от 1,2 до 1,4.
Другой класс применимых неионных ПАВ, которые используются либо в качестве единственного неионного ПАВ, либо в комбинации с другими неионными ПАВ, включает алкоксилированные, предпочтительно этоксилированные, или этоксилированные и пропоксилированные алкиловые эфиры жирных кислот, содержащих 1-4 атома углерода в алкильной цепи, в особенности метиловые эфиры жирных кислот, которые описаны, например, в JP58/217598.
Также могут быть подходящими неионные ПАВ класса аминоксидов, например, N-(кокоалкил)-N,N-диметиламиноксид и N-(талловый алкил)-N,N-бис(2-гидроксиэтил)аминоксид, а также алканоламиды жирных кислот или алканоламиды этоксилированных жирных кислот.
В более предпочтительном варианте осуществления ПАВ представляют собой додецилсульфат натрия, соединения четвертичного аммония, алкилпиридиниййодиды, Tween 80, Tween 85, Triton X-100, Brij 56, биологические ПАВ, рамнолипид, сурфактин, висконсин или сульфонаты.
Если неионные ПАВ, такие как этоксилаты спиртов, этоксилаты нонилфенола, алкилполигликозиды, алкилдиметиламиноксиды, этоксилированные моноэтаноламиды жирных кислот, моноэтаноламиды жирных кислот, полигидроксиалкиламиды жирных кислот или N-ацил-N-алкильные производные глюкозамина («глюкамиды»), включены в моющую композицию, их содержание, как правило, будет составлять примерно от 0,2% до примерно 40%.
В некоторых вариантах осуществления настоящее изобретение относится к способу, в котором концентрация, по меньшей мере, одного ПАВ составляет от 0 до 500, от 0,00001 до 100, от 0,0001 до 50, от 0,0001 до 40, от 0,001 до 30, от 0,01 до 20, от 0,1 до 15, от 1 до 10 миллиграммов на грамм ткани.
В некоторых вариантах осуществления изобретение относится к способу, в котором концентрация, по меньшей мере, одного ПАВ составляет от 0 до 50, от 0,0001 до 40, от 0,001 до 30, от 0,01 до 20, от 0,1 до 10 или от 1 до 5 г на литр раствора.
Моющая композиция по настоящему изобретению может содержать 0-65% моющего компонента или комплексообразующего агента, например, цеолита, дифосфата, трифосфата, фосфоната, карбоната, цитрата, нитрилотриуксусной кислоты, этилендиаминтетрауксусной кислоты, диэтилентриаминпентауксусной кислоты, алкил- или алкенилянтарной кислоты, растворимых силикатов или слоистых силикатов, например, MGDA: метилглициндиуксусной кислоты или, альтернативно, GLDA: тетранатриевой соли L-глутаминовой-N,N-диуксусной кислоты. Моющая композиция по настоящему изобретению может также не включать основы, т.е. быть по существу свободной от моющего компонента.
Количество моющего компонента может составлять более 5%, более 10%, более 20%, более 30%, более 40% или более 50% и может быть менее 80% или 65%. В составе для мытья посуды, содержание моющего компонента, как правило, составляет 40-65%, в частности 50-65%.
Моющий компонент может, в частности, представлять собой хелатообразующий агент, который образует водорастворимые комплексы с Ca и Mg. Прочность комплекса, образованного моющим компонентом и ионами Ca++ и/или Mg++, выраженная величиной log K (где K означает константу равновесия или стабильности, или условную константу стабильности при данном pH), может находиться в диапазоне 3-8, в частности, 5-8. Константу стабильности можно измерять при 25°C и ионной силе 0,1М, и условную константу стабильности можно измерять в тех же условиях при pH 8,5 или 9.
Моющий компонент может содержать аминогруппу и может представлять собой, например, аминокарбоксилат, аминополикарбоксилат или фосфонат. Он может являться мономерной молекулой, содержащей одну, две или три аминогруппы (как правило, вторичные и третичные аминогруппы), и кроме того, он может включать две, три, четыре или пять карбоксильных групп. Примерами подходящих моющих компонентов являются метилглицин диуксусная кислота (MGDA), глутаминовая-N,N-диуксусная кислота (тетранатриевая соль N,N-дикарбоксиметилглутаминовой кислоты, GLDA), нитрилотриуксусная кислота (NTA), диэтилентриамин пентауксусной кислоты (DTPA), этилендиаминтетрауксусная кислота (EDTA), этилендиамин-N,N’-диянтарная кислота (EDDS), N-(1,2-дикарбоксиэтил)-D,L-аспарагиновая кислота (IDS) и N-(2-гидроксиэтил)иминодиуксусная кислота (EDG), а также их соли.
Моющий компонент предпочтительно обладает буферной емкостью (называемой также резервом щелочности) более 4 (число эквивалентов сильной кислоты, необходимых для изменения значения pH одного литра буферного раствора на одну единицу при сохранении постоянного общего количества кислоты и соли в буферном растворе).
Моющий компонент может являться экологически безвредным секвестрантом (комплексообразователем), например, описанным в WO 09/102854. Подходящие экологически безвредные секвестранты включают один или несколько продуктов из числа секвестрантов на основе аминокислот, секвестрантов на основе сукцинатов, лимонной кислоты и ее солей.
Примеры подходящих продуктов на основе аминокислот включают MGDA (метилглициндиуксусную кислоту), ее соли и производные, а также GLDA (глутаминовую-N,N-диуксусную кислоту) и ее соли и производные. Другие подходящие моющие компоненты описаны в US 6426229. Особенно подходящие моющие компоненты включают, например, аспарагиновую-N-метилуксусную кислоту (ASMA), аспарагиновую-N,N-диуксусную кислоту (ASDA), аспарагиновую-N-монопропионовую кислоту (ASMP), иминодиянтарную кислоту (IDA), N-(2-сульфометил)аспарагиновую кислоту (SMAS), N-(2-сульфоэтил)аспарагиновую кислоту (SEAS), N-(2-сульфометил)глутаминовую кислоту (SMGL), N-(2-сульфоэтил)глутаминовую кислоту (SEGL), N-метилиминодиуксусную кислоту (MIDA), α-аланин-N,N-диуксусную кислоту (α-ALDA), серин-N,N-диуксусную кислоту (SEDA), изосерин-N,N-диуксусную кислоту (ISDA), фенилаланин-N,N-диуксусную кислоту (PHDA), антраниловую-N,N-диуксусную кислоту (ANDA), сульфаниловую-N,N-диуксусную кислоту (SLDA), таурин-N,N-диуксусную кислоту (TUDA) и сульфометил-N,N-диуксусную кислоту (SMDA), и соли указанных кислот со щелочными металлами и аммонием. В одном из аспектов могут применяться соли и производные GLDA. В одном из аспектов может применяться тетранатриевая соль GLDA.
Другие примеры подходящих моющих компонентов включают N-(гидроксиэтил)этилендиаминтетраацетат (HEDTA), диэтанолглицин (DEG), 1-гидроксиэтилиден-1,1-дифосфоновую кислоту (HEDP), диэтилентриаминпента(метиленфосфоновую кислоту) (DTPMP), этилендиаминтетра(метиленфосфоновую кислоту) (EDTMPA) и аминотрис(метиленфосфоновую кислоту) (ATMP).
Примеры подходящих сукцинатов описаны в US 5977053. В одном из аспектов подходящие сукцинаты включают тетранатрий иминосукцинат.
Моющие компоненты можно классифицировать с помощью теста, описанного M.K. Nagarajan et al., JAOCS, vol.61, NO.9 (September 1984), pp.1475-1478, для определения минимального содержания моющего компонента, необходимого для понижения жесткости воды при pH 10,5 с 200 частей на млн. (по содержанию CaCO3) до 10 частей на млн. в растворе гипотетического моющего средства имеющем концентрацию 0,2 процента, где результат теста выражают в виде массового содержания моющего компонента в указанном гипотетическом моющем средстве. Альтернативно, тест можно проводить при pH 8,5, что отражает более низкое значение pH типовых современных стиральных порошков. При проведении этого теста при любом из указанных значений pH, требуемое содержание моющего компонента может составлять 0-25% (сильный компонент), 25-35% (компонент средней силы) или >35% (слабый компонент). Более предпочтительными являются композиции, содержащие сильные моющие компоненты и компоненты средней силы, наиболее предпочтительными являются композиции с сильными моющими компонентами.
Моющий компонент может быть сильным моющим компонентом, например, метилглициндиуксусной кислотой (“MGDA”) или тетранатриевой солью N,N-дикарбоксиметилглутаминовой кислоты (GLDA); он может быть моющим компонентом средней силы, например, натрий триполифосфатом (STPP), или он может являться слабым моющим компонентом, например, цитратом натрия. Более предпочтительными являются композиции, содержащие сильные моющие компоненты и компоненты средней силы, наиболее предпочтительными являются композиции с сильными моющими компонентами. Другими примерами моющих компонентов являются цеолиты, дифосфаты, трифосфаты, фосфонаты, карбонаты, нитрилотриуксусная кислота, этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота, алкил- или алкенилянтарная кислота, растворимые силикаты и слоистые силикаты (например, SKS-6 фирмы Hoechst).
Моющая композиция по настоящему изобретению может содержать один или несколько полимеров. Примерами являются карбоксиметилцеллюлоза, поли(винилпирролидон), поли(этиленгликоль), поли(виниловый спирт), поли(винилпиридин-N-оксид), поли(винилимидазол), поликарбоксилаты, например, полиакрилаты, сополимеры малеиновой/акриловой кислот и сополимеры лаурилметакрилата/акриловой кислоты.
Моющая композиция по настоящему изобретению может содержать отбеливающую систему или один или несколько отбеливающих агентов, которые могут включать источник H2O2, например, перборат или перкарбонат, которые могут быть скомбинированы с активаторами отбеливания, образующими перкислоту, например, тетрацетилэтилендиамином или нонаноилоксибензолсульфонатом. Альтернативно, отбеливающая система может включать пероксикислоты, например амидного, имидного или сульфонового типа. Дополнительные подходящие отбеливающие агенты включают другие фотоотбеливатели, предварительно полученные перкислоты, источники пероксида водорода, активаторы отбеливания, пероксид водорода, катализаторы отбеливания и их смеси. В случае применения отбеливающего агента, композиции по настоящему изобретению, как правило, могут включать примерно от 0,1% до примерно 50% или даже примерно от 0,1% до примерно 25% отбеливающего агента по массе от чистящей композиции по настоящему изобретению.
Моющая композиция может также содержать другие традиционные моющие ингредиенты, например, кондиционеры для тканей, включая глины, усилители пенообразования, пеногасители, антикоррозионные средства, средства для суспендирования грязи, средства, препятствующие повторному осаждения грязи, красители, бактерициды, оптические усилители яркости, гидротропы, ингибиторы потускнения или отдушки.
Различия в местных и региональных условиях, например, жесткости воды и температуре стирки, вызывают потребность в региональных моющих композициях. В примерах моющих композиций 1 и 2 приведены приблизительные композиции типового европейского средства для автоматического мытья посуды (ADW) и типового европейского стирального порошка, соответственно.
Пример моющей композиции 1: типовая европейская моющая композиция ADW
|
Пример моющей композиции 2: типовой европейский стиральный порошок.
|
Фермент(ы) моющих композиций по настоящему изобретению можно стабилизировать с применением стандартных стабилизирующих агентов и ингибиторов протеаз, например, полиолов, таких как пропиленгликоль или глицерин, сахаров или сахарных спиртов, различных солей, таких как NaCl, KCl; молочной кислоты, муравьиной кислоты, борной кислоты или производных борной кислоты, например, ароматических боратов или производных фенилбороновой кислоты, например, 4-формилфенилбороновой кислоты, или пептидальдегидов, например, ди-, три- или тетрапептидальдегидов или аналогов альдегидов (любых производных формулы B1-B0-R, где R означает H, CH3, CX3, CHX2 или CH2X (X=галоген), B0 означает одиночный остаток аминокислоты (предпочтительно с необязательно замещенной алифатической или ароматической боковой цепью); и B1 состоит из одного или нескольких аминокислотных остатков (предпочтительно, одного, двух или трех), необязательно включающих N-концевую защитную группу, или как описано в WO 09118375, WO 98/13459), или ингибиторов протеаз белкового типа, таких как RASI, BASI, WASI (бифункциональных ингибиторов альфа-амилазы/субтилизина, получаемых из риса, ячменя и пшеницы), или CI2 или SSI. Композиция может иметь состав, описанный, например, в WO 92/19709, WO 92/19708 и US 6472364. В некоторых вариантах осуществления, применяемые в настоящем изобретении ферменты стабилизированы присутствием в итоговых композициях водорастворимых источников ионов цинка (II), кальция (II) и/или магния (II), которые доставляют данные ионы ферментам, а также источников других ионов металлов (например, бария (II), скандия (II), железа (II), марганца (II), алюминия (III), олова (II), кобальта (II), меди (II), никеля (II) и оксованадия (IV)).
В настоящем изобретении предусматривается, что любой индивидуальный фермент, включая фермент по настоящему изобретению, может быть добавлен в моющую композицию в количестве, соответствующем 0,01-200 мг фермента на литр моющего раствора, предпочтительно 0,05-50 мг фермента на литр моющего раствора, в частности 0,1-10 мг фермента на литр моющего раствора.
Как правило, моющие композиции по настоящему изобретению включают, по меньшей мере, 0,0001 массового процента, примерно от 0,0001 до примерно 10, примерно от 0,001 до примерно 1, или примерно от 0,01 до примерно 0,1, или примерно от 0,05 до примерно 15% масс., примерно от 0,05 до примерно 20% или примерно от 1 до примерно 20%, или примерно от 1 до примерно 15% масс., по меньшей мере, одного фермента, разработанного в настоящем изобретении. В некоторых предпочтительных вариантах осуществления, моющие композиции по настоящему изобретению, как правило, имеют такой состав, чтобы при их применении в операциях чистки в водной среде, значение pH моющей водной среды составляло примерно от 5,0 до примерно 11,5, или, в альтернативных вариантах осуществления, даже примерно от 6,0 до примерно 10,5. В некоторых предпочтительных вариантах осуществления гранулированные или жидкие продукты, применяемые для стирки, имеют такой состав, чтобы значение pH находилось в пределах примерно от 6 до примерно 8. Способы регулирования pH при рекомендуемых дозировках включают применение буферов, щелочей, кислот и т.д. и хорошо известны специалисту в данной области.
Кроме того, ферменты по настоящему изобретению могут быть включены в моющие композиции, раскрытые в заявке WO 97/07202, которая включена в настоящее описание посредством ссылки.
МАТЕРИАЛЫ И МЕТОДИКИ
Методики определения активности вариантов протеазы
Образцы тканей
Стандартные образцы тканей получали от EMPA St. Gallen, Lerchfeldstrasse 5, CH-9014, St.Gallen, Switzerland. А именно, тип EMPA117 (ткань полиэфир/хлопок, загрязненная кровью, молоком и чернилами). Другие стандартные образцы тканей получали от Center For Testmaterials BV, P.O. Box 120, 3133 KT Vlaardingen, the Netherlands. А именно, тип C-10 (хлопок, загрязненный маслом/молоком/пигментом) и PC-03 (ткань полиэфир/хлопок, загрязненная шоколадным молоком/сажей).
Меламиновые плитки
Стандартные меламиновые плитки получали от Center For Testmaterials BV, P.O. Box 120, 3133 KT Vlaardingen, the Netherlands. А именно, тип DM-21 (загрязненные вареным яичным желтком).
Штаммы и плазмиды
Штамм Bacillus lentus 309 депонирован NCIB, ему был присвоен учетный номер NCIB 10309, и данный штамм описан в патенте США 3723250, включенном в настоящее описание посредством ссылки. Исходную субтилазу 309 или Savinase® можно получать из штамма 309. Организмом-хозяином для экспрессии являются Bacillus subtilis.
Плазмиду pSX222 использовали в качестве «челночного» вектора для E.Coli-B.subtilis и вектора экспрессии для B. subtilis (как описано в WO 96/34946).
Общие методики молекулярной биологии
Если не указано иное, операции и трансформации ДНК проводили с использованием стандартных методик молекулярной биологии (Sambrook et al. (1989) Molecular cloning: A laboratory manual, Cold Spring Harbor lab., Cold Spring Harbor, NY; Ausubel, F.M. et al. (eds) “Current protocols in Molecular Biology”. John Wiley and Sons, 1995; Harwood, C.R., and Cutting, S.M. (eds.) “Molecular Biological Methods for Bacillus”. John Wiley and Sons, 1990).
Ферменты для проведения операций с ДНК
Если не указано иное, все ферменты для проведения процедур с ДНК, как, например, рестрикционные эндонуклеазы, лигазы и т.д. получали от New England Biolabs, Inc. Ферменты для проведения операций с ДНК использовали в соответствии со спецификациями поставщиков.
Ферментация
Ферментацию для получения субтилазы осуществляли при pH 7,3 и температуре 37°C на вращательно-качающемся столе при 225 об/мин в 50-мл пробирках, содержащих 15 мл двойной среды TY, в течение 2-3 дней.
Для ознакомления с описанием среды TY см. стр. 1.1.3 Media Preparation and Bacteriological Tools в “Current protocols in Molecular Biology” John Wiley and Sons, 1995; Harwood, C.R., and Cutting, S.M. (eds).
Очистка
Варианты субтилазы, секретированные из клеток-хозяев, можно без труда выделить из культуральной среды с помощью хорошо известных методик, включающих выделение клеток из среды с помощью центрифугирования или фильтрования, и осаждение белковых компонентов из среды с помощью солей, например, сульфата аммония, с последующей хроматографией, например, ионообменной хроматографией, аффинной хроматографией, или подобных методик.
Каталитическая активность
Каталитическую активность вариантов по настоящему изобретению можно определить с помощью анализа «кинетика гидролиза модельного субстрата Suc AAPF-pNA»:
субстрат pNA: Suc-AAPF-pNA (Bachem L-1400).
Температура: комнатная температура.
Аналитический буфер: 50 мМ Tris/HCl, 1 мМ CaCl2, pH 9,0.
20 мл протеазы (разбавленной 0,01% Triton X-100) смешивали с 100 мл аналитического буфера. Анализ начинали путем добавления 100 мл субстрата pNA (50 мг, растворенного в 1,0 мл ДМСО и затем разбавленного 45× 0,01% Triton X-100). Определяли увеличение OD405 как показатель активности протеазы.
Тест на моющую эффективность
Для оценки эффективности выбранного варианта субтилазы в моющей композиции, осуществляли эксперименты по определению моющей способности. Варианты фермента по настоящему изобретению тестировали с использованием автоматического анализа механического усилия (AMSA). С помощью теста AMSA можно определить моющую эффективность большого числа моющих растворов, взятых в незначительном количестве, с добавками фермента. Более подробное описание можно найти в примере 3.
Моющие средства
Моющие средства для определения моющей эффективности ферментов по настоящему изобретению, можно получать, приобретая на рынке коммерческие моющие средства, включающие все компоненты, и затем инактивируя ферментные компоненты тепловой обработкой (5 минут при 85°C в водном растворе). Кроме того, непосредственно у производителя можно приобрести основу поставляемого на рынок моющего средства, не содержащую ферментов. Помимо этого, можно приготовить подходящий модельный моющий состав согласно указаниям настоящего описания и использовать его в тестах по определению моющей эффективности.
ПРИМЕРЫ
Пример 1
Конструирование и экспрессия вариантов фермента
Варианты по настоящему изобретению могут быть сконструированы и экспрессированы способами, известными специалисту в данной области техники. Ниже приведен один из примеров способа получения варианта по настоящему изобретению.
Сайт-направленный мутагенез
Сайт-направленные варианты субтилизина 309 (Savinase®) по настоящему изобретению, включающие определенные вставки/делеции/замены, получали традиционным клонированием фрагментов ДНК (Sambrook et al. Molecular cloning: A laboratory manual, 2nd Ed., Cold Spring Harbor, 1989), полученных с помощью PCR, с олигонуклеотидами, содержащими желаемые мутации.
Матричной плазмидной ДНК может являться pSX222 или ее аналог, содержащий вариант субтилизина 309. Мутации в конструкцию вариантов вводили путем олиго-направленного мутагенеза.
Варианты субтилизина 309 трансформировали в E.coli. ДНК, выделенную после культивирования трансформированных бактерий в течение ночи, трансформировали в B. subtilis, выполняя расщепление рестрикционной эндонуклеазой, очистку фрагментов ДНК, лигирование, трансформацию B. subtilis. Трансформацию B. subtilis осуществляли, как описано у Dubnau et al., 1971, J. Mol. Biol.56, pp. 209-221.
Сайт-направленный мутагенез для введения мутаций в определенную область
Синтезировали мутагенные праймеры (олигонуклеотиды), соответствующие последовательности ДНК, фланкирующей сайт мутации, разделенные парами оснований ДНК, определяющими вставки/делеции/замены.
После этого, полученные мутагенные праймеры использовали в реакции PCR с модифицированной плазмидой pSX222. Полученный в результате PCR фрагмент очищали и амплифицировали во второй PCR-реакции, полученный продукт PCR очищали и амплифицировали в третьей реакции PCR, затем гидролизовали эндонуклеазами и клонировали в челночный вектор pSX222 E. coli-B. subtilis. Реакции PCR проводили в обычных условиях. Плазмидную ДНК трансформировали в E. Coli по хорошо известным методикам, и одну колонию E. coli секвенировали для подтверждения запланированной мутации.
Для очистки вариантов субтилазы по настоящему изобретению, экспрессионную плазмиду pSX222, включающую вариант по настоящему изобретению, трансформировали в компетентный штамм B.subtilis и подвергали ферментации, как описано выше.
Пример 2
Очистка и определение концентрации фермента
После ферментации осуществляли очистку вариантов субтилизина с использованием гидрофобной хроматографии с индукцией заряда (HCIC) и последующим вакуумным фильтрованием.
Для захвата фермента в HCIC использовали целлюлозную матрицу, к которой был прикреплен 4-меркаптоэтилпиридин (4-MEP).
Гранулы целлюлозной матрицы размером 80-100 мкм смешивали со средой, содержащей экстракт дрожжей и трансформированные B. subtilis, способные секретировать варианты субтилизина, и инкубировали при pH 9,5 в микропланшетах Unifilter®.
Поскольку 4-MEP является гидрофобным при pH>7 и варианты субтилизина являются гидрофобными при pH 9,5, между секретированным ферментом и 4-MEP на гранулах осуществляется гидрофобное связывание. После инкубирования среду и остатки клеток удаляли вакуумным фильтрованием, тогда как гранулы и фермент оставались на фильтре.
Для элюирования фермента с гранул, понижали pH, промывая фильтр буфером для элюирования (pH 5). При этом ферменты отделялись от гранул, и их можно было извлечь из буфера.
Концентрацию очищенного варианта субтилизина оценивали с помощью титрования активного цента фермента (AST).
Очищенный фермент инкубировали с высокоафинным ингибитором CI-2A при различных концентрациях, ингибируя различное количество активных центров. Протеаза и ингибитор связываются друг с другом в соотношении 1:1 и, соответственно, концентрацию фермента можно непосредственно соотнести с концентрацией ингибитора, при которой протеаза становится неактивной. Для измерения остаточной активности протеазы после инкубирования с ингибитором добавляли субстрат (0,6М Suc-Ala-Ala-Pro-Phe-pNA в буфере Tris/HCl), и в течение последующих 4 минут наблюдали за увеличением концентрации продукта распада субстрата, т.е. pNA (паранитрофенола), периодически измеряя поглощение при 405 нм с помощью прибора для считывания Elisa.
Пример 3
Варианты по настоящему изобретению тестировали на моющую эффективность с помощью теста AMSA как на твердых поверхностях, так и на образцах тканей. Ниже приведены методики и результаты тестирования.
Моющая эффективность вариантов субтилизина на твердых поверхностях
Описание методики тестирования AMSA
Для оценки эффективности выбранных вариантов протеазы в композициях для мытья посуды, т.е. модельном детергенте ADW с MGDA и модельном детергенте ADW с STPP, проводили эксперименты по определению моющей способности. Тестирование протеаз по настоящему изобретению проводили с использованием автоматического анализа механического усилия (AMSA). С помощью теста AMSA можно определить моющую способность значительного числа взятых в небольших количествах моющих растворов, содержащих ферменты. Поддон для теста AMSA имеет ряд слотов для тестируемых растворов и крышку, плотно прижимающую образец, имитирующий отмываемую посуду, а именно меламиновую плитку, против всех отверстий слотов. Во время отмывания, поддон, тестируемые растворы, меламиновую плитку и крышку энергично встряхивали для приведения тестируемого раствора в контакт с загрязненной меламиновой плиткой и прилагали регулярное механическое усилие, периодически меняя его направление. Для ознакомления с более подробным описанием см. WO 02/42740, в частности раздел «Варианты осуществления, относящиеся к специальным методикам» на стр.23-24.
Эксперимент проводили при описанных ниже условиях:
|
|
Ниже приведены результаты тестирования различных вариантов в составе ADW. В результатах коэффициент равен 1. Моющей эффективности Savinase присвоено значение 1, и результаты вариантов сравниваются с этим значением.
|
|
Приведенные результаты явно демонстрируют, что варианты по настоящему изобретению эффективно разрушают белковые загрязнения, например, остатки вареных яиц.
Моющая эффективность дополнительных вариантов субтилизина на твердых поверхностях
Дополнительные варианты по настоящему изобретению тестировали на моющую эффективность с помощью анализа AMSA на твердых поверхностях в тех же условиях, которые описаны выше.
|
|
Приведенные результаты явно демонстрируют, что варианты по настоящему изобретению эффективно разрушают белковые загрязнения, например, остатки вареных яиц.
Моющая эффективность вариантов субтилизина на текстильных материалах
Для оценки эффективности выбранных вариантов субтилазы в композиции на основе коммерческих моющих составов, проводили эксперименты по определению моющей способности. Варианты ферментов по настоящему изобретению тестировали с использованием автоматического анализа механического усилия (AMSA). С помощью теста AMSA можно определить моющую способность значительного числа моющих растворов, взятых в небольших количествах, содержащих ферменты. Поддон для теста AMSA имеет ряд слотов для тестируемых растворов и крышку, плотно прижимающую образец ткани, который предполагается подвергнуть стирке, против всех отверстий слотов. Во время стирки поддон, тестовые растворы, ткань и крышку энергично встряхивали, чтобы привести тестируемый раствор в контакт с тканью, и прилагали механическое усилие.
Описание методики тестирования AMSA
Для оценки моющей эффективности выбранных вариантов протеаз в стиральных порошках, проводили эксперименты по определению моющей способности. Тестирование протеаз по настоящему изобретению проводили с использованием автоматического анализа механического усилия (AMSA). С помощью теста AMSA можно определить моющую способность значительного числа моющих растворов, взятых в небольших количествах, содержащих ферменты. Поддон для теста AMSA имеет ряд слотов для тестируемых растворов и крышку, плотно прижимающую образец ткани, который предполагается подвергнуть стирке, против всех отверстий слотов. Во время стирки, поддон, тестовые растворы ткань и крышку энергично встряхивали, чтобы привести тестируемый раствор в контакт с тканью, и прилагали регулярное механическое усилие, периодически меняя его направление. Для ознакомления с более подробным описанием см. WO 02/42740, в частности раздел «Варианты осуществления, относящиеся к специальным методикам» на стр.23-24.
Эксперимент проводили в описанных ниже условиях:
|
Жесткость воды доводили до 15°dH добавлением к тестируемой системе CaCl2, MgCl2 и NaHCO3 (Ca2+:Mg2+=4:1:7,5). После стирки образцы тканей промывали водопроводной водой и сушили.
Эффективность варианта фермента определяли по яркости цвета ткани, постиранной с применением конкретной протеазы. Яркость можно выразить также в виде интенсивности света, отраженного от образца ткани при освещении его белым светом. Если образец загрязнен, интенсивность отраженного света, ниже, чем в случае чистого образца. Следовательно, можно использовать интенсивность отраженного света для измерения моющей эффективности протеазы.
Измерение яркости цвета осуществляли на профессиональном планшетном сканнере (Kodak iQsmart, Kodak, Midtager 29, DK-2605 Brøndby, Denmark), который использовали для получения изображения постиранного образца ткани.
Для определения величины интенсивности светового потока от сканированного изображения использовали, например, специально разработанное программное обеспечение (Novozymes Color Vector Analyzer), причем параметры изображения в формате 24 бита/пиксель конвертировали в значения интенсивности для красного, зеленого и голубого цветов (RGB). Значение интенсивности (Int) вычисляли путем сложения величин RGB в векторной форме и затем вычислением длины результирующего вектора:
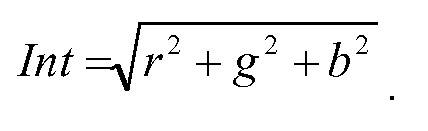
Образцы тканей
Образцы C-10 и PC-03 получали от Center For Testmaterials BV, P.O. Box 120, 3133 KT Vlaardingen, the Netherlands, и образец EMPA117 получали от EMPA Testmaterials AG Mövenstrasse 12, CH-9015 St.Gallen, Switzerland.
Ниже приведены результаты теста по стирке тканей AMSA для различных вариантов по настоящему изобретению. Для эффективности Savinase принято значение 1, и результаты вариантов нормированы относительно этой величины.
|
Ниже приведены дополнительные результаты теста по стирке тканей AMSA для различных вариантов по настоящему изобретению. Для эффективности исходного фермента (т.е. без замены N218D) принято значение 1, и результаты вариантов нормированы относительно этой величины.
|
Приведенные результаты явно демонстрируют, что варианты по настоящему изобретению обладают улучшенной моющей эффективностью при стирке изделий из ткани по сравнению с исходным ферментом.






