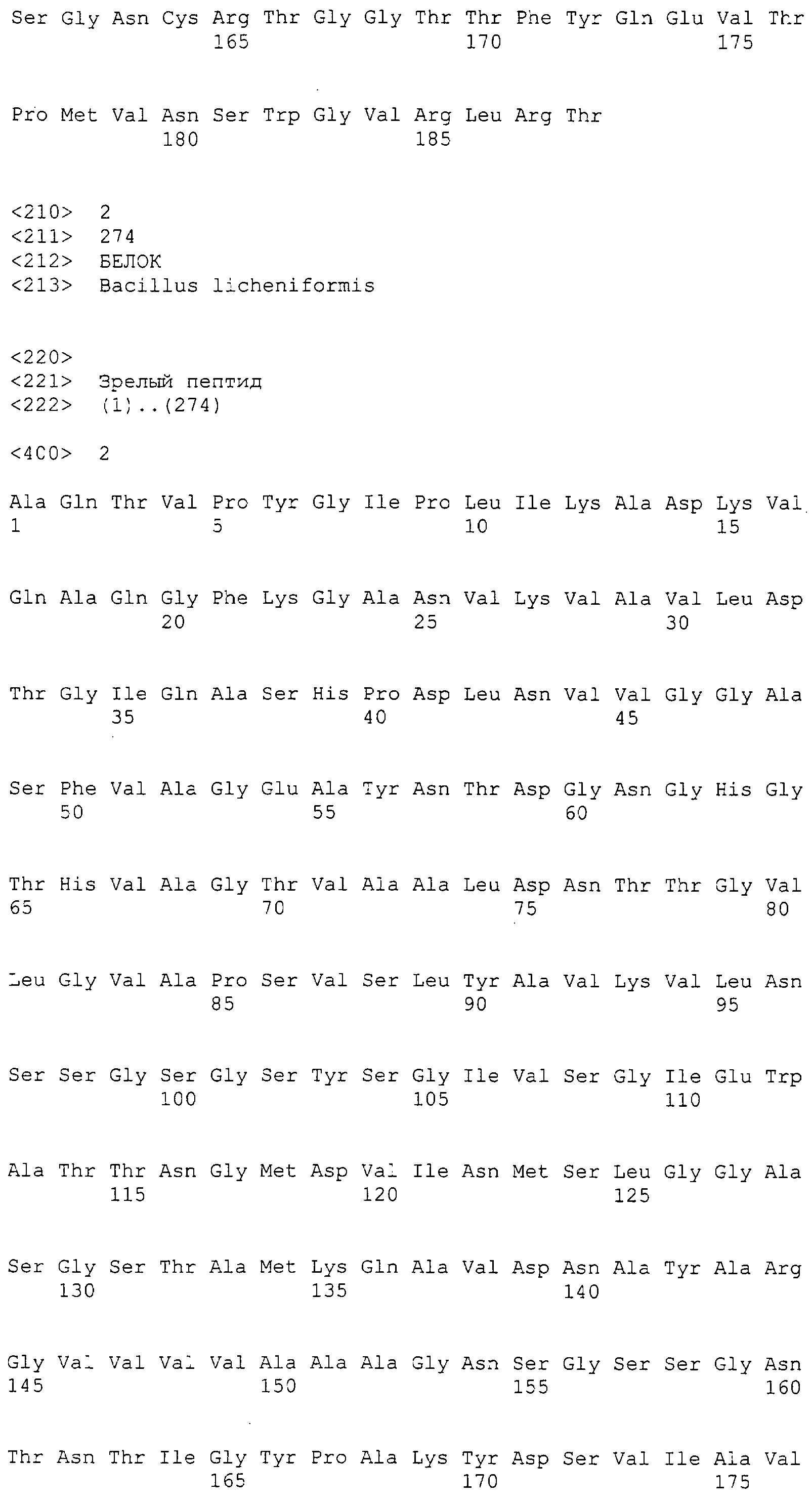Результат интеллектуальной деятельности: СПОСОБ ПИВОВАРЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к способу пивоварения, в котором для контроля за коллоидальной устойчивостью напитков используется термостабильная протеаза. Протеазы могут быть получены из организмов Nocardiopsis, Bacillus или Thermoascus. Протеаза добавляется либо в затор во время фильтрации, и/или в сусло после фильтрации, но перед варкой сусла.
УРОВЕНЬ ТЕХНИКИ
Во многих таких напитках, как пиво, вино, сок и других, образуется осадок в процессе их производства или хранения. Это явление описывается как мутность. Общепринято, что мутность вызывается взаимодействием белков и полифенолов, присутствующих в напитке. Это взаимодействие приводит к образованию нерастворимой или полурастворимой суспензии коллоидных частиц. Так как мутность обычно похожа на мутность, вызванную микробным загрязнением, то, как правило, предпочтительно, чтобы напитки, особенно пиво, оставались очень чистыми и прозрачными даже при длительном хранении. Следовательно, были разработаны технологические процедуры для уменьшения такого помутнения. Эти технологические процедуры воздействуют либо на белки, либо на полифенолы, либо на и на те, и на другие.
Силикагели, Бентонит, поливинилполипирролидон (ПВПП) и другие, используются для адсорбции белков и полифенолов, уменьшая мутность и улучшая коллоидальную устойчивость. Однако такие вещества при многократном применении приводят к сокращению доходов и, в результате, к повышению цен. Более того, они также удаляют другие необходимые соединения из напитка, что может сказаться на его качестве.
Также для улучшения коллоидальной устойчивости напитков, особенно пива, в процессе ферментации применяются ферменты, особенно протеазы. Традиционно, для снижения холодного помутнения применяются такие протеазы, как папаин и бромелин. Однако эти протеазы не являются специфичными и, как было показано, влияют на стабильность пены напитка путем гидролиза белков, ответственных за пенообразование. Кроме того, их применение также приводит к изменению вкуса напитка. Другим подходом явилось применение специфических протеаз, которые гидролизуют только гидрофильные белки, вызывающие мутность, но не гидрофобные белки, образующие пену. Например, известна пролилспецифичная эндопротеаза, которая специфически гидролизует белки, вызывающие мутность, таким образом повышая коллоидальную устойчивость и сохраняя стабильность пены. При применении протеаз в процессе ферментации они могут сохранить свою активность в полученном пиве, что, как правило, нежелательно. При этом инактивация путем пастеризации может привести к уничтожению вкуса пива.
Все еще существует необходимость в улучшении технологических процедур для обеспечения коллоидальной устойчивости напитков, особенно пива.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение относится к способу пивоварения, включающему контактирование затора в процессе фильтрации и/или сусла после фильтрации, но перед варкой сусла, с термостабильной протеазой.
В одном аспекте протеаза получена из организмов Nocardiopsis, Thermoascus или Bacillus.
В одном аспекте изобретение относится к способу пивоварения, включающему контактирование затора в процессе фильтрации и/или сусла после фильтрации, но перед варкой сусла, с протеазой, чья аминокислотная последовательность включает таковую, соответствующую Последовательности №1, 2 или 3, и их варианты, которые идентичны Последовательностям №1, 2, или 3 на по меньшей мере 70%.
В одном аспекте способ приводит к уменьшению мутности в пивном продукте.
В одном аспекте изобретение относится к способу пивоварения, включающему контактирование затора в процессе фильтрации и/или сусла после фильтрации, но перед варкой сусла, с термостабильной протеазой, тем самым повышается коллоидная стабильность в сравнении с пивом, сваренным традиционным способом.
В одном аспекте контактирование осуществляется во время промывания дробины.
В одном аспекте контактирование осуществляется после фильтрации.
В одном аспекте контактирование осуществляется при температуре по меньшей мере 60 градусов по Цельсию (здесь и далее обозначаемых °C). В другом аспекте температура составляет по меньшей мере 70°C. В следующем аспекте температура составляет по меньшей мере 74°C, более предпочтительно, по меньшей мере 75°C, более предпочтительно, по меньшей мере 76°C, более предпочтительно, по меньшей мере 77°C и наиболее предпочтительно, по меньшей мере 78°C.
В одном аспекте контактирование осуществляется в течение периода от 10 минут (здесь и далее обозначаемых мин) до 5 часов, предпочтительно, контактирование осуществляют от 20 мин до 3 часов, более предпочтительно от 30 мин до 2 часов и, наиболее предпочтительно, от 30 мин до 1 часа.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
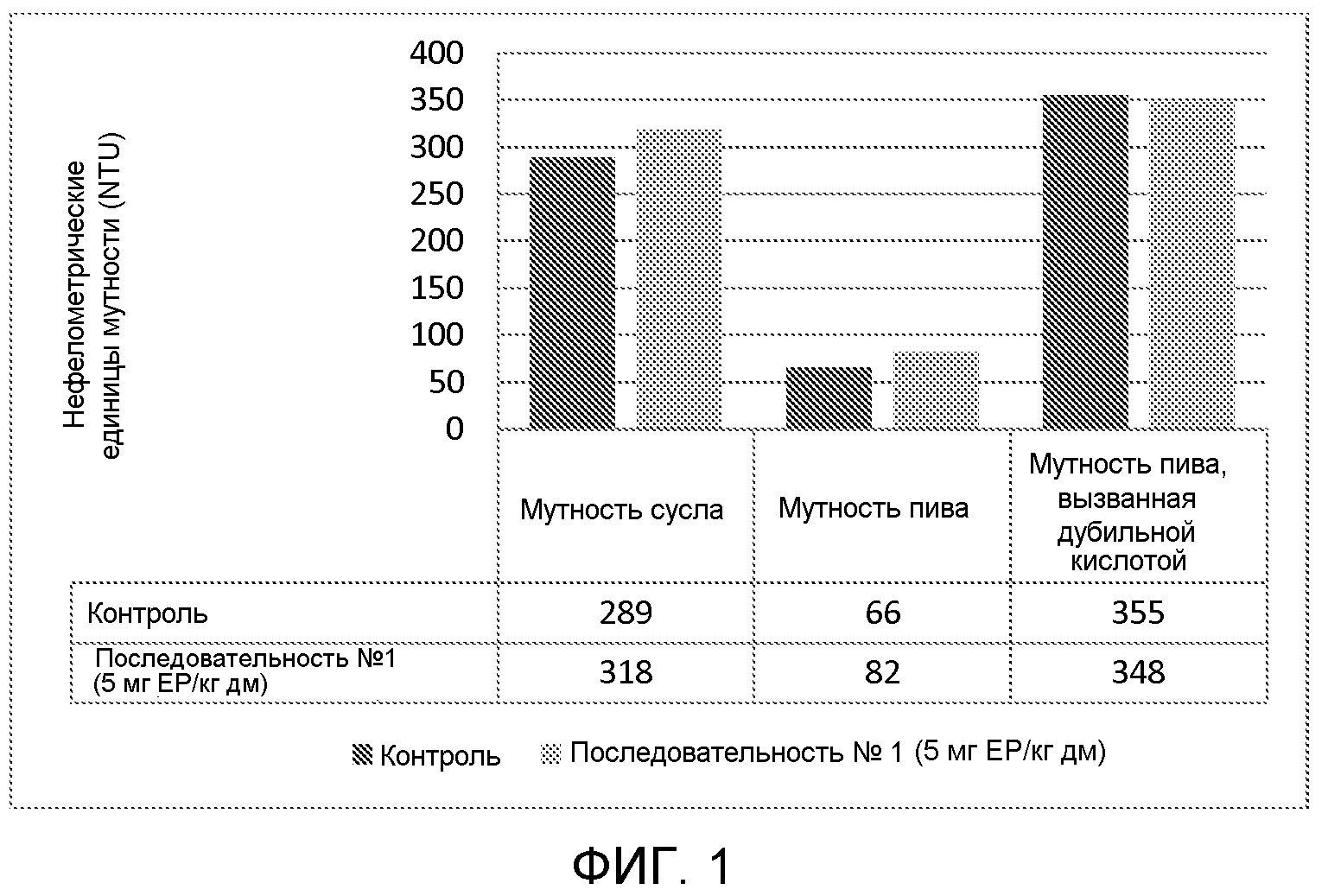
Фиг. 1 показывает измерение мутности сусла и пива, полученного из затора, обработанного протеазой с аминокислотной последовательностью Последовательности №1, против необработанного затора (контроль). По оси Y отложены величины в нефелометрических единицах мутности (NTU).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Процесс пивоварения хорошо известен специалистам в данной области. Традиционный способ может быть кратко изложен следующим образом. Исходным сырьем является осоложенный (то есть увлажненный, пророщенный и затем высушенный) ячмень и/или несоложенные добавки, называемые крупкой (промежуточный продукт помола зерна). В процессе затирания солода, где крупка дробится и смешивается с водой, нагревается и взбалтывается, углеводы разрушаются до ферментируемых сахаров с помощью ферментов, природно присутствующих в солоде. После затирания, необходимо отделить жидкий экстракт (сусло) от твердых частиц (отработанные частицы зерна и добавок) для получения чистого сусла. Эта процедура описывается как фильтрация. Перед фильтрацией, температура затора может подниматься до примерно 75-78°C (165-173 °F) (известно как «маш-аут» («mash out»), инактивация отработавших ферментов). Важно провести фильтрацию сусла, так как твердая фракция обогащена большим количеством белка, слабо модифицированного крахмала, жирными веществами, силикатами и полифенолами (таннинами) и белками. Экстракт, удержанный в отработанном зерне после сбора первого сусла, также может быть вымыт при добавлении горячей воды на поверхность отфильтрованного осадка. Эта процедура называется промывание дробины. Горячая вода протекает через отработанное зерно и разжижает оставшийся экстракт. Разжиженное сусло называется вторым суслом, и его экстракт имеет плотность, сниженную до 1-2% по сравнению с исходной плотностью первого сусла. После добавления хмеля сусло варится. Тем самым многочисленные вещества, включая некоторые белки, денатурируют, и произойдет преципитация полифенолов. После охлаждения и удаления осадка готовое пивное сусло (a) насыщается воздухом и добавляются дрожжи. После основной ферментации, обычно длящейся 5-10 дней, удаляется большая часть дрожжей, и так называемое молодое пиво (b) хранится при низкой температуре, обычно при 0-5°C, от одной до 12 недель. В течение этого периода оставшиеся дрожжи будут осаждаться вместе с полифенолами. Для удаления избытка оставшихся полифенолов проводится фильтрация. Зрелое пиво (c) может быть насыщено углекислым газом перед разливом по бутылкам. Двуокись углерода не только способствует очевидной «полноте», или экстрактивности пива, и действует как усилитель вкуса, но также повышает потенциал пенообразования и играет важную роль в продлении срока годности продукта.
Термин «пиво» при использовании в данном тексте подразумевается как охватывающий как минимум пиво, приготовленное из заторов, полученных из несоложенего зерна, равно как и из заторов, полученных из осоложенного зерна, и всех заторов, полученных из смеси несоложенего и осоложенного зерна. Термин «пиво» также охватывает пиво, приготовленное с помощью добавок, и пиво со всевозможными вариантами содержания алкоголя.
Не ограничиваясь теорией, считается, что взаимодействие между белками и полифенолами в пиве, хранящемся при низких температурах или в течение длительного времени, ведет к появлению агрегатов, которые известны как мутность. Так как мутность влияет на качество (также известно как коллоидная стабильность) пива, были разработаны способы, предотвращающие подобную мутность. В процессе пивоварения, большинство комплексов белков и полифенолов высаживаются охлаждением жидкости в период созревания пива. Остаточные полифенолы и/или белки удаляются с помощью ПВПП, силикагеля, бентонита и других.
Согласно настоящему изобретению коллоидная стабильность пива определяется как количество циклов нагревания, требующихся для того, чтобы коллоидальная неустойчивость, измеренная в единицах ЕПК (Европейская Пивоваренная Конвенция), превысила 2. Один цикл нагревания соответствует приблизительно 25 дням срока годности (MEBAK 2.15.2.1, Fociertmethode, Vorausbestimmung der chemisch-physikalischen stabilitat, Methodensamlung der Mitteleuropaischen Brautechniche Analysekommission (MEBAK), Selbstverlag der MEBAK, Freising Weihenstephan).
Мутность также называется «муть» или «непрозрачность», или «коллоидальная неустойчивость», в данной области, и, следовательно, эти термины могут использоваться как взаимозаменямые.
Другим способом уменьшения помутнения является применение протеаз.
Такие протеазы, как папаин, имеющие широкий спектр активности, используются для расщепления белков, возможно с выходом меньшего количества и/или более растворимых агрегатов белка и полифенолов. Однако применение этих ферментов также затрагивает белки, вовлеченные в устойчивость пены, таким образом сказываясь на качестве готового продукта.
Также, гипотетически, такие специфические протеазы, как пролил- или аланинспецифические протеазы, предпочтительно действуют на белки, активно участвующие в помутнении, и не задействованные в пенообразовании, таким образом сохраняя стабильность пены готового продукта.
Предпочтительно, чтобы готовый продукт был очищен от активностей привнесенных извне ферментов. Поэтому ферменты, подобно вышеперечисленным протеазам, обычно добавляются в затор (вода + крупка) в процессе затирания солода. Таким образом, они активны во время затирания и инактивируются или деградируют во время фильтрации и варки сусла.
Авторы изобретения неожиданно обнаружили, что добавление протеаз в затор во время фильтрации и/или в сусло после этапа фильтрации, но перед этапом варки сусла, обеспечивает хорошую коллоидальную устойчивость.
Авторы изобретения неожиданно обнаружили, что протеазы, которые либо не проявляют эффекта, либо оказывают прямое отрицательное воздействие на коллоидальную устойчивость, при добавлении в начале затирания солода, в действительности демонстрируют очень хорошее повышение коллоидальной устойчивости пива при добавлении во время и/или после фильтрации. Потеря эффекта в случае, когда фермент добавляется на этапе затирания солода, может осуществлять по нескольким причинам, одной из которых является ингибирование протеаз в заторе. Авторы изобретения обнаружили, что отрицательный эффект протеаз, добавленных на этапе затирания солода, в то же время будучи положительным при добавлении позже в технологическом процессе, связан со способностью протеазы высвобождать белковые вещества в сусло при добавлении на ранних этапах технологического процесса, что отрицательно сказывается на коллоидальной устойчивости, даже если фермент способен деградировать белки, образующие коллоид. Авторы изобретения установили, что этого можно избежать, если протеаза добавляется после фильтрации или значительно позже в технологическом процессе, с целью ограничить высвобождение белкового материала в сусло, например, во время фильтрации, более конкретно, во время промывания дробины. Как ни удивительно, авторы изобретения нашли, что количество высвобожденного белка должно поддерживаться на уровне по меньшей мере 10% повышения уровня белка (измерено по методу Кьельдаля), предпочтительно, менее 9%, более предпочтительно, менее 8%, более предпочтительно, менее 7%, более предпочтительно, менее 6% и, наиболее предпочтительно, менее 5%.
Как ни удивительно, авторы изобретения обнаружили, что количество высвобожденного белка с молекулярным весом в районе 10000 кДа (полосы 4-6) сохраняется на относительно низком уровне.
Как ни удивительно, также было обнаружено, что протеаза, которая ранее не рассматривалась как действующая специфически на белки, вызывающие мутность, и из-за этого не обладающая низкой активностью в отношении пенообразующих белков, не только может обеспечить хорошую коллоидальную устойчивость, но также делает это без какого-либо или только со слабым отрицательным эффектом на стабильность пены пива, если она добавляется к затору во время фильтрации и/или в сусло после фильтрации, но перед варкой сусла.
Как ни удивительно, авторы изобретения обнаружили, что протеазы, которые также являются термостабильными, обеспечивают хорошую коллоидальную устойчивость, будучи добавленными в затор во время фильтрации и/или в сусло после фильтрации, но перед варкой сусла.
Как ни удивительно, эффект на коллоидальную устойчивость протеаз(ы), внесенных в сусло после фильтрации, может быть получен в течение 2 часов, что гораздо меньше, чем несколько дней, требующихся при применении протеаз при ферментации.
Авторы изобретения неожиданно обнаружили, что термостабильные протеазы имеют очень хорошую активность в отношении коллоидальной устойчивости, при добавлении к затору во время фильтрации и/или в сусло после фильтрации, но перед варкой сусла.
Также авторы изобретения обнаружили, что применение протеазы, которая существенно сдерживает свою активность во время и/или после фильтрации, как ни удивительно, ведет в пивоварении к повышению коллоидальной устойчивости пива.
Таким образом, в одном аспекте изобретение относится к способу пивоварения, включающему контактирование затора во время фильтрации и/или сусла после фильтрации, но перед варкой сусла, с протеазой, которую можно получить из организмов Nocardiopsis, Bacillus или Thermoascus.
Термины «затор», «фильтрация» и «сусло» имеют обычное значение, принятое в данной области.
Протеазы известны в данной области техники. Они представляют собой полипептиды, обладающие протеазной активностью, и также известны как пептидазы, протеиназы, пептид гидролазы или протеолитические ферменты. Протеазы могут быть экзопротеазами, которые гидролизуют пептиды, начиная с любого их конца, или эндопротеазами, которые действуют на внутреннюю часть полипептидных цепей (эндопептидазы). Эндопептидазы демонстрируют активность в отношении пептидных субстратов, блокированных по N- и C-концам, что актуально для специфичности протеаз, представляющих интерес в данном случае. Термин «протеаза» в данном тексте определяет фермент, который гидролизует пептидные связи. Он включает любой фермент, принадлежащий к группе ферментов КФ (Классификация Ферментов) 3.4 (включая все тринадцать субклассов группы). Номер КФ соотносится с изданием Номенклатура Ферментов 1992 от NC-IUBMB, Academic Press, San Diego, Calif., включая расширения 1 5, опубликованные в Eur. J. Biochem. 1994, 223, 15; Eur. J. Biochem. 1995, 232, 16; Eur. J. Biochem. 1996, 237, 15; Eur. J. Biochem. 1997, 250, 16; и Eur. J. Biochem. 1999, 264, 610 650 соответственно. Номенклатура регулярно дополняется и обновляется, см., к примеру, World Wide Web (WWW) на сайте www.chem.qmw.ac.uk/iubmb/enzyme/index.html.
Протеазы классифицируются на основе их механизма катализа по следующим группам: сериновые протеазы (S), цистеиновые протеазы (C), аспарагиновые протеазы (A), металлопротеазы (M), и неизвестные, или, как точно не классифицированные, протеазы (U), см. Справочник протеолитических ферментов, A. J. Barrett, N. D. Rawlings, J. F. Woessner (eds), Academic Press (1998), в особенности общую вводную часть.
Протеазная активность может быть измерена с помощью любого теста, в котором используется субстрат, содержащий пептидные связи, соответствующие специфичности анализируемой протеазы. Аналогичным образом к анализируемой протеазе подбираются условия теста pH и температурного теста. Примеры теста-pH - значения pH 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12. Примеры температурного теста - 30, 35, 37, 40, 45, 50, 55, 60, 65, 70, 80, 90 или 95°C. Примеры субстратов для протеаз включают (но не ограничены ими): казеин, такой как казеин, сшитый с азурином (AZCL-казеин) и коммерческий препарат Protazyme AK.
Нет никаких ограничений по происхождению протеазы настоящего изобретения и/или для использования согласно настоящему изобретению. Таким образом, термин «протеаза» включает не только природные ферменты или протеазы дикого типа, полученные из микроорганизмов любого рода, но также любые их мутанты, варианты, фрагменты и т.д., проявляющие протеазную активность, равно как и синтетические протеазы, такие как протеазы с «перетасованными» участками и консенсусные протеазы. Подобные генно-инженерные протеазы могут быть получены способами, общеизвестными в данной области, например путем сайт-направленного мутагенеза, с помощью ПЦР (используя ПЦР фрагмент, содержащий требуемую мутацию, как один из праймеров в реакциях ПЦР), или ненаправленным мутагенезом. Получение консенсусных белков описано в таких работах, как, например, EP 897985. Генная «перетасовка» в общих чертах описана в таких работах, как, например, WO 95/22625 и WO 96/00343. Перестройка генов протеаз может быть осуществлена в независимости от конкретной последовательности исходных генов путем синтетической перетасовки, как описано Ness, J. E. и соавторами в издании Nature Biotechnology, Vol. 20 (12), pp. 1251 1255, 2002. Для обеспечения вероятности вставки всех аминокислотных остатков, обнаруженных в наборе исходных протеаз, проектируются синтетические олигонуклеотиды с вырожденной последовательностью ДНК, и гены собираются согласно ссылке. «Перетасовка» может быть проведена на основе полноразмерной последовательности, либо только для части последовательности, которая позже объединяется с остальной частью гена для получения полноразмерной последовательности.
В одном аспекте протеаза получена из организма Nocardiopsis.
Nocardiposis был описан Meyer в 1976 году (Meyer, 1976, Int J Syst Bacterid, 26, 487-493). Nocardiopsis dassonvillei является одним из видов данного рода и имеет альтернативные названия Nocardiopsis dassonvillei subsp. dassonvillei, Nocardiopsis antarctica или даже Streptomyces flavidofuscus. Предпочтительно, протеаза получена из организма рода Nocardiopsis, более предпочтительно, Nocardiopsis dassonvillei, Nocardiopsis alba или Nocardiopsis antarctica, более предпочтительно, Nocardiopsis dassonvillei subsp. dassonvillei.
В другом аспекте протеаза получена из организма Bacillus или Thermoascus. Протеазы, полученные из Bacillus, хорошо известны в данной области. Протеазы, полученные из Thermoascus, описаны в WO 03/048353.
Термин «получены из», при использовании в данном тексте в связи с конкретным источником, подразумевает, что полипептид, кодируемый последовательностью нуклеиновой кислоты, производится источником либо рекомбинантной клеткой (также называемой «клетка-хозяин»), в которой присутствует последовательность нуклеиновой кислоты источника. В предпочтительном варианте осуществления изобретения полипептид секретируется внеклеточно. В зависимости от того, какой хозяин используется в процессе производства рекомбинантного продукта, протеазы настоящего изобретения могут быть гликозилированы или не гликозилированы. В дополнение, протеазы изобретения также могут содержать модифицированный начальный остаток метионина, в некоторых случаях как результат жизнедеятельности организма-хозяина.
Клетки-хозяева могут представлять собой одноклеточный микроорганизм, например прокариотический, или неодноклеточный микроорганизм, например эукариотический. Целесообразными в качестве клеток-хозяев являются бактериальные клетки, такие как грамположительные бактерии, включая, но не ограничиваясь, клетки Bacillus или клетки Streptomyces, либо клетки молочнокислых бактерий; или грамотрицательные бактерии, такие как E. coli и Pseudomonas sp. Молочнокислые бактерии включают, но не ограничены, видами родов Lactococcus, Lactobacillus, Leuconostoc, Streptococcus, Pediococcus и Enterococcus.
Другими клетками-хозяевами могут являться клетки грибов (включая типы Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota (как определено Hawksworth и соавторами в Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK), равно как и Oomycota (как ссылаются в ранее указанном издании Hawksworth и соавторов, 1995, на стр. 171) и все митоспоровые грибы (Hawksworth и соавторы, 1995, вышеуказанное издание).
В одном аспекте грибная клетка-хозяин является дрожжевой клеткой. Термин «дрожжи» при использовании в данном тексте включает аскоспоровые дрожжи (Endomycetales), базидиоспоровые дрожжи и дрожжи, принадлежащие к несовершенным грибам (Blastomycetes). Так как классификация дрожжей может измениться в будущем, для целей настоящего изобретения дрожжи должны быть определены как описано в издании Biology and Activities of Yeast (Skinner, F. A., Passmore, S. M., and Davenport, R. R., eds, Soc. App. Bacteriol. Symposium Series №9, 1980). Дрожжевыми клетками-хозяевами могут быть клетки Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia.
Дрожжевыми клетками-хозяевами могут быть клетки мицелиальных грибов. Термин «мицелиальные грибы» включает все мицелиальные формы подразделов Eumycota и Oomycota (как определено Hawksworth и соавторами, 1995, см. выше). Мицелиальные грибы характеризуются тем, что стенки их мицелия состоят из хитина, целлюлозы, глюкана, хитозана, маннана и других сложных полисахаридов. Вегетативный рост осуществляется за счет удлинения гиф, а катаболизм углерода облигатно аэробный. В отличие от них вегетативный рост дрожжей, таких как Saccharomyces cerevisiae, осуществляется путем почкования одноклеточного таллома, а катаболизм углерода может быть ферментативным.
Неограничивающими примерами клеток-хозяев, относящихся к мицелиальным грибам, являются клетки видов: Acremonium, Aspergillus, Fusarium, Humicola, Mucor, Myceliophthora, Neurospora, Penicillium, Thielavia, Tolypocladium или Trichoderma.
Согласно способам производства настоящего изобретения клетки культивируются в питательной среде, пригодной для получения протеазы с применением методик, известных в данной области техники. Например, клетки могут культивироваться путем культивирования во встряхиваемых колбах, ферментации в малых или больших объемах (включая непрерывную, периодическую, периодическую ферментацию с добавлением субстрата или твердофазную ферментацию) в лаборатории или промышленных биореакторах, проводимого в подходящей среде и при условиях, позволяющих полипептиду экспрессироваться и/или выделяться. Культивирование проводится в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, с применением методик, известных в данной области техники. Соответствующие среды доступны от коммерческих поставщиков, либо могут быть приготовлены согласно опубликованным рецептам (например, в каталогах Американской Коллекции Типовых Культур). Если протеаза секретируется в питательную среду, то может быть восстановлена непосредственно из среды. Если протеаза не секретируется, то может быть восстановлена из клеточного лизата.
Полученная протеаза может быть восстановлена способами, известными в данной области. Например, протеаза может быть восстановлена из питательной среды с помощью стандартных технологических процедур, включая, но не ограничиваясь, центрифугирование, фильтрацию, экстракцию, сушку распылением, эвапорацию или осаждение.
Протеазы настоящего изобретения могут быть очищены с помощью различных методик, известных в данной области техники, включая, но не ограничиваясь, хроматографию (например, ион-обменную, аффинную, гидрофобную, хроматофокусирование и гель-фильтрацию), электрофоретические методы (например, препаративное изоэлектрическое фокусирование), дифференциальную растворимость (например, осаждение сульфатом аммония), электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия или экстракции (см., например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989).
В одном аспекте протеаза содержит аминокислотную последовательность, соответствующую Последовательности №1 и ее варианты, которые идентичны Последовательности №1, на по меньшей мере 70%.
В другом аспекте протеаза содержит и аминокислотную последовательность, соответствующую Последовательности №2 или 3 и варианты, которые идентичны соответствующей исходной последовательности на по меньшей мере 70%.
Термин «вариант» предназначен для определения полипептида, который является производным от Последовательности №1, или 2, или 3, и который обладает протеазной активностью. Как правило, варианты отличаются от исходной протеазы (в этом случае протеазы, имеющей последовательность Последовательности №1 или 2, или 3) на один или более аминокислотных остатков, которые, например, могут быть добавлены или удалены с любого или обоих N- или C-концов протеазы, вставлены или удалены из одного или более сайтов внутри аминокислотной последовательности протеазы, или замещают один или более аминокислотных остатков внутри, или с какого-либо, или с обоих, концов аминокислотной последовательности исходной протеазы. Варианты могут иметь природное происхождение (например, варианты полипептидов, кодируемых аллельными вариантами гена, которые представляют собой какую-либо из двух или более альтернативных форм гена, занимающего тот же самый хромосомный локус), либо быть созданы искусственно, с помощью многообразия методик, известных в данной области (например, ПЦР).
Протеаза в соответствии с настоящим изобретением содержит аминокислотную последовательность, которая идентична части зрелого пептида, соответствующего Последовательности №1 или 2, либо 3, например, по меньшей мере, на примерно 70%. В конкретных примерах осуществления изобретения степень идентичности Последовательности №1 или 2, или 3, или 4, составляет, по меньшей мере, примерно 72%, 74%, 76%, 78%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или по меньшей мере 99%.
Для целей настоящего изобретения степень идентичности двух аминокислотных последовательностей определяется программой «выравнивать», которая представляет собой выравнивание по алгоритму Нидлмана-Вунша (то есть глобальное выравнивание). Программа используется для выравнивания полипептидов, равно как и нуклеотидных последовательностей. По умолчанию используется матрица замен BLOSUM50, со штрафом для первого остатка разрыва -12 и штрафами для последующих остатков разрыва -2.
«Выравнивать» является частью программного обеспечения FASTA версии v20u6 (см. W. R. Pearson and D. J. Lipman (1988), "Improved Tools for Biological Sequence Analysis", PNAS 85:2444 2448, и W. R. Pearson (1990) "Rapid and Sensitive Sequence Comparison with FASTP и FASTA", Methods in Enzymology 183:63 98). Белковые выравнивания FASTA используют алгоритм Смита-Ватермана без ограничений по размеру разрыва (см. "Smith-Waterman algorithm", T. F. Smith and M. S. Waterman (1981) J. Mol. Biol. 147:195 197).
Степень идентичности двух аминокислотных последовательностей также может быть определена методом Clustal (Higgins, 1989, CABIOS 5: 151 153) с использованием программного обеспечения LASERGENE.TM.MEGALIGN.TM. (DNASTAR, Inc., Madison, Wis.) с таблицей идентичности и следующими параметрами множественного выравнивания: штраф за внесение пропуска 10 и штраф за продление пропуска 10. Параметры попарного выравнивания: размер участка максимального совпадения (K-tuple)=1, штраф за внесение пропуска = 3, длина сегмента, включающего наилучший выровненный сегмент ("окна")=5, и число непрерывно совпадающих участков ("диагонали")=5.
В одном аспекте контактирование протеазы и сусла осуществляют после фильтрации.
Температура во время фильтрации обычно около 78°C, поэтому может понадобиться снизить температуру после фильтрации, чтобы предоставить возможность работать ферменту, уменьшение температуры повышает стоимость процесса пивоварения, и, следовательно, выгодно наименьшее возможное снижение температуры и предпочтительно полное отсутствие.
Температура, при которой вносится фермент, предпочтительно составляет по меньшей мере 60°C, более предпочтительно, по меньшей мере 70°C, более предпочтительно, по меньшей мере 72°C, более предпочтительно, по меньшей мере 74°C, более предпочтительно, по меньшей мере 75°C, более предпочтительно, по меньшей мере 76°C, более предпочтительно, по меньшей мере 77°C и, даже более предпочтительно, по меньшей мере 78°C.
В одном аспекте протеаза является термостабильной протеазой. Термостабильность является показателем способности фермента сохранять активность при высокой температуре. Для целей настоящего изобретения термостабильность протеазы оценивается с помощью теста с субстратом, в отношении которого протеаза активна, таким, как, например, Protazyme AK ®, как описано в примере 3. В одном аспекте протеаза сохраняет по меньшей мере 70% исходной активности, например, такую как по меньшей мере 75%, такую как по меньшей мере 76%, такую как по меньшей мере 77%, такую как по меньшей мере 78%, такую как по меньшей мере 79%, такую как по меньшей мере 80%, такую как по меньшей мере 81%, такую как по меньшей мере 82%, такую как по меньшей мере 83%, такую как по меньшей мере 84%, такую как по меньшей мере 85%, такую как по меньшей мере 86%, такую как по меньшей мере 87%, такую как по меньшей мере 88%, такую как по меньшей мере 89%, такую как по меньшей мере 90%, такую как по меньшей мере 91%, такую как по меньшей мере 92%, такую как по меньшей мере 93%, такую как по меньшей мере 94%, такую как по меньшей мере 95%, такую как по меньшей мере 96%, такую как по меньшей мере 97%, такую как по меньшей мере 98%, такую как по меньшей мере 99%, после инкубации при 70°C и pH 5,5 в течение 10 минут, с применением буферной системы, описанной в примере 3.
В одном аспекте термостабильность также может оцениваться после инкубации при 70°C в течение более длительного промежутка времени, такого как, например, 60 минут, с применением теста, описанного в примере 3. В таких случаях протеаза сохраняет по меньшей мере 20% активности, такую активность, как по меньшей мере 25%, такую как по меньшей мере 30%, такую как по меньшей мере 35%, такую как по меньшей мере 40%, такую как по меньшей мере 45%, такую как по меньшей мере 50%, такую как по меньшей мере 55%, такую как по меньшей мере 60%, такую как по меньшей мере 65%, такую как по меньшей мере 70%, такую как по меньшей мере 75%, такую как по меньшей мере 80%, такую как по меньшей мере 85%, такую как по меньшей мере 90%, такую как по меньшей мере 95%, такую как по меньшей мере 97%, такую как по меньшей мере 99% своей активности, при pH 5,5, с применением буферной системы, описанной в примере 3.
В одном аспекте контактирование осуществляется в период времени от 10 минут до 5 часов, предпочтительно от 20 мин до 3 часов, более предпочтительно, от 30 мин до 2 часов и, наиболее предпочтительно, от 30 мин до 1 часа.
В одном аспекте применение способа изобретения ведет к уменьшению мутности, в сравнении с пивом, сваренным общепринятым образом.
Для количественного определения мутности в напитке часто используется турбидиметр, также называемый мутномер. В турбидиметре измеряется количество света, которое рассеивается при предусмотренном угле относительно направления падающего луча света. Измерения непрозрачности весьма целесообразны при измерении помутнения, образующегося в результате полифенол-белкового взаимодействия.
«Пиво, сваренное общепринятым образом» определяется как пиво, которое было изготовлено способом пивоварения, где протеаза добавляется в затор на этапе затирания солода.
В другом аспекте применение способа изобретения позволяет уменьшить использование технологических добавок, применяемых для снижения помутнения в процессе пивоварения и хранения. «Технологическая добавка» соответствует средству, которое используется в процессе пивоварения и/или хранения для уменьшения помутнения. Технологические добавки включают, но не ограничены, силикагель, ПВПП, бентонит и другие.
В одном аспекте уменьшение осуществляют на 100 процентов, что подразумевает отсутствие технологических добавок. В другом аспекте пиво производится без фильтрации на силикагеле и предпочтительно без фильтрации на силикагеле и ПВПП.
В одном аспекте применение способа изобретения позволяет получить пиво, обладающее стабильностью пены либо равной, либо более высокой, чем пиво, сваренное общепринятым образом.
Пена образуется диоксидом углерода, высвобождающимся при снятии давления во время разлива пива. Пена является стабильной благодаря присутствию поверхностно-активных веществ, таких как пенообразующие белки, которые собираются на поверхности пузырьков и образуют эластичную пленку вокруг газовых пузырьков. Стабильность пены пива определяется измерением времени (в секундах), требуемого для опадания пены на заданное расстояние, по методике NIBEM (MEBAK 2.19.2). Эта методика известна в данной области (MEBAK 2.19.2., Schaumbestimmung nach NIBEM, Methodensamlung der Mitteleuropaischen Brautechniche Analysekommission (MEBAK), Selbstverlag der MEBAK, Freising Weihenstephan).
ПРИМЕРЫ
ПРИМЕР 1: Роль протеазы Последовательности №1 в поддержании коллоидальной устойчивости пива, при добавлении на любом из двух этапов: затирания или в готовое пиво.
Целью являлось исследование, проявляет ли вышеуказанная протеаза схожую протеолитическую активность при использовании в заторе или в готовом пиве, и существует ли различие в коллоидальной устойчивости в этих случаях.
Протеаза была получена, как описано в патенте США 5312748. Протеолитическая активность определялась с помощью хорошо известного метода Ансона с использованием гемоглобина в качестве субстрата, см. Journal of General Physiology, 22, 79-89 (1959). Одна единица Ансона (AU) соответствует количеству протеолитического фермента, которое расщепляет гемоглобин при значении pH 9,0 и температуре 25°C за время реакции 10 минут с такой начальной скоростью, что в минуту образуется такое количество продуктов расщепления, которое не может быть осаждено трихлоруксусной кислотой, и эти продукты расщепления дают то же окрашивание с реагентом фенола, что и один миллиэквивалент тирозина.
Проводились тесты затирания в лабораторных масштабах с использованием 100% солода. Затор обрабатывался протеазой в количестве, соответствующем 5 мг чистого фермента белка протеазы (Последовательности №1) (EP)/кг солода, следуя протоколу затирания, приведенному в таблице 1. Контрольный образец без добавления протеазы также затирался согласно приведенной схеме.
|
Сусло (12°P (градусов Плато)) ферментировалось (12°C, 5 дней, дрожжевой штамм W 35/70), и мутность сусла и пива измерялась с помощью турбодиметра (Турбодиметр фирмы Hach модель 2100 AN). Кроме того, потенциал образования мутности в готовом ферментированном пиве измерялся путем принудительного помутнения при добавлении дубильной кислоты, в соответствии с методикой, опубликованной Siebert в 1997 г. (J. Am. Soc. Brew. Chem. 55(2):73-78, 1997).
Результаты приведены на Фигуре 1.
Из результатов ясно следует, что протеаза не влияла на мутность сусла или пива, что оказалось неожиданным. Даже добавление дубильной кислоты не выявило различий, что указывает на невозможность усиления коллоидальной устойчивости путем добавления таннинов в затор.
ПРИМЕР 2: Влияние протеазы на коллоидальную устойчивость и стабильность пены пива при добавлении во время либо после фильтрации, но перед варкой сусла.
Сусло было восстановлено из обычного 100% хорошо растворенного солода для немецкого светлого пильзенского пива отварочным способом затирания в промышленных масштабах согласно следующей схеме: затирание при 62°C в течение 20 мин, повышение температуры до 65°C (1°C/мин), оставить при 65°C на 15 мин, 20% затора варятся 20 мин и смешиваются с оставшимся затором, который держали при 65°C, что приводит к температуре затирания 72°C, которая поддерживается 30 мин, 20% затора варятся 20 мин и смешиваются с оставшимся затором, который держали при 72°C, что приводит к температуре 78°C, и начинается фильтрация. Во время промывания дробины добавлялась вода до соотношения солода к воде 1:5.
Сусло разводилось до 12 градусов Плато и разделялось на три порции. Порция сусла A не обрабатывалось ферментом (контроль), порция сусла B инкубировалось в течение 2 часов при 70°C с 5 мг белка фермента/кг солода (протеаза Последовательности №1), что соответствует 0,019 AU/кг солода, и порция сусла C инкубировалось в течение 2 часов при 60°C с 5 мг белка фермента/кг солода с пролин-специфической протеазой Brewers Clarex, полученной от DSM (Het Overloon 1 6411 TE Heerlen (NL)), что соответствует 2,7 г препарата Brewers Clarex/100 литров пива. По окончании обработки ферментом сусло варили (инактивация фермента) в течение одного часа с хмелем (8% α-кислот). Три порции сусла проходили одну и ту же процедуру пивоварения полупромышленного производства. В сусло вводили 15×106 клеток/мл дрожжей обычного низового брожения типа (W 34 70"). Ферментация проводилась при 12°C в течение 140 часов, и три порции пива стабилизировали с помощью ПВПП (15 г/гл). Разлив пива по 0,5 литровым флаконам проводился вручную.
Коллоидная стабильность образцов полученного пива определялась согласно методике MEBAK 2.15.2.1 (0°C/40°C/0°C). Образование мути измерялось в единицах ЕПК (Европейской Пивоваренной Конвенции) после 15 циклов нагревания. Уделяя особое внимание коллоидальной устойчивости, срок годности пива может быть определен с помощью числа циклов нагревания, которым может быть подвергнуто пиво до достижения значений мутности, превышающих 2,0 единиц ЕПК (один цикл нагревания приблизительно соответствует 25 дням срока годности).
|
Данные показывают, что образцы пива, обработанные протеазой Последовательности №1 (Порция B), обладают заметно лучшей коллоидальной устойчивостью из всех образцов (Порции A-C). Далее, образцы с Brewers Clarex (порция C) демонстрируют лучшие показатели, чем контрольный образец (порция A).
Был оценен срок годности порций, и он приведен ниже.
|
Данные показывают, что образцы пива, обработанные протеазой Последовательности №1 (Порция B), имеют самый долгий срок хранения из всех образцов (Порции A-C). Также образцы с Brewers Clarex (порция C) имеют лучший срок годности, чем контрольный образец (порция A).
Стабильность пены (NIBEM) была определена согласно методике MEBAK (2.19.2).
|
Данные показывают, что образцы пива, обработанные протеазой Последовательности №1 и Brewers Clarex (Порции B и С), могут быть охарактеризованы как обладающие свойством хорошей стабильности пены в той степени, что превосходят контрольный образец (порция A).
ПРИМЕР 3: Тест на термостабильность протеазы
Термостабильность протеаз Последовательности №1, Последовательности №2 и Последовательности №3 и препарата Нейтраза (Neutrase® фирмы Novozymes A/S, Bagsvaerd, Denmark) анализировали с использованием препарата Protazyme AK® (Megazyme International Ireland Ltd, Wicklow, Ireland) в качестве субстрата. Альтернативно, при необходимости могут быть использованы другие субстраты, при условии, что данная протеаза обладает активностью в отношении этого субстрата.
Протеазы Последовательности №1, 2, 3 и Нейтраза были разведены до концентрации 1 мг/мл в аналитическом буфере (100 мм янтарной кислоты, 100 мм HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота), 100 мм CHES (N-циклогексил-2-амино этансульфоновая кислота), 100 мм CABS (4-(циклогексиламино)-1-бутансульфоновая кислота), 1 мм CaCl2, 150 мм KCl, 0,01% Тритон X-100, pH доведен до 5,5 с помощью NaOH). Затем протеазы пре-инкубировались i) во льду, ii) 10 мин при 70°C. Была приготовлена пустая проба (аналитический буфер без протеазы) и преинкубировалась тем же образом. Таблетки препарата Protazyme AK суспендировались в 0,01% Тритоне X-100, одна таблетка на 2 мл. Для каждой реакции, 500 мкл раствора Protazyme смешивались с 500 мкл аналитического буфера (описан выше) в пробирке Эппендорфа и помещались в лед. Для начала реакции в пробирку добавлялись 20 мкл протеазы, и пробирки инкубировались в термомиксере для пробирок Эппендорфа при 70°C, 1400 об/мин в течение 15 мин. Реакцию останавливали помещением пробирок в лед. Образцы центрифугировались холодными в течение 3 минут при 14000 g, и измерялась оптическая плотность OD590 супернатанта. Значение OD590 для пустого образца вычиталось из соответствующих значений образцов, обработанных протеазами. Термостабильность протеаз была определена вычислением процентной активности образцов, преинкубированных при 70°C, в сравнении с образцами, преинкубированными во льду (100%). Результаты приведены в таблице ниже.
|
Из приведенной выше таблицы ясно следует, что протеазы Последовательностей №1, 2 и 3 сохраняли 88, 71 и 93 процента своей активности, соответственно, при 70°C, что указывает на их термостабильность. Однако Нейтраза вообще не сохраняла своей активности при 70°C, что указывает, что она не термостабильна.
ПРИМЕР 4: Роль протеаз Последовательностей №1, 2, 3 и Нейтразы в определении коллоидальной устойчивости, установленная в системе сусла.
Способны ли протеазы (Последовательностей 1, 2, 3 и Нейтраза) улучшать коллоидальную устойчивость сусла в сравнении с контролем, было исследовано следующим образом.
Сусло было восстановлено из обычного 100% хорошо растворенного солода для немецкого светлого пильзенского пива настойным способом затирания согласно следующей схеме: затирание при 54°C в течение 30 мин, повышение температуры до 64°C (1°C/мин), оставить при 64°C на 60 мин, повышение температуры до 78°C (1°C/мин), оставить при 78°C на 10 минут и затем фильтровать (соотношение солода к воде при затирании 1:4). Во время промывания дробины добавлялась вода, что привело к соотношению солода к воде 1:8.
Сусло инкубировалось в течение 1 часа при 76°C согласно следующему протоколу:
1) Контроль
2) 8,0 мг EP (белка фермента) протеазы Последовательности №1 EP/л сусла
3) 8,0 мг EP протеазы Последовательности №2 EP/л сусла
4) 8,0 мг EP протеазы Последовательности №3 EP/л сусла
5) 8,0 мг EP Нейтраза/л сусла
После инкубации сусло варилось 30 мин с целью инактивации фермента.
Уровень мутности сусла, суммарный азот и свободный аминный азот (САА) анализировали следующим образом.
Уровень мутности сусла определялся путем смешивания 50 мл фильтрованного сусла (фильтровалось на стекловолоконном фильтре Sartorius Minisart-GF) с 150 мл воды в кювете, и начальный уровень мутности (мутностьначальная) измерялся с помощью мутномера (модель: HZ 013 компании Lg-automatic ApS, DK) при угле 90°. Затем тот же образец помещался на магнитную мешалку, и добавлялись 2×3,75 мл раствора Brewtan C (200 мг Brewtan C (галлотанин, Ajinomoto OmniChem, Belgium)/л воды). Раствор инкубировался 40 мин, и измерялось конечная мутность (мутностьконечная). Мутность сусла высчитывается с помощью нижеприведенной формулы:
Мутность сусла = мутностьконечная - мутностьначальная (Формула 1)
Суммарный азот (Кьельдаль) анализировали согласно изданию «Analytica» ЕПК. Свободный аминный азот (САА) определялся согласно методике MEBAK-II 2.9.4.11. Результат анализа изложен в таблице ниже.
|
Из вышепредставленных результатов очевидно следует, что протеазы Последовательностей №1, 2, 3 оказывают на мутность сусла положительное влияние, то есть, их применение приводит к уменьшению помутнения сусла, по сравнению с контролем (без ферментативной обработки). Протеаза Последовательности №3 демонстрирует максимальный эффект, следом идут протеазы Последовательностей №1 и 2 в этом порядке. Применение Нейтразы сказывается на помутнении сусла отрицательно.
Безотносительно связи с теорией, мы считаем, что отрицательный эффект препарата Нейтраза вызван отсутствием термостабильности.
Похоже, что количество САА (Свободный аминный азот) не сильно изменялось при обработке протеазой. Добавление протеазы Последовательности №3 приводило к наибольшему увеличению уровня САА.
Суммарный азот (N), измеренный по методу Кьельдаля (Таблица 2). Значимых различий между образцами, обработанными протеазой, и контрольным суслом не наблюдается.
ПРИМЕР 5: Роль протеаз Последовательностей №1, 2, 3 в определении коллоидальной устойчивости, установленная в системе пива.
Способны ли протеазы (Последовательностей 1, 2, 3) улучшать коллоидальную устойчивость пива в сравнении с контролем, было исследовано следующим образом.
Сусло было восстановлено из обычного 100% хорошо растворенного солода для немецкого светлого пильзенского пива отварочным способом затирания в промышленных масштабах согласно следующей схеме: затирание при 62°C в течение 20 мин, повышение температуры до 65°C (1°C/мин), оставить при 65°C на 15 мин, 20% затора варятся 20 мин и смешиваются с оставшимся затором, который держали при 65°C, что приводит к температуре затирания 72°C, которая поддерживается 30 мин, 20% затора варятся 20 мин и смешиваются с оставшимся затором, который держали при 72°C, что приводит к температуре 78°C, и начинается фильтрация. Во время промывания дробины добавлялась вода до соотношения солода к воде 1:5.
Сусло разводили до 12 градусов Плато и разделяли на 5 порций, и порции 1-5 инкубировались в течение 1 часа при 76°C согласно следующему:
1) Протеаза Последовательности №3 (1,6 мг EP/л)
2) Протеаза Последовательности №1 (3,8 мг EP/л)
3) Протеаза Последовательности №2 (2,6 мг EP/л)
4) Контроль (нет фермента)
5) Контроль (полностью стабилизированное пиво: 15 г/л ПВПП + 40 г/л силикагель)
По окончании ферментативной обработки сусло варили (инактивация фермента) в течение одного часа с хмелем (8% α-кислоты). 5 порций сусла проходили через одну и ту же процедуру пивоварения полупромышленного производства. В сусло вводили 15×106 клеток/мл дрожжей обычного низового брожения типа (W 34 70"). Ферментация проводилась при 12°C в течение 140 часов, и 5 порций пива фильтровали. Разлив пива по 0,5 литровым флаконам проводился вручную.
Суммарный азот сусла и суммарный САА сусла анализировали, как описано ранее. Результаты приведены ниже.
|
|
Из вышеприведенных результатов следует, что, похоже, ферментативная обработка не сказывалась на показателях свободного амино азота (САА) сусла и суммарного азота сусла.
Коллоидная стабильность образцов готового пива была определена в соответствии с методикой MEBAK 2.15.2.1 (0°C/40°C/0°C). Мутность измеряли в единицах ЕПК. Уделяя особое внимание коллоидальной устойчивости, срок годности пива может быть определен с помощью количества циклов нагревания, которым может быть подвергнуто пиво до достижения значений мутности, превышающих 2,0 единиц ЕПК. Один цикл нагревания приблизительно соответствует 25 дням срока годности.
Результаты приведены ниже.
|
Таблица 5 показывает, что образцы, обработанные Протеазами Последовательностей №1, 2, 3, в особенности после фильтрации при 76°C, имеют лучшую коллоидальную устойчивость, чем контроль и полностью стабилизированный контроль.
ПРИМЕР 6: Влияние Протеаз на качество сусла при добавлении на различных этапах технологического процесса с акцентом на белковый состав и мутность сусла.
Изучалось влияние протеаз на белковый состав и качество сусла при добавлении на этапе затирания солода, в конце затирания и после фильтрации.
1,5 кг хорошо растворенного солода перемалывались с помощью 2-вальцовой мельницы Heger MM40 (зазор 0,8 мм) и затирались с 6 литрами воды (качества, соответствующего стандартам пивоварения). Схема затирания была следующей: 30 минут при 52°C, 30 минут при 62°C, 30 минут при 72°C и 10 минут при 78°C. Отделение сусла проводилось в фильтрационном чане. После сбора первого сусла проводилось промывание дробины с двукратным использованием 3 литров воды для пивоварения с температурой 76°C. Сусло варилось 20 мин при атмосферных условиях. Было проведено 7 независимых экспериментов, и Протеаза последовательности №1 добавлялась согласно плану, представленному в таблице 6.
|
Образцы сусла отбирались после варки и анализировали, включая следующий анализ: суммарный азот (Кьельдаль), свободный аминоазот (САА), мутность (непрозрачность) после добавления Brewtan C. Также с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия анализировали белковый состав пивного сусла (описан ниже в примере 7). Все методики выполнялись согласно изданию «Analytica» ЕПК, за исключением добавления Brewtan C, которое проводилось согласно процедуре, описанной выше в примере 4. Результаты приведены ниже.
|
Вышеприведенные результаты демонстрируют, что любое контактирование протеазы с затором повышает суммарное содержание азота, и, таким образом, изменяет качество сусла и пива, тогда как контактирование протеазы с суслом не изменяет суммарное содержание азота в сусле.
Также был подсчитан Индекс высвобождения белка по Кьельдалю (PRIK).
Таким образом, PRIK - или Индекс высвобождения белка по Кьельдалю, - определяется как количество высвобожденного белка над контрольным уровнем без фермента, в процентах от контроля, то есть PRIK = ((количество белка в сусле, определенное методом Кьельдаля в образце с ферментом) - (количество белка в сусле, определенное методом Кьельдаля в контрольном образце без фермента))×100/(количество белка в сусле, определенное методом Кьельдаля в контрольном образце без фермента).
Следовательно, настоящее изобретение включает способ, в котором количество белка в сусле (PRIK), определенное согласно примеру 6, повышается менее чем на 10%, предпочтительно повышается менее чем на 9%, более предпочтительно, повышается менее чем на 8%, более предпочтительно, повышается менее чем на 7%, более предпочтительно, повышается менее чем на 6%, более предпочтительно, повышается менее чем на 5%, более предпочтительно, повышается менее чем на 4%, более предпочтительно, повышается менее чем на 3%, более предпочтительно, повышается менее чем на 2% и наиболее предпочтительно, повышается менее чем на 1%.
|
Как показывают измерения суммарного азота, контактирование затора с протеазой повышает уровень САА, но не до той же степени, что и уровень суммарного азота. Это указывает на то, что белки становятся растворимыми при добавлении протеазы в затор, но только частично гидролизованными до пептидов или аминокислот.
|
Где GATA (Тест на мутность с галлиевой кислотой) представляет собой снижение мутности относительно контроля без белка как % от контроля, то есть GATA = [((мутность контроля без белка)-(мутность образца))/(мутность контроля без белка)]×100.
Результаты измерения помутнения показывают, что добавление протеазы в сусло удаляет белки, чувствительные к помутнению, тогда как любое контактирование протеазы с затором повышает общее количество азота и, как следствие, повышает потенциальную возможность помутнения.
ПРИМЕР 7: Анализ белков сусла после обработки протеазами с помощью метода на основе ПАГ-ДСН анализа сусла, то есть электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ПАГ-ДСН).
Сусло, полученное после обработки протеазами, как указано выше в примере 6, анализировали с применением ПАГ-ДСН с целью обнаружения каких-либо количественных или качественных изменений в белковом профиле.
Образцы были подготовлены для ПАГ-ДСН добавлением 30 мкл 4X буфера для внесения белка, содержащего дитиотреитол (DTT) (Fermentas, #R0891), к 90 мкл образца с получением 1X буфера для внесения белка (0,0626 M Tris-HCl, pH 6,8, 2% ДСН, 0,01% бромфенолового синего, 10% глицерола и 0,1 M DTT) с последующим прогреванием при 85°C в течение 3 мин 10 мкл образцов вносились в 4-20% не требующий окрашивания гель (Criterion Stain Free gel (Biorad)) с использованием Трис/глицин/ДСН буфера для проведения электрофореза (24 мм Трис, 0,2 M глицин и 0,1% ДСН). Использовался неокрашенный белковый маркер PageRuler™ (Fermentas, #SM0661). Электрофорез проводился 15 мин при 100 В и затем при 180 В в течение приблизительно 1 часа, пока фронт не достигал низа геля. Белки визуализировались с использованием устройства для формирования изображения Criterion Stain Free (Biorad, California, USA).
Количество белка в различных полосах образца в ПАГ-ДСН было подсчитано с помощью лабораторного программного обеспечения для системы Criterion Stain Free (Biorad).
6 белковых полос, одна за другой, были идентифицированы для каждого образца с использованием образца сваренного сусла в качестве эталона.
Белковая полоса 1 является дискретной полосой, расположенной в размерном ряду на позиции 40 кДа +/-2 кДа. Белковые полосы 2, 3 и 4 являются дискретными полосами, расположенными между 15 и 10 кДа, где полоса 2 имеет самый большой размер (на 15 кДа +/-2 кДа), полоса 4 самая маленькая (сразу над 10 кДа), и полоса 3 является дискретной полосой между полосами 2 и 4. Белковые полосы 5 и 6 - следующие дискретные полосы с меньшим МВ (молекулярным весом), находятся на 10 кДа и ниже, из них полоса 5 имеет самый большой размер (приблизительно 10 кДа) и полоса 6 самая маленькая (<10 кДа). Площадь белковой полосы была отмечена рамкой, так что она охватывает всю полосу. В некоторых случаях полосы были настолько сильно выражены, что они перекрывались между собой, и в этом случае полосы были разделены согласно размерам, видимым в дорожке с эталонным образцом сваренного сусла.
Интенсивность полос рассчитывалась с помощью лабораторного программного обеспечения для обработки визуальной информации. Для каждого образца интенсивность индивидуальных полос сравнивалась с интенсивностью такой же полосы в эталонном образце (сваренное сусло) (Таблица 10). Кроме того, количество (%) белка в полосе 2 подсчитывалось путем деления интенсивности полосы на сумму интенсивностей полос от 1 до 6 (Таблица 11).
|
|
Добавление Протеазы Последовательности №1 в низкой и высокой концентрациях на различных этапах процесса пивоварения изменяло белковый профиль. Исходя из сравнения интенсивностей индивидуальных белковых полос в образцах, обработанных Протеазой Последовательности №1, со сваренным суслом без фермента, обработка сусла или затора протеазой значительно уменьшает количество белка в полосе 2 (14,0-51,7% интенсивности полосы в сваренном сусле). Однако, если протеаза добавлялась к затору, количество белка в полосах 4-6 значительно повышалось, до 307,2% по сравнению с полосами в сваренном сусле (100%). При этом добавление протеазы в сусло приводило к снижению суммарного количества белка (92,2% суммарного белка в сваренном сусле), тогда как добавление протеазы в затор приводило к увеличению суммарного количества белка (123,7-215,1% суммарного белка в сваренном сусле).
Если сравнивать процентное количество белка в полосе 2 с суммарным количеством белка (полосы с 1 по 6) в каждом образце, то обработка затора и сусла протеазой приводит к значительному уменьшению количества белка в полосе 2 (2,0-6,5% суммарного белка), в сравнении с необработанными сладким суслом и сваренным суслом (15,5- 15,7% суммарного белка) (Таблица 11). Три другие протеазы из примера 4, протеазы Последовательностей №2, 3 и Нейтраза, тестировались на эффективность расщепления белка в сладком сусле. Результаты приведены ниже:
|
Итак, настоящее изобретение также включает способ, в котором CPRA менее 80% и CLRA ниже 200%, предпочтительно, где CPRA ниже 70% и CLRA ниже 200%, более предпочтительно, где CPRA ниже 60% и CLRA ниже 200%, и наиболее предпочтительно, где CPRA ниже 50% и CLRA ниже 200%.
|
Обе Протеазы Последовательностей №3 и №2 расщепляли белок из полосы 2 до содержания 13,8-48,8% соответствующей полосы в сваренном сусле (Таблица 11). От всего суммарного количества белка, на долю полосы 2 приходится только 1,9-6,3% при применении Протеаз Последовательностей №1, 2 и 3, по сравнению с 14,7% в сваренном сусле (Таблица 13). Фермент Нейтраза не оказывал значимого влияния на относительное количество белка в полосе 2 (Таблицы 12 и 13), что, возможно, является следствием меньшей термостабильности (T-опт. (pH)=50 (pH 9)).