Результат интеллектуальной деятельности: Способ лечения желудочковых нарушений ритма сердца (варианты)
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к лечению нарушений сердечного ритма, предпочтительно желудочковых аритмий, в условиях кардиохирургического стационара для снижения социально значимых потерь от внезапной сердечной смерти (ВСС).
Актуальность и социальная значимость ВСС неоспорима и подтверждена всеми ведущими медицинскими научными, практическими международными сообществами и союзами (Всероссийское научное общество кардиологов, Европейское общество кардиологов, Американский колледж кардиологии, Ассоциация Нарушений Ритма Сердца, Всемирная Организация Здравоохранения). По расчетным данным в РФ внезапно от сердечных причин ежегодно умирает 200000-250000 человек (Центральная база статистических данных Федеральной службы государственной статистики, 2010 год).
Согласно полученным при проведении суточном мониторировании ЭКГ у пациентов, умерших внезапно, установлено, что в подавляющем большинстве случаев (85%) механизмами развития ВСС являются желудочковые тахиаритмии - желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) с последующим развитием асистолии (Национальные Рекомендации по определению риска и профилактике внезапной сердечной смерти, Всероссийское научное общество кардиологов, 2012 год). Среди заболеваний сердца основной причиной ВСС является ИБС, на долю которой приходится до 80% всех случаев (Zipes DP, Wellens HJJ. Sudden cardiac death. Circulation 1998; 98:2334-2351).
Основным принципом лечения и профилактики развития жизнеугрожающих аритмий является выключение из проведения зон замедленного проведения электрического импульса. Данные зоны представляют собой физиологически и/или патологические измененные очаги миокарда в виде «слоенного пирога», причиной появления которых являются острые сердечные катастрофы (инфаркт миокарда), хронические заболевания (кардиомиопатии) либо врожденные аномалии развития сердца. Миокард в этих зонах представляется собой чередующие участки неповрежденного миокарда и фиброзной ткани, а «выключение» этих участков никак не влияет на сократительную способность сердца, в то время как проведение электрического импульса возбуждения становится однонаправленным и гомогенным (Catheter Ablation of Scar-based Ventricular Tachycardia: Relationship of Procedure Duration to Outcomes and Hospital Mortality / Yu R et al, Heart Rhythm. 2014 Oct. 3. pii: S1547-5271(14)01131-Х).
Единственным на сегодняшний день радикальным методом лечения желудочковой тахикардии, а также методом профилактики фибрилляции желудочков является метод радиочастотной катетерной аблации (EHRA/HRS/APHRS expert consensus on ventricular arrhythmias / Europace (2014) 16, 1257-1283 doi:10.1093/europace/euul94). При аблации происходит коагуляция промежуточного миокарда с дальнейшим превращением его в рубцовую ткань, не способную к электрическому проведению импульса.
Но метод катетерной аблации обладает следующими недостатками:
1. Низкая проникающая способность радиочастотного электрического тока аблационного катетера (не более 7 мм);
2. Высокая морфологическая гетерогенность тканей после аблации, что является причиной крайне низкой терапевтической эффективности лечения ФЖ и ЖТ в отдаленном периоде наблюдения;
3. Техническая сложность процедуры заключается в неоднородности эндокардиальной и эпикардиальной поверхности сердца (трабекулярность, папиллярные мышцы, хорды, синусы сердца), при таких условиях практически невозможно выполнить непрерывные аблационные линии, ограничивающие целевую зону по периметру и на всю глубину миокарда;
4. Высокий процент послеоперационных осложнений, который связан с длительностью процедуры, часто превышающей 4-5 часов, с развитием перфораций сердца, воспалительным синдромом за счет объема пораженной поверхности, с частыми летальными случаями;
5. Высокая стоимость комплексного оперативного лечения (с учетом имплантации кардиовертер-дефибриллятора может превышать 1 млн рублей на человека)
С другой стороны, эффекта блокирования проведения электрического сигнала в миокарде можно добиться другим способом, с помощью инъекции ботулинического нейротоксина. Нейротоксины получают из штаммов бактерии Clostridium botulinum. Существуют несколько серотипов ботулинических нейротоксинов, но в клинической практике наиболее широко используется ботулинический нейротоксин типа А (БНТА). Известен механизм биологического действия БНТА, который заключается в блокаде белка SNAP-25 в пресинаптической мембране, что приводит к невозможности присоединения внутриклеточных везикул, нагруженных ацетилхолином, к клеточной стенке. В результате чего прекращается проведение сигнала между клетками через синапс вследствие отсутствия нейромедиатора. На уровне сердца действие БНТА проявляется локальным блокированием возбуждения миокарда в зоне инъекции, которое, однако, не имеет генерализованного действия и не затрагивает основные водители ритма и проводящие нервные пучки.
Известен фармацевтический состав (RU 2535115), содержащий нейротоксин ботулина, активный агент и физиологически приемлемый наполнитель, отличающийся тем, что в качестве нейротоксина ботулина состав содержит ботулотоксин типа А, в качестве активного агента - мукополисахарид хитозоль, взятые в соотношении 1:(103-109), предпочтительно 1:(106-108) по массе соответственно. Недостатком данной композиции является отсутствие подтвержденного антиаритмического действия при нарушении ритма сокращений желудочков сердца.
Задачей изобретения является разработка способа лечения желудочковых нарушений ритма сердца с помощью фармацевтического состава (далее BTS), содержащего ботулинический нейротоксин типа А, путем инъекции в зоны, являющиеся очагом эктопического возбуждения миокарда желудочков.
Технический результат - разработан метод профилактики и лечения желудочковой тахикардии (ЖТ) и фибрилляции желудочков (ФЖ) для пациентов, которым противопоказана радиочастотная аблация миокарда, при этом инфильтрация миокарда желудочка, содержащего очаг эктопического возбуждения, приводит к максимально равномерной денервации ткани.
Задача решается двумя способами проведения операции: 1) под контролем зрения с выполнением срединной стернотомии (при «открытой» операции) - лечение путем превентивного введения BTS в стенку желудочка, а именно в целевые зоны, являющиеся очагом эктопического возбуждения миокарда желудочков; 2) способом миниинвазивного интрамиокардиального введения BTS, в стенку желудочка, а именно в целевые зоны, являющиеся очагом эктопического возбуждения миокарда желудочков.
Вариант 1 включает контроль электрокардиографии, инвазивный контроль артериального давления, контроль насыщения периферической крови кислородом, инфузионную поддержку кровообращения, выполнение срединной стернотомии, накладывание ранорасширителя, выполнение перикардотомии. Затем в область левого желудочка, питаемого нисходящей ветвью левой коронарной артерии, выполняют инъекции фармацевтическим составом, содержащим ботулинический нейротоксин типа А. Каждую инъекцию производят в целевые зоны в объеме 0,2-0,4 мл, при этом суммарная доза ботулинического нейротоксина типа А составляет 0,5-0,9 Ед/кг веса.
Вариант 2 включает контроль электрокардиографии, инвазивный контроль артериального давления, контроль насыщения периферической крови кислородом, выделение бедренной артерии, установку интродьюсера, введение инъекционного катетера под контролем рентгеноскопии, выполнение электроанатомического картирования левого желудочка. Затем в предварительно определенные целевые зоны левого желудочка производят инъекции фармацевтическим составом, содержащим ботулинический нейротоксин типа А. После удаляют инъекционный катетер и интродьюсер с одновременным затягиванием кисетного шва на бедренной артерии. Каждую инъекцию производят в целевые зоны в объеме 0,2-0,4 мл, при этом суммарная доза ботулинического нейротоксина типа А составляет 0,5-0,9 Ед/кг веса.
Для точной локализации областей эктопии используется метод электроанатомического картирования с помощью системы Noga ХР Cardiac Navigation System (Biosense Webster, Inc., США). Инъекция препарата, содержащего БНТА, производится двумя способами: под контролем зрения непосредственно в миокард желудочка, для чего выполняется открытая операция, или миниинвазивной техникой с помощью специализированного эндоваскулярного катетера для эндомиокардиальной инъекции Myostar Injection Catheter (Biosense Webster, Inc., США).
Специализированные эндоваскулярные катетеры для эндомиокардиальной инъекции, а также система цифровой электромагнитной навигации сердца давно и активно представлена на международном и российском рынке медицинских услуг, использование официально разрешено на территории РФ, США, стран Евросоюза, Китая, Индии, стран СНГ. Данные навигационные системы и катетеры используются рутинно в клинической практике для введения непосредственно в сердечную мышцу аутологичных стволовых клеток, их производных, антибиотиков, препаратов генной трансдукции, активации факторов роста (Efficiency of intramyocardial injections of autologous bone marrow mononuclear cells in patients with ischemic heart failure: a randomized study / Pokushalov E, Romanov A et al. / J Cardiovasc Transl Res. 2010 Apr; 3(2):160-8).
Представленные изображения иллюстрируют:
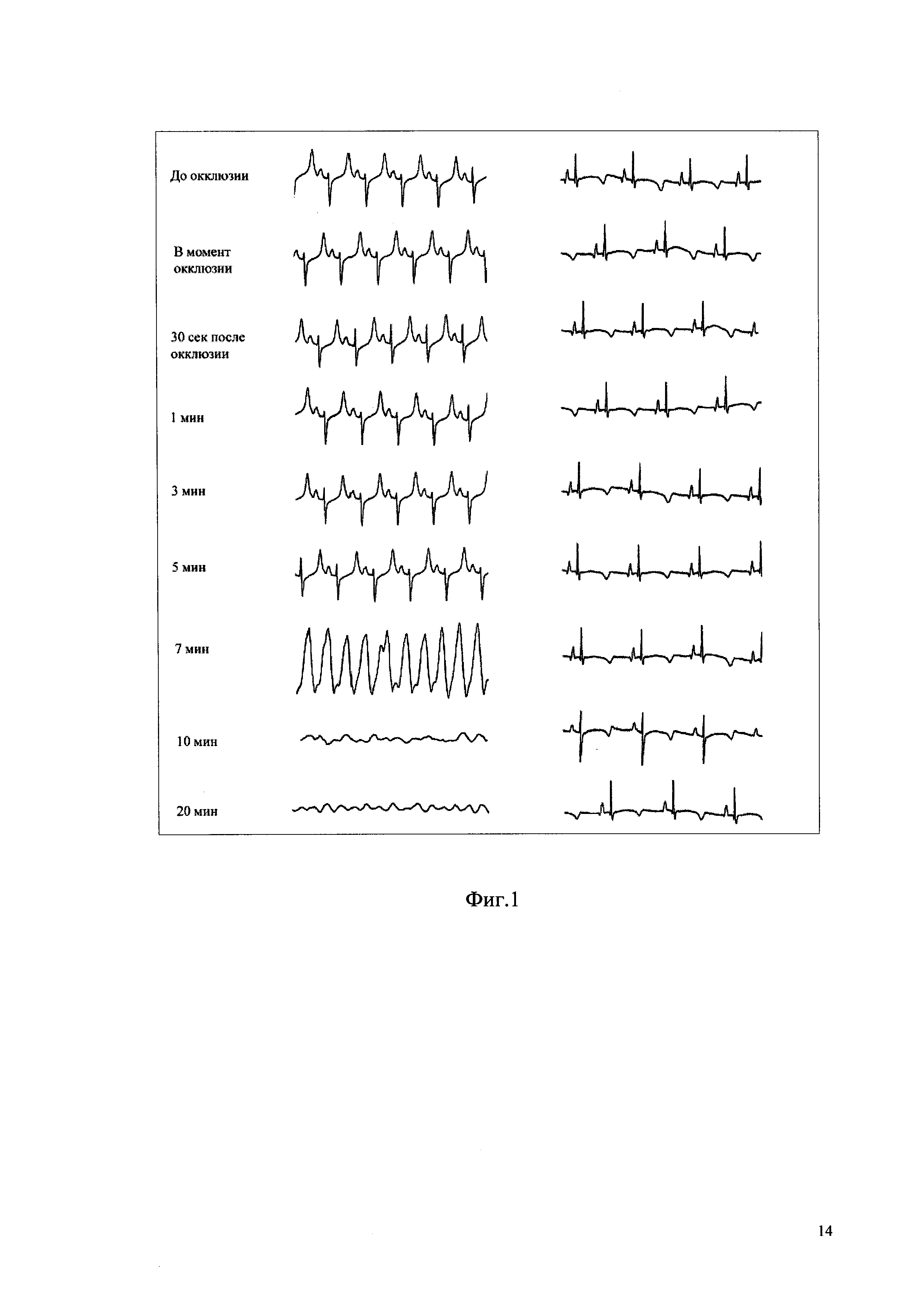
Фиг. 1 - Динамика ЭКГ после перевязки нисходящей ветви левой коронарной артерии у экспериментальных животных контрольной (слева) и опытной (справа) групп.
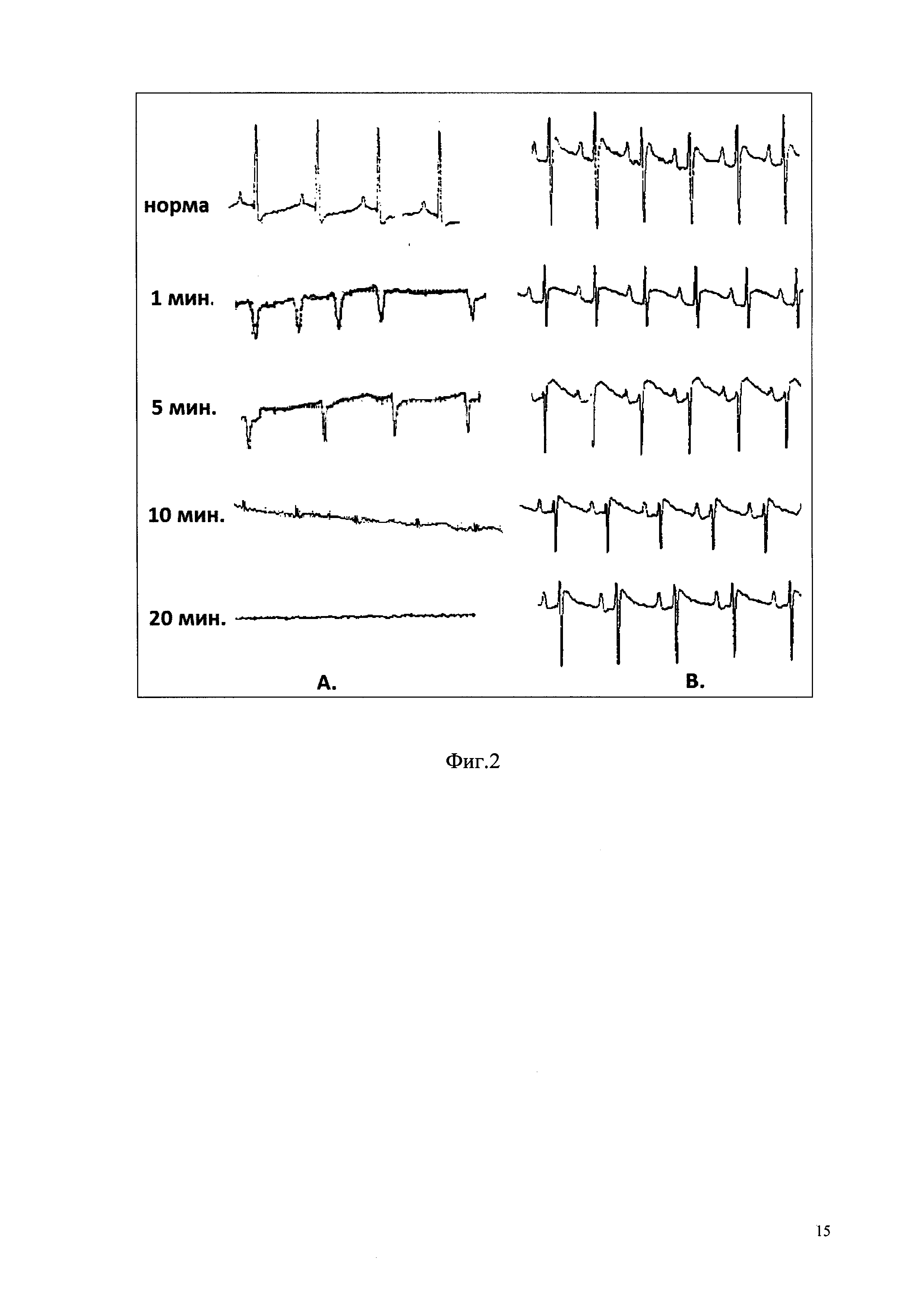
Фиг. 2 - Влияние BTS на фибрилляцию желудочков сердца, вызванную внутривенным введением адреналина: А - фибрилляция желудочков, вызванная адреналином (в/в, 100 мкг/кг); В - влияние адреналина на сердечную деятельность после превентивной инъекции BTS.
Изобретение подтверждается следующими примерами.
Пример 1. Способ моделирования ФЖ и его лечения путем превентивного введения BTS в стенку желудочка у животных при «открытой» операции.
Экспериментальная работа осуществлялась согласно этическим нормам, регламентирующим эксперименты на животных в соответствии с международными и российскими нормативно-правовыми документами («Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях: EST №123» от 18 марта 1986 г. Страсбург, 1986; «Об утверждении правил лабораторной практики: приказ Министерства здравоохранения Российской Федерации» №267 от 19 июня 2003 г.).
Подготовку к операции производили следующим способом. Утром в день операции ветеринарный врач выполнял премедикацию комбинацией препаратов атропин, золетил-100 и кетамин. Дозировку в каждом конкретном случае выбирали исходя из веса животного. После наступления сна животное тщательно мыли, выбривали щетину на ушах, грудной клетке, на внутренней поверхности бедра и на хвосте, взвешивали. Переносили на операционный стол и закрепляли в положении «на спине». В краевую вену уха устанавливали периферический катетер для инъекций подходящего размера, к грудной клетке прикрепляли датчики для электрокардиографии. Плетизмографический датчик для контроля насыщения периферической крови кислородом крепили на хвост. Для контроля артериального давления в левую бедренную артерию пункционным способом устанавливали артериальный катетер, через который присоединяли систему инвазивного контроля давления. Все критически важные витальные параметры - пульс, артериальное давление, температуру в глотке, ЭКГ, насыщение крови кислородом - фиксировали в режиме «реального времени» системой мониторинга IntelliVue МР40 (Phillips, Германия). Динамику данных вносили в наркозную карту экспериментального животного с периодичностью 15 минут. После этого внутривенно вводили миорелаксант (адруан, 4 мг) и выполняли интубацию трахеи трубкой диаметром 7-8 мм. Раздували обтурирующую манжету, подсоединяли аппарат искусственной вентиляции легких Julian Plus (Draeger, Германия), начинали принудительную вентиляцию чистым кислородом, содержащим 3% севофлюрана (по объему) с частотой 12-14 циклов в минуту. Дыхательный объем подбирали индивидуально в зависимости от веса животного. Через установленный ранее периферический катетер проводили инфузионную поддержку кровообращения кристаллоидными (раствор Рингера, изотонический раствор) и/или коллоидными (гелафузин, полиглюкин) растворами. Объем инфузии определялся врачом-ветеринаром согласно весоростовым показателям и данным объективного мониторинга витальных функций экспериментального животного. При необходимости для контроля диуреза устанавливали мягкий мочевой катетер.
Исследование проводили на 2 группах мини-свиней «Минисибс» (ИЦиГ СО РАН) по 3 особи в каждой. В опытной группе выполняли инъекцию BTS в области левого желудочка, питаемые нисходящей ветвью левой коронарной артерии (НВЛКА). Производили 5-7 инъекций по 0,2-0,4 мл каждая, таким образом, чтобы достичь суммарной дозы 0,9 Ед БНТА/кг веса животного (данная доза является предпочтительной). Объем инъекции 0,2-0,4 мл не влияет на функциональные свойства миокарда в области инъекции, объем определен экспериментально. Затем через 60 минут выполняли перевязку данной ветви на расстоянии 0,1-0,2 см после ее выхода из-за ушка левого предсердия. В контрольной группе выполняли перевязку НВЛКА без введения препарата.
Хирургический доступ и оперативный прием следующие. Выполняли срединную стернотомию, накладывали ранорасширитель для разведения краев стернотомной раны, производили перикардотомию, листки перикарда разводили на держалках. Производили 5-7 инъекций препарата по 0,2-0,4 мл каждая. Затем удаляли ранорасширитель, стернотомную рану прикрывали стерильной салфеткой и производили хирургическую паузу на 60 минут для достижения терапевтического действия препарата. В ходе всей операции производили мониторирование ЭКГ. Если после введения BTS появлялись ЭКГ-признаки острого инфаркта миокарда, животное исключали из дальнейшего исследования.
Для моделирования ФЖ под нисходящую ветвь левой коронарной артерии на расстоянии 0,1-0,2 см после ее выхода из-за ушка левого предсердия, где располагается бифуркация, проводили лигатуру из плетеной синтетической нити диаметром 2/0 и завязывали узел, но не затягивая его. Далее в течение 60 с регистрировали ЭКГ, после чего осуществляли одномоментную перевязку коронарной артерии путем затягивания узла на лигатуре. Желудочковая экстрасистолия у экспериментальных животных контрольной группы развивалась в первые 1-7 минут наблюдения. ЭКГ регистрировали в момент перевязки артерии, далее через 30 с, 1, 3, 5, 10 и 20 мин. Животных, у которых не возникало нарушений ритма, в эксперимент не включали.
В результате показано, что одномоментная перевязка нисходящей ветви левой коронарной артерии у мини-свиней контрольной группы приводила к развитию нарушений сердечного ритма желудочков по типу политопной желудочковой экстрасистолии, ЖТ с переходом в ФЖ и летальным исходом. Превентивная инъекция препарата BTS в дозировке 0,9 Ед/кг за 60 минут до перевязки НВЛКА предотвращала развитие желудочковых нарушений сердечного ритма (фиг. 1). Летальных исходов среди экспериментальных животных отмечено не было.
Пример 2. Способ моделирования ФЖ и его лечения путем превентивного интрамиокардиального введения фармацевтического состава, содержащего ботулинический нейротоксин типа А, в стенку желудочка у животных
Исследование проводили на 2 группах мини-свиней «Минисибс» (ИЦиГ СО РАН) по 3 особи в каждой. В опытной группе производили 5-7 инъекций BTS по 0,2-0,4 мл каждая таким образом, чтобы достичь суммарной дозы 0,9 Ед БНТА/кг веса животного (данная доза является предпочтительной). Объем инъекции 0,2-0,4 мл не влияет на функциональные свойства миокарда в области инъекции, объем определен экспериментально. Инъекции выполняли за 60 минут до моделирования желудочковых нарушений ритма. В контрольной группе использовали интактных животных. Модель ФЖ производили внутривенным введением раствора адреналина гидрохлорида в дозе 100 мг/кг
Анестезиологическое обеспечение использовали аналогично указанному в примере 1. Животных опытной группы готовили следующим образом. Для выполнения миниинвазивной интрамиокардиальной инъекции кожу операционного поля в проекции правой бедренной артерии трижды обрабатывали раствором бетадина, накрывали стерильной простыней с окном для доступа к коже. Затем выполняли кожный разрез, ткани разделяли ножницами тупым способом, визуализировали бедренную артерию. При необходимости использовали электронож-коагулятор Force-EZ (ValleyLab, США) или аналогичный. Артерию выделяли из окружающих тканей на протяжении 2-5 см. В зоне установки интродьсера монофиламентной нерассасывающейся полипропиленовой нитью Prolen диаметром 5/0 с атравматической иглой (или аналогом) накладывали кисетный шов, но не затягивали его. После этого артерию внутри области наложения кисетного шва пунктировали иглой, заводили проволочный проводник и устанавливали интродьюсер размером 8Fr. Проводник убирали. В интродьюсер вводили инъекционный катетер Myostar с помощью С-дуги ОЕС9800 (GE Helthcare, США) под контролем рентгеноскопии продвигали катетер до левого желудочка, периодически выполняя контрольную артериографию введением 5-20 мл рентген-контрастного препарата Визипак-320 (или аналога), чтобы удостовериться в правильности положения катетера. Производили электроанатомическое картирование левого желудочка с помощью системы NogaXP, затем выдвигали инъекционную иглу и вводили 0,2-0,4 мл препарата BTS, в предполагаемую электроанатомическую проекцию зоны аритмии.
На заключительном этапе экспериментальной операции удаляли инъекционный катетер и интродьюсер с одновременным затягиванием кисетного шва на бедренной артерии. Контролировали отсутствие кровотечения, при необходимости выполняли хирургический гемостаз. Рану послойно ушивали нерассасывающейся полипропиленовой нитью Prolen (или аналог) диаметром 2/0.
В результате показано, что внутривенное введение адреналина у животных контрольной группы вызывало политопную желудочковую экстрасистолию, переходящую в фибрилляцию желудочков с летальным исходом в течение 5-10 минут. Превентивная инъекция препарата BTS в дозировке 0,9 Ед/кг за 60 минут до введения адреналина предотвращала развитие желудочковых нарушений сердечного ритма (фиг. 2).