Результат интеллектуальной деятельности: Производное пиридоксина для лечения эпилепсии
Вид РИД
Изобретение
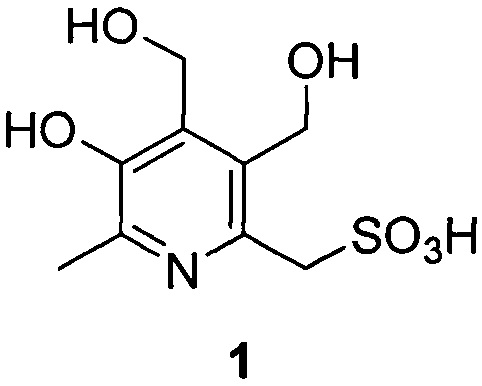
Изобретение относится к физиологически активным веществам - производным пиридоксина, а именно, соединению формулы 1, обладающего противоэпилептической активностью.
Эпилепсия - одно из наиболее распространенных в мире хронических заболеваний нервной системы, которым страдают как дети, так и взрослые. По данным ВОЗ, эпилепсией страдают около 50 млн человек, что составляет порядка 0,5-1% населения планеты. Ежегодно в мире диагностируется примерно 2,5 млн новых случаев. 30% больных эпилепсией являются фармакорезистентными.
Из исследованного уровня техники заявителем не выявлены технические решения - аналоги заявленного технического решения по химической структуре.
Из исследованного уровня техники заявителем выявлены известные технические решения - аналоги заявленного технического решения по назначению, а именно - противоэпилептические препараты.
В соответствии с современной международной практикой все имеющиеся в настоящее время противоэпилептические препараты (ПЭП) подразделяют на:
- старые (фенобарбитал и дифенин);
- промежуточные (сукцинимиды и бензодиазепины);
- базовые (вальпроаты и карбамазепин);
- новые (ламотриджин, топирамат, окскарбазепин, леветирацетам, тиагабин, габапентин, фелбамат, прегабалин, зонисамид).
Из перечисленных выше препаратов препараты вальпроевой кислоты (вальпроаты) и препараты группы карбамазепина в настоящее время применяют наиболее часто и считают препаратами «первого выбора» (базовые препараты).
Известен препарат Депакин (Sanofi-Aventis, Франция). Активное вещество: вальпроевая кислота. Показания к применению: генерализованные эпилептические приступы - клонические, тонические, тонико-клонические, абсансы, миоклонические, атонические; синдром Леннокса-Гасто; парциальные эпилептические приступы с вторичной генерализацией или без нее (в монотерапии или в комбинации с другими противоэпилептическими средствами). Допускается применение в педиатрии.
Недостатком известного препарата являются следующие побочные эффекты: сонливость, расстройства желудочно-кишечного тракта, гепатотоксичность, панкреотоксичность, тошнота, набор веса [Stevens G.M. Pharmacology / G.М. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (вальпроат натрия) при пероральном введении LD50: 977 мг/кг, при внутрибрюшинном введении LD50: 470 мг/кг (http://datasheets.scbt.com/sc-202378.pdf).
Известен препарат Финлепсин (AWD.pharma, Германия). Активное вещество: карбамазепин. Показания к применению: эпилепсия - парциальные припадки с элементарной симптоматикой (фокальные припадки), парциальные припадки со сложной симптоматикой, психомоторные припадки, большие судорожные припадки в основном фокального генеза (большие судорожные припадки во время сна, диффузные большие судорожные припадки), смешанные формы эпилепсии; невралгия тройничного нерва; идиопатическая невралгия языкоглоточного нерва; боли при диабетической полиневропатии; эпилептиформные судороги при рассеянном склерозе, спазмы лицевых мышц при невралгии тройничного нерва, тонические судороги, пароксизмальная дизартрия и атаксия, пароксизмальные парестезии и приступы боли; синдром алкогольной абстиненции (тревога, судороги, гипервозбудимость, нарушения сна); психотические расстройства (аффективные и шизоаффективные расстройства, психозы, нарушения функции лимбической системы). Допускается применение в педиатрии.
Недостатком известного препарата являются следующие побочные эффекты: сонливость, заторможенность и прочие признаки угнетения центральной нервной системы, атаксия, тошнота, редко - апластическая анемия [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (карбамазепин) при пероральном введении LD50: 529 мг/кг, при внутрибрюшинном введении LD50: 114 mg/kg (http://datasheets.scbt.com/sc-202518.pdf).
Известен препарат Фенобарбитал (ОАО Дальхимфарм, Россия). Активное вещество: фенобарбитал. Показания к применению: эпилепсия - генерализованные тонико-клонические припадки, фокальные приступы у взрослых и детей; хорея; спастические параличи; различные судорожные реакции; в качестве успокаивающего в малых дозах в сочетании с другими препаратами (спазмолитики, сосудорасширяющие средства) при нейровегетативных расстройствах; как снотворное средство. Допускается применение в педиатрии.
Недостатком известного препарата являются следующие побочные эффекты: атаксия, снижение умственных способностей, сонливость, головокружение, развитие зависимости, сыпь, угнетение дыхания [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на крысах (фенобарбитал) при пероральном введении LD50: 163 мг/кг (http://www.sciencelab.com/msds.php?msdsId=9926461).
Известен препарат Дифенин (Усолье-Сибирский ХФЗ, Россия). Активное вещество: фенитоин. Показания к применению: эпилепсия (большие судорожные припадки); эпилептический статус с тонико-клоническими припадками; эпилептические припадки в нейрохирургии (профилактика и лечение); желудочковые аритмии (в т.ч. при гликозидной интоксикации или связанные с интоксикацией трициклическими антидепрессантами); невралгия тройничного нерва (в качестве средства второго ряда или в комбинации с карбамазепином). Допускается применение в педиатрии.
Недостатком известного препарата являются следующие побочные эффекты: нарушения пищеварения, гиперплазия десен, мегалобластная анемия и прочие проявления недостаточности красных кровяных телец, остеомаляция, психиатрические проявления [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (фенитоин натрия) при пероральном введении LD50: 165 мг/кг (http://www.pfizer.com/system/files/products/material_safety_data/PHENYTOIN%20SODIUM%20SOLN.pdf).
Известен препарат Суксилеп (Delpharm Lille S.a.S., Франция). Активное вещество: этосуксимид. Показания к применению: приступы пикнолептических абсансов; сложные и атипичные судорожные припадки; миоклонико-астатические малые припадки; юношеские миоклонические припадки (импульсивные малые припадки). Не рекомендуется к применению для детей до 6 лет.
Недостатком известного препарата являются следующие побочные эффекты: сонливость, головокружение, нарушения пищеварения, вялость и тошнота [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (этосуксимид) при пероральном введении LD50: 1530 мг/кг (http://www.pfizer.com/files/products/material_safety_data/ETHOSUXIMIDE%20CAPSULES.pdf).
Известен препарат Ламитор (Torrent Pharmaceuticals, Индия). Активное вещество: ламотриджин. Показания к применению: эпилепсия - парциальные и генерализованные припадки, включая тонико-клонические судороги, а также припадки при синдроме Леннокса-Гасто в составе комбинированной терапии или монотерапии. Допускается применение в педиатрии.
Недостатком известного препарата являются следующие побочные эффекты: атаксия, диплопия, головокружение, сонливость, головная боль, тошнота, сыпь, синдром Стивенса-Джонсона [Stevens G.M. Pharmacology / G.М. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (ламотриджин) при пероральном введении LD50: 269 мг/кг (http://www.msds-gsk.com/GetSdsFile.ashx?fileId=5508).
Известен препарат Топирамат (АЛСИ Фарма, Россия). Активное вещество: топирамат. Показания к применению: монотерапия у взрослых и детей с 6 лет с парциальными (с вторичной генерализацией или без) или первично генерализованными тонико-клоническими судорогами; комплексная терапия у взрослых и детей старше 3 лет с парциальными с вторичной генерализацией или без или генерализованными тонико-клоническими судорогами, а также для лечения судорог, обусловленных синдромом Леннокса-Гасто; профилактика приступов мигрени у взрослых.
Недостатком известного препарата являются следующие побочные эффекты: атаксия, головокружение, сонливость, нистагм, парестезия, психомоторные нарушения [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на крысах (топирамат) при пероральном введении LD50: 3570 мг/кг (https://fagron.com/sites/default/files/document/msds_coa/97240-79-4_(USA).pdf).
Известен препарат Леветинол (Actavis hf., Исландия). Активное вещество: леветирацетам. Показания к применению: парциальные судороги с вторичной генерализацией или без нее у пациентов с 16 лет с впервые диагностированной эпилепсией; миоклонические судороги у пациентов с ювенильной миоклонической эпилепсией с 12 лет; первично генерализованные тонико-клонические судороги у пациентов с идиопатической генерализованной эпилепсией с 12 лет.
Недостатком известного препарата являются следующие побочные эффекты: сонливость, слабость и головокружение [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (леветирацетам) при пероральном введении LD50: >5000 мг/кг (http://www.akorn.com/documents/catalog/msds/50383-241-16.pdf) при внутривенном введении LD50: 1081 мг/кг (https://www.caymanchem.com/msdss/9001820m.pdf).
Известен препарат Тебантин (Gedeon Richter, Венгрия). Активное вещество: габапентин. Показания к применению: парциальные судороги с вторичной генерализацией или без нее у взрослых и детей старше 12 лет в качестве монотерапии или дополнительной терапии; парциальные судороги с вторичной генерализацией или без нее у детей от 3 до 12 лет в качестве дополнительной терапии; нейропатические боли у больных старше 18 лет.
Недостатком известного препарата являются следующие побочные эффекты: атаксия, сонливость, головокружение, нистагм и дрожание конечностей [Stevens G.M. Pharmacology / G.М. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (габапентин) при пероральном введении LD50: >5000 мг/кг; при внутривенном введении LD50: 1000-2000 мг/кг (http://www.pfizer.com/system/files/products/material_safety_data/PZ01158.pdf).
Известен препарат Лирика (Pfizer Manufacturing Deutschland, Германия). Активное вещество: прегабалин. Показания к применению: нейропатическая боль у взрослых; эпилепсия (в качестве дополнительной терапии у взрослых с парциальными судорожными приступами, сопровождающимися или не сопровождающимися вторичной генерализацией); генерализованное тревожное расстройство у взрослых; фибромиалгия у взрослых. Не применяется в педиатрии.
Недостатком известного препарата являются следующие побочные эффекты: сонливость, нарушения зрения, набор веса, нарушение координации движений [Stevens G.M. Pharmacology / G.M. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на крысах (габапентин) при пероральном введении LD50: >5000 мг/кг; при внутривенном введении LD50: >300 мг/кг (http://www.pfizer.com/system/files/products/material_safety_data/PZ01158.pdf).
Известен препарат Зонегран (Eisai Co. Ltd., Япония). Активное вещество: зонисамид.. Показания к применению: монотерапия у пациентов с парциальными эпилептическими приступами с вторичной генерализацией или без, с впервые диагностированной эпилепсией; в составе дополнительной терапии у взрослых, подростков и детей с 6 лет с парциальными эпилептическими приступами с вторичной генерализацией или без.
Недостатком известного препарата являются следующие побочные эффекты: головная боль, головокружение, сонливость, анорексия, тошнота, в раннем возрасте - метаболический ацидоз [Stevens G.M. Pharmacology / G.М. Stevens, С.W. Brenner - Philadelphia: Elsevier/Saunders, 2013. - 519 c. (https://books.google.ru/books?id=Cd39SN6OBiMC&pg=PA204&redir_esc=y#v=onepage&q&f=false)]. Острая токсичность на мышах (зонисамид) при пероральном введении LD50: 1829 мг/кг, при внутрибрюшинном введении LD50: 699 mg/kg (http://datasheets.scbt.com/sc-203316.pdf).
Таким образом, общими недостатками известных препаратов являются: наличие существенных побочных эффектов, невосприимчивость симптомов болезни к лечению, а также высокая стоимость лечения. На сегодняшний день велика потребность в создании и внедрении в клиническую практику новых, эффективных и безопасных препаратов для лечения эпилепсии.
Задачей заявленного технического решения является получение нового соединения, обладающего высокой противоэпилептической активностью и не имеющего аналогов в мире по химической структуре.
Техническим результатом предлагаемого изобретения является новое противоэпилептическое соединение на основе пиридоксина, обладающее способностью эффективно купировать эпилептические припадки.
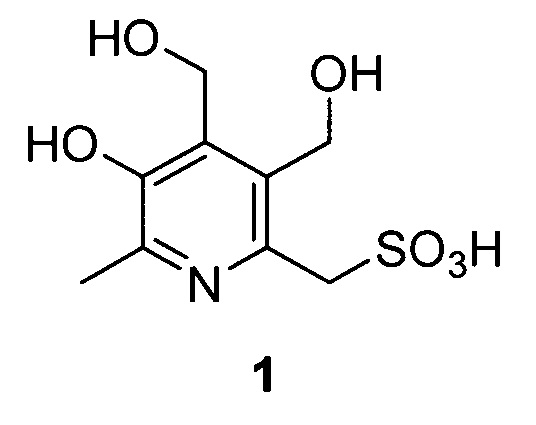
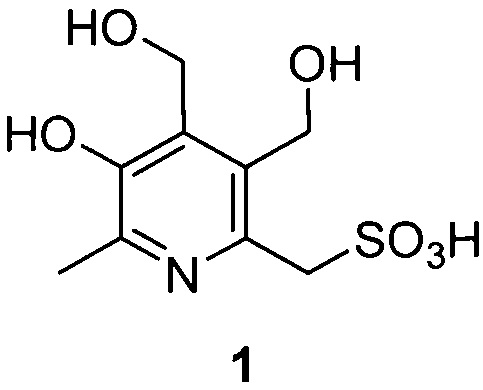
Задача решается и указанный технический результат достигается получением заявленного нового соединения формулы 1, обладающего способностью эффективно снижать эпилептическую активность мозга.
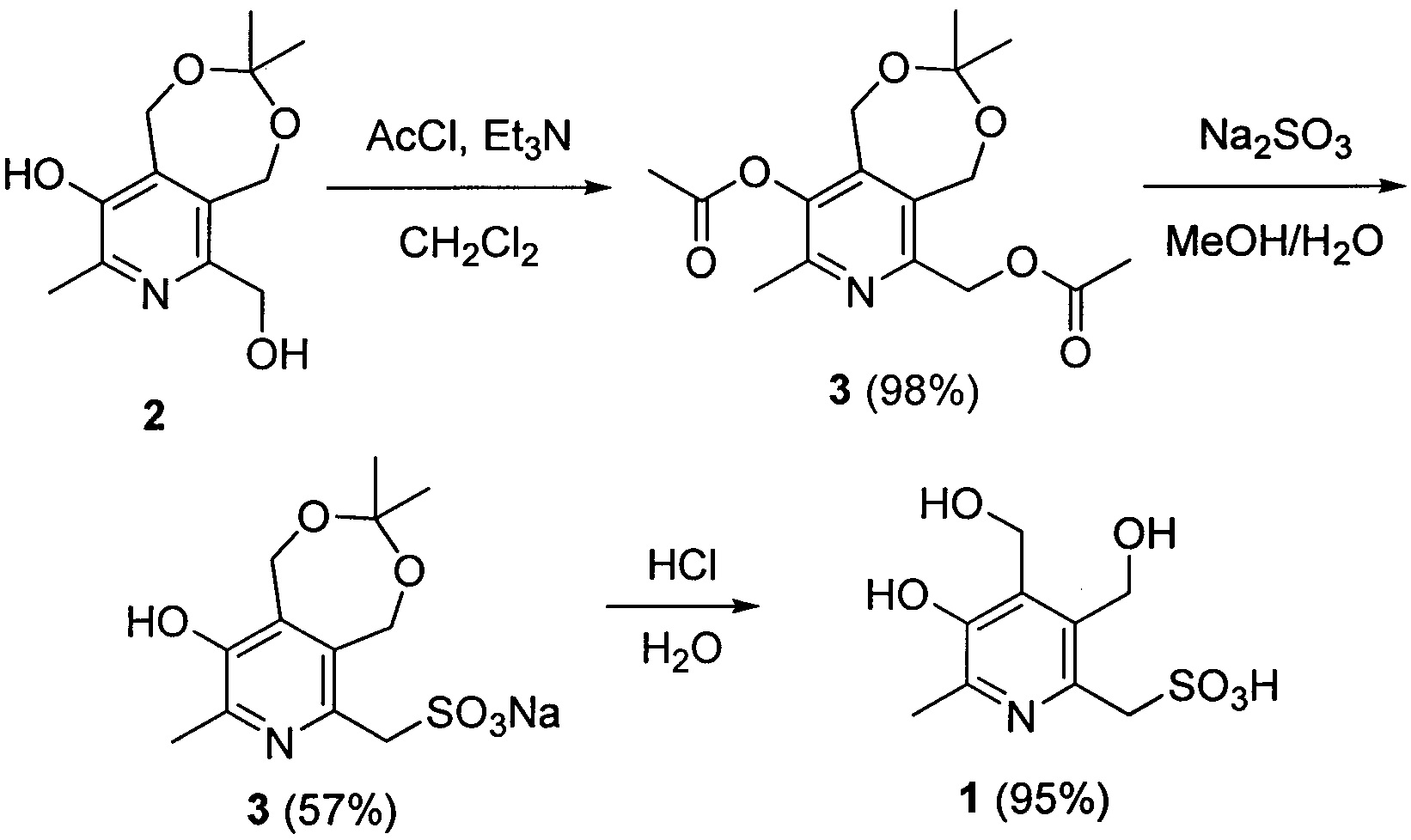
Заявленное соединение получают посредством трехстадийного синтеза из исходного 6-гидроксиметильного производного пиридоксина 2 согласно нижеприведенной схеме:
Структуры полученных соединений подтверждены методами масс-спектрометрии, 1H и 13C ЯМР-спектроскопии. Спектры ЯМР регистрируют на приборе Bruker AVANCE-400. Химический сдвиг определяют относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13C). Температуры плавления определяют с помощью прибора Stanford Research Systems МРА-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводят методом ТСХ на пластинах Sorbfil Plates. Эксперимент ВЭЖХ/МС сверхвысокого разрешения проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия).
В качестве препаратов, вызывающих эпилептические припадки, брали пенициллин и коразол, которые, как известно из уровня техники, способны вызывать эпилептические припадки при попадании в центральную нервную систему [Миронов А.Н., Бунатян Н.Д. и др. Руководство по проведению доклинических исследований лекарственных средств].
Заявленное техническое решение иллюстрируется Фиг. 1 и Фиг. 2.
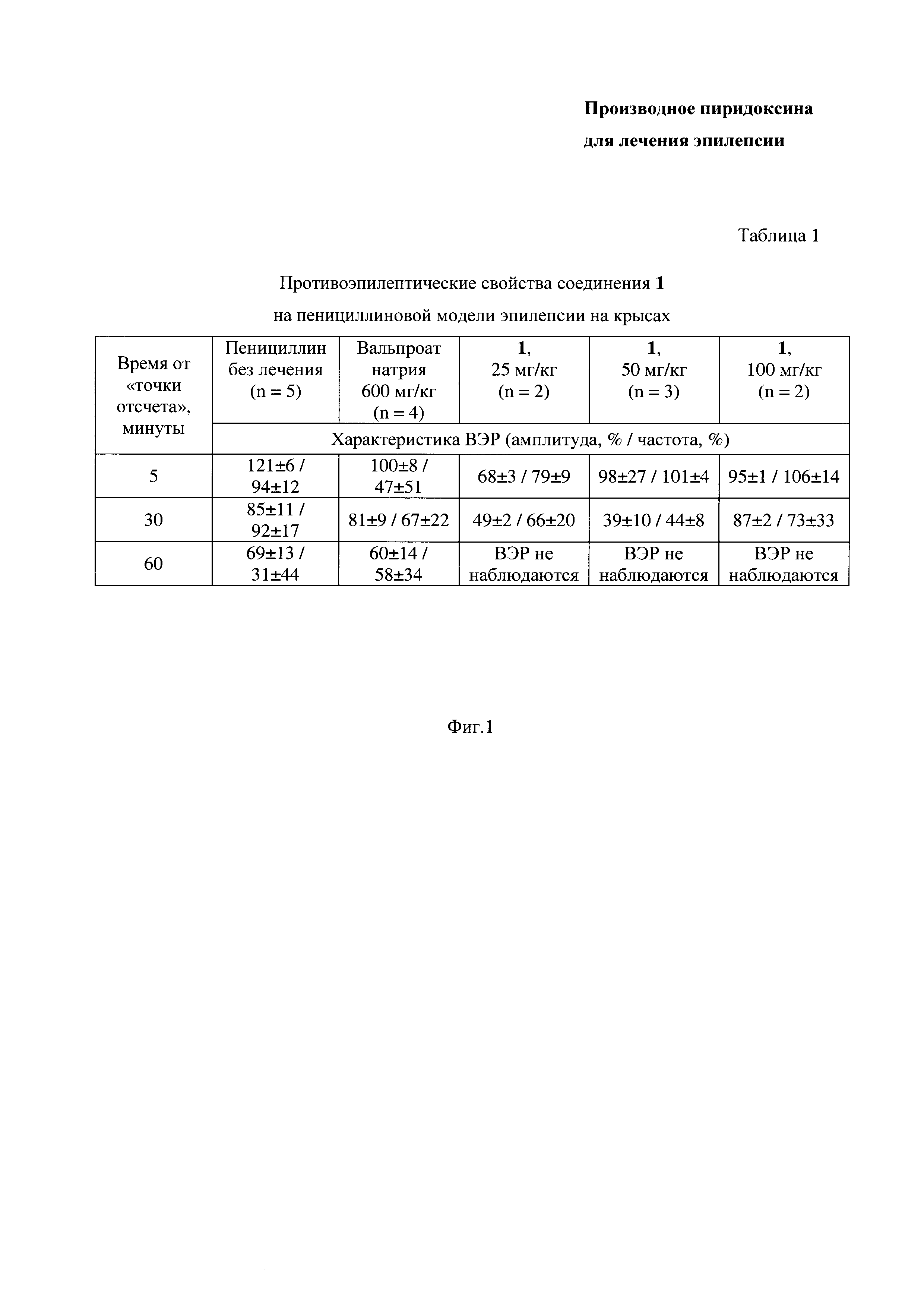
На Фиг. 1 представлена Таблица 1, в которой приведены данные по противоэпилептическим свойствам соединения 1 на пенициллиновой модели эпилепсии на крысах.
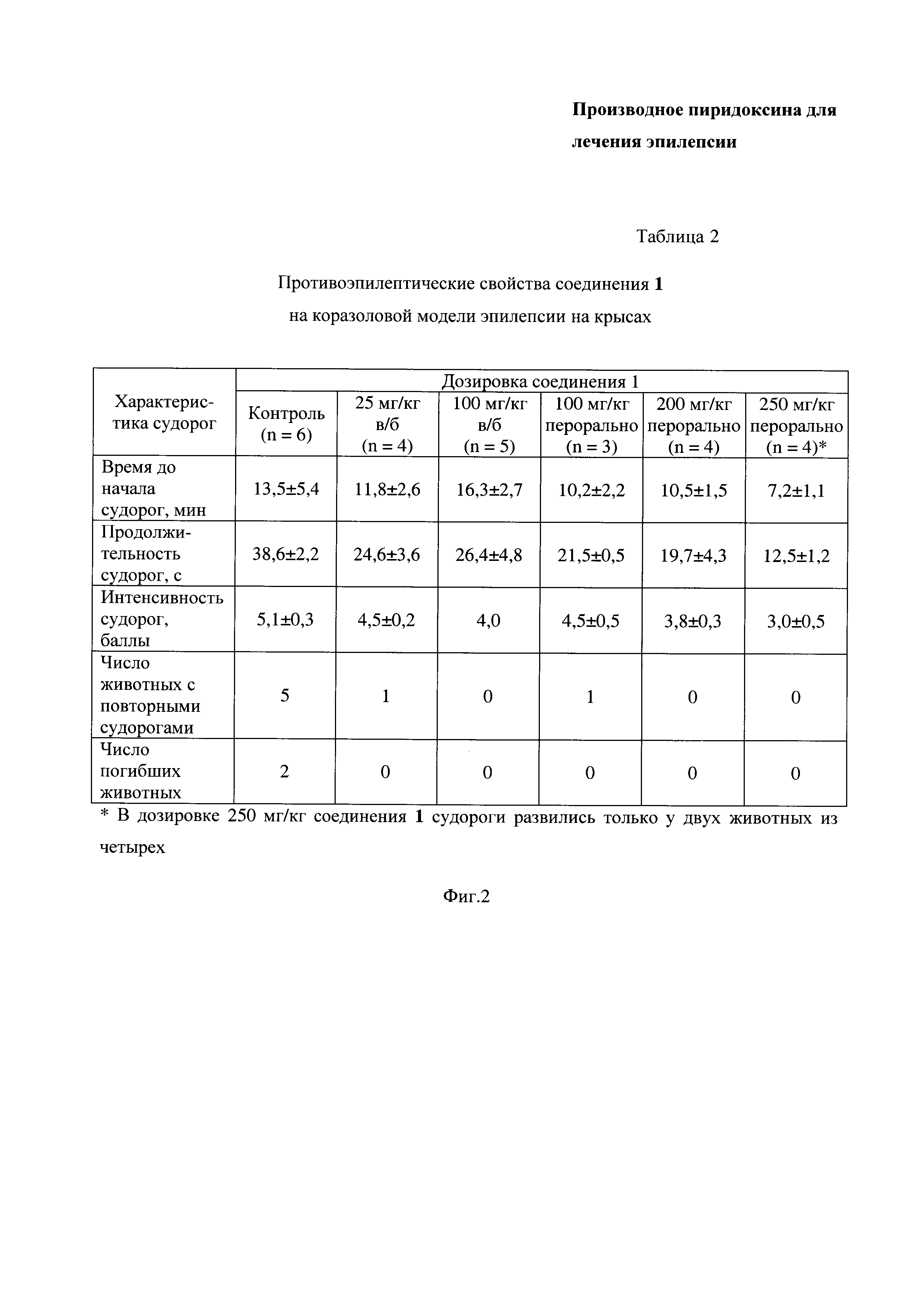
На Фиг. 2 представлена Таблица 2, в которой приведены данные по противоэпилептическим свойствам соединения 1 на коразоловой модели эпилепсии на крысах.
Заявленное техническое решение поясняется следующими примерами конкретного выполнения.
Пример 1. Синтез (5-гидрокси-3,4-бис(гидроксиметил)-6-метилпиридин-2-ил)метансульфокислоты (1).
Соединение 1 получают в 3 стадии из исходного соединения (2).
1 стадия. Навеску 100.0 г (0.418 моль) 6-(гидроксиметил)-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-9-ола (2) [Штырлин, Н.В. Новый метод синтеза 6-метил-2,3,4-трис(гидроксиметил)пиридин-5-ола / Н.В. Штырлин, А.Д. Стрельник, Л.П. Сысоева, О.А. Лодочникова, Е.Н. Климовицкий, Ю.Г. Штырлин // Журн. орг. химии. - 2009. - Т. 45, Вып. 8. - С. 1274-1275.] суспендируют в 1000 мл дихлорметана. К полученной суспензии при перемешивании одной порцией добавляют 145.0 мл (1.045 моль) триэтиламина, затем по каплям 74.2 мл (1.045 моль) ацетилхлорида. Реакционную смесь перемешивают 2 часа при комнатной температуре. После этого раствор промывают три раза по 500 мл воды. Органическую фракцию сушат над сульфатом магния, профильтровывают и упаривают на роторном испарителе с получением 132.0 г (98%) (9-ацетокси-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-6-ил)метилацетата (3).
2 стадия. Навеску (9-ацетокси-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-6-ил)метилацетата (3) из предыдущей стадии (132.0 г, 0.408 моль) растворяют в 700 мл метилового спирта. Отдельно готовят раствор 127.0 г (1.225 моль) сульфита натрия в 900 мл воды. Полученные растворы сливают вместе и перемешивают при комнатной температуре в течение 4 часов. После чего смесь нейтрализуют соляной кислотой до pH 7.0 и упаривают на роторном испарителе. Сухой кубовый остаток экстрагируют 600 мл горячего н-пропилового спирта и фильтруют. Из фильтрата при охлаждении выпадает продукт, который отфильтровывают, промывают 3 раза по 50 мл холодным н-пропанолом и сушат с получением 75.9 г (57%) (9-гидрокси-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-6-ил)метансульфоната (4) натрия. Т. пл. 197°C с разл. ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 1.38 (с, 6Н, C(CH3)2); 2.30 (с, 3H, CH3); 3.82 (с, 2Н, CH2-S); 4.79 (с, 2Н, CH2); 4.90 (с, 2Н, CH2). ЯМР 13C {1H} (100 МГц, ДМСО-d6), δ, м.д.: 19.28; 23.73; 57.47; 59.11; 60.97; 101.45; 132.07; 134.18; 140.97; 143.25; 146.78. HRMS-ESI: найдено [M+H]+ 326.0669, [M+Na]+ 348.0488, C12H16NNaO6S, вычислено [M+H]+ 326.0669, [M+Na]+ 348.0488.
3 стадия. Навеску (9-гидрокси-3,3,8-триметил-1,5-дигидро-[1,3]диоксепино[5,6-с]пиридин-6-ил)метансульфоната (4) натрия из предыдущей стадии (75.9 г, 0.233 моль) растворяют в 500 мл воды. Полученный раствор доводят до pH 1 концентрированной соляной кислотой. Реакционную смесь оставляют на 3 часа при комнатной температуре, после чего упаривают на роторном испарителе. Сухой остаток экстрагируют 200 мл холодной соляной кислоты и отфильтровывают. К фильтрату добавляют 700 мл изопропанола. Из смеси на холоду выпадает кристаллический осадок, который отфильтровывают и промывают 3 раза по 30 мл холодным изопропанолом и сушат с получением целевого продукта - 60.8 г (95%) (5-гидрокси-3,4-бис(гидроксиметил)-6-метилпиридин-2-ил)метансульфокислоты (1). Т. разл. 250°C. ЯМР 1H (400 МГц, ДМСО-d6), δ, м.д.: 2.56 (с, 3H, CH3); 4.27 (с, 2Н, CH2-S); 4.70 (с, 2Н, CH2); 4.90 (с, 2Н, CH2). ЯМР 13C {1H} (100 МГц, ДМСО-d6), δ, м.д.: 14.74; 51.57; 55.52; 56.19; 136.44; 138.79; 141.50; 142.95; 151.62. HRMS-ESI: найдено [M+H]+ 264.0536, C9H13NO6S, вычислено [M+H]+ 264.0536.
Пример 2. Исследование влияния соединения 1 на электрическую активность мозга при эпилептических приступах (на примере пенициллиновой модели эпилепсии).
Эксперименты проводили на самцах крыс линии Вистар массой тела 180-250 г.
Под изофлурановым наркозом (1.5%) проводят операционную подготовку к эксперименту. Для анестезии на время эксперимента используют уретан (1,5 мг/кг). Далее фиксируют животное в стереотаксической установке. В черепе животных просверливают отверстия 2×2 мм над симметричными областями сенсомоторной коры головного мозга и устанавливают 16-ти канальный зонд на кремниевой основе (Neuronexus) с шагом 100 мкм между регистрирующими электродами для отведения электрической активности с указанных областей. Хлорсеребряный электрод, который служит объединенным заземленным и электродом сравнения, вводят в мозжечок или зрительную кору на глубину 2-3 мм.
Для создания очага эпилептической активности параллельно соматосенсорным зонам в области зрительной коры просверливают отверстия 2×2 мм, куда апплицируют 10 мкл раствора натриевой соли бензилпенициллина в концентрации 40000 МЕ/мл.
Соединение 1 в дозе 100 мг/кг, 50 мг/кг, 25 мг/кг вводят внутрибрюшинно (в/б) на фоне устойчивой эпилептиформной активности через 30 минут после аппликации пенициллина. Оценивают амплитудно-частотные характеристики эпилептиформной активности.
В качестве вещества сравнения используют вальпроат натрия 600 мг/кг, который вводят в/б на фоне устойчивой эпилептиформной активности.
При статистической обработке экспериментальных данных используют статистические программы Origin 8.5 и IBM SPSS Statistics.
Достоверность различий между популяциями оценивают по U-критерию Манна-Уитни.
Результаты экспериментов заявителя по Примеру 2 показывают следующее.
Через 2-3 минуты после внутричерепной аппликации пенициллина наблюдают появление на электроэнцефалограмме острых высокоамплитудных волн (1000-20000 мкВ) с частотой от 20 до 70 мин-1. Высокоамплитудные электрические разряды (ВЭР), вызываемые пенициллином, наблюдают на протяжении трех часов регистрации. Их наличие, частота и амплитуда являются характеристическими показателями эпилептической активности головного мозга.
Эффект пенициллина через 30 минут действия приравнен к 100% и назван «точкой отсчета», начиная с которой вводят исследуемые соединения (заявленное соединение и препарат сравнения - вальпроат натрия).
Характеристики ВЭР через 5, 30 и 60 минут после точки отсчета приведены в Таблице 1 на Фиг. 1.
Из данных Таблицы 1 видно, что введение заявленного соединения 1 приводит к снижению амплитуды и частоты ВЭР, полностью подавляя ВЭР у животного через 60 минут после введения.
Введение вальпроата натрия не приводит к полному подавлению ВЭР.
Из вышеизложенного можно сделать вывод, что противоэпилептический эффект заявленного соединения 1 в дозе 25, 50, 100 мг/кг выражен значительно сильнее, чем у препарата сравнения - вальпроата натрия, так как введение вальпроата натрия даже в дозе 600 мг/кг не приводит к полному подавлению ВЭР. Таким образом, противоэпилептический эффект заявленного соединения выше, по сравнению с вальпроатом натрия, не менее чем в 6-24 раза.
Пример 3. Исследование влияния соединения 1 на развитие судорог (на примере коразоловой модели эпилепсии).
Эксперименты проводили на самцах крыс линии Вистар массой тела 180-250 г.
Коразол в дозе 80 мг/кг вводят подкожно в область шейного отдела спины. Животные наблюдались в течение 60 мин после инъекции коразола с регистрацией основного показателя - первых генерализованных клонических судорог с утратой рефлекса переворачивания.
Интенсивность развития судорожного приступа изучали по 6-балльной шкале:
- 0 - отсутствие судорожной активности;
- 1 - гиперкинезия;
- 2 - дрожание, подергивание, чрезмерный груминг, стереотипные движения;
- 3 - клонические судороги передних лап с подъемом на задние лапы;
- 4 - выраженные тонико-клонические судороги, падение животного набок, наличие фазы тонической экстензии;
- 5 - повторные тонико-клонические судороги, утрата позы;
- 6 - полный тонический приступ с апноэ, гибель животного.
Для исследования влияния заявленного соединения 1 на развитие судорог, вызванных коразолом, соединение 1 растворяют в физиологическом растворе и вводят следующим образом:
- в дозах 25 мг/кг, 100 мг/кг внутрибрюшинно (в/б) за 30 минут до индукции судорог коразолом;
- в дозах 100 мг/кг, 200 мг/кг, 250 мг/кг внутрижелудочно за 1 час до индукции судорог коразолом.
Развитие судорожного синдрома оценивают по следующим показателям:
- время до начала судорог (мин);
- продолжительность судорог (сек);
- интенсивность судорог по 6-балльной шкале;
- число животных с повторными судорогами;
- число погибших животных в группе.
При статистической обработке экспериментальных данных используют статистические программы Origin 8.5 и IBM SPSS Statistics.
Достоверность различий между популяциями оценивают по U-критерию Манна-Уитни.
Результаты исследования влияния соединения 1 на развитие судорог, вызванных коразолом, приведены в Таблице 2 на Фиг. 2.
Как видно из данных, приведенных в Таблице 2, результаты эксперимента по Примеру 3 показывают выраженную противоэпилептическую активность соединения 1 на коразоловой модели эпилепсии на крысах как при пероральном, так и в/б путях введения, которая выражается в дозозависимом снижении продолжительности и интенсивности судорог.
Кроме того, во всех дозировках соединение 1 сильно снижает вероятность возникновения повторных судорог, а также полностью предотвращает летальные исходы.
Наилучшие результаты по уменьшению развития судорожного приступа после введения коразола наблюдают при пероральном введении соединения 1 в дозе 250 мг/кг. В концентрациях 100 и 200 мг/кг эффект заявленного соединения 1 выражен несколько меньше.
Пример 4. Определение острой токсичности на мышах при пероральном введении.
Исследование проводили на мышах линии CD-1 (ICR) (6-8 недель, вес не менее 18 г, самки). Используют двукратное внутрижелудочное (пероральное) введение соединения 1 в объеме не более 0.5 мл/30 г живой массы тела мыши с применением желудочного зонда.
Введение осуществляют животным, лишенным корма (на промежуток времени не менее 8 часов) со свободным доступом к воде. Объем введения рассчитывают индивидуально для каждого животного, основываясь на массе тела, зарегистрированной непосредственно перед введением вещества. Доступ к воде и корму возобновляют через час после введения.
Для приготовления дозы 5000 мг/кг для введения мышам взвешивают навеску 1.5 г соединения 1 в полистироловой лодочке на весах Vibra (Shinko Denshi, Япония), переносят в мерную колбу класса точности А на 10 мл объема, растворяют в дистиллированной воде и доводят до метки. По причине недостаточной растворимости соединения 1, к полученному объему раствора добавляют еще 10 мл дистиллированной воды.
Клинический осмотр животных проводят индивидуально после введения на протяжении 30 минут, затем не реже одного раза в час на протяжении 4 часов, далее ежедневно 1 раз в день в течение 14 дней. Массу тела регистрируют непосредственно перед введением препарата для расчета объема введения, далее 1 раз в два дня.
На основании проведенных исследований обнаружено, что соединение 1 является малотоксичным, поскольку параметр ЛД50 при пероральном применении у крыс превышает 5000 мг/кг массы тела.
Пример 5. Определение острой токсичности на мышах при внутрибрюшинном введении.
Исследование проводили на мышах линии CD-1 (ICR) (6-8 недель, вес не менее 18 г) обоего пола. Использовали однократное внутрибрюшинное введение соединения 1 в дозах 1000 мг/кг и 2000 мг/кг в объеме 1 мл на 40 г массы тела мыши с применением инсулинового шприца. Объем введения рассчитывали индивидуально для каждого животного, основываясь на массе тела, зарегистрированной непосредственно перед введением вещества.
Для приготовления дозы 2000 мг/кг для введения мышам взвешивают навеску 800 мг соединения 1 в полистироловой лодочке на весах Vibra (Shinko Denshi, Япония), переносят в мерную колбу класса точности А на 10 мл объема, растворяют в физиологическом растворе и доводят до метки. Раствор фильтруют шприцевыми насадками с размером пор 0.22 мкм (Jet Biofil).
Для приготовления дозы 1000 мг/кг для введения мышам взвешивают навеску 400 мг соединения 1 в полистироловой лодочке на весах Vibra (Shinko Denshi, Япония), переносят в мерную колбу класса точности А на 10 мл объема, растворяют в физиологическом растворе и доводят до метки. Раствор фильтруют шприцевыми насадками с размером пор 0.22 мкм (Jet Biofil).
Клинический осмотр животных проводят индивидуально после введения на протяжении 30 минут, затем не реже раза в час на протяжении 4 часов, далее ежедневно 1 раз в день в течение 14 дней. Массу тела регистрируют непосредственно перед введением препарата для расчета объема введения, далее 1 раз в два дня.
На основании проведенных исследований обнаружено, что соединение 1 является малотоксичным, поскольку параметр ЛД50 при внутрибрюшинном введении у крыс превышает 2000 мг/кг массы тела.
Таким образом, из вышеизложенного можно сделать вывод, что заявленное соединение проявляет высокий уровень противоэпилептической активности.
Так, в дозах 25, 50 и 100 мг/кг соединение 1 полностью подавляет эпилептическую электрическую активность мозга в течение часа после внутрибрюшинного введения крысам на пенициллиновой модели эпилепсии.
На коразоловой модели эпилепсии на крысах показано снижение интенсивности и продолжительности судорог при введении соединения 1 в дозах 25 и 100 мг/кг внутрибрюшинно и 100 и 200 мг/кг перорально, а также полное предотвращение развития судорог в отдельных случаях при дозировке 250 мг/кг при пероральном введении.
При этом соединение 1 является малотоксичным, поскольку параметр ЛД50 у крыс превышает 2000 и 5000 мг/кг массы тела при внутрибрюшинном и пероральном введении соответственно.
В целом можно констатировать, что заявителем выполнены поставленные задачи и достигнут заявленный технический результат, а именно - получено новое соединение, обладающее высокой противоэпилептической активностью и не имеющего аналогов в мире по химической структуре. Полученный препарат потенциально позволит существенно повысить качество и продолжительность жизни пациентов.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», т.к. может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.