Результат интеллектуальной деятельности: Производные пиридоксина и ацетона с противоопухолевой активностью
Вид РИД
Изобретение
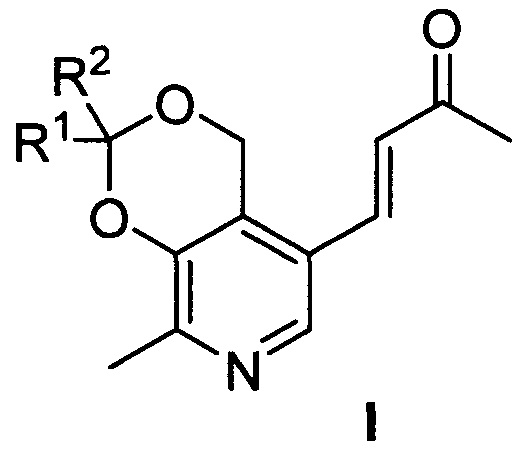
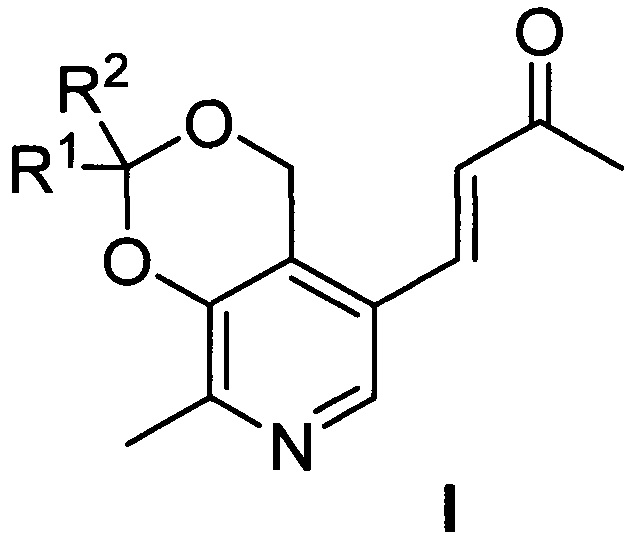
Изобретение относится к синтетическим биологически активным веществам гетероциклического ряда, обладающим выраженной противоопухолевой активностью в отношении клеток преимущественно злокачественных новообразований и высокой безопасностью по отношению к условно нормальным и нормальным клеткам, а также высоким значением летальной дозы (далее - LD50) (средняя смертельная (летальная) доза токсического вещества, необходимая для того, чтобы погибла половина членов испытуемой популяции) по сравнению с существующими на дату подачи заявки препаратами указанного назначения и представляющим собой производные пиридоксина и ацетона общей формулы I
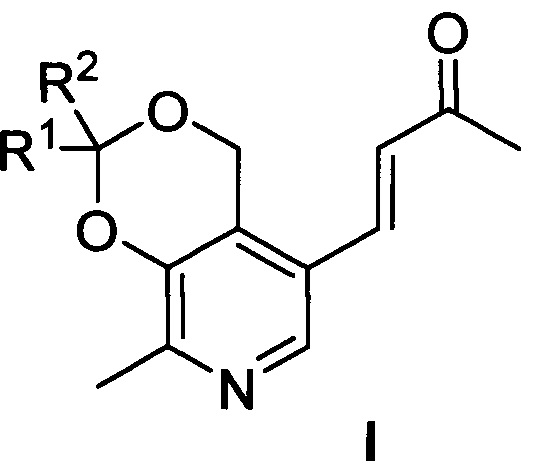
где R1=R2=СH3; R1=H, R2=С2H5; R1=H, R2=С3H7; R1=H, R2=С4H9; R1-R2=спиро-С4H8; R1-R2=спиро-С5H10; R1=H, R2=CH(CH3)C9H19.
Соединения формулы I обладают противоопухолевой активностью в отношении клеток преимущественно злокачественных новообразований и высокой безопасностью по отношению к условно нормальным и нормальным клеткам и могут найти применение в медицине в области лечения социально значимых заболеваний, а именно онкологических заболеваний.
По данным Всемирной организации здравоохранения (ВОЗ) в 2012 году зафиксировано 8.2 миллиона случаев смерти, связанных с раком. Поэтому задача по повышению эффективности химической терапии опухолей (или злокачественных новообразований в соответствии с терминологией Международной классификацией болезней МКБ-10) является одной из самых важных практических задач современной клинической онкологии. Высокая токсичность применяемых в медицинской практике противоопухолевых препаратов обусловливает необходимость введения корректировок в схемы химиотерапии, а именно регуляции вводимых доз препаратов и увеличения интервалов между курсами химической терапии. Как следствие, формируется фенотип адаптивной множественной лекарственной устойчивости (МЛУ), и опухолевые клетки (преимущественно злокачественные новообразования) вырабатывают резистентность к лекарственным препаратам, зачастую отличным по структуре от использованных при терапии.
Так, в источниках [Baguley B.C. Multidrug Resistance in Cancer (Множественная лекарственная устойчивость при раке) // J. Methods in Mol. Bio. - 2010. - V. 596. - P. 1-14] и [Gillet J.P., Gottesman MM. Mechanisms of Multidrug Resistance in Cancer (Механизм множественной лекарственной устойчивости при раке) // J. Methods in Mol. Bio. - 2010. - V. 596. - P. 47-76] описаны различные механизмы устойчивости стволовых опухолевых клеток к лекарственным средствам (Опухолевая стволовая клетка - специфическая опухолевая клетка - долгоживущая и медленно пролиферирующая, способная при трансплантации иммунодефицитным животным in vivo индуцировать рост опухоли, идентичной исходной, в то время как другие короткоживущие и более дифференцированные клетки опухоли этой способностью не обладают).
В источниках [Gergely S., Paterson K. Jill., Joseph A., Michael M.G. Targeting multidrug resistance in cancer (Таргетная множественная лекарственная устойчивость при раке) // J. Nat Rev Drug Discov. - 2006. - V. 5. - P. 219-234] и [Gottesman M.M., Fojo Т., Bates S.E. Multidrug resistance in cancer: role of ATP-depend transporters (Множественная лекарственная устойчивость при раке: роль АТФ-зависимых транспортеров) // Macmillan Magazines Ltd. - 2002. - V. 2. - P. 48-58] описаны механизмы устойчивости опухолевых клеток к лекарственным средствам, связанные с АТФ-зависимыми обратными транспортерами.
В источнике [Gottesman M.M. The molecular basis of multidrug resistance in cancer: the early years of P-glycoprotein research (Молекулярная основа множественной лекарственной устойчивости при раке: ранние годы исследования Р-гликопротеинов) // FEBS Utters. - 2006. - V. 580. - Р. 998-1009] описана роль Р-гликопротеинов в формировании множественной лекарственной устойчивости опухолевых клеток.
Таким образом, из вышеизложенного можно сделать вывод, что проблема повышения эффективности действия противоопухолевых препаратов в отношении резистентных к химиотерапии преимущественно злокачественных новообразований актуальна и в настоящее время.
Из исследованного заявителем уровня техники выявлено, что согласно Распоряжению от 26 декабря 2015 года №2724-р, подготовленного Минздравом России, в перечень жизненно необходимых и важнейших лекарственных препаратов РФ в группу L01 АТХ (анатомо-терапевтическо-химическая классификация) входят следующие противоопухолевые препараты:
- L01A - алкилирующие средства (бендамустин, ифосфамид, мелфалан, хлорамбуцил, циклофосфамид, бусульфан, кармустин, ломустин, дакарбазин, темозоломид),
- L01B - антиметаболиты (метотрексат, пеметрексед, ралтитрексид, меркаптопурин, неларабин, флударабин, азацитидин, гемцитабин, капецитабин, фторурацил, цитарабин),
- L01C - алкалоиды растительного происхождения и другие природные вещества (винбластин, винкристин, винорелбин, этопозид, доцетаксел, паклитаксел),
- L01D - противоопухолевые антибиотики и родственные соединения (даунорубицин, доксорубицин, идарубицин, митоксантрон, эпирубицин, блеомицин, митомицин),
- L01X - другие противоопухолевые препараты (карбоплатин, оксалиплатин, цисплатин, прокарбазин, бевацизумаб, ритуксимаб, трастузумаб, цетуксимаб, вандетаниб, гефитиниб, дазатиниб, ибрутиниб, иматиниб, нилотиниб, сорафениб, сунитиниб, эрлотиниб, аспарагиназа, гидроксикарбамид, бортезомиб, иринотекан, третиноин, эрибулин).
Некоторые из указанных препаратов, например тамоксифен, ралоксифен, торемифен, эстрамустин, эллиптиниум, обладают селективностью по отношению к эстрогензависимым новообразованиям, таким как рак молочной железы. Недостатками этих препаратов являются недостаточная клиническая эффективность, а также возникновение к ним резистентности опухолевых клеток [Ring A., Dowsett М. Mechanisms of tamoxifen resistance (Механизмы устойчивости к тамоксифену). Endocr Relat Cancer, 2004, 11, 643-658].
Одними из наиболее эффективных препаратов для лечения злокачественных новообразований являются антрациклины группы даунорубицина, такие как доксорубицин, карминомицин и аклациномицин. Они относятся к часто используемым в противоопухолевой терапии средствам.
Так, в источнике [Lown J.W. Anthracycline and anthraquinone anticancer agents: current status and recent development (Антрациклиновые и антрахиноновые противораковые средства: современное состояние и последние разработки.) // Pharmacol. Ther. - 1993. - V. 60. - P. 185-214] описаны механизмы действия различных антрациклинов и способы улучшения их терапевтической эффективности.
В источнике [Sinha В.K., Dusre L., Collins С., Myers С.Е. Resistance of paraquat and adriamycin in human breast tumor cells: role of free radical formation (Резистентность к параквату и адриамицину в опухолевых клетках молочной железы человека: роль образования свободных радикалов) // Biochim. Biophys. Acta. - 1989. - V. 1010. - P. 304-310] описаны биохимические основы индуцированного паракватом образования свободных радикалов и механизм устойчивости к этому агенту в клеточных линиях опухолей молочной железы человека. Также было проведено сравнение воздействия адриамицина и параквата на опухолевые клетки во взаимосвязи с образованием свободных радикалов.
Недостатками представленных выше лекарственных средств в целом являются недостаточно высокая эффективность наряду с низкой безопасностью, кроме этого, известные средства отличаются от заявленных веществ по химической структуре и составу.
Из исследованного заявителем уровня техники выявлено изобретение, совпадающее с заявленным по назначению (достигаемому результату), по патенту США [US 2015/0322093 Small molecule inhibitors of nicotinamide phosphoribosyltransferase (NAMPT) (Низкомолекулярные ингибиторы никотинамидфосфорибозилтрансферазы) / The Curators of the University of Missouri - Опубл. - 12.11.2015], сущностью которого являются соединения, в том числе алкенилпроизводные пиридина, содержащие кетоновый фрагмент. Известные соединения являются противоопухолевыми агентами, ингибиторами никотинамид-фосфорибозилтрансферазы, и имеют в своем составе некоторые структурные фрагменты, присущие заявленным соединениям общей формулы I
В целом известное изобретение совпадает с заявленным техническим решением по назначению, однако его нельзя рассматривать в качестве аналога заявленного технического решения по причине отличия по химической структуре и составу.
Таким образом, из вышеизложенного можно сделать общий вывод, что при проведении заявителем анализа уровня техники по российским и зарубежным патентным базам данных, научной литературе и Интернет-ресурсам не выявлены аналоги к заявленному техническому решению по химической структуре и составу. Вместе с тем, заявителем выявлены соединения, которые являются аналогами заявленного технического решения по назначению, но которые, однако, обладают указанными выше недостатками, а именно недостаточно высокой эффективностью при использовании по назначению наряду с низкой безопасностью.
Задачей заявленного технического решения является создание принципиально новых соединений, обладающих выраженной активностью в отношении клеток преимущественно злокачественных новообразований и высокой безопасностью по отношению к условно нормальным и нормальным клеткам, а также высоким значением LD50, которые расширяют арсенал известных средств указанного назначения и обеспечивают возможность вывода на рынок новых противоопухолевых средств, не имеющих аналогов в мире.
Техническим результатом предлагаемого изобретения является создание соединений, проявляющих сопоставимую (или превосходящую) с известными в мире цитостатиками противоопухолевую активность в отношении преимущественно злокачественных новообразований и характеризующихся значительно большей цитотоксической безопасностью по отношению к условно нормальным и нормальным клеткам человека.
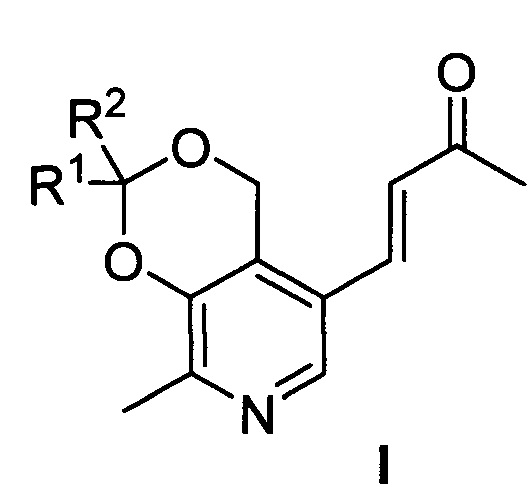
Сущностью предлагаемого изобретения являются производные пиридоксина и ацетона общей формулы I
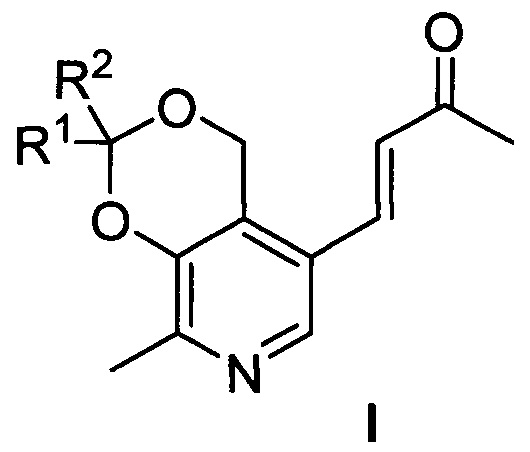
где R1=R2=СН3; R1=Н, R2=С2Н5; R1=Н, R2=С3Н7; R1=Н, R2=С4Н9; R1-R2=спиро-С4Н8; R1-R2=спиро-С5Н10; R1=Н, R2=CH(CH3)C9H19, обладающие противоопухолевой активностью по отношению к преимущественно злокачественным новообразованиям и высокой безопасностью по отношению к условно нормальным и нормальным клеткам.
Поставленная цель решается путем синтеза веществ общей формулы I
где R1=R2=СН3; R1=Н, R2=С2Н5; R1=Н, R2=С3Н7; R1=Н, R2=С4Н9; R1-R2=спиро-С4Н8; R1-R2=спиро-С5Н10; R1=Н, R2=CH(CH3)C9H19.
Характеристики новых соединений приведены в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1D и 2D ЯМР спектроскопии (1Н, 13С, COSY, HSQC, NOESY).
Спектры ЯМР 1Н зарегистрированы на приборе «Bruker» AVANCE 400 (400 МГц). Химический сдвиг определяют относительно сигналов остаточных протонов дейтерированного растворителя.
HRMS-эксперимент проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Температуру плавления веществ определяют на приборе OptiMelt МРА100 (Stanford Research Systems).
Контроль за ходом реакций проводят методом ТСХ на пластинах Sorbfil ПТСХ-АФ-А-УФ. Препаративную хроматографию соединений проводят на силикагеле КСКГ фр. 0.10-0.16 (Экофарм).
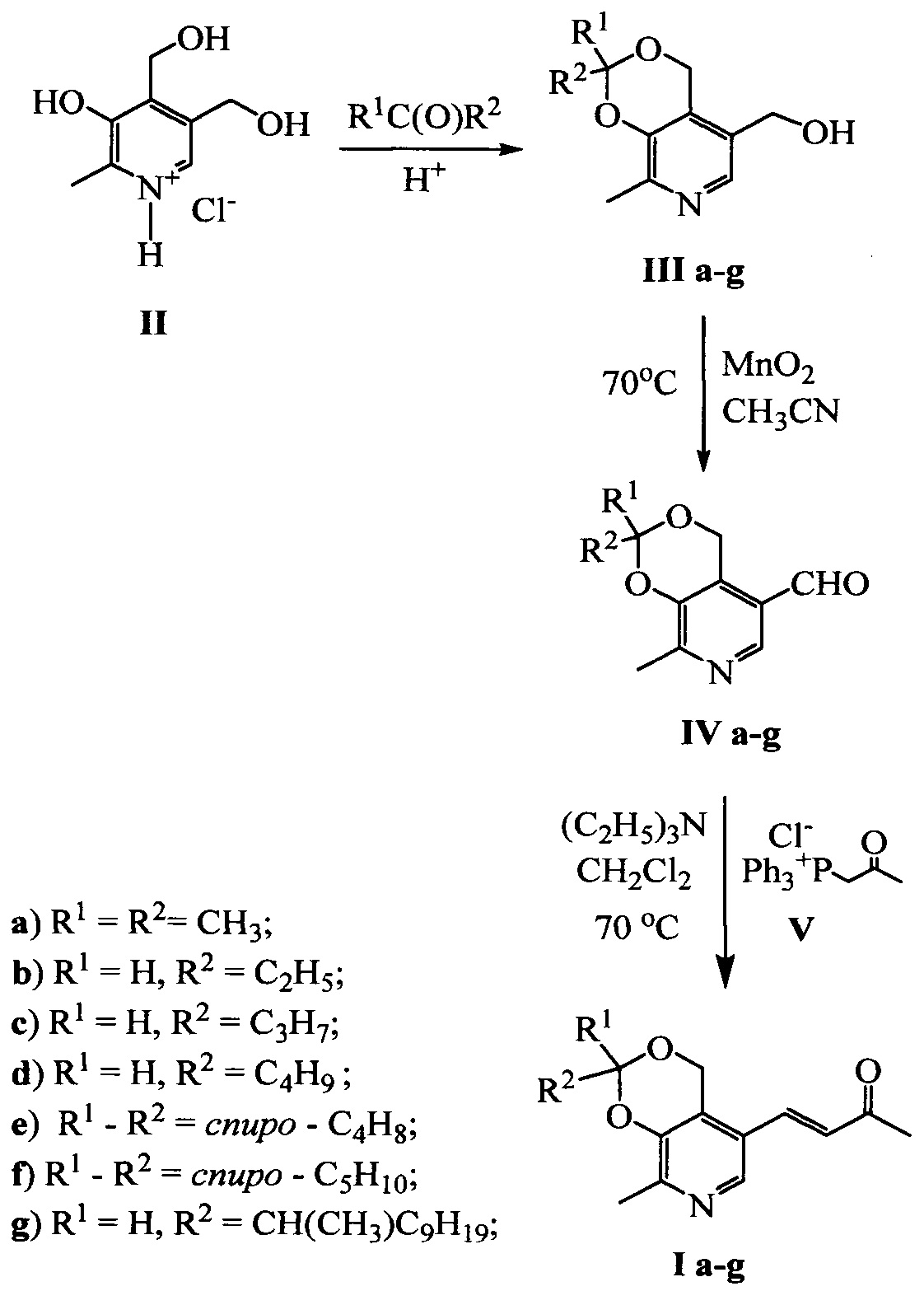
Заявленные соединения формулы I получают в три стадии согласно нижеприведенной схеме
Заявленное техническое решение иллюстрируется Фиг. 1-3.
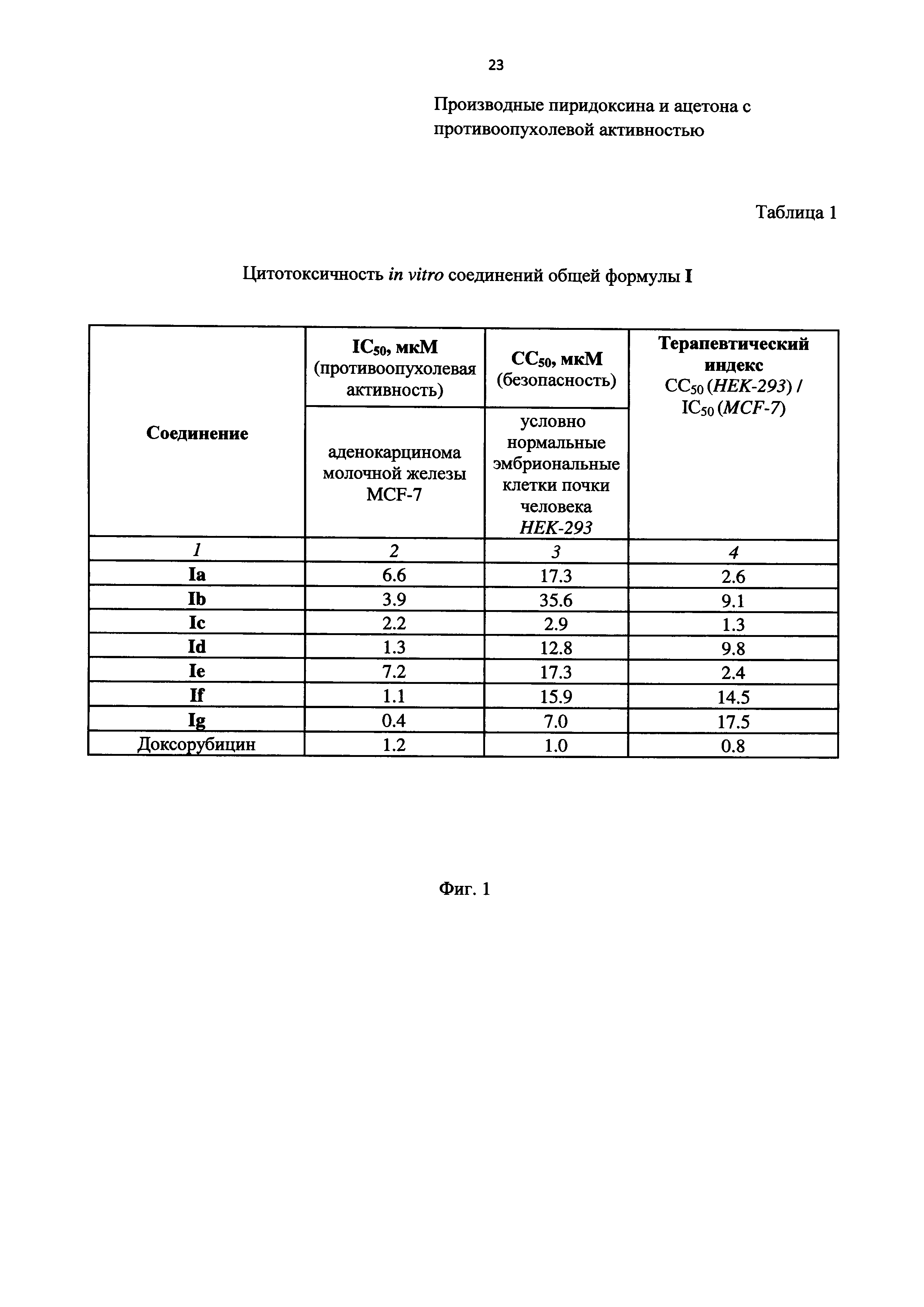
На Фиг. 1 представлена Таблица 1, в которой приведены данные по цитотоксичности in vitro соединений общей формулы I.
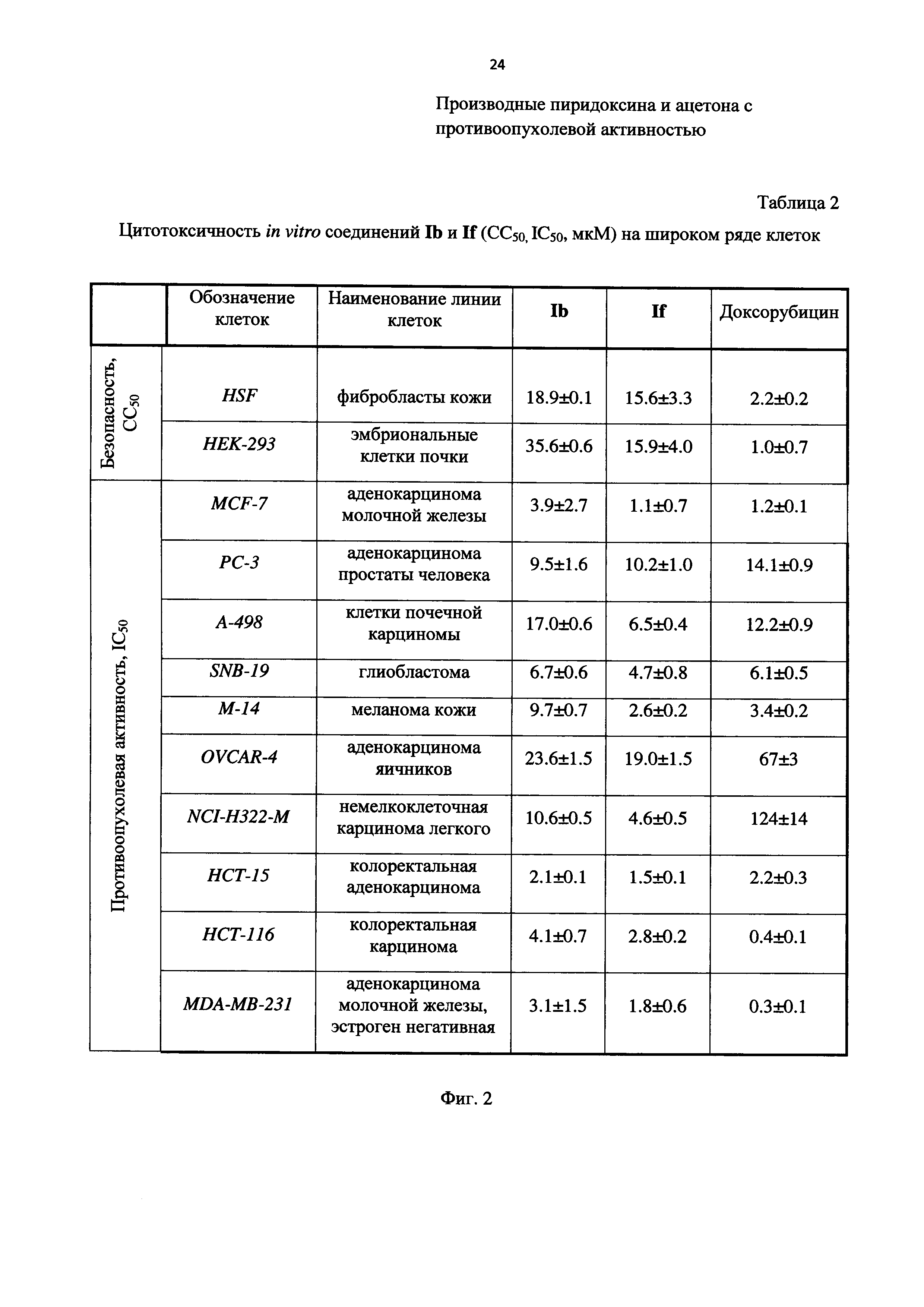
На Фиг. 2 представлена Таблица 2, в которой приведены данные по цитотоксичности in vitro соединений Ib и If (IC50, мкМ) на широком ряде клеток.
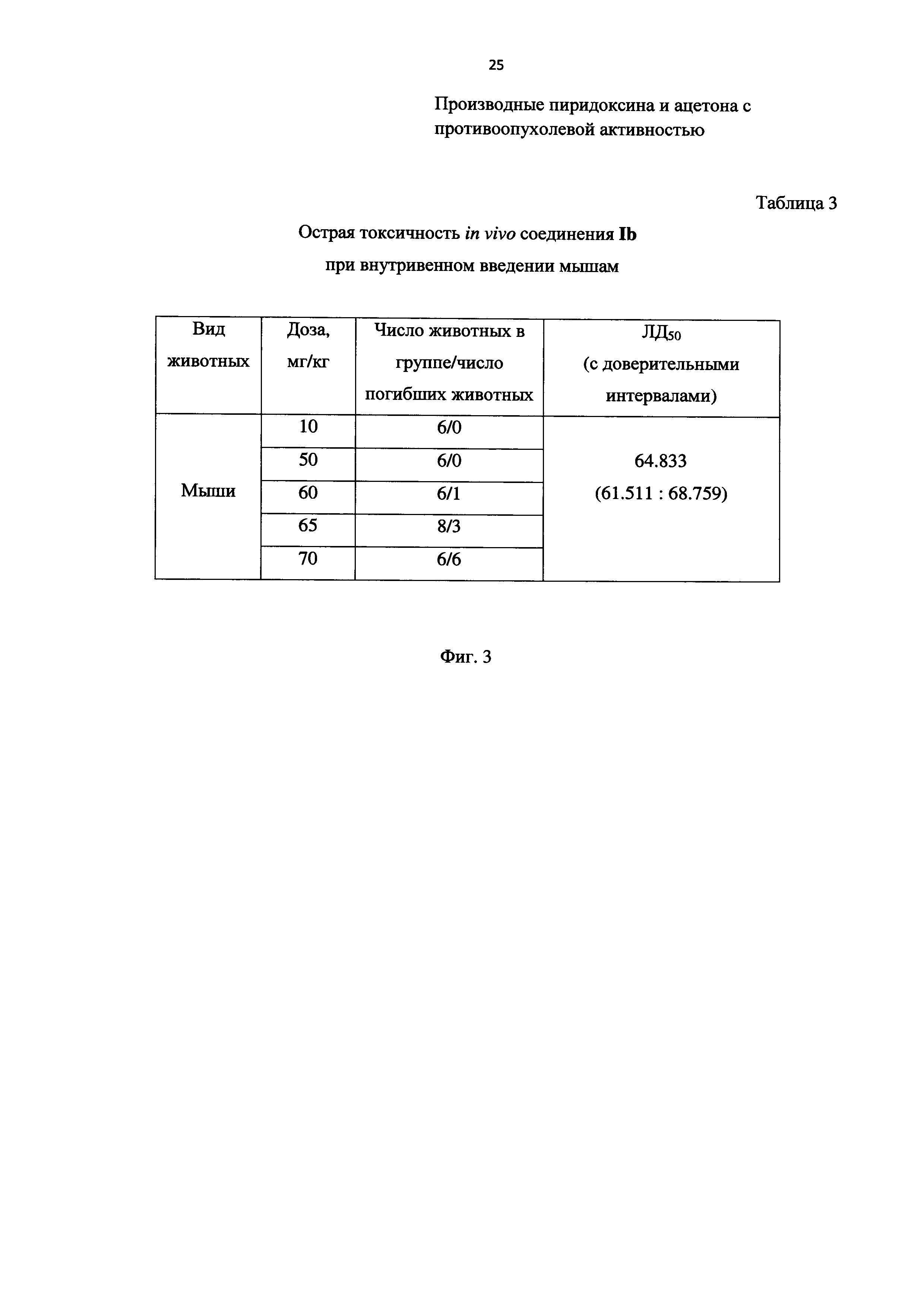
На Фиг. 3 представлена Таблица 3, в которой приведены данные по острой токсичности in vivo соединения Ib при внутривенном введении мышам.
Примеры конкретного осуществления заявленного технического решения.
На первой стадии известным способом получают соединения IIIa-g. Способ получения указанных соединений описан в известных публикациях.
Соединение IIIa описано в работе [Cohen A., Synthetical Experiments in the В Group of Vitamins. Part V. Novel Derivatives of Pyridoxine / A. Cohen, E.G. Huges // J. Chem. Soc. - 1952. - P. 4384-4386].
Соединения IIIb, IIId и IIIg описаны в изобретении к патенту [2607522. Четвертичные аммониевые соли на основе производных витамина В6 / ФГАОУ ВО КФУ. - Опубл. - 10.01.2017, Бюл. №1].
Соединения IIIc и IIIe описаны в изобретении к патенту [2561501. Антиретровирусные препараты на основе производных азидотимидина / ФГАОУ ВО КФУ. - Опубл. - 27.08.2015, Бюл. №24].
Соединение IIIf описано в изобретении к патенту [1,030,400. Sulfur-Containing Derivatives of Vitamin В6 and process for their preparation / Merck, Actiengesellschaft. - Опубл. - 20.01.1965].
На второй стадии получают соединения IV.
Общая методика получения соединений IV.
К раствору исходного ацеталя (кеталя) пиридоксина (5.00 ммоль) в 100 мл ацетонитрила добавляют активированный оксид марганца (IV) (6.52 г, 75.0 ммоль), после чего реакционную смесь перемешивают при 70°С в течение 20 минут. Затем осадок отфильтровывают. Далее фильтрат концентрируют в вакууме и очищают с помощью колоночной хроматографии (элюент - этилацетат).
Пример 1. Получение 2,2,8-Триметил-4H-[1,3]диоксино[4,5-с]пиридин-5-карбальдегида (IVa)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIIa (1.05 г, 5.00 ммоль). Выход продукта 70% (0.75 г), желтое маслообразное вещество. Данное соединение ранее было описано в работе [Korytnyk, W. Pyridoxine chemistry. V. synthesis of isopyridoxal, 5-pyridoxic acid lactone, and their derivatives / W. Korytnyk, E.J. Kris, R.P. Singh // J. Org. Chem. - 1964. - V. 29. - P. 574-579].
Пример 2. Получение 2-Этил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-карбальдегида (IVb)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIIb (1.05 г, 5.00 ммоль). Выход продукта 72% (0.75 г), желтое маслообразное вещество. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.07 (т, 3Н, 3JHH=7.5 Гц, СНСН2СН3), 1.85-1.94 (м, 2Н, СНСН2СН3), 2.51 (с, 3Н, СН3), 4.95 (т, 1H, 3JHH=5.1 Гц, СНСН2СН3), 5.14, 5.28 (АВ, 2Н, 2JHH=18.0 Гц, CH2O), 8.46 (с, 1H, СН), 10.00 (с, 1H, С(О)Н). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 7.86 (с, СНСН2СН3), 19.52 (с, СН3), 27.53 (с, СНСН2СН3), 65.87 (с, CH2O), 100.79 (с, СНСН2СН3), 126.41 (с, CPyr), 128.53 (с, CPyr), 147.08 (с, CPyr), 148.45 (с, CPyr), 154.10 (с, CPyr), 191.93 (с, С(О)Н). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 208.0968. C11H14NO3, вычислено [М+Н] 208.0968.
Пример 3. Получение 8-Метил-2-пропил-4H-[1,3]диоксино[4,5-с]пиридин-5-карбальдегида (IVc)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIIc (1.12 г, 5.00 ммоль). Выход продукта 75% (0.83 г), желтое маслообразное вещество. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 0.77 (т, 3Н, 3JHH=7.2 Гц, СН(CH2)2CH3), 1.28-1.37 (м, 2Н, СНСН2СН2СН3), 1.55-1.67 (м, 2Н, СНСН2СН2СН3), 2.23 (с, 3Н, СН3), 4.77 (т, 1H, 3JHH=4.6 Гц, СН(СН2)2СН3), 4.83, 4.94 (АВ, 2Н, 2JHH=17.8 Гц, CH2O), 8.18 (с, 1Н, СН), 9.73 (с, 1H, С(О)Н). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 13.56 (с, СН(СН2)2СН3), 16.58 (с, СНСН2СН2СН3), 18.99 (с, СН3), 35.82 (с, СНСН2СН2СН3), 65.28 (с, CH2O), 99.40 (с, СН(СН2)2СН3), 125.94 (с, CPyr), 127.96 (с, CPyr), 146.53 (с, CPyr), 147.85 (с, CPyr), 153.36 (с, CPyr), 191.32 (с, С(О)Н). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 222.1125. C12H16NO3, вычислено [М+Н] 222.1125.
Пример 4. Получение 2-Бутил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-карбальдегида (IVd)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIId (1.19 г, 5.00 ммоль). Выход продукта 78% (0.92 г), желтое маслообразное вещество. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 0.94 (т, 3Н, 3JHH=7.2 Гц, СН(СН2)3СН3), 1.35-1.44 (м, 2Н, СН(СН2)2СН2СН3), 1.47-1.54 (м, 2Н, СНСН2СН2СН2СН3), 1.81-1.94 (м, 2Н, СНСН2(СН2)2СН3), 2.50 (с, 3Н, СН3), 5.00 (т, 1H, 3JHH=5.2 Гц, СН(СН2)3СН3), 5.13, 5.27 (АВ, 2Н, 2JHH=18.0 Гц, CH2O), 8.46 (с, 1H, СН), 10.00 (с, 1H, С(О)Н). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 13.90 (с, СН(СН2)3СН3), 19.35 (с, СН3), 22.38 (с, (СН2)2СН2СН3), 25.56 (с, СНСН2СН2СН2СН3) 33.81 (с, СНСН2(СН2)2СН3), 65.65 (с, СН2О), 99.91 (с, СН(СН2)3СН3), 126.23 (с, CPyr), 128.31 (с, CPyr), 146.89 (с, CPyr), 148.24 (с, CPyr), 153.82 (с, CPyr), 191.69 (с, С(О)Н). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 236.1281. C13H18NO3, вычислено [М+Н] 236.1281.
Пример 5. Получение 8'-Метил-4'H-спиро[циклопентан-1,2'-[1,3]диоксино[4,5-с]пиридин]-5'-карбальдегида (IVe)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIIe (1.18 г, 5.00 ммоль). Выход продукта 71% (0.83 г), желтое маслообразное вещество. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.78-1.85 (м, 4Н, спиро-С5Н8), 1.91-1.98 (м, 4Н, спиро-С5Н8), 2.50 (с, 3Н, СН3), 5.19 (с, 2Н, CH2O), 8.45 (с, 1H, СН), 10.02 (с, 1H, С(О)Н). Спектр ЯМР 13С {1H} (CDCl3) δ, м.д.: 19.36 (с, СН3), 23.46 (с, спиро-С5Н8), 36.03 (с, спиро-С5Н8), 61.46 (с, CH2O), 111.27 (с, спиро-С5Н8), 126.06 (с, CPyr), 127.49 (с, CPyr), 146.55 (с, CPyr), 146.95 (с, CPyr), 154.23 (с, CPyr), 191.85 (с, С(О)Н). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 234.1125. C13H16NO3, вычислено [М+Н] 234.1125.
Пример 6. Получение 8'-Метил-4'H-спиро[циклогексан-1,2'-[1,3]диоксино[4,5-с]пиридин]-5'-карбальдегида (IVf)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIIf (1.25 г, 5.00 ммоль). Выход продукта 74% (0.91 г), желтое маслообразное вещество. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.40-1.53 (м, 2Н, спиро-С6Н10), 1.56-1.69 (м, 4Н, спиро-С6Н10), 1.72-1.86 (м, 4Н, спиро-С6Н10), 2.52 (с, 3Н, СН3), 5.15 (с, 2Н, CH2O), 8.45 (с, 1H, СН), 10.02 (с, 1H, С(О)Н). Спектр ЯМР 13С {1H} (CDCl3) δ, м.д.: 19.65 (с, СН3), 22.53 (с, спиро-С6Н10), 25.28 (с, спиро-С6Н10), 33.41 (с, спиро-С6Н10), 59.61 (с, CH2O), 100.51 (с, спиро-С6Н10), 126.10 (с, CPyr), 127.58 (с, CPyr), 146.48 (с, CPyr), 146.60 (с, CHPyr), 154.47 (с, CPyr), 192.14 (с, С(О)Н). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 248.1281. C14H18NO3, вычислено [М+Н] 248.1281.
Пример 7. Получение 8-Метил-2-(ундекан-2-ил)-4H-[1,3]диоксино[4,5-с]пиридин-5-карбальдегида (IVg) (смесь двух диастереомеров, 1:1)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IIIg (1.68 г, 5.00 ммоль). Выход продукта 69% (1.15 г), желтое маслообразное вещество. Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.85 (т, 6Н, 3JHH=6.6 Гц, 2(СНСН(СН3)(СН2)8СН3)), 1.01-1.07 (м, 6Н, СНСН(СН3)(СН2)8СН3), 1.16-1.36 (м, 28Н, СНСН(СН3)(СН2)8СН3), 1.37-1.47 (м, 2Н, СНСН(СН3)(СН2)8СН3), 1.58-1.70 (м, 2Н, СНСН(СН3)(СН2)8СН3), 1.88-1.99 (м, 2Н, 2(СНСН(СН3)(СН2)8СН3)), 2.5 (с, 6Н, 2СН3), 4.83 (д, Н, 3JHH=4.5 Гц, СНСН(СН3)(СН2)8СН3), 4.84 (д, Н, 3JHH=4.5 Гц, СНСН(СН3)(СН2)8СН3), 5.11, 5.28 (АВ, 1H, 2JHH=17.9, СН2О), 5.12, 5.28 (АВ, 2Н, 2JHH=17.6 Гц, CH2O), 8.45 (с, 2Н, 2СН), 10.00 (с, 2Н, 2С(O)Н). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 13.41 (с, СН3), 13.63 (с, СН3), 13.73 (с, СН3), 14.21 (с, СН3), 19.47 (с, СН3), 19.52 (с, СН3), 22.78 (с, 2(СНСН(СН3)(СН2)8СН3)), 26.99 (с, (СНСН(СН3)(СН2)8СН3)), 27.03 (с, (СНСН(СН3)(СН2)8СН3)), 29.43 (с, 2(СНСН(СН3)(СН2)8СН3)), 29.81 (с, 2(СНСН(СН3)(СН2)8СН3)), 30.10 (с, 2(СНСН(СН3)(СН2)8СН3)), 30.62 (с, 2(СНСН(СН3)(СН2)8СН3)), 30.97 (с, 2(СНСН(СН3)(СН2)8СН3)), 32.00 (с, 2(СНСН(СН3)(СН2)8СН3)), 37.21 (с, СНСН(СН3)(СН2)8СН3), 37.26 (с, СНСН(СН3)(СН2)8СН3), 66.04 (с, 2CH2O), 102.70 (с, 2СНСН(СН3)(СН2)8СН3), 126.44 (с, 2CPyr), 128.58 (с, CPyr), 128.59 (с, CPyr), 146.96 (с, 2СН), 148.64 (с, CPyr), 148.68 (с, CPyr), 154.08 (с, CPyr), 154.12 (с, CPyr), 191.88 (с, 2С(O)Н). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 334.2377. C20H32NO3, вычислено [М+Н] 334.2377.
На третьей стадии получают заявленные соединения I.
Общая методика получения соединений I.
К раствору фосфониевой соли V (1.00 г, 2.56 ммоль) в 30 мл хлористого метилена последовательно прибавляют альдегид IV (2.56 ммоль) и триэтиламин (1.36 мл, 9.80 ммоль), после чего реакционную смесь перемешивают в течение 72 часов при 70°С в закрытом сосуде. Растворитель удаляют в вакууме, сухой остаток растворяют в этилацетате (50 мл), нерастворимый осадок трифенилфосфиноксида отфильтровывают, продукт очищают с помощью колоночной хроматографии (элюент - диэтиловый эфир).
Пример 8. Получение (E)-4-(2,2,8-Триметил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)бут-3-ен-2-она (Ia)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVa (0.53 г, 2.56 ммоль). Выход продукта 60% (0.38 г), белые кристаллы, Т.пл. 86°С. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.55 (с, 6Н, С(СН3)2), 2.36 (с, 3Н, СН3), 2.41 (с, 3Н, СН3), 4.90 (с, 2Н, CH2O), 6.64, 7.36 (АВ, 2Н, 3JHH=16.1 Гц, СН=СН), 8.25 (с, 1Н, СН). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 18.95 (с, СН3), 24.76 (с, С(СН3)2), 28.54 (с, С(O)СН3), 59.10 (с, CH2O), 99.93 (с, С(СН3)2), 124.46 (с, CPyr), 125.19 (с, CPyr), 129.15 (с, СН), 135.78 (с, СН), 138.94 (с, СН), 146.03 (с, CPyr), 149.87 (с, CPyr), 197.48 (с, С(O)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 248.1281. C14H18NO3, вычислено [М+Н] 248.1281.
Пример 9. Получение (E)-4-(2-Этил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)бут-3-ен-2-она (Ib)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVb (0.53 г, 2.56 ммоль). Выход продукта 70% (0.44 г), белые кристаллы, Т.пл. 86°С. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.05 (т, 3Н, 3JHH=7.5 Гц, СНСН2СН3), 1.83-1.93 (м, 2Н, CHCH2CH3), 2.33 (с, 3Н, СН3), 2.42 (с, 3Н, СН3), 4.92 (т, 1H, 3JHH=5.2 Гц, СНСН2СН3), 4.93, 4.98 (АВ, 2Н, 2JHH=15.8 Гц, CH2O), 6.60, 7.31 (АВ, 2Н, 3JHH=16.1 Гц, СН=СН), 8.24 (с, 1H, СН). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 7.85 (с, СНСН2СН3), 18.77 (с, СН3), 27.51 (с, СНСН2СН3), 28.51 (с, С(O)СН3), 64.55 (с, CH2O), 100.72 (с, СНСН2СН3), 124.81 (с, CPyr), 126.76 (с, CPyr), 129.22 (с, СН), 135.63 (с, СН), 139.53 (с, СН), 147.79 (с, CPyr), 149.44 (с, CPyr), 197.38 (с, С(O)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 248.1281. C14H18NO3, вычислено [М+Н] 248.1281.
Пример 10. Получение (E)-4-(8-Метил-2-пропил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)бут-3-ен-2-она (Ic)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVc (0.57 г, 2.56 ммоль). Выход продукта 76% (0.51 г), белые кристаллы, Т.пл. 83°С. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.00 (т, 3Н, 3JHH=7.4 Гц, СН(СН2)2СН3), 1.52-1.61 (м, 2Н, СНСН2СН2СН3), 1.79-1.93 (м, 2Н, СНСН2СН2СН3), 2.35 (с, 3Н, СН3), 2.44 (с, 3Н, СН3), 4.95, 5.00 (АВ, 2Н, 2JHH=15.8 Гц, CH2O), 5.00 (т, 1H, 3JHH=5.2 Гц, СН(СН2)2СН3), 6.62, 7.33 (АВ, 2Н, 3JHH=16.2 Гц, СН=СН), 8.27 (с, 1H, СН). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 14.00 (с, СН(СН2)2СН3), 17.05 (с, СНСН2СН2СН3), 18.85 (с, СН3), 28.58 (с, С(О)СН3), 36.29 (с, СНСН2СН2СН3), 64.61 (с, CH2O), 99.88 (с, СН(СН2)2СН3), 124.86 (с, CPyr), 126.84 (с, CPyr), 129.25 (с, СН), 135.67 (с, СН), 139.57 (с, СН), 147.87 (с, CPyr), 149.50 (с, CPyr), 197.44 (с, С(O)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 262.1438. C15H20NO3, вычислено [М+Н] 262.1438.
Пример 11. Получение (E)-4-(2-Бутил-8-метил-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)бут-3-ен-2-она (Id)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVd (0.60 г, 2.56 ммоль). Выход продукта 60% (0.42 г), белые кристаллы, Т.пл. 72°С. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 0.92 (т, 3Н, 3JHH=7.2 Гц, СН(СН2)3СН3), 1.33-1.42 (м, 2Н, СН(СН2)2СН2СН3), 1.45-1.52 (м, 2Н, CHCH2CH2CH2CH3), 1.78-1.91 (м, 2Н, СНСН2(СН2)2СН3), 2.32 (с, 3Н, СН3), 2.40 (с, 3Н, СН3), 4.91, 4.97 (АВ, 2Н, 2JHH=15.8 Гц, CH2O), 4.96 (т, 1Н, 3JHH=5.2 Гц, СН(СН2)3СН3), 6.58, 7.29 (АВ, 2Н, 2JHH=16.2 Гц, СН=СН), 8.23 (с, 1H, СН). Спектр ЯМР 13С {1H} (CDCl3) δ, м.д.: 14.01 (с, СН(СН2)3СН3), 18.78 (с, СН3), 22.49 (с, С СН(СН2)2СН2СН3), 25.70 (с, СНСН2СН2СН2СН3), 28.47 (с, С(О)СН3), 33.93 (с, СНСН2(СН2)2СН3), 64.53 (с, СН2О), 100.01 (с, СН(СН2)3СН3), 124.78 (с, CPyr), 126.75 (с, CPyr), 129.18 (с, СН), 135.60 (с, СН), 139.51 (с, СН), 147.79 (с, CPyr), 149.41 (с, CPyr), 197.34 (с, С(О)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 276.1594. C16H22NO3, вычислено [М+Н] 276.1594.
Пример 12. Получение (E)-4-(8'-Метил-4'H-спиро[циклопентан-1,2'-[1,3]диоксино[4,5-с]пиридин]-5'-ил)бут-3-ен-2-она (Ie)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVe (0.60 г, 2.56 ммоль). Выход продукта 80% (0.56 г), белые кристаллы, Т.пл. 77°С. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 1.76-1.87 (м, 4Н, спиро-С5Н8), 1.89-2.03 (м, 4Н, спиро-С5Н8), 2.36 (с, 3Н, СН3), 2.42 (с, 3Н, СН3), 4.94 (с, 2Н, CH2O), 6.64, 7.36 (АВ, 2Н, 3JHH=16.2 Гц, СН=СН), 8.26 (с, 1H, СН). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 18.88 (с, СН3), 23.64 (с, спиро-С5Н8), 28.55 (с, С(O)СН3), 36.17 (с, спиро-С5Н8), 60.50 (с, CH2O), 111.28 (с, спиро-С5Н8), 124.62 (с, CPyr), 125.99 (с, CPyr), 129.17 (с, СН), 135.77 (с, СН), 139.14 (с, СН), 146.58 (с, CPyr), 149.95 (с, CPyr), 197.50 (с, С(O)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 274.1438. C16H20NO3, вычислено [М+Н] 274.1438.
Пример 13. Получение (E)-4-(8'-Метил-4'H-спиро[циклогексан-1,2'-[1,3]диоксино[4,5-с]пиридин]-5'-ил)бут-3-ен-2-она (If)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVf (0.63 г, 2.56 ммоль). Выход продукта 88% (0.65 г), белые кристаллы, Т.пл. 80°С. Спектр ЯМР 1H (CDCl3) δ, м.д.: 1.39-1.55 (м, 2Н, спиро-С6Н10), 1.55-1.66 (м, 4Н, спиро-С6Н10), 1.66-1.77 (м, 2Н, спиро-С6Н10), 1.78-1.88 (м, 2Н, спиро-С6Н10), 2.34 (с, 3Н, СН3), 2.43 (с, 3Н, СН3), 4.88 (с, 2Н, CH2O), 6.62, 7.34 (АВ, 2Н, 3JHH=16.2 Гц, СН=СН), 8.23 (с, 1H, СН). Спектр ЯМР 13С {1Н} (CDCl3) δ, м.д.: 18.85 (с, СН3), 22.53 (с, спиро-С6Н10), 25.24 (с, спиро-С6Н10), 28.46 (с, С(O)СН3), 33.38 (с, спиро-С6Н10), 58.39 (с, CH2O), 100.21 (с, спиро-С6Н10), 124.44 (с, CPyr), 125.80 (с, CPyr), 129.08 (с, СН), 135.79 (с, СН), 138.88 (с, СН), 145.80 (с, CPyr), 149.79 (с, CPyr), 197.49 (с, С(O)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 288.1594. C17H22NO3, вычислено [М+Н] 288.1594.
Пример 14. Получение (E)-4-(8-Метил-2-(ундекан-2-ил)-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)бут-3-ен-2-она (Ig) (смесь двух диастереомеров, 1:1)
Реакцию проводят согласно вышеприведенной общей методике с использованием соединения IVg (0.85 г, 2.56 ммоль). Выход продукта 80% (0.77 г), белые кристаллы, Т.пл. 77°С. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 0.87 (т, 6Н, 3JHH=6.6 Гц, 2(СНСН(СН3)(СН2)8СН3)), 1.05 (д, 3Н, 3JHH=6.2 Гц, СНСН(СН3)(СН2)8СН3), 1.06 (д, 3Н, 3JHH=6.2 Гц, СНСН(СН3)(СН2)8СН3), 1.19-1.48 (м, 30Н, CHCH(СН3)(СН2)8СН3), 1.55-1.70 (м, 2Н, СНСН(СН3)(СН2)8СН3), 1.88-1.99 (м, 2Н, 2(СНСН(СН3)(СН2)8СН3)), 2.36 (с, 6Н, 2СН3), 2.45 (с, 6Н, 2СН3), 4.82 (д, 2Н, 3JHH=4.3 Гц, 2(СНСН(СН3)(СН2)8СН3)), 4.98 (с, 4Н, 2CH2O), 6.62, 7.34 (2АВ, 4Н, 3JHH=16.1 Гц, 2СН=СН), 8.26 (с, 2Н, 2СН). Спектр ЯМР 13С {1H} (CDCl3) δ, м.д.: 13.69 (с, СН3), 13.79 (с, СН3), 14.24 (с, 2СН3), 18.82 (с, СН3), 18.86 (с, СН3), 22.81 (с, 2(СНСН(СН3)(СН2)8СН3)), 27.03 (с, 2(СНСН(СН3)(СН2)8СН3)), 28.57 (с, 2(С(O)СН3)), 29.47 (с, 2(СНСН(СН3)(СН2)8СН3)), 29.73 (с, 2(СНСН(СН3)(СН2)8СН3)), 29.96 (с, 2(СНСН(СН3)(СН2)8СН3)), 31.05 (с, 2(СНСН(СН3)(СН2)8СН3)), 31.21 (с, 2(СНСН(СН3)(СН2)8СН3)), 32.03 (с, 2(СНСН(СН3)(СН2)8СН3)), 37.26 (с, СНСН(СН3)(СН2)8СН3), 37.31 (с, СНСН(СН3)(СН2)8СН3), 64.82 (с, 2CH2O), 102.67 (с, СНСН(СН3)(СН2)8СН3), 102.71 (с, СНСН(СН3)(СН2)8СН3), 124.87 (с, 2CPyr), 126.89 (с, 2CPyr), 129.26 (с, 2СН), 135.80 (с, 2СН), 139.55 (с, 2СН), 148.01 (с, CPyr), 148.09 (с, CPyr), 149.56 (с, CPyr), 149.60 (с, CPyr), 197.45 (2С(O)СН3). Масс-спектр (HRMS-ESI): найдено [М+Н]+ 374.2690. C23H36NO3, вычислено [М+Н] 374.2690.
Исследование противоопухолевой активности и безопасности in vitro производных пиридоксина и ацетона общей формулы I
Основополагающим показателем, характеризующим безопасность заявленных соединений общей формулы I, является терапевтический индекс, представляющий собой соотношение индексов СС50 к IC50. Терапевтический индекс отражает действительный уровень безопасности заявленных соединений общей формулы I, при этом, чем выше его значение, тем более безопасным является данное соединение.
Исследование цитотоксичности заявленных соединений в отношении злокачественных новообразований человека (что является показателем противоопухолевой активности заявленных соединений) проводили на следующих линиях клеток (NCI-60) в соответствии с Международной классификацией болезней МКБ-10, класс «Злокачественные новообразования»:
- Злокачественные новообразования органов пищеварения (колоректальной аденокарциномы НСТ-15 (GSM136289), колоректальной карциномы НСТ-116 (GSM136288));
- Злокачественные новообразования органов дыхания и грудной клетки (немелкоклеточной карциномы легкого NCI-H322M (GSM136307));
- Меланома и другие злокачественные новообразования кожи (меланомы М-14 (GSM136320));
- Злокачественное новообразование молочной железы (аденокарцинома молочной железы MCF-7 (АТСС® НТВ-22™), аденокарцинома молочной железы, эстроген негативная MDA-MB-231 (АТСС® НТВ-26™);
- Злокачественные новообразования женских половых органов (аденокарциномы яичников OVCAR-4 (GSM136312));
- Злокачественные новообразования мужских половых органов (аденокарциномы простаты РС-3 (GSM136316));
- Злокачественные новообразования мочевых путей (карциномы почки А-498 (GSM136294));
- Злокачественные новообразования глаза, головного мозга и других отделов ЦНС (глиобластомы SNB-19 (GSM136283)).
То есть исследована противоопухолевая активность заявленных соединений в отношении 10 видов клеток злокачественных новообразований, относящихся к 8 классам из 15 по МКБ-10. Исследования по отношению к остальным классам злокачественных новообразований по МКБ-10 заявителем не проведены ввиду отсутствия опухолевого материала (культур клеток) для исследования, однако, на основании полученных заявителем результатов, возможно предположить, что противоопухолевая активность заявленных соединений распространяется на все 15 классов злокачественных новообразований по МКБ-10.
Исследование цитотоксичности заявленных соединений в отношении нормальных или условно нормальных клеток человека (что является показателем токсической безопасности заявленных соединений) проводили на нормальных клетках - фибробластах кожи человека (HSF) и на условно нормальных эмбриональных клетках почки человека (HEK-293).
Далее описан способ получения и оценки исследуемых клеток известными методами.
Линии клеток культивируют в среде α-МЕМ (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (РАА, Австралия), L-глутамина и 1% пенициллина-стрептомицина в атмосфере 5% СО2 при 37°С до образования монослоя. Для получения клеточной суспензии монослой клеток трипсинизируют с последующей инактивацией трипсина добавлением среды α-МЕМ с сывороткой. Далее клетки осаждают центрифугированием при 500 g в течение 5 минут. Осадок ресуспендируют в фосфатно-солевом буфере пипетированием.
Оценку жизнеспособности клеток и подсчет их концентрации производят после окраски аликвоты клеток 0.4% раствором трипанового синего в соотношении 1:1 в камере гемоцитометра Нейбауэра. В эксперименте используют суспензии с количеством жизнеспособных клеток не менее 90%.
Чувствительность исследуемых клеток в отношении синтезированных соединений оценивают с использованием пролиферативного МТТ-теста (3-(4,5-Диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) (Promega, США) по описанной ниже методике. В качестве препарата сравнения используют доксорубицин.
Клетки (2 тыс. клеток в лунке) культивируют в 180 мкл питательной среды в стандартных условиях в 96-луночном планшете в течение суток. Далее добавляют 20 мкл стокового раствора и инкубируют в стандартных условиях в течение 72 часов. Далее среду с препаратами заменяют на питательную среду (80 мкл) и добавляют по 20 мкл МТТ-реагента (5 мг/мл), инкубируют в течение 3.5 часов, затем убирают среду и добавляют 100 мкл ДМСО. По истечении 10 минут измеряют оптическую плотность клеточных растворов при 555 нм (референтная длина волны - 650 нм) на планшетном ридере TECAN (Швейцария).
Результаты обрабатывают с помощью программного обеспечения OriginPro 8. Рассчитывают процент жизнеспособных клеток в каждой опытной лунке относительно лунок контроля, не подвергавшемуся действию препаратов, жизнеспособность которых принимают за 100%. Далее строят графики зависимости жизнеспособности клеток, выражаемые в процентах, относительно десятичного логарифма концентраций добавленных соединений. Полученную кривую подвергают анализу "Fit Sigmoidal - DoseResp" в программном обеспечении OriginPro 8, находят логарифм концентрации в точке 50% жизнеспособности клеток. По обратному логарифму находят концентрацию вещества, при которой происходит ингибирование роста клеток на 50%, т.е. полумаксимальное ингибирование (далее IC50) (Р<0.05) (Р - это уровень статистической ошибки, в данном случае меньше 5%). Результаты представлены в Таблице 1 на Фиг. 1 и Таблице 2 на Фиг. 2.
В Таблице 1 на Фиг. 1 представлены показатели цитотоксичности in vitro соединений общей формулы I. Таблица состоит из четырех столбцов:
- в первом столбце приведены заявленные соединения Ia-Ig, в последней строке приведено известное соединение - доксорубицин;
- во втором столбце приведены данные IC50 соединений Ia-Ig на клетках аденокарциномы молочной железы MCF-7, что отражает противоопухолевую активность заявленных соединений в отношении злокачественных новообразований. Чем меньше значение IC50, тем соединение имеет большую противоопухолевую активность;
- в третьем столбце приведены данные СС50 соединений Ia-Ig на условно нормальных эмбриональных клетках почки человека HEK-293, что отражает безопасность заявленных соединений по отношению к нормальным клеткам. Чем выше значение IC50, тем соединение имеет большую безопасность;
- в четвертом столбце приведены значения терапевтического индекса для заявленных соединений Ia-Ig, представляющие из себя отношение IC50 (HEK-293) к IC50 (MCF-7). Терапевтический индекс является основополагающим показателем, так как отражает общий уровень безопасности веществ - чем выше его значение, тем более безопасным является данное соединение.
Из представленных в Таблице 1 (Фиг. 1) экспериментальных данных видно, что значения IC50 заявленных соединений для аденокарциномы молочной железы MCF-7 сопоставимы по сравнению с доксирубицином для соединений Id, If, Ig, а в остальных случаях имеют более высокие значения.
При этом значения СС50 заявленных соединений для условно нормальных эмбриональных клеток почки человека HEK-293 превышают показатель доксорубицина в 2.9-35.6 раза (в среднем - в 19.3 раза). Это свидетельствует о том, что заявленные соединения значительно безопаснее известного средства доксорубицин и, вследствие этого, их (заявленные соединения) возможно применять для лечебных целей в значительно больших количествах, чем известное средство.
Это подтверждается приведенными в Таблице 1 (Фиг. 1) значениями терапевтического индекса, который является решающим показателем для определения комплексной эффективности заявленного технического решения. Так, терапевтический индекс доксорубуцина равен 0.8 по сравнению с терапевтическим индексом, находящимся в диапазоне 1.3-17.5 для заявленных соединений (в среднем - 9.4).
Таким образом, на основе анализа величины терапевтического индекса можно сделать вывод, что уровень безопасности заявленных соединений в 1.6-21.9 раза выше, чем у известного соединения доксорубуцина (в среднем - в 11.8 раза).
Исходя из вышеизложенного, на основании данных, приведенных в Таблице 1 (Фиг. 1), можно сделать вывод, что все заявленные соединения общей формулы I являются более эффективными, а именно безопасными в сравнении с доксорубицином и действующими более селективно в отношении злокачественных новообразований.
В Таблице 2 на Фиг. 2 представлены данные цитотоксичности (СС50 и IC50, мкМ) наиболее активных соединений Ib и If, выполненные на десяти линиях опухолевых клеток (исследована противоопухолевая активность) и на двух линиях нормальных (HSF) и условно нормальных (HEK-293) клеток (исследована безопасность) соответственно.
Из представленных в Таблице 2 (Фиг. 2) данных следует, что заявленные соединения Ib и If по отношению к нормальным (HSF) и условно нормальным (HEK-293) клеткам действуют в больших концентрациях, чем доксорубицин, следовательно, являются более безопасными.
Так, СС50 заявленных веществ на фибробластах кожи HSF больше СС50 доксорубицина на тех же клетках в диапазоне от 7.1 до 8.6 раза, а в случае клеток HEK-293 - от 15.9 до 35.6 раза.
В случае противоопухолевой активности соединения Ib и If как минимум не уступают доксорубицину, а в некоторых случаях и превосходят его. Например, IC50 соединения If превосходит IC50 доксорубицина на 8 из 10 линиях опухолевых клеток.
Таким образом, как видно из представленных данных, протестированные соединения общей формулы I обладают выраженной противоопухолевой активностью в отношении злокачественных новообразований, сравнимой с доксорубицином, но при этом являются значительно более безопасными по отношению к нормальным клеткам человека (HSF) и условно нормальным клеткам человека (HEK-293).
Терапевтический индекс in vitro соединений общей формулы I по сравнению с применяемым в химиотерапии опухолевых заболеваний доксорубицином имеет большее значение и находится в диапазоне от 1.6 до 21.9 раз (в среднем 11.8 раза), то есть уровень безопасности заявленных соединений значительно выше, чем у известного соединения доксорубуцина.
Исследование острой токсичности in vivo производных пиридоксина и ацетона общей формулы I
В Таблице 3 на Фиг. 3 представлены данные острой токсичности (LD50, мг/кг) на примере соединения Ib - одного из наиболее безопасных заявляемых соединений. Опыты проведены на белых беспородных мышах (самках) массой 20-28 г. Препарат вводили внутривенно.
При введении препарата в дозе 10 мг/кг у животных выявлялось угнетение, которое через 2-3 минуты исчезало. В течение всего периода исследования на протяжении 14 дней состояние у животных оценивалось как удовлетворительное. Мыши активно передвигались по клетке, принимали корм и воду. В течение всего эксперимента падеж не наблюдался.
При введении препарата в дозе 50 мг/кг у мышей наблюдались угнетение, моргание, атаксия, беспорядочное передвижение по клетке, тремор мышц ушей и спины, затрудненное дыхание. Через 5 минут наблюдалось улучшение состояния подопытных животных. Через 1-1.5 часа мыши начинали активно передвигаться по клетке. Через 2 часа начинали принимать корм и воду. В течение всего эксперимента падеж не наблюдался.
При введении тестируемого препарата в дозе 60 мг/кг наблюдались угнетение, моргание, атаксия, тремор, затрудненное дыхание, бронхоспазм, у некоторых судороги и саливация. Через 2-3 минуты после введения препарата пало 2 мыши. Симптомы интоксикации у выживших животных начинали проходить через 1-2 часа, они начинали активно передвигаться по клетке и принимать корм и воду.
При введении препарата в дозе 65 мг/кг у подопытных животных наблюдались угнетение, моргание, атаксия, затрудненное дыхание, бронхоспазм, саливация, судороги. Через 2-3 минуты пало 3 мыши из 8. Симптомы интоксикации у выживших животных начинали проходить через 1-2 часа, они начинали активно передвигаться по клетке и принимать корм и воду.
При введении тестируемого препарата в дозе 70 мг/кг наблюдались угнетение, моргание, атаксия, тремор, затрудненное дыхание, бронхоспазм, судороги. Через 1-2 минуты пали все подопытные мыши.
При этом следует отметить, что у доксорубицина значение острой токсичности LD50 при внутривенном пути введения составляет 12 мг/кг.
При этом следует акцентировать, что значение LD50 при внутривенном пути введения для заявленного соединения Ib составляет около 65 мг/кг.
Таким образом, заявленное соединение Ib при внутривенном введении почти в 5.5 раза менее токсично доксорубицина при исследовании на мышах.
Из вышеизложенного можно сделать общий вывод, что заявленные соединения на основе производных пиридоксина и ацетона являются новыми высокоактивными и безопасными противоопухолевыми препаратами в отношении клеток преимущественно злокачественных новообразований.
На основании полученных результатов представляется возможным предположить, что противоопухолевая активность заявленных соединений распространяется не только на исследованные 8 классов, а на все 15 классов злокачественных новообразований по МКБ-10.
Таким образом, заявителем решена поставленная задача и достигнут заявленный технический результат, а именно созданы принципиально новые соединения - производные пиридоксина и ацетона, обладающие выраженной активностью по отношению преимущественно к клеткам злокачественных новообразований при одновременно высокой токсической безопасности, которые расширяют арсенал известных средств указанного назначения и обеспечивают возможность вывода на рынок новых противоопухолевых средств, не имеющих аналогов в мире.
Заявленные соединения проявляют сопоставимую (или превосходящую) с известными в мире цитостатиками противоопухолевую активность в отношении широкого ряда клеток преимущественно злокачественных новообразований и характеризуются значительно большей безопасностью по отношению к условно нормальным и нормальным клеткам человека, что позволяет создать новые высокоэффективные и безопасные противоопухолевые лекарственные средства, тем самым улучшив качество жизни пациентов.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как заявителем получены новые соединения с неизвестной ранее структурой, обладающие высокой противоопухолевой активность по отношению к клеткам преимущественно злокачественных новообразований, со значением терапевтического индекса, превосходящим таковое у известного средства - доксорубицина - в среднем в 11.8 раза, что не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», предъявляемому к изобретениям, так как может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.