Результат интеллектуальной деятельности: Новые глипролины с ноотропной, антигипоксической, нейропротективной и анксиолитической активностью
Вид РИД
Изобретение
Область изобретения
Изобретение относится к новым N-фенилацетилзамещенным глипролинам общей формулы:
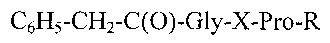
где Х – L- или D-конфигурация; R - ОСН3, ОС2Н5, NH2, ОН, NHCH3.
Новые соединения обладают нейропсихотропной активностью, в том числе ноотропной, нейропротективной, антигипоксической и анксиолитической.
Эти соединения могут быть использованы в качестве фармацевтических агентов; средств для лечения нарушения когнитивных функций, тревожных состояний и нейродегенеративных расстройств.
Уровень техники
Ранее в НИИ фармакологии имени В.В. Закусова в результате целенаправленного создания лекарственных средств дипептидной природы на основе структуры известных непептидных препаратов был создан оригинальный ноотропный препарат ноопепт - этиловый эфир N-фенилацетил-L-пролилглицина (ГВС-111) (Патент РФ №2119496 (1998); US Patent №5,439,930 (1995); Gudasheva Т.А. et al., Eur. J. Med. Chem. 1996). В качестве основного метаболита ноопепта in vivo был обнаружен циклопролилглицин (ЦПГ) (Gudasheva Т.А. et al., 1997), который, по-видимому, образуется в результате энзиматического отщепления фенилацетильного радикала с последующей внутримолекулярной циклизацией.
ЦПГ представляет собой эндогенное соединение, идентифицированное в мозге крыс (Gudasheva Т.А. et al., 1996). Позже было показано, что его содержание в структурах и распределение в субклеточных фракциях ткани мозга крыс неравномерны. Так, почти 60% ЦПГ определяется в ядерной фракции мозга крыс, в то же время его доли в синаптосомальной и митохондриальной фракциях существенно ниже (Гудашева Т.А. и др., 2010). Также описано достоверное различие содержания ЦПГ в мозге мышей линий с различной реакцией на эмоционально-стрессовое воздействие (С.Б. Середенин и др., 2002). Точный механизм образования ЦПГ неизвестен, но в работе новозеландских ученых (Guan et al., 2009) было высказано предположение, что он может быть метаболитом N-концевого трипептида инсулиноподобного фактора роста (IGF-1) Gly-Pro-Glu (GPE).
Для ЦПГ в экспериментах на животных были выявлены антиамнестическая, анксиолитическая, антигипоксическая и нейропротективная активности, которые проявляются в диапазоне доз от 0,05 до 1 мг/кг.
Антиамнестическая активность ЦПГ была выявлена на крысах в тестах условного рефлекса пассивного избегания (УРПИ) и условного рефлекса активного избегания (УРАИ) в дозах 0,1-1,0 мг/кг при внутрибрюшинном введении. (Т.А. Гудашева и др., 1999; Gudasheva Т.А et al, 2001).
Анксиолитическая активность ЦПГ была показана при внутрибрюшинном введении в тесте приподнятого крестообразного лабиринта на крысах в дозах 0,05-0,10 мг/кг (Т.А. Гудашева и др., 2001) и в тесте открытого поля в условиях яркого освещения на мышах в дозах 0,01-0,10 мг/кг (С.Б. Середенин и др. 2002).
Нейропротективная активность ЦПГ была показана in vitro на различных клеточных культурах и разных моделях повреждения в диапазоне концентраций 10-8-10-5 М (K.R.C. Prakash et al. 2002, Колясникова К.Н. и др. 2012, Loi Н. Tran US Patent 7232798) В патенте США №7232798 описана актипаркинсоническая активность ЦПГ (1 мг/кг внутрибрюшинно) на модели паркинсонического синдрома у крыс, вызванного односторонним введением 6-гидроксидофамина в стриатум. В международной заявке РСТ WO 03/039487 описана нейропротективная активность ЦПГ (0,02-2,00 мкг при внутримозговом введении) на модели ишемического гипоксического повреждения у крыс, вызванного односторонней перевязкой сонных артерий с последующей асфиксией.
Для ЦПГ описано стимулирующее влияние на нейрогенез in vitro (С. Barlow et al., US Patent Appl. 2010/0216734) и иммуностимулирующая активность на рыбах в дозе 20 мг/кг внутрибрюшинно (Gao-Xue Wang et al. 2011).
Сущность изобретения
Целью изобретения являлся синтез новых замещенных дипептидов с потенциальной возможностью превращаться in vivo в циклический дипептид - цикло-пролилглицин, и, как следствие, обладающих анксиолитической, ноотропной, антигипоксической, нейропротективной и другими активностями, характерными для ЦПГ.
Образование ЦПГ будет легче происходить при наличии цисоидной пептидной связи в исходном линейном пептиде, доля которой выше в структуре Gly-Pro, нежели в Pro-Gly.
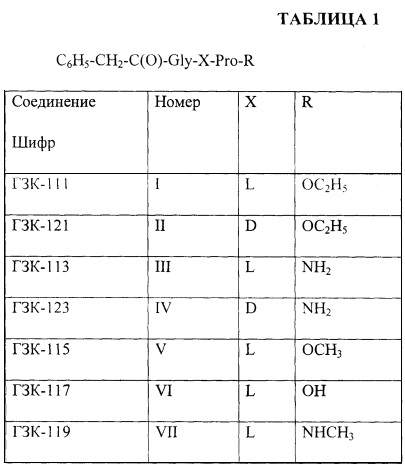
В связи с этим поставленная цель достигается синтезом соединений общей формулы
C6H5-CH2-C(O)-Gly-X-Pro-R
где Х=L или D конфигурация; R=ОСН3 или ОС2Н5 или NH2 или ОН или NHCH3.
Примерами предлагаемых соединений могут служить следующие:
I этиловый эфир N-фенилацетилглицил-L-пролина
II этиловый эфир N-фенилацетилглицил-D-пролина
III амид N-фенилацетилглицил-L-пролина
IV амид N-фенилацетилглицил-D-пролина
V N-фенилацетилглицил-L-пролин
VI метиловый эфир N-фенилацетилглицил-L-пролина
VII метиламид N-фенилацетилглицил-L-пролина
Шифры соединений изобретения иллюстрирует таблица 1.
Приведенные выше соединения получали классическими способами пептидного синтеза в растворе, преимущественно методом смешанных ангидридов ("The Peptides". Vol. 1. 1965 (Academic Press), E. Schroeder, K. Lubke, или в "The Peptides", Vol. 1, 1979 (Academic Press) E. Cross, L. Meinhofen). В качестве карбоксильной компоненты использовали фенилацетилглицин, а в качестве аминокомпоненты - метиловый или этиловый эфир пролина.
N-ацильные производные получали по реакции Шоттен-Баумана с использованием хлорангидрида фенилуксусной кислоты (Winitz М et al., 1956).
Амиды дипептидов получали обработкой метиловых или этиловых эфиров дипептидов аммиаком в метаноле. Метиламид получали аминолизом соответствующего эфира дипептида.
Дипептид с открытой карбоксильной группой получали гидролизом 1 н щелочью низкоалкильного эфира соответствующего дипептида.
Примеры осуществления изобретения
В примерах используются следующие сокращения:
DMF - диметилформамид
DMSO - диметилсульфоксид
IBCF - изобутилхлорформиат
Gly - глицил
NMM - N-метилморфолин
Pro - пролил
Phac - фенилацетил
ТСХ - тонкослойная хроматография
ЯМР - ядерный магнитный резонанс
Температуру плавления определяли на приборе Optimelt МРА100 (Stanford Research Systems, Великобритания) в открытых капиллярах без корректировки.
Удельное оптическое вращение регистрировали на автоматическом поляриметре ADP 440 Polarimeter (Bellingham + Stanley Ltd., Великобритания).
1Н-ЯМР-спектры регистрировали в шкале δ, м.д., на спектрометре Bruker АС-250 (Германия) в растворах DMSO-d6, используя в качестве внутреннего стандарта тетраметилсилан.
Для обозначения резонансных сигналов использовали следующие сокращения: с - синглет, д - дублет, т - триплет, кв - квадруплет, м - мультиплет.
Тонкослойную хроматографию (ТСХ) выполняли на пластинах DC Kieselgel 60 G/F254 (Merck, Германия), хроматограммы проявляли в парах йода или ультрафиолетовых лучах.
Элементный анализ проводили на приборе для определения углерода и водорода с четырьмя электрическими печами (600-900°С, тип МА-Г/6Р, завод ЛЭТО, Россия) в токе кислорода и на аппарате для определения азота с тремя такими же электрическими печами в токе углекислого газа.
ПРИМЕР1. Получение этилового эфира N-фенилацетилглицил-L-пролина, N-Phac-Gly-L-Pro-OEt (I).
а) N-фенилацетилглицин, N-Phac-Gly-OH.
К раствору 7,50 г (0,1 моль) глицина в 25 мл 4 н NaOH при -10°С при интенсивном перемешивании прибавляли 13,24 мл (0,1 моль) фенилацетилхлорида и 25 мл 4 н NaOH. Далее реакционную смесь перемешивали при охлаждении в течение 30 мин, потом снимали внешнее охлаждение и экстрагировали примеси и непрореагировавший хлорангидрид этилацетатом (3×15 мл). Затем раствор подкисляли 4 н HCl до pH 2-3 по универсальному индикатору, выпавший осадок отфильтровывали. Получали 5,83 г (30%) N-фенилацетилглицина с т. пл. 143-144°С. Rf 0,8 (бутанол-уксусная кислота-вода 4:1:1).
Спектр 1Н-ЯМР (DMSO-d6+CF3COOD) δ, м.д.: 3,47 (2Н, с, CH2Ar), 3,76 (2Н, д, СН2 Gly), 7,27 (5Н, м, ArH), 8,40 (1H, т, NH Gly).
Лит. данные [D.W. Young et al., 1977]: т.пл. 138-143°С.
б) Хлоргидрат этилового эфира L-пролина, L-Pro-OEt⋅HCl
К 60 мл абсолютного этанола, охлажденного до -20°С, прибавляли по каплям 2,5 мл (34,64 ммоль) тионилхлорида и порциями вносили 2,00 г (17,32 ммоль) L-пролина. Далее реакционную смесь перемешивали 2 ч при -5°С и 2 ч при комнатной температуре. Растворитель удаляли в вакууме; эту операцию повторяли дважды, каждый раз добавляя 30 мл абсолютного этанола. Получали 2,40 г (77%) хлоргидрата этилового эфира L-пролина в виде масла. Rf 0,75 (изопропиловый спирт - водный аммиак 7:3). [α]23D -43° (с 3, этанол). Спектр 1Н-ЯМР (DMS-d6) δ, м.д.: 1,19 (3 Н, т, CH3CH2O), 1,8-2,1 (4 Н, м, CγH2 Pro, СβН2 Pro), 3,2 (2 Н, м, СδН2 Pro), 4,2 (2 Н, м, CH3CH2O), 4,5 (1 Н, м, CαH Pro), 9,9 (1 Н, уш. с, NH).
Лит. данные [Л.С. Назарова и др., 1984]: [α]23D -44,8° (с 3,03, этанол)
в) Этиловый эфир N-фенилацетилглицил-L-пролина,
N-Phac-Gly-L-Pro-OEt (I)
К охлажденному до -10°C раствору 1,93 г (10 ммоль) N-фенилацетилглицина в 10 мл DMF при интенсивном перемешивании одновременно прибавляли 1,4 мл (10,00 ммоль) IBCF и 1,1 мл (10,00 ммоль) NMM. После 2-3 мин перемешивания прикапывали раствор 1,79 г (10,00 ммоль) хлоргидрата этилового эфира пролина и 1,1 мл (10,00 ммоль) NMM в 15 мл DMF. Реакционную смесь перемешивали еще 30 мин при -10°С и 1 ч при комнатной температуре. Осадок отфильтровывали, фильтрат выпаривали в вакууме, остаток растворяли в CHCl3. Раствор последовательно промывали 3% NaHCO3, водой, 1н HCl и вновь водой, высушивали безводным сульфатом натрия и выпаривали. Получали 2,87 г (90%) масла оранжевого цвета, перекристаллизовывали из смеси этилацетата и эфира. Получали белые кристаллы с т.пл. 111-112°С.  =0.80, (диоксан-вода 9:1), [α]230 -90° (с 1, метанол). Рассчитано для C17H22N2O4: С=64.13%; Н=6.97%; N=8.80%. Найдено: С=64.27%; Н=7.05%; N=8.63%.
=0.80, (диоксан-вода 9:1), [α]230 -90° (с 1, метанол). Рассчитано для C17H22N2O4: С=64.13%; Н=6.97%; N=8.80%. Найдено: С=64.27%; Н=7.05%; N=8.63%.
Спектр 1Н-ЯМР (DMS-d6) δ, м.д.: 1,2 (3 Н, м, CH3CH2O), 1,8-2,1 (4 Н, м, СγН2 Pro, СβН2 Pro), 3,5 (2 Н, с, СН2С6Н5), 3,6 (2 Н, м, СδН2 Pro), 3,85 и 4,0 (2Н, 2 д.д., J 17,6, J 5,6 Гц, СαН2 Gly), 4,2 (2 Н, м, СН3СН2О), 4,5 (1 Н, м, СαН Pro), 6,4 (1 Н, д.д., J 5,6 Гц, NH), 7,3 (5Н,м, С6Н5).
ПРИМЕР 2. Получение этилового эфира N-фенилацетилглицил-D-пролина,
N-Phac-Gly-D-Pro-OEt (II)
а) Хлоргидрат этилового эфира D-пролина, D-Pro-OEt⋅HCl.
Получали аналогично Iб с использованием D-пролина. Выход 87%. [α]23D+42° (с 3, этанол). Спектр 1Н-ЯМР (DMS-d6) δ, м.д.: 1,18 (3 Н, т, CH3CH2O), 1,8-2,1 (4 Н, м, СγН2 Pro, СβН2 Pro), 3,19 (2 Н, м, СδН2 Pro), 4,2 (2 Н, м, СН3СН2О), 4,5 (1 Н, м, СαН Pro), 9,9(1 Н, уш. с, NH).
Лит. данные [Л.С. Назарова и др., 1984]: [α]23D+44,16° (с 3,03, этанол).
б) Этиловый эфир N-фенилацетилглицил-D-пролина,
N-Phac-Gly-D-Pro-OEt.
Получали аналогично Iв из N-фенилацетилглицина, полученного как описано в Iа, и хлоргидрата этилового эфира D-пролина. Выход 64%. 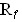 =0,80, (диоксан-вода 9:1), т.пл. 112-113°С, [α]23D+90° (с 1; метанол). Рассчитано для C17H22N2O4: С=64,13%; Н=6,97%; N=8,80%. Найдено: С=63,91%; Н=6, 90%; N=8,63%
=0,80, (диоксан-вода 9:1), т.пл. 112-113°С, [α]23D+90° (с 1; метанол). Рассчитано для C17H22N2O4: С=64,13%; Н=6,97%; N=8,80%. Найдено: С=63,91%; Н=6, 90%; N=8,63%
Спектр 1Н-ЯМР (DMS-d6) δ, м.д.: 1,2 (3Н, м, CH3CH2O), 1,85-2,2 (4Н, м, CγH2 Pro, СβН2 Pro), 3,5 (2Н, с, CH2Ar), 3,6 (2Н, м, СδН2 Pro), 3,86 и 4,0 (2Н, 2 д.д., J 17,6 Гц, J 5,6 Гц, CαH2 Gly), 4,2 (2Н, м, CH3CH2O). 4,5 (1Н, м, CαH Pro), 6,4 (1H, д.д., J 5,6 Гц, NH), 7,3 (5Н, м, Ar).
ПРИМЕР 3. Получение амида N-фенилацетилглицил-L-пролина, N-Phac-Gly-L-Pro-NH2 (III)
Раствор 0,500 г (1,57 ммоль) N-Phac-Gly-L-Pro-OEt, полученного аналогично Iв, в 10 мл насыщенного NH3 метанола оставляли плотно закрытым на 5 дней при комнатной температуре. Окончание реакции определяли с помощью ТСХ. После завершения реакции метанольный раствор концентрировали до начала выпадения осадка. Выпавший осадок отфильтровывали, промывали на фильтре метанолом и сухим эфиром, высушенным над CaCl2, перекристаллизовывали из этилового спирта. Получали 0,385 г (85%) с т.пл. 179-180°С. 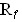 =0,35 (хлороформ-метанол 9:1). [α]23D -67° (с 1, метанол). Рассчитано для C15H19N3O3: С=62,53%; Н=6,48%; N=14,61%. Найдено: С=62,75%; Н=6,65%; N=14,40%.
=0,35 (хлороформ-метанол 9:1). [α]23D -67° (с 1, метанол). Рассчитано для C15H19N3O3: С=62,53%; Н=6,48%; N=14,61%. Найдено: С=62,75%; Н=6,65%; N=14,40%.
Спектр 1Н-ЯМР (DMS-d6) δ, м.д.: 1,7-2,1 (4Н, м, CγH2 Pro, СβН2 Pro), 3,5 (2Н, с, CH2Ar), 3,6 (2Н, м, СδН2 Pro), 3,85 и 4,0 (2Н, 2 д.д., СαН2 Gly), 4,3 (1H, д.д., СαН Pro), 7,2-7,3 (5Н, м, Ar), 6,9 и 7,2 (2Н, два с, NH2), 8.1 (1Н, т, NH).
ПРИМЕР 4. Получение амида N-фенилацетилглицил-D-пролина, N-Phac-Gly-D-Pro-NH2 (IV)
Получен аналогично III из N-Phac-Gly-D-Pro-OEt (II). Выход 65%. Т.пл. 178-180°С. [α]22D 67° (с 1, метанол). 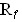 =0,35 (хлороформ-метанол 9:1). Рассчитано для C15H19N3O3⋅0,5Н2О: С=60,34%; Н=6,70%; N=14,07%. Найдено: С=60,26%; Н=6,65%; N=14,12%
=0,35 (хлороформ-метанол 9:1). Рассчитано для C15H19N3O3⋅0,5Н2О: С=60,34%; Н=6,70%; N=14,07%. Найдено: С=60,26%; Н=6,65%; N=14,12%
Спектр 1Н-ЯМР (DMS-d6) δ, м.д.: 1,7-2,1 (4Н, м, СγН2 Pro, СβН2 Pro), 3,5 (2Н, с, CH2Ar), 3,6 (2Н, м, СδН2 Pro), 3,86 и 4,0 (2Н, 2 д.д., СαН2 Gly), 4,3 (1Н, д.д., СαН Pro), 7,2-7,3 (5Н. м, Ar). 7.0 и 7.3 (2Н, два с. NH2), 8,1 (1Н, т, NH).
ПРИМЕР 5. Получение N-фенилацетилглицил-L-пролина, N-Phac-Gly-L-Pro-ОН (V).
Суспензию 0,300 г (3,5 ммоль) N-Phac-Gly-L-Pro-OEt, полученного аналогично Iв, в 1.5 мл 1 н NaOH перемешивали при комнатной температуре в течение 3 ч до получения раствора, затем подкисляли 2 н HCl до рН 3. Раствор упаривали в вакууме до получения масла, которое растворяли в 15 мл хлороформа. Нерастворившуюся часть отфильтровывали, фильтрат выпаривали в вакууме. Остаток затирали под эфиром, твердую часть отфильтровали и высушивали в вакууме при комнатной температуре. Получали 0,200 г (73%) продукта с т.пл. 165-166°С. 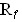 =0,35 (диоксан - вода 9:1), [α]23D -75° (с 1, метанол). Рассчитано для C15H18N2O4: С=62,07%; Н=6,21%; N=9,66%.Найдено: С=62,11%; Н=6,26%; N=10,09%.
=0,35 (диоксан - вода 9:1), [α]23D -75° (с 1, метанол). Рассчитано для C15H18N2O4: С=62,07%; Н=6,21%; N=9,66%.Найдено: С=62,11%; Н=6,26%; N=10,09%.
Спектр 1Н-ЯМР (CDCl3) δ, м.д.: 1,9-2,8 (4Н, м, СγН2 Pro, СβН2 Pro), 3,16 и 3,56 (2Н, м, СδН2 Pro), 3,60 (2Н, с, CH2Ar), 3,86 и 3,98 (2Н, два м., CαH2 Gly), 4,16 и 4,35 (1Н, два м, CαH Pro), 6,45 и 6,85 (2Н, два с, NH2), 7,2-7,3 (5Н, м, Ar).
ПРИМЕР 6. Получение метилового эфира N-фенилацетилглицил-L-пролина, N-Phac-Gly-L-Pro-OMe (VI).
а) Хлоргидрат метилового эфира L-пролина, L-Pro-OMe-HCl
К 120 мл метилового спирта, охлажденного до -20°С, прибавляли по каплям 5,1 мл (70,00 ммоль) тионилхлорида и порциями вносили 4,00 г (34,64 ммоль) L-пролина. Суспензию перемешивали 2 часа при -5°С, и 2 часа при комнатной температуре. Растворитель удаляли в вакууме; эту операцию повторяли дважды, каждый раз добавляя 50 мл метанола. Остаток в виде желтого масла кристаллизовали под диэтиловым эфиром, отфильтровывали и высушивали в вакууме над KOH. Получали 5,32 г (93%) хлоргидрата метилового эфира L-пролина. Т.пл. 67-69°С. 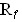 0,78 (изопропиловый спирт - водный аммиак 7:3). -30.4 (с 1, вода). Лит. т.пл. 71°С, [α]23D -34 (c1, вода) (А.А. Гершкович, В.Г. Кибирев, «Синтез пептидов. Реагенты и методы» Монография. Киев, «Наукова думка», 1987, с. 173)
0,78 (изопропиловый спирт - водный аммиак 7:3). -30.4 (с 1, вода). Лит. т.пл. 71°С, [α]23D -34 (c1, вода) (А.А. Гершкович, В.Г. Кибирев, «Синтез пептидов. Реагенты и методы» Монография. Киев, «Наукова думка», 1987, с. 173)
б) Метиловый эфир N-фенилацетилглицил-L-пролина, N-Phac-Gly-L-Pro-OMe (V)
К охлажденному до -10°С раствору 1,5 г (7,8 ммоль) N-фенилацетилглицина, полученного аналогично Iа, в 10 мл DMF при интенсивном перемешивании одновременно прибавляли 1,1 мл (7,8 ммоль) IBCF и 0,9 мл (7,8 ммоль) NMM. После 2-3 мин перемешивания прикапывали раствор 1,3 г (7,8 ммоль) хлоргидрата метилового эфира пролина и 0,9 мл (7,8 ммоль) NMM в 15 мл DMF. Реакционную смесь перемешивали еще 30 мин при -10°С и 1 ч при комнатной температуре. Осадок отфильтровывали, фильтрат выпаривали в вакууме, остаток растворяли в CHCl3. Раствор последовательно промывали 3% NaHCO3, водой, 1н HCl и вновь водой, высушивали безводным сульфатом натрия и выпаривали. Полученное масло затирали под эфиром, твердую часть отфильтровывали и получали 1,1 г (46%) продукта с т.пл. 117-118°С. 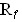 =0,65 (диоксан-вода 9:1), [а]23D -85° (с 1, метанол). Рассчитано для C16H20N2O4: С=64,13%; Н=6,97%; N=8,80%. Найдено: С=64,27%; Н=7,05%; N=8,63%
=0,65 (диоксан-вода 9:1), [а]23D -85° (с 1, метанол). Рассчитано для C16H20N2O4: С=64,13%; Н=6,97%; N=8,80%. Найдено: С=64,27%; Н=7,05%; N=8,63%
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 1,81 и 2,13 (2Н, два м, CβH2 Pro), 1,89 (2Н, м, CγH2 Pro), 3,46 (4Н, м, СδН2(Pro), CH2Ar), 3,61 и 3,68 (3Н, два с, ОСН3), 3,84 и 4,03 (2Н, два д.д., CαH2(Gly)), 4,16 и 4,35 (1Н, два д.д., CαH(Pro)), 7,2-7,3 (5Н, м, Ar).
ПРИМЕР 7. Получение метиламида N-фенилацетилглицил-L-пролина, N-Phac-Gly-L-Pro-NHCH3 (VII).
К раствору 0,300 г (1 ммоль) N-Phac-Gly-L-Pro-OMe, полученного аналогично VIб, в 5 мл метанола добавляли 2,5 мл насыщенного CH3NH2 абсолютного этанола. Полученный раствор оставляли плотно закрытым на 7 дней при комнатной температуре. Окончание реакции определяли с помощью ТСХ. После завершения реакции раствор выпаривали в вакууме, полученное масло затирали под эфиром. Выпавший осадок отфильтровывали, промывали на фильтре метанолом и сухим эфиром, высушенным над CaCl2. Полученное вещество перекристаллизовывали из этилового спирта, получали 0,251 г (84%) метиламида с т.пл. 180-181°С. 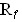 =0,35 (хлороформ-метанол 9:1). [α]23D -76° (с 1, метанол). Рассчитано для C15H19N3O3: С=63,35%; Н=6,98%; N=13,85%. Найдено: С=62,47%; Н=7,21%; N=14,06%
=0,35 (хлороформ-метанол 9:1). [α]23D -76° (с 1, метанол). Рассчитано для C15H19N3O3: С=63,35%; Н=6,98%; N=13,85%. Найдено: С=62,47%; Н=7,21%; N=14,06%
Спектр 1Н-ЯМР (DMSO-d6) δ, м.д.: 1.67-2.21 (4Н, м, СγН2 Pro, СβН2 Pro), 2.50-2.60 (3Н, м, CH3NH), 3.49 (2Н, с, CH2Ar), 3.51 (2Н, м, CδH2 Pro), 3.85 и 4.0 (2Н, 2 м, СαН2 Gly), 4.22 (1H, д.д., СαН Pro), 7.12-7.39 (5Н, м, Ar), 7.72 и 8.03 (1Н, два кв., CH3NH), 8.15 (1Н, т, NH).
Результаты фармакологического изучения заявляемых соединений in vitro
Изучение метаболизма ГЗК-111
Использовали гомогенат мозга и плазму крови беспородных крыс-самцов массой 250-280 г. Для получения гомогената мозга животных декапитировали, мозг извлекали на льду, измельчали и гомогенизировали в 9 объемах забуференного физиологического раствора (PBS (Sigma), pH 7.3) при помощи УЗ-дезинтегратора УЗДН-1 (СССР) обработкой 3 раза по 30 с во льду (22 кГц). Полученный гомогенат хранили при -20°С не более 3 дней и использовали после размораживания. Кровь собирали после декапитации в пробирки BD Vacutainer с ЭДТА, центрифугировали и хранили полученную плазму при температуре -20°С не более 7 дней.
Раствор 3 мг ГЗК-111 в 100 мкл ацетонитрила добавляли к 900 мкл биологического образца (гомогената мозга или плазмы крови крысы). Смесь инкубировали при 37°С на водяной бане в течение 60-300 мин. Затем к 100 мкл инкубационной смеси добавляли равный объем ацетонитрила, образцы встряхивали в течение 10 мин и центрифугировали в течение 10 мин при 12000 об/мин. 20 мкл супернатанта хроматографировали на колонке Nucleosil С18 (4×125 мм, зернение 5 мкм), при 25°С используя градиентную элюцию от 0 до 30% ацетонитрила, содержащего 3,7 мМ гексансульфоната натрия (Altex, США) на хроматографе Gilson 41 (Gilson, США) со скоростью потока 1 мл/мин. Детектирование проводили в двухволновом режиме для регистрации поглощения амидной связи (220 нм) и ароматических групп (260 нм) с использованием УФ-детектора Gilson 116 (Gilson, США). Сбор и обработку хроматографических данных осуществляли с помощью программного обеспечения «МультиХром» 1.52v для Windows (Ampersand Ltd., Россия). Полученные результаты приведены в таблицах 2 и 3.
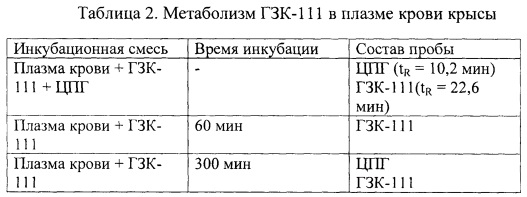
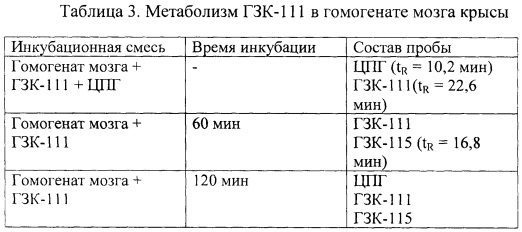
Таким образом, при инкубации ГЗК-111 как с плазмой крови, так и с гомогенатом мозга наблюдается образование ЦПГ.
Изучение нейропротекторной активности ГЗК-111
Нейропротекторная активность ГЗК-111 была изучена на клеточной модели повреждения дофаминергических нейронов нейротоксином 6-OHDA с использованием клеток нейробластомы человека линии SH-SY5Y.
Клетки линии SH-SY5Y рассеивали с плотностью 10 тыс. клеток в лунку в 96-луночные планшеты в среде DMEM, содержащей 15% FBS и 2 мМ L-глутамина и инкубировали при 37°С и 5% CO2 до образования монослоя. Для индукции 6-гидроксидофаминовой токсичности в культуральную среду вносили 6-OHDA в конечной концентрации 100 мкМ и инкубировали в течение 24 ч при 37°С в 5% CO2. После этого заменяли среду и культивировали в течение 24 часов в тех же условиях [K. Riveles et al., 2008]. ГЗК-111 вносили за 24 часа до повреждающего воздействия в диапазоне конечных концентраций от 10-8 до 10-5 М.
Для определения жизнеспособности клеток использовали МТТ-тест [G.R. Jackson et al., 1992]. Оптическую плотность измеряли на спектрофотометре "Multiscan EX" ("Thermo") при длине волны 600 нм.
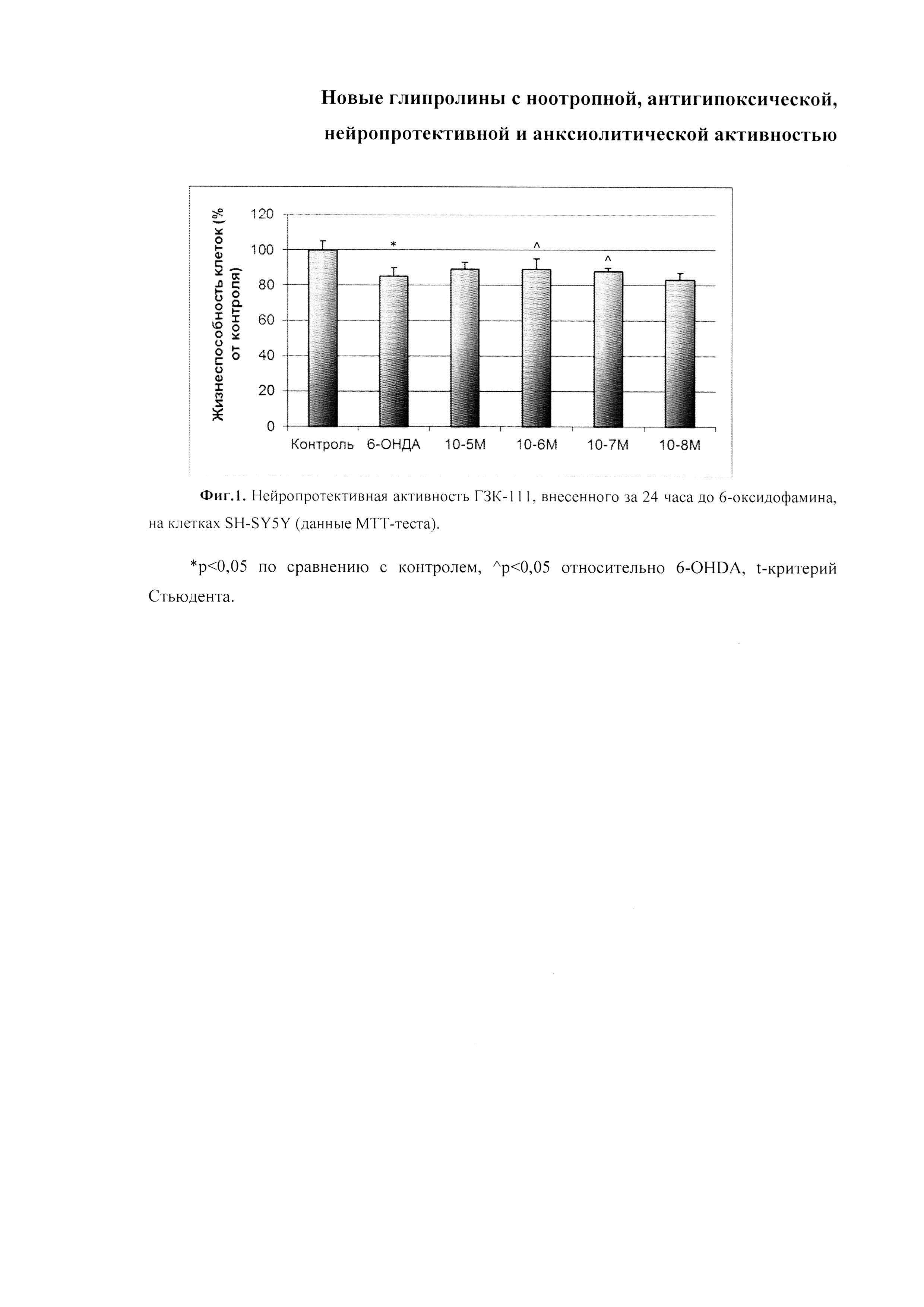
Результаты защитного действия ГЗК-111 приведены на фиг. 1.
Нейропротекторная активность ГЗК-111 является концентрационно-зависимой и проявляется в концентрациях 10-6 и 10-7 М.
Описание чертежа.
Фиг. 1. Нейропротективная активность ГЗК-111, внесенного за 24 часа до 6-оксидофамина, на клетках SH-SY5Y (данные МТТ-теста). По оси абсцисс - концентрации, по оси ординат - жизнеспособность клеток в % от контроля. *р<0,05 по сравнению с контролем, ^р<0,05 относительно 6-OHDA, t-критерий Стьюдента.
Результаты фармакологического изучения заявляемых соединений in vivo
Животные. Опыты выполнены на мышах-самцах инбредной линий Balb/c массой 19-25 г (НПП «Питомник лабораторных животных ФИБХ РАН), на белых беспородных мышах-самцах массой 23-28 г и на белых беспородных крысах-самцах массой 250-280 г (Государственное предприятие Питомник лабораторных животных "Столбовая" при РАМН). Животных содержали в виварии при свободном доступе к пище и воде и естественной смене светового режима. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 351.000.3-96 и 51000.4-96), приказу МЗ РФ №276 от 19.06.2003 г. Эксперименты проводили с 10 до 16 часов.
1. Изучение противогипоксического действия соединений ГЗК-111, ГЗК-121 и ГЗК-113 в тесте нормобарической гипоксии с гиперкапнией в гермообъеме.
Исследование выполнено на белых беспородных половозрелых мышах самцах массой 23-28 г. Изучение противогипоксического действия вещества проводилось при использовании методики гипобарической гипоксии с гиперкапнией в гермообъеме (Воронина Т.А. и др., 2012, Лукьянова Л.Д. и др., 1990).
Нормобарическая гипоксия с гиперкапнией в гермообъеме («баночная» гипоксия) является часто используемым методом оценки противогипоксической активности веществ. Согласно методике мышей одинакового веса (разброс не более 2-х г на группу) помещали по одному животному в герметически закрываемые банки объемом 250 см3. Регистрировали время выживания (резервное время) животных в банке в условиях гипоксии.
Вещества растворяли в физиологическом растворе и вводили однократно внутрибрюшинно в дозах 0,1; 0,5 и 1,0 мг/кг за 60 минут до помещения животного в банку. Животным контрольной группы вводили физиологический раствор в эквивалентном объеме (примерно 0,2 мл на мышь).
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей. Результат считали достоверным при р<0,05 (t-критерий Стьюдента).
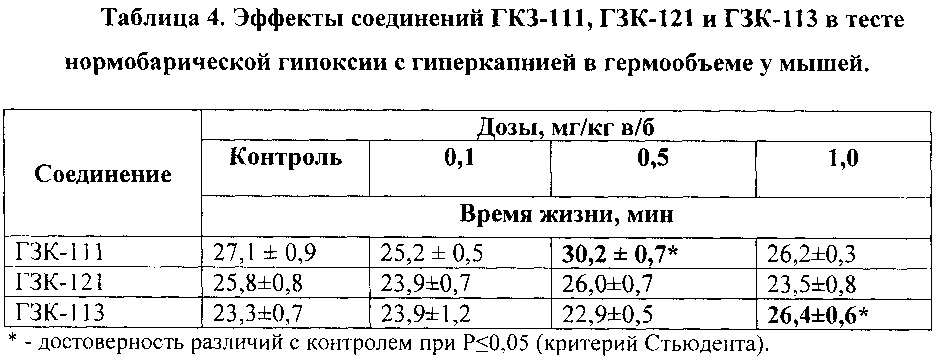
Установлено, что соединение ГЗК-111 в дозе 0,5 мг/кг статистически достоверно увеличивает (примерно на 11%) время выживания мышей в условиях гипоксии. (Таблица 4). В дозах 0,1 и 1,0 мг/кг соединение было неактивно. Эффект ГЗК-111 стереоселективен: его энантиомер ГЗК-121 в дозах 0,1; 0,5 и 1,0 мг/кг не проявлял антигипоксического действия (таблица 4).
Соединение ГЗК-113 в дозе 1,0 мг/кг достоверно увеличивает время выживания мышей в условиях гипоксии примерно на 15%. В дозах 0,1 и 0,5 мг/кг оно не оказывало влияния на продолжительность жизни мышей.
2. Изучение анксиолитического действия соединений ГЗК-111 и ГЗК-121 в тесте приподнятого крестообразного лабиринта.
Изучение анксиолитического действия веществ осуществлялось при использовании методики приподнятого крестообразного лабиринта по Pellow, которая является базисным тестом и широко используется при поиске и изучении веществ с анксиолитической активностью как в России, так и за рубежом (Воронина Т.А. Середенин С.Б., Яркова М.А., Воронин М.А., 2012; Воронина Т.А. и др., 2007, Pellow S. et al., 1985).
Исследование выполнено на белых беспородных половозрелых крысах самцах массой 250-280 г. Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-22°С и 30-70% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 10 крыс в каждой клетке, при постоянном доступе к экструдированному брикетированному корму ГОСТ Р 50258-92 (1993) и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%. Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов.
Методика приподнятого крестообразного лабиринта (ПКЛ) основана на естественном страхе нахождения на открытых площадках и падения с высоты и навыке предпочтения грызунами темных нор. В исследовании использовали ПКЛ, который состоит из крестообразно расходящихся от центральной площадки под прямым углом 4-х рукавов: два противоположных, открытых, без стенок и два закрытых, темных. Центральная площадка и пол открытых рукавов прозрачны, тогда как пол и стенки закрытых рукавов покрашены в темный цвет. Рукава имеют размеры: ширину 14 см и длину 50 см, высота стенок 30 см, центральная площадка 14 см ×14 см, ПКЛ приподнят над полом на 60 см. Животное помещают в ПКЛ на центральную площадку, головой к открытому рукаву и в течение 5-ти минут регистрируют время пребывания животных в открытых и закрытых рукавах, на центральной площадке и количество заходов в открытые и закрытые рукава. Анксиолитический эффект препарата оценивается по увеличению числа заходов в светлые рукава и времени нахождения в них и на центральной площадке.
Вещества растворяли в физиологическом растворе и вводили однократно внутрибрюшинно за 15 минут до эксперимента. Соединение ГЗК-111 вводили в дозах 0,75; 1,50 и 3,00 мг/кг, соединение ГЗК-121 - в дозе 1,50 мг/кг. Контрольным животным вводили физиологический раствор.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей. Результаты считали достоверными при р<0,05 по непараметрическому U-критерию Манна-Уитни.
Установлено, что животные контрольной группы испытывают страх перед открытым пространством и высотой в установке ПКЛ, что проявляется в быстром уходе животных в закрытые рукава лабиринта, где они проводят большее время (Таблица 5).
Соединение ГЗК-111 в дозе 1,5 мг/кг существенно изменяет поведение животных в условиях методики приподнятого крестообразного лабиринта. Под влиянием вещества наблюдается выраженное и статистически достоверное увеличение основного показателя - времени нахождения животных в открытых рукавах в 17 раз при использовании дозы 1,5 мг/кг. Наряду с этим, под влиянием вещества в дозе 1,5 мг/кг наблюдается статистически достоверное уменьшение времени, проводимого в закрытых рукавах лабиринта и увеличение времени, проводимого на центральной площадке ПКЛ. Полученные данные свидетельствуют о наличии у соединения в дозе 1,5 мг/кг отчетливого анксиолитического эффекта.
Под влиянием соединения в дозах 0,75 и 3,0 мг/кг наблюдается статистически достоверное увеличение (в 3,7 и 4,1 раза соответственно) времени нахождения животных на центральной площадке ПКЛ, и тенденция к повышению времени, проводимому в открытых рукавах лабиринта. Таким образом, при снижении дозы соединения до 0,75 мг/кг или увеличении до 3 мг/кг анксиолитический эффект соединения в ПКЛ уменьшается по сравнению с дозой 1,50 мг/кг (Таблица 5).
Полученные данные свидетельствуют о выраженном анксиолитическом действии соединения в дозе 1,5 мг/кг в базисном тесте ПКЛ, что характеризуется статистически достоверным существенным увеличением основного показателя - времени нахождения животных в открытых рукавах и времени нахождения на центральной площадке. Максимальный эффект выявляется при использовании соединения в дозе 1,5 мг/кг, при которой основной показатель анксиолитического эффекта - время, проводимое животным в открытых рукавах, увеличивается в 17 раз.
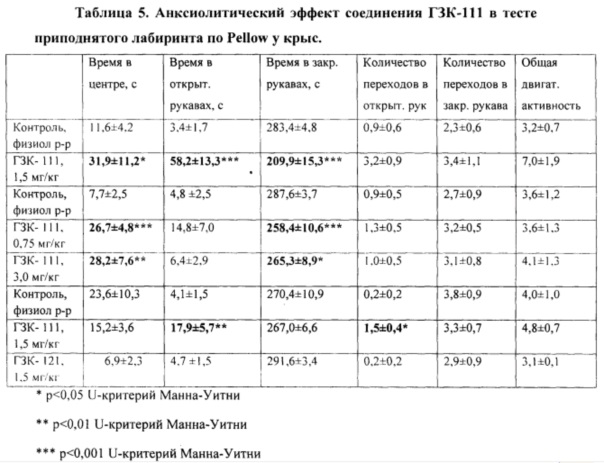
Эффект ГЗК-111 был стереоселективен: его энантиомер ГЗК-121 в дозе 1,5 мг/кг был неактивен (см. таблицу 5).
3. Влияние соединения ГЗК-111 на поведение мышей линии Balb/c в условиях эмоционально-стрессового воздействия в тесте «открытое поле».
Тест «открытое поле» - распространенная модель оценки поведения грызунов в условиях эмоционального стресса, формирующегося как реакция на новую обстановку и угрожающую ситуацию. В работе применена методика освещенного «открытого поля», при котором перенос животного из темноты на ярко подсвеченную арену создает дополнительный стрессирующий фактор, основанный на естественном стремлении грызунов избегать ярко освещенных мест (С.Б. Середенин, А.А. Ведерников, 1979).
В исследовании использованы мыши-самцы инбредной линий Balb/c массой 19-25 г (НПП «Питомник лабораторных животных ФИБХ РАН). Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-22°С и 30-70% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 20 мышей в каждой клетке, при постоянном доступе к экструдированному брикетированному корму ГОСТ Р 50258-92 [1993] и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%). Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов.
Соединение ГЗК-111 готовилось в виде раствора в дистиллированной воде и вводилось однократной внутри брюшинной инъекцией.
Через 30 минут после внутрибрюшинного введения соединения животное сначала помещали на 1 мин в темную камеру, а затем - на один из периферических квадратов "открытого поля", которое представляет из себя белую круглую арену диаметром 1 метр с белыми бортами высотой 50 см. Арена равномерно освещена 4-мя бестеневыми лампами по 75 Вт каждая, расположенными на высоте 1 м над поверхностью поля. Все пространство арены равномерно разделено 4-мя концентрическими окружностями, которые в свою очередь разбиты радиусами на сектора так, что периферическая окружность состоит из 16 одинаковых криволинейных квадратов. Наблюдение за животным производили в течение 3 минут, раздельно фиксировали число пересеченных квадратов на периферии (ПА), в центральных областях (ЦА), число заходов в центр (Ц), а также число вертикальных стоек (ВА) и количество дефекаций (Деф). Суммарное число пересеченных квадратов вместе с числом вертикальных стоек обозначали как общую активность (ОДА).
О наличии анксиолитического действия судили по выявлению активирующего эффекта на двигательную активность у животных с реакцией замирания в тесте «открытое поле» (линия Balb/c).
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (ANOVA, критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни).
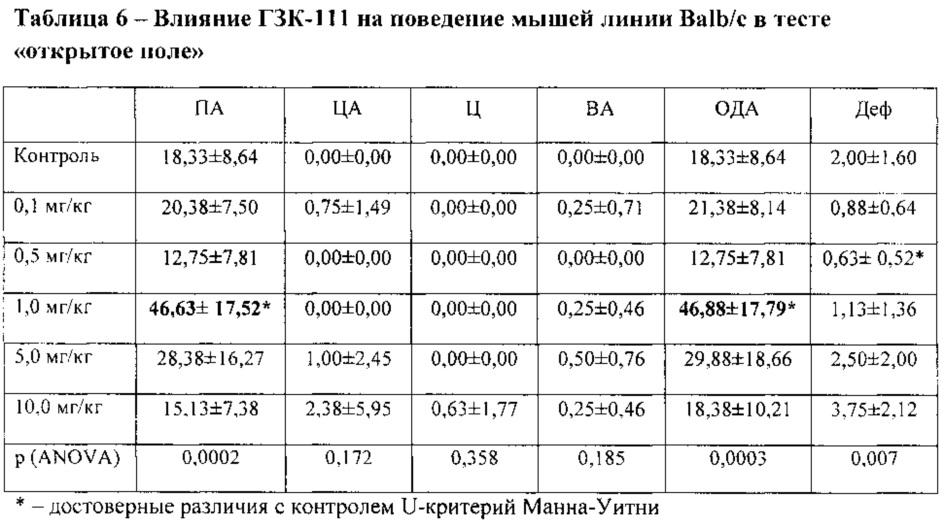
В условиях эмоционально-стрессового воздействия в тесте «открытое поле» при внутрибрюшинном введении у соединения ГЗК-111 в дозе 1,0 мг/кг обнаружено статистически значимое повышение периферической и общей двигательной активности мышей линии Balb/c по сравнению с контролем (таблица 6).
Полученные данные согласуются с результатами, полученными в тесте приподнятого крестообразного лабиринта.
4. Изучение антиамнестического (ноотропного) действия соединений ГЗК-111 и ГЗК-121 в тесте электрошоковой амнезии у крыс.
Исследование выполнено на белых беспородных половозрелых крысах самцах массой 250-280 г. Изучение антиамнестического действия вещества проводилось при использовании методики электрошоковой амнезии условного рефлекса пассивного избегания (УРПИ) (Воронина Т.А., Островская Р.У., Гарибова Т.Л., 2012).
Изучение антиамнестического действия вещества проводилось при использовании методики электрошоковой амнезии условного рефлекса пассивного избегания в сертифицированной установке "Lafayette Instrument Со" (США) у крыс. Установка представляет собой темную камеру размером 400×400×400 мм с электродным полом. Темная камера соединена через квадратную гильотинную дверцу размером 60×60 мм с навесной платформой размером 250×70 мм. Навесная платформа освещена лампой 60 Вт, расположенной на высоте 400 мм. Темная камера располагается на лабораторном столе, а платформа висит над полом на высоте 800 мм.
Крысу сажали на ярко освещенную платформу хвостом к открытой гильотинной двери, ведущей в темную камеру. Вследствие норкового рефлекса после нахождения входа в темный отсек камеры крыса переходила в темный отсек. Затем осуществляли обучение, которое состояло в том, что, когда крыса находилась в темном отделении, отверстие закрывали и наносили животному неизбегаемое электроболевое раздражение через пол (8 ударов, сила обучающего тока 0,45 мА, длительность каждого импульса составляла 1 с, интервал между последовательными импульсами - 2 с) - сильное обучение. После получения болевого раздражения (обучение) крыса выскакивала из темного отсека на освещенную платформу. Таким образом, животное было обучено тому, что в темной камере она получает болевое раздражение и помнит об этом. Крысу снимали с платформы и помещали в обычную клетку.
Для получения амнезии УРПИ животным непосредственно после обучения УРПИ проводили через корнеальные электроды, используя сертифицированный прибор («Harvard apparatus)), Германия) максимальный электрошок (250 вольт, 120-122 мА, 0,1 сек). Тест на воспроизведение обученности и амнезию проводили через 24 ч после обучения, для чего крысу опять сажали на платформу хвостом к отверстию и регистрировали латентный период захода животного в темное отделение и затем в течение 180 с число животных совсем не зашедших в темный опасный отсек и остававшихся на освещенной висячей платформе (крысы, хорошо помнящие ситуацию).
Соединение ГЗК-111 вводили однократно, внутрибрюшинно в дозах 0,1; 0,5 и 1,0 мг/кг за 40 минут до обучения, а соединение ГЗК-121 - в дозе 0,5 мг/кг. Контрольным животным в таком же объеме вводили физиологический раствор.
Статистическая обработка результатов была осуществлена с помощью статистических пакетов "BioStat" для Windows. Рассчитывали средние показатели по группе и стандартные ошибки показателей. Результаты считали достоверными при р<0,05 по t-критерию Стьюдента.
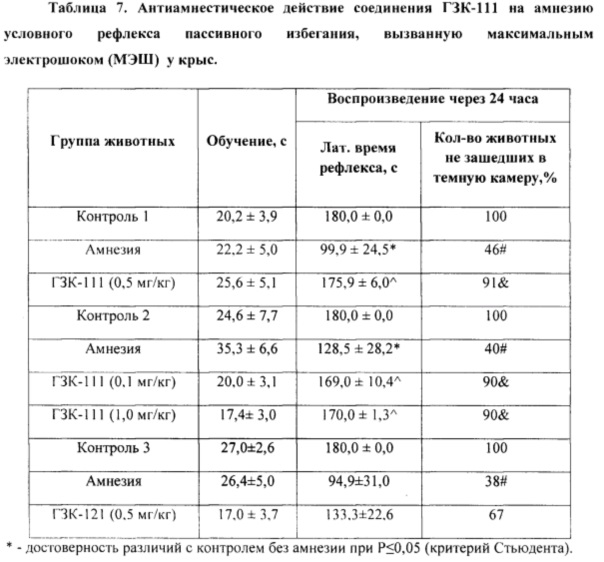

Как видно из таблицы 7, соединение ГЗК-111 в дозах 0,1; 0,5 и 1,0 мг/кг обладает выраженном антиамнестическим эффектом. В то же время его D-энантиомер (ГЗК-121) неактивен, т.е. эффект ГЗК-111 стереоспецифичен.
Заключение
Таким образом, было показано, что при инкубации ГЗК-111 как с плазмой крови, так и с гомогенатом мозга наблюдается образование ЦПГ. Соединение ГЗК-111 проявляет нейропротективную активность in vitro на клеточной модели повреждения дофаминергических нейронов нейротоксином 6-OHDA с использованием клеток нейробластомы человека линии SH-SY5Y. Эффект является концентрационно-зависимым и проявляется в концентрациях 10-6 и 10-7 М. Соединения ГЗК-111 (0,5 мг/кг) и ГЗК-113 (1,0 мг/кг) обладают противогипоксическим эффектом в условиях теста нормобарической гипоксии с гиперкапнией в гермообъеме, что выражается в статистически достоверном увеличении времени выживания животных в условиях гипоксии. Соединение ГЗК-111 при внутрибрюшинном введении обладает отчетливым анксиолитическим эффектом в базисном тесте приподнятого крестообразного лабиринта, что выражается в статистически достоверном существенном увеличении времени нахождения животных в открытых рукавах и на центральной площадке лабиринта. Максимальный эффект выявляется при использовании соединения в дозе 1,5 мг/кг, при которой основной показатель анксиолитического эффекта - время, проводимое животным в открытых рукавах, увеличивается в 17 раз. Соединение ГЗК-111 в широком диапазоне доз (0,1-1,0 мг/кг) обладает антиамнестическим эффектом в жестком тесте электрошоковой амнезии, что выражается в статистически достоверном увеличении латентного времени захода в темную камеру и процента животных, совсем не зашедших в темную камеру. Антигипоксический, анксиолитический и антиамнестический эффекты ГЗК-111 являются стереоспецифическими.
Литература
Т.А. Gudasheva, S.S. Воуко, V.Kh. Akparov, R.U. Ostrovskaya, A.P. Skoldinov, G.G. Rozantsev, T.A. Voronina, V.P. Zherdev, S.B. Seredenin. Identification of a novel endogenous memory facilitating cyclic dipeptide cyclo-prolylglycine in rat brain. FEBS Letters. 1996. V. 391. P. 149-152.
Гудашева T.A., Середенин С.Б., Бойко С.С, Жердев В.П., Вичужанин М.В. Региональная и субклеточная локализация цикло-пролилглицина в мозге крыс Бюллетень экспериментальной биологии и медицины, 2010. - N 6. - С. 648-650.
С.Б. Середенин, Т.А. Гудашева, С.С Бойко и др., Бюл. экспер. биол., 133(4), 417-419 (2002).
Т.А. Гудашева, Р.У. Островская, С.С Трофимов и др., Бюл. Экспер. Биол., 116(10), 411-413 (1999).
Gudasheva Т.А., Ostrovskaya R.U., Romanova G.A. et al In: Peptides 2000. Jean Martinez and Jean-Alain Fehrenz (Eds.) EDK, Paris, France, 647-648 (2001).
Т.А. Гудашева, M.A. Константинопольский, Р.У. Островская и др., Бюл. Экспер. Биол., 131(5), 547-550 (2001).
K.R.C. Prakash, Y. Tang, А.Р. Kozikowski et al., Bioorg. Med. Chem., 10, 3043-3048 (2002),
Колясникова K.H., Гудашева T.A., Назарова Г. и др. Сходство цикло-пролилглицина с пирацетамом по антигипоксическому и нейропротекторному эффектам.
Экспериментальная и клиническая фармакология, 2012. - N 9. - С. 3-6.
Loi Н. Tran US Patent 7232798.
С. Barlow, Т.А. Carter, A. Morse, K. Treuner, K.I. Lorrain, D. Gitnick, J.C Pires Modulation of Neurogenesis by Nootropic Agents, US Patent Appl. 2010/0216734.
Gao-Xue Wang, Yong Wang, Zong-Fan Wu, Hai-Feng Jiang, Rui-Qiang Dong, Fu-Yuan Li, Xiao-Lin Liu, Immunomodulatory effects of secondary metabolites from thermophilic Anoxybacillus kamchatkensis XA-1 on carp, Cyprinus carpio Fish Shellfish Immunol. 2011 30(6):1331-1338.
Патент РФ №2119496 Производные N-ацилпролилдипептидов (1998).
US Patent N5439930 N-Acylprolyldipeptides having antiamnestic antyhypoxic and anorexigenic effects (1995).
Gudasheva T.A., Voronina T.A., Ostrovskaya R.U., Rozantsev G.G., Vasilevich N.I., Trofimov S.S., Kravchenko E.V., Skoldinov A.P., Seredenin S.B. Synthesis and antiamnesic activity of a series of N-acylprolyl-containing dipeptides. Eur. J. Med. Chem. 1996. V. 31, №2. P. 151-157.
T.A. Gudasheva, S.S. Boyko, R.U. Ostrovskaya, T.A. Voronina, V.Kh. Akparov, S.S. Trofimov, G.G. Rozantsev, A.P. Skoldinov, V.P. Zherdev and S.B. Seredenin. The major metabolite of dipeptide piracetam analogue GVS-111 in rat brain and its similarity to endogenous neuropeptide cyclo-L-prolylglycine. Eur. J. Drug Metab. Pharmacokinetics. 1997. V. 22, №3. P. 245-252
T.A. Gudasheva, S.S. Boyko, V.Kh. Akparov, R.U. Ostrovskaya, A.P. Skoldinov, G.G. Rozantsev, T.A. Voronina, V.P. Zherdev, S.B. Seredenin. Identification of a novel endogenous memory facilitating cyclic dipeptide cyclo-prolylglycine in rat brain. FEBS Letters. 1996. V. 391. P. 149-152.
"The Peptides". Vol. 1. 1965 (Academic Press), E. Schroeder, K. Lubke.
"The Peptides", Vol. 1, 1979 (Academic Press) E. Cross, L. Meinhofen.
Winitz M, Bloch-Frankenthal L, Izumiya N, Birnbaum SM, Baker CC, Greenstein ID (1956) J Am Chem Soc 78, 2423-2427.
D.W. Young, D.J. Morecombe, and P.K. Sen Eur. J. Biochem. 75, 133- 147 (1977).
Л.С. Назарова, Ю.Б. Розонов, A.M. Лихошерстов и др., Хим.-фарм. журн. 1984. Т. 18, №12, с. 1445-1448.
А.А. Гершкович, В.Г. Кибирев, «Синтез пептидов. Реагенты и методы» Монография. Киев, «Наукова думка», 1987. с. 173.
K. Riveles, L.Z. Huang, М. Quik, Neurotoxicology, 29(3), 421-427 (2008).
G.R. Jackson, K. Werrbach-Perez, E.L. Ezell et al., Brain Res., 592(1-2), 239-248 (1992).
Воронина T.A., Островская Р.У., Гарибова Т.Л., Методические рекомендации по доклиническому изучению лекарственных средств с ноотропным типом действия, «Руководство по проведению доклинических исследований лекарственных средств», Москва, Издание ФГБУ «НЦЭМСП» Минздравсоцразвития России, 2012, Часть 1, глава 17, с. 276-296.
Лукьянова Л.Д., Гацура В.В., Пастушенков Л.В., Урюпов О.Ю., Лесновская Е.В., Методические рекомендации по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств, Москва, МЗ СССР, Фармакологический Комитет, 1990.
Воронина Т.А. Середенин С.Б., Яркова М.А., Воронин М.А., Методические рекомендации по доклиническому изучению транквилизирующего (анксиолитического) действия лекарственных средств; «Руководство по проведению доклинических исследований лекарственных средств». Москва, Издание ФГБУ «НЦЭМСП» Минздравсоцразвития России, 2012, Часть 1, глава 16, с. 264-275;
Воронина Т.А., Экспериментальная фармакология феназепама. В книге Середенин С.Б. и соавт, Воронина Т.А., Незнамов Г.Г., Жердев В.П., «Феназепам. 25 лет в медицинской практике». М.: Наука, 2007, с. 9-132.
С.Б. Середенин, А.А. Ведерников / Влияние психотропных препаратов на поведение инбредных мышей в условиях открытого поля / Бюлл. Эксп. Биол. Мед. - 1979. - Т. 88, №7, с. 38-40.
Pellow S., Chopin P., File S.E., Driley M., Validation of open-close arm entries in an elevated plus maze as a measure of anxiety in the rat., J. Neurosci. Meth., 1985, v. 14, pp. 149-167.
Воронина T.A., Островская P.У., Гарибова Т.Л., Методические рекомендации по доклиническому изучению лекарственных средств с ноотропным типом действия, «Руководство по проведению доклинических исследований лекарственных средств». М.: Издание ФГБУ «НЦЭМСП» Минздравсоцразвития России, 2012, Часть 1, глава 17, с. 276-296.