Результат интеллектуальной деятельности: Способ совместного культивирования зрелых адипоцитов с клетками крыс
Вид РИД
Изобретение
Изобретение относится к биотехнологии, а именно к способам совместного культивирования зрелых адипоцитов с другими типами клеток крыс.
Известен способ совместного культивирования (сокультивирования) адипоцитов с другими клетками млекопитающих в виде гетерогенной монослойной культуры (Santander A.M., Lopez-Ocejo О., Casas О et. al. Paracrine Interactions between Adipocytes and Tumor Cells Recruit and Modify Macrophages to the Mammary Tumor Microenvironment: The Role of Obesity and Inflammation in Breast Adipose Tissue // Cancers (Basel). 2015. V. 15, N. 7(1). P. 143-178). Способ предусматривает смешивание двух клеточных суспензий и последующее формирование из гетерогенной популяции общего монослоя. К недостаткам этого способа следует отнести невозможность дифференцированного подхода к оценке биохимических и морфологических изменений в клетках определенного типа.
Известен также способ сокультивирования, сочетающий суспензионную культуру зрелых адипоцитов и монослойную культуру клеток второго типа (Vu V., Kim W., Fang X. et al. Coculture with primary visceral rat adipocytes from control but not streptozotocin-induced diabetic animals increases glucose uptake in rat skeletal muscle cells: Role of adiponectin // Endocrinology. 2007. N. 148. P. 4411-4419). Способ состоит в предварительном выращивании монослоя клеток второго типа; наслаивании суспензии зрелых адипоцитов; совместном культивировании двух клеточных популяций. К недостаткам этого способа сокультивирования следует отнести загрязнение монослоя адгезированных клеток оседающими адипоцитами; низкую жизнеспособность и изменение метаболизма адипоцитов во взвешенном состоянии.
Также известен способ сокультивирования с использованием полупроницаемых мембранных вкладышей (Janke J., Engeli S., Gorzelniak К. et al. Mature adipocytes inhibit in vitro differentiation of human preadipocytes via angiotensin type 1 receptors // Diabetes. 2002. V. 51, N. 6. P. 1699-1707). При этом монослой адгезированных клеток второго типа культивируют на дне сосуда, а суспензия адипоцитов, отделенная мембранным вкладышем, локализуется в верхней части культуральной ячейки.
Недостатками являются неоднородность популяции адипоцитов по локализации (адгезированные на поверхности мембранной вставки, взвешенные, плавающие на поверхности культуральной среды) и низкая жизнеспособность неприкрепленных жировых клеток. Кроме того способ ограничивает возможность применения микроскопии для контроля за состоянием адипоцитов.
В качестве ближайшего аналога (прототипа) принят способ сокультивирования с использованием полупроницаемых мембранных вкладышей с альтернативным размещением клеточных популяций (Dirat В., Bochet L., Dabek М. et. al. Cancer-associated adipocytes exhibit an activated phenotype and contribute to breast cancer invasion // Cancer Res. 2011. V. 71, N 7. P. 2455-2465). Способ включает формирование монослоя адгезированных адипоцитов в нижней части культуральной ячейки; выращивание в монокультуре второго типа клеток на поверхности мембранной вкладки; совместное культивирование двух популяций адгезированных клеток. К недостаткам прототипа следует отнести самопроизвольный отрыв адипоцитов от поверхности культурального пластика, приводящий к всплыванию части жировых клеток. Это ведет к неоднородности популяции адипоцитов по локализации в объеме культуры (адсорбированные на дне ячейки или на нижней поверхности вкладки, взвешенные) и свойствам, что в свою очередь отражается на результатах биохимических анализов, делая их маловоспроизводимыми, затрудняет манипуляции с жировыми клетками. Неоднотипная локализация адипоцитов в комплексе с оптическими свойствами полупроницаемой мембраны затрудняет микроскопический контроль за состоянием клеточных популяций в ходе сокультивирования.
Задачей изобретения является разработка способа совместного культивирования зрелых адипоцитов с клетками крыс, способных к адгезии к культуральному пластику, обеспечивающего однотипную локализацию адипоцитов в объеме культурального сосуда и расширяющего возможности микроскопического наблюдения за состоянием обеих клеточных популяций.
Поставленная задача решается благодаря тому, что в способе совместного культивирования зрелых адипоцитов с клетками крыс с использованием полупроницаемых мембран вкладышей, включающем выделение зрелых адипоцитов из жировой ткани крыс, раздельное формирование клеточных монослоев на дне культуральной ячейки и на поверхности вкладыша, совместное культивирование двух клеточных популяций в общем культуральном сосуде, предусмотрены следующие отличия: 1) вкладыш, выполненный в виде пластины из непроницаемого для воды оптически прозрачного материала, размещают поверх культурального сосуда; 2) монослой прикрепленных адипоцитов формируют из всплывающих клеток с пространственной ориентацией на нижней стороне вкладыша; 3) гомогенный монослой прикрепленных адипоцитов отделяют от седиментировавших и взвешенных клеток путем переноса вкладыша из сосуда с монокультурой в сосуд для совместного культивирования.
Сущность предложенного способа заключается в следующем. Выделение зрелых адипоцитов из жировой ткани крыс может быть проведено специалистом в данной области любым известным методом.
Монослой всплывающих адипоцитов получают следующим способом. Культуральные сосуды подходящего объема, предпочтительно лунки многолуночного планшета, заполняют более чем наполовину объема питательной средой, рекомендованной для культивирования адипоцитов, в частности DMEM (среда Игла в модификации Дульбеко). Среду предварительно выдерживают в СО2-инкубаторе при температуре 37°С в течение 1-2 часов для установления равновесия газов. Поверх среды аккуратно наслаивают клеточную суспензию с расчетным количеством адипоцитов. Культуральные сосуды доверху заполняют питательной средой и, избегая образования пузырьков воздуха, накрывают покровными пластинами. Пластины выполнены из материала (стекла, обработанного пластика), отвечающего двум требованиям: 1) оптическая прозрачность, позволяющая использовать микроскоп для визуального контроля за состоянием клеточной популяции; 2) способность обеспечить клеточную адгезию. Адипоциты инкубируют при температуре 37°С в атмосфере 5% СО2 в течение 1-2 суток. В дальнейшем без изменения ориентации пластину с монослоем адипоцитов переносят в сосуд для сокультивирования.
В качестве второго типа клеток для совместного культивирования могут быть выбраны любые клетки, способные к адгезии к культуральному пластику, в том числе гепатоциты, миоциты, тиреоциты, мультипотентые мезинхимальные стромальные клетки (МСК) и другие. Эти клетки могут представлять собой первичные культуры или постоянные клеточные линии. Получение монослоя адгезированных клеток может быть проведено специалистом в данной области с использованием специальных методов.
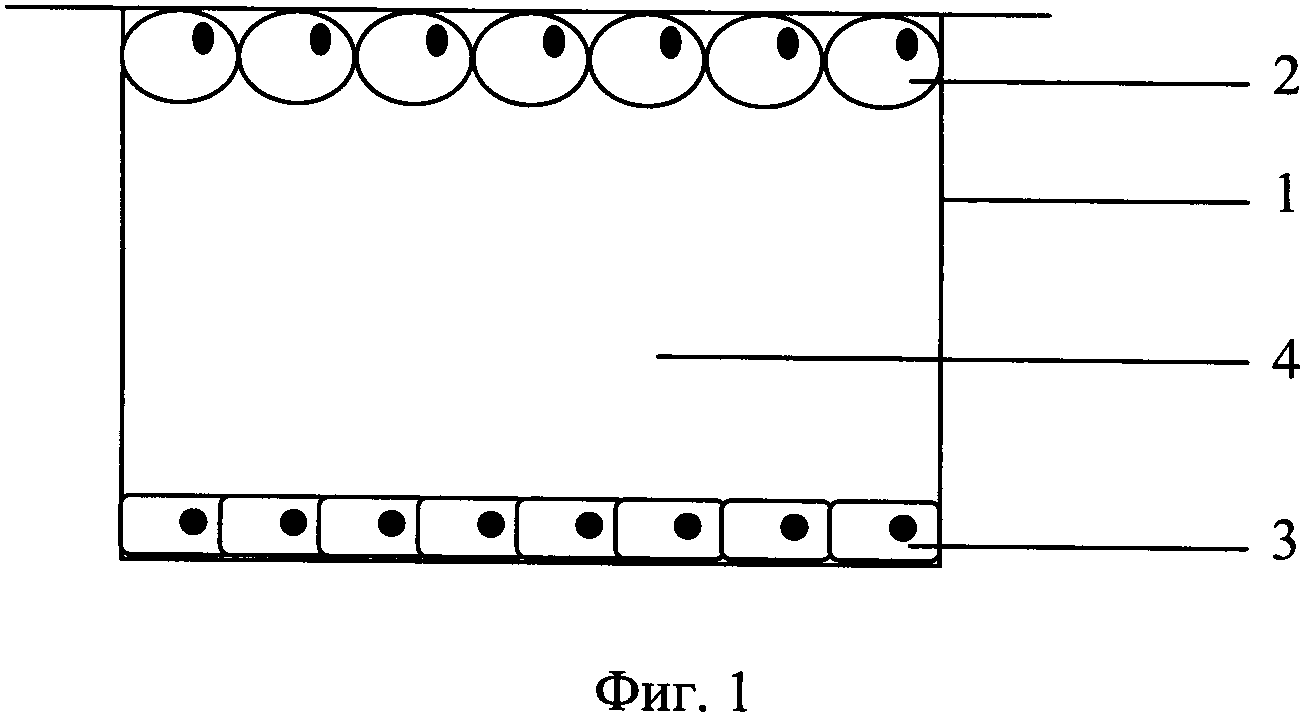
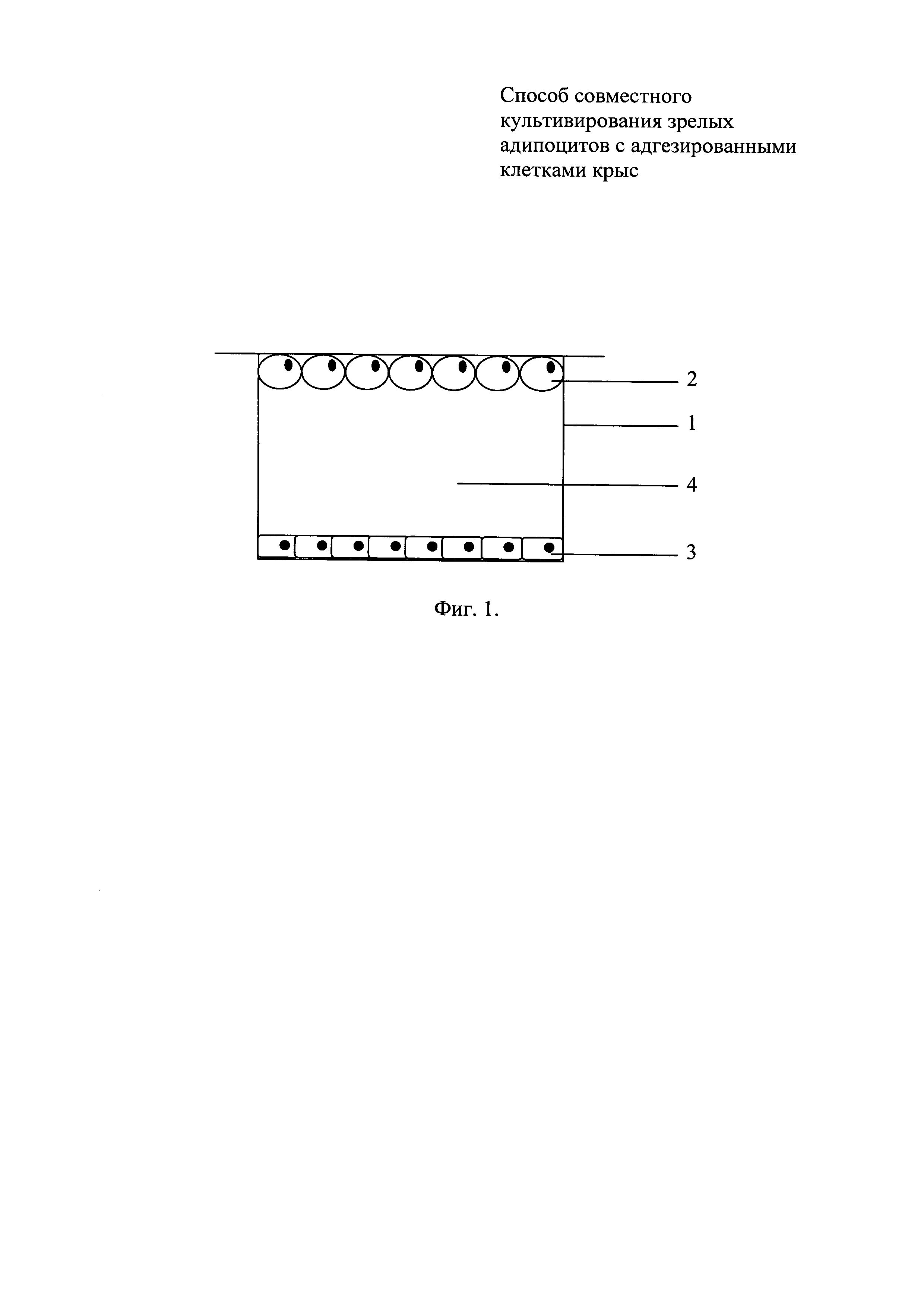
Совместное культивирование адипоцитов с клетками второго типа ведут в культуральном сосуде (фиг. 1), конструкция которого повторяет конструкцию сосуда, использованного для получения монослоя адипоцитов. Поверх сосуда фиг. 1 (1) размещена пластина с монослоем всплывших адипоцитов фиг. 1 (2), на дне сосуда находится монослой из клеток второго типа фиг. 1 (3). Питательная среда фиг. 1 (4), заполняя весь объем культурального сосуда, обеспечивает свободную диффузию веществ между двумя клеточными популяциями. Состав питательной среды, наличие в ней дополнительных фармакологических препаратов, так же как продолжительность и условия инкубации, подбираются специалистом в данной области исходя из конкретных задач.
Между совокупностью существенных признаков заявляемого объекта и достигаемым техническим результатом существует причинно-следственная связь. Благодаря изменению положения вкладыша в культуральном сосуде, а именно перемещению его из глубины сосуда к верхнему краю, в качестве субстрата для клеточной адгезии может использоваться только нижняя сторона вкладыша (покровной пластины). При такой конструкции культурального сосуда адипоциты формируют монослой преимущественно не на дне сосуда, а на поверхности покровной пластины, т.к. лишь в этом случае выталкивающая сила Архимеда из фактора, противодействующего адгезии клеток, превращается в фактор способствующий ей. В дальнейшем перенос покровной пластины в отдельный сосуд для сокультивирования позволяет отделить прикрепившиеся адипоциты от седиментировавших и взвешенных клеток, что обеспечивает однотипную локализацию адипоцитов при сокультивировании. Использование для изготовления покровной пластины вместо полупроницаемой мембраны водонепроницаемого оптически прозрачного материала (стекла, обработанного пластика), резко снижая светорассеяние на нем, существенно расширяет возможности микроскопического наблюдения за состоянием клеток, контроля полноты прикрепления и спонтанного открепления адипоцитов как на этапе монокультуры, так и на стадии сокультивирования.
Изобретение позволяет осуществлять сокультивирование любых адгезированных клеток крыс с прикрепившимися адипоцитами, сохраняя раздельность монослоев. Популяция адипоцитов характеризуется высокой гомогенностью благодаря однотипной локализации жировых клеток на поверхности покровной пластины, прочность адгезии адипоцитов достаточна для сохранения целостности монослоя в ходе сокультивирования. Жизнеспособность прикрепившихся адипоцитов сохраняется не менее 5 дней.
Конструкция сосуда для сокультивирования поддерживает свободный обмен молекулами любого размера между клеточными популяциями. Но благодаря разборности конструкции сохраняется возможность использования дополнительных полупроницаемых вкладышей, позволяющих избирательно ограничивать диффузию метаболитов в ходе одного эксперимента. Предлагаемый способ может быть использован для изучения долгосрочных эффектов паракринных взаимодействий, в том числе при тестировании фармакологических препаратов.
Отсутствие пор в материале покровной пластины улучшает его оптические свойства и снижает загрязнение препарата красителем, расширяя возможности применения и повышая качество микроскопии прижизненных и окрашенных препаратов обеих клеточных популяций.
Краткое описание чертежей
Фиг. 1. Схема культурального сосуда для сокультивирования зрелых адипоцитов с другими адгезированными клетками: 1 - культуральный сосуд; 2 - монослой всплывающих адипоцитов на покровной пластине; 3 - монослой адгезированных клеток второго типа; 4 - питательная среда.
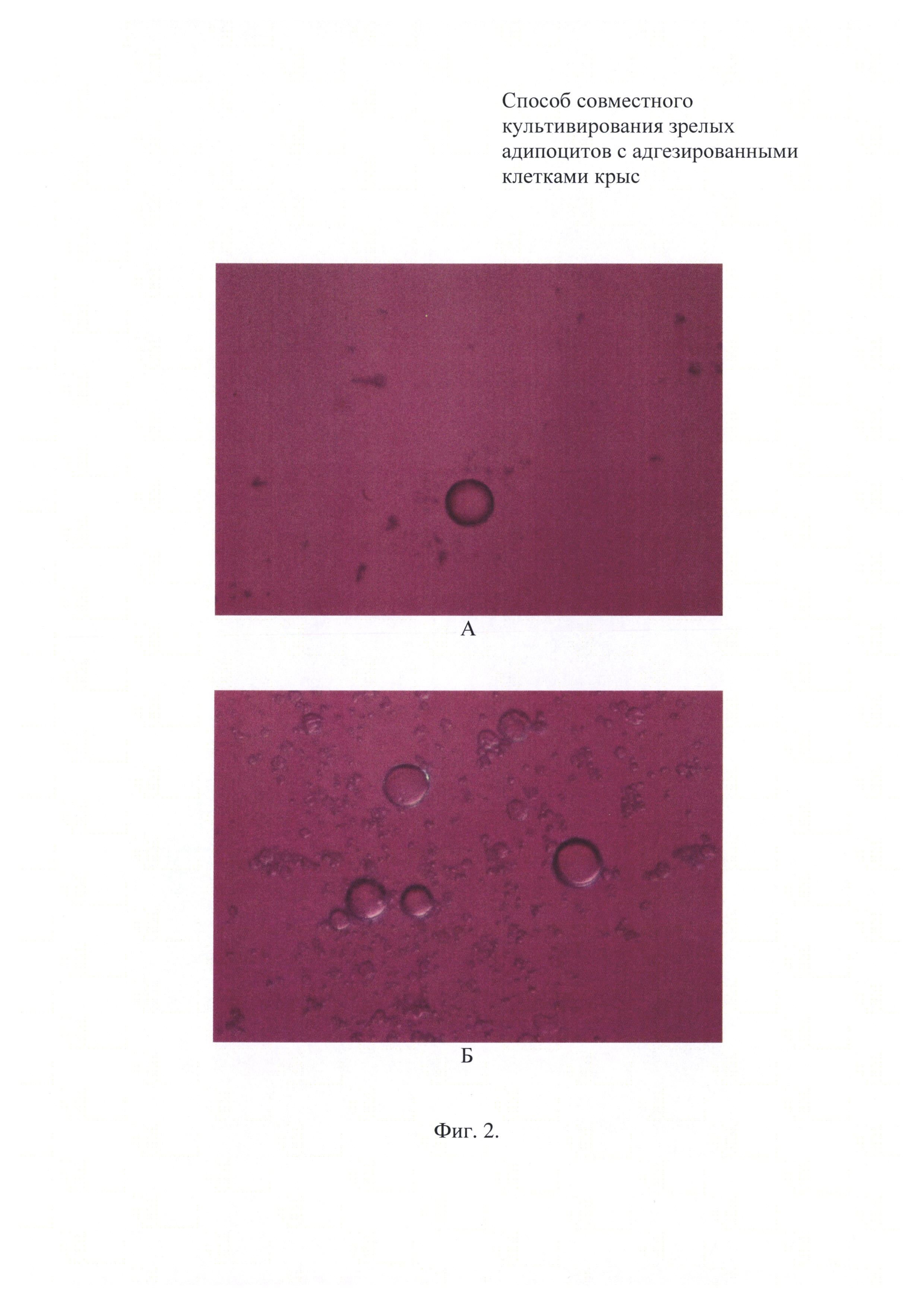
Фиг. 2. Прижизненное фото адипоцитов в монокультуре: А - монослой седиментировавших адипоцитов; Б - монослой всплывших адипоцитов.
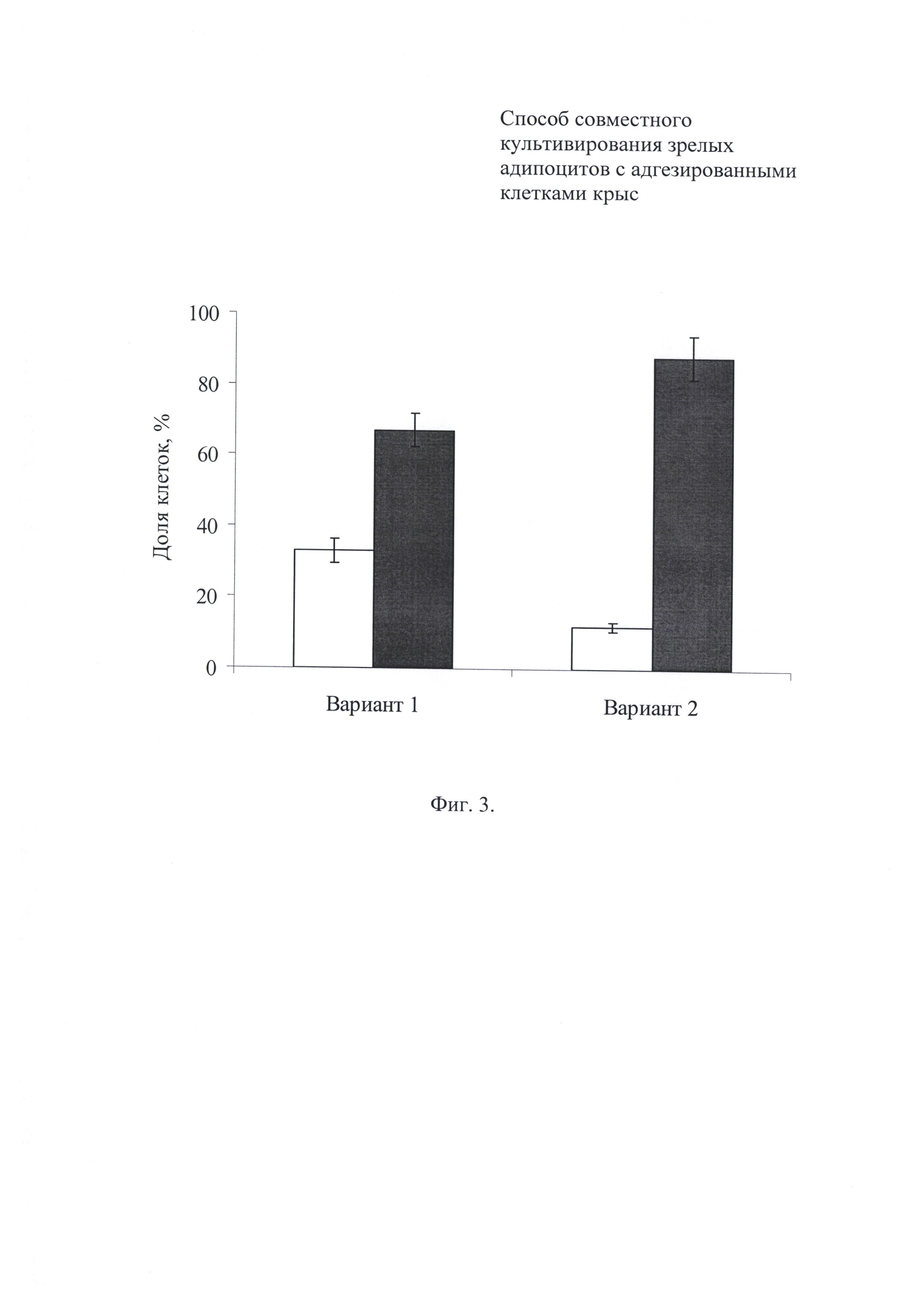
Фиг. 3. Распределение зрелых адипоцитов на дне ячейки и на поверхности покровной пластины в зависимости от технологии внесения клеточной суспензии (в процентах). Вариант 1 - клетки вносят на дно ячейки. Вариант 2 - клеточную суспензию наслаивают поверх питательной среды. Светлые прямоугольники - осевшие адипоциты, темные прямоугольники - всплывшие адипоциты.
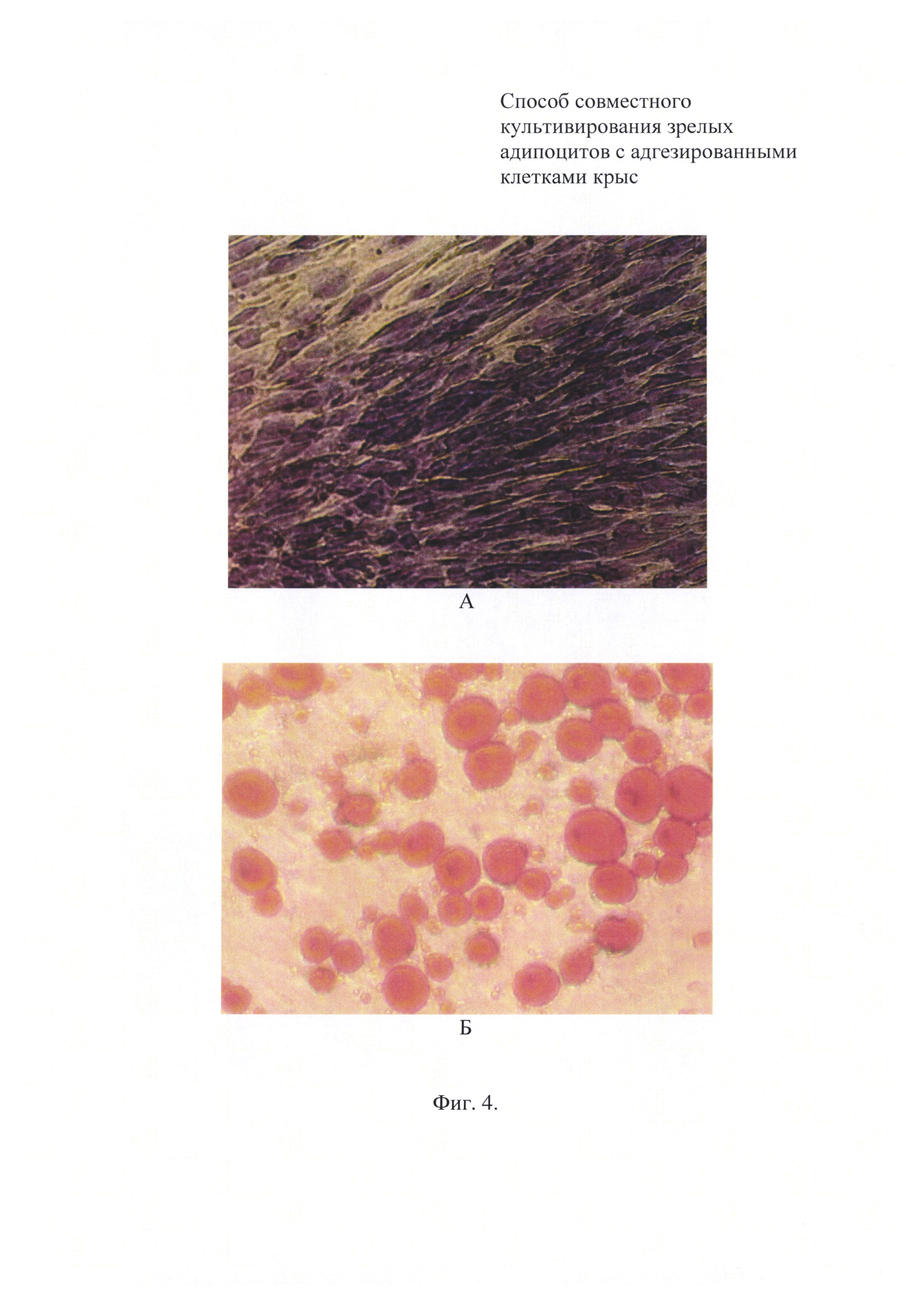
Фиг. 4. Фото клеточных монослоев при совместном культивировании адипоцитов и фибробластов в течение 5 дней: А - монослой адгезированных фибробластов (окраска по Романовскому-Гимза); Б - монослой всплывших адипоцитов (окраска красителем Oil Red О).
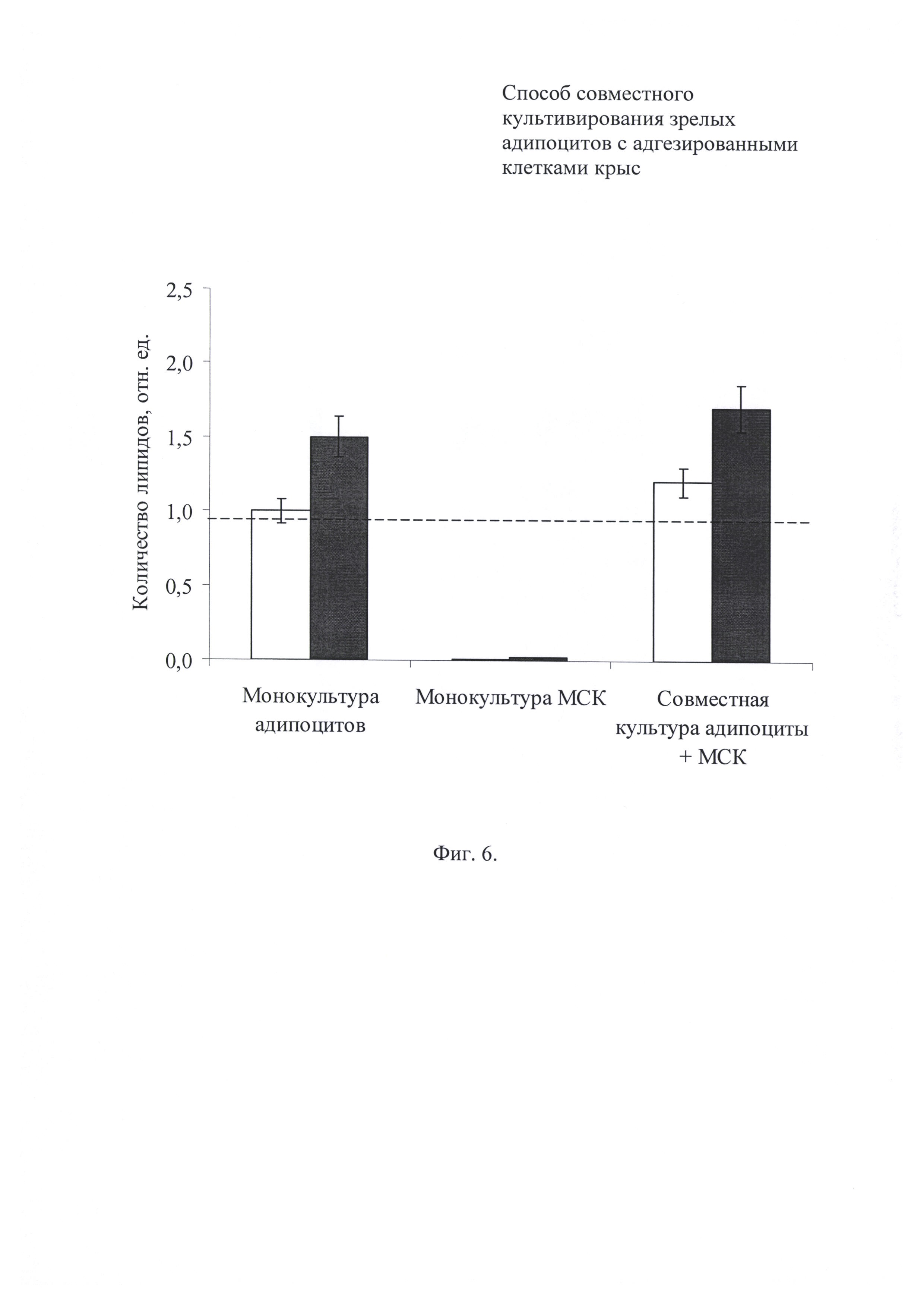
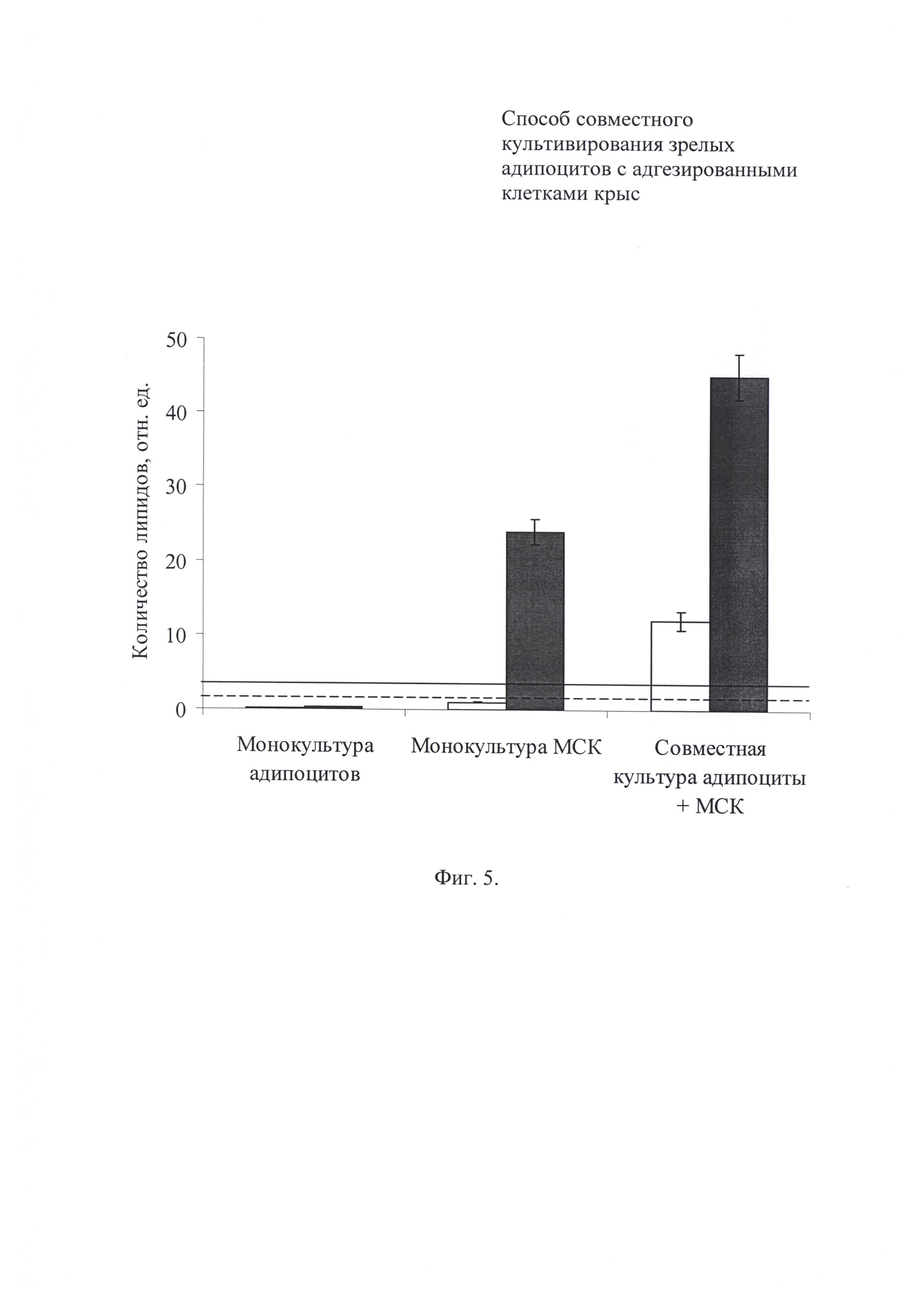
Фиг. 5. Количество липидов на дне культурального сосуда после 5 дней сокультивирования адипоцитов и МСК. Светлые прямоугольники - питательная среда DMEM; темные прямоугольники - питательная среда DMEM + инсулин; пунктирная линия - количество липидов в 1 день сокультивирования, среда DMEM; сплошная линия - количество липидов в 1 день сокультивирования, среда DMEM + инсулин. Данные представлены в относительных единицах; за единицу принимали содержание липидов в монокультуре неиндуцированных МСК (среда DMEM).
Фиг. 6. Количество липидов на покровной пластине после 5 дней сокультивирования адипоцитов и МСК. Светлые прямоугольники - питательная среда DMEM; темные прямоугольники - питательная среда DMEM + инсулин; пунктирная линия - количество липидов в 1 день сокультивирования, среда DMEM. Данные представлены в относительных единицах; за единицу принимали содержание липидов в монокультуре адипоцитов, поддерживаемых в среде DMEM.
Возможность осуществления заявляемого изобретения показана следующими примерами:
Пример 1. Получение монослоя всплывающих адипоцитов и его характеристика
Жировую ткань крыс получали от белых беспородных крыс весом 150-200 г с соблюдением норм биоэтики. В работе использовали подкожный жир из бедренной области.
Выделение зрелых адипоцитов осуществляли по методике, описанной Hazen S.A. с соавторами (Hazen S.A., Rowe W.A., Lynch C.J. Monolayer cell culture of freshly isolated adipocytes using extracellular basement membrane components. // Journal of Lipid Research. 1995. V. 36. P. 868-875) с некоторыми модификациями. Образцы ткани измельчали ножницами и инкубировали с раствором коллагеназы I типа (200 ед/мл) в DMEM со стептомицином и пенициллином (100 ед/мл) при 37°С в течение 60 минут при постоянном встряхивании. Адипоциты суспендировали в растворе. Непереваренные фрагменты ткани отделяли путем фильтрования через сито с размером ячеек 250 мкм. Клеточную взвесь центрифугировали 10 мин со скоростью 1000 об/мин. Осадок стромально-васкулярной фракции и маточный раствор удаляли. Флотировавшие адипоциты ресуспендировали в растворе Хенкса и центрифугировали в тех же условиях. Процедуру отмывки повторяли трехкратно.
Для получения монослоя всплывающих адипоцитов в ячейки 24-луночного планшета клетки вносили в количестве 104. Ячейки доверху заполняли питательной средой DMEM с антибиотиком и 10% фетальной телячьей сывороткой. Для установления равновесия газов среду предварительно в течение 1,5-2 ч выдерживали при температуре 37°С. Поверх каждой ячейки размещали покровное стекло размером 17×17 мм, избегая образования пузырей воздуха. Планшет накрывали крышкой и инкубировали при 37°С в атмосфере 5% СО2. Спустя сутки, когда всплывшие адипоциты прикреплялись к поверхности покровных стекол, их использовали для исследований.
Микроскопический контроль за прикреплением седиментирующих и всплывающих адипоцитов указывает на существенное преобладание в популяции клеток, локализованных на поверхности покровной пластины (фиг. 2). При этом характер распределения адипоцитов зависит от технологии внесения клеточной суспензии (фиг. 3). При внесении клеточной суспензии на дно ячейки фиг. 3 (вариант 1) соотношение осевших и всплывших адипоцитов примерно равно 1:2. При наслаивании клеточной суспензии поверх питательной среды, заполняющей не менее половины объема ячейки фиг. 3 (вариант 2), всплывает около 90% зрелых адипоцитов.
Для оценки прочности прикрепления клеток стеклянную пластину с монослоем адипоцитов переносили в новую ячейку, доверху заполненную свежей питательной средой. Спустя сутки на дне ячейки фиксировались одиночные жировые клетки, их число не превышало 50 на лунку. При повторных процедурах переноса число открепившихся клеток не увеличивалось. Таким образом монослой всплывающих адипоцитов обладает достаточной адгезией, чтобы выдержать манипуляции в ходе сокультивирования. Связанное с откреплением адипоцитов загрязнение дна ячейки не может служить источником серьезной погрешности.
Зрелые адипоциты были идентифицированы при окрашивании красителем Oil Red О. Популяция всплывающих адипоцитов по существу являлась однородной, т.к. загрязнение другими типами клеток не превышало 5%. В ходе культивирования изменений типичной морфологии зрелых адипоцитов отмечено не было.
Жизнеспособность свежеизолированных адипоцитов, определенная с помощью трипанового синего, составляла 90-95% и на протяжении 5 дней культивирования превышала 85%.
Пример 2. Сокультивирование зрелых адипоцитов с фибробластами кожи
Выделение адипоцитов из жировой ткани крыс и формирование монослоя адипоцитов проводили способом, описанным в примере 1.
Выделение фибробластов проводили из полнослойных кожных лоскутов крыс по методу, описанному Pajoum Shariati S.R. с коллегами (Pajoum Shariati S.R., Shokrgozar M.A., Vossoughi M., Eslamifar A. In vitro coculture of human skin keratinocytes and fibroblasts on a biocompatible and biodegradable scaffold // Iran Biomed J. 2009. V. 13, N. 3. P. 169-177) с некоторыми модификациями. Образцы ткани, очищенные от шерсти и гиподермы,измельчали ножницами и инкубировали с раствором коллагеназы I типа (200 ед./мл) в DMEM со стептомицином и пенициллином (100 ед./мл) при 37°С в течение 2 часов при постоянном встряхивании. Непереваренные фрагменты ткани отделяли фильтрованием через сито, клетки осаждали центрифугированием (10 мин. со скоростью 1000 об/мин), осадок ресуспендировали в питательной среде. Фибробласты культивировали в чашках Петри в среде DMEM с антибиотиком и 10% фетальной телячьей сывороткой при 37°С в атмосфере 5% CO2. На следующий день для удаления неприкрепившихся клеток питательную среду заменяли свежей. В дальнейшем среду меняли каждые 2-3 суток. При достижении субконфлюэнтного состояния клетки снимали трипсином-ЭДТА и пересевали в новые чашки.
Для сокультивирования использовали фибробласты второго пассажа. Клетки выращивали в 24-луночном планшете до достижения конфлюэнтности. Ячейки доверху заполняли питательной средой DMEM, поверх, сохраняя ориентацию клеточного монослоя, размещали покровные стекла с прикрепленными адипоцитами. Совместные культуры инкубировали в стандартных условиях в течение 5 дней. Одновременно в аналогичных условиях выращивали монокультуры адипоцитов и фибробластов.
Прижизненную оценку состояния клеточных популяций проводили визуально с использованием микроскопов с прямой и инвертированной оптическими схемами. Морфологию фибробластов оценивали после окраски по Романовскому-Гимза, наличие жировых капель в адипоцитах подтверждали в ходе окраски красителем Oil Red О.
Клетки обеих клеточных популяций сохраняли типичное строение (фиг. 4). На дне ячейки были обнаружены одиночные клетки открепившихся адипоцитов, общая численность которых не превышала 50 штук на ячейку. Признаков загрязнения популяции адипоцитов открепившимися фибробластами отмечено не было. Жизнеспособность фибробластов и адипоцитов, определенная с помощью трипанового синего, составляла более 90%.
Таким образом предлагаемый способ позволяет достичь однотипной локализации прикрепленных адипоцитов в ходе сокультивирования с минимальным загрязнением жировыми клетками популяции, находящейся на дне ячейки.
Пример 3. Сокультивирование зрелых адипоцитов с мультипотентными мезинхимальными стромальными клетками (МСК)
Целью эксперимента было оценить влияние зрелых жировых клеток на накопление липидов в МСК на поздних этапах адипогенной дифференцировки.
Выделение адипоцитов из жировой ткани крыс и формирование монослоя адипоцитов проводили способом, описанным в примере 1.
Выделение МСК производили из жировой ткани крыс по методу Zuk et. al. (Zuk P.A., Zhu M., Ashjian P. et all. Human adipose tissue is a source of multipotent stem cells // Molecular Biology of the Cell. 2002. V. 13. P. 4279-4295). Образцы ткани измельчали ножницами и инкубировали с раствором коллагеназы I типа (200 ед./мл) в DMEM со стрептомицином и пенициллином (100 ед./мл) при 37°С в течение 60 минут при постоянном встряхивании. После инактивации фермента эквивалентным объемом среды DMEM, содержащей 10% фетальной телячьей сыворотки, клетки осаждали центрифугированием. Осадок отбирали, ресуспендировали в 0,5 мл среды и подвергали гемолизу в течение 2 минут в дистиллированной воде. Изотоничность восстанавливали добавлением 10-кратного фосфатно-солевого буфера. Клетки повторно осаждали центрифугированием, пропускали через нейлоновое сито 100 мкм и высевали в чашки Петри. Клетки культивировали в среде DMEM с антибиотиком и 10% фетальной телячьей сывороткой при 37°С в атмосфере 5% СО2. На следующий день для удаления неприкрепившихся клеток питательную среду заменяли свежей. В дальнейшем среду меняли каждые 2-3 суток. При достижении субконфлюэнтного состояния клетки снимали трипсином-ЭДТ А и пересевали в новые чашки.
Индукцию адипогенной дифференцировки проводили по методу, описанному Hauner Н. с соавторами (Hauner Н., Wabitsch M., Pfeiffer E.F. Differentiation of adipocyte precursor cells from obese and nonobese adult women and from different adipose tissue sites // Horm Metab Res Suppl. 1988. V. 19. P. 35-39). МСК третьего пассажа выращивали в 24-луночном планшете до достижения 80% конфлюэнтности. В ячейки вносили 1000-кратный индуцирующий коктейль (1 мкл на мл среды), создающий конечные концентрации инсулина (5 мкг/мл), дексаметазона (1 мкмоль/л), изобутилметилксантина (500 мкмоль/л). Через двое суток индуцирующую среду заменяли питательной средой, содержащей инсулин (5 мкг/мл). Спустя семь дней, когда в индуцированных клетках стали обозначаться первые липидные капли, МСК использовали для сокультивирования со зрелыми адипоцитами.
Сокультивирование зрелых адипоцитов и индуцированных МСК. Покровные стекла с прикрепившимися адипоцитами с сохранением ориентации клеточного монослоя размещали поверх ячеек с индуцированными или неиндуцированными МСК. Замену питательной среды на аналогичную (DMEM + инсулин или DMEM соответственно) осуществляли каждые 2-3 дня, добиваясь чтобы она заполняла весь объем ячейки без воздушных пузырей. Совместные культуры инкубировали в стандартных условиях в течение 5 дней. Одновременно выращивали монокультуры адипоцитов и МСК.
Прижизненную оценку состояния клеточных популяций проводили визуально с использованием микроскопов с прямой и инвертированной оптическими схемами. Морфологию клеток изучали после окраски по Романовскому-Гимза, наличие жировых капель доказывали в ходе окраски красителем Oil Red О. Для количественного определения липидов краситель Oil Red О экстрагировали с влажных препаратов растворами изопропанола возрастающей концентрации (от 60% до 100%). Экстракты колориметрировали при длине волны 540 нм в кюветах 3 мм. Результаты представляли в относительных единицах. Для популяции клеток, выращенных на дне сосуда, за единицу принимали содержание липидов в монокультуре неиндуцированных МСК. Для популяции клеток, выращенных на покровной пластине, за единицу принимали содержание липидов в монокультуре адипоцитов, поддерживаемых в среде DMEM. Исследование проведено в 6 повторах. Для каждой группы рассчитывали среднее, стандартное отклонение, стандартную ошибку среднего.
В ходе совместного культивирования количество запасенных липидо, как в индуцированных, так и в неиндуцированных МСК увеличивалось более чем в 10 раз по сравнению с исходным уровнем (на фиг. 5 сплошная линия и пунктирные линии соответственно). Влияние зрелых адипоцитов на процесс накопления липидов неиндуцироваными МСК было сопоставимо с действием индуцирующего коктейля в монокультуре мезинхимальных стромальных клеток. Однако морфологически две популяции существенно отличались. В монокультуре клетки содержали по несколько крупных жировых включений. Для совместной культуры, напротив, характерны множественные мелкие липидные капли.
Запас липидов в монослое зрелых адипоцитов определялся, прежде всего, наличием в питательной среде инсулина (фиг. 6). Под действием этого гормона количество липидов возрастало и одновременно сокращалось число адипоцитов малого диаметра. Присутствие МСК в совместной культуре не оказывало значимого влияния на накопление липидов зрелыми алипоцитами.
Проведенный эксперимент демонстрирует, что при совместном культивировании зрелые адипоциты стимулируют липогенез в клетках дифференцирующихся МСК, в то время как обратное влияние не обнаруживается.
Таким образом, предлагаемое изобретение позволяет поддерживать однотипную локализацию прикрепленных адипоцитов в ходе сокультивирования, расширяя возможности использования микроскопии для контроля за состоянием обеих клеточных популяций. Способ может быть использован для изучения долгосрочных эффектов паракринных взаимодействий, в том числе при тестировании фармакологических препаратов.
Способ совместного культивирования зрелых адипоцитов с клетками крыс, способных к адгезии к культуральному пластику, характеризующийся тем, что выделяют зрелые адипоциты из жировой ткани крыс, получают монослой прикрепленных к вкладышу адипоцитов в монокультуре, где для получения монослоя адипоциты размещают в сосуде с монокультурой, который доверху заполняют питательной средой, накрывают указанный сосуд вкладышем и формируют за счет всплывающих клеток монослой прикрепленных к нижней стороне вкладыша адипоцитов, далее на дне сосуда для совместного культивирования формируют слой клеток крыс, способных к адгезии, путем выращивания их в сосуде для совместного культивирования до достижения конфлюэнтности, после чего весь объем сосуда заполняют питательной средой, вкладыш с прикрепленным монослоем адипоцитов и с сохранением ориентации переносят из сосуда с монокультурой в сосуд для совместного культивирования и размещают его поверх сосуда для совместного культивирования, причем вкладыш выполнен в виде пластины из непроницаемого для воды оптически прозрачного материала.