Результат интеллектуальной деятельности: МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ, КОТОРЫЕ ВОЗДЕЙСТВУЮТ НА СУБЪЕДИНИЦУ С ВАКУОЛЯРНОЙ АТФАЗЫ И ПРИДАЮТ УСТОЙЧИВОСТЬ К ЖЕСТКОКРЫЛЫМ НАСЕКОМЫМ-ВРЕДИТЕЛЯМ
Вид РИД
Изобретение
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
Настоящая заявка испрашивает приоритет по дате подачи заявки предварительной заявки США, серийный номер 61/428608, поданной 30 декабря 2010 года, на "МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ, КОТОРЫЕ ВОЗДЕЙСТВУЮТ НА СУБЪЕДИНИЦУ С ВАКУОЛЯРНОЙ АТФАЗЫ И ПРИДАЮТ УСТОЙЧИВОСТЬ К ЖЕСТКОКРЫЛЫМ НАСЕКОМЫМ-ВРЕДИТЕЛЯМ".
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в целом относится к генетическим методам регулирования повреждения растений, вызванного жесткокрылыми насекомыми. В конкретных вариантах осуществления настоящее изобретение относится к идентификации целевых кодирующих и некодирующих последовательностей и к применению технологий рекомбинантных ДНК для посттранскрипционного подавления или ингибирования экспрессии целевых кодирующих и некодирующих последовательностей в клетках жесткокрылых насекомых для обеспечения защитного эффекта у растений.
УРОВЕНЬ ТЕХНИКИ
Западный кукурузный жук (WCR), Diabrotica virgifera virgifera LeConte, является одним из наиболее вредных видов кукурузных корневых червей в Северной Америке и имеет особенно важное значение в зерновых районах Среднего Запада США. Северный кукурузный жук (NCR), Diabrotica barberi Smith and Lawrence, является близкородственным видом, который обитает в тех же зонах, что и WCR. Существует несколько других родственных подвидов Diabrotica, которые являются серьезными вредителями в Северной Америке: мексиканский кукурузный корневой червь (MCR), D. virgifera zeae Krysan and Smith; южный кукурузный жук (SCR), D. undecimpunctata howardi Barber; D. balteata LeConte; D. undecimpunctata tenella; и D. u. undecimpunctata Mannerheim. Министерство сельского хозяйства США в настоящее время оценивает, что кукурузные корневые черви являются причиной упущенной выручки в 1 миллиард долларов ежегодно, включая 800 миллионов долларов в год ущерба и 200 миллионов долларов издержек, связанных с обработкой.
Летом WCR и NCR сохраняются в почве в виде яиц. Насекомые пребывают в стадии яйца в течение зимы. Яйца продолговатой формы, белые, длиной меньше 0,004 дюйма (0,01016 см). Личинка выходит из яйца в конце мая или в начале июня, причем точное время выхода из яйца меняется каждый год в зависимости от температурных различий и местоположения. Вновь вылупившиеся личинки представляют собой белых червей длиной меньше 0,125 дюйма. После того, как личинка вылупляется, она начинает питаться корнями кукурузы. Кукурузные корневые черви проходят через три фазы развития личинки. После питания в течение нескольких недель, личинки линяют в стадию куколки. Они окукливаются в почве и затем появляются из почвы в виде взрослых особей в июле и августе. Взрослые особи личинок корневых червей имеют в длину 0,25 дюйма (0,63 см).
Личинки кукурузного корневого червя заканчивают свое развитие на кукурузе и на некоторых других видах злаковых. Личинки, выращенные на желтом щетиннике, появляются позже и имеют меньший размер головной капсулы у взрослых особей, чем личинки, выращенные на кукурузе. Ellsbury et al. (2005) Environ. Entomol. 34:627-34. Взрослые особи WCR питаются кукурузными рыльцами, пыльцой и зернышками на незащищенных верхушках початков. Если взрослые особи WCR появляются раньше появления генеративных тканей кукурузы, они могут питаться тканью листьев, тем самым замедляя рост растения, и иногда уничтожают растение-хозяин. Однако взрослые особи быстро переходят на предпочитаемые ими кукурузные рыльца и пыльцу, когда они становятся доступны. Взрослые особи NCR также питаются генеративными тканями растения кукурузы, но, напротив, редко питаются листьями кукурузы.
Большинство повреждений кукурузы, наносимых корневыми червями, связано с питанием личинок. Вновь вылупившиеся корневые черви вначале питаются тонкими корневыми волосками кукурузы и делают ходы в кончиках корня. По мере того, как личинки становятся больше, они питаются и делают ходы в главных корнях. Когда корневые черви присутствуют в большом количестве, питание личинок часто приводит к сокращению корней по всей длине до основания стебля. Тяжелое повреждение корней ухудшает их способность транспортировать воду и питательные вещества в растение, снижает рост растения и приводит в результате к снижению зерновой продукции, при этом зачастую существенно уменьшая общую урожайность. Тяжелое повреждение корней также часто приводит к полеганию растений кукурузы, что усложняет сбор урожая и также снижает урожайность. Кроме того, питание взрослых особей генеративными тканями растения кукурузы может приводить к удалению столбиков на верхушке початков кукурузы. Если такое "срезание столбиков" является достаточно сильным во время сбрасывания пыльцы, то опыление может быть нарушено.
Попытки контроля злаковых корневых червей могут быть предприняты с помощью чередования культур, химических инсектицидов, биопестицидов (например, спорообразующая грамположительная бактерия, Bacillus thuringiensis) или с помощью их комбинации. Существенным недостатком чередования культур является наложение нежелательных ограничений на использование сельскохозяйственных угодий. Кроме того, кладка яиц некоторых видов корневых червей может происходить на полях, занятых соей, что снижает эффективность метода чередования культур, применяемого на практике с помощью кукурузы и сои. Химические инсектициды являются наиболее обнадеживающей стратегией по достижению контроля над злаковыми корневыми червями. Применение химических инсектицидов, однако, не является совершенной стратегией борьбы со злаковыми корневыми червями; в США ежегодный ущерб от злакового корневого червя составляет свыше миллиарда долларов, при суммировании расходов на химические инсектициды и стоимости ущерба, наносимого корневыми червями, который может иметь место, несмотря на применение инсектицидов. Высокие популяции личинок, сильные дожди и неправильное применение инсектицида (инсектицидов) могут приводить к недостаточному уничтожению злаковых корневых червей. Кроме того, постоянное применение инсектицидов приводит к отбору устойчивых к инсектицидам штаммов корневых червей, а также к возникновению серьезных экологических проблем, связанных с токсичностью многих инсектицидов в отношении видов, не являющихся мишенями.
РНК-интерференция (RNAi) представляет собой процесс с использованием эндогенных клеточных путей, при котором молекула интерферирующей РНК (iRNA) (например, молекула дцРНК), которая специфична всей последовательности гена-мишени или какой-либо его части соответствующего размера, вызывает деградацию мРНК, кодирующей ген-мишень. В последние годы RNAi применяют для осуществления “нокдауна” генов у некоторых видов и в экспериментальных системах; например, у C. elegans, растений, эмбрионов насекомых и у клеток в клеточной культуре. Смотрите, например, Fire et al. (1998) Nature 391:806-11; Martinez et al. (2002) Cell 110:563-74; McManus and Sharp (2002) Nature Rev. Genetics 3:737-47.
RNAi осуществляется за счет разрушения мРНК эндогенным путем, включающим в себя белковый комплекс DICER. DICER расщепляет длинные молекулы дцРНК на короткие фрагменты длиной приблизительно 20 нуклеотидов, называемые малыми интерферирующими РНК (миРНК). Молекула миРНК расплетается с образованием двух одноцепочечных РНК: “сопровождающая” цепь и ведущая цепь. “Сопровождающая” цепь разрушается, и ведущая цепь встраивается в РНК-индуцируемый сайленсинг-комплекс (RISC). Молекулы ингибиторной микрорибонуклеиновой кислоты (микроРНК) аналогичным образом могут включаться в RISC. Посттранскрипционное молчание генов происходит, когда ведущая цепь специфически связывается с комплементарной последовательностью молекулы мРНК и индуцирует расщепление с помощью белков Argonaute, каталитического компонента комплекса RISC. Известно, что данный процесс происходит повсюду в организме, несмотря на исходно ограниченные концентрации миРНК и/или микроРНК у некоторых эукариот, таких как растения, нематоды и некоторые насекомые.
Расщепляются и разрушаются только транскрипты, комплементарные миРНК и/или микроРНК, и поэтому нокдаун экспрессии мРНК специфичен по отношению к последовательности. В растениях существует несколько функциональных групп генов DICER. Эффект сайленсинга генов RNAi сохраняется в течение дней и, в экспериментальных условиях, может приводить к уменьшению представленности целевого транскрипта на 90% или больше, с последующим снижением уровней соответствующего белка.
Патент США 7612194 и патентные публикации США № US 2007/0050860, № US 2010/0192265 и № US 2011/0154545 раскрывают библиотеку из 9112 маркеров экспрессируемых последовательностей tag (EST), выделенных из куколки D. v. virgifera LeConte. В патенте США 7612194 и в патентной публикации США № US 2007/0050860 предложено функционально связать указанные последовательности с промотором молекулы нуклеиновой кислоты, которая комплементарна одной из нескольких определенных частичных последовательностей H+-АТФазы вакуолярного типа D. v. virgifera (V-ATPase), раскрытых в указанных публикациях для экспрессии антисмысловой РНК в клетках растений. Патентная публикация США № US 2010/0192265 предлагает функциональное связывание промотора с молекулой нуклеиновой кислоты, которая комплементарна определенной частичной последовательности гена D. v. virgifera с неизвестной и нераскрытой функцией (указано, что частичная последовательность на 58% идентична продукту гена C56C10.3 в C. elegans) для экспрессии антисмысловой РНК в клетках растений. Патентная публикация США № US 2011/0154545 предлагает функциональное связывание промотора с молекулой нуклеиновой кислоты, которая комплементарна двум определенным частичным последовательностям генов бета-субъединицы коатомера D. v. virgifera для экспрессии антисмысловой РНК в клетках растений. Кроме того, в патенте США 7943819 раскрыта библиотека из 906 маркерных экспрессируемых tag-последовательностей (EST), выделенных из личинки, куколки и рассеченных насекомых D. v. virgifera LeConte, и предложено функциональное связывание промотора с молекулой нуклеиновой кислоты, которая комплементарна определенной частичной последовательности гена белка 4b мультивезикулярного тельца D. v. virgifera для экспрессии двухцепочечной РНК в клетках растений.
В патенте США 7612194 и в патентных публикациях США № US 2007/0050860, № US 2010/0192265 и № US 2011/0154545 не предоставляется дополнительного указания по применению какой-либо определенной последовательности из более чем девяти тысяч предоставленных последовательностей, перечисленных в них, для РНК-интерференции, за исключением нескольких отдельных частичных последовательностей V-ATPase и отдельных частичных последовательностей генов с неизвестной функцией. Кроме того, патент США 7612194 и патентные публикации США № US 2007/0050860 и № US 2010/0192265, и № US 2011/0154545 не содержат указаний относительно других последовательностей из более чем девяти тысяч предоставленных последовательностей, которые являлись бы летальными или хотя бы полезными в других отношениях, при их использовании в качестве дцРНК или миРНК в видах злакового корневого червя. В патенте США 7943819 не представлены рекомендации по применению какой-либо конкретной последовательности из более чем девяти тысяч последовательностей, перечисленных в нем, для РНК-интерференции, кроме отдельной частичной последовательности гена хроматин-модифицирующего белка 4b. Кроме того, в патенте США 7943819 не представлены рекомендации относительно того, какие другие последовательности из более чем девяти тысяч предоставленных последовательностей являлись бы летальными, или хотя бы полезными в других отношениях, при их использовании в качестве дцРНК или миРНК в видах злакового корневого червя.
Подавляющее большинство последовательностей, комплементарных ДНК злаковых корневых червей (таких как указанные выше), не являются летальными для видов злаковых корневых червей при их использовании в виде дцРНК или миРНК. Например, Baum et al. (2007) описывают эффекты ингибирования нескольких генов-мишеней WCR с помощью RNAi. Авторы сообщали, что 8 из 26 целевых генов, которые они тестировали, не вызывали существенной гибели жесткокрылых насекомых-вредителей в эксперименте с применением очень высокой концентрации iRNA (например, дцРНК) свыше 520 нг/см2.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Раскрыты молекулы нуклеиновой кислоты (например, гены-мишени, ДНК, дцРНК, миРНК, микроРНК и hpРНК) и способы их применения для борьбы с жесткокрылыми насекомыми-вредителями, включая, например, D. v. virgifera LeConte (западный кукурузный жук, "WCR"); D. barberi Smith and Lawrence (северный кукурузный жук, "NCR"); D. u. howardi Barber (южный кукурузный жук, "SCR"); D. v. zeae Krysan and Smith (мексиканский кукурузный жук, "MCR"); D. balteata LeConte; D. u. tenella; и D. u. undecimpunctata Mannerheim. В конкретных примерах раскрыты показательные молекулы нуклеиновой кислоты, которые могут быть гомологичны по меньшей мере части одной или более нативных последовательностей нуклеиновой кислоты жесткокрылых насекомых-вредителей.
В указанных и в других примерах нативная последовательность нуклеиновой кислоты может представлять собой ген-мишень, продукт которого может быть, например и без ограничения: вовлечен в метаболический процесс; вовлечен в репродуктивный процесс; или вовлечен в развитие личинки. В некоторых примерах посттрансляционное ингибирование экспрессии целевого гена молекулой нуклеиновой кислоты, содержащей гомологичную последовательность, может быть летальным для жесткокрылых насекомых или может приводить к снижению роста и/или размножения. В конкретных примерах по меньшей мере один ген, выбранный из перечня, включающего D_vir_c47185_Caf1 180; D_vir_c1229_VatpaseC; D_vir_c1319_vatpaseH; и Contig_01_Rho1_l-191_CDC42, может быть выбран в качестве целевого гена для посттранскрипционного сайленсинга. В конкретных примерах целевой ген, используемый для посттрансляционного ингибирования, представляет собой ген, кодирующий субъединицу С вакуолярнойАТФазы, содержащий нуклеотидную последовательность, обозначаемую как D_vir_c1229_VatpaseC (SEQ ID NO: 2), или гомологичную ей последовательность. Таким образом, в описании раскрываются выделенные молекулы нуклеиновой кислоты, содержащие последовательность D_vir_c1229_VatpaseC (SEQ ID NO: 2), комплементарную ей последовательность и определенные новые фрагменты любой из обеих последовательностей.
Также раскрыты молекулы нуклеиновой кислоты, содержащие нуклеотидную последовательность, которая кодирует полипептид, который по меньшей мере на 85% идентичен аминокислотной последовательности в составе продукта целевого гена (например, продукта гена, выбранного из группы, состоящей из D_vir_c47185_Caf1 180; D_vir_c1229_VatpaseC; D_vir_c1319_VatpaseH; и Contig_01_Rho1_1-191_CDC42). В конкретных примерах молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид, который по меньшей мере на 85% идентичен аминокислотной последовательности полипептида, кодируемого геном субъединицы С вакуолярной АТФазы, содержащим нуклеотидную последовательность, обозначаемую здесь как D_vir_c1229_VatpaseC (SEQ ID NO: 2), или гомологичную ей последовательность. Кроме того, раскрываются молекулы нуклеиновой кислоты, содержащие нуклеотидную последовательность, которая представляет собой обратную комплементарную последовательность для нуклеотидной последовательности, которая кодирует полипептид, который по меньшей мере на 85% идентичен аминокислотной последовательности в составе продукта целевого гена.
Также раскрываются последовательности кДНК, которые можно использовать для получения молекул иРНК (например, дцРНК, миРНК, микроРНК и hpРНК), которые комплементарны всему целевому гену или его части у жесткокрылых насекомых, например: D_vir_c47185_Caf1 180; D_vir_c1229_VatpaseC; D_vir_c1319_VatpaseH; и/или Contig_01_Rho1_1-191_CDC42. В конкретных вариантах осуществления дцРНК, миРНК, микроРНК и/или hpРНК могут быть получены in vitro или in vivo с помощью генетически модифицированного организма, например, растения или бактерии. В конкретных примерах раскрываются молекулы кДНК, которые можно использовать для получения молекул иРНК, которые комплементарны D_vir_c1229_VatpaseC или его определенным новым фрагментам.
Также раскрываются средство для ингибирования экспрессии важного гена жесткокрылого насекомого и средство для обеспечения устойчивости растения к жесткокрылым насекомым. Средство для ингибирования экспрессии важного гена жесткокрылого насекомого представляет собой одно- или двухцепочечную молекулу РНК, состоящую из любой из SEQ ID NO: 7, 8, 10, 11, 49, 50, 86, 87, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 127, 128, 129, 130, 131 или из комплементарной им последовательности. Средство для обеспечения устойчивости растения к жесткокрылым насекомым представляет собой молекулу ДНК, содержащую последовательность нуклеиновой кислоты, кодирующую средство для ингибирования экспрессии важного гена у жесткокрылого насекомого, функционально связанного с промотором, где молекула ДНК способна интегрироваться в геном растения кукурузы.
Раскрываются способы контроля популяции жесткокрылого насекомого, включающие предоставление жесткокрылому насекомому молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которые действует после поглощения жесткокрылым насекомым с ингибированием биологической функции у жесткокрылого насекомого, где молекула iRNA содержит всю нуклеотидную последовательность или ее часть, выбранную из группы, состоящей из: SEQ ID NO: 1; последовательности, комплементарной SEQ ID NO: 1; SEQ ID NO: 2; последовательности, комплементарной SEQ ID NO: 2; SEQ ID NO: 3; последовательности, комплементарной SEQ ID NO: 3; SEQ ID NO: 4; последовательности, комплементарной SEQ ID NO: 4; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей всю последовательность или часть любой из последовательностей SEQ ID NO: 1-4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей всю последовательность или часть любой из последовательностей SEQ ID NO: 1-4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую всю последовательность или часть любой из последовательностей SEQ ID NO: 1-4; и последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую всю последовательность или часть любой из последовательностей SEQ ID NO: 1-4.
В конкретных примерах раскрываются способы контроля популяции жесткокрылого насекомого, включающие предоставление жесткокрылому насекомому молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которая действует после поглощения жесткокрылым насекомым с ингибированием биологической функции у жесткокрылого насекомого, где молекула iRNA содержит нуклеотидную последовательность, выбранную из группы, состоящей из: всей последовательности или части SEQ ID NO: 1; последовательности, комплементарной всей последовательности или части SEQ ID NO: 1; SEQ ID NO: 2; последовательности, комплементарной SEQ ID NO: 2; SEQ ID NO: 3; последовательности, комплементарной SEQ ID NO: 3; SEQ ID NO: 4; последовательности, комплементарной SEQ ID NO: 4; всей последовательности или части SEQ ID NO: 5; всей последовательности или части последовательности, комплементарной SEQ ID NO: 5; всей последовательности или части SEQ ID NO: 6; всей последовательности или части последовательности, комплементарной SEQ ID NO: 6; SEQ ID NO: 7; последовательности, комплементарной SEQ ID NO: 7; SEQ ID NO: 8; последовательности, комплементарной SEQ ID NO: 8; SEQ ID NO: 112; последовательности, комплементарной SEQ ID NO: 112; SEQ ID NO: 113; последовательности, комплементарной SEQ ID NO: 113; всей последовательности или части нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей SEQ ID NO: 1; всей последовательности или части последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей SEQ ID NO: 1; всей последовательности или части нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую SEQ ID NO: 1; и всей последовательности или части последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую SEQ ID NO: 1.
В описании также раскрываются способы, в которых дцРНК, миРНК, микроРНК и/или hpРНК могут быть предоставлены жесткокрылому насекомому в тесте кормления, или в генетически модифицированных растительных клетках, экспрессирующих дцРНК, миРНК, микроРНК и/или hpРНК. В указанных и в других примерах дцРНК, миРНК, микроРНК и/или hpРНК могут потребляться личинками жесткокрылых насекомых. Потребление дцРНК, миРНК, микроРНК и/или hpРНК изобретения может затем приводить к RNAi у личинок, которая, в свою очередь, может вызывать сайленсинг гена, необходимого для выживаемости жесткокрылого насекомого, и приводит в конечном итоге к гибели личинок. Таким образом, раскрываются способы, в которых молекулы нуклеиновой кислоты, содержащие типичную последовательность (последовательности), полезную для борьбы с жесткокрылыми насекомыми, предоставляются жесткокрылому насекомому. В конкретных примерах жесткокрылое насекомое, контролируемое путем применения молекул нуклеиновой кислоты изобретения, может представлять собой WCR или NCR.
Упомянутые выше и другие особенности будут более понятны благодаря приведенному ниже подробному описанию некоторых вариантов осуществления, которое следует далее со ссылкой на прилагаемые фигуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
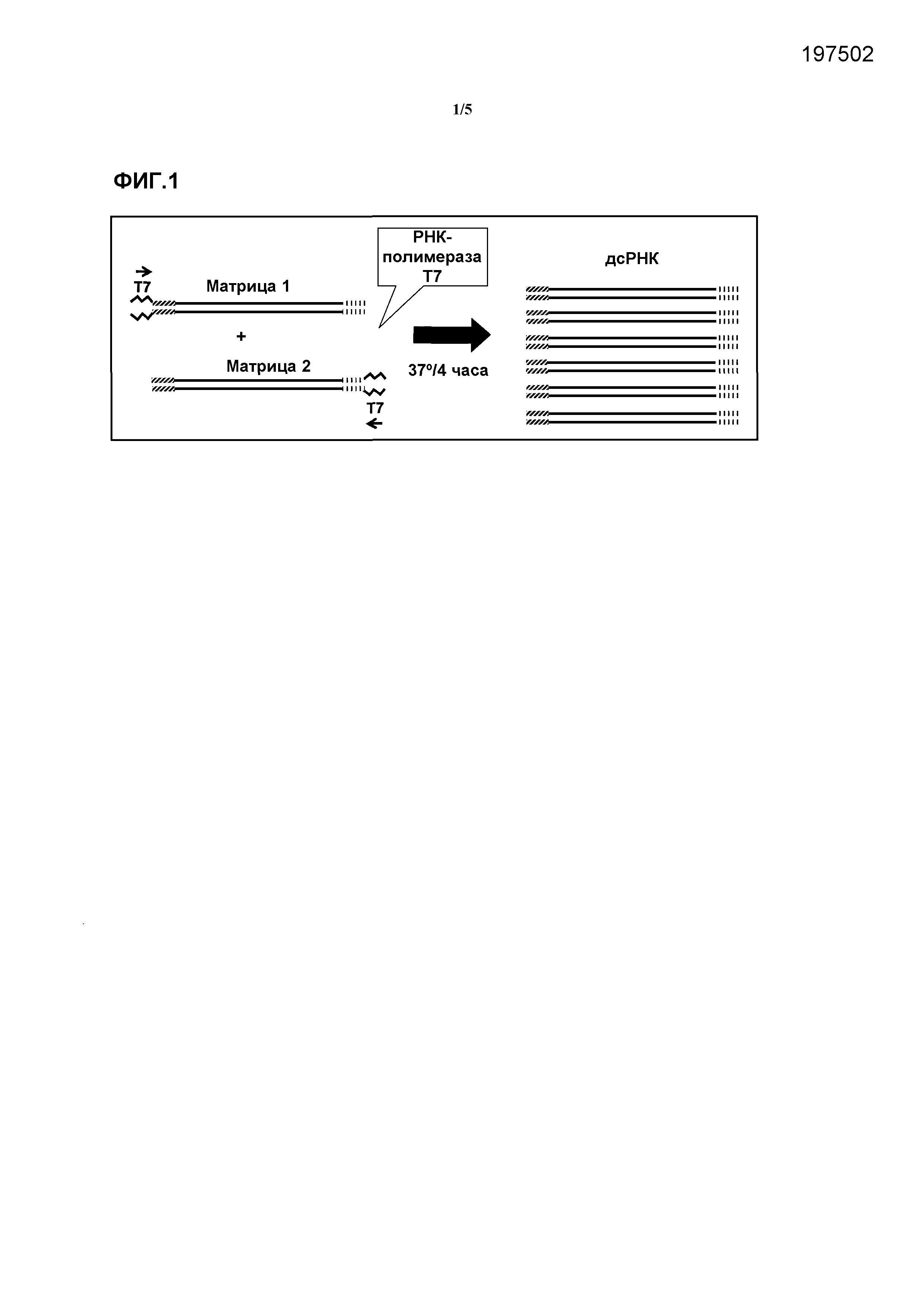
Фиг.1 представляет собой изображение стратегии, применяемой для создания специфических матриц для получения дцРНК.
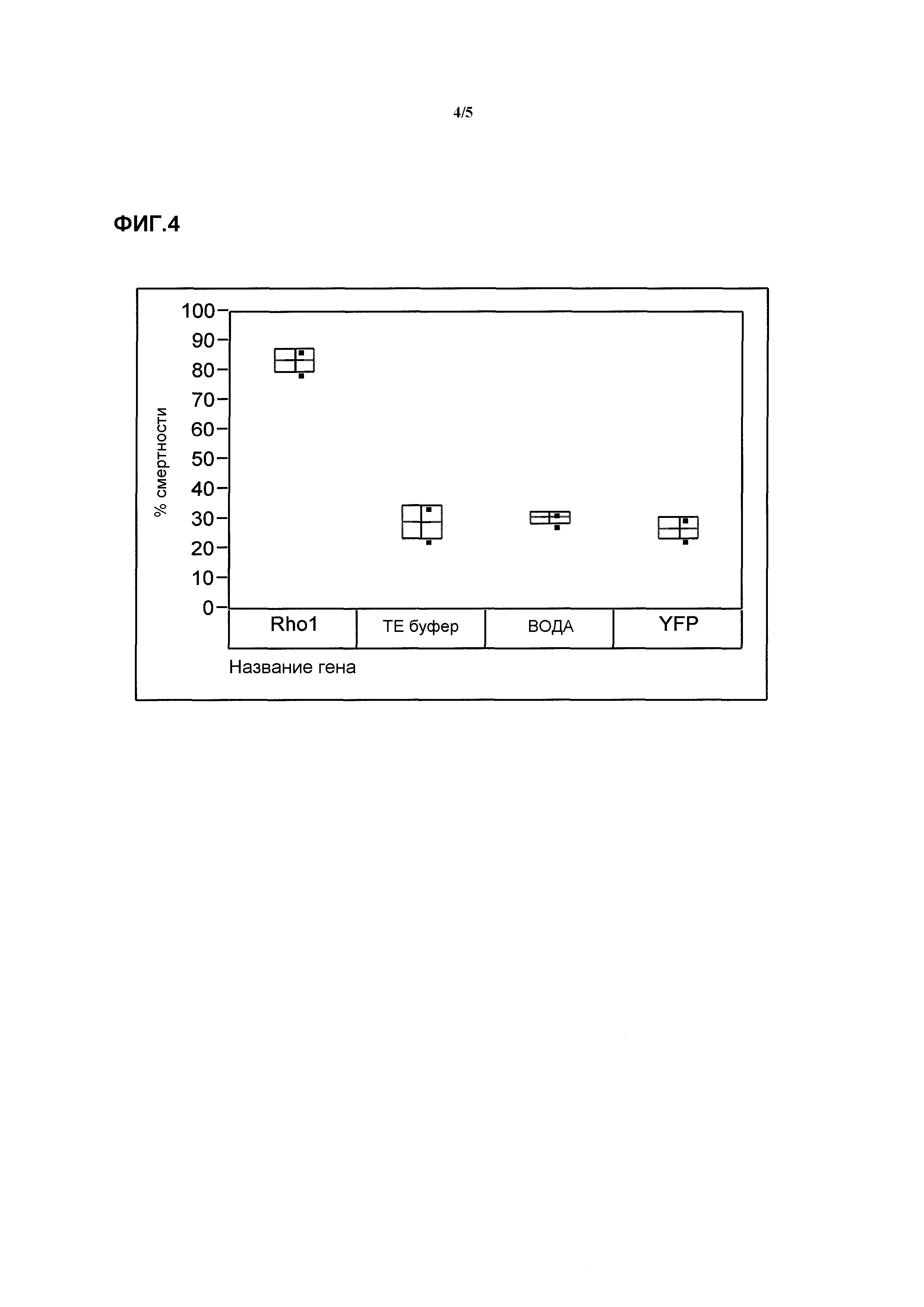
Фиг.2 представляет собой график изменчивости при ингибировании роста жесткокрылых насекомых, обработанных показательными молекулами нуклеиновой кислоты.
Фиг.3 представляет собой график изменчивости, отражающий смертность жесткокрылых насекомых, обработанных показательными молекулами нуклеиновой кислоты.
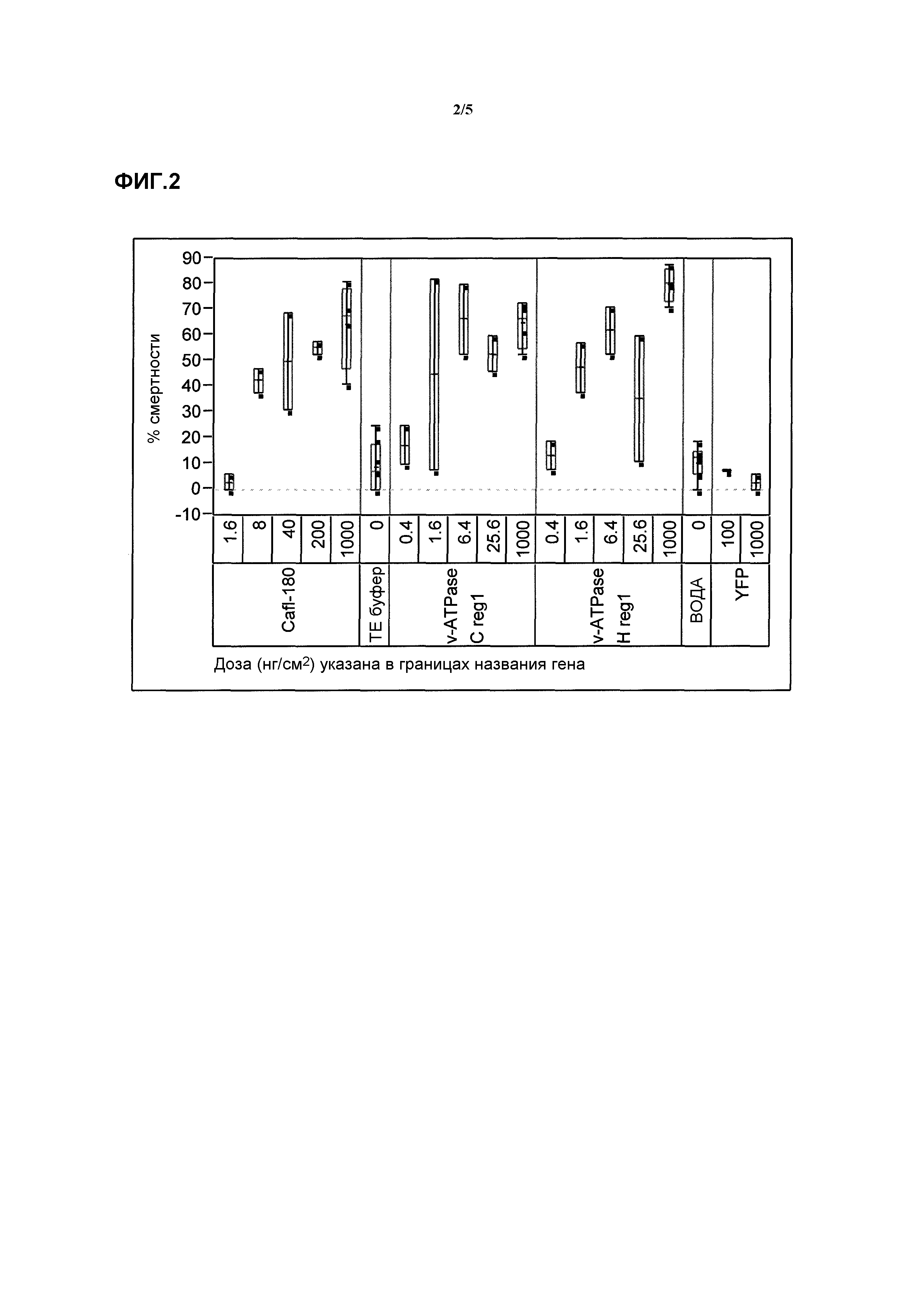
Фиг.4 представляет собой другой график изменчивости при ингибировании роста жесткокрылых насекомых, обработанных показательными молекулами нуклеиновой кислоты.
Фиг.5 представляет собой описание в виде картинки некоторых нуклеотидных последовательностей, которые могут быть представлены в определенных молекулах нуклеиновой кислоты изобретения. Если указано, то "(последовательность)", обозначает участок изображенной нуклеотидной последовательности, характеризующийся любой длиной и определенной последовательностью, например и без ограничения, непрерывный сегмент любой из SEQ ID NO: 1-4. Участки изображенных нуклеотидных последовательностей, выделенные курсивом, являются произвольными.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновой кислоты, перечисленные в прилагаемом списке последовательностей, показаны с использованием стандартных буквенных аббревиатур нуклеотидных оснований, как определено в 37 C.F.R. § 1.822. Показана только одна цепь каждой последовательности нуклеиновой кислоты, но комплементарная цепь и обратная комплементарная цепь понятны, поскольку они включены посредством ссылки на представленную цепь. В прилагаемом списке последовательностей:
SEQ ID NO: 1 представляет типичную последовательность кДНК Diabrotica, обозначаемую в некоторых местах как D_vir_c47185_Caf1 180 или Caf1-180.
SEQ ED NO: 2 представляет типичную последовательность кДНК Diabrotica, обозначаемую в некоторых местах как D_vir_c1229_VatpaseC или VatpaseC.
SEQ ID NO: 3 представляет типичную последовательность кДНК Diabrotica, обозначаемую в некоторых местах как D_vir_c1319_VatpaseH или VatpaseH.
SEQ ID NO: 4 представляет типичную последовательность кДНК, обозначаемую в некоторых местах как Contig_01_Rho1_1-191_CDC42 или Rho1.
SEQ ID NO: 5-8 представляют типичные некодирующие фрагменты субъединицы C кДНК вакуолярной АТФазы Diabrotica.
SEQ ID NO: 9-11 представляют типичные некодирующие фрагменты субъединицы H кДНК вакуолярной АТФазы Diabrotica.
SEQ ID NO: 12 представляет последовательность промотора фага T7.
SEQ ID NO: 13-38 представляют праймеры, используемые для амплификации частей кодирующих областей показательных целевых генов с помощью ПЦР.
SEQ ID NO: 39-48 представляют праймеры, используемые для амплификации областей генов Caf1-180 и VatpaseC для синтеза шпилечной РНК.
SEQ ID NO: 49 представляет последовательность ДНК Caf1-180, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136) для версии 1 вектора экспрессии, которая содержит консенсусную последовательность кукурузы.
SEQ ID NO: 50 представляет последовательность ДНК VatpaseC, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 для версии 1 вектора экспрессии, которая содержит консенсусную последовательность кукурузы.
SEQ ID NO: 51 представляет последовательность области 1 ДНК аннексина.
SEQ ID NO: 52 представляет последовательность области 2 ДНК аннексина.
SEQ ID NO: 53 представляет последовательность области 1 ДНК бета-спектрина 2.
SEQ ID NO: 54 представляет последовательность области 2 ДНК бета-спектрина 2.
SEQ ID NO: 55 представляет последовательность области 1 ДНК mtRP-L4.
SEQ ID NO: 56 представляет последовательность области 2 ДНК mtRP-L4.
SEQ ID NO: 57 представляет последовательность ДНК, кодирующую YFP.
SEQ ID NO: 58-85 представляют праймеры, используемые для амплификации областей генов аннексина, бета-спектрина 2, mtRP-L4 и YFP для синтеза дцРНК.
SEQ ID NO: 86 представляет показательный амплифицированный фрагмент 260 п.н. кДНК D_vir_c47185_Caf1-180, который применяли в качестве матрицы при синтезе молекулы дцРНК.
SEQ ID NO: 87-90 представляют типичные некодирующие фрагменты кДНК Rho1 Diabrotica.
SEQ ID NO: 91 представляет типичную последовательность ДНК Caf1-180, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136), включающую дополнительный сайт клонирования, фланкирующий интрон, для версии 1 вектора экспрессии, которая содержит консенсусную последовательность кукурузы.
SEQ ID NO: 92 представляет типичную последовательность ДНК Caf1-180, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136) для версии 2 вектора экспрессии, которая не содержит консенсусную последовательность кукурузы.
SEQ ID NO: 93 представляет типичную последовательность ДНК VatpaseC, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136), содержащую дополнительный сайт клонирования, фланкирующий интрон, для версии 1 вектора экспрессии hpРНК, которая содержит консенсусную последовательность кукурузы.
SEQ ID NO: 94 представляет типичную последовательность ДНК VatpaseC, образующую РНК в виде “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136) для версии 2 вектора экспрессии hpРНК, которая не содержит консенсусную последовательность кукурузы.
SEQ ID NO: 95 представляет типичный сегмент смысловой цепи ДНК Caf1-180, содержащей интрон ST-LS1 (SEQ ID NO: 136) для версии 3 вектора экспрессии.
SEQ ID NO: 96 представляет типичный сегмент антисмысловой цепи ДНК Caf1-180 для версии 3 вектора экспрессии.
SEQ ID NO: 97 представляет типичную последовательность ДНК Caf1-180, образующую РНК в виде “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136) для версии 3 вектора экспрессии.
SEQ ID NO: 98 представляет типичный сегмент смысловой цепи ДНК VatpaseC, содержащей интрон ST-LS1 (SEQ ID NO: 136) для версии 3 вектора экспрессии.
SEQ ID NO: 99 представляет типичный сегмент антисмысловой цепи ДНК VatpaseC версии 3 вектора экспрессии.
SEQ ID NO: 100 представляет типичную последовательность ДНК VatpaseC, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136) для версии 3 вектора экспрессии.
SEQ ID NO: 101 представляет типичный сегмент смысловой цепи ДНК VatpaseC, содержащей интрон ST-LS1 (SEQ ID NO: 136) для версии 4 вектора экспрессии.
SEQ ID NO: 102 представляет типичный сегмент антисмысловой цепи ДНК VatpaseC для версии 4 вектора экспрессии.
SEQ ID NO: 103 представляет типичную последовательность ДНК VatpaseC, образующую РНК в виде “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136), для версии 4 вектора экспрессии.
SEQ ID NO: 104 представляет типичный сегмент смысловой цепи ДНК VatpaseH, содержащей интрон ST-LS1 (SEQ ID NO: 136), для версии 1 вектора экспрессии.
SEQ ID NO: 105 представляет типичный сегмент антисмысловой цепи ДНК VatpaseH для версии 1 вектора экспрессии.
SEQ ID NO: 106 представляет типичную последовательность ДНК VatpaseH, образующую РНК в виде “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136), для версии 1 вектора экспрессии.
SEQ ID NO: 107 представляет типичный сегмент смысловой цепи ДНК Rho1, содержащей интрон ST-LS1 (SEQ ID NO: 136), для версии 1 вектора экспрессии.
SEQ ID NO: 108 представляет типичный сегмент антисмысловой цепи ДНК Rho1 для версии 1 вектора экспрессии.
SEQ ID NO: 109 представляет типичную последовательность ДНК, образующую РНК в форме “шпильки”, содержащую интрон ST-LS1 (SEQ ID NO: 136), для версии 1 вектора экспрессии.
SEQ ID NO: 110 представляет типичный сегмент ДНК Caf-180, используемый для получения матрицы при синтезе дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 111 представляет типичный сегмент области 1 ДНК VatpaseC, используемый для получения матрицы при синтезе дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 112 представляет типичный сегмент области 1 ДНК VatpaseC (короткий), используемый для получения матрицы при синтезе дцРНК, применяемой в биологических тестах с рационами кормления.
SEQ ID NO: 113 представляет типичный сегмент ДНК области 2 VatpaseC, используемый для получения матрицы при синтезе дцРНК, в биологических тестах с рационами кормления.
SEQ ID NO: 114 представляет типичный сегмент ДНК области 1 VatpaseH, используемый для получения матрицы при синтезе дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 115 представляет типичный сегмент области 2 ДНК VatpaseH, используемый для получения матрицы при синтезе дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 116 представляет типичный сегмент ДНК Rho1, используемый для получения матрицы при синтезе дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 117 представляет типичную смысловую цепь РНК VatpaseC ("VatpaseC5’-15"), применяемую в качестве дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 118 представляет дополнительную типичную смысловую цепь РНК VatpaseC ("VatpaseC5’-25"), применяемую в качестве дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 119 представляет дополнительную типичную смысловую цепь РНК VatpaseC ("VatpaseC3’-15"), применяемую в качестве дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 120 представляет дополнительную типичную смысловую цепь РНК VatpaseC ("VatpaseC3’-25"), применяемую в качестве дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 121-126 представляют праймеры, используемые для амплификации частей гена VatpaseC Diabrotica в качестве матриц для синтеза дцРНК.
SEQ ID NO: 127 представляет типичную смысловую цепь VatpaseC ("VatpaseC5’-50"), применяемую в качестве матрицы дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 128 представляет типичную смысловую цепь VatpaseC ("VatpaseC5’-100"), применяемую в качестве матрицы дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 129 представляет типичную смысловую цепь VatpaseC ("VatpaseC-174"), применяемую в качестве матрицы дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 130 представляет типичную смысловую цепь VatpaseC ("VatpaseC3’-50"), применяемую в качестве матрицы дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 131 представляет типичную смысловую цепь VatpaseC ("VatpaseC3’-100"), применяемую в качестве дцРНК в биологических тестах с рационами кормления.
SEQ ID NO: 132-135 представляют праймеры, применяемые в молекулярных анализах трансгенной кукурузы.
SEQ ED NO: 136 представляет интрон ST-LS1, который может быть полезен в некоторых вариантах осуществления для формирования шпилечной РНК.
SEQ ID NO: 137-138 представляют типичные некодирующие фрагменты кДНК Rho1 Diabrotica.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
I. Обзор некоторых вариантов осуществления
В описании раскрываются способы и композиции для генетического контроля поражений, вызванных жесткокрылыми насекомыми. Также предоставляются способы идентификации одного или более генов, необходимых для жизненного цикла жесткокрылого насекомого, для использования в качестве целевого гена для RNAi-опосредованного контроля популяции жесткокрылого насекомого. Векторы на основе плазмидной ДНК, кодирующие молекулы дцРНК, могут быть сконструированы для подавления одного или более целевых генов, необходимых для роста, выживания, развития и/или репродукции. В некоторых вариантах осуществления предоставляются способы посттранскрипционного подавления экспрессии или ингибирования кодирующей или некодирующей последовательности целевого гена у жесткокрылого насекомого. В указанных и других вариантах осуществления жесткокрылое насекомое может потреблять одну или более молекул дцРНК, миРНК, микроРНК и/или hpРНК, транскрибированные из всей или части молекулы нуклеиновой кислоты, которая комплементарна кодирующей или некодирующей последовательности целевого гена, что обеспечивает защитный эффект для растений.
Таким образом, некоторые варианты осуществления включают специфичное к последовательности ингибирование экспрессии продуктов целевого гена, с использованием дцРНК, миРНК, микроРНК и/или hpРНК, которые комплементарны кодирующей и/или некодирующей последовательностям целевого гена (генов), для достижения по меньшей мере частичного контроля над распространением жесткокрылого насекомого. Раскрывается набор выделенных и очищенных молекул нуклеиновой кислоты, содержащих нуклеотидную последовательность, например, как отражено в одной из SEQ ID NO: 1-8, 50, 93, 94, 98-103, 111-113 и 127-131. В некоторых вариантах осуществления стабильная молекула дцРНК (например, SEQ ID NO: 117-120) может экспрессироваться из указанных последовательностей, их фрагментов или гена, содержащих одну из указанных последовательностей, для посттранскрипционного сайленсинга или ингибирования целевого гена. В определенных вариантах осуществления выделенные и очищенные молекулы нуклеиновой кислоты включают SEQ ID NO: 2 и/или всю последовательность или часть любой из SEQ ID NO: 5 и 6.
Некоторые варианты осуществления включают рекомбинантную клетку-хозяин (например, растительную клетку), содержащую в своем геноме по меньшей мере одну последовательность рекомбинантной ДНК, кодирующую по меньшей мере одну молекулу iRNA (например, дцРНК). В конкретных вариантах осуществления молекула (молекулы) дцРНК может экспрессироваться при потреблении жесткокрылым насекомым, для посттранскрипционного сайленсинга или ингибирования экспрессии целевого гена у жесткокрылого насекомого. Последовательность рекомбинантной ДНК может включать, например, любую из SEQ ID NO: 1-8, 50, 93, 94, 98-103, 111-113 и 127-131, фрагменты любой из SEQ ID NO: 1-8, 50, 93, 94, 98-103, 111-113 и 127-131, или частичную последовательность гена, содержащую одну из последовательностей SEQ ID NO: 1-8, 50, 93, 94, 98-103, 111-113 и 127-131, или их комплементарные последовательности.
Конкретные варианты осуществления включают рекомбинантную клетку-хозяина, содержащую в своем геноме последовательность рекомбинантной ДНК, кодирующую по меньшей мере одну молекулу (молекулы) iRNA (например, дцРНК), содержащую SEQ ID NO: 2 и/или всю последовательность или часть любой из SEQ ID NO: 5 и 6. При потреблении жесткокрылым насекомым молекула (молекулы) iRNA может отключать или ингибировать экспрессию целевого гена субъединицы С вакуолярной АТФазы, содержащего SEQ ID NO: 2, 5-8, 112 и 113, у жесткокрылого насекомого, и тем самым вызывать прекращение роста, развития, размножения и/или питания жесткокрылого насекомого.
В некоторых вариантах осуществления рекомбинантная клетка-хозяин, содержащая в своем геноме по меньшей мере одну последовательность рекомбинантной ДНК, кодирующую по меньшей мере одну молекулу дцРНК, может представлять собой трансформированную растительную клетку. Некоторые варианты осуществления включают трансгенные растения, содержащие такую трансформированную растительную клетку. Помимо таких трансгенных растений, предоставляются растения-потомки трансгенного растения любого поколения, трансгенные семена и продукты трансгенного растения, каждый из которых содержит последовательность (последовательности) рекомбинантной ДНК. В конкретных вариантах осуществления молекула дцРНК изобретения может экспрессироваться в трансгенной растительной клетке. Таким образом, в указанных и в других вариантах осуществления молекула дцРНК изобретения может быть выделена из клетки трансгенного растения. В конкретных вариантах осуществления трансгенное растение представляет собой растение, выбранное из группы, включающей кукурузу (Zea mays), сою (Glycine max) и растения семейства Poaceae.
Некоторые варианты осуществления включают способ модулирования экспрессии целевого гена в клетке жесткокрылого насекомого. В указанных и других вариантах осуществления может предоставляться молекула нуклеиновой кислоты, где молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую молекулу дцРНК. В конкретных вариантах осуществления нуклеотидная последовательность, кодирующая молекулу дцРНК, может быть функционально связана с промотором и также может быть функционально связана с последовательностью терминации транскрипции. В конкретных вариантах осуществления способ модулирования экспрессии целевого гена в клетке жесткокрылого насекомого может включать: (a) трансформирование растительной клетки вектором, содержащим нуклеотидную последовательность, кодирующую молекулу дцРНК; (b) культивирование трансформированной растительной клетки в условиях, достаточных, чтобы обеспечить развитие культуры растительных клеток, содержащей множество трансформированных растительных клеток; (c) отбор трансформированной растительной клетки, которая содержит интегрированный в свой геном вектор; и (d) определение, что отобранная трансформированная растительная клетка содержит молекулу дцРНК, кодируемую нуклеотидной последовательностью вектора. Растение можно регенерировать из растительной клетки, которая имеет в своем геноме интегрированный вектор и содержит молекулу дцРНК, кодируемую нуклеотидной последовательностью вектора.
Таким образом, также раскрывается трансгенное растение, содержащее вектор с нуклеотидной последовательностью, кодирующей молекулу дцРНК, интегрированной в геном, где трансгенное растение содержит молекулу дцРНК, кодируемую нуклеотидной последовательностью вектора. В конкретных вариантах осуществления экспрессия молекулы дцРНК в растении является достаточной для модуляции экспрессии целевого гена в клетке жесткокрылого насекомого, которое контактирует с трансформированным растением или клеткой растения, например, путем питания трансформированным растением, частью растения (например корнями) или клеткой растения. Трансгенные растения, раскрытые здесь, могут проявлять сопротивляемость и/или повышенную устойчивость к поражению жесткокрылыми насекомыми. Конкретные трансгенные растения могут проявлять сопротивляемость и/или повышенную устойчивость к одному или более жесткокрылых насекомых, выбранных из группы, состоящей из: WCR; NCR; SCR; MCR; D. balteata LeConte; D. u. tenella; и D. u. undecimpunctata Mannerheim.
Также в описании раскрываются способы доставки регулирующих агентов, таких как молекула iRNA, жесткокрылому насекомому. Такие регулирующие агенты могут вызывать, прямо или косвенно, ухудшение способности жесткокрылого насекомого питаться, расти или каким-либо другим путем причинять ущерб хозяину. В некоторых вариантах осуществления предоставляется способ, включающий доставку стабильной молекулы дцРНК жесткокрылому насекомому для подавления по меньшей мере одного целевого гена у жесткокрылого насекомого, таким образом уменьшая или устраняя повреждение растения жесткокрылым насекомым. В некоторых вариантах осуществления способ ингибирования экспрессии целевого гена у жесткокрылого насекомого может приводить к прекращению роста, развития, размножения и/или питания жесткокрылого насекомого. В некоторых вариантах осуществления способ может приводить в итоге к гибели жесткокрылого насекомого.
В некоторых вариантах осуществления предоставляются композиции (например, топическая композиция), которые содержат молекулу iRNA (например дцРНК) изобретения для применения в растениях, животных и/или окружающей среде растения или животного, чтобы обеспечить устранение или уменьшение заражения жесткокрылыми насекомыми. В конкретных вариантах осуществления композиция может представлять собой питательную композицию или источник пищи, которым кормят жесткокрылое насекомое. Некоторые варианты осуществления включают создание композиции или источника питания, доступного для усвоения жесткокрылым насекомым. Потребление композиции, содержащей молекулы iRNA, может приводить к поглощению молекул одной или более клетками жесткокрылого насекомого, что в свою очередь может приводить к ингибированию экспрессии по меньшей мере одного целевого гена в клетке (клетках) жесткокрылого насекомого. Потребление или повреждение растения или растительной клетки жесткокрылым насекомым можно ограничить или устранить в или на любой ткани хозяина или в окружающей среде, где присутствует жесткокрылое насекомое, путем предоставления одной или более композиций, содержащих молекулу iRNA изобретения, в хозяине жесткокрылого насекомого.
Композиции и способы, раскрытые в описание, можно использовать в комбинациях вместе с другими способами и композициями для контролирования ущерба, причиняемого жесткокрылыми насекомыми. Например, молекула iRNA, как описано здесь, для защиты растений от жесткокрылых насекомых может быть использована в способе, включающем дополнительное применение одного или более химических агентов, эффективных против жесткокрылого насекомого, биопестицидов, эффективных против жесткокрылого насекомого, севооборота или рекомбинантных генетических технологий, которые проявляют характеристики, отличающиеся от характеристик RNAi-опосредованных методов и композиций RNAi изобретения (например, рекомбинантное получение белков растений, которые вредны для жесткокрылого насекомого (например, Bt-токсины)).
II. Сокращения
дцРНК - двухцепочечная рибонуклеиновая кислота
GI - ингибирование роста
NCBI - Национальный Центр Биотехнологической Информации
гДНК - геномная ДНК
iRNA - ингибиторная рибонуклеиновая кислота
ORF - открытая рамка считывания
RNAi - интерференция рибонуклеиновой кислоты
микроРНК - ингибиторная микрорибонуклеиновая кислота
миРНК - малая ингибиторная рибонуклеиновая кислота
hpРНК - рибонуклеиновая кислота в форме “шпильки”
UTR - нетранслируемая область
WCR - западный корневой жук (Diabrotica virgifera virgifera LeConte)
NCR - северный корневой жук (Diabrotica barberi Smith and Lawrence)
MCR - мексиканский корневой жук (Diabrotica virgifera zeae Krysan and Smith)
ПЦР - полимеразная цепная реакция
RISC - РНК-индуцируемый сайленсинг-комплекс
SCR - южный корневой жук (Diabrotica undecimpunctata howardi Barber)
III. Термины
В описании и в таблицах, которые следуют далее, используется ряд терминов. Для обеспечения ясного последовательного понимания описания и формулы изобретения, включающих содержание, в котором даны указанные термины, предоставляются следующие определения.
Жесткокрылое насекомое: В данном контексте термин "жесткокрылое насекомое" относится к насекомым рода Diabrotica, которые питаются кукурузой и другими истинными злаками. В конкретных примерах жесткокрылое насекомое выбирают из перечня, включающего D. v. virgifera LeConte (WCR); D. barberi Smith and Lawrence (NCR); D. u. howardi (SCR); D. v. zeae (MCR); D. balteata LeConte; D. u. tenella; и D. u. undecimpunctata Mannerheim.
Контакт (с организмом): В данном контексте термин "контакт с" организмом или "потребление" организмом (например, жесткокрылым насекомым), применительно к молекуле нуклеиновой кислоты, включает интернализацию молекулы нуктеиновой кислоты в организме, например и без ограничения: поглощение молекулы организмом (например при питании); контактирование организма с композицией, содержащей молекулу нуклеиновой кислоты; и смачивание организмов раствором, содержащим молекулу нуклеиновой кислоты.
Контиг: В данном контексте термин "контиг" обозначает последовательность ДНК, которую воссоздают из набора перекрывающихся сегментов ДНК, полученных из одного генетического источника.
Растение кукурузы: В данном контексте термин "растение кукурузы" относится к растению вида Zea mays (кукуруза).
Экспрессия: В данном контексте "экспрессия" кодирующей последовательности (например, гена или трансгена) относится к процессу, при котором кодированная информация единицы транскрипции нуклеиновой кислоты (включая, например, геномную ДНК или кДНК) переводится в действующую, бездействующую или структурную часть клетки, в том числе, включая синтез белка. На экспрессию гена могут влиять внешние сигналы; например, воздействие агента на клетку, ткань или организм, которое увеличивает или уменьшает экспрессию гена. Экспрессию гена также можно регулировать в любом месте метаболического пути от ДНК до РНК и до белка. Регуляция экспрессии гена происходит, например, с помощью контролей, действующих на транскрипцию, трансляцию, транспорт и процессинг РНК, деградацию промежуточных молекул, таких как мРНК, или с помощью активации, инактивации, компартментализации, или деградации специфических белковых молекул после того, как они были произведены, или с помощью комбинаций указанных процессов. Экспрессию генов можно оценить на уровне РНК или на уровне белка с помощью любого метода, известного в данной области, включая без ограничения, Нозерн-блоттинг, ЩТ-ПЦР, Вестерн-блоттинг или тест(ы) определения активности белков in vitro, in situ или in vivo.
Генетический материал: В данном контексте термин "генетический материал" включает все гены и молекулы нуклеиновой кислоты, такие как ДНК и РНК.
Ингибирование: В данном контексте термин "ингибирование", когда он используется для описания эффекта на кодирующую последовательность (например, ген), обозначает измеряемое снижение на клеточном уровне мРНК, транскрибируемой из кодирующей последовательности и/или пептида, полипептида или белкового продукта кодирующей последовательности. В некоторых примерах экспрессия кодирующей последовательности может быть ингибирована, так что экспрессия практически устраняется. "Специфическое ингибирование" обозначает ингибирование целевой кодирующей последовательности без последующего влияния на экспрессию других кодирующих последовательностей (например, генов) в клетке, где осуществляется специфическое ингибирование.
Выделенный: "Выделенный" биологический компонент (такой как нуклеиновая кислота или белок) по существу отделен от, произведен отдельно от или очищен от других биологических компонентов клетки организма, в котором он встречается в природе, т.е. от других хромосомных и экстрахромосомных ДНК и РНК, и белков. Молекулы нуклеиновой кислоты и белки, которые были "выделены", включают молекулы нуклеиновой кислоты и белки, очищенные с помощью стандартных способов очистки. Термин также включает нуклеиновые кислоты и белки, полученные с помощью рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновой кислоты, белки и пептиды.
Молекула нуклеиновой кислоты: В данном контексте термин "молекула нуклеиновой кислоты" может относиться к полимерной форме нуклеотидов, которые могут включать смысловую и антисмысловую цепи РНК, кДНК, геномной ДНК и синтетические формы и смешанные полимеры указанных выше соединений. Нуклеотид может обозначать рибонуклеотид, дезоксирибонуклеотид или модифицированную форму любого типа нуклеотида. "Молекула нуклеиновой кислоты" в данном контексте является синонимом "нуклеиновой кислоты" и "полинуклеотида". Молекула нуклеиновой кислоты обычно имеет в длину по меньшей мере 10 оснований, если не указано иное. Нуклеотидную последовательность молекулы нуклеиновой кислоты читают по соглашению с 5’-конца к 3’-концу молекулы. "Комплементарная последовательность" нуклеотидной последовательности обозначает последовательность, в направлении от 5’-конца к 3’-концу, нуклеиновых оснований, которые образуют пары оснований с нуклеиновыми основаниями нуклеотидной последовательности (т.е. A-T/U и G-C). "Обратная комплементарная последовательность" последовательности нуклеиновой кислоты обозначает последовательность, в направлении от 3’-конца к 5’-концу, нуклеиновых оснований, которые образуют пары оснований с нуклеиновыми основаниями нуклеотидной последовательности.
"Молекулы нуклеиновой кислоты" включают одно- и двухцепочечные формы ДНК; одноцепочечные формы РНК; и двухцепочечные формы РНК (дцРНК). Термин "нуклеотидная последовательность" или "последовательность нуклеиновой кислоты" относится как к смысловой, так и к антисмысловой цепям нуклеиновой кислоты в виде отдельных одиночных цепей или в виде дуплекса. Термин "рибонуклеиновая кислота" (РНК) включает iRNA (ингибиторная РНК), дцРНК (двухцепочечная РНК), миРНК (малая интерферирующая РНК), мРНК (матричная РНК), микроРНК (микро-РНК), hpРНК (шпилечная РНК), тРНК (транспортная РНК), заряженные или незаряженные за счет соответствующей ацилированной аминокислоты), и кРНК (комплементарная РНК). Термин "дезоксирибонуклеиновая кислота" (ДНК) включает кДНК, геномную ДНК и гибриды ДНК-РНК. Термины "сегмент нуклеиновой кислоты" и "сегмент нуклеотидной последовательности" или в более общем смысле "сегмент" понятны специалистам в данной области в качестве функционального термина, который включает геномные последовательности, последовательности рибосомальной РНК, последовательности транспортной РНК, последовательности матричной РНК, последовательности оперона и сконструированные малые нуклеотидные последовательности, которые кодируют или могут быть адаптированы для кодирования пептидов, полипептидов или белков.
Олигонуклеотид: Олигонуклеотид представляет собой короткий полимер нуклеиновой кислоты. Олигонуклеотиды могут быть получены при расщеплении более длинных сегментов нуклеиновой кислоты или с помощью полимеризации отдельных нуклеотидных предшественников. Автоматизированные синтезаторы позволяют провести синтез олигонуклеотидов длиной до нескольких сотен пар оснований. Поскольку олигонуклеотиды могут связываться с комплементарной нуклеотидной последовательностью, их можно использовать в качестве зондов для детектирования ДНК или РНК. Олигонуклеотиды, состоящие из ДНК (олигодезоксирибонуклеотиды) можно использовать в ПЦР, технологии для амплификации последовательностей ДНК и РНК (обратно транскрибируемой в кДНК). В РЦР олигонуклеотид обычно обозначается как "праймер", который обеспечивает удлинение олигонуклеотида ДНК-полимеразой и репликацию комплементарной цепи.
Молекула нуклеиновой кислоты может включать как встречающиеся в природе, так и модифицированные нуклеотиды, связанные друг с другом встречающимися в природе и/или не встречающимися в природе нуклеотидными связями. Молекулы нуклеиновой кислоты можно модифицировать химически или биохимически, или они могут содержать искусственные нуклеотидные основания или производные нуклеотидных оснований, что легко понять специалистам в данной области. Такие модификации включают, например, введение меток, метилирование, замену одного или более природных нуклеотидов их аналогами, межнуклеотидные модификации (например, введение незаряженных связей: например, метилфосфонатов, сложных фосфотриэфиров, фосфорамидатов, карбаматов и т.д.; введение заряженных связей: например, фосфортиоатов, фосфордитиоатов и т.д.; боковых групп, например, пептидов; интеркалирующих агентов, например, акридина, псоралена и т.д.; хелатообразующих агентов; алкилирующих агентов; и модифицированных связей, например, альфа-аномерных нуклеиновых кислот и т.д.). Термин "молекула нуклеиновой кислоты" также охватывает любую топологическую конформацию, включая одноцепочечные, двухцепочечные, частично дуплексные и триплексные конформации, конформации типа “шпильки”, кольцевые конформации и конформации типа “висячий замок”.
Используемый здесь в отношении ДНК термин "кодирующая последовательность," "структурная нуклеотидная последовательность" или "структурная молекула нуклеиновой кислоты" относится к нуклеотидной последовательности, которая в конечном итоге транслируется в полипептид с помощью транскрипции и мРНК, когда она находится под контролем соответствующих регуляторных последовательностей. В отношении РНК термин "кодирующая последовательность" относится к нуклеотидной последовательности, которая транслируется в пептид, полипептид или белок. Границы кодирующей последовательности определяются стартовым кодоном трансляции на 5’-конце и кодоном, терминирующим трансляцию, на 3’-конце. Кодирующие последовательности включают, но без ограничения: геномную ДНК; кДНК; EST; и рекомбинантные нуклеотидные последовательности.
Геном: В данном контексте термин "геном" относится к хромосомной ДНК, обнаруживаемой в ядре клетки, и также относится к ДНК органелл, обнаруживаемой в субклеточных компонентах клетки. В некоторых вариантах осуществления изобретения молекулу ДНК можно ввести в растительную клетку таким образом, что молекула ДНК интегрируется в геном растительной клетки. В указанных и других вариантах осуществления молекулу ДНК можно интегрировать либо в нуклеарную ДНК растительной клетки, либо в ДНК хлоропласта или митохондрии растительной клетки. Термин "геном", когда используется в отношении бактерии, относится как к хромосоме, так и к плазмидам в бактериальной клетке. В некоторых вариантах осуществления изобретения молекулу ДНК можно ввести в бактерию, в результате чего молекула ДНК интегрируется в геном бактерии. В указанных и других вариантах осуществления молекула ДНК может либо интегрироваться хромосомно, либо располагаться в виде плазмиды или в плазмиде.
Идентичность последовательности: Термин "идентичность последовательности" или "идентичность", который используется здесь в контексте двух последовательностей нуклеиновых кислот или полипептидных последовательностей, обозначает остатки в двух последовательностях, которые являются одинаковыми при выравнивании на предмет нахождения максимального соответствия в установленном окне сравнения.
В данном контексте термин "процент идентичности последовательности" может относиться к показателю, определяемому при сравнении двух оптимально выравненных последовательностей (например, последовательностей нуклеиновой кислоты) в окне сравнения, причем часть полинуклеотидной последовательности в окне сравнения может включать добавки или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит добавок или делеций) при оптимальном выравнивании двух последовательностей. Процент рассчитывается путем определения числа положений, в которых идентичное основание нуклеиновой кислоты или аминокислотный остаток присутствует в обеих последовательностях, с получением числа соответствующих положений, делением числа соответствующих положений на общее число положений в окне сравнения и умножением результата на 100 с получением процента идентичности последовательностей. Последовательность, которая идентична в каждом положении при сравнении с эталонной последовательностью, считается 100% идентичной эталонной последовательности, и наоборот.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например, в Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994) Methods Mol. Biol. 24:307-31; Tatiana et al. (1999) FEMS Microbiol. Lett. 174:247-50. Подробное рассмотрение способов выравнивания последовательностей и расчетов гомологии можно найти, например, в Altschul et al. (1990) J. Mol. Biol. 215:403-10.
Программа Basic Local Alignment Search Tool (BLASTTM; Altschul et al. (1990)) Национального Центра Биотехнологической Информации (NCBI) может быть получена из нескольких источников, включая Национальный Центр Биотехнологической Информации (Bethesda, MD), и в Интернете для применения с использованием нескольких программ анализа последовательностей. Описание определения идентичности последовательности с использованием указанной программы доступно в Интернете в разделе "помощь" для BLASTTM. Для сравнений последовательностей нуклеиновых кислот функция "Blast 2 sequences" программы BLASTTM (Blastn) может быть задействована с использованием стандартной матрицы BLOSUM62, с установленными по умолчанию параметрами. Последовательности нуклеиновой кислоты с еще большим сходством с эталонными последовательностями будут показывать возрастающий процент идентичности при их оценке данным способом.
Специфически гибридизуемый/специфически комплементарный: В данном контексте термины "специфически гибридизуемый" и "специфически комплементарный" являются терминами, которые показывают достаточную степень комплементарности, благодаря чему происходит стабильное и специфическое связывание между молекулой нуклеиновой кислоты и целевой молекулой нуклеиновой кислоты. Гибридизация между двумя молекулами нуклеиновой кислоты предусматривает образование антипараллельного выравнивания между последовательностями двух молекул нуклеиновой кислоты. Две молекулы, кроме того, способны создавать водородные связи с соответствующими основаниями на противоположной цепи с образованием двухцепочечной молекулы, которая, если она является достаточно стабильной, обнаруживается с использованием способов, хорошо известных в данной области. Молекула нуклеиновой кислоты не должна быть на 100% комплементарной своей последовательности-мишени для специфической гибридизации. Однако величина комплементарности последовательности, которая должна иметь место для того, чтобы гибридизация была специфической, является функцией используемых условий гибридизации. Условия гибридизации, приводящие к определенным значениям степени жесткости, могут меняться в зависимости от природы предпочитаемого метода гибридизации и длины гибридизующихся последовательностей нуклеиновой кислоты. В целом, температура гибридизации и ионная сила (в особенности концентрация Na+ и/или Mg++) буфера гибридизации будет определять строгость гибридизации, хотя продолжительность отмывок и композиции отмывочных буферов также влияют на строгость гибридизации. Расчеты, касающиеся условий гибридизации, необходимых для достижения определенных степеней строгости, известны специалистам в данной области и обсуждаются, например, у Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual. 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 and 11; и Hames and Higgins (eds.) Nucleic Acid Hybridization. IRL Press, Oxford, 1985. Дополнительные подробные инструкции и указания относительно гибридизации нуклеиновых кислот можно найти, например, у Tijssen, "Overview of principles of hybridization and the strategy of nucleic acid probe assays," в Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes. Part I, Chapter 2, Elsevier, NY, 1993; и Ausubel et al, Eds., Current Protocols in Molecular Biology. Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
В данном контексте "строгие условия" охватывают условия, при которых гибридизация будет происходить только при наличии менее чем 20% несоответствия между молекулой гибридизации и гомологичной последовательностью в молекуле-мишени нуклеиновой кислоты. "Строгие условия" включают, кроме того, определенные уровни строгости. Таким образом, используемые здесь "умеренно строгие" условия представляют собой условия, в которых молекулы с более чем 20% несоответствия последовательности не будут гибридизоваться; условия "повышенной строгости" представляют собой условия, в которых последовательности с более чем 10% несоответствия не будут гибридизоваться; и условия "очень высокой строгости" представляют собой условия, в которых последовательности с более чем 5% несоответствия не будут гибридизоваться.
Представленные ниже условия являются показательными, неограничивающими условиями гибридизации.
Режим высокой строгости (для обнаружения последовательностей, которые обладают по меньшей мере 90% идентичности последовательности): Гибридизация в 5× SSC буфере при 65°C в течение 16 часов; отмывка дважды в 2× SSC буфере при комнатной температуре в течение 15 минут каждая; и отмывка дважды в 0,5× SSC буфере при 65°C в течение 20 минут каждая.
Режим умеренной строгости (для обнаружения последовательностей, которые обладают по меньшей мере 80% идентичности последовательности): Гибридизация в 5-6× SSC буфере при 65-70°C в течение 16-20 часов; отмывка дважды в 2× SSC буфере при комнатной температуре в течение 5-20 минут каждая; и отмывка дважды в 1× SSC буфере при 55-70°C в течение 30 минут каждая.
Режим нестрогого контроля (будут гибридизоваться последовательности, которые обладают по меньшей мере 50% идентичности последовательности): Гибридизация в 6× SSC буфере от комнатной температуры до 55°C в течение 16-20 часов; отмывка по меньшей мере два раза в 2-3× SSC буфере от комнатной температуры до 55°C в течение 20-30 минут каждая.
Используемый в описании термин "по существу гомологичный" или "существенная гомология" по отношению к непрерывной последовательности нуклеиновой кислоты относится к непрерывным нуклеотидным последовательностям, которые гибридизуются в строгих условиях с эталонной последовательностью нуклеиновой кислоты. Например, последовательности нуклеиновой кислоты, которые по существу гомологичны эталонной последовательности нуклеиновой кислоты любой из SEQ ID NO: 1-6, представляют собой такие последовательности нуклеиновой кислоты, которые гибридизуются в строгих условиях (например, в условиях умеренной строгости, описанных выше) с референсной последовательностью нуклеиновой кислоты любой из SEQ ID NO: 1-6. По существу гомологичные последовательности могут характеризоваться по меньшей мере 80% идентичности последовательности. Например, по существу гомологичные последовательности могут характеризоваться от приблизительно 80% до 100% идентичности последовательности, как например, приблизительно 81%; приблизительно 82%; приблизительно 83%; приблизительно 84%; приблизительно 85%; приблизительно 86%; приблизительно 87%; приблизительно 88%; приблизительно 89%; приблизительно 90%; приблизительно 91%; приблизительно 92%; приблизительно 93%; приблизительно 94% приблизительно 95%; приблизительно 96%; приблизительно 97%; приблизительно 98%; приблизительно 98,5%; приблизительно 99%; приблизительно 99,5%; и приблизительно 100%. Свойство существенной гомологии тесно связано со специфической гибридизацией. Например, молекула нуклеиновой кислоты специфически гибридизуется при наличии достаточной степени комплементарности, чтобы не допустить неспецифического связывания нуклеиновой кислоты с нецелевыми последовательностями в условиях, в случае если желательно специфическое связывание, например, в строгих условиях гибридизации.
В данном контексте термин "ортолог" относится к гену в двух или более видах, который произошел от общей родовой нуклеотидной последовательности, и может сохранять одну и ту же функцию в двух или более видах.
В данном контексте считают, что две последовательности молекул нуклеиновой кислоты демонстрируют "полную комплементарность", если каждый нуклеотид последовательности, читаемой в 5’-3’ направлении, комплементарен каждому нуклеотиду другой последовательности, читаемой в 3’-5’ направлении. Нуклеотидная последовательность, которая комплементарна эталонной нуклеотидной последовательности, будет демонстрировать последовательность, идентичную обратной комплементарной последовательности эталонной нуклеотидной последовательности. Указанные термины и описания ясно определены в данной области и понятны специалистам в данной области.
Функционально связанный: Первая нуклеотидная последовательность функционально связана со второй последовательностью нуклеиновой кислоты, если первая последовательность нуклеиновой кислоты находится в функциональной зависимости со второй последовательностью нуклеиновой кислоты. При получении рекомбинантным способом функционально связанные последовательности нуклеиновой кислоты, как правило, являются непрерывными, и в случае необходимости соединяют две кодирующие белок области в одной и той же рамке считывания (например, в полицистронной ORF). Однако нуклеиновые кислоты не должны граничить друг с другом, чтобы быть функционально связанными.
Термин "функционально связанный", когда он используется в отношении регуляторной последовательности и кодирующей последовательности, означает, что регуляторная последовательность влияет на экспрессию связанной кодирующей последовательности. "Регуляторные последовательности" или "контрольные элементы" обозначают нуклеотидные последовательности, которые влияют на сроки и уровень/величину транскрипции, процессинга или стабильности РНК, или трансляции ассоциированной кодирующей последовательности. Регуляторные последовательности могут включать промоторы; лидерные последовательности трансляции; интроны; энхансеры; структуры типа "стебель-петля"; последовательности репрессоров связывания; терминирующие последовательности; последовательности распознавания сигналов полиаденилирования, и т.д. Определенные регуляторные последовательности могут быть расположены против хода транскрипции и/или по ходу транскрипции кодирующей последовательности, с которой они функционально связаны. Также определенные регуляторные последовательности, функционально связанные с кодирующей последовательностью, могут быть расположены на ассоциированной комплементарной цепи двухцепочечной молекулы нуклеиновой кислоты.
Промотор: В данном контексте термин "промотор" обозначает область ДНК, которая может находиться в 3’-5’ направлении по отношению к началу транскрипции, и которая может быть вовлечена в распознавание и связывание РНК-полимеразы и других белков для инициации транскрипции. Промотор может быть функционально связан с кодирующей последовательностью для экспрессии в клетке, или промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с кодирующей последовательностью для экспрессии в клетке. "Растительный промотор" может представлять собой промотор, способный к инициации транскрипции в клетках растений. Примеры промоторов, регулируемых стадией развития, включают промоторы, которые преимущественно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы обозначают как "тканепредпочтительные". Промоторы, которые инициируют транскрипцию только в определенных тканях, обозначают как "тканеспецифические". "Клеточно-специфический" промотор предпочтительно запускает экспрессию в определенных типах клеток в одном или более органах, например, сосудистые клетки корней или листьев. "Индуцируемый" промотор может представлять собой промотор, который регулируется условиями окружающей среды. Примеры условий окружающей среды, которые могут инициировать транскрипцию с помощью индуцируемых промоторов, включают анаэробные условия и наличие света. “Тканеспецифические”, “тканепредпочтительные”, клеточно-специфические и индуцируемые промоторы образуют класс "неконститутивных" промоторов. "Конститутивный" промотор является промотором, который может быть активен в большинстве условий окружающей среды или в большинстве типов клеток или тканей.
Какой-либо индуцируемый промотор может быть использован в некоторых вариантах осуществления изобретения. Смотрите Ward et al. (1993) Plant Mol. Biol. 22:361-366. При наличии индуцируемого промотора скорость транскрипции возрастает в ответ на индуцирующий агент. Типичные индуцируемые промоторы включают, но без ограничения: промоторы системы ACEI, которые реагируют на медь; ген In2 кукурузы, который реагирует на антидоты гербицида на основе бензолсульфонамида; репрессор Tet Tn10-системы; и индуцируемый промотор гена стероидного гормона, транскрипционная активность которого может индуцироваться гликокортикостероидным гормоном (Schena et al. (1991) Proc. Natl. Acad. Sci. USA 88:0421).
Показательные конститутивные промоторы включают, но без ограничения: промоторы вирусов растений, такие как промотор 35S вируса мозаики цветной капусты (CaMV); промоторы генов актина риса; промоторы убиквитина; pEMU; MAS; промотор гистона H3 кукурузы; и промотор ALS, XbaI/NcoI фрагмент 5’ структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, сходная с указанным фрагментом XbaI/NcoI) (Международная публикация PCT № WO 96/30530).
Кроме того, любой тканеспецифичный или тканепредпочтительный промотор можно использовать в некоторых вариантах осуществления изобретения. Растения, трансформированные молекулой нуклеиновой кислоты, содержащей кодирующую последовательность, функционально связанную с тканеспецифичным промотором, могут производить продукт кодирующей последовательности исключительно или преимущественно в специфической ткани. Показательные тканеспецифичные или тканепредпочтительные промоторы включают, но без ограничения: промотор, специфичный для корней, такой как промотор гена фазеолина; промотор, специфичный для листьев, и светоиндуцируемый промотор, такой как промоторы cab или rubisco; промотор, специфичный для пыльника, такой как промотор LAT52; промотор, специфичный для пыльцы Zm13; и промотор, предпочтительный для микроспоры, такой как промотор apg.
Трансформация: В данном контексте термин "трансформация" или "трансдукция" обозначает перенос одной или более молекул нуклеиновой кислоты в клетку. Клетка "трансформируется" молекулой нуклеиновой кислоты, трансдуцированной в клетку, если молекула нуклеиновой кислоты стабильно реплицируется клеткой, либо с помощью включения молекулы нуклеиновой кислоты в клеточный геном, либо с помощью эписомальной репликации. В данном контексте термин "трансформация" охватывает все методики, с помощью которых молекула нуклеиновой кислоты может быть введена в такую клетку. Примеры включают, но без ограничения: трансфекцию вирусными векторами; трансформацию плазмидными векторами; электропорацию (Fromm et al. (1986) Nature 319:791-3); липофекцию (Feigner et al. (1987) Proc. Natl. Acad. Sci. USA 84:7413-7); микроинъекцию (Mueller et al. (1978) Cell 15:579-85); перенос, опосредованный Agrobacterim (Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7); прямой захват ДНК; и баллистическую трансфекцию (Klein et al. (1987) Nature 327:70).
Трансген: Экзогенная последовательность нуклеиновой кислоты. В некоторых примерах трансген может представлять собой последовательность, которая кодирует одну или обе цепи молекулы дцРНК, которая содержит нуклеотидную последовательность, которая комплементарна молекуле нуклеиновой кислоты, обнаруживаемой у жесткокрылого насекомого. В других примерах трансген может представлять собой антисмысловую последовательность нуклеиновой кислоты, где экспрессия антисмысловой последовательности нуклеиновой кислоты ингибирует экспрессию целевой последовательности нуклеиновой кислоты. В других примерах трансген может представлять последовательность гена (например, гена устойчивости к гербициду), гена, кодирующего промышленно или фармацевтически полезное соединение, или гена, кодирующего желаемый сельскохозяйственный признак. В указанных и в других примерах трансген может содержать регуляторные последовательности, функционально связанные с кодирующей последовательностью трансгена (например, с промотором).
Вектор: Молекула нуклеиновой кислоты, которую вводят в клетку, например, для получения трансформированной клетки. Вектор может включать последовательности нуклеиновой кислоты, которые обеспечивают репликацию в клетке-хозяине, такие как точка начала репликации. Примеры векторов включают, но без ограничения: плазмиду; космиду; бактериофаг; или вирус, который переносит экзогенную ДНК в клетку. Вектор также может содержать один или более генов, антисмысловые последовательности и/или гены селектируемых маркеров и другие генетические элементы, известные в данной области. Вектор может трансдуцировать, трансформировать или инфицировать клетку, при этом заставляя клетку экспрессировать молекулы нуклеиновой кислоты и/или белки, кодируемые вектором. Вектор необязательно содержит материалы, способствующие осуществлению поступления молекулы нуклеиновой кислоты в клетку (например, липосома, белковая оболочка и т.д.).
Урожайность: Стабилизированная урожайность приблизительно 100% или выше по сравнению с урожайностью контрольных сортов в той же местности возделывания, при выращивании в то же самое время и при таких же условиях. В конкретных вариантах осуществления "улучшенная урожайность" или "повышение урожайности" означает культурный сорт растения, характеризующийся стабилизированной урожайностью 105-115% или выше, по сравнению с урожайностью контрольных сортов при возделывании в той же местности, характеризующейся существенной плотностью популяций жесткокрылых насекомых, которые повреждают сельскохозяйственную культуру, выращиваемую в то же время и в тех же условиях.
Если специально не оговорено, в данном контексте при употреблении единственного числа имеют в виду "по меньшей мере один".
За исключением особо указанных случаев, все технические и научные термины, используемые здесь, имеют такое же значение, как обычно понимают специалисты в области, к которой относится раскрытие изобретения. Определения общих терминов молекулярной биологии можно найти, например, у Lewin B., Genes V. Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology. Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference. VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8). Все процентные значения представлены по весу, и все количественные отношения в смешанных растворах представлены по объему, если не указано иначе. Все значения температур представлены в градусах Цельсия.
IV. Молекулы нуклеиновой кислоты, содержащие последовательность жесткокрылого насекомого
A. Обзор
В настоящем документе описываются молекулы нуклеиновой кислоты, полезные для контроля жесткокрылых насекомых. Описанные молекулы нуклеиновой кислоты включают последовательности-мишени (например, нативные гены и некодирующие последовательности), дцРНК, миРНК, hpРНК и микроРНК. Например, в некоторых вариантах осуществления описываются молекулы дцРНК, миРНК, микроРНК и/или hpРНК, которые могут быть специфически комплементарны всей последовательности или части одной или более нативных последовательностей нуклеиновой кислоты жесткокрылого насекомого. В указанных и других вариантах осуществления нативная последовательность(и) нуклеиновой кислоты может представлять собой один или более целевых генов, продукт которого может быть, например и без ограничения: вовлечен в метаболический процесс; вовлечен в репродуктивный процесс; или вовлечен в развитие личинки. Молекулы нуклеиновой кислоты, описанные здесь, при введении в клетку, содержащую по меньшей мере одну нативную последовательность(и) нуклеиновой кислоты, к которой молекулы нуклеиновой кислоты специфически комплементарны, могут инициировать RNAi в клетке, и таким образом уменьшить или прекратить экспрессию нативной последовательности(ей) нуклеиновой кислоты. В некоторых примерах уменьшение или прекращение экспрессии целевого гена с помощью молекулы нуклеиновой кислоты, содержащей последовательность, специфически комплементарную гену, может быть летальным для жесткокрылых насекомых или может приводить к снижению роста и/или репродукции.
В некоторых вариантах осуществления может быть выбран по меньшей мере один целевой ген жесткокрылого насекомого, где целевой ген содержит нуклеотидную последовательность, выбранную из перечня, содержащего D_vir_c47185_Caf1 180 (SEQ ID NO: 1); D_vir_c1229_VatpaseC (SEQ ID NO: 2); D_vir_c1319_VatpaseH (SEQ ID NO: 3); и Contig_01_Rho1_1-191_CDC42 (SEQ ID NO: 4). В конкретных примерах выбирают целевой ген жесткокрылого насекомого, где целевой цен кодирует субъединицу С вакуолярной АТФазы и содержит SEQ ID NO: 2.
В некоторых вариантах осуществления целевой ген может представлять собой молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует полипептид, содержащий непрерывную аминокислотную последовательность, которая по меньшей мере на 85% идентична (например, приблизительно на 90%, приблизительно на 95%, приблизительно на 96%, приблизительно на 97%, приблизительно на 98%, приблизительно на 99%, приблизительно на 100%, или на 100% идентична) аминокислотной последовательности белкового продукта одного из генов D_vir_c47185_Caf1 180 (SEQ ID NO: 1); D_vir_c1229_VatpaseC (SEQ ID NO: 2); D_vir_c1319_VatpaseH (SEQ ID NO: 3); и Contig_01_Rho1_1-191_CDC42 (SEQ ID NO: 4). Целевой ген может представлять собой любую последовательность нуклеиновой кислоты жесткокрылого насекомого, посттранскрибционное ингибирование которой оказывает повреждающее действие на жесткокрылое насекомое или обеспечивает защитный эффект растения против жесткокрылого насекомого. В конкретных примерах целевой ген представляет собой молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует субъединицу С вакуолярной АТФазы, содержащую непрерывную аминокислотную последовательность, которая по меньшей мере на 85% идентична, приблизительно на 90% идентична, приблизительно на 95% идентична, приблизительно 96% идентична, приблизительно 97% идентична, приблизительно 98% идентична, приблизительно 99% идентична, приблизительно 100% идентична, или на 100% идентична аминокислотной последовательности белкового продукта SEQ ID NO: 2.
Согласно изобретению, предоставляются нуклеотидные последовательности, экспрессия которых дает в результате молекулу РНК, содержащую нуклеотидную последовательность, которая специфически комплементарна всей нативной молекуле РНК или ее части, которая кодируется кодирующей последовательностью у жесткокрылого насекомого. В некоторых вариантах осуществления после потребления экспрессированной молекулы РНК жесткокрылым насекомым, может быть достигнута понижающая регуляция кодирующей последовательности в клетках жесткокрылого насекомого. В конкретных вариантах осуществления понижающая регуляция кодирующей последовательности в клетках жесткокрылого насекомого может приводить к отрицательному воздействию на рост, жизнеспособность, пролиферацию и/или репродукцию жесткокрылого насекомого.
В некоторых вариантах осуществления последовательности-мишени включают транскрибируемые некодирующие последовательности РНК, такие как 5’UTR; 3’UTR; сплайсированные лидерные последовательности; последовательности интронов; последовательности аутронов (например, 5’UTR РНК с последующей модификацией в транс-сплайсинге); донорные последовательности (например, некодирующая РНК, необходимая для предоставления донорных последовательностей при транс-сплайсинге); и другие некодирующие транскрибируемые РНК целевых генов жесткокрылого насекомого. Такие последовательности могут быть получены из моноцистронных и полицистронных генов.
Таким образом, здесь также описываются применительно к некоторым вариантам осуществления молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которые включают по меньшей мере одну нуклеотидную последовательность, которая специфически комплементарна всей последовательности-мишени или ее части у жесткокрылого насекомого. В некоторых вариантах осуществления молекула iRNA может содержать нуклеотидную последовательность(и), которая комплементарна всем или части из множества последовательностей-мишеней; например, 2, 3, 4, 5, 6, 7, 8, 9, 10, или больше последовательностей-мишеней. В конкретных вариантах осуществления молекула iRNA может быть получена in vitro или in vivo с помощью генетически модифицированного организма, такого как растение или бактерия. Также раскрываются последовательности кДНК, которые можно использовать для получения молекул дцРНК, молекул миРНК, молекул микроРНК и/или молекул hpРНК, которые специфически комплементарны всей или части последовательности-мишени у жесткокрылого насекомого. Также описываются рекомбинантные ДНК-конструкты, применяемые для осуществления стабильной трансформации конкретных хозяев-мишеней. Трансформированные хозяева-мишени могут экспрессировать эффективные уровни молекул дцРНК, миРНК, микроРНК и/или hpРНК из рекомбинантных ДНК-конструктов. Таким образом, также описывается вектор для трансформации растений, содержащий по меньшей мере одну нуклеотидную последовательность, функционально связанную с гетерологичным промотором, функциональным в растительной клетке, где экспрессия нуклеотидной последовательности(ей) дает в результате молекулу РНК, содержащую нуклеотидную последовательность, которая специфически комплементарна всей последовательности-мишени или ее части у жесткокрылого насекомого.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты, полезные для контроля жесткокрылых насекомых, могут включать: нативную последовательность нуклеиновой кислоты, выделенную из Diabrotica, D_vir_c1229_VatpaseC (SEQ ID NO: 2); нуклеотидные последовательности, которые при экспрессии дают в результате молекулу РНК, содержащую нуклеотидную последовательность, которая специфически комплементарна нативной молекуле РНК, которая кодируется D_vir_c1229_VatpaseC (SEQ ID NO: 2); молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которые содержат по меньшей мере одну нуклеотидную последовательность, которая специфически комплементарна D_vir_c1229_VatpaseC (SEQ ID NO: 2); последовательности кДНК которые можно использовать для получения молекул дцРНК, молекул миРНК, молекул микроРНК и/или молекул hpРНК, которые специфически комплементарны D_vir_c1229_VatpaseC (SEQ ID NO: 2); и рекомбинантные ДНК-конструкты, применяемые при осуществлении стабильной трансформации конкретных хозяев-мишеней, где трансформированный хозяин-мишень содержит одну или более из указанных выше молекул нуклеиновой кислоты.
В указанных и других вариантах осуществления молекулы нуклеиновой кислоты, полезные для контроля жесткокрылых насекомых, могут включать: фрагмент С вакуолярной АТФазы Diabrotica, содержащий всю или часть любой из SEQ ID NO: 5 и 6; нуклеотидные последовательности, которые при экспрессии дают в результате молекулу РНК, содержащую нуклеотидную последовательность; молекулу, содержащую нуклеотидную последовательность, которая специфически комплементарна нативной молекуле РНК Diabrotica, содержащей всю последовательность или часть любой из SEQ ID NO: 5 и 6; молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которые содержат по меньшей мере одну нуклеотидную последовательность, которая специфически комплементарна всей последовательности или части любой из SEQ ID NO: 5 и 6; последовательности кДНК, которые можно использовать для получения молекул dsРНК, молекул siРНК, молекул микроРНК и/или молекул hpРНК, которые специфически комплементарны всей последовательности или части любой из SEQ ID NO: 5 и 6; и рекомбинантные ДНК-конструкты, применяемые для осуществления стабильной трансформации конкретных хозяев-мишеней, где трансформированный хозяин-мишень содержит одну или более из указанных выше молекул нуклеиновой кислоты.
В указанных и других вариантах осуществления дополнительные молекулы нуклеиновой кислоты, полезные для контроля жесткокрылых насекомых, могут включать: D_vir_c47185_Caf1 180 (SEQ ID NO: 1); D_vir_c1319_VatpaseH (субъединица H вакуолярной АТФазы) (SEQ ID NO: 3); и Contig_01_Rho1_1-191_CDC42 (Rho1 малый ГТФ-связывающий белок) (SEQ ID NO: 4); нуклеотидные последовательности, которые при экспрессии дают молекулы РНК, содержащие нуклеотидную последовательность, которая специфически комплементарна нативной молекуле РНК, которая кодируется D_vir_c47185_Caf1 180 (SEQ ID NO: 1); D_vir_c1319_VatpaseH (SEQ ID NO: 3); или Contig_01_Rho1_1-191_CDC42 (SEQ ID NO: 4); молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которые содержат по меньшей мере одну нуклеотидную последовательность, которая специфически комплементарна D_vir_c47185_Caf1 180 (SEQ ID NO: 1); D_vir_c1319_VatpaseH (SEQ ID NO: 3); или Contig_01_Rho1_1-191_CDC42 (SEQ ID NO: 4); последовательности кДНК, которые можно использовать для получения молекул дцРНК, молекул миРНК, молекул микроРНК и/или молекул hpРНК, которые специфически комплементарны D_vir_c47185_Caf1 180 (SEQ ID NO: 1); D_vir_c1319_VatpaseH (SEQ ID NO: 3); или Contig_01_Rho1_1-191_CDC42 (SEQ ID NO: 4); и рекомбинантные ДНК-конструкты, применяемые для осуществления стабильной трансформации конкретных хозяев-мишеней, где трансформированный хозяин-мишень содержит одну или более из указанных выше молекул нуклеиновой кислоты.
B. Молекулы нуклеиновой кислоты
Настоящее изобретение предоставляет, в частности, молекулы iRNA (например, молекулы дцРНК, миРНК, микроРНК и hpРНК), которые ингибируют экспрессию целевого гена в клетке, ткани или органе жесткокрылого насекомого; и молекулы ДНК, способные экспрессироваться в виде молекулы iRNA в клетке или микроорганизме для ингибирования экспрессии целевого гена в клетке, ткани или в органе жесткокрылого насекомого.
Некоторые варианты осуществления изобретения предоставляют выделенную молекулу нуклеиновой кислоты, содержащую по меньшей мере одну (например, одну, две, три или более) нуклеотидную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; последовательности, комплементарной SEQ ID NO: 2; SEQ ID NO: 5; последовательности, комплементарной SEQ ID NO: 5; SEQ ID NO: 6; последовательности, комплементарной SEQ ID NO: 6; SEQ ID NO: 7; последовательности, комплементарной SEQ ID NO: 7; SEQ ID NO: 8; последовательности, комплементарной SEQ ID NO: 8; SEQ ID NO: 112; последовательности, комплементарной SEQ ID NO: 112; SEQ ID NO: 113; последовательности, комплементарной SEQ ID NO: 113; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов, содержащего всю последовательность или часть любой из SEQ ID NO: 5 и 6; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов, содержащему всю последовательность или часть любой из SEQ ID NO: 5 и 6; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей любую из SEQ ID NO: 2, 5-8, 112 и/или 113; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 2, 5-8, 112 и/или 113; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 2, 5-8, 112 и/или 113; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 2, 5-8, 112 и/или 113; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащего всю последовательность или часть любой из SEQ ID NO: 5 и 6; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащему всю последовательность или часть любой из SEQ ID NO: 5 и 6; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, который транскрибируется в нативную молекулу РНК, содержащую всю последовательность или часть любой из SEQ ID NO: 5 и 6; и последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую всю последовательность или часть любой из SEQ ID NO: 5 и 6. В конкретных вариантах осуществления контакт жесткокрылого насекомого с выделенной последовательностью нуклеиновой кислоты или потребление жесткокрылым насекомым выделенной последовательности нуклеиновой кислоты ингибирует рост, развитие, размножение и/или питание жесткокрылого насекомого.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты изобретения также может включать по меньшей мере одну (например, одну, две, три или более) нуклеотидную последовательность, выбранную из группы, состоящей из: всей последовательности или части SEQ ID NO: 1; всей или части последовательности, комплементарной SEQ ID NO: 1; SEQ ID NO: 3; последовательности, комплементарной SEQ ID NO: 3; SEQ ID NO: 4; последовательности, комплементарной SEQ ID NO: 4; фрагмента по меньшей мере из 19 непрерывно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 или 4; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 или 4; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей любую из SEQ ID NO: 1, 3 или 4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 или 4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащего любую из SEQ ID NO: 1, 3 или 4; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащему любую из SEQ ID NO: 1, 3 или 4; фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4; и последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4. В конкретных вариантах осуществления контактирование жесткокрылого насекомого с последовательностью выделенной нуклеиновой кислоты или потребление жесткокрылым насекомым последовательности выделенной нуклеиновой кислоты ингибирует рост, развитие, размножение и/или питание жесткокрылого насекомого.
В некоторых вариантах осуществления молекула нуклеиновой кислоты изобретения может содержать по меньшей мере одну (например, одну, две, три или более) последовательность ДНК, способную экспрессироваться в виде молекулы iRNA в клетке или микроорганизме для ингибирования экспрессии целевого гена в клетке, ткани или органе жесткокрылого насекомого. Такая последовательность (последовательности) ДНК может быть функционально связана с промоторной последовательностью, которая функционирует в клетке, содержащей молекулу ДНК, чтобы инициировать или увеличить транскрипцию молекулы (молекул), кодирующей дцРНК. В одном варианте осуществления по меньшей мере одна (например, одна, две, три или более) последовательность ДНК может быть получена из SEQ ID NO: 2. Производные SEQ ID NO: 2 включают фрагменты SEQ ID NO: 2. В некоторых вариантах осуществления фрагмент SEQ ID NO: 2 может включать, например, по меньшей мере приблизительно 19 последовательно расположенных нуклеотидов любой из SEQ ID NO: 5 и 6, или последовательности, комплементарной любой из указанных выше последовательностей. Таким образом, фрагмент SEQ ID NO: 2 может содержать, например, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 последовательно расположенных нуклеотидов SEQ ID NO: 2, или комплементарной ей последовательности и включать всю последовательность или часть любой из SEQ ID NO: 5 и 6, или комплементарной ей последовательности. В указанных и других вариантах осуществления фрагмент SEQ ID NO: 2 может включать, например, больше чем приблизительно 19 последовательно расположенных нуклеотидов SEQ ID NO: 2 или комплементарной ей последовательности. Таким образом, фрагмент SEQ ID NO: 2 может содержать, например, 19, 20, 21, приблизительно 25 (например, 22, 23, 24, 25, 26, 27, 28 и 29), приблизительно 30, приблизительно 40 (например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и 45), приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130, приблизительно 140, приблизительно 150, приблизительно 160, приблизительно 170, приблизительно 180, приблизительно 190, приблизительно 200 или более последовательно расположенных нуклеотидов SEQ ID NO: 2, или комплементарной ей последовательности, и содержать всю последовательность или часть любой из SEQ ID NO: 5 и 6, или комплементарной ей последовательности.
В конкретных вариантах осуществления по меньшей мере одна последовательность ДНК, способная экспрессироваться в виде молекулы iRNA в клетке или микроорганизме для ингибирования экспрессии целевого гена в клетке, ткани или органе жесткокрылого насекомого, может также включать последовательность(и) ДНК, которую получают из нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO: 1, 3 и 4. Производные нуклеотидной последовательности, выбранные из группы, включающей SEQ ID NO: 1, 3 и 4, содержат фрагменты одной или более из SEQ ID NO: 1, 3 и 4. В некоторых вариантах осуществления фрагмент одной или более из SEQ ID NO: 1, 3 и 4 может содержать, например, по меньшей мере приблизительно 19 последовательно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 и 4, или комплементарной им последовательности. Таким образом, фрагмент одной или более из SEQ ID NO: 1, 3 и 4 может включать, например, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 последовательно расположенных нуклеотидов любой из последовательностей SEQ ID NO: 1, 3 и 4, или комплементарной им последовательности. В указанных и других вариантах осуществления фрагмент одной или более из SEQ ID NO: 1, 3, и 4 может содержать, например, более чем приблизительно 19 последовательно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 и 4, или комплементарной им последовательности. Таким образом, фрагмент одной или более из SEQ ID NO: 1, 3, и 4 может содержать, например, 19, 20, 21, приблизительно 25 (например, 22, 23, 24, 25, 26, 27, 28 и 29), приблизительно 30, приблизительно 40 (например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и 45), приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130, приблизительно 140, приблизительно 150, приблизительно 160, приблизительно 170, приблизительно 180, приблизительно 190, приблизительно 200, или более последовательно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 и 4, или комплементарных им последовательностей.
Некоторые варианты осуществления включают введение частично или полностью стабилизированных молекул дцРНК в жесткокрылое насекомое для ингибирования экспрессии целевого гена в клетке, ткани или органе жесткокрылого насекомого. При экспрессии в виде молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК) и потреблении жесткокрылым насекомым, последовательности нуклеиновой кислоты, содержащие один или более фрагментов любой из SEQ ID NO: 1-4, могут вызывать одно или несколько из перечисленного: гибель, ингибирование роста, изменение в соотношении полов, уменьшение потомства, прекращение заражения и/или прекращение поедания жесткокрылым насекомым. Например, в некоторых вариантах осуществления предоставляется молекула дцРНК, содержащая нуклеотидную последовательность, включающую от приблизительно 19 до приблизительно 300 нуклеотидов, которая по существу гомологична последовательности целевого гена жесткокрылого насекомого и содержащей SEQ ID NO: 2, или всю последовательность или часть любой из SEQ ID NO: 5 и 6. Специфические примеры молекул дцРНК, содержащих по меньшей мере одну нуклеотидную последовательность, которая по существу гомологична SEQ ID NO: 2 или всей или части любой из SEQ ID NO: 5 и 6, может иметь в длину, без ограничения, по меньшей мере 19, 20, 21, приблизительно 25 (например, 22, 23, 24, 25, 26, 27, 28, и 29), приблизительно 30, приблизительно 40 (например, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и 45), приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130, приблизительно 140, приблизительно 150, приблизительно 160, приблизительно 170, приблизительно 180, приблизительно 190, приблизительно 200, или больше нуклеотидов. Такие молекулы дцРНК могут также включать один или более фрагментов SEQ ID NO: 1, 3 и/или 4. Экспрессия такой молекулы дцРНК может, например, приводить к гибели жесткокрылого насекомого, которое поглощает молекулу дцРНК.
В определенных вариантах осуществления молекулы дцРНК, предоставляемые изобретением, содержат нуклеотидные последовательности, комплементарные гену-мишени, содержащему SEQ ID NO: 2, и/или нуклеотидные последовательности, комплементарные всей последовательности или части любой из SEQ ID NO: 5 и 6, ингибирование которых в гене-мишени у жесткокрылого насекомого приводит к уменьшению или устранению белкового фактора или фактора нуклеотидной последовательности, который необходим для роста, развития или другой биологической функции жесткокрылого насекомого. Выбранная нуклеотидная последовательность может демонстрировать от приблизительно 80% до приблизительно 100% идентичности последовательности с SEQ ID NO: 2; с непрерывным фрагментом нуклеотидной последовательности, изложенной в SEQ ID NO: 2, включая всю последовательность или часть любой SEQ ID NO: 5 и 6; или с последовательностью, комплементарной любой из указанных выше последовательностей. Например, выбранная нуклеотидная последовательность может демонстрировать приблизительно 81%; приблизительно 82%; приблизительно 83%; приблизительно 84%; приблизительно 85%; приблизительно 86%; приблизительно 87%; приблизительно 88%; приблизительно 89%; приблизительно 90%; приблизительно 91%; приблизительно 92%; приблизительно 93%; приблизительно 94% приблизительно 95%; приблизительно 96%; приблизительно 97%; приблизительно 98%; приблизительно 98,5%; приблизительно 99%; приблизительно 99,5%; или приблизительно 100% идентичности с последовательностью SEQ ID NO: 2; с непрерывным фрагментом нуклеотидной последовательности, изложенной в SEQ ID NO: 2, включая всю последовательность или часть любой из SEQ ID NO: 5 и 6; или с последовательностью, комплементарной любой из указанных выше последовательностей. В конкретных вариантах осуществления молекула дцРНК, предоставляемая изобретением, также может содержать одну или более нуклеотидных последовательностей, комплементарных целевому гену, включая одну из SEQ ID NO: 1, 3 и 4, ингибирование которых в целевом гене у жесткокрылого насекомого приводит к уменьшению или устранению белкового фактора или фактора нуклеотидной последовательности, который необходим для роста, развития или другой биологической функции жесткокрылого насекомого.
В некоторых вариантах осуществления молекула ДНК, способная экспрессироваться в виде молекулы iRNA в клетке или микроорганизме для ингибирования экспрессии целевого гена, может содержать одиночную нуклеотидную последовательность, которая специфически комплементарна всей или части нативной последовательности нуклеиновой кислоты, обнаруживаемой в одном или более видах-мишенях жесткокрылых насекомых, или молекула ДНК может быть построена в виде химеры из нескольких таких специфически комплементарных последовательностей.
В некоторых вариантах осуществления молекула нуклеиновой кислоты может содержать первую и вторую нуклеотидные последовательности, разделенные "спейсерной последовательностью”. Спейсерная последовательность может представлять собой область, содержащую любую последовательность нуклеотидов, которая облегчает образование вторичной структуры между первой и второй нуклеотидными последовательностями, в случае, если это желательно. В одном варианте осуществления спейсерная последовательность является частью смысловой или антисмысловой кодирующей последовательности мРНК. Спейсерная последовательность, альтернативно, может содержать любую комбинацию нуклеотидов или их гомологов, которые способны ковалентно связываться с молекулой нуклеиновой кислоты. Например, в некоторых вариантах осуществления молекула ДНК может содержать нуклеотидную последовательность, кодирующую одну или более различных молекул ДНК, где каждая из различных молекул РНК содержит первую нуклеотидную последовательность и вторую нуклеотидную последовательность, где первая и вторая нуклеотидные последовательности комплементарны друг другу. Первая и вторая нуклеотидные последовательности могут быть соединены внутри молекулы РНК спейсерной последовательностью. Спейсерная последовательность может составлять часть первой нуклеотидной последовательности или второй нуклеотидной последовательности. Экспрессия молекулы РНК, содержащей первую и вторую нуклеотидные последовательности, может приводить к образованию молекулы дцРНК настоящего изобретения, с помощью специфической гибридизации первой и второй нуклеотидных последовательностей. Первая нуклеотидная последовательность или вторая нуклеотидная последовательность может быть в значительной степени идентична последовательности нуклеиновой кислоты, нативной для жесткокрылого насекомого (например, целевой ген или транскрибируемая некодирующая последовательность), ее производному или ее комплементарной последовательности.
Молекулы нуклеиновой кислоты дцРНК содержат двойные цепи полимеризованных рибонуклеотидных последовательностей и могут включать модификации либо фосфатно-сахарного скелета, либо нуклеозида. Модификации структуры РНК могут быть специально разработаны, чтобы обеспечить специфическое ингибирование. В одном варианте осуществления молекулы дцРНК можно модифицировать с помощью универсального ферментного процесса так, чтобы можно было получить молекулы миРНК. В указанном ферментативном процессе можно использовать фермент РНКазу III, такой как DICER у эукариот, in vitro или in vivo. Смотрите Elbashir et al. (2001) Nature 411:494-8; и Hamilton and Baulcombe (1999) Science 286(5441):950-2. DICER или функционально эквивалентные ферменты РНКазы III расщепляют более крупные цепи дцРНК и/или молекулы hpРНК на более мелкие олигонуклеотиды (например, миРНК), каждый из которых имеет длину приблизительно 19-25 нуклеотидов. Молекулы миРНК, образующиеся под действием таких ферментов, имеют 2-3 нуклеотида, выступающих на 3’-конце, и 5’-фосфатный и 3’-гидроксильный концы. Молекулы миРНК, образующиеся под действием ферментов РНКазы III, раскручиваются и разделяются на одноцепочечные РНК в клетке. Молекулы миРНК затем специфически гибридизуются с последовательностями РНК, транскрибированными из целевого гена, и обе молекулы РНК в дальнейшем разрушаются с помощью присущего клеткам механизма деградации РНК. Указанный процесс может приводить к эффективной деградации или устранению последовательности РНК, кодируемой целевым геном в организме-мишени. Результатом является посттранскрипционный сайленсинг желаемого гена. В некоторых вариантах осуществления молекулы миРНК, образующиеся под действием эндогенных ферментов РНКазы III из гетерологичных молекул нуклеиновой кислоты, могут эффективно опосредовать отрицательную регуляцию генов-мишеней у жесткокрылых насекомых.
В некоторых вариантах осуществления молекула нуклеиновой кислоты изобретения может включать по меньшей мере одну не встречающуюся в природе нуклеотидную последовательность, которая может транскрибироваться в одноцепочечную молекулу РНК, способную к образованию молекулы дцРНК in vivo с помощью внутримолекулярной гибридизации. Такие последовательности дцРНК обычно являются способными к самосборке, и могут предоставляться в источнике питания жесткокрылого насекомого для достижения посттранскрипционного ингибирования целевого гена. В указанных и других вариантах осуществления молекула нуклеиновой кислоты изобретения может содержать две различные не встречающиеся в природе нуклеотидные последовательности, каждая из которых специфически комплементарна другому целевому гену у жесткокрылого насекомого. Если такая молекула нуклеиновой кислоты предоставляется в виде молекулы дцРНК жесткокрылому насекомому, молекула дцРНК ингибирует экспрессию по меньшей мере двух различных целевых генов у жесткокрылого насекомого.
C. Получение молекул нуклеиновой кислоты
Ряд нативных последовательностей жесткокрылых насекомых можно использовать в качестве последовательностей-мишеней для создания молекул нуклеиновой кислоты изобретения, таких как молекулы iRNA и ДНК, кодирующие iRNA. Отбор нативных последовательностей не является, однако, прямым процессом. Только небольшое число нативных последовательностей у жесткокрылого насекомого будет представлять собой эффективные мишени. Например, нельзя прогнозировать с определенностью, будет ли конкретная нативная последовательность эффективно деактивироваться молекулами нуклеиновой кислоты изобретения, или будет ли деактивация конкретной нативной последовательности оказывать отрицательное воздействие на рост, жизнеспособность, пролиферацию и/или репродукцию жесткокрылого насекомого. Подавляющее большинство нативных последовательностей жесткокрылого насекомого, такие как EST, выделенные из него (например, последовательности, приведенные в патенте США 7612194 и в патенте США 7943819), не оказывают отрицательного воздействия на рост, жизнеспособность, пролиферацию и/или репродукцию жесткокрылого насекомого, такого как WCR или NCR. Также нельзя предсказать какие из нативных последовательностей, которые могут оказывать отрицательное воздействие на жесткокрылое насекомое, можно использовать в рекомбинантных технологиях для экспрессирования молекул нуклеиновой кислоты, комплементарных таким нативным последовательностям в растении-хозяине и для оказания отрицательного воздействия на жесткокрылое насекомое после поедания им без нанесения ущерба растению-хозяину.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты изобретения (например, молекулы дцРНК, которые должны предоставляться в растении-хозяине жесткокрылого насекомого) выбирают для воздействия на последовательности кДНК, кодирующие белки или части белков, необходимые для выживания жесткокрылого насекомого, такие как аминокислотные последовательности, вовлеченные в метаболические или катаболические биохимические пути, деление клеток, размножение, энергетический обмен, пищеварение, паразитизм и т.п. Как описывается здесь, потребление композиций организмом-мишенью, содержащих одну или больше дцРНК, по меньшей мере один сегмент которых специфически комплементарен по меньшей мере в основном идентичному сегменту РНК, продуцируемой в клетках заданного патогена, может приводить к гибели или другому угнетению мишени. Нуклеотидную последовательность, ДНК или РНК, полученную у жесткокрылого насекомого, можно использовать для создания растительных клеток, устойчивых к повреждению жесткокрылыми насекомыми. Растение-хозяин жесткокрылого насекомого (например, Z. mays или G. max), например, можно трансформировать так, чтобы оно содержало одну или больше нуклеотидных последовательностей, полученных у жесткокрылого насекомого, как предусматривается здесь. Трансформированная нуклеотидная последовательность хозяина может кодировать одну или более РНК, которые превращаются в последовательность дцРНК в клетках или биологических жидкостях внутри трансформированного хозяина, что делает дцРНК доступной, если/когда жесткокрылое насекомое образует пищевую связь с трансгенным хозяином. Это может привести к подавлению экспрессии одного или более генов в клетках жесткокрылого насекомого, и в конечном итоге к гибели или ингибированию его роста или развития.
Таким образом, в некоторых вариантах осуществления целевым является ген, который существенным образом вовлечен в рост, развитие и репродукцию жесткокрылого насекомого. Другие целевые гены для применения в настоящем изобретении могут включать, например, гены, которые играют важную роль в жизнеспособности, движении, миграции, росте, развитии, инфицирующей способности, определении мест кормления и репродукции жесткокрылого насекомого. Таким образом, ген-мишень может быть конститутивным геном или фактором транскрипции. Кроме того, нативная нуклеотидная последовательность жесткокрылого насекомого, подходящая для применения в настоящем изобретении, также может быть получена из гомолога (например, ортолог), гена растения, вируса, бактерии или насекомого, функция которого известна специалисту в данной области, и нуклеотидная последовательность которого специфически гибридизуется с геном-мишенью в геноме намеченого жесткокрылого насекомого. Способы идентификации гомолога гена с известной нуклеотидной последовательностью с помощью гибридизации известны специалистам в данной области.
В некоторых вариантах осуществления изобретение предоставляет способы получения молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность для создания молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК). Один такой вариант осуществления включает: (a) анализ одного или более целевых генов в отношении его экспрессии, функции и фенотипа на основании дцРНК-опосредованной супрессии гена у жесткокрылого насекомого; (b) тестирование библиотеки кДНК или гДНК с помощью зонда, содержащего всю нуклеотидную последовательность или ее часть или гомолог последовательности запланированного жесткокрылого насекомого, который демонстрирует изменение (например, снижение) роста или развития в фенотипе, в анализе дцРНК-опосредованной супрессии; (c) идентификацию клона ДНК, который специфически гибридизуется с зондом; (d) выделение клона ДНК, идентифицированного на стадии (b); (e) секвенирование фрагмента кДНК или гДНК, который содержит клон, выделенный на стадии (d), где в результате транскрипции молекулы нуклеиновой кислоты с установленной последовательностью получают всю или значительную часть последовательности РНК или гомологичной последовательности; и (f) химический синтез всей или значительной части последовательности гена, или миРНК, или микроРНК, или hpРНК, или мРНК, или дцРНК.
В других вариантах осуществления способ получения фрагмента нуклеиновой кислоты, содержащего нуклеотидную последовательность для создания значительной части молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК) включает: (a) синтез первого и второго олигонуклеотидных праймеров, специфически комплементарных части нативной нуклеотидной последовательности интересующего жесткокрылого насекомого; и (b) амплификацию вставки кДНК или гДНК, представленной в векторе клонирования, с использованием первого и второго олигонуклеотидных праймеров стадии (a), где амплифицированная молекула нуклеиновой кислоты воспроизводит значительную часть молекулы миРНК или микроРНК, или hpРНК, или мРНК, или дцРНК.
Нуклеиновые кислоты изобретения можно выделить, амплифицировать или получить с помощью ряда других способов. Например, молекулу iRNA (например, дцРНК, миРНК, микроРНК и hpРНК) можно получить с помощью ПЦР-амплификации целевой последовательности нуклеиновой кислоты (например, целевого гена или целевой транскрибируемой некодирующей последовательности), полученной из библиотеки гДНК или ее частей. ДНК или РНК можно выделить из организма-мишени и создать из них библиотеки нуклеиновых кислот с использованием способов, известных специалистам в данной области, и библиотеки гДНК или кДНК, полученные из организма-мишени, можно использовать для ПЦР-амплификации и секвенирования целевых генов. Подтвержденный продукт ПЦР можно применять в качестве матрицы в транскрипции in vitro для создания смысловой и антисмысловой РНК с минимальными промоторами. Альтернативно, молекулы нуклеиновой кислоты можно синтезировать с помощью любой из ряда методик (смотрите, например, Ozaki et al. (1992) Nucleic Acids Research, 20: 5205-5214; и Agrawal et al. (1990) Nucleic Acids Research, 18: 5419-5423), включая применение автоматизированного синтезатора ДНК (например, P.E. Biosystems, Inc. (Foster City, Calif.) модель 392 или 394 DNA/RNA Synthesizer), с использованием стандартных химических синтезов, таких как фосфорамидитный химический синтез. Смотрите, например, Beaucage et al. (1992) Tetrahedron, 48: 2223-2311; патенты США № 4980460, № 4725677, № 4415732, № 4458066 и № 4973679. Альтернативные химические синтезы, приводящие к появлению неприродных групп в скелете молекулы, таких как фосфортиоатные группы, фосфорамидатые группы и т.п., также могут быть использованы.
Молекула РНК, дцРНК, миРНК, микроРНК или hpРНК настоящего изобретения может быть получена химически или ферментативно специалистом в данной области с помощью реакций, проводимых в ручную, или автоматизированных реакций, или in vivo в клетке, содержащей молекулу нуклеиновой кислоты, включающую в себя последовательность, кодирующую молекулу РНК, дцРНК, миРНК, микроРНК или hpРНК. Также РНК можно получить с помощью частичного или полного органического синтеза - любой модифицированный рибонуклеотид можно ввести с помощью ферментативного или органического синтеза in vitro. Молекулу РНК можно синтезировать с помощью клеточной РНК-полимеразы или РНК-полимеразы бактериофагов (например, РНК-полимераза T3, РНК-полимераза T7 и РНК-полимераза SP6). Экспрессирующие конструкции, полезные для клонирования и экспрессии нуклеотидных последовательностей, известны в данной области. Смотрите, например, международную публикацию PCT № WO 97/32016; и патенты США № 5593874, № 5698425, № 5712135, № 5789214 и № 5804693. Молекулы РНК, которые синтезируют химически или с помощью ферментативного синтеза in vitro, можно очистить перед введением в клетку. Например, молекулы РНК можно выделить из смеси с помощью экстракции с растворителем или смолой, преципитации, электрофореза, хроматографии или с помощью комбинации указанных методов. Альтернативно, молекулы РНК, которые синтезируют химически или с помощью ферментативного синтеза in vitro, можно использовать с минимальной очисткой или без очистки, например, чтобы избежать потерь при подготовке образца. Молекулы РНК можно высушить для хранения или растворить в водном растворе. Раствор может содержать буферы или соли для активации отжига и/или стабилизации двойных цепей молекулы дцРНК.
В вариантах осуществления молекула дцРНК может быть сформирована из одной самокомплементарной цепи РНК или из двух комплементарных цепей РНК. Молекулы дцРНК можно синтезировать in vivo или in vitro. Эндогенная РНК-полимераза клетки может опосредовать транскрипцию одной или двух цепей РНК in vivo, или можно использовать клонированную РНК-полимеразу для проведения транскрипции in vivo или in vitro. Посттранскрипционное ингибирование целевого гена у жесткокрылого насекомого может направляться хозяином путем специфической транскрипции в органе, ткани или типе у хозяина (например, при использовании тканеспецифичного промотора); путем стимуляции в хозяине условием окружающей среды (например, при использовании индуцируемого промотора, который чувствителен к инфекции, стрессу, температуре и/или химическим индукторам); и/или путем осуществления транскрипции на какой-либо стадии развития или в каком-либо возрасте хозяина (например, при использовании промотора, специфичного для стадии развития). Цепи РНК, которые образуют молекулу дцРНК, независимо от того, транскрибируются они in vitro или in vivo, могут быть или не быть полиаденилированы, и могут быть или не быть способны транслироваться в полипептид с помощью трансляционного аппарата клетки.
D. Рекомбинантные векторы и трансформация клетки-хозяина
В некоторых вариантах осуществления изобретение также предоставляет молекулу ДНК для введения в клетку (например, в бактериальную клетку, дрожжевую клетку или растительную клетку), где молекула ДНК содержит нуклеотидную последовательность, которая после экспрессии в РНК и потребления жесткокрылым насекомым, обеспечивает супрессию целевого гена в клетке, ткани или органе жесткокрылого насекомого. Таким образом, некоторые варианты осуществления предоставляют молекулу рекомбинантной нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты, способную экспрессироваться в виде молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК) в растительной клетке для ингибирования экспрессии целевого гена у жесткокрылого насекомого. Для инициации или усиления экспрессии такие молекулы рекомбинантной нуклеиновой кислоты могут содержать одну или более регуляторных последовательностей, такие регуляторные последовательности могут быть функционально связаны с последовательностью нуклеиновой кислоты, способной экспрессироваться в виде iRNA. Известны способы экспрессии молекулы, вызывающей супрессию генов в растениях, и они могут быть использованы для экспрессии нуклеотидной последовательности настоящего изобретения. Смотрите, например, международную публикацию PCT № WO 06073727; и патентную публикацию США № 2006/0200878 A1).
В конкретных вариантах осуществления молекула рекомбинантной ДНК изобретения может содержать последовательность нуклеиновой кислоты, кодирующую молекулу дцРНК. Такие молекулы рекомбинантной ДНК могут кодировать молекулы дцРНК, способные ингибировать экспрессию эндогенного целевого гена (генов) в клетке жесткокрылого насекомого после потребления. Во многих вариантах осуществления транскрибированная молекула дцРНК может быть предоставлена в стабильной форме; например, в виде структуры шпильки, и стебля, и петли.
В указанных и других вариантах осуществления одна цепь молекулы дцРНК может быть образована с помощью транскрипции из нуклеотидной последовательности, которая в основном гомологична нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO: 2; последовательности, комплементарной SEQ ID NO: 2; SEQ ID NO: 5; последовательности, комплементарной SEQ ID NO: 5; SEQ ID NO: 6; последовательности, комплементарной SEQ ID NO: 6; SEQ ID NO: 7; последовательности, комплементарной SEQ ID NO: 7; SEQ ID NO: 8; последовательности, комплементарной SEQ ID NO: 8; SEQ ID NO: 112; последовательности, комплементарной SEQ ID NO: 112; SEQ ID NO: 113; последовательности, комплементарной SEQ ID NO: 113; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов, содержащего всю последовательность или часть любой из SEQ ID NO: 5 и 6; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов, содержащему всю последовательность или часть любой из SEQ ID NO: 5 и 6; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей любую из последовательностей SEQ ID NO: 2, 5-8, 112 и/или 113; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 2, 5-8, 112 и/или 113; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 2, 5-8, 112 и/или 113; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 2, 5-8, 112 и/или 113; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей всю последовательность или часть любой из SEQ ID NO: 5 и 6; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей всю последовательность или часть любой из SEQ ID NO: 5 и 6; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую всю последовательность или часть любой из SEQ ID NO: 5 и 6; и последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую всю последовательность или часть любой из SEQ ID NO: 5 и 6. Одна цепь молекулы дцРНК также может быть образована с помощью транскрипции из нуклеотидной последовательности, которая в основном гомологична нуклеотидной последовательности, выбранной из группы, состоящей из: SEQ ID NO: 1; последовательности, комплементарной SEQ ID NO: 1; SEQ ID NO: 3; последовательности, комплементарной SEQ ID NO: 3; SEQ ID NO: 4; последовательности, комплементарной SEQ ID NO: 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов любой из последовательностей SEQ ID NO: 1, 3 или 4; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов любой из последовательностей SEQ ID NO: 1, 3 или 4; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей любую из SEQ ID NO: 1, 3 или 4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 или 4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 или 4; комплементарной последовательности фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 или 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 или 4; и комплементарной последовательности фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из последовательностей SEQ ID NO: 1, 3 или 4.
В конкретных вариантах осуществления молекула рекомбинантной ДНК, кодирующая молекулу дцРНК, может содержать по меньшей мере две нуклеотидные последовательности, при этом кодирующая последовательность расположена таким образом, что одна нуклеотидная последовательность имеет смысловую ориентацию, и другая нуклеотидная последовательность имеет антисмысловую ориентацию, по отношению к по меньшей мере одному промотору, где смысловая нуклеотидная последовательность и антисмысловая нуклеотидная последовательность связаны или соединены спейсерной последовательностью, длиной приблизительно от пяти (приблизительно 5) до одной тысячи (приблизительно 1000) нуклеотидов. Спейсерная последовательность может образовывать петлю между смысловой и антисмысловой последовательностями. Смысловая нуклеотидная последовательность или антисмысловая нуклеотидная последовательность может быть в основном гомологична нуклеотидной последовательности целевого гена (например, гена, содержащего одну из SEQ ID NO: 1-4) или ее фрагменту. В некоторых вариантах осуществления, однако, молекула рекомбинантной ДНК может кодировать молекулу дцРНК без спейсерной последовательности. В вариантах осуществления смысловая кодирующая последовательность и антисмысловая кодирующая последовательность могут быть разной длины.
Последовательности, идентифицированные как оказывающие повреждающий эффект на жесткокрылых насекомых или оказывающие защитный эффект на растения от жесткокрылых насекомых, можно без труда включить в экспрессируемые молекулы дцРНК путем создания соответствующих кассет экспрессии в рекомбинантной молекуле нуклеиновой кислоты изобретения. Например, такие последовательности можно экспрессировать в виде “шпильки”, имеющей структуру “стебель-петля”, если взять первый сегмент, соответствующий последовательности гена-мишени (например, SEQ ID NO: 2 и последовательности, содержащие всю или часть любой из SEQ ID NO: 5 и/или 6); соединить указанную последовательность со спейсерной областью второго сегмента, который негомологичен или некомплементарен первому сегменту; и связать его с третьим сегментом, где по меньшей мере часть третьего сегмента в основном комплементарна первому сегменту. Такая конструкция образует структуру “стебель-петля” при гибридизации первого сегмента с третьим сегментом, в которой образуется структура петли, включающей в себя второй сегмент. Смотрите, например, патентные публикации США №№ US 2002/0048814 и US 2003/0018993; и международные публикации PCT №№ WO94/01550 и WO98/05770. Молекулу дцРНК можно создать, например, в форме двухцепочечной структуры, такой как структура типа “стебель-петля” (например, “шпилька”), при этом продукция миРНК, воздействующих на нативную последовательность жесткокрылого насекомого, увеличивается при коэкспрессии фрагмента запланированного гена, например, на дополнительной экспрессируемой в растении кассете, что приводит к усилению продукции миРНК или уменьшает метилирование, чтобы предотвратить транскрипционный сайленсинг генов промотора шпилечной дцРНК.
Варианты осуществления изобретения включают введение рекомбинантной молекулы нуклеиновой кислоты настоящего изобретения в растение (т.е. трансформацию) для достижения ингибирующих уровней экспрессии одной или более молекул iRNA в отношении жесткокрылого насекомого. Молекула рекомбинантной ДНК, например, может представлять собой вектор, такой как линейная плазмида или замкнутая в кольцо плазмида. Векторная система может представлять собой один вектор или плазмиду, или два или более векторов или плазмид, которые вместе содержат общую ДНК, которую нужно ввести в геном хозяина. Кроме того, вектор может представлять собой экспрессионный вектор. Последовательности нуклеиновой кислоты изобретения, например, могут быть помещены соответствующим образом в вектор, под контролем соответствующего промотора, который функционирует в одном или более хозяевах для запуска экспрессии связанной с ним кодирующей последовательности или другой последовательности ДНК. Существует много векторов, используемых для данной цели, и выбор подходящего вектора будет зависеть преимущественно от размера нуклеиновой кислоты, которую помещают в вектор, и конкретной клетки-хозяина, которую трансформируют с помощью вектора. Каждый вектор содержит различные компоненты, в зависимости от его функции (например, амплификация ДНК или экспрессия ДНК) и конкретной клетки-хозяина, с которой он совместим.
Для придания трансгенному растению устойчивости к жесткокрылому насекомому рекомбинантная ДНК, например, может транскрибироваться в молекулу iRNA (например, молекулу РНК, которая образует молекулу дцРНК) в тканях или жидкостях рекомбинантного растения. Молекула iRNA может включать нуклеотидную последовательность, которая является по существу гомологичной и способна специфически гибридизоваться с соответствующей транскрибируемой нуклеотидной последовательностью у жесткокрылого насекомого, которое может питаться видом растения-хозяина. Жесткокрылое насекомое может контактировать с молекулой iRNA, которая транскрибируется в клетках трансгенного растения-хозяина, например, путем потребления в пищу клеток или жидкостей трансгенного растения-хозяина, которые содержат молекулу iRNA. Таким образом, экспрессия целевого гена супрессируется молекулой iRNA, у жесткокрылых насекомых, которые паразитируют на трансгенном растении-хозяине. В некоторых вариантах осуществления подавление экспрессии целевого гена у жесткокрылого насекомого-мишени может давать в результате растение, устойчивое к вредителю.
Чтобы обеспечить доставку молекул iRNA жесткокрылому насекомому во время пищевого контакта с растительной клеткой, которая трансформирована рекомбинантной молекулой нуклеиновой кислоты изобретения, необходима экспрессия (т.е. транскрипция) молекул iRNA в растительной клетке. Таким образом, рекомбинантная молекула нуклеиновой кислоты может содержать нуклеотидную последовательность изобретения, функционально связанную с одной или более регуляторными последовательностями, такими как последовательность гетерологичного промотора, которая функционирует в клетке-хозяине, такой как бактериальная клетка, в которой молекула нуклеиновой кислоты должна амплифицироваться, или растительная клетка, в которой молекула нуклеиновой кислоты должна экспрессироваться.
Промоторы, подходящие для применения в молекулах нуклеиновой кислоты изобретения, включают промоторы, которые представляют собой индуцируемые, вирусные, синтетические или конститутивные промоторы, которые хорошо известны в данной области. Неограничивающие примеры, описывающие такие промоторы, включают патенты США № 6437217 (промотор кукурузы RS81); № 5641876 (промотор актина риса); № 6426446 (промотор кукурузы RS324); № 6429362 (промотор кукурузы PR-1); № 6232526 (промотор кукурузы A3); № 6177611 (конститутивные промоторы кукурузы); № 5322938, № 5352605, № 5359142 и № 5530196 (промотор 35S); № 6433252 (промотор L3 олеозина кукурузы); № 6429357 (промотор 2 актина риса и интрон 2 актина риса); № 6294714 (светоиндуцируемые промоторы); № 6140078 (промоторы, индуцируемые солями); 6252138 (патоген-индуцируемые промоторы); № 6175060 (промоторы, индуцируемые дефицитом фосфора); № 6388170 (двунаправленные промоторы); № 6635806 (промотор гамма-коиксин (gamma-coixin)); и патентная заявка США с серийным № 09/757089 (промотор альдолазы хлоропластов кукурузы). Дополнительные промоторы включают промотор нопалин-синтазы (NOS) (Ebert et al. (1987) Proc. Natl. Acad. Sci. USA 84(16):5745-9) и промотор октопин-синтазы (OCS) (которые оба используются в опухоль-индуцирующих плазмидах Agrobacterium tumefaciens); промоторы колимовируса, такие как промотор 19S вируса мозаики цветной капусты (CaMV) (Lawton et al. (1987) Plant Mol. Biol. 9:315-24); промотор CaMV 35S (Odell et al. (1985) Nature 313:810-2; промотор 35S вируса мозаики цветной капусты (Walker et al. (1987) Proc. Natl. Acad. Sci. USA 84(19):6624-8); промотор сахарозосинтазы (Yang and Russell (1990) Proc. Natl. Acad. Sci. USA 87:4144-8); промотор комплекса R-генов (Chandler et al. (1989) Plant Cell 1:1175-83); промотор связывания хлорофилла a/b гена белка; CaMV35S (патенты США № 5322938, № 5352605, № 5359142 и № 5530196); FMV35S (патенты США № 6051753 и 5378619); промотор PC1SV (патент США № 5850019); промотор SCP1 (патент США № 6677503); и промоторы AGRtu.nos (учетный номер последовательности в GenBank V00087; Depicker et al. (1982) J. Mol. Appl. Genet. 1:561-73; Bevw et al. (1983) Nature 304:184-7).
В конкретных вариантах осуществления молекулы нуклеиновой кислоты изобретения включают тканеспецифичный промотор, такой как промотор, специфичный для тканей корней. Промоторы, специфичные для тканей корней, запускают экспрессию функционально связанных с ними последовательностей исключительно или предпочтительно в тканях корней. Примеры промоторов, специфичных для тканей корней, известны в данной области. Смотрите, например, патенты США №№ 5110732, 5459252 и 5837848; и публикации Opperman et al. (1994) Science 263:221-3; и Hirel et al. (1992) Plant Mol. Biol. 20:207-18. В некоторых вариантах осуществления нуклеотидную последовательность фрагмента для контроля жесткокрылого насекомого согласно изобретению можно клонировать между двумя промоторами, специфичными для тканей корней, которые функциональны в клетке трансгенного растения, и экспрессировать для получения молекул РНК в клетке трансгенного растения, которые затем могут образовывать молекулы дцРНК, как описано выше. Молекулы iRNA, экспрессированные в тканях растения, могут поглощаться жесткокрылым насекомым, вследствие чего достигается подавление экспрессии целевого гена.
Дополнительные регуляторные последовательности, которые необязательно могут быть функционально связаны с молекулой нуклеиновой кислоты, представляющей интерес, включают последовательности 5’ UTR, расположенные между промоторной последовательностью и кодирующей последовательностью, которые функционируют в качестве лидерной последовательности трансляции. Лидерная последовательность трансляции присутствует в полностью процессированной мРНК и может влиять на процессинг первичного транскрипта и/или стабильность РНК. Примеры лидерной последовательности трансляции включают лидеры белков теплового шока кукурузы и петуньи (патент США № 5362865), лидеры белка оболочки растительных вирусов, лидеры растительных вирусов rubisco и др. Смотрите, например, Turner and Foster (1995) Molecular Biotech. 3(3):225-36. Неограничивающие примеры последовательностей 5’ UTR включают GmHsp (патент США № 5659122); PhDnaK (патент США № 5362865); AtAnt1; TEV (Carrington and Freed (1990) J. Virol. 64:1590-7); и AGRtunos (учетный номер последовательности в GenBank V00087; и Bevan et al. (1983) Nature 304:184-7).
Дополнительные регуляторные последовательности, которые необязательно могут быть функционально связаны с интересующей молекулой нуклеиновой кислоты, также включают 3’ нетранслируемые последовательности, 3’ участки терминации транскрипции или участки полиаденилирования. Указанные генетические элементы расположены ниже кодирующей нуклеотидной последовательности и включают полинуклеотиды, которые обеспечивают сигнал полиаденилирования и/или другие регуляторные сигналы, способные влиять на транскрипцию или процессинг мРНК. Сигнал полиаденилирования функционирует в растениях, чтобы вызвать присоединение полиаденилатных последовательностей к 3’-концу предшественника мРНК. Последовательность полиаденилирования может быть выделена из множества генов растений или из генов T-DNA. Неограничивающим примером 3’ участка терминации транскрипции является 3’ участок норалин-синтазы (nos 3’; Fraley et al. (1983) Proc. Natl. Acad. Sci. USA 80:4803-7). Пример использования различных 3’ нетранслируемых участков приводится у Ingelbrecht et al, (1989) Plant Cell 1:671-80. Неограничивающие примеры сигналов полиаденилирования включают ген RbcS2 из Pisum sativum (Ps.RbcS2-E9; Coruzzi et al. (1984) EMBO J. 3:1671-9) и AGRtunos (учетный номер последовательности в GenBank E01312).
Некоторые варианты осуществления могут включать вектор для трансформации растений, который включает в себя выделенную и очищенную молекулу ДНК, содержащую по меньшей мере одну из описанных выше регуляторных последовательностей, функционально связанных с одной или более нуклеотидными последовательностями настоящего изобретения. При экспрессии одна или более нуклеотидных последовательностей дают в результате одну или более молекул РНК, содержащих нуклеотидную последовательность, которая специфически комплементарна всей или части нативной молекулы РНК у жесткокрылого насекомого. Таким образом, нуклеотидная последовательность(и) может содержать сегмент, кодирующий всю или часть рибонуклеотидной последовательности, представленной в интересующем транскрипте РНК жесткокрылого насекомого, и может содержать инвертированные повторы всего или части интересующего транскрипта жесткокрылого насекомого. Вектор для трансформации растений может содержать последовательности, специфически комплементарные более чем одной целевой последовательности, обеспечивая таким образом продукцию более чем одной дцРНК для ингибирования экспрессии двух или более генов в клетках одной или более популяций или видов жесткокрылых насекомых-мишеней. Сегменты нуклеотидной последовательности, специфически комплементарные нуклеотидным последовательностям, представленным в различных генах, могут быть объединены в одной составной молекуле нуклеиновой кислоты для экспрессии в трансгенном растении. Такие сегменты могут быть смежными или могут быть разделены спейсерной последовательностью.
В некоторых вариантах осуществления плазмида настоящего изобретения, уже содержащая по меньшей мере одну нуклеотидную последовательность изобретения, может быть модифицирована последовательным включением дополнительной нуклеотидной последовательности(ей) в ту же самую плазмиду, где дополнительная нуклеотидная последовательность(и) функционально связана с теми же регуляторными элементами, что и исходная по меньшей мере одна нуклеотидная последовательность. В некоторых вариантах осуществления молекула нуклеиновой кислоты может быть создана для ингибирования нескольких целевых генов. В некоторых вариантах осуществления несколько генов, которые нужно ингибировать, могут быть получены из одного вида жесткокрылого насекомого, что может усиливать эффективность молекулы нуклеиновой кислоты. В других вариантах осуществления гены могут быть получены у разных жесткокрылых насекомых, что может расширять ряд жесткокрылых насекомых, против которых эффективен(ы) агент(ы). Когда предполагается супрессия или комбинация экспрессии и супрессии нескольких генов, может быть изготовлен полицистронный элемент ДНК.
Рекомбинантная молекула нуклеиновой кислоты или вектор настоящего изобретения может включать селектируемый маркер, который придает выбираемый фенотип трансфомированной клетке, такой как растительная клетка. Селектируемые маркеры могут также применяться для выбора растений или растительных клеток, которые содержат рекомбинантную молекулу нуклеиновой кислоты изобретения. Маркер может кодировать устойчивость к биоцидам, устойчивость к антибиотикам (например, к канамицину, к Geneticin (G418), к блеомицину, к гигромицину и т.д.) или устойчивость к гербицидам (например, глифозат и т.д.). Примеры селектируемых маркеров включают, но не ограничиваясь ими, ген neo, который кодирует устойчивость к канамицину и может быть выбран для применения канамицина, G418 и т.д., ген bar, который кодирует устойчивость к биалафосу; мутантный ген синтазы EPSP, который кодирует устойчивость к глифосфату; ген нитрилазы, который придает устойчивость к бромоксинилу; мутантный ген ацетолактатсинтазы (ALS), который придает устойчивость к имидазолину или сульфонилуреазе; и ген устойчивости к метотрексату DHFR. Доступны многочисленные селектируемые маркеры, которые придают устойчивость к ампициллину, блеомицину, хлорамфениколу, гентамицину, гигромицину, канамицину, линкомицину, метотрексату, фосфонотрицину, пуромицину, спектиномицину, рифампицину, стрептомицину и тетрациклину и т.п. Примеры таких селектируемых маркеров описаны, например, в патентах США № 5550318; № 5633435; 5780708; и № 6118047.
Рекомбинантная молекула нуклеиновой кислоты или вектор настоящего изобретения может также содержать скринируемый маркер. Скринируемые маркеры могут применяться для мониторинга экспрессии. Примеры скринируемых маркеров включают ген β-глюкуронидазы или uidA (GUS), который кодирует фермент, различные хромогенные субстраты которого известны (Jefferson et al. (1987) Plant Mol. Biol. Rep. 5:387-405); ген R-локуса, который кодирует продукт, который регулирует продукцию антоцианиновых пигментов (красный цвет) в тканях растений (Dellaporta et al. (1988) "Molecular cloning of the maize R-nj allele by transposon tagging with Ac." In 18th Stadler Genetics Symposium. P. Gustafson and R. Appels, eds. (New York: Plenum), pp. 263-82); ген β-лактамазы (Sutcliffe et al. (1978) Proc. Natl. Acad. Sci. USA 75:3737-41); ген, который кодирует фермент, различные хромогенные субстраты которого известны (например, PAD AC, хромогенный цефалоспорин); ген люциферазы (Ow et al. (1986) Science 234:856-9); ген xylE, который кодирует катехолдиоксигеназу, которая может конвертировать хромогенные катехолы (Zukowski et al. (1983) Gene 46(2-3):247-55); ген амилазы (Ikatu et al. (1990) Bio Technol. 8:241-2); ген тирозиназы, который кодирует фермент, способный окислять тирозин до DOPA и допахинона, который в свою очередь конденсируется до меланина (Katz et al. (1983) J. Gen. Microbiol. 129:2703-14); и α-галактозидазу.
В некоторых вариантах осуществления рекомбинантные молекулы нуклеиновой кислоты, которые описаны выше, можно использовать в способах создания трансгенных растений и экспрессии гетерологичных нуклеиновых кислот в растениях для получения трансгенных растений, которые демонстрируют сниженную восприимчивость к жесткокрылым насекомым. Векторы для трансформации растений можно создать, например, путем вставки молекул нуклеиновой кислоты, кодирующих молекулы iRNA в векторы для трансформации растений и введения их в растение.
Подходящие способы трансформации клеток-хозяев включают любой способ, с помощью которого ДНК может быть помещена в клетку, например, с помощью трансформации протопластов (смотрите, например, патент США № 5508184), десикационно/ингибиторно-опосредованного захвата ДНК (десикационно/ингибиторно-опосредованного захвата ДНК, например, Potrykus et al. (1985) Mol. Gen. Genet. 199:183-8), с помощью электропорации (смотрите, например, патент США № 5384253), с помощью перемешивания с кремний-карбидными волокнами (смотрите, например, патенты США № 5302523 и № 5464765), с помощью Agrobacterium-опосредованной трансформации (смотрите, например, патенты США № 5563055; № 5591616; № 5693512; № 5824877; № 5981840; и № 6384301) и с помощью ускорения покрытых ДНК частиц (смотрите, например, патенты США № 5015580; № 5550318; № 5538880; № 6160208; № 6399861; и № 6403865) и т.д. Технологии, которые особенно полезны для трансформации кукурузы, описаны, например, в патентах США № 7060876 и № 5591616; и в международной публикации PCT WO 95/06722. Применяя технологии, такие как указанные, клетки фактически любых видов могут быть устойчиво трансформированы. В некоторых вариантах осуществления трансформирующую ДНК интегрируют в геном клетки-хозяина. В случае многоклеточных видов трансгенные клетки могут быть регенерированы в трансгенные организмы. Любая из указанных технологий может быть использована для получения трансгенного растения, например, содержащего одну или более последовательностей нуклеиновой кислоты, кодирующих одну или более молекул iRNA в геноме трансгенного растения.
Наиболее широко применяемый метод введения экспрессионного вектора в растения основан на природной системе трансформации Agrobacterium. A. tumefaciens и A. rhizogenes представляют собой почвенные бактерии, патогенные для растений, которые генетически трансформируют клетки растений. Плазмиды Ti и Ri A. tumefaciens и A. rhizogenes, соответственно, несут гены, ответственные за генетическую трансформацию растения. Ti (опухоль-индуцирующие)-плазмиды содержат большой сегмент, известный как Т-ДНК, который переносится трансформированным растениям. Другой сегмент Ti-плазмиды, участок vir, ответственен за перенос Т-ДНК. Участок Т-ДНК ограничен терминальными повторами. В модифицированных бинарных векторах удалены гены, индуцирующие опухоль, и функции участка vir используют для переноса чужеродной ДНК, ограниченной пограничными последовательностями Т-ДНК. Т-участок также может содержать селектируемый маркер для эффективной регенерации трансгенных растений и клеток, и сайт множественного клонирования для введения последовательностей, предназначенных для переноса, например, нуклеиновой кислоты, кодирующей дцРНК.
Таким образом, в некоторых вариантах осуществления вектор для трансформации растений получают из Ti-плазмиды A. tumefaciens (смотрите, например, патенты США № 4536475, № 4693977, № 4886937, и № 5501967; и европейский патент EP 0122791) или Ri-плазмиды A. rhizogenes. Дополнительные векторы для трансформации растений включают, в качестве примера и без ограничения, векторы, описанные в публикациях Herrera-Estrella et al. (1983) Nature 303:209-13; Bevan et al. (1983) Nature 304:184-7; Klee et al. (1985) Bio/Technol. 3:637-42; и в европейском патенте EP0120516, и векторы, полученные из любого из вышеуказанных векторов. Другие бактерии, такие как Sinorhizobium, Rhizobium и Mesorhizobium, которые взаимодействуют с растениями естественным образом, можно модифицировать для опосредования переноса генов в некоторые другие растения. Указанные ассоциированные с растениями симбиотические бактерии можно сделать компетентными для переноса генов с помощью введения в них обезвреженной Ti-плазмидой и подходящего бинарного вектора.
После внесения экзогенной ДНК в клетки-реципиенты, трансформированные клетки обычно идентифицируют для последующего культивирования и регенерации растений. С целью улучшения способности идентифицировать трансформированные клетки, может быть желательным использование селектируемого или скринируемого маркерного гена, как отмечалось ранее, с вектором трансформации, используемым для создания трансформанта. В том случае, когда используется селектируемый маркер, трансформированные клетки идентифицируют в потенциально трансформированной клеточной популяции путем воздействия на клетки селективного агента или агентов. В том случае, когда используется скринируемый маркер, можно проводить скрининг клеток по желаемому признаку маркерного гена.
Клетки, которые переносят воздействие селективного агента, или клетки, которые считали положительными в скрининговом исследовании, можно культивировать в среде, которая поддерживает регенерацию растений. В некоторых вариантах осуществления любая подходящая культуральная среда для растительной ткани (например, среды MS и N6) может быть модифицирована путем включения других веществ, например, регуляторов роста. Ткань могут поддерживать на основной среде с регуляторами роста до получения количества ткани, достаточного для проведения работ по регенерации растения или последующих повторных раундов отбора вручную до тех пор, пока морфология ткани не будет удовлетворять требованиям регенерации (например, по меньшей мере, 2 недели), затем переносят на среду, способствующую образованию ростка. Когда ростки сформированы, их переносят на среду, способствующую формированию корней. Культуры периодически переносят, пока происходит формирование корней. После того, как сформируется достаточное количество корней, растения можно перенести в почву для дальнейшего роста и созревания.
Для подтверждения присутствия представляющей интерес молекулы нуклеиновой кислоты (например, последовательности ДНК, кодирующей одну или более молекул iRNA, которые ингибируют экспрессию целевого гена у жесткокрылого насекомого) в регенерирующих растениях, можно провести ряд тестов. Такие тесты включают, например: молекулярно-биологические тесты, такие как Сайзерн и Нозерн-блоттинг, ПЦР и секвенирование нуклеиновой кислоты; биохимические тесты, такие как обнаружение присутствия белкового продукта, например, иммунологическими методами (ELISA и/или Вестерн-блоттинг) или с помощью ферментативной функции; исследования частей растений, например, исследования листьев или корней; и анализ фенотипа всего регенерированного растения.
События интеграции можно проанализировать, например, с помощью ПЦР-амплификации с применением, например, олигонуклеотидных праймеров, специфичных для молекулы нуклеиновой кислоты, представляющей интерес. Следует понимать, что генотипирование с помощью ПЦР включает, но не ограничивается амплификацией с помощью полимеразной цепной реакции (ПЦР) геномной ДНК, полученной из ткани каллуса, выделенной из растения-хозяина, предположительно содержащей искомую молекулу нуклеиновой кислоты, интегрированную в геном, с последующим стандартным клонированием и проведением анализа последовательности продуктов ПЦР-амплификации. Методы ПЦР-генотипирования хорошо описаны (например, Rios, G. et al. (2002) Plant J. 32:243-53) и могут быть применены к геномной ДНК, полученной из любого вида растения (например, Z. mays или G. max) или типа ткани, включая клеточные культуры.
Трансгенное растение, сформированное с помощью способов трансформации Agrobacterium, обычно содержит отдельную простую рекомбинантную последовательность ДНК, вставленную в одну хромосому, и называется трансгенным объектом. Отдельная рекомбинантная последовательность ДНК называется "трансгенным объектом" или "объектом интеграции". Такие трансгенные растения являются гемизиготными по вставленной экзогенной последовательности. В некоторых вариантах осуществления трансгенное растение, гомозиготное по трансгену, может быть получено с помощью полового скрещивания (самоопыления) самостоятельного изолированного трансгенного растения, которое содержит одну последовательность экзогенного гена для продукции семян F1. Одна четверть полученных семян F1 будет гомозиготной относительно трансгена. После прорастания семян F1 образуются растения, которые могут тестироваться на гетерозиготность или гомозиготность, обычно с помощью анализа SNP или термического анализа амплификации, который учитывает различие между гетерозиготами и гомозиготами (то есть анализа зиготности).
В конкретных вариантах осуществления в растительной клетке продуцируются по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 или больше различных молекул iRNA, которые обладают ингибиторным эффектом в отношении жесткокрылого насекомого. Молекулы iRNA (например, молекулы дцРНК) могут быть экспрессированы из нескольких последовательностей нуклеиновой кислоты, введенных в различных событиях трансформации, или из одной последовательности нуклеиновой кислоты, введенной во время одного события трансформации. В некоторых вариантах осуществления различные молекулы iRNA экспрессируются под контролем одного промотора. В других вариантах осуществления различные молекулы iRNA экспрессируются под контролем нескольких промоторов. Можно экспрессировать отдельные молекулы iRNA, которые содержат несколько последовательностей нуклеиновой кислоты, которые гомологичны различным локусам у одного или более жесткокрылых насекомых (например, локусы, определяемые SEQ ID NO: 2 и одной или более из SEQ ID NO: 1, 3 и 4), оба локуса в различных популяциях одного вида жесткокрылого насекомого или в различных видах жесткокрылых насекомых.
В дополнение к прямой трансформации растения рекомбинантной молекулой нуклеиновой кислоты, трансгенные растения можно получить скрещиванием первого растения, характеризующегося по меньшей мере одним трансгенным объектом, со вторым растением, не содержащим такого объекта. Например, рекомбинантная молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, которая кодирует молекулу iRNA, может быть введена в линию первого растения, которое способно к трансформации для получения трансгенного растения, такое трансгенное растение можно скрестить со второй линией растения, для интрогрессии нуклеотидной последовательности, которая кодирует молекулу iRNA в наследственность второй линии растения.
Некоторые варианты осуществления изобретения также включают товарные продукты, содержащие одну или более последовательностей настоящего изобретения, которые получают из рекомбинантного растения или семени, содержащих одну или более нуклеотидных последовательностей настоящего изобретения. Товарный продукт, содержащий одну или более нуклеотидных последовательностей настоящего изобретения, как предполагается, включает, но без ограничения, муку, масла, дробленые или целые зерна, или семена растения, или любой пищевой продукт, содержащий какую-либо муку, масло или дробленое или целое зерно рекомбинантного растения, или семя, содержащее одну или более последовательностей настоящего изобретения. Обнаружение одной или более последовательностей настоящего изобретения в одном или более товаре широкого потребления или в товарных продуктах, рассматриваемых здесь, de facto свидетельствует о том, что товар широкого потребления или товарный продукт состоит из трансгенного растения, разработанного для экспрессии одной или более нуклеотидных последовательностей настоящего изобретения с целью контроля заболевания растений с использованием методов дцРНК-опосредованной супрессии генов.
В некоторых аспектах семена и товарные продукты, произведенные трансгенными растениями, полученными из трансформированных растительных клеток, где семена или товарные продукты содержат детектируемое количество последовательности нуклеиновой кислоты изобретения. В некоторых вариантах осуществления такие товарные продукты могут быть произведены, например, путем получения трансгенных растений и приготовления продуктов питания или корма из них. Товарные продукты, содержащие одну или более последовательностей нуклеиновой кислоты изобретения, включают, например, и без ограничения: муку, масла, дробленые или целые зерна или семена растения, и любой продукт питания, содержащий муку, масло, дробленые или целые зерна рекомбинантного растения, или семена, содержащие одну или более последовательностей нуклеиновой кислоты изобретения. Обнаружение одной или более последовательностей изобретения в одном или более товаре широкого потребления или в товарных продуктах de facto является свидетельством того, что товар широкого потребления или товарный продукт состоит из трансгенного растения, разработанного для экспрессии одной или более молекул iRNA изобретения с целью контроля жесткокрылых насекомых.
В некоторых вариантах осуществления трансгенное растение или семя, содержащее молекулу нуклеиновой кислоты изобретения, также может содержать по меньшей мере один другой трансгенный объект в своем геноме, включая без ограничения: трансгенный объект, благодаря которому транскрибируется молекула iRNA, воздействующая на локус у жесткокрылого насекомого, отличный от локусов, обозначенных SEQ ID NO: 1-4; трансгенный объект, благодаря которому транскрибируется молекула iRNA, воздействующая на ген в организме, отличном от жесткокрылого насекомого (например, нематода, паразитирующая на растении); ген, кодирующий инсектицидный белок (например, инсектицидный белок Bacillus thuringiensis); ген устойчивости к гербициду (например, ген устойчивости к глифосату); и ген, способствующий желательному фенотипу у трансгенного растения, такому как повышенная урожайность, измененный метаболизм жирных кислот или восстановление цитоплазматической мужской стерильности). В конкретных вариантах осуществления последовательности, кодирующие молекулы iRNA изобретения, можно объединить с признаками контроля заболевания и другими признаками контроля насекомых у растения для достижения желаемых признаков повышенного контроля заболевания и повреждения насекомыми. Сочетание признаков контроля насекомых, которые реализуются за счет ясно выраженного механизма действия, обеспечивает получение защищенных трансгенных растений с превосходной устойчивостью, по сравнению с растениями, обладающими одним контрольным признаком, например, благодаря снижению вероятности того, что в природе разовьется устойчивость к данному признаку.
V. Супрессия гена-мишени у жесткокрылого насекомого
A. Обзор
В некоторых вариантах осуществления изобретения по меньшей мере одна молекула нуклеиновой кислоты, полезная для контроля жесткокрылых насекомых, может предоставляться жесткокрылому насекомому, где молекула нуклеиновой кислоты вызывает RNAi-опосредованный сайленсинг гена у жесткокрылого насекомого. В конкретных вариантах осуществления молекула iRNA (например, дцРНК, миРНК, микроРНК и hpРНК) может предоставляться хозяину жесткокрылого насекомого. В некоторых вариантах осуществления молекула нуклеиновой кислоты, полезная для контроля жесткокрылых насекомых, может предоставляться жесткокрылому насекомому путем контактирования молекулы нуклеиновой кислоты с жесткокрылым насекомым. В указанных и других вариантах осуществления молекула нуклеиновой кислоты, полезная для контроля жесткокрылых насекомых, может предоставляться в питательном субстрате жесткокрылого насекомого, например, в питательной композиции. В указанных и других вариантах осуществления молекула нуклеиновой кислоты, полезная для контроля жесткокрылых насекомых, может предоставляться путем потребления растительного материала, содержащего молекулу нуклеиновой кислоты, которая поглощается жесткокрылым насекомым. В определенных вариантах осуществления молекула нуклеиновой кислоты представлена в растительном материале в результате экспрессии рекомбинантной последовательности нуклеиновой кислоты, введенный в растительный материал, например, с помощью трансформации растительной клетки вектором, содержащим рекомбинантную последовательность нуклеиновой кислоты, и регенерации растительного материала или целого растения из трансформированной растительной клетки.
B. RNAi-опосредованная супрессия целевого гена
В вариантах осуществления изобретение предоставляет молекулы iRNA (например, дцРНК, миРНК, микроРНК и hpРНК), которые могут быть созданы для воздействия на важные нативные нуклеотидные последовательности (например, важные гены) в геноме и/или в библиотеке кДНК жесткокрылого насекомого (например, WCR или NCR), например, путем создания молекулы iRNA, которая включает в себя по меньшей мере одну цепь, содержащую нуклеотидную последовательность, которая специфически комплементарна последовательности-мишени. Последовательность молекулы iRNA, созданной таким образом, может быть идентична последовательности-мишени или может включать несоответствия, которые не препятствуют специфической гибридизации между молекулой iRNA и ее последовательностью-мишенью.
Молекулы iRNA изобретения можно использовать в способах супрессии гена у жесткокрылого насекомого, снижая, тем самым, уровень или частоту повреждения, вызываемого у растения паразитом (например, защищенное трансформированное растение, содержащее молекулу iRNA). В данном контексте термин "генная супрессия" обозначает хорошо известные способы снижения уровней белка, продуцируемого в результате транскрипции гена в мРНК и последующей трансляции мРНК, включая снижение экспрессии белка из гена или кодирующей последовательности, включая посттранскрипционное ингибирование экспрессии и транскрипционную супрессию. Посттранскрипционное ингибирование опосредуется специфической гомологией между всей мРНК или частью, транскрибированной из гена или кодирующей последовательности, намеченной для супрессии, и соответствующей молекулой iRNA, используемой для супрессии. И, посттранскрипционное ингибирование обозначает существенное и измеримое снижение количества мРНК, имеющейся в клетке, для связывания на рибосомах.
В вариантах осуществления, где молекула iRNA представляет собой молекулу дцРНК, молекула дцРНК может расщепляться ферментом, DICER, на две короткие молекулы миРНК (длиной приблизительно 20 нуклеотидов). Двухцепочечная молекула миРНК, образовавшаяся в результате активности DICER на основе молекулы дцРНК, может разделиться на две одноцепочечные миРНК; "сопровождающая" цепь и "направляющая” цепь. “Сопровождающая” цепь может разрушаться, и “направляющая” цепь может включаться в RISC. Посттранскрипционное ингибирование осуществляется путем специфической гибридизации “направляющей” цепи со специфической комплементарной последовательностью молекулы мРНК и последующего расщепления ферментом, Argonaute (каталитический компонент комплекса RISC).
В вариантах осуществления изобретения можно использовать любую форму молекулы iRNA. Специалисту в данной области понятно, что молекулы дцРНК обычно более стабильны при получении и во время стадии доставки молекулы iRNA в клетку, чем одноцепочечные молекулы РНК, и они обычно также являются более стабильными в клетке. Таким образом, в то время как молекулы миРНК и микроРНК, например, могут обладать одинаковой эффективностью в некоторых вариантах осуществления, молекула дцРНК может быть выбрана благодаря своей стабильности.
В конкретных вариантах осуществления предоставляется молекула нуклеиновой кислоты, которая содержит нуклеотидную последовательность, указанная нуклеотидная последовательность может экспрессироваться in vitro для получения молекулы iRNA, которая в основном гомологична молекуле нуклеиновой кислоты, кодируемой нуклеотидной последовательностью в геноме жесткокрылого насекомого. В определенных вариантах осуществления транскрибированная молекула iRNA in vitro может представлять собой стабилизированную молекулу дцРНК, которая содержит структуру “стебель-петля”. После того, как жесткокрылое насекомое контактирует с транскрибированной in vitro молекулой iRNA, у жесткокрылого насекомого может происходить посттранскрипционное ингибирование целевого гена (например, жизненно важного гена).
В некоторых вариантах осуществления изобретения экспрессия молекулы нуклеиновой кислоты, содержащей по меньшей мере 19 последовательно расположенных нуклеотидов нуклеотидной последовательности, используется в методе посттранскрипционного ингибирования целевого гена у жесткокрылого насекомого, где нуклеотидную последовательность выбирают из группы, состоящей из: SEQ ID NO: 2; последовательности, комплементарной SEQ ID NO: 2; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов SEQ ID NO: 2; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов SEQ ID NO: 2; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей SEQ ID NO: 2; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica содержащей SEQ ID NO: 2; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую SEQ ID NO: 2; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую SEQ ID NO: 2; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей SEQ ID NO: 2; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей SEQ ID NO: 2; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую SEQ ID NO: 2; и последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую SEQ ID NO: 2. В определенных вариантах осуществления молекула нуклеиновой кислоты содержит всю последовательность или часть любой из SEQ ID NO: 5-8, 112 и/или 113 (например, всю или часть любой из SEQ ID NO: 5 и 6). В определенных вариантах осуществления может быть использована экспрессия молекулы нуклеиновой кислоты, которая характеризуется идентичностью по меньшей мере 80% (например, 80%, приблизительно 81%, приблизительно 82%, приблизительно 83%, приблизительно 84%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 100% и 100%) с любой из указанных выше молекул. В указанных и других вариантах осуществления может быть экспрессирована молекула нуклеиновой кислоты, которая специфически гибридизуется с молекулой РНК, представленной по меньшей мере в одной клетке жесткокрылого насекомого.
В указанных и других вариантах осуществления экспрессия по меньшей мере еще одной молекулы нуклеиновой кислоты, содержащей по меньшей мере 19 последовательно расположенных нуклеотидов нуклеотидной последовательности, может быть использована в способе посттранскрипционного ингибирования целевого гена у жесткокрылого насекомого, где нуклеотидную последовательность выбирают из группы, состоящей из: SEQ ID NO: 1; последовательности, комплементарной SEQ ID NO: 1; SEQ ID NO: 3; последовательности, комплементарной SEQ ID NO: 3; SEQ ID NO: 4; последовательности, комплементарной SEQ ID NO: 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 и 4; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов любой из SEQ ID NO: 1, 3 и 4; нативной кодирующей последовательности организма Diabrotica (например, WCR), содержащей любую из SEQ ID NO: 1, 3 и 4; последовательности, комплементарной нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 и 4; нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 и 4; последовательности, комплементарной нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 и 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 и 4; последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной кодирующей последовательности организма Diabrotica, содержащей любую из SEQ ID NO: 1, 3 и 4; фрагмента по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 и 4; и последовательности, комплементарной фрагменту по меньшей мере из 19 последовательно расположенных нуклеотидов нативной некодирующей последовательности организма Diabrotica, которая транскрибируется в нативную молекулу РНК, содержащую любую из SEQ ID NO: 1, 3 и 4. В определенных вариантах осуществления может быть использована экспрессия молекулы нуклеиновой кислоты, которая характеризуется по меньшей мере 80% идентичностью (например, 80%, приблизительно 81%, приблизительно 82%, приблизительно 83%, приблизительно 84%, приблизительно 85%, приблизительно 86%, приблизительно 87%, приблизительно 88%, приблизительно 89%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 100% и 100%) с любой из указанных выше последовательностей. В указанных и других вариантах осуществления может экспрессироваться молекула нуклеиновой кислоты, которая специфически гибридизуется с молекулой РНК, представленной по меньшей мере в одной клетке жесткокрылого насекомого.
Важной особенностью некоторых вариантов осуществления изобретения является то, что система посттранскрипционного ингибирования RNAi допускает вариации последовательностей у генов-мишеней, которые можно ожидать в связи с генетической мутацией, полиморфизмом штаммов или эволюционной дивергенцией. Интродуцированная молекула нуклеиновой кислоты необязательно должна быть абсолютно гомологична первичному продукту транскрипции или полностью процессированной мРНК целевого гена, при условии, что интродуцированная молекула нуклеиновой кислоты специфически гибридизуется или с первичным продуктом транскрипции, или с полностью процессированной мРНК целевого гена. Кроме того, интродуцированная молекула нуклеиновой кислоты необязательно должна быть полноразмерной по отношению к первичному продукту транскрипции или полностью процессированной мРНК целевого гена.
Ингибирование целевого гена с применением технологии iRNA настоящего изобретения является специфичным по отношению к последовательности; т.е. нуклеотидные последовательности в основном гомологичные молекуле(ам) iRNA являются мишенью для генетического ингибирования. В некоторых вариантах осуществления молекула РНК, содержащая нуклеотидную последовательность, идентичную части последовательности целевого гена, может быть использована для ингибирования. В указанных и других вариантах осуществления может быть использована молекула РНК, содержащая нуклеотидную последовательность с одной или более вставками, делециями и/или точечными мутациями по сравнению с последовательностью целевого гена. В конкретных вариантах осуществления молекула iRNA и часть целевого гена могут разделять, например, по меньшей мере приблизительно от 80%, по меньшей мере приблизительно от 81%, по меньшей мере приблизительно от 82%, по меньшей мере приблизительно от 83%, по меньшей мере приблизительно от 84%, по меньшей мере приблизительно от 85%, по меньшей мере приблизительно от 86%, по меньшей мере приблизительно от 87%, по меньшей мере приблизительно от 88%, по меньшей мере приблизительно от 89%, по меньшей мере приблизительно от 90%, по меньшей мере приблизительно от 91%, по меньшей мере приблизительно от 92%, по меньшей мере приблизительно от 93%, по меньшей мере приблизительно от 94%, по меньшей мере приблизительно от 95%, по меньшей мере приблизительно от 96%, по меньшей мере приблизительно от 97%, по меньшей мере приблизительно от 98%, по меньшей мере приблизительно от 99%, по меньшей мере приблизительно от 100% и 100% идентичности последовательности. Альтернативно, дуплексная область молекулы дцРНК может специфически гибридизоваться с частью транскрипта целевого гена. В специфически гибридизуемых молекулах неполная последовательность, проявляющая более высокую степень гомологии, компенсирует более длинную менее гомологичную последовательность. Длина нуклеотидной последовательности дуплексной области молекулы дцРНК, которая идентична части транскрипта целевого гена, может составлять по меньшей мере приблизительно 25, 50, 100, 200, 300, 400, 500 или по меньшей мере приблизительно 1000 оснований. В некоторых вариантах осуществления может использоваться последовательность длиной больше 20-100 нуклеотидов. В конкретных вариантах осуществления может использоваться последовательность длиной больше чем приблизительно 200-300 нуклеотидов. В конкретных вариантах осуществления может использоваться последовательность длиной больше чем приблизительно 500-1000 нуклеотидов, в зависимости от размера целевого гена.
В определенных вариантах осуществления экспрессия целевого гена жесткокрылого насекомого может ингибироваться по меньшей мере на 10%, по меньшей мере на 33%, по меньшей мере на 50% или по меньшей мере на 80% внутри клетки жесткокрылого насекомого, так что происходит существенное ингибирование. Существенное ингибирование относится к ингибированию выше порога, что дает в результате обнаруживаемый фенотип (например, прекращение роста, прекращение питания, прекращение развития и смертность насекомых и т.д.), или детектируемое снижение РНК и/или продукта гена, соответствующего целевому гену, который ингибируется. Хотя в определенных вариантах осуществления изобретения ингибирование происходит по существу во всех клетках жесткокрылого насекомого, в других вариантах осуществления ингибирование происходит только в подгруппе клеток, экспрессирующих целевой ген.
В некоторых вариантах осуществления транскрипционная супрессия опосредуется присутствием в клетке молекулы дцРНК, демонстрирующей существенную идентичность последовательности с последовательностью ДНК промотора или с комплементарной ей последовательностью для осуществления эффекта, обозначаемого как "промоторная транс-супрессия" (promoter trans suppression). Генная супрессия может быть эффективной в отношении целевых генов у жесткокрылого насекомого, которое может потреблять такие молекулы дцРНК или контактировать с ними, например, при поедании растительного материала или контактировании с растительным материалом, содержащим молекулы дцРНК. Молекулы дцРНК для использования в промоторной транс-супрессии, могут быть специально созданы для ингибирования или подавления одной или более гомологичных или комплементарных последовательностей в клетках жесткокрылого насекомого. Посттранскрипционная супрессия генов с помощью РНК со смысловой или антисмысловой ориентацией для регуляции экспрессии генов в растительных клетках раскрывается в патентах США № 5107065; № 5759829; № 5283184; и № 5231020.
C. Экспрессия молекул iRNA, предоставляемых жесткокрылому насекомому
Экспрессия молекул iRNA для RNAi-опосредованного ингибирования гена у жесткокрылого насекомого может осуществляться в любом из многочисленных форматов in vitro или in vivo. Затем молекулы iRNA можно предоставить жесткокрылому насекомому, например, путем контактирования молекул iRNA с паразитом, или заставляя паразита принимать внутрь или другим путем усваивать молекулы iRNA. Некоторые варианты осуществления изобретения включают трансформированные растения-хозяева жесткокрылых насекомых, трансформированные растительные клетки и потомство трансформированных растений. Трансформированные растительные клетки и трансформированные растения могут быть сконструированы для экспрессии одной или более молекул iRNA, например, под контролем гетерологичного промотора, чтобы обеспечить защитный эффект против паразитов. Таким образом, если трансгенное растение или растительная клетка съедается жесткокрылым насекомое во время питания, паразит может проглотить молекулы iRNA, экспрессированные в трансгенных растениях или клетках. Нуклеотидные последовательности настоящего изобретения также могут быть помещены в большое число прокариотических и эукариотических микроорганизмов-хозяев для получения молекул iRNA. Термин "микроорганизм" включает прокариотические и эукариотические виды, такие как бактерии и грибы.
Модуляция генной экспрессии может включать частичное или полное подавление такой экспрессии. В другом варианте осуществления способ подавления генной экспрессии у жесткокрылого насекомого включает предоставление в ткани хозяина паразита в количестве, подавляющем ген, по меньшей мере одной молекулы дцРНК, транскрибированной из нуклеотидной последовательности, как описано здесь, по меньшей мере один сегмент которой комплементарен последовательности мРНК в клетках жесткокрылого насекомого. Молекула дцРНК, включая ее модифицированную форму, такую как молекула миРНК, микроРНК или hpРНК, потребленная патогенным микроорганизмом согласно изобретению, может быть по меньшей мере приблизительно на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или приблизительно на 100% идентична молекуле РНК, транскрибированной из молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4. Таким образом, предоставляются выделенные и в основном очищенные молекулы нуклеиновой кислоты, включающие, но без ограничения, неприродные нуклеотидные последовательности и рекомбинантные ДНК-конструкты для транскрипции молекул дцРНК настоящего изобретения, которые подавляют или ингибируют экспрессию эндогенной кодирующей последовательности или целевой кодирующей последовательности у жесткокрылого насекомого при введении в него.
Конкретные варианты осуществления предоставляют систему доставки для доставки молекул iRNA для посттранскрибционного ингибирования одного или более целевых генов у жесткокрылого насекомого, паразитирующего на растении, и контроля популяции жесткокрылого насекомого, паразитирующего на растении. В некоторых вариантах осуществления система доставки включает потребление трансгенной растительной клетки-хозяина или содержимое клетки-хозяина, включающей в себя молекулы РНК, транскрибированные в клетке-хозяине. В указанных и других вариантах осуществления создают трансгенную растительную клетку или трансгенное растение, которое содержит рекомбинантную ДНК-конструкцию, которая при транскрипции дает стабильную молекулу дцРНК изобретения. Трансгенные растительные клетки и трансгенные растения, содержащие последовательности нуклеиновой кислоты, кодирующие определенную молекулу iRNA, можно создать с применением рекомбинантных технологий ДНК (такие базовые технологии хорошо известны в данной области) для построения вектора для трансформации растений, содержащего нуклеотидную последовательность, кодирующую молекулу iRNA изобретения (например, стабильную молекулу дцРНК); для трансформации растительной клетки или растения; и для создания трансгенной растительной клетки или трансгенного растения, которое содержит транскрибируемую молекулу iRNA.
Для придания трансгенному растению устойчивости к жесткокрылому насекомому молекулу рекомбинантной ДНК можно, например, транскрибировать в молекулу iRNA, такую как молекула дцРНК, молекула миРНК, молекула микроРНК или молекула hpРНК. В некоторых вариантах осуществления молекула РНК, транскрибированная из молекулы рекомбинантной ДНК, может образовывать молекулу дцРНК в тканях или жидкостях рекомбинантного растения. Такая молекула дцРНК может быть включена в часть нуклеотидной последовательности, которая идентична соответствующей нуклеотидной последовательности, транскрибируемой из последовательности ДНК в жесткокрылом насекомом того типа, который может паразитировать на растении-хозяине. Экспрессия целевого гена у жесткокрылого насекомого супрессируется молекулой дцРНК, и подавление экспрессии целевого гена у жесткокрылого насекомого дает в результате трансгенное растение, которое устойчиво к жесткокрылому насекомому. Показано, что модуляторные эффекты молекул дцРНК применимы к различным генам, экспрессированным в паразитах, включая, например, эндогенные гены, ответственные за клеточный метаболизм или клеточную трансформацию, включая конститутивные гены; факторы транскрипции; гены, связанные с линькой; и другие гены, которые кодируют полипептиды, вовлеченные в клеточный метаболизм или нормальный рост и развитие.
При транскрипции in vivo из трансгена или из экспрессирующей конструкции, можно использовать регуляторную область (например, промотор, энхансер, сайленсер и сигнал полиаденилирования) в некоторых вариантах осуществления для транскрипции цепи (или цепей) РНК. Таким образом, в некоторых вариантах осуществления, как указано выше, нуклеотидная последовательность при использовании в получении молекул iRNA может быть функционально связана с одной или более промоторными последовательностями, функциональными в растительной клетке-хозяине. Промотор может представлять собой эндогенный промотор, обычно присутствующий в геноме хозяина. Нуклеотидная последовательность настоящего изобретения под контролем функционально связанной промоторной последовательности также может быть фланкирована дополнительными последовательностями, которые благоприятно влияют на транскрипцию и/или стабильность образующегося транскрипта. Такие последовательности могут быть расположены слева от функционально связанного промотора, справа от 3’-конца экспрессирующей конструкции, и могут располагаться как слева от промотора, так и справа от 3’-конца экспрессирующей конструкции.
Некоторые варианты осуществления предоставляют способы уменьшения повреждения растения-хозяина (например, зернового растения), вызванного жесткокрылым насекомым, которое питается растением, где способ включает предоставление в растении-хозяине трансформированной растительной клетки, экспрессирующей по меньшей мере одну молекулу нуклеиновой кислоты изобретения, где молекула(ы) нуклеиновой кислоты функционирует после поглощения жесткокрылым насекомым с ингибированием экспрессии последовательности-мишени у жесткокрылого насекомого, такое ингибирование экспрессии вызывает гибель, уменьшение роста и/или снижение репродуктивности жесткокрылого насекомого, уменьшая таким образом повреждение растения-хозяина, вызываемое жесткокрылым насекомым. В некоторых вариантах осуществления молекула(ы) нуклеиновой кислоты включает молекулы дцРНК. В указанных и других вариантах осуществления молекула(ы) нуклеиновой кислоты включает молекулы дцРНК, каждая из которых содержит более чем одну нуклеотидную последовательность, которая специфически гибридизуется с молекулой нуклеиновой кислоты, экспрессированной в клетке жесткокрылого насекомого. В некоторых вариантах осуществления молекула(ы) нуклеиновой кислоты состоит из одной нуклеотидной последовательности, которая специфически гибридизуется с молекулой нуклеиновой кислоты, экспрессированной в клетке жесткокрылого насекомого.
В некоторых вариантах осуществления предоставляется способ повышения урожая зерновой сельскохозяйственной культуры, где способ включает интродукцию в зерновое растение по меньшей мере одной молекулы нуклеиновой кислоты изобретения; культивирование зерновой сельскохозяйственной культуры для обеспечения экспрессии молекулы iRNA, содержащей последовательность нуклеиновой кислоты, где экспрессия молекулы iRNA, содержащей последовательность нуклеиновой кислоты, ингибирует ущерб, наносимый жесткокрылым насекомым и/или рост жесткокрылого насекомого, таким образом уменьшая или устраняя потерю урожая вследствие заражения жесткокрылым насекомым. В некоторых вариантах осуществления молекула iRNA представляет собой молекулу дцРНК. В указанных и других вариантах осуществления молекула(ы) нуклеиновой кислоты включает молекулы дцРНК, каждая из которых содержит более чем одну нуклеотидную последовательность, которая специфически гибридизуется с молекулой нуклеиновой кислоты, экспрессированной в клетке жесткокрылого насекомого. В некоторых вариантах осуществления молекула(ы) нуклеиновой кислоты состоит из одной нуклеотидной последовательности, которая специфически гибридизуется с молекулой нуклеиновой кислоты, экспрессированной в клетке жесткокрылого насекомого.
В некоторых вариантах осуществления предоставляется способ модулирования экспрессии целевого гена у жесткокрылого насекомого, включающий: трансформацию растительной клетки вектором, содержащим последовательность нуклеиновой кислоты, кодирующую по меньшей мере одну молекулу нуклеиновой кислоты изобретения, где нуклеотидная последовательность функционально связана с промотором и с последовательностью терминации транскрипции; культивирование трансформированной растительной клетки в условиях, достаточных, чтобы обеспечить развитие культуры растительных клеток, содержащей несколько трансформированных растительных клеток; отбор трансформированных растительных клеток, которые содержат в своем геноме интегрированную молекулу нуклеиновой кислоты; скрининг трансформированных растительных клеток в отношении экспрессии молекулы iRNA, кодируемой интегрированной молекулой нуклеиновой кислоты; отбор трансгенной растительной клетки, которая экспрессирует молекулу iRNA; и кормление отобранной трансгенной растительной клеткой жесткокрылого насекомого. Растения также могут быть регенерированы из трансформированных растительных клеток, которые экспрессируют молекулу iRNA, кодируемую интегрированной молекулой нуклеиновой кислоты. В некоторых вариантах осуществления молекула iRNA является молекулой дцРНК. В указанных и других вариантах осуществления молекула(ы) нуклеиновой кислоты включает молекулы дцРНК, каждая из которых содержит более чем одну нуклеотидную последовательность, которая специфически гибридизуется с молекулой нуклеиновой кислоты, экспрессированной в клетке жесткокрылого насекомого. В некоторых вариантах осуществления молекула(ы) нуклеиновой кислоты состоит из одной нуклеотидной последовательности, которая специфически гибридизуется с молекулой нуклеиновой кислоты, экспрессированной в клетке жесткокрылого насекомого.
Молекулы iRNA изобретения можно поместить внутрь семян или на семена растительного вида (например, кукуруза), либо в виде продукта экспрессии рекомбинантного гена, включенного в геном растительных клеток, либо использовать их при дражировании и протравливании семян, которые производят перед посадкой семян. Растительная клетка, содержащая рекомбинантный ген, считается трансгенным объектом. Также включены системы доставки для доставки молекул iRNA жесткокрылым насекомым. Например, молекулы iRNA изобретения могут быть непосредственно интродуцированы в клетки жесткокрылого насекомого. Способы интродукции могут включать прямое смешивание iRNA с растительной тканью, полученной у хозяина жесткокрылого насекомого, а также нанесение композиций, содержащих молекулы iRNA изобретения, на ткань растения-хозяина. Например, молекулы iRNA можно распылить на поверхность растения. Альтернативно, молекула iRNA может быть экспрессирована микроорганизмом, и микроорганизм может быть нанесен на поверхность растения или интродуцирован в корень или стебель физическими средствами, например, с помощью инъекции. Как обсуждалось выше, также можно генетически сконструировать трансгенное растение, которое экспрессирует по меньшей мере одну молекулу iRNA в количестве, достаточном, чтобы вызвать гибель известных жесткокрылых насекомых, которые паразитируют на растении. Молекулы iRNA, полученные с помощью химического или ферментного синтеза, также можно включить в состав способом, согласующимся со стандартными агротехническими приемами, и применять в виде напыляемых продуктов для контроля заболевания растений. Составы могут включать подходящие адгезивные агенты и смачиватели, необходимые для эффективного покрытия листьев, а также УФ-протектанты для защиты молекул iRNA (например, молекулы дцРНК) от УФ-повреждения. Такие добавки обычно используют в производстве биоинсектицидов, и они хорошо известны специалистам в данной области. Такие составы для нанесения можно объединить с другими напыляемыми инсектицидными составами (на биологической или другой основе) для усиления защиты растений от жесткокрылых насекомых.
Все ссылки, включая публикации, патенты и патентные заявки, приведенные в настоящей заявке, включены в качестве ссылки в том случае, когда они не противоречат деталям настоящего раскрытия, и они включены в равной мере, как если бы каждая ссылка была указана независимо и специально посредством ссылки и изложена здесь во всей полноте. Ссылки, обсуждаемые здесь, предоставляются исключительно для их раскрытия до даты регистрации настоящей заявки. Настоящий документ не содержит ничего, что можно было бы истолковать как признание того, что авторы изобретения не имеют право датировать задним числом такое раскрытие на основании предшествующего изобретения.
Следующие примеры предоставляются, чтобы проиллюстрировать определенные конкретные особенности и/или аспекты. Указанные примеры не следует истолковывать как ограничивающие раскрытие описанных конкретных особенностей или аспектов.
ПРИМЕРЫ
Пример 1: материалы и методы
Приготовление образцов и биотесты
Ряд молекул дцРНК (включая Caf1-180; область 1 субъединицы С вакуолярной АТФазы (v-ATPase); область 2 субъединицы С вакуолярной АТФазы; область 1 субъединицы H вакуолярной АТФазы; область 2 субъединицы H вакуолярной АТФазы; и Rho1) синтезировали и очищали с помощью набора MEGAscript® RNAi (AMBION, Foster City, CA). Очищенные молекулы дцРНК получали в буфере TE, и все биологические тесты включали контрольную обработку, состоящую из указанного буфера, которая служила в качестве проверки фонового уровня смертности или ингибирования роста WCR. Концентрации молекул дцРНК в буфере биотеста измеряли с применением спектрофотометра NanoDropTM 8000 (Thermo Scientific, Wilmington, DE).
Образцы тестировали в отношении активности насекомых в биотестах, которые осуществляли с новорожденными личинками насекомых на искусственном питании для насекомых. Яйца WCR получали от Crop Characteristics, Inc. (Farmington, MN).
Биотесты осуществляли в 128-луночных пластмассовых планшетах, специально разработанных для проведения биотестов с участием насекомых (C-D International, Pitman, NJ). Каждая лунка содержала приблизительно 1,0 мл питания, разработанного для роста жесткокрылых насекомых. Аликвоту образца белка объемом 60 мкл наносили пипеткой на поверхность питания 1,5 см2 в каждой лунке (40 мкл/см2). Концентрации образцов дцРНК рассчитывали в виде количества дцРНК на квадратный сантиметр (нг/см2) площади поверхности в лунке. Обработанные планшеты оставляли в вытяжном шкафу до тех пор, пока жидкость на поверхности питания не испарялась или не впитывалась в питание.
В течение нескольких часов вылупления отдельные личинки собирали смоченной щеткой из верблюжьего волоса и помещали на обработанную пищу (одна или две личинки на лунку). Заполненные лунки 128-луночных пластмассовых планшетов затем плотно закрывали самоклеящимися полосками прозрачного пластика и проделывали отверстия для газообмена. Планшеты для биотестов оставляли в контролируемых условиях окружающей среды (28°C, приблизительно 40% относительной влажности, 16:8 [цикл дня и ночи]) в течение 9 дней, после чего записывали общее число насекомых, подвергавшихся воздействию в каждом образце, количество погибших насекомых и вес выживших насекомых. Процент смертности насекомых, средние значения веса живых насекомых и ингибирование роста рассчитывали для каждого варианта обработки. Замедление роста определяли как снижение средних значений живой массы. Ингибирование роста (GI) рассчитывали следующим образом:
GI=[1-(TWIT/TNIT)/(TWIBC/TNIBC)]
где TWIT - общий вес живых насекомых в обработке;
TNIT - общее число насекомых в обработке;
TWIBC - общий вес живых насекомых при проверке фона (контроль с буфером); и
TNIBC - общий вес насекомых при проверке фона (контроль с буфером).
Значение GI50 определяют как концентрацию образца в пище, при которой значение GI составляет 50%. Значение LC50 (50% летальная концентрация) регистрируют как концентрацию образца в питании, при которой 50% подопытных насекомых погибает. Статистический анализ выполняли с применением программного обеспечения JMPTM (SAS, Cary, NC).
Повторные биотесты показали, что поедание образцов приводит к удивительной и неожиданной гибели и ингибированию роста личинок кукурузного жука.
Пример 2: идентификация кандидатов генов-мишеней
Личинки WCR первой возрастной стадии выбирали для транскриптомного анализа, поскольку контроль на данной стадии роста с помощью трансгенной технологии устойчивости к насекомым был бы полезным.
Общую РНК выделяли приблизительно из 0,9 гм целых личинок WCR первой возрастной стадии (Diabrotica virgifera virgifera LeConte; 4-5 дней после выведения, хранили при 16°C) и очищали с применением следующего метода на основе фенол/TRI REAGENT® (Molecular Research Center, Cincinnati, OH; по каталогу № TR 118):
Личинки гомогенизировали при комнатной температуре в гомогенизаторе объемом 15 мл с 10 мл TRI REAGENT® до получения гомогенной суспензии. После 5 мин инкубации при комнатной температуре, гомогенат помещали в 1,5-мл центрифужные микропробирки (1 мл на пробирку), добавляли 200 мкл хлороформа, и смесь энергично встряхивали в течение 15 секунд. Затем экстракту давали осесть при комнатной температуре в течение 10 мин, фазы разделяли центрифугированием при 12000g при 4°C. Верхнюю фазу (содержащую приблизительно 0,6 мл) осторожно переносили в другую стерильную 1,5-мл пробирку, и добавляли равный объем (0,6 мл) изопропанола комнатной температуры. После инкубации при комнатной температуре в течение 5-10 мин, смесь центрифугировали 8 мин при 12000g (4°C или 25°C).
Супернатант осторожно собирали и удаляли, и осадок РНК дважды отмывали с помощью перемешивания на вортексе с 75% этанолом, с извлечением с помощью центрифугирования в течение 5 мин при 7500g (4°C или 25°C) после каждой промывки. Этанол осторожно удаляли, осадок высушивали на воздухе в течение 3-5 мин, и затем растворяли в безнуклеазной стерильной воде. Концентрацию РНК определяли путем измерения абсорбции (A) при 260 нм и 280 нм. Типичная экстракция из 0,9 г личинок позволяла извлечь свыше 1 мг общей РНК, с коэффициентом отношения A260/A280 1,9. Экстрагированную таким образом РНК хранили при - 80°C до проведения последующих исследований.
Качество РНК определяли путем проведения анализа аликвоты в 1% агарозном геле. Раствор агарозного геля получали с применением стерилизованного в автоклаве 10× TAE буфера (Трис-ацетат ЭДТА, 1× концентрация включает 0,04 M Трис-ацетат, 1 мМ ЭДТА (натриевая соль этилендиаминтетрауксусной кислоты, pH 8,0) разведенный водой, обработанной DEPC (диэтилпирокарбонат) в обработанном в автоклаве контейнере. 1× TAE применяли в качестве подвижного буфера. Перед использованием электрофорезную камеру и гребенку для формирования лунок очищали реагентом RNAseAwayTM (Invitrogen Inc., Carlsbad, CA). Два мкл образца РНК смешивали с 8 мкл TE буфера (10 мМ Tris HCl, pH 7,0; 1 мМ ЭДТА) и 10 мкл буфера для образца РНК (Novagen®, по каталогу № 70606; EMD4 Bioscience, Gibbstown, NJ). Образец нагревали при 70°C в течение 3 мин, охлаждали до комнатной температуры, и помещали в лунку по 5 мкл (содержащих от 1 мкг до 2 мкг РНК). Коммерчески доступные маркеры молекулярного веса РНК помещали одновременно в отдельные лунки для сравнения размеров молекул. Электрофорез проводили при 60 В в течение 2 часов.
Нормализованную библиотеку кДНК получали из общей РНК с помощью провайдера коммерческого провайдера ервиса (Eurofins MWG Operon, Huntsville, AL), с использованием случайного праймирования.
Нормализованную библиотеку кДНК личинок секвенировали при масштабе 1/2 шкалы путем проведения серии анализов на секвенаторе GS FLX 454 TitaniumTM в лаборатории Eurofins MWG Operon, с получением свыше 600000 чтений со средней длиной чтений 348 п.н. 350000 чтений были собраны в более чем 50000 контигов. Как несобранные считывания, так и контиги конвертировали в базы данных, совместимые с программой BLAST с использованием общедоступной программы FORMATDB (доступна в Национальном Центре Биологической Информации (NCBI)).
Гены-кандидаты для воздействия RNAi выбирали с помощью информации, касающейся применения летальных эффектов RNAi конкретных генов у других насекомых, таких как Drosophila и Tribolium. Указанные гены предположительно являлись важными для выживания и роста жесткокрылых насекомых. Выбранные гомологи генов-мишеней идентифицировали в базе данных последовательностей транскриптов, как описано ниже. Полные или частичные последовательности генов-мишеней амплифицировали с помощью ПЦР для создания матриц для получения двухцепочечных РНК (дцРНК).
Поиски в базе данных TBLASTN с использованием кандидатных кодирующих последовательностей белков проводили в сопоставлении с BLAST-совместимыми базами данных, содержащими несобранные считывания последовательностей Diabrotica или собранные контиги. Существенные совпадения с последовательностью Diabrotica (определяемые как значение выше, чем e-20 при определении гомологии контигов, и выше чем e-10 при определении гомологии несобранных считываний) подтверждали с применением BLASTX в сопоставлении с базой данных неповторяющихся последовательностей NCBI. Результаты данного поиска BLASTX подтверждали, что гомологичные последовательности генов-кандидатов Diabrotica, идентифицированные при поиске TBLASTN, в действительности содержали гены Diabrotica или являлись наилучшим соответствием, доступным в последовательностях Diabrotica для последовательности кандидатного гена, другого, чем ген Diabrotica. В большинстве случаев кандидатные гены Tribolium, которые аннотированы как белок, давали однозначную гомологию последовательности с последовательностью или последовательностями в транскриптомных последовательностях Diabrotica. В некоторых случаях было очевидно, что некоторые контиги или несобранные считывания последовательностей Diabrotica, отобранные по гомологии с кандидатным геном, не относящимся к Diabrotica, перекрываются, и что сборка контигов не даст удовлетворительный результат соединения таких перекрываний. В таких случаях SequencherTM v4.9 (Gene Codes Conooration, Ann Arbor, MI) использовали для сборки последовательностей в более длинные контиги.
Ряд кандидатных генов-мишеней идентифицировали в качестве генов, которые могут привести к гибели жесткокрылого насекомого или к ингибированию роста, развития или репродукции WCR, включая SEQ ID NO: 1-4. Полноразмерные или частичные клоны последовательностей кандидатных генов-гомологов Diabrotica использовали для создания ПЦР-ампликонов для синтеза дцРНК.
SEQ ID NO: 1 соответствует D_vir_c47185, который является гомологом Caf1-180, и обозначается здесь как Caf1-180. Известно, что Caf1-180 Drosophila участвует в доставке гистонов на вновь синтезированную ДНК и Caf1-180. Показано, что мутации с потерей функции у Drosophila Caf1-180 вызывают блокировку роста личинок и развития, и гибель личинок (Klapholz et al. (2009) Chromosoma 118(2):235-48; Tyler et al. (2001) Mol. Cell Biol. 21(19):6574-84; Song et al. (2007) Dev. Biol. 311(1):213-22).
SEQ ID NO: 2 соответствует D_vir_c1229, которая является гомологом субъединицы С вакуолярной АТФазы и обозначается здесь как VatpaseC. SEQ ID NO: 5-8 представляют собой несмежные фрагменты последовательности VatpaseC.
SEQ ID NO: 3 соответствует D_vir_c1319, который является гомологом субъединицы Н вакуолярной АТФазы и обозначается здесь как VatpaseH. SEQ ID NO: 9-11 представляют собой несмежные фрагменты последовательности VatpaseH.
Вакуолярная АТФаза Drosophila представляет собой многосубъединичный протонный переносчик, вовлеченный в сигнальный путь рецептора Notch (Vaccari et al. (2010) Development 137(11):1825-32). Показано, что мутации с потерей функции в субъединицах вакуолярной АТФазы Drosophila являются рецессивными летальными мутациями (Allan et al. (2005) Physiol. Genomics 22(2):128-38; и Davies et al. (1996) J. Biol. Chem. 271(48):30677-84). VATPaseC (Vha44) и VATPaseH (VhaSFD) представляют собой две субъединицы вакуолярной АТФазы Drosophila.
SEQ ID NO: 4 представляет собой Contig_01_Rho1_1-191_CDC42, обозначаемый здесь как Rho1. Функция Rho1 Drosophila состоит в регулировании сборки и разборки филаментов актина, и мутации с потерей функции Rho1 Drosophila оказывают значительное влияние на клеточный компонент движения, ремоделирование синапсов, развитие личинок и ответ на стресс (Fox et al. (2005) Development 132(21):4819-31; Kadandale et al. (2010) Proc. Natl. Acad. Sci. U.S.A. 107(23): 10502-7; Rosales-Nieves et al. (2006) Nat. Cell Biol. 8(4):367-76; Magie and Parkhurst (2005) Dev. Biol. 278(1):144-54; и Xu et al. (2008) Dev. Biol. 321(1):88-100).
Пример 3: амплификация генов-мишеней
Создавали праймеры для амплификации частей кодирующих областей каждого гена-мишени с помощью ПЦР. Смотрите таблицу 1. В соответствующих случаях последовательность промотора фага T7 (TTAATACGACTCACTATAGGGAGA (SEQ ID NO: 12)) включали в 5’-конце амплифицированной смысловой или антисмысловой цепи. Смотрите таблицу 1. Геномную ДНК экстрактировали из WCR, и ПЦР-праймеры использовали для амплификации всей или части нативной последовательности гена-мишени из геномной ДНК с помощью реакции ПЦР.
|
Пример 4: конструкции RNAi
Создание матрицы с помощью ПЦР и синтез дцРНК
Стратегия, примененная для создания специфических матриц для получения дцРНК in vitro, показана на фиг.1. Матрицы ДНК, предназначенные для применения в синтезе дцРНК, получали с помощью ПЦР с применением пар праймеров, указанных в таблице 1, и (в качестве матрицы в ПЦР) одноцепочечной кДНК, полученной из общей РНК, выделенной из личинки WCR первой возрастной стадии. Для каждой выбранной области гена-мишени выполняли две отдельных ПЦР-амплификации. При первой ПЦР-амплификации вводили последовательность промотора T7 в 5’-конец амплифицированных смысловых цепей. С помощью второй реакции включали последовательность промотора T7 в 5’-концы антисмысловых цепей. Два ПЦР-амплифицированных фрагмента каждой области генов-мишеней затем смешивали приблизительно в одинаковых количествах, и смесь использовали в качестве матрицы для транскрипции при получении дцРНК. Фиг.1. Двухцепочечную РНК синтезировали и очищали с использованием набора Ambion® MEGAscript® RNAi, следуя инструкциям производителя (Foster City, CA). Последовательности матриц дцРНК, амплифицированные с конкретными праймерами, представляли собой: SEQ ID NO: 86 (Caf1-180); SEQ ID NO: 7 и 8 (VatpaseC); SEQ ID NO: 10 и 11 (VatpaseH); и SEQ ID NO: 87 (Rho1). Концентрации дцРНК измеряли с помощью спектрофотометра NanoDropTM 8000 (Thermo Scientific, Wilmington, DE).
Построение векторов для трансформации растений. Метод 1
Стандартные методы клонирования технологии Multi-site Gateway® (Invitrogen) использовали для построения экспрессионных векторов шпилечной РНК (hpРНК) для WHISKERSTM-опосредованной трансформации клеток кукурузы. Отдельные исходные векторы конструировали для двух маркерных генов, используемых для скрининга/селекции клеток кукурузы после трансформации; гена желтого флуоресцентного белка (YFP, Shagin et al. (2004) Mol. Biol. Evol. 21(5):841-50) и гена устойчивости к гербициду (ген фосфинотрицин-ацетилтрансферазы (PAT), Wehrmann et al. (1996) Nat. Biotechnol. 14(10): 1274-8). Экспрессия каждого из указанных генов контролировалась копией промотора гена актина 1 риса (OsAct1, патент США № 5641876). Фрагмент, содержащий 3’-нетранслируемую область гена пероксидазы кукурузы (ZmPer5 3’ UTR v2, патент США № 6699984), использовали для терминации транскрипции генов.
Третий тип исходного вектора, созданный для получения hpРНК, также конструировали с использованием фрагментов гена Caf1-180 или гена VatpaseC. Области генов-мишеней Caf1-180 и VatpaseC амплифицировали для синтеза “шпилек” с применением праймеров, указанных в таблице 2. Внутримолекулярному образованию шпильки первичными транскриптами РНК способствовало расположение (в пределах одной единицы транскрипции) двух копий фрагмента гена-мишени с противоположной ориентацией по отношению друг к другу, два фрагмента были разделены последовательностью интрона ST-LS1 (Vancanneyt et al. (1990) Mol. Gen. Genet. 220(2):245-50). Продукция первичного транскрипта мРНК запускалась копией промотора убиквитина 1 кукурузы (патент США № 5510474). Таким образом, первичный транскрипт мРНК включает в себя две последовательности фрагмента гена в виде больших инвертированных повторов друг друга, разделенных последовательностью интрона. Фрагмент, содержащий 3’-нетранслируемую область гена липазы кукурузы (ZmLip 3’ UTR, патент США № 7179902), использовали для терминации транскрипции генов.
|
SEQ ID NO: 49 представляет последовательность Caf1-180, образующую шпильку, и SEQ ID NO: 50 представляет последовательность VatpaseC, образующую шпильку.
Создавали две версии “исходных” векторов для экспрессии hpРНК для каждого из генов Caf1-180 и VatpaseC. В первой версии “исходных” векторов контекстная консенсусная последовательность кукурузы, содержащая стартовую точку трансляции, была представлена в мРНК 5’ нетранслируемой лидерной последовательности, прилегающей к 5’-концу первой последовательности фрагмента гена-мишени, которая была представлена в "прямой" ориентации (которая находится в смысловой ориентации относительно промотора). Во второй версии консенсусную последовательность кукурузы, содержащую стартовую точку трансляции, не включали.
Стандартную реакцию рекомбинации GATEWAY® осуществляли с 3 “исходными” векторами и “адресным” вектором (pDAB104124) с применением LR CLONASE II PLUSTM от Invitrogen. В готовом экспрессионном векторе hpРНК, кассета hpРНК была фланкирована кассетами экспрессии генов YFP и PAT.
Очистку фрагментов для WHISKERSTM-опосредованной трансформации осуществляли в препаративном масштабе с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), после того как ДНК экспрессионного вектора YFP/hpРНК/PAT расщепляли с помощью либо BclI (для конструкций Caf1-180), либо BbsI плюс AfeI (для конструкций VatpaseC) для удаления бактериального гена устойчивости к спектиномицину, представленному в скелете вектора.
Создание векторов для трансформации растений. Метод 2
“Адресный” вектор WHISKERSTM. Стандартную методику клонирования для одного сайта GATEWAY® (INVITROGEN) использовали для построения экспрессионного вектора шпилечной РНК (hpРНК) для WHISKERSTM-опосредованной трансформации клеток кукурузы. Два маркерных гена включали в “адресный” вектор (называемый pDAB108916) и использовали для скрининга и селекции клеток кукурузы после трансформации. Ген желтого флуоресцентного белка (YFP, Shagin et al. (2004) Mol. Biol. Evol. 21(5):841-50) использовали для визуального скрининга, и ген устойчивости к гербициду (фосфинотрицин-ацетилтрансфераза (PAT), Wehrmann et al. (1996) Nat. Biotechnol. 14(10): 1274-8) использовали для селекции трансформантов. Экспрессия каждого из двух маркерных генов контролировалась отдельными копиями промотора бациллярного баднавируса сахарного тростника (SCBV) (патент США № 6489462), содержащего химерную 5’UTR-последовательность, собранную из 5’UTR-части гена белковой оболочки вируса полосатой пятнистости кукурузы (учетный номер в GENBANK X01633) и интрона1 гена алкогольдегидрогеназы кукурузы (учетный номер в GENBANK X04049). Фрагмент, содержащий 3’UTR картофеля (Solarium tuberosum) StPinII 3’UTR (An et al. (1989) Plant Cell. 1:115-122) использовали для терминации транскрипции генов YFP и PAT, соответственно.
Первый “исходный” вектор, разработанный для получения hpРНК, строили с использованием фрагментов ДНК, несущих смысловую последовательность Caf1-180 v3 (+интрон ST-LS1) (SEQ ID NO: 95) и фрагментов ДНК, несущих антисмысловую последовательность Caf1-180 v3 (SEQ ID NO: 96). Указанные фрагменты синтезировали отдельно с помощью коммерческого производителя (DNA2.0; Menlo Park, CA). Синтетические части соединяли в соответствующей ориентации с помощью стандартных методов клонирования с образованием конструкции, формирующей “шпильку” SEQ ID NO: 97, и конструкцию клонировали между промотором и последовательностью 3’UTR в “исходный” вектор. Продукция первичного транскрипта мРНК запускалась копией промотора 1 убиквитина кукурузы (патент США № 5510474), тогда как последовательность, содержащую 3’ нетранслируемую область гена 5 пероксидазы кукурузы (ZmPer5 3’ UTR v2, патент США № 6699984) использовали для терминации транскрипции фрагмента гена-мишени. Внутримолекулярному образованию шпильки первичными транскриптами РНК способствовало расположение (в пределах одной единицы транскрипции) двух копий фрагмента гена-мишени с противоположной ориентацией по отношению друг к другу, два фрагмента были разделены последовательностью интрона ST-LS1 (Vancanneyt et al. (1990) Mol. Gen. Genet. 220(2):245-50). Таким образом, первичный транскрипт мРНК включает в себя две последовательности фрагмента гена в виде больших инвертированных повторов друг друга, разделенных последовательностью интрона.
Стандартную реакцию рекомбинации GATEWAY® осуществляли с построенным “исходным” вектором для Caf-180 v3 в форме “шпильки” и “адресным” вектором pDAB108916 с применением LR CLONASE II PLUSTM от INVITROGEN. В готовом экспрессионном векторе hpРНК Caf-180 v3 (pDAB109830), кассета экспрессии гена YFP была фланкирована кассетами экспрессии генов hpРНК и PAT.
Аналогично, стандартные методы клонирования GATEWAY® для одного сайта использовали для построения других экспрессионных векторов шпилечной РНК (hpРНК) для WHISKERSTM-опосредованной трансформации клеток кукурузы. Указанные дополнительные векторы включали конструкции hpРНК для VatpaseC v3, VatpaseC v4, VatpaseH v1 и Rho1 v1.
Второй “исходный” вектор, разработанный для получения hpРНК, создавали с использованием синтетических фрагментов, содержащих VatpaseC v3 смысловую (+интрон ST-LS1) последовательность (SEQ ID NO: 98) и VatpaseC v3 антисмысловую последовательность (SEQ ID NO: 99), соединенных в подходящей ориентации (SEQ ID NO: 100) с помощью стандартных методов клонирования. “Исходный” вектор VaptaseC v3 использовали для GATEWAY® клонирования с “адресным” вектором (pDAB108916) при построении экспрессионного вектора pDAB109828 для hpРНК VatpaseC v3.
Третий “исходный” вектор, разработанный для получения hpРНК, создавали с использованием синтетических фрагментов, содержащих VatpaseC v4 смысловую (+интрон ST-LS1) последовательность (SEQ ID NO: 101) и VatpaseC v4 антисмысловую последовательность (SEQ ID NO: 102), соединенных в подходящей ориентации (SEQ ID NO: 103) с помощью стандартных методов клонирования. “Исходный” вектор VatpaseC v4 применяли для GATEWAY® клонирования с “адресным” вектором (pDAB108916) при построении экспрессионного вектора pDAB109838 для hpРНК VatpaseC v4.
Четвертый “исходный” вектор, разработанный для получения hpРНК, создавали с использованием синтетических фрагментов, содержащих VatpaseH v1 смысловую (+интрон ST-LS1) последовательность (SEQ ID NO: 104) и VatpaseH v1 антисмысловую последовательность (SEQ ID NO: 105), соединенные в подходящей ориентации (SEQ ID NO: 106) с помощью стандартных методов клонирования. “Исходный” вектор VatpaseH v1 использовали для клонирования GATEWAY® с “адресным” вектором (pDAB108916) при построении экспрессионного вектора pDAB109829 для hpРНК VatpaseH v1.
Пятый “исходный” вектор, разработанный для получения hpРНК, создавали с использованием синтетических фрагментов, содержащих Rho1 v1 смысловую (+интрон ST-LS1) последовательность (SEQ ID NO: 107) и Rho1 v1 антисмысловую последовательность (SEQ ID NO: I08), соединенные в подходящей ориентации (SEQ ID NO: 109) с помощью стандартных методов клонирования. “Исходный” вектор Rho1 v1 использовали для клонирования GATEWAY® с “адресным” вектором (pDAB108916) при построении экспрессионного вектора pDAB109834 для hpРНК Rho1 v1.
WHISKERSTM-опосредованную трансформацию осуществляли с помощью очищенной кольцевой плазмидной ДНК. Смотрите пример 9.
“Адресный” вектор Agrobacterium. Стандартные методы клонирования GATEWAY® (INVITROGEN) применяли для построения экспрессионных векторов шпилечной РНК (hpРНК) для трансформации зародышей кукурузы. “Исходные” векторы, приготовленные как указано выше, для получения hpРНК для Caf-180 v3, VatpaseC v3, VatpaseH v1 и Rho1 v1 применяли при клонировании GATEWAY® с “адресным” вектором (pDAB108915), сконструированным в виде бинарного вектора из Agrobacterium для трансформации растений. Между левой и правой пограничными повторяющимися последовательностями T-ДНК включала в себя растительный селектируемый маркер/ген устойчивости к гербициду, содержащий кодирующую последовательность белка AAD1 (патент США № 7838733), транскрипция которой контролировалась промотором SCBV, как описано выше. Терминацию транскрипции и полиаденилирование мРНК aad1 определяли с помощью 3’UTR липазы кукурузы, что выявляется главным образом, как указано, в виде оснований 921-1277, учетный номер в GENBANKTM gb¦L35913.1¦MZELIPASE, и в патенте США № 7179902. Результирующие бинарные экспрессионные векторы hpРНК обозначали pDAB109817 (для Caf-180 v3), pDAB109815 (для VatpaseC v3), pDAB109816 (для VatpaseH v1) и pDAB109821 (для Rho1 v1).
При трансформации кукурузы бинарные экспрессионный векторы hpРНК интродуцировали в обезвреженный штамм Agrobacterium tumefaciens DAt13192, как описано в международной заявке PCT № PCT US11/046028, зарегистрированной 29 июля 2011 года.
Пример 5: скрининг кандидатов генов-мишеней
Синтетические дцРНК, предназначенные для ингибирования некоторых, но не всех последовательностей генов-мишеней, идентифицированные в примере 2, вызывали смертность и ингибирование роста при их потреблении WCR в биологических тестах кормления. Наблюдали, что Caf1-180, VatpaseC, VatpaseH и Rho1 демонстрировали значительно более высокую эффективность в данном тесте, по сравнению с другими отобранными дцРНК.
Повторные биологические тесты продемонстрировали, что потребление каждой из конструкций, транскрибированных в дцРНК Caf1-180 (SEQ ID NO: 110), дцРНК области 1 VatpaseC (SEQ ID NO: 111), дцРНК области 1 VatpaseC короткая (SEQ ID NO: 112); дцРНК области 2 VatpaseC (SEQ ID NO: 113), дцРНК области 1 VatpaseH (SEQ ID NO: 114), VatpaseH области 2 (SEQ ID NO: 115) дцРНК и дцРНК Rho1 (SEQ ID NO: 116) приводило к неожиданно устойчивым показателям смертности и ингибирования роста личинок западного корневого жука. В таблицах 3 и 4 показаны результаты биологических тестов кормления для личинок WCR после 9-дневного воздействия указанных дцРНК. На фиг.2-4 показаны графики вариабельности смертности и ингибирования роста жесткокрылых насекомых, обработанных показательными молекулами нуклеиновой кислоты.
|
|
Ранее предполагалось, что определенные гены Diabrotica spp. можно применить для RNAi-опосредованного контроля насекомых. Смотрите патентную публикацию США № 2007/0124836, которая раскрывает 906 последовательностей, и патент США № 7614924, который раскрывает 9112 последовательностей. Однако установлено, что многие гены, которые считались полезными для RNAi-опосредованного контроля насекомых, оказались неэффективными для борьбы с Diabrotica. Также установили, что Caf1-180, VatpaseC, VatpaseH и Rho1 обеспечивают удивительный и неожиданный контроль Diabrotica, по сравнению с другими генами, которые считались полезными для RNAi-опосредованного контроля насекомых.
Аннексин, бета-спектрин 2 и mtRP-L4 предложены в патенте США № 7614924, как оказывающие нужный эффект в RNAi-опосредованном контроле насекомых. SEQ ID NO: 51 представляет собой последовательность ДНК области 1 аннексина, и SEQ ID NO: 52 представляет собой последовательность ДНК области 2 аннексина. SEQ ID NO: 53 представляет собой последовательность ДНК области 1 бета-спектрина 2, и SEQ ID NO: 54 представляет собой последовательность ДНК области 2 бета-спектрина 2. SEQ ID NO: 55 представляет собой последовательность ДНК области 1 mtRP-L4, и SEQ ID NO: 56 представляет собой последовательность ДНК области 2 mtRP-L4. Последовательность YFP (SEQ ID NO: 57) также использовали для получения дцРНК, которую использовали в качестве отрицательного контроля.
Каждую из указанных последовательностей использовали для получения дцРНК с помощью методов примера 4, и каждую дцРНК тестировали с применением биологических тестов кормления, описанных выше. В таблице 5 перечислены последовательности праймеров, используемых для получения молекул дцРНК аннексина, бета-спектрина 2 и mtRP-L4. В таблице 6 представлены результаты биологических тестов кормления личинок WCR после 9-дневного воздействия указанных молекул дцРНК. Повторные биологические тесты продемонстрировали, что потребление указанных дцРНК не приводило к гибели или ингибированию роста личинок западного кукурузного жука выше, чем в контрольных образцах с буфером TE, YFP или с водой.
|
|
Пример 6: Эффекты длины последовательности на эффективность дцРНК VatpaseC
Молекулы дцРНК субъединицы С вакуолярной АТФазы (VatpaseC) длиной в диапазоне от 349 до 500 п.н. являлись активными в биологических тестах кормления против личинок западного кукурузного жука. Смотрите таблицу 3. Чтобы определить зависимость эффективности молекул дцРНК от длины, изменяли длину дцРНК VatpaseC и проводили тестирование. Выбирали последовательности, которые представляли собой 5’-концевые 15, 25, 50 и 100 оснований, и 3’-концевые 100, 50, 25 и 15 оснований сегмента, состоящего из 174 пар оснований кодирующей последовательности VatpaseC (SEQ ID NO: 2).
Фрагменты дцРНК, представляющие собой 15-п.н. и 25-п.н. 5’ и 3’ последовательности VatpaseC, синтезированы коммерческим производителем (INTEGRATED DNA TECHNOLOGIES; Coralville, IA). Смотрите таблицу 7. 5’- и 3’-фрагменты дцРНК длиной 50 п.н. и 100 п.н. и полноразмерный 174 п.н. фрагмент дцРНК создавали из ПЦР-амплифицированных матриц ДНК с применением РНК-полимеразы T7 согласно инструкциям, прилагаемым к набору MEGAscriptTM RNAi (AMBION®, Foster City, CA) с применением праймеров, перечисленных в таблице 8. Комбинации праймеров, используемых для амплификации матриц ДНК различной длины, перечислены в таблице 9.
|
|
|
дцРНК VatpaseC (т.е. VatpaseC5’-15, VatpaseC5’-25, VatpaseC5’-50, VatpaseC5’-100, VatpaseC3’-15, VatpaseC3’-25, VatpaseC3’-50, VatpaseC3’-100 и VatpaseC-174) тестировали в одной дозе (1000 нг/см2) в отношении активности (летальности) с применением биологических тестов кормления личинок западного кукурузного жука. Как показано в таблице 10, активности указанных образцов дцРНК (которые измеряли в виде выраженной в процентах смертности личинок на 9-й день кормления) отличались. Питание, содержащее образцы 15-п.н. и 25-п.н. дцРНК VatpaseC (как 5’, так и 3’), не вызывало существенной смертности личинок, которая представляла собой результат, сходный с отрицательным контролем при использовании дцРНК YFP. Однако, как 5’-, так и 3’-дцРНК VaptaseC длиной 100 п.н., и 5’- и 3’-дцРНК VaptaseC длиной 174 п.н. давали в результате сходные неожиданно высокие показатели смертности личинок. Два образца 50-п.н. дцРНК показали различные результаты в биологических тестах кормления; образец дцРНК VatpaseC5’-50 не вызывал существенной смертности личинок, но показал существенное замедление роста, тогда как образец дцРНК VaptaseC3’-50 вызывал почти 60% смертность, что является почти таким же высоким показателем, как значения, полученные с образцами 100-п.н. и 174-п.н. дцРНК. Смотрите таблицу 10.
Кроме того, активности дцРНК VatpaseC определяли для шести изучаемых доз (1,0, 3,9, 62,5, 250 и 1000 нг/см2) при получении относительных значений LC50 и GI50. Смотрите таблицу 11. Показатель LC50 полученный для образца VatpaseC3’-100 составлял 3,01 нг/см2, что являлось наиболее низким наблюдаемым значением (т.е. самая высокая активность). Особенно следует отметить показатель LC50 9,81 нг/см2, полученный для образца VatpaseC-174. Конструкция, предназначенная для получения шпилечной формы VatpaseC v4 в растениях кукурузы, обнаружила активность. Смотрите пример при тестировании с выращенными в теплице растениями. Смотрите пример 10, таблицу 18. Указанный фрагмент последовательности VaptaseC v4 (166 п.н.) почти идентичен последовательности VatpaseC-174, описанной здесь; последовательность VatpaseC-174, описанная здесь, отличается только отсутствием 8 п.н. (ATGACTGA) на 5’-конце 166 п.н. фрагмента последовательности VaptaseC v4.
|
|
|
Пример 7: эффекты изменения последовательности дцРНК на эффективность дцРНК VatpaseC
Молекулы дцРНК, которые не полностью комплементарны последовательности-мишени (например, обладающие только 95% идентичностью с мРНК-мишенью), эффективны для контроля жесткокрылых насекомых. Некомплементарные основания вводили в смысловую цепь или антисмысловую цепь дцРНК VatpaseC, что приводило к ошибочным спариваниям оснований смысловой и антисмысловой цепей дцРНК (и в результате, к ошибочным спариваниям оснований дцРНК- и мРНК-мишени in vivo). Эффекты на инсектицидную активность неполностью соответствующих дцРНК в отношении личинок западного кукурузного жука измеряли в биологических тестах кормления.
Только одну из двух цепей ДНК, кодирующих дцРНК VatpaseC, видоизменяли за один раз, и один некомплементарный нуклеотид искусственно вводили в каждый сайт мутации. Сайты мутации были произвольно расположены с интервалами в 20 нуклеотидов по всей длине мутированной цепи ДНК, кодирующей дцРНК VatpaseC. Идентичность нуклеотида, выбранного для замены нативного нуклеотида, устанавливали на основании близкорасположенных нуклеотидов по обе стороны от сайта мутации, которые не были комплементарны нуклеотиду на неизмененной цепи, расположенному напротив сайта мутации. В случае, если три или более нуклеотидов являлись одинаковыми в данном положении, для замены нативного нуклеотида выбирали ближайший отличающийся нуклеотид.
Две неполностью комплементарные, в основном гомологичные дцРНК VatpaseC (v4) (т.е. v4.1 и v4.2) разрабатывали, создавали и тестировали в отношении инсектицидной активности. Обе дцРНК включали в себя 166 п.н. последовательности VatpaseC v4, плюс шесть нуклеотидов (GGGAGA) на 5’-конце каждой цепи РНК, которые являются артефактами транскрипции, осуществляемой с помощью промотора T7. Таким образом, общая длина каждой дцРНК составляла 178 п.н.
В основном гомологичную дцРНК VatpaseC v4.1 разрабатывали и создавали с некомплементарными основаниями, интродуцированными в антисмысловую цепь. Такую дцРНК получали с помощью следующих стадий: (1) разрабатывали антисмысловую цепь, которая содержала мутацию, интродуцированную в каждые 20 нуклеотидов; (2) химически синтезировали (IDT) фрагменты ДНК, содержащие измененную последовательность антисмысловой цепи ДНК или нативную последовательность смысловой цепи ДНК (т.е. без мутаций); (3) олигонуклеотиды ДНК, содержащие измененную антисмысловую цепь, и олигонуклеотиды, содержащие смысловую цепь, подвергали отжигу с образованием двухцепочечных молекул; (3) ПЦР-амплификацию с применением праймеров, содержащих 5’-концевые последовательности промотора T7, использовали для включения последовательности промотора T7 в 5’-концы обеих цепей, получая таким образом соответствующие матрицы для синтеза дцРНК; и (4) осуществляли синтез дцРНК с использованием РНК-полимеразы T7 и набора AMBION® MEGAscriptTM RNAi, в соответствии с инструкциями производителя.
В основном гомологичную дцРНК VatpaseC v4.2, характеризующуюся мутациями, интродуцирванными с интервалами 20 оснований в последовательность смысловой цепи (но характиризующуюся нативной последовательностью антисмысловой цепи), получали с помощью соответствующих модификаций приведенных выше способов. Кроме того, дцРНК VatpaseC v4, содержащую нативную последовательность (т.е. характеризующуюся полностью комплементарными смысловой и антисмысловой цепями), конструировали и использовали в качестве контроля при сравнении эффективности в основном гомологичных дцРНК VatpaseC v4.1 и v4.2 в биологических тестах кормления личинок западного кукурузного жука (проводимых с применением ранее описанных выше методов).
Семь доз указанных дцРНК (0,2, 1,0, 3,9, 15,6, 62,5, 250 и 1000 нг/см2) тестировали в биологических тестах кормления у личинок западного кукурузного жука первой возрастной стадии, для получения значений LC50 и GI50. Тесты проводили независимо два раза, и каждый эксперимент осуществляли в двух повторениях.
Показатель LC50, рассчитанный для в основном гомологичной дцРНК VatpaseC v4.1 (несоответствия в антисмысловой цепи) составлял 780,9 нг/см2, что в 7,9 раза выше, чем показатель LC50, полученный для нативной (т.е. неизмененной) дцРНК VatpaseC v4. Смотрите таблицу 12. Результат показывает, что даже антисмысловая цепь дцРНК VatpaseC v4.1, состоящая из 178 оснований и содержащая 8 измененных оснований, существовала достаточная гомология с цепью мРНК-мишени жесткокрылого насекомого, чтобы вызвать летальный эффект после потребления дцРНК. Показатель LC50, рассчитанный для в основном гомологичной дцРНК VatpaseC v4.2 (несоответствия в смысловой цепи) составлял 868,6 нг/см2, указанный показатель сходен со значением, полученным для VatpaseC v4.1, и в 8,8 раза выше, чем показатель, полученный в указанных тестах для дцРНК VatpaseC v4. Результаты показывают, что в основном гомологичные дцРНК, содержащие несоответствия в смысловой цепи дцРНК, сохраняют достаточную гомологию с цепью мРНК-мишени жесткокрылого насекомого, чтобы вызвать летальный эффект после потребления дцРНК. Кроме того, обнаружили, что в указанных биологических тестах кормления дцРНК VatpaseC v4.1 и v4.2 характеризовались значениями GI50, которые были выше, чем значение, рассчитанное для нативной (т.е. неизмененной) дцРНК VatpaseC v4. Смотрите таблицу 12. Таким образом, очевидно, что дцРНК VatpaseC v4.1 и 4.2 способны индуцировать как улучшенное ингибирование роста, так и повышенную смертность после поедания жесткокрылым насекомым.
|
Пример 8: Agrobacterium-опосредованное получение трансгенных тканей кукурузы, содержащих инсектицидные дцРНК в форме “шпильки”
Стерилизация початка и выделение зародыша. Недоразвившиеся зародыши кукурузы получали от растений Zea mays инбредной линии B104, выращенных в теплице и самоопыленных или опыленных растениями-сибсами для получения початков. Початки собирали приблизительно через 9-12 дней после опыления. В день проведения эксперимента поверхность початков стерилизовали путем погружения в 20% раствор натрий гипохлорита (6,15%) и встряхивания в течение 20-30 мин, затем три раза промывали в стерильной воде. После стерилизации незрелые зиготные зародыши (1,5-2,4 мм) асептически иссекали из каждого початка, и случайным образом распределяли по микроцентрифужным пробиркам, содержащим жидкую среду для инокуляции (2,2 мг/л соли MS (Frame et al, 2011, см. выше); витамины модифицированной MS 1× ISU (Frame et al. (2011) "Genetic Transformation Using Maize Immature Zygotic Embryos," в Plant Embryo Culture Methods and Protocols: Methods in Molecular Biology. T. A. Thorpe and E. C. Yeung, (Eds.), SPRINGER SCIENCE AND BUSINESS MEDIA, LLC, pp 327-341); 68,4 мг/л сахарозы; 36 мг/л глюкозы; 115 мг/л L-пролина; 100 мг/л мио-инозита; и 200 мкМ ацетосирингон (приготовленный в ДМСО); при pH 5,4). В данной серии экспериментов зародыши из опыленных початков использовали для каждой трансформации.
Закладка культуры Agrobacterium. Сохраняемые в глицерине исходные культуры штамма Agrobacterium DAt13192, содержащего бинарные векторы трансформации, описанного выше в примере 4, наносили штриховым методом на чашки с минимальной средой AB (Watson et al. (1975) J. Bacteriol. 123:255-64), содержащей подходящие антибиотики, и выращивали при 20°C в течение 3-4 дней. Брали отдельную колонию с каждой чашки, делали посев штриховым методом на чашки со средой YEP (10 мг/л экстракта дрожжей; 10 мг/л пептона; и 5 мг/л NaCl), содержащей подходящие антибиотики, и инкубировали при 20°C в течение 1-2 дней.
Культура Agrobacterium и совместное культивирование. Колонии Agrobacterium брали с чашки со средой YEP, суспендировали в 10 мл среды для инокуляции в 50-мл одноразовой пробирке, и клеточную плотность доводили до значений OD550 (оптическая плотность, измеренная при 550 нм) 0,2-0,4 с использованием спектрофотометра. Культуры Agrobacterium инкубировали на ротационном шейкере при 125 оборотов в минуту (комнатная температура) в то время, как осуществляли диссекцию зародышей. Незрелые зиготные зародыши (ранее выделенные из стерилизованных зерен кукурузы и помещенные в 1 мл среды для инокуляции) однократно отмывали в среде для инокуляции. Суспензию Agrobacterium, 2 мл, добавляли в каждую пробирку с зародышами, и пробирки помещали на шейкерную платформу на 10-15 минут. Зародыши переносили на среду для совместного культивирования (4,33 мг/л соли MS; витамины модифицированной среды MS 1× ISU; 30 мг/л сахарозы; 700 мг/л L-пролина; 3,3 мг/л дикамба (3,6-дихлор-o-анисовая кислота или 3,6-дихлор-2-метоксибензойная кислота) в KOH; 100 мг/л мио-инозитола; 100 мг/л ферментативного гидролизата казеина; 15 мг/л AgNO3; 100 мкМ ацетосирингон в ДМСО; и 3 мг/л GELZANTM (SIGMA-ALDRICH®); при pH 5,8), ориентируя щитком вверх, и инкубировали при 25°C, при 24-часовом освещении с интенсивностью освещения 50 мкЕ·м-2·с-1 в течение 3 дней.
Отбор каллуса и регенерация предполагаемых объектов. После периода совместного культивирования зародыши переносили на среду Resting (4,33 мг/л соли MS; витамины модифицированной MS 1× ISU; 30 мг/л сахарозы; 700 мг/л L-пролина; 3,3 мг/л Дикамба в KOH; 100 мг/л мио-инозитола; 100 мг/л ферментативного гидролизата казеина; 15 мг/л AgNO3; 0,5 мг/л MES моногидрата (2-(N-морфолино)этансульфоновой кислоты; PHYTOTECHNOLOGIES LABORATORIES® Lenexa, KS); 250 мг/л карбенициллина; и 2,3 мг/л GELZANTM; при pH 5,8), и инкубировали при 25°C, при 24-часовом освещении с интенсивностью освещения 50 мкЕ·м-2·с-1 в течение 3 дней.
Зародыши переносили на селективную среду 1 (которая включала в себя среду Resting (как указано выше) и 100 нМ кислоту R-галоксифоп (0,0362 мг/л)), и инкубировали в темноте или при 24-часовом освещении с интенсивностью освещения 50 мкЕ·м-2·сек-1 в течение 7-14 дней при 28°C. Пролиферирующие эмбриогенные каллусы переносили на селективную среду 2 (которая включала в себя среду Resting (как указано выше), 500 нМ кислоты R-галоксифоп (0,1810 мг/л)), и инкубировали при 24-часовом освещении с интенсивностью освещения 50 мкЕ·м-2·с-1 в течение 14-21 дня при 28°C. На данной стадии отбора получали трансгенный каллус для последующей пролиферации и дифференцировки.
Пролиферирующие эмбриогенные каллусы переносили на среду, используемую перед регенерацией растений (4,33 мг/л соли MS; витамины модифицированной MS 1× ISU; 45 мг/л сахарозы; 350 мг/л L-пролина; 100 мг/л мио-инозитола; 50 мг/л ферментативного гидролизата казеина; 1,0 мг/л AgNO3; 0,25 мг/л MES; 0,5 мг/л нафтилуксусной кислоты в NaOH; 2,5 мг/л абсцизиновой кислоты в этаноле; 1 мг/л 6-бензиламинопурина; 250 мг/л карбенициллина; 2,5 мг/л GELZANTM; и 500 нМ кислота R-галоксифоп; при pH 5,8), и культивировали при 24-часовом освещении с интенсивностью освещения 50 мкЕ·м-2·с-1 в течение 7 дней при 28°C.
Эмбриогенные каллусы с почками, похожими на побеги, переносили на среду для регенерации растений I (4,33 мг/л соли MS; витамины модифицированной MS 1× ISU; 60 мг/л сахарозы; 100 мг/л мио-инозитола; 125 мг/л карбенициллина; 3,0 мг/л GELZANTM; и 500 нМ кислота R-галоксифоп; при pH 5,8) и культивировали при 24-часовом освещении с интенсивностью освещения 50 мкЕ·м-2·с-1 в течение 7 дней.
Небольшие ростки с первичными корнями переносили на среду Shoot/Root (4,33 мг/л соли MS; витамины модифицированной MS 1× ISU; 30 мг/л сахарозы; 100 мг/л мио-инозитола; 3,5 мг/л GELZANTM; при pH 5,8) в PHYTATRAYSTM (PHYTOTECHNOLOGIES LABORATORIES®) и инкубировали с циклом дня и ночи 16:8 часов при интенсивности света 140-190 мкЕ·м-2·с-1 в течение 7 дней при 27°C. Предполагаемые трансгенные ростки анализировали в отношении числа трансгенных копий и переносили в почву.
Получение семян. Растения пересаживали в почвозаменяющую среду роста METRO-MIXTM 360 (SUN GRO HORTICULTURE; Bellevue, WA), и закаливали в вегетационном домике. Растения затем пересаживали в грунтовую смесь SUNSHINE CUSTOM BLENDTM 160 и выращивали до цветения в теплице. Для получения семян осуществляли контролируемое опыление.
Биологические тесты с западным кукурузным жуком на растениях, выращенных в теплице, осуществляли по методам, описанным в примере 12. Растения с оценкой корней 0,75 или ниже сразу пересаживали в горшки объемом 5 галлонов для получения семян. Пересаженные растения обрабатывали инсектицидом для предотвращения дальнейшего повреждения личинками и ликвидации насекомых в теплицах. Производили ауткроссинг растений B104 с нетрансгенными растениями B104 (донор пыльцы) для получения семян. Семена, произведенные этими растениями, сохраняли для оценки в T1 и последующих генераций растений.
Штамм Agrobacterium DAt13192, содержащий экспрессируемую растением конструкцию, кодирующую шпилечную дцРНК Caf1-180 v3 (пример 4; конструкция в плазмиде pDAB109817) использовали для получения трансгенных растений кукурузы B104. Биологические тесты с западным кукурузным жуком на указанных выращенных в теплице трансгенных растениях, осуществляли с помощью методов, описанных в примере 12. Растения, трансформированные сходной плазмидой (pDAB101556), которая содержала ген для продукции YFP, но не содержала ген для продукции дцРНК, использовали в качестве отрицательных контролей. Результаты биологических тестов представлены в таблице 13.
|
Штамм Agrobacterium DAt13192, содержащий экспрессируемую растением конструкцию, кодирующую шпилечную дцРНК VatpaseC v3 (пример 4; конструкция в плазмиде pDAB109815) использовали для получения трансгенных растений кукурузы B104. Биологические тесты с западным кукурузным жуком на указанных выращенных в теплице трансгенных растениях, осуществляли с помощью методов, описанных в примере 12. Растения, трансформированные сходной плазмидой (pDAB101556), которая содержала ген для продукции YFP, но не содержала ген для продукции дцРНК, использовали в качестве отрицательных контролей. Результаты биологических тестов представлены в таблице 14.
|
Штамм Agrobacterium DAt13192, содержащий экспрессируемую растением конструкцию, кодирующую шпилечную дцРНК VatpaseH v1 (пример 4; конструкция в плазмиде pDAB109816) использовали для получения трансгенных растений кукурузы B104. Биологические тесты с западным кукурузным жуком на указанных выращенных в теплице трансгенных растениях, осуществляли с помощью методов, описанных в примере 12. Растения, трансформированные сходной плазмидой (pDAB101556), которая содержала ген для продукции YFP, но не содержала ген для продукции дцРНК, использовали в качестве отрицательных контролей. Результаты биологических тестов представлены в таблице 15.
|
Пример 9: WHISKERS-опосредованное получение тканей трансгенной кукурузы, содержащих инсектицидные дцРНК Caf1-180 v3 в форме “шпильки”
Получали растения, которые производят одну или более инсектицидных молекул дцРНК (например, по меньшей мере одна молекула дцРНК, включая молекулу дцРНК, воздействующую на ген, содержащий одну из SEQ ID NO: 1-4) в результате экспрессии химерного гена, стабильно интегрированного в геном. Молекулы ДНК для трансформации растений получали, как описано в примере 4, и доставляли в клетки кукурузы в суспензии клеточной культуры Hi-II с помощью WHISKERS-опосредованной трансформации (главным образом, как описано в патентах США № 5302523 и № 5464765; в патентной публикации США № 2008/0182332; и в публикации Petolino and Arnold (2009) M. Paul Scott (ed.) Methods in Molecular Biology: Transgenic Maize. Vol. 526, Humana Press, NY, pp 59-67).
Трансформация растительных клеток и отбор. Все процедуры WHISKERS-опосредованной трансформации выполняли с использованием стандартных асептических методик, и в целом следовали методам, описанным у Petolino and Arnold (2009), как указано выше. Суспензии эмбриогенных клеток Zea mays Hi-II (Armstrong et al. (1991) Maize Genet. Coop. Newslett. 65:92-3) пересевали путем переноса 30 мл осевшей суспензии клеток, плюс 70 мл кондиционированной среды (т.е. среды, в которой выращивали клетки) в 200 мл свежей среды H9CP (4,33 мг/л соли MS Basal (PHITOTECHNOLOGIES LABORATORIES, по каталогу № M524); 30,0 мг/л сахарозы; 100,0 мг/л мио-инозитола; 200 мг/л ферментативного гидролизата казеина; 2,0 мг/л 2,4-дихлорфеноксиуксусной кислоты; 2,0 мг/л нафталенуксусной кислоты; 691 мг/л L-пролина; 2,0 мг/л глицина; 0,5 мг/л тиамина HCl; 0,5 мг/л пиридоксина HCl; 0,05 мг/л никотиновой кислоты; при pH 6,0), содержащей 5% кокосового молока (SIGMA ALDRICH, St. Louis, MO; по каталогу № C5915) в 175-мл одноразовой центрифужной пробирке с коническим дном NALGENETM (THERMO FISHER SCIENTIFIC; по каталогу № 3145-0175). Разведенные клетки затем инкубировали в стерильной одноразовой колбе для клеточных культур объемом 1 л в темноте при 28°C на гиророторном шейкере с радиусом вращения 1 дюйм (2,54 см) при 120 оборотах в минуту, и клетки пересевали каждые 3,5 дня, как описано выше.
На следующий день после пересевания и за 18-24 часа до проведения процедуры трансфекции 50 мл среды H9CP, содержащей 30 мл осевших клеток, добавляли к 150 мл свежей среды GN6 (3,99 мг/л основных солей среды Chu N6 с витаминами (PHITOTECHNOLOGIES LABORATORIES, по каталогу № C167); 30 мг/л сахарозы; 100 мг/л мио-инозитола; 2 мг/л 2,4-дихлорфеноксиуксусной кислоты; при pH 6,0) в стерильной 1-л колбе, и культуру инкубировали на гиророторном шейкере, как описано выше.
После 18-24 часов инкубации в среде GN6, всю клеточную суспензию переносили в стерильную 175-мл одноразовую центрифужную пробирку с коническим дном и давали клеткам осесть в течение 1-3 мин, получая в результате клеточный объем приблизительно 40 мл. Отработанную среду осторожно сливали с осадка и остаточную жидкость удаляли пипеткой для получения сырой клеточной массы. Клетки ресуспендировали приблизительно в 180 мл среды с высокой осмотичностью (GN6-SM; среда GN6, дополненная 45 мг/л сорбита и 45 мг/л маннита) в центрифужной пробирке, и культуру помещали на настольный встряхиватель-качалку при комнатной температуре (23-25°C) приблизительно на 30 минут, но не более чем на 45 минут. После 30 минут осмотической обработки клеткам давали осесть в центрифужной пробирке в течение 3-5 минут. Затем жидкость осторожно удаляли до отметки 50 мл на центрифужной пробирке с помощью пипетки, с предосторожностью, чтобы не повредить клетки.
Для доставки плазмидной ДНК в клетки кукурузы в суспензии культуры, 5 мл 5% масс/масс суспензии карбидно-кремниевых нитевидных кристаллов BIOGRADETM SC-9 (ADVANCED COMPOSITE MATERIALS, Greer, SC; lot 981011-101) готовили путем добавления соответствующего количества среды GN6-SM к стерилизованным (автоклавированным) сухим нитевидным кристаллам. Соответствующее количество ДНК pDAB109830 (пример 4) добавляли в центрифужную пробирку (обычно 80 мкг/50 мл суспензии с 40 мл клеток), плотно закрывали крышку и пробирку слегка взбалтывали, чтобы перемешать содержимое. Центрифужную пробирку надежно закрепляли в коммерческом смесителе для краски (RED DEVILTM Model 5400; Minneapolis, MN), модифицированном для надежного закрепления пробирки, и перемешивали в течение 10-20 секунд. После разведения для уменьшения осмолярности среды приблизительно 150 мл свежей среды (GN6-SM:GN6; 2:1 об/об) до конечного объема приблизительно 200 мл, клетки инкубировали на настольном встряхивателе-качалке при комнатной температуре в течение приблизительно 1 часа.
Трансфицированные клетки затем переносили пипеткой в аликвотах приблизительно 8,3 мл на стерильную 70-мм фильтровальную бумагу #4 WHATMANTM (THERMO FISHER SCIENTIFIC), стараясь равномерно распределить клетки на фильтровальной бумаге. Фильтры помещали на агаровую среду GN6 в пластмассовых чашках 100×20 мм и затем инкубировали в пластмассовых ящиках в темноте при 28°C в течение 7 дней.
Через одну неделю после трансформации фильтровальную бумагу с прикрепленными к ней клетками переносили на свежие чашки с твердой агаровой средой GN6-1H (среда GN6, дополненная 2,5 мг/л GELZANTM), содержащей 1,0 мг/л BIALAPHOS в чашках 100×20 мм, и инкубировали в темноте при 28°C. BIALAPHOS предоставлялся в виде HERBIACE® (20% ai) (MEIJI SEIKA KAISHA LTD.; Tokyo, JP).
Через одну неделю клетки внедряли в мягкий агар путем соскабливания клеточного содержимого с каждой фильтровальной бумаги в 50-мл стерильную одноразовую центрифужную пробирку, содержащую 15 мл мягкой агарозной среды GN6 (среда GN6 с 7,0 мг/л агарозы SEAPLAQUETM; LONZA, Rockland, ME) при 37-40°C, осторожного перемешивания закрытой пробирки, и последующего выливания содержимого пробирки равномерно на четыре пластмассовые чашки 100×25 мм, содержащие твердую агаровую среду GN61H. Каждую чашку встряхивали, чтобы покрыть поверхность ровным слоем клеточной суспензии, и после застывания среды чашки инкубировали при 28°C в темноте.
После 6-10 недель инкубации, хорошо растущие выступающие на поверхности колонии переносили на свежие чашки, содержащие агаровую среду GN61H. Указанные кандидатные трансформированные колонии выращивали в течение 2-4 недель на селективной среде, чтобы определить стабильные объекты, обладающие массой 50-200 мг ткани, которые затем подвергали молекулярному анализу.
Образцы 0,1-мл осажденных каллусных клеток, полученных из кандидатных объектов, разделяли на образцы и помещали в 1,2-мл полипропиленовые кассетные пробирки COSTARTM (CORNING, INC.; Corning NY) и замораживали при -80°C.
Молекулярные анализы. Каллусные клеточные объекты анализировали в отношении относительной экспрессии полноразмерного транскрипта с помощью количественной ПЦР в режиме реального времени Per 5 3’UTR, и оценивали число копий путем сравнения с геном кукурузы, являющимся эндогенным внутренним контролем (TIP41-подобный белок). РНК выделяли с применением набора RNeasyTM 96 (QIAGEN, Valencia, CA). После первой отмывки (RW 1) колонки обрабатывали ДНКазой без примеси РНКаз QIAGEN в буфере "RDD" (согласно предлагаемому в инструкции к набору дополнительному протоколу). Первую цепь кДНК получали с помощью HIGH CAPACITY cDNA SYNTHESIS KIT (INVITROGEN) в 10 мкл реакционного объема с 5 мкл денатурированной РНК, главным образом, в соответствии с рекомендованным производителем протоколом. Протокол незначительно модифицировали, чтобы включить добавление 10 мкл 100 мкМ олигонуклеотида T20VN (IDT) в 1-мл пробирку стоковой смеси случайных праймеров, для приготовления рабочего запаса комбинированных случайных праймеров и олиго dT.
После синтеза кДНК образцы разводили 1:3 безнуклеазной водой и хранили при -20°C до проведения исследований. ПЦР в реальном времени осуществляли на LIGHTCYCLERTM 480 (ROCHE DIAGNOSTICS, Indianapolis, IN) в 10 мкл реакционного объема. Все тесты включали в себя отрицательные контроли без матрицы (только смесь). Для построения стандартных кривых бланковую пробу (вода в начальной лунке) также включали в начальный планшет, чтобы проверить образцы на перекрестную контаминацию. Реакции проводили с ROCHE UNIVERSAL PROBETM в количестве 0,5 мкМ и праймерами для целевого и референсного генов в количестве 10 мкМ. Последовательности праймеров указаны в таблице 16. Реакцию ПЦР проводили при следующих условиях: (1) активация последовательности-мишени при 95°C в течение 10 мин; (2) 43 цикла (денатурации при 95°C в течение 10 секунд и удлинение цепи при 60°C); (3) получение при 72°C в течение 1 секунды; и (4) охлаждение при 40°C в течение 10 секунд.
|
Анализ данных. Данные анализировали с применением программного обеспечения LIGHTCYCLERTM Software v1.5 с помощью относительной количественной оценки с применением алгоритма максимального значения второй производной для расчета значений Cq согласно рекомендациям поставщика. В отношении анализов экспрессии, показатели экспрессии рассчитывали с применением метода ΔCt (т.е. 2-(Cq TARGET-Cq REF)), который основан на сравнении различий значений Cq двух мишеней, с базовым значением 2, которое выбирают при допущении, что в случае оптимизированных реакций ПЦР удвоение продукта происходит в каждом цикле.
Регенерация трансгенного растения. Проводили регенерацию некоторых стабильно трансформированных объектов в растения для осуществления биологических тестов с насекомыми в полевых условиях.
После проведения процесса селекции каллусные культуры переносили на среду 28, применяемую перед регенерацией, (4,33 мг/л базовой среды MS с витаминами; 30,0 мг/л сахарозы; 5 мг/л 6-бензиламинопурина; 25 мкг/л 2,4-дихлорфеноксиуксусной кислоты; 2,5 мг/л GELZANTM; и 1,0 мг/л BIALAPHOS). Пересаженные каллусные культуры инкубировали в течение 7 дней при 28°C при непрерывном белом флуоресцентном свете (приблизительно 50 мкЕ·м-2·с-1).
Для регенерации культуры переносили на среду для регенерации 36 (4,33 мг/л базовой среды MS с витаминами; 30 мг/л сахарозы; 2,5 мг/л GELZANTM; и 1,0 мг/л BIALAPHOS), и ростки оставляли для формирования и роста при 28°C в непрерывном белом флуоресцентном свете вплоть до 3 недель. Когда ростки достигали подходящей фазы роста, их разрезали с помощью щипцов и скальпеля, переносили в пробирку размером 20×100 мм, содержащую агар, и помещали на свет на 2 дня.
Трансгенным растениям присваивали уникальные идентификаторы и переносили в помещение с регулируемыми условиями окружающей среды (приблизительно 28°C дневная температура; 24°C ночная температура; с периодом дополнительной освещенности 16:8). Трансгенные растения переносили из пробирок в горшочки размером 3,5 дюйма (приблизительно 9 см), и возвращали в помещение с регулируемыми условиями окружающей среды на 1-2 недели, чтобы помочь растениям акклиматизироваться. Трансгенные растения затем помещали в теплицу, и пересаживали из небольших горшочков в специальные контейнеры ROOTRAINERSTM (style TINUSTM) 350-4; SPENCER-LEMAIRE INDUSTRIES; Acheson, Alberta, Canada), по одному растению на объект на один контейнер ROOTRAINERTM, для проведения биологических тестов кормления насекомых. Приблизительно через четыре дня после пересадки растений в ROOTRAINERSTM растения T0 можно было использовать в биологических тестах кормления насекомых. Биологические тесты кормления насекомых осуществляли с помощью методов, описанных в примере 12.
Присутствие и экспрессия трансгена, продуцирующего шпилечную дцРНК, приводит к уменьшению подрезания корней WCR, что проявлялось у тех растений, которые демонстрировали высокие уровни экспрессии транскрипта дцРНК (которые измеряли путем относительной количественной оценки результатов ПЦР Per5 3’UTR). Результаты биологических тестов с западным кукурузным жуком, проведенные на тех объектах, которые включали в себя шпильку RNAi, содержащую SEQ ID NO: 97, и которые имели относительный уровень экспрессии в 16 раз выше, чем собственный TIP41-подобный референсный ген, представлены в таблице 17. Полученные данные свидетельствуют об удивительном результате, что 36% трансгенных RNAi растений продемонстрировали снижение повреждения WCR, по сравнению только с 3% среди тестируемых нетрансгенных контрольных растений. Хотя биологический ответ варьирует среди трансгенных растений кукурузы T0, трансгенные растения показали существенное снижение подрезки корней WCR, по сравнению с нетрансгенными контрольными растениями.
|
Пример 10: WHISKERS-опосредованное получение тканей трансгенной кукурузы, содержащих инсектицидные дцРНК VatpaseC v3 и VatpaseC v4 в форме “шпильки”
Методы трансформации, описанные в примере 9, использовали для получения трансгенных растений кукурузы Hi-II, экспрессирующих дцРНК VatpaseC v3 или дцРНК VatpaseC v4 в форме “шпильки”, путем трансформации плазмидами pDAB109828 и pDAB109838 (пример 4). Молекулярный скрининг осуществляли по методам скрининга, описанным в примере 9, и биологические тесты с западным кукурузным жуком проводили согласно методам биологических тестов, описанным в примере 12.
Присутствие и экспрессия трансгена, продуцирующего шпилечную дцРНК, приводит к уменьшению подрезания корней WCR, что проявлялось у тех растений, которые демонстрировали высокие уровни экспрессии транскрипта дцРНК (которые измеряли путем относительной количественной оценки результатов ПЦР Per5 3’UTR). Результаты биологических тестов с западным кукурузным жуком, проведенные на тех объектах, которые включали в себя RNAi “шпильку”, содержащую SEQ ID NO: 100 (VatpaseC v3) или SEQ ID NO: 103 (VatpaseC v4), и которые имели относительный уровень экспрессии в 20 раз выше, чем собственный TIP41-подобный референсный ген, представлены в таблице 18. Полученные данные свидетельствуют об удивительном результате, что 43% трансгенных RNAi растений продемонстрировали снижение повреждения WCR, по сравнению с 0% среди тестируемых нетрансгенных контрольных растений. Хотя биологический ответ варьирует среди трансгенных растений кукурузы T0, только у трансгенных растений наблюдали существенное снижение подрезания корней WCR.
|
Пример 11: WHISKERS-опосредованное получение тканей трансгенной кукурузы, содержащих инсектицидные дцРНК VatpaseH v1 в форме “шпильки”
Методы трансформации, описанные в примере 9, использовали для получения трансгенных растений кукурузы Hi-II, экспрессирующих шпилечные дцРНК VatpaseH v1, при трансформации с помощью плазмиды pDAB109829 (пример 4). Молекулярный скрининг осуществляли по методам скрининга, описанными в примере 9, и биологические тесты с западным кукурузным жуком проводили согласно методам биологических тестов, описанным в примере 12.
Присутствие и экспрессия трансгена, продуцирующего шпилечную дцРНК, приводит к уменьшению подрезания корней WCR, что проявлялось у тех растений, которые демонстрировали высокие уровни экспрессии транскрипта дцРНК (которые измеряли путем относительной количественной оценки результатов ПЦР Per5 3’UTR). Результаты биологических тестов с западным кукурузным жуком, проведенные на тех объектах, которые включали в себя RNAi шпильку, содержащую SEQ ID NO: 106, и которые имели относительный уровень экспрессии в 18 раз выше, чем собственный TIP41-подобный референсный ген, представлены в таблице 19. Полученные данные свидетельствуют об удивительном результате, что 60% трансгенных RNAi растений продемонстрировали снижение повреждения WCR, по сравнению с 0% среди тестируемых нетрансгенных контрольных растений. Хотя биологический ответ варьирует среди трансгенных растений кукурузы T0, трансгенные растения показали существенное снижение подрезки корней WCR, по сравнению с нетрансгенными контрольными растениями.
|
Пример 12: Биологический тест с насекомыми трансгенной кукурузы
Яйца западного кукурузного жука (WCR, Diabrotica virgifera virgifera LeConte) получали в почве от Crop Characteristics (Farmington, MN). Яйца инкубировали при 28°C в течение 10-11 дней. Яйца отмывали от почвы, помещали в 0,15% раствор агара, и доводили концентрацию приблизительно до 75-100 яиц на аликвоту объемом 0,25 мл. Планшет для вылупления готовили в чашке Петри с аликвотой суспензии яиц для мониторинга скорости вылупления.
Почву вокруг растений кукурузы заражали 150-200 яйцами WCR. Насекомым позволяли кормиться в течение 2 недель, затем применяли к каждому растению метод балльной оценки корней "Root Rating". Шкалу повреждений узлов использовали для классификации. Oleson et al. (2005) J. Econ. Entomol. 98(1):1-8.
Растения с оценкой корней 0,75 или ниже пересаживали в горшки объемом 5 галлонов для получения семян. Пересаженные растения обрабатывали инсектицидом для предотвращения дальнейшего повреждения личинками и ликвидации насекомых в теплицах. Производили ауткроссинг растений Hi-II с инбредной линией кукурузы 5XH751 (донор пыльцы) для получения семян. Семена, произведенные этими растениями, сохраняли для оценки растений T1 и последующих генераций растений.
Пример 13: трансгенные растения Zea mays, содержащие последовательности жесткокрылого насекомого
От 10 до 20 трансгенных растений T0 Zea mays получали, как описано в примерах 8 и 9. Другие 10-20 растений T1 несвязанных линий Zea mays, экспрессирующие шпилечную дцРНК для конструкции RNAi в порядке, предусмотренном в SEQ ID NO: 1-4, получали для проверочного заражения злаковыми корневыми червями. Их наличие подтверждали с помощью ОТ-ПЦР. Общую РНК из выбранных растений T1 несвязанных линий необязательно использовали для ОТ-ПЦР с праймерами, разработанными для связывания в интроне кассеты “шпильки” в каждой из конструкций RNAi. Кроме того, специфические праймеры для каждого целевого гена в RNAi-конструкции необязательно использовали для амплификации и подтверждения продукции предварительно процессированной мРНК, необходимой для продукции миРНК у растений. Амплификация с получением при электрофорезе желаемых полос, соответствующих каждому целевому гену, подтверждает экспрессию шпилечной РНК в каждом трансгенном растении Zea mays. Затем процессинг шпилечной дцРНК целевых генов в миРНК необязательно подтверждали в несвязанных трансгенных линиях с применением блот-гибридизации РНК.
Фенотипическое сравнение растений Zea mays трансгенных RNAi линий и дикого типа
Целевые гены или последовательности жесткокрылого насекомого, выбранные для создания шпилечной дцРНК, не обладают сходством с каким-либо известным геном или последовательностью растения. Поэтому предполагается, что продукция или активация (системной) RNAi конструкциями, воздействующими на указанные гены или последовательности, не будет оказывать какое-либо отрицательное воздействие на трансгенные растения. Однако развитие и морфологические характеристики растений трансгенных линий сравнивали с растениями дикого типа, а также с трансгенными линиями, трансформированными пустым вектором шпилечной дцРНК. Сравнивали характеристики корней, побегов, листьев растений и их репродукционные характеристики. Не обнаруживали видимых различий в длине корней и формах роста трансгенных растений и растений дикого типа. Характеристики ростков растений, такие как высота, число листьев и размеры, время цветения, размеры и внешний вид цветков были сходными. В целом, не обнаружили видимых морфологических различий между трансгенными линиями и линиями, не экспрессирующими целевые молекулы iRNA при культивировании in vitro и в почве в теплице.
Пример 14: трансгенные растения Zea mays, содержащие последовательность жесткокрылого насекомого и дополнительные конструкции RNAi
Трансгенное растение Zea mays, содержащее в своем геноме гетерологичную кодирующую последовательность, которая транскрибируется в молекулу iRNA, которая воздействует на организм, отличающийся от жесткокрылого насекомого, трансформируют с помощью Agrobacterium- или WHISKERSTM-опосредованной трансформации для получения одной или более инсектицидных молекул дцРНК (например, по меньшей мере одна молекула дцРНК, включая молекулу дцРНК, воздействующую на ген, содержащий одну из SEQ ID NO: 1-4). Препараты молекул ДНК для трансформации растений, полученные, главным образом, как описано в примере 4, доставляют в суспензии культур клеток кукурузы Hi-II, полученных из трансгенного растения Zea mays, содержащего гетерологичную кодирующую последовательность в своем геноме, которая транскрибируется в молекулу iRNA, которая воздействует на другой организм, чем жесткокрылое насекомое.
Пример 15: трансгенные растения, устойчивые к жесткокрылым насекомым
В полевых условиях продукция дцРНК, миРНК или микроРНК, соответствующих целевым генам, и последующее потребление жесткокрылыми насекомыми путем поедания приводит к отрицательной регуляции целевых генов путем РНК-опосредованного сайленсинга генов. Если функция целевого гена является важной, то нарушается рост, развитие и репродукция жесткокрылого насекомого, что в случае по меньшей мере одного из WCR, NCR, SCR, MCR, D. balteata LeConte, D. u. tenella,и D. u. undecimpunctata Mannerheim приводит к неспособности успешно паразитировать, питаться, развиваться и/или репродуцироваться или вызывает гибель жесткокрылого насекомого на одной или более стадиях развития. Выбор целевых генов и успешное применение RNAi, таким образом, используется для контроля жесткокрылых насекомых. От пяти до десяти повторов 10-20 независимых трансгенных линий T1 Z.mays для каждой конструкции RNAi испытывают с видами злаковых корневых червей. Испытания проводят в дупликатах для каждого вида злаковых корневых червей. Проращивают семена T1 линий растений, содержащих RNAi, и устойчивые растения переносят в модифицированную среду Кнопа через 10-15 дней после прорастания. Контрольные семена растений дикого типа Z. mays проращивают в то же время и используют для заражения злаковыми корневыми червями.
Значительно больше (>50%) злаковых корневых червей выжило на растениях контрольной группы, чем растениях трансгенных линий Z. mays, содержащих одну или более конструкций RNAi. Содержание iRNA измеряют у злаковых корневых червей, питающихся корнями растений дикого типа и трансгенных растений с применением количественной ПЦР в режиме реального времени. Значительно больше молекул iRNA обнаружили в растениях трансгенных линий Z. mays, содержащих одну или более конструкций RNAi, чем в контрольных растениях. Указанные результаты показывают, что трансгенные линии производят миРНК, соответствующие генам-мишеням, и что указанные миРНК доступны для потребления при питании злаковыми корневыми червями. Более того, результаты показывают, что RNAi-опосредованное ингибирование всех целевых генов воздействует на рост, развитие и жизнеспособность намеченного злакового корневого червя. Кроме того, молекулы RNAi с последовательностями, содержащими несоответствия, характеризующиеся более чем 80% идентичности последовательности с целевыми генами, воздействуют на злаковых корневых червей аналогичным образом с последовательностями дикого типа. Спаривание последователььности, содержащей несоответствия, с нативными последовательностями с образованием шпилечной дцРНК в той же самой конструкции RNAi обеспечивает производимую растением миРНК, способную воздействовать на рост, развитие и жизнеспособность питающихся ими жесткокрылых насекомых.