Результат интеллектуальной деятельности: КАПСУЛЬНЫЙ СОСТАВ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к капсульному составу. В частности, настоящее изобретение относится к капсульному составу, содержащему фосфонооксиметильное производное равуконазола.
Предшествующий уровень техники
В качестве лекарственной формы для перорально вводимых лекарственных препаратов широко применяют капсульный состав, содержащий оболочку капсулы и материал, инкапсулированный в капсулу (инкапсулированный материал). Наиболее часто применяемой основой оболочки капсулы для образования оболочки капсулы является желатин. Однако состав, полученный с оболочкой капсулы, содержащей желатин в качестве основы оболочки капсулы (желатиновая оболочка капсулы), может вызывать задержку растворения лекарственного средства из оболочки капсулы, поскольку инкапсулированный материал может взаимодействовать с желатином при хранении.
Перорально вводимые лекарственные препараты проглатываются, и затем обеспечивается возможность растворения лекарственного средства из состава, и лекарственное средство затем всасывается через желудочно-кишечный тракт с проявлением фармакологических эффектов. Следовательно, состав, который характеризуется замедленным растворением в результате хранения, как правило, демонстрирует сниженное всасывание лекарственного средства через желудочно-кишечный тракт и не обеспечивает надлежащие фармакологические эффекты.
В качестве соединения, которое, как правило, взаимодействует с желатином, известны соединение с карбонильной группой или альдегидной группой, восстанавливающие сахара и соединение, из которого при хранении образуется альдегид. Их конкретные примеры включают лактозу и полиэтиленгликоль (макрогол).
Однако растворение не всегда может быть замедлено до такой степени, чтобы это влияло на фармакологические эффекты лекарственных препаратов, даже если соединение, взаимодействующее с желатином, инкапсулировано в желатиновую оболочку капсулы. Например, широко распространены лекарственные препараты, которые содержат гранулы, содержащие лактозу или полиэтиленгликоль, инкапсулированные в желатиновую оболочку капсулы. Кроме того, также коммерчески доступна желатиновая оболочка капсулы, содержащая полиэтиленгликоль в оболочке капсулы per se, и причем лекарственные препараты, в которых используют такую оболочку капсулы, также распространены в Японии.
Таким образом, трудно предсказать будет или нет лекарственный препарат, содержащий лекарственное средство, инкапсулированное в желатиновую оболочку капсулы, вызывать задержку растворения до такой степени, чтобы это влияло на фармакологические эффекты.
Равуконазол представляет собой триазольное соединение, обладающее противогрибковым действием, и имеет низкую растворимость в воде. В патентном документе 1 раскрыто фосфонооксиметильное производное равуконазола, которое является пролекарством равуконазола, имеющее улучшенную растворимость. В патентном документе 2 раскрыт состав, содержащий фосфонооксиметильное производное равуконазола. Однако в патентном документе 2 не раскрыт характер растворения фосфонооксиметильного производного равуконазола из состава или задержка растворения в результате хранения и не раскрыта основа оболочки капсулы.
Документы известного уровня техники
Патентный документ
Патентный документ 1: перевод на японский язык РСТ заявки №2003-520235.
Патентный документ 2: WO 2007/097386.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задачи, решаемые с помощью настоящего изобретения
Авторы настоящего изобретения обнаружили, что при инкапсулировании фосфонооксиметильного производного равуконазола в желатиновую оболочку капсулы растворение фосфонооксиметильного производного равуконазола из оболочки капсулы в значительной степени замедляется после хранения. Целью настоящего изобретения является получение капсульного состава, содержащего фосфонооксиметильное производное равуконазола, который обеспечивает уменьшение задержки растворения в результате хранения независимо от инкапсулированного количества фосфонооксиметильного производного равуконазола.
Средства для решения задачи
Настоящее изобретение относится к капсульному составу, в котором оболочку капсулы, не содержащую желатин, используют в качестве оболочки капсулы для инкапсулирования фосфонооксиметильного производного равуконазола.
Настоящее изобретение охватывает следующее.
[1] Капсульный состав, содержащий
инкапсулированный материал, содержащий
{[(1R,2R)-2-[4-(4-цианофенил)-1,3-тиазол-2-ил]-1-(2,4-дифторфенил)-1-(1Н-1,2,4-триазол-1-илметил)пропил]окси}метилдигидрофосфат (далее в данном документе периодически называемый "соединение 1"), или его фармакологически приемлемую соль, или сольват любого из вышеупомянутого (в данном описании обобщенно и периодически называемые "фосфонооксиметильное производное равуконазола"), и
оболочку капсулы, не содержащую желатин;
[2] капсульный состав по вышеизложенному параграфу [1], где оболочка капсулы образована основой оболочки капсулы, содержащей крахмал, пуллулан, поливиниловый спирт или гипромеллозу;
[3] капсульный состав по вышеизложенному параграфу [1], где оболочка капсулы образована основой оболочки капсулы, содержащей пуллулан или гипромеллозу;
[4] капсульный состав по вышеизложенному параграфу [1], где оболочка капсулы образована основой оболочки капсулы, содержащей гипромеллозу;
[5] капсульный состав по любому из вышеизложенных параграфов [1]-[4], где фосфонооксиметильное производное равуконазола представляет собой L-лизин-{[(1R,2R)-2-[4-(4-цианофенил)-1,3-тиазол-2-ил]-1-(2,4-дифторфенил)-1-(1Н-1,2,4-триазол-1-илметил)пропил]окси}метилдигидрофосфат-этанол (1/1/1) (далее в данном документе периодически называемый "соединение 2");
[6] капсульный состав по любому из вышеизложенных параграфов [1]-[5], где инкапсулированный материал дополнительно содержит оксид магния;
[7] капсульный состав по любому из вышеизложенных параграфов [1]-[6], где массовое соотношение фосфонооксиметильного производного равуконазола в пересчете на массу соединения 2 к оболочке капсулы составляет 0,27 или более;
[8] капсульный состав по любому из вышеизложенных параграфов [1]-[6], где массовое соотношение фосфонооксиметильного производного равуконазола в пересчете на массу соединения 2 к оболочке капсулы составляет от 0,27 до 10;
[9] капсульный состав по вышеизложенному параграфу [7] или [8], где содержание фосфонооксиметильного производного равуконазола в пересчете на массу соединения 2 на оболочку капсулы составляет 17 мг или более;
[10] капсульный состав по любому из вышеизложенных параграфов [1]-[9], где средняя степень растворения фосфонооксиметильного производного равуконазола через 60 минут после начала испытания на растворимость согласно Японской фармакопее, 16-е издание, составляет 60% или более после хранения состава в незапечатанном состоянии при условиях 40°C и 75% относительной влажности в течение 1 месяца; и
[11] капсульный состав по любому из вышеизложенных параграфов [1]-[9], где средняя степень растворения фосфонооксиметильного производного равуконазола через 60 минут после начала испытания на растворимость согласно Японской фармакопее, 16-е издание, составляет 85% или более после хранения состава в незапечатанном состоянии при условиях 40°C и 75% относительной влажности в течение 1 месяца.
Полезный эффект
Согласно настоящему изобретению можно получить капсульный состав, который может обеспечивать уменьшение задержки растворения фосфонооксиметильного производного равуконазола, которая может иметь место при хранении, независимо от инкапсулированного количества фосфонооксиметильного производного равуконазола.
Краткое описание графических материалов
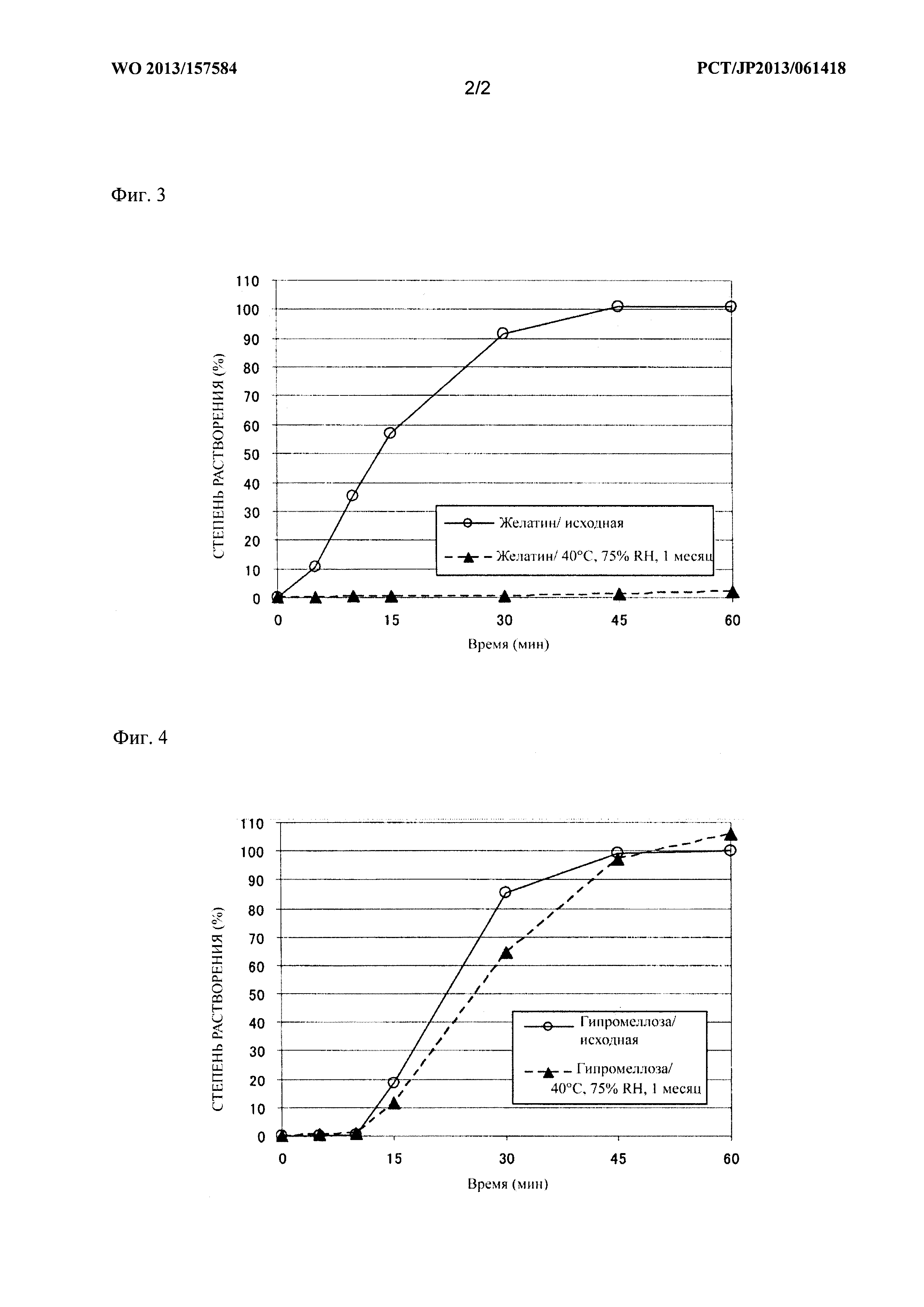
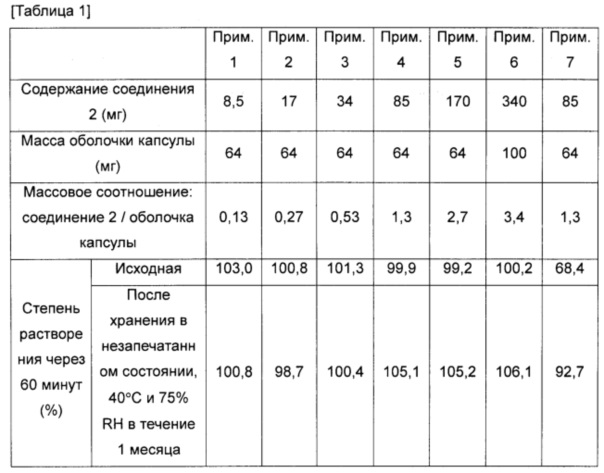
Фиг. 1 представляет собой график, на котором сравнивают зависимость между содержанием лекарственного средства и средней степенью растворения через 60 минут после начала испытания (степень растворения через 60 минут) у образцов до хранения, что также описано в таблице 1 тестового примера 1;
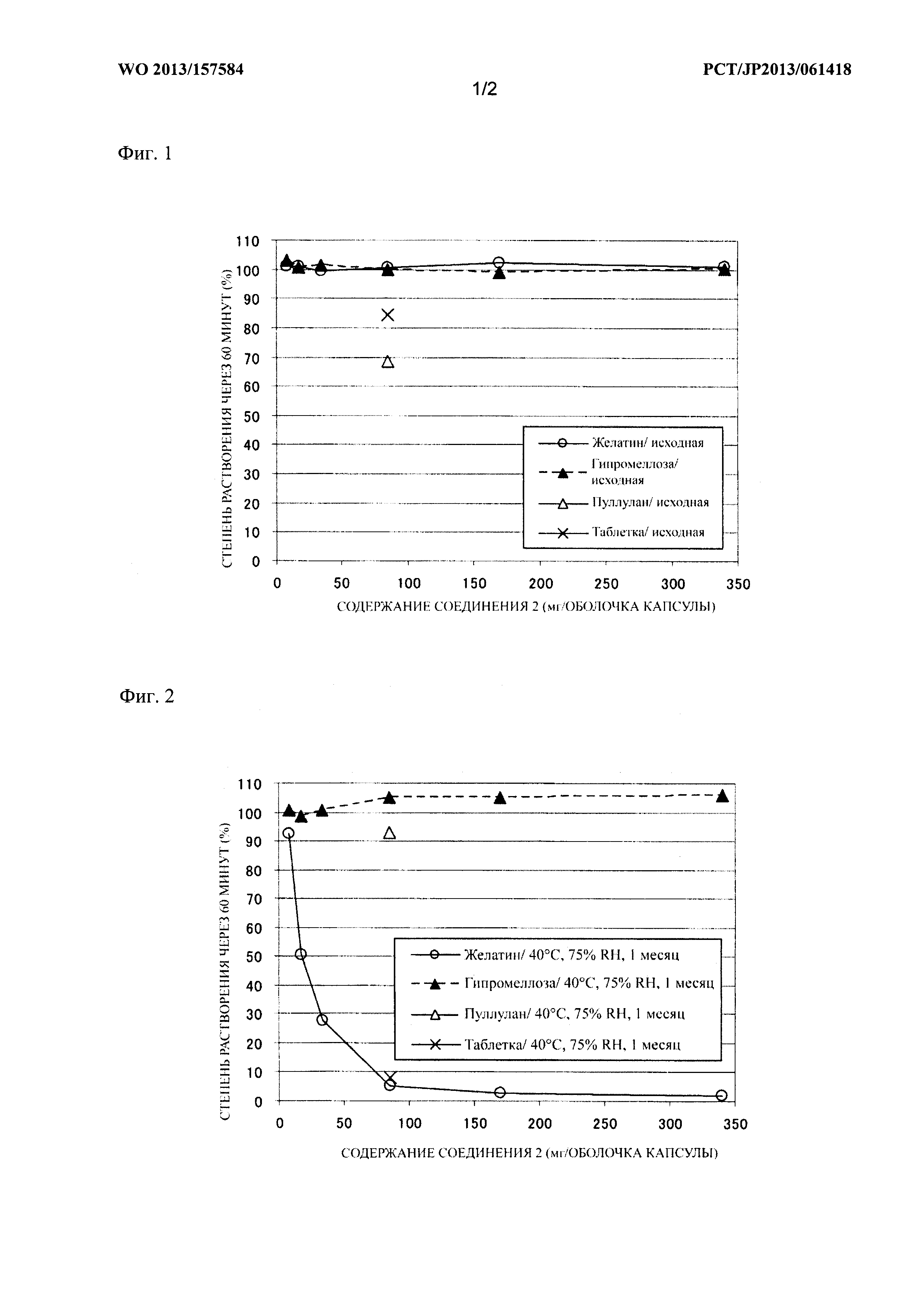
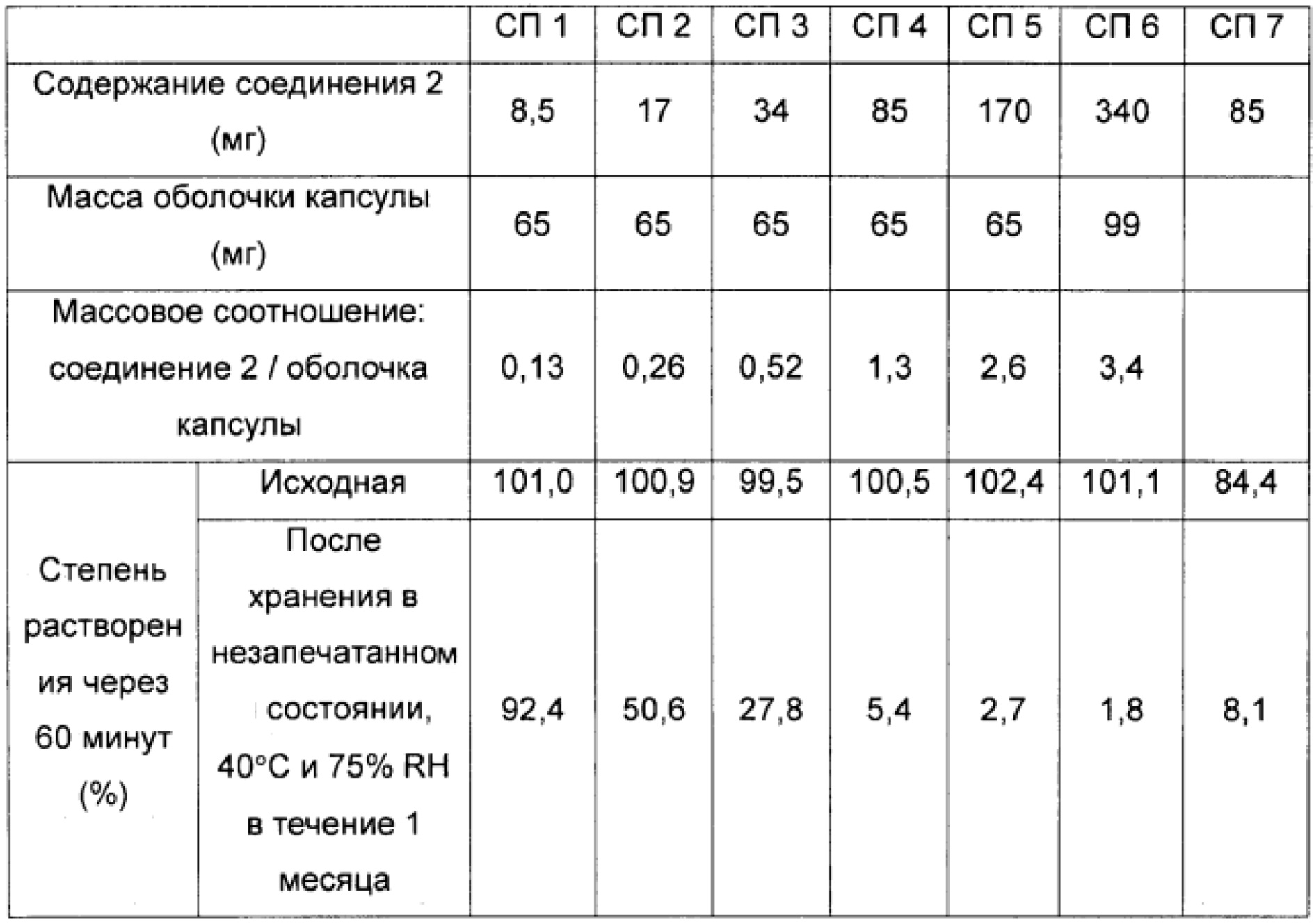
Фиг. 2 представляет собой график, на котором сравнивают зависимость между содержанием лекарственного средства и средней степенью растворения через 60 минут после начала испытания (степень растворения через 60 минут) у образцов после хранения в течение 1 месяца при условиях 40°C и 75% относительной влажности, что также описано в таблице 1 тестового примера 1;
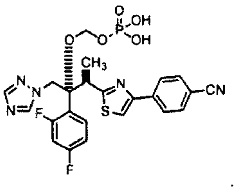
Фиг. 3 представляет собой график, на котором сравнивают характер растворения лекарственного средства из желатиновой оболочки капсулы до и после хранения в течение 1 месяца при условиях 40°C и 75% относительной влажности, что также описано в таблице 2 тестового примера 1; и
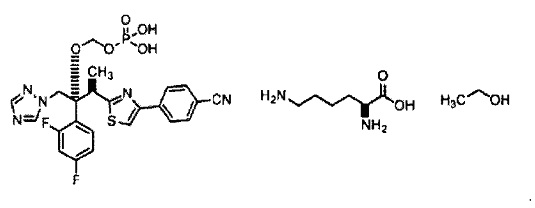
Фиг. 4 представляет собой график, на котором сравнивают характер растворения лекарственного средства из оболочки капсулы (оболочка капсулы из гипромеллозы), содержащей гипромеллозу (гидроксипропилметилцеллюлозу) в качестве основы, до и после хранения в течение 1 месяца при условиях 40°C и 75% относительной влажности, что также описано в таблице 2 тестового примера 1.
Способ осуществления настоящего изобретения
Способы осуществления настоящего изобретения проиллюстрированы следующими вариантами осуществления. Таким образом, следующие варианты осуществления не ограничивают настоящее изобретение. Варианты осуществления, модифицированные специалистом в данной области техники, например, также охватываются объемом настоящего изобретения, поскольку они согласуются с концепцией настоящего изобретения. (Капсульный состав)
Настоящее изобретение представляет собой капсульный состав, содержащий инкапсулированный материал, содержащий фосфонооксиметильное производное равуконазола, и оболочку капсулы, не содержащую желатин. В настоящем изобретении фосфонооксиметильное производное равуконазола инкапсулировано в оболочку капсулы, не содержащую желатин.
(Фосфонооксиметильное производное равуконазола)
В настоящем изобретении фосфонооксиметильное производное равуконазола представляет собой
{[(1R,2R)-2-[4-(4-цианофенил)-1,3-тиазол-2-ил]-1-(2,4-дифторфенил)-1-(1Н-1,2,4-триазол-1-илметил)пропил]окси}метилдигидрофосфат (соединение 1) или его фармакологически приемлемую соль. Фосфонооксиметильное производное равуконазола также может представлять собой сольват соединения 1 или его фармакологически приемлемую соль. Примеры сольвата включают гидрат и этанолат.
Примеры фармакологически приемлемой соли соединения 1 включают соль неорганического основания, соль органического основания и соль основной аминокислоты.
Примеры соли неорганического основания включают соль щелочного металла, такую как натриевая соль, калиевая соль и т.п.; соль щелочноземельного металла, такую как кальциевая соль, магниевая соль и т.п.; и аммониевую соль.
Примеры соли органического основания включают соль алкиламина, такую как триметиламин, триэтиламин и т.п.; алканоламина, такую как этаноламин, диэтаноламин, триэтаноламин и т.п.; гетероциклического амина, такую как пиридин, пиколин и т.п.; дициклогексиламина и N,N'-дибензилэтилендиамина.
Пример соли основной аминокислоты включает соль лизина, орнитина, гистидина или аргинина. Соль основной аминокислоты предпочтительно представляет собой моно-, ди- или три-соль основной аминокислоты.
Фармакологически приемлемая соль предпочтительно представляет собой соль лизина, более предпочтительно соль L-лизина и еще более предпочтительно моно-соль L-лизина (соль L-лизина; моно-соль лизина) или ди-соль L-лизина (ди-соль лизина).
Фосфонооксиметильное производное равуконазола предпочтительно представляет собой сольват его фармакологически приемлемой соли. Сольват предпочтительно представляет собой этанолат моно-соли L-лизина или этанолат ди-соли L-лизина и более предпочтительно
L-лизин-{[(1R,2R)-2-[4-(4-цианофенил)-1,3-тиазол-2-ил]-1-(2,4-дифторфенил)-1-(1Н-1,2,4-триазол-1-илметил)пропил]окси}метилдигидрофосфат-этанол (1/1/1) (соединение 2).
Соединение 1 представляет собой соединение, представленное следующей формулой 1, и соединение 2 представляет собой соединение, представленное следующей формулой 2.
Формула 1:
Формула 2:
Соединения 1 и 2, охваченные выражением "фосфонооксиметильное производное равуконазола", можно получать согласно описанию РСТ заявки №2003-520235 в переводе на японский язык (патентный документ 1) и WO 2007/097386 (патентный документ 2).
(Оболочка капсулы, не содержащая желатин)
В настоящем изобретении выражение "оболочка капсулы, не содержащая желатин" означает оболочку капсулы, которая не содержит желатин в качестве основы оболочки капсулы, которая является основным компонентом оболочки капсулы. Пример оболочки капсулы включает оболочку капсулы, содержащую, например, гипромеллозу, пуллулан, поливиниловый спирт или крахмал в качестве основы оболочки капсулы. Оболочка капсулы предпочтительно представляет собой оболочку капсулы, содержащую гипромеллозу или пуллулан в качестве основы оболочки капсулы, и более предпочтительно оболочку капсулы, содержащую гипромеллозу в качестве основы оболочки капсулы. Оболочка капсулы также может содержать, в дополнение к основе оболочки капсулы, такой как гипромеллоза, пуллулан, поливиниловый спирт, крахмал и т.п., гелеобразователь, такой как каррагинан; вспомогательный гелеобразователь, такой как хлорид калия; красящее вещество; и другие компоненты, которые обычно могут быть добавлены к оболочке капсулы в качестве компонента оболочки капсулы. Например, можно использовать коммерчески доступный продукт в качестве оболочки капсулы, содержащей гипромеллозу или пуллулан в качестве основы оболочки капсулы. Оболочку капсулы, содержащую поливиниловый спирт в качестве основы оболочки капсулы, можно получать согласно, например, способу, описанному в патентной публикации JP-A-2001-170137, и оболочку капсулы, содержащую крахмал в качестве основы оболочки капсулы, можно получать согласно, например, способу, описанному в Но J. Bae, et al. "Film and pharmaceutical hard capsule formation properties of mungbean, water chestnut, and sweet potato starches", Food Chemistry, 106 (2008) p. 96-105. (Инкапсулированный материал)
В настоящем изобретении выражение "инкапсулированный материал" означает содержимое, которое присутствует в (внутри) оболочке капсулы в случае, если оно представлено в виде капсульного состава, а не оболочки капсулы per se или ее компонента.
Инкапсулированный материал конкретно не ограничен, при условии, что он содержит фосфонооксиметильное производное равуконазола, и может представлять собой композицию, содержащую фосфонооксиметильное производное равуконазола.
Пример композиции, содержащей фосфонооксиметильное производное равуконазола, включает композицию, которая содержит фосфонооксиметильное производное равуконазола и факультативно фармакологически приемлемую добавку, такую как стабилизатор, наполнитель, связующее вещество, разрыхлитель, смазывающее вещество, антиоксидант, вкусовое вещество, красящее вещество и ароматизирующее вещество. Примеры композиции включают композицию, полученную путем смешивания фосфонооксиметильного производного равуконазола с вышеуказанной добавкой; гранулированную композицию, полученную путем добавления к фосфонооксиметильному производному равуконазола вышеуказанной добавки и подвергания любому виду грануляции, такому как грануляция встряхиванием, грануляция экструзией, грануляция с помощью галтовочного барабана, грануляция в псевдоожиженном слое, грануляция распылением и т.п. (в случае композиции вышеуказанная добавка может содержать растворитель); и композицию, содержащую вышеуказанные гранулы, смешанные с вышеуказанной добавкой.
В настоящем изобретении предпочтительно, чтобы инкапсулированный материал не содержал желатин.
Примеры стабилизатора включают различные основные вещества, раскрытые в WO 2007/097386 (патентный документ 2). Можно использовать два или более основных веществ в комбинации.
Основное вещество может представлять собой вещество с pH 7 или более в виде 1% водного раствора или суспензии, предпочтительно вещество с pH 8 или более в виде 1% водного раствора или суспензии и более предпочтительно вещество с pH 10 или более в виде 1% водного раствора или суспензии. Примеры основного вещества включают неорганическое основание, органическое основание, основную аминокислоту и основный полимер.
Примеры неорганического основания включают гидроксид карбоната магния, гидрокарбонат калия, гидрокарбонат натрия, карбонат калия, карбонат натрия, карбонат магния, карбонат кальция, карбонат бария, тяжелый карбонат магния, осажденный карбонат кальция, гидроксид лития, гидроксид калия, гидроксид натрия, гидроксид магния, гидроксид кальция, гидроксид магния и алюминия, высушенный гель гидроксида алюминия, оксид магния, оксид кальция, оксид бария, силикат кальция, силикат магния, алюмосиликат магния, алюминат магния, метасиликат-алюминат магния, вторичный кислый фосфат натрия, дигидрофосфат натрия, синтетический гидроталькит, копреципитат гидроксида алюминия и гидроксида магния, копреципитат гидроксида алюминия, карбоната магния и карбоната кальция и копреципитат гидроксида алюминия и гидрокарбоната натрия. Неорганическое основание предпочтительно представляет собой гидроксид карбоната магния, оксид магния, гидроксид магния, карбонат натрия, карбонат кальция, гидрокарбонат натрия или силикат кальция и более предпочтительно гидроксид карбоната магния, гидроксид магния, оксид магния или гидрокарбонат натрия.
Примеры органического основания включают стеарат кальция, стеарат магния, стеарат натрия, стеарилфумарат натрия, тринатриевый цитрат, бензоат натрия, моноэтаноламин, диэтаноламин, триэтаноламин, трибутиламин, дициклогексилметиламин и N-метилпирролидин. Органическое основание предпочтительно представляет собой стеарат кальция, тринатриевый цитрат или бензоат натрия и более предпочтительно бензоат натрия.
Примеры основной аминокислоты включают лизин, орнитин, гистидин и аргинин. Основная аминокислота предпочтительно представляет собой лизин или аргинин и более предпочтительно аргинин.
Примеры основного полимера включают, например, сополимер аминоалкила и метакрилата Е, поливинилацетальдиэтиламиноацетат и этилцеллюлозу.
Основное вещество предпочтительно представляет собой гидроксид карбоната магния, гидроксид магния, оксид магния, гидрокарбонат натрия или аргинин и более предпочтительно оксид магния.
Примеры наполнителя включают лактозу, сахарозу, глюкозу, фруктозу, крахмал, картофельный крахмал, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, кристаллическую целлюлозу, микрокристаллическую целлюлозу, измельченную солодку, маннит, эритрит, мальтит, сорбит, трегалозу, безводную кремниевую кислоту, силикат кальция, гидрокарбонат натрия, фосфат кальция, безводный фосфат кальция и сульфат кальция.
Примеры связующего вещества включают крахмал, аравийскую камедь, трагакант, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, метилцеллюлозу, частично прежелатинизированный крахмал, прежелатинизированный крахмал, поливиниловый спирт, альгинат натрия, пуллулан и глицерин.
Примеры разрыхлителя включают аминокислоту, крахмал, кукурузный крахмал, карбонат кальция, кармеллозу, кармеллозу кальция, кроскармеллозу натрия, гидроксипропилцеллюлозу с низкой степенью замещения, оксипропилированный крахмал и кросповидон.
Примеры смазывающего вещества включают стеарат магния, стеариновую кислоту, стеарат кальция, стеарилфумарат натрия, тальк и макрогол.
Примеры антиоксиданта включают аскорбат натрия, L-цистеин, сульфит натрия, токоферол и соевый лецитин.
Примеры вкусовых веществ включают лимонную кислоту, аскорбиновую кислоту, винную кислоту, яблочную кислоту, аспартам, ацесульфам калия, тауматин, сукралозу, сахарин натрия, двойной глицирризинат калия, глутамат натрия, 5'-инозинат натрия и 5'-гуанилат натрия.
Примеры красящего вещества включают оксид титана, полуторную окись железа, желтую полуторную окись железа, кошениль, кармин, рибофлавин, пищевой желтый №5 и пищевой голубой №2.
Примеры вкусового вещества включают лимонное масло, апельсиновое масло, ментол, масло мяты перечной, борнеол и ванильную эссенцию.
В капсульном составе по настоящему изобретению массовое соотношение фосфонооксиметильного производного равуконазола к оболочке капсулы (фосфонооксиметильное производное равуконазола / оболочка капсулы), в тех случаях, когда его рассчитывают исходя из массы в пересчете на соединение 2, составляет, как правило, 0,10 или более, предпочтительно 0,27 или более, более предпочтительно 0,53 или более и еще более предпочтительно 1,3 или более. Выражение "масса в пересчете на соединение 2" означает значение, полученное путем преобразования массы инкапсулированного фосфонооксиметильного производного равуконазола в массу эквимолярного соединения 2 с использованием соотношения молекулярной массы соединения 2 и инкапсулированного фосфонооксиметильного производного равуконазола.
Верхний предел массового соотношения фосфонооксиметильного производного равуконазола к оболочке капсулы определяют в соответствии с массой и внутренним объемом оболочки капсулы. Массовое соотношение фосфонооксиметильного производного равуконазола к оболочке капсулы, в тех случаях, когда его рассчитывают исходя из массы в пересчете на соединение 2, составляет, как правило, 10 или менее, предпочтительно 5,0 или менее, более предпочтительно 4,5 или менее и еще более предпочтительно 4,0 или менее.
Массовое соотношение фосфонооксиметильного производного равуконазола к оболочке капсулы (в тех случаях, когда его рассчитывают исходя из массы в пересчете на соединение 2; то же самое применяют далее в данном абзаце) составляет, как правило, 0,10-10, предпочтительно 0,27-10, более предпочтительно 0,53-10 и еще более предпочтительно 1,3-10; причем в тех случаях, когда верхний предел массового соотношения фосфонооксиметильного производного равуконазола к оболочке капсулы составляет 5,0, оно составляет, как правило, 0,10-5,0, предпочтительно 0,27-5,0, более предпочтительно 0,53-5,0 и еще более предпочтительно 1,3-5,0.
В капсульном составе по настоящему изобретению содержание фосфонооксиметильного производного равуконазола на оболочку капсулы, в пересчете на массу соединения 2, составляет, как правило, 5 мг или более, предпочтительно 17 мг или более, более предпочтительно 34 мг или более и еще более предпочтительно 85 мг или более. Выражение "масса в пересчете на соединение 2" означает значение, полученное путем преобразования массы инкапсулированного фосфонооксиметильного производного равуконазола в массу эквимолярного соединения 2 с использованием соотношения молекулярной массы соединения 2 и инкапсулированного фосфонооксиметильного производного равуконазола.
В капсульном составе по настоящему изобретению, как правило, массовое соотношение фосфонооксиметильного производного равуконазола (в пересчете на массу соединения 2; то же самое применяют далее в данном абзаце) к оболочке капсулы составляет 0,10-10, и содержание фосфонооксиметильного производного равуконазола на оболочку капсулы составляет 5 мг или более, предпочтительно массовое соотношение фосфонооксиметильного производного равуконазола к оболочке капсулы составляет 0,27-10, и содержание фосфонооксиметильного производного равуконазола на оболочку капсулы составляет 17 мг или более, более предпочтительно массовое соотношение фосфонооксиметильного производного равуконазола к оболочке капсулы составляет 0,53-10, и содержание фосфонооксиметильного производного равуконазола на оболочку капсулы составляет 34 мг или более, и еще более предпочтительно массовое соотношение фосфонооксиметильного производного равуконазола к оболочке капсулы составляет 1,3-10, и содержание фосфонооксиметильного производного равуконазола на оболочку капсулы составляет 85 мг или более.
Верхний предел содержания фосфонооксиметильного производного равуконазола на оболочку капсулы, как правило, определяют в соответствии с внутренним объемом применяемой оболочки капсулы, хотя он может варьировать в зависимости от дозы, которая необходима для обеспечения необходимого фармакологического эффекта. Содержание фосфонооксиметильного производного равуконазола на оболочку капсулы исходя из внутреннего объема оболочки капсулы составляет, как правило, 1,5 г/мл или менее, предпочтительно 0,8 г/мл или менее и более предпочтительно 0,7 г/мл или менее.
В настоящем изобретении, несмотря на то, что процент содержания фосфонооксиметильного производного равуконазола в инкапсулированном материале конкретно не ограничен, процент содержания предпочтительно является высоким, с учетом лекарственного препарата, так что объем состава можно уменьшить. Капсульный состав по настоящему изобретению, даже если процент содержания фосфонооксиметильного производного равуконазола является высоким, может высвобождать, как правило, 60% или более и предпочтительно 85% или более фосфонооксиметильного производного равуконазола в качестве средней степени растворения через 60 минут после начала испытания на растворимость после хранения. В настоящем изобретении процент содержания фосфонооксиметильного производного равуконазола исходя из массы инкапсулированного материала составляет, как правило, 50% или более, предпочтительно 75% или более, более предпочтительно 90% или более и еще более предпочтительно 95% или более. (Способ получения капсульного состава)
Капсульный состав по настоящему изобретению можно получать согласно известным способам, в том числе способу, описанному в разделе "1.2 Капсула" (страница 10) Японской фармакопеи, 16-е издание, "Общие правила получения". Примеры способа получения капсульного состава включают способ, при котором только фосфонооксиметильное производное равуконазола инкапсулируют в оболочку капсулы; способ, при котором композицию, содержащую фосфонооксиметильное производное равуконазола, факультативно смешанную с добавкой, такой как наполнитель, связующее вещество, разрыхлитель, смазывающее вещество и т.п., инкапсулируют в оболочку капсулы; способ, при котором фосфонооксиметильное производное равуконазола, факультативно дополненное добавкой, такой как наполнитель, связующее вещество, разрыхлитель, растворитель и т.п., подвергают любому виду грануляции, в том числе грануляции встряхиванием, грануляции экструзией, грануляции с помощью галтовочного барабана, грануляции в псевдоожиженном слое, грануляции распылением и т.п., с получением гранул, которые затем инкапсулируют в капсулу; и способ, при котором композицию, содержащую вышеуказанные гранулы, факультативно смешанную с добавкой, такой как наполнитель, связующее вещество, разрыхлитель, смазывающее вещество и т.п., инкапсулируют в оболочку капсулы.
(Применение капсульного состава)
Капсульный состав по настоящему изобретению можно вводить с целью лечения заболеваний у животных, в особенности у млекопитающих, более конкретно у человека. Показание к применению капсульного состава по настоящему изобретению конкретно не ограничено, поскольку это показание является заболеванием, при котором можно применять фосфонооксиметильное производное равуконазола. Капсульный состав по настоящему изобретению является применимым для лечения грибковых инфекций, таких как кандидоз, онихомикоз и т.п. Доза фосфонооксиметильного производного равуконазола, которое является фармакологически активным веществом, может варьировать в зависимости от различных условий, в том числе активности фармакологически активного вещества, симптома, возраста, массы тела пациентов и т.п. Основная доза для перорального введения составляет 10-2000 мг/день и предпочтительно 50-1000 мг/день.
Капсульный состав по настоящему изобретению может высвобождать, как правило, 60% или более, предпочтительно 75% или более, более предпочтительно 85% или более, еще более предпочтительно 90% или более и в особенности предпочтительно 95% или более фосфонооксиметильного производного равуконазола, в зависимости от средней степени растворения через 60 минут после начала испытания на растворимость в соответствии с разделом "6.10 Испытание на растворимость (страницы 117-121)" в Японской фармакопее, 16-е издание, которое описано в примерах, даже если состав хранят, например, в незапечатанном состоянии при условиях 40°C и 75% относительной влажности в течение 1 месяца.
Настоящее изобретение представляет собой способ уменьшения задержки растворения фосфонооксиметильного производного равуконазола из капсульного состава в результате хранения путем инкапсулирования инкапсулированного материала, содержащего фосфонооксиметильное производное равуконазола, в оболочку капсулы, не содержащую желатин, независимо от инкапсулированного количества фосфонооксиметильного производного равуконазола. Пример условия хранения включает хранение в незапечатанном состоянии при условиях 40°C и 75% относительной влажности в течение 1 месяца.
Согласно способу по настоящему изобретению средняя степень растворения фосфонооксиметильного производного равуконазола из капсульного состава после хранения может представлять собой, например, как правило, 60% или более, предпочтительно 75% или более, более предпочтительно 85% или более, еще более предпочтительно 90% или более и в особенности предпочтительно 95% или более.
Примеры
Варианты осуществления и эффекты настоящего изобретения описаны далее в данном документе более подробно со ссылкой на примеры и сравнительные примеры. Данные примеры иллюстрируют варианты осуществления, и настоящее изобретение охватывает варианты осуществления, отличные от примеров, описанных далее. Специалист в данной области техники может осуществлять различные модификации следующих примеров для того, чтобы использовать их в качестве вариантов осуществления настоящего изобретения, и при этом модифицированные варианты осуществления также охватываются объемом настоящего изобретения, при условии, что они согласуются с концепцией настоящего изобретения.
[Пример 1]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 8,55 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 8,5 мг соединения 2 на оболочку капсулы.
[Пример 2]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 17,1 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 17 мг соединения 2 на оболочку капсулы.
[Пример 3]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 34,2 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 34 мг соединения 2 на оболочку капсулы.
[Пример 4]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 85,5 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 85 мг соединения 2 на оболочку капсулы.
[Пример 5]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 171,0 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 170 мг соединения 2 на оболочку капсулы.
[Пример 6]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 342,1 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 0, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 340 мг соединения 2 на оболочку капсулы.
[Пример 7]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 85,5 мг в оболочку капсулы из пуллулана (NPcaps®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 85 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 1]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 8,55 мг в желатиновую оболочку капсулы (размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 8,5 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 2]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 17,1 мг в желатиновую оболочку капсулы (размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 17 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 3]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 34,2 мг в желатиновую оболочку капсулы (размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 34 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 4]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 85,5 мг в желатиновую оболочку капсулы (размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 85 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 5]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 171,0 мг в желатиновую оболочку капсулы (размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 170 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 6]
Соединение 2 (19,88 г), фосфонооксиметильное производное равуконазола, смешивали с 0,12 г стеарата магния (изготовленного Mallinckrodt) в пробирке. Полученную в результате смесь отвешивали в количестве 342,1 мг в желатиновую оболочку капсулы (размер 0, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 340 мг соединения 2 на оболочку капсулы.
[Сравнительный пример 7]
В ступке смешивали 5,0 г соединения 2, фосфонооксиметильного производного равуконазола, 0,3 г повидона (изготовленного ISP), 1,5 г кроскармеллозы натрия (изготовленной FMC International), 0,3 г оксида магния (изготовленного Kyowa Chemical Industry Co., Ltd.) и 1,55 г маннита (изготовленного Mitsubishi Shoji Foodtech Co., Ltd.). В полученную в результате смесь добавляли смесь этанола:воды=7:1 (вес/вес) и гранулировали. Гранулированный материал высушивали в термостатической камере с последующим регулированием размера частиц с помощью сита с размером ячеек 1 мм. Добавляли отсортированные по размеру гранулы и смешивали с 1,2 г кармеллозы (изготовленной Nichirin Chemical Industries, Ltd.), 0,05 г силиката кальция (изготовленного Tokuyama Corporation) и 0,1 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 170 мг и прессовали на приборе для испытания материалов (Autograph®, изготовленном Shimadzu Corporation) с получением таблетки диаметром 7,5 мм, содержащей 85 мг соединения 2.
[Тестовый пример 1]
Капсульные составы или таблетки, полученные в примерах 1-7 и сравнительных примерах 1-7, использовали в качестве образцов. Образцы помещали в пробирки и хранили в незапечатанном состоянии в течение 1 месяца при следующих условиях: 40°C и 75% относительной влажности. Образцы до и после хранения оценивали в отношении характера растворения в фосфатном буфере, pH 6,8.
Испытание на растворимость проводили согласно способу, описанному в разделе "6.10 Испытание на растворимость" в Японской фармакопее, 16-е издание, как описано ниже. В специализированные сосуды загружали, соответственно, 900 мл фосфатного буфера, рН 6,8, и их присоединяли к устройству, и с помощью термометра, который затем удаляли, подтверждали, что тестовый раствор поддерживается при 37±0,5°C. Каждый из капсульных составов помещали в отстойник, который изображен на фиг. 6.10-2а (страница 118) Японской фармакопеи, 16-е издание, и затем аккуратно загружали в сосуды, во избежание образования пузырьков воздуха на поверхности образцов. Таблетки аккуратно загружали в сосуды в том виде, в котором они находились, во избежание образования пузырьков на поверхности образцов. Сразу же после того, как образцы загружали, устройство приводили в действие при скорости вращения лопастной мешалки 50 об/мин и в каждый предварительно определенный момент времени пробу отбирали из зоны посредине между поверхностью тестового раствора и верхней частью вращающейся лопасти, не менее 10 мм от стенки сосуда. Отобранный тестовый раствор фильтровали через фильтр с размером пор 0,45 мкм, и фильтрат использовали для измерения коэффициента поглощения, как описано далее в данном документе. Раствор для испытания на растворимость готовили путем добавления к 136,1 г безводного первичного кислого фосфата калия и 224 мл 2 моль/л водного раствора гидроксида натрия чистой воды до 20 л.
Степень растворения соединения 2 рассчитывали путем измерения коэффициента поглощения тестового раствора (фильтрата), который собирали в предварительно определенный момент времени, и затем фильтровали, как описано выше, и сравнивали коэффициент поглощения с коэффициентом поглощения стандартного раствора, полученного отдельно. Коэффициент поглощения измеряли с помощью кюветы с толщиной поглощающего слоя 10 мм. Комбинации измеряемой длины волны и опорной длины волны использовали для измерений образцов, показанных ниже. Следующие комбинации также включают в качестве эталонных данных условия измерения для образцов, содержащих менее 7 мг и 380 мг или более соединения 2.
Образцы, содержащие менее 7 мг соединения 2: измеряемая длина волны 285 нм/опорная длина волны 350 нм.
Образцы, содержащие 7 мг или более и менее 40 мг соединения 2: измеряемая длина волны 302 нм/опорная длина волны 350 нм.
Образцы, содержащие 40 мг или более и менее 200 мг соединения 2: измеряемая длина волны 315 нм/опорная длина волны 350 нм.
Образцы, содержащие 200 мг или более и менее 380 мг соединения 2: измеряемая длина волны 318 нм/опорная длина волны 350 нм.
Образцы, содержащие 380 мг или более и менее 800 мг соединения 2: измеряемая длина волны 322 нм/опорная длина волны 350 нм.
Образцы, содержащие 800 мг или более соединения 2: измеряемая длина волны 325 нм/опорная длина волны 350 нм.
Средняя степень растворения через 60 минут после начала испытания (степень растворения через 60 минут) для образцов из примеров 1-7 и сравнительных примеров 1-7 показана в таблице 1 и на фиг. 1 и 2. Профиль степени растворения с 5 по 60 минуту после начала испытания для образцов из примера 6 и сравнительного примера 6 показан в таблице 2 и на фиг. 3 и 4.
Степень растворения для каждого примера и каждого сравнительного примера, показанная в таблицах и на чертежах, является средней степенью растворения трех образцов.
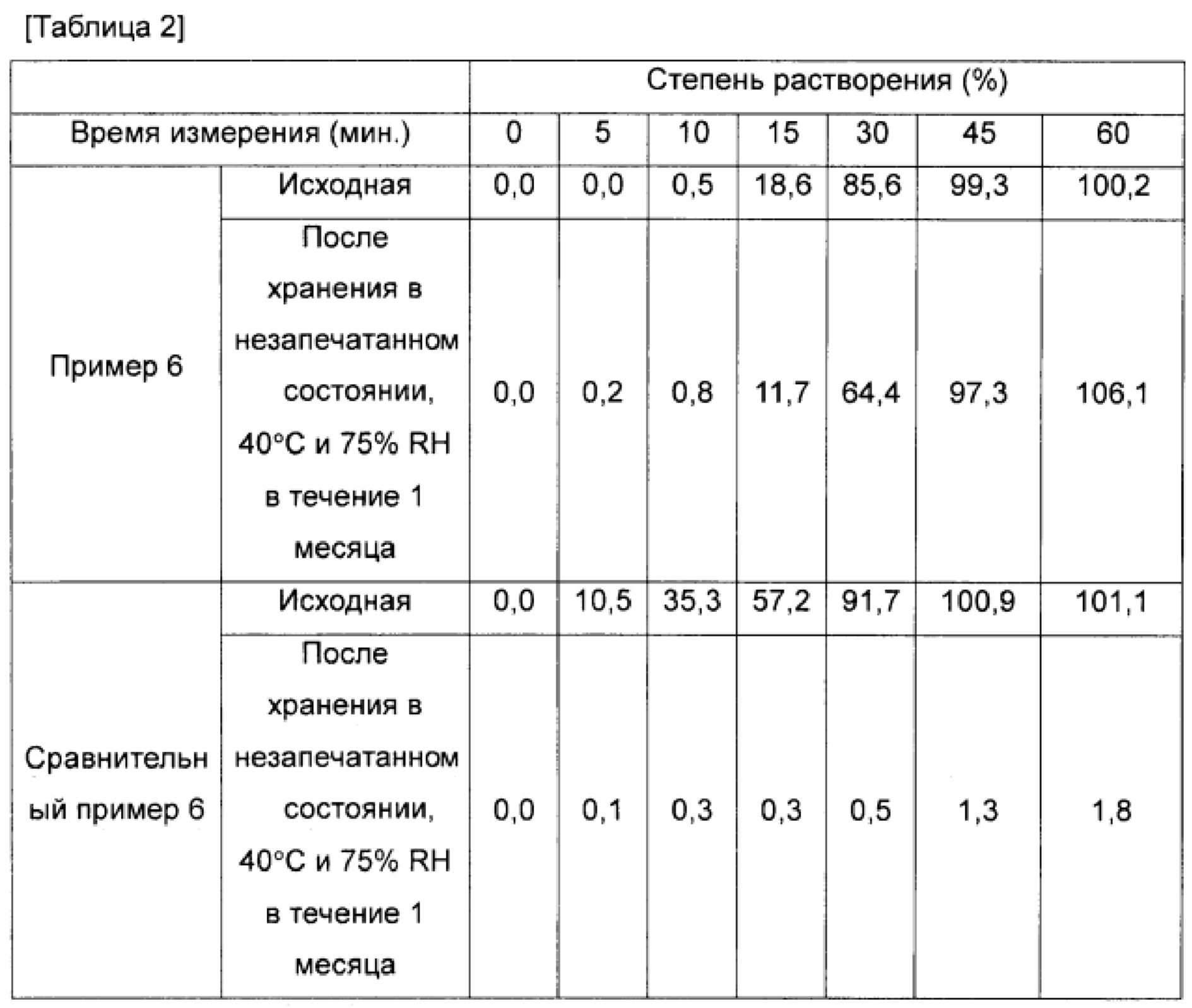
Принимая во внимание геометрическое изменение после хранения, наблюдали, что образцы из примера 7 (оболочка капсулы из пуллулана) размякли и были деформированы, а образцы из сравнительного примера 7 (таблетки) набухли. Для образцов, в которых использовали оболочку капсулы из гипромеллозы и желатиновую оболочку капсулы, не наблюдали никакого размягчения или деформации оболочки капсулы.
Средние степени растворения образцов из примеров 1-7, которые хранили при 40°C, не снизились по сравнению с исходными значениями. В частности, образцы из примеров 1-6 (оболочка капсулы из гипромеллозы) быстро высвобождали 85% или более содержания соединения 2, независимо от инкапсулированного количества соединения 2, через 60 минут после начала испытания, даже после хранения при 40°C. Образцы из примера 7 (оболочка капсулы из пуллулана) продемонстрировали большее количество вариаций средней степени растворения среди образцов по сравнению с образцами оболочки капсулы из гипромеллозы.
Наблюдали, что средние степени растворения образцов из сравнительных примеров 1-7 после хранения при 40°C понижались, и при этом величина снижения средней степени растворения была более значительной при повышении содержания соединения 2. В частности, образцы из сравнительных примеров 4-7, которые содержат 85 мг или более соединения 2, имели среднюю степень растворения менее 10% даже через 60 минут после начала испытания.
[Пример 8]
Смешивали 796 г соединения 2, фосфонооксиметильного производного равуконазола, и 4 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 172 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 171 мг соединения 2 на оболочку капсулы.
[Пример 9]
Смешивали 794,4 г соединения 2, фосфонооксиметильного производного равуконазола, 1,6 г оксида магния (изготовленного Kyowa Chemical Industry Co., Ltd.) и 4 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 172 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 171 мг соединения 2 на оболочку капсулы.
[Пример 10]
Смешивали 792 г соединения 2, фосфонооксиметильного производного равуконазола, 4 г оксида магния (изготовленного Kyowa Chemical Industry Co., Ltd.) и 4 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 173 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 171 мг соединения 2 на оболочку капсулы.
[Пример 11]
Смешивали 788 г соединения 2, фосфонооксиметильного производного равуконазола, 8 г оксида магния (изготовленного Kyowa Chemical Industry Co., Ltd.) и 4 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 174 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 171 мг соединения 2 на оболочку капсулы.
[Пример 12]
Смешивали 148,05 г соединения 2, фосфонооксиметильного производного равуконазола, 0,75 г оксида магния (изготовленного Kyowa Chemical Industry Co., Ltd.) и 1,2 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 173 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 3, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 171 мг соединения 2 на оболочку капсулы.
[Пример 13]
Смешивали 147,75 г соединения 2, фосфонооксиметильного производного равуконазола, 0,75 г оксида магния (изготовленного Kyowa Chemical Industry Co., Ltd.) и 1,5 г стеарата магния (изготовленного Mallinckrodt). Полученную в результате смесь отвешивали в количестве 174 мг в оболочку капсулы из гипромеллозы (VcapsPlus®, размер 2, изготовленную CAPSUGEL) с получением капсульного состава, содержащего 171 мг соединения 2 на оболочку капсулы.
[Тестовый пример 2]
Капсульный состав с гипромеллозой, полученный в примере 12, использовали в качестве образца. Образец хранили в незапечатанном состоянии так же, как и в тестовом примере 1, и при этом образцы до и после хранения оценивали в отношении характера растворения в фосфатном буфере, pH 6,8.
Средняя степень растворения через 60 минут после начала испытания (степень растворения через 60 минут) для образцов до и после хранения показана в таблице 3. Степень растворения, показанная в таблице, является средней степенью растворения трех образцов.
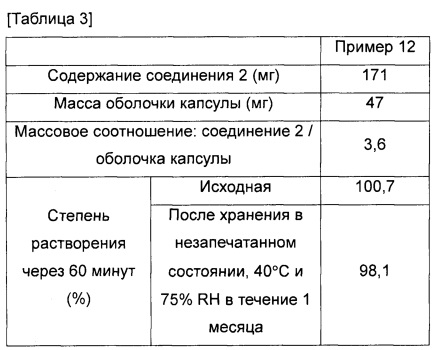
Средняя степень растворения образцов из примера 12, которые хранили при 40°C, не снизилась по сравнению с исходным значением.
Промышленная применимость
Согласно настоящему изобретению можно получать капсульный состав, содержащий фосфонооксиметильное производное равуконазола. Капсульный состав по настоящему изобретению обеспечивает уменьшение задержки растворения в результате хранения независимо от инкапсулированного количества фосфонооксиметильного производного равуконазола и, таким образом, имеет промышленную применимость в области медицины.