Результат интеллектуальной деятельности: N-ПИПЕРОНИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ
Вид РИД
Изобретение
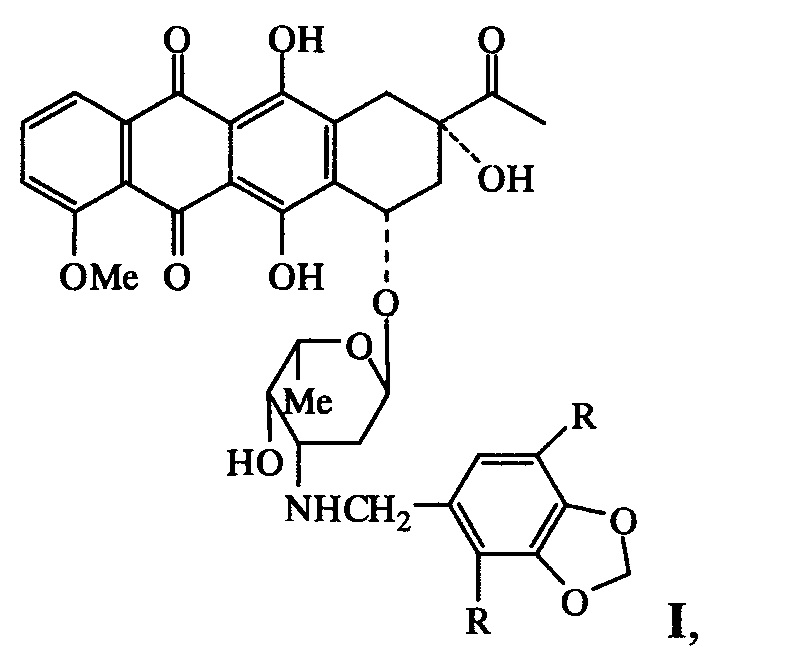
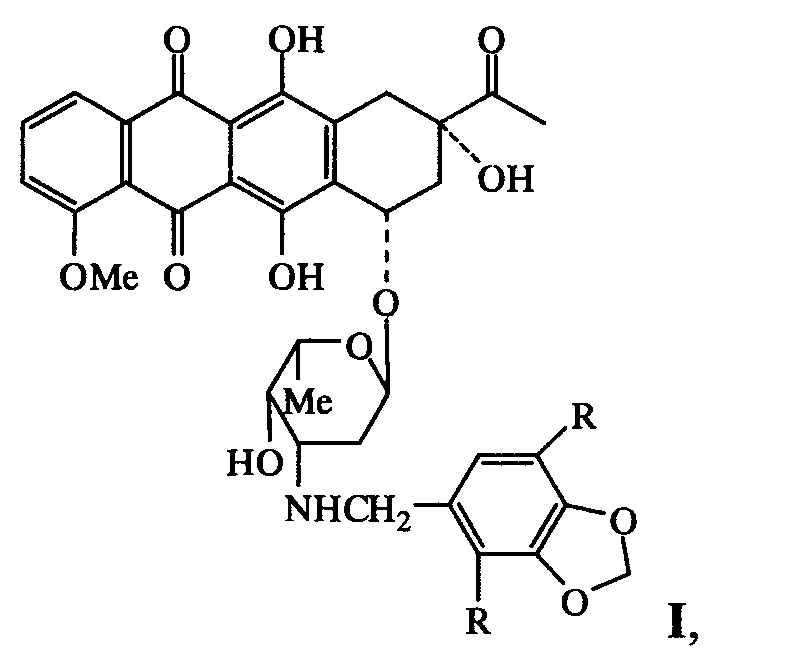
Изобретение относится к области фармацевтики и медицины, в частности онкологии, конкретно к новым N-пиперонильным производным даунорубицина формулы I, обладающим антипролиферативными свойствами и относительно низкой острой токсичностью:
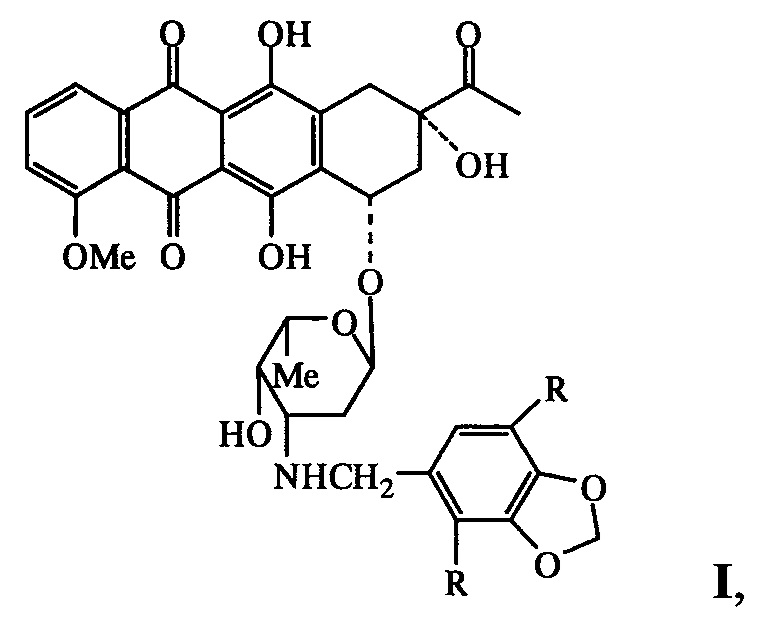
где R=Н (Ia), ОСН3 (Ib), и их фармацевтически приемлемым солям.
Изобретение может быть использовано для лечения ряда онкологических заболеваний, связанных с пролиферацией опухолевых клеток, в частности немелкоклеточного рака легкого, рабдомиосаркомы, карциномы кишечника, аденокарциномы молочной железы и других злокачественных новообразований.
В настоящее время лечение перечисленных заболеваний представляет собой серьезную проблему, поскольку известные химиотерапевтические агенты, применяемые с этой целью, отличаются высокой острой токсичностью, их использование приводит к сужению терапевтического индекса и сопряжено с различными побочными эффектами в отношении здоровых клеток.
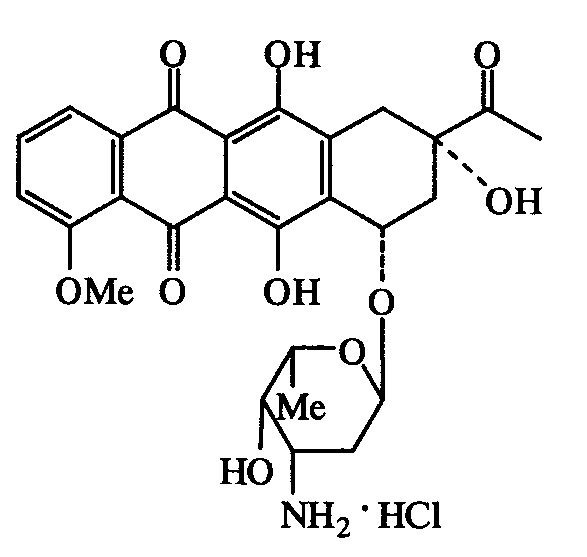
Известен широко применяемый в медицинской практике противоопухолевый препарат даунорубицин [Машковский М.Д. Лекарственные средства. М.: Новая волна, 2016. - С. 999]
 .
.
Однако это соединение обладает высокой острой токсичностью [Woodman R.J., Cysyk R.L., Kline I., Gang М., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695].
Антипролиферативными свойствами обладает и целый ряд производных даунорубицина. Однако производные даунорубицина, как и он сам, обнаруживая антипролиферативные свойства в субмикромолярных концентрациях, имеют высокую острую токсичность [Машковский М.Д. Лекарственные средства. М.: Новая волна, 2016. - С. 998-201; Olsufyeva T.N., Tevyashova A.N., Trestchalin I.D., Preobrazhenskaya M.N., et al. Carbohydrate Research, 2003, 338 (13), 1359-1367].
Существует потребность в расширении арсенала противоопухолевых средств за счет соединений, проявляющих сильное антипролиферативное действие и обладающих при этом низкой острой токсичностью.
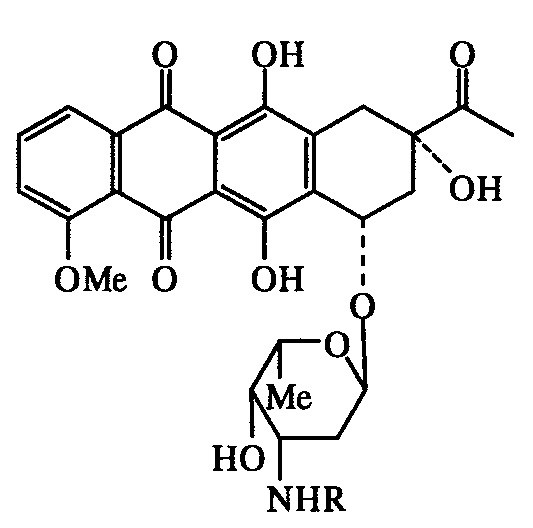
Известны немногочисленные примеры N-алкил- и N-аралкилзамещенных даунорубицинов, которые являются близкими структурными аналогами заявляемых соединений:
 ,
,
где R=С6Н4OСН2С6Н5-3, СH2С6H3(ОСH2С6H5)2-3,4, (CH2)15CH3, (СН2)4СОО-(3β)холестен-5-ил-3.
Комплексы таких соединений с липопротеинами низкой плотности обладают антипролиферативными свойствами [Masquelier М., Tirzitis G., Peterson CO., Palsson M., Amolins A., Plotniece M., Plotniece A., Makarova N., Vitols S.G. Eur. J. Med. Chem., 2000, 35 (4), 429-438]. Данные об острой токсичности указанных соединений в литературе отсутствуют.
Задачей настоящего изобретения является создание новых производных даунорубицина, обладающих широким спектром антипролиферативных свойств в сочетании с относительно низкой острой токсичностью.
Задача решается новыми N-пиперонильными производными даунорубицина общей формулы I
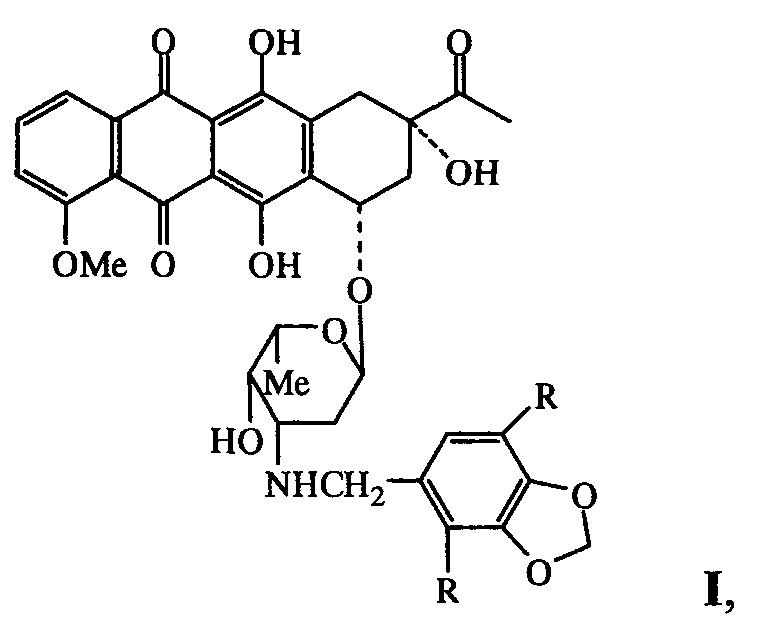
где R=Н (Ia), ОСН3 (Ib), и их фармацевтически приемлемыми солями. Указанные соединения обладают антипролиферативными свойствами и низкой острой токсичностью.
Заявляемые соединения формулы I, их свойства и применение ранее не были известны.
Соединения формулы I получали восстановительным алкилированием даунорубицина ароматическими альдегидами аналогично описанному в [Masquelier М., Tirzitis G., Peterson CO., Palsson M., Amolins A., Plotniece M., Plotniece A., Makarova N., Vitols S.G. Eur. J. Med. Chem., 2000, 35 (4), 429-438] по приведенной ниже схеме, используя в качестве исходных соединений даунорубицина гидрохлорид и соответствующие 1,3-бензодиоксол-5-карбальдегиды, а в качестве восстановителя - цианоборгидрид натрия, реакцию проводили в среде водного ацетонитрила при комнатной температуре (20-25°С).
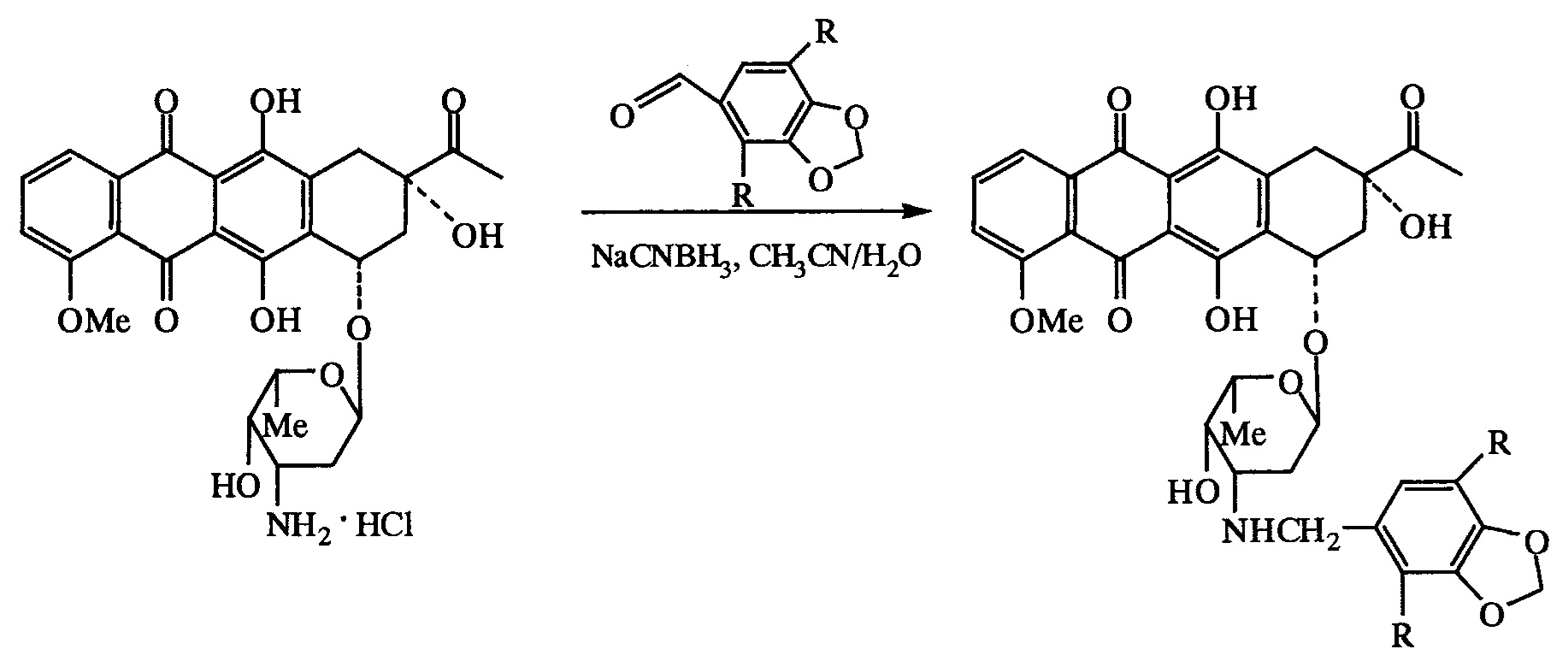
R=Н, ОСН3
Выходы соединений Ia и Ib составляли 32-34%, их структура доказана данными спектроскопии ЯМР (1Н и 13С), а индивидуальность и химическая чистота - данными элементного анализа.
Исследование антипролиферативной активности заявляемых соединений показало наличие ингибирующего действия в отношении целого ряда опухолей мышечной ткани: рабдомиосаркомы (RD), карциномы кишечника (НСТ116), аденокарциномы молочной железы (MCF7) - и немелкоклеточного рака легкого (А549), в большинстве случаев превышающего ингибирующее действие даунорубицина (см. таблицу, в которой приведены IC50 - концентрации соединений, вызывающие 50%-ное ингибирование роста популяции клеток).
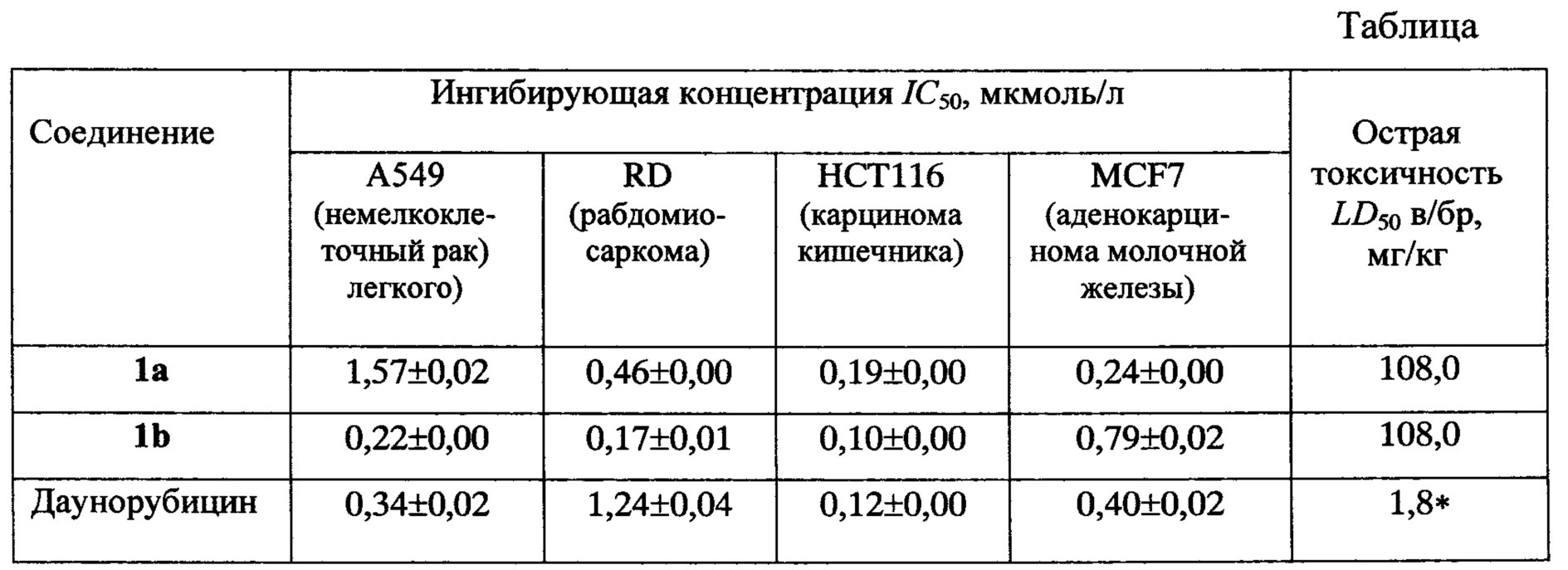
* Данные из работы [Woodman R.J., Cysyk R.L., Kline I., Gang M., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695].
Анализ острой токсичности заявляемых соединений показал, что их LD50 (при внутрибрюшинном введении мышам) составляет 108,0 мг/кг, т.е. они относятся к умеренно токсичным веществам по классификации токсичности Сидорова [Сидоров К.К. О классификации токсичности ядов при парентеральных способах введения. - В сб.: Токсикология новых промышленных химических веществ (вып. 13). М.: Медицина, 1973, 47-51], тогда как даунорубицин относится к высокотоксичным веществам: его LD50 при внутрибрюшинном введении мышам составляет 1,8 мг/кг [Woodman R.J., Cysyk R.L., Kline I., Gang M., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695]. Таким образом, острая токсичность заявляемых соединений примерно в 60 раз ниже, чем острая токсичность широко применяемого препарата даунорубицина.
Сочетание широкого спектра антипролиферативного действия и относительно низкой острой токсичности заявляемых соединений свидетельствует о потенциальной возможности их использования для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.
Технический результат настоящего изобретения состоит в создании новых производных даунорубицина, сочетающих широкий спектр антипролиферативных свойств в отношении ряда злокачественных опухолей с относительно низкой острой токсичностью (108 мг/кг).
Для получения заявляемых соединений использовали следующие коммерческие реагенты и растворители: пиперональ (1,3-бензодиоксол-5-карбальдегид), ацетонитрил, сульфат натрия (осушитель), силикагель для колоночной хроматографии, метанол, хлороформ (Acros Organics) и 4,7-диметокси-1,3-бензодиоксол-5-карбальдегид (Molbase).
Настоящее изобретение иллюстрируется приведенными примерами и данными таблицы, которые не ограничивают объем заявляемого изобретения.
Пример 1. Получение (8S-цис)-8-ацетил-10-{[3-(1,3-бензодиоксол-5-илметил-амино)-2,3,6-тридезокси-альфа-L-ликсогексопиранозил]окси}-7,8,9,10-тетрагидро-6,8,11-тригидрокси-1 -метокси-5,12-нафтацендиона (Iа)
В колбу, защищенную от света черной бумагой, помещают раствор 0,5 г (3,6 ммоль) пипероналя в смеси 6 мл CH3CN и 2 мл воды, к нему прибавляют 0,1 г (0,18 ммоль) даунорубицина гидрохлорида и перемешивают 30 мин при 20°С. Затем прибавляют 0,034 г (0,53 ммоль) NaBH3CN (содержание основного вещества не менее 98%) и перемешивают при той же температуре 2 ч. Затем прибавляют 15 мл воды и 15 мл CHCl3, органический слой отделяют, водный экстрагируют CHCl3 (3×15 мл). Объединенные органические экстракты промывают 30 мл воды, водный экстракт промывают СНСl3 (2×15 мл), органические экстракты объединяют и сушат Na2SO4. Растворитель удаляют на роторном испарителе, остаток очищают колоночной хроматографией на силикагеле (колонка: l 33 см, d 2 см). Сначала хлороформом элюируют избыток альдегида, затем смесью СНСl3МеОН=50:1 элюируют целевой продукт темно-оранжевого цвета. Его очищают дополнительно растворением в МеОН (3 мл) и осаждением эфиром, затем сушат в вакууме над Р2О5 до постоянного веса. Получают 41 мг (32%) соединения Iа
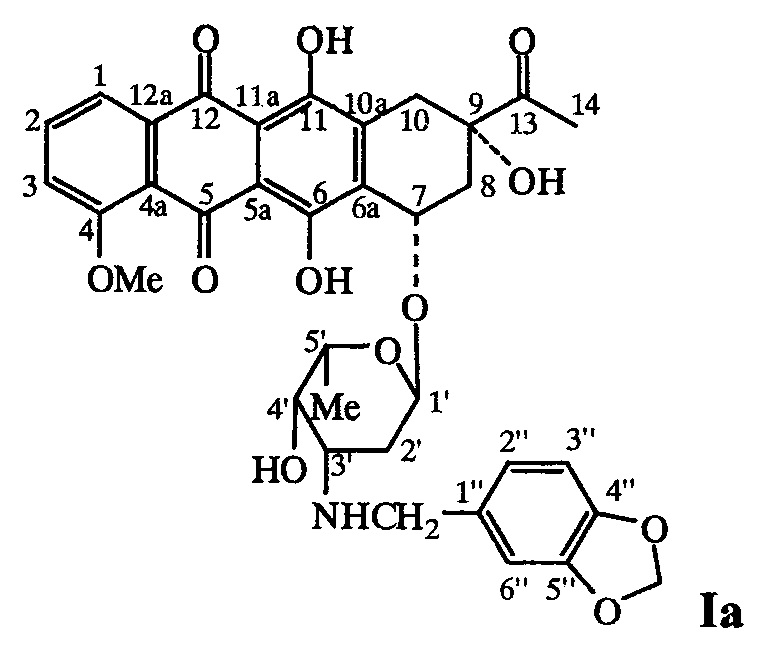
1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ, м.д.: 1,40 (д, 3Н, 3JHH=6,8 Гц, 6'-СН3); 1,67-1,71 и 1,79-1,86 (два м, 1H+1Н, 10-СН2); 2,10-2,15 и 2,38-2,41 (два м, 1H+1Н, 2'-СН2); 2,45 (с, 3Н, 14-СН3); 2,99 и 3,25 (два д, 1Н+1Н, 2JHH=18,8 Гц, 8-СН2); 3,60 и 3,73 (два д, 1Н+1Н, 2JHH=12,4 Гц, N-CH2); 3,67 (с, 1Н, 4'-Н); 4,09 (кв, 1Н, 3JHH=6,8 Гц, 5'-Н); 4,11 (с, 3Н, 4-ОСН3); 5,32 (уш. с, 1Н, 7-Н); 5,54 (уш. с, 1Н, 1'Н); 5,93 (с, 2Н, 0-СН2-О); 6,71 и 6,72 (два д, 1Н+1Н, 3JHH=8.0 Гц, 2''-Н+3''-Н); 6,78 (с, 1Н, 6''-Н); 7,41 (д, 1Н, 3JHH=8,0 Гц, 3-Н); 7,81 (т, 1H, 3JHH=8,0 Гц, 2-Н); 8,06 (д, 1Н, 3JHH=7,6 Гц, 1-Н); 13,25 (уш. с, 1Н, 11-ОН); 14,00 (уш. с, 1Н, 6-ОН). 13С ЯМР-спектр (CDCl3, 100,61 МГц), δ, м.д.: 16,96 (5'-СН3); 24,64 (14-С); 30,15 (2'-С); 33,05 (8-С); 34,68 (10-С); 50,03 (N-CH2); 52,22 (5'-С); 56,45 (7-С); 60,23 (СН3O); 66,70 (4'-С); 69,66 (9-С); 100,75 (1'-С); 100,82 (O-СН2-О); 107,98 (1-С); 108,36 (2-С); 110,94 (5а-С); 111,09 (11а-С); 118,20 (3''-С); 119,55 (2''-С); 120,55 (10а-С); 120,96 (6''-С); 133,41 (1''-С); 134,07 (4а-С); 134,21 (6а-С); 135,18 (12а-С); 135,50 (3-С); 147,48 и 147,54 (4''-С+5''-С); 155,55 (11-С); 156,20 (6-С); 160,78 (4-С); 186,29 (5-С); 186,64 (12-С); 211,71 (13-С). Вычислено для С35Н35HO12⋅3Н2O (%): С 58,74; Н 5,77; N 1,96. Найдено (%): С 58,34; Н 4,84; N 1,97.
Пример 2. Получение (8S-цис)-8-ацетил-10-{[3-(4.7-диметокси-1.3-бензодиоксол-5-илметиламино)-2,3,6-тридезокси-альфа-L-ликсогексопиранозил]окси}-7.8.9.10-тетра-гидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендиона (Ib)
В колбу, защищенную от света черной бумагой, помещают раствор 0,8 г (3,6 ммоль) 4,7-диметокси-1,3-бензодиоксол-5-карбальдегида в смеси 6 мл CH3CN и 2 мл воды, к нему прибавляют 0,1 г (0,18 ммоль) даунорубицина гидрохлорида и перемешивают 30 мин при 20°С. Затем прибавляют 0,034 г (0,53 ммоль) NaBH3CN (содержание основного вещества не менее 98%) и перемешивают при той же температуре 2 ч. Затем прибавляют 15 мл воды и 15 мл CHCl3, органический слой отделяют, водный экстрагируют CHCl3(3×15 мл). Объединенные органические экстракты промывают 30 мл воды, водный экстракт промывают CHCl3 (2×15 мл), органические экстракты объединяют и сушат Na2SO4. Растворитель удаляют на роторном испарителе, остаток очищают колоночной хроматографией на силикагеле (колонка: l 33 см, d 2 см). Сначала хлороформом элюируют избыток альдегида, затем смесью СНСl3:МеОН=50:1 элюируют целевой продукт темно-оранжевого цвета. Его очищают дополнительно растворением в МеОН (3 мл) и осаждением эфиром, затем сушат в вакууме над Р2О5 до постоянного веса. Получают 51 мг (34%) соединения Ib
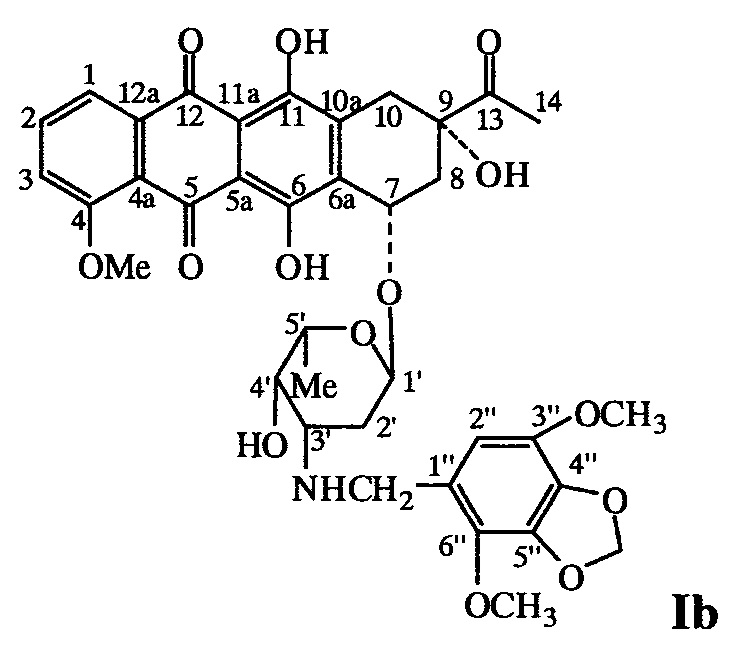
1Н ЯМР-спектр (CDCl3, 400,13 МГц), δ, м.д.: 1,42 (д, 3Н, 3JHH=8,0 Гц, 6'-СН3); 1,62-1,66 и 1,79-1,83 (два м, 1Н+1H, 10-СН2); 2,10-2,15 и 2,38-2,41 (два м, 1Н+1H, 2'-СН2); 2,45 (с, 3Н, 14-СН3); 3,00 и 3,25 (два д, 1H+1H, 2JHH=16,0 Гц, 8-СН2); 3,61 и 3,72 (два д, 1Н+1H, 2JHH=12,0 Гц, N-CH2); 3,73 (уш. с, 1Н, 4'-Н); 3,82 и 3,91 (два с, 3Н+3Н, 3''-ОСН3+6''-ОСН3); 4,09 (кв, 1Н, 3JHH=6,8 Гц, 5'-Н); 4,11 (с, 3Н, 4-ОСН3); 4,73 (уш. с, 1Н, NH); 5,33 (уш. с, 1Н, 7-Н); 5,54 (уш. с, 1Н, 1'-Н); 5,94 (с, 2Н, O-СН2-O); 6,37 (с, 1Н, 2''-Н); 7,41 (д, 1Н, 3JHH=8.0 Гц, 3-Н); 7,81 (т, 1H, 3JHH=8,0 Гц, 2-Н); 8,06 (д, 1Н, 3JHH=8,0 Гц, 1-Н); 13,25 (уш. с, 1H, 11-ОН); 14,00 (уш. с, 1Н, 6-ОН). 13С ЯМР-спектр (CDCl3, 100,61 МГц); δ, м.д.: 17,04 (5'-СН3); 24,66 (14-С); 30,19 (2'-С); 33,31 (8-С); 34,84 (10-С); 45,27 (N-CH2); 51,72 (7-С); 56,58 и 56,81 (3''-ОСН3+6''-ОСН3); 59,88 (СН3О); 66,50 (4'-С); 69,65 (9-С); 100,83 (1'-С); 101,51 (O-СН2-O); 108,52 (1-С); 111,19 (5а-С); 111,35 (11а-С); 118,28 (2-С); 119,70 (3-С); 120,90 (2''-С); 124,23 (1'-С); 134,26 (4а-С); 134,36 (6а-С); 135,49 (12а-С); 135,59 (3-С); 136,19 и 136,40 (3''-С+6''-С); 138,05 и 138,66 (4''-С+5''-С); 155,85 (11-С); 156,35 (6-С); 160,97 (4-С); 186,65 (5-С); 187,01 (12-С); 211,73 (13-С). Вычислено для С37H39NO14⋅7H2O (%): С 52,42; Н 6,30; N 1,65. Найдено (%): С 52,44; Н 5,91; N 3,00.
Биологическая активность полученных соединений
Определение острой токсичности
Острую токсичность соединений Iа и Ib оценивали по экспресс-методу Прозоровского на беспородных белых мышах массой 22-24 г [Прозоровский В.Б., Прозоровская М.П., Демченко В.М. Фармакология и токсикология, 1978, 41 (4); 497-502] при внутрибрюшинном способе введения. Результаты определения острой токсичности приведены в таблице. LD50 заявляемых соединений составляют 108,0 (73-160) мг/кг, что позволяет отнести их к 3-му классу веществ «Умеренно токсичные вещества» по классификации токсичности Сидорова [Сидоров К.К. О классификации токсичности ядов при парентеральных способах введения. - В сб.: Токсикология новых промышленных химических веществ (вып. 13). М.: Медицина, 1973, 47-51]. LD50 даунорубицина при внутрибрюшинном введении мышам составляет 1,8 мг/кг [Woodman R.J., Cysyk R.L., Kline I., Gang М., Venditti J.M. Cancer Chemother. Rep., 1975, 59 (4), 689-695]. Это означает, что данное вещество относится ко 2-му классу «Высокотоксичные вещества» по классификации токсичности Сидорова.
Определение антипролиферативных свойств
Антипролиферативные свойства заявляемых соединений Iа и Ib были определены по МТТ-тесту [Mather J.P., Roberts Р.Е. Introduction to cell and tissue culture. Theory and technique. New York: Plenum Press, 1998, 175-194]. Культуры клеток человека A549 (ATCC® CCL-185™, RD (АТСС® СС-136™) и НСТ116 (АТСС® CCL-247™) выращивали в среде DMEM (НЛП ПанЭко), а клеток MCF7 (АТСС® НТВ-22™) - в среде ЕМЕМ (НЛП ПанЭко). В ростовую среду добавляли 10% эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2 ммоль L-глутамина (НЛП ПанЭко), 1% гентамицина (ОАО Биохимик) в качестве антибиотика и инкубировали при 37°С в атмосфере 5% СO2 и 95% воздуха. Клетки сеяли в 96-луночный планшет (CELLTREAT™ в количестве 1×104 клеток/200 мкл и культивировали при 37°С во влажной атмосфере, содержащей 5% СO2. После 24 ч инкубации к культурам клеток добавляли растворы тестируемых соединений различных концентраций (от 100 до 0,0012 мкмоль/л) и далее клетки культивировали в тех же условиях в течение 72 ч. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все соединения растворяли в ДМСО (PANREAC QUIMICA S.L.U). Конечная концентрация ДМСО в лунке не превышала 0,1% и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 0,1%. После инкубации в каждую лунку добавляли 20 мкл раствора 5 мг МТТ [бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия] (Sigma-Aldrich) в 1 мл ДМСО и дополнительно инкубировали в течение 2 ч. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм, за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50%-ное ингибирование роста популяции клеток (IС50), оценивали на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0. Результаты определения концентраций заявляемых соединений, вызывающих 50%-ное ингибирование роста популяции клеток, приведены в таблице, представленной выше.
Как видно из таблицы, соединения общей формулы I обладают сочетанием относительно низкой острой токсичности (108 мг/кг) и расширенным спектром антипролиферативных свойств как в отношении опухолей мышечной ткани: рабдомиосаркомы (RD), карциномы кишечника (НСТ116), аденокарциномы молочной железы (MCF7), так и в отношении немелкоклеточного рака легкого (А549), и, следовательно, могут быть использованы для лечения онкологических заболеваний, связанных с пролиферацией опухолевых клеток.