Результат интеллектуальной деятельности: ТКАНЕИНЖЕНЕРНЫЙ БИОДЕГРАДИРУЕМЫЙ СОСУДИСТЫЙ ИМПЛАНТ
Вид РИД
Изобретение
Изобретение относится к области медицины и тканевой инженерии и может быть использовано в сердечно-сосудистой хирургии при выполнении реконструктивных операций на сосудах.
В последние годы для нужд сосудистой хирургии активно ведутся исследования, направленные на создание «готовых к использованию» тканеинженерных сосудистых графтов, способных поддерживать жизнеспособность и функции клеток в условиях организма. Использование матриксов, или так называемых подложек, из природных или синтетических полимеров уже привело к существенным успехам в тканевой инженерии кровеносных сосудов. Важной характеристикой таких подложек является пористость материала, которая способствует миграции клеток, передаче сигналов, доставке питательных веществ и удалению продуктов метаболизма. Кроме того, используемые матриксы обеспечивают механическую поддержку клеткам, формирующим ткань будущего сосуда.
На сегодняшний день наиболее перспективным является способ изготовлениясосудистых матриксов методом электроформования (электроспиннинг) из биосовместимых биорезорбируемых полимерных композиций. Электроспиннинг позволяет получить нановолокна из самых различных материалов (полимеров, композитов, полупроводников, металлов и даже керамики), формируя высокопористые сосудистые графты разного диаметра и с различными прочностными характеристиками [Hasan A, Memic A, Annabi N et al. Electrospun scaffolds for tissue engineering of vascular grafts. Acta Biomater.; 10, 11-25 (2014)].
Известно, что полноценный тканеинженерный кровеносный сосуд должен состоять из трех слоев: функционального эндотелия; меди, образованной гладкомышечными клетками; а также адвентиции, сформированной фибробластами. При этом стимуляторами образования новых тканей в полимерном каркасе являются биологически активные молекулы. В тканевой инженерии кровеносных сосудов нашли свое применение ростовые факторы, оказывающие влияние на функции фибробластов, а также эндотелиальных и гладкомышечных клеток. Ростовые факторы способны регулировать миграцию клеток, их пролиферацию, дифференцировку, апоптоз и дедифференцировку. [Briggs Т., Arinzeh T.L. Growth factor delivery from electrospun materials // J. Biomater. Tissue Eng. - 2011. - Vol. 1, №2. - P. 129-138.].
Однако ростовые факторы нестабильны и имеют короткий период полураспада в результате протеолитической деградации, что делает неэффективным их введение в системный кровоток и приводит к необходимости осуществления доставки в место регенерации тканей.
Известен синтетический сосудистый протез, содержащий биологически активные молекулы и белки внеклеточного матрикса, при этом в качестве структурообразующих полимеров предложено использовать полимолочную кислоту, сополимер полимолочной и полигликоевой кислоты, поликапролактон и их смеси (Appl. US 2010/0125330 A1: Int. Cl. A61F 2/82, B05D 7/00. Synthetic vascular prosthesis and method of preparation / Bronislava G. Belenkaya (US); Edward C. Kwok (US); appl. no. 12/620403, filed 11.17.2009; pub. date 20.05.2010.). При выполнении электроспиннинга в полимерную конструкцию инкорпорируют, по меньшей мере, один дополнительный ингредиент, которыми могут быть любые сосудистые факторы роста, такие как: TGF 1, PDGF-BB и VEGF, любой природный компонент внеклеточного матрикса, а именно белки для клеточной адгезии, протеогликаны, гиалуроновую кислоту или пептиды, содержащие аминокислотную последовательность, которая стимулирует клеточную адгезию (например, RGD).
Недостатком данного технического решения является методика изготовления протеза, при которой отсутствует послойное избирательное введение в состав полимерных матриксов биологически активных компонент (ростовых факторов и белков внеклеточного матрикса), что препятствует дифференцированному привлечению клеток предшественников в толщу стенки полимерной конструкции для последующего моделирования сосудистой стенки, по строению близкой к естественной.
Известен сосудистый графт, изготовленный из биорезорбируемых полимерных композиций с инкорпорированными биологически активными молекуами, в толщу стенки матрикса (PCT/US 2009/030407; Int. О. A61L 27/14, A61F 2/06. Compositions and methods for promoting patency of vascular grafts / Breuer Chistopher (US), Kryiakides Themis (US), Ron J ason (US);assign Yale University (US) Fil. 08.01.2008; Pub. Date 16.07.2009). В качестве основных полимеров используют полимолочную и полигликолевую кислоты, полиуретаны, поликапролактон, полигидроксиалканоаты, полиангидриды и их комбинации, смеси или их сополимеры. Для обеспечения ремоделирования тканей на месте полимерных сосудистых трансплантатов предложено использовать цитокины и хемокины, способствующие привлечению клеток в зону имплантации из кровотока или окружающих тканей. К ним отнесли моноцитарный хемоаттрактантный протеин МСР-1, IL-1β и гранулоцитарный колониестимулирующий фактор G-CSF. При этом выбранные цитокины предварительно заключали в микросферы либо капсулы и местно вводили в сосудистый трансплантат.
Недостатком предлагаемого подхода является методика инкорпорировнаия биологически активных компонент в состав графта - метод дисперсии, который не способен обеспечить длительный и равномерный выход данных веществ в зону локации графта во времени. Помимо этого, использование МСР-1, IL-1β, которые являются провоспалительными агентами, может спровоцировать излишнее привлечение к сосудистому графту моноцитарно-макрофагальной фракции, способной стимулировать развитие местной воспалительной реакции и гиперплазии неоинтимы. Гранулоцитарный колониестимулирующий фактор роста G-CSF стимулирует пролиферацию и дифференцировку поздних клеток-предшественников в нейтрофилы, которые не только не способны сформировать на месте полимерного каркаса ткань de novo, близкую по строению к естественной ткани сосудистой стенки, но и могут стимулировать развитие местной воспалительной реакции в зоне локации графта.
Наиболее близким к заявляемому техническому решению, является двухслойный биодеградируемый сосудистый графт, изготавливаемый методом электроспиннига и введением в полимерный каркас биологически активных веществ (Appl. US 2014/0309726 А1: Int. CI. A61F 2/06, A61L 27/20, A61L 27/54, A61L 27/50. Biodegradable vascular grafts / Yadong Wang (US); appl. no. 14/6365987, filed 16.06.2014; pub. date 16.10.2014.). Представленный сосудистый трансплантат содержит внутренний слой, выполненный из биоразлагаемого полиэфирного соединения - полиглицеролсебаката (PGS), и наружную оболочку, выполненную из поликапролактона (PCL) и/или полимеров или сополимеров гликоевой и молочной кислоты. Для снижения тромбогенных свойств импланта и повышения его биосовместимости, внутреннюю поверхность графта покрывают гепарином, а наружную оболочку пропитывают любыми биологически активными компонентами, способствующими регенерации тканей (фактор роста стволовых клеток (SCF), сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста (TGF), фактор роста фибробластов (FGF), эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), колониестимулирующий фактор (CSF), инсулинзависимый фактор роста (IGF), хемоаттрактантную молекулу (SDF), белки внеклеточного матрикса - коллаген, эластин, фибронектин, ламинин и др.).
Недостатком способа является отсутствие избирательности введения во внешнюю оболочку биологически активных компонент и белков внеклеточного матрикса. Целесообразность использования предлагаемого изобилия ростовых факторов и белков внеклеточного матрикса сомнительна, так как может привести к неконтролируемой регенерации тканей на месте биодеградируемого сосудистого графта и, как следствие, нежелательным морфологическим проявлениям (несоответствие вновь образованной на фоне подобной стимуляции ткани нормальному морфологическому строению сосудистой стенки, гиперплазия новообразованной ткани с нарушением проходимости сосудистого графта и прочее). Также отсутствует обоснование дозы вводимых веществ, что является очень важным аспектом при стимуляции роста новых тканей и их формировании.
Техническим результатом изобретения является создание биодеградируемого полимерного тканеинженерного сосудистого графта, соответствующего послойному строению стенки сосуда живого организма с сохранением функциональной активности биологически активных компонент до заданного срока деградации полимерного матрикса.
Технический результат достигается, за счет дифференцированного и послойного инкорпорирования биологически активных молекул в заданной концентрации при изготовлении пористого сосудистого импланта методом электроспиннинга.
С учетом механизмов ангиогенеза и стимулирующего влияния ростовых факторов на определенные клетки-предшественники, были выбраны наиболее эффективные комбинации биологически активных компонент [Lee К., Silva Е.А., Mooney D.J. Growth factor delivery-based tissue engineering: general approaches and a review of recent developments // J. R. Soc. Interface. - 2011. - №8. - P. 153-170.]. Так, для стимуляции эндотелизации графтов использовали сосудистый эндотелиальный фактор роста (VEGF), который выступает главным регулятором развития сосудов в эмбриогенезе (васкулогенезе), а также их формирования во взрослом организме (ангиогенезе). Являясь хемоаттрактантом для эндотелиальных прогениторных клеток VEGF, привлекает их из кровотока для воссоздания монослоя эндотелиальных клеток на внутренней поверхности биодеградитуемых сосудистых имплантов. При этом необходимость инкорпорировать VEGF по всей толще стенки графта отсутствует.
Основной фактор роста фибробластов (bFGF) оказывает влияние на широкий спектр клеток и тканей. Он является митогеном для фибробластов, в результате чего играет значимую роль в процессах ремоделирования тканей и регенерации. Ангиогенная функция bFGF заключается в способности стимулировать покоящиеся эндотелиальные клетки, вызывая их пролиферацию и организацию в трубчатые структуры [Yun Y.-R. Fibroblast growth factors: biology, function, and application for tissue regeneration // J. Tissue Eng. - 2010. - Vol. 2010. - 218142.]. Кроме того, bFGF стимулирует пролиферацию гладкомышечных клеток стенки кровеносного сосуда и способствует их выживанию [Капо M.R. VEGF-A and FGF-2 synergistically promote neoangiogenesis through enhancement of endogenous PDGF-B-PDGFR signaling // Journal of Cell Science. - 2005. - №118. - P. 3759-3768.].
SDF-1 не является ростовым фактором, однако данная хемоаттрактантная молекула обладает выраженной ангиогенной активностью и способствует привлечению в стенку будущего сосуда клеток-предшественников мезенхимального происхождения (ММСК). Изоформы SDF-1α и SDF-1β препятствуют апоптозу эндотелиальных клеток, стимулируют их пролиферацию и формирование капиллярной трубки.
Таким образом, две последние биомолекулы способны помочь миграции в толщу стенки графта и пролиферации в ней фибробластов и ММСК - клеток, формирующих новую ткань на месте биорезорбируемого трубчатого каркаса.
С учетом особенностей влияния на различные типы клеток VEGF, bFGF и хемоаттрактантной молекулы SDF-1a нами разработаны оригинальные технологии совокупного инкорпорирования данных биомолекул в состав полимерной композиции.
В качестве полимеров для изготовления тканеинженерного матрикса использовали смесь полигидроксибутирата-валерата (PHBV) и поликапролактона (PCL) в соотношении 1:2, растворенную в хлороформе до получения 5% концентрации PHBV и 10% PCL.
Предварительное введение в раствор биодеградируемого полимера ростовых факторов позволяет инкапсулировать их в полимерное волокно и изолировать от окружающей среды. В таком случае выход ростовых факторов из такого вида матриксов осуществляется в процессе пассивной диффузии из пор, пронизывающих волокно, а также в результате биодеградации полимера.
Разведение биологически активных компонент (VEGF, bFGF, SDF-1a) осуществляли физиологическим раствором (0,9% Na Cl) или фосфатно-солевым буфером. При этом итоговая концентрация VEGF, bFGF и SDF-1a составила от 12,5 до 500 нг на 1 мл полимерного раствора, что соответствует эффективному влиянию биологически активных молекул при сроке биорезорбции полимерных волокон до 3 лет. Выбор данной концентрации также обусловлен необходимостью скорейшей стимуляции клеточной миграции и пролиферации в зоне локации сосудистых графтов с учетом снижения репаративных функций человеческого организма с возрастом, особенно на фоне имеющихся хронических заболеваний.
Полученные растворы полимера в органическом растворителе и водного раствора биомолекул смешивали до получения суспензии. Находясь в полярном растворителе - воде или фосфатном буфере, молекулы ростового фактора не контактируют с неполярным растворителем и, следовательно, не подвергаются денатурации.
Двухфазный электроспиннинг проводили при следующем режиме: напряжение на игле - от 15 до 23 kV, скорость подачи раствора полимера - от 0,3 до 1 мл/ч, скорость вращения коллектора - от 100-250 rpm, расстояние от иглы до намоточного коллектора - 15 см, размер иглы - от 22 до 27G. При выбранном режиме формировались полноценные волокна полимера диаметром до 500 нм наряду с формированием нитей микронного размера.
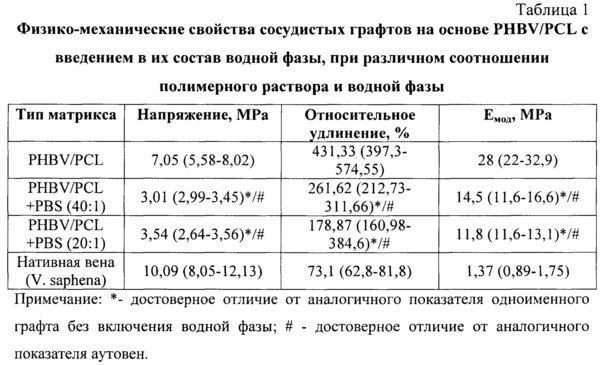
Отмечено, что введение в состав полимерных матриксов водной фазы снижало прочность и относительное удлинение графта, но при этом уменьшалась и жесткость изделия. Достоверной разницы в изменении физико-механических свойств сосудистого импланта при использовании долевого соотношения полимерного раствора и водной фазы, содержащей 1 или несколько дифференцировочных факторов, в диапазоне от 20:1 до 40:1 не выявлено, что позволило использовать данные разведения полимера при изготовлении графта (таблица 1).
Способ осуществляют следующим образом. Предварительно подготавливают 2 вида смесей полимерного раствора на хлороформе с биомолекулами в соотношении 20-40:1.
При этом смесь №1 включает от 20 до 40 частей раствора PGBV/PCL в хлороформе и 1 часть VEGF в фосфатно-солевом буфере или 0,9% растворе NaCl в концентрации от 1 до 20 мкг на 1 мл водного раствора, что эквивалентно итоговой концентрации от 12,5 до 500 нг на 1 мл полимерного раствора;
Смесь №2 состоит из 20-40 частей раствора полимера в хлороформе и 1 части водной композиции, содержащей смесь bFGF и SDF-1a от 1 до 20 мкг каждого дифференцировочного фактора на 1 мл водного раствора, что эквивалентно итоговой концентрации от 12,5 до 500 нг каждого дифференцировочного фактора на 1 мл полимерного раствора в зависимости от используемого соотношения раствора ростовых факторов с полимерным раствором.
После подготовки смесей выполняют электроформование сосудистого импланта с использованием смеси №1 в течение 1/3 от общего времени изготовления графта, а оставшиеся 2/3 времени выполняют двухфазный электроспиннинг со смесью №2.
Преимуществами предлагаемого метода инкорпорирования дифференцировочных факторов в состав биодеградируемого сосудистого импланта является не только учет специфичности действия инкорпорируемых биоактивных молекул в разрезе послойного формирования будущей сосудистой стенки на базе временного биодеградируемого трубчатого каркаса, но и достаточная концентрация VEGF, bFGF и SDF-1a, которая позволит сохранить функциональную активность конечного изделия после его имплантации в организм, несмотря на длительные сроки биорезорбции (до 3 лет).
Ниже приведены примеры реализации предложенного способа.
Пример 1. Для инкорпорирования VEGF на внутреннюю поверхность биодеградируемого сосудистого графта, приготавливают смесь 1, для чего выполняют навеску сухих полимеров на основе полигидроксибутирата-валерата (PHBV) и поликапролактона (PCL) из расчета 0,5 г PHBV (с включением оксивалериата 8%) и 1,0 г PCL, в качестве растворителя вводят 10,0 мл хлороформа. Для приготовления водного раствора VEGF 20 мкг ростового фактора разводят в 0,5 мл физиологического раствора (0,9% NaCl) и добавляют к готовому полимерному раствору PHBV/PCL. Получаем соотношение раствора полимера к водной фазе 20:1. Перемешивание ингредиентов выполняют на магнитной мешалке. Итоговая концентрация VEGF на 1 мл полученного полимерного раствора составляет 500 нг.
Одновременно подготавливают смесь 2, предназначенную для инкорпорирования bFGF и SDF-1α. Вновь предварительно готовится 10,0 мл полимерного PHBV/PCL раствора (описание выше). Для водного раствора, содержащего bFGF и SDF-1α, берется по 20 мкг каждого дифференцировочного фактора и вносится в 0,5 мл физиологического раствора (0,9% NaCl). Затем два приготовленных раствора (смесь 1 и смесь 2) смешивают на магнитной мешалке. Полученное соотношение раствора полимера к водной фазе составит 20:1. Итоговые концентрации bFGF и SDF-1α на 1 мл полученного полимерного раствора составляют 500 нг.
Процесс двухфазного электроспиннинга осуществляют в следующем порядке:
Сначала 1/3 от всего времени изготовления сосудистого графта малого диаметра (1 час) электроспиннинг осуществляют, используя смесь 1, в следующем режиме: напряжение на игле - 23 kV, скорость подачи раствора полимера - 0,3 мл/ч, скорость вращения коллектора - 200 rpm, расстояние от иглы до намоточного коллектора - 15 см, размер иглы - 27G.
После чего 2/3 от всего времени изготовления сосудистого графта малого диаметра (2 часа) электроспиннинг осуществляют, используя смесь 2, в следующем режиме: напряжение на игле - 23 kV, скорость подачи раствора полимера - 0,3 мл/ч, скорость вращения коллектора - 200 rpm, расстояние от иглы до намоточного коллектора - 15 см, размер иглы - 27G.
Пример 2. Для инкорпорирования VEGF на внутреннюю поверхность биодеградируемого сосудистого графта, приготавливают смесь 1, для чего выполняют навеску сухих полимеров на основе полигидроксибутирата-валерата (PHBV) и поликапролактона (PCL) из расчета 1,0 г PHBV (с включением оксивалериата 8%) и 2,0 г PCL, в качестве растворителя вводят 20,0 мл хлороформа. Для приготовления водного раствора VEGF 10 мкг ростового фактора разводят в 0,5 мл физиологического раствора (0,9% NaCl) и добавляют к готовому полимерному раствору PHBV/PCL. Получаем соотношение раствора полимера к водной фазе 40:1. Перемешивание ингредиентов выполняют на магнитной мешалке. Итоговая концентрация VEGF на 1 мл полученного полимерного раствора составляет 125 нг.
Одновременно подготавливают смесь 2, предназначенную для инкорпорирования bFGF и SDF-1α. Вновь предварительно готовится 20,0 мл полимерного PHBV/PCL раствора (описание выше). Для водного раствора, содержащего bFGF и SDF-1α, берется по 10 мкг каждого дифференцировочного фактора и вносится в 0,5 мл физиологического раствора (0,9% NaCl). Затем два приготовленных раствора (смесь 1 и смесь 2) смешивают на магнитной мешалке. Полученное соотношение раствора полимера к водной фазе составит 40:1. Итоговые концентрации bFGF и SDF-1α на 1 мл полученного полимерного раствора составляют 125 нг.
Процесс двухфазного электроспиннинга осуществляют в следующем порядке:
Сначала 1/3 от всего времени изготовления сосудистого графта малого диаметра (1 час) электроспиннинг осуществляют, используя смесь 1, в следующем режиме: напряжение на игле - 23 kV, скорость подачи раствора полимера - 0,3 мл/ч, скорость вращения коллектора - 200 rpm, расстояние от иглы до намоточного коллектора - 15 см, размер иглы - 27G.
После чего 2/3 от всего времени изготовления сосудистого графта малого диаметра (2 часа) электроспиннинг осуществляют, используя смесь 2, в следующем режиме: напряжение на игле - 23 kV, скорость подачи раствора полимера - 0,3 мл/ч, скорость вращения коллектора - 200 rpm, расстояние от иглы до намоточного коллектора - 15 см, размер иглы - 27G.
Таким образом, полученный сосудистый графт имеет пористую структуру стенки и состоит из двух взаимосвязанных слоев (внутреннего и наружного), каждый из которых содержит соответствующие компоненты, необходимые для полноценной регенерации тканей на месте временного биорезорбирумого трубчатого каркаса и формирования собственного сосуда.
В экспериментах in vivo (околосердечная имплантация полимерных матриксов на основе PHBV/PCL, PHBV/PCL + VEGF, PHBV/PCL + SFD-1a, PHBV/PCL + bFGF сроком на 3 месяца) было выявлено, что имплантация пустых и биофункционализированных полимерных матриксов не вызывала местной воспалительной реакции. Через 3 месяца имплантации в матриксах с VEGF и прилежащих к ним тканях отмечали активный неоангиогенез. Толща PHBV/PCL + bFGF - матриксов была значительно заселена фибробластами и окружена наиболее выраженной соединительнотканной капсулой. В матриксах с инкорпорированным SDF-la наблюдали активную инфильтрацию клетками, синтезирующими внеклеточный матрикс, и неоангиогенез с образованием более крупных кровеносных сосудов относительно всех исследуемых образцов. Таким образом, инкорпорированные молекулы после высвобождения из матрикса проявляли биологическую активность в окружающих тканях в течение всего эксперимента.
Полученные результаты подтверждают биологическую активность инкорпорируемых молекул, в состав биодеградируемого графта для послойного формирования in situ (на месте) ткани de novo (новообразованной).

