Результат интеллектуальной деятельности: ЛИНИИ ТРАНСГЕННОЙ СОИ, ГЕНЕТИЧЕСКОЕ СОБЫТИЕ 8264.42.32.1, УСТОЙЧИВОЕ К ГЕРБИЦИДАМ С ПАКЕТИРОВАННЫМИ ГЕНАМИ НА ЕГО ОСНОВЕ, И ИХ ДЕТЕКТИРОВАНИЕ
Вид РИД
Изобретение
Перекрестные ссылки на родственные заявки
В настоящей заявке, в соответствии со ст. 35 Кодекса законов США, §119(е), испрашивается преимущество предварительной заявки рег. № 61/507444, поданной 13 июля 2011, и заявки 61/515634, поданной 5 августа, 2011. Эти заявки во всей своей полноте и во всех целях вводятся в настоящее описание посредством ссылки.
Предшествующий уровень техники
Глифосат (N-фосфонометилглицин), гербицид широкого спектра действия, ингибирует 5-енолпирувилшикимат-3-фосфат-синтазу (EPSPS), то есть фермент пути метаболизма шикимовой кислоты, под действием которого в клетках растений продуцируются незаменимые ароматические аминокислоты. Ингибирование EPSPS является эффективным способом нарушения синтеза белков, и тем самым, уничтожения пораженных клеток растений. Поскольку глифосат не обладает селективностью по отношению к клеткам растений, то он уничтожает как сорняки, так и культурные растения. Таким образом, он может быть использован в сельскохозяйственном производстве только в том случае, если культурные растения будут подвергнуты модификации, сообщающей им резистентность к глифосату, что будет обеспечивать выживание нужных растений после их обработки глифосатом.
Для выделения мутантных EPSP-синтаз, которые являются резистентными к глифосату, была применена технология рекомбинантных ДНК. Такие резистентные к глифосату мутантные EPSP-синтазы могут быть введены в растения и могут сообщать трансформированным растениям резистентность к глифосату. Так, например, ген резистентности к глифосату был выделен из штамма CP4 Agrobacterium, как описано в патенте США No. 5633435. Эта работа и все цитируемые там работы вводятся в настоящее описание посредством ссылки.
Другие гены устойчивости к глифосату были сконструированы путем внесения мутаций. Такими генами являются ген AroA, выделенный Comai и описанный в патентах США №№ 5094945, 4769061 и 4535060. Был использован мутант с одной мутацией, описанный в патенте США № 5310667 и полученный путем замены глицинового остатка аланиновым остатком в положениях аминокислот 80-120. Двойные мутанты были описаны в патентах США №№ 6225114 и 5866775, где в ген EPSPS дикого типа, помимо вышеуказанной мутации, была введена вторая мутация (замена аланинового остатка треониновым остатком в положениях 170-210).
В других работах, резистентная к глифосату кукуруза была получена путем введения модифицированного гена EPSPS кукурузы, несущего мутации в положении остатка 102 (замену треонина на изолейцин) и остатка 106 (замену пролина на серин) в аминокислотной последовательности, кодируемой последовательностью, имеющейся в GenBank под рег. №. X63374. См., патенты США №№ 6566587 и 6040497.
Примерами генетических событий, сообщающих резистентность к глифосату у сои, являются генетические события сои GTS 40-3-2 (Padgette et al. 1995) и генетические события сои MON89788 (патенты США № 7608761).
За последние годы, широкое применение технологии выращивания резистентных к глифосату сельскохозяйственных культур и почти повсевместное применение глифосата привели к появлению большого количества резистентных к глифосату сорняков, которые плохо поддаются уничтожению. В регионах, в которых фермеры сталкиваются с резистентными к глифосату сорняками или с сорняками других видов, которые еще труднее поддаются уничтожению, такой недостаточный спектр гербицидного действия глифосата может быть компенсирован путем резервуарного смешивания или чередования применения глифосата с другими гербицидами, которые будут уничтожать сорняки, не входящие в спектр действия гербицидов.
Гербицид, 2,4-дихлорфеноксиуксусная кислота (2,4-D), может быть использован в комбинации с глифосатом для борьбы с более широким рядом широколистных или двудольных сорняков, которые могут приобретать устойчивость или резистентность к глифосату. 2,4-D, которая используется в качестве гербицида уже в течение более 60 лет и обеспечивает послевсходовое уничтожение однолетних, двулетних и многолетних широколистных сорняков широкого ряда. Что касается кукурузы, сои и хлопчатника, то 2,4-D (при норме введения 560-1120 г экв. кислоты/га (г э.к./га)) уничтожает главные сорняки этих культур, включая: Ambrosia artemisiifolia, Ambrosia triflda, Xanthium strumarium, Chenopodium album, Helianthus annuus, Ipomoea sp., Abutilon theophrasti, Conyza Canadensis и Senna obtusifolia. 2,4-D обеспечивает частичное уничтожение некоторых широко распространенных сорняков, включая Polygonum pensylvanicum, Polygonum persicaria, Cirsium arvense, Taraxacum officinale и Amaranthus sp., включая Amaranthus rudis, и Amaranthus palmeri.
Ограничение по дальнейшему применению 2,4-D заключается в том, что ее селективность к двудольным культурам, таким как соя или хлопчатник является очень низкой, а поэтому 2,4-D обычно не применяют к чувствительным двудольным культурам (и даже поблизости от этих культур). Кроме того, применение 2,4-D к пастбищным культурам до некоторой степени ограничено природой возможного повреждения этих культур. 2,4-D в комбинации с глифосатом была использована для обеспечения более тщательного выжигания пастбищной травы перед посевом культур сои и хлопчатника, высаживаемых на непахотные земли; однако, из-за чувствительности этих двудольных растений к 2,4-D, такое выжигание может быть осуществлено, главным образом, по меньшей мере за 14-30 дней до посева (Agriliance, 2005).
Одним микроорганизмом, который был широко исследован на его способность разлагать 2,4-D, является Ralstonia eutropha, содержащий ген, tfdA, который кодирует фермент (TfdA), катализирующий первую стадию пути минерализации. (См., патенты США № 6153401 и GENBANK Acc. No. M16730). TfdA катализирует превращение 2,4-D-кислоты в дихлорфенол (DCP) посредством диоксигеназной реакции, зависящей от α-кетоглутарата (Smejkal et al, 2001). DCP обладает более низкой гербицидной активностью по сравнению с 2,4-D. tfdA был использован в трансгенных растениях для сообщения резистентности к 2,4-D у двудольных растений (например, у хлопчатника и табака), которые, по своей природе, являются восприимчивыми к 2,4-D (Streber et al. (1989), Lyon et al. (1989), Lyon (1993) и в патенте США No. 5608147).
Ряд генов типа tfdA, которые кодируют белки, способные разлагать 2,4-D, были выделены из соответствующей среды и депонированы в базе данных Genbank. Многие гомологи являются аналогичными TfdA (то есть, имеют >85%-ную идентичность аминокислот) и обладают ферментативными свойствами, аналогичными ферментативным свойствам TfdA. Однако, существует ряд гомологов, которые значительно менее идентичны TfdA (25-50%), но при этом, имеют характерные остатки, ассоциированные с остатками α-кетоглутарат-Fe (II)-диоксигеназ. Следовательно, специфичность дивергентных белков TfdA к субстрату пока не обнаруживалась.
Примером 2,4-D-расщепляющего гена с низкой гомологией (<35%) к tfdA является ген aad-12, происходящий от Delftia acidovorans (Schleinitz et al. (2004) and Westendorf et al. (2002). Ген aad-12 кодирует S-энантиомер-специфическую α-кетоглутарат-зависимую диоксигеназу, которая была использована в растениях для сообщения им устойчивости к некоторым феноксиауксиновым гербицидам, включая, но не ограничиваясь ими, феноксиалканоатные гербициды (например, гербициды на основе феноксиуксусной кислоты, такие как 2,4-D и MCPA; и гербициды на основе феноксибутановой кислоты, такие как 2,4-DB и MCPB) и гербициды на основе пиридилоксиалкановой кислоты (например, гербициды на основе пиридилоксиуксусной кислоты, такие как триклопир и флуроксипир), а также кислотные, солевые или сложноэфирные формы активного(ых) ингредиента(ов). (см., например, WO 2007/053482).
Глюфозинат-аммоний («глюфозинат») представляет собой несистемный и неселективный гербицид, принадлежащий к классу фосфинотрицинов. L-фосфинотрицин, то есть, активный ингредиент глюфозината, используется, главным образом, для послевсходового уничтожения широколистных и травянистых сорняков, а именно, посредством необратимого ингибирования глутамин-синтазы, то есть,фермента, необходимого для детоксификации аммиака в растениях. Глюфозинатные гербициды являются коммерчески доступными и имеются в продаже под торговыми знаками IGNITE® и LIBERTY®.
Фермент фосфинотрицин-N-ацетилтрансфераза (PAT), выделенная из почвенных бактерий Streptomyces viridochromogenes, катализирует превращение L-фосфинотрицина в его неактивную форму посредством ацетилирования. Оптимизированная для растения форма гена, экспрессирующего PAT, была использована в растениях сои для сообщения им устойчивости к глюфозинатному гербициду. Одним из таких примеров растений сои, резистентных к глюфозинату, являются трансгенная соя генетического события A5547-127. Совсем недавно, применение глюфозинатного гербицида к растениям с признаками устойчивости к глюфозинату было предложено как неселективный метод эффективной борьбы с сорняками, резистентными к ALS и глифосату.
Экспрессия гетерологичных или чужеродных генов в растениях зависит от того, встраивается ли этот чужеродный ген в хромосому. Это может быть обусловлено, например, хроматиновой структурой (например, гетерохроматином) или непосредственной близостью элементов регуляции транскрипции (например, энхансеров) к сайту интеграции (Weising et al., Ann. Rev. Genet 22:421-477, 1988). Тот же самый ген в том же самом трансгенном растении (или в другом организме) может обнаруживать широкую вариабельность в уровнях экспрессии у различных генетических событий. Также могут наблюдаться различия в пространственных или временных профилях экспрессии. Так, например, различия в относительных уровнях экспрессии трансгена в различных тканях растений могут не соответствовать профилям, ожидаемым для данных элементов регуляции транскрипции, присутствующих во введенной генной конструкции.
Таким образом, для идентификации генетических событий в линии, которая экспрессирует введенный представляющий интерес ген, часто создают и скринируют большое число мутаций до тех пор, пока не будет достигнут уровень экспрессии, удовлетворяющий определенным требованиям. Для коммерческих целей, обычно создается от ста до тысячи различных модификаций, и эти модификации скринируют для выявления одной модификации, которая будет сообщать желаемые уровни и профили экспрессии трансгенов. Генетическое событие, которое дает нужные уровни и/или профили экспрессии трансгенов может быть использовано для интрогрессии трансгена в другую генетическую среду посредством полового ауткроссинга с использованием стандартных методов скрещивания. В потомстве таких кроссов сохраняется характер экспрессии трансгена, присущие исходному трансформанту. Такая стратегия применяется для обеспечения надежной экспрессии генов у ряда сортов, которые хорошо адаптированы для их культивирования в условиях данной местности.
Краткое описание сущности изобретения
Настоящее изобретение относится, в частности, к эффективным способам борьбы с вырабатыванием резистентности у сорняков, которые обеспечивают возможность эффективного применения технологии сообщения культурным растениям устойчивости к гербицидам. Настоящее изобретение также предлагает фермерам широкий выбор универсальных и адаптивных средств борьбы с сорняками.
Более конкретно, настоящее изобретение, в частности, относится к генетическому событию сои (Glycine max), обозначенному pDAB8264.42.32.1 («pDAB8264.42.32.1-генетическое событие сои»), репрезентативные семена которой и семена ее потомства депонированы в Американской коллекции типовых культур (ATCC) под рег. No. PTA-1 1993. Настоящее изобретение включает растения сои, содержащие генетическое событие pDAB8264.42.32.1 (и включает растения сои, содержащие трансгенную вставку между последовательностями SEQ ID NO:1 и SEQ ID NO:2).
Трансгенная вставка, присутствующая в рассматриваемом генетически модифицированном растении и в его депонированных семенах, включает три гена устойчивости к гербицидам: aad-12, 2mEpsps и pat. Ген aad-12, происходящий от Delftia acidovorans, кодирует белок арилоксиалканоат-диоксигеназу (AAD-12), которая сообщает устойчивость, например, к таким гербицидам, как 2,4-дихлорфеноксиуксусная кислота и пиридилоксиацетат. Ген 2mepsps, модифицированная последовательность EPSPS, выделенная из кукурузы, продуцирует белок, сообщающий устойчивость к гербицидам, таким как глифосат. Ген pat, выделенный из почвенных бактерий Streptomyces viridochromogenes, сообщает устойчивость к гербициду глюфозинату.
В других своих аспектах, настоящее изобретение включает растения потомства, соевые бобы, семена и/или регенерируемые части растений и семян, и потомство, содержащее генетическое событие pDAB8264.42.32.1, а также полученные из них пищевые или кормовые продукты. Настоящее изобретение также включает части генетического события pDAB8264.42.32.1, которыми являются, но не ограничиваются ими, пыльца, овули, цветки, побеги, корни, листья, ядра вегетативных клеток, клетки пыльцы и другие клетки растений, содержащие генетическое событие pDAB8264.42.32.1. Настоящее изобретение также относится к растениям сои, обладающим устойчивостью к множеству гербицидов, включая феноксиауксиновые и/или арилоксиалканоатные гербициды, глифосат и/или глюфозинат. Такие растения сои могут также включать гены, которые сообщают устойчивость к различным другим неселективным и селективным гербицидам, включая, но не ограничиваясь ими, гербициды дикамбу, имидазолинон и HPPD. Настоящее изобретение также включает новые генетические композиции, содержащие генетическое событие pDAB8264.42.32.1, и показатели агрономической продуктивности растений сои, содержащих генетическое событие pDAB8264.42.32.1.
Настоящее изобретение, в частности, относится к скрещиванию растений и к растениям, устойчивым к гербицидам. Настоящее изобретение включает новое генетическое событие в растениях сои, содержащее описанный здесь полинуклеотид, встроенный в специфический сайт генома клетки сои.
В некоторых вариантах изобретения, указанный трансген/полинуклеотид может быть «сцеплен» с другими признаками, включая, например, агрономические признаки и/или белки, уничтожающие насекомых. Однако настоящее изобретение включает растения, имеющие одну описанную здесь генную модификацию.
Дополнительные признаки могут быть введены в геном растения или в локус, такой как генетическое событие pDAB8264.42.32.1, например, посредством скрещивания растений, повторной трансформации трансгенного растения, содержащего генетическое событие pDAB8264.42.32.1, или добавления новых признаков благодаря направленной интеграции посредством гомологичной рекомбинации.
Другие варианты осуществления изобретения включают вырезание части трансгенной вставки и/или фланкирующих последовательностей генетического события pDAB8264.42.32.1, или всех указанных вставок и/или последовательностей. После вырезания, в специфический хромосомный сайт генетического события pDAB8264.42.32.1 может быть введена другая и/или дополнительная вставка. Таким образом, эта репрезентативная вставка может быть, заменена репрезентативной вставкой рассматриваемого генетически модифицированного растения сои, либо эта репрезентативная вставка может быть сцеплена с другой(ими) вставкой(ами).
В одном из своих вариантов настоящее изобретение охватывает хромосомный сайт-мишень сои, локализованный на хромосоме 15. В некоторых вариантах изобретения, этот сайт-мишень включает гетерологичную нуклеиновую кислоту. В некоторых вариантах изобретения, этот хромосомный сайт-мишень сои локализован между фланкирующими последовательностями, представленными в SEQ ID NO:1 и SEQ ID NO:2.
В одном из своих вариантов, настоящее изобретение охватывает способ возделывания трансгенного растения сои, где указанный способ включает встраивание гетерологичной нуклеиновой кислоты в определенное положение хромосомы 15. В другом варианте изобретения, гетерологичную нуклеиновую кислоту встраивают в хромосому 15 в положение, находящееся поблизости от различных описанных здесь репрезентативных полинуклеотидных сегментов или между этими сегментами.
Кроме того, настоящее изобретение относится к анализам на присутствие рассматриваемом генетическом событии в образце (например, в растении сои). Эти анализы основаны на определении последовательности ДНК рекомбинантной конструкции, встроенной в геном сои, и геномных последовательностей, фланкирующих инсерционный сайт. Настоящее изобретение также относится к наборам и к условиям проведения этих анализов.
Таким образом, настоящее изобретение относится, в частности, к клонированию и к анализу последовательностей ДНК целой репрезентативной вставки и ее граничных областей (в линиях трансгенной сои). Эти последовательности являются уникальными. На основе этих последовательностей вставок и граничных областей (и областей стыка) могут быть и были созданы праймеры, специфичные к такому генетическому событию. ПЦР-анализ показал, что эти указанные генетические модификации могут быть идентифицированы путем оценки ПЦР-ампликонов, сконструированных с использованием наборов праймеров, специфичных к такой модификации. Таким образом, эти и другие родственные методы могут быть применены для уникальной идентификации линий сои, содержащих генетическое событие согласно изобретению.
Настоящее изобретение также, в частности, относится к РЦР-анализам TAQMAN, конечной целью которых является детектирование генетического события 8264.42.32.1. Некоторые варианты изобретения относятся к анализам, позволяющим определить зиготность. Настоящее изобретение также относится, в частности, к применению эталонного гена GMFL01-25-J19 (GenBank: AK286292.1), используемого для определения зиготности. Эти и другие родственные методы могут быть применены для уникальной идентификации зиготности генетического события pDAB8264.42.32.1 и выведенных линий сои, содержащих данное генетическое событие.
Краткое описание графического материала
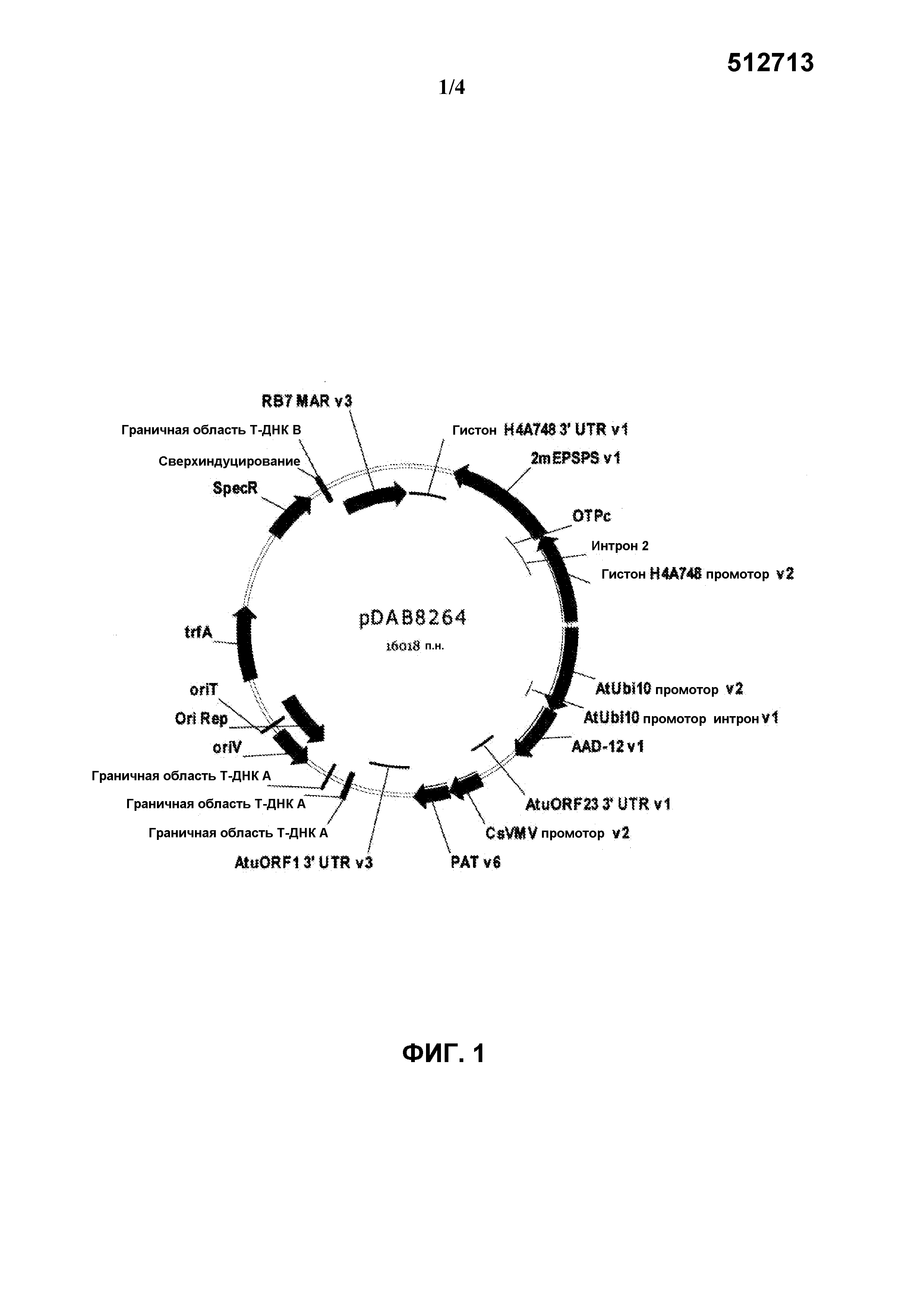
На фиг.1 представлена карта плазмиды pDAB8264.
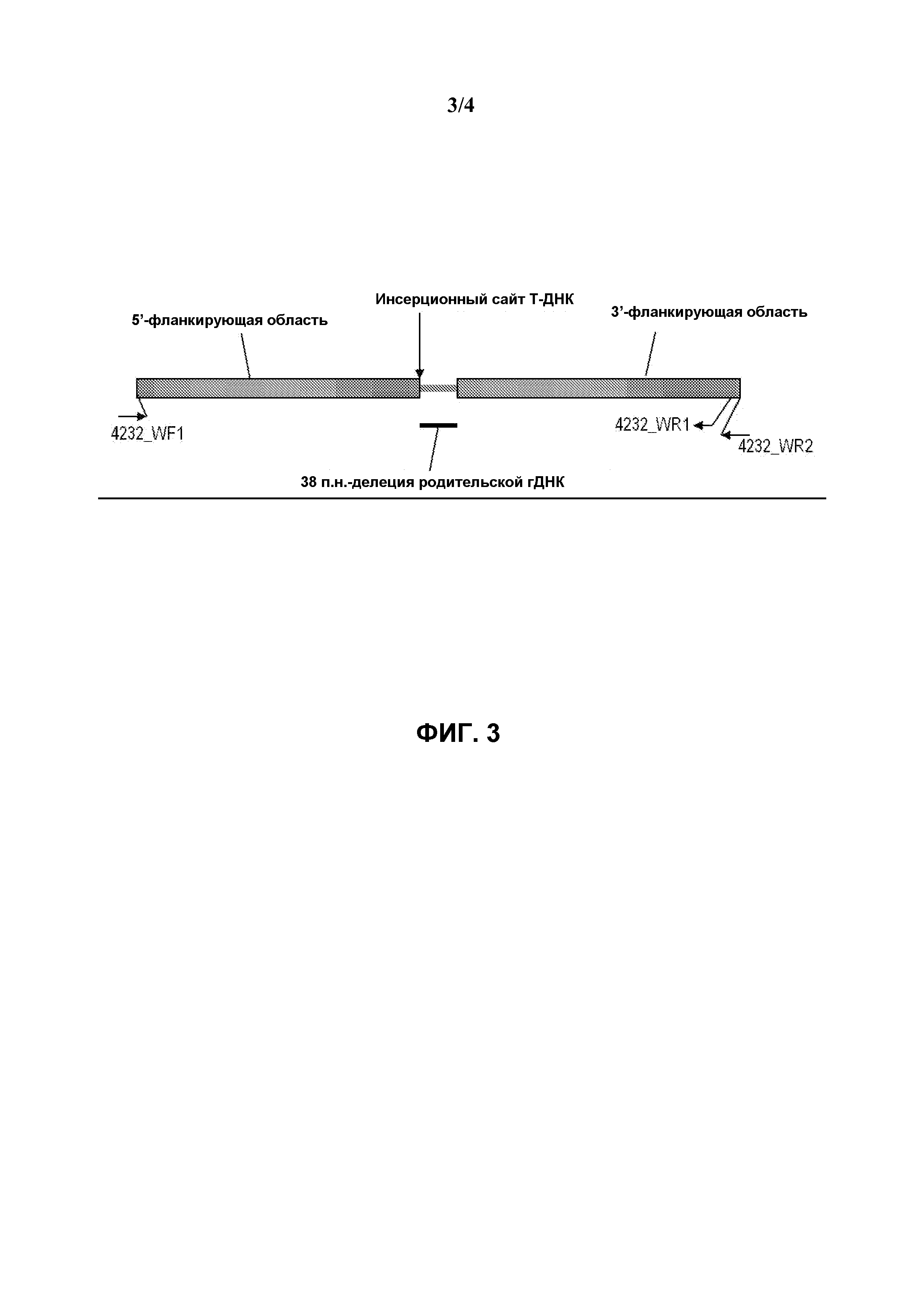
На фиг.2 схематически представлена диаграмма, иллюстрирующая определение локализации праймеров для подтверждения 5'- и 3'-граничной последовательности генетического события pDAB8264.42.32.1 в сое.
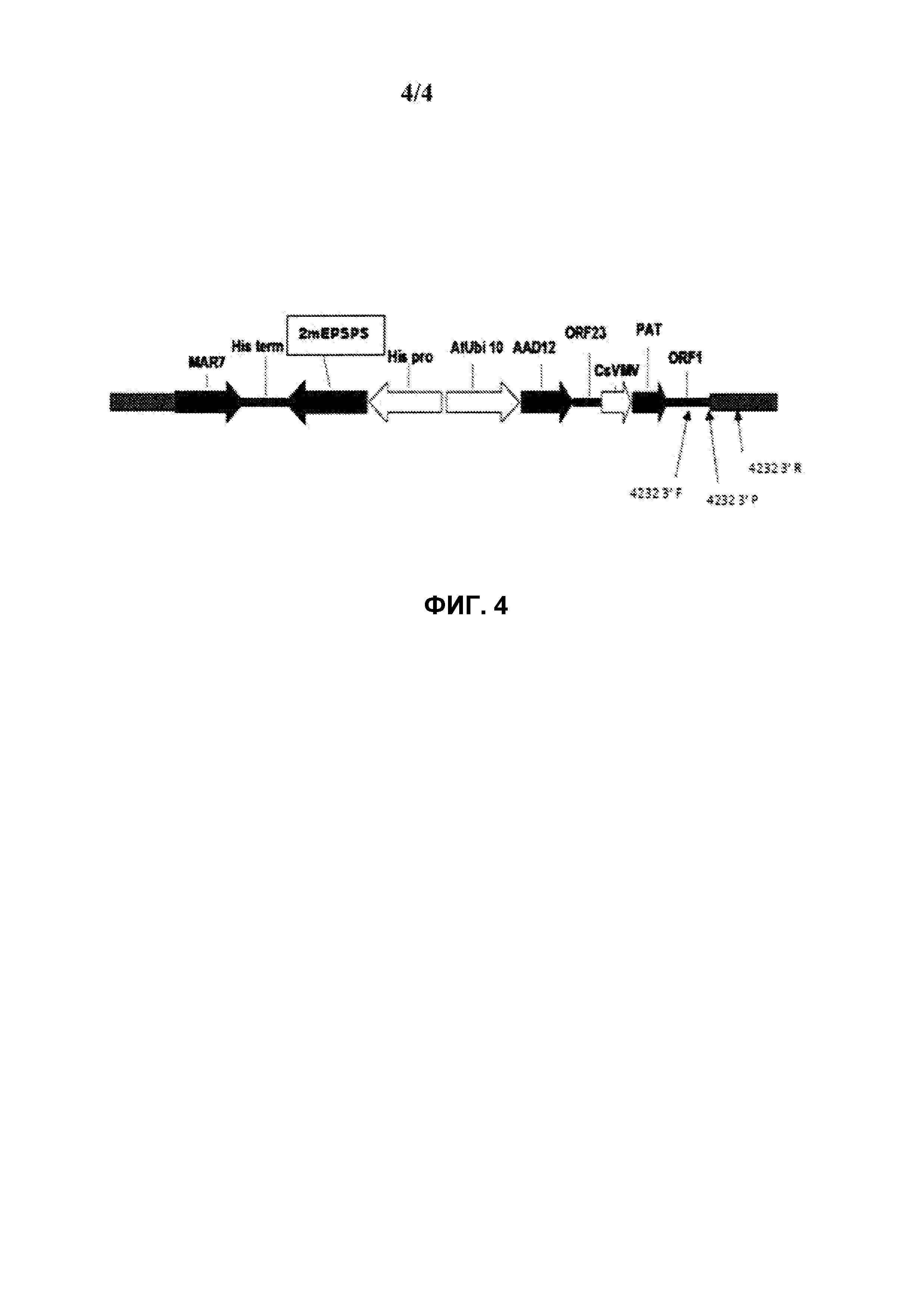
На фиг.3 схематически представлена диаграмма, иллюстрирующая определение локализации праймеров для подтверждения нетрансформированной и геномной ДНК, где генетическим событием в сое является pDAB8264.42.32.1.
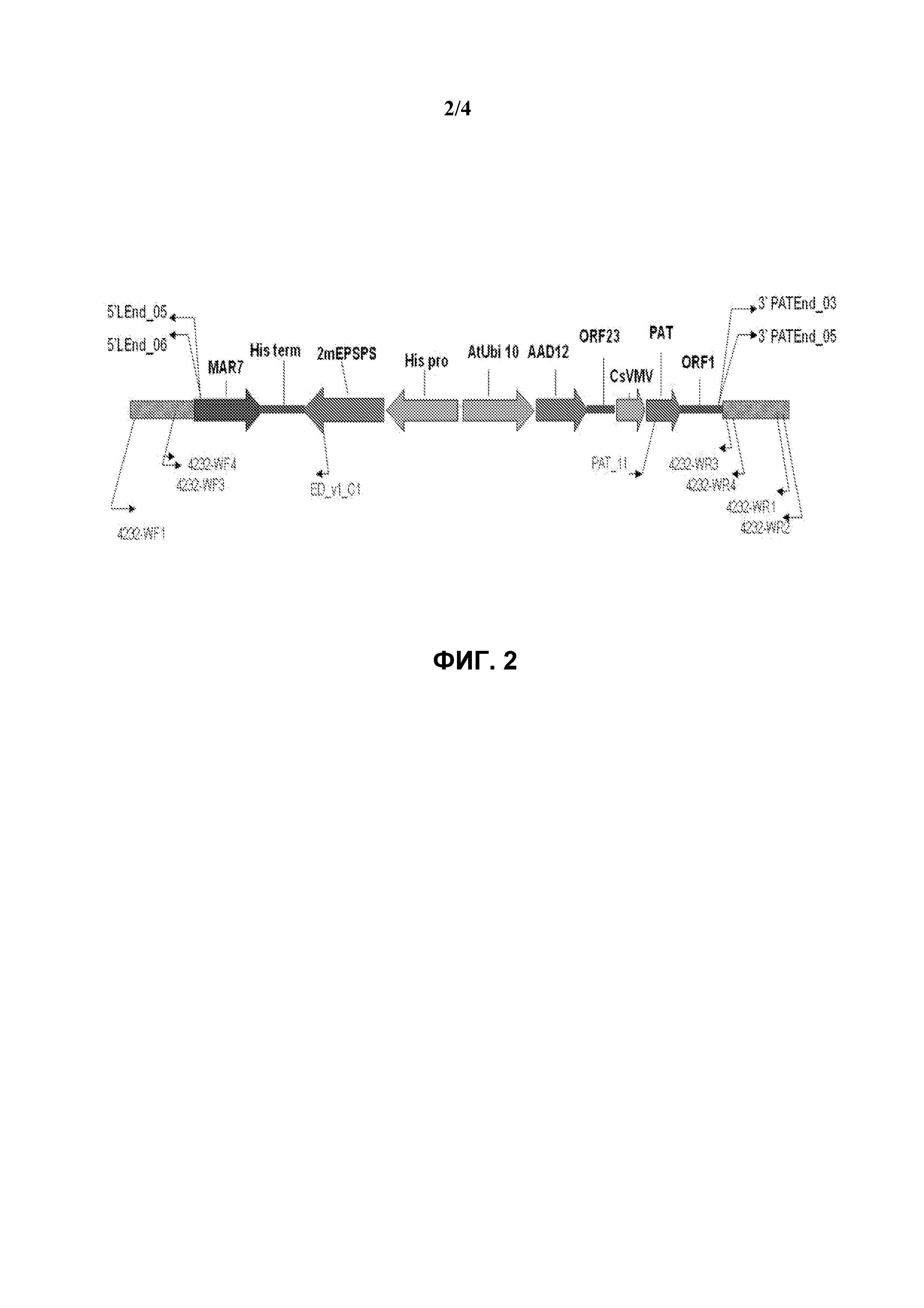
На фиг.4 схематически представлена диаграмма, иллюстрирующая определение локализации праймеров для проведения анализа TAQMAN в целях детектирования присутствия генетического события pDAB8264.42.32.1 в сое.
Краткое описание последовательностей
SEQ ID NO:1 представляет собой 5'-фланкирующую граничную последовательность рассматриваемого генетического события pDAB8264.42.32.1 в сое.
SEQ ID NO:2 представляет собой 3'-фланкирующую граничную последовательность рассматриваемого генетического события pDAB8264.42.32.1 в сое.
SEQ ID NO:3 представляет собой праймер 4232_WF1.
SEQ ID NO:4 представляет собой праймер 4232_WF3.
SEQ ID NO:5 представляет собой праймер 4232_WF4.
SEQ ID NO:6 представляет собой праймер 4232_WR1.
SEQ ID NO:7 представляет собой праймер 4232_WR2.
SEQ ID NO:8 представляет собой праймер 4232_WR3.
SEQ ID NO:9 представляет собой праймер 4232_WR4.
SEQ ID NO:10 представляет собой праймер ED_v1_Cl.
SEQ ID NO:11 представляет собой праймер PAT_11.
SEQ ID NO:12 представляет собой праймер 4232_3'F.
SEQ ID NO:13 представляет собой праймер 4232_3'R.
SEQ ID NO:14 представляет собой зонд 4232_3'P.
SEQ ID NO:15 представляет собой праймер GMS116F.
SEQ ID NO:16 представляет собой праймер GMS116R.
SEQ ID NO:17 представляет собой зонд GMS116Probe.
SEQ ID NO:18 представляет собой вставку T-цепи pDAB8264 и неполные геномные 5'- и 3'-фланкирующие последовательности.
SEQ ID NO:19 представляет собой 5'-геномную последовательность-вставку (включая область стыка) для генетического события pDAB8264.42.32.1.
SEQ ID NO:20 представляет собой последовательность 3'-вставки-стыка для рассматриваемого генетического события pDAB8264.42.32.1.
SEQ ID NO:21 представляет собой последовательность плазмиды pDAB8264.
Подробное описание изобретения
Описанное здесь изобретение включает новые генетические события растения сои (соевые бобы), содержащие кластер для экспрессии множества генов устойчивости к гербицидам, встроенных в специфический локус генома клеток сои. В частности, были выращены новые линии растения сои, содержащие генетическое событие pDAB8264.42.32.1. Такое трансгенное растение обладает устойчивостью к множеству гербицидов, включая феноксиауксиновые и/или арилоксиалканоатные гербициды, глифосат и/или глюфозинат. Устойчивость ко многим гербицидам позволяет фермерам выбрать оптимальную комбинацию гербицидов для более эффективной борьбы с отдельными популяциями сорняков.
Репрезентативной трансгенной вставкой, содержащей генетическое событие pDAB8264.42.32.1, являются генетические элементы, экспрессирующие три различных гена устойчивости к гербицидам: (1) синтетический ген aad-12; (2) модифицированную последовательность EPSPS кукурузы, кодирующую белок, который, по сравнению с полипептидом EPSPS дикого типа, содержит мутации, а именно, мутацию в положении аминокислоты 102 (замену треонина изолейцином) и в положении 106 (замену пролина серином), которая сообщает резистентность или устойчивость к гербициду глифосату; и (3) и ген pat, который сообщает устойчивость или резистентность к гербициду глюфозинату. Ген aad-12, происходящий от Delftia acidovorans, кодирует белок арилоксиалканоат-диоксигеназу (AAD-12), то есть, фермент, способный дезактивировать гербициды, имеющие α-кетоглутаратную группу, включая феноксиалканоатные гербициды (например, гербициды на основе феноксиуксусной кислоты, такие как 2,4-D и MCPA; и гербициды на основе феноксибутановой кислоты, такие как 2,4-DB и MCPB) и гербициды на основе пиридилоксиалкановой кислоты (например, гербициды на основе пиридилоксиуксусной кислоты, такие как триклопир и флуроксипир), включая кислотные, солевые или сложноэфирные формы активного(ых) ингредиента(ов).
Настоящее изобретение также относится к анализам на присутствие рассматриваемого генетического события в образце. Аспекты настоящего изобретения включают способы конструирования и/или продуцирования любых описанных или предлагаемых здесь диагностических молекул нуклеиновой кислоты, а в частности, молекул, которые полностью или частично состоят из рассматриваемых фланкирующих последовательностей.
Настоящее изобретение, в частности, относится к скрещиванию растений и к растениям, устойчивым к гербицидам. В некоторых вариантах изобретения, указанная полинуклеотидная последовательность может быть «сцеплена» с другими признаками (такими как, другой(ие) ген(ы) устойчивости к гербицидам и/или ген(ы), кодирующий(ие) белки, уничтожающие насекомых, или, например, белки, ингибирующие последовательности РНК). Однако настоящее изобретение также включает растения, имеющие одну описанное здесь генетическое событие.
Более конкретно, настоящее изобретение относится, в частности, к генетическому событию сои pDAB8264.42.32.1, к линиям растений, содержащих указанный трансген, и к методам клонирования и анализа ДНК-последовательности этой трансгенной вставки и/или ее граничных областей. Линии растений согласно изобретению могут быть детектированы с использованием описанных и предлагаемых здесь последовательностей.
В некоторых вариантах изобретения, предлагаемый или описанный здесь полинуклеотидный сегмент (такой как SEQ ID NO:1, SEQ ID NO:2, и/или вставка между ними, как указано, например, на фиг.2) может быть вырезан, а затем снова введен с дополнительной(ыми) полинуклеотидной(ыми) последовательностью(ями).
В некоторых своих вариантах, настоящее изобретение относится к клеточным линиям сои, устойчивым к гербицидам, и к их идентификации. Настоящее изобретение, в частности, относится к детектированию наличия рассматриваемого генетического события для того, чтобы определить, содержит ли потомство, полученное путем полового скрещивания, представляющее интерес генетическое событие. Кроме того, настоящее изобретение включает способ детектирования данной модификации, которая будет удовлетворять требованиям, предъявляемым Регуляторными органами для получения разрешения на поступление этого продукта на первичный рынок с указанием на этикетке данного пищевого продукта, например, что этот продукт был получен из рекомбинантных культур. Присутствие рассматриваемого генетического события может быть детектировано любым хорошо известным методом детектирования нуклеиновых кислот, таким как полимеразная цепная реакция (ПЦР) или ДНК-гибридизация с использованием нуклеиновокислотных зондов. Анализ, проводимый с помощью ПЦР, специфичной к генетическому событию, описан ниже. (Другой пример можно найти в публикации Windels et al. (Med. Fac. Landbouww, Univ. Gent 64/5b:459462, 1999)). Некоторые из этих примеров относятся к использованию серии праймеров, охватывающих последовательность стыка, расположенную между вставкой и фланкирующей ДНК.
В настоящей заявке описаны репрезентативное генетическое событие сои pDAB8264.42.32.1, ее отбор и характеризация на стабильность и экспрессию в целом растении и на молекулярные уровни от поколения к поколению. Обе фланкирующие последовательности генетического события pDA8264.42.32.1 были секвенированы и представлены здесь как SEQ ID NO:1 и SEQ ID NO:2. Были разработаны анализы, специфичные для такой модификации. Было также проведено картирование генома сои (хромосомы 15 сои). Может быть осуществлена интрогрессия генетического события pDAB8264.42.32.1 в элитные сорта, которым была сообщена устойчивость к таким гербицидам, как феноксиауксин, глифосат и глюфозинат, в инбредных и гибридных линиях сои.
Рассматриваемый ген EPSPS кодирует мутантную 5-енолпирувил-3-фосфошикимовая кислота-синтазу (EPSPS). Ген EPSPS дикого типа был впервые выделен из кукурузы Zea mays, и его последовательность была депонирована в GenBank под рег. № X63374. См. также патент США No. 6566587 (а в частности, описанную там последовательность SEQ ID NO:3).
Для достижения высокого уровня экспрессии гетерологичных генов в растениях может оказаться предпочтительным реконструировать указанные гены так, чтобы они более эффективно экспрессировались в клетках растений. Модификация нуклеотидной последовательности EPSPS в растении дикого типа может сообщать такую резистентность при ее экспрессии в клетках растений. Как описано в патенте '587, в полипептиде EPSPS, модификация с заменой треонина изолейцином в положении остатка 102 и модификация с заменой пролина серином в положении 106 белка, по сравнению с полипептидом дикого типа, приводит к образованию полипептида EPSPS с двойной мутацией (2mEPSPS), используемого в рассматриваемой вставке. При его экспрессии в клетках растений, он сообщает устойчивость к глифосату. Рассматриваемый ген EPSPS, также обозначаемый здесь «ген 2mepsps» или DMMG, может быть альтернативно оптимизирован для повышения уровня экспрессии в двудольных растениях, а также в однодольных растениях, а в частности, в растениях сои. Встречаемость кодонов может быть выбрана исходя из предпочтительной встречаемости кодона семядоли, то есть, белок может быть реконструирован так, чтобы он кодировался кодонами, которые чаще встречаются у однодольных и двудольных растений. Для повышения эффективности транскрипции/трансляции 2mepsps-кодирующей последовательности и для облегчения проведения стадий модификаций ДНК могут быть удалены нежелательные последовательности и избыточные рестрикционные сайты. Оптимизированный по семядоле вариант рассматриваемого гена однодольных растений также подробно описан в предварительной заявке США (рег.№ 61/419703), поданной 3 декабря 2010 под заголовком «OPTIMIZED EXPRESSION OF GLYPHOSATE RESISTANCE ENCODING NUCLEIC ACID MOLECULES IN PLANT CELLS».
Как было описано ранее, введение и интеграция трансгена в геном растения представляют собой спонтанные события внесения некоторых генетических событий (а поэтому, термин «модификация» («event») относится к вставке, которая экспрессируется в трансформируемом растении). То есть, при осуществлении многих методов трансформации, таких как трансформация агробактерией (Agrobacterium), метод «выстреливания генов» и WHISKERS, нельзя точно предсказать, в какой участок генома будет встраиваться трансген. Таким образом, идентификация фланкирующей геномной ДНК растения по обеим сторонам вставки может играть важную роль для идентификации растения, которое имеет данную инсерционную модификацию. Так, например, могут быть сконструированы ПЦР-праймеры, которые генерируют ПЦР-ампликон в области стыка между вставкой и геномом хозяина. Этот ПЦР-ампликон может быть использован для идентификации уникальной инсерционной модификации или инсерционной модификации другого типа.
В процессе введения вставки в геном клеток растений нередко возникают некоторые делеции или другие альтерации во вставке и/или во фланкирующих ее геномных последовательностях. Таким образом, релевантный сегмент описанной здесь плазмидной последовательности может содержать некоторые незначительные модификации. Это справедливо также и для описанных здесь фланкирующих последовательностей. Таким образом, растение, содержащее полинуклеотид, имеющий определенную степень идентичности с рассматриваемыми фланкирующими последовательностями и/или с последовательностями вставки, входит в объем настоящего изобретения. Полинуклеотидная последовательность может считаться идентичной последовательности согласно изобретению, если она по меньшей мере на 65%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 75%, более предпочтительно, по меньшей мере на 80%, а наиболее предпочтительно, по меньшей мере 85% 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентична представленной или описанной здесь последовательности. Для определения таких растений и полинуклеотидных последовательностей согласно изобретению может быть также проведена гибридизация в определенных условиях, описанных в настоящей заявке. Последовательность, содержащая фланкирующие последовательности и полноразмерную последовательность вставки, может быть подтверждена путем сравнения с последовательностью депонированных семян.
Термин «генетические события» («event») означает изначально случайные события трансформации, причем, за время разработки настоящего изобретения, по меньшей мере 2500 семян линии сои, содержащей указанные генетические модификации, были депонированы в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, VA, 20110 и являются общедоступными, без каких-либо ограничений (но в соответствии с патентным правом). Этот депозит был зарегистрирован в ATCC под депозитарным номером No. PTA-11993. 100 упаковок (25 семян на упаковку) семян Glycine max (семена сои Glycine max L.: pDAB8264.42.32.1) было депонировано 11 июля 2011. Этот депозит был проанализирован 26 июля, 2011, и на данное время, эти семена были жизнеспособными. Указанный депозит был положен на хранение согласно Будапештскому договору о депонировании семян в целях проведения патентной процедуры. Данный депозит будет храниться, без ограничений к его доступу, в депозитарии ATCC, который является общедоступным депозитарием, в течение 30 лет, или в течение пяти лет после самого последнего запроса, или в течение срока действия патента, каким бы долгим он не был, и этот депозит будет заменен, если он утратит свою жизнеспособность в течение этого периода времени.
Депонированные семена являются частью настоящего изобретения. Совершенно очевидно, что из этих семян могут быть выращены растения сои, и такие растения являются частью настоящего изобретения. Настоящее изобретение также относится к последовательностям ДНК, содержащимся в этих растениях сои, которые могут быть использованы для детектирования этих растений и их потомства. Методы детектирования и наборы согласно изобретению могут быть применены для идентификации любого одного, двух или даже всех трех этих трансформантов, в зависимости от конечной цели проведения данного теста.
Описанные здесь определения и примеры приводятся для лучшего понимания настоящего изобретения и в качестве руководства по его практическому осуществлению. Если это не оговорено особо, то употребляемые здесь термины имеют свои общепринятые значения, понятные среднему специалисту в данной области. В настоящем описании используется номенклатура оснований ДНК согласно ст. 37 Свода законов США (CFR) § 1.822.
Используемый здесь термин «потомство» означает потомство любого поколения родительского растения, которое содержит генетическое событие pDAB8264.42.32.1.
«Трансгенное растение с генетическим событием» («event») получают путем трансформации клеток растений гетерологичной ДНК, то есть, конструкцией нуклеиновой кислоты, включающей представляющий интерес трансген; регенерации популяции растений, полученных после встраивания трансгена в геном растения; и отбора конкретного растения, отличающегося тем, что оно имеет инсерцию в конкретном положении генома. Термин «трансгенное растение с генетическим событием» («event») означает исходный трансформант и потомство трансформанта, которые включают гетерологичную ДНК. Термин «трансгенное растение с генетическим событием» («event») также означает растение потомства, продуцированного посредством полового ауткроссинга трансформанта и растения другого сорта, включающего геномную/трансгенную ДНК. Даже после повторного возвратного скрещивания с рекуррентным родителем, встроенная трансгенная ДНК и фланкирующая геномная ДНК (геномная/трансгенная ДНК), происходящая от трансформированного родителя, присутствует в потомстве этого кросса на том же самом хромосомном участке. Термин «трансген» («event») также означает ДНК исходного трансформанта и его потомства, содержащих встроенную ДНК и фланкирующую геномную последовательность, расположенную в непосредственной близости от встроенной ДНК, которая, как предполагается, должна передаваться потомству, которое получает эту встроенную ДНК, включая представляющий интерес трансген, в результате полового скрещивания одной родительской линии, которая содержит встроенную ДНК (например, исходного трансформанта и его потомства, продуцируемого после самоопыления), и родительской линии, которая не содержит встроенную ДНК.
«Последовательность стыка» охватывает положение, в котором ДНК, встроенная в геном, присоединена к ДНК генома нативного растения сои, фланкирующей положение инсерции, и идентификации или детектирования одной или другой последовательности стыка в растительном генетическом материале будут достаточными для выявления такого трансгена. Настоящее изобретение включает последовательности ДНК, которые охватывают инсерции в описанных здесь трансформантах сои и фланкирующие ДНК аналогичной длины. Конкретные примеры таких диагностических последовательностей описаны в настоящей заявке, однако, в настоящем изобретении могут быть использованы и другие диагностические последовательности, которые перекрываются с последовательностями стыка указанных инсерций или с последовательностями стыка инсерций и геномной последовательности.
Настоящее изобретение, в частности, относится к идентификации событий трансформации с использованием таких фланкирующих последовательностей, последовательностей стыка и последовательностей вставки. Настоящее изобретение включает использование родственных ПЦР-праймеров и ампликонов. В соответствии с настоящим изобретением, для детектирования или идентификации коммерчески доступных сортов или линий трансгенной сои, выведенных из запатентованных линий трансгенной сои, могут быть применены методы ПЦР-анализа с использованием ампликонов, которые охватывают встроенную ДНК и ее граничные области.
Бинарная плазмида pDAB8264 (SEQ ID NO:21) включает генетические элементы, представленные на фиг.1. Нижеследующие генетические элементы (не включая граничные последовательности T-цепи) содержатся в области T-цепи pDAB8264. В таблице 1, нумерация остатков генетических элементов соответствует нумерации остатков описанной здесь последовательности SEQ ID NO:21.
|
|
|
Последовательности SEQ ID NO:19 и 20, соответственно, представляют собой 5'- и 3'-фланкирующие последовательности, которые присутствуют вместе с 5'- и 3'-частями последовательности вставки, как более подробно описано ниже, и таким образом, включают 5'- и 3'-последовательности «стыка» или «транзиции» вставки и геномной ДНК. Что касается последовательности SEQ ID NO:19, то остатки 1-1246 представляют собой геномную 5'-фланкирующую последовательность, а остатки 1247-1550 представляют собой остатки 5'-конца вставки. Что касается последовательности SEQ ID NO:20, то остатки 1-176 представляют собой остатки 3'-конца вставки, а остатки 177-680 представляют собой геномную 3'-фланкирующую последовательность. Таким образом, последовательности стыка или транзиции в области 5'-конца вставки находятся в положениях остатков 1246-1247 последовательности SEQ ID NO:19. Аналогичным образом, последовательности стыка или транзиция в области 3'-конца вставки находятся в положениях остатков 176-177 последовательности SEQ ID NO:20. Полинуклеотидами согласно изобретению являются полинуклеотиды, содержащие, например, 5, 10, 20, 50, 100, 150, или 200 оснований, а возможно и более, и любые включения между ними с любой стороны последовательности стыка. Таким образом, праймер, охватывающий последовательность стыка, может содержать, например, 5-10 оснований, которые должны гибридизоваться с фланкирующей последовательностью, и 5-10 оснований, которые должны гибридизоваться с последовательностью вставки. Зонды и ампликоны могут быть сконструированы аналогичным образом, хотя, обычно, они длиннее праймеров.
Рассматриваемые последовательности (включая фланкирующие последовательности) являются уникальными. На основе этих последовательностей-вставок и граничных последовательностей были получены трансген-специфические праймеры. ПЦР-анализ показал, что эти линии растения сои могут быть идентифицированы по различным генотипам сои путем анализа ПЦР-ампликонов, полученных с использованием этих наборов трансген-специфических праймеров. Таким образом, эти и другие родственные процедуры могут быть применены для идентификации уникальности указанных линий растения сои. Идентифицированные здесь последовательности являются уникальными.
Способы детектирования согласно изобретению являются особенно ценными, если их применять в комбинации со скрещиванием растений для того, чтобы определить, какое потомство содержит данный трансген, после чего родительское растение, содержащее представляющий интерес трансген, может быть скрещено с линией другого растения для сообщения потомству одного или более дополнительных представляющих интерес признаков. Эти методы с применением ПЦР-анализов являются предпочтительными для реализации программ по скрещиванию растений сои, а также по контролю качества, в частности, товарного семенного материала трансгенной сои. В настоящее время существуют и используются наборы для ПЦР-детектирования этих линий трансгенной сои. Это позволяет также ускорить регистрацию продукта и его поступление на реализацию.
Кроме того, для идентификации конкретной геномной локализации каждой вставки могут быть использованы фланкирующие/геномные последовательности сои. Эта информация может быть использована для получения молекулярных маркерных систем, специфичных для каждого трансгена. Такие системы могут быть использованы для разработки ускоренной стратегии скрещивания и получения данных по сцеплению.
Кроме того, информация о фланкирующей последовательности может быть использована для исследования и характеризации процессов интеграции трансгенов, свойств сайта геномной интеграции, отбора трансформантов, стабильности трансгенов и их фланкирующих последовательностей, и экспрессии генов (особенно процессов, относящихся к сайленсингу генов, профилю метилирования трансгенов, эффектам положений и к потенциальным элементам, ассоциированным с экспрессией, таким как MARS [области присоединения к матрице] и т.п.).
Исходя из всего вышесказанного, совершенно очевидно, что настоящее изобретение включает семена, депонированные как семена с генетическим событием 11 июля, 2011 и доступные под депозитарным № ATCC PTA-11993. Настоящее изобретение также включает устойчивое к гербицидам растение сои, выращенное из семян, депонированных в ATCC под указанным регистрационным номером и в указанную дату. Кроме того, настоящее изобретение включает части указанного растения, такие как листья, образцы ткани, семена, полученные от указанного растения, пыльцу, муку (соевую муку) и другие части (где указанные части содержат трансгенную вставку, фланкированную последовательностями SEQ ID NO:1 и SEQ ID NO:2). Настоящее изобретение также включает не-тотипотентные клетки, происходящие от любых рассматриваемых растений (включая клетки частей указанных растений, перечисленных выше).
Кроме того, настоящее изобретение включает потомство растений и/или потомство растений, выращенных из депонированных семян, а предпочтительно, семян растения сои, резистентного к гербицидам, где указанное растение имеет геном, содержащий описанную здесь детектируемую геномную ДНК дикого типа/последовательность «стыка» ДНК-вставки. Используемый здесь термин «соя» означает растение Glycine max и включает все его сорта, которые могут быть выведены путем скрещивания одного растения сои с другим растением сои.
Настоящее изобретение также включает способы получения кроссов с использованием растения согласно изобретению в качестве по меньшей мере одного родителя. Так, например, настоящее изобретение включает F1-гибрид растения, включающий в качестве одного или двух родителей любые описанные здесь растения. Настоящее изобретение также относится к семенам, продуцированным такими F1-гибридами согласно изобретению. Настоящее изобретение включает способ продуцирования семян F1-гибрида путем скрещивания описанного здесь растения с другим растением (например, инбредным родителем) и сбора полученных гибридных семян. Настоящее изобретение включает описанное здесь растение, которое является либо женским родительским растением, либо мужским родительским растением. Характеризация полученных растений может быть проведена более эффективно после тщательного исследования растений-родителей.
Устойчивое к гербицидам растение сои согласно изобретению может быть выведено путем первого полового скрещивания первого родительского растения сои, выращенного из семени любой из указанных здесь линий, и второго родительского растения сои, с получением множества растений-потомков первой генерации; а затем отбора потомства первой генерации, которое является резистентным к гербициду (или которое имеет по меньшей мере один из трансгенов согласно изобретению); самоопыления потомства первой генерации с продуцированием множества растений-потомков второй генерации; а затем отбора потомства второй генерации, которое является резистентным к гербициду (или которое имеет по меньшей мере один из трансгенов согласно изобретению). Эти стадии могут также включать возвратное скрещивание растения-потомка первой генерации или растения-потомка второй генерации со вторым родительским растением сои или с третьим родительским растением сои. Затем может быть засеяна культура сои, содержащая семена сои согласно изобретению или ее потомства.
Следует также отметить, что два различных трансгенных растения могут быть также скрещены с получением потомства, которое содержит два независимо сегрегирующихся добавленных экзогенных гена. После самоопыления соответствующего потомства могут быть получены растения, которые являются гомозиготными по обоим добавленным экзогенным генам. Возвратное скрещивание с родительским растением и ауткроссинг с нетрансгенным растением также рассматривается как вегетативное размножение. Другие методы скрещивания, обычно применяемые для сообщения различных признаков и выращивания различных культур, известны специалистам. Скрещивание при бэккроссировании было использовано для простого наследования хорошо наследуемого признака путем переноса генов в нужные гомозиготные сорта или инбредную линию, которая является рекуррентным родителем. Источник передаваемого признака называют родителем-донором. Как и ожидалось, полученное растение имеет признаки рекуррентного родителя (например, сорта), и этот желательный признак передается от родителя-донора. После первого скрещивания отбирают растения, обладающие фенотипом родителя-донора, и эти растения повторно скрещивают (подвергают возвратному скрещиванию) с рекуррентным родителем. Как и ожидалось, полученное растение имеет признаки рекуррентного родителя (например, сорта), и этот желательный признак передается от родителя-донора.
Молекулы ДНК согласно изобретению могут быть использованы в качестве молекулярных маркеров в методе скрещивания с применением маркеров (MAB). Молекулы ДНК согласно изобретению могут быть использованы в методах с применением маркеров (таких как AFLP-, RFLP-, RAPD-, SNP- и SSR-маркеры), которые позволяют идентифицировать агрономически ценные и генетически сцепленные признаки, известные специалистам. Признак резистентности к гербицидам может быть прослежен у потомства кросса, полученного путем скрещивания с растением сои согласно изобретению (или с их потомством и любым другим сортом или другой разновидностью растения сои) с применением MAB-методов. Маркерами для указанных признаков являются молекулы ДНК, и MAB-методы, хорошо известные специалистам, могут быть применены для прослеживания признака(ов) резистентности к гербицидам у растений сои, где по меньшей мере одна линия растения сои согласно изобретению или его потомства является родителем или предком. Способы согласно изобретению могут быть применены для идентификации растения сои любого сорта, имеющего рассматриваемый трансген.
Способы согласно изобретению включают способ получения устойчивого к гербицидам растения сои, где указанный способ включает интрогрессию генетического события pDAB8264.42.32.1 в растение сои данного сорта. Более конкретно, способы согласно изобретению могут включать скрещивание двух растений согласно изобретению или одного растения согласно изобретению с любым другим растением. Предпочтительные способы также включают отбор потомства указанного кросса путем анализа указанного потомства на генетическое событие, детектируемое в соответствии с настоящим изобретением. Так, например, настоящее изобретение может быть применено для прослеживания рассматриваемого генетического события во всех циклах скрещивания с растениями, имеющими другие желательные признаки, такие как агрономические показатели, протестированные в настоящем изобретении в различных примерах. Растения, содержащие рассматриваемый трансген и имеющие нужный признак, могут быть детектированы, идентифицированы, отобраны и сразу использованы, например, в других раундах скрещивания. Рассматриваемый трансген/признак может быть также объединен с признаком(ами) резистентности к насекомым и/или с другими признаками устойчивости к гербицидами посредством скрещивания и мониторинга такого трансгена/признака в соответствии с настоящим изобретением. Одним из вариантов последнего аспекта является растение, содержащее рассматриваемый трансген и ген, кодирующий резистентность к гербициду дикамбе.
Таким образом, настоящее изобретение может быть объединено, например, с дополнительными признаками, кодирующими резистентность к глифосату (например, резистентность к растительной или бактериальной глифосатоксидазе (GOX)) и глифосатацетилтрансферазе (GAT); дополнительными признаками, кодирующими резистентность к глюфозинату (например, резистентность к биалафосу (bar)); признаками, сообщающими резистентность к гербициду, ингибирующему ацетолактат-синтазу (ALS) (например, к имидазолинонам [таким как имазетапир], к сульфонилмочевинам, сульфоанилиду триазолпиримидина, к пиримидинилтиобензоатам и к другим химическим веществам [Csrl, SurA и т.п.]); признаками резистентности к бромоксинилу (например, Bxn); признаками резистентности к гербициду дикамбе (см., например, заявку на патент США 2003/0135879); признаками резистентности к ингибиторам фермента HPPD (4-гидроксифенил-пируват-диоксигеназы); признаками резистентности к ингибиторам фитоендезатуразы (PDS); признаками резистентности к гербицидам, ингибирующим фотосистему II (например, psbA); признаками резистентности к гербицидам, ингибирующим фотосистему I; признаками резистентности к гербицидам, ингибирующим протопорфириногеноксидазу IX (PPO) (например, РРО-1), и признаками резистентности к гербицидам на основе фенилмочевины (например, CYP76B1). Один или более таких признаков могут быть объединены в соответствии с настоящим изобретением в целях эффективного уничтожения, замедления и/или предупреждения распространения заносных сорняков и/или сообщения резистентности к гербицидам многих классов.
Для специалиста в данной области очевидно, что ген aad-12, используемый в настоящем изобретении, также сообщает резистентность к соединениям, которые превращаются в феноксиацетатауксиновые гербициды (например, 2,4-DB, MCPB и т.п.). Молекула масляной кислоты, присутствующая в гербициде 2,4-DB, превращается посредством β-окисления в фитотоксичную 2,4-дихлорфеноксиуксусную кислоту. Аналогичным образом, MCPB превращается посредством β-окисления в фитотоксичную MCPA. Гербициды на основе бутановой кислоты сами по себе не являются гербицидными, но, посредством β-окисления в чувствительных к ним растениях, они могут превращаться в соответствующую кислоту с продуцированием гербицида в форме уксусной кислоты, которая является фитотоксичной. Гербициды на основе бутановой кислоты не оказывают вредного воздействия на растения, не способные к быстрому β-окислению. Однако, растения, которые способны к быстрому β-окислению и могут превращать гербицид на основе бутановой кислоты в форму уксусной кислоты, впоследствии могут быть защищены AAD-12.
Методы применения гербицидов хорошо известны специалистам. Такие методы применения могут включать приготовление резервуарной смеси из более чем одного гербицида. Предпочтительными гербицидами, подходящими для использования в настоящем изобретении, являются комбинации гербицидов глифосата, глюфозината и феноксиауксина (таких как 2,4-D; 2,4-DB; MCPA; MCPB). Другими предпочтительными комбинациями являются смеси «глифосат плюс 2,4-D» или «глюфозинат плюс 2,4-D». Гербициды этих трех типов могут быть использованы в предпочтительных комбинациях, которые, как очевидно, являются преимущественными для осуществления настоящего изобретения. Один или более из рассматриваемых гербицидов могут быть внесены на поля/посевные площади перед их засевом семенами согласно изобретению. Такое внесение может быть осуществлено, например, за 14 дней до посева семян согласно изобретению. Один или более из рассматриваемых гербицидов могут быть также внесены после посева семян, но до появления всходов. Один или более из рассматриваемых гербицидов могут быть также внесены в грунт (для уничтожения сорняков) или нанесены на верхушку сорняков и/или на верхушку трансгенных растений согласно изобретению. Рассматриваемые три гербицида могут быть применены поочередно, либо они могут быть использованы в комбинации, например, для уничтожения или предупреждения роста сорняков, которые могут быть устойчивыми к одному гербициду, но не к другому. Как очевидно специалистам, в различных способах согласно изобретению, гербициды рассматриваемых трех типов могут быть внесены в различное время.
Кроме того, рассматриваемый трансген может быть сцеплен с одним или более дополнительными признаками устойчивости к гербицидам, с одним или более дополнительными исходными признаками (например, с резистентностью к насекомым, резистентностью к заражению грибами или устойчивостью к стрессам и т.п.) или с продуктивными признаками (например, с повышенной урожайностью, с повышенной маслянистостью, улучшенным качеством волокна и т.п.), где признаки обоих типов является трансгенными и нетрансгенными. Таким образом, настоящее изобретение может быть применено для выращивания сельскохозяйственных культур с полным набором улучшенных агрономических признаков, таких как качество культуры, ее приспособляемость и экономический показатель «затраты - эффективность борьбы с любыми вредителями сельскохозяйственных культур».
Методы интеграции полинуклеотидной последовательности в специфический сайт хромосомы растительной клетки посредством гомологичной рекомбинации описаны в литературе. Так, например, сайт-специфическая интеграция, описанная в публикации патентной заявки No. 2009/0111188 A1, включает использование рекомбиназ или интеграз, опосредующих введение донорной полинуклеотидной последовательности в хромосому мишени. Кроме того, в международной патентной заявке No. WO 2008/021207 описана гомологичная рекомбинация, опосредуемая белками «цинковые пальцы» и осуществляемая для интеграции одной или более донорных полинуклеотидных последовательностей в специфические положения генома. Рекомбиназы, такие как FLP/FRT, описанные в патенте США No. 6720475, или CRE/LOX, описанные в патенте США № 5658772, могут быть использованы для интеграции полинуклеотидной последовательности в специфический сайт хромосомы. И наконец, использование мегануклеаз для встраивания донорных полинуклеотидов в специфический сайт хромосомы было описано в публикации Puchta et al., PNAS USA 93 (1996) pp. 5055-5060).
Специалистам по существу известны и применяются другие различные методы сайт-специфической интеграции в клетки растений (Kumar et al, Trends in Plant Set 6(4) (2001) pp. 155-159). Кроме того, системы сайт-специфической рекомбинации, которые были идентифицированы у некоторых прокариотических и низших эукариотических организмов, могут быть использованы и в растениях. Примерами таких систем являются, но не ограничиваются ими, система рекомбиназ R/RS плазмиды pSRl дрожжей Zygosaccharomyces rouxii (Araki et al. (1985) J. Mol. Biol. 182: 191-203), и система Gin/gix фага Mu (Maeser and Kahlmann (1991) Mol. Gen. Genet. 230: 170-176).
В некоторых вариантах изобретения могут оказаться желательными интеграция или сцепление с новым(ыми) трансгеном(ами) в непосредственной близости от существующей трансгенной вставки. Трансгенная вставка может рассматриваться как предпочтительный геномный локус, который был выбран исходя из уникальных признаков, таких как единственный инсерционный сайт, нормальная менделевская сегрегация и стабильная экспрессия, и преимущественная комбинация свойств, включая устойчивость к гербициду и агрономическая продуктивность в отдельно взятом и в различных других географических регионах. Новые интегрированные трансгены должны способствовать сохранению экспрессионных свойств трансгенов в уже существующих трансформантах. Кроме того, поскольку уже были идентифицированы геномные фланкирующие последовательности и положения нового интегрированного трансгена, то необходимо разработать анализы для детектирования и подтверждения нового интегрированного трансгена. И наконец, интеграция нового трансгена в специфическое положение хромосомы, которое сцеплено с существующим трансгеном, будет облегчать интрогрессию трансгенов в другой генетический фон посредством полового ауткроссинга с применением стандартных методов скрещивания.
В некоторых вариантах изобретения, может оказаться желательным вырезание полинуклеотидных последовательностей из трансгенной вставки. Например, вырезание трансгена, описанное в предварительной заявке на патент США No. 61/297628, осуществляют с использованием нуклеаз «цинковые пальцы» для удаления полинуклеотидной последовательности, состоящей из генного экспрессионного кластера, из интегрированной в хромосому трансгенной вставки. Удаляемой полинуклеотидной последовательностью может быть селективный маркер. После вырезания и удаления полинуклеотидной последовательности, модифицированная трансгенная вставка может быть снова встроена путем инсерции полинуклеотидной последовательности. Вырезание полинуклеотидной последовательности и последующее повторное встраивание модифицированной трансгенной вставки дает определенные преимущества, такие как возможность повторного использования селективного маркера или предупреждение непредусмотренных замен в транскриптоме растения, которые могут происходить в результате экспрессии специфических генов.
В настоящем изобретении описан специфический сайт на хромосоме 15 в геноме сои, который является особенно подходящим для встраивания в него гетерологичных нуклеиновых кислот. В настоящем изобретении описана 5'-фланкирующая последовательность и 3'-фланкирующая последовательность, которые могут быть также использованы для идентификации и/или определения локализации сайта инсерции/присоединения на хромосоме 15. Таким образом, настоящее изобретение относится к способам введения представляющих интерес гетерологичных нуклеиновых кислот в предварительно определенный сайт-мишень или в область, расположенную поблизости от этого сайта-мишени. Настоящее изобретение также охватывает семена сои и/или растение сои, содержащие любую гетерологичную нуклеотидную последовательность, встроенную в описанный здесь сайт-мишень или в обычное окружение этого сайта. Одним из средств достижения такой нацеленной интеграции является вырезание и/или введение другой вставки вместо описанного здесь pat-экспрессирующего кластера. Вообще говоря, в настоящем изобретении может быть применен любой метод, которым является, например, но не ограничивается им, направленная гомологичная рекомбинация.
Используемый здесь термин «сцепление» трансгена или признака означает объединение желательных признаков в одной трансгенной линии. Селекционеры осуществляют сцепление трансгенных признаков посредством скрещивания родителей, каждый из которых имеет один из нужных признаков, а затем идентифицируют потомство, которое имеет оба этих нужных признака. Другим способом сцепления генов является перенос двух или более генов в ядро клетки-растения во время трансформации. Другим способом сцепления генов является повторная трансформация трансгенного растения другим представляющим интерес геном. Так, например, сцепление генов может быть применено для объединения двух или более различных признаков, включая, например, два или более различных признаков, например, резистентность к насекомым и резистентность к болезням, а также два или более признаков резистентности к гербицидам, и/или признак(и) резистентности к насекомым и признак(и) резистентности к гербицидам. Помимо использования представляющего интерес гена, При «сцеплении генов», помимо представляющего интерес гена, можно также использовать селективный маркер.
Используемый здесь термин «гомологичная рекомбинация» означает реакцию между любой парой нуклеотидных последовательностей, имеющих соответствующие сайты, содержащие аналогичные нуклеотидные последовательности, посредством которых две нуклеотидных последовательности могут взаимодействовать (подвергаться рекомбинации) с образованием новой последовательности рекомбинантной ДНК. Сайты каждой из аналогичных нуклеотидных последовательностей называются здесь «гомологичными последовательностями». Вообще говоря, частота гомологичной рекомбинации возрастает по мере увеличения длины гомологичной последовательности. Таким образом, если гомологичная рекомбинация наблюдается между двумя нуклеотидными последовательностями, имеющими меньшую степень идентичности, то частота (или эффективность) рекомбинации снижается по мере увеличения дивергентности этих двух последовательностей. Рекомбинация может быть осуществлена с использованием одной гомологичной последовательности на каждого донора и молекулу-мишень, в результате чего может быть получен продукт рекомбинации «простого кроссинговера». Альтернативно, две гомологичные последовательности могут находиться на каждой из нуклеотидных последовательностей мишени и донора. Рекомбинация между двумя гомологичными последовательностями на доноре и двумя гомологичными последовательностями на мишени приводит к получению продукта рекомбинации «двойного кроссинговера». Если гомологичные последовательности на донорной молекуле фланкируют последовательность, подвергаемую модификации (например, представляющую интерес последовательность), то рекомбинация посредством двойного кроссинговера с молекулой-мишенью будет приводить к образованию продукта рекомбинации, в котором представляющая интерес последовательность будет заменять последовательность ДНК, которая первоначально находилась между гомологичными последовательностями на молекуле-мишени. Обмен последовательностями ДНК между мишенью и донором, которая происходит в результате события рекомбинации с двойным кроссинговером, называется «заменой последовательностей».
Рассматриваемое трансгенное растение способно к трансгенной экспрессии трех различных белков, обладающих устойчивостью к гербицидам, что приводит к развитию устойчивости к комбинациям гербицидов, которые могут уничтожать почти все широколистные и травянистые сорняки. Эти экспрессионный кластер/трансгенная вставка, имеющие признак устойчивости ко многим гербицидам, могут быть сцеплены, например, с другими признаками устойчивости к гербицидам (например, резистентности к глифосату, резистентности к глюфозинату, резистентности к имидазолинону, резистентности к дикамбе, резистентности к HPPD, резистентности к бромоксинилу и т.п.), и с признаками резистентности к насекомым (такими как Cry1F, CrylAb, Cry1Ac, Cry34/45, Cry1Be, CrylCa, Cry1Da, CrylEa, Cry1Fa, инсектицидные белки вегетативной системы («VIPS»), включая VIP3A и т.п.). Кроме того, белки устойчивости к гербицидам, присутствующие в экспрессионном кластере/трансгенной вставке согласно изобретению, могут служить в качестве одного или более селективных маркеров sto, облегчающих отбор первичных трансформантов растений, генетически сконструированных с использованием второго гена или группы генов.
Эти комбинации признаков были положены в основу разработки новых способов борьбы с сорняками различных видов (и т.п.), что было продиктовано приобретением этими сорняками резистентности к гербицидам или их природной устойчивостью к этим гербицидам (например, к глифосату). Таким образом, новые способы борьбы с сорняками, осуществляемые с использованием генетического события pDAB8264.42.32.1, входят в объем настоящего изобретения.
Сообщение культурам рассматриваемых трансгенных признаков, взятых как в комбинации, так и отдельно, позволяет осуществлять борьбу с другими культурами-самосевами, устойчивыми к гербицидам, где указанные культуры не содержат генов, сообщающих устойчивость к фенокси-гербицидам, пиридилокси-гербицидам, глифосатным и/или глюфозинатным гербицидам.
Предпочтительные растения или семена согласно изобретению содержат в своем геноме идентифицированные здесь последовательности-вставки вместе по меньшей мере с 20-500 или более смежными фланкирующими нуклеотидами, находящимися на обеих сторонах вставки, как описано в настоящей заявке. Если это не оговорено особо, то термин «фланкирующие последовательности» означает последовательности, идентифицированные в SEQ ID NO:1 и SEQ ID NO:2. И в этом случае, рассматриваемыми трансгенами являются гетерологичные ДНК, встроенные между рассматриваемыми фланкирующими геномными последовательностями, расположенными в непосредственной близости от встроенной ДНК. Как и ожидалось, все эти фланкирующие последовательности или их части могут передаваться потомству, которое будет иметь встроенную ДНК благодаря половому скрещиванию с родительской линией, которая включает указанный трансген.
Настоящее изобретение включает тканевые культуры регенерируемых клеток растения согласно изобретению. Настоящее изобретение также включает растение, регенерируемое из указанной тканевой культуры, а в частности, растение, которое обладает способностью экспрессировать все морфологические и физиологические признаки репрезентативного сорта. Предпочтительные растения согласно изобретению обладают всеми физиологическими и морфологическими признаками растения, выращенного из депонированных семян. Настоящее изобретение также включает потомство таких семян и семян, обладающих представляющими интерес качественными признаками.
Модификации (такие как мутация, а также трансфекция и скрещивание) растений или их семян или частей, позволяют выводить сорта, которые могут быть названы «по существу, выведенными» сортами. Международная Организация по защите новых сортов растений (UPOV) представила нижеследующее руководство, позволяющее определить, является ли данный сорт по существу, выведенным из защищенного сорта:
[A] Этот сорт, предположительно, должен быть, по существу, выведенным из другого сорта («родительского сорта»), если:
(i) он преимущественно выведен из родительского сорта или из сорта, которые сам преимущественно выведен из родительского сорта, но, при этом, сохраняет основные свойства, характерные для генотипа или комбинации генотипов родительского сорта;
(ii) он явно отличается от родительского сорта; и
(iii) за исключением различий, которые являются результатом дериватизации, он соответствует родительскому сорту по основным признакам, характерным для генотипа или комбинации генотипов родительского сорта.
Документ UPOV, подготовленный Ведомством США, был принят на Шестой конференции с участием Международных организаций, проходившей в Женеве 30 октября, 1992.
Используемый здесь термин «линия» означает группу растений, которые имеют незначительные различия между собой по меньшей мере по одному признаку или вообще не имеют родовых различий. Такие линии могут быть созданы в результате самоопыления и скрещивания нескольких поколений, или вегетативного размножения из одного родителя с применением методов культивирования тканей или клеток.
Используемые здесь термины «сорт» и «разновидность» являются синонимами и означают линию, используемую в промышленном производстве.
Термины «стабильность» или «стабильный», если они относятся к данному компоненту, означают, что данный компонент сохраняется от поколения к поколению, а предпочтительно, по меньшей мере по трем поколениям, в основном, на одном и том же уровне, например, предпочтительно, ±15%, более предпочтительно, ±10%, а наиболее предпочтительно, ±5%. Стабильность может зависеть от температуры, региона, стресса и времени посева. Последующие поколения, выращенные в полевых условиях, должны продуцировать этот компонент на аналогичном уровне.
Термин «коммерческая ценность» растения означает, что данное растение имеет хорошую всхожесть и высокую фертильность, что позволяет фермерам выращивать эту культуру на фермах со стандартным сельскохозяйственным оборудованием, а масло с описанными здесь компонентами может быть экстрагировано из семян на стандартном оборудовании для помола и экстракции. Данная культура считается коммерчески ценной, если ее урожайность, определяемая по массе семян, содержание масла и общее количество масла, полученное на один акр, составляет в пределах 15% от средней урожайности какого-либо другого сравнимого коммерческого сорта сои, не имеющего каких-либо других ценных признаков, характерных для данного региона.
Термин «агрономически элитный» относится к линии, которая имеет желательные агрономические свойства, такие как высокая урожайность, зрелость, резистентность к болезням и т.п., а также устойчивость к гербицидам, сообщаемые рассматриваемому(ым) трансформанту(ам). Агрономические признаки, взятые отдельно или в любой комбинации, как описано ниже в примерах для растения, содержащего трансген согласно изобретению, входят в объем настоящего изобретения. Любые и все описанные агрономические признаки и контрольные точки могут быть использованы для идентификации таких растений либо в виде оценочного балла, либо любой граничной точки или обеих граничных точек интервала значений, используемых для определения свойств таких растений.
Как будет очевидно из данного описания, предпочтительные варианты наборов для детектирования могут, например, включать зонды и/или праймеры, связанные с «последовательностями стыка» или «последовательностями транзиции» и/или содержащие «последовательности стыка» или «последовательности транзиции» (где геномная фланкирующая последовательность сои присоединена к последовательности вставки). Так, например, эти наборы включают полинуклеотидные зонды, праймеры и/или ампликоны, сконструированные для идентификации одной или обеих последовательностей стыка (где вставка присоединена к фланкирующей последовательности), как показано в таблице 1. Одной из стандартных конструкций является конструкция, имеющая один праймер, который гибридизуется во фланкирующей области, и один праймер, который гибридизуется во вставке. Такие праймеры обычно имеют длину по меньшей мере 15 остатков. При таком расположении, праймеры могут быть использованы для генерирования/амплификации детектируемого ампликона, который указывает на присутствие трансгена согласно изобретению. Эти праймеры могут быть использованы для генерирования ампликона, который охватывает (и включает) последовательность стыка, указанную выше.
Праймер(ы), «присоединяющиеся» к фланкирующей последовательности, обычно не гибридизуется(ются) в области, находящейся за пределами приблизительно 200 оснований или за пределами области стыка. Таким образом, типичные фланкирующие праймеры должны быть сконструированы так, чтобы они содержали по меньшей мере 15 остатков любой цепи в пределах 200 оснований во фланкирующих последовательностях от начала вставки. То есть, праймеры, содержащие последовательность соответствующего размера, состоящую из остатков (или гибридизующиюся с ними) в области, составляющей в пределах от 100 до 200-500 оснований или т.п., и начинающейся от любой из последовательностей стыка или обеих последовательностей стыка, идентифицированых выше, также входят в объем настоящего изобретения. Аналогичным образом, праймеры вставки могут быть сконструированы в любом участке вставки, однако, остатки на этой вставке (включая комплемент), находящейся в области, составляющей в пределах от 100 до 200-500 или т.п. оснований, и начинающейся от последовательности(ей) стыка, идентифицированной(ых) выше, могут быть использованы, например, для конструирования каждого праймера без исключения.
Для специалиста в данной области также очевидно, что праймеры и зонды могут быть сконструированы для гибридизации, в стандартных условиях гибридизация и/или ПЦР-условиях, с сегментами представленных здесь последовательностей (или их комплементов), где указанный праймер или зонд не является полностью комплементарным репрезентативной последовательности. То есть, в данном случае может быть допустима определенная степень несоответствия. Что касается праймера, состоящего приблизительно из 20 нуклеотидов, то, обычно, например, один, два или т.п. нуклеотидов необязательно будут связываться с противоположной цепью, если ошибочно спаренное основание находится внутри или на конце праймера, противоположного ампликону. Различные подходящие условия гибридизации приводятся ниже. В качестве зондов могут быть также использованы синтетические нуклеотидные аналоги. Могут быть также использованы пептид-содержащие нуклеиновокислотные зонды (PNA), а также ДНК- и РНК-зонды. Важно отметить, что такие зонды и праймеры (которые способны идентифицировать и дифференцировать уникальные признаки) могут быть использованы в диагностических анализах на присутствие трансгена согласно изобретению.
Следует отметить, что при ПЦР-амплификации могут возникать ошибки, которые могут давать, например, незначительные ошибки при секвенировании. То есть, если это не оговорено особо, описанные здесь последовательности были определены путем конструирования длинных ампликонов, происходящих от геномных ДНК сои, с последующим клонированием и секвенированием этих ампликонов. Поэтому неудивительно, что в последовательностях, полученных и определенных таким способом, могут быть обнаружены незначительные различия и некоторые несоответствия, если принять во внимание необходимость проведения множества раундов амплификации для получения ампликона, достаточного для секвенирования геномных ДНК. Следует заметить и принять во внимание, что любые уточнения, необходимые для исправления ошибок или несоответствий такого типа, которые обычно возникают при секвенировании, входят в объем настоящего изобретения.
Следует также отметить, что некоторые геномные последовательности нередко являются делетированными, например, при встраивании последовательности в процессе создания трансгена. Таким образом, между рассматриваемыми фланкирующими последовательностями и геномными последовательностями, имеющимися, например, в базе данных GENBANK, могут наблюдаться некоторые различия.
Компоненты «вставки» представлены на фигурах и более подробно обсуждаются ниже в примерах. Полинуклеотидные последовательности ДНК этих компонентов или их фрагменты могут быть использованы в качестве ДНК-праймеров или зондов в способах согласно изобретению.
В некоторых вариантах изобретения, указанные композиции и способы применяются для детектирования присутствия трансгенной/геномной области вставки в растениях сои и в ее семенах и т.п. Настоящее изобретение относится к последовательностям ДНК, содержащим описанную здесь трансгенную/геномную последовательность стыка в области вставки; сегменты, содержащие идентифицированную здесь последовательность стыка, и комплементы любых указанных репрезентативных последовательностей и любых их сегментов. Последовательность стыка области вставки охватывает последовательность стыка, расположенную между гетерологичной ДНК, встроенной в геном, и ДНК, присутствующей в клетках растения сои и фланкирующей сайт инсерционный сайт. Такие последовательности позволяют диагностировать данный трансген.
На основе этих последовательностей вставки и граничных последовательностей могут быть сконструированы праймеры, специфичные для данного трансгена. ПЦР-анализ показал, что линии растения сои согласно изобретению могут быть идентифицированы на различные генотипы сои путем проведения анализа ПЦР-ампликонов, полученных с использованием наборов этих праймеров, специфичных для данного трансгена. Эти и другие родственные методы могут быть применены для идентификации уникальных свойств этих линий растения сои. Таким образом, ПЦР-ампликоны, происходящие от указанных пар праймеров, являются уникальными и могут быть использованы для идентификации указанных линий растения сои.
В некоторых вариантах изобретения, последовательности ДНК, которые содержат смежный фрагмент нового трансгена/геномной области вставки, также являются аспектом настоящего изобретения. Настоящее изобретение включает последовательности ДНК, которые содержат полинуклеотидную последовательность трансгенной вставки достаточной длины, происходящую от одной или более вышеуказанных растений сои, и/или последовательности, которые могут быть служить в качестве праймерных последовательностей для продуцирования продукта-ампликона, используемого для идентификации одного или более этих растений сои.
Родственные варианты изобретения относятся к последовательностям ДНК, которые содержат по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более смежных нуклеотидов трансгенной части идентифицированной здесь последовательности ДНК или ее комплемента, и фланкирующую последовательность ДНК сои аналогичной длины (такую как SEQ ID NO:1 и SEQ ID NO:2 и их сегменты), происходящую от указанных последовательностей или их комплементов. Такие последовательности могут быть использованы в качестве ДНК-праймеров в методах амплификации ДНК. Ампликоны, продуцированные с использованием этих праймеров, позволяют идентифицировать любые описанные здесь генетически модифицированные растения сои. Поэтому, настоящее изобретение также включает ампликоны, продуцированные с использованием таких ДНК-праймеров и гомологичных праймеров.
Настоящее изобретение также включает способы детектирования присутствия ДНК в образце, который соответствует описанному здесь трансгену сои. Такие способы могут включать: (a) контактирование образца, содержащего ДНК, с набором праймеров, которые, при их использовании в реакции амплификации нуклеиновой кислоты с ДНК, происходящей по меньшей мере от одного из этих трансгенов сои, продуцируют ампликон, позволяющий идентифицировать указанный(е) трансген(ы); (b) осуществление реакции амплификации нуклеиновой кислоты с получением ампликона, и (c) детектирование ампликона.
Другие способы детектирования согласно изобретению включают способ детектирования присутствия ДНК в образце, соответствующем указанному трансгену, где указанный способ включает: (a) контактирование образца, содержащего ДНК с зондом, который гибридизуется в жестких условиях гибридизации с ДНК, происходящей по меньшей мере от одного из указанных трансгенов сои, и который не гибридизуется в жестких условиях гибридизации с ДНК контрольного растения сои (не содержащего представляющую интерес ДНК-вставку); (b) гибридизацию образца и зонда в жестких условиях; и (c) детектирование гибридизации зонда с ДНК.
В других своих вариантах, настоящее изобретение включает способы получения растения сои, содержащего генетическое событие pDAB8264.42.32.1, где указанный способ включает стадии: (a) полового скрещивания первой родительской линии сои (содержащей экспрессионные кластеры согласно изобретению, сообщающие растениям указанной линии признак резистентности к гербицидам) со второй родительской линией сои (не имеющей такого признака устойчивости к гербицидам) с получением множества потомств растения; и (b) отбор потомства растения с использованием молекулярных маркеров. Такие способы могут включать, но необязательно, дополнительную стадию возвратного скрещивания потомства растения со второй родительской линией сои с получением чистосортного растения сои, которое имеет указанный признак устойчивости к гербицидам.
В соответствии с другим своим аспектом, настоящее изобретение относится к способам определения зиготности потомства кроссов с указанным трансгеном. Такие способы могут включать контактирование образца, содержащего ДНК сои, с набором праймеров согласно изобретению. Указанные праймеры, при их использовании в реакции амплификация нуклеиновой кислоты с геномной ДНК, происходящей по меньшей мере от одного из указанных трансгенных растений сои, продуцируют первый ампликон, позволяющий идентифицировать по меньшей мере один из указанных трансгенов сои. Такие способы также включают осуществление реакции амплификации нуклеиновой кислоты с продуцированием первого ампликона; детектирование первого ампликона и контактирование образца, содержащего ДНК сои, с указанным набором праймеров (указанный набор праймеров, если он используется в реакции амплификации нуклеиновой кислоты с геномной ДНК растений сои, продуцирует второй ампликон, содержащий нативную геномную ДНК сои, гомологичную геномной области сои); и осуществление реакции амплификации нуклеиновой кислоты с продуцированием второго ампликона. Указанные способы также включают детектирование второго ампликона и сравнение первого и второго ампликонов в образце, где присутствие обоих ампликонов указывает на то, что данный образец является гетерозиготным по трансгенной вставке.
Наборы для детектирования ДНК могут быть разработаны с применением описанных здесь композиций и методов, хорошо известных специалистам в области детектирования ДНК. Эти наборы являются подходящими для идентификации рассматриваемой ДНК-вставки в образце растения сои, и могут быть применены в методах скрещивания растений сои, содержащих эту ДНК. Указанные наборы содержат последовательности ДНК, которые являются гомологичными или комплементарными ампликонам, например, описанным в настоящей заявке, или последовательности ДНК, которые являются гомологичными или комплементарными ДНК, содержащейся в трансгенных генетических элементах рассматриваемых трансформантов. Эти последовательности ДНК могут быть использованы в реакциях амплификации ДНК или в качестве зондов в методе гибридизации ДНК. Указанные наборы могут также содержать реагенты и материалы, необходимые для осуществления метода детектирования.
«Зонд» представляет собой выделенную молекулу нуклеиновой кислоты, к которой присоединена стандартная детектируемая метка или репортерная молекула (например, радиоактивный изотоп, лиганд, хемилюминесцентный агент или фермент). Такой зонд комплементарен цепи нуклеиновой кислоты-мишени, а в случае настоящего изобретения, цепи геномной ДНК, происходящей от одного из указанных трансформантов сои, независимо от того, происходят ли они от растения сои или образца, включающего ДНК трансформанта. Зондами согласно изобретению являются не только дезоксирибонуклеиновые или рибонуклеиновые кислоты, но также и полиамиды и другие материалы, которые специфически связываются с последовательностью ДНК-мишени и могут быть использованы для детектирования присутствия этой последовательности ДНК-мишени. Термин «выделенный» полинуклеотид означает, что данный полинуклеотид находится не в том состоянии, в котором он обычно присутствует в природе, а функционально присоединен, например, к гетерологичному промотору. Аналогичным образом, термин «очищенный» белок означает белок, который не находится в своем природном состоянии.
«Праймеры» представляют собой выделенные/синтезированные нуклеиновые кислоты, которые были подвергнуты отжигу с комплементарной цепью ДНК-мишени посредством гибридизации нуклеиновых кислот с образованием гибрида «праймер - цепь ДНК-мишени» и с последующим удлинением цепи ДНК-мишени под действием полимеразы, например, ДНК-полимеразы. Пары праймеров согласно изобретению могут быть использованы для амплификации последовательности нуклеиновой кислоты-мишени, например, с помощью полимеразной цепной реакции (ПЦР) или с применением других стандартных методов амплификации нуклеиновых кислот.
Зонды и праймеры обычно имеют длину в 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189,190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225,226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477,478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499 или 500 полинуклеотидов или более. Такие зонды и праймеры специфически гибридизуются с последовательностью-мишенью посредством гибридизации в условиях высокой жесткости. Предпочтительно, зонды и праймеры согласно изобретению имеют последовательности, полностью идентичные последовательности-мишени, и зонды, которые отличаются от последовательности-мишени и сохраняют способность гибридизоваться с последовательностями-мишенями, могут быть сконструированы стандартными методами.
Методы получения и использования зондов и праймеров описаны, например, в руководстве Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, ed. Sambrook et al., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989. Пары ПЦР-праймеров могут быть получены из известной последовательности, например, с использованием компьютерных программ, разработанных для этой цели.
Праймеры и зонды, полученные на основе описанных здесь фланкирующих последовательностей ДНК и последовательностей вставки, могут быть использованы для подтверждения (и если это необходимо, для коррекции) описанных последовательностей стандартными методами, например, путем повторного клонирования и секвенирования таких последовательностей.
Нуклеиновокислотные зонды и праймеры согласно изобретению гибридизуются с последовательностью ДНК мишени в жестких условиях. Для детектирования присутствия ДНК трансгенной вставки в образце может быть применен стандартный метод гибридизации нуклеиновых кислот или метод амплификации нуклеиновых кислот. Молекулы нуклеиновой кислоты или их фрагменты способны специфически гибридизоваться с другими молекулами нуклеиновой кислоты в определенных условиях. Считается, что две молекулы нуклеиновой кислоты способны специфически гибридизоваться друг с другом, если эти две молекулы образуют антипараллельную структуру двухцепочечной нуклеиновой кислоты. Считается, что молекула нуклеиновой кислоты «комплементарна» другой молекуле нуклеиновой кислоты, если эти молекулы обладают полной комплементарностью. Считается, что молекулы являются «полностью комплементарными», если каждый нуклеотид одной из этих молекул комплементарен нуклеотиду другой молекулы. Две молекулы считаются «минимально комплементарными», если они могут гибридизоваться друг с другом, но при этом, сохранять стабильность, достаточную для их гибридизации друг с другом по меньшей мере в стандартных условиях «низкой жесткости». Аналогичным образом, считается что молекулы являются «комплементарными», если они могут гибридизоваться друг с другом, но при этом, сохранять стабильность, достаточную для их гибридизации друг с другом по меньшей мере в стандартных условиях «высокой жесткости». Стандартные условия жесткости описаны в руководстве Sambrook et al., 1989. Поэтому, отклонение от полной комплементарности допустимо, если такое отклонение не будет приводить к абсолютной неспособности молекул образовывать двухцепочечную структуру. Для того, чтобы молекула нуклеиновой кислоты могла служить в качестве праймера или зонда, необходимо только, чтобы она была в достаточной степени комплементарна последовательности, способной образовывать стабильную двухцепочечную структуру в присутствии конкретного растворителя и в присутствии соли в определенной концентрации.
Используемый здесь термин «по существу, гомологичная последовательность» означает последовательность нуклеиновой кислоты, которая специфически гибридизуется с комплементом последовательности нуклеиновой кислоты, с которой она гибридизуется в условиях «высокой жесткости». Термин «жесткие условия» функционально определены с точки зрения гибридизации нуклеиновокислотного зонда с нуклеиновой кислотой-мишенью (то есть, с конкретной представляющей интерес последовательностью нуклеиновой кислоты), проводимой в соответствии с процедурой специфической гибридизации, обсуждаемой в руководстве Sambrook et al., 1989, at 9.52-9.55. См. также, Sambrook et al., 1989 at 9.47-9.52 and 9.56-9.58. В соответствии с этим, нуклеотидные последовательности согласно изобретению могут быть использованы в соответствии с их способностью селективно образовывать дуплексные молекулы с комплементарными фрагментами ДНК.
В зависимости от цели применения, условия гибридизации могут варьироваться для достижения различных степеней селективности зонда по отношению к последовательности-мишени. В тех случаях, когда требуется высокая селективность, обычно используются относительно жесткие условия образования гибридов, например, в случае проведения анализа TAQMAN в конечной точке и ПЦР в реальном времени, следует использовать MgCl2 в концентрации от 1,5 мМ и приблизительно до 4,0 мМ при температуре приблизительно 60-75°C, при этом, для повышения жесткости, время удерживания может варьироваться, как описано в настоящей заявке. В других методах, гибридизацию обычно проводят с использованием относительно низких концентраций соли и/или при высокой температуре, например, в другом случае, концентрация NaCl может составлять приблизительно от 0,02M до 0,15M NaCl, а температура может составлять приблизительно от 50°C до 70°C. Жесткие условия, например, могут включать по меньшей мере 2-кратную промывку гибридизационного фильтра промывочным буфером высокой жесткости (0,2×SSC, 0,1% ДСН, 65°C). Соответствующие условия жесткости, стимулирующие гибридизацию ДНК, например, обработка 6,0× хлоридом натрия/цитратом натрия (SSC) приблизительно при 45°C, с последующей промывкой 2,0×SSC при 50°C, известны специалистам в данной области. Так, например, концентрация соли в стадии промывки может быть выбрана из концентраций соли, обычно используемых в условиях низкой жесткости, а именно, приблизительно 2,0×SSC при 50°C, и концентраций соли, обычно используемых в условиях высокой жесткости, а именно, приблизительно 0,2×SSC при 50°C. Кроме того, температура в стадии промывки, которая в условиях низкой жесткости составляет приблизительно 22°C, то есть комнатную температуру, может быть повышена до температуры гибридизации в условиях высокой жесткости, то есть приблизительно до 65°C. Температура и концентрация соли могут варьироваться, либо один из этих параметров может оставаться постоянным, а другой может изменяться. При таких селективных условиях могут наблюдаться незначительные несоответствия, если они вообще имеются, между зондом и матрицей или цепью-мишенью. Детектирование последовательностей ДНК посредством гибридизации хорошо известно специалистам, и репрезентативные методы анализов посредством гибридизации описаны в патентах США №№ 4965188 и 5176995.
В особенно предпочтительном варианте изобретения, нуклеиновая кислота согласно изобретению может специфически гибридизоваться с одним или более проиллюстрированными или описанными здесь праймерами (или ампликонами или другими последовательностями), включая комплементы и их фрагменты, в условиях высокой жесткости. В одном из аспектов настоящего изобретения, маркерная молекула нуклеиновой кислоты согласно изобретению имеет последовательность нуклеиновой кислоты, представленную здесь в одной из репрезентативных последовательностей, или ее комплементы и/или фрагменты.
В другом аспекте настоящего изобретения, маркерная молекула нуклеиновой кислоты согласно изобретению имеет последовательность, которая на 80-100% или 90-100% идентична указанным последовательностям нуклеиновой кислоты. В другом аспекте настоящего изобретения, маркерная молекула нуклеиновой кислоты согласно изобретению имеет последовательность, которая на 95-100% идентична указанной последовательности нуклеиновой кислоты. Такие последовательности могут быть использованы в качестве маркеров в методах скрещивания растений для идентификации потомства генетических кроссов. Гибридизация зонда с молекулой ДНК-мишени может быть детектирована любыми методами известными специалистам, и такими методами могут быть, но не ограничиваются ими, методы, осуществляемые с использованием флуоресцентных меток, радиоактивных меток, меток на основе антител и хемилюминесцентных меток.
Что касается амплификации последовательности нуклеиновой кислоты-мишени (например, с помощью ПЦР), проводимой с использованием конкретной пары праймеров для амплификации, то термин «жесткие условия» означает условия, которые позволяют паре праймеров гибридизоваться только с последовательностью нуклеиновой кислоты-мишени, с которой может связываться праймер, имеющий соответствующую последовательность дикого типа (или ее комплемент), и предпочтительно, продуцировать уникальный продукт амплификации, то есть, ампликон.
Термин «специфичный к (последовательности-мишени)» означает, что зонд или праймер гибридизуются в жестких условиях гибридизации только с последовательностью-мишенью в образце, содержащем такую последовательность-мишень.
Используемые здесь термины «амплифицированная ДНК» или «ампликон» означают продукт амплификации последовательности нуклеиновой кислоты-мишени, которая является частью нуклеиновокислотной матрицы. Так, например, для того, чтобы определить, может ли растение сои, полученное в результате полового скрещивания, содержать трансгенную геномную ДНК растения сои согласно изобретению, ДНК, экстрагированная из образца ткани растения сои, может быть подвергнута амплификации нуклеиновой кислоты с использованием пары праймеров, которая включает праймер, происходящий от фланкирующей последовательности, присутствующей в геноме растения и находящейся поблизости от инсерционного сайта встроенной гетерологичной ДНК, и второй праймер, происходящий от встроенной гетерологичной ДНК, в результате чего может быть получен ампликон, который может быть использован для детектирования присутствия трансгенной ДНК. Ампликон имеет длину и последовательность, которые также являются подходящими для детектирования такого трансгена. Длина ампликона может варьироваться в пределах от общей длины пар праймеров плюс одна пара нуклеотидных оснований, и/или общей длины пар праймеров плюс приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314, 315, 316, 317, 318, 319, 320, 321, 322, 323, 324, 325, 326, 327, 328, 329, 330, 331, 332, 333, 334, 335, 336, 337, 338, 339, 340, 341, 342, 343, 344, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 361, 362, 363, 364, 365, 366, 367, 368, 369, 370, 371, 372, 373, 374, 375, 376, 377, 378, 379, 380, 381, 382, 383, 384, 385, 386, 387, 388, 389, 390, 391, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 402, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 417, 418, 419, 420, 421, 422, 423, 424, 425, 426, 427, 428, 429, 430, 431, 432, 433, 434, 435, 436, 437, 438, 439, 440, 441, 442, 443, 444, 445, 446, 447, 448, 449, 450, 451, 452, 453, 454, 455, 456, 457, 458, 459, 460, 461, 462, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499 или 500, 750, 1000, 1250, 1500, 1750, 2000 или более пар нуклеотидных оснований (± любые из перечисленных выше приращений). Альтернативно, пара праймеров может происходить от фланкирующей последовательности, расположенной на обеих сторонах встроенной ДНК, в результате чего может продуцироваться ампликон, который включает полноразмерную нуклеотидную последовательность вставки. Один из членов пары праймеров, происходящий от геномной последовательности растения, может находиться на определенном расстоянии от встроенной последовательности ДНК. Такое расстояние может включать интервал от одной пары нуклеотидных оснований и приблизительно до двадцати тысяч пар нуклеотидных оснований. В используемое здесь понятие термина «ампликон», в частности, не входят димеры праймеров, которые могут образовываться в реакции термоамплификации ДНК.
Амплификация нуклеиновой кислоты может быть осуществлена любым из различных методов амплификации нуклеиновой кислоты, известных специалистам, включая полимеразную цепную реакцию (ПЦР). Специалистам известны различные методы амплификации, и эти методы описаны, inter alia, в патенте США No. 4683195 и в патенте США № 4683202. Методы ПЦР-амплификации были разработаны для амплификации геномной ДНК длиной до 22 т.п.н. Эти методы, а также другие методы амплификации ДНК, известные специалистам, могут быть применены для практического осуществления настоящего изобретения. Последовательность гетерологичной трансгенной ДНК-вставки или фланкирующая геномная последовательность рассматриваемого трансформанта сои могут быть подтверждены (и скорректированы, если это необходимо) путем амплификации таких последовательностей, происходящих от указанного трансформанта, с использованием праймеров, происходящих от описанных здесь последовательностей, с последующим проведением стандартного секвенирования ПЦР-ампликона или клонированной ДНК.
Ампликон, полученный такими методами, может быть детектирован различными способами. Наиболее хорошо известным методом детектирования ДНК-ампликонов является электрофорез в агарозном геле и окрашивание этидийбромидом. Другим таким методом является генетический элементный анализ, где сконструированный ДНК-олигонуклеотид перекрывается со смежной фланкирующей последовательностью геномной ДНК и со встроенной последовательностью ДНК. Этот олигонуклеотид иммобилизуют на лунках микротитрационного луночного планшета. После ПЦР представляющей интерес области (проводимой с использованием одного праймера во встроенной последовательности и одного праймера в смежной фланкирующей геномной последовательности), одноцепочечный ПЦР-продукт может быть гибридизован с иммобилизованным олигонуклеотидом и может служить в качестве матрицы для проведения реакции удлинения на одно основание с использованием ДНК-полимераз и меченных ddNTP, специфичных к предполагаемому следующему основанию. Считывание может быть осуществлено с помощью флуоресцентного или ELISA-анализа. Сигнал указывает на присутствие вставки/фланкирующей последовательности, что свидетельствует об успешном осуществлении амплификации, гибридизации и удлинении на одно основание.
Другим методом является метод пиросеквенирования, описанный Winge (Innov. Pharma. Tech. 00: 18-24, 2000). В этом методе, сконструированный олигонуклеотид перекрывается со смежной геномной ДНК и с последовательностью стыка ДНК-вставки. Олигонуклеотид подвергают гибридизации с одноцепочечным ПЦР-продуктом представляющей интерес области (проводимой с использованием одного праймера во встроенной последовательности и одного праймера во фланкирующей геномной последовательности), и инкубируют в присутствии ДНК-полимеразы, ATP, сульфурилазы, люциферазы, апиразы, аденозин-5'-фосфосульфата и люциферина. Затем отдельно добавляют DNTP, и такое добавление приводит к продуцированию детектируемого светового сигнала. Световой сигнал указывает на присутствие трансгенной вставки/фланкирующей последовательности, что свидетельствует об успешном осуществлении амплификации, гибридизации и удлинении на одно или несколько оснований.
Другим методом, который может быть применен для детектирования ампликона согласно изобретению, является поляризация флуоресценции. В этом методе конструируют олигонуклеотид, который перекрывается с геномной фланкирующей последовательностью и с последовательностью стыка ДНК-вставки. Олигонуклеотид подвергают гибридизации с одноцепочечным ПЦР-продуктом представляющей интерес области (проводимой с использованием одного праймера во встроенной ДНК и одного праймера во фланкирующей геномной последовательности ДНК), и инкубируют в присутствии ДНК-полимеразы и флуоресцентно меченного ddNTP. Удлинение на одно основание приводит к включению ddNTP. Такое включение может быть определено по изменению поляризации на флуориметре. Изменение поляризации указывает на присутствие трансгенной вставки/фланкирующей последовательности, что свидетельствует об успешном осуществлении амплификации, гибридизации и удлинении на одно основание.
TAQMAN (PE Applied Biosystems, Foster City, Calif.) представляет собой метод детектирования присутствия ДНК и количественной оценки последовательности ДНК. Вкратце, был сконструирован олигонуклеотидный зонд FRET, который перекрывается с геномной фланкирующей последовательностью и с последовательностью стыка ДНК-вставки. Зонд FRET и ПЦР-праймеры (один праймер во встроенной последовательности ДНК и один во фланкирующей геномной последовательности) подвергают реакции циклизации в присутствии термостабильной полимеразы и dNTP. В процессе специфической амплификации, ДНК-полимераза Taq гидролизуется, в результате чего, из гасящей молекулы на зонде FRET высвобождается флуоресцентная молекула. Флуоресцентный сигнал указывает на присутствие фланкирующей последовательности/трансгенной последовательности-вставки, что свидетельствует об успешном осуществлении амплификации и гибридизации.
Для детектирования последовательности могут быть применены описанные методы молекулярных маяков. Вкратце, был сконструирован олигонуклеотидный зонд FRET, который перекрывается с фланкирующей геномной последовательностью и с последовательностью стыка ДНК-вставки. Уникальность структуры зонда FRET состоит в том, что этот зонд имеет вторичную структуру, поддерживающую флуоресцентную и гасящую молекулы в непосредственной близости друг от друга. Зонд FRET и ПЦР-праймеры (один праймер во встроенной последовательности ДНК и один во фланкирующей геномной последовательности) подвергают реакции циклизации в присутствии термостабильной полимеразы и dNTP. После успешной ПЦР-амплификации, гибридизация зонда FRET с последовательностью-мишенью приводит к удалению вторичной структуры зонда и к пространственному разделению флуоресцентной и гасящей молекул. В результате возникает флуоресцентный сигнал. Флуоресцентный сигнал указывает на присутствие фланкирующей геномной последовательности/трансгенной последовательности-вставки, что свидетельствует об успешном осуществлении амплификации и гибридизации.
Принимая во внимание тот факт, что определенная локализация в геноме сои является особенно подходящей для инсерции, можно сказать, что настоящее изобретение также включает семена сои и/или растение сои, содержащие по меньшей мере одну не-aad12/pat/2mepsps-кодирующую последовательность, находящуюся в этом положении генома или почти рядом с этим положением. Одним из вариантов является замена описанной здесь вставки на другую вставку. Вообще говоря, в настоящем изобретении может быть, например, осуществлена направленная гомологичная рекомбинация. Технология такого типа рассматривается, например, в WO 03/080809 A2 и в соответствующей опубликованной заявке на патент США (U.S. 2003/0232410). Таким образом, настоящее изобретение включает растения и клетки растений, содержащие гетерологичную вставку (введенную вместо множества копий репрезентативных вставок или в комбинации с этими копиями), фланкированную полноразмерными фланкирующими последовательностями, представленными здесь как SEQ ID NO:1 и SEQ ID NO:2, или распознаваемой частью этих последовательностей. С применением такого(их) способа(ов) может (могут) быть также встроена(ы) дополнительная копия (или дополнительные копии) репрезентативной вставки или любых ее компонентов.
Все цитируемые здесь патенты, патентные заявки, предварительные заявки и публикации, во всей своей полноте вводятся в настоящее описание посредством ссылки в той области, которая конкретно соответствует описанию настоящего изобретения.
Нижеследующие примеры приводятся для иллюстрации методов практического осуществления изобретения и описания некоторых предпочтительных вариантов изобретения. Эти примеры не должны рассматриваться как ограничение настоящего изобретения. При этом, для специалиста в данной области очевидно, что методы, описанные в нижеследующих примерах, представляют собой конкретно применяемые подходы, представленные для иллюстрации предпочтительных вариантов практического осуществления изобретения. Однако, специалисту в данной области, исходя из описания изобретения, будет очевидно, что в эти конкретные варианты осуществления изобретения может быть внесено множество изменений, позволяющих получить такой же или аналогичный результат и не выходящих за рамки существа и объема изобретения. Если это не оговорено особо, то все проценты даны по массе, а все соотношения растворителей в смеси даны по объему, если это не указано конкретно.
Если это не оговорено особо, то нижеследующие сокращения означают:
|
|
ПРИМЕРЫ
Пример 1: Трансформация и отбор растений сои с генетическим событием pDAB8264.42.32.1, содержащих 2mEPSPS и AAD-12
Трансгенную сою (Glycine max), содержащую генетическое событие pDAB8264.42.32.1, получали посредством Agrobacterium-опосредуемой трансформации эксплантатов в утолщениях в семядоле сои. Для инициации трансформации использовали инактивированный штамм EHA101 Agrobacterium (Hood et al., 1993), несущий бинарный вектор pDAB8264 (фиг.1), содержащий селективный маркер, pat v6, и представляющие интерес гены, aad-12 v1 и 2mEPSPS v1, в области T-цепи ДНК.
Agrobacterium-опосредуемую трансформацию осуществляли модифицированным методом, описанным Zeng et al. (2004). Вкратце, семена сои (сорта Maverick) проращивали на базальной среде, а затем выделяли утолщения семядоли, и эти утолщения инфицировали агробактерией. В среды для стимуляции образования, удлинения и укоренения побегов добавляли цефотаксим, тиментин и ванкомицин в целях удаления агробактерий. Для ингибирования роста нетрансформированных побегов использовали глюфозинат. Отобранные побеги переносили в среду для укоренения для инициации образования корней, а затем переносили в почвенную смесь для акклиматизации проростков.
Верхушечные листья отобранных проростков окрашивали глюфозинатом для скрининга на предполагаемые трансформанты. Скринированные проростки переносили в теплицу, оставляли для акклиматизации, а затем листья окрашивали глюфозинатом для повторного подтверждения устойчивости к гербицидам и детектирования присутствия предполагаемых трансформантов. Затем брали образцы скринированных растений и проводили их молекулярный анализ для подтверждения присутствия селективного маркерного гена и/или представляющего интерес гена. Растения T0 оставляли в теплице для самоопыления и получали семена Т1.
Этот трансформант, то есть, сою с генетическим событием pDAB8264.42.32.1, получали из независимо трансформированного изолята. Растения Т1 подвергали возвратному скрещиванию и интрогрессии в элитные сорта в последующих поколениях. Данный трансформант отбирали исходя из его уникальных свойств, таких как единственный инсерционный сайт, нормальная менделевская сегрегация, стабильная экспрессия и превосходная комбинация свойств, включая устойчивость к гербицидам и агрономические показатели. В нижеследующих примерах представлены данные, которые были использованы для характеризации трансформанта сои с генетическим событием pDAB8264.42.32.1.
Пример 2: Характеризация экспрессии белка в генетическом событии сои с модификацией pDAB8264.42.32.1
Были охарактеризованы биохимические свойства рекомбинантных белков AAD-12, 2mEPSPS и PAT, экспрессируемых в генетическом событии сои с модификацией pDAB8264.42.32.1. Количественный твердофазный иммуноферментный анализ (ELISA) представляет собой известный биохимический анализ, который может быть осуществлен в целях характеризации биохимических свойств белков и подтверждения экспрессии этих белков в указанных трансформантах сои.
Пример 2.1: Экспрессия белка PAT в тканях растения
Уровни белка PAT определяли в генетическом событии сои pDAB8264.42.32.1. Растворимый белок PAT, экстрагированный из ткани листьев сои, анализировали с помощью количественного твердофазного иммуноферментного анализа (ELISA).
Образцы ткани сои выделяли из тестируемых растений и подготавливали для анализа на экспрессию. Белок PAT экстрагировали из тканей растений сои с использованием забуференного фосфатом физиологического раствора, содержащего детергент твин-20 (PBST), включающий 1% поливинилпирролидон (ПВП). Ткань растения центрифугировали, а затем собирали водный супернатант, разводили соответствующим буфером, если это необходимо, и анализировали с использованием набора для «сэндвич»-ELISA PAT. Этот набор использовали в соответствии с протоколом, рекомендованным производителями (Envirologix, Portland, ME). Этот анализ подтвердил экспрессию белка PAT.
Анализ по детектированию осуществляли для оценки стабильности экспрессии, а также вертикального наследования (между поколениями) и горизонтального наследования (между линиями внутри поколения) генетического события pDAB8264.42.32.1 в растениях сои. Поколения трансформантов сои с генетическим событием pDAB8264.42.32.1 от T3 до T5 имели стабильную экспрессию, и такая экспрессия наблюдалась во всех линиях.
Пример 2.2: Экспрессия белков AAD-12 and 2mEPSPS в тканях растения
Уровни белков AAD-12 и 2mEPSPS определяли в генетическом событии сои pDAB8264.42.32.1. Растворимые белки, экстрагированные из ткани листьев сои, анализировали с помощью количественного твердофазного иммуноферментного анализа (ELISA).
Образцы ткани сои выделяли из тестируемых растений и подготавливали для анализа на экспрессию. Белки AAD-12 и 2mEPSPS экстрагировали из тканей растений сои с использованием забуференного фосфатом физиологического раствора, содержащего детергент твин-20 (PBST), включающий 1% альбумин бычьей сыворотки (BSA). Ткань растения центрифугировали, а затем собирали водный супернатант, разводили соответствующим буфером, если это необходимо, и анализировали с использованием набора для «сэндвич»-ELISA AAD-12 и GA21, соответственно. Этот набор использовали в соответствии с протоколом, рекомендованным производителями (AAD-12: номер по каталогу 20-0161, Beacon Analytical Systems, Inc., Saco, Maine; 2mEPSPS: кат. #7020100, Strategic Diagnostics, Newark, DE). Поколения трансформантов сои с генетическим событием pDAB8264.42.32.1 от T4 до T6 имели стабильную экспрессию AAD-12 и 2mEPSPS, и такая экспрессия наблюдалась во всех линиях.
Пример 2.3: Исследование по эффективности экспрессии
Полевые исследования на уровни экспрессии генетического события сои pDAB8264.42.32.1 осуществляли на растениях в фазе роста V3. Исследования по определению уровней экспрессии проводили на всех делянках, обработанных гербицидами путем распыления, а также на необработанных делянках. Эти эксперименты осуществляли в соответствии с описанными ранее протоколами. Уровни экспрессии были аналогичны для всех делянок, то есть, для необработанных делянок и делянок, обработанных различными комбинациями гербицидов (таблица 2). Ни на одной стадии исследования, какого-либо значимого повреждения растений не наблюдалось.
|
Пример 3: Клонирование и характеризация последовательности ДНК во вставке и во фланкирующих граничных областях трансформантов сои с генетическим событием pDAB8264.42.32.1
Для характеризации и описания геномного инсерционного сайта определяли последовательность граничных областей фланкирующей геномной Т-ДНК трансформанта сои с генетическим событием pDAB8264.42.32.1. Была подтверждена геномная последовательность трансформанта сои с генетическим событием pDAB8264.42.32.1, включающая 1246 п.н. 5'-фланкирующей граничной последовательности (SEQ ID NO:1) и 504 п.н. 3'-фланкирующей граничной последовательности (SEQ ID NO:2). ПЦР-амплификация граничных последовательностей трансформанта сои с генетическим событием pDAB8264.42.32.1 подтвердила, что граничные области происходят от исходного растения сои, а области стыка представляют собой уникальные последовательности трансформанта сои с генетическим событием pDAB8264.42.32.1. Области стыка могут быть использованы для трансген-специфической идентификации генетического события сои pDAB8264.42.32.1. Кроме того, инсерционный сайт Т-цепи был охарактеризован путем амплификации геномного фрагмента, соответствующего области идентифицированных фланкирующих граничных последовательностей, происходящих от генома нетрансформированной сои дикого типа. Сравнение pDAB8264.42.32.1-генетического события сои с растением, имеющим геномную последовательность дикого типа, выявило делецию оригинального локуса приблизительно в 38 п.н. В целом, характеризация вставки и граничной последовательности pDAB8264.42.32.1-генетического события сои показала, что в геноме сои присутствует интактная копия Т-цепи.
|
|
|
|
|
|
|
Пример 3.1: Подтверждение геномных последовательностей сои
Выравнивание 5'- и 3'-фланкирующих граничных областей с полноразмерной геномной «шотган»-последовательностью хромосомы 15 Glycine max показало, что событие pDAB8264.42.32.1-генетического события сои был встроен в хромосому 15 генома сои. Для подтверждения инсерционного сайта для трансгена генома pDAB8264.42.32.1-генетического события сои осуществляли ПЦР с использованием различных пар праймеров (фиг.2, таблица 3, таблица 4 и таблица 5). Геномную ДНК генетического события сои pDAB8264.42.32.1 и другие трансгенные или нетрансгенные линии сои использовали в качестве матрицы. Таким образом, для того, чтобы подтвердить, что 5'-граничные последовательности представляют собой скорректированные 2mEPSPS v1-специфические праймеры, например, были выбраны праймеры ED_v1_C1 и праймеры, сконструированные для клонированной 5'-концевой граничной последовательности и/или сравниваемой последовательности на хромосоме 15 генома сои, и обозначенные 4232-WF1, 4232-WF3 и 4232-WF4, и эти праймеры были использованы в целях амплификации ДНК-сегмента, который охватывает ген 2mEPSPS v1 до 5'-конца граничной последовательности. Аналогичным образом, для подтверждения клонированной 3'-концевой граничной последовательности, pat-специфический праймер, например, PAT_11, и четыре праймера, сконструированные для клонированной 3'-концевой граничной последовательности и/или сравниваемой последовательности на хромосоме 15 генома сои и обозначенные 4232-WRl, 4232-WR2, 4232-WR3 и 4232-WR4, были использованы в целях амплификации ДНК-сегментов, которые охватывают ген pat до 3'-концевой граничной последовательности. ДНК-фрагменты предсказанного размера были амплифицированы только из геномной ДНК генетического события сои pDAB8264.42.32.1. с использованием каждой пары праймеров, то есть, одного праймера, локализованного на фланкирующей граничной области pDAB8264.42.32.1-генетического события сои и одного трансген-специфического праймера, но не из образцов ДНК, происходящих от других трансгенных линий сои или нетрансгенного контроля. Полученные результаты показали, что клонированные 5'- и 3'-граничные последовательности представляют собой фланкирующие граничные последовательности вставки T-цепи для pDAB8264.42.32.1-генетического события сои.
Для дополнительного подтверждения присутствия в геноме сои ДНК-вставки Т-цепи, геномную ДНК, не содержащую вставки Т-цепи в pDAB8264.42.32.1-генетическом событии сои, подвергали ПЦР-амплификации по всем граничным последовательностям растения сои. Один праймер, сконструированный для 5'-концевой граничной последовательности, 4232-WF1, и два праймера, сконструированные для 3'-концевой граничной последовательности, 4232-WRl и 4232-WR2, были использованы в целях амплификации 5'-концевой граничной последовательности и 3'-концевой граничной последовательности ДНК-сегментов, в которые была встроена Т-цепь pDAB8264. Как и ожидалось, ПЦР-амплификация, проводимая с использованием пары праймеров 4232-WF1 и 4232-WRl, позволяла амплифицировать приблизительно 2,4 т.п.н. ДНК-фрагмента, происходящего от геномной ДНК нетрансгенных контрольных растений сои и других трансгенных линий сои, но не из pDAB8264.42.32.1-генетического события сои. Аналогичным образом, ПЦР-реакции, проводимые с использованием пары праймеров 4232-WF1 и 4232-WR2, продуцировали приблизительно 2,5 т.п.н. ДНК-фрагмента, происходящего от геномной ДНК нетрансгенных контрольных растений сои и других трансгенных линий сои, но не из pDAB8264.42.32.1-генетического события сои. Выравнивание идентифицированных 5'- и 3'-граничных областей последовательности pDAB8264.42.32.1-генетического события сои с полноразмерной геномной «шотган»-последовательностью хромосомы 15 Glycine max показало, что в локусе исходного генома присутствовала делеция в 38 п.н. (фиг.3). Полученные результаты показали, что событие pDAB8264.42.32.1-генетического события сои был встроен в сайт хромосомы 15 генома сои.
Пример 4: Характеризация pDAB8264.42.32.1-генетического события сои с помощью саузерн-блот-анализа
Саузерн-блот-анализ проводили в целях определения профиля интеграции в pDAB8264.42.32.1-генетическом событии сои. В результате этих экспериментов были получены данные, которые продемонстрировали интеграцию и целостность трансгенов aad-12 v1 и 2mEPSPS v1 в геноме сои. pDAB8264.42.32.1-генетическое событие сои было охарактеризовано как полноразмерный трансформант, образованный посредством простой интеграции и содержащий одну копию PTU aad-12 v1 и 2mEPSPS v1, происходящую от плазмиды pDAB8264.
Данные Саузерн-блот-анализа позволяют предположить, что полноразмерный фрагмент Т-цепи был встроен в геном генетического события сои pDAB8264.42.32.1. Более тщательный Саузерн-блот-анализ был проведен с использованием зонда, специфичного к генам aad-12 v1 и 2mEPSPS v1, содержащимся в области интеграции Т-цепи pDAB8264, и с использованием описанных здесь рестриктирующих ферментов, которые имеют сайты расщепления, локализованные в плазмиде, и продуцируют гибридизующиеся фрагменты, которые находятся внутри плазмиды, или фрагменты, которые охватывают область стыка плазмиды и геномной ДНК сои (граничные фрагменты). Молекулярные массы, полученные исходя из Саузерн-гибридизации для комбинации рестриктирующих ферментов и зонда, были уникальными для данного трансформанта, что обеспечивало его точную идентификацию. Эти анализы также показали, что данный плазмидный фрагмент был встроен в геномную ДНК сои без реарранжировки PTU aad-12 v1 и 2mEPSPS v1.
Пример 4.1: Сбор образцов листьев сои и выделение геномной ДНК (гДНК)
Геномную ДНК экстрагировали из ткани листьев, собранных от отдельных растений сои, содержащих pDAB8264.42.32.1-генетическое событие сои. Кроме того, гДНК выделяли из нормальных растений сои сорта Maverick, имеющих генетический фон, который является репрезентативным для линии данного растения, где отсутствуют гены aad-12 v1 и 2mEPSPS v1. Отдельную геномную ДНК экстрагировали из лиофилизованной ткани листьев в соответствии со стандартным методом CTAB (Sambrook et al. (1989)). После экстракции, ДНК количественно оценивали на спектрофлуориметре с использованием реагента PICO GREEN (Invitrogen, Carlsbad, CA). Затем ДНК визуализировали на агарозном геле для подтверждения концентраций, полученных в анализе с использованием PICO GREEN, и для качественной оценки ДНК.
Пример 4.2: Гидролиз и разделение ДНК
Для молекулярной характеризации pDAB8264.42.32.1-генетического события сои с помощью Саузерн-блот-анализа, десять микрограммов (10 мкг) геномной ДНК подвергали гидролизу. Геномную ДНК, происходящую от сои pDAB8264.42.32.1 и от нетрансгенной линии сои сорта Maverick, гидролизовали путем добавления приблизительно пяти единиц выбранного рестриктирующего фермента на мкг ДНК и соответствующего реакционного буфера к каждому образцу ДНК. Каждый образец инкубировали приблизительно при 37°C в течение ночи. Рестриктирующие ферменты HindIII, NcoI, NsiI и PacI использовали отдельно для каждого гидролизата (New England Biolabs, Ipswich, MA). Кроме того, позитивный по гибридизации контрольный образец получали путем объединения плазмидной ДНК, pDAB8264, с геномной ДНК, происходящей от нетрансгенной сои сорта Maverick. «Коктейль» из плазмидной ДНК/геномной ДНК гидролизовали с применением тех же самых методов и с использованием того же самого рестриктирующего фермента, которые были выбраны для тест-образцов. После инкубирования гидролизатов в течение ночи добавляли 25 мкл раствора QUIK-PRECIP PLUS (EdgeBiosystems, Gaithersburg, MD), и гидролизованные образцы ДНК осаждали изопропанолом. Осажденную ДНК ресуспендировали в 15 мкл 1 × буфера для загрузки (0,01% бромфенолового синего, 10,0 мМ EDTA, 10,0% глицерина, 1,0 мМ триса, pH 7,5). Образцы ДНК и маркеры молекулярной массы подвергали электрофорезу в 0,85% агарозных гелях с 0,4 × буфера TAE при 35 вольт приблизительно в течение 18-22 часов для разделения фрагментов. Гели окрашивали этидийбромидом, и ДНК визуализировали путем облучения ультрафиолетом (УФ).
Пример 4.3: Перенос с помощью Саузерн-блот-анализа и обработка мембраны
Саузерн-блот-анализ проводили, в основном, как описано в публикации Memelink, et al. (1994). Вкратце, после электрофоретического разделения и визуализации ДНК-фрагментов, гели подвергали депуринизации путем добавления 0,25M HCl приблизительно в течение 20 минут, а затем обрабатывали денатурирующим раствором (0,4M NaOH, 1,5M NaCl) приблизительно в течение 30 минут и нейтрализующим раствором (1,5M NaCl, 0,5M триса, pH 7,5) в течение по меньшей мере 30 минут. Перенос с помощью Саузерн-блот-анализа проводили в течение ночи на найлоновых мембранах с использованием капиллярной системы, содержащей 10 × SSC. После переноса, ДНК связывали с мембраной с использованием реагентов для перекрестного сшивания при УФ-излучении, а затем мембрану быстро промывали 2 × SSC-раствором. С применением такого способа получали Саузерн-блот-мембраны, готовые для гибридизации.
Пример 4.4: Мечение ДНК-зонда и гибридизация
ДНК-фрагменты, связанные с найлоновой мембраной, детектировали с использованием меченного зонда. Зонды получали путем ПЦР-включения нуклеотида, меченного дигоксигенином (DIG), [DIG-11]-dUTP, в ДНК-фрагмент, амплифицированный из плазмиды pDAB8264 с использованием праймеров, специфичных к генным элементам (таблица 6). Генерирование ДНК-зондов с помощью ПЦР-синтеза осуществляли с использованием набора для синтеза ПЦР-зонда, меченного DIG (PROBE SYNTHESIS KIT) (Roche Diagnostics, Indianapolis, IN) в соответствии с процедурами, рекомендованными производителями.
Меченные зонды анализировали с помощью электрофореза в агарозном геле для определения их качества и количества. Затем нужное количество меченного зонда использовали для гибридизации с ДНК-мишенью на найлоновых мембранах в целях детектирования специфических фрагментов методами, в основном, описанными для получения раствора DIG EASY HYB (Roche Diagnostics, Indianapolis, IN). Вкратце, блоты на найлоновой мембране, содержащие иммобилизованную ДНК, быстро промывали 2 × SSC и предварительно гибридизовали с 20-25 мл предварительно нагретого раствора DIG EASY HYB в сосудах для гибридизации приблизительно при 45-55°C в течение примерно 2 часов в печи для гибридизации. Затем раствор для предварительной гибридизации декантировали и заменяли на ~15 мл предварительно нагретого раствора DIG EASY HYB, содержащего нужное количество специфических зондов, денатурированных путем кипячения в водяной бане в течение приблизительно пяти минут. Затем проводили стадию гибридизации приблизительно при 45-55°C в течение ночи в печи для гибридизации.
По окончании гибридизации зонда, растворы DIG EASY HYB, содержащие зонды, декантировали в очищенные пробирки и хранили приблизительно при -20°C. Эти зонды могут быть повторно использованы два раза в соответствии с процедурой, рекомендованной производителями. Блоты на мембранах быстро ополаскивали и два раза промывали в очищенных пластиковых контейнерах промывочным буфером в условиях низкой жесткости (2 × SSC, 0,1% ДСН) приблизительно в течение пяти минут при комнатной температуре, а затем два раза промывали промывочным буфером в условиях высокой жесткости (0,1 × SSC, 0,1% ДСН), каждый раз в течение 15 минут приблизительно при 65°C. Блоты на мембранах быстро промывали 1 × малеиновокислотным буфером, взятым из набора промывочных и блокирующих буферов DIG (DIG WASH AND BLOCK BUFFER SET (Roche Diagnostics, Indianapolis, IN)), приблизительно в течение 5 минут. Затем осуществляли блокирование в 1 × блокирующем буфере в течение 2 часов и инкубирование с антителом против DIG-AP (щелочной фосфатазы) (Roche Diagnostics, Indianapolis, ΓΝ) в 1 × блокирующем буфере в течение минимум 30 минут. После 2-3 промывок 1 × промывочным буфером, специфические ДНК-зонды оставались связанными с блотами на мембране, а затем DIG-меченные ДНК-стандарты визуализировали с использованием хемилюминесцентной системы детектирования нуклеиновых кислот (CDP-STAR CHEMILUMINESCENT NUCLEIC ACID DETECTION SYSTEM (Roche Diagnostics, Indianapolis, IN)) в соответствии с рекомендациями производителей. Блоты экспонировали с хемилюминесцентной пленкой один или несколько раз для детектирования гибридизующихся фрагментов и для визуализации стандартов молекулярных масс. Пленки проявляли в проявителе пленок ALL-PRO 100 PLUS (Konica Minolta, Osaka, Japan), и изображения сканировали. Число и размер детектированных полос были задокументированы для каждого зонда. DIG-меченный маркер молекулярной массы ДНК II (DIG MWM II) и DIG-меченный маркер молекулярной массы ДНК VII (DIG MWM VII) визуально обнаруживались после детектирования DIG, как описано в настоящей заявке, а поэтому они были использованы для определения размера гибридизующегося фрагмента на Саузерн-блотах.
|
Пример 4.5: Результаты Саузерн-блот-анализа
Размеры предполагаемых и наблюдаемых фрагментов, а также конкретные гидролизаты и зонд, где указанные гидролизаты и зонд были получены на основе известных рестрикционных сайтов ферментов PTU aad-12 v1 и 2mEPSPS v1 представлены в таблице 7. На основе этих гидролизатов и гибридизации были идентифицированы два типа фрагментов: внутренние фрагменты, в которых известные сайты ферментов фланкируют область зонда и полностью входят в состав инсерционной области PTU aad-12 v1 и 2mEPSPS v1; и граничные фрагменты, в которых один известный сайт фермента локализован на одном конеце области зонда, а другой сайт, как и ожидалось, локализован в геноме сои. Размеры граничных фрагментов варьируются в зависимости от типа трансформанта, поскольку в большинстве случаев, сайты интеграции ДНК-фрагментов являются уникальными для каждого трансформанта. Граничные фрагменты представляет собой средство для определения локализации рестрикционных сайтов ферментов по отношению к интегрированной ДНК и для оценки числа ДНК-вставок. Саузерн-блот-анализы, проводимые на многих поколениях pDAB8264.42.32.1-генетического события сои, давали результаты, которые позволяют предположить, что низкокопийные интактные PTU aad-12 v1 и 2mEPSPS v1, происходящие от плазмиды pDAB8264, были встроены в геном генетического события сои pDAB8264.42.32.1.
|
|
|
Рестриктирующие ферменты HindIII и NcoI связываются с уникальными рестрикционными сайтами в плазмиде pDAB8264 и расщепляют их. Затем, эти ферменты отбирали для характеризации вставки гена aad-12 v1 в pDAB8264.42.32.1-генетических событиях сои. Было предсказано, что граничные фрагменты размером >4078 п.н. или >3690 п.н. гибридизуются с зондом после гидролиза ферментами HindIII или NcoI, соответственно (таблица 7). Одиночные полосы гибридизации aad-12 v1 размером ~4100 п.н. и ~6700 п.н. наблюдались в случае использования ферментов HindIII или NcoI, соответственно. Гибридизация зонда с полосами такого размера, предположительно, указывает на присутствие одного сайта инсерции гена aad-12 v1 в геноме pDAB8264.42.32.1-генетического события сои. Рестриктирующий фермент NsiI был выбран для выделения фрагмента, содержащего транскрипционную единицу aad-12 v1 растения (PTU; промотор/ген/терминатор) (таблица 7). Предсказанный ~4900 п.н.-фрагмент наблюдался в случае использования зонда после гидролиза ферментом NsiI. Результаты, полученные при ферментативном гидролизе образцов pDAB8264.42.32.1 с последующей гибридизацией зонда показали, что интактная PTU aad-12 v1, происходящая от плазмиды pDAB8264, была встроена в геном pDAB8264.42.32.1-генетического события сои.
Рестриктирующие ферменты HindIII, NcoI и NsiI связываются с рестрикционными сайтами в плазмиде pDAB8264 и расщепляют их. Затем, эти ферменты отбирали для характеризации вставки гена 2mEPSPS v1 в pDAB8264.42.32.1-генетические события сои. Было предсказано, что граничные фрагменты размером >4260 п.н., >3749 п.н. или >5199 п.н. гибридизуются с зондом после гидролиза ферментами HindIII, NcoI и NsiI, соответственно (таблица 7). Одиночные полосы гибридизации 2mEPSPS v1 размером ~5300 п.н., ~18000 п.н. и ~7500 п.н. наблюдались в случае использования ферментов HindIII, NcoI и NsiI, соответственно. Гибридизация зонда с полосами такого размера, предположительно, указывает на присутствие одного сайта инсерции гена 2mEPSPS v1 в геноме pDAB8264.42.32.1-генетических событий сои. Рестриктирующий фермент PacI был выбран для выделения фрагмента, содержащего транскрипционную единицу 2mEPSPS v1 растения (PTU; промотор/ген/терминатор) (таблица 7). Предсказанный ~6700 п.н.-фрагмент наблюдался в случае использования зонда после гидролиза ферментом PacI. Результаты, полученные при ферментативном гидролизе образцов pDAB8264.42.32.1-генетического события сои с последующей гибридизацией зонда показали, что интактная PTU 2mEPSPS v1, происходящая от плазмиды pDAB8264, была встроена в геном pDAB8264.42.32.1-генетического события сои.
Пример 4.6: Отсутствие последовательностей остова
Саузерн-блот-анализ также проводили в целях подтверждения отсутствия гена резистентности к спектиномицину (specR), элемента Ori Rep и белка инициации репликации trfA (элемента trf A) в pDAB8264.42.32.1-генетического события сои. Как и ожидалось, в образцах генетического события сои pDAB8264.42.32.1, какой-либо специфической гибридизации с геном резистентности к спектиномицину, с элементом Ori Rep или с элементом trfA не наблюдалось в том случае, если в Саузерн-блот-анализ были включены соответствующие позитивный контроль (плазмидная ДНК pDAB8264, добавленная к геномной ДНК Maverick) и негативный контроль (геномная ДНК Maverick). После гидролиза ферментами HindIII или NcoI и гибридизации с specR-специфическим зондом, одна ожидаемая полоса размером ~9300 п.н. или ~5200 п.н. наблюдалась в образце позитивного контроля (с pDAB8264, добавленной к геномной ДНК Maverick), соответственно. SpecR-зонд не гибридизовался с образцами негативного контроля и pDAB8264.42.32.1-генетического события сои. Аналогичным образом, одна ожидаемая полоса размером ~7400 п.н. детектировалась в образце позитивного контроля (с pDAB8264, добавленной к геномной ДНК Maverick), но отсутствовала в образцах негативного контроля и pDAB8264.42.32.1-генетического события сои после NcoI-гидролиза и гибридизации с OriRep-специфическим зондом. Кроме того, только одна ожидаемая полоса размером ~9300 п.н. детектировалась в образце позитивного контроля (с pDAB8264, добавленной к геномной ДНК Maverick), но отсутствовала в образцах негативного контроля и pDAB8264.42.32.1-генетического события сои после HindIII-гидролиза и гибридизации с trfA-специфическим зондом. Эти данные указывают на отсутствие гена резистентности к спектиномицину, элемента Ori Rep и белка инициации репликации trfA в pDAB8264.42.32.10-генетическом событии сои.
Пример 5: Испытания для оценки агрономических показателей и испытания в полевых условиях на урожайность и устойчивость к гербицидам
Было проведено несколько агрономических испытаний для оценки агрономических показателей генетического события сои pDAB8264.42.32.1. Большинство испытаний в полевых условиях проводили в различных географических регионах в Соединенных Штатах, где культивировали сорт сои, содержащей генетическое событие pDAB8264.42.32.1. Было проведено три серии экспериментов. В первой серии экспериментов сравнивали агрономическую эффективность pDAB8264.42.32.1-генетических событий сои, которые были обработаны путем опрыскивания гербицидами 2,4-D и глифосатом, и агрономическую эффективность pDAB8264.42.32.1-генетических событий сои, которые не были обработаны гербицидами. Во второй серии экспериментов сравнивали агрономическую эффективность pDAB8264.42.32.1-генетических событий сои с агрономической эффективностью контрольных растений близкой изолинии Maverick. И наконец, в третьей серии экспериментов тестировали устойчивость pDAB8264.42.32.1-генетических событий сои к глюфозинату.
В первой серии экспериментов сравнивали pDAB8264.42.32.1-генетические события сои, которые обрабатывали путем опрыскивания солью диметиамина 2,4-D в дозе 1120 г экв./га (Weedar 64, Nufarm, Burr Ridge, IL) и глифосатом в дозе 1120 г экв./га (Durango, Dow AgroSciences, Indianapolis, ΓΝ), с pDAB8264.42.32.1-генетическими событиями сои, которые не обрабатывали гербицидами. Обработку гербицидами проводили на фазах роста V3 и R2. Испытания в полевых условиях, состоящие из стадий опрыскивания и без опрыскивания, осуществляли на делянках с произвольным расположением в течение 2-летнего независимого культивирования. Испытания в полевых условиях, проводимые в 2010 году, состояли из повторных культивирований двадцати пяти культур в каждой делянке, а испытания в полевых условиях, проводимые в 2011 году, состояли из четырех культивирований двадцати шести культур в каждой делянке. В обоих экспериментах, каждая делянка состояла из двух рядов длиной 12,5 футов, а всего было засеяно 30 дюймов с расстоянием 2,5 футов между делянками. В течение всего сезона, полевые участки возделывали в соответствии с обычной агрономической практикой и с уничтожением сорняков. В течение всего сезона был оценен ряд агрономических показателей. Данные для этих показателей и стадий роста, если они были получены, представлены в таблице 8.
|
|
|
По окончании вегетационного периода, данные, полученные со всех участков, объединяли и проводили анализ по всем участкам. Затем проводили анализ данных и, исходя из этого анализа, вычисляли величины для различных показателей культур с применением метода наименьших квадратов как показано в таблице 9. В случае параметров, для которых измеряли значимый указанный в таблице эффект, а затем осуществляли разделение средних с применением t-критерия Стъюдента в целях проведения сравнения между обработанными pDAB8264.42.32.1-генетическими событиями сои и необработанными pDAB8264.42.32.1-генетическими событиями сои. Степень вероятности для определения значимости составляла p=0,05. pDAB8264.42.32.1-генетические события сои обнаруживали устойчивость к резервуарной смеси 2,4-D и глифосата. В противоположность этому, ни одно из растений сорта Maverick, которое было обработано резервуарной смесью 2,4-D и глифосата, не обнаруживало устойчивости к обработке гербицидами.
|
|
pDAB8264.42.32.1-генетическое событие сои обнаруживало высокий уровень устойчивости к резервуарной смеси глифосата и 2,4-D на стадиях роста V3 и R2 в вегетационный период. Хотя наблюдались небольшие повреждения при начальной обработке растений гербицидами, однако, сначала эти повреждения не были значимыми, а более сильно проявлялись только через 14 дней после обработки. Все оцененные признаки, за исключением массы 100 семян и случаев развития болезни, были одинаковыми как для pDAB8264.42.32.1-генетических событий сои, обработанных гербицидами, так и для pDAB8264.42.32.1-генетических событий сои, которые не были обработаны гербицидами. Нанесение 2,4-D и глифосата на pDAB8264.42.32.1-генетических событиях сои в полевых условиях не приводило к какому-либо значимому изменению агрономических показателей или признаков, которые могли бы влиять на агрономическую продуктивность pDAB8264.42.32.1-генетического события сои.
Во второй серии экспериментов сравнивали агрономические показатели для выбранных агрономических свойств pDAB8264.42.32.1-генетических событий сои и контрольных растений близкой изолинии Maverick. Испытания в полевых условиях осуществляли на делянках с произвольным расположением в течение двух лет независимого культивирования. Испытания в полевых условиях, проводимые в 2010 году, состояли из двух культивирований двадцати пяти культур в каждой делянке, а испытания в полевых условиях, проводимые в 2011 году, состояли из четырех культивирований двадцати шести культур в каждой делянке. В обоих экспериментах, каждая делянка состояла из двух рядов длиной 12,5 футов, а всего было засеяно 30 дюймов с расстоянием 2,5 футов между делянками. В течение всего сезона, полевые участки возделывали в соответствии с обычной агрономической практикой и с уничтожением сорняков. В течение всего сезона был оценен ряд агрономических показателей. Данные для этих показателей и стадий роста, если они были получены, представлены в таблице 8.
По окончании вегетационного периода, данные, полученные со всех участков, объединяли и проводили анализ по всем участкам. Затем проводили анализ данных, и исходя из этого анализа вычисляли величины для различных показателей культур с применением метода наименьших квадратов как показано в таблице 10. В случае параметров, для которых измеряли значимый указанный в таблице эффект, позже осуществляли разделение средних с применением t-критерия Стъюдента для проведения сравнения между растением сорта Maverick и pDAB8264.42.32.1-генетическим событием сои. Степень вероятности для определения значимости составляла p=0,05.
|
|
Все оцененные признаки генетического события сои pDAB8264.42.32.1 были аналогичны признакам растения сорта Maverick, за исключением окраски семян. pDAB8264.42.32.1-генетические события сои имели окраску семян, оцененную как 1,8, а растения сорта Maverick имели окраску семян, оцененную как 1,3. Такое различие не является слишком существенным для фермеров и не влияет на продуктивность данной культуры, а также не приводит к существенным изменениям агрономических показателей, которые могли бы негативно влиять на продуктивность данной культуры. Полученные результаты показали, что генетическое событие сои pDAB8264.42.32.1 может развиваться не так, как растение сорта Maverick с точки зрения некоторых агрономических показателей, однако, такие различия являются минимальными и не выходят за пределы обычных показателей соевых культур при их возделывании на стандартных фермах.
Для проведения теста на устойчивость pDAB8264.42.32.1-генетического события сои к гербициду глюфозинату, такой трансформант высевали на опытные поля штата Индианы в вегетационный период 2010 г. Растение сорта Maverick, которое было впервые трансформировано для продуцирования pDAB8264.42.32.1-генетического события сои, высевали в каждый питомник и включали в эксперименты в качестве контроля. Этот трансформант рандомизировали с другими трансформантами, которые были на одной и той же стадии развития, выбранной для проведения теста, и этот тест проводили с четырьмя повторностями. Растение сорта Maverick было включено как нетрансформированный контроль. Испытания проводили по модифицированной дробно-деляночной схеме с обработкой всех делянок целиком и субделянок с трансформантами. На одни растения сои наносили глюфозинат в количестве 822 г э.к./га, а другие контрольные растения не обрабатывали. Обработку проводили на фазах роста V5 и R2. Устойчивость к гербицидам определяли путем анализа растений на поражение через 6 часов и 7 дней после обработки. Поражение растений оценивали визуально на хлороз, некроз листьев и на гибель всего растения. pDAB8264.42.32.1-генетическое событие сои был в высокой степени устойчивым к обработке глюфозинатными гербицидами. В противоположность этому, ни одно из растений сорта Maverick не было устойчивым к гербицидам.
Пример 6: Трансген-специфичный анализ TaqMan
Трансген-специфичный анализ TAQMAN был разработан в целях детектирования присутствия в сое генетического события pDAB8264.42.32.1 и определения статуса зиготности растений в популяциях, полученных путем скрещивания. Генетическое событие pDAB8264.42.32.1 сои содержит T-цепь бинарного вектора pDAB8264 (фиг.4). Для специфического детектирования трансгена pDAB8264.42.32.1 генетического события сои, специфические праймеры и зонды TAQMAN были сконструированы в соответствии с последовательностями ДНК, локализованными у 5'-конца (SEQ ID NO:19) или 3'-конца (SEQ ID NO:20) последовательности «вставка-стык» данного растения (фиг.4). Один трансген-специфичный анализ для детектирования трансгена pDAB8264.42.32.1 генетического события сои был разработан так, чтобы он позволял специфически детектировать ДНК-фрагмент в 131 п.н., который охватывает интегрирующую 3'-последовательность стыка, с использованием двух праймеров и мишень-специфического зонда MGB, синтезированного на синтезаторе Applied Biosystems (ABI) и содержащего репортер FAM у своего 5'-конца. Специфичность такого метода TAQMAN для детектирования генетического события сои pDAB8264.42.32.1 оценивали для 11 различных трансформантов, содержащих PTU 2mEPSPS v1 и aad-12 v1, и для контрольного нетрансгенного сорта сои (Maverick), в виде дуплекса с эндогенным эталонным геном, встречающимся в сое, GMFL01-25-J19 (кДНК Glycine max, GenBank: AK286292.1).
Пример 6.1: Выделение гДНК
В этом исследовании тестировали образцы геномной ДНК (гДНК), выделенные из 11 различных трансформантов сои и из нетрансгенных сортов сои. Геномную ДНК экстрагировали с использованием модифицированного набора для экстракции растительной ДНК (Qiagen MAGATTRACT PLANT DNA kit) (Qiagen, Valencia, CA). Для экстракции гДНК использовали диски свежих листьев сои, 8 дисков на образец. Для проведения данного исследования, образцы разводили водой, не содержащей ДНКазы, до концентрации приблизительно 10 нг/мкл.
Пример 6.2: Анализ TaqMan и результаты такого анализа
Специфические праймеры и зонды TAQMAN были сконструированы для проведения анализа TAQMAN, специфичного к генетическому событию сои pDAB8264.42.32.1. Эти реагенты могут быть использованы для детектирования генетического события сои pDAB8264.42.32.1 в условиях, перечисленных ниже. В таблице 11 представлен список последовательностей праймеров и зондов, которые были специально сконструированы для детектирования генетического события сои pDAB8264.42.32.1.
|
|
Мультиплексную ПЦР-амплификацию проводили в следующих условиях: ПЦР-буфер 1 × Roche, 0,4 мкΜ трансформант-специфического прямого праймера, 0,4 мкΜ трансформант-специфического обратного праймера, 0,4 мкΜ праймера GMS116F, 0,4 мкΜ праймера GMS116R, 0,2 мкΜ трансформант-специфического зонда, 0,2 мкΜ зонда GMS116, 0,1% ПВП, 6-20 нг гДНК в общем объеме реакционной смеси 10 мкл. Эту смесь амплифицировали в следующих условиях: (i) 95°C, 10 минут, (ii) 95°C, 10 секунд, (iii) 60°C, 40 секунд, (iv) повторение стадий (ii)-(iii) за 40 циклов, (v) выдерживание при 40°C. ПЦР в реальном времени осуществляли на оборудовании ROCHE LIGHTCYCLER 480. Анализ данных проводили путем измерения точки пересечения (величины Cp), определенный с помощью программы LIGHTCYCLER 480, которая представляет собой число циклов ПЦР, где скорость изменения флуоресценции достигает своего максимума.
В методе TAQMAN для детектирования трансгена pDAB8264.42.32.1-генетического события сои оценивали 11 различных трансформантов, содержащих PTU 2mEPSPS v1 и aad-12 v1, и нетрансгенный сорт сои в виде дуплекса с эндогенным эталонным геном, встречающимся в сое, GMFL01-25-J19 (GenBank: AK286292.1). Этот анализ позволяет специфически детектировать генетическое событие сои pDAB8264.42.32.1 и не дает или не увеличивает какие-либо ложноположительные результаты по сравнению с контролем (то есть, 11 различных трансформантов, содержащих PTU 2mEPSPS v1 и aad-12 v1, и нетрансгенного сорта сои). Трансформант-специфические праймеры и зонды могут быть использованы для детектирования генетического события сои pDAB8264.42.32.1, и эти условия и реагенты являются подходящими для проведения анализов на зиготность.
Пример 7: Предполагаемая последовательность pDAB8264.42.32.1-генетического события сои
Последовательность SEQ ID NO:18 представляет собой предполагаемую последовательность трансгена pDAB8264.42.32.1 генетического события сои. Эта последовательность содержит 5'-геномную фланкирующую последовательность, предполагаемую вставку Т-цепи pDAB8264 и 3'-геномные фланкирующие последовательности. Что касается последовательности SEQ ID NO:18, то остатки 1-1246 представляют собой остатки 5'-геномной фланкирующей последовательности; остатки 1247-11507 представляют собой остатки вставки Т-цепи pDAB8264, а остатки 11508-12011 представляют собой 3'-геномную фланкирующую последовательность. Таким образом, последовательность стыка или последовательность транзиции, расположенные у 5'-конца вставки, находятся в положениях остатков 1246-1247 SEQ ID NO:18. Последовательность стыка или последовательность транзиции, расположенные у 3'-конца вставки, находятся в положениях остатков 11507-11508 SEQ ID NO:18.
Следует отметить, что SEQ ID NO:18 представляет собой предполагаемую репрезентативную последовательность трансгена pDAB8264.42.32.1 генетического события сои 1, и эта последовательность была получена после сопоставления путем выравнивания последовательностей SEQ ID NO:19, SEQ ID NO:20 и Т-цепи pDAB8264. Фактическая последовательность вставки T-цепи pDAB8264.42.32.1-генетического события сои может несколько отличаться от последовательности SEQ ID NO:18 (например, в положениях остатков 1247-11507). В процессе трансформации, то есть, введения вставки Т-цепи в геном клеток растений, нередко возникают некоторые делеции или другие альтерации во вставках. Кроме того, при ПЦР-амплификации могут возникать ошибки, которые могут приводит к незначительным ошибкам при секвенировании. Так, например, описанные здесь фланкирующие последовательности были определены путем продуцирования ампликонов из геномных ДНК сои, с последующим клонированием и секвенированием ампликонов. Поэтому неудивительно, что в последовательностях, полученных и определенных таким способом, могут быть обнаружены незначительные различия и некоторые несоответствия, если принять во внимание необходимость проведения множества раундов амплификации для получения ампликона, достаточного для секвенирования геномных ДНК. Следует заметить и принять во внимание, что любые уточнения, необходимые для исправления ошибок или несоответствий такого типа, которые обычно возникают при секвенировании, входят в объем настоящего изобретения. Таким образом, релевантный сегмент описанной здесь плазмидной последовательности может содержать некоторые незначительные модификации. Таким образом, растение, содержащее полинуклеотид, имеющий определенную степень идентичности рассматриваемой последовательности вставки, входит в объем настоящего изобретения. Последовательность SEQ ID NO:18 или любой ее сегмент могут считаться идентичными представленной или описанной здесь последовательности, если они представляют собой полинуклеотидную последовательность, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична представленной или описанной здесь последовательности. Последовательность, содержащая фланкирующие последовательности и последовательность вставки, может быть подтверждена путем сравнения с последовательностью депонированных семян. Таким образом, некоторые различия между последовательностью SEQ ID NO:18 и фактической вставкой Т-цепи генетического события сои pDAB8264.42.32.1 могут быть идентифицированы и входят в объем настоящего изобретения.
Пример 8: Использование инсерционного сайта pDAB8264.42.32.1-генетического события сои для направленной интеграции
Соответствующие агрономические показатели трансген-содержащего pDAB8264.42.32.1-генетического события сои для нескольких поколений, выращенных в полевых условиях, позволяют предположить, что эти идентифицированные области, находящиеся поблизости от инсерционного сайта на хромосоме 15 pDAB8264.42.32.1-генетического события сои, имеют геномные участки, достаточно хорошо подходящие для направленной интеграции других представляющих интерес трансгенов. Такая направленная интеграция позволяет решить проблемы, связанные с наличием так называемого «эффекта положения», и устранить риск возникновения мутаций в геноме после интеграции трансгена у хозяина. Другими преимуществами такой направленной интеграции являются, но не ограничиваются ими, уменьшение большого числа событий трансформации, которые должны быть скринированы и протестированы до получения трансгенного растения, которое будет иметь желаемый уровень экспрессии трансгена без каких-либо отклонений, обусловленных случайной инсерцией трансгена в играющий важную роль локус генома хозяина. Кроме того, такая направленная интеграция допускает сцепление трансгенов, что будет приводить к более эффективному скрещиванию элитных линий растения, содержащих оба гена.
С применением описанной здесь технологии, специалист в данной области может самостоятельно вводить представляющие интерес полинуклеиновые кислоты в тот же инсерционный сайт, который присутствует в pDAB8264.42.32.1-генетическом событии сои или в сайт, находящийся в непосредственной близости от инсерционного сайта pDAB8264.42.32.1-генетического события сои. Один из таких методов описан в Международной патентной заявке No. WO2008/021207, которая во всей своей полноте вводится в настоящее описание посредством ссылки.
Вкратце, геномная последовательность размером до 20 т.п.н., фланкирующая 5'-конец инсерционного сайта, и геномная последовательность размером до 20 т.п.н., фланкирующая 3'-конец инсерционного сайта SEQ ID NO:18, была использована для фланкирования представляющего интерес гена или представляющих интерес генов, которые должны быть встроены в геном pDAB8264.42.32.1-генетического события сои посредством гомологичной рекомбинации. Этот представляющий интерес ген или представляющие интерес гены могут быть встроены точно в инсерционный сайт pDAB8264.42.32.1-генетического события сои, либо они могут быть встроены в какой-либо другой участок в пределах области 20 т.п.н., находящийся поблизости от инсерционных сайтов pDAB8264.42.32.1-генетического события сои, что будет обеспечивать соответствующий уровень экспрессии трансгена и не будет оказывать какого-либо негативного влияния на растение. ДНК-векторы, содержащие представляющий интерес ген или представляющие интерес гены и фланкирующие последовательности, могут быть встроены в клетки растений любым одним из нескольких методов, известных специалистам, включая, но не ограничиваясь ими, Agrobacterium-опосредуемую трансформацию. Инсерция донорного ДНК-вектора в сайт-мишень pDAB8264.42.32.1-генетического события сои может быть проведена более эффективно с применением одного или нескольких методов, включая, но не ограничиваясь ими, ко-экспрессию или стимуляцию генов-усилителей рекомбинации или ингибирование эндогенных генов-супрессоров рекомбинации.
Кроме того, известно, что расщепление двухцепочечных специфических последовательностей в геноме может быть проведено в целях повышения частоты гомологичной рекомбинации, а поэтому, инсерция в инсерционный сайт pDAB8264.42.32.1-генетического события сои или в его фланкирующие области может быть проведена более эффективно благодаря экспрессии природных или сконструированных последовательность-специфических эндонуклеаз, расщепляющих такие последовательности. Таким образом, с применением описанной здесь технологии, любая гетерологичная нуклеиновая кислота может быть встроена в сайт-мишень, расположенный между последовательностями SEQ ID NO:1 и SEQ ID NO:2 или в непосредственной близости от них, а в некоторых случаях, в последовательность SEQ ID NO:18 или в непосредственной близости от нее.
Пример 9: Вырезание экспрессионного кластера, содержащего ген pat, из pDAB8264.42.32.1-генетического события сои
Удаление экспрессионного кластера, содержащего селективный маркерный ген, может оказаться предпочтительным для направленного встраивания в pDAB8264.42.32.1-генетическое событие сои. Удаление селективного маркера pat из pDAB8264.42.32.1-генетического события сои позволяет повторно использовать селективный маркер pat для направленной интеграции полинуклеиновых кислот в положение генома pDAB8264.42.32.1-генетического события сои в последующих поколениях растений сои.
С применением описанной здесь технологии, специалист в данной области может самостоятельно вырезать представляющие интерес полинуклеиновые кислоты из pDAB8264.42.32.1-генетического события сои. Один из таких методов описан в патенте США, который зарегистрирован под № 13/011666, и который во всей своей полноте вводится в настоящее описание посредством ссылки.
Вкратце, были сконструированы последовательность-специфические эндонуклеазы, такие как нуклеазы «цинковые пальцы», которые распознают такие последовательности ДНК, связываются с ними и специфически расщепляют последовательности ДНК, фланкирующие генный экспрессионный кластер. Нуклеазы «цинковые пальцы» доставляются в клетку растения путем скрещивания родительского растения, содержащего трансгенные кластеры, экспрессирующие нуклеазу «цинковые пальцы», со вторым родительским растением, содержащим pDAB8264.42.32.1-генетическое событие сои. Полученное потомство культивируют до созревания семян и анализируют на отсутствие pat-экспрессирующего кластера по окрашиванию листьев гербицидом, содержащим глюфозинат. Потомство растений, которое не являются резистентным к гербициду, подтверждают на молекулярном уровне и подвергают самоопылению. Вырезание и удаление pat-экспрессирующего кластера подтверждают на молекулярном уровне у потомства, полученного после самоопыления. С применением описанной здесь технологии, любая гетерологичная нуклеиновая кислота может быть вырезана из хромосомы 15 сои в сайте-мишени, расположенном между последовательностями SEQ ID NO:1 и SEQ ID NO:2, а предпочтительно, в SEQ ID NO:18.