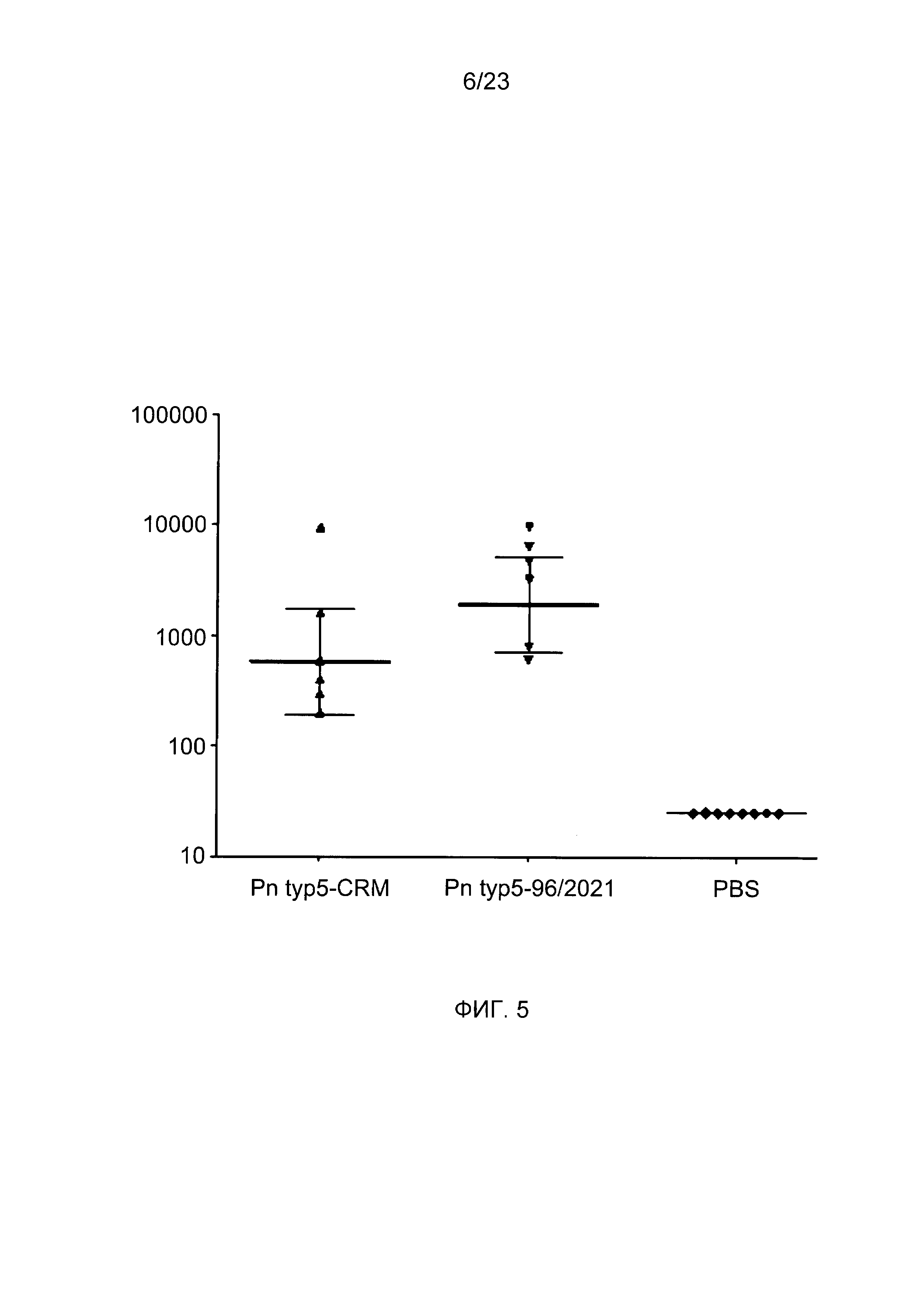Результат интеллектуальной деятельности: МОЛЕКУЛА, СОДЕРЖАЩАЯ SPR0096 и SPR2021
Вид РИД
Изобретение
По настоящей заявке испрашивается приоритет временной заявки США № 61/556456, поданной 7 ноября 2011 года; и временной заявки США № 61/566407, поданной 2 декабря 2011 года. Идеи указанных выше заявок включены в настоящее описание в качестве ссылок в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к конъюгатам антигенов и молекул носителей, и вакцинам, содержащим эти конъюгаты. Антигенами, главным образом, являются сахариды.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Использование конъюгации с белками-носителями для повышения иммуногенности сахаридных антигенов хорошо известно [например, рассмотрено в ссылках 1-9 и т.д.] и ее применяют, в частности, для детских вакцин [10]. Тремя широко используемыми белками-носителями в современных вакцинах являются столбнячный токсоид (TT), дифтерийный токсоид (DT) и вариант дифтерийного токсоида CRM197. Эти белки используют в качестве носителей для различных сахаридов, в частности, менингококковых капсулярных сахаридов (см., например, использование TT в качестве носителя для сахаридов, происходящих из серогрупп N.meningitidis A, C, W135 и Y в ссылке 11; и DT и CRM197 в качестве носителей для тех же сахаридов в ссылках 12 и 13 соответственно). Появилась обеспокоенность в отношении чрезмерного использования этих белков-носителей в вакцинах [см., например, ссылку 14], и были предложены различные альтернативные носители (например, белок D из H.influenzae в ссылке 15). Однако многие альтернативные белки-носители не являются настолько же эффективными, как и TT, DT и/или CRM197. Таким образом, остается потребность в поиске альтернативных и/или лучших белков-носителей.
Таким образом, задачей изобретения является предоставление дополнительных или лучших белков-носителей, в частности, белков-носителей для менингококковых капсулярных сахаридов. Белки-носители можно использовать в конъюгатах для индукции защитных и/или терапевтических иммунных ответов против инфекций или лекарственных средств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения открыли, что белки, содержащие два конкретных антигена Streptococcus pneumoniae, антиген spr0096 и антиген spr2021, являются эффективными носителями. Эти носители являются универсальными и могут быть конъюгированы с различными антигенами, в частности, сахаридами, например, из патогенных организмов. Полученные конъюгаты могут быть более иммуногенными, чем конъюгаты на основе используемых в настоящее время белков-носителей, например, CRM197. Более того, они могут обеспечить более высокие уровни защитного иммунитета против патогенов, из которых происходят сахариды.
Таким образом, изобретение относится к конъюгату, содержащему антиген и молекулу носителя, где молекула носителя содержит антиген spr0096 и антиген spr2021. Молекула носителя, как правило, содержит антиген spr0096 и антиген spr2021 в качестве одной полипептидной цепи (ʺгибридныйʺ полипептид). Как правило, антиген представляет собой сахарид. Сахарид может представлять собой любой сахарид, в частности, сахарид из патогенного организма. Например, сахарид может представлять собой капсулярный сахарид из N.meningitidis, глюкан или капсулярный сахарид из S.pneumoniae. Когда сахарид представляет собой капсулярный сахарид из N.meningitidis, он, как правило, происходит из одной из следующих серогрупп менингококков: A, C, W135 и Y. Когда сахарид представляет собой глюкан, он, как правило, представляет собой ламинарин. Когда сахарид представляет собой капсулярный сахарид из S.pneumoniae, он, как правило, происходит из одного из следующих серотипов пневмококков: 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F. Однако в некоторых вариантах осуществления сахарид не является капсулярным сахаридом из S.pneumoniae.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим конъюгат по изобретению в комбинации с фармацевтически приемлемым носителем.
Кроме того, настоящее изобретение относится к способам индукции иммунного ответа у млекопитающего, включающим введение конъюгата или фармацевтической композиции по изобретению млекопитающему.
Кроме того, настоящее изобретение относится к молекулам носителей, которые модифицированы так, чтобы они включали неприродные аминокислоты.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
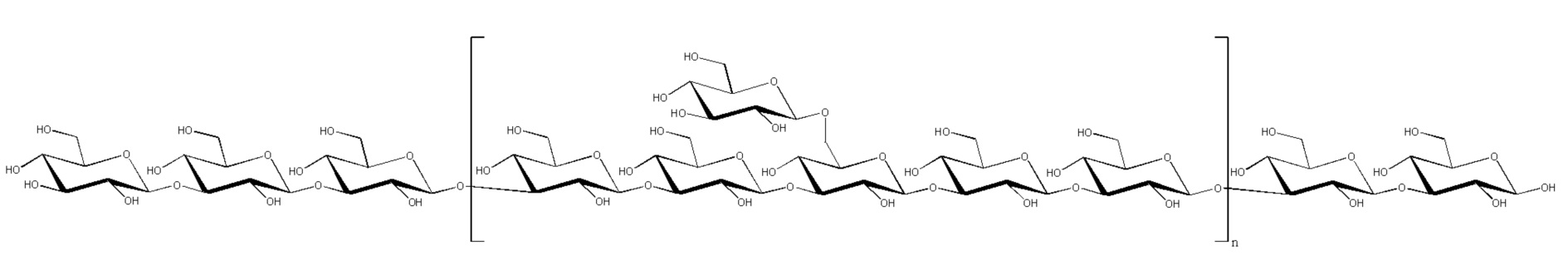
На фиг. 1 представлены повторяющиеся элементы репрезентативных бактериальных сахаридов для применения в рамках изобретения.
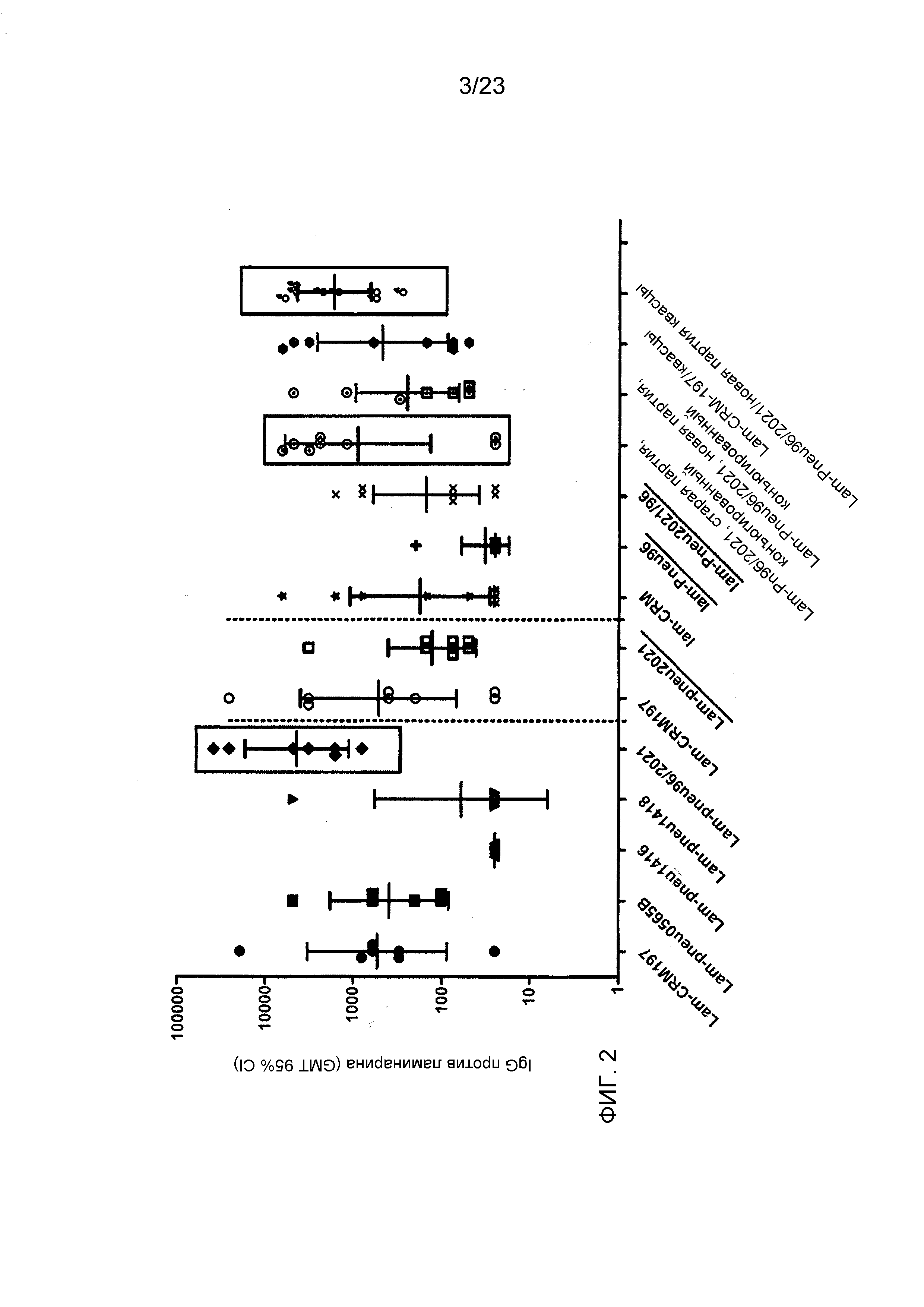
На фиг. 2 сравнивается иммуногенность ламинарина, конъюгированного с различными пневмококковыми белками, и эталонного носителя CRM197.
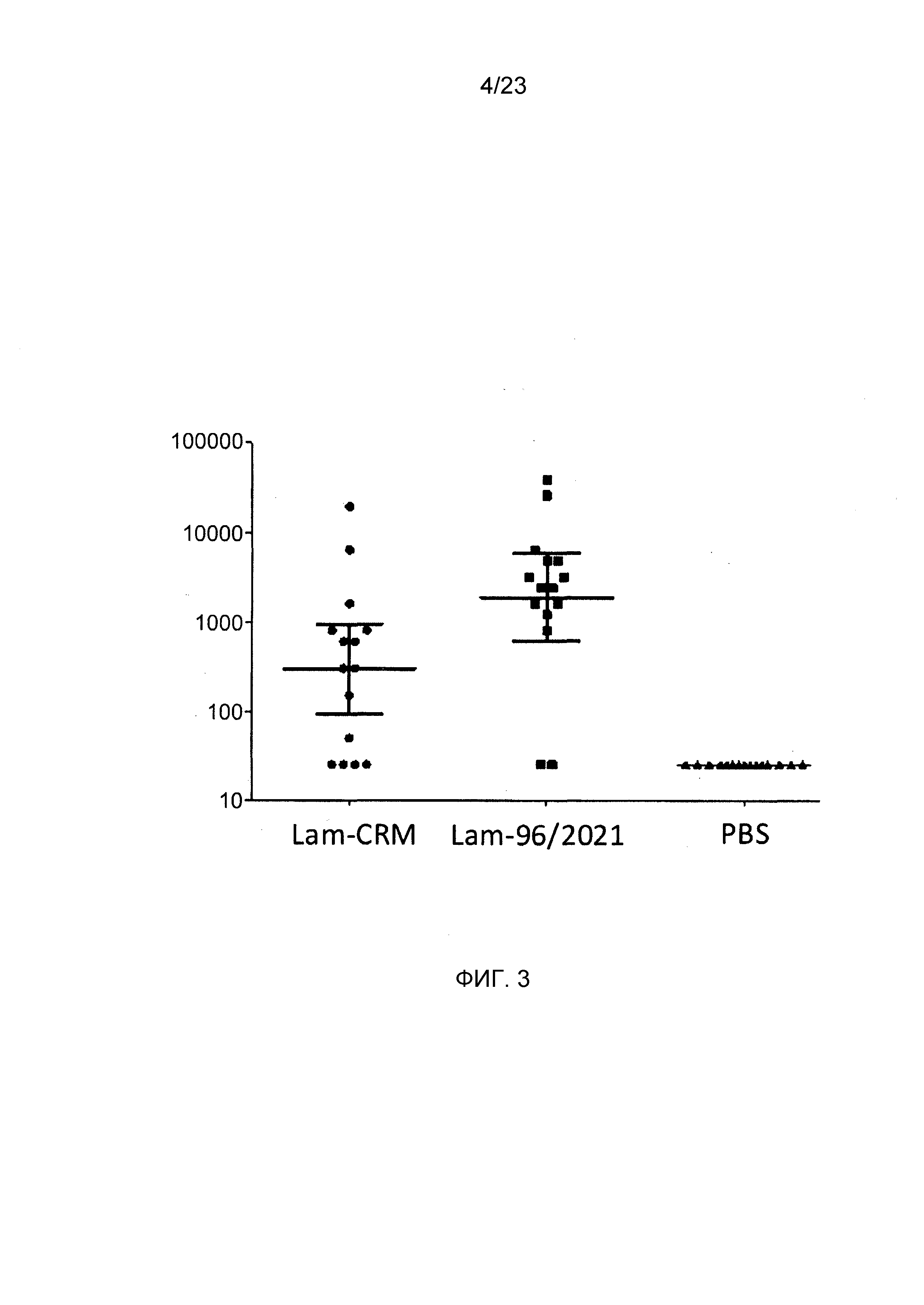
На фиг. 3 сравнивается иммуногенность конъюгата ламинарина по изобретению и эталонного конъюгата CRM197.
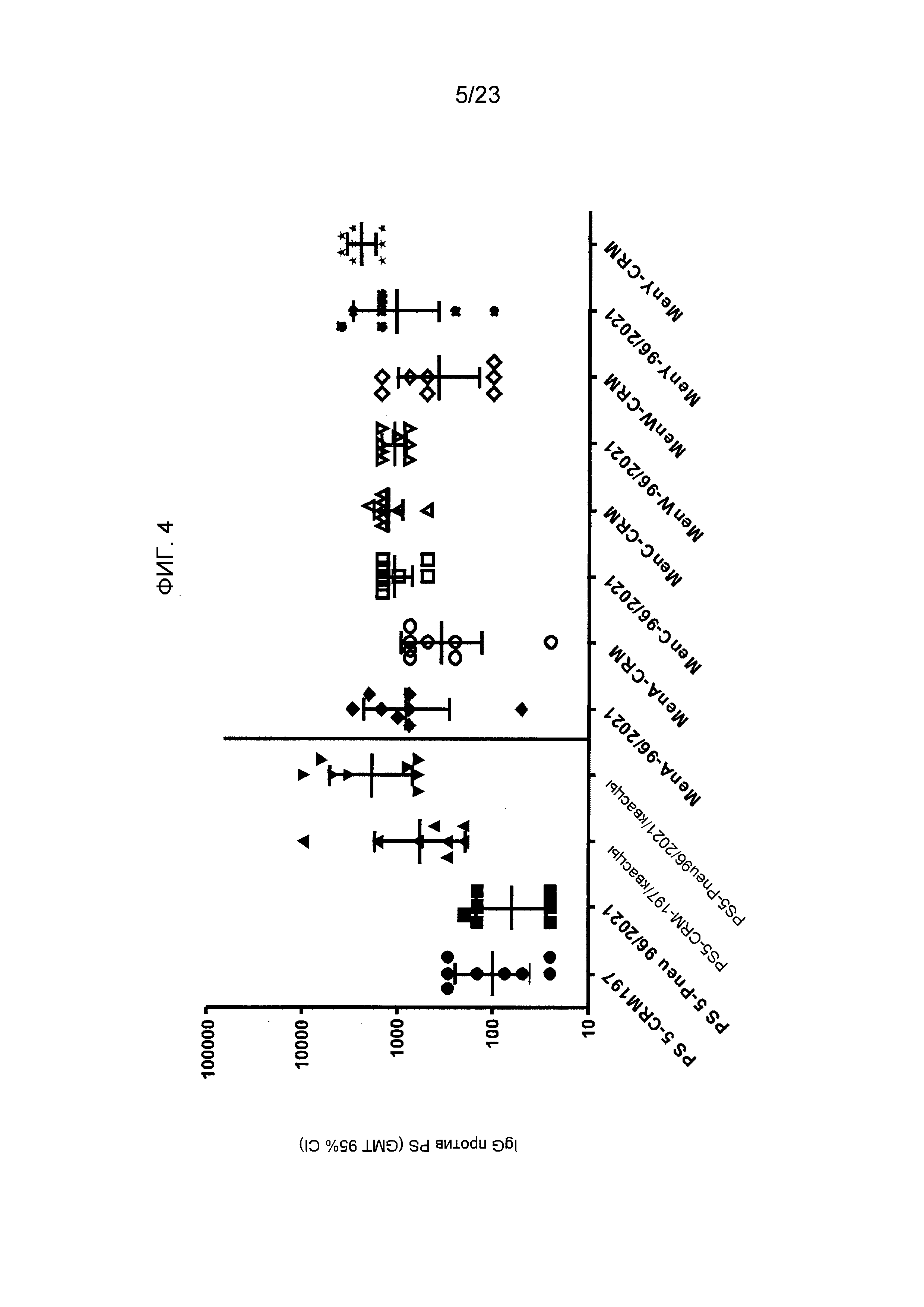
На фиг. 4 сравнивается иммуногенность различных конъюгатов пневмококковых и менингококковых сахаридов по изобретению и эталонных конъюгатов CRM197.
На фиг. 5 сравнивается иммуногенность пневмококкового конъюгата по изобретению с эталонным конъюгатом CRM197.
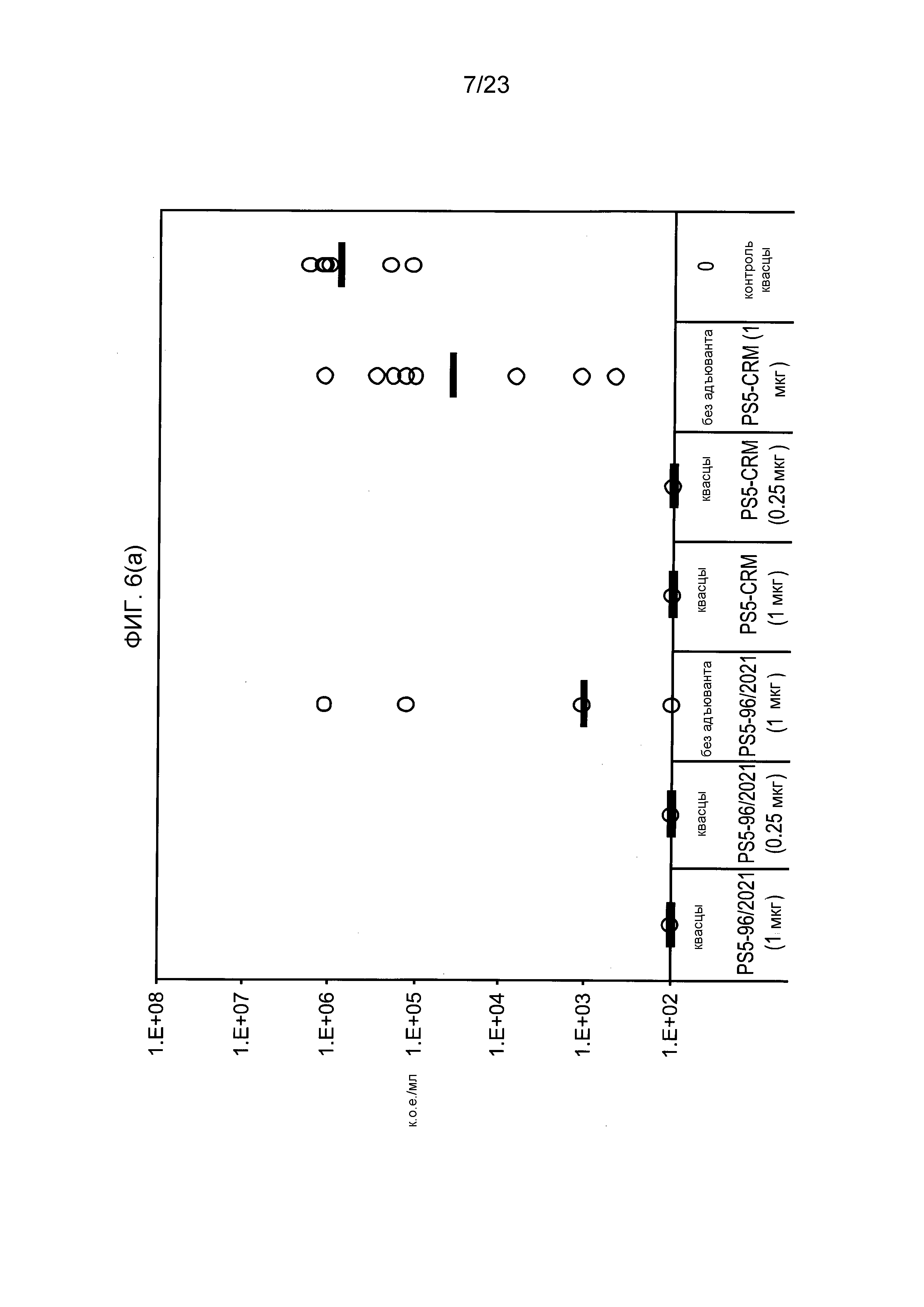
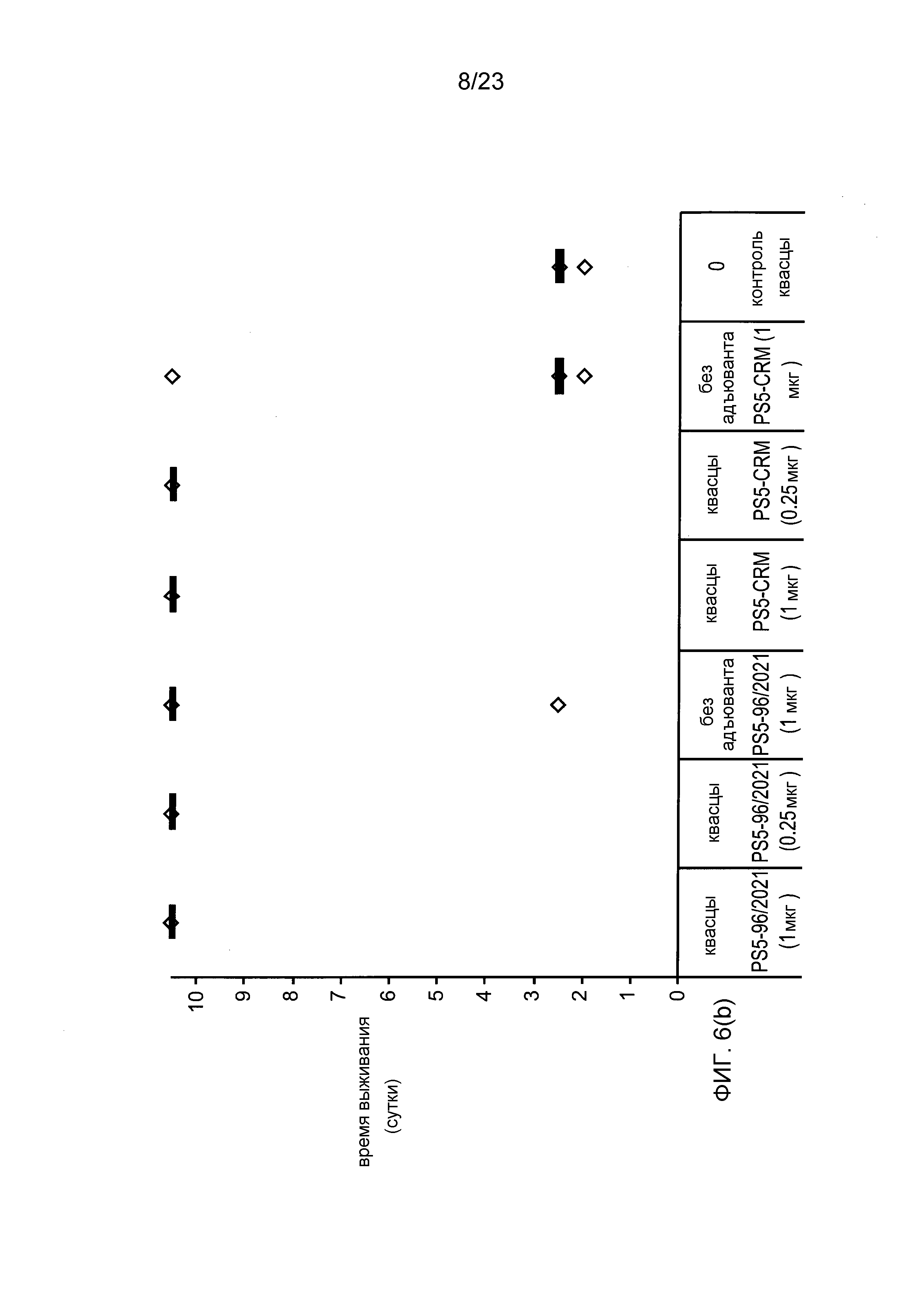
На фиг. 6 сравниваются эффекты пневмококкового конъюгата по изобретению и эталонного конъюгата CRM197 в модели защитного иммунитета против пневмококковой инфекции серотипа 5.
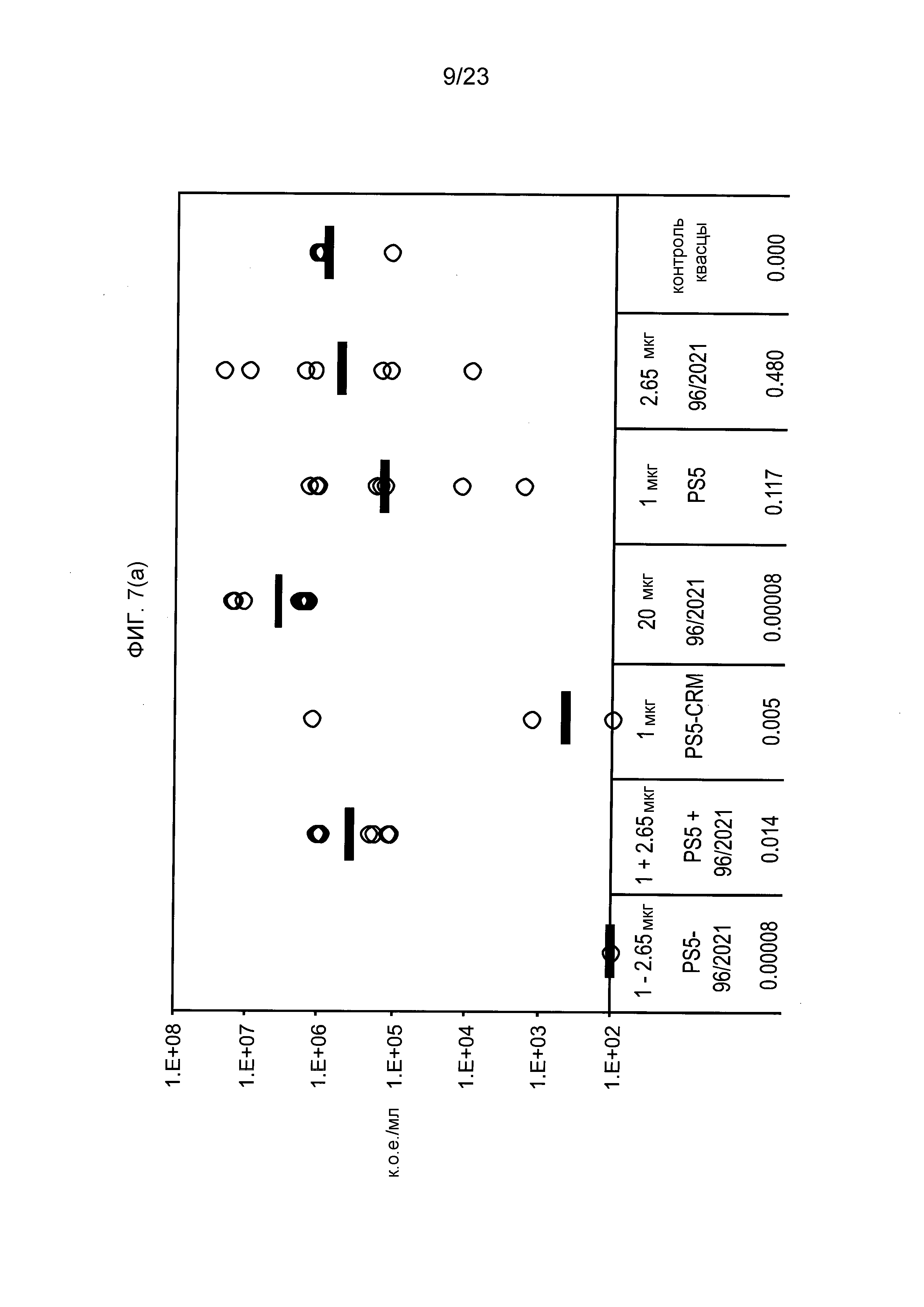
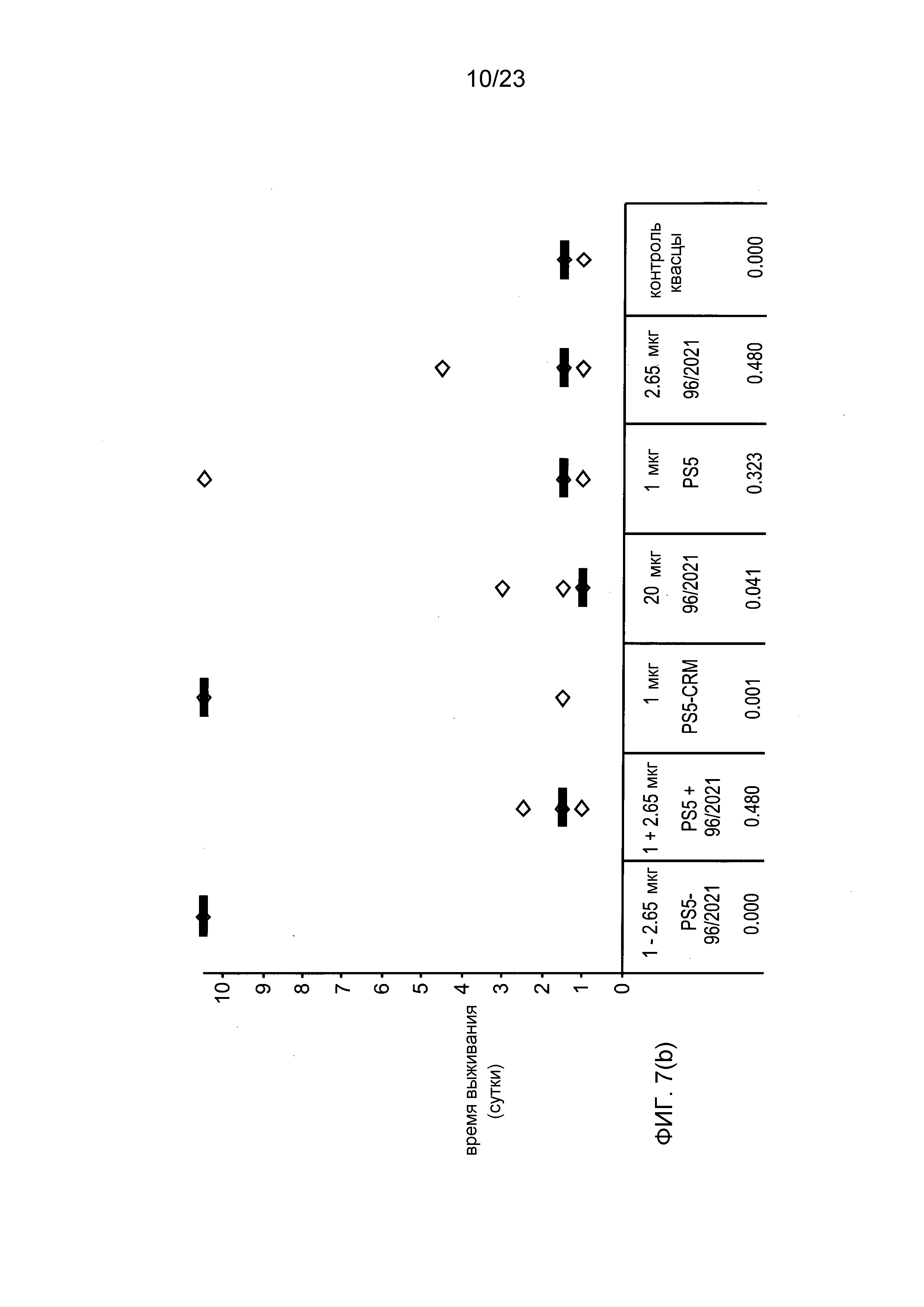
На фиг. 7 сравниваются эффекты пневмококкового конъюгата по изобретению, эталонного конъюгата CRM197, и пневмококкового сахарида и носителя отдельно и вместе, в модели защитного иммунитета против пневмококковой инфекции серотипа 5.
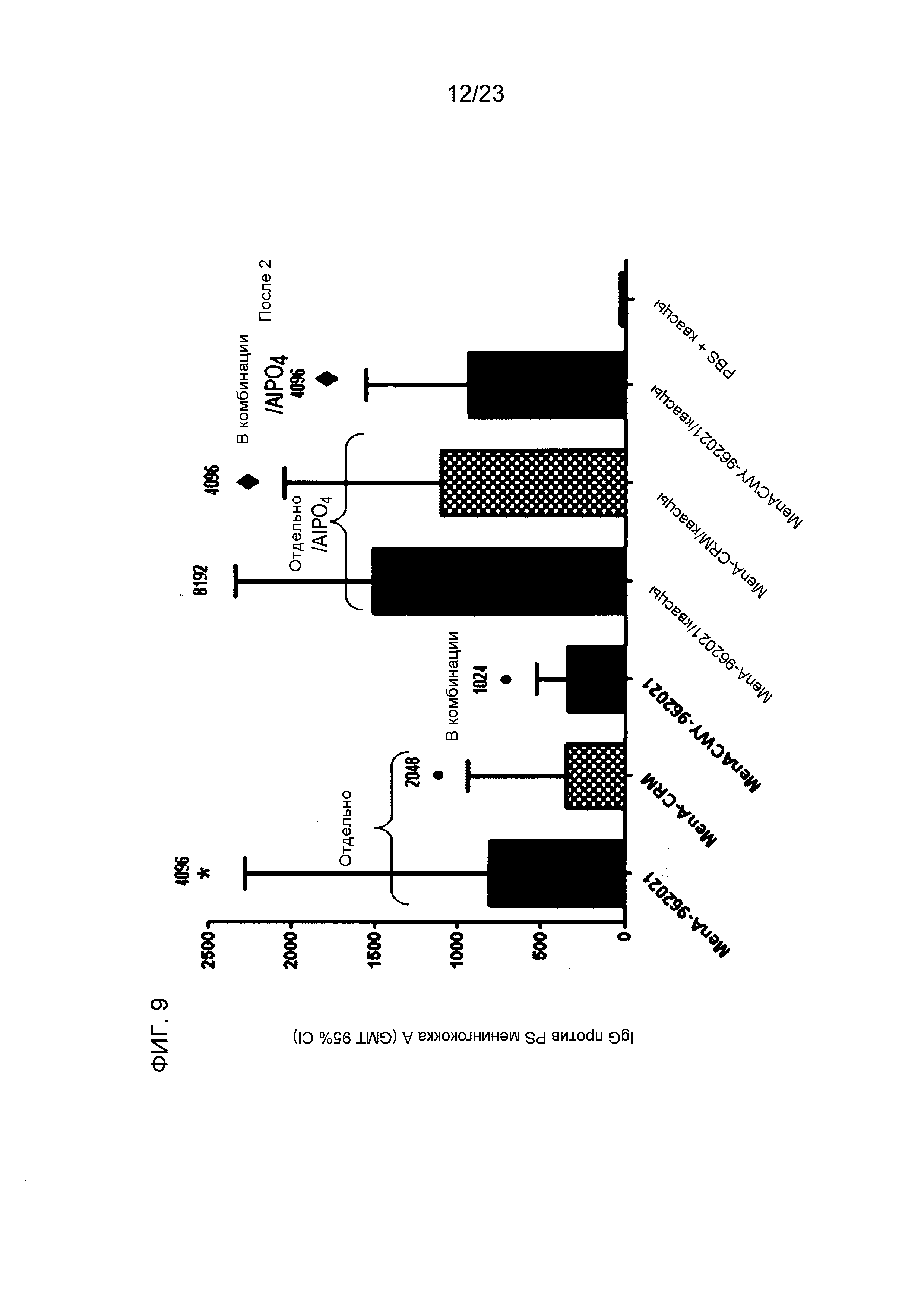
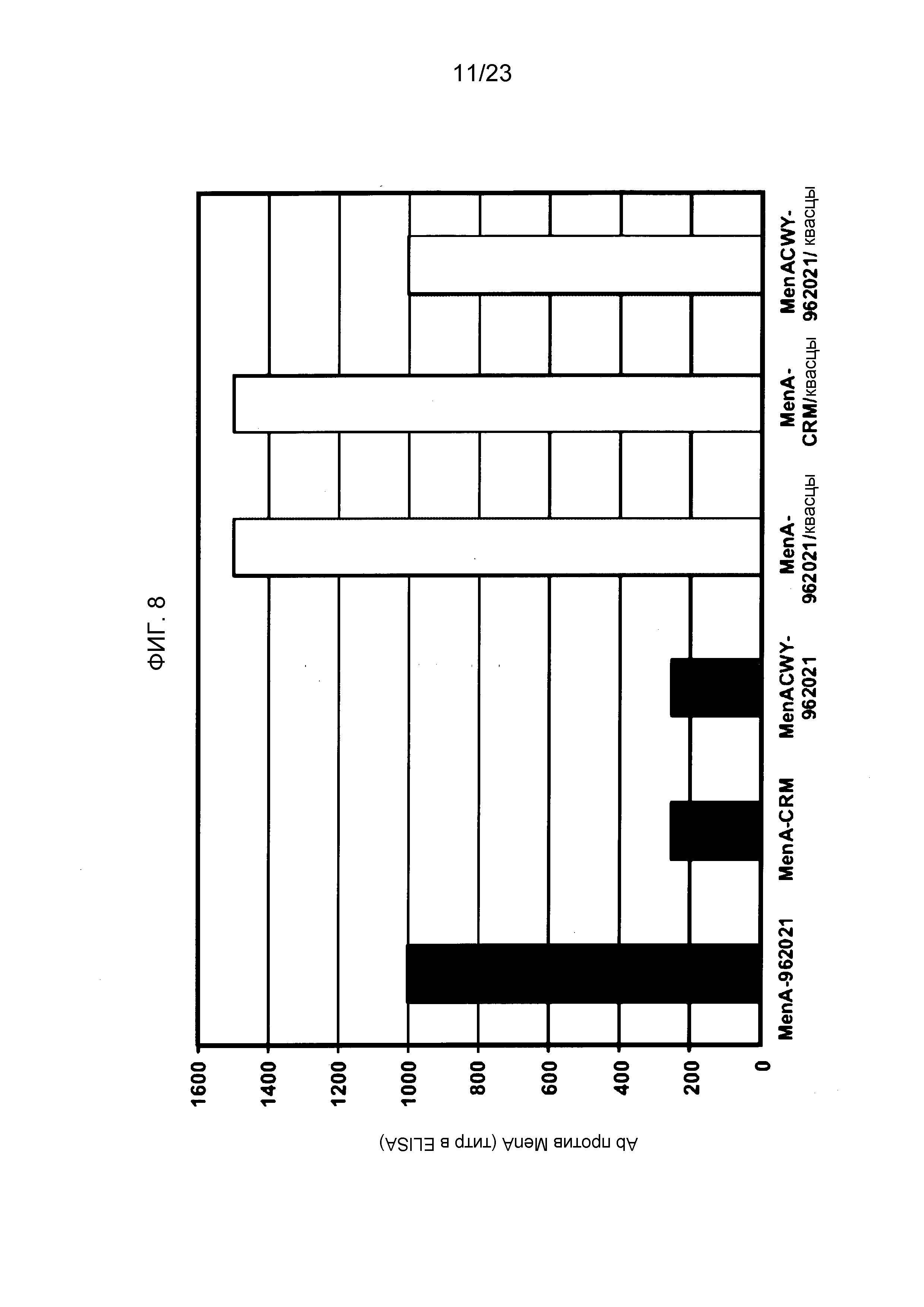
На фиг. 8-10 сравнивается иммуногенность менингококкового конъюгата серогруппы A по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами. На фиг. 9 и 10 над каждым столбцом приведены титры SBA.
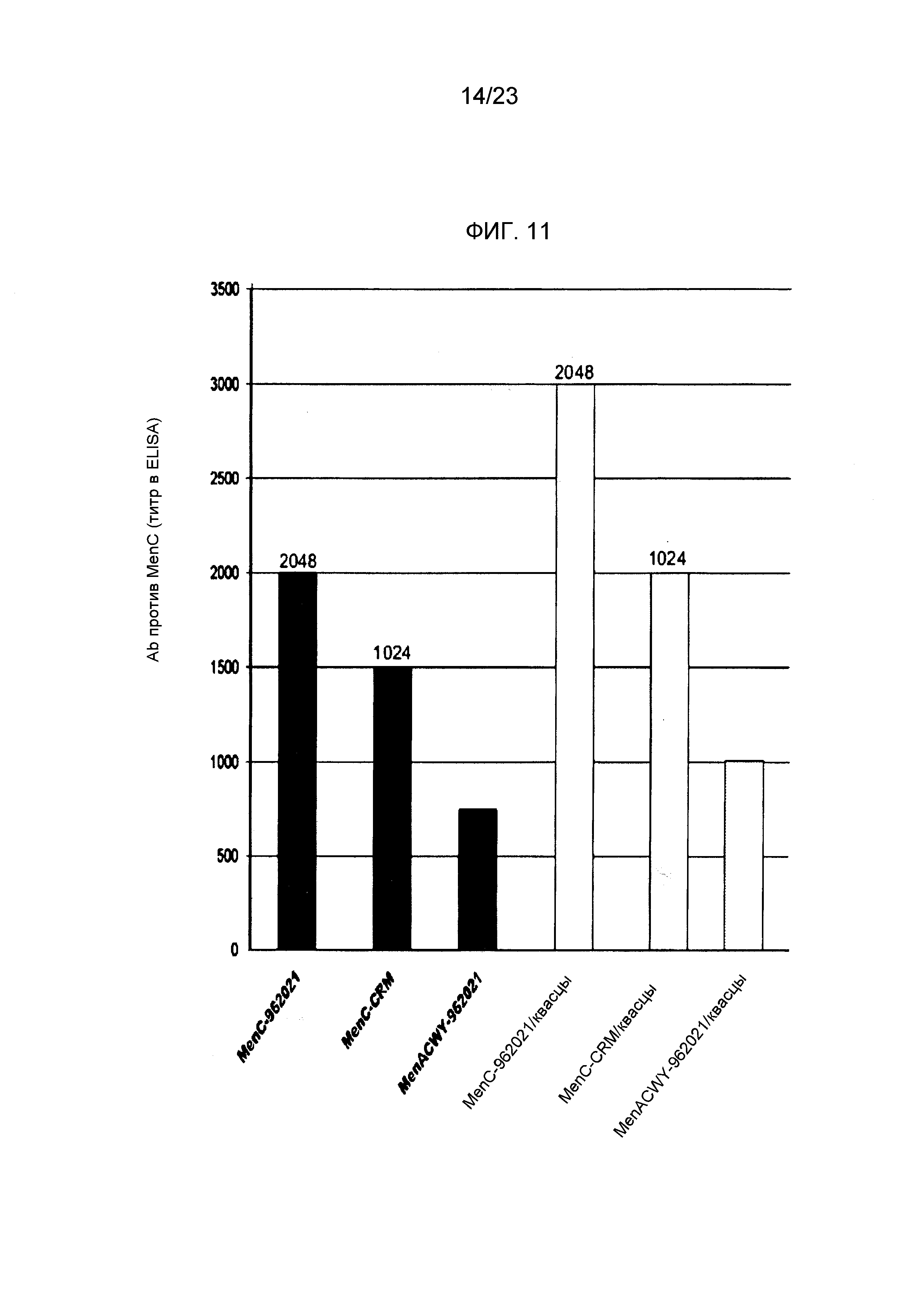
На фиг. 11 сравнивается иммуногенность менингококкового конъюгата серогруппы C по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
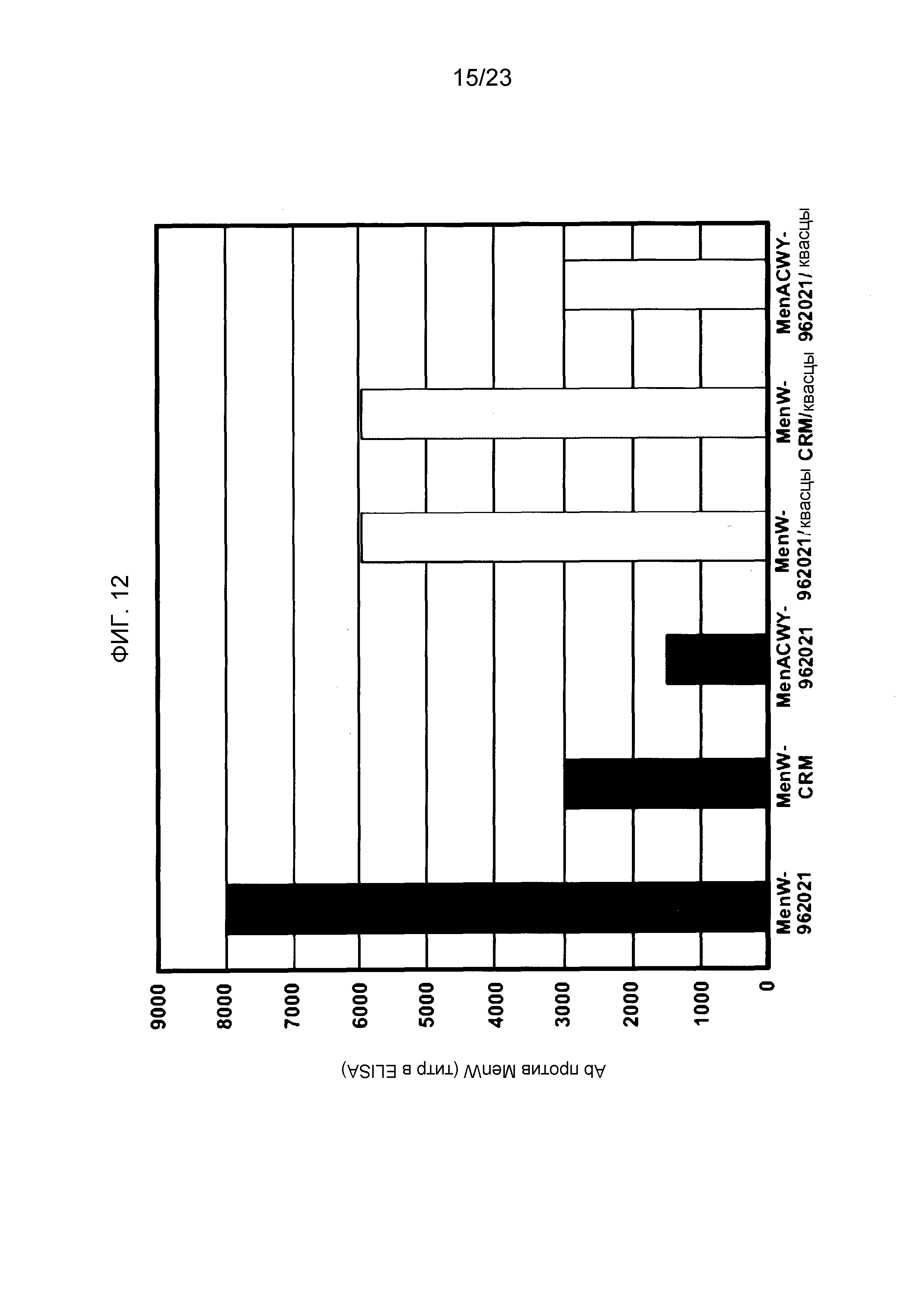
На фиг. 12 сравнивается иммуногенность менингококкового конъюгата серогруппы W135 по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
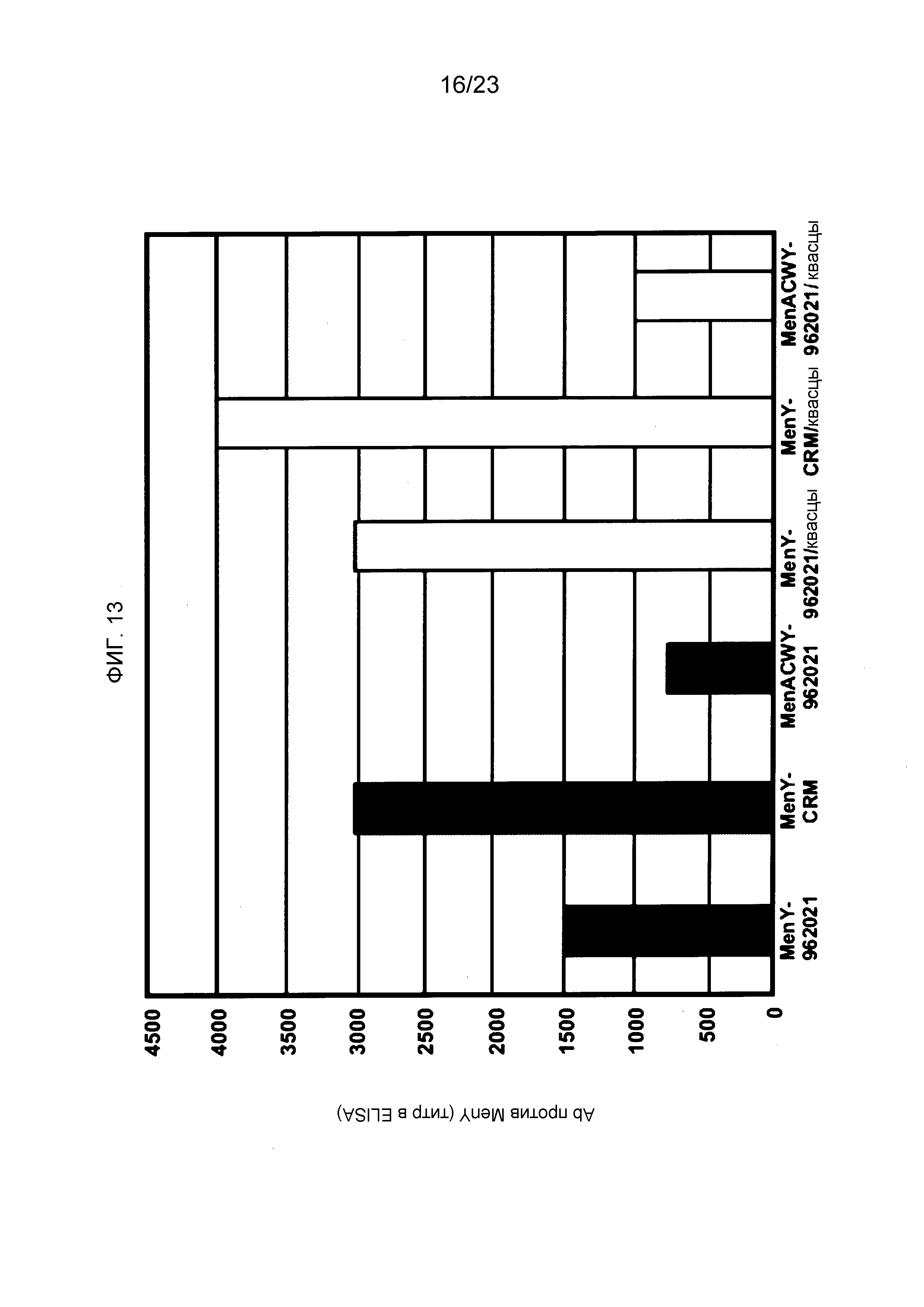
На фиг. 13 сравнивается иммуногенность менингококкового конъюгата серогруппы Y по изобретению и эталонного конъюгата CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
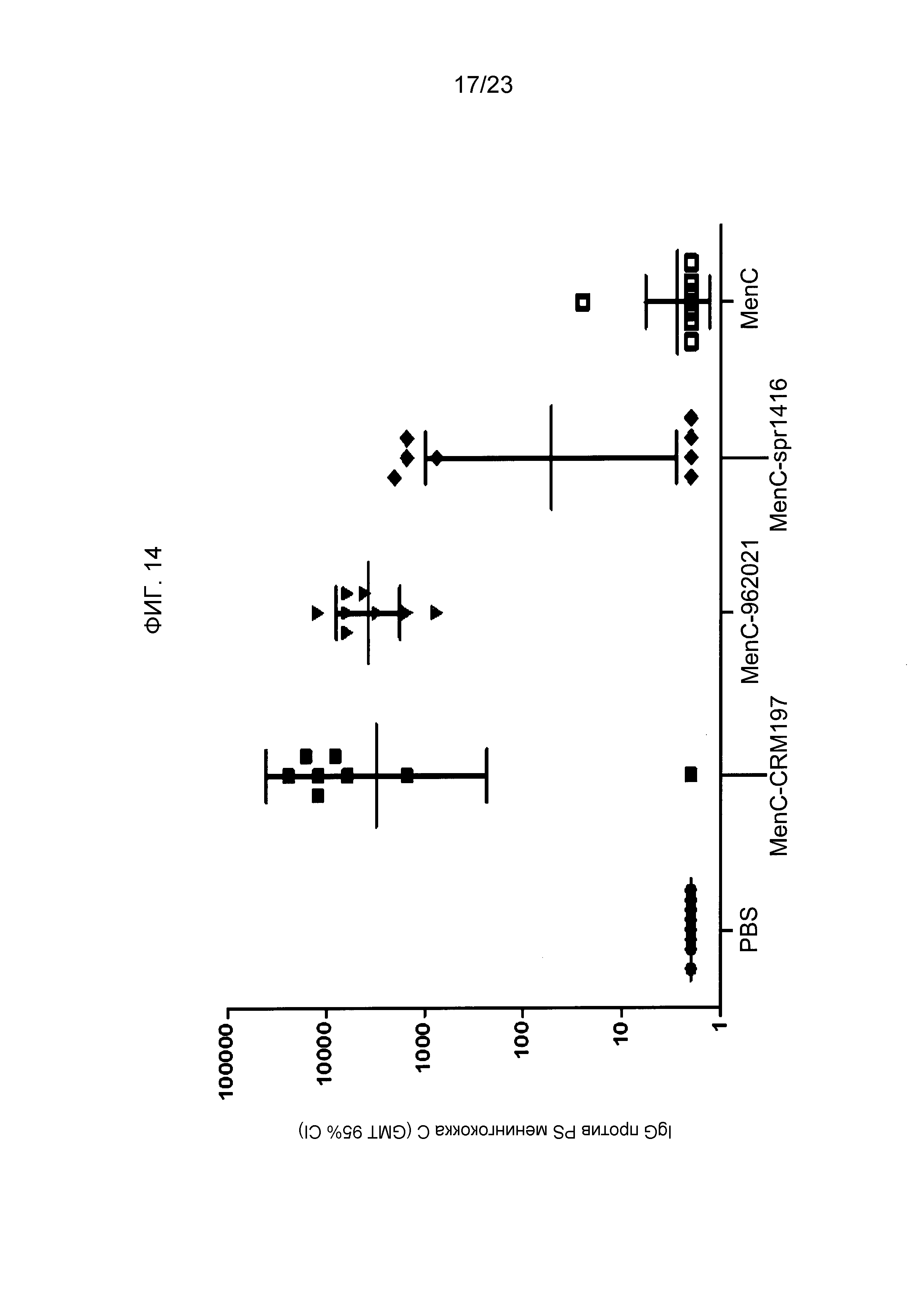
На фиг. 14 сравнивается иммуногенность менингококкового конъюгата серогруппы C по изобретению и эталонного конъюгата CRM197 и конъюгата spr1416.
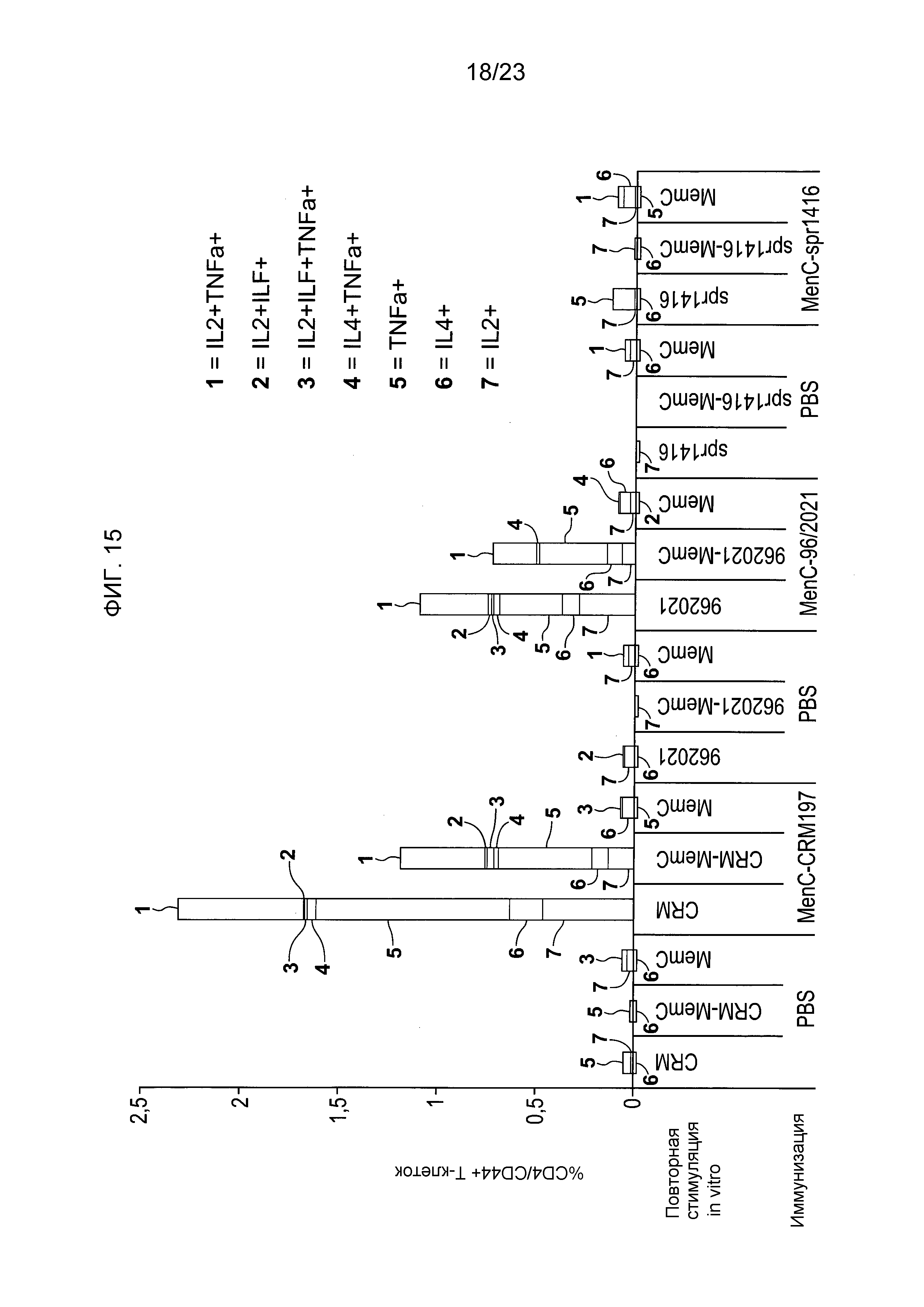
На фиг. 15 сравнивается T-клеточный ответ на менингококковый конъюгат серогруппы C по изобретению и эталонный конъюгат CRM197 и конъюгат spr1416.
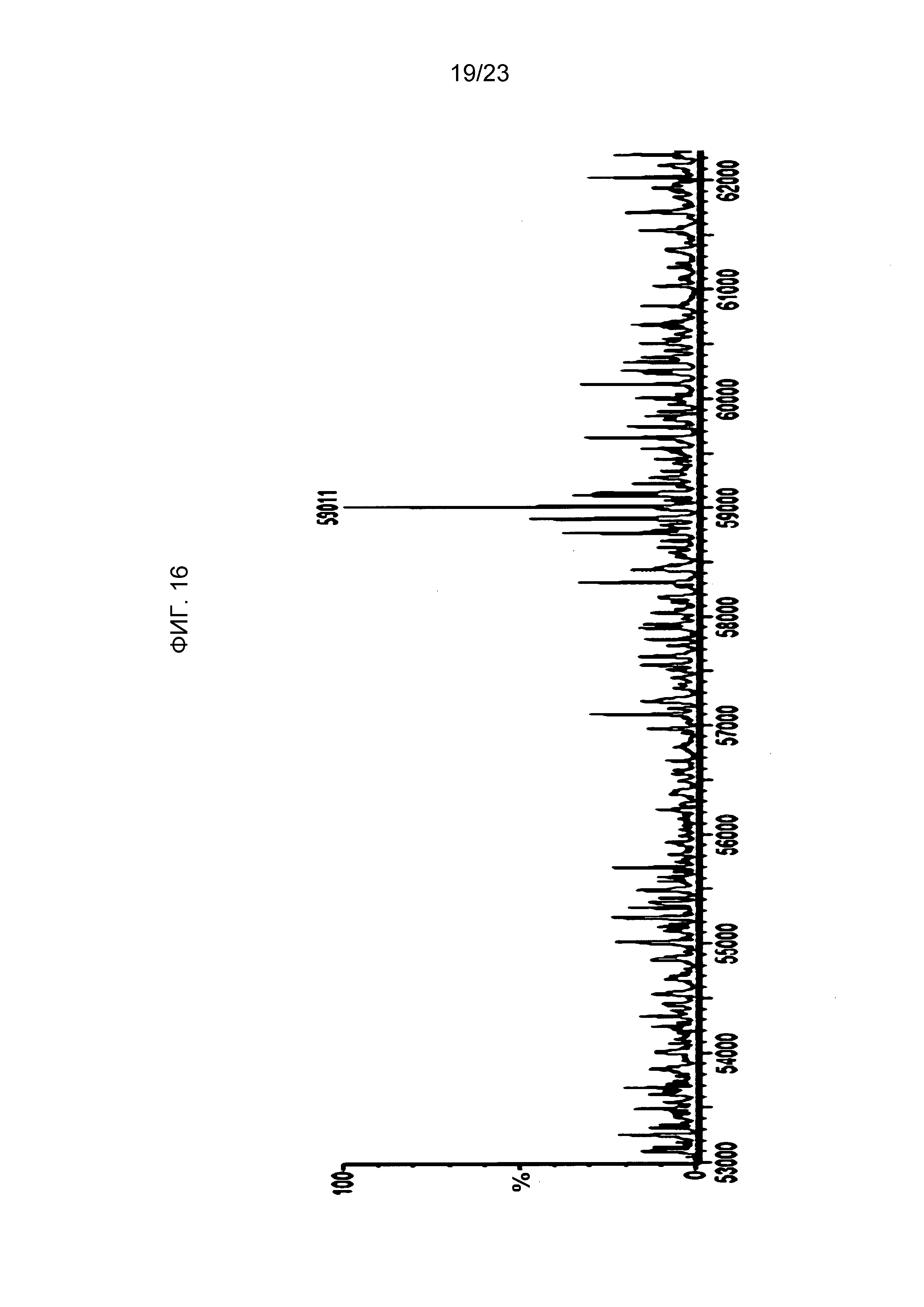
На фиг. 16 представлена кривая масс-спектрометрии для носителя по изобретению, экспрессированного в клетке-хозяине так, чтобы остатки 1-гомоаллилглицина были включены в белок в положениях, обычно содержащих метионин (SEQ ID NO: 20 против SEQ ID NO: 9).
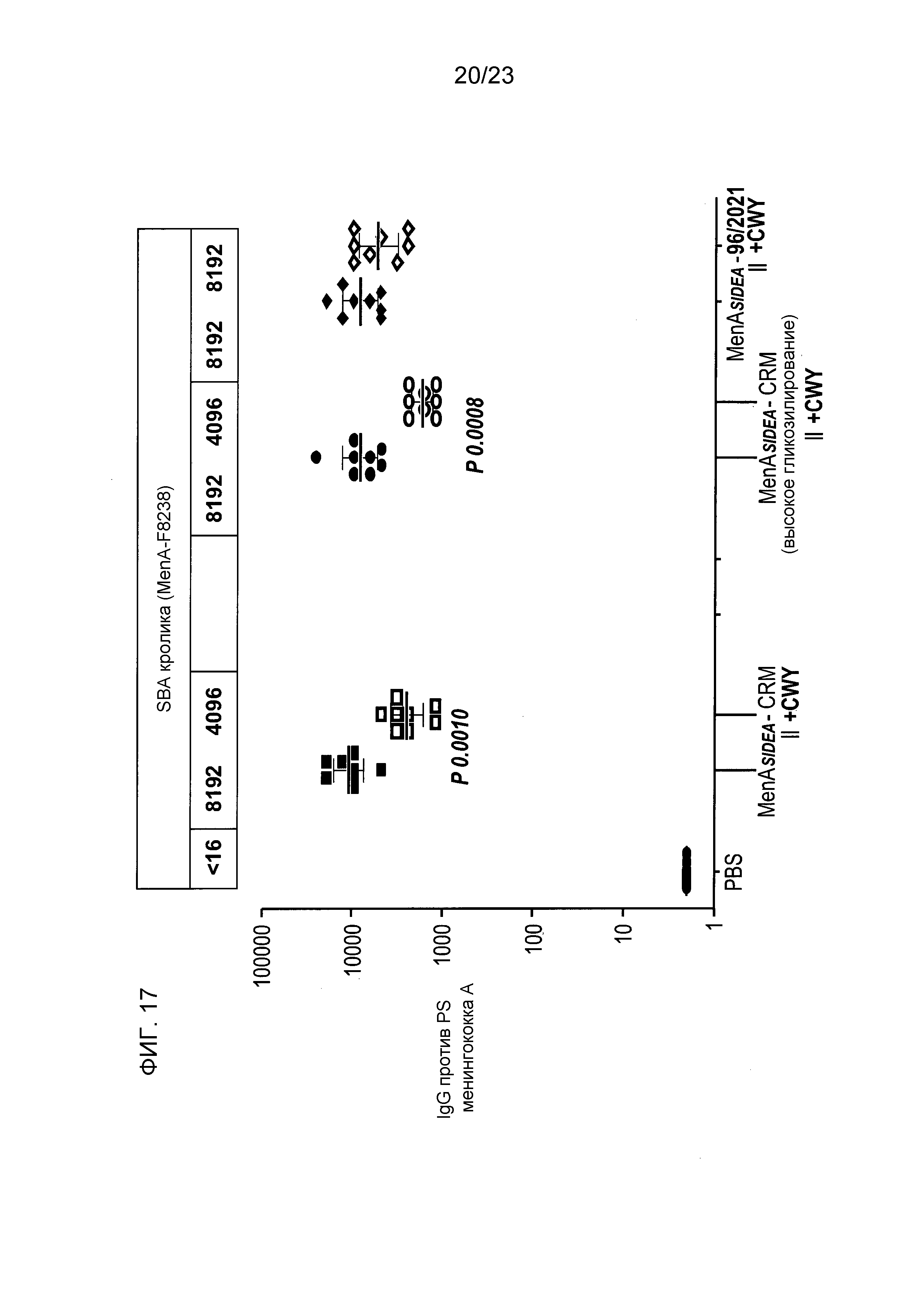
На фиг. 17 сравнивается иммуногенность менингококкового конъюгата серогруппы A по изобретению и эталонных конъюгатов CRM197, отдельно и в комбинации с другими менингококковыми конъюгатами.
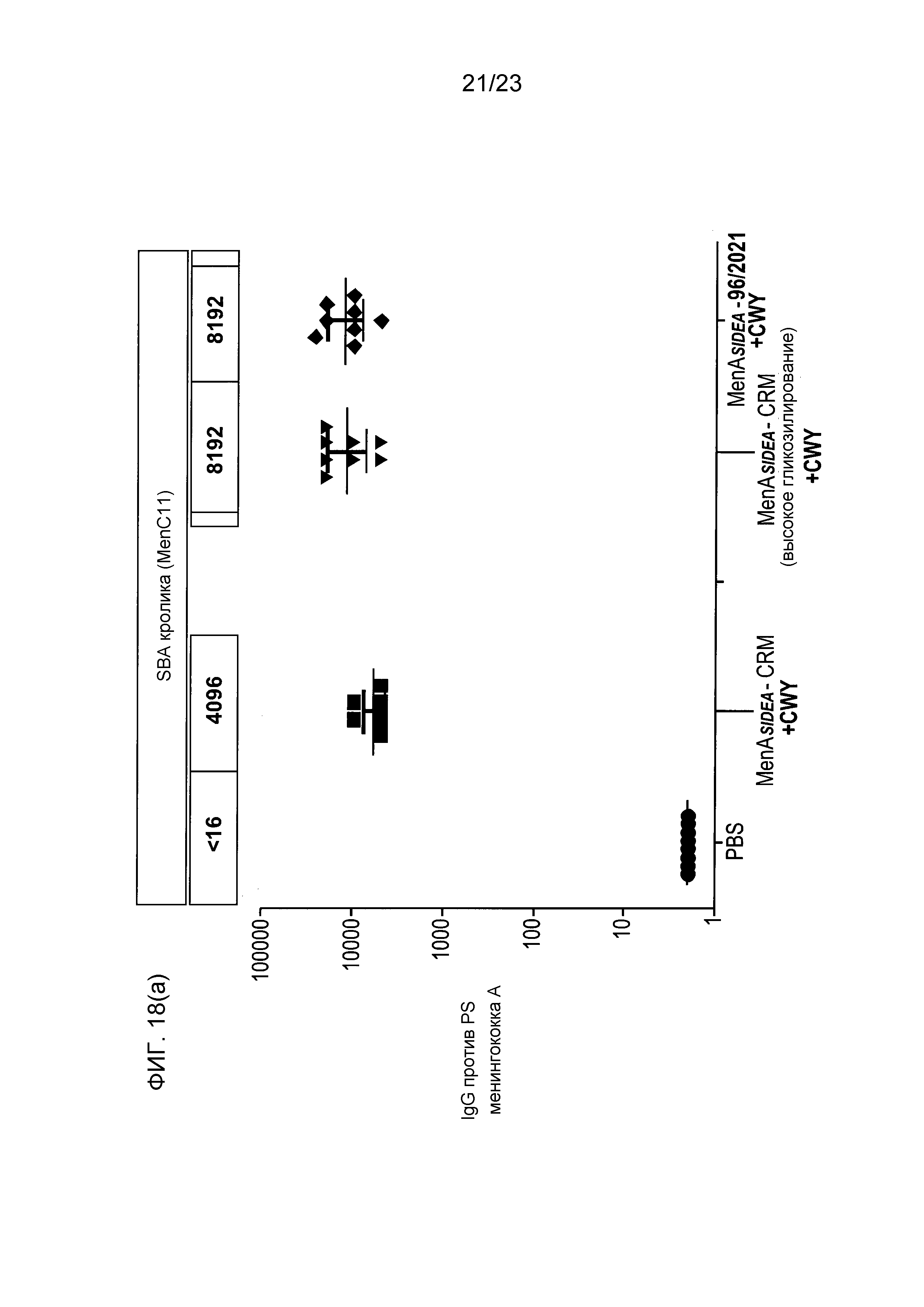
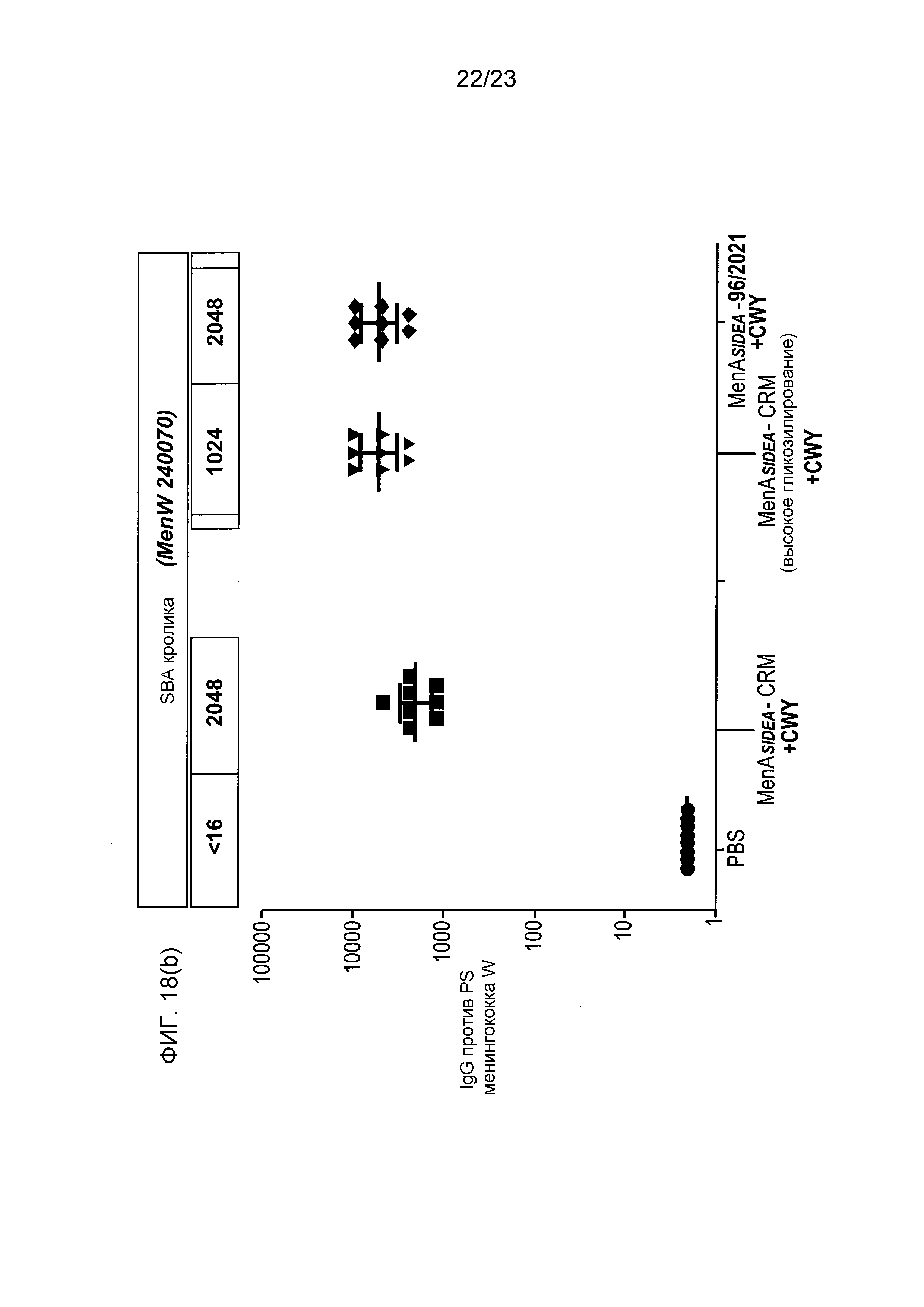
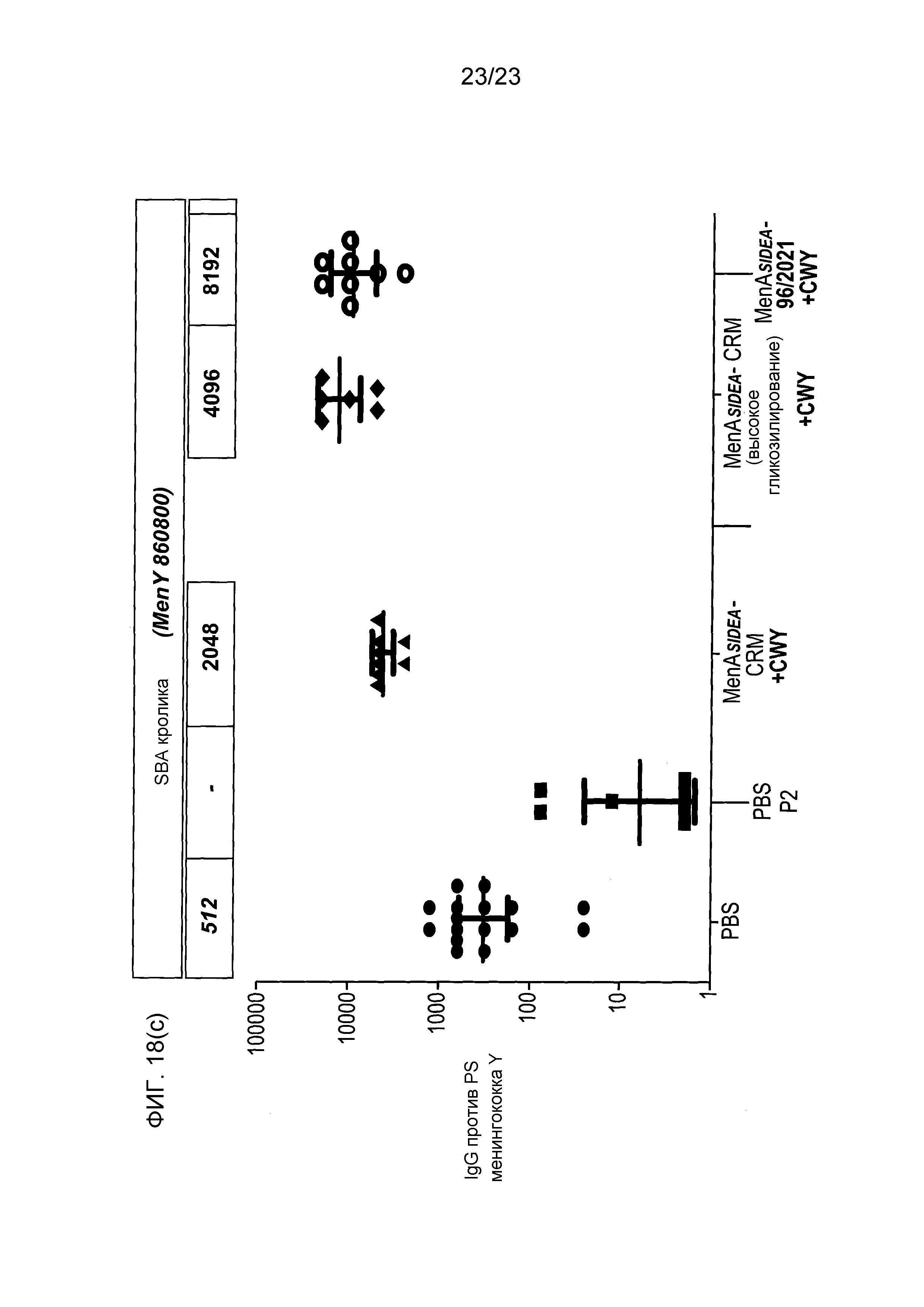
На фиг. 18 сравнивается иммуногенность других менингококковых конъюгатов в исследовании согласно фиг. 17.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к конъюгату, содержащему антиген и молекулу носителя, где молекула носителя содержит антиген spr0096 и антиген spr2021. Признаки этого конъюгата подробно описаны ниже.
Изобретение также относится к молекулам носителей, которые модифицированы так, чтобы они включали неприродные аминокислоты. Иллюстративные модификации и белки носителей также подробно описаны ниже.
Молекула носителя
Молекула носителя содержит антиген spr0096 и антиген spr2021. Как правило, молекула носителя содержит антиген spr0096 и антиген spr2021 в качестве единой полипептидной цепи (ʺгибридныйʺ полипептид).
Антиген spr0096
Исходная последовательность полипептида ʺspr0096ʺ описана в ссылке 16 в качестве ʺгипотетического белкаʺ (см. GI:15902140). Для информации, аминокислотная последовательность полноразмерного spr0096, встречающегося в штамме R6, приведена в настоящем описании в качестве SEQ ID NO: 1.
Антиген spr0096 по изобретению содержит по меньшей мере один CD4+ T-клеточный эпитоп. CD4+ T-клетки помогают B-лимфоцитам продуцировать антитела против антигенов [17]. T-клеточные эпитопы можно идентифицировать эмпирически (например, с использованием PEPSCAN [18, 19] или сходных способов), или их можно предсказывать (например, с использованием антигенного индекса Jameson-Wolf [20], подходов на основе матрицы [21], TEPITOPE [22], нейронных сетей [23], OptiMer & EpiMer [24,25], ADEPT [26], Tsites [27], гидрофильности [28], антигенного индекса [29] или способов, описанных в ссылке 30, и т.д.).
Предпочтительные антигены spr0096 для применения в рамках настоящего изобретения включают аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 1; и/или (b) содержащую фрагмент по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 1, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти полипептиды spr0096 включают варианты SEQ ID NO: 1 (например, SEQ ID NO: 2; см. ниже). Предпочтительные фрагменты (b) содержат по меньшей мере один CD4+ T-клеточный эпитоп из SEQ ID NO: 1. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на C-конце и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на N-конце SEQ ID NO: 1 при сохранении по меньшей мере одного CD4+ T-клеточного эпитопа SEQ ID NO: 1. В других фрагментах отсутствуют один или несколько белковых доменов. Одним пригодным фрагментом является SEQ ID NO: 14, в котором отсутствует последовательность природного лидерного пептида. Антиген spr0096 может состоять из одного CD4+ T-клеточного эпитопа из SEQ ID NO: 1.
Форма варианта spr0096 с вставкой вблизи его C-конца относительно SEQ ID NO: 1 в настоящем описании представлена как SEQ ID NO: 2. Использование этого варианта для иммунизации описано в ссылке 31 (SEQ ID NO: 150 в указанном документе), где она описана как домен белка LysM. Таким образом, антиген spr0096 для применения в рамках настоящего изобретения может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 2; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 2, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти полипептиды включают варианты SEQ ID NO: 2. Предпочтительные фрагменты (b) включают по меньшей мере один CD4+ T-клеточный эпитоп из SEQ ID NO: 2. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на C-конце и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на N-конце SEQ ID NO: 2 при сохранении по меньшей мере одного CD4+ T-клеточного эпитопа SEQ ID NO: 2. В других фрагментах отсутствуют один или несколько белковых доменов. Одним подходящим фрагментом является SEQ ID NO: 15, в котором отсутствует последовательность природного лидерного пептида. Иммуногенные фрагменты SEQ ID NO: 2 идентифицированы в таблице 1 ссылки 31. Антиген spr0096 может состоять из одного CD4+ T-клеточного эпитопа из SEQ ID NO: 2.
Антиген spr0096 можно использовать в форме димера, например, гомодимера.
Антиген spr2021
Исходная полипептидная последовательность ʺspr2021ʺ описана в ссылке 16 в качестве ʺобщего стрессорного белка GSP-781ʺ (см. GI:15904062). Для информации, аминокислотная последовательность полноразмерного spr2021, встречающегося в штамме R6, приведена в настоящем описании в качестве SEQ ID NO: 3.
Антиген spr2021 по изобретению содержит по меньшей мере один CD4+ T-клеточный эпитоп.
Предпочтительные антигены spr2021 для применения в рамках изобретения содержат аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 3; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 3, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более). Эти полипептиды spr2021 включают варианты SEQ ID NO: 3. Предпочтительные фрагменты (b) содержат по меньшей мере один CD4+ T-клеточный эпитоп из SEQ ID NO: 3. Другие предпочтительные фрагменты лишены одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на C-конце и/или одной или нескольких аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25 или более) на N-конце SEQ ID NO: 3 при сохранении по меньшей мере одного CD4+ T-клеточного эпитопа SEQ ID NO: 3. В других фрагментах отсутствуют один или несколько белковых доменов. Одним пригодным фрагментом является SEQ ID NO: 4, в которой отсутствует последовательность природного лидерного пептида. Антиген spr0096 может состоять из одного CD4+ T-клеточного эпитопа из SEQ ID NO: 3.
В ссылке 31 описан spr2021 в качестве секретируемого белка массой 45 кДа, имеющего гомологию с GbpB, и описано его применение в качестве иммуногена (SEQ ID NO: 243 в указанном документе; SP2216). Иммуногенные фрагменты spr2021 указаны в таблице 1 ссылки 31 (стр.73). Другой пригодный фрагмент spr2021 описан в качестве SEQ ID NO: 1 в ссылке 32 (аминокислоты 28-278 SEQ ID NO: 3 в настоящем описании).
Гибридный полипептид
Как правило, антиген spr0096 и антиген spr2021 экспрессируются в качестве одной полипептидной цепи (ʺгибридныйʺ полипептид). Гибридные полипептиды могут быть представлены формулой NH2-A-{-X-L-}n-B-COOH, где: A представляет собой необязательную N-концевую аминокислотную последовательность; B представляет собой необязательную C-концевую аминокислотную последовательность; n представляет собой целое число, равное 2 или более (например, 2, 3, 4, 5, 6 и т.д.); каждый X представляет собой аминокислотную последовательность антигена spr0096 или антигена spr2021 (как описано выше), где по меньшей мере один X представляет собой антиген spr0096 и по меньшей мере один X представляет собой антиген spr2021; и L представляет собой необязательную линкерную аминокислотную последовательность. Обычно n равно 2. Когда n равно 2, X1 обычно представляет собой антиген spr0096 и X2 обычно представляет собой антиген spr2021. Когда n составляет более 2, каждый антиген spr0096 (когда присутствует более одного антигена) может быть таким же или отличающимся и каждый антиген spr2021 (когда присутствует более одного антигена) может быть таким же или отличающимся.
Антиген spr0096 или антиген spr2021, который представляет собой аминокислотную последовательность каждого X, является таким, как определено выше. Когда эти антигены определены как (a) имеющие 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с данной последовательностью; и/или (b) содержащие фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот данной последовательности, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), уровень идентичности в (a) и величина ʺnʺ в (b) могут быть одинаковыми для каждого X.
Лидерная пептидная последовательность в форме дикого типа каждой части -X- может быть включена или может отсутствовать в гибридном белке. В некоторых вариантах осуществления лидерные пептиды удалены, за исключением лидерных пептидов части -X-, расположенной на N-конце гибридного белка, т.е. лидерный пептид X1 сохранен, однако лидерные пептид X2 … Xn отсутствуют. Это эквивалентно удалению всех лидерных пептидов и использованию лидерного пептида X1 в качестве части -A-.
Для каждого из n случаев {-X-L-}, линкерная аминокислотная последовательность -L- может присутствовать или отсутствовать. Например, когда n=2, гибрид может представлять собой NH2-X1-L1-X2-L2-COOH, NH2-X1-X2-COOH, NH2-X1-L1-X2-COOH, NH2-X1-X2-L2-COOH и т.д. Линкерная аминокислотная последовательность(и) -L-, как правило, является короткой (например, 20 или меньше аминокислот, т.е. 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают короткие пептидные последовательности, которые облегчают клонирование, полиглициновые линкеры (т.е. содержащие Glyn, где n=2, 3, 4, 5, 6, 7, 8, 9, 10 или более) и гистидиновые метки (т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие линкерные аминокислотные последовательности будут понятны специалистам в данной области. Пригодным линкером является GSGGGG (SEQ ID NO:5) или GSGSGGGG (SEQ ID NO:6), причем дипептид Gly-Ser образован участком рестрикции BamHI, таким образом, способствуя клонированию и манипулированию, и тетрапептид (Gly)4 является типичным полиглициновым линкером. Другие подходящие линкеры, в частности, для применения в качестве конечного Ln представляют собой дипептид Leu-Glu или SEQ ID NO: 7.
-A- представляет собой необязательную N-концевую аминокислотную последовательность. Она, как правило, является короткой (например, 40 или менее аминокислот, т.е. 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают лидерные последовательности для регуляции транспорта белка или короткие пептидные последовательности, которые облегчают клонирование и очистку (например, гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более). Другие подходящие N-концевые аминокислотные последовательности будут понятны специалистам в данной области. Если X1 лишен его собственного N-концевого метионина, -A- предпочтительно представляет собой олигопептид (например, с 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотами), который обеспечивает N-концевой метионин, например, Met-Ala-Ser, или единичный остаток Met.
-B- представляет собой необязательную C-концевую аминокислотную последовательность. Она, как правило, является короткой (например, 40 или менее аминокислот, т.е. 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1). Примеры включают последовательности для регуляции транспорта белка, короткие пептидные последовательности, которые облегчают клонирование или очистку (например, содержащие гистидиновые метки, т.е. Hisn, где n=3, 4, 5, 6, 7, 8, 9, 10 или более, такие как SEQ ID NO: 8), или последовательности, которые повышают стабильность белка. Другие подходящие C-концевые аминокислотные последовательности будут понятны специалистам в данной области.
Примеры гибридов включают полипептиды, которые содержат аминокислотную последовательность spr0096-spr2021 (например, SEQ ID NO: 9) или spr2021-spr0096 (например, SEQ ID NO: 10). Гибрид также может содержать аминокислотную последовательность, имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 9 или 10. Как правило, гибрид содержит аминокислотную последовательность SEQ ID NO: 9. Гибрид также может содержать аминокислотную последовательность, имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 9.
В конкретных вариантах осуществления молекула носителя содержит (a) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 2; и (b) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 3.
Молекулы носителей, модифицированные так, чтобы они включали неприродные аминокислоты
Также изобретение относится к молекулам носителей, модифицированным так, чтобы они включали неприродные аминокислоты. Неприродную аминокислоту можно использовать для конъюгации молекулы носителя с другой молекулой.
В некоторых альтернативах молекула носителя содержит одну или несколько (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.д.) неприродных аминокислот. Неприродная аминокислота может иметь функциональную группу с реакционным профилем, который отличается от реакционного профиля функциональных групп, доступных для реакции в белках, состоящих из канонических аминокислот (например, аминогруппа лизина или сульфгидрильная группа цистеина). Это, в свою очередь, означает, что хемоселективные реакции позволяют проведение сайт-селективной конъюгации в заданных участках, где в белок включена неприродная аминокислота.
В конкретных вариантах осуществления молекула носителя содержит один или несколько остатков L-гомоаллилглицина (HAG). Как правило, остатки HAG замещают остатки метионина в последовательности. HAG, химически известная как L-2-амино-5-гексановая кислота, является аналогом метионина и содержит реакционноспособный алкеновый участок. HAG может заменять метионин на стадиях как инициации, так и элонгации, синтеза белка. HAG имеет олефиновую боковую цепь, которая имеет отличающийся реакционный профиль относительно функциональных групп, встречающихся в канонических аминокислотах, реагирующую через тиил-еновый механизм.
В других вариантах осуществления молекула носителя может быть модифицирована включением других неприродных аминокислот, которые позволяют проведение сайт-селективной конъюгации в заданных участках. Например, молекула носителя может быть модифицирована так, чтобы один или несколько (например, 1, 2, 3, 4, 5 и т.д.) остатков п-ацетилфенилаланина были включены в ее последовательность. Эта аминокислота имеет кето-функциональную группу, которая не присутствует ни в одной из канонических аминокислот, и, таким образом, аминокислота может специфически реагировать с гидразинами, алкоксиаминами и семикарбазидами в мягких водных условиях, образуя гидразоновые, оксимные и семикарбазоновые связи. Другие аминокислоты с кето-функциональными группами включают м-ацетилфенилаланин и п-бензоилфенилаланин и эти остатки можно использовать аналогичным образом.
В других вариантах осуществления молекула носителя может быть модифицирована так, чтобы она включала азидную группу (которая также не встречается в канонических аминокислотах), например путем включения одного или нескольких (например, 1, 2, 3, 4, 5 и т.д.) остатков п-азидофенилаланина. Азидная группа может реагировать с ацетиленовой группой на партнере по конъюгации в катализируемой медью (I) [2+3] реакции циклоприсоединения. Напротив, можно встроить способами инженерии в белок-носитель не встречающуюся в природе ацетиленовую группу путем включения одного или нескольких (например, 1, 2, 3, 4, 5 и т.д.) остатков п-пропаргилоксифенилаланина, которые затем можно подвергать реакции с помощью того же механизма с азидной группой на партнере по конъюгации.
В следующих вариантах осуществления молекула носителя может быть модифицирована так, чтобы она включала один или несколько (например, 1, 2, 3, 4, 5 и т.д.) остатков фенилселеноцистеина. Обработка этого остатка пероксидом водорода позволяет его конъюгацию с тиольными группами.
В иллюстративных модифицированных молекулах носителей по изобретению антиген spr0096 может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 1; и/или (b) содержащую фрагмент по меньшей мере из ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 1, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько остатков метионина в полипептиде заменен на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 16.
Форма варианта spr0096 с вставкой вблизи его C-конца относительно SEQ ID NO: 1, представлена как SEQ ID NO: 2 в настоящем описании. Таким образом, антиген spr0096 для применения в рамках изобретения может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 2; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 2, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько остатков метионина в полипептиде заменен на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 17. В другом или тех же примерах модифицированных молекул носителей по изобретению антиген spr2021 может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 3; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 3, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько из остатков метионина в полипептиде заменен на HAG. В некоторых вариантах осуществления два или более, три или более, или четыре или более из остатков метионина остатки в полипептиде заменены на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 18.
Форма варианта spr2021 представляет собой SEQ ID NO: 4, в которой отсутствует природная лидерная пептидная последовательность. Таким образом, антиген spr2021 для применения в рамках изобретения может содержать аминокислотную последовательность: (a) имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 4; и/или (b) содержащую фрагмент из по меньшей мере ʺnʺ последовательно расположенных аминокислот SEQ ID NO: 4, где ʺnʺ равно 7 или более (например, 8, 10, 12, 14, 16, 18, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250 или более), где один или несколько из остатков метионина в полипептиде заменены на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 19.
Следующие примеры модифицированных молекул носителя включают гибридные полипептиды, как определено выше, где один или несколько из остатков метионина в полипептиде заменен на HAG. Например, гибридный полипептид может содержать аминокислотную последовательность spr0096-spr2021 (например, SEQ ID NO: 9) или spr2021-spr0096 (например, SEQ ID NO: 10), или аминокислотную последовательность, имеющую 50% или более идентичность (например, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или более) с SEQ ID NO: 9 или 10, где один или несколько из остатков метионина в полипептиде заменен на HAG. В некоторых вариантах осуществления два или более, или три или более остатков метионина в полипептиде заменены на HAG. Например, молекула носителя может иметь последовательность, указанную в SEQ ID NO: 20 или 21. В конкретных вариантах осуществления молекула носителя содержит (a) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 2; и/или (b) один или несколько (например, 1, 2, 3, 4, 5 и т.д.) CD4+ T-клеточных эпитопов из SEQ ID NO: 3.
Эти способы также можно использовать для других известных неприродных аминокислот, и, кроме того, для других молекул носителей. Таким образом, в описанных выше вариантах осуществления молекула носителя может представлять собой любую из этих других молекул носителей. Предпочтительные молекулы носителей включают бактериальные токсины, такие как дифтерийные или столбнячные токсины или токсоиды, или их мутанты. Их часто используют в вакцинах на основе конъюгатов. Мутант дифтерийного токсина CRM197 является особенно предпочтительным [33]. Также можно использовать фрагмент C столбнячного токсоида [34]. Другие молекулы носителей включают антигены, такие как spr0096 или spr2021, как описано выше. Следующие пригодные молекулы носителей включают комплекс белков наружной мембраны N.meningitidis [35], синтетические пептиды [36, 37], белки теплового шока [38, 39], коклюшные белки [40, 41], цитокины [42], лимфокины [150], гормоны [150], факторы роста [150], искусственные белки, содержащие множество CD4+ T-клеточных эпитопов человека из различных происходящих из патогенов антигенов [43], таких как N19 [44], белок D из H.influenzae [45-47], пневмолизин [48] или его нетоксичные производные [49], пневмококковый поверхностный белок PspA [50], осуществляющие захват железа белки [51], токсин A или B из C.difficile [52], рекомбинантный экзобелок A Pseudomonas aeruginosa (rEPA) [53] и т.д.
Антиген
Антиген, как правило, представляет собой сахарид. Когда антиген представляет собой сахарид, сахарид может представлять собой любой сахарид, в частности, сахарид из патогенного организма. Иллюстративные сахариды для применения в рамках изобретения описаны ниже. В частности, сахарид может представлять собой бактериальный сахарид, например, бактериальный капсулярный сахарид. Репрезентативные бактериальные сахариды представлены на фиг.1.
Сахариды можно использовать в форме олигосахаридов. Их удобным образом получают путем фрагментации очищенного полисахарида (например, гидролизом), после которой обычно следует очистка фрагментов желаемого размера. Сахариды можно очищать из природных источников. В качестве альтернативы очистке сахариды можно получать посредством полного или частичного синтеза.
Когда антиген не является сахаридом, он может представлять собой любой другой антиген, т.е. любой иммуноген или гаптен. Конъюгаты по изобретению могут индуцировать иммунный ответ против гаптена, конъюгированного с молекулой носителя. Гаптен может представлять собой, например, лекарственное средство, вызывающее злоупотребление [54]. Примеры включают, но не ограничиваются ими, опиаты, марихуану, амфетамины, кокаин, барбитураты, глутетимид, метиприлон, хлоралгидрат, метаквалон, бензодиазепины, LSD, никотин, антихолинергические лекарственные средства, антипсихотические лекарственные средства, триптамин, другие психомиметические лекарственные средства, седативные средства, фенциклидин, псилоцибин, летучий нитрит и другие лекарственные средства, индуцирующие физическую и/или психологическую зависимость.
Капсулярные сахариды N.meningitidis
Сахарид может представлять собой бактериальный капсулярный сахарид. Иллюстративные бактериальные капсулярные сахариды включают сахариды из N.meningitidis. На основе капсулярного полисахарида организмов идентифицированы различные серогруппы N.meningitidis, включая A, B, C, H, I, K, L, 29E, W135, X, Y и Z. Сахарид в рамках изобретения может происходить из любой из этих серогрупп. Как правило, сахарид происходит из одной из следующих серогрупп менингококков: A, C, W135 и Y.
Капсулярные сахариды обычно используют в форме олигосахаридов. Их удобно получать фрагментацией очищенного капсулярного полисахарида (например, посредством гидролиза), после чего обычно следует очистка фрагментов желаемого размера.
Фрагментацию полисахаридов, как правило, проводят до конечной средней степени полимеризации (DP) в олигосахариде менее 30 (например, от 10 до 20, предпочтительно около 10 для серогруппы A; от 15 до 25 для серогрупп W135 и Y, предпочтительно около 15-20; от 12 до 22 для серогруппы C и т.д.). DP можно удобным образом измерять посредством ионообменной хроматографии или колориметрических анализов [55].
Если проводят гидролиз, гидролизат обычно разделяют по размеру для удаления коротких олигосахаридов [56]. Это можно осуществлять различными путями, такими как ультрафильтрация с последующей ионообменной хроматографией. Олигосахариды со степенью полимеризации, меньшей или равной приблизительно 6, предпочтительно удаляют в случае серогруппы A, и олисахариды со степенью полимеризации, меньшей чем приблизительно 4, предпочтительно удаляют в случае серогрупп W135 и Y.
Химический гидролиз сахаридов обычно вовлекает обработку либо кислотой, либо основанием, в условиях, которые являются стандартными в данной области. Условия для деполимеризации капсулярных сахаридов до составляющих их моносахаридов известны в данной области. Один из способов деполимеризации вовлекает использование пероксида водорода [57]. Пероксид водорода добавляют к сахариду (например, до конечной концентрации H2O2 1%), а затем смесь инкубируют (например, при приблизительно 55єC) до тех пор, пока не достигнут желаемого уменьшения длины цепи. Наблюдение за уменьшением с течением времени можно проводить путем извлечения образцов из смеси, а затем измерения (среднего) размера молекул сахарида в образце. Затем после достижения желаемой длины цепи деполимеризацию можно останавливать быстрым охлаждением.
Серогруппы C, W135 и Y
Способы получения капсулярных полисахаридов из менингококков известны уже много лет и, как правило, вовлекают процесс, включающий стадии преципитации полисахаридов (например, с использованием катионного детергента), фракционирование этанолом, экстракции холодным фенолом (для удаления белка) и ультрацентрифугирования (для удаления LPS) [например, см. ссылку 58].
Более предпочтительный способ [59] вовлекает преципитацию полисахаридов с последующей солюбилизацией преципитированного полисахарида с использованием низшего спирта. Преципитацию можно осуществлять с использованием катионного детергента, такого как тетрабутиламмоний и соли цитилтриметиламмония (например, бромидные соли), или бромид гексадиметрина и соли миристилтриметиламмония. Бромид цетилтриметиламмония (ʺCTABʺ) является особенно предпочтительным [60]. Солюбилизацию преципитированного материала можно осуществлять с использованием низшего спирта, такого как метанол, пропан-1-ол, пропан-2-ол, бутан-1-ол, бутан-2-ол, 2-метилпропан-1-ол, 2-метилпропан-2-ол, диолы и т.д., однако этанол является особенно пригодным для солюбилизации комплексов CTAB-полисахарид. Этанол можно добавлять к преципитированному полисахариду до конечной концентрации этанола (на основе общего содержания этанола и воды) от 50% до 95%.
После повторной солюбилизации полисахарид можно далее обрабатывать для удаления примесей. Это является особенно важным в ситуациях, когда даже незначительное загрязнение неприемлемо (например, для продуцирования вакцин для человека). Это, как правило, вовлекает одну или несколько стадий фильтрации, например, можно использовать глубинную фильтрацию, фильтрацию через активированный уголь, фильтрацию по размеру и/или ультрафильтрацию.
После фильтрации для удаления примесей полисахарид можно преципитировать для дальнейшей обработки и/или переработки. Это удобно осуществлять путем катионного обмена (например, путем добавления солей кальция или натрия).
После очистки капсулярные сахариды конъюгируют с белками-носителями, как описано ниже.
Следующие и альтернативные способы очистки и конъюгации менингококковых сахаридов описаны в ссылках 57 и 61.
В качестве альтернативы очистке капсулярные сахариды по настоящему изобретению можно получать посредством полного или частичного синтеза, например, синтез Hib описан в ссылке 62, и синтез MenA описан в ссылке 63.
Сахарид может быть химически модифицированным, например, он может быть O-ацетилированным или де-O-ацетилированным. Любое такое де-O-ацетилирование или гиперацетилирование может быть осуществлено в конкретных положениях в сахариде. Например, большинство штаммов серогруппы C имеют O-ацетильные группы в положении C-7 и/или C-8 остатков сиаловой кислоты, но приблизительно 15% клинических изолятов лишены этих O-ацетильных групп [64, 65]. Ацетилирование, по-видимому, не влияет на эффективность защиты (например, в отличие от продукта MenjugateTM, в продукте NeisVac-CTM используется де-O-ацетилированный сахарид, но обе вакцины являются эффективными). Сахарид серогруппы W135 представляет собой полимер дисахаридных элементов сиаловая кислота-галактоза. Сахарид серогруппы Y сходен с сахаридом серогруппы W135 за исключением того, что дисахаридный повторяющийся элемент включает глюкозу вместо галактозы. Подобно сахаридам серогруппы C, сахариды MenW135 и MenY имеют вариабельное O-ацетилирование, но в положениях сиаловой кислоты 7 и 9 [66]. Любые такие химические модификации предпочтительно осуществляют до конъюгации, однако альтернативно или дополнительно их осуществляют в процессе конъюгации.
Сахариды из различных серогрупп предпочтительно очищают по отдельности, а затем комбинируют, либо до, либо после конъюгации.
Серогруппа A
Конъюгаты по изобретению могут включать антиген капсулярного сахарида серогруппы A. Сахарид можно очищать и конъюгировать аналогично тому, как и для серогрупп C, W135 и Y (см. выше), хотя он структурно отличается – в то время как капсулы серогрупп C, W135 и Y основаны на сиаловой кислоте (N-ацетилнейраминовая кислота, NeuAc), капсула серогруппы A основана на N-ацетилманнозамине, который является природным предшественником сиаловой кислоты. Сахарид серогруппы A является особенно чувствительным к гидролизу и его нестабильность в водной среде означает, что (a) иммуногенность жидких вакцин в отношении серогруппы A снижается с течением времени, и (b) контроль качества является более трудным вследствие высвобождения продукта гидролиза сахарида в вакцину.
Нативный капсулярный сахарид MenA представляет собой гомополимер (α1→6)-связанного N-ацетил-D-маннозамин-1-фосфата с частичным O-ацетилированием в положении C3 и C4. Основной гликозидной связью является 1-6-фосфодиэфирная связь, вовлекающая полуацетальную группу C1 и спиртовую группу C6 D-маннозамина. Средняя длина цепи составляет 93 мономеров. Он имеет следующую формулу:
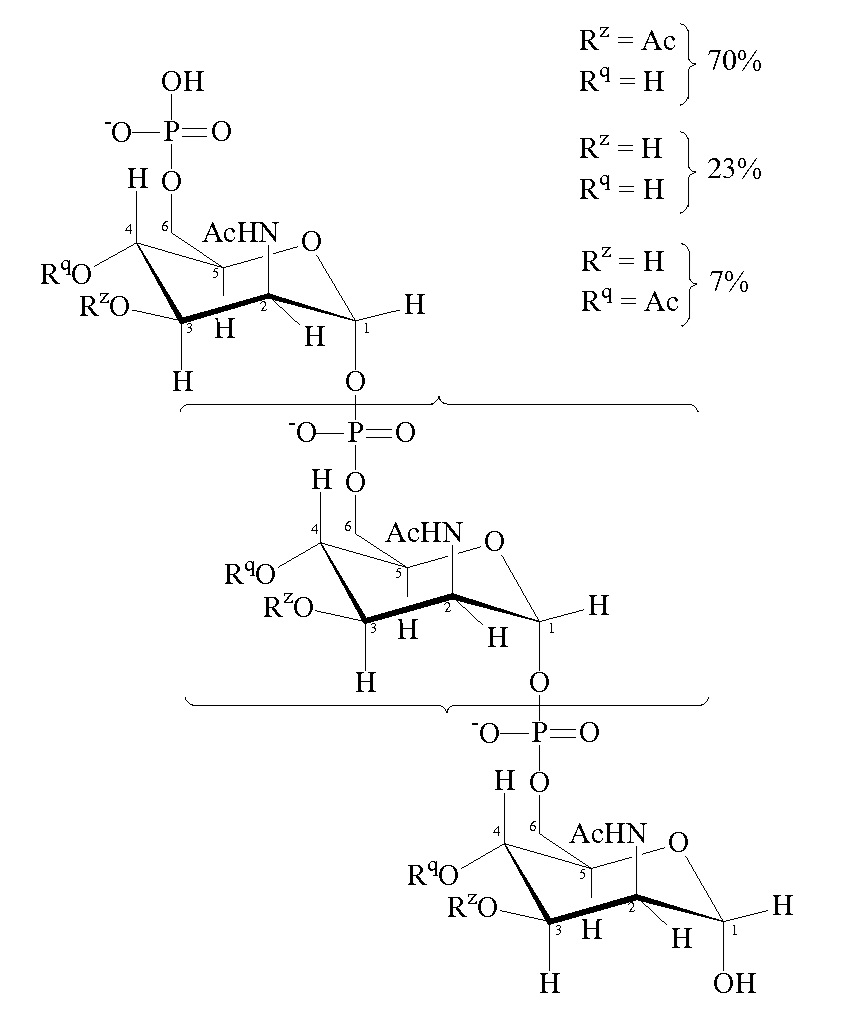
Был получен модифицированный сахаридный антиген, который сохраняет иммуногенную активность нативного сахарида серогруппы A, но который является значительно более стабильным в воде. Гидроксильные группы, присоединенные к атомам углерода 3 и 4 моносахаридных элементов, заменены блокирующей группой [ссылки 67 и 68].
Количество моносахаридных элементов, имеющих блокирующие группы вместо гидроксилов, может варьировать. Например, все или по существу все моносахаридные элементы могут иметь блокирующие группы. Альтернативно по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% моносахаридных элементов могут иметь блокирующие группы. По меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 моносахаридных элементов могут иметь блокирующие группы.
Аналогично, количество блокирующих групп на моносахаридном элементе может варьировать. Например, количество блокирующих групп на любом конкретном моносахаридном элементе может составлять 1 или 2.
Концевой моносахаридный элемент может иметь или может не иметь блокирующую группу вместо его нативного гидроксила. Предпочтительно сохранять свободную аномерную гидроксильную группу на концевом моносахаридном элементе для обеспечения основы для дальнейших реакций (например, конъюгации). Аномерные гидроксильные группы можно преобразовывать в аминогруппы (–NH2 или –NH-E, где E представляет собой азот-защитную группу) путем восстановительного аминирования (с использованием, например, NaBH3CN/NH4Cl), а затем можно регенерировать после преобразования других гидроксильных групп в блокирующие группы.
Блокирующие группы для замены гидроксильных групп могут быть прямо доступными посредством реакции дериватизации гидроксильной группы т.е. путем замены атома водорода гидроксильной группы другой группой. Пригодные производные гидроксильных групп, которые действуют в качестве блокирующих групп, представляют собой, например, карбаматы, сульфонаты, карбонаты, сложные эфиры, простые эфиры (например, силильные простые эфиры или алкильные простые эфиры) и ацетали. Некоторыми конкретными примерами таких блокирующих групп являются аллил, Aloc, бензил, BOM, трет-бутил, тритил, TBS, TBDPS, TES, TMS, TIPS, PMB, MEM, MOM, MTM, THP и т.д. Другие блокирующие группы, которые не являются доступными прямо и которые полностью заменяют гидроксильную группу, включают C1-12 алкил, C3-12 алкил, C5-12 арил, C5-12 арил-C1-6 алкил, NR1R2 (R1 и R2 определены в следующем абзаце), H, F, Cl, Br, CO2H, CO2(C1-6 алкил), CN, CF3, CCl3 и т.д.
Типичные блокирующие группы имеют формулу: -O-X-Y или -OR3 где: X представляет собой C(O), S(O) или SO2; Y представляет собой C1-12 алкил, C1-12 алкокси, C3-12 циклоалкил, C5-12 арил или C5-12 арил-C1-6 алкил, каждый из которых может быть необязательно замещенным 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2H, CO2(C1-6 алкила), CN, CF3 или CCl3; или Y представляет собой NR1R2; R1 и R2 независимо выбраны из H, C1-12 алкила, C3-12 циклоалкила, C5-12 арила, C5-12 арил-C1-6 алкила; или R1 и R2 могут быть связаны с образованием C3-12 насыщенной гетероциклической группы; R3 представляет собой C1-12 алкил или C3-12 циклоалкил, каждый из которых необязательно может быть замещен 1, 2 или 3 группами, независимо выбранными из F, Cl, Br, CO2(C1-6 алкила), CN, CF3 или CCl3; или R3 представляет собой C5-12 арил или C5-12 арил-C1-6 алкил, каждый из которых необязательно может быть замещен 1, 2, 3, 4 или 5 группами, выбранными из F, Cl, Br, CO2H, CO2(C1-6 алкила), CN, CF3 или CCl3. Когда R3 представляет собой C1-12 алкил или C3-12 циклоалкил, он, как правило, замещен 1, 2 или 3 группами, как определено выше. Когда R1 и R2 связаны с образованием C3-12 насыщенной гетероциклической группы, это означает, что R1 и R2 вместе с атомом азота образуют насыщенную гетероциклическую группу, содержащую любое количество атомов углерода от 3 до 12 (например, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12). Гетероциклическая группа может содержать 1 или 2 гетероатомов (таких как N, O или S), отличных от атома азота. Примерами C3-12 насыщенных гетероциклических групп являются пирролидинил, пиперидинил, морфолинил, пиперазинил, имидазолидинил, азетидинил и азиридинил.
Блокирующие группы -O-X-Y и -OR3 могут быть образованы из групп -OH с помощью стандартных методик дериватизации, таких как реакция гидроксильной группы с ацилгалогенидом, алкилгалогенидом сульфонилгалогенидом и т.д. Таким образом, атом кислорода в -O-X-Y обычно представляет собой атом кислорода гидроксильной группы, в то время как группа -X-Y в -O-X-Y обычно заменяет атом водорода гидроксильной группы.
Альтернативно блокирующие группы могут быть доступны посредством реакции замещения, такой как реакции замещения типа реакции Мицунобу. Эти и другие способы получения блокирующих групп из гидроксильных групп хорошо известны.
Конкретные блокирующие группы для применения в рамках изобретения представляют собой -OC(O)CF3 [69] и карбаматную группу OC(O)NR1R2, где R1 и R2 независимо выбраны из C1-6 алкила. Как правило, оба из R1 и R2 представляют собой метил, т.е. блокирующая группа представляет собой -OC(O)NMe2. Карбаматные блокирующие группы имеют стабилизирущий эффект на гликозидную связь, и их можно получать в мягких условиях.
Особенно предпочтительной блокирующей группой является -OC(O)CH3 [68]. Доля 4- и/или 3-положений в модифицированном сахариде Neisseria meningitidis серогруппы A, который имеет эту блокирующую группу, может варьировать. Например, доля 4-положений, которые имеют блокирующие группы, может составлять приблизительно 0%, по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или приблизительно 100%, причем по меньшей мере 80% и приблизительно 100% являются предпочтительными. Аналогично, доля 3-положений, которые имеют блокирующие группы, может составлять приблизительно 0%, по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или приблизительно 100%, причем предпочтительными являются по меньшей мере 80% и приблизительно 100%. Как правило, доля 4- и 3-положений, которые имеют блокирующие группы, является приблизительно одинаковой для каждого положения. Иными словами, соотношение 4-положений, которые имеют блокирующие группы, и 3-положений, которые имеют блокирующие группы, составляет приблизительно 1:1. Однако в некоторых вариантах осуществления доля 4-положений, которые имеют блокирующие группы, может варьировать относительно доли 3-положений, которые имеют блокирующие группы. Например, доля соотношение 4-положений, которые имеют блокирующие группы и 3-положений, которые имеют блокирующие группы, может составлять 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3 или 1:2. Аналогично, соотношение 3-положений, которые имеют блокирующие группы, и 4-положений, которые имеют блокирующие группы, может составлять 1:20, 1:19, 1:18, 1:17, 1:16, 1:15, 1:14, 1:13, 1:12, 1:11, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3 или 1:2.
Типичные модифицированные сахариды MenA содержат n моносахаридных элементов, где по меньшей мере h% моносахаридных элементов не имеют групп –OH как в положении 3, так и в положении 4. Величина h равна 24 или более (например, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 98, 99 или 100) и обычно 50 или более. Отсутствующие группы –OH представляют собой блокирующие группы, как определено выше.
Другие типичные модифицированные сахариды MenA содержат моносахаридные элементы, где по меньшей мере s моносахаридных элементов не имеют –OH в положении 3 и не имеют –OH в положении 4. Величина s равна по меньшей мере 1 (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 60, 70, 80, 90). Отсутствующие группы –OH представляют собой блокирующие группы, как определено выше.
Пригодные модифицированные сахариды MenA для применения в рамках изобретения имеют формулу:
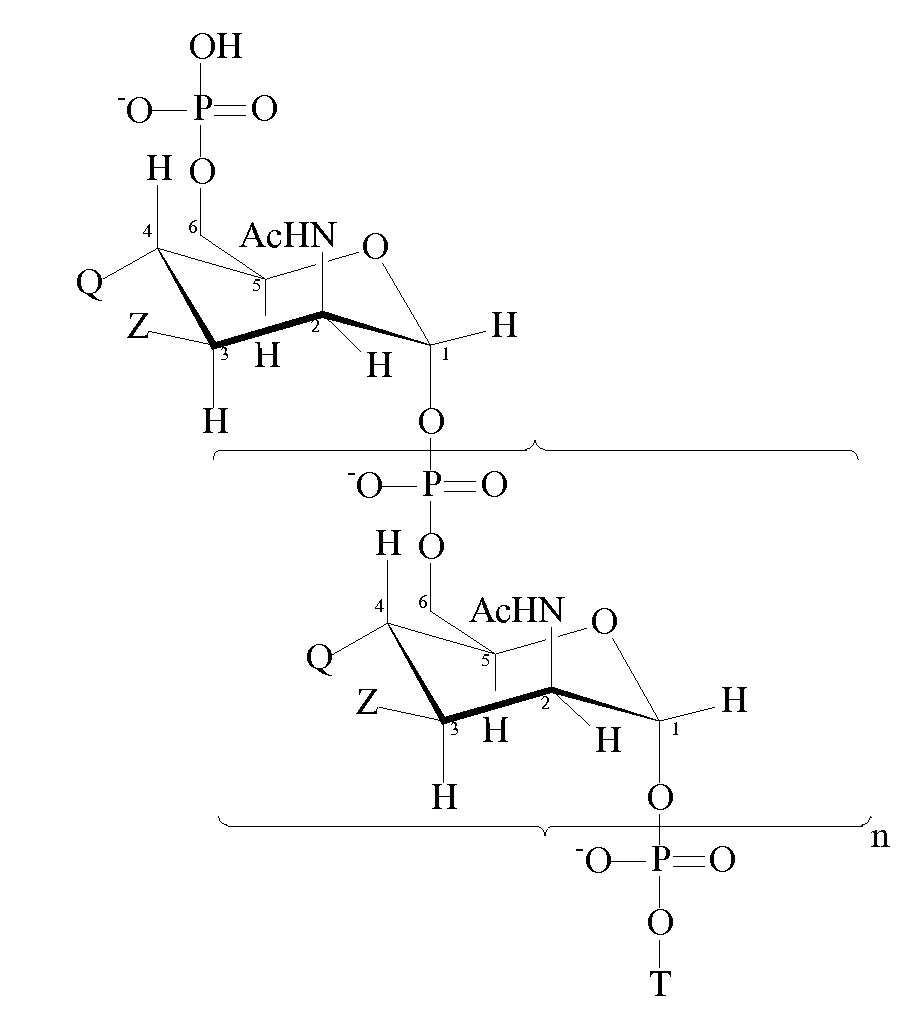
где
n представляет собой целое число от 1 до 100 (в частности, целое число от 5 до 25, обычно 15-25);
T имеет формулу (A) или (B):
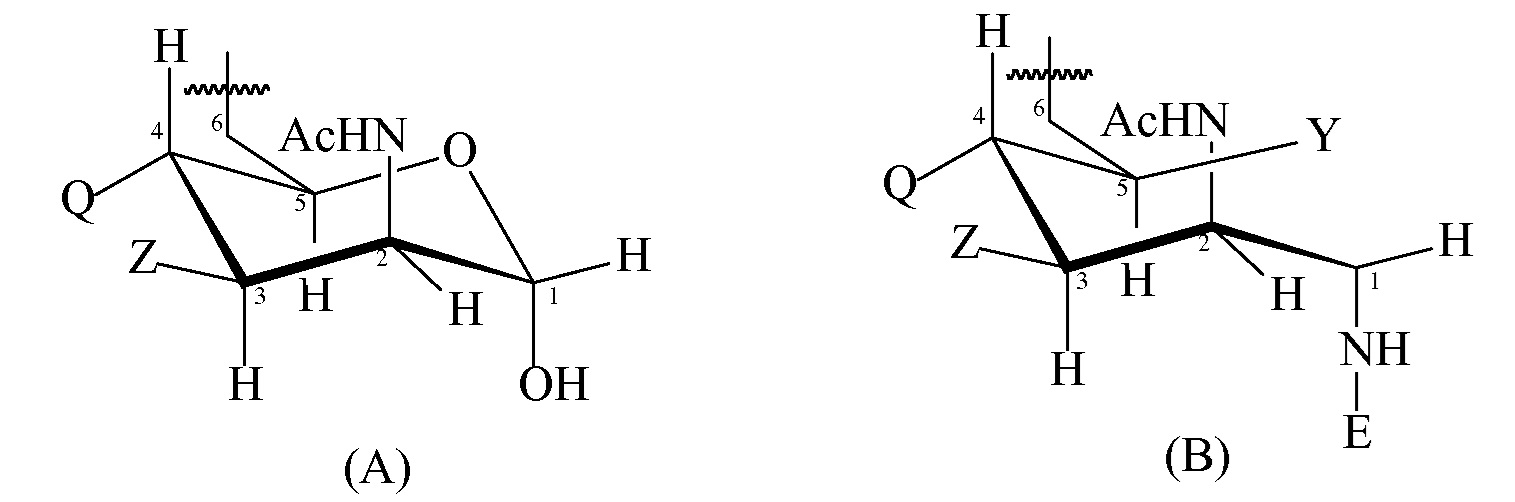
каждая группа Z независимо выбрана из OH или блокирующей группы, как определено выше; и
каждая группа Q независимо выбрана из OH или блокирующей группы, как определено выше;
Y выбран из OH или блокирующей группы, как определено выше;
E представляет собой H или азот-защитную группу;
и где более чем приблизительно 7% (например, 8%, 9%, 10% или более) групп Q представляют собой блокирующие группы. В некоторых вариантах осуществления гидроксильная группа, присоединенная к углероду 1 в формуле (A), заменена блокирующей группой, как определено выше. В некоторых вариантах осуществления E в формуле (B) представляет собой линкер или молекулу носителя по изобретению. Когда E представляет собой линкер, линкер может быть ковалентно связан с молекулой носителя по изобретению.
Каждая из n+2 групп Z может быть одной и той же или может отличаться от других. Аналогично, каждая из n+2 групп Q может быть одной и той же или может отличаться от других. Все группы Z могут представлять собой OH. Альтернативно по меньшей мере 10%, 20, 30%, 40%, 50% или 60% групп Z могут представлять собой OAc. Как правило, приблизительно 70% групп Z представляют собой OAc, причем остальные из групп Z представляют собой OH или блокирующие группы, как определено выше. По меньшей мере приблизительно 7% групп Q представляют собой блокирующие группы. Как правило, по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или даже 100% групп Q представляют собой блокирующие группы.
Глюканы
Сахарид может представлять собой глюкан. Глюканы представляют собой содержащие глюкозу полисахариды, встречающиеся, среди прочих, в клеточных стенках грибов. α-глюканы включают одну или несколько α-связей между субъединицами глюкозы, в то время как β-глюканы включают одну или несколько β-связей между субъединицами глюкозы. Глюкан, используемый в соответствии с изобретением, включает β-связи и может содержать только β-связи (т.е. без α-связей).
Глюкан может содержать одну или несколько β-1,3-связей и/или одну или несколько β-1,6-связей. Также он может содержать одну или несколько β-1,2-связей и/или β-1,4-связей, но обычно его единственные β-связи представляют собой β-1,3-связи и/или β-1,6-связи.
Глюкан может быть разветвленным или линейным.
Полноразмерные нативные β-глюканы являются нерастворимыми и имеют молекулярную массу в диапазоне миллионов дальтон. В конъюгатах по изобретению предпочтительно использовать растворимые глюканы. Солюибилизацию можно осуществлять путем фрагментации длинных нерастворимых глюканов. Это можно осуществлять путем гидролиза или, удобнее, расщепления глюканазой (например, β-1,3-глюканазой или β-1,6-глюканазой). В качестве альтернативы короткие глюканы можно получать синтетически путем связывания моносахаридных структурных элементов.
Предпочтительными являются низкомолекулярные глюканы, в частности, глюканы с молекулярной массой менее 100 кДа (например, менее 80, 70, 60, 50, 40, 30, 25, 20 или 15 кДа). Также можно использовать олигосахариды, например, содержащие 60 или менее (например, 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4) моносахаридных элементов глюкозы. В этом диапазоне предпочтительными являются олигосахариды с 10-50 или 20-40 моносахаридными элементами.
Глюкан может представлять собой глюкан грибов. ''Глюкан грибов'' обычно получают из гриба, но, когда конкретная структура глюкана встречается как в грибах, так и не в грибах (например, в бактериях, низших растениях или водорослях), тогда не являющийся грибом организм можно использовать в качестве альтернативного источника. Таким образом, глюкан может происходить из клеточной стенки Candida, таких как C.albicans, или из Coccidioides immitis, Trichophyton verrucosum, Blastomyces dermatidis, Cryptococcus neoformans, Histoplasma capsulatum, Saccharomyces cerevisiae, Paracoccidioides brasiliensis или Pythiumn insidiosum.
Существуют различные источники β-глюканов грибов. Например, коммерчески доступны чистые β-глюканы, например, пустулан (Calbiochem) представляет собой β-1,6-глюкан, очищенный из Umbilicaria papullosa. β-глюканы можно очищать из клеточных стенок грибов различными способами. Например, в ссылке 70 описана двухстадийная методика получения экстракта растворимого в воде β-глюкана из Candida, свободного от маннана клеточной стенки, вовлекающая окисление посредством NaClO и экстракцию с помощью DMSO. Полученный продукт (ʺрастворимый β-D-глюкан Candidaʺ или ʺCSBGʺ) в основном состоит из линейного β-1,3-глюкана с линейной частью β-1,6-глюкана. Аналогично, в ссылке 71 описано получение GG-zym из Calbicans. Такие глюканы из C.albicans включают (a) β-1,6-глюканы с боковыми цепями β-1,3-глюкана и средней степенью полимеризации, приблизительно равной 30, и (b) β-1,3-глюканы с боковыми цепями β-1,6-глюкана и средней степенью полимеризации, приблизительно равной 4.
В некоторых вариантах осуществления изобретения глюкан представляет собой β-1,3-глюкан с некоторым β-1,6-ветвлением, как наблюдают, например, в ламинаринах. Ламинарины встречаются в коричневых водорослях и морских водорослях. Соотношение β(1-3):β(1-6) ламинаринов варьирует среди различных источников, например, оно составляет только 3:2 в ламинарине Eisenia bicyclis, но вплоть до 7:1 в ламинарине Laminaria digititata [72]. Таким образом, глюкан, используемый в рамках изобретения, может иметь соотношение β(1-3):β(1-6) от 1,5:1 до 7,5:1, например, приблизительно 2:1, 3:1, 4:1, 5:1, 6:1 или 7:1. Необязательно, глюкан может иметь концевую субъединицу маннита, например, 1,1-α-связанный остаток маннита [73]. Глюкан также может содержать субъединицы маннозы.
В других вариантах осуществления глюкан имеет исключительно или в основном β-1,3-связи, как наблюдает в курдлане. Эти глюканы могут обеспечивать лучшую защиту, чем глюканы, содержащие другие связи, в частности, глюканы, содержащие β-1,3-связи, и более высокую долю β-1,6-связей. Таким образом, можно получать глюкан только из β-1,3-связанных остатков глюкозы (например, линейные β-D-глюкопиранозы исключительно с 1,3-связями). Хотя необязательно глюкан может включать моносахаридные остатки, которые не являются β-1,3-связанными остатками глюкозы, он может включать β-1,6-связанные остатки глюкозы. Соотношение β-1,3-связанных остатков глюкозы и этих других остатков должно составлять по меньшей мере 8:1 (например, ≥9:1, ≥10:1, ≥11:1, ≥12:1, ≥13:1, ≥14:1, ≥15:1, ≥16:1, ≥17:1, ≥18:1, ≥19:1, ≥20:1, ≥25:1, ≥30:1, ≥35:1, ≥40:1, ≥45:1, ≥50:1, ≥75:1, ≥100:1 и т.д.) и/или существует одна или несколько (например, ≥1, ≥2, ≥3, ≥4, ≥5, ≥6, ≥7, ≥8, ≥9, ≥10, ≥11, ≥12 и т.д.) последовательностей из по меньшей мере пяти (например, ≥5, ≥6, ≥7, ≥8, ≥9, ≥10, ≥11, ≥12, ≥13, ≥14, ≥15, ≥16, ≥17, ≥18, ≥19, ≥20, ≥30, ≥40, ≥50, ≥60 и т.д.) соседних неконцевых остатков, связанных с другими остатками только посредством β-1,3-связей. Под ʺнеконцевымʺ подразумевают остаток, который не присутствует на свободном конце глюкана. В некоторых вариантах осуществления соседние неконцевые остатки могут не включать какие-либо остатки, связанные с молекулой носителя, линкером или другим спейсером, как описано ниже. Наличие пяти соседних неконцевых остатков, связанных с другими остатками только посредством β-1,3-связей, может обеспечить защитный антительный ответ, например, против C.albicans.
В следующих вариантах осуществления конъюгат может включать два различных глюкана, например, первый глюкан, имеющий соотношение β(1-3):β(1-6) от 1,5:1 до 7,5:1, и второй глюкан, имеющий исключительно или в основном β-1,3-связи. Например, конъюгат может включать как глюкан ламинарина, так и глюкан курдлана.
Когда β-глюкан включает как β-1,3-связи, так и β-1,6-связи, в желаемом соотношении и/или последовательности, тогда этот глюкан может быть встречающимся в природе (например, ламинарин), или он может быть получен искусственно. Например, он может быть получен химическим синтезом целиком или частично. Способы химического синтеза β-1,3/β-1,6-глюканов известны, например, из ссылок 74-84. β-глюкан, включающий как β-1,3, и β-1,6-связи в желаемом соотношении, также можно получать, начиная с доступного глюкана и обрабатывая его β-1,6-глюканазой (также известной как глюкан-эндо-1,6-β-глюкозидаза, 1,6-β-D-глюкан-глюканoгидролаза и т.д.; EC 3.2.1.75) или β-1,3-глюканазой (такой как экзо-1,3-глюканаза (EC 3.2.1.58) или эндо-1,3-глюканаза (EC 3.2.1.39) до тех пор, пока не будет достигнуто желаемое соотношение и/или последовательность.
Когда является желательным глюкан, содержащий только β-1,3-связанную глюкозу, тогда обработку β-1,6-глюканазой можно продолжать до завершения, поскольку β-1,6-глюканаза в конечном итоге обеспечит чистый β-1,3-глюкан. Однако более удобно использовать чистый β-1,3-глюкан. Его можно получать синтетически, посредством химического и/или ферментативного синтеза, например, с использованием (1→3)-β-D-глюкансинтаз, несколько из которых известно из многих организмов (включая бактерии, дрожжи, растения и грибы). Способы химического синтеза β-1,3-глюканов известны, например, из ссылок 85-88. В качестве пригодной альтернативы синтезу можно использовать природный β-1,3-глюкан, такой как курдлан (линейный β-1,3-глюкан из Agrobacterium, ранее известный как Alcaligenes faecalis var. myxogenes; коммерчески доступный, например, от Sigma-Aldrich, каталожный номер C7821) или парамилон (β-1,3-глюкан из Euglena). Организмы, продуцирующие высокие уровни β-1,3-глюканов, известны в данной области, например, Agrobacterium из ссылок 89 и 90 или Euglena gracilis из ссылки 91.
Ламинарин и курдлан, как правило, встречаются в природе в качестве высокомолекулярных полимеров, например, с молекулярной массой по меньшей мере 100 кДа. Они часто являются нерастворимыми в водной среде. Таким образом, в их природных формах они не достаточно пригодны для иммунизации. Таким образом, в рамках изобретения можно использовать более короткий глюкан, например, глюканы, содержащие 60 или менее моносахаридных элементов глюкозы (например, 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4). Можно использовать глюкан, имеющий количество остатков глюкозы в диапазоне 2-60, например, 10-50 или 20-40 элементов глюкозы. Глюкан с 25-30 остатками глюкозы является особенно пригодным. Пригодные глюканы могут быть получены, например, посредством гидролиза кислотой природного глюкана или посредством ферментативного расщепления, например, глюканазой, такой как β-1,3-глюканаза. Также пригоден глюкан с 11-19, например, 13-19, и, в частности, 15 или 17, моносахаридными элементами глюкозы. В частности, глюканы со следующими структурами (A) или (B) особенно предусматриваются для применения в рамках настоящего изобретения:
(A)
где n+2 находится в диапазоне 2-60, например, 10-50 или 2-40. Предпочтительно, n+2 находится в диапазоне 25-30 или 11-19, например, 13-17. Авторы изобретения обнаружили, что пригодным является n+2=15.
(B)
 где n находится в диапазоне 0-9, например, 1-7 или 2-6. Предпочтительно, n находится в диапазоне 3-4 или 1-3. Авторы изобретения обнаружили, что пригодным является n=2.
где n находится в диапазоне 0-9, например, 1-7 или 2-6. Предпочтительно, n находится в диапазоне 3-4 или 1-3. Авторы изобретения обнаружили, что пригодным является n=2.
В некоторых вариантах осуществления глюкан представляет собой один молекулярный тип. В этих вариантах осуществления все молекулы глюкана идентичны с точки зрения последовательности. Таким образом, все молекулы глюкана идентичны с точки зрения их структурных свойств, включая молекулярную массу и т.д. Как правило, эту форму глюкана получают химическим синтезом, например, с использованием способов, описанных выше. Например, в ссылке 86 описан синтез одного β-1,3-связанного типа. Альтернативно в других вариантах осуществления глюкан можно получать из природного глюкана, например, глюкан из L.digitata, Agrobacterium или Euglena, как описано выше, при этом глюкан очищают до тех пор, пока не получат требуемый один молекулярный тип. Природные глюканы, которые очищены таким образом, являются коммерчески доступными. Глюкан который представляет собой один молекулярный тип, можно идентифицировать путем измерения полидисперсности (Mw/Mn) образца глюкана. Этот параметр можно удобным образом измерять с помощью SEC-MALLS, например, как описано в ссылке 92. Пригодные глюканы для применения в этом варианте осуществления изобретения имеют полидисперсность, приблизительно равную 1, например, 1,01 или менее.
Растворимость природных глюканов, таких как курдлан, можно увеличивать путем внесения ионных групп (например, посредством сульфатирования, в частности, в положении O-6 в курдлане). Такие модификации можно использовать в рамках изобретения, однако в идеальном случае их избегают, поскольку они могут изменять антигенность глюкана.
Когда сахарид представляет собой глюкан, он, как правило, представляет собой ламинарин.
Капсулярные сахариды S.pneumoniae
Как рассмотрено выше, сахарид также может представлять собой бактериальный капсулярный сахарид. Следующие иллюстративные бактериальные капсулярные сахариды включают капсулярные сахариды из S.pneumoniae. Однако в некоторых вариантах осуществления сахарид не является капсулярным сахаридом из S.pneumoniae.
Когда сахарид представляет собой капсулярные сахариды из S.pneumoniae, он, как правило, происходит из одного из следующих серотипов пневмококков: 1, 2, 3, 4, 5, 6A, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F, предпочтительно из 1, 5, 6B, 14, 19F и 23F. Капсулярные полисахариды из S.pneumoniae содержат повторяющиеся олигосахаридные элементы, которые могут содержать вплоть до 8 остатков сахаров. Олигосахаридные элементы для основных серотипов S.pneumoniae описаны на фиг.1 и в ссылках 93 и 94.
Капсулярные сахариды S.agalactiae
Кроме того, иллюстративные бактериальные капсулярные сахариды, включают капсулярные сахариды из Streptococcus agalactiae (ʺGBSʺ). Капсулярный сахарид ковалентно связан с пептидогликановым остовом GBS, и он отличается от антигена группы B, который является другим сахаридом, который связан с пептидогликановым остовом.
Капсулярные сахариды GBS являются химически родственными, но с антигенной точки зрения значительно отличаются. Все капсулярные сахариды GBS обладают следующей общей трисахаридной основой:
β-D-GlcpNAc(1→3)β-D-Galp(1→4)β-D-Glcp
Различные серотипы GBS отличаются тем, как эта основа модифицирована. Различие между серотипами Ia и III, например, является следствием использования либо GlcNAc (Ia), либо Gal (III), в этой основе для связывания последовательных трисахаридных основ. Оба из серотипов Ia и Ib имеют дисахарид [α-D-NeupNAc(2→3)β-D-Galp-(1→], связанный с GlcNAc в основе, но связь является либо 1→4 (Ia), либо 1→3 (Ib).
Обусловленное GBS заболевание возникает, в основном, вследствие серотипов Ia, Ib, II, III, IV, V, VI, VII и VIII, причем более 85% вызывается пятью серотипами: Ia, Ib, III и V. В рамках изобретения может использоваться сахарид из одного из этих четырех серотипов. Капсулярные сахариды каждого из этих четырех серотипов включают: (a) концевой остаток N-ацетилнейраминовой кислоты (NeuNAc) (обычно обозначаемый как сиаловая кислота), который во всех случаях связан 2→3 с остатком галактозы; и (b) остаток N-ацетилглюкозамина (GlcNAc) в трисахаридной основе.
Все четыре сахарида включают остатки галактозы в трисахаридной основе, однако серотипы Ia, Ib, II и III также содержат дополнительные остатки галактозы в каждом повторяющемся элементе.
Сахариды, используемые в соответствии с изобретением, могут быть в их нативной форме или они могут быть модифицированными. Например, сахарид может быть более коротким, чем нативный капсулярный сахарид, или он может быть химически модифицированным. В частности, капсулярный сахарид серотипа V, используемый в рамках изобретения, может быть модифицирован, как описано в ссылках 95 и 96. Примером является капсулярный сахарид серотипа V, который по существу десиалирован. Десиалированный капсулярный сахарид GBS серотипа V можно получать посредством обработки очищенного капсулярного сахарида GBS серотипа V в мягких кислых условиях (например, 0,1 M серная кислота при 80єC в течение 60 минут) или посредством обработки нейраминидазой, как описано в ссылке 96. Таким образом, сахарид, используемый в соответствии с изобретением, по существу может представлять собой полноразмерный капсулярный полисахарид, встречающийся в природе, или он может быть короче природной длины. Для применения в рамках настоящего изобретения полноразмерные полисахариды можно деполимеризовывать с получением более коротких фрагментов, например, посредством гидролиза в мягкой кислоте, посредством нагревания, разделяющей по размеру хроматографии и т.д. В частности, капсулярные сахариды серотипа II и/или III, используемые в рамках изобретения, можно деполимеризовывать, как описано в ссылках 97 и 98.
Сахарид может быть химически модифицированным относительно капсулярного сахарида, встречающегося в природе. Например, сахарид может быть де-O-ацетилированным (частично или полностью), де-N-ацетилированным (частично или полностью), N-пропионированным (частично или полностью) и т.д. Деацетилирование может происходить до, в процессе или после конъюгации, однако предпочтительно оно происходит до конъюгации. В зависимости от конкретного сахарида, деацетилирование может влиять или может не влиять на иммуногенность. Значение O-ацетилирования на сахаридах GBS в различных серотипах обсуждается в ссылке 99, и в некоторых вариантах осуществления O-ацетилирование остатков сиаловой кислоты в положениях 7, 8 и/или 9 сохраняется до, в процессе или после конъюгации, например, посредством внесения защитной группы/удаления защитной группы, посредством повторного ацетилирования и т.д. Однако, как правило, сахарид GBS, используемый в рамках настоящего изобретения, по существу не имеет O-ацетилирования остатков сиаловой кислоты в положениях 7, 8 и/или 9. В частности, когда сахарид GBS очищен экстракцией основанием, как описано ниже, тогда O-ацетилирование обычно утрачивается. Эффект деацетилирования и т.д. можно оценивать с помощью стандартных анализов.
Капсулярные сахариды можно очищать известными способами, как описано в 100. Типичный способ вовлекает экстракцию основанием, центрифугирование, фильтрацию, обработку РНКазой/ДНКазой, обработку протеазой, концентрирование, эксклюзионную хроматографию, ультрафильтрацию, анионообменную хроматографию и дальнейшую ультрафильтрацию. Также является пригодной обработка клеток GBS ферментом мутанолизином, который расщепляет клеточную стенку бактерий на свободные компоненты клеточной стенки.
В качестве альтернативы можно использовать способ очистки, описанный в ссылке 101. Он вовлекает экстракцию основанием, обработку этанолом/CaCl2, преципитацию с CTAB и повторную солюбилизацию. Кроме того, альтернативный способ описан в ссылке 102.
Капсулярные сахариды S.aureus
Следующие иллюстративные бактериальные капсулярные сахариды включают капсулярные сахариды из S.aureus, в частности, капсулярные полисахариды из S.aureus типа 5 и типа 8. Структуры капсулярных полисахаридов типа 5 и типа 8 описаны в ссылках 103 и 104 как:
Тип 5
→4)-β-D-ManNAcA(3OAc)-(1→4)-α-L-FucNAc(1→3)-β-D-FucNAc-(1→
Тип 8
→3)-β-D-ManNAcA(4OAc)-(1→3)-α-L-FucNAc(1→3)-β-D-FucNAc-(1→
Полученные недавно данные ЯМР-спектроскопии [105] привели к пересмотру этих структур как:
Тип 5
→4)-β-D-ManNAcA-(1→4)-α-L-FucNAc(3OAc)-(1→3)-β-D-FucNAc-(1→
Тип 8
→3)-β-D-ManNAcA(4OAc)-(1→3)-α-L-FucNAc(1→3)-α-D-FucNAc(1→
Полисахарид может быть химически модифицированным относительно капсулярного полисахарида, встречающегося в природе.
Например, полисахарид может быть де-O-ацетилированным (частично или полностью), де-N-ацетилированным (частично или полностью), N-пропионированным (частично или полностью) и т.д. Деацетилирование может происходить до, в процессе или после конъюгации, однако, как правило, оно происходит до конъюгации. В зависимости от конкретного полисахарида, деацетилирование может влиять или может не влиять на иммуногенность, например, в вакцине NeisVac-CTM используется де-O-ацетилированный полисахарид, в то время как полисахарид в MenjugateTM является ацетилированным, но обе вакцины являются эффективными. Эффект деацетилирования и т.д. можно оценивать с помощью стандартных анализов. Например, значение O-ацетилирования для капсулярных полисахаридов S.aureus 5 типа или 8 типа рассмотрено в ссылке 106. Нативными полисахаридами в настоящем документе называют полисахариды, имеющие 5% O-ацетилирование. Эти полисахариды индуцируют антитела как к полисахаридному остову, так и к O-ацетильным группам. Полисахариды с 0% O-ацетилированием, тем не менее, индуцируют антитела к полисахаридному остову. Оба типа антител являются опсонизирующими в отношении штамма S.aureus, в котором варьирует содержание O-ацетила. Таким образом, капсулярные полисахариды типа 5 или типа 8, используемые в рамках настоящего изобретения, могут иметь от 0 до 100% O-ацетилирования.
Степень O-ацетилирования полисахарида можно определять любым способом, известным в данной области, например, посредством протонного ЯМР (например, как описано в ссылках 107, 108, 109 или 110). Следующий способ описан в ссылке 111. Сходные способы можно использовать для определения степени N-ацетилирования полисахарида. O-ацетильные группы можно удалять посредством гидролиза, например, посредством обработки основанием, таким как безводный гидразин [112] или NaOH [106]. Сходные способы можно использовать для удаления N-ацетильных групп. Для поддержания высоких уровней O-ацетилирования на капсулярных полисахаридах типа 5 и/или 8, обработку, которая может приводить к гидролизу O-ацетильных групп, минимизируют, например, обработку при крайних значениях pH.
Капсулярные полисахариды можно очищать известными способами, как описано в ссылках, приведенных в настоящем описании. Типичный способ вовлекает инактивацию фенол-этанолом клеток S.aureus, центрифугирование, обработку лизостафином, обработкуРНКазой/ДНКазой, центрифугирование, диализ, обработку протеазой, дополнительный диализ, фильтрацию, преципитацию этанолом/CaCl2, диализ, лиофилизацию, анионообменную хроматографию, диализ, лиофилизацию, эксклюзионную хроматографию, диализ и лиофилизацию [113]. Альтернативный способ вовлекает автоклавирование клеток S.aureus, ультрафильтрацию содержащего полисахарид супернатанта, концентрирование, лиофилизацию, обработку метаперйодатом натрия для удаления тейхоевой кислоты, дополнительную ультрафильтрацию, диафильтрацию, высокоэффективную жидкостную хроматографию, диализ и лиофилизацию [114].
Однако изобретение не ограничивается полисахаридами, очищенными из природных источников, и полисахариды можно получать другими способами, такими как полный или частичный синтез.
Другие бактериальные капсулярные сахариды
Кроме того, иллюстративные бактериальные капсулярные сахариды включают капсулярные сахариды из Haemophilus influenzae типа b, Salmonella enterica Typhi Vi и Clostridium difficile.
Углевод S.agalactiae
Также в рамках изобретения можно использовать некапсулярные бактериальные сахариды. Иллюстративным некапсулярным бактериальным сахаридом является углевод GAS S. pyogenes (также известный как полисахарид GAS клеточной стенки или GASP). Этот сахарид имеет разветвленную структуру с остовом из L-рамнопиранозы (Rhap), состоящую из чередующихся связей альфа-(1→2) и альфа-(1→3), и остатков D-N-ацетилглюкозамина (GlcpNAc), бета-(1→3)-соединенных с чередующимися кольцами рамнозы ([115]).
Углевод GAS обычно находится в его нативной форме, но он может быть модифицированным. Например, сахарид может быть более коротким, чем нативный углевод GAS, или он может быть химически модифицированным.
Таким образом, сахарид, используемый в соответствии с изобретением, может быть по существу полноразмерным углеводом GAS, встречающимся в природе, или он может быть короче природной длины. Для применения в рамках изобретения полноразмерные полисахариды могут быть деполимеризованы с получением более коротких фрагментов, например, посредством гидролиза мягкой кислотой, нагревания, разделяющей по размеру хроматографии и т.д. Короткий фрагмент, предположительно соответствующий концевому элементу на углеводе GAS, был предложен для применения в вакцине [116]. Таким образом, в рамках настоящего изобретения предусматриваются короткие фрагменты. Однако предпочтительно использовать по существу полноразмерные сахариды. Углевод GAS, как правило, имеет молекулярную массу приблизительно 10, в частности, приблизительно 7,5-8,5 кДа. Молекулярную массу можно измерять с помощью ВЭЖХ, например, SEC-ВЭЖХ, с использованием колонки TSK Gel G3000SW (Sigma) относительно стандартов на основе пуллулана, таких как стандарты, доступные от Polymer Standard Service [117].
Сахарид может быть химически модифицированным относительно углевода GAS, встречающегося в природе. Например, сахарид может быть де-N-ацетилированным (частично или полностью), N-пропионированным (частично или полностью) и т.д. Эффект деацетилирования и т.д., например, на иммуногенность, можно оценивать с помощью стандартных анализов.
Конъюгат
Изобретение относится к конъюгату, содержащему антиген и молекулу носителя, где молекула носителя содержит антиген spr0096 и антиген spr2021.
Молекула носителя может быть ковалентно конъюгирована с антигеном прямо или через линкер. Можно использовать любую подходящую реакцию конъюгации с любым подходящим линкером, когда это желательно.
Присоединение антигена к носителю предпочтительно осуществляют через группу -NH2, например, в боковой цепи остатка лизина в белке-носителе или остатка аргинина. Когда антиген имеет свободную альдегидную группу, тогда она может реагировать с амином в носителе с образованием конъюгата посредством восстановительного аминирования. Присоединение к носителю также можно осуществлять через группу -SH, например, в боковой цепи остатка цистеина. Альтернативно антиген может быть присоединен к носителю через линкерную молекулу.
Антиген, как правило, активируют или функционализируют перед конъюгацией. Активация может вовлекать, например, цианилирующие реагенты, такие как CDAP (например, тетрафторборат 1-циано-4-диметиламинопиридиния [118, 119 и т.д.]). В других пригодных способах используются карбодиимиды, гидразиды, активные сложные эфиры, норборан, п-нитробензойная кислота, N-гидроксисукцинимид, S-NHS, EDC, TSTU (также см. введение в ссылке 7).
Прямые связи с белком могут включать окисление антигена с последующим восстановительным аминированием с белком, как описано, например, в ссылках 120 и 121.
Связи через линкерную группу можно вносить с использованием любой известной методики, например, методик, описанных в ссылках 122 и 123. Как правило, линкер присоединяют через аномерный углерод сахаридного антигена. Предпочтительным типом связи является линкер на основе адипиновой кислоты, который может быть образован связыванием свободной группы -NH2 (например, внесенной в сахарид посредством аминирования) с адипиновой кислотой (с использованием, например, активации диимидом), а затем связыванием белка с полученным промежуточным соединением антиген-адипиновая кислота [5, 124, 125]. Сходным предпочтительным типом связи является линкер на основе глутаровой кислоты, который может быть образован путем присоединения к свободной группе -NH2 глутаровой кислоты аналогичным образом. Линкеры на основе адипиновой и глутаровой кислоты также могут быть образованы посредством прямого присоединения к антигену, т.е. без внесения свободной группы, например, свободной группы -NH2, в антиген с последующим присоединением белка к полученному промежуточному соединению антиген-адипиновая/глутаровая кислота. Другим предпочтительным примером связи является карбонильный линкер, который может быть образован посредством реакции свободной гидроксильной группы модифицированного антигена с CDI [126, 127] с последующей реакцией с белком с образованием карбаматной связи. Другие линкеры включают β-пропионамидо [128], нитрофенилэтиламин [129], галоацилгалогениды [130], гликозидные связи [131], 6-аминокапроновую кислоту [132], N-сукцинимидил-3-(2- пиридилдитио)пропионат (SPDP) [133], дигидразид адипиновой кислоты ADH [134], C4-C12 части [135], и т.д. Также можно использовать конденсацию с карбодиимидом [136].
Бифункционалный линкер можно использовать для получения первой группы для связывания с аминогруппой в антигене (например, внесенной в антиген посредством аминирования) и второй группы для связывания с носителем (как правило, для связывания с аминогруппой в носителе). Альтернативно первая группа способна направлять связывание с антигеном, т.е. без предшествующего введения группы, например, аминогруппы, в антиген.
В некоторых вариантах осуществления первая группа в бифункциональном линкере, таким образом, способна реагировать с аминогруппой (-NH2) на антигене. Эта реакция, как правило, вовлекает электрофильное замещение водорода амина. В других вариантах осуществления первая группа в бифункциональном линкере способна реагировать прямо с антигеном. В обеих группах вариантов осуществления вторая группа в бифункциональном линкере, как правило, способна реагировать с аминогруппой на носителе. Эта реакция, также обычно вовлекает электрофильное замещение амина.
Когда реакции как с антигеном, так и с носителем, вовлекают носитель, тогда предпочтительно использовать бифункциональный линкер. Например, можно использовать гомобифункциональный линкер формулы X-L-X, где: две группы X являются одинаковыми и могут реагировать с аминами; и где L представляет собой связывающую часть в линкере. Аналогично, можно использовать гетеробифункциональный линкер формулы X-L-X, где: две группы X отличаются и могут реагировать с аминами; и где L представляет собой связывающую часть в линкере. Предпочтительной группой X является N-оксисукцинимид. L предпочтительно имеет формулу L'-L2-L', где L' представляет собой карбонил. Предпочтительными группами L2 являются неразветвленные алкилы с 1-10 атомами углерода (например, C1, C2, C3, C4, C5, C6, C7, C8, C9, C10), например, -(CH2)4- или -(CH2)3-.
Аналогично, когда реакция с антигеном вовлекает прямое связывание и реакция с носителем вовлекает амин, тогда также предпочтительно использовать бифункциональный линкер. Например, можно использовать гомобифункциональный линкер формулы X-L-X, где: две группы X являются одинаковыми и могут реагировать с антигеном/амином; и где L представляет собой связывающую часть в линкере. Аналогично, можно использовать гетеробифункциональный линкер формулы X-L-X, где: две группы X отличаются и одна из них может реагировать с антигеном, в то время как другая из них может реагировать с амином; и где L представляет собой связывающую часть в линкере. Предпочтительной группой X является N-оксисукцинимид. L предпочтительно имеет формулу L'-L2-L', где L' представляет собой карбонил. Предпочтительными группами L2 являются неразветвленные алкилы с 1-10 атомами углерода (например, C1, C2, C3, C4, C5, C6, C7, C8, C9, C10), например, -(CH2)4- или -(CH2)3-.
Другие группы X для применения в бифункциональных линкерах, описанных в двух предшествующих абзацах, представляют собой группы, которые образуют сложные эфиры при комбинировании с HO-L-OH, такими как норборан, п-нитробензойная кислота и сульфо-N-гидроксисукцинимид.
Следующие бифункциональные линкеры для применения в рамках изобретения включают акрилоилгалогениды (например, хлорид) и галоацилгалогениды.
В процессе связывания с антигеном линкер обычно добавляют в молярном избытке относительно антигена.
Когда антиген имеет одну группу, которая связана с молекулой носителя (необязательно через линкер), и носитель имеет множество групп, которые связаны с различными молекулами антигена/линкера, полученный конъюгат может образовывать структуру ʺзвездыʺ. Эта структура содержит центральную молекулу носителя с множеством молекул антигенов, отходящих от носителя (необязательно через линкер). Когда антиген имеет более одной группы, которая связана с молекулой носителя (необязательно через линкер), и носитель имеет более одной группы, которая связана с различными молекулами антигена/линкера, полученный конъюгат может образовывать структуру ʺсетиʺ. Эта структура содержит сеть молекул носителя, соединенных молекулами антигена (необязательно через линкеры).
Конъюгаты могут иметь избыток носителя (масс./масс.) или избыток антигена (масс./масс.), например, в диапазоне соотношений от 1:5 до 5:1. Типичными являются конъюгаты с избытком белка-носителя, например, в диапазоне от 0,2:1 до 0,9:1, или с равными массами. Конъюгат может включать небольшие количества свободного (т.е. неконъюгированного) носителя. Когда данный белок-носитель присутствует как в свободной, так и в конъюгированной форме в композиции по изобретению, неконъюгированная форма составляет предпочтительно не более 5% от общего количества белка-носителя в композиции в целом, и более предпочтительно присутствует в количестве менее 2% (по массе).
Когда конъюгат содержится в фармацевтической композиции по изобретению, композиция также может содержать свободный белок-носитель в качестве иммуногена [137].
После конъюгации свободные и конъюгированные антигены можно разделять. Существует множество подходящих способов, например, гидрофобная хроматография, тангенциальная ультрафильтрация, диафильтрация и т.д. [также см. ссылки 138, 139 и т.д.]. Предпочтительной является ультрафильтрация в тангенциальном потоке.
Сахаридная часть в конъюгате предпочтительно представляет собой низкомолекулярный сахарид или олигосахарид, как определено выше. Перед конъюгацией олигосахариды обычно разделяют по размеру.
Предпочтительно конъюгат растворим в воде и/или в физиологическом буфере.
Получение и конъюгация молекул носителей, модифицированных так, чтобы они включали неприродные аминокислоты
Когда один или несколько неприродных аминокислотных остатков включают в молекулу носителя, тогда это можно осуществлять с использованием стандартных методик. Один такой способ включает использование модифицированных клеток-хозяев, в которых аминоацил-тРНК-синтетаза для конкретного кодона модифицирована способами инженерии так, чтобы она связывала тРНК с неприродной аминокислотой, которая затем встраивается в носитель в ходе трансляции [см. ссылку 140 для обзора таких способов]. Альтернативно в некоторых методиках используется тот факт, что некоторые неприродные аминокислоты встраиваются в белки нативным клеточным аппаратом, когда природная собственная аминокислота не присутствует. Примером этого второго типа методики является включение HAG. В этом случае в некоторых клетках, если клетка имеет низкое количество или не имеет метионина, тогда нативный клеточный аппарат включает HAG вместо метионина на стадиях инициации и элонгации при синтезе белка. Многие клетки-хозяева, используемые для экспрессии белка, являются прототрофными для метионина, т.е. клетка может синтезировать эту аминокислоту de novo. Таким образом, с использованием клеток, которые являются ауксотрофами метионина, можно снизить уровни метионина до такого низкого уровня, что HAG включается в белки вместо метионина. Примеры ауксотрофных по метионину клеток-хозяев включают штаммы E. coli B834 (DE3) (Merck) и T7 Express Crystal (NEB), хотя другие подходящие штаммы будут очевидны специалисту в данной области.
Технология/реакции конъюгации, используемая для конъюгации молекулы носителя, должна быть пригодна для функциональной группы в неприродной аминокислоте. Например, когда неприродная аминокислота представляет собой HAG, тогда используют тииленовую конъюгацию [см., например, ссылку 141].
Смеси, содержащие конъюгаты
Конъюгаты по изобретению можно смешивать с дополнительными антигенами. Эти дополнительные антигены могут представлять собой другие конъюгаты по изобретению или они могут представлять собой другие антигены.
Например, предусматриваются смеси конъюгатов. По меньшей мере один из конъюгатов в этих смесях представляет собой конъюгат по изобретению, т.е. молекула носителя содержит антиген spr0096 и антиген spr2021. Как правило, другой конъюгат(ы) в этих смесях также представляют собой конъюгаты по изобретению. Однако, когда другой конъюгат(ы) не является конъюгатом по изобретению, молекула носителя может представлять собой любой пригодный белок-носитель (как описано ниже), как правило, одну и ту же молекулу носителя в каждом конъюгате.
Например, предусматриваются смеси конъюгатов из более чем одной серогруппы N.meningitidis, например, композиции, содержащие сахариды из серогрупп A+C, A+W135, A+Y, C+W135, C+Y, W135+Y, A+C+W135, A+C+Y, C+W135+Y, A+C+W135+Y и т.д. Как правило, смесь представляет собой смесь конъюгатов, содержащую сахариды из серогрупп A, C, W135 и Y. По меньшей мере один из конъюгатов в этих смесях представляет собой конъюгат по изобретению, т.е. молекула носителя содержит антиген spr0096 и антиген spr2021. Как правило, другой конъюгат(ы) в этих смесях также представляет собой конъюгаты по изобретению. Однако, когда другой конъюгат(ы) не является конъюгатами по изобретению, молекула носителя может представлять собой любой подходящий белок-носитель (как описано ниже), как правило, одну и ту же молекулу носителя в каждом конъюгате.
Пригодные белки-носители представляют собой бактериальные токсины, такие как дифтерийные и столбнячные токсины, или токсоиды, или их мутанты. Авторы изобретения открыли, что мутант дифтерийного токсина CRM197 [142] является особенно пригодным. Другие пригодные белки-носители включают комплекс белков наружной мембраны N.meningitidis [143], синтетические пептиды [144, 145], белки теплового шока [146, 147], коклюшные белки [148, 149], цитокины [150], лимфокины [150], гормоны [150], факторы роста [150], сывороточный альбумин человека (как правило, рекомбинантный), искусственные белки, содержащие множество CD4+ T-клеточных эпитопов человека из различных происходящих из патогенов антигенов [17], таких как N19 [151], белок D из H.influenzae [152-154], пневмококковый поверхностный белок PspA [155], пневмолизин [156] или его нетоксичные производные [157], осуществляющие захват железа белки [158], токсин A или B из C.difficile [159], белок GBS [160], белок GAS [161] и т.д.
Один белок-носитель может содержать более одного полисахаридного антигена [162, 163]. Для этого различные сахариды можно смешивать перед процессом конъюгации. Однако, как правило, существуют отдельные конъюгаты для каждого сахарида, при этом различные сахариды смешивают после конъюгации. Отдельные конъюгаты могут быть основаны на одном и том же носителе, в частности, на одном и том же носителе, содержащем антиген spr0096 и антиген spr2021.
Смесь по изобретению может представлять собой, например, смесь отдельных конъюгатов для каждого сахарида из серогрупп A, C, W135 и Y, где конъюгат серогруппы A представляет собой конъюгат по изобретению, т.е. молекула носителя содержит антиген spr0096 и антиген spr2021, и конъюгаты серогруппы C, W135 и Y не являются конъюгатами по изобретению. В этом варианте осуществления молекула носителя в конъюгатах серогруппы C, W135 и Y, как правило, представляет собой CRM197.
Когда смесь содержит капсулярные сахариды из серогрупп как A, так и C, предпочтительно, чтобы соотношение (масс./масс.) сахарид MenA:сахарид MenC превышало 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше).
Когда смесь содержит капсулярные сахариды из серогруппы Y и одной или обеих из серогрупп C и W135, предпочтительно, чтобы соотношение (масс./масс.) сахарид MenY:сахарид MenW135 превышало 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше) и/или чтобы соотношение (масс./масс.) сахарид MenY:сахарид MenC составляло менее 1 (например, 1:2, 1:3, 1:4, 1:5 или ниже).
Предпочтительные соотношения (масс./масс.) для сахаридов из серогрупп A:C:W135:Y представляют собой: 1:1:1:1; 1:1:1:2; 2:1:1:1; 4:2:1:1; 8:4:2:1; 4:2:1:2; 8:4:1:2; 4:2:2:1; 2:2:1:1; 4:4:2:1; 2:2:1:2; 4:4:1:2; и 2:2:2:1. Как правило, соотношение представляет собой 2:1:1:1.
Смеси также могут содержать белки. Например, смеси могут включать белки из серогруппы B N.meningitidis [например, ссылки 164-169] или препараты OMV [например, ссылки 170-173 и т.д.].
Кроме того, антиген(ы) может содержать антигены из патогенов, не являющихся N.meningitidis. Таким образом, композиции по изобретению, кроме того, могут содержать один или несколько антигенов не из N.meningitidis, включая дополнительные бактериальные, вирусные или паразитарные антигены. Они могут быть выбраны из следующих:
- сахаридный антиген из Streptococcus pneumoniae [например, ссылки 174-176; главы 22 и 23 ссылки 183].
- антиген из вируса гепатита A, такой как инактивированный вирус [например, 177, 178; глава 15 ссылки 183].
- антиген из вируса гепатита B, такой как поверхностный и/или ядерный антигены [например, 178, 179; глава 16 ссылки 183].
- антиген из вируса гепатита C [например, 180].
- антиген из Bordetella pertussis, такой как коклюшный голотоксин (PT) и филаментный гемагглютинин (FHA) из B.pertussis, необязательно также в комбинации с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 181 и 182; глава 21 ссылки 183].
- дифтерийный антиген, такой как дифтерийный токсоид [например, глава 13 ссылки 183].
- столбнячный антиген, такой как столбнячный токсоид [например, глава 27 ссылки 183].
- сахаридный антиген из Haemophilus influenzae B [например, глава 14 ссылки 183].
- антиген из N.gonorrhoeae [например, 164-167].
- антиген из Chlamydia pneumoniae [например, 184, 185, 186, 187, 188, 189, 190].
- антиген из Chlamydia trachomatis [например, 191].
- антиген из Porphyromonas gingivalis [например, 192].
- антиген(ы) вируса полиомиелита [например, 193, 194; глава 24 ссылки 183], такой как IPV.
- антиген(ы) вируса бешенства [например, 195, такой как лиофилизированный инактивированный вирус [например, 196, RabAvertTM].
- антигены вирусов кори, свинки и/или краснухи [например, главы 19, 20 и 26 ссылки 183].
- антиген(ы) вируса гриппа [например, главы 17 и 18 ссылки 183], такие как поверхностные белки гемагглютинин и/или нейраминидаза.
- антиген из Moraxella catarrhalis [например, 197].
- антиген из Streptococcus pyogenes (стрептококк группы A) [например, 198, 199, 200].
- антиген из Streptococcus agalactiae (стрептококк группы B) [например, 160, 201-203].
- антиген из S.epidermidis [например, капсулярный полисахарид типа I, II и/или III, получаемый из штаммов ATCC-31432, SE-360 и SE-10, как описано в ссылках 204, 205 и 206].
Когда используют сахаридный или углеводный антиген, его, как правило, конъюгируют с носителем для повышения иммуногенности. Молекула носителя может представлять собой носитель по изобретению, т.е. носитель, который содержит антиген spr0096 и антиген spr2021. Альтернативно молекула носителя может представлять собой любой подходящий белок-носитель, например, как описано выше. Конъюгация H.influenzae B, менингококкового и пневмококкового сахаридного антигенов хорошо известна.
Токсические белковые антигены можно детоксифицировать, когда это необходимо (например, детоксификация коклюшного токсина химическими и/или генетическими способами [182]).
Когда дифтерийный антиген включен в композицию, также обычно включают столбнячный антиген и коклюшные антигены. Аналогично, когда включен столбнячный антиген, также обычно включают дифтерийный и коклюшный антигены. Аналогично, когда включен коклюшный антиген, также обычно включают дифтерийный и столбнячный антигены.
Антигены могут быть адсорбированы на соль алюминия.
Антигены в композиции, как правило, присутствуют в концентрации по меньшей мере 1 мкг/мл для каждого из них. Как правило, концентрация любого данного антигена будет достаточной для индукции иммунного ответа против этого антигена.
В качестве альтернативы использованию белковых антигенов в композиции по изобретению, можно использовать нуклеиновую кислоту, кодирующую антиген [например, ссылки 207-215]. Белковые компоненты композиций по изобретению, таким образом, могут быть заменены нуклеиновой кислотой (обычно ДНК, например, в форме плазмиды), которая кодирует белок.
На практике, может существовать верхний предел количества антигенов, включенных в композиции по изобретению. Количество антигенов (включая конъюгаты по изобретению) в композиции по изобретению может составлять менее 20, менее 19, менее 18, менее 17, менее 16, менее 15, менее 14, менее 13, менее 12, менее 11, менее 10, менее 9, менее 8, менее 7, менее 6, менее 5, менее 4 или менее 3. Количество конъюгатов по изобретению в композиции может составлять менее 6, менее 5 или менее 4.
Фармацевтические композиции, содержащие конъюгаты
Изобретение относится к фармацевтической композиции, содержащей (a) конъюгат по изобретению, и (b) фармацевтически приемлемый носитель. Подробное обсуждение таких носителей доступно в ссылке 216.
Микробные инфекции поражают различные области организма и, таким образом, композиции по изобретению можно получать в различных формах. Например, композиции можно получать в качестве инъецируемых препаратов, либо в качестве жидких растворов, либо в качестве суспензий. Также можно получать твердые формы, пригодные для растворения или суспендировали в жидких носителях перед инъекцией. Композицию можно получать для местного введения, например, в качестве мази, крема или порошка. Композицию можно получать для перорального введения, например, в качестве таблетки или капсулы, или в качестве сиропа (необязательно с вкусовыми добавками). Композицию можно получать для легочного введения, например, в качестве ингалятора, с использованием тонкого порошка или спрея. Композицию можно получать в качестве суппозитория или пессария. Композицию можно получать для назального, ушного или глазного введения, например, в качестве капель, в качестве спрея или в качестве порошка [например, 217]. Композиция может быть включена в жидкость для полоскания рта. Композиция может быть лиофилизированной.
Фармацевтическая композиция предпочтительно является стерильной. Предпочтительно она не содержит пирогенов. Предпочтительно она является забуференной, например, до pH 6-pH 8, обычно до приблизительно pH 7.
Изобретение также относится к устройству для доставки, содержащему фармацевтическую композицию по изобретению. Устройство может представлять собой, например, шприц или ингалятор.
Фармацевтические композиции по изобретению предпочтительно представляют собой иммунногенные композиции, поскольку они содержат иммунологически эффективное количество антигена. Под ʺиммунологически эффективным количествомʺ подразумевают, что введение этого количества индивидууму, либо в однократной дозе, либо в качестве части серии, является эффективным для лечения или профилактики. Это количество варьирует, в зависимости от состояния здоровья и физического состояния индивидуума, подлежащего лечению, возраста, таксономической группы индивидуума, подлежащего лечению (например, не являющийся человеком примат, примат и т.д.), способности иммунной системы индивидуума синтезировать антитела, желаемой степени защиты, состава вакцины, оценки медицинской ситуации лечащим врачом и других имеющих значение факторов. Ожидается, что количество будет находиться в относительно широком диапазоне, который может быть определен с помощью стандартных испытаний. Введение дозировок может соответствовать схеме с однократной дозой или схеме с многократными дозами (например, включающей вспомогательные дозы). Композицию можно вводить вместе с другими иммунорегулирующими средствами.
После составления композиции по изобретению можно вводить прямо индивидууму. Индивидуумы, подлежащие лечению, могут представлять собой животных; в частности, можно лечить человека.
Иммуногенные композиции по изобретению можно использовать терапевтически (т.е. для лечения существующей инфекции) или профилактически (т.е. для предупреждения инфекции в будущем). Терапевтическая иммунизация является особенно пригодной для лечения инфекции Candida у индивидуумов с иммунодефицитом.
Иммуногенная композиция может включать дополнительный адъювант, который может функционировать, усиливая иммунный ответ (гуморальный и/или клеточный), индуцируемый у пациента, которому вводят композицию. Адъюванты, которые можно использовать в рамках изобретения, включают, но не ограничиваются ими:
- Содержащую минерал композицию, включающую соли кальция и соли алюминия (или их смеси). Соли кальция включают фосфат кальция (например, частицы ʺCAPʺ, описанные в ссылке 218). Соли алюминия включают гидроксиды, фосфаты, сульфаты и т.д., причем соли имеют любую пригодную форму (например, гелеобразную, кристаллическую, аморфную и т.д.). Адсорбция на этих солях является предпочтительной. Содержащие минерал композиции также можно изготавливать в качестве частиц соли металла [219]. Можно использовать адъюванты, известные как гидроксид алюминия и фосфат алюминия. Эти названия являются общепринятыми, но их используют только для удобства, поскольку ни одно из них не является точным описанием истинного химического соединения, которое присутствует (например, см. глава 9 ссылки 302). В рамках изобретения могут быть использованы любые из адъювантов на основе ʺгидроксидовʺ или ʺфосфатовʺ, которые обычно используют в качестве адъювантов. Адъюванты, известные как ʺгидроксид алюминияʺ, обычно представляют собой соли оксигидроксида алюминия, которые, как правило, являются по меньшей мере частично кристаллическими. Адъюванты, известные как ʺфосфат алюминияʺ, как правило, представляют собой гидроксифосфаты алюминия, часто также содержащие небольшие количества сульфата (т.е. сульфат гидроксифосфата алюминия). Их можно получать преципитацией, и условия реакции и концентрации в ходе осаждения влияют на степень замещения фосфатом гидроксила в соли. В рамках изобретения может быть использована смесь как гидроксида алюминия, так и фосфата алюминия. В этом случае фосфата алюминия может быть больше, чем гидроксида, например, с соотношением масс по меньшей мере 2:1 например, ≥5:1, ≥6:1, ≥7:1, ≥8:1, ≥9:1 и т.д. Концентрация Al+++ в композиции для введения пациенту предпочтительно составляет менее чем 10 мг/мл, например, ≤5 мг/мл, ≤4 мг/мл, ≤3 мг/мл, ≤2 мг/мл, ≤1 мг/мл и т.д. Предпочтительный диапазон составляет от 0,3 до 1 мг/мл. Предпочтительным является максимум 0,85 мг/доза.
- Сапонины [глава 22 ссылки 302], которые представляют собой гетерологичную группу стериновых гликозидов и тритерпеноидных гликозидов, которые встречаются в коре, листьях, стеблях, корнях и даже цветах широкого диапазона видов растений. Сапонин из коры дерева Quillaia saponaria Molina широко исследован в качестве адъюванта. Также сапонин может быть коммерчески полученным из Smilax ornata (сарсапарель), Gypsophilla paniculata (фата невесты) и Saponaria offlcianalis (мыльный корень). Адъювантные составы на основе сапонина включают очищенные составы, такие как QS21, а также липидные составы, такие как ISCOM. QS21 поставляется на рынок в качестве StimulonTM. Композиции сапонина очищают с использованием ВЭЖХ и ОФ-ВЭЖХ. Идентифицированы конкретные фракции, очищенные с использованием этих способов, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонин представляет собой QS21. Способ получения QS21 описан в ссылке 220. Также составы на основе сапонинов могут содержать стерин, такой как холестерин [221]. Сочетания сапонинов и холестеринов можно использовать для образования уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM) [глава 23 ссылки 302]. ISCOM, как правило, также включают фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. В ISCOM можно использовать любой известный сапонин. Предпочтительно, ISCOM включает один или несколько из QuilA, QHA и QHC. ISCOM дополнительно описан в ссылках 221-223. Необязательно, в ISCOM может отсутствовать дополнительный детергент [224]. Обзор разработки адъювантов на основе сапонинов может быть найден в ссылках 225 и 226.
- Бактериальные ADP-рибозилирующие токсины (например, термолабильный энтеротоксин E.coli ʺLTʺ, холерный токсин ʺCTʺ, или коклюшный токсин ʺPTʺ) и их детоксифицированные производные, такие как мутантные токсины, известные как LT-K63 и LT-R72 [227]. Применение детоксифицированных ADP-рибозилирующих токсинов в качестве адъювантов для слизистых оболочек описано в ссылке 228 и в качестве первичных адъювантов в ссылке 229.
- Биоадгезивные и мукоадгезивные вещества, такие как микросферы с этерифицированной гиалуроновой кислотой [230] или хитозан и его производные [231].
- Микрочастицы (т.е. частица диаметром от ~100 нм до ~150 мкм, более предпочтительно, диаметром от ~200 нм до ~30 мкм, или диаметром от ~500 нм до ~10 мкм), образованные из материалов, которые являются биологически деградируемыми и нетоксичными (например, поли(α-гидроксикислота), полигидроксимасляная кислота, полимер сложного ортоэфира, полиангидрид, поликапролактон и т.д.), причем сополимер лактида и гликолида является предпочтительным, необязательно обработанных для того, чтобы они имели отрицательно заряженную поверхность (например, посредством SDS) или положительно заряженную поверхность (например, посредством катионного детергента, такого как CTAB).
- Липосомы (главы 13 и 14 ссылки 302). Примеры липосомальных составов, пригодных для применения в качестве адъювантов, описаны в ссылках 232-234.
- Мурамилпептиды, такие как N-ацетилмурамил-L-треонил-D-изоглутамин (ʺthr-MDPʺ), N-ацетил-нормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилглюкозаминил-N-ацетилмурамил-L-Al-D-изоглутамин-L-Ala-дипальмитоксипропиламид (ʺDTP-DPPʺ, или ʺTheramideTMʺ), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (ʺMTP-PEʺ).
- Полимер полиоксидония [235, 236] или другое N-окисленное производное полиэтиленпиперазина.
- Метилинозин-5'-монофосфат (ʺMIMPʺ) [237].
- Полигидроксилированное соединение пирролизидина [238], такое как соединение формулы:
где R выбран из группы, включающей водород, прямую или разветвленную, незамещенную или замещенную, насыщенную или ненасыщенную ацильную, алкильную (например, циклоалкильную), алкенильную, алкинильную и арильную группы, или их фармацевтически приемлемую соль или производное. Примеры включают, но не ограничиваются ими: казуарин, казуарин-6-α-D-глюкопиранозу, 3-эпиказуарин, 7-эпиказуарин, 3,7-диэпиказуарин и т.д.
- лиганд CD1d, такой как α-гликозилцерамид, например, α-галактозилцерамид [239-246] (например, α-галактозилцерамид), фитосфингозин-содержащие α-гликозилцерамиды, OCH, KRN7000 [(2S,3S,4R)-1-O-(α-D-галактопиранозил)-2-(N-гексакозаноиламино)-1,3,4-октадекантриол], CRONY-101, 3ʺ-O-сульфогалактозилцерамид и т.д.
- гамма-инулин [247] или его производное, такое как алкаммулин.
- Эмульсия типа ʺмасло в водеʺ. Известны различные эмульсии, и они, как правило, включают по меньшей мере одно масло и по меньшей мере одно поверхностно-активное вещество, причем масло(а) и поверхностно-активное вещество(а) являются биологически деградируемыми (метаболизируемыми) и биологически совместимыми. Капли масла в эмульсии, как правило, имеют диаметр менее 5 мкм, и они могут даже иметь субмикронный диаметр, причем этих малых размеров достигают с помощью микрофлуидизатора для получения стабильных эмульсий. Капли с размером менее 220 нм являются предпочтительными, поскольку их можно подвергать стерилизации фильтрованием.
- Иммуностимулирующий олигонуклеотид, такой как иммуностимулирующий олигонуклеотид, содержащий мотив CpG (динуклеотидная последовательность, содержащая неметилированнйы остаток цитозина, связанный через фосфатную связь с остатком гуанозина), или мотив CpI (динуклеотидная последовательность, содержащая цитозин, связанный с инозином), или двухцепочечную РНК, или олигонуклеотид, содержащий палиндромную последовательность, или олигонуклеотид, содержащий последовательность поли(dG). Иммуностимулирующие олигонуклеотиды могут включать модификации/аналоги нуклеотидов, такие как фосфоротиоатные модификации, и они могут быть двухцепочечными или (за исключением РНК) одноцепочечными. В ссылках 248, 249 и 250 описаны возможные замены аналогами, например, замена гуанозина 2'-дезокси-7-деазагуанозином. Адъювантный эффект олигонуклеотидов CpG дополнительно рассмотрен в ссылках 251-256. Последовательность CpG может быть направлена на TLR9, например, мотив GTCGTT или TTCGTT [257]. Последовательность CpG может быть специфической для индукции Th1-иммунного ответа, такая как CpG-A ODN (олигодезоксинуклеотид), или она может быть специфической для индукции B-клеточного ответа, например, CpG-B ODN. CpG-A и CpG-B ODN рассмотрены в ссылках 258-260. Предпочтительно, CpG представляет собой CpG-A ODN. Предпочтительно, CpG-олигонуклеотид сконструирован так, чтобы 5'-конец был доступен для распознавания рецептором. Необязательно, две последовательности CpG-олигонуклеотидов могут быть связаны на их 3'-концах с образованием ʺиммуномеровʺ. См., например, ссылки 257 и 261-263. Пригодным CpG-адъювантом является CpG7909, также известный как ProMuneTM (Coley Pharmaceutical Group, Inc.). Другим является CpG1826. В качестве альтернативы, или дополнительно, использованию последовательностей CpG, можно использовать последовательности TpG [264], и эти олигонуклеотиды могут быть свободными от неметилированных мотивов CpG. Иммуностимулирующий олигонуклеотид может быть богатым пиримидинами. Например, он может содержать более одного последовательно расположенного тимидинового нуклеотида (например, TTTT, как описано в ссылке 264), и/или он может иметь нуклеотидный состав с >25% тимидина (например, >35%, >40%, >50%, >60%, >80%, и т.д.). Например, он может содержать более одного последовательно расположенного цитозинового нуклеотида (например, CCCC, как описано в ссылке 264), и/или он может иметь нуклеотидный состав с >25% цитозина (например, >35%, >40%, >50%, >60%, >80%, и т.д.). Эти олигонуклеотиды могут не содержать неметилированных мотивов CpG. Иммуностимулирующие олигонуклеотиды, как правило, содержат по меньшей мере 20 нуклеотидов. Они могут содержать менее 100 нуклеотидов.
Особенно пригодный адъювант на основе иммуностимулирующих олигонуклеотидов известен как IC31TM [265]. Таким образом, адъювант, используемый в рамках изобретения, может содержать смесь (i) олигонуклеотида (например, из 15-40 нуклеотидов), включающего по меньшей мере один (и предпочтительно несколько) мотив CpI, и (ii) поликатионного полимера, такого как олигопептид (например, из 5-20 аминокислот), включающего по меньшей мере одну (и предпочтительно несколько) трипептидную последовательность(и) Lys-Arg-Lys. Олигонуклеотид может представлять собой дезоксинуклеотид, содержащий 26-мерную последовательность 5'-(IC)13-3' (SEQ ID NO: 1). Поликатионный полимер может представлять собой пептид, содержащий 11-мерную аминокислотную последовательность KLKLLLLLKLK (SEQ ID NO: 2).
- 3-O-деацилированный монофосфориллипид A (ʺ3dMPLʺ, также известный как ʺMPLTMʺ) [266-269]. В водных условиях, 3dMPL может образовывать мицеллярные агрегаты или частицы с различными размерами, например, с диаметром <150 нм или >500 нм. Любой или оба из них можно использовать в рамках изобретения, и лучшие частицы можно отбирать посредством общепринятого анализа. Более мелкие частицы (например, достаточно маленькие для получения прозрачной водной суспензии 3dMPL) являются предпочтительными для применения в соответствии с изобретением, вследствие их более высокой активности [270]. Предпочтительные частицы имеют средний диаметр менее 220 нм, более предпочтительно менее 200 нм или менее 150 нм или менее 120 нм, и они могут даже иметь средний диаметр менее 100 нм. Однако в большинстве случаев, средний диаметр не будет составлять менее 50 нм.
- Соединение имидазохинолина, такое как имиквимод (ʺR-837ʺ) [271, 272], резиквимод (ʺR-848ʺ) [273], и их аналоги; и их соли (например, соли хлористоводородной кислоты). Дополнительные подробности, касающиеся иммуностимулирующих имидазохинолинов, могут быть найдены в ссылках 274-278.
- Соединение тиосемикарбазона, такое как соединения, описанные в ссылке 279. Способы составления, изготовления и скрининга активных соединений также описаны в ссылке 279. Тиосемикарбазоны являются особенно эффективными в отношении стимуляции продукции цитокинов, таких как TNF-α, мононуклеарными клетками периферической крови человека.
- Соединение триптантрина, такое как соединения, описанные в ссылке 280. Способы составления, изготовления и скрининга активных соединений также описаны в ссылке 280. Тиосемикарбазоны являются особенно эффективными в отношении стимуляции продукции цитокинов, таких как TNF-α, мононуклеарными клетками периферической крови человека.
- Нуклеозидный аналог, такой как: (a) изаторабин (ANA-245; 7-тиа-8-оксогуанозин):
и его пролекарства; (b) ANA975; (c) ANA-025-1; (d) ANA380; (e) соединения, описанные в ссылках 281-283.
- Локсорибин (7-аллил-8-оксогуанозин) [284].
- Соединения, описанные в ссылке 285, включая: соединения ацилпиперазина, соединения индолдиона, соединения тетрагидраизохинолина (THIQ), соединения бензоциклодиона, аминоазавинильные соединения, соединения аминобензимидазолхинолинона (ABIQ) [286, 287], соединения гидрафталамида, соединения бензофенона, соединения изоксазола, соединения стерина, соединения квиназилинона, соединения пиррола [288], соединения антрахинона, соединения хиноксалина, соединения триазина, соединения пиразолопиримидин и соединения бензазола [289].
- Производное аминоалкилглюкозаминидфосфата, такое как RC-529 [290, 291].
- Фосфазин, такой как поли[ди(карбоксилатофенокси)фосфазин] (ʺPCPPʺ), как описано, например, в ссылках 292 и 293.
- Замещенная мочевина или соединение формулы I, II или III, или их соль:
как определено в ссылке 294, такие как ʺER 803058ʺ, ʺER 803732ʺ, ʺER 804053ʺ, ʺER 804058ʺ, ʺER 804059ʺ, ʺER 804442ʺ, ʺER 804680ʺ, ʺER 804764ʺ, ʺER 803022ʺ или ʺER 804057ʺ, например:
 ER804057
ER804057
- Производные липида A из Escherichia coli, такие как OM-174 (описанные в ссылках 295 и 296).
- Соединения, содержащие липиды, связанные с фосфат-содержащим ациклическим остовом, такие как антагонист TLR4 E5564 [297, 298]:
Эти и другие вещества с адъювантной активностью более подробно рассмотрены в ссылках 302 и 303.
Антигены и адъюванты в композиции, как правило, находятся в смеси.
Композиции могут включать два или более из указанных адъювантов. Например, они могут преимущественно включать как эмульсию типа ʺмасло в водеʺ, так и 3dMPL и т.д.
Конкретные адъюванты на основе эмульсии типа ʺмасло-в-водеʺ, пригодные в рамках изобретения, включают, но не ограничиваются ими:
- Субмикронную эмульсию сквалена, Tween 80 и Span 85. Состав эмульсии по объему может представлять собой приблизительно 5% сквален, приблизительно 0,5% полисорбат 80 и приблизительно 0,5% Span 85. В единицах массы, эти отношения составляют 4,3% сквален, 0,5% полисорбат 80 и 0,48% Span 85. Этот адъювант известен в качестве ʺMF59ʺ [299-301], как более подробно описано в главе 10 ссылки 302 и главе 12 ссылки 303. Эмульсия MF59 преимущественно включает цитратные ионы, например, 10 мМ натрий-цитратный буфер.
- Эмульсию сквалена, токоферола и Tween 80. Эмульсия может включать фосфатно-солевой буфер. Также она может включать Span 85 (например, при 1%) и/или лецитин. Эти эмульсии могут иметь от 2 до 10% сквалена, от 2 до 10% токоферола и от 0,3 до 3% Tween 80, и массовое отношение сквалена и токоферола предпочтительно составляет ≤1, поскольку это обеспечивает более стабильную эмульсию. Сквален и Tween 80 могут быть представлены в объемном отношении приблизительно 5:2. Одну такую эмульсию можно получать растворением Tween 80 в PBS с получением 2% раствора, затем смешиванием 90 мл этого раствора со смесью (5 г DL-α-токоферола и 5 мл сквалена), затем микрофлуидизацией смеси. Полученная эмульсия может иметь субмикронные капли масла, например, со средним диаметром между 100 и 250 нм, предпочтительно приблизительно 180 нм.
- Эмульсию сквалена, токоферола и детергента Triton (например, Triton X-100). Эмульсия также может включать 3d-MPL (см. ниже). Эмульсия может содержать фосфатный буфер.
- Эмульсию, содержащую полисорбат (например, полисорбат 80), детергент Triton (например, Triton X-100) и токоферол (например, α-токоферола сукцинат). Эмульсия может включать эти три компонента в массовом отношении приблизительно от 75:1 до 1:10 (например, 750 мкг/мл полисорбат 80, 110 мкг/мл Triton X-100 и 100 мкг/мл α-токоферола сукцината), и эти концентрации должны учитывать любой вклад в эти компоненты от антигенов. Эмульсия также может включать сквален. Эмульсия также может включать 3d-MPL (см. ниже). Водная фаза может содержать фосфатный буфер.
- Эмульсию сквалана, полисорбата 80 и полоксамера 401 (ʺPluronicTM L121ʺ). Эмульсию можно изготавливать в фосфатно-солевом буфере, pH 7,4. Эта эмульсия является пригодным носителем для доставки мурамилдипептидов, и ее можно использовать с треонил-MDP в адъюванте ʺSAF-1ʺ [304] (0,05-1% Thr-MDP, 5% сквалан, 2,5% Pluronic L121 и 0,2% полисорбат 80). Ее можно использовать без Thr-MDP, как и в адъюванте ʺAFʺ [305] (5% сквалан, 1,25% Pluronic L121 и 0,2% полисорбат 80). Предпочтительной является микрофлуидизация.
- Эмульсию, имеющую 0,5-50% масла, 0,1-10% фосфолипида, 0,05-5% неионное поверхностно-активное вещество. Как описано в ссылке 306, предпочтительными фосфолипидными компонентами являются фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидилглицерин, фосфатидная кислота, сфингомиелин и кардиолипин. Капли субмикронных размеров являются преимущественными.
- Субмикронная эмульсия типа ʺмасло-в-водеʺ неметаболизируемого масла (такого как легкое минеральное масло) и по меньшей мере одного поверхностно-активного вещества (такого как лецитин, Tween 80 или Span 80). Могут быть включены добавки, такие как сапонин QuilA, холестерин, сапонин-липофильный конъюгат (такой как GPI-0100, описанный в ссылке 307, получаемый добавлением алифатического амина к дезацилсапонину через карбоксильную группу глюкуроновой кислоты), бромид диметилдиоктадециламмония и/или N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин.
- Эмульсию, в которой сапонин (например, QuilA или QS21) и стерин (например, холестерин) связаны в качестве спиралевидных мицелл [308].
Медицинские способы лечения и применения
Изобретение также относится к конъюгату по изобретению для применения в медицине, например, для применения для повышения антительного ответа у млекопитающего.
Изобретение также относится к способу повышения иммунного ответа у млекопитающего, включающему введение конъюгата или фармацевтической композиции по изобретению млекопитающему.
Изобретение также относится к применению конъюгата по изобретению для изготовления лекарственного средства для предупреждения или лечения микробной инфекции у млекопитающего.
Иммунный ответ, увеличенный с помощью этих способов и применений, обычно включает антительный ответ, предпочтительно защитный антительный ответ. Способы оценки антительных ответов после иммунизации антигеном хорошо известны в данной области. Антительный ответ предпочтительно представляет собой IgA- или IgG-ответ. Иммунный ответ может быть профилактическим и/или терапевтическим. Млекопитающим предпочтительно является человек.
Эффективность терапевтического лечения можно исследовать путем мониторинга микробной инфекции после введения композиции по изобретению. Эффективность профилактического лечения можно исследовать посредством мониторинга иммунных ответов против антигена (например, антител против антигена) после введения композиции.
Композиции по изобретению в основном будут вводить пациенту прямо. Прямую доставку можно осуществлять посредством парентеральной инъекции (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно или в интерстициальное пространство ткани), или посредством ректального, перорального, вагинального, местного, трансдермального, внутрикожного, глазного, назального, ушного или легочного введения. Предпочтительными являются инъекция или интраназальное введение.
Изобретение можно использовать для индукции системного иммунитета и/или иммунитета слизистых оболочек.
Вакцины, полученные в соответствии с изобретением, можно использовать для введения как детям, так и взрослым. Таким образом, индивидуум может быть в возрасте менее 1 года, 1-5 лет, 5-15 лет, 15-55 лет или по меньшей мере 55 лет. Предпочтительными индивидуумы для введения вакцин являются пожилые люди (например, ≥50 лет, ≥60 лет и предпочтительно ≥65 лет), или дети (например, ≤5 лет). Однако вакцины пригодны не только для этих групп и их можно использовать в целом в популяции.
Лечение можно осуществлять по схеме с однократной дозой или по схеме с многократными дозами. Многократные дозы можно использовать в схеме первичной иммунизации и/или в схеме вторичной иммунизации. В схеме с многократными дозами различные дозы можно вводить одним и тем же или различными путями, например, парентеральная первичная иммунизация и вторичная иммунизация через слизистую оболочку, первичная иммунизация через слизистую оболочку и парентеральная вторичная иммунизация, и т.д. Введение более одной дозы (как правило, двух доз) является особенно пригодным у иммунологически наивных пациентов. Многократные дозы, как правило, вводят с интервалом, составляющим по меньшей мере 1 неделю (например, приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 6 недель, приблизительно 8 недель, приблизительно 10 недель, приблизительно 12 недель, приблизительно 16 недель и т.д.).
Применения и способы по изобретению являются особенно пригодными для лечения/защиты от инфекций, вызываемых организмом, из которого происходит антиген. Иллюстративные применения/способы описаны ниже.
Капсулярные сахариды N.meningitidis
Применения и способы могут быть предназначены для профилактики и/или лечения заболевания, вызываемого N.meningitidis, например, менингита, септицемии и т.д.
Глюканы
Поскольку глюканы (и, в частности, β-глюканы) являются незаменимым и важнейшим полисахаридным составляющим практически всех патогенных грибов, в частности, грибов, вовлеченных в инфекции у индивидуумов с иммунодефицитом, и также бактериальных патогенов и простейших, иммунитет против глюкана может быть эффективным против широкого диапазона патогенов и заболеваний. Например, сыворотка против глюканов, полученная после иммунизации S.cerevisiae, является перекрестно реактивной в отношении C.albicans. Иммунитет широкого спектра является особенно пригодным, поскольку для этих инфекционных для человека агентов-грибов химиотерапия является недостаточной, появляется устойчивость к противогрибковым лекарственным средствам, и потребность в профилактических и терапевтических вакцинах все в большей степени признается.
Применения и способы по изобретению особенно пригодны для лечения/защиты от инфекций: видами Candida, такими как C.albicans; видами Cryptococcus, такими как C.neoformans; видами Enterococcus, такими как E.faecalis; видами Streptococcus, такими как S.pneumoniae, S.mutans, S.agalactiae и S.pyogenes; видами Leishmania, такими как L.major; видами Acanthamoeba, такими как A.castellani; видами Aspergillus, такими как A.fumigatus и A.flavus; видами Pneumocystis, такими как P.carinii; видами Mycobacterium, такими как M.tuberculosis; видами Pseudomonas, такими как P.aeruginosa; видами Staphylococcus, такими как S.aureus; видами Salmonella, такими как S.typhimurium; видами Coccidioides, такими как C.immitis; видами Trichophyton, такими как T.verrucosum; видами Blastomyces, такими как B.dermatidis; видами Histoplasma, такими как H.capsulatum; видами Paracoccidioides, такими как P.brasiliensis; видами Pythium, такими как P.insidiosum; и видами Escherichia, такими как E.coli.
Применения и способы являются особенно пригодными для профилактики/лечения заболеваний, включающих, но не ограничивающихся ими: кандидоз (включая печеночно-селезеночный кандидоз, инвазивный кандидоз, хронический кожно-слизистый кандидоз и диссеминированный кандидоз); кандидемию; аспергиллез, криптококкоз, дерматомикозы, споротрихоз и другие подкожные микозы, бластомикоз, гистоплазмоз, кокцидиомикоз, паракокцидиомикоз, пневмоцитоз, стоматит, туберкуклез, микобактериоз, респираторные инфекции, скарлатину, пневмонию, импетиго, ревматическую атаку, сепсис, септицемию, кожный и висцеральный лейшманиоз, роговичный акантамебиаз, кистозный фиброз, брюшной тиф, гастроэнтерит и гемолитический уремический синдром. Активность против C.albicans является особенно пригодной для лечения инфекций у пациентов со СПИД.
Конъюгаты по изобретению можно комбинировать с неглюкановыми антигенами в единую композицию для одновременной иммунизации против множества патогенов. В качестве альтернативы получению комбинированной вакцины, конъюгаты можно вводить пациентам по существу одновременно (например, в ходе той же медицинской консультации или посещения медицинского специалиста или центра вакцинации) с другими вакцинами. Антигены для применения в этих комбинированных вакцинах или для одновременного введения включают, например, иммуногены из Streptococcus agalactiae, Staphylococcus aureus и/или Pseudomonas aeuruginosa, вируса гепатита A, вируса гепатита B, Neisseria meningitidis (такие как сахариды или конъюгированные сахариды, для серогрупп A, C, W135 и/или Y), Streptococcus pneumoniae (такие как сахариды или конъюгированные сахариды), и т.д.
Конъюгаты по изобретению можно использовать вместе с противогрибковыми препаратами, в частности, когда пациент уже является инфицированным. Противогрибковые препараты обеспечивают немедленный терапевтический эффект, в то время как конъюгат обеспечивает длительный эффект. Пригодные противогрибковые препараты включают, но не ограничиваются ими, азолы (например, флуконазол, итраконазол), полиены (например, амфотерицин B), флуцитозин, и ингибиторы эпоксидазы сквалена (например, тербинафин) [также см. ссылку 309]. Противогрибковый препарат и конъюгат можно вводить по отдельности или в комбинации. При введении по отдельности, их, как правило, вводят в пределах 7 суток друг от друга. После первого введения конъюгата противогрибковый препарат можно вводить более одного раза.
Капсулярные сахариды S.pneumoniae
Применения и способы могут быть предназначены для профилактики и/или лечения заболевания, вызываемого пневмококком, например, менингита, сепсиса, пневмонии и т.д.
Определения
Для осуществления на практике настоящего изобретения можно использовать, если нет иных указаний, общепринятые способы химии, биохимии, молекулярной биологии, иммунологии и фармакологии, в пределах квалификации специалиста в данной области. Такие способы полностью объяснены в литературе. См., например, ссылки 216 и 310-316 и т.д.
Выше используется нумерация ʺGIʺ. Номер GI, или ʺидентификатор GenInfoʺ, представляет собой серию цифр, присваиваемую последовательно каждой записи о последовательности, обрабатываемой NCBI, когда последовательности добавляют в его базы данных. Номер GI не имеет сходства с номером доступа записи о последовательности. Когда в последовательность вносят поправки (например, для коррекции или добавления аннотации или информации), тогда она получает новый номер GI. Таким образом, последовательность, ассоциированная с данным номером GI, никогда не меняется.
Когда ʺдоменʺ антигена отсутствует, это может подразумевать отсутствие сигнального пептида, цитоплазматического домена, трансмембранного домена, внеклеточного домена и т.д.
Термин ʺсодержащийʺ охватывает ʺвключающийʺ, а также ʺсостоящийʺ, например, композиция, ʺсодержащаяʺ X, может состоять исключительно из X или она может включать что-либо дополнительное, например, X+Y.
Термин ʺприблизительноʺ в отношении числового значения x является необязательным и означает, например, x±10%.
Слово ʺпо существуʺ не исключает ʺполностьюʺ, например, композиция, которая ʺпо существу не содержитʺ Y, может полностью не содержать Y. Когда необходимо, слово ʺпо существуʺ может быть пропущено в определении по изобретению.
Термин ʺканоническийʺ в отношении аминокислот означает, что аминокислота представляет собой одну из двадцати аминокислот, кодируемых универсальным генетическим кодом, т.е. аланин, аспарагин, аспарагиновую кислоту, аргинин, цистеин, глутамин, глицин, глутаминовую кислоту, гистидин, изолейцин, лизин, лейцин, фенилаланин, метионин, серин, пролин, триптофан, треонин, тирозин и валин.
Если нет конкретных указаний, процесс, включающий стадию смешения двух или более компонентов, не требует какого-либо конкретного порядка смешивания. Таким образом, компоненты можно смешивать в любом порядке. Когда имеются три компонента, два компонента можно объединять друг с другом, а затем сочетание можно комбинировать с третьим компонентом, и т.д.
Когда используют материалы животных (и, в частности, крупного рогатого скота) в культуре клеток, их следует получать из источников, в которых отсутствуют трансмиссивные губчатые энцефалопатии (TSE), и, в частности, отсутствует губчатая энцефалопатия крупного рогатого скота (BSE). В целом, предпочтительным является культивирование клеток при полном отсутствии материалов из животных.
Когда соединение вводят в организм в качестве части композиции, тогда это соединение можно альтернативно заменять пригодным пролекарством.
Указание на процентную идентичность последовательностей между двумя аминокислотными последовательностями означает, что при выравнивании этот процент аминокислот является одинаковым при сравнении двух последовательностей. Это выравнивание и процентную гомологию или идентичность последовательностей можно определять с использованием программного обеспечения, известного в данной области, например, программного обеспечения, описанного в разделе 7.7.18 ссылки 317. Предпочтительное выравнивание проводят с помощью алгоритма поиска гомологии Смита-Ватермана с использованием аффинного поиска пропусков со штрафом за внесение пропуска, равным 12, и штрафом за продолжение пропуска, равным 2, матрицей BLOSUM 62. Алгоритм поиска гомологии Смита-Ватермана описан в ссылке 318.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
A. Получение и очистка конъюгатов
Ламинарин, пневмококковый капсулярный сахарид серотипа 5 и менингококковые капсулярные олигосахариды серотипов A, C, W135 и Y конъюгировали с различными известными и экспериментальными белками-носителями и очищали, как описано ниже.
Lam-96/2021: Ламинарин конъюгировали с SEQ ID NO: 9 в соответствии со способом ссылки 319 в фосфатно-солевом буфере с использованием активированного ламинарина при молярном отношении сложноэфирных групп полисахарида к белку, равному 30, и концентрации белка 2-10 мг/мл. Конъюгаты очищали с помощью аффинной хроматографии с иммобилизованными ионами металла (IMAC), с использованием гистидиновой метки на белке-носителе. Очистку проводили с помощью планшетов His MultiTrap HP platesTM (GE Healthcare), предварительно упакованных 96-луночных фильтровальных планшетов для мелкомасштабной очистки меченных гистидином белков, с использованием вакуумного источника. Очищенные конъюгаты охарактеризовывали с помощью SDS-Page; MicroBCA в отношении содержания белка; и HPAEC-PAD в отношении содержания сахаридов. Две партии имели следующие свойства:
|
Ламинарин конъюгировали с SEQ ID NO: 10 (Lam-2021/96) тем же способом. Для сравнения, ламинарин сходным образом конъюгировали со следующими белками-носителями: CRM197, spr0565B (SEQ ID NO: 11), spr1416 (SEQ ID NO: 12), spr1418 (SEQ ID NO: 13), spr2021 (SEQ ID NO: 3) и spr0096 (SEQ ID NO: 1).
MenA-, C-, W- и Y-96/2021: менингококковые капсулярные олигосахариды из серогрупп A, C, W135 и Y конъюгировали с SEQ ID NO: 9 с использованием способа, описанного в ссылке 320. Конъюгаты очищали способом IMAC, как описано выше. Очищенные конъюгаты охарактеризовывали с помощью SDS-Page, MicroBCA и HPAEC-PAD. Репрезентативные конъюгаты имели следующие свойства:
|
Для сравнения, эти сахариды сходным образом конъюгировали с CRM197 с использованием способа, описанного в ссылке 320. Также с использованием этого способа получали конъюгат MenA-CRM197 с более высоким соотношением сахарид:белок (далее в настоящем описании, ʺвысоким гликозилированиемʺ). Менингококковый капсулярный олигосахарид серогруппы C также конъюгировали с spr1416 (SEQ ID NO: 12).
Pneumo type 5-96/2021: пневмококковый капсулярный сахарид серотипа 5 разделяли по размеру на колонке Sephacryl S300 и окисляли в растворе 10 мМ NaPi, 500 мМ NaCl при pH 7,2 с NaIO4 (30% моль от количества моль повторяющегося элемента PS) при комнатной температуре в течение ночи. Материал очищали диализом с мембраной с пороговым значением 6-8 кДа против воды. Конъюгацию осуществляли посредством восстановительного аминирования с использованием окисленного сахарида в 100 мМ Na2B4O7, 100 мМ NaCl при pH 8,4 (5 мг/мл) при соотношении сахарид:белок 1:1 (масс./масс.) и соотношении белок:NaBH3CN 1:1 (масс./масс.) при 37°C в течение 48 часов. Конъюгаты очищали добавлением твердого сульфата аммония (500 г/л) в раствор неочищенного конъюгата, удержанием смеси в течение 30 минут при 0°C для обеспечения осаждения конъюгата, а затем центрифугированием и растворение осадка в 10 мМ NaPi при pH7,2.
Очищенные конъюгаты охарактеризовывали с помощью SDS-Page, MicroBCA и HPAEC-PAD. Репрезентативные конъюгаты имели следующие свойства:
|
Для сравнения этот сахарид сходным образом конъюгировали с CRM197.
B. Иммуногенность Lam-96/2021 по сравнению с другими конъюгатами ламинарин-пневмококковый белок
Иммуногенность конъюгата Lam-96/2021 сравнивали с ламинарином, конъюгированным с другими белками-носителями, происходящими из пневмококковых белковых антигенов. В кратком изложении, сахаридные конъюгаты (в дозе 5 мкг сахарида) с адъювантом на основе квасцов или без него вводили подкожно мышам Balb/C на 1, 14 и 28 сутки. У мышей проводили взятие крови на 42 сутки и измеряли специфические антитела против ламинарина с помощью ELISA (с использованием планшетов, покрытых неконъюгированным ламинарином [321]).
Результаты представлены на фиг.2, причем вертикальными пунктирными линиями обозначены отдельные исследования. В первом исследовании конъюгат Lam-96/2021 был более иммуногенным, чем конъюгаты ламинарина на основе пневмококковых белковых антигенов spr0565B, spr1416 и spr1418. Конъюгат также был более иммуногенным, чем эталонный конъюгат ламинарина на основе CRM197 (см. фиг.3, на которой данные из первого и третьего исследования на фиг.2 объединены). Во втором исследовании иммуногенность конъюгата ламинарина на основе spr2021 отдельно была более низкой, чем у этого эталонного конъюгата. В третьем исследовании конъюгат Lam-96/2021 был более иммуногенным, чем конъюгат ламинарина на основе spr0096 отдельно. Конъюгат также был, в общем, более иммуногенным, чем эталонные конъюгаты на основе CRM197, как в присутствии, так и в отсутствие адъюванта на основе квасцов.
С. Иммуногенность других сахаридных конъюгатов на основе 96/2021
Иммуногенность конъюгатов MenA-, C-, W- и Y-96/2021 и pneumo type 5-96/2021 исследовали с использованием той же схемы, что и для конъюгатов ламинарина, и сравнивали с эталонными конъюгатами на основе CRM197. Мышей Balb/C иммунизировали 2 мкг сахарида MenA, 1 мкг сахарида MenC, 1 мкг сахарида MenW и 1 мкг сахарида MenY на дозу. Специфические антитела против полисахарида определяли с помощью анализа ELISA (с использованием планшетов, покрытых нативным неконъюгированным полисахарид).
Результаты представлены на фиг.4, причем вертикальная линия обозначает отдельные исследования. В первом исследовании было показано, что конъюгат pneumo type 5-96/2021 является иммуногенным. Конъюгат был более иммуногенным, чем эталонный конъюгат на основе CRM197 в присутствии квасцов (сходный результат с квасцами наблюдали в сходном исследовании иммуногенности, описанном на фиг.5). Во втором исследовании бело показано, что MenA-, C-, W- и Y-96/2021 являются иммуногенными с иммуногенностью, сравнимой или лучшей относительно иммуногенности эталонных конъюгатов.
D. Конъюгаты Pneumo type 5-96/2021 обеспечивают защитный иммунитет
Конъюгат pneumo type 5-96/2021 сравнивали с эталонным конъюгатом pneumo type 5-CRM197 в модели на мышах защитного иммунитета против пневмококковой инфекции серотипа 5. В этом эксперименте группы из десяти мышей иммунизировали внутрибрюшинно различными иммуногенами (с или без квасцов в качестве адъюванта) на 0, 14 и 28 сутки. Две группы мышей, иммунизированных PBS отдельно и PBS/квасцами, соответственно, использовали в качестве отрицательных контролей. Через две недели после последней иммунизации все группы инфицировали внутрибрюшинно летальной дозой штамма пневмококков типа 5 (STREP-5). Эффективность защиты оценивали с использованием показателей снижения бактериемии и смертности. Через 24 часа после инфицирования уровень бактериемии оценивали в каждой из иммунизированных групп и сравнивали с контрольными группами. За смертностью наблюдали в течение 10 суток после инфицирования.
Результаты представлены на фиг.6. Оба конъюгата обеспечивали полную защиту при дозах 1 мкг и 0,25 мкг в присутствии адъюванта на основе квасцов. Однако только конъюгат pneumo type 5-96/2021 был способен обеспечивать защиту от смертности в отсутствие адъюванта.
В сходном исследовании эти конъюгаты сравнивали с сахаридом или белком-носителем 96/2021 отдельно и вместе. Оба конъюгата обеспечили полную (конъюгат pneumo type 5-96/2021) или практически полную (pneumo type 5-CRM197) защиту. Напротив, сахарид и носитель (отдельно или вместе) были неэффективными (фиг.7).
E. Иммуногенность конъюгатов MenA-96/2021
После второй иммунизации сыворотки объединяли от мышей, которым вводили: a) олигосахарид MenA, конъюгированный с CRM197 или с 96/2021; b) комбинацию конъюгатов MenA-, C-, W- и Y-96/2021 с квасцами или без них. Эти объединенные сыворотки исследовали с помощью ELISA в отношении титра антител против серогруппы A. Функциональность антител, индуцированных против капсулярного полисахарида, оценивали в бактерицидном анализе сыворотки с использованием комплемента кролика (rSBA).
На фиг.8 представлены результаты для объединенных сывороток. Конъюгаты MenA-96/2021 были более иммуногенными, чем конъюгаты MenA-CRM197. Конъюгаты MenA-96/2021 оставались иммуногенными при комбинировании с соответствующими конъюгатами MenC, MenW135 и MenY. Сходные наблюдения были сделаны, когда исследовали сыворотку после второй иммунизации от индивидуальных мышей (фиг.9, титры SBA над столбцами).
В другом исследовании получали сыворотку после второй иммунизации от индивидуальных мышей, которым вводили: a) олигосахарид MenA, конъюгированный с CRM197 или с 96/2021; b) комбинации конъюгатов MenA-96/2021 с конъюгатами MenC-, W- и Y-CRM197, с квасцами или без них. Эти объединенные образцы исследовали посредством ELISA в отношении титра антител против серогруппы A. Вновь, конъюгаты MenA-96/2021 были более иммуногенными, чем конъюгаты MenA-CRM197 (фиг.10, титры SBA над столбцами). Конъюгаты MenA-96/2021 оставались иммуногенными, когда их комбинировали с конъюгатами MenC-, W- и Y-CRM197.
F. Иммуногенность конъюгатов MenC-96/2021
После второй иммунизации объединяли сыворотки от мышей, которым вводили: a) олигосахарид MenC, конъюгированный с CRM197 или с 96/2021; b) комбинацию конъюгатов MenA-, C-, W- и Y-96/2021, с квасцами или без них. Эти объединенные образцы исследовали способом ELISA в отношении титра антител против серогруппы C. Функциональность антител, индуцированных против капсулярного полисахарида, оценивали в бактерицидном анализе сыворотки с использованием комплемента кролика (rSBA).
На фиг.11 представлены результаты для объединенных сывороток с титрами SBA над столбцами. Иммуногенность конъюгатов MenC-96/2021, по-видимому, была более высокой или сравнимой с иммуногенностью конъюгатов MenC-CRM197. Конъюгаты MenC-96/2021 оставались иммуногенными при комбинировании с соответствующими конъюгатами MenC, MenW135 и MenY.
G. Иммуногенность конъюгатов MenW-96/2021
Сыворотки после второй иммунизации объединяли от мышей, которым вводили: a) олигосахарид MenW, конъюгированный с CRM197 или с 96/2021; b) комбинацию конъюгатов MenA-, C-, W- и Y-96/2021, с квасцами или без квасцов. Эти объединенные образцы исследовали способом ELISA в отношении титра антител против серогруппы W.
На фиг.12 представлены результаты для объединенных сывороток. Иммуногенность конъюгатов MenW-96/2021, по-видимому, является более высокой (без квасцов) или сравнимой (с квасцами) с иммуногенностью конъюгатов MenW-CRM197. Конъюгаты MenW-96/2021 оставались иммуногенными при комбинировании с соответствующими конъюгатами MenC, MenW135 и MenY.
J. Иммуногенность конъюгатов MenY-96/2021
Сыворотки после второй иммунизации объединяли от мышей, которым водили: a) олигосахарид MenY, конъюгированный с CRM197 или с 96/2021; b) комбинацию конъюгатов MenA-, C-, W- и Y-96/2021, с квасцами или без них. Эти объединенные образцы исследовали посредством ELISA в отношении титра антител серогруппы Y.
Как показано на фиг.13, иммуногенность конъюгатов MenY-96/2021, по-видимому, сравнима с иммуногенностью конъюнгатов MenY-CRM197, и они остаются иммуногенными при комбинировании с соответствующими конъюгатами MenC, MenW135 и MenY.
I. T-клеточный ответ на конъюгаты MenC-96/2021
Сравнивали T-клеточный ответ на олигосахарид MenC, конъюгированный с CRM197, 96/2021 или spr1416. В этом эксперименте группы из восьми мышей CD1 иммунизировали подкожно различными иммуногенами (доза сахарида без квасцов 1 мкг) на 0, 14 и 28 сутки. Две группы мышей, иммунизироваанных PBS отдельно и неконъюгированным олигосахаридом MenC (доза сахарида 1 мкг), соответственно, использовали в качестве отрицательных контролей. Через 21 сутки после последней иммунизации сыворотку каждой мыши исследовали в отношении антител против полисахарида с помощью ELISA. Селезенки трех мышей в каждой группе извлекали для анализа профиля T-клеточных цитокинов с помощью многоцветного FACS с внутриклеточным окрашиванием после повторной антигенспецифической стимуляции in vitro.
Результаты ELISA представлены на фиг.14. Иммуногенность конъюгатов MenC-96/2021 оказалась более высокой или сравнимой с иммуногенностью конъюгатов MenC-CRM197 и MenC-spr1416. CRM197 и 96/2021, но не spr1416, индуцировали T-клеточные ответы (фиг.15).
J. Получение 96/2021, включающего HAG
Нуклеиновую кислоту, кодирующую гибрид 96/2021 SEQ ID NO: 9 (в векторе pET21+ или pET24+ (Merck)) трансформировали в компетентные клетки ауксотрофных по метионину штаммов E. coli B834(DE3) (Merck) и T7 express crystal (NEB) с использованием стандартных методик.
Для получения белков, включающих HAG, клетки инокулировали в среду с определенным химическим составом, так чтобы можно было контролировать точную концентрацию метионина. В качестве основной среды использовали либо комплекс AB4, либо минимальную среду M9, которая не содержала метионина, дополненные антибиотиками соответствующим образом для поддержания хозяина и/или экспрессирующей плазмиды. Композиция каждой среды является следующей:
AB4 без метионина:
AB4base 2x: 1 г/л аланина, 0,858 г/л аргинина, 0,65 г/л аспарагина, 0,656 г/л аспарагиновой кислоты, 0,202 г/л цистеина, 0,806 г/л глутамина, 0,812 г/л глутаминовой кислоты, 1,036 г/л глицина, 0,26 г/л гистидина, 0,594 г/л изолейцина, 1,176 г/л лейцина, 0,806 г/л лизина, 0,554 г/л фенилаланина, 0,476 г/л пролина, 4,108 г/л серина, 0,622 г/л треонина, 0,222 г/л триптофана, 0,5 г/л тирозина, 0,83 г/л валина, 1 г/л аденина, 0,858 г/л гуанозина, 0,65 г/л тимина, 0,656 г/л урацила, 1000 мл воды.
Vit Mix 1000x: 1 г/л рибофлавина, 1 г/л ниацинамида, 1 г/л пиридоксинхлорида, 1 г/л тиамина, 1000 мл воды.
Микроэлементы 2000x: 5,6 г/л FeSO4. 7H2O, 4,0 г/л MnCl4. 4H2O, 5,6 г/л CoCl2. 6H2O, 3,0 г/л CaCl2. 2H2O, 0,4 г/л CuSO4, 0,6 г/л ZnSO4. 7H2O, 1000 мл воды.
Глюкоза (25%): 250 г/л глюкозы, 1000 мл воды.
Конечная среда AB4 (1x): 2,0×500 мл AB4base, 386,5 мл воды, 20×100 мл PBS, 1 мл Vit Mix, 0,5 мл микроэлементов, 12 мл глюкозы (25%).
M9:
Раствор I: 200 г/л глюкозы, 4,9 г/л MgSO4. 7H2O, 0,28 г/л CaCl2. 2H2O, 1000 мл воды.
Раствор II (pH 7,4): 70 г/л K2HPO4, 30 г/л KH2PO4, 5 г/л NaCl, 6 г/л (NH4)2SO4, 1000 мл воды.
Для получения конечной среды растворы I/II смешивали в соотношении 85:5:10 (H2O:раствор I:раствор II).
Штамм B834(DE3) или T7 express crystal, содержащий экспрессирующий вектор для 96/2021, инокулировали либо в основную среду AB4, либо в основную среду M9, дополненную метионином до 0,176 г/л. Клетки выращивали при 25°C при встряхивании при 180 об./мин. до достижения OD600 1,6, при измерении с помощью спектрофотометра DU530 (Beckman). В этот момент времени клетки осаждали центрифугированием при 10000g в течение 30 минут при 4°C и промывали два раза в свежей основной среде без какого-либо метионина, чтобы удалить метионин из клеточного осадка. После этого осадок ресуспендировали и инокулировали в свежую культуру с основной средой, на этот раз дополненную HAG до той же концентрации, в которой присутствовал метионин на первоначально стадии роста (к этой среде метионин не добавляли). Культуру дополняли IPTG до 1 мМ для индукции экспрессии гибридного белка 96/2021 и инкубировали в течение дополнительных 3-6 при 25°C при встряхивании при 180 об/мин.
Полученные клетки подвергали лизису и белок очищали с использованием колонки IMAC с каким-либо остаточным имидазолом, удаленным посредством диализа. Затем измеряли массу очищенного белка посредством масс-спектрометрии (см. фиг.16), и подтверждали, что он имеет массу, приблизительно соответствующую предсказанной массе белка SEQ ID NO: 20 (т.е. SEQ ID NO: 9, в которой метионин заменен на L-гомоаллилглицин). Это показало, что экспрессия белка в присутствии HAG и в отсутствие метионина обеспечивала замену метионина посредством HAG в процессе экспрессии 96/2021.
Исследование иммунизации (1)
Общий протокол анализа: мышей Balb/c иммунизировали посредством подкожной инъекции по схеме, описанной ниже. Объем инъекции составлял 200 мкл и инъекция содержала адъювант на основе фосфатных квасцов.
|
Конъюгаты имели следующие свойства:
|
Титр IgG-антитела против капсулярного полисахарида серогруппы A и титр сывороточных бактерицидных антител против штамма серогруппы A F8238 после третьей иммунизации представлен на фиг.17. Конъюгаты серогруппы A были иммуногенными и индуцировали бактерицидные антитела. Ответы были немного сниженными, когда любой из конъюгатов CRM197 комбинировали с другими конъюгатами CRM197, происходящими из серогрупп C, W135 и Y, но все еще были значительно более высокими, чем контроля. Напротив, небольшое снижение или отсутствие снижения наблюдали, когда конъюгат MenA-96/2021 комбинировали с этими конъюгатами. Таким образом, применение 96/2021 в качестве носителя может помочь снизить какое-либо иммунное противодействие между конъюгатами серогруппы A и этими конъюгатами.
Титр IgG-антител против капсулярного полисахарида серогрупп C, W135 и Y и титр сывороточных бактерицидных антител против штаммов из этих серогрупп после третьей иммунизации представлены на фиг.18. Использование 96/2021 в качестве носителя для серогруппы A не влияло на иммунные ответы на эти другие полисахариды.
Будет понятно, что изобретение описано с помощью только примеров и можно вносить модификации при сохранении объема и сущности изобретения.
ССЫЛКИ
[1] Lindberg (1999) Vaccine 17 Suppl 2:S28-36
[2] Buttery & Moxon (2000) J R Coll Physicians Lond 34:163-8
[3] Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-33, vii
[4] Goldblatt (1998) J. Med. Microbiol. 47:563-567
[5] EP-B-0 477 508
[6] US patent 5,306,492
[7] WO98/42721
[8] Dick et al. in Conjugate Vaccines (eds. Cruse et al.) Karger, Basel, 1989, Vol. 10, 48-114
[9] Hermanson Bioconjugate Techniques, Academic Press, San Diego CA (1996)
[10] Ramsay et al. (2001) Lancet 357(9251):195-6
[11] Prieler et al. (2006) 47th Annual ICAAC (abstract)
[12] Rennels et al. (2004) Pediatr Infect Dis J. 23(5):429-35
[13] Snape et al. (2008) JAMA 299(2):173-84
[14] Dagan et al. (2010) Vaccine. 28(34):5513-23. Epub 2010 Jun 25
[15] WO 00/56360
[16] Hoskins et al. (2001) J.Bacteriol. 183:5709-5717
[17] Falugi et al. (2001) Eur J Immunol. 31(12):3816-24
[18] Geysen et al. (1984) PNAS USA 81:3998-4002
[19] Carter (1994) Methods Mol Biol 36:207-23
[20] Jameson, BA et al. 1988, CABIOS 4(1):181-186
[21] Raddrizzani & Hammer (2000) Brief Bioinform 1(2):179-89
[22] De Lalla et al. (1999) J. Immunol. 163:1725-29
[23] Brusic et al. (1998) Bioinformatics 14(2):121-30
[24] Meister et al. (1995) Vaccine 13(6):581-91
[25] Roberts et al. (1996) AIDS Res Hum Retroviruses 12(7):593-610
[26] Maksyutov & Zagrebelnaya (1993) Comput Appl Biosci 9(3):291-7
[27] Feller & de la Cruz (1991) Nature 349(6311):720-1
[28] Hopp (1993) Peptide Research 6:183-190
[29] Welling et al. (1985) FEBS Lett. 188:215-218
[30] Davenport et al. (1995) Immunogenetics 42:392-297
[31] WO2004/092209
[32] WO2008/061953
[33] Research Disclosure, 453077 (Jan 2002)
[34] WO2005/000346
[35] EP-A-0372501
[36] EP-A-0378881
[37] EP-A-0427347
[38] WO93/17712
[39] WO94/03208
[40] WO98/58668
[41] EP-A-0471177
[42] WO91/01146
[43] Falugi et al. (2001) Eur J Immunol 31:3816-3824
[44] Baraldo et al. (2004) Infect Immun 72(8):4884-7
[45] EP-A-0594610
[46] Ruan et al. (1990) J Immunol 145:3379-3384
[47] WO 00/56360
[48] Kuo et al. (1995) Infect Immun 63:2706-13
[49] Michon et al. (1998) Vaccine. 16:1732-41
[50] WO 02/091998
[51] WO 01/72337
[52] WO 00/61761
[53] WO 00/33882
[54] US 6,699,474
[55] Ravenscroft et al. (1999) Vaccine 17:2802-2816
[56] Costantino et al. (1999) Vaccine 17:1251-1263
[57] WO 02/058737
[58] Frash (1990) p.123-145 of Advances in Biotechnological Processes vol. 13 (eds. Mizrahi & Van Wezel)
[59] WO 03/007985
[60] Inzana (1987) Infect. Immun. 55:1573-1579
[61]WO 200/5103230
[62] Kandil et al. (1997) Glycoconj J 14:13-17
[63] Berkin et al. (2002) Chemistry 8:4424-4433
[64] Glode et al. (1979) J Infect Dis 139:52-56
[65] WO 94/05325; US patent 5,425,946
[66] WO 2005/033148
[67] WO 03/080678
[68] WO 2008/084411
[69] Nilsson & Svensson (1979) Carbohydrate Research 69: 292-296)
[70] Tokunaka et al. (1999) Carbohydr Res 316:161-172
[71] WO 03/097091
[72] Pang et al. (2005) Biosci Biotechnol Biochem 69:553-8
[73] Read et al. (1996) Carbohydr Res. 281:187-201
[74] Takeo and Tei (1986) Carbohydr Res. 145:293-306
[75] Tanaka et al. (2003) Tetrahedron Letters 44:3053-3057
[76] Ning et al. (2002) Tetrahedron Letters 43:5545-5549
[77] Geurtsen et al. (1999) Journal of Organic Chemistry 64 (21):7828-7835
[78] Wu et al. (2003) Carbohydr Res. 338:2203-12
[79] Nicolaou et al. (1997) J. Am. Chem. Soc. 119:449-450
[80] Yamada et al. (1999) Tetrahedron Letters 40:4581-4584
[81] Yamago et al. (2001) Org. Lett. 24:3867-3870
[82] Yuguo et al. (2004) Tetrahedron 60: 6345-6351
[83] Amaya et al. (2001) Tetrahedron Letters 42:9191-9194
[84] Mei et al. (2005) Carbohydr Res. 340:2345-2351
[85] Takeo et al. (1993) Carbohydr Res. 245:81-96
[86] Jamois et al. (2005) Glycobiology 15(4):393-407
[87] Lefeber et al. (2001) Chem. Eur. J. 7(20):4411-4421
[88] Huang et al. (2005) Carbohydr Res. 340:603-608
[89] US patent 5508191
[90] MiKyoung et al. (2003) Biochemical Engineering Journal, 16:163-8
[91] Barsanti et al. (2001) J Appl Phycol 13:59-65
[92] Bardotti et al. (2008) Vaccine 26:2284-96
[93] Jones (2005) An. Acad. Bras. Cienc, 77(2) 293-324
[94] Jones (2005) J Pharm Biomed Anal 38 840-850
[95] WO2006/050341
[96] Guttormsen et al. (2008) Proc Natl Acad Sci USA. 105(15):5903-8. Epub 2008 Mar 31.
[97] WO96/40795
[98] Michon et al. (2006) Clin Vaccine Immunol. 2006 Aug;13(8):936-43
[99] Lewis et al. (2004) PNAS USA 101:11123-8
[100] Wessels et al. (1989) Infect Immun 57:1089-94
[101] WO2006/082527
[102] WO2009/081276
[103] Moreau et al. (1990) Carbohydrate Res. 339(5):285-91
[104] Fournier et al. (1984) Infect. Immun. 45(1):87-93
[105] Jones (2005) Carbohydrate Res. 340(6):1097-106.
[106] Fattom et al. (1998) Infect Immun. 66(10):4588-92
[107] Lemercinier and Jones (1996) Carbohydrate Res. 296:83-96.
[108] Jones and Lemercinier (2002) J Pharm Biomed Anal. 30(4):1233-47
[109] WO 05/033148
[110] WO 00/56357
[111] Hestrin (1949) J. Biol. Chem. 180:249-261
[112] Konadu et al. (1994) Infect. Immun. 62:5048-5054
[113] Fattom et al. (1990) Infect Immun. 58(7):2367-74
[114] Gilbert et al. (1994) J. Microb. Meth. 20:39-46
[115] Kreis et al. (1995) Int J Biol Macromol. 17(3-4):117-30
[116] Höög et al.(2002) Carbohydr Res. 337(21-23):2023-36
[117] www.polymer.de
[118] Lees et al. (1996) Vaccine 14:190-198
[119] WO95/08348
[120] US patent 4,761,283
[121] US patent 4,356,170
[122] US patent 4,882,317
[123] US patent 4,695,624
[124] Mol. Immunol., 1985, 22, 907-919
[125] EP-A-0208375
[126] Bethell G.S. et al., J. Biol. Chem., 1979, 254, 2572-4
[127] Hearn M.T.W., J. Chromatogr., 1981, 218, 509-18
[128] WO 00/10599
[129] Gever et al., Med. Microbiol. Immunol, 165: 171-288 (1979)
[130] US patent 4,057,685
[131] US patents 4,673,574; 4,761,283; 4,808,700
[132] US patent 4,459,286
[133] US patent 5,204,098
[134] US patent 4,965,338
[135] US patent 4,663,160
[136] WO2007/000343.
[137] WO96/40242
[138] Lei et al. (2000) Dev Biol (Basel) 103:259-264
[139] WO 00/38711
[140] Wang et al. (2009) Chem. Biol. 16:323-336
[141] Floyd et al. (2009) Angew. Chem. 48:7798-7802
[142] Research Disclosure, 453077 (Jan 2002)
[143] EP-A-0372501
[144] EP-A-0378881
[145] EP-A-0427347
[146] WO93/17712
[147] WO94/03208
[148] WO98/58668
[149] EP-A-0471177
[150] WO91/01146
[151] Baraldo et al. (2004) Infect Immun 72(8):4884-7
[152] EP-A-0594610
[153] Ruan et al. (1990) J Immunol 145:3379-3384
[154] WO 00/56360
[155] WO 02/091998
[156] Kuo et al. (1995) Infect Immun 63:2706-13
[157] Michon et al. (1998) Vaccine. 16:1732-41
[158] WO 01/72337
[159] WO 00/61761
[160] WO2004/041157
[161] WO 02/34771
[162] WO99/42130
[163] WO2004/011027
[164] WO99/24578
[165] WO99/36544
[166] WO99/57280
[167] WO 00/22430
[168] Tettelin et al. (2000) Science 287:1809-1815
[169] Pizza et al. (2000) Science 287:1816-1820
[170] WO 01/52885
[171] Bjune et al. (1991) Lancet 338(8775):1093-1096
[172] Fukasawa et al. (1999) Vaccine 17:2951-2958
[173] Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333
[174] Watson (2000) Pediatr Infect Dis J 19:331-332
[175] Rubin (2000) Pediatr Clin North Am 47:269-285, v.
[176] Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207
[177] Bell (2000) Pediatr Infect Dis J 19:1187-1188
[178] Iwarson (1995) APMIS 103:321-326
[179] Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
[180] Hsu et al. (1999) Clin Liver Dis 3:901-915
[181] Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355
[182] Rappuoli et al. (1991) TIBTECH 9:232-238
[183] Vaccines (2004) eds. Plotkin & Orenstein. ISBN 0-7216-9688-0
[184] WO 02/02606
[185] Kalman et al. (1999) Nature Genetics 21:385-389
[186] Read et al. (2000) Nucleic Acids Res 28:1397-406
[187] Shirai et al. (2000) J. Infect. Dis. 181(Suppl 3):S524-S527
[188] WO99/27105
[189] WO 00/27994
[190] WO 00/37494
[191] WO99/28475
[192] Ross et al. (2001) Vaccine 19:4135-4142
[193] Sutter et al. (2000) Pediatr Clin North Am 47:287-308
[194] Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126
[195] Dreesen (1997) Vaccine 15 Suppl:S2-6
[196] MMWR Morb Mortal Wkly Rep 1998 Jan 16;47(1):12, 19
[197] McMichael (2000) Vaccine 19 Suppl 1:S101-107
[198] WO 02/34771
[199] Dale (1999) Infect Dis Clin North Am 13:227-43, viii
[200] Ferretti et al. (2001) PNAS USA 98: 4658-4663
[201] WO 03/093306
[202] WO2004/018646
[203] WO2004/041157
[204] lchiman and Yoshida (1981) J. Appl. Bacteriol. 51:229.
[205] US4197290
[206] lchiman et al. (1991) J. Appl. Bacteriol. 71:176
[207] Robinson & Torres (1997) Seminars in Immunology 9:271-283
[208] Donnelly et al. (1997) Annu Rev Immunol 15:617-648
[209] Scott-Taylor & Dalgleish (2000) Expert Opin Investig Drugs 9:471-480
[210] Apostolopoulos & Plebanski (2000) Curr Opin Mol Ther 2:441-447
[211] Ilan (1999) Curr Opin Mol Ther 1:116-120
[212] Dubensky et al. (2000) Mol Med 6:723-732
[213] Robinson & Pertmer (2000) Adv Virus Res 55:1-74
[214] Donnelly et al. (2000) Am J Respir Crit Care Med 162(4 Pt 2):S190-193
[215] Davis (1999) Mt. Sinai J. Med. 66:84-90
[216] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472
[217] Almeida & Alpar (1996) J. Drug Targeting 3:455-467
[218] US patent 6355271
[219] WO 00/23105
[220] US 5,057,540
[221] WO96/33739
[222] EP-A-0109942
[223] WO96/11711
[224] WO 00/07621
[225] Barr et al. (1998) Advanced Drug Delivery Reviews 32:247-271
[226] Sjolanderet et al. (1998) Advanced Drug Delivery Reviews 32:321-338
[227] Pizza et al. (2000) Int J Med Microbiol 290:455-461
[228] WO95/17211
[229] WO98/42375
[230] Singh et al] (2001) J Cont Release 70:267-276
[231] WO99/27960
[232] US 6,090,406
[233] US 5,916,588
[234] EP-A-0626169
[235] Dyakonova et al. (2004) Int Immunopharmacol 4(13):1615-23
[236] FR-2859633
[237] Signorelli & Hadden (2003) Int Immunopharmacol 3(8):1177-86
[238] WO2004/064715
[239] De Libero et al, Nature Reviews Immunology, 2005, 5: 485-496
[240] US patent 5,936,076
[241] Oki et al, J. Clin. Investig., 113: 1631-1640
[242] US2005/0192248
[243] Yang et al, Angew. Chem. Int. Ed., 2004, 43: 3818-3822
[244] WO2005/102049
[245] Goff et al, J. Am. Chem., Soc., 2004, 126: 13602-13603
[246] WO 03/105769
[247] Cooper (1995) Pharm Biotechnol 6:559-80
[248] Kandimalla et al. (2003) Nucleic Acids Research 31:2393-2400
[249] WO 02/26757
[250] WO99/62923
[251] Krieg (2003) Nature Medicine 9:831-835
[252] McCluskie et al. (2002) FEMS Immunology and Medical Microbiology 32:179-185
[253] WO98/40100
[254] US patent 6,207,646
[255] US patent 6,239,116
[256] US patent 6,429,199
[257] Kandimalla et al. (2003) Biochemical Society Transactions 31 (part 3):654-658
[258] Blackwell et al. (2003) J Immunol 170:4061-4068
[259] Krieg (2002) Trends Immunol 23:64-65
[260] WO 01/95935
[261] Kandimalla et al. (2003) BBRC 306:948-953
[262] Bhagat et al. (2003) BBRC 300:853-861
[263] WO 03/035836
[264] WO 01/22972
[265] Schellack et al. (2006) Vaccine 24:5461-72
[266] Myers et al. (1990) pages 145-156 of Cellular and molecular aspects of endotoxin reactions
[267] Ulrich (2000) Chapter 16 (pages 273-282) of reference
[268] Johnson et al. (1999) J Med Chem 42:4640-9
[269] Baldrick et al. (2002) Regulatory Toxicol Pharmacol 35:398-413
[270] WO 94/21292
[271] US 4,680,338
[272] US 4,988,815
[273] WO92/15582
[274] Stanley (2002) Clin Exp Dermatol 27:571-577
[275] Wu et al. (2004) Antiviral Res. 64(2):79-83
[276] Vasilakos et al. (2000) Cell Immunol. 204(1):64-74
[277] US patents 4689338, 4929624, 5238944, 5266575, 5268376, 5346905, 5352784, 5389640, 5395937, 5482936, 5494916, 5525612, 6083505, 6440992, 6627640, 6656938, 6660735, 6660747, 6664260, 6664264, 6664265, 6667312, 6670372, 6677347, 6677348, 6677349, 6683088, 6703402, 6743920, 6800624, 6809203, 6888000 and 6924293
[278] Jones (2003) Curr Opin Investig Drugs 4:214-218
[279] WO2004/060308
[280] WO2004/064759
[281] US 6924271
[282] US2005/0070556
[283] US 5658731
[284] US patent 5011828
[285] WO2004/87153
[286] US 6,605,617
[287] WO 02/18383
[288] WO2004/018455
[289] WO 03/082272
[290] Johnson et al. (1999) Bioorg Med Chem Lett 9:2273-2278
[291] Evans et al. (2003) Expert Rev Vaccines 2:219-229
[292] Andrianov et al. (1998) Biomaterials 19:109-115
[293] Payne et al. (1998) Adv Drug Delivery Review 31:185-196
[294] WO 03/011223
[295] Meraldi et al. (2003) Vaccine 21:2485-2491
[296] Pajak et al. (2003) Vaccine 21:836-842
[297] Wong et al. (2003) J Clin Pharmacol 43(7):735-42
[298] US2005/0215517
[299] WO90/14837
[300] Podda & Del Giudice (2003) Expert Rev Vaccines 2:197-203
[301] Podda (2001) Vaccine 19: 2673-2680
[302] Vaccine Design: The Subunit and Adjuvant Approach (eds. Powell & Newman) Plenum Press 1995 (ISBN 0-306-44867-X)
[303] Vaccine Adjuvants: Preparation Methods and Research Protocols (Volume 42 of Methods in Molecular Medicine series). ISBN: 1-59259-083-7. Ed. O'Hagan
[304] Allison & Byars (1992) Res Immunol 143:519-25
[305] Hariharan et al. (1995) Cancer Res 55:3486-9
[306] WO95/11700
[307] US patent 6,080,725
[308] WO2005/097181
[309] Wills et al. (2000) Emerging Therapeutic Targets 4:1-32
[310] Molecular Biology Techniques: An Intensive Laboratory Course, (Ream et al., eds., 1998, Academic Press)
[311] Methods In Enzymology (S. Colowick and N. Kaplan, eds., Academic Press, Inc.)
[312] Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell, eds, 1986, Blackwell Scientific Publications)
[313] Sambrook et al. (2001) Molecular Cloning: A Laboratory Manual, 3rd edition (Cold Spring Harbor Laboratory Press)
[314] Handbook of Surface and Colloidal Chemistry (Birdi, K.S. ed., CRC Press, 1997)
[315] Ausubel et al. (eds) (2002) Short protocols in molecular biology, 5th edition (Current Protocols)
[316] PCR (Introduction to Biotechniques Series), 2nd ed. (Newton & Graham eds., 1997, Springer Verlag)
[317] Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987) Supplement 30
[318] Smith & Waterman (1981) Adv. Appl. Math. 2: 482-489
[319] Torosantucci et al. (2005) J Exp Med 202:597-606
[320] WO 03/007985
[321] Bromuro et al. (2010) Vaccine 28(14):2615-23